.-J2-111 .-J121..)1p:.>~1 :..)11341
.:.Ap~~1
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
`p211 'ia41 j
`lt2-1 1-J211 ô J1
MINISTERE DE L'ENSEINGNEMENT SUPERIEUR ET DE
LA
RECHERCHE SCIENTIFIQUE
J.-`1-8-411 a-i-Je -I
..)41 (1.912.3 `112.911
.>2 p11
INSTITUT DES SCIENCES DE LA MER ET DE
L'AMENAGEMENT DU
LITTORAL

MEMOIRE EN VUE DE L'OBTENTION D'UN
DIPLOME
D'INGENIEUR D'ETAT EN SCIENCES DE LA MER
OPTION : Aquaculture
SUJET :
CONTRIBUTION A L'ETUDE DE L'INVERSION SEXUELLE CHEZ
UNE
ESPECE DE POISSON D'EAU DOUCE : TILAPIA (Oreochromis
niloticus)
Présenté par :
Melle
Ibtissem AIT HAMOUDA
Soutenu le 21 septembre 2005 devant la commission
d'examen formée de :
|
Président :
|
Mr SEFIANE O.
|
axa
|
ISMAL
|
|
Examinateur :
|
Mr BOUAZIZ A.
|
axa
|
INESSM
|
|
Examinateur :
|
Mr REFES W.
|
axa
|
ISMAL
|
|
Rapporteur :
|
Melle ADJOUT H.
|
axa
|
CNDPA
|
|
Co-Rapporteur :
|
Mr ZOUAKH D. E.
|
axa
|
USTHB
|

R.eMeR.C1 e M e NTS
A M. Omar SEFIANE, chargé de cours à l'ISMAL
(Institut des Sciences de la Mer et de l'Aménagement du Littoral) qui a
accepté de présider ce jury et de nous faire profiter de sa
longue expérience ;
A M. Wahid REFES, directeur des études à l'ISMAL
qui a accepté d'examiner ce travail bien que ce thème ne
corresponde pas à ceux qui lui sont plus familiers. Sa vaste culture
scientifique y pourvoira ;
A M. Ahmed BOUAZIZ, chargé de cours à l'ISMAL
qui a accepté de participer à ce jury. De plus, je le remercie de
m'avoir proposé son aide durant les quelques dernières semaines
qui ont précédé cette soutenance ;
A Melle Hakima ADJOUT, du laboratoire d'aquaculture
au CNDPA (Centre National d'études et de Documentation pour la
Pêche et l'Aquaculture) pour avoir eu l'idée de proposer ce sujet
qui m'a permis d'acquérir des technique qui m'étaient
complètement inconnues jusqu'à présent, ainsi que pour son
soutien et ses multiples interventions tout au long de ce mémoire ;
A M. Djamel Eddine ZOUAKH, chargé de cours à
l'USTHB (Université des Sciences et de la Technologie : Houari
Boumediene) pour avoir non seulement accepté de faire partie du jury
mais aussi d'en être l'un des rapporteurs. Il s'est montré d'une
grande disponibilité que se soit pour une aide documentaire ou pour les
quelques occasions de discussion, trop rares, mais toujours très
fructueuses ;
A M. Mostapha DJELLALI, chef de département des
laboratoires et flottille au CNDPA, pour ces précieux conseils ainsi que
sa disponibilité ;
A toute l'équipe du laboratoire de chimie du CNDPA,
pour nous avoir aidé et rendu plein de services durant notre
présence parmi eux ;
Aux équipes des bibliothèques de l'ISMAL et du
CNDPA, pour avoir toujours répondu avec célérité et
compétence à nos multiples demandes de documentation et
d'interrogation de banques de données ;
A ma mère, pour tout ce qu'elle a fait pour moi ces vingt
trois dernières années ; dieu sait qu'elle en a fait beaucoup
surtout que les occasions de la remercier s'avèrent très rares
;
A tous les membres de ma famille, pour leur aide et leur soutien
et surtout pour la confiance qu'ils ont pu mettre en moi ;
A mes amis qui m'ont soutenu tout au long de ce parcours ; un
petit clin d'oeil à Lhadi qui est resté à mes
côtés et qui m'a supporté pendant les trois
dernières années ainsi qu'à Billel pour ces multiples
interventions informatiques et sans qui mon travail n'aurait pas vu le jour
à temps ;
Mille MERCI.
vs4 %ina `M`&n9e ctin9 i92%
`Mien`&9297/i9...
I btissem
ABREVIATIONS :
O. niloticus : Oreochromis niloticus
11 â-OH?4 : 11
â-hydroxyandrosténedione 17 á-ET : 17
á-éthynyltestostérone
17 á-MT : 17
á-méthyltestostérone
C.N.D.P.A. : Centre national d'études et
de documentation pour la pêche et l'aquaculture F.A.O. :
Food and Agriculture Organisation
M.P.R.H. : Ministère de la Pêche et
des Ressources Halieutiques
> : supérieur à #177;
: plus ou moins
? : mâle ? : femelle
%o : pour mille % : pourcent
°C : degré Celsius avr. :
Avril
cm : centimètres g :
grammes
g/j : gramme par jour h :
heures
Ind. : Indéterminé j
: jours
JAE : jour après éclosion
juil. : Juillet
l : litre Max. : maximum
M.E.S. : matières en suspension
mg/l : milligramme par litre
Min. : minimum mm :
millimètres
Nb : nombre O2 dissous :
oxygène dissous
pH : Potentiel hydrogène Pm :
Poids moyen
T : température Tm :
taille moyenne

SOMMAIRE
ABREVIATIONS
INTRODUCTION 1
CHAPITRE I : GENERALITES
1. Caractéristiques taxonomiques et
morphologiques 2
1.1. Caractéristiques du Tilapia du Nil : Oreochromis
niloticus 2
1.2. Morphologie 3
2. Distribution géographique 4
3. Ecologie 5
3.1. Température 5
3.2. Salinité 5
3.3. Potentiel d'hydrogène (pH) 6
3.4. Oxygène dissous (O2 dissous) 6
3.5. Composés azotés 6
4. Régime alimentation 6
5. Biologie de la reproduction 7
5.1. Maturité sexuelle 7
5.2. Fécondité 7
5.3. Reproduction 8
5.4. Comportement lors de la reproduction 10
6. Croissance 10
6.1. La production d'alevins monosexes mâles 12
6.2. Le traitement hormonal des alevins 13
CHAPITRE II : MATERIELS ET METHODES
1. Matériel biologique 15
2. Matériel de laboratoire 16
3. Protocole expérimental 18
3.1. Reproduction 18
3.2. Récolte de frai 18
3.3. Alimentation des géniteurs et des alevins 20
3.3.1. Composition de l'aliment 20
3.3.2. Traitement hormonal des alevins 21
3.3.3. Ration alimentation et fréquence de nourrissage
21
4. Suivi des paramètres physico-chimiques et
biologiques 22
4.1. Paramètres physico-chimiques 22
4.2. Paramètres biologiques 22
4.2.1. Poids 22
4.2.2. Taille 22
4.3. Méthodes de calcul 23
4.3.1. Croissance relative (relation taille-poids) 23
4.3.2. Taux de mortalité 23
5.Etude de l'inversion sexuelle 24
5.1. Sexage manuel 24
5.2. Squash gonadique 24
CHAPITRE III : RESULTATS ET DISCUSSION
1. Etude des paramètres physico-chimiques
25
1.1. Dans le Raceway de reproduction 25
1.2. Dans les aquariums d'alevinage 25
1.3. Dans les bassins de prégrossissement 26
2. Etude des paramètres biologiques
28
2.1. Etude de la croissance 28
2.1.1. Croissance pondérale
28
2.1.2. Croissance linéaire
29
2.2. Relation taille-poids 31
2.3. Etude du taux de mortalité cumulée 33
2.4. Etude de l'inversion sexuelle 34
CONCLUSION 36
BIBLIOGRAPHIE 37
GLOSSAIRE
ANNEXES
Introduction
Le Tilapia présente un grand potentiel pour
l'aquaculture avec une production mondiale estimée à environ 1
100 000 tonnes (F.A.O., 1999). Cette activité est en progression en
Afrique en tant que source de protéines animales très
nutritives.
L'espèce piscicole la plus intéressante,
Oreochromis niloticus représente 85% des élevages des
Tilapias dans le monde de par sa disponibilité et une période de
ponte étalée sur l'année ; elle supporte les situations de
stress et les activités liées à la pisciculture ainsi que
des larges variations des paramètres physico-chimiques du milieu. En
plus, sa chair est délicieuse et contient peu d'arêtes, avec un
fort contenu protéique et vitaminique (Kestemont et al., in
FAO, 1989).
En Algérie, l'élevage de Tilapia est une
activité nouvelle ; l'introduction de cette espèce est
très récente (mai 2001) (MPRH, CNDPA, 2002) et les travaux de
recherche la concernant sont peu nombreux tel que ceux de Bouroubi &
Zeghimi (2004) ; Bouzid & Farah (2004) et Ouldmaamar & Tikarrouchine,
2005.
Dans le présent travail, nous tenterons de masculiniser
des alevins d'Oreochromis niloticus à l'aide d'une hormone pour
contrôler son élevage puis étudier son taux de croissance
et démontrer l'importance des élevages monosexes* de populations
de Tilapia pour optimiser les systèmes de production. Car le principal
« inconvénient » de cette espèce est sa
prolificité due à une maturité précoce et à
une fréquence élevée des pontes conduisant au
surpeuplement et donc à une faible croissance individuelle
(nanisme*).
Deux types de solutions à ce problème ont
été envisagés :
- Elevage d'individus du même sexe (monosexe),
spécialement les mâles dont la vitesse de croissance se
révèle supérieure à celle des femelles ;
- Elevage de Tilapia associé à des
prédateurs qui consomment les alevins.
La première solution peut être mise en oeuvre par
quatre procédés principaux : - Sexage manuel* ;
- Production d'hybrides monosexes ;
- Modification génétique
- Réversion du sexe des alevins par traitement hormonale
(objet de notre travail).
Ce mémoire, dont la partie pratique est
réalisée au sein du Centre National d'étude et de
Documentation pour la Pêche et l'Aquaculture (CNDPA) est une contribution
à l'étude de l'inversion hormonale chez une espèce d'eau
douce : Tilapia : Oreochromis niloticus.

1. Caractéristiques taxonomiques et
morphologiques
1.1. Caractéristiques taxonomiques* du Tilapia du Nil
: Oreochromis nioticus
Les Tilapias, fondement de l'aquaculture africaine, forment
désormais, à partir de quelques espèces endémiques
en Afrique, la base de la pisciculture d'eau douce de la ceinture
intertropicale du globe (Lazard, 1990).
Le terme Tilapia est en général utilisé
pour désigner l'important groupe élevé à des fins
commerciaux appartenant à la famille des Cichlidés. Cette
expression est d'origine africaine du mot « thiape » qui veut dire
poisson. L'élevage des Tilapias existe depuis plus de 2500 ans (Chapman,
2003).
Les Cichlides se distinguent des autres familles par un groupe
de caractères nets : une écaille très
développée à l'aisselle des pelviennes, l'absence des
dents au plafond buccal, des os pharyngiens inférieurs plus ou moins
unis sur la ligne médiane.
Cette famille appartient à l'ordre des perciformes. Ils
occupent les eaux douces et saumâtres d'Afrique et fréquentent
à peu prés tous les biotopes à l'exception des eaux
torrentielles et cavernicoles.
Le terme Tilapia regroupe une centaine d'espèces
appartenant à la famille des Cichlidés qui englobe quatre genres
en se basant sur les caractères anatomiques, le comportement
reproducteur et la nutrition (Trewavas, 1983) :
- Oreochromis : avec une incubation buccale* et une
garde uniparentale* maternelle, ils sont en plus planctonophages* ;
- Sarotherodon : avec une incubation buccale et une
garde biparentale* ou paternelle, ils sont planctonophages ;
- Tilapia : avec une incubation des oeufs sur substrat*
et une garde biparentale (en couple), ils sont macrophytophages* ;
- Danakilia : caractéristiques
éco-morphologiques particulières.
En élevage, seul le genre Oreochromis est
représenté avec cinq espèces principales :
- Oreochromis niloticus (Tilapia du Nil) ;
- Oreochromis mossambicus ;
- Oreochromis aureus ;
- Oreochromis hornorum ;
- Le Tilapia rouge, issu du croisement : O. mossambicus
(?) x O. niloticus (?).
1.2. Morphologie
Oreochromis niloticus se reconnaît aisément
par (fig. 1) :
- Une tête portant une narine de chaque côté
;
- Un corps comprimé latéralement, couvert
essentiellement d'écailles cycloïdes* et parfois d'écailles
cténoïdes* ;
- La nageoire dorsale comprend 17-18 rayons épineux
suivis de 12-14 rayons mous ; - La nageoire anale est formée de 3 rayons
épineux précédés de 09-10 rayons mous ; - Les
nageoires pelviennes portent un rayon dur suivi de 05 rayons mous ;
- La ligne latérale, sur les deux flancs* du poisson, est
interrompue en comptant 18 à
19 écailles, puis décroche vers le bas une seconde
ligne d'une douzaine d'écailles ; - Un nombre élevé de
branchiospines* fines et longues (18 à 28 sur la partie
inférieure et 04 à 07 sur la partie
supérieure du premier arc branchial) ;
- Trois à quatre séries de dents sur chaque
mâchoire et six chez les individus
dépassant les 20 cm LS (Longueur Standard).
Oreochromis niloticus est facilement reconnaissable
grâce aux bandes verticales régulières noires sur la
nageoire caudale. La coloration générale est gris argentée
avec des bandes grises plus foncé qui zèbrent l'animal.
Les macules* (taches) blanches entre les rayons des nageoires
impaires, ainsi qu'une coloration générale grise avec des flancs
rosâtres, voir rouge sont des signes caractéristiques chez
l'adulte (Arrignon, 2000).

Coloration rosâtre
17 à 18 rayons
épineux
12 à 14 rayons
mous
Barres noires sur la nageoire caudale
Figure 1 : Caractéristiques
morphologiques d'Oreochromis niloticus adulte avec des
barres
verticales noires sur la nageoire caudale (Melard C. in FAO, 2002).
2. Répartition géographique
Oreochromis niloticus présente une
répartition originelle strictement africaine couvrant les bassins du
Nil, du Niger, des Volta et du Sénégal jusqu'au lac Tanganika
ainsi que la vallée du Jourdain en Palestine (Philippart & Ruwet,
1982) (fig.2).
Au début du 20ème siècle et
pour augmenter la production de la protéine animale, une série
d'introduction et d'acclimatation de cette espèce a eu lieu dans divers
pays ; et en Algérie, cette introduction est très récente
(Avril 2002) et a porté sur 4000 alevins* et 200 géniteurs*
importés d'Égypte (CNDPA, 2004) (fig.3).
Mais ces introductions ne se sont pas limitées à
l'Afrique puisqu'on trouve cette espèce aussi bien en Amérique
Centrale (Hawaï, Mexique), en Amérique du Sud (Brésil), en
Amérique du Nord (Arizona, Californie) et en Asie (Thaïlande,
Chine, Japon). Enfin cette espèce commence également à
être cultivée dans les eaux chaudes industrielles en
régions tempérées. C'est le cas en Europe (Allemagne, 1977
et Belgique, 1980).
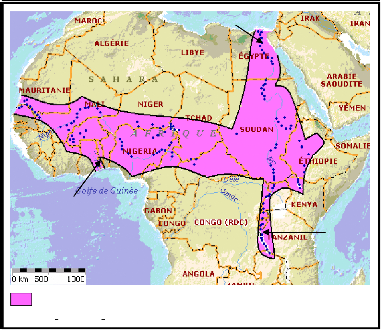
Aire de répartition naturelle d' Oreochromis
niloticus.
? Capture de spécimens identifiés formellement
Lac Volta
Nil
Lac Tanganika
Figure 2 : Répartition originelle
d'Oreochromis niloticus en Afrique
(Source : FAO, 2002 ;
adaptée par nous-même)
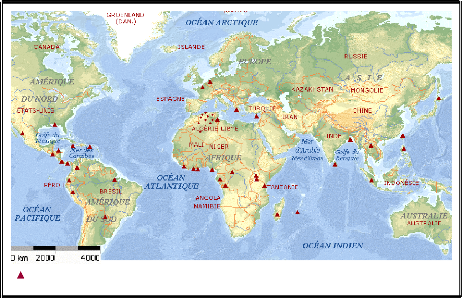
Lieux d'introduction d'Oreochromis niloticus dans le
monde ? Lieux d'introduction d'Oreochromis niloticus
en Algérie
Figure 3 : Points d'introduction
d'Oreochromis niloticus dans le monde
(Source : CNDPA, 2004 ; Arrignon, 2000 & FAO 1989 ;
adaptée par nous-même).
3. Écologie
De nombreuses études de terrain et de laboratoire
(Pullin & Lowe McConnell, 1982) montent qu'Oreochromis niloticus
est une espèce relativement euryèce* et eurytope* adaptée
à de larges variations des facteurs écologiques du milieu
aquatique et colonisant des milieux extrêmement variés.
3.1. Température :
Oreochromis niloticus, espèce thermophile*, se
rencontre en milieu naturel entre 13,5 et 33°C mais l'intervalle de
tolérance thermique observé en laboratoire est plus large : 7
à 41°C pendant plusieurs heures (Balarin & Hatton, 1979). La
température optimale de reproduction se situe entre 26 et 28°C, le
minimum requis étant 22°C ; cette espèce ne se nourrit pas
en dessous de 15°C (Malcolm et al., 2000).
3.2. Salinité :
Bien que O. niloticus soit une espèce d'eau
douce, son euryhalinité* est bien connue car, on le rencontre dans les
eaux de salinité comprise entre 0,015 et 30 %o.
Toutefois, au-delà de 20 %o, l'espèce subit un
stress* important qui la rend sensible aux maladies, réduisant sa
compétitivité par rapport à d'autres espèces. La
reproduction serait inhibée en eau saumâtre à partir de 15
à 18 %o (Malcolm et al., 2000).
3.3. Potentiel d'hydrogène (pH) :
De même, la tolérance aux variations de pH est
très grande puisque l'espèce se rencontre dans des eaux
présentant des valeurs de pH de 5 à 11. L'idéal
étant situé entre 6,5 et 8,5. Lorsque le pH atteint 2 à 3,
un comportement de stress physiologique apparaît avec une nage rapide,
une accélération des mouvements operculaires, une remontée
en surface pour avaler l'air, une incapacité de contrôler la
position du corps et enfin la mort du poisson (Malcolm et al.,
2000).
3.4. Oxygène dissous (O2 dissous) :
Pour la concentration en oxygène dissous, cette
espèce tolère à la fois des déficits et des
saturations importantes. Ainsi jusqu'à 3 mg/l d'oxygène dissous,
O. niloticus ne présente pas de difficulté
métabolique particulière mais en deçà de cette
valeur, un stress respiratoire se manifeste, bien que la mortalité ne
survienne qu'après 6 h d'exposition à des teneurs de 3 mg/l. Il
n'empêche que cette espèce peut supporter, sur de courtes
périodes, de faibles concentrations en oxygène dissous. L'optimum
requis est de 5 mg/l.
Sa consommation est en relation directe avec l'importance de
la ration alimentaire : l'accroissement est minimum avec la ration de
maintenance et maximum avec la ration maximale (Malcolm et al.,
2000).
3.5. Composés azotés :
La concentration des déchets azotés
excrétés par les branchies et l'urine est en fonction de la
température, taille des poissons, concentration de l'ammoniaque dans le
milieu et la qualité de l'aliment, et doit être maintenue
inférieure au seuil critique d'O. niloticus, elle ne doit pas
dépasser 5 mg/l pour les nitrates, 500 mg/l pour les nitrites, 15 mg/l
pour l'ammoniaque total et 200 mg/l pour les M.E.S. (Malcolm et al.,
2000).
4. Régime alimentaire
La nourriture des herbivores, tels que les Tilapias, est
généralement excédante à leur capacité de
consommation, mais la qualité de cette nourriture est très
variable (principalement en apport protéique), ce qui influe sur leur
croissance.
Étant donné que les arcs branchiaux
d'Oreochromis niloticus disposent de microbranchiospines et de
branchiospines longues et nombreuses, l'eau qui y transite est
véritablement filtrée de son plancton. Cette espèce est
donc, en milieu naturel, essentiellement phytoplanctonophage* et consomme de
multiples espèces de Chlorophycées, Cyanophycées, etc...;
ce qui ne l'empêche pas d'absorber du zooplancton et même des
sédiments riches en bactéries et diatomées.
Mais en milieu artificiel (système de pisciculture)
cette espèce est pratiquement omnivore* (euryphage*) valorisant divers
déchets agricoles, tirant parti des excréments de porcs ou de
volailles, de déchets ménagers, acceptant facilement des aliments
composés sous forme de granulés, etc... Cette capacité
d'adaptation à divers aliments et déchets est
phénoménale et est à la base de sa haute
potentialité pour la pisciculture.
5. Biologie de la reproduction 5.1. Maturité
sexuelle*:
Oreochromis niloticus est connu pour sa
maturité sexuelle précoce qui peut intervenir dés 03-04
mois dans certains élevages ; des individus de 30 g et de 8 cm peuvent
se reproduire (Balarin & Haller, 1982). Elle est en fonction des conditions
de milieu et de la densité des individus.
Dans les milieux naturels, la taille de première
maturité chez O. niloticus varie généralement
entre 14 et 20 cm, ce qui correspond à un âge de 2 à 3 ans,
mais peut atteindre 28 cm et différer chez les mâles et les
femelles. Toutefois cette taille de maturité peut se modifier au sein
d'une même population en fonction des conditions fluctuantes du milieu
(FAO, 2002).
Selon Lowe-McConnel (1982), les facteurs qui diminuent la taille
de maturité sont: - Dimensions réduites du milieu (confinement)
;
- Déficit alimentaire qualitatif et quantitatif ;
- Pêche trop intensive.
5.2. Fécondité :
Oreochromis niloticus présente une faible
fécondité qui varie de quelques centaines d'oeufs à
plusieurs milliers par ponte chez les gros individus.
Par contre, la fréquence élevée de ponte et
la garde parentale des alevins (incubation buccale), permettent d'obtenir de
bonnes productions d'alevins par femelle.
La fécondité absolue (nombre d'ovules pondus en une
fois) est aussi très variable puisqu'elle fluctue fortement, comme le
montre Moreau (1979), en fonction:
- du poids des femelles,
- des milieux et des saisons.
5.3. Reproduction :
Oreochromis niloticus fait partie des incubateurs
buccaux uniparentaux maternels. Lorsque les conditions abiotiques deviennent
favorables en milieu naturel (une température d'au moins 22°C est
nécessaire à la reproduction et à l'incubation des oeufs),
les adultes migrent vers la zone littorale et les mâles se rassemblent en
arène de reproduction* sur un substrat meuble, sablonneux ou argileux
où ils délimitent chacun leur territoire et creusent un nid en
forme d'assiette creuse.
Les femelles vivent en groupe à l'écart des
arènes de reproduction où elles effectuent de brefs passages. En
allant d'un territoire à l'autre, elles sont sollicitées par les
mâles. En cas d'arrêt au-dessus d'un nid et après une parade
nuptiale de synchronisation sexuelle, la femelle dépose un lot d'ovules
que le mâle féconde immédiatement et que la femelle reprend
dans sa bouche pour les incuber et les y gardent pendant la durée
d'incubation, soit 04 à 05 jours pour l'éclosion et 07 à
12 jours pour la résorption de la vésicule vitelline. Les oeufs
sont oblongs, mesurant environ 2,3 mm de grand diamètre sur 1,9 mm de
petit diamètre. Cette opération peut être
recommencée avec le même mâle ou un voisin (Ruwet et
al., 1976) ; après quoi, la femelle quitte l'arène et incube
ses oeufs fécondés (annexe 01). A cette époque, la femelle
présente un abaissement de la cavité buccopharyngienne*, des
opercules légèrement écartés (fig.4).
Figure 4 : Femelle incubante avec les oeufs dans
sa bouche (Source : FAO 1989).
L'éclosion des oeufs a lieu dans la bouche 4 à 5
jours après la fécondation. Une fois leur vésicule
vitelline résorbée, les alevins capables de nager sont encore
gardés par la femelle pendant plusieurs jours.
Toutefois, ils restent à proximité de leur
mère et, au moindre danger, se réfugient dans sa cavité
buccale (fig.5). A la taille d'environ 10 mm, les alevins, capables de
rechercher leur nourriture, quittent leur mère et vivent en petits
bancs.

Figure 5 : Alevins nageant à
proximité de la bouche de leur mère
(Source : FAO 1989).
Une femelle en bonne condition se reproduit toutes les six
à huit semaines dans la nature et tous les quinze à vingt jours
dans un milieu contrôlé ; ce qui, à raison de 800 à
1 000 oeufs en moyenne pour une femelle de 250 g, risque de conduire au
surpeuplement* et au nanisme en milieu mal contrôlé.
La période de reproduction d'Oreochromis
niloticus est potentiellement continue pendant toute l'année, si la
température de l'eau est supérieure à 22°C. Toutefois
on constate des pics d'activité reproductrice induits par:
- Augmentation de la photopériode et de l'intensité
lumineuse,
- Augmentation de la température de l'eau,
- Augmentation du niveau de l'eau.
Toutes ces caractéristiques de reproduction
d'Oreochromis niloticus démontrent non seulement la
plasticité de l'espèce à s'adapter à des conditions
diverses mais expliquent aussi sa haute résilience à savoir sa
capacité à revenir rapidement après perturbation à
un seuil optimum de densité dans son milieu naturel (Baroiller &
Jalabert, 1990).
5.4. Comportement lors de la reproduction :
Le comportement reproductif chez Oreochromis niloticus
a été rapporté, par plusieurs auteurs. Turner (1986)
montre que le comportement reproductif est profondément influencé
par le système d'accouplement et a découvert que les femelles
préfèrent s'accoupler avec des mâles dont le nid est le
plus large (annexe 01).
En aquarium, les mâles préfèrent les
territoires proches de la surface. En plus, les mâles captifs se livrent
des combats circulaires de courtes durées et de petite intensité.
Des « mouvements expressifs », qui consistent notamment en "menace"
en "coup de queue", constituent en quelque sorte un langage instinctif.
Ça sert probablement à évaluer la force d'un autre
mâle, et à l'établissement du territoire (Malcolm et
al., 2000).
L'introduction d'une femelle prête à pondre dans
un aquarium où se trouve un mâle territorial est tout aussi
intéressante, mais, il faut se méfier de l'agressivité du
mâle. Après une courte phase agressive de sa part, les mouvements
changent totalement et on assiste à la parade faite de mouvements dits
de "tremblement", à des "cercles" etc... (Malcolm et
al., 2000).
6. Croissance
En général, Oreochromis niloticus est
connue pour sa croissance rapide et présente un indice de croissance
plus performant que les autres espèces du genre, sa durée de vie
étant relativement courte (6 à 8 ans) (Pauly et al. in
Malcolm et al., 2000).
Une autre caractéristique d'O. niloticus
concerne son dimorphisme sexuel* de croissance qui se marque dés 20
à 40 g, poids à partir duquel les femelles acquièrent la
maturité sexuelle (Kestemont et al. in Malcolm et al.,
2000).
Le dimorphisme sexuel apparaît principalement au niveau
de la papille* génitale (fig.6), ce qui permet un sexage précoce
en élevage, cette papille étant chez le mâle
protubérante en forme de cône avec un pore urogénital
à l'extrémité, alors que chez la femelle, elle est petite,
arrondie avec une fente transversale au milieu (pore génital) et un pore
urinaire à l'extrémité.
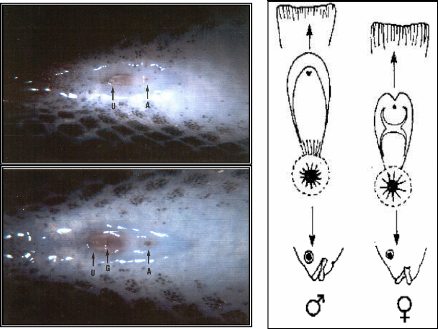
1
2
3
Figure 6 : Dimorphisme sexuel de la papille
uro-génitale entre un mâle de 24 g (1) et une
femelle de 20 g (2) chez Oreochromis niloticus. La
papille femelle est caractérisée par une fente transversale
(orifice génital) entre l'anus et l'orifice urinaire.
Chez le mâle : A = anus ; U = orifice uro-génital.
Grossissement = 75 x.
Chez la femelle : A = anus ; U = orifice urinaire ; G = orifice
génital. Gross. = 33 x. (Photo Toguyeni & Baroiller in
Adjout & Meziane, 2002).
(3) : Papilles génitales chez un
mâle et une femelle d'O. niloticus (Source : FAO, 2002).
Une grande partie de l'énergie de la femelle est investie
dans la production d'ovules, l'incubation des oeufs et la garde des jeunes
larves*.
Les reproductions incontrôlées provoquent une
surpopulation qui entraîne une diminution de la croissance par manque de
nourriture et/ou d'oxygène disponible.
Outre que le sexe, il existe d'autres facteurs qui influencent la
croissance d' Oreochromis niloticus en élevage intensif, tel
que :
- La température : une élévation de
celle-ci pour un poids corporel donné produit une
augmentation de la vitesse de croissance ;
- L'alimentation : elle agit sur la croissance via trois
paramètres ; la qualité de l'aliment, le taux de nourrissage et
la fréquence de nourrissage ;
- L'oxygène dissous : il exerce une action positive sur la
croissance quand sa teneur augmente (>3 mg/l avec un optimum de 5 mg/l) ;
- La biomasse* : son augmentation a un effet négatif sur
la croissance s'exprimant
par un stress du aux contacts inter-individuels
;
- M.E.S. : l'effet négatif des M.E.S. sur la croissance
pourrait provenir du stress mécanique exercé sur les branchies
avec un métabolisme réduit.
Les principales techniques utilisées pour remédier
aux problèmes de faible croissance des femelles et de reproduction
anarchique sont les suivantes :
· Une charge importante permettant de bloquer la
reproduction, mais n'évite pas le problème de faible croissance
des femelles ;
· La production d'individus triploïdes* (3n
chromosomes) stériles (plus de reproductions anarchiques et meilleure
croissance), soit directement avec un choc thermique appliqué sur les
oeufs peu après la fécondation, soit indirectement par croisement
entre des Tilapias tétraploïdes* (4n chromosomes) fertiles obtenus
aussi par choc thermique au moment de la première division cellulaire
(mitose) et des individus normaux diploïdes* (2n chromosomes) ;
· la production d'alevins monosexes mâles.
6.1. La production d'alevins monosexes
mâles
Les Tilapias, avec plus de 20 espèces
déjà utilisées en élevage (Guerrero, 1982), sont
particulièrement appréciés pour leur robustesse, leur
large distribution, leur taux de croissance important et leur reproduction
aisée. Ces particularités biologiques conduisent, en milieu
confiné, à une surpopulation, avec une tendance au nanisme
(Lazard, 1984).
C'est pourquoi le contrôle strict de la reproduction
devrait permettre d'améliorer la rentabilité des élevages.
Les techniques envisagées pour contrôler la reproduction des
poissons cherchent à agir sur le développement de la gonade* soit
en modulant son activité (stimulation, inhibition temporaire ou
définitive), soit en l'orientant vers le sexe qui possède les
meilleures potentialités aquacoles (Mires, 1982).
L'élevage d'O. niloticus de consommation
concerne de plus en plus les populations monosexes mâles, pour
éviter les reproductions incontrôlées et obtenir de
meilleurs rendements, étant donné que les mâles grandissent
plus rapidement que les femelles.
Trois techniques sont utilisées pour produire des
populations monosexes mâles : la séparation des sexes, les
hybridations* interspécifiques et l'inversion hormonale* du sexe.
· La première consiste à élever
les alevins jusqu'à un stade qui permet de sexer les poissons par examen
de la papille uro-génitale. Cette méthode représente un
gaspillage de surface, d'eau et d'aliment puisque les femelles ne sont
éliminées que lorsqu'elles atteignent la maturité sexuelle
(Rothbard et al., 1983).
· L'hybridation des espèces de Tilapia conduit
à une progéniture caractérisée par une proportion
élevée de mâles (Mires, 1982). Le désavantage de
cette méthode est la nécessité de maintenir une souche
pure de géniteurs. Dans le cas contraire la proportion de mâles
dans la descendance s'écarte fortement des 100% attendus.
· L'inversion hormonale du sexe :
o Inversion "directe" qui consiste à masculiniser* une
population d'alevins en
incorporant un stéroïde* dans
l'alimentation (Baroiller & Jalabert, 1989) ;
o Fabrication de mâles transsexuels* (femelles à
génotype* mâle) avec de
l'oestradiol*. Leur descendance avec
des mâles donnera 100 % de mâles.
Le sexage utilisé en Afrique ne peut être
effectué que sur des animaux matures. Par ailleurs, il nécessite
du temps et de la main d'oeuvre et s'accompagne d'au moins 10 % d'erreurs de
diagnostic (Lazard, 1980). En ce qui concerne l'hybridation, il est difficile
de maintenir un pourcentage très élevé de mâles
hybrides de première génération. Ceci est lié
à la contamination des souches parentales de géniteurs par des
descendants hybrides. En revanche, l'inversion hormonale masculinisante s'est
révélée être un outil fiable.
6.2. Le traitement hormonal des alevins
La technique d'inversion hormonale du sexe,
démontrée pour la première fois chez Oryzias
latipes (poisson chat) (Yamamoto in FAO, 2002), consiste à
obtenir une population d'individus phénotypiquement identiques par
administration de stéroïdes, à des doses et selon des
moments, des modes et des temps d'administration propres à chaque
espèce (Baroiller, 1996). Ainsi avec les androgènes*, les alevins
à génotype femelle sont amenés à se
développer comme des mâles fonctionnels, ce qui conduit à
l'obtention d'une population à phénotype* 100% mâle. Ce
traitement aux androgènes a conduit à des résultats
intéressants chez plusieurs espèces de Tilapia (Guerrero &
Guerrero, 1988).
L'inversion "directe" consiste à administrer de la
méthyltestostérone aux alevins avant qu'ils n'aient atteint la
différenciation sexuelle (avant le 60ème jour chez
O. niloticus) (Jalabert et al., 1974) (Mcandrew &
Majumdar, 1989).
Ce traitement est appliqué depuis 3 à 7 jours
après l'éclosion pendant 2 à 4 semaines, ce qui permet
d'obtenir 95 à 100 % de mâles à la suite de l'inversion des
femelles en mâles à génotype femelle. Cette technique doit
être réalisée en conditions intensives pour que les alevins
ne puissent absorber que l'aliment dans lequel est incorporée la
méthyltestostérone.
Chez Oreochromis niloticus, les potentialités
stéroïdogènes des gonades mâles et femelles ont
été analysées durant les trois premiers mois de leur vie ;
cette période couvre les processus de la différenciation
ovarienne et testiculaire. La testostérone* peut être
synthétisée par les gonades des deux sexes contrairement à
l'oestradiol dont la production est spécifique à l'ovaire. Or,
certains androgènes comme la 11 f3-hydroxyandrosténedione (11
f3-OHA4) et l'andrénostérone s'avèrent spécifiques
du sexe mâle durant cette même période et présentent
des potentialités masculinisantes (Baroiller & Toguyeni, 1996).
Les stéroïdes artificiels présentent une
meilleure efficacité de masculinisation que les androgènes
naturels. L'efficacité de la 17cL-méthyltestostérone* est
attribuée à son élimination plus lente que celle des
stéroïdes naturels comme la testostérone (Baroiller, 1988).
Les alevins de Tilapia traités aux androgènes présentent
généralement une croissance plus rapide que ceux non
traités (Rothbard et al., 1983).
La préparation et l'administration de l'aliment sont
décrits par Rothbard et al., 1983 :
· Dissolution de 50 mg de 17
cL-méthyltestostérone* (pour la masculinisation) ou de 60
mg
de 17 cL-éthynyltestostérone* (pour la féminisation) dans
0,7 l d'éthanol à 95% ;
· Mélange de la solution dans 1 kg d'aliment ;
· Évaporation de l'éthanol par séchage
du mélange au soleil durant quelques heures ;
· Nourrissage des alevins* à raison de 14% de leur
poids par jour.
Sa mise en oeuvre ne peut s'envisager que dans des stations
spécialisées mettant en oeuvre des techniques de précision
: dosage de l'hormone, contrôle de l'eau d'alimentation, utilisation
d'antibiotiques. Les dangers d'utilisation de ces hormones pour une production
destinée à la consommation humaine peuvent exister, même si
leur ampleur est inconnue.
Cette technique est utilisée depuis plusieurs
années par certains pays producteurs de Tilapia comme Israël,
Taiwan et les philippines. Toute fois, elle implique de traiter chaque nouvelle
population d'alevins destinés à la production. Or, l'utilisation
de l'hormone pour la production destinée à la consommation
humaine reste interdite dans de nombreux pays (France, Royaume Uni...) pour qui
le devenir et l'effet des produits de dégradation des
stéroïdes de synthèse sont insuffisamment
étudiés (Baroiller & Toguyeni, 1996).

Notre travail au niveau du CNDPA consiste à
réaliser une inversion sexuelle sur des larves de Tilapia en incorporant
une hormone (17 alpha-méthyltestostérone) dans l'aliment à
distribuer selon la méthode décrite paùr Rothbard et
al. (1983). Cette technique est appliquée sur deux lots avec une
durée d'application différente. Leur sex-ratio est obtenu par
examen de la papille uro-génitale et par squash gonadique.
D'autre part, une étude de la croissance des individus de ces deux lots
est envisagée.
1. Matériel biologique
Notre expérience nécessite une famille de
larves, afin de réaliser une inversion hormonale du sexe, obtenue en
faisant reproduire des géniteurs de Tilapia (Fig.7). Ces
géniteurs, proviennent du CNDPA et sont identifiés à
partir de la cette systématique :
Règne :
Animal
Phylum :
Métazoaires*
Embranchement :
Vertébrés*
Classe :
Poissons
Ordre : Perciformes
Famille :
Cichlides
Genre :
Oreochromis
Espèce : Oreochromis
niloticus

O. niloticus
Mâle

O. niloticus
Femelle
Figure 7 : Mâle et femelle du Tilapia
Oreochromis niloticus.
Les géniteurs sont sélectionnés en fonction
de leurs tailles et de leurs poids pour former un lot homogène et
éviter toute agressivité entre les individus (Tab.I).
Tableau I : Poids des géniteurs mis en
reproduction.
|
Femelles (poids en g)
|
39
|
37
|
36
|
36
|
35
|
35
|
35
|
34
|
34
|
|
Mâles (poids en g)
|
|
47
|
|
|
45
|
|
|
43
|
|
2. Matériel de laboratoire
Notre expérience s'est déroulée sur une
durée de cinq mois (20 semaines) en trois phases dans trois milieux
d'élevage différents :
Première phase : Reproduction des
géniteurs, pendant quatre semaines, dans un Raceway en fibre de verre de
4,40 m de long, de 0,80 m de profondeur et d'un volume de 2,50 m3
(fig.8A);
Deuxième phase : Inversion sexuelle sur les
larves, pendant quatre semaines, dans des aquariums de 0,70 m de longueur, 0,30
m de largeur, 0,40 m de profondeur et d'un volume de 0,84 m3
(fig.8B)
Troisième phase : Prégrossissement
des alevins, pendant 12 semaines, dans des bassins circulaires en ciment, en
hors sol à l'extérieur, de 2,50 m de diamètre, 01 m de
profondeur et d'un volume de 3,50 m3 (fig.8C)

Figure 8 : Enceintes d'élevage
où se sont déroulés les trois phases de
l'expérience
(A : Raceway ; B : aquariums ; C : Bassin
circulaire).
Le Raceway, les aquariums et les bassins circulaires sont
remplis, au début de chacune des trois phases avec une eau de puit non
chlorée.
L'entretien de ces installations est facile. Le Raceway et les
aquariums nécessitent un renouvellement journalier de 20% du volume
d'eau ainsi qu'une évacuation de déchets avec une pompe manuelle
(fig.9A), sans que les poissons ne soient manipulés.
L'entretien hebdomadaire consiste lui à un nettoyage
rigoureux des parois et une vidange complète avec une pompe
émergée (fig.9B).
Les bassins circulaires sont vidangés tous les dix
jours, au moment des pesées, pour éviter de détruire la
flore et de la faune planctonique qui prolifère dans les bassins et dont
se nourrissent les poissons.

Figure 9 : Pompes servant à vidanger
les enceintes d'élevage.
(A : pompe manuelle ; B : pompe
émergée).
Néanmoins, un certain nombre de précautions
doivent être prises pour assurer des conditions optimales durant la
reproduction et la période d'alevinage* ; c'est pour cela que le Raceway
et les aquariums sont munis de thermostats (fig. 1 0A) pour maintenir la
température au dessus de 26°C, de pompes à aération
(fig.10B) pour garder le taux d'oxygène dissous au dessus de 3 mg/l
ainsi qu'un filtre mécanique (fig. 1 0C).
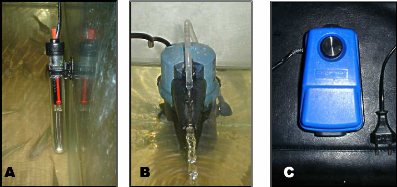
Figure 10 : Matériel utilisé
pour maintenir les conditions physico-chimiques à l'optimum
(A :
Thermostat ; B : Filtre mécanique ; C : Pompe d'aération).
3. Protocole expérimental 3.1. Reproduction
Pour obtenir nos trois lots d'alevins, nous avons placé
le 23 mars 2005 des géniteurs de Tilapia en reproduction dans le Raceway
; ce système minimise le risque qu'une femelle prête à
pondre ne soit fécondée. Le seul inconvénient
réside dans le fait que les poissons, une fois prêts, se
reproduisent rapidement et que l'observateur humain n'y assiste que rarement.
En revanche, le Raceway présente un certain nombre d'avantages, à
savoir :
· Ne nécessite que peu d'espace, comparé aux
bassins ;
· Contrôle permanent des conditions environnementales
et des phases de l'élevage ;
· Récolte aisée et fréquente de la
production ;
· Possibilité d'intervention dès le moindre
problème ;
· Facilité de traitement thérapeutique lors
de l'apparition de maladies ;
· Gestion très précise de la descendance.
3.2. Récolte du frai
La première récolte des larves, après
mise en charge des Raceway, est généralement effectuée
entre le 11ème et le 34ème jour (Guerrero & Guerrero, 1988).
Dans notre cas, la récolte des larves est réalisée 29
jours après la mise en reproduction des géniteurs,
c'est-à- dire le 21 avril 2005. Cette récolte journalière,
facilement réalisable, présente plusieurs avantages:
- les jeunes alevins sont au stade de la nage libre et se
déplacent en "nuage", s'ils ne sont pas directement
récoltés de la bouche des femelles;
- la prédation des jeunes par les adultes est
réduite au minimum ;
- les soins à apporter aux oeufs et aux larves
vésiculées sont minimes.
La récolte des larves est effectuée à
l'aide d'épuisettes à fines mailles (fig. 1 1A). Par contre, la
capture des géniteurs se fait avec des épuisettes ou un salabre*.
Cette capture nous permet d'examiner l'état des géniteurs et de
prélever les oeufs et les larves en incubation dans la bouche des
femelles incubantes (fig. 1 1B).
CHAPITRE II : Matériels et méthodes

B

A
Figure 11 : (A) : Epuisette servant à
capturer les femelles incubantes.
(B) Récolte des larves en incubation dans la bouche d'une
femelle.
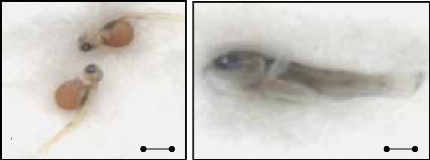
Lors de cette récolte, nous avons prélevé
des larves à quatre stades différents (fig. 12). Concernant
l'expérience de l'inversion hormonale, nous avons choisis des larves
avec leurs sacs vitellins pour leur éviter d'ingérer un aliment
exogène (fig. 1 2C).

A
2 mm

B
1,7 mm
1 mm
D
C
1,5 mm
Figure 12 : Les différents stades de
vie des larves prélevées chez les femelles incubantes.
(A :
oeuf en début d'éclosion ; B : oeuf éclos ;
C : larve
pendant la résorption vitelline ; D : larve après la
résorption vitelline).
300 larves sont prélevées du Raceway de
reproduction et sont réparties équitablement dans trois
aquariums, ils vont y restés un mois avant d'être
déversés dans trois bassins de pré grossissement. Le reste
est mis dans un Raceway pour faire l'objet de repeuplements. Les trois lots
sont élevés de la même façon et sont soumis aux
mêmes conditions. La seule variante est la présence ou pas
d'hormone dans l'aliment ainsi que la durée du traitement.
Pour l'inversion sexuelle, les trois lots de larves seront
nourris comme suit :
Le lot 01 est le lot témoin ; il est nourri pendant
toute l'expérience avec l'aliment artificiel dépourvu d'hormone
;
Le lot 02 est un essai basé sur l'expérience
égyptienne, il est nourri avec l'aliment traité à
l'hormone 17 a-Méthyltestostérone pendant une semaine ;
Le lot 3 est traité avec la même hormone pendant
un mois (quatre semaines).
Pour le reste de l'expérience, les lots 02 et 03 sont
nourris avec l'aliment sans hormone. 3.3. Alimentation des
géniteurs et des alevins
3.3.1. Composition de l'aliment :
L'aliment utilisé durant notre l'expérience est
un aliment industriel de marque « SEKIRIN BASIC »
présenté dans des sachets de 500 g, les granulés sont de
taille moyenne (fig. 1 3A). L'aliment est fabriqué en Malaisie avec la
composition suivante : farine de poisson, farine de
crevette, farine de blé, son de
riz, farine de soja, farine de
maïs, caroténoïdes,
vitamines A, B1, B2,
C et E, Calcium,
Magnésium, biotine* et autres
oligoéléments. Les analyses physico-chimiques de
l'aliment ont révélé ces teneurs :
Tableau II : Composition de l'aliment
utilisé pendant l'expérience.
Composants
|
% de la matière sèche
|
Protéines Fibre
Matières grasses Matières minérales
Humidité
|
Min. 33
Max. 3
Min. 4
Max. 3
10
|
|
Cet aliment est broyé à l'aide d'un broyeur
électrique (fig. 1 3B) puis tamisé avec un tamis de 500 jt de
porosité pour faciliter son ingestion aux larves, on obtiendra ainsi un
pulvérulent (fig. 1 3C).
3.3.2. Traitement hormonal des alevins
:
L'aliment traité à l'hormone est
préparé selon la méthode de Rothbard et al.
(1983) :
Dissoudre 12,5 mg de 17
á-Méthyltestostérone dans 175 ml
d'éthanol à 95% puis mélanger la
solution avec 250 g d'aliment broyé
à l'aide d'une spatule en inox dans un récipient en plastique. On
laisse évaporer l'alcool à l'air libre pendant quelques heures.
L'ensemble de ces opérations doit être pratiqué avec des
gants et un masque pour éviter tout contact direct avec l'hormone.

Figure 13 : Aliment utilisé pour le
nourrissage des larves durant l'expérience
(A : granulé ; C :
pulvérulent). (B : Broyeur utilisé pour piler l'aliment.)
3.3.3. Ration alimentaire* et fréquence de
nourrissage :
La ration alimentaire journalière (R.A.) est
calculée selon cette formule (FAO, 2002) :
R. A. = (Pm x T. N. / 100) x Nombre
d'individu
Pm : poids moyen (g) ; T.N.
: taux de nourrissage
Le taux ainsi que la fréquence de nourrissage, au
début de l'expérience, sont les mêmes pour les trois lots
mais ce taux change en fonction du poids moyen de larves, il est de 14% de
biomasse pour les larves, de 11% pour les petits alevins de 2 g, de 10% pour
ceux d'environ 5 g et de 6% pour les individus d'environ 40 g
(géniteurs) pour qui l'aliment est présenté sous forme
granulée avec une ration alimentaire de 29 g/j. Pour le poids moyen
d'une larve fraîchement éclose, on utilise la valeur de 10 mg
(confirmée par FAO, 2002). La ration alimentaire est distribuée
deux fois par jour.
Une fois l'administration de l'hormone au lot n°03 est
terminée (22 mai 2005), les lots d'alevins sont transférés
vers les bassins circulaires, se trouvant à l'extérieur, pour la
phase de prégrossissement qui se prolonge jusqu'au 13 août 2005
(12 semaines).
4. Suivi des paramètres physico-chimiques et
biologiques: 4.1. Paramètres physico-chimiques :
Par précaution, les paramètres
physico-chimiques de l'eau (température, pH et oxygène dissous)
sont surveillés tous les jours, pendant toute la durée de
l'expérience ; ils sont prélevés à l'aide d'un
analyseur multi paramètre (fig.14). (Annexe 02, 03 et 04).

Figure 14 : Analyseur multi paramètres
servant à mesurer les paramètres
physico-chimiques
(température, pH et oxygène dissous...).
4.2. Paramètres biologiques :
Des informations significatives de la « condition »
des poissons sont révélées par les mesures du poids, de la
taille et du taux de mortalité. Pour suive et étudier la
croissance des trois lots, un échantillonnage* de dix larves est
effectué de chaque lot, chaque semaine à partir du 23 avril 2005
jusqu'au transfert des larves vers les bassins circulaires (le 21 mai 2005).
Au-delà, l'échantillonnage se fera tous les dix jours
jusqu'à la fin de l'expérience (le 15 août 2005). Les
résultats sont présentés dans le chapitre III et dans
l'annexe 05.
4.2.1. Poids :
La biométrie des poids est effectuée à
l'aide d'une balance à précision (fig.15A). Nous prenons en
considération les poids moyens (Pm) de chaque lot. La
détermination du Pm est nécessaire pour le calcul de la nouvelle
ration alimentaire.
4.2.2. Taille :
Pour le suivi de la croissance linéaire des alevins,
les mesures des tailles sont effectuées au même moment que celle
des poids, à l'aide d'un ichtyomètre* (fig. 1 5B). Sont retenues,
les tailles moyennes (Tm).
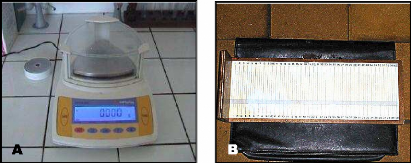
Figure 15 : Matériel utilisé
pour mesurer les paramètres biométriques pendant le suivi
de
la croissance (A : Balance à précision ; B :
Ichtyomètre).
4.3. Méthodes de calcul :
4.3.1. Croissance relative (relation taille - poids)
(Tessier, 1948) :
Une relation d'allométrie de type W = a
Lb lie le poids d'un poisson à sa longueur ; dans
cette équation :
W : poids du poisson (g).
L : longueur du poisson (cm).
a : constante.
b : coefficient d'allométrie ( entre le
poids et la longueur ).
* Si b = 3, la croissance est dite isométrique,
c'est-à-dire que W croît proportionnellement au cube de la
longueur.
* Si b < 3, l'allométrie est minorante,
c'est-à-dire que W croît moins vite que le cube de la longueur.
* Si b > 3, l'allométrie est majorante, c'est
à dire que W croît plus vite que le cube de la longueur. Les
valeurs de a et b s'obtiennent en transformant la fonction exponentielle ci-
dessus en fonction linéaire de type: Ln W = Ln a + b Ln L
4.3.2. Taux de mortalité :
Le taux de mortalité (T. M.) est déterminé
au moment des échantillonnages comme
suit :
T. M. (%) = (Nb d'individus morts / Ni) x
100
Ni : effectif initial
5. Étude de l'inversion sexuelle
L'étude de l'inversion sexuelle est effectuée
sur les lots traités à la 17 ct-MT. Pour cela, et après 16
semaines d'élevage, les poissons ont atteint un poids moyen de 13,03 g
et une taille moyenne de 9,3 cm qui nous permettent d'effectuer un sexage
manuel pour déterminer leur sex-ratio*, et de confirmer ces
résultats au moyen d'un microscope photonique en pratiquant des
squashs gonadiques*.
5.1. Sexage manuel :
La technique de sexage manuel est pratiquée par examen
de la papille urogénitale. Avec cette méthode, un pourcentage
d'erreur n'est pas à exclure. Pour avoir une bonne fiabilité des
résultats, tous les individus des trois lots vont être soumis
à cette même technique (fig. 16).
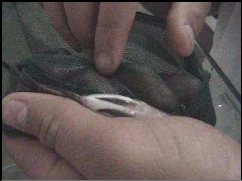
Figure 16 : Examen de la papille
génitale pour déterminer le sexe de l'individu. 5.2.
Squash gonadique :
Après le sexage manuel, et lorsque les
caractéristiques histologiques de la différenciation gonadique
femelle et mâle sont bien engagées, tous les alevins de chaque lot
sont sacrifiés et disséqués pour extraire les gonades et
les examiner, par simple squash sous microscope à un
grossissement de 10x et 40x.
La présence d'ovocytes*
prévitellogéniques ou vitellogéniques* définit
l'appareil génital femelle et celle de formes lobulaires ou des amas de
spermatozoïdes caractérisent la présence de tissus
testiculaires et par conséquent le sexe phénotypique.

1. Etude des paramètres physico-chimiques 1.1.
Dans le Raceway de reproduction
30
25
T °C
pH
O2 dissous mg/l
20
15
10
5
0
26/3/05 28/3/05 30/3/05 1/4/05 3/4/05 5/4/05 7/4/05 9/4/05
11/4/05 13/4/05 15/4/05 17/4/05 19/4/05 21/4/05

Dates
(Durée de
l'expérience)
Figure 17 : Paramètres physico-chimiques
du Raceway de reproduction
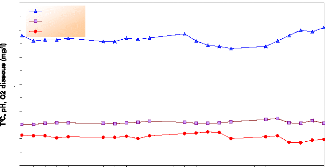
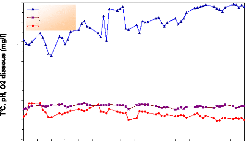
La figure 17 représente les variations des
paramètres physico-chimiques durant la phase de reproduction qui s'est
déroulée du 26 mars au 21 avril 2005, la température varie
entre 21.6 et 25.5 °C avec une moyenne de 23.35 #177; 1.00 °C, ce qui
correspond à la saison (début de printemps) ; le pH fluctue entre
7,6 et 8,7 avec une moyenne de 7.95 #177; 0.28 et l'oxygène dissous
entre 4.2 et 6.2 mg/l avec une moyenne de 5.3 #177; 0.53 mg/l.
1.2. Dans les aquariums d'alevinage :
35
30
Dates
(Age des poissons)
Dates
(Age des poissons)
25
20
T°C
pH
O2 dissous mg/l
25
20
T°C
pH
O2 dissous mg/l
15
15
10
10
5
5
0
23/4/05 27/4/05 1/5/05 5/5/05 9/5/05 13/5/05 17/5/05 21/5/05
0
23/4/05 27/4/05 1/5/05 5/5/05 9/5/05 13/5/05 17/5/05 21/5/05
35
30
Aquarium 01 (lot témoin) :
Aquarium 02 (lot traité ~ une semaine) :
Aquarium 03 (lot traité '3 un mois) :
35
30
25 T°C
pH
20 O2 dissous mg/l
15
10
5
0
23/4/05 27/4/05 1/5/05 5/5/05 9/5/05 13/5/05 17/5/05 21/5/05

Dates
(Age des poissons)
Figure 18 : Paramètres physico-chimiques
des aquariums 01, 02 et 03
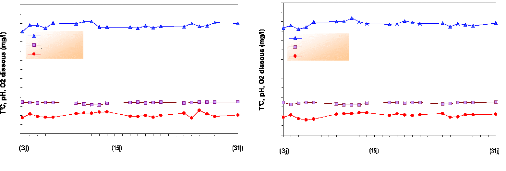
Pour cette deuxième phase de l'expérience qui
est l'alevinage et l'inversion sexuelle, nous avons essayé de maintenir
les paramètres physico-chimiques à l'optimum pour minimiser les
facteurs de stress aux poissons (fig.18). Cette phase a duré un mois (du
21 avril au 21 mai 2005) avec des moyennes de température de 29.4 #177;
0.69°C pour les aquariums 01 et 02 et 29.8 #177; 0.64°C pour
l'aquarium 03.
La moyenne retenue pour le pH est de 8.42 #177; 0.23 pour
l'aquarium 01, de 8.4 #177; 0.25 pour l'aquarium 02 et de 8.42 #177; 0.23 pour
l'aquarium 03.
Pour l'oxygène dissous, une moyenne de 5.1 #177; 0.60 mg/l
est relevée de l'aquarium 01, de 5.2 #177; 0.55 mg/l de l'aquarium 02 et
de 5.06 #177; 0.62 mg/l de l'aquarium 03.
1.3. Dans les bassins de
prégrossissement
T°C
pH
O2 dissous mg/l
35
30
T°C
pH
O2 dissous mg/l
25
25
20
20
15
15
10
10
5
0
22/5/05 1/6/05 11/6/05 21/6/05 1/7/05 11/7/05 21/7/05 31/7/05
10/8/05
(32 j) (52 j) (72 j) (92 j) (112 j)
Dates
(Age des poissons)
5
0
22/5/05 1/6/05 11/6/05 21/6/05 1/7/05 11/7/05 21/7/05 31/7/05
10/8/05
(32 j) (52 j) (72 j) (92 j) (112 j)
Dates
(Age des poissons)
26
35
30
Bassin 01 (lot témoin) : Bassin
02 (lot traité '3 une semaine) :
Bassin 03 (lot traité ~ un mois) :
35
30
T°C
pH
O2 dissous mg/l
25
20
15
10
5
0
22/5/05 1/6/05 11/6/05 21/6/05 1/7/05 11/7/05 21/7/05 31/7/05
10/8/05 (32 j) (52 j) (72 j) (92 j) (112 j)
Dates
(Age des poissons)
Figure 19 : Paramètres physico-chimiques
des bassins 01, 02 et 03
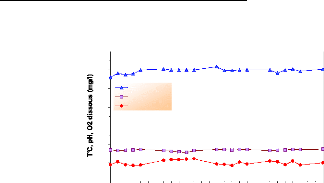
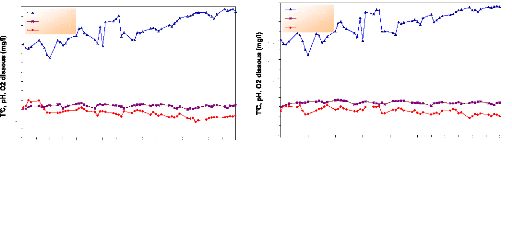
Le prégrossissement des alevins s'est
déroulé à l'extérieur (en plein air) durant 03 mois
(du 22 mai au 13 août 2005), ce qui explique les fluctuations de ces
paramètres (fig.19), surtout la température qui varie pour les
trois bassins de 21.33°C en début juin à 34.3°C
à la mi-août, avec une moyenne de 28.9 #177; 3.5°C pour le
bassin 01, 29.4 #177; 3.39°C pour le bassin 02 et 29.8 #177; 3.58°C
pour le bassin 03. Cette hausse est relative à la saison estivale.
Le pH varie pour les trois bassins de 7.53 à 9.27 avec
une moyenne de 8 #177; 0.4 pour le bassin 01, 8.57 #177; 0.38 pour le bassin 02
et 8.5 #177; 0.4 pour le bassin 03.
En ce qui concerne l'oxygène dissous, ses valeurs
varient de 4.47 à 9.07 mg/l avec des moyennes de 6.5 #177; 1.2 mg/l pour
le bassin 01, 6.42 #177; 0.85 mg/l pour le bassin 02 et 6.5 #177; 1.1 mg/l pour
le bassin 03.
Conclusion :
Le Tilapia est une espèce relativement euryèce
qui s'adapte à de larges variations écologiques. Les
paramètres physico-chimiques relevés tout au long de
l'expérience semblent convenir totalement à Oreochromis
niloticus et l'ensemble des valeurs se trouve dans l'intervalle optimum de
l'espèce.
2. Etude des paramètres biologiques
2.1. Etude de la croissance
2.1.1. Croissance pondérale
16
14
12
lot 1
lot 2
lot 3
10
8
6
4
2
0
0 10 20 30 40 50 60 70 80 90 100 110 120
Age des larves (j)
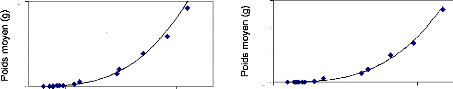
Figure 20 : Croissance d'Oreochromis
niloticus en fonction du poids moyen
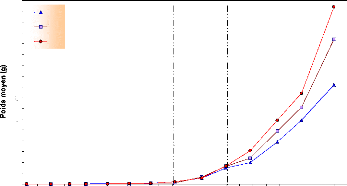
Dans le graphe ci-dessus, on remarque que les alevins sont
passés d'un poids de 0.01g pour les trois lots à la fin avril
à un poids de 9.2 g pour le lot 01, de 13.4 g pour le lot 02 et de 16.4
g pour le lot 03 à la mi-août. On remarque aussi que les trois
courbes de l'évolution pondérale, ont la même allure ; la
différence demeure dans la cinétique de croissance pour chaque
lot. Suite à ça, on peut diviser le graphe en trois parties :
Une croissance plutôt stationnaire
pendant les sept premières semaines (1-55 JAE**) où on
décèle un gain de poids de 0.22 g pour le lot 01, de 0.1 g pour
le lot 02 et de 0.22 g pour le lot 03 ;
Une croissance lente pendant trois semaines
(55-75 JAE), où le gain de poids est de 1.3 g, 1.54 g et 1.46 g
respectivement pour les lots 01, 02 et 03 ;
Une croissance qui s'accélère
nettement pendant les six dernières semaines (75-115 JAE) avec un gain
de poids de 7.7 g pour le lot 01, 11.8 g pour le lot 02 et 14.7 g pour le lot
03.
**JAE : jours après éclosion
2.1.2. Croissance linéaire
10
9
8
7
6
5
4
3
2
1
0
lot 1
lot 2
lot 3
0 10 20 30 40 50 60 70 80 90 100 110 120
Age des larves (j)
Figure 21 : Croissance d'Oreochromis
niloticus en fonction des tailles moyennes
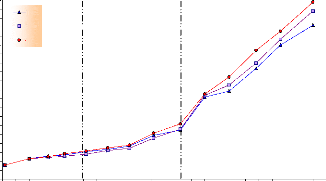
Pour la croissance linéaire, on remarque le même
schéma d'évolution que pour la croissance pondérale. De la
figure 21, on peut remarquer que les alevins sont passés d'une taille de
0.8 cm (à leur éclosion) à une taille de 8.6 cm pour le
lot 01, de 9.4 cm pour le lot 02 et de 9.9 cm pour le lot 03 à la fin de
l'expérience.
Le graphe nous montre aussi que les trois courbes sont
pratiquement superposées et ce jusqu'au 75ème jour.
Ensuite, l'évolution semble plus rapide pour le lot 03 que pour le lot 2
qui est encore plus rapide que pour le lot 01.
A partir de ces courbes, on peut déduire trois phases
pour les trois lots, qui correspondent à trois vitesses de croissance
:
Une croissance linéaire stationnaire
pendant le premier mois d'élevage (1-30 JAE) qui correspond à la
phase d'alevinage où le gain en taille est de 0.75 cm pour le lot 01,
0.6 cm pour le lot 02 et 0.78 cm pour le lot 03 ;
Une croissance linéaire lente pendant
le deuxième mois (30-65 JAE), avec un gain
en taille de 1.95 cm, 2 cm
et 2.29 cm respectivement pour les lots 01, 02 et 03 ;
Une croissance rapide pendant les deux
derniers mois (65-115 JAE), le gain en taille est de 5.86 cm pour le lot 01,
6.6 cm pour le lot 02 et 6.81 cm pour le lot 03 ;
Bien que les conditions physico-chimiques semblent convenir
à l'alevinage et bien que la ration alimentation soit respectée
et présentée sous forme pulvérulente pour faciliter son
ingestion aux larves, la première phase de la croissance
pondérale et linéaire d'aspect stationnaire, pourrait être
due au confinement du milieu (pendant l'alevinage dans les aquariums) ou
à l'inadaptation à l'aliment donné qui peut être
attribuée à son tour à différents facteurs :
formulation inadéquate, médiocre qualité des
matières premières ou taux de protéines en-deça des
valeurs préconisées par Jauncey & Ross (in FAO,
1989) (Tab. III).
Tableau III : Proportions des composés
alimentaires (en % de la matière sèche)
pour
différentes catégories de Tilapias (d'après
JAUNCEY & ROSS in FAO, 1989).
|
Composés (% mat. sèche)
|
<0.5g
|
0.5-10 g
|
10-35 g
|
35g
|
Géniteurs
|
|
Protéines brutes
|
50
|
35-40
|
30-35
|
25-30
|
30
|
|
Lipides bruts
|
10
|
10
|
6-10
|
6
|
8
|
|
Hydrates de C digestibles
|
25
|
25
|
25
|
25
|
25
|
|
Fibres
|
8
|
8
|
8-10
|
8-10
|
8-10
|
|
Vitamines
|
2
|
2
|
2
|
2
|
2
|
|
Minéraux
|
4
|
4
|
4
|
4
|
4
|
La deuxième phase de croissance correspond au
prégrossissement (31-115 JAE) qui se déroule dans les bassins
circulaires où la densité d'empoissonnement varie de 51.33
individus/m3 pour le lot 01, 33.33 individus/m3 pour le
lot 02 et 41.32 individus/m3 pour le lot 03 à 31 JAE
(correspond à la période où la croissance est lente)
à 44 individus/m3 pour le lot 01, 18 individus/m3
pour le lot 02 et 17 individus/m3 pour le lot 03 à 115 JAE
(correspond à la période où la croissance est rapide). Les
poissons sont placés en élevage mixte (lot 01), ou en
élevage monosexe (inversion hormonale : lots 02 et 03).
Vers 80-85 JAE, la croissance est rapide mais à des
vitesses différentes pour les trois lots. Nous pensons que cette
différence de croissance pourrait correspondre à la
maturité sexuelle du Tilapia qui intervient à cet âge dans
un élevage, sans oublier que les individus mâles présentent
une croissance nettement plus rapide que les femelles et atteignent une taille
nettement supérieure (lot 03).
On remarque que durant cette troisième phase, la
croissance du lot 02 est plus rapide que celle du lot 01 bien qu'ils aient le
même sex-ratio et soient élevés dans les mêmes
conditions. La seule variante réside dans la densité
d'empoissonnement des bassins qui est moins importante pour le lot 02.
On remarque aussi que la croissance du lot 03 est plus rapide
que celle du lot 02 bien que la densité ainsi que les conditions
d'élevage sont les mêmes pour les deux lots. La seule variante
réside dans le pourcentage des mâles et le sex-ratio dans chaque
lot qui tend vers 1/1 (mâle/femelle) dans le lot 02 et vers 1/0 dans le
lot 03.
On peut déduire que deux paramètres ont
influencé la croissance des alevins des trois lots durant toute
l'expérience : 1) la densité d'élevage et 2) le
sex-ratio.
Conclusion :
L'hétérogénéité du poids
des poissons soumis à un même traitement augmente avec la
croissance. Ces différences de croissance dans un groupe (lot) de
poissons ayant le même poids initial et vivant dans les mêmes
conditions peuvent s'expliquer par le ratio sexuel, le comportement face
à l'aliment et/ou la génétique (Gardeur et al.
in Ouledmaamar & Tikerrouchine, 2005). Une densité
élevée serait probablement responsable d'un ralentissement de la
croissance d'individus du même lot, créant ainsi des écarts
relativement importants. De plus, ces différences de croissance ne
résultent pas seulement d'une compétition pour la nourriture mais
également peuvent être dues à une augmentation du stress
résultent de l'accroissement des contacts inter individus.
2.2. Relation taille-poids
Lot 01 (lot témoin) : Lot 02
(lot traité '3 une semaine):
10 15
W = 0,0129L3,0854
W = 0,01 14L3,162
R2 = 0,9893
10 R2 = 0,9842
5
5
0
0 2 4 6 8 10
Taille moyenne (cm) 0
0 2 4 6 8 10
Taille moyenne (cm)
Lot 03 (lot traité '3 un
mois):
15
20
W = 0,0105L3,2004
R2 = 0,9884
10
5
0
0 2 4 6 8 10
Taille moyenne (cm)
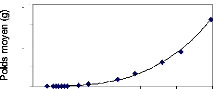
Figure 22 : Comparaison des relations
taille-poids entre les lots 01, 02 et 03
La figure 22 représente la relation taille-poids des
individus d 'Oreochromis niloticus étudiés.
L'application du modèle de croissance de Von Bertalanffy (Lazard et
al., 1990) montre qu'il existe une très bonne corrélation
pour les trois lots (R12 = 0.99 ; R22 = 0.98 ;
R32 = 0.99). Néanmoins, l'application d'un modèle peut
s'avérer hasardeuse vu le nombre réduit d'individus ainsi que les
conditions de l'expérience (utilisation d'hormone). Cependant, la valeur
de la pente obtenue pour les trois lots (3.08 ; 3.16 ; 3,2) est voisine de 3,
ceci est en accord avec la bibliographie étudiée (Moreau in
Lazard et al., 1990).
La représentation graphique de la relation taille-poids
du lot 01 montre que l'allométrie est isométrique, le coefficient
de croissance relative entre le poids et la longueur est égal à 3
(b = 3.0854), c'est à dire que le poids croit proportionnellement au
cube de la longueur, on remarque aussi un très bon coefficient de
corrélation (R2= 0,9893) qui met en évidence le
degré de corrélation entre les deux variables.
Concernant le lot 02, on remarque que le coefficient
d'allométrie est supérieur à 3 (b= 3,162), le type de
croissance est dit majorante c'est à dire que le poids croit plus vite
que le cube de la longueur et la corrélation entre les deux variables
est très élevée (R2= 0,9842).
La représentation graphique de la relation taille-poids
du lot 03 présente un coefficient d'allométrie supérieur
à 3 (b= 3,2004), le type de croissance dans ce cas est dit majorante ;
c'est à dire que le poids croit plus vite que le cube de la longueur et
les deux variables sont bien corrélées (R2=
0.9884).
D'après les résultats obtenus, nous pouvons avancer
que les alevins n'évoluent pas de la même manière puisque
nous sommes en présence de deux types de croissance.
Sachant que les trois lots d'alevins sont placés dans
des conditions d'élevage similaires et que la seule variante est
l'incorporation ou pas d'hormones dans l'aliment ainsi que sa durée
d'administration aux alevins, on peut conclure selon les observations
notées pendant l'expérience que les alevins de Tilapia
traités aux androgènes présentent
généralement une croissance plus rapide que les individus non
traités, confirmé par Rothbard et al. (1983).
2.3. Etude du taux de mortalité
cumulée
80
70
60
50
40
30
20
10
0
lot 1
lot 2
lot 3
0 10 20 30 40 50 60 70 80 90 100 110 120
Age des larves (j)
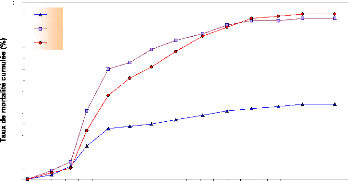
Figure 23 : Mortalité cumulée
chez Oreochromis niloticus
D'après la figure 23, les taux de mortalité sont de
23 % pour le lot 01, de 52 % pour le lot 02 et de 38 % pour le lot 03 pour le
premier mois d'alevinage.
Nous pensons particulièrement au cannibalisme* et
à l'agressivité reconnue du Tilapia pour expliquer ces
mortalités, car c'est au cours de la période d'alevinage que ce
phénomène est le plus à craindre (Lazard et al.,
1990) et que quelques larves mortes avaient les yeux perforés et le
corps déchiqueté. Nos suppositions semblent être
confirmées par Balarin & Haller (1982); ils ont
démontré qu'il arrive également que le cannibalisme
apparaisse parmi les alevins d'une même ponte. Dans ce cas, la
différence de poids et/ou de taille (rapport 3 à 1) engendre un
comportement agressif allant jusqu'au cannibalisme; ce qui semble se produire
dans notre expérience d'après les résultats de la
pesée du 21 mai 2005 (par exemple, nous avons des individus de 0.123 et
de 0.016 g dans le lot 01 et des individus de 0.052 et 0.0 17 g dans le lot
02). Cette hétérogénéité du poids et de la
taille apparaît, pour les trois lots, durant toute la durée de
l'expérience.
2.4. Etude de l'inversion sexuelle
Tableau IV : Résultats du sexage manuel
et du squash gonadique pratiqués sur les individus
d' Oreochromis niloticus.
|
Effectif
|
Survie
|
Sexage manuel
|
Squash gonadique
|
|
au
|
(%)
|
|
|
|
|
|
|
|
|
|
|
|
sexage
|
(Ni=100)
|
6'
|
?
|
Ind.
|
6'?
|
Mâles
(%)
|
6'
|
?
|
Ind.
|
6'?
|
Mâles
(%)
|
|
Lot 01
|
66
|
66
|
24
|
36
|
6
|
0
|
36,36
|
31
|
26
|
9
|
0
|
46,96
|
|
Lot 02
|
27
|
27
|
20
|
3
|
4
|
0
|
74,07
|
13
|
3
|
0
|
11
|
48,14
|
|
Lot 03
|
25
|
25
|
24
|
1
|
0
|
0
|
96
|
24
|
1
|
0
|
0
|
96
|
Ni : effectif initial
Ind. : indéterminé
?? : Inversion incomplète, organisme avec
gonade mixte (hermaphrodite).
+ La survie des alevins, déterminée au moment du
sexage, diffère d'une manière significative entre le lot
témoin et ceux soumis à l'inversion hormonale.
+ Les sex-ratios des trois lots d'alevins (118 individus) ont
été déterminés par sexage manuel puis
confirmés par squash gonadique (Tab.IV). Aucune différence
significative n'apparaît dans le sex-ratio du lot 02 par rapport au lot
témoin
+ Le premier lot (témoin) présente un sex-ratio
de 1/1 (mâle/femelle), le deuxième lot (traité à
l'hormone pendant une semaine) présente aussi un sex-ratio de 1/1, par
contre, le troisième lot (traité à l'hormone pendant un
mois) a un sex-ratio de 1/0.
+ L'examen microscopique du lot 02 révèle que
40.74 % des individus présentent des caractéristiques
hermaphrodites c'est à dire que la gonade est mixte est présente
les deux tissus mâle et femelle à la fois. Nous pensons que
l'apparition de ce phénomène est liée à la courte
durée du traitement hormonal qu'a subi ce lot (une semaine). Car Chez
O. niloticus, la sensibilité au traitement hormonal
apparaît durant une période critique précise. Le traitement
pour être efficace doit être appliqué durant une
période minimale de 21 jours. Histologiquement, se déroulent
successivement chez les individus femelles, la prolifération ovogoniale
entre 20 et 28 JPF** (Baroiller, 1988). Chez le mâle, durant la
même période, se déroule la phase de multiplication
très progressive des cellules somatiques et spermatogoniales (Baroiller,
1988). Les hormones exogènes sont donc fournies à l'alevin avant
la mise en place de ces processus histologiques.
+ Le traitement du lot 03 à la 17 ct-MT a
déplacé significativement, par rapport au témoin, le
sex-ratio en faveur du sexe mâle.
Conclusion
De nos données, on peut conclure que
l'expérience de l'inversion du sexe par hormone est réussie pour
le lot 03 (traité à l'hormone pendant un mois), on a obtenu un
sex-ratio de 1/0 (mâle/femelle) par rapport au lot témoin qui
présente un sex-ratio de 1/1. Le deuxième lot (traité
à l'hormone pendant une semaine) présente le même sex-ratio
de 1/1, ce qui signifie que l'inversion sexuelle, dans ce lot, ne s'est
produite ou était incomplète.
Conclusion
L'objectif principal de la présente étude a
porté sur la technique d'inversion hormonale du sexe d'Oreochromis
niloticus, qui consiste à obtenir une population d'individus
phénotypiquement identiques par administration de stéroïdes
sexuels. Ce traitement aux androgènes a conduit à des
résultats très intéressants dans notre cas. En effet, au
terme de nos travaux, nous avons constaté que :
1. Les différentes phases d'élevage aussi bien
des géniteurs que des larves montrent que les paramètres
physico-chimiques relevés tout au long de l'expérience semblent
convenir parfaitement à Oreochromis niloticus puisque
l'ensemble des valeurs enregistrées se trouve dans l'intervalle optimum
de l'espèce.
2. Les sex-ratios des trois lots d'alevins ont
été déterminés par sexage manuel puis
confirmés par squash gonadique de la totalité des 118 poissons
obtenus soit trois lots. Un des deux lots traités à la 17a-MT
présente une déviation du sex-ratio par rapport au témoin.
Aucune différence significative n'apparaît dans le sex-ratio du
deuxième 02 par rapport à ce lot témoin.
3. Les alevins étant mis dans les mêmes
conditions expérimentales ont présenté des taux de
croissance assez faibles. Nous supposons que l'aliment fourni et le confinement
du milieu seraient la cause du nanisme observé. En plus de ce dernier,
nous avons eu des taux de mortalité pouvant atteindre des seuils
élevés. Nous pensons au cannibalisme et à
l'agressivité reconnue du Tilapia pour expliquer ces
mortalités.
4. Signalons enfin que les alevins de Tilapia traités
aux androgènes présentent généralement une
croissance plus rapide que les individus non traités (Guerrero, 1982 ;
Rothbard et al., 1983 ; Guerrerro & Guerrerro, 1988 ; Baroiller,
1988 ; Baroiller & Toguyeni, 1996 ).
5. La survie des alevins, déterminée au moment
du sexage, diffère d'une manière significative entre le lot
témoin et ceux soumis à l'inversion hormonale. 40,74% des
individus du lot 02 révèlent lors de l'examen microscopique de
leurs squashs des caractéristiques hermaphrodites. On pense que
l'apparition de ce phénomène est du à la courte
durée du traitement hormonal qu'a subit ce lot (une semaine)
Bibliographie
ADJOUT H. & MEZIANE N., 2002 - Etude
technico-économique d'une ferme aquacole de production intensive de
Tilapia nilotica intégrée à l'agriculture dans la
région d'Adrar au sud de l'Algérie. Master européen.
Amén. Gest. Prod. Aquat. Université Montpellier II : 61 p
ARRIGNON J., 2000 - Pisciculture en eau douce :
le Tilapia. Le technicien d'agriculture tropicale. Maisonneuve et Larose
: 125 p.
BALARIN J. D. & HALLER R. D., 1982 - The
intensive culture of Tilapia in tanks, raceways and cages. In: Muir &
Roberts (eds). Recent Advances in Aquaculture, vol. 1,
London
BALARIN J. D. & HATTON J. D., 1979 -
Tilapia: A guide to their biology and culture in Africa. Unit of
Aqua. Pathobio., Stirling University: 174 p.
BAROILLER J. F. & JALABERT B., 1989 -
Contribution of research in reproductive physiology to the culture of
Tilapias. Aquat. Living Resour. (2): 105-116.
BAROILLER J. F. & JALABERT B., 1990 -
Physiologie de la reproduction des Tilapias : Bilan des connaissances et
perspectives de recherche d'intérêt appliqué. In :
Lazard, Jalabert et Doudet (eds). L 'aqua. Tilapias du dév. Rech.
Cahiers scientifiques du CTFT (10) :
39-62.
BAROILLER J. F. & TOGUYENI A., 1996 -
Comparaison des effets d'un stéroide naturel, la 11
â-Hydroxy-androsténédione (11 â -OH-A4) et d'un
androgène de synthèse, la 1 7á -Methyltestostérone
(17 á-MT) sur le sex-ratio chez Oreochromis niloticus. In :
Pullin & Lazard (eds). Third International Symposium on Tilapia in
aquaculture, nov. 1991, Côte d'Ivoire. ICLARM Conf. Proc. (41) :
261-269.
BAROILLER J. F., 1988 - Etude
corrélée de l'apparition des critères morphologiques de la
différenciation de la gonade et de ses potentialités
stéroidogènes chez Oreochromis niloticus. Ph. D.
dissertation, University Pierre et Marie Curie, Paris.
BAROILLER J. F., 1996 - Significant
proportions of unexpected males in the majority of progenies from single pair
matings with siblings sexinversed males of Oreochromis niloticus.
In: Pullin & Lazard (eds). Third International Symposium on Tilapia in
aquaculture, november 1991, Côte d'Ivoire. ICLARM Conf.
Proc. (41) : 319-327.
BOUROUBI H. & ZEGHIMI M. L., 2004 - Etude
de l'adaptation à la salinité d'un poisson d'eau douce :
Oreochromis niloticus (Pisces, cichlidae). Mémoire Ing.
d'état,U.S.T.H.B. (Alger) : 42 p.
BOUZID N. & FARAH S., 2004 - Impact du
PbO sur la croissance et maturité sexuelle de Tilapia : Oreochromis
niloticus. Mémoire Ing. d'état, I.S.M.A.L.(Alger) :
51 p.
CHAPMAN A., 2003 - Culture of hybrid Tilapia :
reference profile. IFAS extension. University of Florida. Edis. : 86
p.
ENCARTA 2003 - Tilapia.
Encyclopédie® Microsoft® Encarta 2003 ; (c) 1993-2002
Microsoft Corporation.
FAO, 1989 - Aquaculture production (1984-1986).
FAO Fisheries Circular, 815, FIDI/C815: 106 p.
FAO, 2002 - Les méthodes de production
d'alevins de Tilapia nilotica. ADCP/REP/89/46 : 120 p.
GUERRERO R. D., 1982 - Control of Tilapia
reproduction. In: Pullin & LoweMcConnell (eds). The biology and culture
of Tilapia, ICLARM Conf. Proc. (7) : 309-3 16
GUERRERRO R. D. & GUERRERRO L. A., 1988 -
Feasibility of commercial production of sex reversed Nile Tilapia
fingerlings in the Philippines. In Pullin, Maclean (eds). Second
International Symposium on Tilapia in aquaculture, march 1987, Thailand ICLARM
conf. Proc. (15) : 183-186.
JALABERT B., MOREU J., PLANQUETTE P., BILLARD R., 1974
- Déterminisme du sexe chez Tilapia nilotica : action
de la methyltestostérone dans l'alimentation des alevins sur la
différenciation sexuelle ; proportion des sexes dans la descendance des
mâles « inversés ». Ann. Biol. Anim. Biochim.
Biophys., 14 (4-B) : 729 - 739.
LAZARD J., 1980 - Le développement de
la pisciculture intensive en Côte d'Ivoire. Exemple de la ferme piscicole
pilote de Natio-Kobadara. Notes et Documents sur la pêche et la
pisciculture, (21) : 1-44.
LAZARD J., 1984 - L'élevage du Tilapia en
Afrique. Données techniques sur sa pisciculture en étang.
Revue Bois et Forêts des Tropiques, (206) : 3
3-50.
LAZARD J., 1990 - Transferts de poissons et
développement de la production piscicole. Rev. Hydrobiol.
Trop., 23(3) : 25 1-256.
LAZARD J., JALABERT B. & DOUDET T., 1990 -
L'aquaculture des Tilapias du développement à la
recherche. Cahiers scientifiques, (10), C. T.F. T. :
115p.
LOWE-McCONNELL R. H., 1982 - Tilapias in fish
communities. In : Pullin & LowMcConnell (eds). The biology and culture
of Tilapias. ICLARM Conf. Proc., (7) : 83-113.
MALCOLM C., BEVERIDJE H. & McANDREW B. J., 2000 -
Tilapias: biologie and exploitation. Institute of aquaculture.
University of stirling, Scotland. Kluwer Academic Publishers: 185 p.
McANDREW B. J. & MAJUMDAR K. C., 1989 -
Growth studies on juvenile Tilapia using pure species, hormone-treated
and nine interspecific hybrids. Aquaculture and Fisheries
Management (20) : 35-47.
MIRES D., 1982 - A Study of the problems of
the mass productions of hybrid Tilapia fry. In : Pullin & McConnell
(eds). ICLARM. Conf. Proc. Center for Living Aquatic Res. Management,
Philippines, (7) : 317-329.
MOREAU J., 1979 - Biologie et
évolution des peuplements de Cichlides introduits dans les lacs
malgaches d'altitude. Thèse de Doctorat d'Etat n°38, Institut
Polytechnique de Toulouse : 301 p.
OULDMAAMAR S. & TIKARROUCHINE K., 2005 -
Contribution à la recherche d'indicateurs biologiques
d'exposition à des polluants. Cas de l'effet du Pb2+ sur la
croissance, le métabolisme et la maturité sexuelle du Tilapia :
Oreochromis niloticus. Mémoire Ing. d'état,
université de Blida : 80 p.
PULLIN R. S. V. & LOWE-McCONNELL R. H., 1982 -
The biology and culture of Tilapias. ICLARM Conf. Proc.,
philippines, (7) : 432 p.
ROTHBARD S., SOLNIK E., SHABBATH S., AMADO R., GRABIE
I., 1983 - The technology of mass production of hormonally
sex-inversed all male Tilapias. In Fishelton & Yaron (eds). First
International Symposium on Tilapia in Aquaculture. Israel : 425-434
RUWET J. C., VOSS J., HANON L., MICHA J. C., 1976 -
Biologie et élevage du Tilapia. In : FAO (eds), Symposium
on aquaculture in Africa, october 1975, Ghana. CIFA Tech. Pap.,
(4) : 332-364.
TREWAVAS E., 1983 - Tilapias: Taxonomy and
Speciation. In : Pullin & Maclean (eds). Second International Symposium
on Tilapia in aquaculture, march 1987, Thailand ICLARM conf. Proc.,
(15) : 3-13.
TURNER G. F., 1986 - Territory dynamics and
cost of reproduction in a captive poplulation of the colonial nesting
mouth-brooder Oreochromis mossambicus. Journ. Fish
Biol., (29) : 573-587.
SITES INTERNET:
http://www.ier.ml/peche/oni.htm
http://www.animaldivetsity.ummz.umich.edu/site/accounts/pictures/Oreochromis.html
http://www.animaldivetsity.ummz.umich.edu/site/accounts/classification/Oreochromis.ht
ml#Oreochromis
http://www.fao.org/docrep/T8655f/t8655fo3.html
http://www.aquatext.com/index.html
http://www.webcityof.com/mifftitl.htm
http://www.fishbase.org/
http://www.worldfishcenter.org/
http://www.ag.auburn.edu/dept/faa
http://www.larvalbase.org/
ENTERPRISES CONSULTEES:
L'hormone Méthyltestostérone, flacon de 5 g.
Laboratory : Fluka Chemika. Code : 435667/1 2/002. C20 H30 O2 (58-18-4). Packed
in Switzerland.
Annexe
ANNEXE 01 : Le comportement reproductif chez
Oreochromis niloticus

Figure 01: Des mâles rivalisent et
défendent leurs nids au-dessus. Figure 02: Un
mâle qui essaie d'attirer une femelle
Un mâle nettoie et construit un nid dessous. dans son nid
pour la féconder


Figure 03: L'accouplement où la femelle
pond les oeufs Figure 04: Incubation buccale des oeufs par la
femelle après
pendant que le mâle s'apprête à les
féconder leurs fertilisation par le mâle
ANNEXE 02: Paramètres physico-chimiques
dans le Raceway de reproduction
|
Dates
|
Température °C
|
pH
|
O2 dissous mg/l
|
|
26-mars-05
|
24
|
7,6
|
5,6
|
|
27-mars-05
|
23
|
7,6
|
5,5
|
|
28-mars-05
|
23,2
|
7,8
|
5,5
|
|
29-mars-05
|
23,2
|
7,9
|
5,1
|
|
30-mars-05
|
23,5
|
7,9
|
5,3
|
|
31-mars-05
|
/
|
/
|
/
|
|
01-avr-05
|
/
|
/
|
/
|
|
02-avr-05
|
22,9
|
7,8
|
5,2
|
|
03-avr-05
|
22,9
|
7,7
|
5,2
|
|
04-avr-05
|
23,5
|
7,9
|
5,4
|
|
05-avr-05
|
23,3
|
8
|
5
|
|
06-avr-05
|
23,6
|
8,2
|
5,5
|
|
07-avr-05
|
/
|
/
|
/
|
|
08-avr-05
|
/
|
/
|
/
|
|
09-avr-05
|
24,3
|
8
|
5,9
|
|
10-avr-05
|
23
|
7,8
|
6
|
|
11-avr-05
|
22,2
|
7,8
|
6,2
|
|
12-avr-05
|
22
|
7,9
|
6,1
|
|
13-avr-05
|
21,6
|
8,1
|
5
|
|
14-avr-05
|
/
|
/
|
/
|
|
15-avr-05
|
/
|
/
|
/
|
|
16-avr-05
|
22
|
8,5
|
5,3
|
|
17-avr-05
|
23
|
8,7
|
5,5
|
|
18-avr-05
|
24
|
7,9
|
4,3
|
|
19-avr-05
|
25
|
7,8
|
4,2
|
|
20-avr-05
|
24,7
|
8,3
|
4,7
|
|
21-avr-05
|
25,5
|
7,8
|
4,8
|
ANNEXE 03: Paramètres physico-chimiques
dans les aquariums d'alevinage
|
Dates
|
Aquarium 01
|
Aquarium 02
|
Aquarium 03
|
|
T°C
|
pH
|
O2 mg/l
|
T°C
|
pH
|
O2 mg/l
|
T°C
|
pH
|
O2 mg/l
|
|
21-avr-05
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
|
22-avr-05
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
|
23-avr-05
|
27,7
|
8,6
|
4,4
|
28,3
|
8,6
|
4,7
|
28
|
8,5
|
4,5
|
|
24-avr-05
|
29,5
|
8,5
|
5,4
|
29
|
8,1
|
5,3
|
29,1
|
8,3
|
5,3
|
|
25-avr-05
|
29,5
|
8,4
|
4,7
|
28
|
8,4
|
4,3
|
28,7
|
8,4
|
4,5
|
|
26-avr-05
|
28,7
|
8,5
|
4,5
|
31,7
|
8,6
|
4
|
29
|
8,5
|
4,3
|
|
27-avr-05
|
30,1
|
8,5
|
4,5
|
29,9
|
8,6
|
4,2
|
30
|
8,6
|
4,4
|
|
28-avr-05
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
|
29-avr-05
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
|
30-avr-05
|
29,9
|
8,3
|
5,5
|
30
|
8,2
|
5,5
|
30,3
|
8,3
|
5,7
|
|
01-mai-05
|
30,5
|
8,1
|
5,7
|
30
|
8
|
5,6
|
30
|
8,1
|
5,9
|
|
02-mai-05
|
30,5
|
7,9
|
5,6
|
31
|
7,9
|
5,7
|
30
|
8
|
5,9
|
|
03-mai-05
|
29
|
7,8
|
5,9
|
30
|
8
|
5,9
|
30
|
7,8
|
6
|
|
04-mai-05
|
29
|
8,3
|
6
|
29,5
|
8,4
|
5,9
|
30
|
8,3
|
6,1
|
|
05-mai-05
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
|
06-mai-05
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
|
07-mai-05
|
29
|
8,5
|
4,8
|
29,3
|
8,6
|
5,2
|
30,9
|
8,6
|
4,7
|
|
08-mai-05
|
28,7
|
8,6
|
4,7
|
29,5
|
8,6
|
5,6
|
29,9
|
8,6
|
4,6
|
|
09-mai-05
|
29,3
|
8,4
|
5
|
30,2
|
8,4
|
5,3
|
29,9
|
8,4
|
4,3
|
|
10-mai-05
|
28,8
|
8,5
|
4,5
|
29,8
|
8,6
|
5,2
|
30
|
8,6
|
5,2
|
|
11-mai-05
|
29,2
|
8,6
|
5
|
30
|
8,6
|
5,4
|
30,1
|
8,6
|
4,7
|
|
12-mai-05
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
|
13-mai-05
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
|
14-mai-05
|
29,1
|
8,36
|
5,6
|
29,6
|
8,23
|
5,7
|
30
|
8,32
|
5,5
|
|
15-mai-05
|
32,1
|
8,5
|
4,3
|
27,8
|
8,3
|
4,7
|
29,2
|
8,4
|
5,3
|
|
16-mai-05
|
29,2
|
8,6
|
6,4
|
29,5
|
8,6
|
4,8
|
30
|
8,5
|
4,5
|
|
17-mai-05
|
29,3
|
8,6
|
5,4
|
29,2
|
8,6
|
5,4
|
30,2
|
8,6
|
5,5
|
|
18-mai-05
|
30,2
|
8,6
|
4,7
|
28,9
|
8,6
|
5,4
|
29,7
|
8,6
|
4,4
|
|
19-mai-05
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
|
20-mai-05
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
|
21-mai-05
|
30,5
|
8,7
|
5,1
|
29,6
|
8,7
|
5,5
|
30,2
|
8,7
|
5
|
ANNEXE 04: Paramètres physico-chimiques
dans les bassins de prégrossissement
|
Dates
|
Bassin 01
|
Bassin 02
|
Bassin 03
|
|
T°C
|
pH
|
O2 mg/l
|
T°C
|
pH
|
O2 mg/l
|
T°C
|
pH
|
O2 mg/l
|
|
22-mai-05
|
25
|
7,7
|
8
|
25,5
|
7,7
|
5,8
|
27,5
|
8,5
|
6,3
|
|
23-mai-05
|
24
|
7,7
|
8,4
|
24,5
|
7,9
|
6,4
|
26,1
|
8,6
|
7,6
|
|
24-mai-05
|
23,9
|
8,2
|
10
|
24,3
|
8,2
|
9,2
|
27,1
|
8,7
|
7,8
|
|
25-mai-05
|
24,3
|
8,4
|
9,5
|
25
|
8,5
|
9,2
|
27,8
|
8,8
|
7,6
|
|
26/27-mai-05
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
|
28-mai-05
|
26
|
8,5
|
9,9
|
27,2
|
8,7
|
9,3
|
29
|
8,9
|
7,4
|
|
29-mai-05
|
25
|
8,3
|
8,6
|
26,1
|
8,5
|
7,5
|
27,5
|
8,9
|
7,9
|
|
30-mai-05
|
24
|
8,2
|
7,5
|
24,3
|
8,4
|
6,9
|
25,3
|
9
|
6,5
|
|
31-mai-05
|
22,2
|
8,4
|
6,7
|
22
|
8,5
|
5,7
|
23
|
8,9
|
5,5
|
|
01-juin-05
|
21,3
|
8,6
|
6,6
|
21,5
|
8,7
|
5,6
|
21,2
|
8,9
|
5,6
|
|
02/03-juin-05
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
|
04-juin-05
|
26
|
8,8
|
6,6
|
26,4
|
8,9
|
6,7
|
28
|
8,8
|
6,5
|
|
05-juin-05
|
25,6
|
8,9
|
6,7
|
26
|
9,1
|
6,3
|
27,4
|
9,1
|
6,9
|
|
06-juin-05
|
24,7
|
7,8
|
6,9
|
24,4
|
7,6
|
6,8
|
28
|
9,2
|
7,1
|
|
07-juin-05
|
25,2
|
8,1
|
7,1
|
25,6
|
8,2
|
6,9
|
28,9
|
9,1
|
7,6
|
|
08-juin-05
|
26,5
|
8,5
|
7,2
|
27,6
|
8,5
|
7,3
|
29,3
|
9,1
|
7,9
|
|
09/10-juin-05
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
|
11-juin-05
|
27,3
|
9
|
7,3
|
28,1
|
9
|
7,7
|
31,8
|
9,2
|
8,7
|
|
12-juin-05
|
29,1
|
9,1
|
7,8
|
29,7
|
9,1
|
7,5
|
29,8
|
9,3
|
6,9
|
|
13-juin-05
|
29,4
|
9,2
|
8
|
30,3
|
9,3
|
7,2
|
30,4
|
9,2
|
7,6
|
|
14-juin-05
|
28
|
8,8
|
7,6
|
29
|
8,9
|
7,5
|
29,8
|
9,1
|
7,1
|
|
15-juin-05
|
27,6
|
8,5
|
7,1
|
28,6
|
8,7
|
8,1
|
29,1
|
9
|
6,8
|
|
16/17-juin-05
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
|
18-juin-05
|
26,2
|
7,8
|
6,9
|
27,2
|
8,7
|
8,9
|
28,4
|
9,2
|
6,3
|
|
19-juin-05
|
25,2
|
8,7
|
5,9
|
26,2
|
8,7
|
7,1
|
28
|
9
|
6,3
|
|
20-juin-05
|
29,6
|
8,9
|
7
|
21,6
|
8,8
|
7
|
32
|
9,1
|
6,8
|
|
21-juin-05
|
24,5
|
8,7
|
7
|
25,3
|
8,7
|
6,7
|
25,8
|
8,9
|
6,6
|
|
22-juin-05
|
30,9
|
8,9
|
6,9
|
33,4
|
8,9
|
7,8
|
33,5
|
9,1
|
7,4
|
|
23/24-juin-05
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
|
25-juin-05
|
31,2
|
8,6
|
6,5
|
32
|
8,6
|
7,5
|
33
|
8,8
|
7,1
|
|
26-juin-05
|
31,8
|
8,6
|
6,3
|
33,2
|
8,4
|
7,5
|
33,5
|
8,7
|
6,9
|
|
27-juin-05
|
32,6
|
8,4
|
6,1
|
33
|
8,1
|
7,6
|
34
|
8,7
|
6,7
|
|
28-juin-05
|
27,1
|
8,3
|
5,6
|
27,5
|
8,6
|
5,8
|
28,4
|
8,4
|
6,8
|
|
29-juin-05
|
28,1
|
7,8
|
7
|
27,5
|
8,1
|
5,8
|
28,1
|
7,7
|
5
|
|
30/01-juin/juil-05
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
|
02-juil-05
|
26,2
|
8,5
|
6,6
|
27,1
|
9
|
6,7
|
29,3
|
8,7
|
5,5
|
|
03-juil-05
|
26,1
|
8,6
|
7,1
|
26,6
|
9
|
6,6
|
27,3
|
8,9
|
7,2
|
|
04-juil-05
|
28,1
|
8,8
|
7,3
|
29,9
|
9
|
7,2
|
30,3
|
9
|
7,1
|
|
05-juil-05
|
28
|
8,8
|
7,2
|
29,5
|
9,1
|
7
|
30
|
8,9
|
7,1
|
|
06-juil-05
|
28,4
|
8,9
|
7
|
29,8
|
9,1
|
6,5
|
30,1
|
8,9
|
6,8
|
|
07/08-juil-05
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
|
09-juil-05
|
29,2
|
8,5
|
6,1
|
30,2
|
8,6
|
6,1
|
31
|
8,5
|
6,4
|
|
10-juil-05
|
29,3
|
8,7
|
6,8
|
30,5
|
8,5
|
6,6
|
31,2
|
8,3
|
6,7
|
|
11-juil-05
|
29
|
8,6
|
6,3
|
30
|
8,6
|
5,9
|
29,8
|
8,1
|
6
|
|
12-juil-05
|
28,5
|
8,6
|
5,8
|
29,2
|
8,4
|
5,6
|
29
|
8,2
|
5,9
|
|
13-juil-05
|
29,1
|
8,9
|
6,2
|
31
|
8,4
|
6
|
29,9
|
8,3
|
6,3
|
|
14/15-juil-05
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
|
16-juil-05
|
30,1
|
8,6
|
5,4
|
31,9
|
7,8
|
5,5
|
31
|
7,6
|
5,9
|
|
17-juil-05
|
29,8
|
8,5
|
5,6
|
29,9
|
8,4
|
5,7
|
29,5
|
7,9
|
6
|
|
18-juil-05
|
30,6
|
7,9
|
5,4
|
30,4
|
8,5
|
5,9
|
30,2
|
8,2
|
6,2
|
|
19-juil-05
|
31,2
|
7,8
|
5,6
|
31
|
8,6
|
5,6
|
31
|
7,9
|
6,1
|
|
20-juil-05
|
32
|
8,3
|
6,4
|
31,5
|
8,7
|
6,4
|
32,5
|
8,3
|
5,5
|
|
21/22-juil-05
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
|
23-juil-05
|
32,5
|
7,5
|
5,2
|
31,8
|
8,4
|
6,5
|
33,6
|
8,3
|
6,4
|
|
24-juil-05
|
32,6
|
7,8
|
5,1
|
32
|
8,4
|
6,9
|
33,8
|
8,4
|
6,7
|
|
25-juil-05
|
33
|
7,6
|
5,3
|
32,6
|
8,5
|
6,7
|
34
|
8,5
|
5,9
|
|
26-juil-05
|
33,4
|
7,9
|
4,2
|
33
|
8,7
|
5,8
|
34,2
|
8,2
|
5,4
|
|
27-juil-05
|
33,5
|
8
|
4,6
|
33,2
|
8,3
|
6
|
34,5
|
8,3
|
6
|
|
28/29-juil-05
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
|
30-juil-05
|
33,5
|
8,6
|
4,8
|
33,8
|
8,5
|
4,5
|
34
|
8,1
|
5,4
|
|
31-juil-05
|
32,8
|
8,4
|
5,2
|
33
|
8,7
|
5
|
33,5
|
8,5
|
4,7
|
|
01-août-05
|
32,5
|
8,3
|
5,4
|
33,2
|
8,6
|
5,6
|
33,3
|
8,4
|
4,8
|
|
02-août-05
|
31,9
|
8,6
|
5,4
|
32,6
|
8,8
|
5,4
|
32,8
|
8,6
|
5,4
|
|
03-août-05
|
33
|
8,7
|
5,5
|
33,3
|
8,9
|
5,7
|
33,8
|
8,9
|
5,5
|
|
04/05-août-05
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
/ /
|
|
06-août-05
|
34,4
|
8,3
|
5,4
|
33,9
|
8,4
|
5,4
|
34,6
|
8,5
|
5,2
|
|
07-août-05
|
34
|
7,9
|
5,5
|
33,7
|
8,2
|
5
|
34,5
|
8,1
|
5,5
|
|
08-août-05
|
34,2
|
8,5
|
5,7
|
34
|
8
|
5,6
|
33,8
|
8,3
|
5,3
|
|
09-août-05
|
34,4
|
8,5
|
5,6
|
34,1
|
8,5
|
5,4
|
34,4
|
8,6
|
5,5
|
|
10-août-05
|
33,8
|
8,6
|
5,9
|
34
|
8,6
|
5
|
34
|
8,6
|
5
|
ANNEXE 05: Paramètres biométriques
(poids moyen, tailles moyens et mortalité) des larves ainsi que leurs
rations alimentaires (R.A.).
Tableau I : Poids moyens des larves de Tilapia
en fonction de leur âge
|
Âge des larves
|
Poids moyen des individus (g)
|
|
Lot 1
|
Lot 2
|
Lot 3
|
|
1 j
|
0,01
|
0,01
|
0,01
|
|
10 j
|
0,017 #177; 0,004
|
0,017 #177; 0,004
|
0,017 #177; 0,004
|
|
17 j
|
0,024 #177; 0,009
|
0,019 #177; 0,007
|
0,020 #177; 0,003
|
|
23 j
|
0,026 #177; 0,0 10
|
0,022 #177; 0,006
|
0,023 #177; 0,008
|
|
31 j
|
0,046 #177; 0,031
|
0,029 #177; 0,011
|
0,029 #177; 0,006
|
|
39 j
|
0,05 5 #177; 0,028
|
0,03 3 #177; 0,023
|
0,05 8 #177; 0,02 5
|
|
47 j
|
0,077 #177; 0,03 5
|
0,065 #177; 0,040
|
0,073 #177; 0,027
|
|
56 j
|
0,228 #177; 0,273
|
0,11 #177; 0,024
|
0,229 #177; 0,073
|
|
66 j
|
0,558 #177; 0,246
|
0,649 #177; 0,215
|
0,572 #177; 0,169
|
|
75 j
|
1,502 #177; 0,246
|
1,646 #177; 0,621
|
1,686 #177; 0,432
|
|
84 j
|
2 #177; 0,596
|
2,4 #177; 0,738
|
3,1 #177; 1,077
|
|
94 j
|
3,9 #177; 0,631
|
4,9 #177; 1,410
|
5,9 #177; 1,269
|
|
103 j
|
5,9 #177; 0,694
|
7,1 #177; 1,583
|
8,4 #177; 1,888
|
|
115 j
|
9,2 #177; 2,409
|
13,4 #177; 2,975
|
16,4 #177; 6,034
|
Tableau II : Taille moyenne des larves de
Tilapia en fonction de leur âge
|
Âge des larves
|
Taille moyenne des individus (cm)
|
|
Lot 1
|
Lot 2
|
Lot 3
|
|
1 j
|
0,8
|
0,8
|
0,8
|
|
10 j
|
1,15 #177; 0,127
|
1,15 #177; 0,127
|
1,15 #177; 0,127
|
|
17 j
|
1,3 #177; 0,202
|
1,22 #177; 0,193
|
1,27 #177; 0,149
|
|
23 j
|
1,36 #177; 0,184
|
1,29 #177; 0,137
|
1,43 #177; 0,200
|
|
31 j
|
1,55 #177; 0,207
|
1,4 #177; 0,163
|
1,58 #177; 0,148
|
|
39 j
|
1,67 #177; 0,279
|
1,61 #177; 0,256
|
1,76 #177; 0,212
|
|
47 j
|
1,85 #177; 0,255
|
1,73 #177; 0,250
|
1,91 #177; 0,238
|
|
56 j
|
2,46 #177; 0,474
|
2,3 #177; 0,133
|
2,57 #177; 0,216
|
|
66 j
|
2,75 #177; 0,558
|
2,80 #177; 0,627
|
3,09 #177; 0,409
|
|
75 j
|
4,6 #177; 0,478
|
4,69 #177; 0,536
|
4,76 #177; 0,435
|
|
84 j
|
4,93 #177; 0,495
|
5,26 #177; 0,587
|
5,71 #177; 0,709
|
|
94 j
|
6,2 #177; 0,787
|
6,5 #177; 1,138
|
7,2 #177; 0,362
|
|
103 j
|
7,5 #177; 0,478
|
7,82 #177;0,632
|
8,27 #177; 0,667
|
|
115 j
|
8,61 #177; 0,812
|
9,4 #177; 0,738
|
9,9 #177; 1,157
|
Tableau III : Taux de mortalité des
larves de Tilapia
|
Âge des larves
|
Taux de mortalité cumulé des alevins en
%
|
|
Lot 1
|
Lot 2
|
Lot 3
|
|
1 j
|
0
|
0
|
0
|
|
10 j
|
2
|
4
|
3
|
|
17 j
|
6
|
8
|
5
|
|
23 j
|
15
|
31
|
22
|
|
31 j
|
23
|
50
|
38
|
|
39 j
|
24
|
53
|
46
|
|
47 j
|
25
|
59
|
51
|
|
56 j
|
27
|
63
|
58
|
|
66 j
|
29
|
66
|
65
|
|
75 j
|
31
|
70
|
69
|
|
84 j
|
32
|
72
|
73
|
|
94 j
|
33
|
72
|
74
|
|
103 j
|
34
|
73
|
75
|
|
115 j
|
34
|
73
|
75
|
GLOSSAIRE
17 á-éthynyltestostérone :
hormone servant à féminiser un lot d'alevins.
17á-méthyltestostérone : hormone servant
à masculiniser un lot d'alevins. Alevinage :
première phase dans un élevage (celui des alevins).
Alevin : poisson morphologiquement
différent de l'adulte, nom donné au jeune poisson depuis la larve
jusqu'à un poids de quelques grammes.
Androgène : hormone
stéroïde sécrétée par le testicule et par la
glande surrénale, impliquée dans le développement des
caractères sexuels masculins, également présente en faible
quantité chez la femme.
Arène de reproduction : espace de
reproduction où se trouve le nid creusé par le mâle chez le
Tilapia.
Biomasse : ensemble de la matière
organique animale ou végétale (présente dans un espace
déterminé).
Biotine : vitamine H ou B8,
synthétisée par une bactérie intestinale. Elle intervient
dans le métabolisme des acides gras, du glucose et de certains acides
aminés, en favorisant leur dégradation (catabolisme).
Branchiospines : protubérances, ornant
les arcs branchiaux des poissons qui constituent un véritable filtre
servant à retenir le plancton.
Cannibalisme : fait de dévorer ses
congénères.
Cavité buccopharyngienne : espace creux
dans la partie inférieure de la bouche.
Cténoïdes (écaille) :
écaille ronde pourvue d'aspérité en dents de scie
dans sa partie postérieure.
Cycloïdes (écailles) :
écaille circulaire dont les bords sont lisses, non
dentelés. Dimorphisme sexuel : aspect différent
du mâle et de la femelle (d'une espèce).
Diploïde : en génétique :
organisme doté de chromosomes en deux exemplaires et associés par
paires (2n chromosomes).
Échantillon : fragment ou petite
quantité d'une population ou d'un ensemble permettant de se faire une
idée de la qualité (d'un produit).
Élevage monosexe : élevage portant
sur des animaux d'un seul sexe, mâle ou femelle, préalablement
triés.
Euryèce : se dit des espèces ayant
une grande amplitude écologique. Euryhalinité :
capacité de résister à des changements importants de
salinité. Euryphage : se dit d'une espèce ayant
une grande amplitude alimentaire. Eurytope : espèces
vivant dans des biotopes très différents.
Flanc : région anatomique latérale
de l'abdomen (de certains animaux).
Garde biparentale (en couple) : se dit lorsque
la garde de la progéniture est pratiquée par les deux parents.
Garde uniparentale : se dit lorsque un seul
parent garde la progéniture. Géniteurs :
mâles et femelles destinés à la reproduction.
Génotype : nom donné à la
totalité du stock chromosomique caractéristique de
l'organisme.
Gonade : organe qui produit des gamètes.
La gonade mâle est le testicule, la gonade femelle est l'ovaire.
Hybridation : désigne le croisement entre
deux variétés, entre deux races ou entre deux espèces
différentes.
Ichtyomètre : (Ichtyos : poisson en grec)
instrument de mesure de la taille du poisson. Incubation buccale :
maintenir les oeufs au chaud et à l'abri dans la bouche.
Inversion hormonale : inversion du sexe d'un
organisme à l'aide d'une hormone ou d'un paramètre
physico-chimique.
Ration alimentaire : correspond à la
quantité d'aliments absorbés par un organisme pendant un temps
donné. Elle peut être exprimée en kilocalories (kcal) ou en
kilojoules (kJ).
Larve : nom donné au jeune poisson depuis
l'éclosion jusqu'à sa métamorphose (formation des
nageoires). la larve est le premier stade du cycle de l'animal.
Macrophytophage : qui se nourrit de
végétaux macroscopiques.
Macule : tache plane sur la peau.
Mâles transsexuels : femelles à
génotype mâle.
Masculiniser : provoquer l'apparition de
caractères sexuels masculins chez une femelle.
Maturité sexuelle : appelée
puberté chez l'espèce humaine, correspond à un âge
où la taille et le poids de l'animal lui permettent de se reproduire.
Métazoaires : organismes animaux
formés de plusieurs cellules, par opposition aux protozoaires, qui sont
formés d'une seule cellule.
Nanisme : phénomène de croissance
réduite, empêchant les poissons d'atteindre une taille adulte
normale.
OEstradiol : hormone femelle la plus active
sécrétée par l'ovaire et impliquée dans le
développement des caractères sexuels féminins.
Omnivore : être vivant qui se nourrit
aussi bien d'aliments d'origine végétale que ceux d'origine
animale.
Ovocyte : cellule reproductrice femelle animale
en cours de maturation. Les ovocytes sont stockés dans les ovaires.
Papille : petite protubérance
vascularisée située à la surface d'une muqueuse, du derme
ou d'un organe et qui contient une terminaison nerveuse.
Phénotype : ensemble de caractères
apparents d'un individu résultant de l'interaction des conditions du
milieu et des facteurs génétiques.
Phytoplanctonophage : se nourrissant de
phytoplancton.
Planctonophage : se nourrissant de plancton
végétal (phyto-) et animal (zoo-).
Salabre : grande épuisette servant
à capture les gros spécimens de poissons ou un grand nombre de
poissons.
Sexage : déterminer les sexes mâle
et femelle par simple observation de la papille génitale.
Sex-ratio : rapport entre le nombre de mâles et le nombre de
femelles d'un lot d'animaux.
Squash gonadique : technique permettant de sexer
les poissons par prélèvement des gonades et leur observation sous
microscope photonique.
Stéroïde : ce groupe comprend
certains alcools (stérols), des acides biliaires, diverses hormones
sexuelles (progestérone, testostérone, oestrogène, ...) ,
et des substances naturelles.
Stress : ensemble de réactions non
spécifiques de l'organisme déclenchées par l'action d'un
agent nocif dit « agent stressant » qui peut être physique,
chimique ou émotionnel et qui s'exerce sur l'organisme et provoque une
agression ou une tension pouvant devenir pathologique.
Substrat : ce sur quoi s'exerce une action. Par
extension : sol, fond, supports naturels ou artificiels.
Surpeuplement : excès de population par
rapport aux ressources disponibles.
Taxonomie : Branche de la biologie
spécialisée dans la classification des espèces et leurs
nomenclatures.
Testostérone : hormone sexuelle
sécrétée par le testicule.
Tétraploïdes : en
génétique, qui possède quatre lots de chromosomes au lieu
de deux (4n chromosomes).
Thermophile : vivant à des
températures élevées.
Triploïdes : en génétique,
qui possède trois lots de chromosomes au lieu de deux (3n
chromosomes).
Vertébrés : animal
possédant une colonne vertébrale.
Vitellogénèse : synthèse du
vitellus qui est une substance de réserve nutritive nécessaire au
développement de l'embryon.



