II.3.2.b. Compatibilité :
Ce terme est utilisé pour décrire les
mélanges de polymères présentant les
propriétés pratiques utiles et cela se soucier s'ils sont
théoriquement miscibles ou non [1].
On peut la définir comme la miscibilité
moléculaire qui est définie comme une
solubilité mutuelle des polymères au niveau
macromoléculaire [17].
II.3.3. Thermodynamiques des
polymères :
La comparaison des mélanges de polymères
avec des systèmes constitués de petites molécules permet
de comprendre la tendance des macromolécules à se séparer
en phases distinctes. Si l'on prend, pour ce faire, un réseau tel que
ceux représentés sur la figure II.1 dans lequel chaque case est
occupée soit par une molécule simple, soit par une unité
appartenant à une chaîne macromoléculaire, l'entropie de
mélange est, par définition, proportionnelle au logarithme du
nombre de complexions (c'est-à-dire d'arrangements possibles) des
différents composants du système [18] :
?S = k ln W
(II.1)
W : Etant le nombre de complexions
k : La constante de Boltzmann
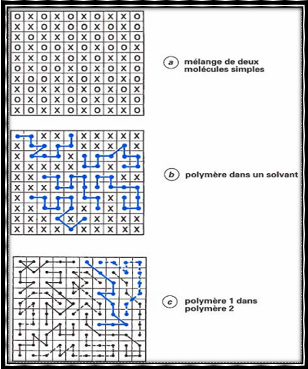
Figure II.1 : Représentation
schématique de différents systèmes binaire
[18].
Dans le cas d'un mélange de deux
molécules simples, le nombre de complexions s'élève
à 2100, tandis qu'il se réduit à 255
pour une solution de polymères et à 210 pour
un mélange de deux polymères différents. L'entropie de
mélange est donc d'autant plus faible que les chaînes
concernées sont longues et n'est généralement pas
suffisante pour compenser les interactions répulsives qui se manifestent
entre les unités de nature chimique différente. Ces interactions
répulsives reflètent la nature endothermique du processus
de mélange et se traduisent par une enthalpie de mélange
positive (?HM > 0). Dans ces conditions,
l'énergie libre de mélange est positive, ce qui est favorable
à la démixtion des polymères [18] :
?GM = ?HM - T?SM >
0
Toutefois, des mélanges miscibles peuvent
être obtenus lorsque les chaînes sont courtes [?SM est
alors plus important] ou lorsque l'enthalpie de mélange n'est que
faiblement positive. Dans certains cas favorables, il peut se produire que
l'énergie d'échange d'unités dissemblables, dont
l'intensité dépend des forces de Van der Waals qui s'exercent
dans le milieu, demeure faible [18].
En revanche, lorsque des interactions attractives du
type liaison hydrogène se forment entre entités de nature
chimique différente, l'enthalpie libre de mélange est
négative. Toutes les conditions sont alors réunies pour que le
mélange formé soit homogène. Il est possible de calculer
l'énergie libre de mélange grâce à la
théorie de Flory-Huggins, moyennant quelques hypothèses
simplificatrices. Ce modèle ne prend en compte que les interactions du
type London-Van der Waals et ignore des éléments comme la
polymolécularité [18].
L'énergie libre de mélange par site
s'écrit :
(II.2)
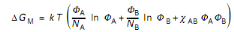
ÖA et ÖB : Les
fractions volumiques des constituants poly (A) et poly (B)
NA et NB : Degrés de
polymérisation des chaînes poly (A) et poly (B),
÷AB : Paramètre
d'interaction entre poly(A) et poly (B),
T : Température absolue,
k : Constante de Boltzmann.
La relation suivante représente, en fait, la
variation d'énergie ? åAB qu'impliquerait l'interaction
entre unités A et B, åAA et åBB
étant les énergies d'interaction respectives des unités A
et B entre elles.
(II.3)
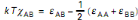
÷AB prend des valeurs positives lorsque
l'interaction entre A et B nécessite un apport d'énergie
(?åAB > 0 et å AB supérieure
à la moyenne de åAA et åBB), c'est a
dire que cette interaction est répulsive ; le mélange est alors
endothermique. L'hypothèse des seules interactions du type London-Van
der Waals implique, par ailleurs, que l'énergie d'attraction entre les
unités dépend de la polarisation ái et du
potentiel d'ionisation I ij par l'expression å
ij= Iij ái áj et comme I est identique
quelle que soit l'unité considérée, le produit kT ÷
AB se réduit à [19] :
(II.4)
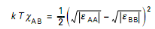
Cette expression, établie en ne prenant en
compte que les forces du type London-Van der Waals, montre bien que
l'interaction entre unités dissemblables est nécessairement
répulsive ou, au mieux, nulle. Les «
hétérocontacte» ne sont donc pas privilégiés.
Quand l'ensemble des N sites est pris en considération,
l'incompatibilité des deux polymères dépend alors du
produit ÷ ABN et est d'autant plus marquée que ÷
ABN est élevé. En pratique, et pour rendre compte de
la réalité des faits expérimentaux, on a
généralement recours à une expression plus
phénoménologique de la densité d'énergie libre du
mélange (par cm3) [18] :
(II.5)
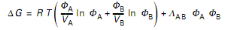
VA, VB : Etant les volumes
molaires des unités constitutives A et B.
R : La constante molaire des gaz parfaits.
Dans cette expression, ËAB
représente un paramètre d'interaction empirique qui,
contrairement à ÷AB, peut dépendre de la
température, de la pression, de la composition du mélange ;
ËAB est considéré proportionnel au carré
de la différence des paramètres de solubilité
äA et äB des constituants poly (A) et poly (B)
[18].
| 


