|
1er Colloque international : Biologie
végétale et environnement (Université de Annaba
2005) .
Sélection au stade gamétophytique
d'écotypes du genre Medicago pour la
tolérance au stress salin : Comparaison entre le
gamétophyte et le sporophyte
AMOURI A et FYAD-LAMECHE F.Z. Laboratoire de
Génétique et d'Amélioration des plantes.
Département de Biologie. Faculté des Sciences. Université
d'Oran-Es-Sénia. Oran.
Mail: amouriaa@yahoo.fr
Résumé. Dans le but
de mettre en évidence un chevauchement de l'expression
génétique pour la tolérance au stress salin, sur des
écotypes d'espèces annuelles du genre
Medicago, nous avons mesuré, à deux
stades de développement différents (sporophytique et
gamétophytique), la germination et la croissance de jeunes plantules, et
des grains de pollen sous différentes concentration de salinité
(0.4 %, 0.6 % et 0.8 %).
Pour les deux paramètres taux de germination et
longueur, l'écotype Tru 42, s'est avéré le
plus tolérant et l'écotype Pol 248 le plus
sensible au stade diploïde et au stade haploïde. Les résultats
obtenus montrent qu'une correspondance entre le comportement du sporophyte et
du gamétophyte pour la tolérance et la sensibilité vis
à vis du stress salin, existe chez l'écotype le
plus tolérant Tru 42 de M.Ttruncatula et les
écotypes les plus sensibles Pol 248 et Pol
242 de M.Polymorpha.
L'existence d'un overlapping fonctionnel
entre le sporophyte et le gamétophyte
pourrait expliquer ces résultats, ce qui permettrait d'envisager la
possibilité d'appliquer la sélection gamétophytique pour
ce caractère chez ces deux espèces.
Mots clés : Medicago -
stress salin - gamétophyte - sporophyte - overlapping.
Summary- In order to put in evidence a
genetic expression overlap for salt tolerance on six ecotypes of three annual
Medicago species (M. truncatula, M, polymorpha and M.
cilaris), we mesuread at two developemental stages (sporophytic and
gametophytic) seed germination rate and young seedling growth rates as pollen
germination and pollen tube growth rate in vitro under different salt
concentration (0.4 %, 0.6 % et 0.8 %).
For germination rates (of seeds and pollen grains) and growth
rates (of young seedling and pollen tube), the Tru 42 ecotype proved
to be the most tolerant and the Pol 248 one the most sensitive at
diploïd and haploïd stage.
So the results obtained showed that a correspondance between
sporophytic and gametophytic behavior for salt tolerance and sensivity exists,
but only for the most tolerant and most sensitive ecotype.
The existence of a fonctional overlapping between the
sporophyte and the gametophyte could explain this results, with would permit to
consider the possibility to apply gametophytic selection for salt tolerance in
two species M.truncatula and M.polymorpha.
Key words : Medicago - salt stress - gametophyte
- sporophyte - overlapping .
Introduction
Les espèces annuelles du genre
Medicago jouent un rôle important dans
l'amélioration de la production fourragère en Algérie.
Elles sont souvent utilisées dans les systèmes de rotation «
céréales-luzernes », se régénèrent par
auto-semis, et permettent le maintien de la fertilité du sol grâce
à leur capacité fixatrice d'azote atmosphérique.
La salinité constitue l'un des facteurs limitant de la
productivité et la distribution de ces plantes dans les zones arides et
semi-arides. Les fortes teneurs en sels de l'eau du sol diminuent
considérablement le potentiel hydrique de cette solution et imposent des
conditions des stress hydriques aux végétaux
(Laval-Martin et Mazliak., 1995).
Un grand nombre de travaux ont montré une
corrélation positive entre les réponses du pollen et celles du
sporophyte à un ensemble de stress (Evans et al., 1990 ;
Hormaza et Herrero., 1996). Cela laisse supposer que la
sélection gamétophytique qui est plus efficace et plus
économique par rapport à la sélection durant la phase
diploïde, peut être appliquée chez les plantes
économiquement importantes. (Shivanna et
Sawhney ., 1993). Beaucoup d'expériences basées
sur le concept d'overlapping se multiplient pour divers objectifs en
amélioration des plantes : résistance à des toxines,
à la sécheresse, etc., gestion efficace de la variabilité
génétique (Saar et al., 1992).
Ce travail a pour objectif d'apprécier la
variabilité génétique de la tolérance à la
salinité au niveau sporophytique et gamétophytique afin de
cribler préalablement des écotypes performants en vue de leur
utilisation dans des systèmes de
rotation « céréale-medicago » dans les
zones salines, arides et semi-arides et de déterminer si la
sélection gamétophytique peut servir pour sélectionner des
génotypes tolérants, et ceci par la mise en évidence d'un
chevauchement dans le comportement des gamétophytes et celui des
sporophytes vis à vis de la salinité c'est-à-dire un
overlapping fonctionnel. Pour cela, une étude
biométrique portant sur les deux phases a consisté à
mesurer la croissance des jeunes plantes et des tubes polliniques sous
différentes concentrations de salinité.
Matériels et méthodes
Le matériel végétal utilisé pour
l'étude biométrique pour les deux phases sporophytique et
gamétophytique est constitué de six écotypes
d'espèces annuelles de Medicago
(Tableau 1), fournis par l'Institut National Agronomique
d'El-Harrach (I.N.A) à Alger-
Algérie.
Par semis, pour chaque population quarante graines
réparties en quatre lots, le lot témoin (0 % NaCl) et les trois
lots traités à différentes concentrations de NaCl
(0.4 %, 0.6 % et 0.8 %),
sont mises à germer à l'obscurité dans des boites de
Pétri tapissées avec du papier filtre dans une étuve
à une température de 27°C, après scarification. Le
dispositif expérimental utilisé au niveau sporophytique est un
dispositif bloc, échelonné dans le temps, complètement
aléatoire, avec cinq répétitions. Dans chaque
répétition, chaque écotype est représenté
par dix individus.
Neuf jours après le semis, les deux paramètres
ont été mesurés, le taux de germination (nombre de graines
germés / Total), ainsi que la longueur des jeunes plante à l'aide
d'un papier millimétré à 0.5 mm de précision. Le
degré de tolérance à différentes concentrations
d'NaCl est calculé par rapport au témoin pour les deux
caractères.
Au niveau gamétophytique, le dispositif
expérimental utilisé, est un dispositif
« blocs », échelonnés dans le temps,
complètement aléatoire, avec trois répétitions.
Dans chaque répétition, chaque écotype est
représenté par cinq plants. Les boutons floraux sont
prélevés avant la fécondation, avant le
déclenchement des fleurs ou avant leur ouverture.
Les anthères non déhiscentes sont
éclatées et leur contenu étalé sur un carré
de papier Cellophane, humidifié et séché d'un coté
et placé sur une goutte de milieu liquide. Les grains de pollen ainsi
isolés à partir de chaque plant pour chaque écotype, sont
placés après ensemencement, sur quatre lames de microscope,
contenant quatre milieux différant par leur concentration en sel (NaCl),
puis mis à incuber dans une étuve à 27°C pendant une
demi- heure. Les observations se font au microscope optique, objectif x10. Le
milieu de culture utilisé, se compose de 100 ppm d'acide borique, 100
ppm de KNO3, 300 ppm de Ca (NO3)2 et 10 % de saccharose dans l'eau
distillée à pH= 6.8 (FYAD-LAMECHE.F.Z., 1999).
Ce milieu (T0) représente le témoin avec 0 % NaCl. Les milieux
T1, T2 et T3, diffèrent par leur concentration en NaCl avec 0.4
%,0.6 % et 0.8 % respectivement
Une demi-heure après germination des grains de pollen
dans les différents milieux, deux paramètres ont
été mesurés, le taux de germination (nombre de grains
germés / Total), ainsi que la longueur du tube pollinique. L'indice de
tolérance à différentes concentrations de NaCl est
calculé par rapport au témoin pour les deux caractères.
Les tests statistiques retenus pour l'analyse des
caractères au niveau gamétophytique sont les mêmes que
ceux utilisés pour l'analyse sporophytique.
Tableau 1.- Population d'espèces
annuelles de Medicago analysées
|
Espèces
|
Ecotype
|
Pays
|
Sites d'origine
|
Altitude (mètres)
|
Pluviométrie
(millimètres)
|
|
M.ciliaris
|
Cil 56
Cil 242
|
Algérie
|
Prés de Ouenza (Souk Ahras).
Kaïs (Khenchela)
|
565
980
|
400
450
|
|
M.plymorpha
|
Pol 242
Pol 248
|
Kaïs (Khenchela)
Ain Berda (Annaba)
|
980
240
|
450
750
|
|
M.truncatula
|
Tru 42
Tru 242
|
Fetzara (Annaba)
Kaïs (Khenchela)
|
100
980
|
660
450
|
.
Résultats et discussion
Pour déterminer la tolérance d'une
variété, un indice (I.T) égal au rapport de la valeur
notée sous stress sur celle du témoin, a été
calculé. Cet indice est compris entre 0 et 1. Il a été
considéré que les plantes tolérantes ont un indice de
tolérance plus élevé que les plantes sensibles.
1 - Analyse biométrique au niveau
sporophytique
Les résultats pour les deux paramètres (taux de
germination des graines et longueur des jeunes plantules) sont
résumés dans le Tableau 2, pour le lot
témoin (0% NaCl) et les lots traités (0.4%, 0.6%,0.8%)
enregistrés neuf jours après le semis
L'analyse de variance appliquée aux résultats
obtenus montre des différences significatives entre les
différentes populations de Medicago
pour l'ensemble des paramètres étudiées (taux de
germination des graines et longueur des plantules) Tableau 3.
En conditions normales, la figure 1-a montre que
l'écotype Tru
242 de M.truncatula a un taux de
germination le plus élevé et un développement plus
important, et que M.ciliaris (Cil
242) présente une faible croissance
végétative avec un faible taux de germination (Photos 01).
Il faut noter que le stress salin a provoqué des
réductions significatives que ce soit pour le taux de germination ou
pour la longueur des plantes et que le traitement T2
(0.6 %) est un indice clé afin de
différencier entre les variétés sensibles et
tolérantes, puisque à cette concentration, des différences
et des réductions significatives sont observées pour les deux
paramètres. Le classement des écotypes à
différentes concentration sel n'est pas superposable à celui du
lot témoin, car les écotypes qui se comportent mieux en
conditions normales, ne présentent pas une bonne vigueur sous un stress,
c'est le cas surtout des écotypes Pol 242 et Pol
248 chez l'espèce M.polymorpha. On a remarqué,
que la variabilité inter et intra spécifique augmentent avec la
concentration en sel, et que les écotypes les plus variables
présentent une meilleure tolérance à la salinité,
c'est le cas de l'espèce M.truncatula par rapport à
M.polymorpha, la moins variable et en même temps la plus
sensible.
Les figures 1-b et 2-b résument les indices de
tolérances du taux de germination et la longueur de la plantule des
différents écotypes pour les différents traitements durant
neuf jours. En comparant la croissance des jeunes plants traitées pour
les différentes concentration en sel utilisées avec leurs
témoins, on remarque que l'écotypes
Tru42 présente un indice de
tolérance plus important qui varie de 0.029 à
0.95, et que Pol 248
présente un indice très faible,
traduisant une réduction considérable de sa croissance et donc sa
sensibilité envers la salinité (Tableau 02).
Ces résultats montrent que l'écotype
(Tru 42) de l'espèce
M.truncatula, présente un degré de
tolérance plus élevé par rapport aux autres populations
pour les deux paramètres sous différentes concentrations en
chlorure de sodium, avec un indice de tolérance
important par rapport aux autres écotypes Pol
242, Cil 242 et Pol
248 considérés sensibles. Pour les
variétés considérées sensibles, les
résultats montre que l'écotype Pol
248 a un faible indice de tolérance
(I.T1) et un indice (I.T3) nul. Ils sont en
accord avec ceux de Teyssendier et al (1972)
qui comparent deux variétés de luzerne de Gabès
de vigueur différente et constatent que la plus vigoureuse germe mieux
que l'autre en présence d'une forte pression osmotique qu'elle soit due
au chlorure de sodium, au mannitol ou au polyéthylène-glycol. Une
étude réalisée au sein d'un lot de luzerne
de Gabès sur les répercussions d'une sélection
pour la germination en présence d'une forte pression osmotique,
révèle que la faculté germinative et l'énergie
germinative des graines du lot étudié sont plus faibles en
présence de sel qu'en présence d'eau distillée.
Lors d'un stress hydrique appliqué chez le Maïs, la
croissance foliaire est ralentie, en particulier une diminution de la zone
d'élongation (Vincent et al., 2002).
Chebouti et Abdelguerfi (2000) signalent que le stress
hydrique provoque une réduction significative des organes, ainsi qu'une
diminution de la production fourragère (feuilles+tiges) chez quatre
populations de M.truncatula.
Selon Brown et Tanner (1983), la réduction de la
longueur des rameaux chez M.sativa est induite par un
déficit hydrique.
Abdelguerfi.A (1978), montre que
M.truncatula est une espèce qui semble
préférer les sols assez calcaires mais pauvres en sodium et
pourtant, elle tolère les teneurs élevées en sodium (400
ppm), et que M.polymorpha est une espèce
à écologie indifférente et on la trouve dans tous les
milieux (salés ou non) et qu'il est nécessaire de descendre au
niveau de la variété afin de préciser son écologie
et d'étudier la résistance au pourcentage de saturation en
sodium, et aussi d'effectuer des essais au laboratoire sur la résistance
des différents écotypes à la salinité.
Effectivement dans notre étude nous avons décelé que
l'écotype Pol 248 qui présente
le moins de variabilité, était le plus sensible et qu'il est plus
ou moins associé à la variété Cil
242, et que l'écotype Tru 42 qui
présente plus de variabilité, était le plus
tolérant pour les deux paramètres (germination des graines et la
longueur des jeunes plantes).
On peut ainsi supposer, l'origine édaphique des deux
écotypes Tru 42 et Pol
248, et dire que la variété tolérante
(Tru 42) provient d'une texture de sol riches
en sel, et que la variété sensible (Pol
248) est issue d'un sol pauvre en sel.
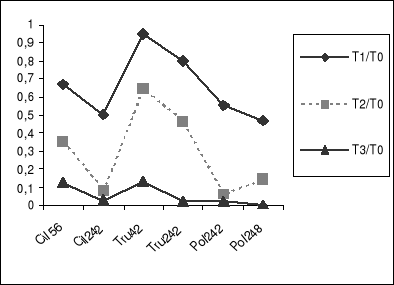
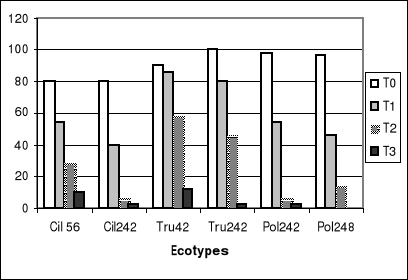
Figure 1-a : Taux de germination des graines
témoins et traitées des différentes populations de
Medicago.
Figure 1-b : Indice de tolérance du taux de
germination des graines sous l'action de différentes concentrations de
salinité. (Durée neuf jours
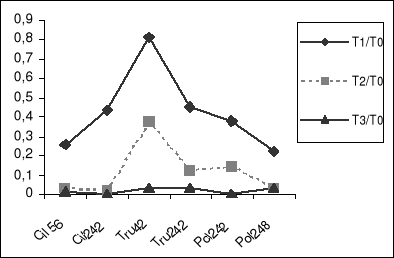
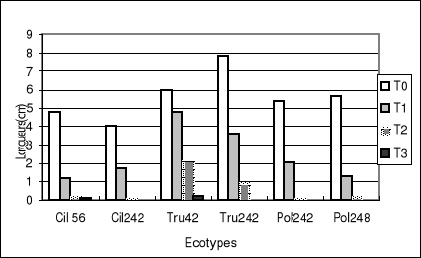
Figure 2-a : Longueurs moyennes par écotype de
jeunes plantes traitées et non traitées des différents
écotypes étudiées chez Medicago.
Figure 2-b : Indice de tolérance de la longueur de
la plantule sous différentes concentrations de sel (NaCl) des
différents écotypes
T0 T1 T2
T3
T0 T1 T2 T3
Cil 242
Cil56
T0 T1 T2
T3
Pol 242
Pol 248
T0 T1 T2 T3
Tru 242
Tru 42
T0 T1 T2 T3
T0 T1 T2 T3





Photo 01- Développement après neuf jours de
croissance des écotypes sous différentes concentrations en sel
(NaCl)
2 - Analyse biométrique au niveau
gamétophytique :
Les résultats pour les deux paramètres (taux de
germination des grains de pollen et longueur des tubes polliniques) sont
résumés dans le Tableau 2.
L'analyse de variance appliquée aux résultats
obtenus pour les deux paramètres (Taux de germination des grains de
pollen et la longueur du tube pollinique), montre des différences
significatives entre variétés que ce soit en conditions normales
ou stressantes. Ainsi nous avons remarqué que le stress salin a
entraîné des réductions importantes pour les deux
paramètres morphologiques étudiés.
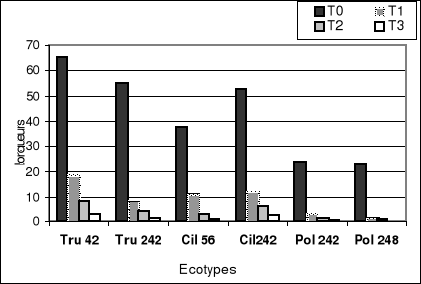
En conditions normales (0% NaCl), la figure 3-a montre que
M.ciliaris (Cil 242) a le taux de
germination le plus élevé et l'écotype (Pol
242) le plus faible. Le développement de la longueur
du tube pollinique chez les témoins est le plus important chez
M.truncatula (Tru
42) avec 65.22 u.m, et l'écotype
Pol248 présente la longueur la plus
faible : 22.75 u.m (Fig 4-a).
En général, les espèces
M.truncatula et M.Ciliaris présentent une plus grande
variabilité intrarspécifique que l'espèce
M.polymorpha. L'écotype Tru42 parait le plus
vigoureux par rapport aux autres écotypes en conditions normales (Photos
2).
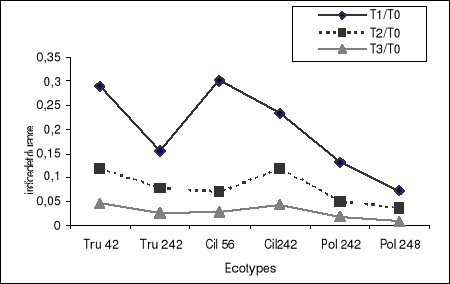
Les résultats ont montré que le
gamétophyte mâle de l'écotype Tru 42
présente plus de variabilité et donc une meilleure
tolérance au stress salin par rapport aux autres écotypes pour
tout les deux indices de tolérances. Seule l'indice de tolérance
I.T1 chez l'écotype Cil
56 a révélé une meilleure vigueur
pollinique seulement pour la longueur(Photos 3) , tandis que les
gamétophytes mâles des deux variétés Pol
242 et Pol 248 les moins variable ont
présentées une sensibilité vis-à-vis du stress
salin. Sous traitement T2 et T3, des différences
significatives entre écotypes ont permis de différencier entre
les écotypes tolérants et sensibles.
Ces résultats permettent de conclure que la
réponse des grains de pollen à différentes concentrations
de salinité, se traduit par un faible taux de germination des grains de
pollen et une diminution de la longueur du tube pollinique, ainsi que celles
des indices de tolérance pour les deux paramètres chez les
différents écotypes. L'écotype
Tru42, présente dans la majorité
des cas une plus forte croissance pollinique, alors que
Pol248 présente un très faible
développement quelque soit le traitement appliqué. La comparaison
intrarspécifique, à partir de l'examen de ces deux
paramètres (longueur du tube pollinique et taux de germination), montre
que l'effet lié à la salinité a provoqué une
variation importante au traitement T2 (0.6 % NaCl) et que la variation
interspécifique est importante entre l'espèce M.polymorpha
et l'ensemble des deux espèces M.ciliaris et
M.truncatula. Ainsi à cette concentration en NaCl, nous avons
pu déterminer quel est l'écotype le plus tolérant
(Tru 42) et l'écotype le plus sensible (Pol
248) et ce résultat est le même que celui trouvé
au stade sporophytique.
Le classement des variétés selon leur indice de
tolérance, n'est pas superposable par
rapport au classement des variétés en conditions normales quelque
soit le stade diploïde ou haploïde. En condition de stress,
l'écotype Tru 42 diffère significativement par rapport aux autres
écotypes et surtout par rapport à l'écotype Pol 248
d'après le Test de Newman et keuls
Quelques travaux ont mis en évidence des
corrélation négatives entre les stress abiotiques et la
germination des grains de pollen ; on cite parmi eux ceux de
(Lambert et al) en
1986, qui ont prouvé que la température a un
effet important sur la viabilité du pollen du Maïs et que le stress
hydrique n'a qu'un effet limité et que l'effet de la
température dépend étroitement de la variété
considérée.
D'après Basseti et Westgate (1993), s'il y a un stress
hydrique la croissance du tube pollinique à l'intérieur de la
soie chez le Maïs, est ralentie et le tube pollinique ne
peut atteindre l'ovule et la fécondation est donc impossible.
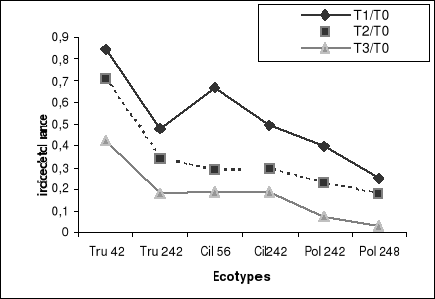
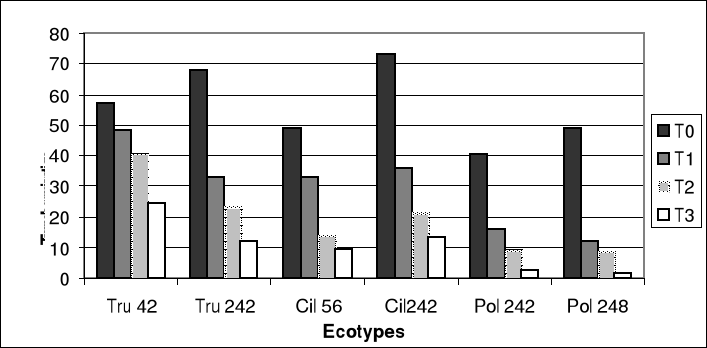
Figure 3-a : Taux de germination
des grains de pollen témoins et traités des différentes
populations de Medicago.
Figure 3-b : Indice de tolérance du taux de
germination des grains de pollen sous l'action de différentes
concentrations de salinité.
(30 mn de mise en culture).
Figure 4-b : Indice de tolérance de la longueur des
tubes polliniques des grains de pollen. .
(30 mn de mise en culture).
Figure 4-a : Longueurs moyennes par écotypes des
tubes polliniques des grains de pollen traités et non traités des
différents écotypes étudiées chez Medicago.
T0
T1

Cil 242
Tru42
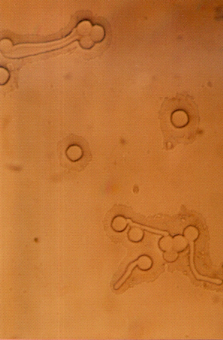
Photos- 02 : Germination du pollen chez quelques
écotypes du genre Médicago en condition normales
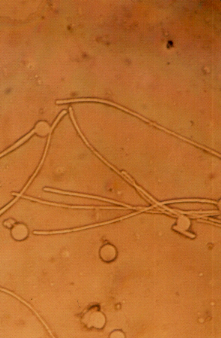
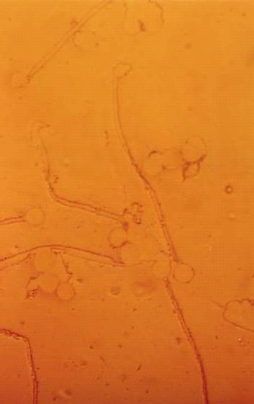
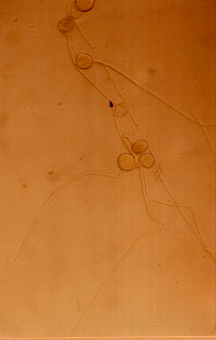
Photos- 03 : Germination du pollen sous différentes
concentrations de NaCl, chez l'écotype Cil 56
Cil 56
Tru 242
T2
T3
3- Comparaison entre le stade sporophytique et
gamétophytique :
En conditions normales, aucune correspondance pour la vigueur
n'a été enregistrée.
Dans l'ensemble, et après les différentes
comparaisons étudiées, les résultats montrent une grande
correspondance entre la vigueur des sporophytes et celles des
gamétophytes pour l'écotype Tru 42 chez
M.truncatula qui est le plus vigoureux et l'écotype Pol
248 de l'espèce M.Polymorpha, le moins vigoureux, que
ce soit au niveau sporophytique ou au niveau gamétophytique dans la
majorité des cas.
L'analyse des résultats obtenus à partir de
toutes les combinaisons possibles de comparaisons de vigueur chez les
différents écotypes entre le stade diploïde et le stade
haploïde, montre une forte correspondance intraspécifique pour un
même écotype, c'est le cas de l'écotype Tru
42 (le plus tolérant quelque soit le stade), et les
écotypes Pol 242 et Pol 248 de
l'espèce M.polymorpha (les plus sensibles). Concernant, les
écotypes Cil 56 et Cil 242, la
correspondance est moins forte, alors que pour l'écotype Tru
242 est très faible. Notons qu'au traitement T3, il y a une
forte correspondance de vigueur, moins forte au traitement T2 et très
faible au traitement T1.
Il a été considéré que
l'écotype Tru 42, est l'écotype
le plus tolérant et les écotypes
Pol248,
Pol242, les plus sensibles quelque soit le stade,
sporophytique ou gamétophytique, et ceci par le biais
des différentes comparaisons effectuées entre le stade
diploïde et le stade haploïde pour les deux paramètres
mesurés, et qui ont révélé des correspondances
spécifiques pour un même écotype chez l'espèce
M.Truncatula (Tru 42) et chez M.Polymorpha (Pol
248), et pour différents écotypes chez
M.Ciliaris. Le classement des écotypes au traitements T3, a
révélé une forte correspondance spécifique par
rapport au traitement T2, et la comparaison par rapport au traitement T1, a mis
en évidence beaucoup de correspondances non spécifiques .
A partir de ces résultats, on peut supposer qu'il y a
un « overlapping » fonctionnel vis-à-vis de la
salinité surtout sous les traitements T2 et T3.
D'ailleurs un grand nombre de travaux ont montré une
corrélation positive entre les réponses du pollen et celles du
sporophyte à un ensemble de stress (Evans et al.,
1990 ; Hormaza et Herrero., 1992).
Des résultats identiques chez les deux types de plante
« légumineuse et solanée »,
révèlent que les réactions du pollen à
différents stress biotiques et abiotiques sont parallèles aux
réactions des plantes ; Par exemple pour le froid, les génotypes
les plus tolérants au niveau sporophytique sont également les
plus tolérants au niveau gamétophytique chez la tomate (Zamir et
al., 1981) ; Chez Solanum tuberosum (Kristjansddottir., 1990) et
chez Zea mays (Lyaki et al., 1989) ;
Des études citées par Evans et
al. (1988) indiquent l'existence d'un tel phénomène
chez diverses plantes : Gossypium hirsutum, vigna sinensis, triticum
aestivum, lycopersicon esculentum et zea mays.
D'après nos résultats qui sont en accord avec
ces divers travaux, nous avons pu prouver qu'il y a une correspondance entre la
vigueur des sporophytes et celles des gamétophytes pour la
tolérance et la sensibilité vis-à-vis du stress salin pour
les écotypes Tru 42 ,Pol 248 et
Pol 242 chez les différents espèces du genre
Médicago, ce qui laisse supposer, l'existence d'un
chevauchement dans l'expression des gènes au niveau du sporophyte et du
gamétophyte responsables pour la tolérance à la
salinité et donc un overlapping structural .
L'overlapping fonctionnel, est un concept qui suppose
l'existence de l'overlapping structural, et établit en outre, une
corrélation entre la vigueur des gamétophytes et celles des
sporophytes qui en sont issus. (Saar et al.,
1992).
La similitude qui se manifeste entre la croissance du tube
pollinique et la tolérance à la salinité au niveau
sporophytique chez l'écotype Tru 42,
permettra ultérieurement de sélectionner les pollens les plus
aptes afin de les utiliser pour féconder des écotypes sensibles
comme Pol 248, donnant ainsi une descendance d'individus d'une
population hybride tolérante au stress salin.
Tableau 02 : Influence du stress salin sur les
deux paramètres, taux de germination et la longueur au niveau
sporophytique et au niveau gamétophytique.
|
Analyse biométrique au niveau sporophytique
(2n)
|
Analyse biométrique au niveau
gamétophytique (n)
|
|
Esp
Ecty
|
M. truncatula
M. ciliaris M. polymorpha
Tru 42 Tru 242 Cil 56 Cil
242 Pol 242 Pol 248
m #177; ó m #177; ó
m #177; ó m #177; ó m #177;
ó m #177; ó
|
M. truncatula M.
ciliaris M. polymorpha
Tru 42 Tru 242 Cil 56 Cil
242 Pol 242 Pol 248
m #177; ó m #177; ó
m #177; ó m #177; ó m #177;
ó m #177; ó
|
|
T.G
T0
T1
T2
T3
I.T1
I.T2
I.T3
|
0,90 #177; 0.042 1#177; 0 0,80 #177; 0.056
0,80 #177; 0.056 0,98 #177; 0.019 0,96 #177; 0.027
0,86 #177; 0.049 0,80 #177; 0.065 0,54 #177; 0.070 0,40
#177; 0.069 0,54 #177; 0.070 0,46 #177; 0.070
0,58 #177; 0.069 0,46 #177; 0.070 0,28 #177; 0.063 0,06
#177; 0.033 0,14 #177; 0.049 0,06 #177; 0.033
0,12#177; 0.045 0,02#177; 0.019 0,10#177; 0.042
0,02#177; 0.019 0 #177; 0 0,02#177; 0.019
0.95 0.80 0.67
0.50 0.55 0.47
0.64 0.46 0.35
0.075 0.14 0.14
0.133 0.020 0.12
0.025 0 0.020
|
0.56#177;0.049 0.68#177;0.046 0.488#177;0.049
0.73#177;0.044 0.402#177;0.049 0.486#177;0.049
0.482#177;0.049 0.326#177;0.046 0.326#177;0.046
0.36#177;0.048 0.16#177;0.036 0.122#177;0.032
0.406#177;0.049 0.234#177;0.042 0.14#177;0.034
0.212#177;0.04 0.086#177;0.028 0.092#177;0.028
0.242#177;0.042 0.122#177;0.032 0.09#177;0.028
0.134#177;0.034 0.014#177;0.011 0.028#177;0.016
0.85 0.47 0.66
0.49 0.39 0.25
0.71 0.34 0.28
0.29 0.22 0.17
0.42 0.17 0.18
0.18 0.06 0.02
|
|
L
T0
T1
T2
T3
I.T1
I.T2
I.T3
|
5.91 #177; 2.60 7,80 #177; 2.07 4.76 #177; 2.89 4,02
#177; 2.72 5,60 #177; 2.04 5,38 #177; 1.54
4.79 #177; 2.61 3.55 #177; 2.67 1.21 #177; 1.98 1.75
#177; 2.54 2,07 #177; 2.59 1,27 #177; 1.91
2,20#177; 2.35 0.94 #177; 1.84 0,16#177; 0.30
0,07#177; 0.36 0,16#177; 0.48 0,086#177; 0.44
0,174#177; 0.58 0,03#177; 0.15 0,048#177; 0.17
0,008#177; 0.056 0,004#177; 0.028 0 #177; 0
0.81 0.45 0.25
0.43 0.38 0.22
0.37 0.12 0.030
0.017 0.014 0.028
0.029 0.003 0.01
0.001 0.0007 0
|
65.22#177;74.92 55.18#177;65.39 36.06#177;53.80
52.68#177;50.53 23.13#177;34.30 22.75#177;33.27
18.83#177;27.13 8.45#177;16.94 11.26#177;21.26
1.64#177;5.39 3.09#177;8.49 12.2#177;22.66
7.75#177;12.69 4.20#177;9.36 2.59#177;7.86
6.23#177;16.21 0.8#177;3.23 1.18#177;4.55
2.80#177;6.67 1.41#177; 50 0.99#177;3.59
2.16#177;7.39 0.18#177;2.13 0.42#177;2.88
0.28 0.15 0.31
0.23 0.13 0.07
0.11 0.04 0.06
0.11 0.05 0.035
0.043 0.026 0.027
0.041 0.018 0.007
|
Esp : Espèce,
Ecty : Ecotype, m #177; ó :
moyenne #177; écart-type, T.G : Taux de
germination des graines et des grains de pollen, L :
Longueur de la jeune plante (cm, centimètre) et longueur du
tube pollinique (u.m : unité micrométrique),
T0 : Témoin, T1, T2 et T3 : 0.4 %, 0.6 % et
0.8 % de NaCl respectivement.
|
Carac-tères
|
Stade sporophytique (2n)
|
Stade gamétophytique (n)
|
|
T.G
|
Traitem-ents
|
Source de la variation
|
ddl
|
Carré
moyen
|
F.obs
|
Niveau p
|
Source de la variation
|
ddl
|
Carré
moyen
|
F.obs
|
Niveau p
|
|
T0
|
Variété
|
5
|
0.035
|
4.146**
|
0.0095
|
Variété
|
5
|
0.078
|
3.29*
|
0.021
|
|
T1
|
Variété
|
-
|
-
|
Ns
|
< 0.01
|
Variété
|
5
|
0.089
|
2.90*
|
0.034
|
|
T2
|
Variété
|
5
|
0.237
|
4.637*
|
0.0056
|
Variété
|
5
|
0.071
|
3.45*
|
0.017
|
|
T3
|
Variété
|
-
|
-
|
Ns
|
< 0.01
|
Variété
|
-
|
-
|
Ns
|
< 0.01
|
|
T0-T1-T2-T3
|
Traitement
|
3
|
4.31
|
141.48
|
0.00
|
Traitem-ent
|
3
|
1.15
|
51.25*
|
0.00
|
|
L
|
T0
|
Variété
|
5
|
81.72
|
5.478**
|
0.0024
|
Variété
|
5
|
158722.8
|
54.03*
|
0.0000
|
|
T1
|
Variété
|
5
|
102.18
|
6.67*
|
0.000827
|
Variété
|
5
|
20115.89
|
57.70*
|
0.0000
|
|
T2
|
Variété
|
5
|
36.11
|
6.35*
|
0.0010
|
Variété
|
5
|
3896.289
|
38.64*
|
0.0000
|
|
T3
|
Variété
|
-
|
-
|
Ns
|
< 0.01
|
Variété
|
5
|
511.58
|
20.45*
|
0.0000
|
|
T0-T1-T2-T3
|
Traitement
|
3
|
1868.49
|
86.89*
|
0.00
|
Traitem-ent
|
3
|
1099544
|
1289.05*
|
0.000
|
Tableau 03 : résultats de l'analyse de
variance pour les deux paramètres étudiés (Taux de
germination et longueur) à deux stades de développement
(sporophytique et gamétophytique)
T.G : taux de germination,
L : longueur, F.obs : F. observé.
Tableau 05 : Comparaison des moyennes des
différents écotypes témoins pour le taux de
germination (tg) au stade (2n) avec la longueur (L) au stade (n)
et vice versa .
Tableau 04 : Comparaison des moyennes des
différents écotypes témoins pour le taux de
germination et la longueur entre les deux stades : sporophytique
et gamétophytique.
|
Ecotype T0
TG (2n)
|
Ecotype T0 TG (n)
|
Ecotype T0
L (2n)
|
Ecotype T0
L (n)
|
|
Tru 242
|
Cil 242
|
Tru 242
|
Tru 42
|
|
Pol 242
|
Tru 242
|
Tru 42
|
Tru 242
|
|
Pol 248
|
Tru 24
|
Pol 248
|
Cil 242
|
|
Tru 42
|
Cil 56
|
Pol 242
|
Cil 56
|
|
Cil 56
|
Pol 248
|
Cil 56
|
Pol 242
|
|
Cil 242
|
Pol 242
|
Cil 242
|
Pol 248
|
|
EcotypeT0
TG (2n)
|
EcotypeT0
L (n)
|
Ecotype T0
L (2n)
|
EcotypeT0 TG (n)
|
|
Tru 242
|
Tru 42
|
Tru 242
|
Cil 242
|
|
Pol 242
|
Tru 242
|
Tru 42
|
Tru 242
|
|
Pol 248
|
Cil 242
|
Pol 248
|
Tru 24
|
|
Tru 42
|
Cil 56
|
Pol 242
|
Cil 56
|
|
Cil 56
|
Pol 242
|
Cil 56
|
Pol 248
|
|
Cil 242
|
Pol 248
|
Cil 242
|
Pol 242
|
Tableau 06 : Comparaison des moyennes des
différents écotypes traités pour le taux de germination
entre les deux stades : sporophytique (2n) et gamétophytique
(n).
|
Ecotype
T1 (2n)
|
Ecotype
T1 (n)
|
Ecotype
T2 (2n)
|
Ecotype
T2 (n)
|
Ecotype T3 (2n)
|
Ecotype
T3 (n)
|
|
Tru 42
|
Tru 42
|
Tru 42
|
Tru 42
|
Tru 42
|
Tru 42
|
|
Tru 242
|
Cil 242
|
Tru 242
|
Tru 242
|
Cil 56
|
Cil 242
|
|
Cil 56
|
Tru 242
|
Cil 56
|
Cil 242
|
Cil 242
|
Tru 242
|
|
Pol 242
|
Cil 56
|
Pol 248
|
Cil 56
|
Tru 242
|
Cil 56
|
|
Pol 248
|
Pol 242
|
Pol 242
|
Pol 242
|
Pol 242
|
Pol 242
|
|
Cil 242
|
Pol 248
|
Cil 242
|
Pol 248
|
Pol 248
|
Pol 248
|
Tableau 07 : Comparaison des indices de tolérances
des différents écotypes pour le taux de germination entre les
deux stades : sporophytique (2n) et gamétophytique (n).
|
Ecotype I.T1 (2n)
|
Ecotype
I.T1 (n)
|
Ecotype
I.T2 (2n)
|
Ecotype
I.T2 (n)
|
Ecotype I.T3 (2n)
|
Ecotype I.T3 (n)
|
|
Tru 42
|
Tru 42
|
Tru 42
|
Tru 42
|
Tru 42
|
Tru 42
|
|
Tru 242
|
Cil 56
|
Tru 242
|
Tru 242
|
Cil 56
|
Cil 56
|
|
Cil 56
|
Cil 242
|
Cil 56
|
Cil 242
|
Cil 242
|
Cil 242
|
|
Pol 242
|
Tru 242
|
Pol 248
|
Cil 56
|
Tru 242
|
Tru 242
|
|
Cil 242
|
Pol 242
|
Pol 242
|
Pol 242
|
Pol 242
|
Pol 242
|
|
Pol 248
|
Pol 248
|
Cil 242
|
Pol 248
|
Pol 248
|
Pol 248
|
Tableau 08 : Comparaison de moyennes des différents
écotypes traités pour la longueur entre les deux stades :
sporophytique (2n) et gamétophytique (n).
|
Ecotype T1 (2n)
|
Ecotype T1 (n)
|
Ecotype T2 (2n)
|
Ecotype T2 (n)
|
Ecotype T3 (2n)
|
Ecotype T3 (n)
|
|
Tru 42
|
Tru 42
|
Tru 42
|
Tru 42
|
Tru 42
|
Tru 42
|
|
Tru 242
|
Cil 242
|
Tru 242
|
Cil 242
|
Cil 56
|
Cil 242
|
|
Pol 242
|
Cil 56
|
Cil 56
|
Tru 242
|
Tru 242
|
Tru 242
|
|
Cil 242
|
Tru 242
|
Pol 248
|
Cil 56
|
Pol 242
|
Cil 56
|
|
Pol 248
|
Pol 242
|
Cil 242
|
Pol 242
|
Cil 242
|
Pol 242
|
|
Cil 56
|
Pol 248
|
Pol 242
|
Pol 248
|
Pol 248
|
Pol 248
|
Tableau 09 : Comparaison des indices de tolérances
des différents écotypes pour la longueur entre les deux
stades : sporophytique (2n) et gamétophytique (n).
|
Ecotype
|
I.T1
(2n)
|
Ecotype
|
I.T1
(n)
|
Ecotype
|
I.T2
(2n)
|
Ecotype
|
I.T2
(n)
|
Ecotype
|
I.T3
(2n)
|
Ecotype
|
I.T3 (n)
|
|
Tru 42
|
0.81
|
Cil 56
|
0.31
|
Tru 42
|
0.37
|
Tru 42
|
0.11
0.11
|
Tru 42
|
0.029
|
Tru 42
|
0.043
|
|
Tru 242
|
0.45
|
Tru 42
|
0.28
|
Tru 242
|
0.12
|
Cil 242
|
Cil 56
|
0.01
|
Cil242
|
0.041
|
|
Cil 242
|
0.43
|
Cil 242
|
0.23
|
Cil 56
|
0.030
|
Tru 242
|
0.04
|
Tru 242
|
0.003
|
Cil 56
|
0.027
|
|
Pol 242
|
0.38
|
Tru242
|
0.15
|
Pol 248
|
0.028
|
Cil 56
|
0.06
|
Cil 242
|
0.001
|
Tru242
|
0.026
|
|
Cil 56
|
0.25
|
Pol 242
|
0.13
|
Cil 242
|
0.017
|
Pol 242
|
0.05
|
Pol 242
|
0.0007
|
Pol242
|
0.018
|
|
Pol 248
|
0.22
|
Pol 248
|
0.07
|
Pol 242
|
0.014
|
Pol 248
|
0.03
|
Pol 248
|
0
|
Pol248
|
0.007
|
Tableau 10 : Comparaison des moyennes des
différents écotypes traités pour le taux de germination
(tg) au stade (2n) avec la longueur (L) au stade (n).
|
Ecotype
|
T1tg
(2n)
|
Ecotype
|
T1 L
(n)
|
Ecotype
|
T2 tg
(2n)
|
Ecotype
|
T2 L
(n)
|
Ecotype
|
T3 tg
(2n)
|
Ecotype
|
T3 L
(n)
|
|
Tru 42
|
0.86
|
Tru 42
|
18.83
|
Tru 42
|
0.58
|
Tru 42
|
7.75
|
Tru 42
|
0.12
|
Tru 42
|
2.80
|
|
Tru 242
|
0.80
|
Cil 242
|
12.2
|
Tru 242
|
0.48
|
Cil 242
|
6.23
|
Cil 56
|
0.10
|
Cil 242
|
2.16
|
|
Cil 56
|
0.54
|
Cil 56
|
11.26
|
Cil 56
|
0.28
|
Tru 242
|
4.20
|
Cil 242
|
0.02
|
Tru 242
|
1.41
|
|
Pol 242
|
0.54
|
Tru 242
|
8.45
|
Pol 248
|
0.14
|
Cil 56
|
2.59
|
Tru 242
|
0.02
|
Cil 56
|
0.99
|
|
Pol 248
|
0.46
|
Pol 242
|
3.09
|
Pol 242
|
0.06
|
Pol 242
|
1.18
|
Pol 242
|
0.02
|
Pol 242
|
0.42
|
|
Cil 242
|
0.40
|
Pol 248
|
1.64
|
Cil 242
|
0.06
|
Pol 248
|
0.8
|
Pol 248
|
0
|
Pol 248
|
0.18
|
Tableau 11 : Comparaison de moyennes des différents
écotypes traités pour taux de germination au stade (n) avec la
longueur au stade (2n)
|
Ecotype
|
T1 L
(2n)
|
Ecotype
|
T1 tg
(n)
|
Ecotype
|
T2 L
(2n)
|
Ecotype
|
T2tg
(n)
|
Ecotype
|
T3 L
(2n)
|
Ecotype
|
T3tg
(n)
|
|
Tru 42
|
4.79
|
Tru 42
|
0.48
|
Tru 42
|
2.20
|
Tru 42
|
0.40
|
Tru 42
|
0.17
|
Tru 42
|
0.24
|
|
Tru 242
|
3.55
|
Cil 242
|
0.36
|
Tru 242
|
0.94
|
Tru 242
|
0.23
|
Cil 56
|
0.048
|
Cil 242
|
0.13
|
|
Pol 242
|
2.07
|
Tru 242
|
0.32
|
Cil 56
|
0.16
|
Cil 242
|
0.21
|
Tru 242
|
0.030
|
Tru 242
|
0.12
|
|
Cil 242
|
1.75
|
Cil 56
|
0.32
|
Pol 248
|
0.16
|
Cil 56
|
0.14
|
Pol 242
|
0.004
|
Cil 56
|
0.09
|
|
Pol 248
|
1.27
|
Pol 242
|
0.16
|
Cil 242
|
0.07
|
Pol 242
|
0.09
|
Cil 242
|
0.008
|
Pol 242
|
0.02
|
|
Cil 56
|
1.21
|
Pol 248
|
0.12
|
Pol 242
|
0.08
|
Pol 248
|
0.08
|
Pol 248
|
0
|
Pol 248
|
0.01
|
Tableau 12 : Comparaison des indices de tolérance
des différents écotypes traités pour le taux de
germination (tg) au stade (2n) avec la longueur (L) au stade (n)
|
Ecotype
|
I.T1 tg
(2n)
|
Ecotype
|
I.T1 L
(n)
|
Ecotype
|
I.T2 tg
(2n)
|
Ecotype
|
I.T2 L
(n)
|
Ecotype
|
I.T3 tg
(2n)
|
Ecotype
|
I.T3 L
(n)
|
|
Tru 42
|
0.95
|
Cil 56
|
0.31
|
Tru 42
|
0.64
|
Tru 42
Cil 242
|
0.11
|
Tru 42
|
0.133
|
Tru 42
|
0.043
|
|
Tru 242
|
0.80
|
Tru 42
|
0.28
|
Tru 242
|
0.46
|
Cil 56
|
0.12
|
Cil242
|
0.041
|
|
Cil 56
|
0.67
|
Cil 242
|
0.23
|
Cil 56
|
0.35
|
Tru 242
|
0.04
|
Cil 242
|
0.025
|
Cil 56
|
0.027
|
|
Pol 242
|
0.55
|
Tru242
|
0.15
|
Pol 248
|
0.14
|
Cil 56
|
0.06
|
Tru 242
|
0.020
|
Tru242
|
0.026
|
|
Cil 242
|
0.50
|
Pol 242
|
0.13
|
Pol 242
|
0.14
|
Pol 242
|
0.05
|
Pol 242
|
0.020
|
Pol242
|
0.018
|
|
Pol 248
|
0.47
|
Pol 248
|
0.07
|
Cil 242
|
0.07
|
Pol 248
|
0.03
|
Pol 248
|
0
|
Pol248
|
0.007
|
Tableau 13 : Comparaison des indices de tolérance
des différents écotypes traités pour le taux de
germination (tg) au stade (n) avec la longueur (L) au stade (2n)
|
Ecotype
|
I.T1 tg
(n)
|
Ecotype
|
I.T1 L
(2n)
|
Ecotype
|
I.T2 tg
(n)
|
Ecotype
|
I.T2 L
(2n)
|
Ecotype
|
I.T3 tg
(n)
|
Ecotype
|
I.T3 L
(2n)
|
|
Tru 42
|
0.85
|
Tru 42
|
0.81
|
Tru 42
|
0.71
|
Tru 42
|
0.37
|
Tru 42
|
0.42
|
Tru 42
|
0.029
|
|
Cil 56
|
0.66
|
Tru 242
|
0.45
|
Tru 242
|
0.34
|
Tru 242
|
0.12
|
Cil 56
|
0.18
|
Cil 56
|
0.01
|
|
Cil 242
|
0.49
|
Cil 242
|
0.43
|
Cil 242
|
0.29
|
Cil 56
|
0.030
|
Cil 242
|
0.18
|
Tru 242
|
0.003
|
|
Tru 242
|
0.47
|
Pol 242
|
0.38
|
Cil 56
|
0.28
|
Pol 248
|
0.028
|
Tru 242
|
0.17
|
Cil 242
|
0.001
|
|
Pol 242
|
0.39
|
Cil 56
|
0.25
|
Pol 242
|
0.22
|
Cil 242
|
0.017
|
Pol 242
|
0.06
|
Pol 242
|
0.0007
|
|
Pol 248
|
0.25
|
Pol 248
|
0.22
|
Pol 248
|
0.17
|
Pol 242
|
0.014
|
Pol 248
|
0.02
|
Pol 248
|
0
|
Conclusion
Grâce a cette étude, il a été
possible d'apprécier et d'évaluer, pour des jeunes plantes de
Medicago, la variabilité génétique de la
tolérance à la salinité au niveau sporophytique et
gamétophytique et de déterminer préalablement
l'écotype le plus tolérant et performant qui est
Tru 42, appartenant à
l'espèce M.truncatula, en vue de son utilisation dans des
systèmes de rotation
« céréale-luzerne » dans les zones salines,
arides et semi-arides.
Au niveau métabolique (biochimique), l'étude de
la cinétique d'expression des isoenzymes d'estérases et des
protéines totales durant l'ontogenèse et pendant le stress salin,
a mis en évidence des variations quantitatives et qualitatives pour la
synthèse des protéines et des enzymes de
stress, entre les deux variétés, tolérante et
sensible, avec une cinétique d'apparition différente
d'osmotines, due à des différences d'expression
génique au cours du stress salin. En repérant ces marqueurs de
tolérance inductibles par ce stress, il est possible de remonter au
niveau des gènes correspondant afin de localiser les zones du
génome impliquées dans la variation de ce caractère de
tolérance au stress salin et de rechercher les QTLs en
question.
En comparant, entre le stade sporophytique et
gamétophytique, nous avons pu mettre en évidence un overlapping
fonctionnel entre la vigueur des gamétophytes et celles des sporophytes
chez les deux écotypes, tolérant et sensible, et qui suppose
qu'il y a un chevauchement dans l'expression génétique pour la
tolérance ou la sensibilité au stress salin chez ces deux
écotypes du genre Médicago.
Ce modeste travail constitue une preuve que la
sélection au stade gamétophytique, technique de sélection,
rapide et économique, peut s'appliquer a la sélection de
variétés tolérantes au sel.
Références
Abdelguerfi.A., 1978. Contribution à
l'étude écologique des luzernes annuelles en Algérie.
Mémoire en vue de l'obtention du diplôme de magister, p :
1-116.
Bassetti et Westgate. , 1993. Water
deficit affects receptivity of maize silks. Crop.Sci., 33:
275-278.
Brown.P.W, Tanner.C.B., 1983. Alfalfa stem
and leaf growth during water stress. Agro. J.Vol.75 (5):
799-804.
Chebouti.A, Abdelguerfi.A., 2002. Etude de
l'effet du déficit hydrique sur le développement et le rendement
fourrager chez quatre populations de Medicago truncatula (L) GAERTN.
INRA d'Alger. Revue semestrielle (10).27-31.
Evans. De, Singh. M .B, Knox. R. B., 1990.
Plant development: Application in biotechnology. In : Blackmore.S, knox.R.B
(Eds) Microspores: evolution and antogeny. Academic press, london San diego, p
309-338.
Evans. De, Rohnie. N .E, sang j. P., palmer M. v,
Mulcahy D. L, Singh M .B and Knox R. B., 1988.
Correlation between gametophytic (pollen) and sporophytic (seed) generation for
polyunsaturated fatty acids in oilseed rape Brassica napus L. Theor. Appl.
Genet., 76: 411-419.
Fyad-Lameche. F-Z., 1999. Polymorphisme des
isoenzymes et des protéines de réserves des graines de population
naturelles d'espèces annuelles de Medicago en relation avec le
système de reproduction. Thèse docteur D'état en
Amélioration des plantes. Université d'Oran-Es-Sénia. 194
p.
Hormaza. J. I, Herrero. M., 1996. Male
gametophitic selection as a plant breeding tool. Scientia horticulturae.
65:321-333.
Lambert.P-J, Schoper.J-B, Vaislas.B-L., 1986.
Maize pollen viability and ear receptivity under water and high temperature
stress. Crop Science, 26, pp: 1029- 1033.
Laval-Martin.D et Mazliak.P., 1995.
Physiologie végétale I : Nutrition et métabolisme.
Collection Methodes : 510-526.
Lyaki.V.A, Soraka.A.I, Kravchenko.A., 1989.
Gametophyte and sporophyte reponse to low temperature in different maize
genotypes. pp:51-55. In: Characterization of male transmission units in higer
plant. Bamabas.B and Liszt (Eds) Martonvasar hungary.
Saar.A, Robert.T, Pilate-André.S, Lamy.F,
Sandmeier.M, Peigne .M-T, Heugas.M, Ricroch.A, Khalfallah.N,Yakovlev.S,
Cherkaoui.M, Bendaoud.L, Tazi.l, Lespinasse.R, le Thi. K., 1992. la
domestication du mil ( Pennisetum typhoïdes Stapf et Hubb).
Modèle d'étude de l'évolution des complexes
d'espèces. Actes du colloque en hommage à Jean Pernès.
pp : 19-35.
Shivanna K.R and sawhney V.K.,1993. Pollen
selection for alternia resistance in oilseed brassicas : responses of
pollen grains and leaves to a toxin of
A.brassicae.Theor.Appl.Genet-86 :339-344.
Teyssendier de la serve.B et Boutin.J-P.,
1972. Polymorphisme de la luzerne : Etude d'une sélection
pour la germination en présence de chlorure de sodium au sein du
cultivar GABES. Ann.Amélior. Plantes, 22 :
225-232.
Vincent. D, Negroni. L, Zivy. M., 2002.
L'analyse protéomique de la réponse au déficit hydrique
dans la feuille de maïs en croissance. Congrès de la SFEAP, 16,
17,18 Octobre 2002, Lille. p : 6.
Zamir.D, transkley.S.D, Jones.R.A., 1981. Low
temperature effect on fertilization by pollen mixtures of wild and cultivated
tomato species. Theor. Appl. Genet. 80: 139-142.
| 


