|
|
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET
POPULAIRE
1VIINISTERE DE L'ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE
CIENTIFIQUE
UNIVERSITE MOHAMED KHIDER BISKRA
|
|
FACULTE DES SCIENCES ET DE LA
TECHNOLOGIE
DEPARTEMENT DE CHIMIE INDUSTRIELLE
|
|
Memoire de fin d'Etude en Vue de 1'Obtention du
Diplome
d'Ingenieur d'Etat
SPECIALITE: Chimie Industrielle OPTION: Genie
Chimique
THEME
|
|
|
|
|
Etude experimentale de l'equilibre
liquide-
liquide des systemes ternaires :(
n-Heptane +
|
|
|
|
|
|
Methanol), (n-Heptane+ Xylerte+Sulfolarte)
et
(n-Heptane + Toluene + Sulfolane).
|
|
Present& 1 ar:
|
|
Touati Mourad & Baghezza Abderrezak
President: Dr Makhloufi Rachid
|
|
Examinateur: Mr. Nedjar Zouhir.
|
|
Encadreur: Dr. Hasseine Abdelmalek.
|
|
|
Promotion 2008/ 2009
|
|
|

R~irrerweirregte
Avant tous, nous remercions DIEU qui nous a donné la
force, le courage et la patience
pour réaliser ce modeste travail.
Cette reconnaissance est infinie envers notre encadreur le
docteur : Hasseine Abdelmalek qui n'a pas fait seulement le
devoir, mais beaucoup plus que ça, étant donnée la
patience, l'humeur toujours joyeuse et le dévouement sans limite, qui
ont été nécessaire aux jeunes apprentis que nous
sommes.
Aussi un grand remerciement à Mr.
Merzougui Abdelkarim et Mr.
Laiadi
Djemoui pour leurs aides.
Que tous mes collègues du laboratoire soient
également chaleureusement remerciés,
eux qui de prés ou de loin, ont permis la
réalisation de ce travail.
Nous voudrons également exprimer toutes nos
reconnaissances aux membres de jury pour l'intérêt qu'ils ont
porté à ce travail et pour l'honneur qu'ils nous ont fait pour
juger ce travail: Mr. Makhloufi Rachid et
Mr. Nedjar Zouhir.
On ne doit pas laisser passer cette occasion, sans faire
exprimer nos gratitudes et remerciement vers toute l'administration, sous la
direction du chef de département : Dr. Barket Djamel.
Pour opportunité de nous inscrire à l'ingéniorat, «
Passerelle cycle court-cycle Long ».
,91/Perei ci 4.4
SOMMAIRE
Introduction générale
~~~.~~~~~~~~~~~...~~~~~~~~~~~. 1
Chapitre I
Extraction liquide-liquide
Introduction~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~..
2
I.1.principe physico-chimique~~~~~~~~~~~~~~~~~~~~..~~
3
I.2. Equilibre liquide-liquide ternaire
~~~~~~~~~~~~~~~~~..~~ 3
1.2.1. Représentation
triangulaire~~~~~~~~~~~~~~~~~~~..~~. 4
1.2.2. Regle des mélanges : relation barycentrique
~~~~~~~~~.~~..~~.... 4
1.2.3. Courbe de distribution et droites de conjugaison
(conodales)~~~~...~~~... 6
1.2.4. Sélectivité~~~~~~~~~~~~~~~~~~~~~~~~~~~~.
8
I.2.5.Facteur de Séparation~~~~~~~~~~~~~~~~~~~~~~~... 9
I.3. Terminologie 9
I.4. propriété de l'extractant
10
I.S. Classification des extracteurs liquide-liquide industriels
~~~~~~~~~~. 11
Chapitre II
Etude Expérimentale de l'équilibre
liquide-liquide
II.;. Matériels et Technique expérimentale
~~~~~~~~~~~~~~~~... 12 II.1.1 Produits~~~~~~~~~~~~~~~~~~~~~~~~~~~~..
12
a) Extractant (Solvant)~~~~~~~~~~~~~~~~~~~~~~~~... 12 a.1
--Méthanol 12
a.2- Sulfolane ~~~~~~~~~~~~~~~~~~~~~~~~~~~ 13
b) Diluant ~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 14
c) Soluté ~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 15
c.1- Xylene ~~~~~~~~~~~~~~~~~~~~~~~~~~~~.. 15
c.2- Toluene 16
11.1.2. Appareillage ~~~~~~~~~~~~~~~~~~~~~~~~~~ 17
11.1.3. Processus Expérimental 17
11.1.3.1. Mode opératoire ~~~~~~~~~~~~~~~~~~~~~~~ 17
11.1.3.1.1. Courbe d'étalonnage 17
11.1.3.1.2 Construction des droites de conjugaison
....................................... 17
11.1.4 -- Extrapolation des résultats (méthode de
calcul) ................................... 18
11.1.4.1 Analyse du raffinat
................................................................. 18
A- Determination de la fraction massique de solute dans le
raffinat (XA) ......... 18
B- Determination de la fraction massique de n-Heptane dans le
raffinat (XB) ...... 19
C- Determination de la fraction massique de solvant dans le
raffinat (XS) ......... 20
11.1.4.2. Analyse du l'extrait
............................................................... 20
A- Determination de la masse totale de
l'extrait......................................... 20
B- Determination de la fraction massique du solute dans
l'extrait (yA) ............. 21
C- Determination les fractions massique du diluant et solvant
dans l'extrait
(yB
,yS)....................................................................................................
21
D- Determination de la composition de l'extrait sans
solvant......................... 21
Chapitre III
Résultats et
discutions
III.1.Introduction
...................................................................................
22
III.2. Résultats
expérimentaux....................................................................
22
III.3. Courbe d'étalonnage
...........................................................................
22
III .4. Les courbes des conjugaisons
.................................................................................
23
III.5. Paramitres de
suivi.............................................................................
27
111.5.1. Fiabilité de données
expérimentales......................................................
27
111.5.2. 1sotherme de distribution
......................................................................... 30
111.5.3. 1sotherme de Sélectivité
................................................................... 31
111.5.4. Le coefficient de distribution ou de partage
............................................. 32
111.5.5. Facteur de Separation
..................................................................... 33
111.5.6. Facteur de
sélectivité.......................................................................
33
Conclusion generale ................
36
Annexe
References Bibliographiques

Introduction generale :
Les données d'équilibre de liquide-liquide (LLE)
des systemes ternaires sont trts importantes pour la simulation, la conception,
l'optimisation et le contrôle de l'opération de séparation.
Les investigations de LLE sur les systemes ternaires de type
Aromatique/Aliphatique+Solvant ont été le sujet d'un grand
d'intérêt ces derniéres années. Les composés
aromatiques sont présents en naphta. Les composés aromatiques de
grande pureté sont difficiles a etre séparés utilisant
l'opération de distillation ordinaire. Puisqu'ils ont des points
d'ébullition dans une gamme étroite. C'est
pourquoi nous nous sommes intéressés a l'extraction
liquide-liquide comme une technique de séparation qui s'avére
intéressante par rapport la distillation. L'extraction liquide-liquide
est, donc un meilleur choix pour séparer les composés aromatiques
du naphta, car ils sont solubles dans une série des solvants organique
ou ionique et son avantage réside dans sa simplicité et surtout
sa haute performance, l'efficacité et le cofit relatif de
l'équipement utilisé qui permet d'atteindre des degrés de
séparation assez élevés [1].
Dans ce travail, les données de l'équilibre
liquide-liquide des systemes ternaires :
(nheptane-Xyléne-Méthanol),
(n-Heptane-Toluéne-Méthanol), (n-Heptane-Xyléne-Sulfolane)
et (n-Heptane-Toluéne-Sulfolane) sont obtenues a partir d'observations
expérimentales. Les résultats obtenus sont analysés pour
étudier la fiabilité, quelque grandeurs physiques (coefficient de
partage), le facteur de séparation et ainsi la
sélectivité.
Ce travail est présenté dans ce mémoire
selon le plan suivant:
Dans le chapitre 1 nous avons réunit toutes les
informations disponibles dans la littérature pour caractériser et
expliquer le phénoméne de l'extraction liquide-liquide.
Dans le chapitre 2 une présentation des principaux
produits utilisés, le mode opératoire, les méthodes
d'analyses et ainsi la procédure de calcul des compositions dans chaque
phase (données d'équilibres).
Le chapitre 3 et dédie aux différents
résultats expérimentaux.
Enfin nous concluons par les différents résultats
obtenus le long de ce travail.

Extraction liquide-liquide
Introduction :
L'extraction liquide-liquide constitue une operation
fondamentale en genie chimique. C'est un procede qui permet la separation de un
ou plusieurs constituants d'un melange en mettant a profit leur distribution
inegale entre deux liquides pratiquement non miscibles. Les methodes
d'extraction se basent essentiellement sur le suivi d'equilibre, et donc le
transfert de masse ne peut etre ignore [2].
Dans l'industrie, l'extraction liquide-liquide concurrence les
autres procedes, tel que la distillation, la cristallisation,
l'adsorption...etc. Dans certains cas elle s'impose de maniere indiscutable,
notamment lorsque les conditions technologiques ou physico-chimiques lui sont
favorables, comme c'est le cas pour [3]:
- La separation de constituants a points d'ebullition voisins
(separation de certains hydrocarbures aromatiques et aliphatiques) ;
- La separation azeotropique ;
- La separation de composes thermosensibles ou instables
(antibiotiques) ;
- La concentration et la purification de solutions diluees,
operation souvent plus economique que la distillation ;
En pratique, l'utilisation d'un procede d'extraction
liquide-liquide requiert deux operations successives :
- La mise en contact intime des deux phases liquides durant un
temps suffisant a l'obtention de l'equilibre ou d'un etat proche de l'equilibre
et pendant lequel le ou les solutes sont transferes de la phase d'alimentation
vers le solvant ;
- Apres leur contact, une separation ulterieure des deux
liquides (extrait et raffinat) sous l'effet de la gravite naturelle a laquelle
peut s'ajouter, dans certains cas, la mise en oeuvre d'autre forces : force
centrifuge, champs electrique...etc[4].
I.1. Principe physico-chimique :
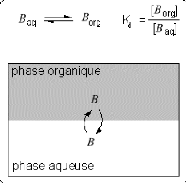
une phase organique non-miscible a l'eau. Lorsque les deux phases
liquides sont en contact il s'etablit l'equilibre de partage suivant pour B
(figure 1) :
Retire 1.1) Equilibre
de partage d'un solute B entre deux phases liquides non-miscibles
(aqueuse
et organique).
Cet equilibre est caracterise par une constante
thermodynamique Kd appelee le coefficient de partage :
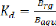
L'extraction sera d'autant plus efficace que le coefficient de
Distribution est grand, on choisit, lorsque cela est possible, un solvant
d'extraction dans lequel le solute est tres soluble
[5].
1.2. Equilibre liquide-liquide d'un system ternaire
:
Les equilibres liquide-liquide ternaire mettent en jeu trois
constituants : diluant (A), solute (B) et solvant ( C). L'introduction du
solvant dans le mélange soluté-diluant provoque l'apparition de
deux phases liquide, la premiere riche en diluant qui l'on appelle raffinat, la
seconde riche en solvant dite extrait [6].
1.2.1. Representation triangulaire :
La presence des trois constituants dans le mélange
liquide, le solute B et les deux constituants A et C, nous conduit a adopter
une presentation graphique au moyen des triangles
équilatéraux.
Chaque sommet représente un constituant pur A, B ou C.
Sur chaque coté du triangle on peut indiquer la composition des
mélanges binaires (entre 0 % et 100 %) A-B, B- C, A- C. Chaque point au
cceur du triangle représente un mélange ternaire A-B- C. Il
s'agit donc de positionner le point représentatif en fonction de la
proportion de chaque constituant sachant que % A + % B + C % = 100 %.
[7].
La figure (I- 2) rappelle les regles de lecture du diagramme.
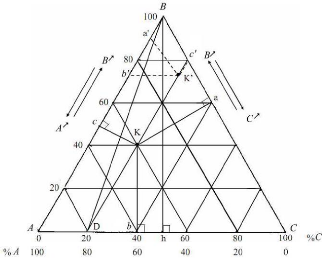
Figure I .2) : Principe de
lecture des compositions sur les diagrammes ternaires. [7] I.2.2.12egle
des mélanges : relation barycentrique
Considérons un mélange ternaire (A + B + C) de
masse R kg qui est mélangé a un mélange ternaire (A + B +
C) de masse E kg mais de composition distincte. Le point M représentatif
du ternaire (A + B + C) final a une composition intermédiaire entre R et
E qui se situe graphiquement en un point de la droite RE dont on peut
déterminer la position en écrivant les bilans massiques a l'aide
de la figure( I.3).
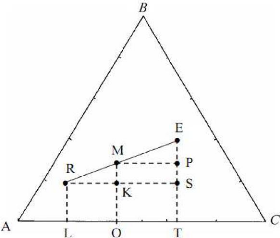
Ileum 1.3) : Relation
barycentrique entre les compositions de M, R et E.
· Bilan massique global :
R + E = M (II-1)
R : masse (kg) du mélange R ;
E : masse (kg) du mélange E ;
M : masse (kg) du mélange M.
· Bilan massique sur le constituant C :
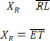
Ou : = = pourcentage de C dans R ;
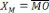
= pourcentage de C dans E ;
= pourcentage de C dans M.
Soit ;
Les relations dans les triangles semblables donnent :
(II-4) + (II-5) conduit a la regle des phases ou regle des
segments inverses :
Cette relation permet de positionner le point M a partir des
masses R et E. Ainsi lorsque :
E/R > 1, le point M est plus proche de R que de E.
Si E/R < 1, le point M est plus proche de E que de R.
· Les bilans massiques sur les trois constituants
conduisent aux relations qui traduisent le fait que le point M est le
barycentre des points R et E affectés de coefficients égaux aux
masses totales des mélanges correspondants. [7]
1.2.3. Courbe de distribution et droites de conjugaison
(conodales) :
Tout mélange liquide ternaire ayant une composition
globale se situant a l'intérieur du domaine de démixtion
génére la formation de deux phases liquides non miscibles de
compositions distinctes. Celles-ci sont régies par la thermodynamique
des mélanges a l'équilibre.
Les constituants du ternaire de composition M (fig. I-3-a) se
répartissent dans l'extrait E riche en C et dans le raffinat R riche en
A. Dans le cas retenu, le soluté B est en concentration
supérieure en E qu'en R. La relation barycentrique obtenue a partir des
bilans massiques fait que les points R, M et E sont alignés. Tout autre
mélange de départ situé sur cette droite RE conduit a des
phases non miscibles de même composition. Cette droite RE est la droite
de conjugaison représentant l'équilibre de composition des deux
phases. De la même faRon le mélange M' conduit a la formation de
deux phases non miscibles de composition R' et E'. Bien que sur le diagramme
ternaire (fig. I.3.a) on ai représenté que quatre conodales, il y
a en réalité une infinité de droites dans le domaine
biphasique. Ces droites sont rarement paralléles et leurs pentes varient
progressivement dans un sens ou dans l'autre. Dans de trés rares cas la
pente s'inverse en passant par une
droite de conjugaison horizontale pour laquelle la teneur en
solute est alors identique dans les deux phases.
Retire 1-4): Courbe de
distribution (b) obtenue a partir des droites de conjugaison du
ternaire
liquide dont le binaire A- C est partiellement miscible.
Le point P est le point critique (droite conjuguee reduite a
un point) traduisant la limite de passage du domaine biphasique au domaine
monophasique. Au point P les courbes de limite de solubilite des solutions
riches en A et celles riches en B se rejoignent.
Le point P est generalement distinct de celui representant la
teneur maximale de B sur la courbe binodale.
La courbe de distribution (fig. I-3-b) represente a
l'equilibre la concentration du solute dans l'extrait (y) en fonction de la
concentration du solute dans le raffinat (x). Ainsi si dans le diagramme
ternaire (fig. I-3-a) l'equilibre thermodynamique est represente par une droite
(la conodale RE) sur la courbe de distribution, chaque equilibre est represente
par un point de coordonnees (R,E) = (x,y).
Compte tenu des pentes des conodales, la courbe de
distribution se situe au-dessus de la bissectrice y = x qui traduit bien que le
constituant B se concentre preferentiellement dans l'extrait. Inversement
lorsque la courbe se situe sous la bissectrice, le solute se concentre dans le
raffinat et les pentes des droites de conjugaison sont negatives.
Le choix d'un solvant C consiste tout d'abord a
vérifier que le coefficient de distribution d = y/x a l'équilibre
soit le plus grand possible ce qui limitera d'autant la quantité de
solvant nécessaire a l'extraction. [7]
1.2.4. Sélectivité :
La courbe de sélectivité représente la
teneur en soluté dans l'extrais en fonction de celle du raffinat mais
aprés élimination du solvant. Elle est obtenue de la même
faRon que la courbe de distribution remplacant les concentrations yA et xA par
les concentrations des phases sans solvant YA et XA.
Tel que :
|
YA
|
yA
|
|
y A + yB
|
|
XA
|
=
|
|
xA
|
|
|
|
xA
|
+ xB
|
Le degré de sélectivité d'un solvant est
défini par [8] :
|
S=
|
X22 /( X 22 +
X,2)
X2, / ( X 2, +
X,, )
|

YA

Pc
XA
FiMure (I.5) : courbe de
sélectivité
I.2.5.Facteur de Séparation :
Dans le cas oil l'on cherche a choisi un solvant pour
séparer un soluté, on doit prendre également en compte la
sélectivité pour le solvant 2 par rapport a celle du solvant 1.
Cette sélectivité est représentée par le facteur de
séparation (3 qui donne par [9] :
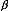
coéfficient.dedistribution
coéfficient.dedistribution
.de
.soluté
.de . diluant
X23
( )
/x21
X13
( )
/ x11
1.3. Terminologie
- Soluté : constituant a extraire ;
- Diluant: liquide contenant les solutés ;
- Solution: ensemble soluté + diluant ;
- Solvant: liquide destiné a extraire les solutés
;
- Extrait : phase issue de l'opération contenant les
solutés extraits. Cette phase est riche en solvant ;
- Raffinat : phase résiduelle épuisée en
soluté. Cette phase est riche en diluant; - Phase lourde : phase ayant
la plus grande masse volumique ;
- Phase légére : phase ayant la plus faible masse
volumique [10].
1.4. Propriétés de l'Extractant :
Le choix de l'extractant pour un procédé
d'extraction liquide-liquide constitue une étape cruciale pour
réaliser une extraction efficace. Généralement il est
déterminé suite a un compromis entre des considérations
technico-économiques et propriétés physico-chimiques,
cependant il est impératif que l'extractant présente un certain
nombre de caractéristiques, parmi lesquels on peut citer :
- Avoir un fort coefficient de distribution vis-à-vis du
soluté a extraire ;
- Une faible solubilité ou pratiquement une
insolubilité avec l'eau (si celle-ci représente la solution
d'alimentation), ceci dans le but de minimiser la perte en solvant dans la
phase raffinat et éviter que l'opération se transforme en un
simple transfert de pollution ;
- Une différence de masses volumiques de l'ordre de 10%
entre les phases en présence (organique et aqueuse) est requise. Ceci
dans le but d'assurer une décantation aisée. Souvent, un
2eme élément est introduit dans la phase organique
(diluant) afin d'en modifier la
masse volumique de l'extractant (en l'augmentant ou en
l'abaissant suivant son rapport a la masse volumique de l'eau) ;
- Une viscosite faible (moins que 3 mPa.s), la valeur de cette
derniere conditionne la quantite d'energie qu'il faudra fournir au systeme
(agitation, pompes...) pour assurer une dispersion des phases favorable au
transfert de matiere ;
- La tension interfaciale joue un role important puisque elle
aussi determine l'efficacite de la dispersion, une tension interfaciale trop
elevee est defavorable a la dispersion reciproque des phases et par consequent
a un contact efficace. Par contre une valeur trop basse de la tension
interfaciale conduit a la formation d'emulsion stable : la decantation devient
alors quasiment impossible ;
- Une stabilite physico-chimique, l'extractant ne devra pas se
degrader sous l'effet d'une oxydation, d'une augmentation de la temperature ou
du pH, il ne devra pas non plus participer a des reactions non reversibles avec
les solutes ;
- Pour la mise en oeuvre du procede, la toxicite,
l'inflammabilite et la volatilite doivent etre pris en consideration.
L'extractant utilise doit etre non toxique et non corrosif et pour eviter des
pertes importantes, seules les extractants peu volatil peuvent intervenir dans
un appareillage ouvert ;
- Un extractant de point de congelation assez bas, afin qu'il ne
cristallise ni ne precipite au cours de l'extraction, est aussi
preferable .
Theoriquement, un extractant efficace devrait posseder
pratiquement toutes les proprietes enoncees ci-dessus. Cependant il est rare
qu'un seul compose recouvre a la fois toutes ces proprietes, raison pour
laquelle il est souvent preferable de cibler juste une ou deux proprietes les
plus importantes au regard du rendement de l'extraction (extractant presentant
de fort coefficient de distribution par rapport a un solute donne par exemple).
Il est alors possible de remedier a la deficience des autres parametres par
ajout dans le systeme d'un second extractant ou de diluant
[11].
I.5.Classification des extracteurs liquide-liquide
industriels :
On distingue trois classes d'appareils d'extraction
liquide-liquide :
> Les
ntélangeurs-décanteurs constitues d'une chambre de
melange suivie d'une chambre de decantation.
· Leurs principaux avantages sont : une efficacite elevee,
une extrapolation fiable et une grande flexibilite.
· Leurs inconvenients majeurs : le coat par etage, le temps
de sejour, la taille de l'installation.
> Les extracteurs-colonnes dans
lesquels la circulation est due a la difference de densite entre la phase
lourde (introduite en haut de colonne) et la phase basse (introduite en bas de
colonne).
> Les extracteurs centrifuges
peuvent être de deux types a étage (melangeur et décanteur
sont regroupés) ou différentiels continus (les phases circulent a
contrecourant dans des garnissages varies) [12].

Etude Experimentale de l `equilibre
liquide-liquide
Dans ce chapitre on etudie l'equilibre liquide-liquide des
systemes ternaire suivants: (n-Heptane + Xylene + Methanol), (n-Heptane +
Toluene + Methanol), (n-Heptane + Xylene + Sulfolane) et (n-Heptane + Sulfolane
+ Methanol) experimentalement a une temperature et pression constante. Dans ce
travail on realises les constructions de la courbe binodale.
II.1 Materiels et Technique experimentale :
II.1.1 Produits :
a) Extractant (Solvant) :
a.1 Methanol:
Le methanol, egalement connu sous le nom d'alcool methylique, de
carbinol, d'alcool de bois, de naphte de bois ou d'esprit de bois est un
compose chimique de formule : CH3OH.
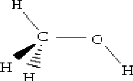
Figure (II.1) : Structure
moleculaire du methanol [13]. * Proprietes physiques
:
|
Numero CAS
|
67-56-1
|
|
Formule
|
CH3OH
|
|
|
Masse Molaire (g.mol-1)
|
32,0422
|
|
Masse Volumique (g/ml)
|
0,79664 a 25° C
|
|
Point d'ebullition (° C)
|
64,7
|
|
Point de Fusion (° C)
|
-97,68
|
|
Indice de Refraction
|
1,3265
|
Tableau (II.&) : Proprietes
Physiques du methanol a l'aide de simulateur ProSim
Le méthanol, est le plus simple des alcools, et il se
présente sous la forme d'un liquide léger, volatil, incolore,
inflammable, toxique avec une odeur caractéristique un peu
écceurant, plus douce et sucrée que celle de l'éthanol
(alcool éthylique). A température ambiante, c'est un solvant
liquide polaire utilisé comme antigel pour liquide de refroidissement,
comme solvant, comme carburant (championnat de champ car nord américain
depuis 1964), et comme dénaturant de l'alcool éthylique dont il
est indissociable par simple distillation. Il est également
utilisé pour la production de biodiesel par réaction de
trans-estérification [13].
a.2- Sulfolane :
Sulfolane (aussi sulfone de
tétraméthyléne, nom systématique: 2, 3, 4, 5 -
tetrahydrothiophene 1,1-dioxide) est un liquide clair et sans couleur
généralement utilisé dans l'industrie chimique en tant
qu'un dissolvant extractif de distillation ou dissolvant de réaction. Le
sulfolane a été a l'origine développé par la
compagnie de Shell Oil dans les années 60 comme dissolvant pour purifier
le butadiéne. Le sulfolane est un composé aprotique
d'organosulfur de formule C411802S [14].
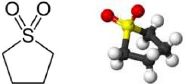
Figure (II.2) : Structure
moléculaire du Sulfolane [14]. * Propriétés
physiques :
|
Numéro CAS
|
126-33-0
|
|
Formule
|
C411802S
|
|
Masse Molaire (g.mol-1)
|
120.17
|
|
Masse Volumique (g/ml)
|
1.261
|
|
Point d'ébullition (° C)
|
285
|
|
Point de Fusion (° C)
|
27.5
|
|
Indice de Réfraction
|
1.48
|
Tableau (11.2) :
Propriétés Physiques du sulfolane
[14].
b) Diluant :
Comme diluant pour la phase organique, le choix s'est
porté sur le n-Heptane. C'est un alcane aliphatique de
chaine carbonée dont les propriétés physiques sont
résumées sur le tableau suivant :
Numéro CAS r'
|
142-82-5
|
Formule
|
C7H16
|
Masse Molaire (g.mol-1)
|
100.21
|
Masse Volumique (g/ml)
|
0.684 a 20° C
|
Point d'ébullition (° C)
|
98
|
Point de Fusion (° C)
|
-91
|
Indice de Réfraction
|
1.387 a 20
|
|
Tableau (11.3) :
Propriétés Physiques du n-Heptane obtenus a l'aide de simulateur
ProSim.
Plus).
c) Solute :
C.1- Xylène :
Le terme xyléne se référe a un groupe de
trois dérivés du benzene, correspondant aux
isoméres ortho-, méta- et para- du
diméthylbenzéne, est un composé chimique de
formule : C6H4 ( CH3)2. [15]
|
Numéro CAS
|
108-38-3
|
|
Formule
|
C8I-110
|
|
Masse Molaire (g.mol-1)
|
106,167
|
|
Masse Volumique (g/ml)
|
0.86
|
|
Point d'ébullition (° C)
|
139,120
|
|
Point de Fusion (° C)
|
-47,850
|
|
Indice de Réfraction
|
1,494
|
Tableau (II.4) :
Propriétés Physiques du xylene obtenu a l'aide de simulateur
ProSim
(Component Plus).
c.2- Toluéne :
Le toluene, également appelé
méthylbenzene ou phénylméthane est un liquide transparent,
insoluble dans l'eau et possédant une odeur caractéristique
rappelant celle du dissolvant pour peinture. Cette odeur rappelle quelque peu
celle, douceAtre, du benzene apparenté. C'est un hydrocarbure aromatique
tres répandu utilisé comme produit de départ
industriel [15].
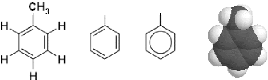
%ieure (II.4) : La structure
moléculaire du toluene [16].
* Propretes physiques :
Les propriétés physiques sont
résumées sur le tableau suivant :
|
Numéro CAS r'
|
203-625-9
|
|
Formule
|
C7I-18
|
|
Masse Molaire (g.mol-1)
|
92.14
|
|
Masse Volumique (g/ml)
|
0.867 a 20° C
|
|
Point d'ébullition (° C)
|
110.6
|
|
Point de Fusion (° C)
|
-95
|
|
Indice de Réfraction
|
1.495 a 20° C
|
Tableau (II.5) :
Propriétés Physiques de Toluene obtenus a l'aide de simulateur
ProSim
(Component Plus).
*Propriétés chimiques :
Le toluene réagit comme un hydrocarbure aromatique
normal par substitution électrophile aromatique. Le groupe
méthyle le rend approximativement 25 fois plus réactif que le
benzene dans ce genre de réactions. Par sulfonation il donne l'acide
para toluene sulfonique, tandis que sa chloration par le chlore en
présence de chlorure ferrique donne un mélange d'isomeres ortho
et para de chlorotoluene. La nitration par l'acide nitrique donne un
mélange d'ortho- et de para-nitrotoluene. En chauffant, la
réaction se poursuit pour donner le dinitrotoluene et finalement le
trinitrotoluene (TNT) qui est explosif [16].
11.1.2. Appareillage :
Les fractions de chaque phase sont déterminées a
l'aide d'un réfractometre.
L'opération s'effectue dans une ampoule a décanter
et on mesure les masses a l'aide d'une balance électronique.
11.1.3. Processus Expérimental :
11.1.3.1. Mode opératoire:
Nos expérience ont été faite au nivaux de
laboratoire de la chimie. 11.1.3.1.1. Courbe
d'étalonnage:
A l'aide d'une pipette en réalisé des
mélanges binaires de xylene (A) + n-Heptane (B) et Toluene (A) +
n-Heptane (B) des compositions bien déterminées, et on mesure
l'indice de réfraction de chaque mélange. On note pour chaque
fois la composition et l'indice qui correspondant.
11.1.3.1.2 Construction des droites de conjugaison
:
Le mode operatoire consiste tout d'abord a la preparation des
charges, constituees generalement d'un solute et d'un diluant, qui dans notre
cas sont :
· Xylene et n-Heptane.
· Toluene et n-Heptane.
Ensuite on traite chaque charge par un solvant
(méthanol, sulfolane) dans un becher de 200cm3 et
agitees a l'aide d'un agitateur.
Le temps d'agitation necessaire pour atteindre l'equilibre
liquide-liquide et a ete fixe a 30 minutes pour chaque echantillon, ensuite on
introduit le melange dans une ampoule a decanter de 125 cm3 et on
laisse ensuite decanter le melange pendant trois heurs (temps bien
determiner).
La decantation totale nous permettra de recuperer l'extrait
(phase organique) et le raffinat (phase aqueuse) isolement pour les quelles on
determinera les masses a l'aide d'une balance electronique.
Apres pesage on procede a Une evaporation qui permet d'eliminer
le solvant (methanol, sulfolane).
En suite on mesure la masse et l'indice de refraction de la
phase surnageant (melange binaire de solute et n-Heptane restante apres
elimination le solvant), puis on determine la masse de la phase raffinat sans
solvant.
Les melanges initiaux et les resultats obtenus sont consignes
dans l'annexe A (les tableaux (A.3), (A.4), (A.5), (A.6) et (A.7)
respectivement).
11.1.4 -- Extrapolation des résultats
(méthode de calcul) :
La determination de ; l'isotherme de distribution et l'isotherme
de selectivite. Sont basee sur la connaissance des compositions de l'extrait et
du raffinat.
Dans ce travaille on prendre a l'analyse du raffinat et en deduit
la composition correspondante en extrait (phase organique) par un bilan
massique.
11.1.4.1 Analyse du ra ffinat :
A- Determination de la fraction massique de solute dans
le ra ffinat (X) :
D'oi i:
mR : est dejà determine donc il nous
reste a determiner mB, R (masse de solute dans le
raffinat).
On peut determiner la composition du raffinat sans solvant
(xA) a partir de la mesure de l'indice de refraction de la phase
aqueuse apres elimination de solvant, en se referant a la courbe d'etalonnage
tracee auparavant.
Soit xA la composition obtenue
D'oi i:
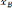
: Fraction massique du solute (dejà determine) ;
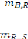
: La masse du solute ;
: La masse du raffinat sans solvant.
B- Determination de la fraction massique de n-Heptane
dans le ra ffinat (XA) :
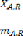
: Fraction massique du diluant ;
: Masse du diluant.

On va determiner la masse du n- Heptane On a :
|
(II.4)
|
|
: La masse du melange binaire de Toluene et n-Heptane restante
apres elimination le
|
C- Determination de la fraction massique de solvant dans
le ra ffinat (Xc) : On a ;
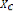
: Fraction massique de solvant ; : La masse de solvant ;
: La masse de raffinat.
On va determiner la masse du solvant comme suite ;
11.1.4.2. Analyse du l'extrait :
L'analyse de l'extrait est faite par voie analytique comme suit
:
A- Determination de la masse totale de l'extrait :
Le bilan massique total, s'ecrit :
M = E + R (II.7)
Soit E = M - R (II.8)
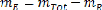
Donc (II.9)
Oil

(II.10)
B- Determination de la fraction massique du solute dans
l'extrait (yB) :
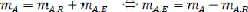
La conservation de masse par chaque constituant implique :
de (11.10) et (11.11) on déduit ;
- Determination les fractions massique du diluant et
solvant dans l'extrait (37A ,37c) ; On détermine
yA et yC d'une maniere analogue a celle
utilisée en paragraphe (B)
|
(11.14)
|
|
(11.15)
|
|
(11.16)
(11.17)
|
D -- Determination de la composition de l'extrait sans
solvant :

Chapitre III Résultats et Conclusion
111 .1. 1ntroduction :
Dans ce chapitre on a présenté tous les
résultats obtenus dans ce travail, ainsi que leur discussion. Il
comporte aussi quelque paramétre d'équilibre tels que la
fiabilité des données expérimentales, l'isotherme de
distribution, les facteurs de séparation et de
sélectivité.
111.2. Résultats expérimentaux :
Les différents résultats de mesures
réalisées seront exposés dans cette partie. Cela concerne
l'extraction de différents systémes ternaire a une
température et une pression constantes. La méthode
expérimentale utilisée a déjà été
décrite au chapitre II, et les conditions analytiques ont
été également explicitées.
111.3. Courbe d'étalonnage :
On représente ci-dessous les courbes
d'étalonnage de deux systémes binaires étudiés
expérimentalement, ces courbes sont obtenues a partir des compositions
bien déterminées en montrant la pureté des produits
utilisés dans ce travail.
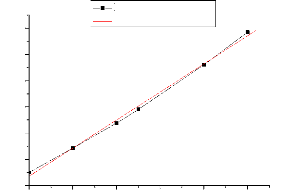
1.50
1.38
0 20 40 60 80 100
n = 1,38709 + 0,00107 * XB
R2=0,99811
INDICE DE REFRACTION(n)
1.48
1.46
1.44
1.42
1.40
Expérimentale DATA Linear fit of DATA
XB DE XYLENE
Retire III-1 : Courbe
d'étalonnage de systéme binaire Xyléne et n-Heptane.
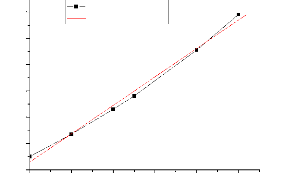
INDICE DE REFRACTION (n)
1.50
1.48
1.46
1.44
1.42
1.40
1.38
Experimentale DATA Linear fit of DATA
n = 1,38576+ 00108 * XA
R2=0,99627
0 20 40 60 80 100
xA
Retire 111-2 : Courbe
d'étalonnage de systéme binaire Xyléne et n-Heptane.
III .4. Les courbes des conjugaisons :
Les tableaux (III.1), (III.2), (III.3) et (III.4)
présentent les compositions d'équilibre de chaque phase (extrait
et raffinat) a 20° C pour les quatre systemes
étudies.
111-4-1- n-Heptane + )(3l7ne +
Methanol
|
Phase de raffinat
|
Phase d'extrait
|
|
XA %
|
XB %
|
XC %
|
YA %
|
YB %
|
YC %
|
|
86.84
|
9.63
|
3.52
|
21.14
|
3.43
|
75.41
|
|
81.11
|
14.29
|
4.60
|
25.74
|
4.57
|
69.68
|
|
76.33
|
20.39
|
6.24
|
27.77
|
8.21
|
60.78
|
|
70.80
|
21.12
|
8.14
|
30.88
|
12.70
|
56.35
|
Tableati 111.1 : Les donnees
experimentales de LLE pour le systeme ternaire
n-Heptane de (A) + Xylene (B) + methanol ( C). (Fraction
massique).
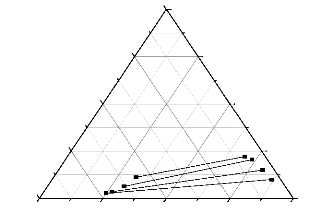
n-heptane
methanol
0,00
1,00
0,25
0,50
0,75
0,75
0,50
0,25
1,00
0,00
0,00 0,25 0,50 0,75 1,00
Retire 111-3 : Courbe de
conodale (n-Heptane + Xylene +Methanol).
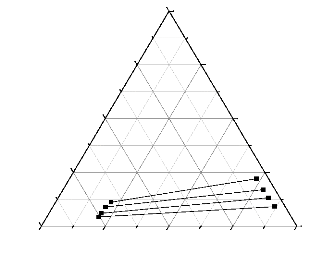
0,00
1,00
0,25
0,50
0,75
0,75
0,50
0,25
1,00
0,00
111.4.2. n-Heptane + Toluene +
Methanol
|
Phase de raffinat %
|
Phase d'extrait %
|
|
XA %
|
XB %
|
XC %
|
YA %
|
YB %
|
YC %
|
|
87.23
|
8.68
|
4.07
|
19.67
|
4.92
|
75.39
|
|
82.92
|
12.58
|
4.49
|
19.50
|
6.97
|
73.47
|
|
76.88
|
18.57
|
4.53
|
20.85
|
8.71
|
70.41
|
|
74.08
|
21.20
|
4.71
|
21.12
|
11.67
|
67.19
|
Tableau 111.2: Les donnees
experimentales de LLE pour le systeme ternaire
n-Heptane de (A) +Toluene (B)
+ methanol ( C). (Fraction massique).

|
Phase de raffinat %
|
Phase d'extrait %
|
|
XA %
|
XB %
|
XC %
|
YA %
|
YB %
|
YC %
|
|
88.93
|
8.15
|
2.91
|
4.09
|
5.40
|
90.50
|
|
84.39
|
11.98
|
3.61
|
6.20
|
7.37
|
86.41
|
|
79.33
|
16.69
|
4.01
|
10.96
|
11.61
|
77.41
|
|
76.19
|
19.02
|
4.78
|
12.02
|
15.17
|
72.80
|
Tableau 111.3 : Les donnees
experimentales de LLE pour le systeme ternaire n-
Heptane de (A) +Xylene (B) + Sulfolane ( C). (Fraction
massique).

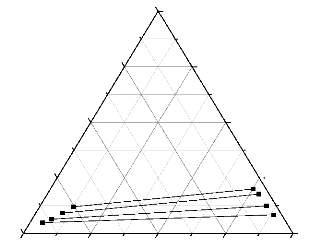
0,00
1,00
0,25
0,50
0,75
0,75
0,50
0,25
1,00
0,00
0,00 0,25 0,50 0,75 1,00
n-heptane sulfolane
Reure 111.5 : Courbe de conodale
(n-Heptane + Xylene +Sulfolane).
|
Phase de raffinat %
|
Phase d'extrait %
|
|
XA %
|
XB %
|
XC %
|
YA %
|
YB %
|
YC %
|
|
91.02
|
7.22
|
1.74
|
13.38
|
7.34
|
79.26
|
|
86.44
|
11.39
|
2.16
|
13.45
|
9.03
|
77.53
|
|
80.82
|
16.98
|
2.19
|
13.93
|
9.41
|
74.57
|
|
77.62
|
19.91
|
2.45
|
14.91
|
13.93
|
71.14
|
Tableau 111.4 : Les donnees
experimentales de LLE pour le systeme ternaire n-
Heptane de (A) +toluene (B) + Sulfolane ( C). (Fraction
massique).
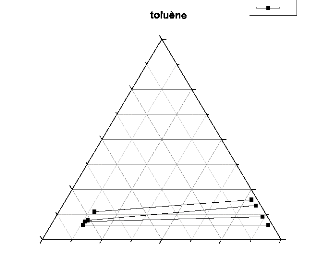
C
n-heptane
sulfolane
0,00
0,25
0,50
0,75
1,00
0,75
0,50
0,25
1,00
0,00
0,00 0,25 0,50 0,75 1,00
Ileu~e 111.6 : Courbe de
conodale (n-Heptane + Toluene +Sulfolane).
111.5. Paramètres de suivi :
Certains paramétres sont souvent utilisés pour
caractériser l'efficacité de l'extraction. On définit les
différents paramétres : la fiabilité des données
d'équilibres, l'isotherme de distribution, l'isotherme de
sélectivité, le facteur de séparation et le facteur de
sélectivité.
111.5.1. Fiabilite de donnees experimentales
:
La fiabilité des données expérimentales
(droites d'équilibres ou tie-line), est confirmé par plusieurs
corrélations, dans ce travail on choisi deux corrélations,
Othmer-Tobias (éq. III.1) et Hand (éq. III.2).
Ces deux corrélations sont données par les
équations suivantes:
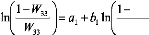
W11
W11
(III.1)
Ou : W33 : Fraction massique de solvant dans
l'extrait.
W1 1 : Fraction massique de diluant dans le raffinat.
|
ln
|
|
W23
= a2 + b2 ln
W33
|
W21
|
(III.2)
|
|
W11
|
Ou : W23 : Fraction massique de soluté dans
l'extrait.
W21 : Fraction massique de soluté dans le
raffinat.
Les coefficients de corrélation et les valeurs du
facteur de corrélation (R2) ont été
déterminés par la méthode des moindres carrés ou
déterminés directement par l'ORIGINE 7.5, et qui sont
rapportés dans le tableau (III.5).Un facteur de corrélation
(R2) prés de 1 suggére un degré
élevé d'uniformité des données
expérimentales.
|
Othmer- Tobias
|
|
|
Hand
|
|
|
Syst (1)
|
|
|
Syst (2)
|
|
|
Syst (3)
|
|
Syst (4)
|
|
|
Syst (1)
|
|
|
Syst (2)
|
|
|
Syst (3)
|
|
|
Syst (4)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A
|
0.5878
|
|
|
-0.2820
|
|
|
0.6203
|
|
-0.4855
|
|
|
-0.1826
|
|
|
-0.5332
|
|
|
-0.4019
|
|
|
-1.0014
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B
|
0.9696
|
|
|
0.4542
|
|
|
1.4186
|
|
0.3842
|
|
|
1.5151
|
|
|
1.0437
|
|
|
1.0963
|
|
|
0.5677
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2
|
0.9909
|
|
|
0.9755
|
|
|
0.9859
|
|
0.9695
|
|
|
0.9270
|
|
|
0.9935
|
|
|
0.9665
|
|
|
ln )
1 + b1
ln1
1
W33=aW33
0.9843
|
a)Othmer- Tobias
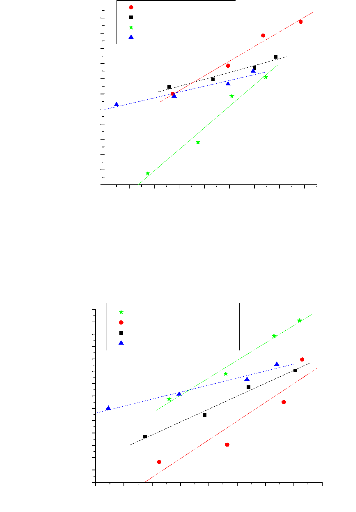
-2.4 -2.2 -2.0 -1.8 -1.6 -1.4 -1.2 -1.0 -0.8
In[(1-Wi;)/ W11 1
Figure (III.7): correlation d'Othmer-Tobias du
n-heptane + xylene + methanol
b) Hand
-2.6 -2.4 -2.2 -2.0 -1.8 -1.6 -1.4 -1.2 -1.0
in(W21/
Wil )
-0.2
-0.4
-0.6
-0.8
-1.0
-1.2
-1.4
-1.6
-1.8
-2.0
-2.2
-2.4
lnk1-W33/ W33
n-heptane+xylène+méthanol
n-heptane+toluene+méthanol n-heptane+xylène+sulfolane
n-heptane+toluene+sulfolane
-0.8
-1.0
-1.2
-1.4
-1.6
-1.8
-2.0
-2.2
-2.4
-2.6
-2.8
-3.0
-3.2
-3.4
-3.6
ln(W23/ W33
n-heptane+xylène+sulfolane
n-heptane+xylène+méthanol n-heptane+toluene+méthanol
n-heptane+toluene+sulfolane
Les figures (III.9) et (III.10) représentent la courbe
de distribution qu'est obtenue en tracant en coordonnées rectangulaires
pour les deux phases (extrait et raffinat), les variations de la composition du
soluté dans la phase riche en solvant, en fonction de la composition en
soluté dans la phase pauvre en solvant. C'est une courbe qui traduit
l'équilibre de distribution du soluté entre les deux phases,
extrait et raffinat.
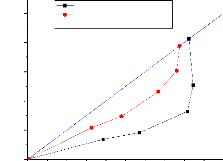
25
n-heptane+xylene+methanol
n-heptane+xylene+sulfolane
20
15
10
5
0
)1B (%)
0 5 10 15 20 25
xr,,,aff (%)
Figure (111.9): Isotherme
de distribution pour les systemes (n-Heptane +Xylene
+Méthanol) et (n-Heptane +Xylene +Sulfolane).
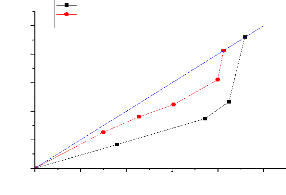
25
20
15
Yr (%)
10
5
0
0 5 10 15 20 25
xr (%)
n-hept ane+toluène+m eth anol n-hept
ane+toluène+sulfol ane
Bureau.scf
Figure (111.10):
Isotherme de distribution pour les systeme (n-Heptane +Toluene
+Méthanol) et (n-Heptane +Toluene +Sulfolane)
111.5.3. 1sotherme de Sélectivité
:
La figure (III.11) et la figure (III.12) représentent
la courbe de sélectivité qu'est tracée en
coordonnées rectangulaires et représente la variation des
compositions en soluté dans l'extrait par rapport a la composition en
soluté dans le raffinat apres élimination du solvant.
Elle est obtenue de la meme facon que la courbe de distribution
remplacant les concentrations yB et xB par les concentrations des phases sans
solvant YA et XA.
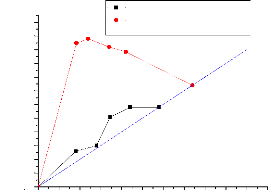
Xsoextriute sans solvant(%)
0,60
0,55
0,50
0,45
0,40
0,35
0,30
0,25
0,20
0,15
0,10
0,05
0.00
n-Heptane+Xylene+methanole n-Heptane+Xylene+Sulfolane
0,00 0,05 0,10 0,15 0,20 0,25 0,30 0,35 0,40 0,45 0,50 0,55
~~ !!- ) ~) )(%, ~~ ~~~ )(%*~'
Figure (III.11) : Isotherme de
selectivite pour les systemes (n-Heptane +Xylene +
Methanol) et (n-Heptane +Xylene +Sulfolane).
n-Heptane+Toluene+Methanol
n-Heptane+Toluene+Sulfolane


0,55
|
yextr
,ssow sans solvant(%)
|
0,50 0,45 0,40 0,35 0,30 0,25 0,20 0,15 0,10 0,05 0.00
|
|
|
|
|
|
0,00 0,05 0,10 0,15 0,20 0,25 0,30 0,35 0,40 0,45 0,50 0,55
~~ !!- ) ~) )(%, ~~ ~~~
)(%*~'
Reure (III.12) : Isotherme de
selectivite pour les systemes (n-Heptane + Toluene +
Methanol) et (n-Heptane +Toluene+Sulfolane).
111.5.4. Le coefficient de distribution ou de partage
:
Le coefficient de distribution ou de partage « kd »
représente le rapport entre la concentration totale en solute dans
l'extrait par rapport a la concentration totale en solute dans le raffinat en
équilibre. Le coefficient de distribution est défini par
:
K -
d
Xi 3
Xi
1
Oil x1 3 , x23 , x1 1 et x2 1
, , et sont les fractions molaires de n-heptane/ toluene dans la phase extrait
et raffinat respectivement qui sont déterminées a partir de
l'analyse des phases .
|
Syst 1
|
Syst 2
|
Syst 3
|
Syst 4
|
|
0.35
|
0.56
|
0.66
|
1.01
|
|
0.31
|
0.55
|
0.61
|
0.79
|
|
0.40
|
0.46
|
0.69
|
0.55
|
|
0.60
|
0.55
|
0.79
|
0.69
|
Tableau III.8 :
Coefficient de distribution de soluté (Kd).
|
Syst 1
|
Syst 2
|
Syst 3
|
Syst 4
|
|
0.24
|
0.22
|
0.04
|
0.14
|
|
0.31
|
0.23
|
0.07
|
0.15
|
|
0.36
|
0.27
|
0.13
|
0.17
|
|
0.43
|
0.28
|
0.15
|
0.19
|
Tableau III.9 :
Coefficient de distribution de diluant (Kd).
111.5.5 Facteur de Separation :
L'efficacité de l'extraction de solute par le solvant est
donnée par son facteur de separation, qui est une indication de la
capacité du solvant de séparer le solute du n-heptane.
Quand la valeur de ce facteur est plus grande que 1, ce qui
signifie que l'extraction de solute (xylene, toluene) par le solvant (Methanol,
Sulfolane) est possible, le tableau cidessous montre que l'extraction
de solute est possible car les valeurs de ce facteur sont supérieures a
1.
|
Syst (1)
|
Syst (2)
|
Syst (3)
|
Syst (4)
|
|
1.45
|
2.54
|
16.50
|
7.21
|
|
1.00
|
2.39
|
12.52
|
5.26
|
|
1.11
|
1.70
|
5.30
|
3.23
|
|
1.39
|
1.96
|
5.26
|
3.63
|
Tableau III.11 : Facteur de
Séparation â.
111.5.6. Facteur de selectivite S :
D'autre part, pour comparer l'efficacité des solvants
utiliser dans notre travail on a définie le facteur de
sélectivité S qui est une indication de la
capacité du solvant 1 pour séparer un soluté par rapport a
un autre solvant 2, les valeurs expérimentaux de ce facteur sont
présenté dans les tableaux (III.10) et les figures (III.13),
(III.14), ces figures montrant que l'extraction des composés aromatiques
et aliphatiques plus efficace avec le Sulfolane par rapport le
méthanol.
|
Syst (1)
|
Syst (2)
|
Syst (3)
|
Syst (4)
|
|
1.44
|
2.22
|
7.00
|
5.00
|
|
1.07
|
1.13
|
4.50
|
3.63
|
|
1.04
|
1.52
|
3.00
|
2.35
|
|
1.31
|
1.59
|
2.89
|
2.40
|
Tableau III.10 : Facteur de
sélectivité S.
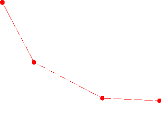
n-heptane+Xylene+Meth anol n-heptane+Xylene+Sulfolane



2
1

0
2 4 6 8 10 12 14 16
E
XB
Retire
(111.13): Facteur de
sélectivité de système (n-Heptane +Xylène+ Solvant)
a 20° C.
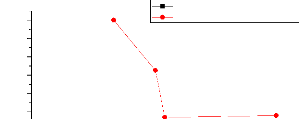
S
4,5
4,0
2,5
5,0
3,5
3,0
n-Heptane+toluene+Methanole n-Heptane+toluene+Sulfolane



2,0
1,5
1,0
0,5
0,0
7
6
5
4
S
3
4 5 6 7 8 9 10 11 12 13 14
XE
A

Conclusion generale:
Dans ce travail, des mesures experimentales ont ete effectuees
pour comprendre le comportement d'equilibre de phase des systemes (n-Heptanes/
xylene/ Methanol), (nHeptane/ toluene/ Methanol), (n-Heptanes/ xylene/
Sulfolane) et (n-Heptane/ toluene/ Sulfolane) l'etude de l'equilibre
liquide-liquide de ces systemes a ete abordee dans l'objectif de repondre a des
besoins industriels specifiques d'une part, et d'autre part, pour apprehender
le comportement de ce type de systemes (Aliphatique/Aromatique) afin de mieux
caracteriser leur comportement thermodynamique.
La generation de donnees experimentales d'equilibres est tres
importante au niveau de l'etude d'equilibre liquide-liquide car elles
permettent d'optimiser le fonctionnement des procedes impliques, experimentales
on peut confirmer que l'ensemble des ces donnees experimentales sont tres
acceptable, cette confirmation est assuree par des correlations tel que
Othmer-Tobias et Hand.
Le calcul des parametres a suivi de l'extraction
liquide-liquide (facteur de separation, facteur de selectivite et coefficient
de distribution), montre qu'on peut considerer sulfolane comme un meilleur
solvant organique pour la separation des composes aromatique a
l'aliphatiques.

ANNEXES
Les tableaux ;
Pour l'étalonnage :
Tableau A.1) : Système binaire
(n-Heptane +Xylène) :
|
Masse de
n-heptane
|
Fraction de
n-heptane %
|
Masse de
xylène
|
Fraction de
xylène %
|
Indice de
réfraction
|
|
10
|
100
|
0
|
0
|
1.390
|
|
8
|
80
|
2
|
20
|
1.4085
|
|
6
|
60
|
4
|
40
|
1.4275
|
|
5
|
50
|
5
|
50
|
1.438
|
|
2
|
20
|
8
|
80
|
1.472
|
|
0
|
0
|
10
|
100
|
1.497
|
Tableau A.2) : Système binaire
(n-Heptane +Toluène):
|
Masse de
n-heptane
|
Fraction de
n-heptane %
|
Masse de
toluène
|
Fraction de
toluène %
|
Indice de
réfraction
|
|
10
|
100
|
0
|
0
|
1,39
|
|
8
|
80
|
2
|
20
|
1,407
|
|
6
|
60
|
4
|
40
|
1,426
|
|
5
|
50
|
5
|
50
|
1,436
|
|
2
|
20
|
8
|
80
|
1,471
|
|
0
|
0
|
10
|
100
|
1,498
|
Les donnes pour les quatre systemes;
Tableau A.3) : Les fractions massiques
initiales:
|
MA (g)
|
XA (%)
|
MB (g)
|
XB (%)
|
Mc (g)
|
Xc (%)
|
|
34
|
61.81
|
4
|
07.27
|
17
|
30.90
|
|
34
|
59.64
|
6
|
10.52
|
17
|
29.82
|
|
34
|
56.66
|
9
|
15.00
|
17
|
28.33
|
|
34
|
54.83
|
11
|
17.74
|
17
|
27.41
|
Tableau A.4) : Les resultats finals Pour
(n-Heptane +Xylene +Methanol) :
|
Phase raffinat
|
|
mR (g)
|
mR-S (g)
|
n0
|
mA (g)
|
mB (g)
|
mC (g)
|
XA %
|
XB %
|
XC %
|
|
34.05
|
32.85
|
1.398
|
29.57
|
3.28
|
1.20
|
86.84
|
9.63
|
3.52
|
|
34.90
|
33.30
|
1.4035
|
28.31
|
4.99
|
1.60
|
81.11
|
14.29
|
4.60
|
|
35.70
|
34.53
|
1.410
|
27.25
|
7.28
|
2.23
|
76.33
|
20.39
|
6.24
|
|
37.20
|
34.19
|
1.4145
|
26.34
|
7.85
|
3.03
|
70.80
|
21.12
|
8.14
|
|
Phase extraite
|
|
mE (g)
|
mE-S (g)
|
n0
|
mA (g)
|
mB (g)
|
mC (g)
|
YA %
|
YB %
|
YC %
|
|
20.95
|
5.15
|
1.3877
|
4.43
|
0.72
|
15.80
|
21.14
|
3.43
|
75.41
|
|
22.10
|
6.70
|
1.3881
|
5.69
|
1.01
|
15.26
|
25.74
|
4.57
|
69.68
|
|
24.30
|
8.47
|
1.3889
|
6.75
|
1.72
|
14.77
|
27.77
|
8.21
|
60.78
|
|
24.80
|
10.81
|
1.3804
|
7.66
|
3.15
|
13.97
|
30.88
|
12.70
|
56.35
|
Tableau A.5) : Les resultats finals Pour
(n-Heptane + Toluene + Methanol)
|
Phase raffinat
|
|
mR (g)
|
mR-S (g)
|
n0
|
mA (g)
|
mB (g)
|
mC (g)
|
XA %
|
XB %
|
XC%
|
|
34.31
|
32.91
|
1.3955
|
29.93
|
2.98
|
1.40
|
87.23
|
8.68
|
4.07
|
|
36.08
|
34.46
|
1.400
|
29.92
|
4.54
|
1.62
|
82.92
|
12.58
|
4.49
|
|
38.33
|
36.59
|
1.406
|
30.47
|
7.12
|
1.74
|
76.88
|
18.57
|
4.53
|
|
39.47
|
37.61
|
1.4095
|
29.24
|
8.37
|
1.86
|
74.08
|
21.20
|
4.71
|
|
Phase extrait
|
|
mE (g)
|
mE-S (g)
|
n0
|
mA (g)
|
mB (g)
|
mC (g)
|
XA %
|
XB %
|
XC %
|
|
20.69
|
5.09
|
1.8368
|
4.07
|
1.02
|
15.60
|
19.67
|
4.92
|
75.39
|
|
20.92
|
5.54
|
1.3873
|
4.08
|
1.46
|
15.37
|
19.50
|
6.97
|
73.47
|
|
21.67
|
6.41
|
1.3877
|
4.53
|
1.88
|
15.26
|
20.85
|
8.71
|
70.41
|
|
22.53
|
7.39
|
1.3886
|
4.76
|
2.63
|
15.14
|
21.12
|
11.67
|
67.19
|
Tableau A.6) : Les resultats finals Pour
(n-Heptane + Xylene + Sulfolane) ;
|
Phase raffinat
|
|
mR (g)
|
mR-S (g)
|
n0
|
mA (g)
|
mB (g)
|
mC(g)
|
XA %
|
XB %
|
XC %
|
|
37.42
|
36.33
|
1.3975
|
33.28
|
3.05
|
1.09
|
88.93
|
8.15
|
2.91
|
|
38.96
|
37.55
|
1.401
|
32.88
|
4.67
|
1.41
|
84.39
|
11.98
|
3.61
|
|
40.12
|
38.51
|
1.406
|
31.83
|
6.70
|
1.61
|
79.33
|
16.69
|
4.01
|
|
41.37
|
39.39
|
1.4085
|
31.52
|
7.87
|
1.98
|
76.19
|
19.02
|
4.78
|
|
Phase extrait
|
|
mE (g)
|
mE-S (g)
|
n0
|
mA (g)
|
mB (g)
|
mC (g)
|
YA %
|
YB %
|
YC %
|
|
17.58
|
1.67
|
1.3881
|
0.72
|
0.95
|
15.91
|
4.09
|
5.40
|
90.50
|
|
18.04
|
2.45
|
1.3885
|
1.12
|
1.33
|
15.59
|
6.20
|
7.37
|
86.41
|
|
19.88
|
4.47
|
1.3895
|
2.17
|
2.30
|
15.39
|
10.96
|
11.61
|
77.41
|
|
20.63
|
5.61
|
1.3904
|
2.48
|
3.13
|
15.02
|
12.02
|
15.17
|
72.80
|
Tableau A.7) : Les resultats finals Pour
(n-Heptane + Toluéne + Sulfolane) ;
|
Phase raffinat
|
|
mR (g)
|
mR-S (g)
|
n0
|
mA (g)
|
mB (g)
|
mC (g)
|
XA %
|
XB %
|
XC %
|
|
34.31
|
33.71
|
1.396
|
31.23
|
2.48
|
0.60
|
91.02
|
7.22
|
1.74
|
|
36.08
|
35.30
|
1.3995
|
31.19
|
4.11
|
0.78
|
86.44
|
11.39
|
2.16
|
|
38.33
|
37.49
|
1.4045
|
30.98
|
6.51
|
0.84
|
80.82
|
16.98
|
2.19
|
|
39.47
|
38.50
|
1.407
|
30.64
|
7.86
|
0.97
|
77.62
|
19.91
|
2.45
|
|
Phase extrait
|
|
mE (g)
|
mE-S (g)
|
n0
|
mA (g)
|
mB (g)
|
mC(g)
|
XA %
|
XB %
|
XC %
|
|
20.69
|
4.29
|
1.3874
|
2.77
|
1.52
|
16.40
|
13.38
|
7.34
|
79.26
|
|
20.92
|
4.70
|
1.3878
|
2.81
|
1.89
|
16.22
|
13.45
|
9.03
|
77.53
|
|
21.67
|
5.51
|
1.3884
|
3.02
|
2.49
|
16.16
|
13.93
|
9.41
|
74.57
|
|
22.53
|
6.50
|
1.3891
|
3.36
|
3.14
|
16.03
|
14.91
|
13.93
|
71.14
|
| 


