|
CONSERVATOIRE NATIONAL DES ARTS ET METIERS DE
PARIS
Mémoire de l'examen « communication pour
l'ingénieur »
BLG 111
Spécialité : Sciences et techniques du
vivant
Option : génie biologique
ANALYSE DES BACTERIES NON CULTIVABLES
Présenté par
David LECHAUDEE
Soutenu le lundi 25 mai 2009
Membres du jury :
Monsieur Ali Saib, Professeur titulaire de la chaire de Biologie
Monsieur Robert Morfin, Professeur des universités
Monsieur Philippe Pochart, Professeur des universités
Madame Antonia Suau-Pernet, Maître de conférences Madame
Marie-Irène Malewiak, Maître de conférences Monsieur Fabien
Magne, Maître de conférences Monsieur Olivier Hennebert,
Maître de conférences


SOMMAIRE
Pages
INTRODUCTION 3
1. LES BACTERIES NON CULTIVABLES, CONTEXTE ET IMPACT SUR
LA SANTE PUBLIQUE. 4
1.1 Caractéristiques physiologiques et
morphologiques des bactéries non cultivables. 4
1.1.1 Caractéristiques des bactéries non
cultivables et non viables. 4
1.1.2 Caractéristiques des bactéries viables
non cultivables (VNC). 5
1.2 Les facteurs induisant l'état non cultivable.
7
1.2.1 Facteurs entraînant la mort cellulaire.
7
1.2.2 Les facteurs de stress cellulaire, induction de
l'état viable non cultivable. 7
1.2.3 Induction expérimentale de l'état viable
non cultivable. 8
1.3 Bactéries VNC dans les denrées
alimentaires, impact et enjeux. 8
1.4 Les bactéries viables non cultivables dans
l'environnement. 9
2. ANALYSES ET METHODES DE RECHERCHE DES BACTERIES NON
CULTIVABLE. 10
2.1 Analyse par fluorimétrie. 10
2.1.1 Double coloration CTC / DAPI. 11
2.1.2 LIVE/DEAD® BacLightTM. 12
2.1.3 Cytométrie de flux. 13
2.2 Direct Viable Count (DVC). 15
2.3 Analyse en Biologie Moléculaire par RT-PCR.
18
3. ETUDES SUR LA VIABILITE, L'ETAT VIABLE NON CULTIVABLE
ET LA RESSUSCITATION. 20
3.1 La ressuscitation. 20
3.2 Les facteurs de ressuscitation : les protéines
Rpf et Sps. 22
CONCLUSIONS 24
REFERENCES BIBLIOGRAPHIQUES 25
LISTE DES ABREVIATIONS 29

INTRODUCTION
Les autorités sanitaires (ex : l'Association
Française de NORmalisation (AFNOR) en France, Food and Drugs
Administration (FDA) aux Etats-Unis) définissent des normes de recherche
et de dénombrement de germes pathogènes dont la plupart sont
basées sur l'utilisation de milieux de culture. Les laboratoires
industriels et publiques utilisent ces milieux, liquides ou
gélosés, sélectifs ou non, afin de permettre aux
bactéries de se multiplier jusqu'à atteindre un niveau
détectable et/ou dénombrable. Ces normes sont donc basées
sur la capacité qu'ont les bactéries à se diviser ou
à former des colonies sur milieux gélosés.
Chaque genre bactérien possède ses
particularités et ses exigences nutritionnelles pour la croissance.
Certaines bactéries sont plus difficiles à cultiver que d'autres,
elles nécessitent des conditions particulières à leur
développement, par exemple Legionella pneumophila (source :
dictionnaire de bactériologie vétérinaire Euzéby
J.P.,
http://www.bacterio.cict.fr/bacdico/ll/legionella.html)
ou encore Mycobacterium Leprae qui n'est pas cultivable sur milieux
complexe ou synthétique (Mukherjee R. et Antia N.H., 1985 [27]).
Le caractère cultivable d'une bactérie
dépend des caractéristiques physiologiques et biochimiques de son
genre ou de son espèce (microorganisme anaérobie,
microaérophile, halophile, différentes auxotrophies selon les
espèces). Les conditions nécessaires à la
prolifération des bactéries au sein d'un même genre ou
d'une même espèce varient également selon l'état
physiologique des cellules. Les conditions extérieures et des facteurs
de stress peuvent influer sur l'état physiologique des cellules. Les
stress peuvent également engendrer la mort des bactéries dans le
cas où elles ne peuvent s'y adapter. Les cellules mortes, sans
activité métabolique, ne peuvent pas être cultivée.
Cependant une bactérie non cultivable n'est pas forcément morte,
une coloration au CTC indiquant que la respiration cellulaire a lieu peut le
montrer (chapitre 2.1.1).
Les bactéries soumises à des stress dus à
leur environnement possèdent des stratégies pour survivre.
Certaines bactéries ont la capacité de former des spores,
d'autres de passer à un état non cultivable : l'état
Viable mais Non Cultivable (VNC).
Dans cette étude, les méthodes d'analyses et de
recherche des bactéries non cultivables seront décrites. Puis les
axes de recherches portant sur le phénomène de retour à un
état cultivable appelé « resuscitation » seront
développés. Il est cependant indispensable dans un premier temps
de décrire et de définir les formes non cultivables des
bactéries. L'impact sur la santé publique de telles formes
bactériennes et les conséquences de leur présence dans
l'environnement sont autant de questions qui suscitent l'intérêt
des microbiologistes et des agences sanitaires.

1. LES BACTERIES NON CULTIVABLES, CONTEXTE ET IMPACT SUR
LA SANTE PUBLIQUE.
Les bactéries sont naturellement présentes
à divers états dans le milieu naturel et dans l'alimentation. Les
paragraphes suivants traitent des caractéristiques de ces
différents états : viables, cultivables ou non, formes
sporulées, mort. Ainsi que les conséquences de la présence
de bactéries non cultivables dans l'alimentation ou dans notre
environnement.
1.1 Caractéristiques physiologiques et
morphologiques des bactéries non cultivables.
Les bactéries non cultivables peuvent se trouver à
différents états dans le milieu naturel : mort, état VNC,
spores. Les articles scientifiques décrivent chacun de ces
états.
1.1.1 Caractéristiques des bactéries non
cultivables et non viables.
Les bactéries mortes, non cultivables et non viables,
n'ont plus de métabolisme. L'activité cellulaire n'existe plus,
il n'y a plus d'échanges entre le cytosol et l'extérieur. Le
renouvellement des lipides membranaires n'ayant plus lieu, la membrane
plasmique des cellules mortes s'en trouve généralement
altérée. Certains facteurs peuvent entraîner la mort des
bactéries ou une lyse cellulaire : un choc osmotique, un traitement
thermique, l'action de surfactant ou encore l'effet du pH. Ces facteurs et
d'autres seront détaillés dans le paragraphe 1.2.1.
Lors d'une croissance en milieu de culture, la mort des
bactéries intervient de façon importante lors de la phase de
déclin.

Figure 1 : Courbe de croissance bactérienne, 1- phase de
latence, 2- phase exponentielle, 3- phase de décélération,
4-
phase stationnaire, 5- phase de déclin

Une culture bactérienne peut être
décomposée en différents stades (figure 1) : La
première phase, dite de latence, est une période pendant laquelle
les cellules bactériennes s'adaptent au milieu dans lequel elles se
trouvent. La seconde phase est la croissance exponentielle : les cellules se
divisent rapidement et colonisent le milieu, à ce stade il y a beaucoup
plus de cellules vivantes que mortes dans la population bactérienne. A
la fin de la phase exponentielle, la croissance ralenti, c'est la phase de
décélération, puis la phase stationnaire. La population
bactérienne reste stable, les bactéries utilisent les composants
du milieu pour synthétiser des métabolites secondaires. Lors de
cette phase le milieu évolue, les métabolites
sécrétés par les bactéries s'accumulent, le nombre
de cellules mortes augmente. Après une phase stationnaire
prolongée les bactéries meurent, soit parce qu'elles ne peuvent
plus assurer leur métabolisme, soit à cause de la toxicité
de certains métabolites qu'elles ont sécrétées. La
membrane cellulaire ainsi que la paroi bactérienne peuvent être
endommagées, c'est ensuite la lyse cellulaire qui intervient. (Prescott
et al., 2003 [33])
L'intérêt de l'étude des bactéries
mortes est limité. Cependant, la présence de bactéries
mortes peut signifier la présence de métabolites, de toxines et
de résidus membranaires tels que les LPS. Ces résidus peuvent
engendrer des intoxinations.
1.1.2 Caractéristiques des bactéries
viables non cultivables (VNC).
Le premier article décrivant et démontrant
l'existence de formes viable non cultivable sur les germes Escherichia
coli et Vibrio cholerae date de 1982 (Xu et al., 1982 [44]).
Depuis, la liste des microorganismes étudiés et décrits
à l'état viable non cultivable s'est allongée (Tableau
1).
Tableau 1 : Liste des bactéries décrites comme
pouvant entrée en état VNC. (Oliver, J.D., 2004 [30])


Une bactérie à l'état viable non
cultivable a perdu sa capacité à se multiplier sur milieu de
culture conventionnel mais possède une activité
métabolique. Cette activité métabolique peut être
mise en évidence par la présence de mRNA dont la durée de
vie est de moins d'une minute (Yaron S., Matthews K.R., 2002 [45]). Ces
bactéries peuvent retrouver leur « cultivabilité »,
phénomène appelé par abus de langage «
ressuscitation» (Oliver J.D. , 2005, [29]).
Le passage à l'état VNC d'une bactérie
est une stratégie qui permet aux cellules de survivre dans des
conditions non favorables, il s'agit d'un état réversible
à l'image de la sporulation des bacilles à GRAM positif tels que
Bacillus ou Clostridium. Ces formes VNC possèdent des
caractéristiques particulières et souvent différentes
d'une espèce à l'autre. Plusieurs études décrivent
les caractéristiques de germes à l'état VNC.
Une étude réalisée chez Campylobacter
jejuni a montrée qu'une cellule viable non cultivable conserve un
taux d'ATP comparable à une cellule cultivable (Beumer et al., 1992
[3]). Cependant, certains changements physiologiques ont été
démontrés chez Campylobacter jejuni : baisse du pH
intracellulaire, chute de la concentration en ions potassium (K+)
(Tholozan et al., 1999, [40]).
Outre les caractéristiques métaboliques et
physiologiques, les bactéries viables non cultivables présentent
des différences morphologiques et structurelles par rapport aux formes
cultivables. Il a été montré, chez Enterococcus
faecalis, une augmentation significative de la résistance
mécanique de la paroi bactérienne (Signoretto et al., 2000 [36]).
Ceci pouvant s'expliquer par des changements dans la structure de la paroi :
notamment par la présence de polymères muropeptidiques de
degré supérieur à deux (trimères,
tétramère, pentamères et plus).
Chez Vibrio vulnificus, des changements de
composition de la membrane plasmique ont été décrits. La
composition en acide gras de cette dernière varie entre l'état
cultivable et non cultivable. A l'état cultivable les acides gras
présents en majorité sont les C16 :0, C16 :1 et C18 :0,
après une courte période à 5°C les acides gras
majoritaires sont C15 :0, C16 :1, C16 :0, C17 :0 et C18 :0. (Day A.P. et Oliver
J.D., 2004 [10]) (CXX :Y, dans la nomenclature des acides gras, XX correspond
au nombre de carbone de la chaine aliphatique, Y correspond aux nombre
d'insaturations de la chaine). Ce constat a été
réalisé dans des conditions de stress hypothermique,
l'hypothèse émise est que ces changements de composition de la
membrane permettent de conserver sa fluidité. Sans ces modifications
membranaires, le passage à l'état VNC est impossible pour
Vibrio vulnificus, les cellules ne peuvent alors survivre au stress
provoqué par le traitement thermique.
Il est important de souligner que les caractéristiques
décrites précédemment sont valables
pour
l'espèce et les conditions étudiées. Les
caractéristiques de l'état VNC peuvent difficilement
être
généralisées. Par exemple, chez
Campylobacter jejuni le volume cellulaire augmente à
l'état VNC

(Tholozan et al., 1999 [40]) alors qu'il n'apparaît pas de
différences significative de volume chez Enterococcus faecalis
(Signoretto et al., 2000 [36]).
1.2 Les facteurs induisant l'état non
cultivable.
1.2.1 Facteurs entraînant la mort cellulaire.
De nombreux facteurs peuvent entraîner la mort cellulaire,
qu'ils soient naturels ou provoqués par des procédés
industriels :
> Températures hautes utilisées pour la
stérilisation ou la pasteurisation
> Choc osmotique
> Solvants organiques et surfactants
> Forte concentration saline
> pH trop acide ou trop basique
> Manque de substrats nécessaires à la survie
> Conservation prolongée à de basses
températures
> Enzyme (exemple : lysozyme)
> Antibiotiques
Tous ces facteurs peuvent engendrer la mort de
bactéries. Leur effet est cependant à relativiser, les
espèces extrêmophiles, halophiles, thermophiles ou psychrophiles
ne réagirons pas de la même façon face à des
conditions extrêmes que des bactéries telles que les
entérobactéries.
C'est pour cela que certains des facteurs cités ci-dessus
seront repris dans le paragraphe suivant comme pouvant induire des formes
VNC.
1.2.2 Les facteurs de stress cellulaire, induction de
l'état viable non cultivable.
Chaque espèce bactérienne possède des
stratégies pour se protéger face à des stress
extérieurs : formation de spores, production de protéines
spécifiques face au stress thermique (ex : heat shock proteins), passage
à des états non cultivable ou encore adaptation du
métabolisme aux conditions extérieures.
Les cellules bactériennes entre en état VNC
lorsqu'elles sont soumises à des stress tels que les
basses ou hautes
températures, variation de la pression osmotique, carence nutritive,
stress oxydatif
provoqué par l'oxygène et les
dérivés actifs de l'oxygène, la déshydratation,
l'exposition

prolongée à la lumière naturel (Besnard
et al. 2002, [2] - Olivier J.D. 2004, [30]). Ces mêmes facteurs peuvent
être létaux. L'effet de chacun d'entre eux dépend notamment
de la durée et du degré d'exposition.
Les conditions naturelles dans lesquelles se trouvent les
bactéries ne sont bien souvent pas optimales pour la croissance et
favorisent l'apparition de formes VNC.
Par exemple, les premières bactéries à
l'état VNC étudiées par Xu et al. en 1982 étaient
Escherichia coli et Vibrio cholerae et provenaient d'eau de
mer et d'eau estuarienne ; des eaux relativement froides (15°C) et d'une
salinité élevée (en moyenne 35g/L de sels pour l'eau de
mer). Dans l'alimentation humaine, les bactéries sont également
mises à rudes épreuves : stockage prolongé à
4°C, aliments salés ou fumés, agents conservateurs ou encore
pasteurisation sont autant de traitements qui peuvent éviter la
prolifération bactérienne mais aussi induire la présence
de formes VNC.
1.2.3 Induction expérimentale de l'état
viable non cultivable.
De nombreuses études sont menées sur les formes
bactériennes VNC. Pour les besoins de ces études il est
nécessaire de pouvoir induire artificiellement le passage des
bactéries à l'état VNC.
La plupart des études sont réalisées sur
des formes induites par une carence nutritive. Pour cela, les bactéries
sont stockées dans des solutions isotoniques dépourvues de
nutriments ou dans de l'eau de mer artificielle. Ce traitement peut être
accompagné d'une incubation à basse température
(Whitesides M.D., Oliver J.D., 1996 [43])
Dans tous les cas, la viabilité des cellules contenues
dans les échantillons bactériens doit être
vérifiée. Par exemple par une double coloration CTC/DAPI,
méthode qui sera explicitée au paragraphe 2.1.1. La «
non-cultivabilité » des formes viables doit également
être vérifiée par mise en culture sur milieu nutritif. Les
milieux suivants sont cités dans plusieurs articles et sont
fréquemment utilisés pour vérifier le caractère non
cultivable des cellules artificiellement induites à l'état VNC :
BHI (Brain Heart Infusion), TSA (Tryptone Soy Agar) ou HIA (Heart Infusion
Agar).
1.3 Présence de bactéries VNC dans les
denrées alimentaires, impact et enjeux.
De nombreuses espèces bactériennes, et notamment
celles pathogènes pour l'Homme, sont décrites
comme pouvant se
trouver dans un état non cultivable dans l'environnement mais aussi dans
les
denrées alimentaires. Des germes tels que Salmonella
enterica, Vibrio cholerae, Escherichia coli

O157 :H7 entéro-hémorragique, Campylobacter
jejuni, Vibrio vulnificus, Shigella dysenteriae,
Enterococcus faecalis, Listeria monocytogenes et d'autres,
tous pathogènes pour l'Homme, pourraient se trouver dans nos
denrées alimentaires à l'état VNC. Ce constat
soulève un problème de santé publique. Les formes VNC dans
l'alimentation humaine seraient par définition non détectables
par les méthodes conventionnelles de recherche de germes
pathogènes, ces méthodes se basant principalement sur
l'utilisation de milieux de culture.
La présence potentielle de ces germes dans
l'alimentation amène la question de leur
pathogénécité, de nombreux articles traitent de l'effet
pathogène des bactéries VNC.
Par exemple Oliver et al. ont montrés que l'injection
chez la souris de Vibrio vulnificus à l'état non
cultivable conduisait à une infection puis à la mort des animaux
(Oliver et al., 1995 [31]). Dans d'autres études la
pathogénécité et le retour à l'état
cultivable de formes VNC sont démontrés : l'inoculation chez le
lapin de Vibrio cholerae engendre une pathologie (Colwell R.R. et al.,
1985 [8]), l'injection chez des patients volontaires humains a
démontré la capacité de Vibrio cholerae à
revenir à l'état cultivable et à se multiplier dans
l'intestin de l'hôte humain (Colwell R.R. et al., 1996 [9]).
Escherichia coli O157 :H7
entéro-hémorragique conserve également sa
pathogénécité à l'état VNC, nous avons vu au
paragraphe 1.1.2 qu'une bactérie VNC conserve un métabolisme
actif, dans le cas de E. coli O157 :H7 la toxine
sécrétée par la bactérie à l'état
cultivable l'est toujours à l'état non cultivable (Liu Y. et al.,
2008 [21]).
Tous ces constats montrent l'intérêt de la mise
au point de méthodes de recherche et de détection des germes VNC
dans l'alimentation, l'eau et l'environnement.
1.4 Les bactéries viables non cultivables dans
l'environnement.
Selon Staley et al. plus de 99% des espèces
présentent dans l'environnement seraient dans un état VNC (Staley
J.T. et al., 1985 [37]). Certaines études ont été
menées sur différentes matrices environnementales telles que les
boues de station d'épuration (Garrec N. et al., 2005 [13]) ou sur des
sols (terre brune) (Turpin P.E. et al., 1993 [41]). Selon les auteurs, la
complexité de ces matrices rend les études fastidieuses et les
résultats discutables. Une matrice plus fréquemment
utilisée pour les études de bactéries VNC est l'eau de mer
ou estuarienne car plus facile à traiter. Les données sur les
bactéries VNC dans l'environnement sont à relativiser. En effet
certaines études montrent que la persistance de formes VNC dans
plusieurs matrices environnementales naturellement contaminées par une
flore viable et cultivable n'est pas possible (Bogosian G. et al., 1996 [4] -
Marscher et al. 2000 [23]). Cette forme de survie bactérienne serait
très limitée dans le

temps face à une flore compétitive.
L'hypothèse émise est que l'état VNC est effectivement un
état de secours en cas de stress important. Cet état permet la
survie des bactéries touchées par ce stress si toute la flore
bactérienne environnante est elle aussi amoindrie. Dans le cas ou des
germes stressés se trouvent à l'état VNC en
compétition face à une flore abondante non stressée, leurs
chances de survie s'en trouve très réduites.*
Un cas particulier de VNC dans l'environnement est cependant
intéressant à évoquer, celui des légionelles. Ce
pathogène de l'Homme pose un problème de santé publique en
cas de présence dans les tours
aéro-réfrigérées, dans les systèmes de
climatisation ou dans les thermes. Les traitements utilisés pour
détruire ces germes in situ (chloration, traitement thermique)
peuvent induire l'apparition de formes VNC de Legionella. Ces germes
ont entre autre la capacité à retrouver leur état
cultivable en présence de protozoaires, comme Tetrahymena
pyriformis très commun dans l'eau douce, dont elles sont les
parasites (Alleron L., Thèse 2008 [1]). Il est a noté qu'une
épidémie de légionellose en 1987 (101 personnes
infectées dont 28 décédées) est à l'origine
de la découverte des formes VNC de Legionella pneumophila dans
des échantillons de l'hôpital de Stafford (U.K.). Le risque
sanitaire dû à la présence de forme VNC est donc bien
réel et peut avoir de graves conséquences.
2. ANALYSES ET METHODES DE RECHERCHE DES BACTERIES NON
CULTIVABLE.
2.1 Analyse par fluorimétrie.
Plusieurs méthodes de recherche et de numération
des bactéries viables sont basées sur la fluorimétrie.
Cette technique nécessite l'utilisation de système de microscopie
à épifluorescence (figure 2). Le principe de cette microscopie
consiste à exciter un fluorochrome à une longueur d'onde
donnée afin de pouvoir en observer le signal émis. Le traitement
de l'image reçue peut être réalisé à l'aide
d'un système informatique relié à une caméra
CCD.


Figure 2 : schéma d'un microscope à
épifluorescence, système microscopie à
épifluorescence ZEISS (Source :
http://www.clermont.inra.fr/plateau_technique_microscopie/equipements_principaux/microscopie_a_epifluorescence)
2.1.1 Double coloration CTC / DAPI
La double coloration CTC-DAPI permet de dénombrer et de
différencier les cellules mortes des cellules vivantes. Le CTC est un
sel de tétrazolium qui, une fois réduit en sel de formazan
insoluble, émet de la fluorescence rouge (après excitation
à 450nm, émission de fluorescence rouge à 630nm). Le CTC
est le colorant permettant de dénombrer les cellules viables, la
réduction du CTC par les cellules est le signe que la respiration
cellulaire à lieu, cela signifie que le métabolisme est actif.
(Garrec N. et al., 2005 [13] - Joux F. et al., 1997 [15])
La coloration au DAPI permet de dénombrer la
totalité des cellules, ce fluorophore se lie spécifiquement
à l'ADN et émet une fluorescence bleue avec un maximum
d'émission à 456nm (excitation à 372nm, lumière
violette). Les colorations peuvent être réalisées
simultanément (figure 3), ou séparément sur deux
échantillons.

Figure 3 : Coloration : A) DAPI - B) CTC observé en
microscopie à fluorescence (Source :
http://www.biochemj.org/bj/380/0859/bj3800859f05.htm?resolution=HIGH)

L'acridine orange est aussi fréquemment utilisée
pour le dénombrement de la flore totale. Ce fluorochrome est un agent
intercalant de l'ADN qui émet une fluorescence verte (maximum
d'émission à 525nm).
2.1.2 LIVE/DEAD® BacLightTM
Il existe plusieurs versions de la méthode
LIVE/DEAD® BacLightTM développée par
Molecular Probes. Ce paragraphe décrit les versions principales
utilisables pour l'étude des cellules viables Procaryotes et
microorganismes unicellulaires Eucaryotes.
La version LIVE/DEAD® BacLightTM
Bacterial viability kit est utilisable pour l'analyse des bactéries,
levures, mycoplasmes et protozoaires. Le principe de ce kit est basé sur
une double coloration par l'intermédiaire de deux florophores : le
SYTO9® et le Propidium Iodide (PI). Le SYTO9®
est un fluorophore qui, après excitation à 470nm, émet une
fluorescence de couleur verte (540nm). Ce marqueur possède la
capacité de diffuser dans les cellules, intègres ou non, et
d'émettre de la fluorescence une fois lié à l'ADN. Le
SYTO9® permet donc de marquer la totalité les cellules
d'un échantillon. Le Propidium Iodide est un agent intercalant de l'ADN,
une fois lié à ce dernier le PI émet une fluorescence
rouge (635nm) après excitation à 470nm. Ce fluorophore ne peut
pénétrer dans les cellules que si les membranes sont
altérées, seules les cellules mortes fluorescent en rouge (figure
4).

Figure 4 : coloration LIVE/DEAD BacLight Bacterial viability
kit SYTO9/ Propidium iodide (source : brochure
Invitrogen). En vert les
cellules viables, en rouge les autres cellules.

Deux autres kit Baclight sont disponibles : le
RedoxSensorTM Green vitality kit et le RedoxSensorTM CTC
vitality kit.
Dans le RedoxSensorTM Green vitality kit. La
différenciation entre cellules mortes et viables se fait grâce
à deux fluorochromes : le PI et le RedoxSensorTM Green. Ce
dernier est un indicateur de respiration cellulaire, à l'état
réduit il émet un signal fluorescent vert. Les cellules viables
sont marquées en vert et les autres cellules sont marquées en
rouge par le PI.
Le kit RedoxSensorTM CTC vitality kit reprend la
méthode de la double coloration CTC/DAPI vu dans le paragraphe
précédent. Dans ce kit le DAPI peut être remplacé
par le SYTO®24 dont le principe est similaire.
Molecular Probes a donc développé une série
de kits permettant de différencier et de dénombrer les cellules
viables et mortes.
Une étude comparative a été
réalisée sur la flore totale d'eau potable entre le kit
LIVE/DEAD® BacLightTM et colorations au CTC et
à l'acridine orange (Boulos L. et al., 1999 [5]). Il ressort de cette
étude que le système BacLightTM permet d'obtenir des
résultats équivalent à une coloration au CTC sur une
population de cellules non stressées. Les auteurs décrivent
également que le nombre de cellules viables détectées par
le système BacLightTM est supérieur à celui
dénombré en coloration CTC et par dénombrement sur milieux
de culture dans le cas de cellules stressées.
2.1.3 Cytométrie en flux
La cytométrie en flux (CMF) est une technologie
largement utilisée en biologie notamment pour ses performances d'analyse
mais aussi parce qu'elle permet un tri physique des populations
étudiées ainsi qu'un dénombrement des cellules viables. La
CMF permet de passer au crible les cellules une par une dans un flux, la
rapidité d'analyse peut aller jusqu'à plusieurs milliers de
cellules par seconde voir plusieurs dizaines de milliers.
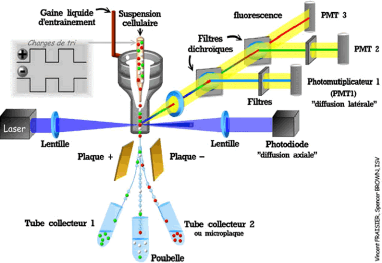

Figure 5 : représentation schématique d'un
cytomètre de flux (source INRP :
http://www.ifr87.cnrs-
gif.fr/pbc/equipement/cytometre.html)
L'analyse par CMF passe par une préparation des
échantillons : la détection des caractères
étudiés nécessite une coloration fluorescente. Les
cellules marquées sont convoyées dans une buse de très
faible diamètre et sont soumises à un rayonnement LASER pour
provoquer l'excitation du fluorophore. La fluorescence émise par le
fluorochrome, provoquée par le passage du rayon laser dans la
gouttelette, est mesurée par un ou plusieurs photomultiplicateurs ou une
photodiodes. Les variations des signaux permettent de sélectionner
différentes populations de l'échantillon et de les séparer
à l'aide d'un champ électrique (Figure 5).
Plusieurs fluorophores permettent de mesurer la
viabilité cellulaire et notamment la Rhodamine 123 (Rh-123)
(Lopez-Amoros R. et al. 1997 [22]). Ce fluorophore se lie aux membranes
plasmiques ; c'est un marqueur cationique révélant la
présence de potentiel membranaire. Plus l'activité
énergétique des cellules est élevée plus la
différence de potentiel au niveau de la membrane seront
élevés et plus les cellules accumuleront la Rh-123 (Kaprelyants
A.S. et Kell D.B., 1991 [17]). La fluorescéine diacétate est
également utilisée comme marqueur de cellule viable. La
fluorescéine diacétate permet de détecter une
activité métabolique dans les cellules, il s'agit d'un ester qui
une fois hydrolysé par une estérase bactérienne
libère un composé fluorogène (Diaper J.P. et al., 1994
[12]). Le défaut de ces colorations est que toutes les souches
bactériennes ne présentent pas la même sensibilité
à ces différents colorants. La même étude montre que
le

marquage par le colorant ChemChrome B balayerai un plus large
nombre d'espèces bactériennes qu'elles soient à GRAM
positif ou négative alors que le FDA serait plus approprié pour
colorer les bactéries à GRAM positif (Diaper J.P. et al., 1994
[12]).
D'autres fluorophores vus dans les précédents
paragraphes peuvent aussi être utilisés, le CTC, le DAPI, le
propidium iodide, le SYTO9 et d'autres (Morin N., 2008 [25]).
L'intérêt d'utiliser la cytométrie en flux est d'augmenter
la sensibilité et la rapidité de dénombrement par rapport
à l'étude microscopique. De plus, le nombre de cellules
étudiées par CMF peut être plus important qu'en microscopie
ce qui permet un traitement statistique plus fiable.
2.2 Direct Viable Count (DVC)
La méthode Direct Viable Count (DVC) a
été décrite par l'équipe de Kogure K. et al. en
1979 (Kogure K. et al, 1979 [19]). Cette méthode consiste à
incuber les cellules d'un échantillon à étudier,
éventuellement après purification ou extraction de la matrice
d'origine, dans un milieu contenant de l'extrait de levures et un inhibiteur de
synthèse d'ADN. L'antibiotique utilisé est l'acide nalidixique,
il s'agit d'un bactériostatique de la famille des quinolones, il inhibe
l'action de la girase empêchant par ce biais la synthèse d'ADN.
Les bactéries viables et sensibles à l'acide nalidixique, ne
pouvant plus se diviser, vont utiliser l'extrait de levures présent dans
le milieu comme substrat et avoir une forme allongée. Ce
caractère morphologique permet la différenciation et la
numération des germes viables.
Le problème est la sensibilité de la
méthode, faussée par les souches naturellement résistantes
à cet antibiotique. C'est pourquoi de nombreuses équipes ont
travaillées sur la méthode DVC en remplaçant l'acide
nalidixique par des cocktails d'antibiotiques. Dans leur article, «
Ecological Implications of an Improved Direct Viable Count Method for Aquatic
Bacteria » paru en 1997, Fabien Joux et Philippe LeBaron de l'observatoire
océanologique de Banyuls sur mer, montrent l'intérêt de
l'utilisation d'un cocktail d'antibiotiques dans l'application de la
méthode Direct Viable Count sur des échantillons marins (Joux F.,
LeBaron P., 1997, [15]). Dans un premier temps ils comparent la
sensibilité de 100 souches bactériennes isolées de
différents environnements marins côtiers à quatre
inhibiteurs de synthèse d'ADN (ciprofloxacine, acide nalidixique, acide
piromidique, acide pipemidique), et d'un inhibiteur de division cellulaire
(cephalexine).
Le tableau 2 nous indique que seulement 36% des souches
testées sont sensibles à l'acide
nalidixique. Ces
résultats montrent donc que l'action de l'acide nalidixique seul est
insuffisante

pour bloquer la croissance de toutes les bactéries d'un
échantillon marin. Ceci implique un biais important dans les
résultats d'une analyse par la méthode DVC.
Tableau 2 : Sensibilité de 100 souches isolées
d'échantillons d'eau de mer (sur deux sites
Méditerranéens) à différents antibiotiques. (Joux
F., LeBaron P., 1997, [15])
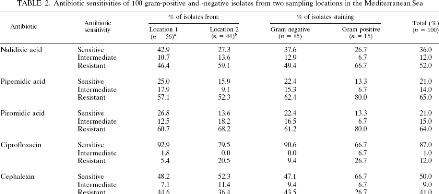

Les auteurs ont alors testé le cocktail d'antibiotiques
suivant : acide nalidixique (20ug/mL), acide piromidique (20ug/mL), acide
pipemidique (10ug/mL), ciprofloxacine (0,5ug/mL) et cephalexine (10ug/mL).
La figure 6 présente l'évolution de la
population bactérienne dans un échantillon d'eau de mer
supplémentée avec 50mg/L d'extrait de levures, couplé dans
un cas avec l'acide nalidixique et dans l'autre avec le cocktails
d'antibiotiques. Les résultats montrent l'efficacité du cocktail
d'antibiotiques à inhiber la flore des échantillons.


Figure 6 : Réponse d'un échantillon naturel d'eau
de mer à l'ajout d'extrait de levures (50mg/L) et
d'antibiotiques.
Barre noire : nombre de bactéries totales sans
antibiotique ; barre blanche : nombre de bactéries totales avec
acide
nalidixique, barre grise : nombre bactéries totales avec le
cocktail antibiotique. Les échantillons présentant
des
croissance sont annotés par des astérisques. (Joux F.,
LeBaron P., 1997 [15])
La combinaison de plusieurs antibiotiques permet d'inhiber la
division et donc la prolifération des bactéries pendant 18h
d'incubation (statique et à 20°C dans l'obscurité). Ceci
permet de prolonger le temps d'incubation et donc le temps d'élongation
des bactéries lors du test DVC. La figure 7 illustre ces
résultats.

Figure 7 : Observation en microscopie à fluorescence,
coloration au DAPI. (A) aspect des bactéries avant incubation,
(B)
aspect après 6h d'incubation avec acide nalidixique, (C) aspect
après 18h d'incubation avec cocktail
d'antibiotiques. Les
flèches indiquent les cellules viables ayant métabolisées
l'extrait de levure (Joux F., LeBaron P.,
1997 [15]).
La méthode DVC permet de dénombrer les cellules
viables par microscopie. Cependant elle est
limitée par la
sensibilité des bactéries aux antibiotiques, certaines
résistantes, d'autres trop
sensibles. De plus, certaines
espèces bactériennes peuvent présenter naturellement un

polymorphisme visible au microscope, par exemple un bacille
à GRAM négatif peut se trouver dans la même culture en
forme de coccobacille ou en forme de très long bacille.
La méthode DVC, optimisée par l'utilisation de
cocktails d'antibiotiques, permet d'étudier la viabilité des
cellules de certains échantillons. La limite de cette méthode est
la différence de sensibilité des bactéries aux
antibiotiques, son utilisation doit être précédée
d'études préliminaires sur la sensibilité aux
antibiotiques des souches étudiées.
2.3 Analyse en Biologie Moléculaire par
RT-PCR
L'utilisation des outils de la Biologie Moléculaire a
permis l'étude des bactéries à l'état viable non
cultivable. Ce paragraphe décrit comment ces outils peuvent permettre la
détection de bactéries VNC.
La Reverse Transcriptase Polymerase Chain Reaction (RT-PCR)
est une technique utilisée pour la recherche de VNC. Les cibles de cette
réaction sont les mRNA transcrits à partir des gènes
potentiellement indicateurs d'une viabilité cellulaire. Une étude
de S. Yaron et K.R. Matthews compare l'efficacité de la RT-PCR sur des
mRNA de différents gènes cibles (Yaron M., Matthews K.R., 2002
[45]). Dans cette étude, la transcription des gènes
rfbE, fliC, stx1, stx2, mobA,
eaeA, hly et le gène codant pour les ARN 16S est
recherchée par une RT-PCR sur des cultures de E. coli O157 :H7
à différents stade de la croissance (figure 8).
Cette expérience permet de montrer que les gènes
rfbE, stx1 et le gène codant pour les ARN 16S sont
transcrits tout au long de la croissance.
Une seconde expérience est réalisée sur
des cellules viables non cultivables ; l'amplification de tous les gènes
par PCR, ainsi que l'amplification des mRNA par RT-PCR sont
réalisées. Tous les gènes sont amplifiés par PCR
alors que la RT-PCR ne permet d'amplifier que les gènes 16S RNA,
stx1, rfbE et mobA. Cela signifie que malgré
la présence de tous les gènes dans les cellules viables non
cultivables seuls les gènes 16S RNA, stx1, rfbE et
mobA sont transcrits. Cette expérience fait de ces gènes
des cibles préférentielles pour la recherche des E. coli
0157 :H7 par RT-PCR. Les auteurs soulèvent cependant un problème
de sensibilité de la méthode en précisant que la
présence de 5.105 à 107 UFC sont requis
selon le gène ciblé pour obtenir une amplification des transcrits
par RT-PCR ; là ou 104 UFC sont nécessaire pour
amplifier les gènes par une PCR classique.


Figure 8 : Amplification par RT-PCR : prélèvement
d'échantillons à différents temps de la culture (a),
résultat des
amplifications (b) : -, pas d'amplification ; +,
amplification positive. nt : non traité. (Yaron M., Matthews K.R.,
2002
[45])
Une équipe de chercheurs a récemment repris les
travaux commencés par Yaron et Matthews et ont réussi diminuer le
seuil de détection de la méthode en obtenant une amplification
positive à partir de 50 UFC pour un litre d'échantillon (Liu Y.
et al. 2008 [21]). Ces résultats ont été possibles
grâce à l'utilisation d'une station électronique
intégrant la technologie des puces à ADN.
L'inconvénient des méthodes RT-PCR est la
spécificité. En effet, lors d'une PCR les cibles sont
spécifiques, les gènes exploités dans l'exemple
cité ci-dessus ne peuvent être utilisé que dans le cas
d'une recherche de E. coli O157 :H7. La méthode restreint
l'utilisateur à une seule cible, d'autres auteurs ont cependant
déjà développé des méthodes de
détection des cellules viables et VNC par RT-PCR pour d'autres
espèces, par exemple : Listeria monocytogenes (Klein et Jejuna,
1997 [18]) ou Staphylococcus aureus (McKillip et al., 1998 [24]).

3. ETUDES SUR LA VIABILITE, L'ETAT VIABLE NON
CULTIVABLE ET LA RESSUSCITATION
L'état VNC est une stratégie mise en place par
les cellules pour survivre en condition de stress extérieur. Cette
hypothèse implique que cet état soit transitoire et
réversible. De nombreuses études sont menées sur le
phénomène de ressuscitation..
3.1 La ressuscitation
La forme la plus simple de retour à l'état
cultivable se produit lorsque les conditions sont favorables à la
croissance. Une exposition à une température favorable peut
suffire à lever l'état VNC (Whitesides M.D., Oliver J.D., 1996
[43]). Cependant ce cas n'est pas généralisé, de nombreux
germes nécessitent des conditions particulières pour la
levée de l'état VNC. Ces conditions dépendent des germes
étudiés, il est donc nécessaire de traiter des exemples
d'études sur des germes particuliers.
Certaines études montrent l'effet d'agents antioxydants
ou anti-ROS (Réactive Oxygen Species). Les cellules à
l'état non cultivable ont un métabolisme réduit, certains
gènes ne sont pas exprimés. Dans l'étude menée par
Kong et al., les auteurs émettent l'hypothèse que Vibrio
vulnificus perd sa capacité à réduire l'H2O2 en
raison de l'absence de synthèse de l'enzyme catalase. Les ROS,
n'étant plus dégradés, deviennent toxiques et
létaux pour les cellules cultivées sur milieux riches. Ce
phénomène est d'autant plus vrai sur milieu gélosé
où ces agents toxiques ne peuvent diffusés comme dans le cas
d'une culture en milieu liquide. Cette hypothèse est
vérifiée par l'intermédiaire d'un mutant dépourvu
d'activité catalase (oxyR-). Ce dernier est incapable de former
des colonies sur milieu HIA, il retrouve cette capacité lorsque le
milieu est supplémenté avec une catalase ou du pyruvate de sodium
(antioxydant) (Kong I.-S. et al., [20]).
Une autre étude a été menée dans
ce sens, montrant l'effet de la ferrioxamine E, molécule
sidérophore permettant l'importation de fer dans la cellule. Le fer
permet de réduire la production de ROS et donc de réduire les
dommages causés aux cellules par ces molécules. En utilisant la
ferrioxamine E les auteurs ont réussi à obtenir un taux de
cellules ressuscitées élevé en culture liquide (Reissbrodt
R. et al. 2002 [35]).

Outres ces effet de l'oxydation sur les cellules d'autres
facteurs entre en jeu pour le retour à un état cultivable :
Le cas de Legionella pneumophila a été
étudié par Michael Steinert et al., ce germe pathogène
pour l'homme est aussi parasite de certains protozoaires. Dans leur
étude, l'équipe décrit un retour à l'état
cultivable de Legionella pneumophila après avoir
été en contact avec Acanthamoeba castellanii, un
protozoaire hôte de Legionella (Steinert M. et al., 1997 [39]).
L'hôte permet aux germes de se multiplier mais aussi d'être
transportés vers un environnement où les conditions sont plus
favorables.
Le retour à un état cultivable de Legionella
pneumophila est également possible après incubation dans des
jaunes d'oeuf fécondés (Hussong D. et al., 1987 [14]). Ce
résultat a été reproduit chez d'autres espèces :
sur Campylobacter jejuni (Cappelier J.M. et al., 1999 [7]),
Listeria monocytogenes (Cappelier J.M. et al., 2007 [6]) et sur
Salmonella enterica (Dhiaf A., A. Bakhrouf., 2004, [11]).
Les études citées ci-dessus soulignent l'importance
de l'environnement sur le caractère cultivable des bactéries.
D'autres études présentent des résultats allant en ce sens
:
Reissbrodt et al. ont montré l'effet de
molécules baptisées « heat-stable autoinducer ». Ces
molécules sont sécrétées par les
entérobactéries en présence de norepinephrine. Cette
hormone stimule la croissance en simulant l'environnement des
entérobactéries hôtes des intestins des mammifères
(Reissbrodt R. et al. 2002 [35]).
Dans cette approche de l'importance de l'environnement de la
bactérie, une étude a été réalisée
sur l'importance de la flore environnante. Le principe de l'étude est de
recréer artificiellement l'environnement naturel des germes non
cultivable y compris la flore bactérienne. Ainsi les auteurs montrent
l'interdépendance de deux types de germes, l'un ne pouvant se
développer qu'en présence de l'autre (Kaeberlein T. et al., 2002
[16]).
Ces résultats de co-cultures ont été
repris par une autre équipe et ont mené à la
découverte de petits peptides agissant comme des facteurs de croissance
en induisant la division des germes voisins. Cette étude a
été réalisées à l'aide de boite de
pétri compartimentées et pouvant laisser diffuser les
molécules. (figure 9). (Nichols D. et al., 2008 [28])


Figure 9 : (A) boite de pétri compartimentée,
(B-C) co-culture avec croissance des germes induit aux contours
du
compartiment central contenant une bactérie
sécrétant un signal de croissance , (D) Le compartiment central
est vide
(témoin négatif), aucune culture dans le compartiment
des bactéries à induire, (E) cellule seule, aucune
croissance
n'est observée. (Nichols D. et al., 2008 [28])
Cette étude révèle donc l'existence de
facteurs, de signaux peptidiques utilisés par les bactéries pour
communiquer. Extraites de leur contexte naturel et en l'absence de signaux
extérieurs certaines bactéries de l'environnement ne sont pas
capable de se développer en milieu artificiel.
La complexité des facteurs de croissance bactériens
explique en partie pourquoi tant de bactéries présentent dans
l'environnement ne peuvent être isolées sur milieux de culture.
3.2 Les facteurs de ressuscitation : les
protéines Rpf et Sps
Une étude menée sur Micrococcus luteus
a permis de démontrer l'influence de la présence de formes
viables et cultivables sur les cellules non cultivables dans un même
milieu. En présence de cellules cultivables de Micrococcus
luteus, les formes VNC de cette bactérie retrouvent leur
capacité à se diviser (Votyakova T.V. et al., 1994 [42]). Cette
« transmission » du caractère cultivable est induite par la
présence de protéines baptisées Resuscitation Promoting
Factor (Rpf). Il s'agit d'une peptidoglycane-hydrolase
sécrétée par Micrococcus luteus à
l'état cultivable. Cette protéine possède une
activité lytique sur les composants de la paroi bactérienne et
entre autre sur les muropeptides (Telkov M.V. et al., 2005 [39]- Mukamolova
G.V. et al., 2006 [26]).
De telles protéines ont également
été découvertes chez d'autres espèces, la plupart
ont en commun un domaine (« Rpf domain ») et une activité
similaire. Les études menées sur chacune des

protéines sécrétées par
différentes espèces bactériennes ont permis de les
classées en différents groupes. La famille des protéines
Rpf comprends plusieurs sous-familles : RpfA, RpfB, RpfC, RpfD, RpfE, les
Shorts Rpfs, les protéines LysM ainsi que le groupe des protéines
SceA et SceD retrouvées chez Staphyloccocus, ce dernier
étant le plus éloigné des autres groupes de
protéines Rpf (Ravagnani A. et al., 2005 [34]). Une étude chez
Salmonella typhimurium a également montré l'existence
d'une protéine de type Rpf permettant un retour à la
l'état cultivable (Panutdaporn N. et al., 2005 [32]).
Les protéines Rpf ne sont cependant pas les seules
à avoir un effet sur la capacité qu'ont les bactéries
à se diviser. La famille des protéines Sps (Stationary phase
survival) a été découverte chez les Firmicutes. Ces
protéines possèdent une activité lytique sur le
peptidoglycane des parois bactériennes, activité similaire aux
protéines Rpf. La famille des protéines Sps est également
subdivisée en groupes A, B, C D et E ; chacun de ces groupes comprend
des protéines possédant un domaine Sps. Les protéines MltA
(Membrane-bound lytic transglycosylase A) présentent chez
Clostridium ainsi qu'une protéine provenant d'un prophage de
Bacillus subtilis, possèdent également un domaine Sps
(Ravagnani A. et al., 2005 [34]).
Ces deux familles de protéines ne se retrouvent pas
chez les mêmes espèces bactériennes, les protéines
Rpf sont retrouvées chez les Actinobactéries alors que les Sps
sont retrouvées chez les Firmicutes.
De tels facteurs pourraient avoir un impact sur la
microbiologie conventionnelle et les milieux de culture. La mise au point de
milieux de culture contenant des facteurs de croissances tels que les
protéines Rpf, Sps ou encore des peptides « signal » vu au
paragraphe précédent pourrais permettre d'élargir notre
connaissance des germes existants dans l'environnement et de découvrir
des espèces jusqu'alors non isolées.


CONCLUSIONS
Les formes non viables des bactéries font l'objet de
nombreuses études. Les récentes publications montrent que les
difficultés rencontrées à cultiver les microorganismes
stressés sont dues à une méconnaissance de l'état
VNC. La physiologie des cellules non cultivables est mal connue. Certaines
études proposent des solutions, par l'intermédiaire de facteurs
de croissance ou d'antioxydants. Ce qui amène à reconnaître
le fait que si microorganismes non cultivables il y a, c'est que nous ne
connaissons pas les solutions permettant de les rendre cultivables.
Les difficultés rencontrées pour cultiver toutes
les bactéries présentes dans notre environnement et dans nos
aliments rendent l'analyse de ces germes plus complexe. C'est pourquoi
différentes méthodes ont été
développées afin de pouvoir détecter et dénombrer
toutes les bactéries viables. Ces méthodes se basent sur la mise
en évidence de caractéristiques de l'état viable :
· Activité enzymatique ou métabolique et
respiration cellulaire.
· Etat des membranes.
· Production d'acides nucléiques (RNA).
La plupart de ces méthodes permettent de détecter
les cellules viables, mais pas de les identifier ni de les isoler. A
l'exception de la RT-PCR qui permet une recherche par espèce.
La RT-PCR permet effectivement de savoir quels types de germes
se trouvent dans la matrice étudiée grâce à des
amorces spécifiques, mais ne permet pas de les isoler. De plus, le
coût d'une analyse en PCR est trop élevé et ne pourrait
actuellement pas servir de méthode normalisée de recherche de
germes pathogènes dans des matrices alimentaires ou
environnementales.
Une des techniques les plus intéressantes et
déjà commercialisée (BactiFlow®,
AES-Chemunex) est la cytométrie en flux. La CMF permet le
dénombrement des cellules viables, la séparation physique entre
les cellules viables et les cellules mortes. Un des atouts majeur de la CMF est
la rapidité dans le traitement des matrices à analyser.
Malgré tout, les méthodes culturales sont
aujourd'hui encore privilégiées dans les normes de recherche des
germes pathogènes. C'est pourquoi les recherches sont encore
tournées vers la microbiologie Pasteurienne, essayant de définir
les molécules nécessaires à la croissance des germes
VNC.
REFERENCES BIBLIOGRAPHIQUES
1- Alleron L. 2008. Etude de l'état
viable non cultivable (VBNC) chez Legionella pneumophila Lens
après traitements monochloramine. Thèse Université de
Poitiers
2- Besnard V., M. Federighi, E. Declercq, F. Jugiau,
J.M. Cappelier. 2002. Environmental and physico-chemical factors
induce VBNC state in Listeria monocytogenes. Sciences. 33
: 359- 370
3- Beumer R.R., J. de Vries, F.M. Rombouts.
1992. Campylobacter jejuni non-culturable coccoid cells. Int. J. Food
Microbiol. 15 :153-163
4- Bogosian G., L.E. Sammons, P.J.L. Morris, J.P.
O'Neil, M.A. Heitkamp, D.B. Weber. 1996. Death of the Escherichia coli
K12 strain W3110 in soil and water. Appl. Environ. Microbiol. 62
: 4114-4120
5- Boulos L., M. Prévost, B. Barbeau, J.
Coallier, R. Desjardins. 1999. LIVE/DEAD®
BacLightTM: application of a new rapid staining method for direct
enumeration of viable and total bacteria in drinking water. J. Microbol.
Methods. 37 : 77-86
6- Cappelier J.M., V. Besnard, S.M. Roche, P. Velge,
M. Federighi. 2007. Avirulent viable but non culturable cells of
Listeria monocytogenes need the presence of an embryo to be recovered
in egg yolk and regain virulence after recovery. Sciences. 38
:573-583
7- Cappelier J.M., J. Minet, C. Magras, R.R. Colwell,
M. Federighi. 1999. Recovery in embryonated eggs of viable but
nonculturable Campylobacter jejuni cells and maintenance of ability to
adhere to HeLa cells after resuscitation. Appl. Environ. Microbiol. 65:
5154-5157
8- Colwell R.R., P.R. Brayton, D.J. Grimes, D.B.
Roszak, S.A. Huq, L.M. Palmer. 1985. Viable but non-culturable
Vibrio cholerae and related pathogens in the environment: implications
for release of genetically engineered microorganisms. Biotechnology. 3
:847-820
9- Colwell R.R., P.R. Brayton, D. Herrington, B.
Tall, A. Huq, M.M. Levine. 1996. Viable but non-culturable Vibrio
cholerae O1 revert to a cultivable state in the Human intestine. World J.
Microbiol. Biotech. 12 :28-31
10- Day A.P., J.D. Oliver. 2004. Changes in
membrane fatty acid composition during entry Vibrio vulnificus into
the viable but nonculturable state. J. Microbiol. 42 :69-73
11- Dhiaf A., A. Bakhrouf. 2004. Recovery in
embryonated chicken eggs of viable but nonculturable Salmonella. Food,
Agriculture & Environ. 2(2) :104-107
12- Diaper J.P., C. Edwards. 1994. The use of
fluorogenic esters to detect viable bacteria by flow cytometry. J. Appl.
Microbiol. 77 : 221-228
13-

Garrec N., V. Besnard, C. Magras, A.M. Pourcher, M.
Federighi. 2005. Behaviour of Listeria monocytogenes Scott A
and a wild strain in different sewage sludge matrices : evaluation of
culturability and viability and determination of potential virulence in a mice
bioassay. Revue Med. Vet. 156,3 :148-154
14- Hussong D., R.R. Colwell, M. O'Brien, E. Weiss,
A.D. Pearson, R.M. Weimer, W.D. Burge. 1987. Viable Legionella
pneumophila not detectable by culture agar media. Bio/technology.
5 : 947-950
15- Joux F. P. Lebaron. 1997. Ecological
implications of an improved Direct Viable Count method for aquatic bacteria.
Appl. Environ. Microbiol. 63 :3643-3647
16- Kaeberlein T., K. Lewis, S.S. Epstein.
2002. Isolating « uncultivable » microorganisms in pure culture in a
simulated natural environment. Science. 296 : 1127-1129
17- Kaprelyants A.S., D.B. Kell. 1991. Rapid
assessment of bacterial viability and vitality by rhodamine 123 an d flow
cytometrie. J. Appl. Microbiol. 72 : 410-422
18- Klein P.G., V.K. Jejuna. 1997. Sensitive
detection of viable Listeria monocytogenes by reverse transcription-PCR. Appl.
Environ. Microbiol. 63 :4441-4448
19- Kogure K, Simidu U, Taga N. 1979. A
tentative direct microscopic method for counting living marine bacteria. Can J
Microbiol. 25(3):415-420
20- Kong I., T.C. Bates, A. Hülsmann, H. Hassan,
B.E. Smith, J.D. Oliver. 2004. Role of catalase and oxyR in
the viable but nonculturable state of Vibrio vulnificus. FEMS
Microbiol. Ecol. 50 : 133-142
21- Liu Y., A. Gilchrist, J. Zhang, X. Li.
2008. Detection of viable but nonculturable Escherichia coli O157 :H7
bacteria in drinking water and river water. Appl. Environ. Microbiol.
74 : 1502-1507
22- Lopez-Amoros R., S. Castel, J. Comas-Riu, J.
Vives-Rego. 1997. Assessment of E.coli and
Salmonella viability and starvation by confocal LASER Microscopy and
flow cytometrie using Rhodamine 123, DiBAC4(3), Propidium Iodide, and CTC.
Cytometry. 29 : 298-305
23- Marsher F., C. Hase, Y. Moënne-Loccoz, G.
Défago. 2000. The viable-but-nonculturable state induced by
abiotic stress in the biocontrol agent Pseudomonas fluorescens CHA0
does not promote strain persistence in soil. Appl. Environ. Microbiol.
66 :1662-1667
24- McKillip J.L., L.-A. Jaykus, M. Drake.
1998. rRNA stabilityin heat-killed and UV-irradiated enterotoxigenic
Staphylococcus aureus and Escherichia coli O157 :H7. Appl.
Environ. Microbiol. 64 : 4264-4268
25-

Morin N., S. Baatout. 2008. La Cytométrie
en Flux appliquée à la Microbiologie. Source internet :
http://homepage.mac.com/petermeeus/BVAC/MG2008/Microbiology_CMF_MGD_2008.pdf
26- Mukamolova G.V., A.G. Murzin, E.G. Salina, G.R.
Demina, D.B. Kell, A.S. Kaprelyants, M. Young. 2006. Muralytic
activity of Micrococcus luteus Rpf and its relationship to
physiological activity in promoting bacterial growth and resuscitation. Mol.
Microbiol. 59(1) :84- 98
27- Mukherjee R., N.H. Antia. 1985.
Intracellular multiplication of leprosy-derived Mycobacteria in
Schwann cells of dorsal root ganglion cultures. J. clinical Microbiol.
21 : 808-814
28- Nichols D., K. Lewis, J. Orjala, S. Mo, R.
Ortenberg, P. O'Connor, C. Zhao, P. Vouros, T. Kaeberlein, S.S.
Epstein. 2008. Short peptide induces an « uncultivable »
microorganism to growth in vitro. Appl. Environ. Microbiol. 74
: 4889-4897
29- Oliver J.D. 2005. Viable but
nonculturable bacteria in food environments. Foodborne pathogens : Microbiology
and molecular biology ISBN 190445500X, 9781904455004. Pages :99- 112
30- Oliver J.D. 2004. The viable but
nonculturable state in bacteria. J. Microbiol. 43 : 93-100
31- Oliver J.D., R. Bockian. 1995. In vivo
resuscitation, and virulence toward mice, of viable but nonculturable cells of
Vibrio vulnificus. Appl. Environ. Microbiol. 61 :
2620-2623
32- Panutdaporn N., K. Kawamoto, H. Asakura, S.-I.
Makino. 2006. Resuscitation of the viable but non-culturable state of
Salmonella enterica serovar Oranienburg by recombinant
resuscitation-promoting factor derived from Salmonella Typhimurium
strain LT2. Int. J. Food Microbiol. 106 :241-247
33- Prescott, M. Lansing . 2003.
Microbiologie. Ed. De Boeck. ISBN 2-8041-4256-6
34- Ravagnani A. C.L. Finan, M. Young. 2005.
A novel Firmicute protein family related to actinobacterial
resuscitation-promoting factors by non orthologous domain displacement. BMC
Genomics. 6 : 39
35- Reissbrodt R., H. Heier, H. Tschäpe, R.A.
Kingsley, P.H. Williams. 2000. Resuscitation by ferrioxamine E of
stressed Salmonella enterica serovar Typhimurium from soil and water
microcosm. Appl. Environ. Microbiol. 66 : 4128-4130
36- Signoretto C., M. Del Mar Lleo, M.C. Tafi, P.
Canepari. 2000. Cell wall chemical composition of Enterococcus
faecalis in the viable but nonculturable state. Appl. Environ. Microbiol.
66 : 1953-1959
37- Staley J.T., A. Konopka. 1985. Measurement
of in situ activities of nonphotosynthetic microorganisms in aquatic and
terrestrial habitats. Annu. Rve. Microbiol. 39 : 321-346
38-

Steinert M., L. Emödy, R. Amann, J.
Rghacker. 1997. Resuscitation of viable but nonculturable
Legionella pneumophila Philadelphia JR32 by Acanthamoeba
castellanii. Appl. Environ. Microbiol. 63 : 2047-2053
39- Telkov M.V., G.R. Demina1, S.A. Voloshin1, E.G.
Salina1, T.V. Dudik1, T.N. Stekhanova1, G.V. Mukamolova1, K.A. Kazaryan1, A.V.
Goncharenko1, M. Young, A.S. Kaprelyants. 2005. Protein of the Rpf
(resuscitation promoting factor) family are peptidoglycan hydrolases.
Biochemistry. 71 : 414-422
40- Tholozan J.L., J.M. Cappelier, J.P. Tissier, G.
Delattre, M. Federighi. 1999. Physiological characterization of
viable-but-nonculturable Campylobacter jejuni cells. Appl. Environ.
Microbiol. 65 : 1110-1116
41- Turpin P.E., K.A. Maycroft, C.L. Rowlands, E.M.H.
Wellington. 1993. Viable but nonculturable salmonellas in soil. J.
Appl. Microbiol. 74 : 421-427
42- Votyakova T.V., A.S. Kaprelyants, D.B.
Kell. 1994. Influence of viable cells on resuscitation of dormant
cells in Micrococcus luteus cultures held in an extended stationary phase : the
population effect. Appl. Environ. Microbiol. 60 : 3284-3291
43- Whitesides M.D., J.D. Oliver. 1996.
Resuscitation of Vibrio vulnificus from the viable but nonculturable
state. Appl. Environ. Microbiol. 63 : 1002-1005
44- Xu H.S., N. Roberts, F.L. Singleton, R.W.
Attwell, D.J. Grimes, R.R. Colwell. 1982. Survival and viability of
nonculturable Escherichia coli and Vibrio cholerae in the
estuarine and marine environment. Mirob. Eco. 8 : 313-323
45- Yaron S., K.R. Matthews. 2002. A reverse
transcriptase-polymerase chain reaction assay for detection of viable
Escherichia coli O157 :H7 : investigation of specific target genes. J.
Appl. Microbiol. 92 : 633-640

LISTE DES ABBREVIATIONS
Par ordre alphabétique :
· ADN (ou DNA) : Acide
DésoxyriboNucléique.
· AFNOR : Association Française de
NORmalisation.
· ARN (ou RNA) : Acide Ribonucléique.
· ATP : Adénosine TriPhosphate.
· BHI : Brain Heart Infusion, milieu de culture.
· CCD (caméra) : Pour Charge Coupled Device,
converti un signal lumineux en signal électrique.
· CTC : 5-cyano-2,3-ditolyl tetrazolium chloride,
sel de tétrazolium formant un composé fluorescent (Formazan).

Image extraite de:
http://en.wikipedia.org/wiki/File:Tetrazolium_reduction.png
· CMF : cytométrie en Flux.
· DAPI : 4'-6 diamino-2 phenylindole (Florophore)
permet la coloration de l'ADN.
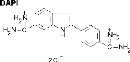
Image extraite de :
http://www.snv.jussieu.fr/bmedia/Mitose/43fluobleue.htm
· DVC : Direct Viable Count.
· FDA : Food and Drugs Administration.
· HIA: Heart Infusion Agar, milieu de culture
gélosé.
· INRP : Institut national de recherche
pédagogique (
http://www.inrp.fr/inrp).
· LASER : Light Amplification by Stimulated
Emission of Radiation.
· LPS : LipoPolySaccharide, il s'agit d'une chaine
polyosidique lié à une chaine lipidique (Lipide A)
insérée dans la membrane plasmique des bactéries à
GRAM négatif.
· mRNA : ARNm, ou Acide RiboNucléique
messager.
· pH : Potentiel Hydrogène.

· PI : Propidium Iodide.
· PCR : polymerase chain reaction.
· ROS : Reactive Oxygen Species.
· Rpf : Resuscitation promoting factor, famille de
protéines.
· RT-PCR : Reverse Transcriptase Polymerase Chain
Reaction.
· Sps : Stationary Phase Survival, famille de
protéines.
· TSA : Tryptone Soy Agar, milieu de culture.
· UFC : Unité Formant Colonie, les UFC sont
l'unité de dénombrement sur milieux gélosés.
· VBNC : Viable But NonCulturable (viable mais non
cultivable).
· VNC : Viable non cultivable.
| 


