République Algérienne Démocratique et
Populaire
Ministère de l'Enseignement Supérieur et de la
Recherche Scientifique
Université Abderrahmane Mira
Béjaïa
Faculté des Sciences de la Nature et de la
Vie
Département de Sciences Biologiques de L'Environnement
MEMOIRE
En vue de l'obtention du diplôme de master
en
axogénétique Végétale et Evolution.
Thème
Caractérisation morphologique et
cytogénétique de
deux endémiques Nord Africaines, Genista
ferox Poir.
et Ebenus pinnata Ait. (Fabaceae) du Golfe de
Béjaïa.
Présenté par :
Melle Aloui Nadra
Melle Rezki
kamélia
Devant le jury :
|
Président :
Promoteur :
Copromotrice
:
Examinateurs :
|
BEKDOUCHE Farid (MC A, U. Béjaïa) SAHNOUNE
Mohamed (MC A, U. Béjaïa) BENMOUHOUB Hassina (MA A, U.
Béjaïa) OURARI Malika (MA A, U. Béjaïa) HAMLAT Mourad
(MA A, U. Béjaïa)
|
Promotion juin 2012
Avant propos
Ce mémoire est l'aboutissement d'un travail passionnel
mais parfois jonché d'obstacles, pour décrire et suivre pas
à pas une parcelle de vie, nous plongeant souvent dans la joie de la
découverte perpétuelle.
Les découvertes scientifiques sont le fruit de
plusieurs siècles de recherches du passé, cependant nous
n'aurions jamais pu remonter dans le temps pour suivre et comprendre les
auteurs du passé, sans les conseils, les éclairages et l'aide
toujours disponible des auteurs présents et tous ceux qui nous ont
encouragé dans notre démarche : c'est pour cela que nous tenons
à les remercier infiniment pour leur aide précieuse :
A notre promoteur, Monsieur Mohamed Sahnoune qui nous remet
souvent en question. Sa rigueur pédagogique nous pousse toujours vers
l'avant.
A Melle Hassina Benmouhoub promotrice toujours
disponible et prête à ajouter des éclairages dans notre
travail.
A Monsieur Farid Bekdouche présidant du jury qui a suivi
notre cheminement avec discrétion et gentillesse.
A Melle Malika Ourari examinatrice toujours
présente et sans cesse a nos cotés pour nous offrir son savoir
faire.
A Monsieur Mourad Hamlat examinateur à l'écoute de
nos besoins, prêt à les satisfaire.
A nos parents qui ont été a nos cotés,
disponibles le jour comme la nuit, à nos frères et soeurs,
à nos oncles et tantes.
A nos amis qui nous ont encouragé par leurs
présences et leurs gentils mots.
A toutes personne qui a contribué de prés ou de
loin à la réalisation de ce mémoire.
A tous, nous vous disons merci.
SOMMAIRE
Introduction~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~1
1/ Généralité 2
1.1/ Le genre Ebenus L. 2
1.1.1/Historique du genre Ebenus L.
2
1.1.1.1/ Ebenus pinnata
Aiton..............................................................................3
1.1.2 /Répartition géographique du genre
Ebenus 3
1.1.3 / Position systématique du genre
Ebenus................................................ 3
1.1.4 / Description morphologique du genre
Ebenus.......................................4 -Description selon Desfontaine
(1790)................................................................4 -
Description selon Quezel et Santa
(1962)......................................................... 4 1.1.5 /Nombre
chromosomique dans le genre Ebenus L.
..................................4 1.1.6 /Intérêts des
espèces du genre Ebenus
................................................... 4
1.2/ Le genre Genista 5
1.2.1 / Historique du genre Genista 5
1.2.2/ Répartition géographique du genre
Genista 5
1.2.3 /Position systématique du genre Genista
L. ............ 6
1.2.4/Description morphologique du genre Genista
6
-Description du genre Genista selon Quezel et
Santa 1962...............................6
-Description de Genista ferox Poiret selon
Desfontaine................................. 6
1.2.5/Nombre chromosomique du genre Genista
7
1.2.5.1/Nombre chromosomique de base.....................
7
1.2.6/Intérets du genre
Genista....................................... 8
2/Matériel et
Méthodes..........................................................................................9
|
2.1 /Choix des stations et échantillonnage
...........................
|
..............................9
|
|
2.2 /le matériel
végétal.......................................................................................
|
10
|
|
2.3/ Etude morphologique
|
10
|
|
2.4 / Réalisation des herbiers
...............................................................
|
10
|
|
2.5/ Etude cytogénétique
|
10
|
|
2.4 / Etude des mitoses
|
11
|
|
2.5.1.1/Obtention des apex racinaires
|
11
|
2.5.1.2/
Prétraitement..........................................................................................11
2.5.1.3/Fixation....................................................................................................
12 2.5.1.4/
Stockage....................................................................................................12
|
2.5.1.5/
Hydrolyse.................................................................................................
12 2.5.1.6/
Coloration................................................................................................
12 2.5.1.7/ Méthode simple et rapide de la mise en évidence de
tous les stades
|
|
De division
.........................................................
|
12
|
|
2.5.1.8/ Montage et observation microscopique
................
|
.............................13
|
|
2.5.2/ Etude de la
méiose....................................................................................
|
13
|
|
2.5.2.1/
Fixation....................................................................................................
|
13
|
|
2.5.2.2/
Coloration................................................................................................
|
13
|
|
2.5.2.3/Observation
microscopique..................................................................
|
14
|
|
2.5.3/Etude de la fertilité
pollinique................................................................
|
14
|
|
2.5.3.1/Le taux fertilité
pollinique.....................................................................
|
14
|
|
1 /Résultats
..........................................................................................................
|
15
|
3.1/Etude morphologique d'Ebenus pinnata
Aiton~~~~~~~~~~~~~ 15 3.1.1/Réalisation de
l'herbier..............................................................................15
3.1.2/ Description de l'appareil
végétatif..........................................................17
3.1.3/ Description de l'appareil
reproducteur................................................ 18 3.2 /
Caractérisation
caryologique.....................................................................22
3.2.1/Etude
mitotique...........................................................................................22
3.2.1.1/Condition de la
germination..................................................................
22
3.2.1.2/Prétraitement..........................................................................................
23 3.2.1.3 / Résultats des différents stades de mitoses
d'E.pinnata Aiton.........24 3.2.1.4/Etablissement du
caryotype.................................................................. 25
3.2.1.5/Réalisation du caryogramme d'Ebenus pinnata Aiton
..................... 25 3.2.2/Etude
méiotique..........................................................................................26
3.2.1 /Etude de la fertilité
pollinique............................................................ 26 3.3/
Etude morphologique de Genista ferox
Poiret....................................... 26 3.3.1 /
Réalisation de
l'herbier...........................................................................
26 3.3.2/ Description de l'appareil
végétatif.........................................................
27 3.3.3 /Description de l'appareil reproducteur
................................................ 27
3.4/ Carylogie de Genista ferox Poiret
...............................................................
34
3.4.1/Etude des
mitoses.......................................................................................34
3.4.1.1/Condition de la
germination..................................................................
34
3.4.1.2/Différent stades mitotiques de
Genista ferox.......................................35 3.4.1.3/Plaque
métaphasique de Genista ferox
Poiret.................................... 36 3..2/Etude des
méioses.......................................................................................
36 3.4.3/Etude de la fertilité
pollinique..................................................................37
4
/Discussion.........................................................................................................
38
4.1/Caractérisation morphologique d'Ebenus
pinnata~~~~~~~~~~~ 38
4.2 /Caractérisation caryologique de
Genista ferox ~~~~~~~~~~~~~ 39
4.3/Morphologie de Genista ferox
~~~~~~~~~~~~~~~~~~~~~~~ 41
4.4/caryologie de Genista ferox ~~~~~~~~~~~~~~~~~~~~~~~~
41
Conclusion 42
Introduction
Introduction
Les deux espèces que nous nous proposons d'étudier
ici sont Ebenus pinnata Aiton et Genista ferox Poiret qui
appartiennent à la famille des légumineuses riche de plus
18000
les milieux terrestres et com
Le genre d'Ebenus a été établi par
Linné dans la suite de Lamark et Willdenow qui l'ont réuni aux
Antylhylis, et que Val semblait disposé à confondre avec les
Hedysarum. Il
comprend 19 espèces actuellement dont treize sont
toutes endémiques à la Turquie (Aytaç et
al., 2000 et Aksoy et al., 2001); le reste des espèces
se répartit entre Pakistan et l'Afghanistan (E. stella
Boiss.), l'Iran (E. stella Boiss., E. lagopus), l'Europe
(E. cretica, E. sibthorpii DC, E. pinnata), et en
Afrique du nord (E. pinnata, E. armitagei) (Davis et Hedge,
1997).
L'intéret des plantes du genre Ebenus est
essentiellement écologique, elles sont utilisées pour
lutter
conter l'érosion et valoriser les sols pauvres (Aytaç et
al., 2000).
17
Le genre Genista, reconnu comme tel par Linné
(1753), incluait les genres Genistella et Spartium (y
compris certaines espèces aujourd'hui incluses dans le genre
Cytisus) et le complexe Genista-Spartium. Les
limites génériques du genre ont été une source de
confusion taxonomique. Le genre Genista comprend 87 espèces
(Martins et al., 2005) dont 23 sont présentes en
Algérie, parmi lesquelles 11 sont endémiques (Maire, 1987). Le
genre Genista
dromadaires), médicinal (Lograda et al., 2010;
Lopèz González, 2001).
17
Sur les 19 espèces d'Ebenus, seules huit ont
été étudiées du point de vue nombres
chromosomiques. Ces huit espèces sont toutes
de la Turquie et sont toutes diploïdes à 2n = 2x
=411 14 (Davis et al., 1988; Aytaç et al., 2000; Aksoy
et al., 2001). Aucune référence à un comptage des
chromosomes d'Ebenus pinnata Aiton, ni en Algérie ni ailleurs
n'a été signalé.
17
Les nombres chromosomiques chez le genre Genista sont
très variables. Ils vont de 2n iii = 12 - 240. On y compte des
diploïdes, triploïdes, tétraploïdes,
pentaloïdes, hexaploïdes et octoploïdes (Goldblat, 1981;
Sanudo, 1979; Verlaque, 1992; Cusma et Chiapella, 2009 et Lograda, 2010). Sur
les 11 espèces endémiques présentes en Algérie, les
nombres chromosomiques n'ont été comptés que pour 6
d'entre elles (Lograda, 2010) : G. tricuspidata Desf. à 2n=
(48+2B), G. vepres Pomel à 2n=4x=52, G. numidica Spach
à 2n=4x=36, G. microcephala Coss. & Dur. à 2n= 4x=
(48+2B), G. ulicina Spach à 2n=2x=18 et G. saharae
Coss. & Dur. à 2n=2x=18. Un seul comptage a été
réalisé sur des mitoses pour G. ferox Poiret; c'est
celui de Tschechow 1931 et Villa 1980 qui rapportent un nombre de 2n = 48.
17
Il ressort de cette petite synthèse que les populations
des espèces E. pinnata Aiton et
Genista ferox Poiret sont très peu
étudiées du point de vue cytogénétique. Ce travail
est une
contribution à combler cette lacune en analysant des
mitoses et des méioses polliniques de ces
espèces poussant dans le Golfe de Béjaïa et
environs.
1/ Généralités
1.1/ Le genre Ebenus L.
1.1.1/ Historique du Genre Ebenus L.
Le nom latin Ebenus parait emprunté du mot
arabe abnous, sous lequel Golius dit que l'on désigne dans l'orient un
bois dur compacte et noir, du reste il faut bien se garder de confondre aucune
des espèces du genre Ebenier avec l'arbre qui fournit aux
tabletiers le bois si recherché sous le nom d'ébène
(Drapiez, 1835 ).
Le genre Ebenus, à été
institué par Linné, pour une plante que des années
auparavant, Prosper, Alpin et l'Ecluse avaient étudié et
décrite sous le nom d'Ebenus cretica. Lamarck effaça ce
genre et joignit avec Willdenow cette seule plante qu'il renfermait à
savoir l'E. cretica au genre Anthyllis, alors que Vahl pour
sa part semblait disposé à le confondre avec les Hedysarum.
Par la suite De Candolle a jugé convenable de rétablir le
genre de Linné avec les caractères qui lui furent imposés
par ce grand botaniste, en ajoutant à l'espèce qui y avait
été primitivement placée quelques Anthyllis de
Willdenow (De Candolle, 1825; Drapiez, 1835).
Cependant la spécificité de cette plante qu'on
ne pouvait inclure ni dans les Anthyllis ni dans les Hedysarum
imposa le rétablissement du genre Ebenus. En effet ce
genre se distingue des Anthyllis par des caractères bien
tranchés: premièrement son calice qui se divisé
au-delà du milieu en lobes acérés qui égalent la
longueur de la corolle, deuxièmement les ailes qui sont
extrêmement courtes, et atteignent à peine la longueur du tube du
calice qui est muni de 5 arêtes plumeuses, un peu plus longues que la
corolle et par le fruit qui ne contient qu'une seule semence (gousse) velue
(Ventenat, 1798 ; De Candolle, 1825).
Le port de ces plantes est très différent, car
les Ebenus sont des herbes ou des sous arbrisseaux à feuilles
pennées avec une foliole impaire, sessile et égale aux autres,
les stipules sont distinctes du pétiole, les pédoncules qui
naissent des aisselles des feuilles portent des épis serrés de
fleurs rouges. La brièveté des ailes de la corolle est un
caractère frappant qu'on ne retrouve guerre que dans les Hedysarum,
les Onobrychis et l'Ebenus, et motive leur rapprochement
(De Candolle, 1825).
En termes d'apparence le genre Ebenus ressemble
à l'Astragalus L. mais il se distingue facilement par son
calice denté qui est deux fois plus grand que le tube; les filaments se
rejoignent formant un tube (étamines monodelphe), avec de courtes ailes
suffisantes pour s'adapter dans le tube du calice (Ayten et al.,
2009).
Le genre Ebenus renferme trois espèces, le
Crética, petite arbrisseau de la crête, le Pinnata
des collines de la Barbarie, et le Sibthorpii du Parnasse et du
mont Atlas, bisannuels comme les précédents, et toutes trois
appartiennent au rivage de la méditerranée (Vaucher, 1841).
Les inventaires menés récemment signalent la
présence d'autres espèces du genre Ebenus. Il existe
aujourd'hui 19 espèces dans le monde (Huber- Morath, 1965).
1.1.1.1/ Ebenus pinnata Aiton
Le 22 octobre 1790, M. Desfontaine a décrit cette
plante déjà indiquée dans le jardin de Kew sous le nom
d'Ebenus pinnata; elle a été trouvée par ce
botaniste sur les coteaux arides des environs de Tunis. La phrase descriptive
qu'il lui consacre est : Ebenus herbacea caule herbaceo, follis impari
pinnatis, foliolis linearibus, sericeis, pedunculis, axillaribus longissimis
aphyllis (Fourcroy, 1791).
On ne compte d'ordinaire que deux espèce dans le genre
Ebenus, savoir : l'E. cretica qui renferme deux
espèces, savoir, 1° : le vrai E. pinnata de Desfontaine,
qui est l'Hedysarum sericeum de Vahl et l'Anthyllis
sericea de Willdenow ; 2° : l'Ebenus pinnata de Sibthorp,
que De condolle nomme E. sibthorpii. En comparant les
échantillons provenant de M. Desfontaine et de Sibthorp, De condolle
trouve les différences suivantes, savoir, que l'E. pinnata de
barbarie a la tiges garnie de poils mous et étalés, tandis que
l'E. sibthorpii qui croit sur les montagnes de l'Athos et du
Parnasse, a la tige couverte d'une pubescente courte et couchée; le
premier a l'épi ovale le deuxième l'a sphérique. La
corolle du premier est plus courte que le calice; celle-ci est égale
à la longueur du calice. Le premier a une bractée ovale, concave
sous chaque fleur; la deuxième a une espèce d'involucre
composé de trois, quatre bractées à la base de
l'épi (De Condolle, 1825).
1.1.2/ Répartition géographique du genre
Ebenus
Les inventaires menés récemment signalent la
présence d'autres espèces du genre Ebenus. Il existe
aujourd'hui 19 espèces dans le monde, dont 13 sont endémiques
avec 3 variétés; ces dernières sont
représentées par 16 taxa qui croissent en Turquie (Huber- Morath,
1965), dont 8 se trouvent à l'est de la méditerranée, et 8
Irano-Touranien, et le reste (6 espèces) se répartissent comme
suite : E. cretica L. et E. sibthorpii DC trouvés en
Crête (Grèce) et en Rhode Islande (USA); E. stella Boiss.
en Iran, en Pakistan et en Afghanistan; E. lagopus (Jaub. et Spach)
Boiss. en sud de l'Iran (Aytaç et al., 2000); E.
pinnata Aiton en Maroc, en Algérie, en Tunisie, et en Lybie; E.
armitagei Schwein en Lybie (Cyrénaïque), en nord ouest de
l'Egypte, et en Algérie (P. H. Davis et I. C. Hedge, 1971).
1.1.3/ Position systématique du genre Ebenus
Domaine: Eukaryota Whittaker
& Margulis, 1978 - eukaryotes
Règne: Plantae Haeckel,
1866 - Plants
Sous règne: Viridaeplantae
Cavalier-Smith, 1981
Phylum: Tracheophyta Sinnott, 1935 ex
Cavalier-Smith, 1998 - Vascular Plants
Subphylum: Euphyllophytina
Classe: Magnoliopsida Brongniart, 1843
- Dicotyledons
Sous classe: Rosidae (Takhtajan,
1967 Superordre: Rosanae Takhtajan, 1967
Ordre: Fabales Bromhead, 1838
Famille: Leguminosae A.L. de Jussieu,
1789, nom. cons. Sous famille: Papilionoideae
Tribu: Hedysareae
Genre: Ebenus C. Linnaeus, 1753
Espèce : Ebenus pinnata -
Aiton
1.1.4/ Description morphologique de l'espèce
Ebenus pinnata
-Description selon Desfontaine (1790)
La phrase descriptive que Desfontaine a consacré pour
E. pinnata est : Ebenus herbacea caule herbaceo,
follis impari pinnatis, foliolis linearibus, sericeis, pedunculis, axillaribus
longissimis aphyllis (Fourcroy, 1791).
1.1.5/ Stratégies d'adaptation d'Ebenus pinnata
Aiton selon Hegazy et al. 2008 :
- Type fonctionnel éphémère
: Ce type est monocarpique (annuel) avec des individus de petites tailles
à 1-3 branches produisant 1-5 inflorescence par individus.

Fig. 1 : Type fonctionnel
éphémère
- Type fonctionnel modéré : Ce
type est monocarpique avec des individus de tailles intermédiaires, avec
peu de branches de 4-10 branches produisant moins de 30 inflorescences par
individus.

Fig. 2 : Type fonctionnel
modéré
- Type fonctionnel permanant : Ce type est
polycarpique (vivace) avec des individus ayant des racines pérennes car
elles stockent des réserves, ce type possède de nombreuses
branches de grandes tailles qui produisent plus de 30 inflorescences par
individus.

Fig. 3 : Type fonctionnel permanant
1.1.6/ Nombres chromosomiques dans le genre Ebenus
L.
Les analyses caryologiques réalisées jusqu'ici
sur le genre Ebenus montrent la présence d'un nombre
chromosomique diploïde à 2n =14 pour huit espèces : E.
reesei, E. barbigera, E. boissieri, E.
bourgaei, E. longipes, E. argentea, E. plumosa
var. plumosa, E. plumosa var. speciosa, E. macrophylla, et
E. barbigera (Davis et al., 1988; Aytaç et
al., 2000; Aksoy et al., 2001).
1.1.7/ Intérêt des espèces du genre
Ebenus
L'analyse d'extraits de la partie aérienne d'Ebenus
pinnata a permis d'isoler les composés suivants : (1) ombuoside,
(2) kaempferol 3-O-rutinoside, (3) rutine, (4) catéchine, et
(5) picéine, avec â-sitostérol et â-sitostérol
glucoside. Les composés 1-4 ont montré une activité
antioxydante (Abreu, 2006).
Les espèces du genre Ebenus croissent sur des
sols pauvres, elles sont de ce fait utilisé pour la revalorisation des
sols et contre l'érosion (Aytaç, 2000).
1.2/ Le genre Genista
1.2.1/ Historique du Genre Genista
Le genre Génista dont le nom paraît
dériver de l'ancien mot Gaulois Gen, qui signifie arbuste, a toujours
trouvé place dans les méthodes de botanique, quoique les
espèces qui le composent aient subi pour la plupart, différentes
mutations occasionnées pas l'incertitude des caractères
assignés à ce genre, incertitude que Linné n'a pu parvenir
à fixer, et qui subsiste encore malgré les efforts constants de
quelques célèbres monographes. On compte environ quatre-vingt
espèces de Genêts, et presque tous les points du globe ont fourni
leur contingent à ce genre, néanmoins le plus considérable
est celui de la région méditerranéenne (Spach, 1834).
La tribu Genisteae constitue un groupe complexe, soulevant des
problèmes d'ordres taxonomiques, caryologiques et phylogéniques
(Pardo et al., 2008).
A la fin du Miocène, deux autres facteurs historiques
ont joué un rôle décisif dans la formation des
espèces végétales et dans la distribution de
l'endémisme autour de la Méditerranée: l'apparition d'une
sécheresse estivale et le développement des activités
humaines (Thompson, 2005).
La tribu Genisteae comprend 30 genres avec 470 espèces
(Verlaque, 1988).
Verlaque (1988) et Cusma et al. (2009)
considèrent qu'une meilleure connaissance de la polyploïdie peut
fournir des renseignements considérables sur les liens de parenté
de certains groupes. Alors que Polhill (1976), Bisby (1981), Goldblatt (1981)
considèrent que la variabilité chromosomique est sans aide
réelle à la systématique.
Le genre Genista, reconnu comme tel par Linné
(1753), incluait les genres Genistella et Spartium (y compris
certaines espèces aujourd'hui incluses dans le genre Cytisus)
et le complexe Genista-Spartium. Les limites
génériques du genre ont été une source de confusion
taxonomique. Suite à cette ambiguïté fondamentale, les
genres originaux linnéens ont été remaniés à
maintes reprises. Les travaux de Cristofolini et Chiapella (1977) et de Pardo
et al. (2004) montrent l'existence de lignées de
diversification au sein du genre Genista qui correspondent aux trois
sous-genres: Genista, Phyllobotrys et
Spartocarpus.
1.2.2/ Répartition géographique du genre
Gensita
Ce genre est Circumméditerranéen,
constitué d'arbustes épineux et non-épineux, la plupart
des espèces de ce genre forment des maquis sclérophylles ou des
matorrals, avec 87 espèces (Martins et al., 2005). Le genre est
représenté en Europe occidentale et centrale, il est
également présent en Turquie, en Syrie et en Afrique du Nord
(Spach, 1844-1845).
L'espèce Genista ferox Poiret, est
représentée en Algerie, en Italie (Sardaigne), au Maroc et en
Tunisie (Fennane et al., 2007). Cette espèce à une
distribution géographique relativement importante qui dépasse de
loin 20.000 km2 à une altitude comprise entre 0 et 500 m. Ce
taxon est connu pour se produire au sein du réseau de zones
protégées, et on croie ne pas être soumis à aucun
processus majeur le menaçant à l'heure actuelle (International
Legume Database and Information Service, 2005).
1.2.3 /Position systématique du genre genista
L
Règne : Plantae
Division : Magnoliophyta Cronquist
Subdivision Magnoliophytina Frohne & U. Jensen
Classe : Rosopsida Batsch
Sous classe : Rosidae Takht.
Superordre : Fabanae R. Dahlgren
Ordre : Fabales Bromhead
Famille : Fabaceae Lindl
Tribu : Genisteae (Adans.) Benth.
1.2.4/ Description morphologique du genre Genista
-Description du genre Genista selon Quezel et
santa 1962
Le calice à 5 segments, les 2 supérieurs libres
ou soudés, les 3 inférieurs formant une lèvre à 3
dents profondes; rarement avec un calice campanulé à 5 dents
subégales. La carène est oblongue, droite ou presque biggibeuse
latéralement.
L'étendard étroit avec 10 étamines
monadelphes, en tube non fendu, 5 longues et 5 courtes. Le Stigmate est
oblique, la gousse est déhiscent et variable. Les arbrisseaux sont
épineux ou parfois aphylles et junciformes. Les feuilles 1 à 3
folioles stipulées ou non. Les graines sont non arillées.
-Description de Genista ferox Poiret selon
Desfontaine
Les feuilles sont trifoliolées ou simples, sessiles,
oblongues et presque glabres. Les rameaux sont striés et spinescents.
Les Fleurs sont en grappes. Les calices sont pubescents, et les corolles sont
glabres. Les légumes sont linéaires, pubescents entre 8 à
10 spermes.
Cette espèce croit en Barbarie; elle est remarquable par
les fortes épines dont ses branches sont armées ; les lieux qui
en sont couverts deviennent inabordables (Spach, 1834).
-Description de l'espèce Genista ferox
selon la flore Quezel et santa 1962
Le calice est presque glabre, caduc en entier ou en partie sur
la gousse, se coupant circulairement au-dessus de la base; celle-ci longue de
3-6 cm. Les folioles sont ovales larges de 3-6 mm. L'Arbuste mesure entre 1
à 3 m de couleur vert gai. Les vieux rameaux sont transformés en
énormes épines très vulnérantes. Les feuilles sont
stipulées, à stipules transformées en petits
aiguillons.
1.2.5/ Nombres chromosomiques du genre Genista
La rareté des travaux de caryologie sur ce genre est
probablement due aussi aux difficultés inhérentes aux variations
du nombre chromosomiques liées à l'aneuploïdie et à
l'eupolyploïdie (Sanudo, 1979 ; Verlaque, 1992 et Goldblat, 1981).
La majorité des recherches cytologiques sur les
Genisteae se limitent à l'étude des mitoses somatiques.
Ces études visent à déterminer le nombre de chromosomes,
leur morphologie et parfois l'établissement des caryotypes. Les travaux
de Böcher et Larsen, (1958) et De Turner et Fearing, (1959) sur les
méoses ont pris une grande ampleur dans les années 70.
Selon Sanudo, (1974) la grande variabilité
numérique est en corrélation avec l'abondance et le degré
de différenciation morphologique des phénotypes. Il confirme
l'importance de la variabilité des nombres chromosomiques dans la
diversification du genre Genista avec des nombres chromosomiques
haploïdes de 6, 9, 11, 12, 13, 15, 16, 18, 20, 22 21, 23, 24, 25, 26, 28,
36, 40, 48, 72, 84, 88, 96 et 120.
Les nombres chromosomiques les plus élevés chez
le genre Genista L. sont 2n = 20x = 120 et 2n = 6x = 96
observés chez Genista tinctoria et Genista
angustifolia respectivement le plus faible étant 2n = 2x = 12
observé chez Genista anglica par Gallego et al.
(1985).
1.2.5.1/ Nombres chromosomiques de base
Le premier nombre chromosomique de base est x=8 (Seen, 1938) ;
Sanudo en 1972 ajoute deux nombres chromosomiques de base x = 9 et x = 12,
au.
Sanudo (1972, 1979) fixe le nombre de base x = 8 pour le genre
Genista L. et considère les multiples de ce nombre comme des
euploïdies et le reste comme des
aneuploïdes. Il justifie cette aneuploïdie par le gain
ou la perte de chromosomes tout en respectant le niveau normal de
ploïdie.
Fernandes et Santos, (1971) concluent que chez les
Légumineuses, les espèces annuelles et bisannuelles tendent vers
un stade diploïde alors que les pérennes tendent vers un stade
polyploïde. Sur les 134 taxons de la tribu des Genisteae
étudiés par ces auteurs, 10,50% sont diploïdes et 89,50%
sont polyploïdes. D'après ces investigations les valences
chromosomiques trouvées sont très variables. Les
tétraploïdes sont très répandues dans la nature,
surtout lorsque le nombre de base est de x = 12.
Il est à remarquer que les tétraploïdes
représentent 56,82% du nombre total des niveaux de ploïdie, les
diploïdes sont particulièrement mieux représentés
lorsque le nombre de base est x = 9 et les autres niveaux de ploïdie
faiblement représentés (Fernandes et Santos, 1971).
1.2.6/ Intérêts du genre Genista
La tribu des Genisteae (Adans.) Benth., famille des Fabaceae,
est essentiellement méditerranéenne (Polhill, 1976). Elle
possède une grande importance écologique, non seulement pour la
grande diversité des espèces, mais aussi par la colonisation des
forêts dégradées et les zones déboisées et de
dominer de nombreuses communautés végétales (Lopèz
González, 2001).
Le genre Genista présente un degré de
haute inflammabilité pendent toute l'année, à cause d'une
importante accumulation des matériaux fins (diamètre < 2.5 mm)
sur la plante (Casal, 1987). Leur quantité de combustible a un maximum
au mois de septembre, d'environ 5300 kcal/kg (Elvira et Hernando, 1989).
Le genre Genista comporte des molécules
naturelles aux propriétés antimicrobiennes et antioxydantes, ces
propriétés ont une grande importance aussi bien dans le domaine
médicale que dans le domaine de l'industrie alimentaire. Les effets
antimicrobiens des différentes espèces de plantes aromatiques et
d'épices sont connus depuis longtemps et mis à profit de
manière empirique (Lograda et al., 2010)
2/ Matériel et Méthodes
2.1/ Choix des stations et échantillonnage
Les stations de récolte et leurs caractéristiques
sont données pour Ebenus pinnata dans le tableau 1 et pour
Genista ferox dans le tableau 2.
Tableau 1 : Données écologiques
d'E.pinnata Aiton
|
Espèce
|
Lieux de Récolte
|
Échantillons
|
Graine récupérées
|
Inflorescences Récupérés
|
Plantes Cueillis
|
Date et heure de récolte
|
Altitude
(métres)
|
Exposition
|
|
Ebenus
|
Kherrata
|
1(avec 11 individus)
|
79
|
|
|
16-12-2011
|
611
|
Est
|
|
pinnata
|
Kherrata
|
2 (Individu1)
|
0
|
|
|
|
|
|
|
aiton
|
|
2 (Individu2)
|
0
|
|
|
|
|
|
|
|
2 (Individu3)
|
0
|
|
|
|
|
|
|
|
2 (Individu4)
|
3
|
|
|
|
|
|
|
|
2 (Individu5)
|
8
|
|
|
|
|
|
|
|
2 (Individu6)
|
1
|
|
|
|
|
|
|
|
2 (Individu7)
|
18
|
|
|
24-16-12-2011
|
623
|
Est
|
|
|
2 (Individu8)
|
4
|
|
|
|
|
|
|
|
2 (Individu9)
|
9
|
|
|
|
|
|
|
|
2(Individu10)
|
11
|
|
|
|
|
|
|
|
2(Individu11)
|
19
|
|
|
|
|
|
|
|
2(Individu12)
|
2
|
|
|
|
|
|
|
|
2(Individu13)
|
22
|
|
|
|
|
|
|
Ighezer
|
1
|
|
20
|
|
10-04-2012 à
|
200-300
|
|
|
Amokrane, Thikhervivine
|
|
|
|
|
11h52
|
|
Est
|
|
Ain-Skhoun
|
2
|
|
32
|
|
20-04-2012
|
100-150
|
Est
|
|
Ain-Skhoun
|
1
|
|
|
4
|
28-03-2012
|
|
|
|
Ain-Skhoun
|
2 (11 infl.)
|
|
|
7
|
10-04-2012
|
|
Est
|
|
|
|
|
|
|
|
|
Est
|
|
Ighezer
|
1
|
|
|
2
|
27-05-2012
|
200-250
|
Est
|
|
Amokrane, Thikhervivine
|
|
|
|
|
|
|
|
Tableau 2 : Stations de récolte de
Genista ferox
|
Espèces
|
Lieux de
Récolte
|
Echantillo
ns
|
Gousses
Récupérées
|
Inflorescences Récupérés
|
Rameaux
Avec bourgeon
axillaire
(Méristème c.)
|
Date et heure
de récolte
|
Altitude
(métres)
|
Exposition
|
|
Genista
|
Route entre
|
1(station
|
40
|
|
|
20-07- 11 à
|
|
Nord
|
|
ferox
|
Amtik -et
|
1)
|
|
|
|
11h
|
200-
|
|
|
ssp
|
Saket
|
|
|
|
|
|
100
|
|
|
Salditana
|
Route Amtik -
|
2 (station
|
12
|
|
|
20-07- 20-
|
|
Nord
|
|
Saket
|
3)
|
|
|
|
11 à 11h
|
|
|
|
Route Amtik -
|
3(station
|
17
|
|
|
20-07- 2011
|
|
Nord
|
|
Saket
|
3)
|
|
|
|
à 11h
|
|
|
|
Saket
|
1
|
|
46
|
|
21-03-2012
|
|
Nord
|
|
|
|
|
|
|
à 12h
|
|
|
|
Cap-Carbon
|
2
|
|
55
|
|
03-04-2012
|
20-50
|
Est
|
|
Cap-Carbon
|
1
|
|
|
8
|
18-04-2012
|
20-50
|
Est
|
|
|
|
|
|
|
à 12h
|
|
|
|
Aiguades
|
2
|
|
|
12
|
18-04-2012
|
|
Est
|
|
|
|
|
|
|
à 13h
|
|
|
2.2/ Le matériel végétal
Le matériel végétal est
représenté par des graines, plantules, boutons floraux de deux
espèces:
-Ebenus pinnata Aiton.
-Genista ferox Poiret ssp Salditana.
Ces graines ont été prélevées
à partir de différentes stations d'échantillonnage au
niveau de la wilaya de Béjaïa (Tableaux 5 et 6), nous avons
effectué des sorties sur terrain à des périodes
différentes, vu la variabilité de la période de
maturité des semences et la période de floraison des fleurs. Les
premières collectes ont été éffectués le 2
Juillet 2011pour G.ferox poiret et le 16 décembre 2011 pour
E.pinnata Aiton.
2.3/ Etude morpholologique -Appareil
végétatif et reproducteur
Nous avons étudié le type morphologique des deux
espèces, l'aspect de leurs tiges, feuilles et racines en
décrivant des échantillons récoltés, ainsi que le
type de germination par ensemencement des graines dans des pots afin de suivre
leurs croissances.
Sous loupe binoculaire au grossissement x0.8, on a pris un
papier millimétré plastifié, sur lequel on a
Séparé les fleurs en pièces florale afin de compter et
décrire le périanthe, l'androcée et le
gynécée et établir ainsi leur disposition; décrire
la forme et la couleur des graines et des gousses et mesuré leurs
tailles; effectuer les diagrammes florales ainsi que leurs formules
florales.
-Palynologie (forme du pollen)
On a disséqué les fleurs en pièces pour
dégager les androcées dont les étamines seront
récupérées et misent directement sur lames en leurs
rajoutant 1goutte de Hcl.
Au départ l'hydrolyse durait 15min, ou 10 min au bain
marie réglé à 60°C, puis on colorait à 5mn au
bain marie toujours. Mais par la suit on a supprimé l'étape
d'hydrolyse et on colorait directement avec une goutte d'orcéine
lactopropionique pendant 1 à 5 mn à T° ambiante. En dernier
on recouvre avec une lamelle et on passe à l'observation au microscope
photonique.
2.4/ Réalisation des herbiers
Les exemplaires d'Ebenus pinnata Aiton et Genista
ferox poiret échantillonnés sont mis sous presse et
asséchés entre des feuilles de papier journal, puis fixés
sur papier dure. Les morceaux séparés de la plante, tels que
fruits et graines, sont placés dans une enveloppe fixée sur la
page correspondante de l'herbier. Chaque planche est ainsi
étiquetée comme il convient: nom de la plante, date et lieu de
cueillette, nom du collecteur, caractéristiques.
2.5/ Etude cytogénétique
Différentes méthodes sont décrites pour
l'étude des chromosomes, elles mettent en jeu l'application d'agents
chimiques pour le prétraitement, la fixation et la coloration des
cellules en divisions. Ces méthodes sont largement décrites dans
le cahier des techniques de cytogénétique végétale
(Jahier 1992).
L'emploi d'une technique adéquate doit permettre une
bonne séparation des chromosomes avec des détails morphologiques
permettant l'établissement correct du caryotype.
L'étude caryologique est effectuée sur des
méristèmes racinaires et caulinaires de graines faites
germées et sur les racines de plantules et méristèmes
caullinaires d'arbustes, et sur des boutons floraux de fleurs dont l'analyse
cellulaire révélerait le plus grand nombre de mitoses et de
méioses possibles.
2.5.1/ Etude des mitoses
2.5.1.1/ Obtention des apex racinaires
La difficulté de germination de certaines graines,
appartenant à la famille des Légumineuses est due à la
présence de téguments (Mazliak, 1984). Pour résoudre ce
problème, raison pour laquelle nous avons scarifié à
l'aide d'un papier verre. Cette scarification est importante pour lever
l'inhibition tégumentaire des graines, surtout pour les graines de
Genista ferox. Les graines sont mises à germer dans des
boîtes de Pétri tapissées de papier filtre humide plus une
goutte de javel. Ensuite on a mit les graines à prégermer au
réfrigérateur pendant 48h afin de lever la dormance et
déterminer ainsi la température optimum de germination pour
chaque espèce, en variant la température des différents
échantillons à l'aide d'une étuves en la réglant
à différentes températures allant de 22 °C à
27 °C.
2.5.1.2/ Prétraitement
Nous nous sommes référés à une
technique qui a pour effet de contracter les chromosomes ce qui facilitera leur
individualisation (La Cour, 1935). Le prétraitement consiste à
prélever des pointes de racines avec les zones
méristématiques et à les mettre dans une solution
antimitotique saturée.
Cette étape à pour but de bloquer les divisions
mitotiques en métaphase, contracter les chromosomes car la colchicine
inhibent la formation du fuseau achromatique et retardent la division du
centromère, ce qui entraînera l'éparpillement des
chromosomes dans la cellule et obtenir un grand nombre de plaques
métaphasiques. La colchicine est de loin la substance qui
présente le moins de danger, parmi les substances antimitotiques.
Les méristèmes caulinaires de G. ferox
poiret extraits à partir de plantules cultivés, et de
rameaux de feuilles d'arbuste, sont immergés dans la colchicine à
0.05% pendant 2h à température ambiante et à
l'obscurité.
Les pointes racinaires d'E.pinnata Aiton atteignant 2
à 2,5 cm, dont on a coupé 0.5 cm, sont extraites à partir
de graines germées, ou de plantules cultivées dans des pots en
cône troués pour permettre la sortie des racines pour les
récupérer, ensuite ces racines sont immergées dans de la
colchicine à 0,5% pendant une heure à 1h 15mn à
température ambiante à l'obscurité.
A fin de ne pas gaspiller notre matériel
végétale, les graines germées dont on a coupé
l'apex qui ne dépasse pas 0.5 cm, sont plantées dans des pots
afin de récupérer environ 18 méristèmes caulinaires
après croissance qui a durer 2mois à compté du jour de
prégermination, ou bien récupérer dés le
départ un seul méristème collinaire à partir de la
première paire de foliole formés.
2.5.1. 3/ Fixation
Nous avons utilisé le fixateur Ethanol-acide
acétique glacial (3v : 1v), qui assure non seulement la fixation mais
aussi un mordançage de la préparation. Ce fixateur peut
être suivi d'une hydrolyse appropriée (Farmer et Moore, 1905).
Le but de cette étape est de détruire toute vie
cellulaire, bloquer les divisions cellulaires en conservant
l'intégrité structurale des chromosomes et protéger les
chromosomes de l'action de l'agent mitoclasique de prétraitement.
La fixation est réalisée pendant 24h au
réfrigérateur pour E. pinnata Aiton, et de 4 jours pour
G.ferox ssp salditana.
2.5.1.4/Stockage
Le matériel végétal peut être
conservé pendant plusieurs mois dans une solution d'éthanol 70 %
congélateur, ou laissé dans le Carnoy I à (-10 °C)
jusqu'à utilisation.
2.5.1.5/ Hydrolyse
L'hydrolyse est une étape nécessaire elle se fait
dans une solution d'acide Hcl (1N) à 60 °C pendant 5 mn.
2.5.1.6/Coloration
Les méristèmes racinaires ou caulinaire
hydrolysé sont colorés avec l'orcéine lactopropionique
pendant une 5 à 10 min au bain marie à 60 °C.
2.5.1.7/Méthode simple et rapide de la mise en
évidence de tous les stades de division
Le protocole précédent dure 27 heures, afin
d'obtenir de très bonnes métaphases pour le comptage
chromosomique, mais l'observation de tous les stades de divisions peut
être réalisée avec une nouvelle technique qui dure
seulement 25 minutes, qui consiste à prendre les
méristèmes racinaire ou caulinaire et faire directement une
hydrolyse pendant 20 min au bain marie à 60°C, suivie de coloration
pendant 5 min, toujours au bain marie à 60 °C.
2.5.1.8/ Montage et observation au microscope
Les zones méristématiques hydrolysées,
colorées et isolées sont déposées sur une lame dans
une goutte d'orcéine lactopropionique, puis écrasées entre
lame et lamelle pour assurer la dissociation. Les cellules en division sont
repérées au microscope photonique à l'aide d'un objectif
de faible grossissement (X 10) puis au grossissement (X 40) pour une bonne
visualisation de l'image. Le dernier grossissement est celui de l'objectif (X
100) à huile à immersion.
Les bonnes plaques métaphasiques ont été
photographiées à l'aide d'un microscope ZEISS West Germany 475002
sur lequel on a placé une camera digitale de marque Panasonic, FS 4
LUMIX à 8.1 mégapixeles.
2.5.2/Etude de la méiose
2.5.2.1/Fixation
Durant la période de floraison, sous des conditions de
température fraiche et d'humidité optimale les boutons floraux
sont prélevés très jeunes et mis immédiatement dans
des tubes a essais, contenant du fixateur Carnoy I (3 volumes d'Ethanol et 1
volume d'acide acétique glacial) ou Carnoy II (6 volumes d'Ethanol, 3
volumes de chloroforme et 1 volume d'acide acétique glacial). Ce
fixateur assure un arrêt rapide des divisions cellulaires. Lors de la
dissection de ces boutons floraux, ces deniers sont remis dans le fixateur, et
on sélectionne les grappes les plus jeunes (dont les fleurs basales ne
sont pas ouvertes) et dont choisis les boutons floraux de la partie terminale
(qui représente le 1/4 de la grappe, pour les deux espèces afin
de repérer les métaphases méiotiques et les
différents stades.

Fig. 4: Extraction d'un bouton floral à
partir d'une Fig. 5 : Extraction d'un bouton floral à
partir
jeune grappe de G.ferox ssp salditana. D'un jeune
panicule d'E.pinnata Aiton.
2.5.2.2/ Coloration
Les étamines seront récupérées et
misent directement sur lames en leurs rajoutant une goutte d'orceine
lactopropionique préparé selon Dyer 1963 pendant 3 mn à
température ambiante.
2.5.2.3/Observation microscopique
Les cellules mères en division sont
repérées au microscope photonique à l'aide d'un objectif
de faible grossissement (X 10) puis au grossissement (X 40) pour une bonne
visualisation de l'image. Le dernier grossissement est celui de l'objectif (X
100) à huile à immersion. Les cellules mères en division
seront photographiées à l'aide d'une camera digitale de marque
Panasonic, FS 4 LUMIX à 8.1 mégapixels.
2.5.3/ Etude de la fertilité pollinique
Les boutons floraux mûrs récoltés au stade
avant l'anthèse sont mis tout de suite dans du fixateur. La technique
utilisée pour étudier la fertilité pollinique a
été inspirée du protocole de Mertens et Hmnersmith 1998
cette technique est la coloration au bleu de coton.
Sur une lame on écrase les anthères pour
libérer le maximum de grains de pollen et on ajoute une petite goutte de
colorant et on recouvre d'une lamelle et on passe à l'observation au
microscope photonique. Les grains de pollen colorés uniformément
d'un bleu foncé sont considérés viables et fertiles alors
que ceux de formes et de tailles anormales et non colorés
uniformément sont considérés non viables et
stériles.
2.5.3.1/Le taux de fertilité
pollinique
TF = N/ (N+AN).
TF : taux de fertilité pollinique
N : nombres de grains de pollen normaux (fertiles). AN : nombres
de grain de pollen anormaux (stériles).
3/ Résultats
3.1 / Etude morphologique d'Ebenus pinnata Aiton
3.1.1/ Réalisation de l'herbier
Trois populations d'Ebenus pinnata ont
été étudiées : Aïn Skhun (Béjaïa),
Thikhervivine (Ighzer Amokrane) et Kerrata (à proximité de
l'entrée ouest du Tunnel). Des herbiers ont été
réalisés pour ces populations au stade plantules et au stade
pleine floraison (Figure 3).

Sahnoune M.
Fig. 6 : Herbier d'E. pinnata Aiton.
3.1.2/ Description de l'appareil
végétatif
· Type morphologique : Tous les
échantillons récoltés présentent une morphologie
d'herbacées annuelles monocarpiques (qui ne fleurissent et fructifient
qu'une seule fois dans la vie, puis meurent).
· Tige : La tige est dressée et
légèrement pubescente comporte entre 4 et 6 branches pour
l'échantillon 1, et entre 2 à 3 branches pour
l'échantillon 2.
· Feuilles : Les feuilles sont
imparipennées couvertes avec de très petites poiles ne
dépassant pas 1 mm, ces feuilles ont un limbe découpé en
folioles sous forme lancéolée, avec un nombre ne dépassant
jamais 7 folioles pour l'échantillon 2 (Kherrata), et en
générales avec 9 folioles pour l'échantillon 2 (Ain
Skhoun).
- Disposition des feuilles : La disposition
est en hélice, dont chaque
ramification comporte à sa base un nombre de stipules
selon le nombre de
pétioles de chaque feuille, chaque stipule avec deux
dents, (figure 7).

Fig. 7 : Stipules d'Ebenus pinnata
Aiton
· Racine
- Type de germination : Après
ensemencement des graines dans des pots, on a constaté que le type de
germination est épigé, car la semence est soulevée de
terre par la présence d'un hypocotyle.
- Type racinaire : La racine est pivotante pour
tous les échantillons récoltés d'E.pinnata
Aiton.
3.1.3/ Description de l'appareil reproducteur
· Inflorescence : - Indéfinie, sous
forme de panicule, dont chaque bractée comporte entre 2 à 3
fleurs.
- Nombre d'inflorescences est entre 7 à 13 pour
l'échantillon 1 (Kherrata), échantillon 1 (Thikhervivine) et
échantillon 2 celui de Ain Skhoun, et il est entre 1à 4 pour
l'échantillon 2 (Kherrata).
- Cette inflorescence est très pédonculées,
en panicule ovoïdes denses avec une taille de 20 à 35 mm de long et
de 18 mm de large, rendus très villeux par les poils du calice pour
l'échantillon 1 (Kherrata), échantillon 1 (Thikhervivine), par
contre l'échantillon 2 (Kherrta) est pédonculé en
panicule, avec une longueur de 18 mm ou
moins, et une largeur de 15 mm ou moins, rendu villeux par les
poiles du calice.
- Ces inflorescences naissent à partir des aisselles des
feuilles.
· Périanthe (ensembles des pièces
protectrices
- Calice : L'ensemble des sépales est
pentamères, ces 5 sépales sont plumeuses et soudées
(figure 8) avec divisions, et sont munies de cinq arêtes. Ce calice
mesure entre 10 et 15 mm pour tous échantillons sauf pour les plantules
car elles sont très jeunes (échantillon 1 de la route d'Amtik,
Saket), et échantillon 2 de Ain-Shkoun).

Fig. 8 : Vue intérieure (calice
renversé) des sépales qui sont plumeuses et soudés avec
divisions, munis d'arêtes, misent sur papier de 2 mm pour chaque carreau
(échantillon 2, Kherrata).
- Corolle : L'ensemble des pétales
est pentamère de couleur rose, avec 2 carènes soudées
mesurant 5 mm, recouverte par 2 ailes très courtes de 1.80 mm, et le
tout est recouvert par un étendard (vexillum) de 4 mm. Cette description
est une caractéristique de la famille des papilionacées.
- Bractée : Petite feuille concave
colorée en vert mesurant 9 mm, située à la base du
pédoncule floral placé du coté de la carène.
- Disposition du périanthe : Toutes
les pièces florales sont en alternance entre eux, les sépales
sont alternés avec les pétales, ces dernières sont
alternées avec les 5 grandes étamines, et ces étamines
sont alternées avec les 5 petites autres étamines.

Fig. 9 : Périanthe
d'E.pinnata Aiton (échantillon 1 de Thikervivine, avec la
bractée en bas de la figure, et deux
petites ailes collées
à la carène à gauche de la figure, et au milieu
l'étendard, et un calice à droit.
· Androcée (ensemble des
étamines
- Etamines diadelphes, avec 9 soudées dont 5
étamines sont grandes et 4 sont petites, et 1 petite étamine
libre (figures 10 et 11) se trouvant du coté de l'étendard.
- Anthère à 2 loges, avec une fixation
médifixe sur le filet, à déhiscence introrse (car la
déhiscence est ouverte sur la corolle).
Fig. 10 : Androcée d'une fleur
fermée d'E.pinnata Aiton démontrant les deux cycles
d'étamines et la difference de taille.
|
Fig. 11 : Androcée d'une fleur
âgée d'E.pinnata Aiton.
|
|
·

Gynécée (ensemble des
carpelles):
- L'ovaire est supère car il est libre au centre de la
fleur, et uniloculaire avec un seul
ovule, car la gousse ne donne qu'une
seule graine à placentation basale (figure 12).
|
Fig. 12 : Deux gousses déhiscentes
d'E.pinnata Aiton en haut de la figure donnant chacune une seule
graine en déchirant la gousse ou on poussant, mises sur papier de 2 mm
pour chaque carreau.
|
|
· Le fruit est sec déhiscent
présenté par une gousse velu monosperme (5 mm de long et de 3 mm
de largeur, (figure 12) qui était incluse dans le calice velu à
partir de la base, donnant des graines qui apparaissent sous forme ovoïde,
lisses de couleur jaune et beige, et d'une taille d'environ de 3 à 2 mm
de longueur et d'environ 1.5 à 2 mm de largeur (figures 13 et 14).
Fig. 13 : Graines vues sous loupe binoculaire
récoltées à Kherrata, avec un pourcentage moyen de graines
rugueuses et lisses pour l'échantillon 2
|
Fig. 14 : Graines récoltées
à Kherrata, avec un pourcentage très élevé de
graines lisses et grandes pour l'échantillon 1.
|
|

-Détermination du type de pollen et sa
forme
Notre résultat montre qu'Ebenus pinnata
Aiton, à un pollen ovoïde, issu d'une cellule mère qui
a donné une tétrade (figure 15), correspondant au type successive
de la formation des pollens, sachant que c'est une caractéristique des
monocotylédones.

Fig. 14 : C. mères en prophase
d'Ebenus pinnata Aiton Fig. 15 : Tétrades
d'Ebenus pinnata Aiton
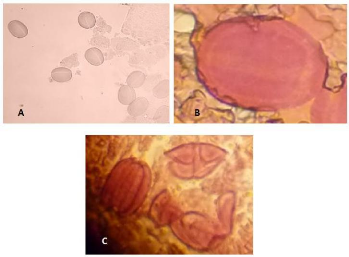
Fig. 16 : Les photos A,B,C représentent
le type de pollen d'Ebenus pinnata Aiton, qui est ovoïde, issue
des tétrade ; la photo A représente un grain de pollen
agrandit.
- Diagramme floral d'Ebenus pinnata Aiton et sa
formule:
Ebenus pinnata Aiton à des fleurs
pentamères complète et zygomorphe (car elle a une seul plan de
symétrie), et présente des alternances entre ces cycle avec une
préfloraison vexillaire.

Fig. 17 : Diagramme floral d'Ebenus
pinnata Aiton.

3.2/ Caractérisation caryologigue
3.2.1/ Etude mitotique
3.2.1.1/ Condition de la germination >
Ebenus pinnata Aiton
Dans les conditions optimum de température, qui est
comprise entre 23°C et 24°C, E.pinnata Aiton, a germé
au bout de 3 jours pour un certains nombre de graines et au bout de 7 jours
pour d'autres, ces graines correspondent au types fonctionnel
modéré (échantillon 1 de Kherrata). Ces résultats
concordent avec la température optimum de germination du type
fonctionnel permanant de la Lybie (Heghazi et al., 2008).
On a trouvé une difficulté pour la
détermination de la température optimum de germination pour les
graines du type fonctionnel éphémère (échantillon 2
celui de kherrata), car en variant la température entre 22°C
à 27°C, on n'a pas eu de germination, on pense que cela est
dû à l'intervalle de température qui ne comprenait pas la
température optimum.

Fig. 18 : Graines d'E.pinnta Aiton
après 48h de prégermination.
3.2.1.2/ Prétraitement :
Trois agents mitoclasiques (Tableau 3) on été
testés. Les conditions optimales d'obtention des plaques
métaphasiques ont été remplies grâce à la
colchicine. La 8 HydroxyQuinoleine à et le bromonaphtalène ne
semble pas être un bon agent mitoclasique pour notre matériel.
Tableau 3 : Mise au point de la technique
d'étude
Prétraitement
|
Durée
|
Résultat
|
Colchicine
|
1h15 pour E.pinnata
|
Trés bon étalement, et
individualisation des
chromosomes avec
condensation maximale.
|
Hydroxy quinoleine
|
2h pour E.pinnata
|
Séparation des chromosomes pour E.pinnata.
|
Bromonaphtalène
|
24 h pour E.pinnta
|
Pas de résultats satisfaisant
|
|
3.2.1.3/ Résultats des différents stades de
mitoses d'E.pinnta Aiton
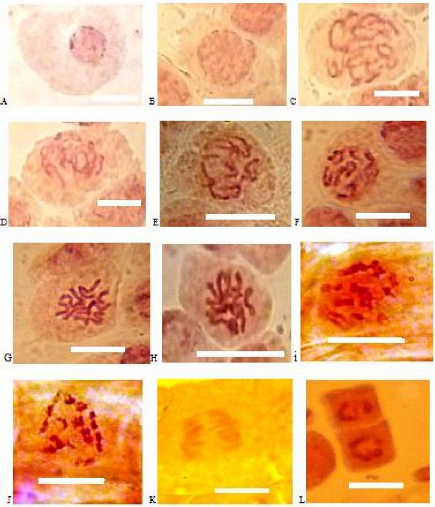
Fig. 19 : Les cellules A, B, C, D, E, F, G,
H, K,, et L sont obtenues sans prétraitement, mais juste avec hydrolyse
pendant 15 à 20min et une coloration à l'orcéine
lactopropionique pendant 5mn, au bain marie. Les figures I et J sont obtenues
avec prétraitement c'est la raison pour la quelle ils sont bien
séparés ; l'échelle est de 10um.

3.2.1.4/ Établissement du caryotype
B

A
Fig. 20 : Les phtos A, B représentent
une plaque métaphasique mitotique d'Ebenus pinnata Aiton
à 2n=14; la flèche représente un satellite ;
l'échelle est de 10um.
3.2.1.5/ Réalisation du caryogramme d'Ebenus
pinnata Aiton :
Tableau 4 : Données numóique de
la garniture chromosomique selon Levan et al.1964.
R = bl (um)/bc (um)
|
Type chromosomique
|
Abreviation
|
R= 0.16/0.15= 1.01
|
métacentrique
|
m
|
R= 0.11/0.11= 1
|
métacentrique
|
m
|
R= 0.13/0.13= 1
|
métacentrique
|
m
|
R= 0.15/0.14= 1.04
|
métacentrique
|
m
|
R= 0.095/0.091= 1.04
|
métacentrique
|
m
|
R= 0.073/0.071=1.03
|
métacentrique
|
m
|
R= 0.13/0.04= 3.25
|
submétacentrique
|
sm
|
|

Fig. 21 : Caryogramme d'Ebenus
pinnata Aiton
3.2.2/ Etude méiotique
L'analyse des plaques métaphasiques montrent un nombre
haploïde de n=7

Fig. 22 : Photos A, B, C, et D
représentent des plaques métaphasiques d'Ebenus pinnata
vue chez les cellules mères en méiose à n=7,
l'échelle est de 10 um.
3.2.1/ Etude de la fertilité
pollinique
L'analyse de la fertilité pollinique des boutons floraux
mûrs pour des échantillons Des résultats indiquent un taux
de fertilité important pour notre espèce.
Tableau 5 : Résultats obtenus avec le
type fonctionnel modéré.
|
Plaque 1
|
Plaque 2
|
Plaque 3
|
Plaque 4
|
Plaque 5
|
Grains de pollen fertiles
|
377
|
360
|
382
|
389
|
380
|
Grains de pollen non fertiles
|
27
|
18
|
15
|
10
|
11
|
Taux de fertilités
|
95%
|
95%
|
96%
|
97%
|
97%
|
|
3.3/ Etude morphologique de Genista ferox poiret
3.3.1/ Réalisation de l'herbier
L'herbier est une collection de plantes pressées et
séchées répertoriées en fonction de leur position
systématique, de leur distribution géographique ou par ordre
alphabétique, servant aux études botaniques. L'herbier permet de
reconnaître, de comparer et d'étudier la flore.

Fig. 23 : Herbier de G. ferox
3.3.2/ Description de l'appareil
végétatif
· Type morphologique : Genista
ferox poiret présente une morphologie d'arbuste ligneux.
· Tige : La tige est dressée et
glabre, comportant des ramules.
· Feuilles : Les feuilles sont
composées de folioles longuement ovoïdes. Ces feuilles sont
trifoliolées, et chaque foliole se termine par une pointe.
- Disposition des feuilles : La position est en
hélice dont la base de chaque pétiole est munie d'une stipule
avec deux dents.

Fig. 24 : Stipules de Genista ferox
poiret
· Racine
- Type de germination : Après
ensemencement des graines dans des pots, on a constaté que le type de
germination est épigé, car la semence est soulevé de terre
par la présence d'un hypocotyle.
- Type racinaire : La racine de Genista
ferox poiret est pivotante.
3.3.3 / Description de l'appareil reproducteur
· Inflorescence
- Indéfinie sous forme de grappe (figure 4).
- Les fleurs sont axillaires misent sur des ramules très
feuillés naissant des épines (figure 25).

Fig. 25: Ramules très feuillés
naissant des épines.
? Périanthe (ensembles des pièces
protectrices
- Calice : L'ensemble des sépales est
pentamères. Ce calice est presque glabre, caduc en entier sur la gousse
et soudé à la base avec deux lèvres, une supérieure
divisée en deux mesurant 8 mm et l'autre inferieure munis de trois dents
plus courtes mesurant 5 mm (figure 26).

Fig. 26 : Sépales soudés avec
deux lèvres, une supérieure avec 2 dents et l'autre inferieure
avec trois dents trés rapprochées, misent sur papier de 1 mm pour
chaque carreau.
- Corolle : L'ensemble des pétales
est pentamère de couleur jaune foncé, avec 2 carènes
soudées 10 mm de long et 3 mm de largeur, recouverte par 2 ailes de 10
mm de long, et le tout est recouvert par un étendard (vexillum) de 10 mm
de long, et 6 mm de largeur. Cette description est une caractéristique
de la famille des papilionacées.
- Bractée : Petite feuille,
située à la base du pédoncule floral placé du
coté de la carène (figure 27).

Fig. 27 : Bractée de G.ferox Poiret
(voir flèche).
- Disposition du périanthe : Toutes
les pièces florales sont en alternance entre eux, les sépales
sont alternés avec les pétales, ces dernières sont
alternées avec les 5 grandes étamines, et ces étamines
sont alternées avec les 5 petites autres étamines.

Fig. 28 : Périanthe de Genista ferox
poiret.
? Androcée (ensemble des
étamines)
- Etamines diadelphes, avec 10 soudées dont 5
étamines sont grandes et le reste sont petites.
- Anthère à 2 loges, avec une fixation
médifixe sur le filet, à déhiscence extrorse.

Fig. 29 : Androcée de Genista ferox
poiret démontrant les deux cycles d'étamines et la
difference de taille.
· Gynécée (ensemble des
carpelles)
- L'ovaire est supère car il est libre au centre de la
fleur, et monocarpellé avec plusieurs ovules, car la gousse donne
plusieurs graines à placentation pariétale (figure 30, A).

A B
Fig. 30 : Gousses de Genista ferox
poiret ssp salditana à position pariétale (photo A) et une
longueur de 60 mm (photo B) donnant beaucoup graines.
· Le fruit : Il est sec
déhiscent présenté par une gousse munie d'arête
légèrement poilu (figure 32) avec 60 mm de long et 3 mm de
largeur (figure 30, B), incluse dans le calice à partir de la base,
donnant des graines ovoïdes, lisses de couleur miel, marron foncé
et noir, et d'une taille comprise entre 1.8 à 2.4 mm de longueur et
entre 1,5 à 2 mm de largeurs (figure 31, B).

Fig. 31 : Graines de G.ferox poiret
(photo A et B)

Fig. 32 : Gousses munies d'arêtes de
G.ferox poiret
-Diagramme floral de Genista ferox poiret ssp
salditana et sa formule:
Ebenus pinnata Aiton à des fleurs
pentamères complète et zygomorphe (car elle a une seul plan de
symétrie), et présente des alternances entre ces cycles avec une
préfloraison vexillaire.

Fig. 33 : Diagramme floral de Genista
ferox Poiret.

-Détermination du type de pollen et sa forme
:
Nos résultats montrent que Genista ferox, est
issue d'une cellule mère qui donne une tétrade qui est une
caractéristique des monocotylédones, et chacune après
séparation donne des grains de pollen.
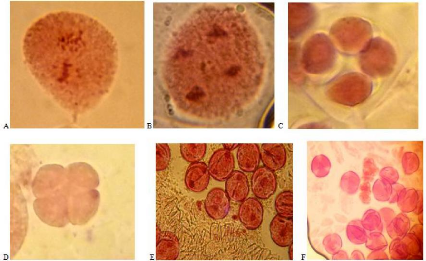
Fig. 34 : Photos A, B représentent les
cellules mères du type successif, photo C et D, montrent la formation
des tétrades et leur séparation, et les deux photos E et F montre
les grains de pollens, sachant que chaque tétrade donne 4 grains de
pollen.

Fig. 35 : Photo a et b montrent la formation
de deux types de tétrades.
3.4/ Carylogie de Genita ferox Poiret
3.4.1/ Etude des mitoses
3.4.1.1/ Condition de la germination >
Genista ferox poiret :
L'intervalle de température optimum pour
G.ferox Poiret est compris entre 25 et 27°C, la durée
minimum de germination est de 10 jours, et un maximum 15 jours pour la plupart
des graines germées.

Fig. 36 : Graines de G.ferox Aiton
après 48h de prégermination. Tableau 6 : Mise au
point de la technique d'étude des mitoses
|
Prétraitement
|
Durée
|
Résultat
|
|
Colchicine
|
2h pour G.ferox
|
Trés bon étalement, et individualisation
des
chromosomes avec condensation maximale.
|
|
Hydroxy quinoleine
|
6h pour G.ferox
|
Pas de résultats.
|
|
Bromonaphtalène
|
24 h pour G.ferox
|
Pas de résultats.
|
3.4.1.2/ Diffèrent stades mitotiques de
Genista ferox

Figure 37 : A,B,D,G, sont obtenues à
partir des divisions mitotique de la paroie de l'anthère, les figures
E,H et I repréentent des cellules obtenus à partir de
méristèmes racinaires, et les deux figures C et F
représentent des cellues obtenues à partir de
méristèmes collinaires.
3.4.1.3/ Plaque métaphasique de Genista
ferox Poiret (plaques métaphasiques)

Fig. 38 : Plaque métaphasique de
Genista ferox Poiret.
Fig. 39 : plaque métaphasique de
Genista ferox Poiret après traitement à la main ;
échelle =10um.
Le caryotype de Genista ferox est composé de
paires chromosomiques métacentriques, submétacentriques,
télocentrique et paires acrocentrique à
2n=4x=48.
3.4.2/ Etude des méioses
Sur les méioses, on a différents nombres qui sont
comptés : 16, 17, 14 et 21 ; Ces nombres correspondent probablement au
cytotype 24 bivalents où tous les bivalents ne sont pas visibles ou
à une coprésence de trivalents tétravalents (Fig. 37).

Fig. 40 : Méioses polliniques en
métaphase 1, chez G.ferox. Différents nombres sont
comptés: A : 16 ; B : 17 ; C : 14 et D : 21.
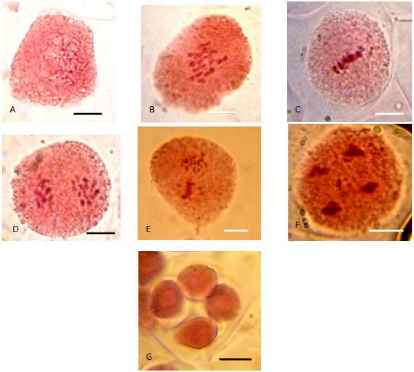
|
Fig. 42 : Grains de pollens fertiles et non
fertiles de G.ferox avec un grossissement de 8 x 1.25 x 40 x zoom
0.5m.
|
Fig. 41 : Les différents stades de la
méiose de la cellule mère de la prophase jusqu'à la
formation des tétrades. A : Prophase 1; B : Métaphase 1 vue de
face; C : Métaphase 2 vue de profile ; D : Télophase 1 ; E :
Métaphase 2 ; F : Télophase 2 ; G : Tétrades. La barre
d'échelle correspond à 10um.
3.4.3/ Etude de la fertilité pollinique
Tableau 7 : L'analyse de la fertilité
pollinique pour Genista ferox
|
Plaque 1
|
Plaque 2
|
Plaque 3
|
Plaque 4
|
Plaque 5
|
|
Nombres de grains de pollen fertiles
|
770
|
1254
|
780
|
771
|
1500
|
|
Nombres de grains de pollen non fertiles
|
18
|
37
|
15
|
22
|
52
|
|
Taux de fertilité
|
97%
|
97%
|
98%
|
97%
|
96%
|
4/ Discussion
4.1/ Caractérisation morphologique d'Ebenus
pinnata
Ebenus pinnata Aiton, comporte trois types fonctionnels
(Hegazy et al., 2008) :
Type fonctionnel éphémère
: ce type est monocarpique avec des individus de petites tailles à 1-3
branches produisant 1-5 inflorescence par individus.
Type fonctionnel modéré : ce
type est monocarpique avec des individus de tailles intermédiaires, avec
peu de branches de 4-10 branches produisant moins de 30 inflorescences par
individus.
Type fonctionnel permanant: ce type est
polycarpique avec des individus ayant des racines pérennes car elles
stockent des réserves, ce type possède de nombreuses branches de
grandes tailles qui produisent plus de 30 inflorescences par individus.
La description des échantillons récoltés
d'E.pinnata Aiton correspondent au type fonctionnel
éphémère pour l'échantillon 2 (Kherrata), et le
restes des échantillons (tableau 1), correspondent au Type fonctionnel
modéré.
Notre caractérisation morphologique
d'E.pinnata Aiton ne correspond pas à la description de
Quézel et Santa 1962, car nos échantillons présentent un
type d'herbacée annuelle et bisannuelle (Vaucher, 1841), alors
qu'E.pinnata Aiton selon la flore de Quézel et Santa, est
décrite comme étant vivace, ce qui laisse à penser que
cette caractéristique est celle du type fonctionnel permanant.
On a constaté aussi, que les graines de
l'échantillon 2 récoltées à Kherrata, qui
correspondent au type fonctionnel éphémère (figure 44),
ressemblent aux graines du type fonctionnel modéré
trouvées en Lybie (figure 43), et les graines de l'échantillon 1
récoltées à Kherrata de type fonctionnel
modéré (figure 46), ressemblent aux graines du type fonctionnel
permanant trouvées en Lybie (figure 45).

Fig. 43 : Graines du type fonctionnel
modéré Fig. 44 : Graines du type fonctionnel
éphémère
récoltées en Lybie, avec un pourcentage très
élevé récoltées à Kherrata, avec un
pourcentage moyen
de graines rugueuses (Hegazy et al., 2008) de graines
rugueuses et lisses.

Fig. 45 : Graines d'ETr11t11 du type
fonctionnel Fig. 46 : Graines du type fonctionnel
modéré récoltées à
permanant, avec un pourcentage très élevé de
graines Kherrata, avec un pourcentage très élevé de
graines
récoltées en Libye lisses et grandes (Hegazy et
1111, 2008) lisses et grandes
4.2/ Caractérisation carylogique d'Ebenus
pinnata
L'étude de la plaque métaphasique du caryotype
d'Ebenus TWn11t11 signale la présence de six paires
métacentriques, et une paire submétacentrique, et une
constriction secondaire avec un satellite (figure 47, e).
La formule chromosomique est la suivante :
2n=2x=14=6m+1sm.
Les constrictions secondaires peuvent jouer le rôle
d'organisateurs nucléolaires (NORs), c'est-à-dire qu'ils
contribuent à la reconstitution du nucléole qui restera visible
pendant toute l'interphase.

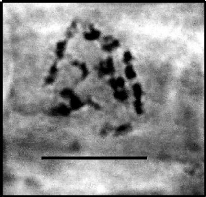
e
Fig. 47 : les photos a, b, c, d et e
représentent des plaques métaphasiques mitotique à 2n=14,
chez différentes espèces d'Ebenus ayant des
organisateurs nucléolaires et des satellites, et des constrictions
secondaires; a) : Ebenus plumosa var. plumosa, b) E.
plumosa var. speciosa, c) E. macrophylla, d) E.
barbigera (Aksoy et al., 2001) et e) E. pinnata Aiton avec
2n=14; l'échelle est de 10 um .
4.3/ Morphologie de Genista ferox
Notre description morphologique concorde avec la description
de Quezel et Santa 1962, ou on a pu determiner le taxon dont elle appartient
qui est Genista ferox Poiret ssp. salditana, qui correspond
aussi à la description de l'herbier de Montpelier : Genista
salditana (feroris) avec des fleurs toutes axillaires, eparses en petit
nombre sur de courts ramules très feuilles naissant des epines. Le
calice est à divisions un peu plus longues que le tube; les superieures
lanceolees; la lèvre inférieur plus longue divisée
jusqu'au tiers en dents subulées rapprochees. Les gousses sont finement
soyeuses argentees, lineaires (longues de 35mm sur 3), presque
droites fortement bossele à sommet medion aigu-lanceole. Les graines
sont ovoïdes comprimees, non echancrees. Les feuilles sont presque toutes
trifoliolees, à folioles pubescentes, d'abord soyeuses, les plus
inférieurs oblongues, les autres linéaires, insensiblement
elargies jusqu'auprès du sommet aigu, à bords plus ou moins
réfléchis ou enroules. Stipules spinuleuses, persistant sur le
coussinet foliaire. Épines peu robustes, simples, vulnérantes.
Rameaux de l'année très feuillés à la fin
terminés en épines, grfles, tubercules.
4.4/ Caryologie de Genista ferox
Le caryotype de Genista ferox ssp salditana est compose
de paires de chromosomes à 2n=4x=48.
Ce nombre à ete confirme par Tschechow, 1931 et Villa,
1980, pour Genista ifniensis qui est Genista ferox ssp.
microphylla.

Fig. 48 : Photo a presente la plaque
metaphasique de G.ferox Poiret ssp salditana, et la photo b presente la plaque
metaphasique de G.ferox Poiret ssp mirophylla ; l'échelle est de 5
ìm.
Conclusion
Les échantillons d'Ebenus pinnata
analysés sont tous de type fonctionnel modéré (bisannuel)
pour les populations d'Ighzer Amokrane et les populations de
Béjaïa. Pour la population de Kherrata elle est composée
d'un mélange du type fonctionnel modéré et du type
fonctionnel éphémère (annuel).
Sur les mitoses, nous avons pu compter 2n = 14 chromosomes et
sur les méioses sept bivalents bien individualisés confirmant
ainsi le comptage sur les mitoses. Ce comptage est probablement le premier
réalisé pour cette espèce puisque aucune
référence bibliographique n'en fait référence. Ce
2n=14 est aussi celui trouvé pour d'autres espèces du genre
Ebenus.
Les taux de fertilité pollinique évalués
pour nos échantillons d'Ebenus pinnata varient de 95 à
97% révélant ainsi une fertilité très
élevée.
L'identification de nos échantillons a
révélé que ceux-ci correspondent à Genista
ferox ssp. salditana. Aucun échantillon correspondant
à Genista ferox ssp. microphylla n'a été
observé.
Les chromosomes de nos échantillons difficiles à
séparer sont plutôt de petite taille. Sur les meilleurs
métaphases mitotiques des méristèmes racinaires et
caulinaires, le nombre de chromosome semble de 2n=48 (probablement un
tétraploïde avec x=12) comme celui rapporté pour Genista
ferox ssp. microphylla des populations de Sardaigne avec 2n=48
chromosomes de même taille que ceux que nous avons observés.
Sur les méioses au stade métaphase 1 nous avons
compté un nombre variable de paquets chromosomiques allant de 14
jusqu'à 21 suggérant un cytotype à 24 bivalents qui ne
sont pas tous visibles.
Les taux de fertilité pollinique que nous avons
évalués vont de 96 à 98% révélant ainsi une
très haute fertilité de nos échantillons infirmant ainsi
l'hypothese de formation de multivalents à la métaphase 1 de la
méiose pollinique. Ce cytotype 2n= 4x=48 serait donc
allotétraploïde ou autotétraploïde
diploïdisée.
En perspective nous comptons élargir cette étude
cytogénétique en plus d'échantillons de populations tout
en améliorant la qualité de nos préparations des
chromosomes au stade métaphase, en vue de réaliser des
caryogrammes et idiogrammes et aussi vérifier au hasard si il n'y a pas
une variabilité caryotypique.
Références
bibliographique
Abreu M., H. Braham , H. Jannet, Z. Mighri and Matthew S., 2007 -
Antioxidant compounds from Ebenus pinnata. Fitoterapia : vol 78, pp.
32-34.
Aksoy H., F. Ünal and Z. Aytaç, 2001 - Caryological
study on four endemic Ebenus L., Taxa (Leguminosae) in
Turkey. Caryologia, 54: 307-311.
Aytaç Z., F. Ünal and M. N. Pinar, 2000 -
Morphological,palinological and cytotaxonomical study of Ebenus
longipes Boiss. & Bal. and E. argentea Siehe ex
Bornm. (Leguminosae) fromTurkey. Israel J. Plant Sci., 48: 321-326.
Ayten ç., Açik L. and Aytaç Z.,2009 -
Biosystematics studies among Ebenus l. species based on morphological,
rapd-pcr and seed protein analyses in turkey; Pak. J. Bot., 41(5): 2477-2486,
2009.
Bisby F. A. and Nicholls K. W., 1977 - Effects of varying
character definitions on classifications of three Genisteae., Bot. J.
Linn., 74: 97-122.
Bôcher T. W. and Larsen K., 1958- Secondary polyploidy
and ecotypical differentiation in Sarothamnus scoparius., New Phytol.,
57(3): 311-317. CNRS. Tome 1, Pp 133- 137.
Casal M., 1987 - Post- fire dynamics of shrubland dominated by
Papilionaceae palnts. Ecol. Medit. 13(4): 87-98.
Cristofolini G. and L. F. Chiapella, 1977 -
Serological.Systematics of the Tribe Genisteae (Fabaceae).,
Taxon; 26(1): 43-56.
Cusma V. T., F. Chiapella L. and Kosovel V., 2009 -
Karyomorphology and systematics of the eastern taxa of Genista sect.
Spartioides and G. pulchella (Genisteae-Fabaceae),
caryologia, 62(2): 102-113.
Davis P. H. and I. C. Hedge, 1971, Floristic links between N. W.
Africa and S. W. Asia, Naturhistor. Mus. Wien 75.
Davis P. H., R. Mill and K. Tan, 1988 - Flora of Turkey and East
Aegean Islands, Supplement, Edinburgh University Press, Edinburgh, pp.
381-382.
De Candolle A. P., 1825 - Mémoires sur la famille des
légumineuses, chez A. Belin, Imprimeur - Libraire, Rue des Mathurins 5,
-J., N°.14, Ville de Lyon, Paris pp. 351- 353.
Drapiez P. A. J., 1835 - Encyclographie de règne
végétal accompagnée de monographies, Volume 4, n°
155, établissement encyclographique, rue de Flandre, Paris, pp. 18 (
www.books.google.dz).
Elvira L. M. and C. Hernando, 1989 - Inflamabilidad y energia de
las especies de sotobosque. Coleccion Monographias INIA 68. MAPA.
Farmer H. J. and J. E. S. Moore, 1905 - On the meiotic phase in
animals and plants.
Fennane M. et Ibn Tattou M. Ouyahya A. et El Oualidi J., 2007 -
Flore Pratique du Maroc Manuel de détermination des plantes.
Fernandes A. et Santos M. F., 1971 - Contribution à la
connaissance cytotaxinomique des Spermatophyta du Portugal. IV-
Leguminosae., Bot. Soc. Broteriana, 45(2a): 178- 219.
Fourcoy M., 1791, la médecine éclairée par
les sciences physiques, tom 1, n° 20, Buisson librairie, pp. 74.
Gallego M. F., Sanchez M. A. and Andres F. N., 1985 - Datos
cariologicas del algunas Genisteas supra-Mediterraneas., Lazaro, 8:
97-103.
Goldplatt., 1981 - Cytology and the phylogeny of
Leguminosae., in R.M Polhill & P.H. Raven, «Advances in
Legume systematics», Royal Bot. Garden, Kew, 427-488.
Hegazy A. K., H. F. Kabier, L. Boulos and O. S. Sharashy, 2010
- Functional traits and life history diversity of the North Africa endemic
Ebenus pinnata Aiton, Flora 205 (2010) 666-673.
Huber-Morath A., 1970 - Ebenus L. In: P. H. Davis (Ed.),
«Flora of Turkey and East Eagean Islands». Vol. 3, Edinburgh
University Press, Edinburgh, pp. 590-596.
Ildis et Louis S., 2004, Diversité structurale et
activité biologique des Albumines entomotoxiques de type 1b des graines
de légumineuses. Thèse de doctorat. Institut national des
sciences appliquées de Lyon. N° d'ordre 04 ISAL 012.
International Legume Database and Information Service, 2005 -
Genista ferox 02/03/2010, Jahier J., 1992 : Techniques de
cytogénétique végétale. INRA. Paris. Pp 57-67.
La cour L., 1935 - Technic for studying chromosome structure.,
Stain Technology, La cour L., 1941. Acetic-orcein, Stain technology, 16:
169.
Levan A., Fredga K. and A. A. Sandberg, 1964. Nomenclature for
centromeric position on chromosomes, Hereditas, 52: 201-220.
Lograda T., 2010 - Etude caryologique et phytochimique de six
espèces endémiques du genre Genista L. en
Algérie, pp. 76-78.
Lograda T., Chaker N., Chalchat J., Ramdani M., Silini H. and
Figueredo G., 2010 - Chemical Composition and AntimicrobialActivity of
Essential Oils of Genista ulicina and G. vepres, Natural
Product Communications, 5(5): 835-838.
Martins A., Wink M., TEI A., Brum-Bousquet M., Tillequin F. and
Rauter A., (2005) - A Phytochemical Study of the Quinolizidine Alkaloids.
Mazliak P., 1984 - Physiologie végétale, Nutrition
et Métabolisme, Hermann méridionales, tom Edition du C. N. R.S,
pp. 474-544.
Pardo C., Cubas P. and Tahiri H., 2004 - Molecular phylogeny
and systematics of Genista (Leguminosae) and related genera
based on nucleotide sequences of nrDNA (ITS region) and cpDNA (trnL- trnF
intergenic spacer)., Plant Systematics and evolution; 244(1-2): 93-119.
Polhill R. M., 1976.-Genisteae (Adans.) Bentham and
related (Leguminosae)., Bot. Syst. 1: 143-368.
Quézel P. et Santa S., 1962 - Nouvelle flore de
l'Algérie et des régions désertiques Méridionales,
pp. 474-544.
Sanudo A., 1974a. In I.O.P.B. chromosome number reports XLVI.,
Taxon, 23(5-6) : 801-802.
Sanudo A., 1979 - Chromosome variability in the Genisteae
(Adam.) Benth. (Leguminosae)., Webbia, 34: 363-408.
Spach E., 1834 - Histoire naturelle des végétaux
phanérogames, volume1, n° 10, Librairie Encyclopédique de
Roret, rue Hautefeuille, Paris, p. 204 (
www.books.google.dz).
Spach E., (1844-45). Revisio generis Genista., Ann. Sci.
Nat., 2(3): 102-279.
Thompson J. D., 2005 - Plant evolution in the Mediterranean,
Oxford University Press, New York, USA.
Tschechow W., 1931 - Karyologisch systematische Untersuchung der
Tribus Sophoreae, Podalyrieae.
Turner B.L., 1956 - Chromosome numbers in the Leguminosae
I., Amer. Journ. Bot., 43(8): 577-581, and Genisteae -Izv. Tomsk.
Otd. Gosud. Russk. Bot. Obsc. 3: 121-131.
Vaucher J. P. E., 1841 - Histoire physiologique des plantes
vasculaires d'Europe, Librairie de Marc Aurel, maison de librairie à
Valence, pp. 181.
Ventenat E. P., 1799 - Tableau du Règne
Végétal Selon La Méthode De Jussieu, vol. 3 Par de
l'imprimerie de J. Drisonnier Paris, p. 394.
Verlaque R., 1988 - Modalités de la speciation chez les
Genisteae, Actes del Simposi Internacional de Botànica Pius
Font i Quer, 2: 49-68.
Verlaque R., 1992 - Modalités de la spéciation chez
les Genisteae. Actes del Simposi Internacional de Botànica Pius
Font i Quer, 2: 49-68.
http://www.tela-botanica.org/page:herbiersinstitutbotamontpellier



