|

République Algérienne Démocratique
et Populaire
Ministère de l'Enseignement Supérieur et de la
Recherche Scientifique
Université Abou Bekr Belkaid
Tlemcen
Faculté des Sciences
Département de
Physique
MÉMOIRE
Pour l'obtention du diplôme
de
MASTER en Physique Médicale
Option : Radioprotection et
Imagerie Médicales
Sujet
Système de double calcul
dosimétrique
Réalisé par
DAHI el hadj
MEHERCHI
Lamia
Jury :
Mr Mustapha BENMOUNA Professeur
(université Tlemcen) Président
Mr Belkacem HATTALI Physicien médicale
(CAC d'Oran) Encadreur
Mr Bachir LIANI Professeur (université
Tlemcen) Examinateur
Mr Abdelkrim MERAD docteur(université
Tlemcen) Examinateur
Remerciement
Ce travail a été effectué au sein du
service de Radiothérapie de l'Etablissement Hospitalier Anti-Cancer EL
AMIR ABD EL KADAR d'Oran. Nous tenons à remercier le Professeur AIDE
(chef de service de radiothérapie) de nous avoir accueillies dans son
Service durant la réalisation de ce mémoire.
Nous exprimons à Messieurs le Professeur BENMOUNA Mustapha
responsable de la physique médicale, pour nous avoir
fait l'honneur d'être le rapporteur de notre travail de
thèse.
Voudrons remercier aussi les membres du jury, le Docteur MERAD
Abdelkrim maitre de conférences et le Professeur LIANI
Bachir pour avoir accepté d'examiner ce travail.
Nous tenons plus particulièrement à
témoigner toute notre reconnaissance à Monsieur Hattali Belgacem
physicien médical de l'établissement hospitalier contre le cancer
EL AMIR ABD EL KADAR d'Oran, qui a su nous encadrer et sans lequel ce travail
n'aurait jamais pu être réalisé. Nos remerciements les plus
sincères pour sa disponibilité, la patience avec laquelle il a
répondu à nos nombreuses questions, ses conseils et son aide.
Encore une fois, nos remerciements pour toute sa disponibilité et son
état réceptif.
Nous n'oublierons pas de remercier Monsieur BOUROUINA Mourad
(physicien médical). Nos remerciements pour tout le
temps qu'il a consacrés pour nous, pour sa gentillesse, sa
disponibilité et son aide le long de ce travail.
Nos remerciements vont également à tous les membres
de l'équipe de physique pour leur accueil chaleureux, leur amitié
et
leur bonne humeur constante.
Enfin, nous tenons à exprimer notre gratitude pour tous
ceux que nous n'avons pas cités et qui ont contribué de
prés ou de
loin à la réalisation de ce mémoire
età l'accomplissement de ce projet.
Table des matières
INTRODUCTION GENERALE 2
Chapitre I
INTERACTION RAYONNEMENT
MATIERE
INTRODUCTION 4
II. LES DIFFERENTS RAYONNEMENTS IONISANTS
4
II.1 Directement ionisants 4
II.2 Indirectement ionisants. 4
III. INTERACTION DES RAYONNEMENTS IONISANTS AVEC LA
MATIER 5
III.1 Rayonnements directement ionisants (Particules
chargées) 5
III.1.1 Caractéristique de l'interaction6
6
III.1.1.1 Pouvoir d'arrêt6 6
III.1.1.2 Pouvoir d'arrêt par collision
6
III.1.1.3 Pouvoir d'arret par freinage
6
III.1.1.4 Transfert d'énergie
linéaire(TEL) 6
III.1.1.5 Densité linéique
d'ionisation(DLI) 7
III.1.1.6 Le parcours 7
III.1.2 particules chargées
légères : électrons (négatons et positons)
8
III.1.2.1 Collision radiative, b«
?? 8
III.1.2.2 Collision dure (hard collision),
ab... 8
III.1.2.3 Collision molle (soft collision),
b»a 8
III.1.2.4 Cas particulier de positons
9
III.1.3 particules chargées lourdes (proton,
á) 10
III.2 Rayonnements indirectement ionisants (photons,
neutron) 10
III.2.1 Rayonnements électromagnétique
10
III.2.1.1 Section efficace 11
III.2.1.2 Coefficient linéique
d'atténuation 11
III.2.1.3 Couche de demi atténuation
11
III.2.1.4 Effet Thomson 12
III.2.1.5 Effet photoélectrique
12
III.2.1.6 Effet Compton 13
III.2.1.7 Effet de création de paires.
13
III.2.1.8 Importance relative des effets
photoélectrique, Compton, et de création de paires
III.2.2 Les neutrons 15
III.2.2.1 L'absorption 15
III.2.2.2 Transmutation :(n, p) ou (n, á)
15
III.2.2.3 Capture radiative -- (n, ã)
16
III.2.2.4 La fission 16
III.2.2.5 La diffusion 17
III.2.2.5.1 Diffusion élastique : (n, n)
17
III.2.2.5.2 Diffusion inélastique : (n,
nã) 17
Chapitre II
LES MOYENS DE LA RADIOTHERAPIE
CONFORMATIONNELLE
I. INTRODUCTION... 18
II.LARADIOTHERAPIEEXTERNE.. 18
III. RADIOTHERAPIE CONFORMATIONNELLE
18
III.1 LES ETAPES-CLES DE LA RADIOTHERAPIE
CONFORMATIONNELLE 19
III.1.1 Acquisition des images 3D 19
III.1.1.1 Installation du patient 19
III.1.1.1.1 Objectifs et contraintes
(problématique) 20
III.1.1.1.2 Objectifs 20
III.1.1.1.3 Les moyens de contention...
20
III.1.1.2 Lasers 21
III.1.1.3 Le scanner 21
III.1.1.3.1 Production des rayons X
22
III.1.1.3.1.1 Générateur
22
III.1.1.3.1.2 Tubes à rayons X
22
III.1.1.3.1.3 Détecteurs 23
III.1.1.3.1.4 Filtrage et collimation
24
III.1.2 La planification de traitement (TPS)
25
III.1.2.1 Définition des volumes ciblent
25
III.1.2.1.1 Le volume tumoral GTV 26
III.1.2.1.2 Le volume clinique ou CTV
26
III.1.2.1.3 Le volume planifié ou PTV
26
III.1.2.1.4 Volume traité TV
26
III.1.2.1.5 Volume irradié IV
26
III.1.2.1.6 Les organes à risques
26
III.1.2.2 Prescription de la dose 27
III.1.2.2.1 Dose totale 27
III.1.2.2.2 Etalement 28
III.1.2.2.3 Fractionnement 28
III.1.2.3 Simulation virtuelle et dosimétrie
informatisée 28
III.1.2.3.1 Simulation du traitement
28
III.1.2.3.2 Dosimétrie prévisionnelle
29
III.1.3 Les accélérateurs
linéaires (L'exécution du traitement) 29
III.1.3.1 Système d'injection
29
III.1.3.1.1 Le pistolet d'électrons
29
III.1.3.1.2 L'injecteur 29
III.1.3.2 Système de génération
des radiofréquences(RF) 30
III.1.3.2.3 La source 30
III.1.3.2.4 Le modulateur 30
III.1.3.2.5 Guide d'onde 30
III.1.3.3 La cible 30
III.1.3.4 Système de collimation
31
III.1.3.4.1 Le collimateur primaire
31
III.1.3.4.2 Le cône égalisateur
31
III.1.3.4.3 La chambre d'ionisation monitrice
32
III.1.3.4.4 Le collimateur secondaire
32
III.1.3.4.5 Collimateur mutilâmes(MLC)
33
III.1.3.5 L'imagerie portale 33
III.2 ROLE DES DIFFERENTS ACTEURS 35
III.2.1 Identification des acteurs
35
III.2.1.1 Le radiothérapeute
36
III.2.1.2 Le physicien médicale
36
III.2.1.3 Le manipulateur en électroradiologie
36
III.2.1.4 L'ingénieur biomédical
36
III.2.1.5 Les fournisseurs 36
Chapitre III
PARAMETRES
DOSIMETRIQUES
I. INTRODUCTION 37
II. LES QUANTITES ET LES UNITES DES RADIATIONS
37
II.1.1 Transport de l'énergie
37
II.1.1.1 Le flux particulaire 37
II.1.1.2 Le flux énergétique
37
II.1.1.3 Fluence particulaire 37
II.1.1.4 Débit de fluence particulaire
37
II.1.1.5 Fluence énergétique.
38
II.1.1.6 Débit de fluence
énergétique 38
II.1.1.7 Radiance particulaire 38
II.1.1.8 Radiance énergétique
38
II.2.2Conversion de l'énergie
38
II.2.2.1 Kerma 39
II.2.2.2 Débit de kerma 39
II.2.2.3 Kerma dans l'air 39
II.2.2.4 L'exposition 40
II.2.2.5 Débit d'exposition
41
II.2.2.6 CEMA 41
II.2.2.7 Débit de CEMA 41
II.2.3 Déposition de l'énergie...
41
II.2.3.1 L'énergie impartie
42
II.2.3.2 L'énergie déposée
42
II.2.3.3 La dose absorbée 42
II.2.3.4 Le débit de la dose absorbée
42
II.2.3.5 Dose à une petite masse de milieu
dans l'air 43
III. LES PARAMETRES UTILISES POUR LE CALCUL DE LA
DOSE 45
III.1 Le champ équivalent 45
III.2 La loi de l'inverse carré de la distance
46
III.3 Pénétration d'un faisceau de
photons dans un fantôme ou un patient 47
III.3.1 La dose à la surface
48
III.3.2La région de build up
48
III.3.3 La profondeur de la dose maximale
48
III.3.4 La dose à la sortie
49
III.4 Facteur de collimateur 49
III.5 Le facteur de diffusions au pic.
50
III.6 Le facteur de diffusions au pic
normalisé 50
III.7 Facteur de dose relatif 51
III.8 Le rendement en profondeur...
51
III.9 La fonction de diffusion 52
III.10 Le rapport tissu-air 52
III.11 Rapport diffusé air 53
III.12 Rapport tissu-fantôme et le rapport
tissu-maximum 53
III.13 Rapport diffusion -maximum 55
III.14 Rapport hors-axe 55
III.15 Le profil de dose 55
III.5.1 La région centrale 56
III.5.2 La pénombre (pénombre physique)
56
III.5.3 L'ombre 56
III.5.4 La planéité de faisceau
57
III.5.5 La symétrie 57
III.5.6 La distribution de l'isodose dans un
fantôme d'eau 57
III.5.7 La distribution de l'isodose dans le patient
58
III.5.7.1 Algorithmes basés sur la correction
58
III.5.7.2 Correction des contours irréguliers
et de l'incidence oblique du faisceau 59
III.5.7.3 Correction par des différentes
méthodes de calcules 59
III.5.7.3.1 Méthodes de SSD effective
59
III.5.7.3.2 Méthode du TAR ou TMR
60
III.5.7.3.3 Méthode de déplacement de
l'isodose 60
III.5.7.3.4 Compensation par l'utilisation des
filtres en coints et les bolus 60
III.5.7.3.5 Corrections
d'inhomogénéités 60
III.5.7.3.6 Algorithmes basés sur les
modélisations 61
IV. CALCULE DES UNITES MONITEURS 61
IV.1 méthode de TPR 62
IV.2 méthode de TAR 62
Chapitre IV
LE LOGICIEL SDCD
I. MATERIEL UTILISE 63
I.1 MEPHYSTO mc2 63
I.2 Fantôme d'eau 64
I.3 Chambre d'ionisation 65
II LES DONNEES REQUISES 66
II.1 Les données générales
66
II.2 Les données à scanner
66
II.3 Les données non scannées
67
III. ARCHITECTURE GENERALE 67
III.1 sources de données (data source)
68
III.1.1 L'identification de la machine
68
III.1.2 Les données générales
69
III.1.3 Les données physiques
70
III.2 dosimétrie (dosimetry)
71
III.2.1 L'identification du patient
71
III.2.2 Donné démographique
73
III.2.3 Paramètres de faisceau
73
III.2.4 résultat finale 76
IV COMPARAISON DES RESULTATS 76
Conclusion 78
Annexes... 79
Bibliographie 82
INTRODUCTION GENERALE :
Le traitement des cancers par rayonnements ionisants ou
radiothérapie a un peu plus d'un siècle. Dans son histoire, la
radiothérapie a connu de nombreuses évolutions car elle s'est
toujours enrichie des avancées scientifiques relevant de la physique
théorique, de la médecine, des sciences de l'ingénierie et
maintenant de l'informatique.
La planification de traitement en radiothérapie est un
processus complexe ; il a plusieurs étapes qui représentent des
risques potentiels, comme il nécessite de multiple sources de
données et des informations concernant le patient et l'équipement
de traitement, et l'interaction de multiples professionnels en
radiothérapie tel que les médecins, les physiciens et les
techniciens.
Le calcule dosimétrique réalisé au cours
de la planification de traitement diffère d'un logiciel à l'autre
selon les protocoles de calcule, les algorithmes utilisées, et les
paramètres de traitement introduits.
Il est important de s'assurer que la dose calculée par
le logiciel de planification de traitement correspond à la dose
mesurée, dans toutes les conditions géométriques du
faisceau d'irradiation.
A cause des erreurs potentielles qui peuvent conduire soit
à un sous dosage qui résulte des récidive tumorale ou un
surdosage qui peut générer des complications sanitaires
après le traitement, une vérification de la dose à
délivrer par un deuxième système de calcul pour chaque
faisceau avant le traitement est recommandé.
Le système de double calcule dosimétrique est un
logiciel secondaire permettant un calcule dosimétrique plus simple qui
utilise les mêmes conditions et les mêmes données que le
principale mais des différents protocoles et différents
algorithmes ; son intérêt est de pouvoir mettre en évidence
une erreur de calcul dans certaines conditions d'irradiation. Il est
indispensable d'établir des critères de comparaison et de
tolérance propres aux logiciels que l'on utilise.
Le présent mémoire est subdivisé en
quatre chapitres. Dans le chapitre I, nous avons donné une description
générale sur les rayonnements ionisants et leurs interactions
avec la matière. Le second chapitre est consacré à
l'organisation et les moyens de la radiothérapie conformationnelle.
Dans le troisième chapitre nous avons défini les
quantités, les unités, et les paramètres
dosimétriques les plus utilisées pour décrire un faisceau
d'irradiation. Une description générale de notre logiciel est
représentée dans le chapitre IV avec une comparaison des
résultats avec le système de planification de traitement. Enfin,
nous avons terminé avec la conclusion et les perspective concernant
notre travaille.
CHAPITRE I
interactions rayonnement matiere
I. INTRODUCTION :
D'une manière générale, on peut
définir un rayonnement ou radiation comme un mode de propagation de
l'énergie dans l'espace, sous forme d'ondes
électromagnétiques ou de particules. Les rayonnements ne peuvent
être détectés et caractérisés que grâce
à leurs interactions avec la matière dans laquelle ils se
propagent. Ils peuvent céder au milieu qu'ils traversent, la
totalité ou une partie de leur énergie au cours de ces
interactions.
Un rayonnement est dit ionisant quand il est susceptible
d'arracher des électrons à la matière. Une
définition plus exhaustive est donnée : « un rayonnement
ionisant est un transport d'énergie sous la forme des particules ou
d'ondes électromagnétiques d'une longueur d'ondes
inférieure ou égale à 100 nanomètres, soit d'une
fréquence supérieure ou égale à 3x1015
hertz, pouvant produire des ions directement ou indirectement.».
L'équivalent en énergie correspond à 12,4 eV. Parmi ces
rayonnements, on distingue ceux qui sont directement ionisants, particules
chargées, de ceux qui sont dits indirectement ionisants car
n'étant pas chargés.
II LES DIFFERENTS RAYONNEMENTS IONISANTS:
II.1 Directement ionisants :
Ils Comprennent les particules chargées
légères (les électrons), et les particules chargées
lourdes(les protons, les particules a, et les ions lourdes) qui déposent
l'énergie au milieu par une seule étape, par le processus
d'interaction coulombienne entre la particule incidente et les électrons
orbitales [1].
II.2 Indirectement ionisants :
Ils Comprennent les neutrons et les rayonnements
électromagnétiques (photons X, et ã) qui déposent
l'énergie au milieu par deux étapes [1]:
- Au premier temps une particule chargée est
libérée dans le milieu absorbant (le photon libère un
électron ou une paire électron/positon, et le neutron
libère un proton ou un noyau de recule).
- Dans la deuxième étape les particules
libérées déposent l'énergie au milieu absorbant par
des interactions colombiennes avec les électrons orbitales des
atomes.
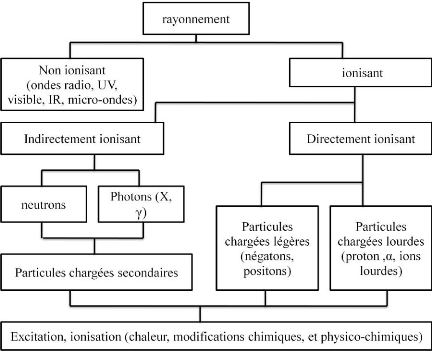
Figure 1.1: les différents types de
rayonnements.
III INTERACTION DES RAYONNEMENTS IONISANTS AVEC LA
MATIERE :
III.1 Rayonnements directement ionisants (Particules
chargées) :
Une particule chargée pénétrante dans un
milieu, interagit par la force coulombienne, avec les noyaux ou les
électrons orbitaux des atomes cibles.
Quelque soit le mécanisme d'interaction entre les
particules chargées et la matière, il y a transfert progressif
d'énergie et ralentissement des particules incidente [2].

III.1.1 Caractéristiques de l'interaction:
III.1.1.1 Pouvoir d'arrêt :
Le pouvoir d'arrêt S est la perte moyenne d'énergie
de la particule par distance parcourue, mesurée par exemple en
KeV.ìm-1.
??= ???? + ???? (1.1)
III.1.1.2 Pouvoir d'arrêt par collision :
Le pouvoir d'arrêt par freinage est définit comme
la perte de l'énergie cinétique de la particule chargée
incident par le processus collision avec les électrons atomique le long
de son parcours [2].
~????
???? = (1.2)
LI??
?Ef : L'énergie cinétique perdue lors de collision
avec les électrons atomiques. ?X : la longueur du parcours de la
particule incidente dans la matière.
III.1.1.3 Pouvoir d'arrêt par freinage :
Le pouvoir d'arrêt par freinage est définit comme la
perte de l'énergie cinétique de la particule chargée
incident par le processus de freinage (radiation) le long de son parcours.
l????
???? = (1.3)
~??
?Ef : L'énergie cinétique perdue lors de
l'émission par freinage.
?X : la longueur du parcours de la particule incidente dans la
matière.
III.1.1.4 Transfert d'énergie
linéaire(TEL) :
On appelle Transfert d'énergie linéaire : la
quantité d'énergie transférée au milieu cible par
la particule incidente,par le processus de collision, par unité de
longueur de parcours. Le TEL s'exprime en KeV.ìm-1 [3].
?????? = ???? (1.4)
III.1.1.5 Densité linéique
d'ionisation(DLI) :
On définit la densité linéique
d'ionisation comme le nombre d'ionisations produit par une particule incidente,
par unité de longueur de trajectoire. La DLI s'exprime en (paires
d'ion).ìm-1 [3].
??????
?????? = (1.5)
????
Wi est l'énergie moyenne transférée pour
chaque ionisation. III.1.1.6 Le parcours :
Les électrons ont une trajectoire très sinueuse :
en effet, on observe généralement une déviation lors de
chaque mode d'interaction (ionisation, excitation, freinage).
Certains peuvent méme subir une déviation de 180?
(phénomène de rétrodiffusion).
Pour caractériser la trajectoire d`électrons ou de
rayonnements électroniques, deux grandeurs peuvent être
définies [4].
- le parcours : il s'agit de la longueur réelle de la
trajectoire de l'électron. Cette grandeur est peu utilisée en
radioprotection.
- la portée : elle représente la profondeur
maximale atteinte par un faisceau d'électrons dans un milieu
considéré. Cette grandeur est très utilisée en
radioprotection lors de la conception d'écran.
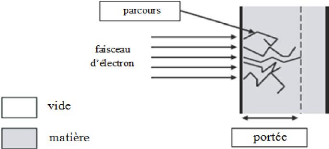
Figure 1.2: parcours et portée d'un faisceau
d'électron.
III.1.2 particules chargées légères :
électrons (négatons et positons) :
Les électrons en mouvement rapides sont obtenus par :
- l'émission â des radioéléments
- des accélérateurs d'électrons
- la projection d'électrons secondaires par des photons X
ou ã.
Leur énergie cinétique, Ec, se situe entre quelques
keV et quelques MeV.
Les interactions des électrons peuvent être
divisées selon le rayon de l'atome cible (a) et la distance entre la
particule incidente et le noyau (b) de cet atome en 3 catégorie :
Collision radiative, Collision dure, Collision mou [2].
III.1.2.1 Collision radiative, b« ?? :
L'électron interagit avec le noyau de l'atome cible est
subit soit une diffusion élastique ou inélastique,
accompagnée d'un changement de sa direction.
La majorité de ces interactions sont élastiques ;
où l'électron ne perd qu'une quantité d'énergie
cinétique insignifiante.
Cependant un faible pourcentage de ces interactions est
inélastique, où la perte d'énergie III.1.2.2
Collision dure (hard collision), ab :
Les électrons peuvent avoir des interactions colombiennes
directes aves les électrons orbitaux. L'énergie
communiquée a ces électrons leur permet soit :
- De les déplacer de leur niveau à un niveau
supérieur (excitation).
- Ou de s'éjecter avec une énergie cinétique
(ionisation).
Le nombre de collisions dures est généralement
faible, mais l'énergie transférée associée a cette
collision est relativement importante (50% de l'énergie cinétique
d'électron incident).
III.1.2.3 Collision molle (soft collision), b»a
:
L'électron incident est affecté par la force
coulombienne de l'atome entier. L'énergie transférée aux
électrons orbitaux est très faible. Cependant le nombre de
collisions mous est généralement important.
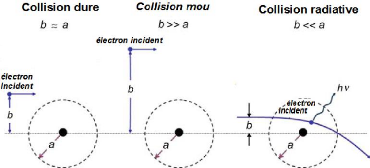
Figure1.3: Les différentes collisions des
particules chargées légères (électrons/positons)
avec la matière.
III.1.2.4 Cas particulier de positons :
L'interaction d'un positon dans la matière commence par
une phase de ralentissement très rapide (3 à 6 picosecondes) au
cours de laquelle, il perd son énergie par les mêmes processus que
l'électron et se comporte de façon similaire.
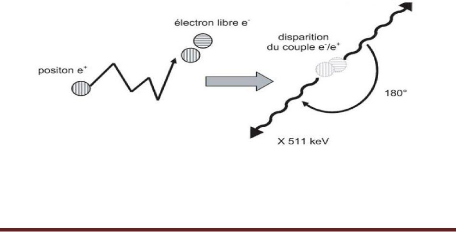
Figure1. 4: le phénomène
d'annihilation.
Une fois thermalisé (énergie cinétique de
quelques 10-2eV), le positon continue sa pénétration dans la
matière par une phase de diffusion ; au cours de laquelle il passe la
plupart du temps dans les régions interatomiques où il est
repoussé par le potentiel positif des noyaux. En fin de diffusion, au
bout de quelques centaines de picosecondes, il s'annihile avec un
électron libre du milieu (la paire électron-positon
disparaît). L'énergie correspondante, soit 1,022MeV
(2me.c2), apparaît sous forme de deux photons,
émis dans des directions opposées et emportant chacun une
énergie de 511keV [5].
III.1.3 particules chargées lourdes (proton,
á) :
Une particule chargée lourde (la masse d'un proton est
environ 1840 fois plus grande que celle d'un électron) ;
pénétrant dans un milieu, interagit avec les atomes du milieu et
se ralentit. La force d'interaction dominante est la force coulombienne entre
la particule incidente, chargée positivement, et les électrons
atomiques, chargés négativement. Les interactions avec les
noyaux, que ce soit par l'intermédiaire des forces coulombiennes ou des
forces nucléaires, sont exceptionnelles (environ 10 fois moins
fréquentes qu'avec les électrons) et peuvent être
négligées dans le processus de ralentissement. On distingue alors
trois processus d'interaction majoritaires:
-Si l'interaction est assez intense, le transfert
d'énergie peut être suffisant pour arracher un électron de
l'atome auquel il était lié : c'est le phénomène
d'ionisation. Il y a création d'une paire d'ions (ion positif et
électron) dans le milieu.
-Si l'interaction est insuffisante pour créer une
ionisation, il y a seulement excitation : l'électron change
d'état quantique, l'excitation le fait passer d'un état initial,
d'énergie de liaison E0, à un état final moins lié,
d'énergie E1.
-Un troisième type de processus concerne la capture
électronique au cours de laquelle le projectile capture, sur une de ses
orbitales externes, un électron de l'atome cible.
En conséquence, les particules chargées lourdes,
étant beaucoup plus lourdes, elles ne sont pas sujettes au rayonnement
de freinage. Les transferts d'énergie sont importants et la trajectoire
est approximativement rectiligne.
Dans l'eau, le TLE est à peu prés de 150
keV.ìm-1, DLI de 4500 paire d'ions.ìm-1. La longueur des
trajectoires, est presque égale à la profondeur de
pénétration. Cette profondeur ne dépasse pas quelques cm
dans l'air et quelques dizaines de ìm dans l'eau [2].
III.2 Rayonnements indirectement ionisants (photons,
neutron) :
III.2.1 Rayonnements électromagnétique:
L'atténuation d'un faisceau de photons par la
matière homogène est un phénomène qui est la
conséquence de plusieurs types d'interactions physiques
élémentaires qui conduisent soit à un
changement de direction du faisceau de photons (diffusion), soit
à un transfert d'une partie de leur énergie à la
matière (absorption totale ou partielle) [5].
III.2.1.1 Section efficace :
Du fait de la neutralité électrique du photon, son
interaction avec la matière est un phénomène
aléatoire dont la probabilité est proportionnelle à
l`épaisseur de la matière traversée.
La probabilité d'une interaction entre un photon et un
atome (ou l'un de ses électrons) est donnée par la section
efficace ó, rapport entre le nombre d'interactions par seconde et le
nombre de photons incidents par unité de surface et par seconde. La
section efficace ó a donc la dimension d'une surface.
Dans la pratique de la physique atomique, on exprime
généralement les sections efficaces au moyen d'une unité
de surface mieux adaptée à cette échelle, le barn (b). Par
définition, 1 barn vaut 10_28m2[5].
III.2.1.2 Coefficient linéique
d'atténuation:
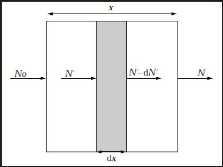
Figure1. 5: l'atténuation d'un faisceau de
photons dans la
matière.
La probabilité d'interaction ì d'un photon par
unité de longueur est appelée coefficient linéique
d'atténuation.
C'est le produit de la section efficace ó par la
densité atomique n (nombre d'atomes par unité de volume) :
ì = nó =
dN` . (1.6)
N`.d'
Le coefficient linéique d'atténuation a la
dimension de l'inverse d'une longueur; l'intégration de cette relation
conduit à une loi exponentielle décroissante liant
l'intensité du faisceau de photons émergeant du milieu sans y
avoir interagi à l'épaisseur traversée x :
N= N0e_'t' (1.7)
III.2.1.3 Couche de demi atténuation :
Le coefficient linéique d'atténuation est
inversement proportionnel à une grandeur appelée couche de
demi-atténuation (CDA), qui est l'épaisseur de matériau
nécessaire pour atténuer la
moitié des photons incidents. En effet, en écrivant
N0 2 = N0e_uCDA , il vient immédiatement:
1n2
't = CDA (1.8)
III.2.1.4 Effet THOMSON :
La diffusion d'un photon de faible énergie s'effectue sur
un électron, assez fortement lié à l'atome pour que se
soit l'ensemble de l'atome qui absorbe le recul.
Le transfert d'énergie à l'atome est alors
négligeable : le photon est diffusé sans perte
d'énergie.
III.2.1.5 Effet photoélectrique :
C'est un phénomène d'absorption totale. Le photon
incident disparait après avoir donné toute son énergie
à un électron d'un atome du milieu.
L'électron éjecté emporte une énergie
cinétique ???? égale à la differance entre
l'énergie ?????? du photon incident et son énergie de liaison
W.
???? = ?????? - ?? (1.9)
A la suite de l'expulsion de l'électron par effet
photoélectrique, il ya réarrangement électronique avec
émission de photons de fluorescence
- Soit de photon X pour les atomes lourd
- Soit de photons ultra-violets pour les atomes légers.
Le photon de fluorescence peut à son tour expulser un
deuxième électron de l'atome ; dans ce cas on dit qu'il s'agit
d'un électron Auger.
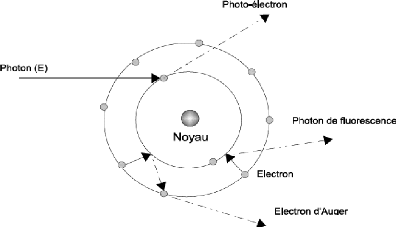
Figure1. 6: l'effet
photoélectrique.
III.2.1.6 Effet COMPTON :
La diffusion Compton correspond à un choc entre un
photon hí et un électron de valence faiblement lié. Le
photon est alors diffusé avec une énergie inférieure
à son énergie incidente h??0 (avec ??0< ??). L'électron
dit de recul est éjecté avec une énergie cinétique
Ecin complémentaire de l'énergie du photon diffusé (h?? =
h??0+Ecin) et un angle Ö. Get électron de recul peut provoquer des
ionisations ultérieures. L'angle de diffusion de l'électron de
recul peut être calculé à l'aide de la formule suivante
:
??
L?? = (1 - ????????) (1.10)
??????
Où Lë est la différence de longueur d'onde
entre le photon incident et le photon diffusé, me est la
masse de l'électron.
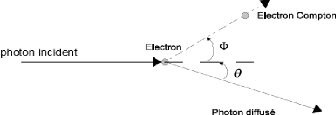
Figure1.7: effet Compton.
III.2.1.7 Effet de création de paires :
Dans le champ électrique intense qui règne au
voisinage du noyau, le photon peut se matérialiser sous forme d'un
électron et d'un positon. Une énergie supérieure à
1,022MeV, correspondante à leurs masses, est dépensée pour
créer l'électron et le positon. L'excédent
d'énergie se répartit, sous forme d'énergie
cinétique, entre les deux particules.
???? = ???? - 2???? (1.11)
L'électron et le positon sont ensuite ralentis dans la
matière par suite de collisions. Lorsqu'il est suffisamment lent, le
positon rencontre un électron du milieu et les deux particules
s'annihilent en émettant deux photons de 0,51 MeV.
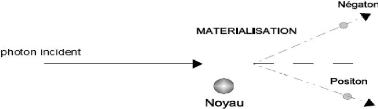
Figure1.8: le processus de création de
paires.
III.2.1.8 Importance relative des effets
photoélectrique, Compton, et de création de paires :
On peut en fonction du numéro atomique du milieu et de
l'énergie du rayonnement électromagnétique définir
trois zones de prépondérance pour chacune des trois interactions
fondamentales [1].
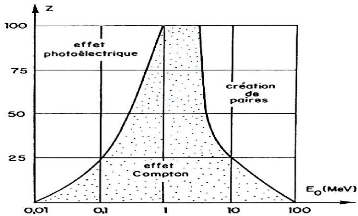
Figure 1.9: limportance relative des trois effets
en fonction de l'énergie
hõ du photon et du numéro
atomique Z du milieu.
L'effet photoélectrique est dominant à basse
énergie. Dans les matériaux lourds, il cesse de l'être
à partir de 500 KeV.
A haute énergie, c'est l'effet de production de paire qui
est prédominant, il commence à le devenir à partir de 5
MeV dans les matériaux de Z élevé.
Entre les deux, se situe un domaine où c'est l'effet
Compton qui domine. Pour les milieux de faible Z (carbone, air, eau, tissus
humains), ce domaine est extrêmement large (de 20 KeV à 3
MeV).
III.2.2 Les neutrons:
Les neutrons présentent peu d'intérêt en
radiothérapie, sauf dans le domaine de la recherche. Par contre ces
particules posent de nombreux et difficiles problèmes de radioprotection
(centre de production d'électricité nucléaire, bombe
thermonucléaire à neutrons).
Les neutrons sont généralement classés en
fonction de leur énergie.
Les neutrons rapides: Ecin> 0.8 MeV.
Les neutrons épithermiques: 1 eV < Ecin< 0.8 MeV
Les neutrons thermiques: Ecin< 1eV
En raison de leur charge nulle, les neutrons ont une
interaction négligeable avec les électrons ; Leur énergie
cinétique est absorbée par les interactions avec les noyaux. Ces
interactions se divisent en deux catégories : celles qui entrainent la
disparition du neutron, que l'on nomme absorptions et celles qui ne contribuent
qu'à diminuer l'énergie du neutron que l'on nomme diffusions [5]
[6].
III.2.2.1 L'absorption :
Au cours de laquelle le neutron disparaît ; ce processus
est dominant pour les neutrons lents ou thermiques (<0,5 eV).
L'absorption neutronique se fait par la transmutation, la capture
radiative ou la fission. III.2.2.2 Transmutation : (n, p) ou (n,
á) :
Un noyau peut absorber un neutron pour former un noyau
composé qui se désexcitera en émettant une particule
chargée : un proton ou une particule alpha. Un noyau différent
est produit par cette réaction nommée transmutation. La
transmutation est la transformation d'un élément en un autre, par
réaction nucléaire.

Figure 1.10: la transmutation.
III.2.2.3 Capture radiative -- (n, ã):
C'est la réaction nucléaire la plus courante. Le
noyau composé ainsi formé, après une brève
durée de vie, émet un rayonnement gamma. En d'autres termes, le
noyau produit est un isotope du noyau cible.
Exemples
La capture radiative la plus simple est l'absorption d'un neutron
par un noyau d'hydrogène pour former du deutérium (ou
hydrogène lourd).
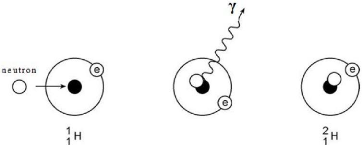
Figure 1.11: capture radiative.
Le deutérium formé est un noyau stable. Toutefois,
plusieurs noyaux produits par la capture radiative sont radioactifs et
émettent des bêtas et des gammas.
III.2.2.4 La fission :
Les réactions de fissions sont généralement
induites par des neutrons sur certains noyaux lourds :
L'absorption du neutron provoque une excitation de tous les
nucléons.
Le noyau se déforme et se scinde en 2 fragments de
fission.
Deux ou trois neutrons sont émis simultanément et
instantanément à la fission, on parle de neutrons prompts de
fission (neutrons rapides).
Remarque :
Les neutrons obtenus peuvent induire à leur tour de
nouvelles fissions (réaction en chaîne).
III.2.2.5 La diffusion :
Au cours de laquelle le neutron perd de l'énergie
cinétique et change de direction; ce processus est dominant pour les
neutrons rapides (~MeV).
III.2.2 .5.1 Diffusion élastique : (n, n)
:
La diffusion élastique rappelle la collision entre des
boules de billard.
Un neutron frappe un noyau, lui transfère de
l'énergie et rebondit dans une direction différente. (Parfois le
noyau absorbe le neutron puis le réémet avec la même
énergie cinétique.) La fraction de l'énergie de
départ qui sera absorbée par le noyau dépend de l'angle
d'incidence -- en plein « front » ou avec un angle -- tout comme une
boule frappée par la boule de choc sur un billard. Le noyau cible
absorbe l'énergie perdue par le neutron et se déplace ensuite
à plus grande vitesse.
III.2.2.5.2 Diffusion inélastique : (n, nã)
:
Lors d'une collision avec un noyau, un neutron peut être
absorbé momentanément.
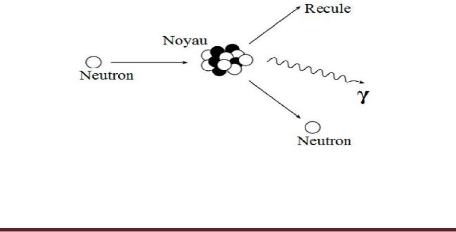
Figure 1.12: diffusion
inélastique.
Ce noyau composé sera dans un état excité.
Il se désexcitera en émettant un nouveau neutron, moins
énergétique, et un photon gamma qui emportera la
différence d'énergie.
CHAPITRE II
les moyens de la radiothérapie
conformationnelle
I. INTRODUCTION :
La radiothérapie est une technique médicale qui
utilise les rayonnements ionisants pour détruire des cellules,
principalement les cellules de tumeurs cancéreuses (Les cellules
cancéreuses en voie de prolifération sont plus sensibles aux
rayonnements que les cellules saines, c'est le fondement de leur utilisation
dans le traitement des tumeurs). Son objectif est de délivrer de la
manière la plus précise possible la dose de rayonnement prescrite
au volume de la tumeur, en épargnant au mieux les tissus sains
avoisinants.
Plus de la moitié des patients atteints d'un cancer sont
traités par radiothérapie à une étape de leur
parcours de soin.
II LA RADIOTHERAPIE EXTERNE :
Elle regroupe l'ensemble des techniques d'irradiation
où la source est placée à distance du patient à
traiter. On parle aussi de télé radiothérapie
transcutanée. Les appareillages les plus utilisés à
l'heure actuelle sont les accélérateurs linéaires de
particules (photons X et électrons). Toutefois, notons l'existence
d'appareils utilisant une source radioactive de cobalt 60 (rayons ã), on
parle alors de cobalthérapie.
III. RADIOTHERAPIE CONFORMATIONNELLE :
Le terme « conformationnelle » signifie «
proche de la forme ou de la configuration d'une structure ». La
radiothérapie conformationnelle 3D est une irradiation
transcutanée dans laquelle le volume traité est adapté au
volume cible reconstruit en 3 dimensions.
L'objectif de cette technique de radiothérapie est de
diminuer la dose délivrée aux tissues sains entourant la tumeur,
d'augmenter la dose dans la tumeur et d'obtenir un meilleur contrôle
local, donc un accroissement de la survie des patients .
A l'heure actuelle, la mise en ~uvre de cette technique fait
appel à :
- des moyens assurant la reproductibilité du traitement
(immobilisation du patient, contention...);
- une imagerie tridimensionnelle de la totalité des
volumes irradiés (scanographie éventuellement
complétée par l'IRM, la TEP, et la fusion d'images...);
- une délinéation des volumes cibles et des organes
critiques auxquels sont appliquées des marges de sécurité
adaptées ;
- une balistique et une collimation personnalisée des
faisceaux (caches personnalisés, collimateurs mutilâmes)
déterminées à partir d'un calcul tridimensionnel de la
distribution de doses dans les différents volumes (GTV, CTV, PTV,
organes à risques) ;
- un contrôle de la reproductibilité du traitement
(imagerie portale, gammagraphie).
III.1 Les étapes-clés de la
radiothérapie conformationnelle:
Trois étapes peuvent être schématiquement
décrites : L'acquisition des données décrivant le patient
et la maladie. La planification du traitement.
L'exécution du traitement.
III.1.1 Acquisition des images 3D :
L'acquisition des données anatomiques est
réalisée selon la où les techniques d'imagerie disponibles
: scanner, IRM, technologies de médecine nucléaire.
Les images scanographiques sont les images de
référence pour le calcul de dose. Néanmoins, la nature et
la qualité des images scanographiques ne permettent pas dans de
nombreuses situations de définir correctement les volumes tumoraux et/ou
les organes à risques nécessitant le recours à d'autres
modes d'imagerie (IRM, TEP) et à la fusion d'images. Cette étape
définit aussi les conditions pour effectuer le traitement,
c'est-à-dire la position exacte que le patient doit prendre.
III.1.1.1 Installation du patient :
En radiothérapie conformationnelle, l'installation du
patient est réalisée sous contrôle médical. Elle
résulte d'une réflexion menée parallèlement
à la prescription des volumes ; elle doit intégrer les
critères d'efficacité et de qualité de traitement mais
aussi de faisabilité et de reproductibilité.
L'installation du patient nécessite une extreme rigueur et
beaucoup de conscience professionnelle de la part du manipulateur qui doit
connaitre les objectifs à atteindre.
Le patient, bien informé des modalités du
traitement participera activement à son installation.
III.1.1.1.1 Objectifs et contraintes :
La prescription médicale des volumes s'effectue en deux
temps : le premier, plus abstrait se concrétise par le deuxième,
plus concret qui consiste en un tracé précis des contours des
structures, sur des coupes obtenues sur un appareil d'imagerie
dédié à la radiothérapie conformationnelle.
L'installation du patient doit donc faire l'objet d'une
décision précise et définitive dés le premier
positionnement du patient sous l'appareil d'imagerie.
III.1.1.1.2 Objectifs:
L'objectif visé est de répondre aux critères
de la radiothérapie conformationnelle qui consiste en un centrage
extrêmement précis sur le volume planifié.
Le premier impératif est de rendre « accessible
» le territoire à traiter et « d'écarter » les
structures seines.
Le deuxième impératif est d'immobiliser le patient
puisqu'il ne doit pas bouger pendant toute la durée de la séance
(10 minutes environ).
Le troisième est d'intégrer d'emblée la
notion de reproductibilité, sachant que les séances de traitement
seront répétées, et que tous les points liés au
point doivent se retrouver strictement au méme endroit, à chaque
séance, dans la configuration géométrique de
l'appareil.
III.1.1.1.3 Les moyens de contention :
Les outils de contention tels que le support thorax
(localisation thoracique), le repose jambes et pieds (localisation pelvienne),
les masques thermoformés (localisation ORL et cérébrale)
ou le plan incliné sein servent à assurer l'immobilisation du
patient pendant le traitement afin d'éviter toute irradiation
intempestive des régions anatomiques non souhaitées.

Figure 2.1:moyens de contention, A: plan
incliné, B: masque thermoformé.
III .1.1.2 Lasers :
Les lasers sont utilisés pour l'établissement
des cordonnés du patient et le marquage de la région à
irradiée.
Le positionnement des lasers transversaux et longitudinaux
dans la salle de scanner dédié doit être
nécessairement le même que celui existant, dans la salle de
traitement pour assurer le positionnement exact du patient. Un laser de scanner
doit être à la même tolérance (1 mm) que les
lumières laser simulateur.
III.1.1.3 Le scanner:
Le scanographe dédié devient un standard dans un
service de radiothérapie. Le parc des simulateurs est progressivement
renouvelé par l'imagerie scanné tridimensionnelle. Du fait de la
variation de densité des tissus sur les images de scanographe et de
l'identification des organes hyper vascularisés par injection
intraveineuse de produit de contraste, on obtient une image 3 D très
riche en information. La précision des organes cibles et critiques est
ainsi augmentée.
Toute la planification CT doit être effectuée
dans des conditions aussi identiques que possible de celles dans la salle de
traitement, y compris le système de soutien aux patients ( hauteur de
canapé), les positionnement des lasers et toutes les aides de
positionnement du patient.
Les scanners « dédiés » ont la
particularité de proposer une ouverture de tunnel plus importante que
ceux réservés pour le diagnostic (supérieur à 80 cm
contre 60 cm) ceci afin de permettre le passage du patient avec sa
contention.
Figure 2 .2: acquisition des images scanographique
pour la planification de traitement.
III.1.1.3.1 Production des rayons X : III.1.1.3.1.1
Générateur :
Les générateurs fournissent, en particulier, la
tension (de l'ordre de130 kV) et le courant nécessaires à
l'accélération des électrons dans le tube à rayons
X. Les générateurs sont du type tension constante, pour assurer
un flux énergétique quasi constant. L'invariabilité est
essentielle puisqu'elle conditionne la valeur ì du coefficient
d'atténuation mesuré. Une stabilité meilleure que 1/1000
permet d'apprécier une différence en atténuation de
l'ordre de 0,3 %.
Pour obtenir une énergie effective supérieure
à 60 keV, les générateurs doivent fournir des tensions
comprises entre 90 kV et 140 Kv sous un courant de 50 à 300 mA en mode
continu ou de 100 à 700 mA en mode pulsé. Pour les régimes
de fonctionnement en mode pulsé, la durée d'impulsion
réglable peut varier de 1 à 7 ms avec une fréquence de 100
à 200 impulsions par seconde, conditionnant l'acquisition des
projections. Dans le cas d'un fonctionnement en mode continu la mesure est
échantillonnée au niveau des détecteurs, pendant une
durée variant de 1 à 7 ms par projection. Avec ce mode de
fonctionnement on peut réaliser jusqu'à 1000 projections par
seconde.
III.1.1.3.1.2 Tubes à rayons X :
Pour les appareils actuels, les puissances
élevées nécessaires exigent l'utilisation de tubes
à anode tournante. La double exigence de l'ouverture importante du
faisceau de rayons X (50 degrés) et de la limitation des effets
gyroscopiques nécessite une orientation de l'axe longitudinal du tube
(ou de l'anode tournante), perpendiculaire au plan du mouvement de rotation.
1. Le tube radiogène est constitué d'une cathode
et d'une anode entourée par des enveloppes de protection.
2. La cathode est la source des électrons. Il s'agit
d'un filament en forme de spirale, composé généralement de
tungstène, qui s'échauffe lors de la mise en route du tube pour
laisser s'échapper les électrons.
3. Les électrons sont accélérés
entre la cathode et l'anode par une forte différence de potentiel,
délivré par le générateur.
4. L'anode est la cible des électrons et le lieu de
production des rayons x. La surface de
bombardement des électrons sur l'anode s'appelle le
foyer.
La surface de l'anode est oblique par rapport à la
direction du faisceau d'électron de manière à permettre
à d'avantage de rayons x de pouvoir sortir du tube.
5. Le tube radiogène, mis sous vide, est entouré de
plusieurs enveloppes de protection permettant d'assurer une protection
thermique, électrique et mécanique.
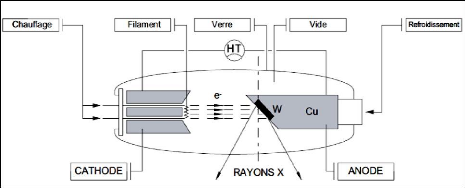
Figure 2.3: principe de fonctionnement du tube
à rayons X.
III.1.1.3.1.3 Détecteurs :
Les caractéristiques essentielles des détecteurs
sont :
L'efficacité de détection quantique qui
représente le rapport entre le nombre de photons absorbés par le
détecteur et le nombre de photons incidents. En pratique, le
paramètre utile est l'efficacité globale de détection qui
est le produit de l'efficacité quantique du détecteur et de
l'efficacité géométrique.
La dynamique des mesures : quelque soit le type de
détecteur utilisé, la dynamique de mesure est de 1:106 (cela
correspond à la différence d'atténuation qui existe entre
le faisceau dans l'air et le faisceau atténué par 70 cm de tissu
mou).
Par ailleurs, les détecteurs doivent présenter les
caractéristiques géométriques suivantes :
- une largeur suffisante, supérieure ou égale
à 20 mm afin de détecter le plus large faisceau de rayons X
disponible.
- une épaisseur suffisamment petite (de l'ordre de 1
à 2 mm) qui conditionne la largeur du rayon de mesure et donc de la
résolution spatiale.
- une profondeur (ou longueur) dans le sens de propagation du
rayonnement suffisante pour
absorber une forte proportion de rayonnement (de 2 à 50
mm, en fonction du type de détecteur).
Deux principes de détection sont utilisés: l'effet
radioluminescent dans les détecteurs solides et l'ionisation dans les
détecteurs à gaz.
III.1.1.3.1.3.1 Détecteurs solides :
Ils sont utilisés par la plupart des scanners actuels.
Les photons X sont absorbés par un scintillateur et convertis en photons
lumineux, eux mêmes convertis en signal électrique par une
photodiode. Leur efficacité est excellente. Ils offrent des temps de
réponse rapides; toutefois, ils présentent une faible
rémanence. Les dimensions d'un détecteur solide sont d'environ 2
mm d'épaisseur, 20 mm de largeur et 2 mm de longueur.
III.1.1.3.1.3.2 Détecteurs à gaz
:
Il s'agit d'une chambre à ionisation contenant du
xénon sous pression. Le xénon est un gaz lourd (A = 131, Z = 54),
sa densité est 4,5 fois supérieure à celle de l'air dans
les mêmes conditions de température et de pression. Pour augmenter
son efficacité de détection on utilise le xénon sous
pression de l'ordre de 2,5.105 Pa.
La chambre comporte des électrodes de champ et des
électrodes de collection des ions. Chaque série
d'électrodes forme une cellule et la chambre de détection peut
comporter jusqu'à 1000 cellules élémentaires
déployées sur un arc de cercle de 45 ou 50 degrés. Les
dimensions de ces cellules sont de l'ordre de 1 mm en épaisseur, 30 mm
en largeur et 50 mm en profondeur et les cellules sont espacées de 0,2
à 1,2 mm. L'efficacité de détection quantique de l'ordre
de 50 à 60 % est fonction de la pression du gaz.
III.1.1.3.1.3.3 Filtrage et collimation :
Le filtrage et la collimation permettent la mise en forme du
faisceau de rayons X.
Filtrage :
Il est effectué par une lame métallique de faible
épaisseur. Il permet d'obtenir un spectre de rayonnement étroit,
et d'approcher le monochromatisme.
Collimations primaires et secondaires :
La collimation primaire est située en aval du filtrage.
Elle calibre le faisceau de rayons X en fonction de l'épaisseur de coupe
désirée. Elle limite l'irradiation inutile.
Le collimateur secondaire a pour but de minimiser la
quantité de rayonnement diffusé
responsable de la dégradation du contraste.
Le collimateur secondaire peut être constitué de
lamelles de plomb focalisées sur le foyer du tube et placées sur
la chaîne des détecteurs. La structure des électrodes des
détecteurs à gaz, de par leur profondeur, favorise la
collimation.
III.1.2 La planification de traitement (TPS) :
La préparation du traitement est réalisée
grâce à un système de planification de traitement TPS pour
déterminer la distribution de dose dans la tumeur et les zones
avoisinantes. Cette distribution de dose doit être optimum de
manière à ce que les tissus normaux autour reçoivent le
minimum de dose. Plusieurs TPS sont utilisés dans les structures
hospitalières.
Ils intègrent des algorithmes de calcul de la distribution
de dose, des outils de traitements des images médicales et de
"contourage" de tumeur pour définir les volumes cibles.
Suivant le degré de complexité et les risques
associés au traitement, la modélisation et la simulation seront
plus ou moins complexifiées. Les différentes étapes de la
planification de traitement sont :
- le placement des faisceaux : choix des angles d'incidences
pour éviter au maximum les structures les plus critiques. Ce choix est
généralement fait dans une représentation dite en beam's
eye view, c'est-à-dire vue du faisceau incident.
- l'ajustement des faisceaux : choix du type de rayonnement, des
accessoires, des modificateurs de faisceaux.
- la phase de calcul dosimétrique où le programme
va calculer la dose déposée par chaque faisceau et quantifier
l'irradiation dans chaque organe considéré.
- La validation clinique du résultat et le transfert des
paramètres de traitement pour la réalisation pratique des
accessoires puis de l'irradiation sous la machine.
III.1.2.1 Définition des volumes cible:
A partir des images médicales, les médecins et les
physiciens médicaux délimitent les volumes cibles à
traiter et les organes à risques à protéger.
Le radiothérapeute dessine sur les différentes
coupes d'images scanné du patient, l'ensemble des structures saines
à protéger ainsi que les différents volumes à
irradier. Ces notions de volumes ont été données dans le
rapport N°50 de l'ICRU [ICRU-50, 1993] qui distingue [7] :
III.1.2.1.1 Le volume tumoral GTV (Gross Tumor Volume)
:
Il correspond à la tumeur et aux tissus envahis
macroscopiquement par du tissu cancéreux ; ils sont visibles à
l'examen clinique, endoscopique ou grace aux technique d'imagerie.
III.1.2.1.2 Le volume clinique ou CTV (Clinical Target
Volume) :
Correspond au volume tumoral ou à son « lit
d'exérèse », additionné des tissus à forte
probabilité d'envahissement infra clinique.
Ces volume peuvent être continus (tissus de
proximité) ou discontinus (territoire ganglionnaire) ; ils sont
déterminés directement grâce à la connaissance des
différents cancers, à leur types histologique et leur «
capacité » à l'extension ou la dissémination.
III.1.2.1.3 Le volume planifié ou PTV (Planning
Target Volume) :
Correspond au volume clinique augmenté d'une marge dite
« de sécurité ».
Le principe de la marge de sécurité est
d'intégrer la difficulté à positionner, de manière
précise et reproductible le volume dans le faisceau. En fait, il faut
prendre en compte les mouvements des organes pendant la séance
(respiration) ainsi que les imprécisions, liées aux aléas
de la technique et de la balistique.
III.1.2.1.4 Volume taité TV (Treated
Volume):
Découle de la technique de traitement ; effectivement,
en radiothérapie externe, les tissus traversés sont
concernés par une proportion plus ou moins importante de la dose totale;
des points extérieurs au volume planifié peuvent recevoir des
doses proches de la dose prescrite.
III.1.2.1.5 Volume irradié IV (Irradiated Volume)
:
Découle également de la balistique, il
correspond au volume recevaant une certain proportion de la dose prescrite (par
exemple 50%), suffisante pour être prise en compte par rapport à
la tolérance des tissus traversés.
III.1.2.1.6 Les organes à risques (moelle,
cristallin, rectum, vessie...) :
Situé à proximité du volume
planifié, ils seront identifiés et si possible exclus du volume
irradié ; ils seront l'objet d'un traçage de conteur par le
médecin et d'une étude dosimétrique par la personne
spécialisée en radiophysique.
En pratique :
Pour la définition des volumes, le médecin
radiothérapeute mènera son action en deux temps : Dans un premier
temps, il prend en compte le cas clinique, la forme histologique du cancer,
l'histoire de la maladie et le type d'évolution : la prescription «
se formalise » (elle prend forme suite à une logique de
déduction) ;
Dans un second temps, grâce à un logiciel de
dosimétrie informatisée il trace, sur des images en coupe, les
conteurs, soit du CTV doit du GTV ou bien du PTV : la prescription « se
concrétise » (elle prend forme suite à la
matérialisation des limites des volumes par un tracé).
|
Figure2.4: les différents volumes
définis lors de la
planification de traitement.
|
III.1.2.2 Prescription de la dose :
Des études ont démontré que tout
surdosage supérieur à 5% est susceptible d'entrainer de graves
complications et tout sous-dosage dans les mêmes proportions augmente le
risque de récidive de la maladie.
Au vu de ces risques, chaque prescription comporte donc le
difficile compromis à trouver entre :
Détruire les cellules cancéreuses pour
contrôler la maladie.
Préserver les cellules saines pour limiter les
complications.
La définition des doses relève uniquement de la
compétence médicale.
Elle associe obligatoirement la dose totale à
l'étalement et au fractionnement.
Les trois paramètres offrent au radiothérapeute
la possibilité d'introduire également dans la prescription, la
notion de traitement curatif ou palliatif, et donc d'opter pour des traitements
« adaptés » à chaque patient.
III.1.2.2.1 Dose totale :
La dose totale correspond à la dose qui doit être
délivrée de la façon la plus homogène possible
à l'ensemble du PTV avec la distinction nécessaire dans le cas
où le volume planifié comporte plusieurs volumes partiels
nécessitant des niveaux de dose différents.
La dose totale est déterminante pour atteindre les
objectifs de la radiothérapie.
Elle est variable et sera fonction du type histologique du
cancer, des cas cliniques et des traitements annexes.
Pour donner un ordre de grandeur, la dose curative dans la
plupart des localisations
cancéreuses, se situe entre 50 et 80 Gy et
à auteur de 45 Gy pour les territoires ganglionnaires.
III.1.2.2.2 Etalement :
Il concerne la durée totale de traitement entre la
première et la dernière séance.
Il peut s'exprimer en nombre de jours (y compris ceux où
il n'y a pas de séances) ou le plus souvent, pour la
radiothérapie externe, en nombre de semaines.
La notion d'étalement vient obligatoirement
compléter la valeur de la dose totale dans la prescription de la dose.
Vu l'importance du facteur temps en radiobiologie, (Une dose de 10 Gy
délivrée en une séance n'aura pas les mémes effets
biologiques qu'une dose de 10 Gy délivrée en une semaine).
Cette notion est donc indispensable pour évaluer
l'efficacité biologique.
II.1.2.2.3 Fractionnement :
Le fractionnement vient compléter la notion
d'étalement ; il précise le nombre de séance effective
contenue dans la durée totale de traitement, il indique donc
indirectement la dose par séance.
Un traitement peut être multifractionné,
c'est-à-dire qu'il peut comporter deux à plusieurs séances
par jour.
III.1.2.3 Simulation virtuelle et dosimétrie
informatisée :
Dans la pratique actuelle, pour les besoins de la
radiothérapie conformationnelle, la simulation virtuelle et
l'étude dosimétrique ont pris une place décisive. Elles
relèvent de la compétence de la personne
spécialisée en radio physique qui garantit que la dose
délivrée aux différents volumes, répond à la
prescription médicale [7].
III.1.2.3.1 Simulation du traitement :
A ce stade de la préparation du traitement, le
positionnement du patient est arrêté. Pour la simulation d'un
traitement, les choix porteront sur les faisceaux d'irradiation : Leur
qualité (nature et énergie du rayonnement) ;
- Leur nombre, leur porte d'entrée, leur direction
(rotation du bras) ;
- Leur contribution à la dose totale (la
pondération) ;
- Leur dimension (ouverture du collimateur, protection) ;
- L'utilisation de modification de faisceaux.
A noter que les rotations du bras et de la table
définissent l'entrée et la sortie du faisceau et donc les
structures traversées.
III.1.2.3.2 Dosimétrie
prévisionnelle:
La dosimétrie prévisionnelle est
réalisée par ordinateur. Le calcul prévisionnel des
distributions de dose au sein du patient virtuel est indispensable car il
permet une liberté de choix de la balistique du traitement et
l'optimisation des différents faisceaux pour les orienter de la
façon et de la forme les plus adaptées. Les logiciels de
dosimétrie disponibles sont hétérogènes.
III.1.3 Les accélérateurs linéaires
(L'exécution du traitement) :
Actuellement l'accélérateur linéaire est
la machine la plus utilisée pour le traitement par la
radiothérapie externe. Dans ce dispositif les électrons sont
accélérés à des énergies
élevées de l'ordre de 25 MeV, et sont utilisés pour
produire deux types des faisceaux cliniques :
Un faisceau de rayons X de freinages de 4 à 25 MV.
Un faisceau d'électrons de 4 à 25 MeV. Au
contraire du tube à rayons X, les électrons sont
accélérés d'une manière, discrète par des
champs électromagnétique de radiofréquences
synchronisées [7] [8] [9].
III.1.3.1 Système d'injection :
III.1.3.1.1 Le pistolet d'électrons :
C'est la source des électrons, essentiellement un
simple accélérateur électrostatique d'électrons
basé sur le principe thermoïonique où les électrons
sont libérés par une cathode chauffé et
accélérés ver l'anode grace à une différence
de potentiel.
III.1.3.1.2 L'injecteur :
Permet de contrôler la quantité et la vitesse des
électrons et réaliser la stabilité de la sortie du
pistolet.
III.1.3.2 Système de génération
des radiofréquences(RF) :
Son rôle est la production des micro-ondes utilisées
pour l'accélération des électrons dans le guide d'ondes.
Il consiste en une source de radiofréquence et un modulateur.
II.1.3.2.1 La source:
Les radiofréquences sont obtenues par l'un des deux
dispositifs :
Magnétron : est un oscillateur qui génère
directement les radiofréquences. Il est utilisé
généralement pour les énergies moyennes (15MV pour les
photons et 14MeV pour les électrons).
Klystron : contrairement au magnétron, le klystron est
un amplificateur des ondes de radiofréquences
générées par un autre dispositif appelé le pilote
de radiofréquence (RF driver). Le klystron est utilisé pour les
machines de hautes énergies (23 MV pour les photons et 21 MeV pour les
électrons).
III.1.3.2.2 Le modulateur
Il fournit la haute tension, le haut courant, et les pulsations
courtes requis pour la source de radiofréquences et le système
d'injection des électrons.
III.1.3.2.3 Guide d'onde:
Le guide d'onde est une structure métallique d'une
section transversale rectangulaire ou circulaire utilisé pour la
transmission des microondes. Deux types des guides d'ondes sont utilisés
dans les accélérateurs linéaires : guide d'onde de
transmission et un autre dit accélérateur. Le premier transmit
les ondes de radiofréquences de la source vers le guide d'onde
accélérateur où les électrons sont
accélérés [2].
III.1.3. 3 La cible :
La cible permettant la création de photons par le
phénomène de bremsstrhalung est épaisse de quelques
millimètres. Elle est composée de matériaux ayant un
numéro atomique élevé (Tungstène) vis-à-vis
duquel les interactions par bremsstrahlung sont grossièrement
proportionnelles. D'autre part, les énergies utilisées dans le
domaine médical (entre 4 MeV et 25 MeV) sont telles que la
majorité des électrons incidents est arrêtée par la
cible. Les
photons émis majoritairement lors du bremsstrahlung, sont
concentrés à la sortie de la cible dans un angle solide de
quelques degrés d'ouverture.
II.1.3.4 Système de collimation:
Il contient plusieurs composantes qui influencent la production,
la mise en forme, localisation, et le contrôle des faisceaux de photons
ou des électrons [7] [8].
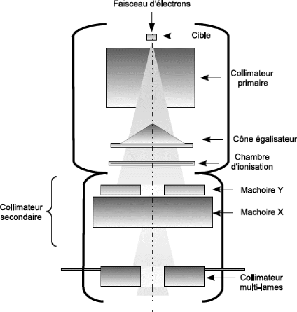
Figure 2.5: système de collimation et mise
en forme du faisceau.
III.1.3.4.1 Le collimateur primaire :
Le collimateur primaire, situé à la sortie de la
cible, limite la section du faisceau pour des raisons de radioprotection du
patient. Il se matérialise par une ouverture conique dans un bloc de
tungstène et définit ainsi le plus large champ circulaire
disponible.
III.1.3.4.2 Le cône égalisateur
:
Le cône égalisateur demeure le module le plus
important dans l'optimisation de l'
irradiation.il est utilisé
pour uniformiser la fluence. La forme de ce module est due à
l'hétérogénéité du faisceau en sortie de la
cible. Comme on l'a vu, les photons sont issus du phénomène de
bremsstrahlung, tendant ainsi à créer plus de photons dans la
direction privilégiée des
électrons incidents. Cependant, les diffusions
multiples subies par les électrons dans la cible entraînent une
homogénéisation énergétique en sortie. Il est donc
nécessaire de compenser cette répartition en intensité en
atténuant subséquemment le faisceau [8].
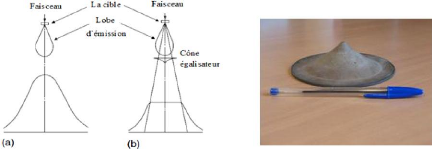
Figure 2.6: schéma explicatif de l'action du
cone égalisateur Figure2.7: image photographique du
cône
sur le profile de dose.
égalisateur.
III.1.3.4.3 La chambre d'ionisation monitrice
:
Le débit de dose, l'homogénéité et
la symétrie du faisceau sont contrôlés en continu pendant
toute l'irradiation du patient par une chambre d'ionisation à
transmission constituant le moniteur. Celle-ci est placée dans le champ
entre le cône égalisateur et le collimateur secondaire. Pour la
sécurité du patient, deux chambres d'ionisations reliées
à deux systèmes de lecture indépendants sont
utilisées. Les deux chambres sont constituées par
l'intérieur d'une cavité scellées afin de garantir une
réponse des chambres indépendante la température et
à la pression. La réponse des chambres au débit de dose
s'exprime en unité moniteur(UM). L'unité moniteur est une
unité machine qui fixe la durée de l'irradiation, donc la
quantité e dose délivrée. La sensibilité
électronique des chambre est ajustée pour que 1 UM corresponde
à une dose de 1 cGy déposée dans un fantôme d'eau
à une profondeur de référence, sur l'axe de champ, pour
une taille de champ de 10x10 cm2 à la distance source-point
de référence de 100 cm.
III.1.3.4.4 Le collimateur secondaire :
Le collimateur secondaire se présente sous la forme de
quatre blocs de tungstène formant deux mâchoires
superposées, l'une dans le sens transverse(X) et l'autre dans le sens
craniocaudal par rapport au patient(Y). Elles permettent de définir des
champs carrés ou
rectangulaire pouvant atteindre 40 cm de coté à
l'isocentre avec une possibilité d'asymétrie et de rotation par
rapport à l'axe du champ.
III.1.3.4.5 Collimateur mutilâmes (MLC)
:
Ce type de collimateur est essentiel pour donner des
traitements en radiothérapie conformationelle. Il consiste en 40
à 60 paires de lames en tungstène ou plomb disposées en
deux rangés opposées soit un total de 80 à 120 lames
(selon les constructeurs).ces lames peuvent être déplacées
individuellement afin de moduler la forme du champ d'irradiation, pour
permettre de s'adapter à la forme de la tumeur. Les fuites des
rayonnements sont atténuées par le filtre secondaire en plus du
chevauchement entre les lames.
Le mouvement des lames est piloté par un ordinateur selon
les données transférées à partir du système
de planification de traitement [8].
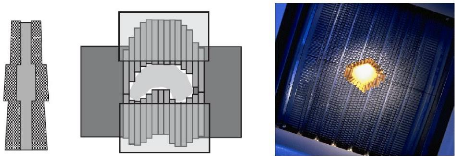
Figure2.8: chevauchement des lamelles et l'adaptation
du collimateur mutilâmes avec le contour de la cible à
traiter.
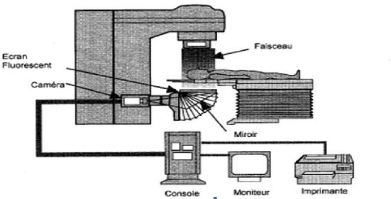
III.1.3.5 L'imagerie portale:
La méthode de vérification de la
conformité du positionnement des champs d'irradiation a
évolué. Des systèmes d'imagerie de contrôle
spécifiques à la radiothérapie (imagerie portale) ont
ainsi été développés. Ils permettent la
visualisation quasi-instantanée de l'image d'un champ d'irradiation
réalisé sous la machine de traitement. On évite ainsi la
perte de temps liée au développement des clichés
radiologiques (gammagraphie) pendant lequel le patient risque de bouger. On
gagne donc en précision et en reproductibilité [7].
L'imagerie portale permet donc d'obtenir, de manière
très rapide, l'image d'un champ d'irradiation avant la séance de
traitement, ce qui donne la possibilité d'intervenir en corrigeant la
mise en place si l'image obtenue n'est pas celle qui est souhaitée. Elle
permet
aussi de réaliser des acquisitions d'images en cours de
traitement (impossible avec la technique des films radiologiques) et de
visualiser ainsi les mouvements du patient afin d'essayer de les quantifier
.L'utilisation quotidienne du portique d'imagerie joue un rôle important
en contrôle qualité et pour la sécurité du patient.
En effet, c'est un outil de traçabilité dans la mesure où
il fournit un historique de la configuration quotidienne du traitement.
Un mauvais positionnement du patient de 5 à 10 mm
suffit à diminuer la dose au volume cible jusqu'à ne plus
être stérilisatrice. Des études ont montré que 10
à 20% des champs d'irradiation présentaient des erreurs de
positionnement supérieures à 1 cm. Ceci est d'autant plus
inquiétant que la marge de sécurité est souvent de cet
ordre. Il y a une réelle corrélation entre ce type d'erreurs et
les échecs thérapeutiques. Deux alternatives sont donc possibles
:
· l'utilisation régulière du portique
d'imagerie,
· l'augmentation de la marge de sécurité au
risque d'endommager davantage de tissus sains.
Tous les systèmes d'imagerie portale actuellement
disponibles fonctionnent selon le même schéma :
· le détecteur est situé dans le faisceau
d'irradiation, il est généralement fixé à
l'accélérateur à l'aide d'un support rétractable
;
· le signal réceptionné par ce
détecteur est converti en un signal numérique par
l'intermédiaire d'une interface et, sur un écran situé
à proximité immédiate du pupitre de commande de
l'accélérateur linéaire est alors visualisée une
image numérique.
Figure2.9 : principe de fonctionnement d'imagerie
portale.
Les avantages de l'imagerie portale sont les suivants :
· simple d'utilisation et fiable ;
· permet une localisation précise par rapport
à des points de repère anatomiques ;
· diminution de la dose au patient ;
· image disponible sur l'écran en une fraction de
seconde ;
· possibilité d'utiliser l'imagerie en continue
(image(s) simple ou multiples pour chaque champ) ;
· possibilité d'éliminer les artéfacts
et erreurs systématiques (bruits et gain peuvent être
ajustéspar l'opérateur) ;
· possibilité d'intégration dans un
réseau informatique hospitalier ;
· stockage informatique ;
· traitement d'images (rehaussement du contraste, des
contours, dessin de structures anatomiques, mesures de distances, zoom, etc.)
;
· possibilité de superposer des images pour les
comparer entre elles.
III.2 Rôle des différents acteurs
La radiothérapie comporte des aspects à la fois
cliniques et techniques. Elle est donc prise en charge par une équipe
multidisciplinaire [11].
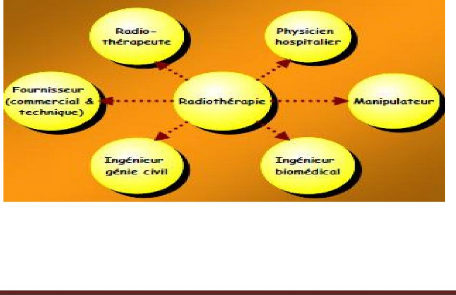
Figure2.10: Les différents acteurs en
radiothérapie
III.2.1 Identification des acteurs
III.2.1.1 Le radiothérapeute:
Est un médecin spécialisé dans
l'utilisation des rayonnements ionisants pour le traitement du cancer. Il doit
être détenteur d'un certificat approprié et/ou d'une
qualification reconnue par l'ordre des médecins. Le certificat est celui
d'études spéciales en électroradiologie ou d'études
spéciales en électroradiologie avec option radiothérapie
(1972), le DES (Diplôme d'Etudes Spéciales) de
radiothérapie (1988) et le DES d'oncologie option radiothérapie
(1992).
III.2.1.2 Le physicien médicale :
Est un spécialiste de la physique des rayonnements
appliquée à la médecine. Il est obligatoirement titulaire
d'un diplôme universitaire de 3ème cycle ou d'un titre
équivalent en sciences physiques. Il a de plus suivi un enseignement
concernant la physique des rayonnements et leurs applications
médicales.
La présence d'un physicien dans les services de
radiothérapie ainsi qu'en médecine nucléaire est
obligatoire.
III.2.1.3 Le manipulateur en électroradiologie
:
Est un technicien paramédical chargé de la
pratique régulière du traitement du patient. Il est
titulaire
d'une école spécialisée agréée ou d'un
brevet de technicien supérieur en
électroradiologie.
III.2.1.4 L'ingénieur biomédical:
Est un ingénieur hospitalier associé à
l'équipe de direction chargé de la gestion technique et
financière de l'ensemble des dispositifs médicaux. Il est
titulaire d'un diplôme universitaire de 3ème cycle en génie
biomédical ou d'un diplôme d'ingénieur.
III.2.1.5 Les fournisseurs:
(Appareils de traitement, accessoires : lasers,
vidéosurveillance...) interviennent par l'intermédiaire des
techniciens ou d'ingénieurs (technico-commerciaux et de maintenance).
CHAPITRE III
paramètres dosimétriques
I. INTRODUCTION:
Les études et les mesures des effets des radiations
requissent plusieurs caractéristiques concernant le champ d'irradiation
dans le point d'intérêt. Dans ce chapitre nous définissons
les quantités, les unités, et les paramètres
dosimétriques les plus utilisées pour décrire un faisceau
d'irradiation :
II. LES QUANTITES ET LES UNITES DES RADIATIONS:
II.1.1 Transport de l'énergie :
II.1.1.1 Le flux particulaire :
Le flux particulaire est défini comme étant le
quotient dN par dt, où dN est le nombre de particules incidentes, et dt
l'intervalle de temps [1] [12]:
?? = ???? (??-1) (3.1)
????
II.2.1.2 Le flux énergétique :
Le flux énergétique est défini comme
étant le quotient dE par dt, où dE est l'énergie des
particules incidentes, et dt l'intervalle de temps :
?? = ???? (??. ??-1) (3.2)
????
II.2.1.3 Fluence particulaire :
La fluence particulaire est définie comme étant le
quotient dN par dA ; où dN est le nombre des particules incidente, et dA
unité de surface :
????
?? = ???? (????-2) (3.3)
II.2.1.4 Débit de fluence particulaire :
Le débit de fluence particulaire est défini comme
étant le quotient d? par dt ; où d? est l'incrément de
fluence particulaire, et dt l'intervalle de temps :
?? = ???? ?o?? (????-2. ??-1)
(3.4)
II.2.1.5 Fluence énergétique :
La fluence énergétique est définie comme
étant le quotient dE par dA, où dE est l'énergie des
particules incidentes, et dA unité de surface :
????
?? = ???? (??. ??-2) (3.5)
II.2.1.6 Débit de fluence énergétique
:
Le débit de fluence énergétique est
défini comme étant Le quotient dØ par dt ; où
dØ est l'incrément de fluence énergétique, et dt
l'intervalle de temps :
?? = ???? (??. ??-2) (3.6)
????
II.2.1.7 Radiance particulaire :
La radiance particulaire est définie comme étant Le
quotient d? par d? ; où d? est le débit de fluence particulaire
par l'angle solide de propagation ? :
?? ? = ????
??? (??-2. ??-2.
????-1) (3.7)
II.2.1.8 Radiance énergétique :
La radiance énergétique est définie comme
étant Le quotient dØ par d? ; où dØ est le
débit de fluence énergétique par l'angle solide de
propagation ? :
?? ? = ????
??? (??. ??-2. ????-1) (3.8)
II.2.2Conversion de l'énergie :
La conversion de l'énergie signifie le transfert de
l'énergie des particules ionisantes aux particules ionisantes
secondaires.
II.2.2.1 Kerma:
Le kerma est défini comme étant Le quotient
dEtr par dm ; où dEtr et la somme des
énergies cinétiques initiales de toutes les particules
chargées, libérées par les particules nom chargées
dans un volume de masse dm :
????????
?? = (??. ????-1) (3.9)
????
L'unité du kerma dans le système international est
le gray (Gy) : 1Gy = 1 j.kg-1
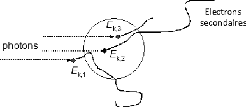
Figure 3.1: transport d'énergie
(kerma)
II.2.2.2 Débit de kerma :
Le débit de kerma est défini comme étant Le
quotient dk par dt ; où dk est l'incrément de kerma, et dt
l'intervalle de temps :
?? = ???? (??. ????-1. ??-1) (3.10)
????
II.2.2.3 Kerma dans l'air :
Pour un faisceau de photon mono-énergétique dans
l'air, le kerma-air dans l'air, (Kair )air à un point donné est
proportionnel à la fluence de l'énergie Ø ou la fluence de
photons ? comme suit :
(???????? )?????? = ?? u???? ?? ?????? =
?? ???? u???? ?? ?????? (3.11)
utr ñ air est le coefficient de transfert massique
d'énergie de l'air pour l'énergie hí . kerma est
constitué de deux composantes : kerma de collision Kco, et
kerma radiative Krad.
?? = ???????? + ???????? (3.12)
Kerma de collision Kco : est l'énergie
transférée aux électrons secondaires, et qui est perdue
lors des collisions.
Kerma radiative Krad : est l'énergie
transférée aux électrons, et qui est perdue par des
processus radiatifs.
Pour les photons mono-énergétiques dans l'air, le
kerma de collision Kco est proportionnel à la fluence
énergétique Ø ou fluence des photons ? comme la suite :
|
???????? = ?? u????
?? ??????
|
= ?? ???? u???? (3.13)
?? ??????
|
uab ñ air est le coefficient d'absorption massique
d'énergie de l'air pour l'énergie hí.
Le coefficient de transfert massique d'énergie u???? ?? et
le coefficient d'absorption massique d'énergie u???? ?? sont
reliés par la relation suivante :
?????? ??????
= (1 - ??) (3.14)
?? ??
?? est la fraction de l'énergie de l'électron qui
est perdue par le phénomène de bremsstrahlung. Pour les
matériaux de Z faible et l'énergie des photons inferieure
à 1 MeV, La fraction ?? 0
?????? ??????
et ?? ???????? (3.15)
?? ??
II.2.2.4 L'exposition :
L'exposition est définie comme étant le quotient
dQ par dm ; où dQ est la valeur absolue de la charge totale des ions de
même signe, produits dans l'air où tous les électrons et
les positons libérés par les photons sont complètement
stoppés dans l'air.
????
?? = ??. ????-1) (3.16)
????
L'unité spéciale de l'exposition est le Roentgen
(R), bien que l'unité de système international est
2,58x10-4 C. kg-1, avec 1R = 2,58x10-4 C.
kg-1 .
II.2.2.5 Débit d'exposition :
Le débit d'exposition est défini comme étant
le quotient dx par dt ; où dx est l'incrément d'exposition, dt
l'intervalle de temps.
??=
???? ??.????-1??-1) (3.17)

????
L'exposition dans l'air et le kerma de collision dans l'air
(Kair
col)air est relié par la relation
suivante :
(???????? ?????? )?????? = ??(???????? ) ?? (3.18)
(???????? )
?? est l'énergie moyenne requise pour créer un pair d'ion dans
l'air (33 ,97 eV/pair
d'ion).
(????????
?????? )?????? = 2,58??10-4 ??
?????????? ?? 33.97 ?? ?? ?? = 0,876 ?????? ?? ] ??
(3.19)
Avec l'exposition X donnée en roentgens. II.2.2.7
CEMA :
Le cema C est défini comme étant le quotient
dEc par dm, où dEc est l'énergie perdue par
les particules chargées, à l'exception des électrons
secondaires, et dm unité de masse.
??????
?? = (??. ????-1) (3.20)
????
II.2.2.8 Débit de CEMA :
Le débit de cema est défini comme étant le
quotient dC par dt ; où dC est l'incrément de cema, et dt
l'intervalle de temps :
?? = ???? (??.????-1.??-1) (3.21)
????
II.2.3 Déposition de l'énergie :
La déposition de l'énergie dans la matière
est un processus stochastique est les quantités discutées au
dessous pour le décrire sont stochastiques.
II.2.3.1 L'énergie impartie :
Considérons un volume qui entoure un point.
L'énergie moyenne impartie à la matière dans ce volume est
:
?? = ?????? - ?????? + ???? (3.22)
?????? est l'énergie radiante incidente,
c'est-à-dire la somme des énergie de toutes les particules
ionisantes qui pénétrant dans le volume.
?????? est l'énergie radiante sortant du volume,
c'est-à-dire la somme des énergie de toutes les particules
ionisantes qui sortent de volume.
???? est la somme de toutes les modification de l'énergie
de masse des noyaux et des particules qui résultent de toutes les
transformations qui se produisent dans la volume.
II.2.3.2 L'énergie déposée :
L'énergie déposée dans un volume
donné se définit comme la somme de tous les énergies
impartie dans ce volume :
?? = ???? (3.23)
II.2.3.3 La dose absorbée :
La dose absorbée est reliée à des
quantités stochastiques de l'énergie impartie. Elle est
définie comme le quotient d?? par dm, où då est
l'énergie moyenne impartie par les radiations ionisantes, et dm
unité de masse pour un volume fini V.
????
?? = (??. ????-1) (3.24)
????
II.2.3.4 Le débit de la dose absorbée :
Le débit de la dose absorbée est défini
comme étant le quotient dD par dt ; où dD est l'incrément
de la dose, et dt l'intervalle de temps :
?? = ???? (??. ????-1. ??-1)
(3.25)
????
II.2.3.5 Dose à une petite masse de milieu dans
l'air :
Le concept `dose à une petite masse de milieu dans
l'air', aussi connu comme 'la dose dans l'espace libre', introduit pour
caractériser la sortie d'une unité de radiation et
d'acquérir la dose de référence pour les calcules
dosimétriques; impliquant le rapport tissu-air (TAR) et le facteur de
diffusion au pic (PSF). La «dose à une petite masse de milieu dans
l'air" est désignée comme étant le ??'?????? et est
basée sur la mesure de kerma air dans l'air. Ce concept est
utilisé généralement dans l'orthovoltage et la
cobaltothérapie, mais avec utilité limitée dans la
radiothérapie par mégavoltage [1] [13].
Les étapes impliquées dans la
détermination de la «dose à une petite masse de milieu dans
l'air", ??'?????? , au point P dans un faisceau de rayonnement à partir
d'un signal mesuré ???? avec une chambre d'ionisation centrée au
point P dans l'air sont:
(1) (2) (3) (4) (5)
???? ???? (????????)?????? (?????)?????? (???????? )??????
??'?????? (3.26)
?? ?? Est le signal mesuré avec une chambre
d'ionisation au point P et corrigé par les grandeurs d'influence, tels
que la température de l'air, pression atmosphérique, et la perte
par recombinaison. La chambre d'ionisation doit avoir la
propriété de build-up et le facteur de calibration de
l'exposition dans l'air ???? ou le facteur de calibration de kerma-air dans
l'air NK
Etape 1 :
Détermination de l'exposition ???? au point P :
?? ?? = ???? ???? (3.27)
Etape 2 :
Détermination de kerma-air dans l'air (Kair)air
au point P :
(???????? )?????? = 0.876 ?????? ?? ???? (3.28)
(Kair )air Peut-être déterminé directement
à partir de M p, si le Nk de la chambre connue :
(????????)?????? = ???????? (3.29)
Etape 3 :
Détermination du Kerma de collision à Am, une masse
extremement petite de n'importe quel matériau (par exemple l'eau), dans
l'air :
(it ab
p air
Am
(KAm )air = (Kair)air
(3.30)
(Ilab / N
/ \ Aair m est le rapport du coefficient d'absorption
massique d'énergie de Am et de l'air. Etape 4 :
Détermination du Kerma de collision à une masse
sphérique d'un milieu centré au point P, ayant le rayon
rmed suffisamment large pour assurer l'équilibre
électronique au point P :
(Kmed)air = (KAm)air k(rmed) (3.31) Où
k(rmed ) est un facteur de correction tenant compte de
l'atténuation du faisceau de photon dans la masse sphérique de
milieu :
|
k(rmed ) ,-,' e
|
itab\
) pmed
p med
|
(3.32)
|
Où ( itab /p)med est le
coefficient d'absorption massique d'énergie du milieu et p sa
densité. Pour l'eau, qui est généralement choisie comme
milieu, la valeur doit être k(rmed) ,-,' 0.987 pour le
cobalt-60 et approximativement 1 pour les photons de faible énergie.
Etape 5 :
La dose à petite masse de milieu dans l'espace libre est
obtenue par la relation suivante :
DI med = 13 (Kmed)air = 13 0.876 cGRY (itapb)maired
Xu k(rmed) (3.33)
Ou â la constante de proportionnalité égale
à 1.003, 1.001, et 1.0 pour le cobalt-60, cesium137, et les rayons X
inferieur à 350 kV, respectivement.
III. LES PARAMETRES UTILISES POUR LE CALCUL DE LA DOSE
:
La radiothérapie externe avec les faisceaux de photons
comporte trois types de machines de traitement : unités des rayons X,
unité de télétherapie isotopique (unités de
cobalt-60), et les accélérateurs linéaires. Les principaux
paramètres qui affectent la livraison de la dose sont [1] :
- La distance source-surface pour la méthode d'irradiation
non isocentrique. - La distance source-axe pour la méthode d'irradiation
isocentrique.
- La profondeur de traitement
- La taille de champ
- L'énergie du faisceau de photons.
III.1 Le champ équivalent:
Les faisceaux utilisés en radiothérapie, ont
différentes formes qui représentent usuellement un compromis
entre la forme actuelle de la cible et le besoin de la simplicité et
l'efficacité dans la formation du faisceau. Quatre formes de champs sont
utilisées : carrée, rectangulaire, circulaire,
irrégulière [1].
Pour un champ de radiation arbitraire, un champ
équivalent carré ou circulaire, sera caractérisé
par des paramètres et des fonctions dosimétriques similaires, qui
peuvent être fondés.
Un champ rectangulaire avec les côtes ?? et b sera
approximativement équivalent à un champ carré avec la
côte ?????? où les deux champs ont le même rapport
surface/périmètre.
|
????
2(??+??) =
|
??????
2
|
2????
où ?????? = ??+?? (3.34)
|
|
4??????
|
??2 = ???????? 2 où ?????? = ??????
. (3.35)
??
Un champ carré arbitraire sera équivalent à
un champ circulaire avec le rayon ?????? où les deux champ ont la
même surface :
|
X(fa)
|
=
|
(Kair (fa))air (Kair (fb))air
|
|
D' med(1
(fa)
|
=
|
f b
|
2
|
(3.38)
|
|
X(fb)
|
D' med(fb)
|
fa
|
|
Figure 3.2: champ carré
équivalent.
III.2 La loi de l'inverse carré de la distance
:
En radiothérapie externe, les sources des photons sont
assimilées comme étant des sources ponctuelles et les faisceaux
qu'ils produisent sont divergents.
Supposons que nous avons une source ponctuelle des photons S,
si un champ carré ayant la côte a (surface A ==
a2 ) à une distance fa de la source , et un champ
carré ayant la côte b (surface B=b2) à une
distance de fb de la source, les deux champs sont géométriquement
liés comme suit:
a/ 2 b/2
tg fa = = (3.36)
f b
Où â est l'angle entre l'axe du faisceau central et
le bord du faisceau géométrique.
La source S émet des photons et produit une fluence
·:13,A à la distance fa et une fluence
·:13,B à distance fb. Le nombre total de photons
Ntot traversant la zone A est égal au nombre total de photons
traversant la zone B (en supposant aucune interaction photon-air entre la zone
A et la zone B), nous pouvons écrire :
A B b2

Nto t = OAA = OBB et
B
Aa2
(3.37)
L'exposition X, Kerma air dans l'air, et la dose à
petite masse de milieu sont directement proportionnelles à la fluence de
photons au point P ; donc il est raisonnable de conclure que les trois
quantités : X, (Kair)air , et D'med
suivent la loi de l'inverse carré de la distance.
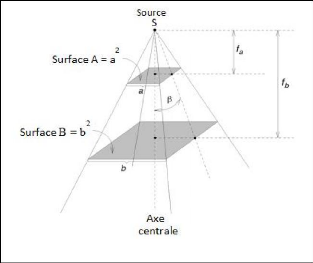
Figure3.3: la divergence du
faisceau
III.3 Pénétration d'un faisceau de
photons dans un fantôme ou un patient :
Un faisceau propageant dans l'air ou le vide, est
gouverné par la loi de l'inverse carré de la distance ; en plus
de cette dernière sa propagation dans un fantôme ou patient est
affectée par l'atténuation et la diffusion. Ces trois effets
rendent la déposition et le calcul de la dose, en un processus
compliqué [1].
La distribution de la dose sur l'axe centrale , pour un faisceau
de photon de mégavoltage pénétrant, dans un patient, est
représentée dans la figure suivante :
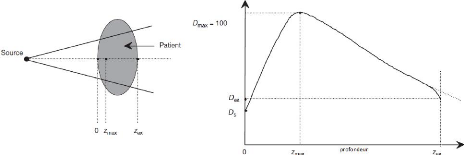
Figure 3.4: pénétration d'un faisceau
de photon dans un fantôme.
III.3.1 La dose à la surface :
Pour les faisceaux de megavoltage, la dose à la surface
est généralement très faible par rapport à la dose
maximale. Elle dépend de l'énergie et la taille du champ (elle
augmente avec la taille de champ et diminue avec l'énergie). Elle
atteint 30% de la dose maximale pour un champ de 10x10 cm2pour le
cobalt-60, 15% pour les faisceaux de rayons X de 6 MV et 10% pour les faisceaux
de 18 MV.
Les rayonnements de haute énergie (mégavoltage)
représentent un avantage important pour le traitement des tumeurs
profondes, grâce à son faible dépôt de la dose
à la surface ; en revanche, les rayonnements de faible énergie
(Orthovoltage) sont utilisés pour le traitement des tumeurs
superficielles.
III.3.2 La région de build up :
La région entre la profondeur z = 0 et la profondeur z
= zmax est considéré comme la région de build-up qui
résulte d'une gamme relativement longue de particules secondaires
chargées et énergétiques (électrons et positons)
qui sont libérés dans le patient, par les interactions des
photons (effet photoélectrique, effet Compton, la production de paires)
et déposant par la suite leurs énergies cinétiques.
Dans la région immédiatement en dessous de la
surface du patient, la condition de l'équilibre électronique
n'existe pas et la dose absorbée est très faible que le kerma de
collision. Cependant, lorsque la profondeur z augmente, l'équilibre
électronique est atteint à
z = zmax, et, où la dose devient comparable avec le kerma
de collision.
Au-delà de zmax la dose et le kerma de
collision, diminuent à cause de l'atténuation des photons, dans
le patient.
III.3.3 La profondeur de la dose maximale:
La profondeur de la dose maximale zmax au dessous
de la surface du patient dépend de l'énergie du faisceau et la
taille de champ. La dépendance de l'énergie étant l'effet
principal, la dépendance de la taille de champ est ignorée, parce
qu'elle représente un effet mineur.
Les valeurs nominales pour zmax égale
à zéro pour les rayons X de faible énergie (orthovoltage),
0.5 cm pour le cobalt-60, 1.5cm pour les faisceaux de 6 MV, et 3cm pour les
faisceaux de 18 MV.
III.3.4 La dose à la sortie :
La dose délivrés au patient, au point de la
sortie des faisceaux est appelée dose à la sortie. Tout
près de la sortie du faisceau, la distribution de la dose s'incurve
légèrement vers le bas, par rapport à l'extrapolation de
la courbe. Cet effet est attribué à la disparition de la
contribution des diffusés, au point de la sortie du faisceau.
II.4 Facteur de collimateur :
L'exposition dans l'air, kerma de l'air dans l'air, et la dose de
petite masse de milieu dans l'air à un point P donné dans l'air
sont constitués de deux composantes: primaire et diffusée.
- La composante primaire : elle est majeure, vient directement
de la source et ne dépend pas de la taille de champ.
-La composante de diffusés : elle est mineure, mais
non-négligeable, et est constituée par les photons
diffusés principalement par le collimateur, l'air et le filtre
égalisateur de l'accélérateur.
L'exposition X, le Kerma-air dans l'air, et la dose de petite
masse de milieu dans l'air dépendent de la taille de champ A et d'un
paramètre référé sous le facteur de
collimateur(CF). Ce dernier est définit sous [1][14]:
???? ??,????) = ?? (??,???? ) (???? ???? (??,?? ??
))?? ???? ?? '(??,???? )
??(10 (?? ??'(10
,????) = ?????? (10,????))?????? = ,????) (3.39)
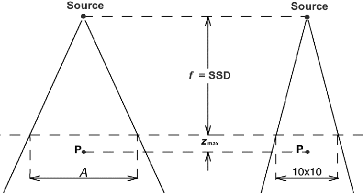
Figure 3.5: géométrie correspondante
à la mesure de CF
III.5 Le facteur de diffusions au pic :
La dose de petite masse de milieu dans l'air Dip est
reliée à Dp (qui est la dose au point P), à la
profondeur Zmax dans le fantôme, par le PSF comme suit :
PSF(A, hv) = D p ( Zmax ,A,f,hv)
(3.40)
Di p (A ,f,h V )
Le PSF dépend de la taille du champ et l'énergie
hv ; il nous donne le facteur par lequel, la dose à un point P dans
l'air, est augmentée par les rayonnements, diffusés dans le
patient ou le fantôme.
Les valeurs typiques du PSF :
PSF 1 pour les petits champs des faisceaux de
mégavoltage,
PSF 1,054 pour les champs de 10x10 cm2 pour le
cobalt-60,
PSF 1,50 pour les champs de 20x20 cm2 pour les rayons
X en orthovoltage.
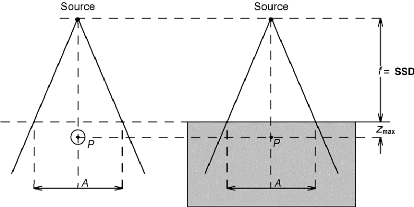
Figure 3.6: géométrie correspondante
à la mesure de PSF
III.6 Le facteur de diffusions au pic normalisé
:
Les diffusions supplémentaires dues au capuchon
affectent les valeurs de PSF. Pour cette raison, on a normalisé le PSF
par rapport à une valeur de référence, et ceci afin que le
rapport des deux valeurs puisse compenser l'erreur due aux diffusions
[1][14].
hv)
NPSF(A) = SF(A,hv) = PSF (A, (3.41)
PSF (10,hv)
III.7 Facteur de dose relatif :
Pour un faisceau de photon donné à une distance
source-surface donnée, la dose à un point P
(à la
profondeur zmax dans le fantôme) dépend de la taille du
champ A. le facteur de dose
relatif RDF (référé sous le factor de
diffusion total Sc,p , ou le débit de la machine relative
(output factor)) est défini comme étant le rapport
de la dose d'un champ donné sur celui d'un champ de
référence dans le point P .
?????? ??, ????) = ????,?? ??, ????) = ???? (????????
,??,??,????)
???? (???????? ,10,??,????) (3.42)
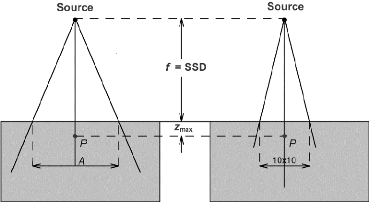
Figure3.7: géométrie correspondante
à la mesure de RDF
III.8 Le rendement en profondeur:
Le PDD est défini comme le rapport en pourcentage de la
dose absorbée D à une profondeur Z sur l'axe centrale, sur la
dose absorbée maximale ???????? sur même axe.
?????? ??, ??, ?? , ????) = ???? × 100 (3.43)
????
Le PDD dépend de quatre paramètres : la profondeur
dans le fantôme, la taille de champ A, la distance source-surface SSD= ??
et l'énergie???? .
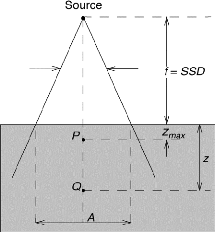
Figure 3.8: géométrie correspondante
à la mesure de PDD
III.9 La fonction de diffusion:
Dans les calculs de la dose, il est désirable de
séparer la composante de diffusion, de la dose totale :
La composante diffusée au point Q= la dose totale - la
composante primaire
=??'p PSF (A, hv)PDD (z, A, f ,hv)/100-
??' p PSF (0, hv)PDD (z, 0, f, hv)/100 (3.44) La fonction de
diffusion est définie comme suit :
S = PSF (A, hv)PDD (z, A, f, hv)- PSF (0, hv)PDD (z, 0, f, hv)
(3.45)
Comme le PDD, la fonction de diffusion S dépend de quatre
paramètres : la profondeur Z, la taille de champ A, la distance
source-surface f et l'énergie hv.
III.10 Le rapport tissu-air:
TAR (z, AQ , hv) est définie comme étant le rapport
de la dose DQ au point Q sur l'axe centrale dans le patient ou le
fantôme, sur la dose D'Q dans le même point sur l'axe
centrale
N D o
TAR(z,AQ,hv ) = ' (3.46)
D' Q
Le rapport tissu-air dépend de trois paramètres :
la profondeur Z, la taille de champ A, et l'énergiehv.
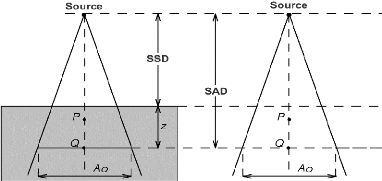
Figure 3.9: géométrie correspondante
à la mesure de TAR
III.11 Rapport diffusé air :
Le SAR décrit la dose absorbée
déposée par les photons diffusés dans le fantôme. Il
est calculé par la soustraction de la valeur extrapolée du TAR
pour le champ de surface nulle (A?0), de la valeur du TAR.
SAR(z,AQ,hv) =TAR(z,AQ,hv) --TAR(z, 0, hv) (3.47)
Le SAR dépend du même paramètre comme le
TAR.
III.12 Rapport tissu-fantôme et le rapport
tissu-maximum :
Le TPR est défini comme étant le rapport de la
dose absorbée à un point sur l'axe central, sur la dose
absorbée, à ce même point et à la même
distance de la source, mais à une profondeur de référence
(zréf) à SAD constante.
TPR(z,AQ,hv) = DQ (3.48)
DQréf
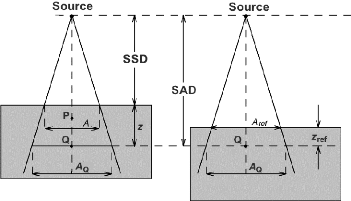
Figure 3.10: géométrie correspondante
à la mesure de TPR
Un TPR spécial est défini lorsque la profondeur
(zréf) est égale à la profondeur de maximum de
dose (zmax ), et il est référé comme le rapport
tissu-maximum TMR(z, AQ,kV).
TM R(z, AQ, kV) = DQ (3.49)
DQmax
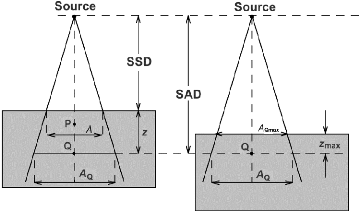
Figure 3.11: géométrie correspondante
à la mesure de TMR
III.13 Rapport diffusion -maximum :
Similairement de la séparation du rapport tissu-air ??,
????, ???? , de la composante primaire
?????? ??, 0, ????) et la composante de diffusion ?????? ??,
????, ???? , le rapport de tissu-maximum ?????? ??,????, ???? peut être
séparé de la composante primaire ?????? ??, 0, ????) et de la
composante de diffusion ?????? ??,????, ???? ; le rapport de diffusion maximum
?????? ??, ????,????
est donc défini comme suit :
??????(??,????,????) = ?????? ??,????,???? ???? (????,????)
????(????,????) - ?????? ??, 0, ????) (3.50)
Le rapport ????(????, ????) ????(????, ????) est donc :
|
???? (????,????)
???? (????,????)
|
=
|
?????? (????,????) ?????? (10,????)
?????? (0,????)
?????? (10 ,????)
|
= ??????(????,????) (3.51)
|
Où ??????(0, ????)=1.
III.14 Rapport hors-axe :
La distribution de la dose au long de l'axe central du faisceau,
ne nous donne qu'une partie de l'information requise, pour une distribution
juste de la dose, dans le patient.
La distribution de la dose dans la dimension perpendiculaire
à l'axe central peut être décrite par le rapport hors-axe
(OAR) ; ce dernier est défini sous le rapport, entre la dose à un
point hors de l'axe du faisceau et, sur celle de l'axe central, à la
même profondeur dans le fantôme.
III.15 Le profil de dose :
La variation de la dose absorbée dans un plan
perpendiculaire à l'axe du faisceau et à une profondeur
donnée, est appelée profil latéral de dose.
Pour les rayons X de mégavoltage, on distingue trois
régions, dans le profil de dose : région centrale, région
de pénombre et celle de l'ombre :
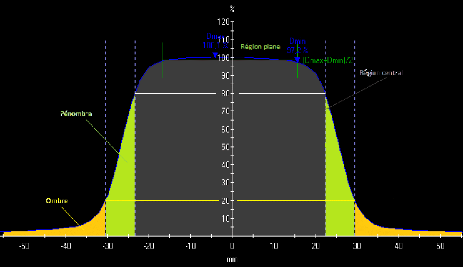
Figure 3.12: géométrie de profile de
dose
III.15.1 La région centrale :
Elle représente la portion centrale du profil, et
s'étend de l'axe central jusqu'à 1-1.5 cm, avant les bords du
champ géométrique de faisceau (la taille de champ
géométrique est indiquée par celle du champ de la
lumière optique).
III.15.2 La pénombre (pénombre physique)
:
Elle est constituée de trois composantes :
- Une composante due à la transmission des
mâchoires, dite pénombre de transmission. - Une composante
attribuée à la taille de la source, dite pénombre
géométrique.
- Une composante due aux rayonnements diffusés dans le
patient ou le fantôme, dite
pénombre de diffusion.
III.15.3 L'ombre :
Elle est une région à l'extérieur du
champ de radiation, la dose dans cette région est
généralement faible, ce qui est due à la transmission des
radiations à travers le collimateur et le blindage de la tête.
III.15.4 La planéité de faisceau :
Elle est évaluée par la détermination de
la dose maximale Dmax et minimale Dmin ,situées
dans la région central du profil de dose correspondante à 80 % de
la taille de champ d'irradiation.
F = 100x Dmax--Dmin (3.52)
Dmax +Dmin
Généralement, les spécifications de
l'accélérateur linéaire requièrent que F doit
être inférieur à 3%, s'il est mesuré dans un
fantôme d'eau à une profondeur de 10cm et SSD de 100 cm, pour une
taille de champ large (usuellement 40x40 cm2).
III.15.5 La symétrie :
La symétrie S est usuellement déterminée
à Zmax , qui représente la profondeur la plus sensible
pour l'évaluation de ce paramètre. Elle est obtenue par la
détermination de la surface pour chaque coté (droit et gauche),
située sous le profil de dose correspondant à Zmax , et
limitée par l'axe central du faisceau et les deux axes droit et gauche,
passants par le niveau de 50% de la dose.
S = 100x
surf ace gauc he--surface droite
(3.53)
surface gauc he +surf ace
droite
III.15.6 La distribution de l'isodose dans un
fantôme d'eau :
Les caractéristiques physiques des faisceaux de
rayonnement sont usuellement mesurées dans des fantômes sous des
conditions standards :
- Un fantôme homogène.
- Une surface de fantôme plate.
- Incidence du faisceau perpendiculaire à la surface de
fantôme.
Les variations planaires et volumétriques de la dose en
profondeur, sont affichées dans des courbes d'isodose qui relient les
points des doses égales dans le volume irradié. Le diagramme de
l'isodose est constitué d'un ensemble de courbes d'isodose, obtenues par
un incrément régulier de PDD. Deux conventions de normalisation
sont utilisées :
Pour la méthode SSD, toutes les valeurs d'isodoses sont
normalisées à 100 au point P sur l'axe central.
Pour la méthode SAD, les valeurs d'isodoses sont
normalisées à 100 à l'isocentre.
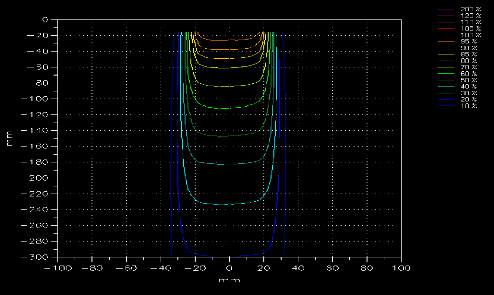
Figure 3.13: les courbes de
l'isodose
III.15.7 La distribution de l'isodose dans le patient :
Les situations cliniques sont généralement plus
complexes :
· La surface de patient peut être d'une forme
irrégulière.
· l'incidence du faisceau sur le patient peut être
oblique.
· La densité des tissus diffère
considérablement de celle de l'eau. La distribution de la dose dans le
patient, peut être déterminée par l'algorithme basé
sur la correction [14].
III.15.7.1 Algorithmes basés sur la correction
:
Ils utilisent les données de dose en profondeur,
mesurées dans des fantômes d'eau, avec une surface plate et une
incidence normale conjointement avec des différentes méthodes
de
correction de l'irrégularité du contour,
l'obliquité de l'incidence, et l'inhomogénéité de
la densité [14][15].
III.15.7.2 Correction des contours irréguliers
et de l'incidence oblique du faisceau :
Un faisceau d'irradiation frappant une surface
irrégulière ou inclinée, produit une distribution de
d'isodose différente de la distribution standard, obtenue à une
surface plate, avec une incidence normale. Deux approches sont utilisées
pour régler ce problème :
III.15.7.3 Correction par des différentes
méthodes de calcules :
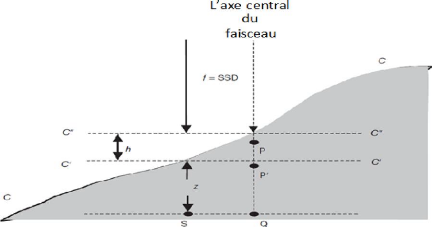
Figure 3.14: Correction des contours
irréguliers et de l'incidence oblique du faisceau
III.15.7.3.1 Méthodes de SSD effective
:
Dans cette méthode, le PDDcorr est
déterminé comme suit :
PDDcorr = PDD' (z, A, f, hy) (ff+h+z:zinax
ax)2
(3.54)
Avec PDD'(z, A, f, hy) est le PDD
sous les conditions standards avec la surface plate C'C'.
Le paramètre h est l'épaisseur du tissu manquant.
III.15.7.3.2 Méthode du TAR ou TMR : Pour
cette méthode, le PDDcorr est donné par :
7,z,A(2,hv)
PDDcorr = PDD? (+h, A, f, hv) 7,(z(+h,A(2,hv)
(3.55)
Avec :
A(2 est la taille de champ au point S à la distance
(f+h+z) de la source.
T représente le TAR ou le TMR.
PDD? représente la valeur PDD à la
profondeur (h+z) pour un fantôme standard, avec une surface de
C?C? .
III.15.7.3.3 Méthode de déplacement de
l'isodose :
La valeur de la dose est déplacée sur l'axe
vertical par (h x k).
k est un facteur dépendant de l'énergie du
faisceau, il a la valeur de 0.7 pour les faisceaux de cobalt-60 jusqu'aux
faisceaux de 5 MeV, 0.6 pour les faisceaux de 5-15 MeV, et 0.5 pour les
faisceaux de 15-30 MeV.
III.15.7.3.4 Compensation par l'utilisation des filtres
en coints et les bolus :
Les filtres en coints :
Les filtres en coints sont fabriqués à base de
plomb, cuivre, ou d'acier. Ils peuvent être utilisés en dehors de
la surface de l'isodose pour les faisceaux de photon frappant une surface
relativement plate sous une incidence oblique. Généralement, ils
sont disponibles avec les angles de 15°, 30°,
45°, et 60°.
Les bolus :
Le bolus est un matériau équivalent de tissus,
placé directement sur la surface de la peau, sur le contour
irrégulier du patient ; il fournit une surface plane pour une incidence
normale du faisceau. En principe, l'utilisation de bolus est simple et
pratique.
III.15.7.3.5 Corrections
d'inhomogénéités :
Le patient contient des structures de différentes
densités.
Une simple méthode pour estimer l'effet approximatif de
l'inhomogénéité est la correction par l`équivalent
de la longueur de chemin, où une profondeur effective est
utilisée pour calculer les paramètres dépendant de la
profondeur [16].
La profondeur effective doff au point p est
changée de Z=Z1+ Z2+ Z3 à Zeff = (Z1+Z
3) +Z2.ñe D (Z, As,
SSD) =
D0 Sc (A, hv) Sp (Zmax , Ap,hv)
TMR (Z of, f , Ap,hv) (SASDA+DZ:zax )2
(3.56)
Figure 3.15: Corrections
d'inhomogénéités
III.15.7.3.6 Algorithmes basés sur les
modélisations :
Cette méthode évite le problème de la
correction, en modélisant les distributions de la dose, dans des
modèles physiques qui simulent le transport actuel des radiations et
prenant en compte toutes les caractéristiques géométriques
et physiques du traitement particulier du patient actuel.
IV CALCULE DES UNITES MONITEURS :
Le calcule des unités moniteurs est basée sur
débit dose de sortie de la machine D 0 mesurée en
cGy/UM au point de sa calibration sous les conditions de
références suivants [1]:
- Mesurée dans un fantôme d'eau.
- Mesurée à l'axe central du faisceau de
radiation.
- Le point situé à une profondeur de
référence (généralement 5 ou 10 cm).
- Mesurée avec une taille de champ de 10x10
cm2.
Mesurée à la distance nominale de la machine
(généralement SSD =100 cm).
IV.1 methode de TPR :
D'apres la définition de TPR (equation 3.48) :
[16] [17] [18]
DQ (z, AQ, f1, hv) =
DIQref(zré p AQ, f2,
hv).TPR(z, AQ, hv) (3.57)
D'prés la loi de l'inverse carre de la distance (equation
2. 38) :
) DQ (Z AQ ,f1,11V)
fl2
Nref(Zre f ,I1Q, fl,hV ) =
TpR(zAQ,hv) f22 (3.58)
DQ,ef(ZrepAQ
,f1,11V)
UM = (3.59)
A)
|
UM =
DQ(zAQ,f1,hv)
.
Do .T P R (z ,A ( 2 ,hv).CF (A,hv).SF (A Q ,hv
|
fi
(3.60)
f2
|
IV.2 methode de TAR :
D'apres la definition de TAR (equation 3.46) : [14]
[16]
13' Q(z'AQ, fi,h11) --
DQ(zAQ,f1,11V)
TAR (AQ ,hv) (3.61)
D'pres la loi de l'inverse carre de la distance (equation
3. 38) :
, fi
D' Qref (Zref , AQ,
f2, MI) = D' Q (Z, AQ,
fl, ' j1. v )
· f2 (3.62)
1 DQ(zAQA,hv) fi
D' Qref (Zre p AQ, f2,
hV ) =TAR ( f (3.63)
14( 2,hv)
·
22
D'apres la définition de TAR (equation 3.46)
:
DQréf (zréf , AQ, f1, hv) =
Di Qréf (ZreP AQ, f2, hv) T
AR (11Qre f,h1l) (3.64)
TAR(AQré Phy) fi
DQréf (Zréf 1
AQ, fi, hv) = DQ (z,
AQ, fl 1 .. h :11 ) j. TAR
(A(2,hv) f22 (3.65)
|
D Q (Z AQ ,f1,11V) U M = Do .CF
(A,h1/).SF (A( 2 ,hV)
|
TAR (AQ, éphy TAR (AQ,hv)
|
fi
(3.66)
f2
|
CHAPITRE IV
le logiciel SDCD
I. MATERIEL UTILISE
I.1 MEPHYSTO mc2 :
MEPHYSTO mc2 (Medical
Physics Tool) avec le Medical physics center
est un logiciel servant à enregistrer et à évaluer
automatiquement des répartitions de doses relatives et absolues
d'installations de radiothérapie, en particulier
d'accélérateurs linéaires à usages médicales
à l'aide des différents types des fantômes. Il permet
l'analyse des données selon des protocoles de dosimétrie
internationaux. [17]
Les données de mesures peuvent être
transférées vers les systèmes de planifications de
traitements en radiothérapie. A cet effet, des programmes de conversion
et de transfert sont requis.

Figure 4.1:Masque principale MEPHYSTO
mc2 Control center.
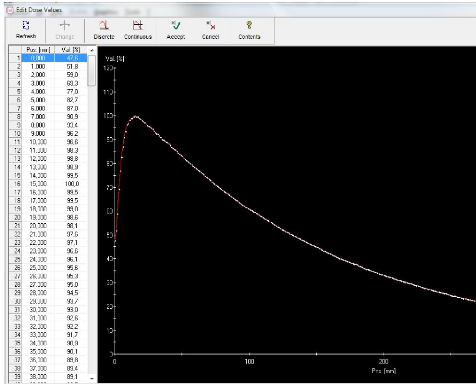
Figure 4.2:La courbe des doses en profondeurs
obtenues par MEPHYSTO mc2.
I.2 Fantôme d'eau :
PTW MP3 est un fantôme d'eau motorisé pour permettre
la mesure automatique de distributions de dose d'un faisceau de radiation.
[18]
L'incidence des rayons peut être verticale, horizontale
ou oblique. Horizontalement, le détecteur peut être
déplacé dans une plage de 600 mm x 500 mm et verticalement de
407,5cm.
Les moteurs de déplacement du détecteur sont
pilotés par le logiciel MEPHYSTO mc2 avec une
précision élevée de positionnement (#177;0,1mm).

Figure 4.3: Fantômes d'eau de type PTW
MP3.
Figure 4.4: Moteur piloté pour le
déplacement du détecteur.
I.3 Chambre d'ionisation :
Les chambres semiflex sont désignées pour la
dosimétrie, principalement pour les mesures de la distribution de la
dose dans un fantôme motorisé. Elle est utilisée pour une
gamme d'énergie entre 30 kV et 50 MV pour les photons, et entre 6 MeV et
50MeV pour les électrons. [19]
II LES DONNEES REQUISES :
Pour réaliser le calcule dosimétrique, notre
système nécessite des données qui caractérise les
faisceaux des photons en fonction des différent paramètres (la
profondeur, la taille de champ, SSD, SAD, l'énergie).
II.1 Les données générales :
- La modalité- L'énergie
- La profondeur de référence
- La profondeur de la dose maximale.
- Distance de référence de la machine (SAD)
- Les paramètres des champs (définies à la
distance de référence de la machine)
Largeur maximale (cm) Longueur maximale (cm) Largeur minimale
(cm) Longueur minimale (cm) [20]
II.2 Les données à scanner :
PDD pour les champs ouverts : sont mesurés pour les
tailles des champs carrés suivants : 3x3, 4x4, 5x5, 7x7, 10x10, 12x12,
15x15, 20x20, 25x25, 30x30, 35x35, et 40x40cm. Le scanne est effectué
jusqu'à 40 cm avec un incrément de 1mm.
TPR pour les champs ouverts : sont mesurés pour les
tailles des champs carrés suivants : 3x3, 4x4, 5x5, 7x7, 10x10, 12x12,
15x15, 20x20, 25x25, 30x30, 35x35, et 40x40cm. Le scanne est effectué
jusqu'à 40 cm avec un incrément de 1mm. [21]
Les profile de dose pour les champs ouverts: sont
mesurés pour les tailles des champs carrés suivants : 5x5, 10x10,
15x15, 20x20, 25x25, 30x30, et la taille de champ maximal. Pour les profondeurs
de dmax, 5, 10, 20, et 30cm Le scanne est effectué jusqu'au
moins 4 cm en dehors de bords de champ avec un incrément de 2mm.
Les PDD pour les filtres en coins : sont mesurés pour
les tailles des champs carrés suivants: 5x5, 10x10, 20x20, et 25x25 cm.
Le scanne est effectué jusqu'une distance supérieur à 30cm
avec un incrément de 1mm.
Les profile de dose pour les filtres en coins : sont
mesurés pour les tailles des champs carrés suivants : 10x10,
20x20,et 25x25 cm .Pour les profondeurs de dmax , 5, 10, 20, et 30cm
.Le scanne est effectué jusqu'au moins 4 cm en dehors de bords de champ
avec un incrément de 2mm. [20]
II.3 Les données non scannées :
Le facteur de dose relatif (Scp) : sont mesurés
à l'isocentre pour les tailles des champs carrés suivants : 3x3,
4x4, 5x5, 7x7, 10x10, 12x12, 15x15, 20x20, 25x25, 30x30, 35x35, et 40x40cm.
La sortie absolue de la machine pour le champ de
référence est mesurée à la profondeur de
référence à l'isocentre.
Facteur de collimateur (Sc) : sont mesurés
à l'isocentre pour les tailles des champs carrés suivants : 3x3,
4x4, 5x5, 7x7, 10x10, 12x12, 15x15, 20x20, 25x25, 30x30, 35x35, et 40x40cm.
Le facteur de diffusions au pic.
Facteur de transmission des filtres en coins : mesuré
à la profondeur de référence et
SSD =100 cm pour les taille des champs suivantes : 5x5, 10x10,
15x15, 20x20, et 25x25cm.
III. ARCHITECTURE GENERALE :
L'ergonomie du logiciel de double calcule dosimétrique
SDCD a été inspirée du système de planification de
traitement XIO. Son développement a été
réalisé sous Delphi en programmation orientée objet. Il
est caractérisé par une fenêtre principale qui contient des
boutons correspondants chacun à une fenêtre secondaire
spécifiée. [22] [23] [24]
Figure 4.5: la fenêtre principale du logiciel
SDCD.
III.1 sources de données (data source):
Cette fenêtre permet la collection des données et
les paramètres qui caractérisent les machines de traitement
disponibles. L'ajout des données d'une nouvelle machine dans se
systéme est réalisé dans plusieurs étapes :
III.1.1 L'identification de la machine :
En donnant un nom significatif qui permet de connaitre le type,
la modalité et l'énergie du rayonnement fourni.
(P.ex. PRIMUS01X-6 qui correspond à la machine PRIMUS de
la société SIEMENS, est les photons X de l'énergie
6MV).
Pour modifier les paramètres d'une machine qui existe
déjà il suffit de double cliquer dans le champ de saisie du nom
identificateur et choisir la machine désirée dans la liste qui
s'affiche.
Figure 4.6: panneau de lidentification de la
machine.
III.1.2 Les données générales :
Le panneau suivant permet de déterminer les
caractéristiques générales de la machines qui sont
déclaré par le fabricant tel que la modalité,
l'énergie, la distance entre la source et l'isocentre(SAD), les
techniques d'irradiation disponible, les dimensions maximales et minimales de
champ d'irradiation, et la distance minimale et maximale entre la source et la
surface à irradier, la profondeur de référence
utilisée pour la calibration de la machine.
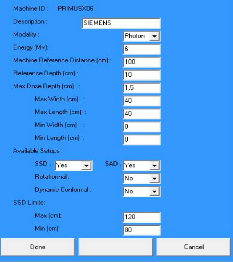
Figure 4.7: panneau de collection des données
générales de la machine.

III.1.3 Les données physiques :
Si les données générales de la machine sont
complètes, on peut continuer d'ajouter les données physiques
nécessaires pour le calcule dosimétrique.
Le panneau concernant les données physique permet de
vérifier l'existence et la validation de ces données. Il contient
six boutons correspondant chacun à un type de données tel que les
PDD, les TPR, les OAR, les PSF, les RDF, et les CF.
Figure 4.8: panneau de choix des données
physiques à ajouter.
Pour assurer l'ajout et l'apparition de la nouvelle machine au
système dosimétrique il faut d'assurer que touts les
données physique sont collecté et validé par le
physicien.
Nous avons utilisé trois méthodes pour collecter ce
type de données :
· L'importation directe des tableaux obtenus à
partir du logiciel de mesures dosimétriques (MEPHYSTO) après
leurs transformations sous formes des tableaux paradoxe en utilisant
l'Access.
· La saisie des données manuellement.
· Et la conversion des données à partir
d'autres tables (PDD vs TPR).
Pour vérifier la validité des données nous
avons ajouté un espace de visualisation pour les représentations
graphiques correspondantes aux tableaux ajoutés.
Les données non scannées :
Pour ce type de données l'utilisateur doit les saisir
manuellement.
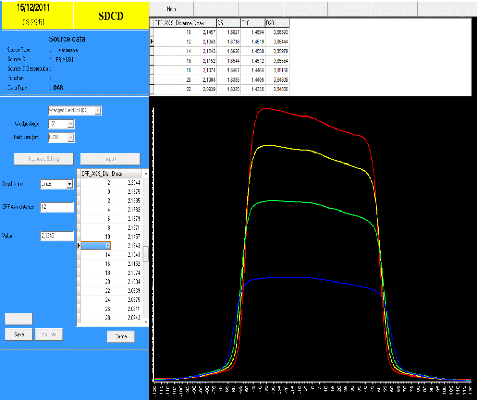
Figure 4.9: panneau de collection des données
physiques.
III.2 dosimétrie (dosimetry):
Cette fenêtre permet de calculer le nombre des
unités moniteurs correspondants à la dose prescrite.
III.2.1 L'identification du patient :
Chaque dossier doit être caractérisé par un
chiffre spécifique pour l'identification du patient c'est L'ID de
patient qui sera unique pour chaque patient.
Figure 4.10: panneau didentification de
patient.
Le panneau suivant permet de choisir la clinique où le
traitement se fait.
Figure 4.11: panneau de choix de la
clinique.
III.2.2 Donné démographique :
Cette étape permet de collecter les informations
générales concernant le patient pour leur traitement dans le
service de radiothérapie (nom du patient, le Médecin, et le site
anatomique a traité).
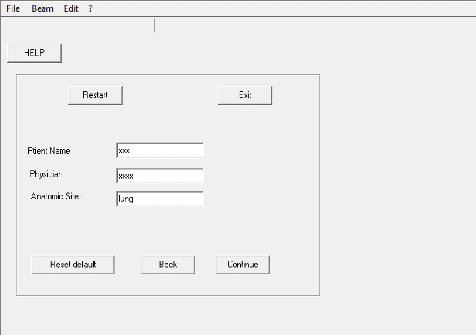
Figure 4.12: panneau de collection des données
démographique.
III.2.3 Paramètres de faisceau :
Nous définissons les paramètres concernant le
faisceau et la machine de traitement (description du faisceau, la technique
d'irradiation, la distance source peau, la taille du champ, la
profondeur...).
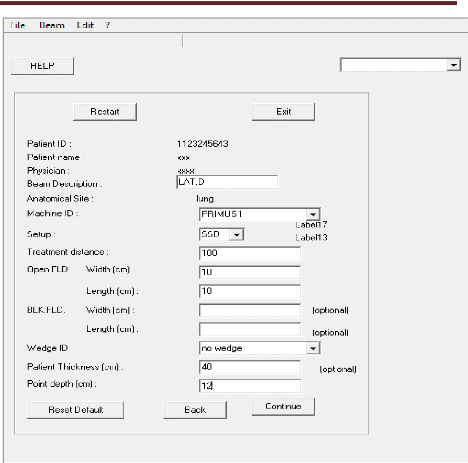
Figure 4.13: panneau de collection des
paramètres de faisceau.
Le panneau suivant permet de compléter les
données concernant le faisceau d'irradiation(le facteur de transmission
du réticule et le facteur de correction), et la détermination de
fraction de la dose délivré par ce faisceau.
Pour ajouter un autre faisceau il suffit de cocher le petit
carré en bas et continuer.
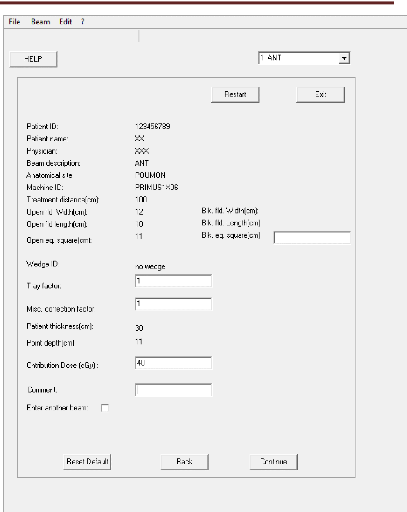
Figure 4.14: panneau pour compléter les
données concernant le faisceau de traitement.
III.2.4 résultat finale :
Après la collection de toutes les donnée
concernant le plant de traitement le résultat de calcule des
unités moniteur s'affiche dans une nouvelle fenêtre imprimable
où toutes les informations de chaque faisceau sont affichées en
plus de la valeur réelle en la valeur entière du nombre des
unités moniteur.

Figure 4.15: l'affichage des résultats
finals.
IV COMPARAISON DES RESULTATS :
Le nombre d'unités moniteur calculé par le TPS
était le plus souvent un peu supérieur à celui
donné par le SDCD, et cela quelles qu'aient été
l'énergie du rayonnement et les paramètres
géométrique de faisceau.
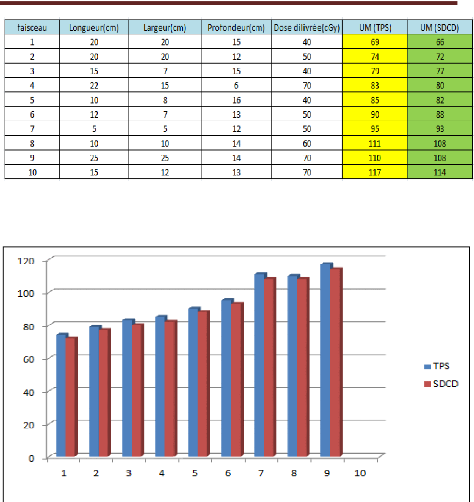
Tableau 4.16 : comparaison entre les résultats
de TPS et de SDCD.
Figure 4.17: comparaison entre les résultats
de TPS et de SDCD
Conclusion
Conclusion.
Conclusion :
Le résultat de se projet s'agit qu'un simple logiciel
de calcule dosimétrique qui inclut des conditions simples tel que le
champ rectangulaire, carrée, l'homogénéité, et les
champs ouverts.
Les perspectives ouvertes par ce projet nous incitent à
continuer son développement pour élargir ses applications. La
révolution permanente des techniques d'imagerie, de transfert des
données médicales, des techniques de traitement, et des moyens
informatiques qui nous obligent à une actualisation réelle de
notre connaissance et plus de recherche et de travaille pour inclure ces offres
tel que l'utilisation du format d'image DICOM pour l'importation des images
médicales réelle, et des information concernant les sites
anatomiques et les densités électroniques des différents
tissus pour une localisation précise de la région à
irradier qui permettent de prendre en compte
l'hétérogénéité et
l'irrégularité des contours.
L'ajout des différents algorithmes actuelle
améliore les calcules dosimétriques et donnes plus de chois des
techniques utilisées et une diversité concernant la distribution
de la dose simulée par chaque algorithme.
Au delà du projet SDCD, ce travaille nous permet
d'aborder la dosimétrie des rayonnements en radiothérapie au
travers d'un regard plus technique et scientifique. Nous avons acquis des
compétences en informatiques, physiques des rayonnements,
dosimétrie, et une méthodologie de travail qui nous permettront
d'aller plus loin dans le domaine de la recherche physique médicale, et
de concrétiser plus facilement nos idées.
Annexes
I. RELATIONS ET DERIVATIONS :
I.1 Relation entre le TAR et le PDD :
DQ
TAR(z,AQ,hv) = ,
D Q
PDD DQ
o(z, A, f,hv) = × 100
DQ
|
DQ = DP
|
PDD (z, A, f, hv)
|
= DIQTAR(z,AQ,hv
|
|
100
|
2
\ v T ( f + z ) PSF(A, hv)
DP = DIpPSF(A, hv) = .' Q v +
zni. i
PDD(z,A, f, hv) ( f + z )2
TAR(z,AQ,hv) = PSF(A, hv)
100 kf + zmax)
D2
D1
D3
D4
D3
D1
I.2 Relation entre le PDD et le TPR :
= TPR(z,B,hv)
1
=
100
= TPR(z,D,hv)
PDD (z, A, SSD, hv) D4 (SSD + zref )2
PSF(C, hv) =
D1 SSD + z ) PSF(A, hv)
D4 D4 D3
=
D1 D3 D1
1
PDD (z, A, SSD, hv)
2 (C hv) (SSD + zref ) PSF(C, = 100
k SSD + z ) PSF(A, hv) TPR(z,D,hv)
En utilisant :
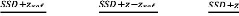
????D +????
c= A
SSD +z--zf
D= A
SSD +z
B = A
SSD , SSD , SSD
On obtient :
SSD + z ) 1 ( SSD + z \ 2
PSF(A, hv)
TPR
hv) PDD(z,A,SSD,hv)
(/ z, SSD , 100 SSD + zref) ????F(/?? SSD + z --
Zref )
SSD ,hv
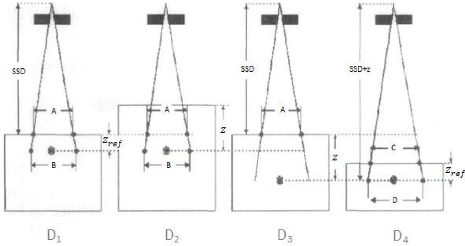
I.3 Relation entre le PDD et le TMR :
DQ
TMR(Z,AQ,1111) = DQmax
X 100
Q
PDD (Z, A, f, hv) = D Dp
|
DQ = DP
|
PDD (z, A, f, hv)
|
= DQmaxTMR(z,AQ,hv
|
|
100
|
|
Annexe.
|
|
|
|
|
|
|
|
|
???? =
??????????
??????
|
??'??PSF ??, ????) = ??'??
= ??'??PSF ????, ????
??????
??,????,???? =
|
|
????
|
2
PSF ??, ????)
?????? ??, ????~
|
~
|
??
?? + ??
~
|
|
??
??, ??,
|
+????????
??, ????~
|
|
??????
|
|
??????
|
????, ????
|
??
|
+ ????????
|
I.4 Relation entre le TAR et le TPR :
|
??????
|
|
=
|
????
|
|
????, ????
??,
|
|
??'
|
??
|
|
??????
|
|
????
|
=
|
??????????
|
|
????,
???????? ,
|
|
|
??' ??
|
|
?????? ??,????, ????
?????? ????????, ????, ????
|
????
= = ?????? ??,????,????
?? ????????
|
Un cas particulier :
?????? ???????? , ????, ???? = PSF ????,????
Donc on peut écrire :
|
?????? ??,????,???? =
|
?????? ??, ????, ????
?????? ????,????
|
Bibliographie
BIBLIOGRAPHIE:
[1] INTERNATIONAL ATOMIC ENERGY AGENCY
"Radiation oncology physics: a handbook for teachers and
students", ISBN 92-0-107304-6 (Vienna, 2005).
[2] ERVIN. B.PODGORSAK
"Radiation Physics for Medical Physicists". Edition: Springer,
2éme edition (2010), ISBN
978-3-642-00874-0.
[3] DANIEL BLANC GUY PORTAL JEAN BARTHE "Les
rayonnements ionisants : détection, dosimétrie,
spectrométrie" edition Dunod.
[4] CHRISTINE JIMONET ET HENRI METIVIER.
"Personne compétente en radioprotection". Principes de
radioprotection-réglementation. EDP Sciences 2007. France. ISBN :
978-2-86883-948-0.
[5] RUSSELL K. HOBBIE BRADLEY J. ROTH
"Intermediate Physics for Medicine and Biology". Edition:
Springer, 4éme edition (2007). ISBN-13: 978-0-387-30942-2.
[6] JOSEPH MAGILL JEAN GALY
"Radioactivity · Radionuclides · Radiation". Edition:
Springer(2005). ISBN 3-540-21116-0.
[7] PAM CHERRY. ANGELA M. DUXBURY
"Practical radiotherapy: Physics and equipment". Edition:
WILEY-BLACKWELL, 2éme edition (2009), ISBN 978-1-4051-8426-7.
[8] MARC DELAPERRIÈRE
"Primus basic functional description». SIEMENS AG MEDICAL
SOLUTIONS CS TS.
[9] R. HELLBORG (ED.)
"Electrostatic Accelerators". Edition: Springer(2005) ISBN-13
978-3-540-23983-3.
[10] L. W. BRADY, PHILADELPHIA, H.-P. HEILMANN,
HAMBURG
"Technical Basis of Radiation Therapy". Edition: Springer,
4éme edition (2007). ISBN-13 978-3-540-21338-3.
[11] ANDRE COSTA. JEAN-PIERRE GERARD
"Guide des Procédures de Radiothérapie Externe
2007". Société française de radiothérapie
oncologique.
[12] D BALTAS. L SAKELLIOU. N ZAMBOGLOU
"The Physics of Modern Brachytherapy for Oncology". Edition:
Taylor & Francis Group (2007). ISBN-13: 978-0-7503-0708-6.
[13] INTERNATIONAL ATOMIC ENERGY AGENCY.
"Absorbed Dose Determination in External Beam Radiotherapy.
An International Code of Practice for Dosimetry Based on Standards of Absorbed
Dose to Water". Technical Reports Series No. 398, (IAEA, Vienna, 2000).
[14] FAIZ MOHAMED. KHAN.
"Physics of Radiation Therapy". Edition: Williams & Wilkins,
4éme edition (2010).
[15] MYRIAM AYADI
"Mesures et intégration des marges de conformation et de
mouvement dans le plan de traitement des cancers bronchiques non à
petites cellules".
L'UNIVERSITE CLAUDE BERNARD - LYON 1. Thèse (2007)
[16] P MAYLES. A NAHUM. J C ROSENWALD
"Handbook of radiotherapy physics". Edition: Taylor &
Francis Group (2007). ISBN 10:0-7503-0806-5.
[17] MEPHYSTO mc2
"Instructions d'utilisation". version de base. D800.175.00/06
(2007). [18]PTW-NEW YORK CORPORATION
"Radiation medicine QA". Radiation Medicine Products from PTW
(2008/2009).
[19] DR. PYCHLAU GMBH
"Absorbed dose determination in photon and high energy electron
beams". PTW FREIBURG(2007). D560.210.01/07.
[20] XiOTM "Beam data collection list". DOC:
9000-959-24G. Last update: Release 4.1.
[21] XiO_TRN_TIMEMUCALC "Time/ Monitor Unit
Calculations". Computerized Medical Systems (CMS). (08/09/2006).
[22] XiOTM " XiO Training Guide".XiO_TUT_433_B.
pdf. PN 98911.
[23] JEROME DARMONT "Programmation sous
Delphi". Université Lumière Lyon2 (1999-2000).
[24] RM DI SCALA "Les bases de l'informatique
et de la programmation". Edition: Berti (04.01.05).
Résumé
Le calcule dosimétrique réalisé au cours
de la planification de traitement diffère d'un logiciel à l'autre
selon les protocoles de calcule, les algorithmes utilisées, et les
paramètres de traitement introduits. Il est important de s'assurer que
la dose calculée par le logiciel de planification de traitement
correspond à la dose mesurée, dans toutes les conditions
géométriques du faisceau d'irradiation.
Le système de double calcule dosimétrique est un
logiciel secondaire permettant un calcule dosimétrique plus simple qui
utilise les mêmes conditions et les mêmes données que le
principale mais des différents protocoles et différents
algorithmes ; son intérêt est de pouvoir mettre en évidence
une erreur de calcul dans certaines conditions d'irradiation. Il est
indispensable d'établir des critères de comparaison et de
tolérance propres aux logiciels que l'on utilise.
| 


