|

Dédicace
A mes chers parents :
Fathi & Mahbouba

Pour leur soutien, leur patience, leur sacrifice et leur
amour,
Vous méritez tout éloge, vous qui avez fait de
nous ce que nous sommes maintenant. Nous espérons être l'image que
vous êtes fait de nous, que dieu vous garde et vous
bénisse.
A mes chers frères et
soeurs :
Raja & Yassine

Pour leur affection et leur encouragement qui ont toujours
été pour nous des plus précieux. Que ce travail soit pour
vous le gage de notre profond amour.
A mon très cher Atef

Quand je t'ai connu, j'ai trouvé l'homme de ma vie, mon
âme soeur et la lumière de mon chemin. Ma vie à tes
cotés est remplie de belles surprises. Tes sacrifices, ton soutien moral
et matériel, ta gentillesse sans égal, ton profond attachement
m'ont permis de réussir mes études. Sans ton aide, tes conseils
et tes encouragements ce travail n'aurait vu le jour. Que dieu réunisse
nos chemins pour un long commun serein et que ce travail soit témoignage
de ma reconnaissance et de mon amour sincère et fidèle.
A mes chers amis

A tous ceux qui nous ont aidés. A tous ceux que
nous aimons, nous dédions ce travail.
Remerciement

J'exprime ma profonde reconnaissance à Mme Nada
ELLOUMI KALLEL, qui a accepté de diriger mes travaux de projet
de fin d'études. C'est avec une attention particulière et
édifiante qu'elle a suivi de près toutes les étapes de ce
travail. Ses conseils et ses critiques constructives, son esprit et sa rigueur
scientifique m'ont été très utiles.
Je voudrais exprimer toute ma gratitude à
Monsieur Mahdi MSAED, Maitre Assistant
à l'Institut Supérieur de Biotechnologie de Sfax ,
pour l'honneur qu'il m'a fait de présider le jury de
mon projet de fin d'études.
Je tiens à remercier, Mme Salma HCHICHA
ZALILA, Maitre Assistante à l'Institut
Supérieur de Biotechnologie de Sfax, qui a bien voulu accepter
d'examiner mon travail.

Toute ma reconnaissance s'adresse également à
toute l'équipe du LARSEN spécialement à
Monsieur Monem KALLEL, Responsable du Laboratoire des Sciences
de l'Environnement, pour m'avoir facilité la réalisation des
analyses et pour tous les encouragements.
Mes plus vifs remerciements s'adressent aussi à
Monsieur Mounir KESSEMTINI, Directeur de la
Société Delta Water pour son soutien, ses conseils, son aide
précieuse et sa disponibilité par la mise à notre
disposition d'un appareil Delta Water pour la réalisation de nos essais
d'expérimentaux.
Je suis agréable d'exprimer mes profonds respects et
mes vifs remerciements à Mr. le Directeur et tous les personnels de
l'ISBS qui ont favorisé de bonnes conditions de
travail.
Je tiens à remercier mes chers enseignants qui n'ont
épargné aucun effort pour réussir notre formation et celle
de mes camarades de promotion de la Protection de l'environnement à
l'ISBS de Sfax.
Je tiens également à remercier tous mes
collègues, et mes amis de l'ISBS et l' ENIS.
Sommaire
Introduction...............................................................................................1
Chapitre 1 :ETUDE BIBLIOGRAPHIQUE
1. L'eau, principal constituant des êtres
vivants..........................................2
2. Des eaux qui agissent sur le processus
vivant.............................................2
2.1. Les pluies
d'orage...............................................................2
2.2. L'exposition au
soleil...........................................................2
2.3. L'eau des
Hunzas..............................................................3
3. L'eau
magnétisée..............................................................................3
3.1.
Définition...........................................................................3
3.2. Les propriétés de l'eau
magnétisée...................................................4
4. Les effets de l'eau
magnétisée.............................................................6
4.1. Action sur l'organisme
humain...................................................6
4.2.Action sur les
animaux.........................................................7
4.3.Action sur les
plantes...........................................................7
5. La salinisation des
sols.......................................................................8
5.1. L'effet sur l'eau dans la
plante...................................................8
5.1.1.L'effet sur la
croissance.........................................................8
5.1.2. L'effet sur l'eau dans la
plante................................................9
5.1.3. L'effet sur les pigments
photosynthétiques..................................9
5.1.4. L'effet sur la
photosynthèse...................................................9
Chapitre 2 : Matériel et
Méthodes
1.1. I.Protocole
expérimental de la dynamisation de l'eau : La technologie
« Delta Water »......11
I.1.Caractérisation physicochimique de
l'eau..............................................11
1. Mesure du pH
..............................................................................12
2.Mesure de la conductivité
électrique...........................................12
3. Déterminations des concentrations des
anions.........................................................12
4. Déterminations des concentrations des
cations.....................................................13
5. Test de chauffage
d'eau.......................................................................................13
6.Test de refroidissement de
l'eau..........................................................................14
7. Test de congélation de
l'eau..............................................................................14
II. Technique et Conditions de
culture............................................................14
II. 1. Paramètres physicochimiques du
sol.......................................................15
1. La
granulométrie....................................................................................15
2.Détermination du
pH.................................................................................15
3.Détermination de la conductivité
électrique (CE).........................................16
4. Matière
organique...................................................................................16
5. Le carbone organique total COT
.......................................................16
6.Détermination du phosphore total
(Pt).................................................17
II.2.Les paramètres étudiés pour le
matériel
végétal.............................................17
II.2.1.Test de
germination..............................................................................17
II.2.2.Paramètres
morphologiques..................................................................18
1.Mesure de la croissance en
longueur.................................................18
2. Mesure de la croissance
pondérale................................................18
II.2.3. Paramètres
physiologiques...................................................................18
1.Mesures de la photosynthèse et de la
transpiration............................18
2.Peroxydation
lipidique....................................................................19
3.Dosage de la
proline.....................................................................19
4. Dosages des pigments
chlorophyllies..............................................19
5.Détermination du contenu relatif en eau
(RWC)..................................19
6. Analyse de la composition
minéralogique.........................................20
7.Le potentiel hydrique
foliaire...........................................................20
8.La perméabilité
membranaire.........................................................20
9. Détermination de la teneur de H2O2
..........................................21
Chapitre 3 : RESULTATS ET DISCUSSION
1.2. I. Estimation de
l'efficacité de l'appareil de magnétisation : Delta
Water.......................22
1.3. I.1.Etude
physico-chimique des eaux
utilisées............................................22
1.4. I.2.Composition
minéralogique de
l'eau.............................................23
1.5. I.3.Evoluation du
pH en fonction du temps.......................................23
1.6. I.4.Test de
chauffage de
l'eau......................................................24
I.5.Test de refroidissement de
l'eau................................................24
1.7. I.6.Test de
congélation de
l'eau...........................................................25
II.Caractérisation physico-chimique du sol avant
et après l'irrigation du sol par l'eau
magnétisée................................................................................................26
II.1. Caractérisation physico-chimique du sol avant
l'irrigation du sol par l'eau
magnétisée.....................................................................................26
1. Texture du
sol......................................................................26
2. Caractéristiques chimiques du
sol...............................................26
II.2. Caractérisation physico-chimique du sol
après l'irrigation par l'eau
magnétisée........................................................................................27
1. Evolution du
Ph.............................................................................27
2. Evolution de la conductivité
électrique............................................28
III. Réponses morphologiques et physiologiques des
plantules de tomates irriguées par des eaux de salinité
croissantes et
magnétisées...........................................................29
III.1. Effets de la salinité et de la
magnétisation de l'eau sur la germination..........29
III.2. Effets de la magnétisation de l'eau et de
la salinité sur la croissance des plantules de
tomate...........................................................................30
1. Effets de la magnétisation et da la salinité
sur le nombre de feuilles.....30
2. Effets de la magnétisation et da la salinité
sur la croissance en longueur des
plantules.....................................................................31
3. Effets de la salinité et la magnétisation sur
la production de
biomasse.........................................................................32
4. Effets de la salinité et la magnétisation sur
le contenu relatif en eau et sur le potentiel hydrique
foliaire....................................................33
III.3. Effets de la magnétisation de l'eau et de
la salinité sur la réponse biochimique des plantules de
tomate......................................................34
1. Effets de la magnétisation de l'eau et de la
salinité sur les teneurs des pigments
chlorophylliens............................................................34
2. Effets de la magnétisation de l'eau et de la
salinité sur la formation des peroxydes d'hydrogène
(H2O2)...................................................35
3.Effets de la magnétisation de l'eau et de la
salinité sur l'accumulation de la
proline.................................................................................35
4. Effets de la magnétisation de l'eau et de la
salinité sur la peroxydation
membranaire...........................................................................36
5. Effets de la magnétisation de l'eau et de la
salinité sur l'intégrité
membranaire...........................................................................37
Conclusion...............................................................................................38
Listes des figures
Figure 1. L'eau des
hunzas..............................................................................3
Figure 2. Schéma du champ magnétique et de la
direction de l'écoulement de l'eau au cours du traitement (Maheshwari
and Grewal, 2009)....................................................4
Figure 3. La structure de l'eau dynamisée en
micromolécules (Microcluster)................4
Figure 4. Cristaux de Masaru Emoto (un Médecin
chercheur Japonais)........................5
Figure 5.Tension superficielle faible de l'eau
magnétisée.........................................5
Figure 6. Effet de la consommation de l'eau vitalisée
sur le sang...............................6
Figure 7. L'installation de l'appareil Delta
water........................................................11
Figure 8. Evolution de la température des eaux
magnétisées (T) et non magnétisées (N.T.) suite
à un chauffage électrique. (N.T. :non
magnétisée ;T :magnétisée)............................24
Figure 9. Evolution de la température de
refroidissement des eaux magnétisées et non
magnétisées...............................................................................................25
Figure 10. Evolution de la température de
congélation de l'eau magnétisée et non
magnétisée...............................................................................................26
Figure 11. Evolution du pH des sols en fonction de la
magnétisation et de la
salinité....................................................................................................28
Figure 12. Evolution de la conductivité
électrique des sols en fonction de la magnétisation et de la
salinité............................................................................................29
Figure 13. L'effet de la magnétisation et la
salinité sur la germination des graines de tomates pour
différents types
d'eaux.........................................................................30
Figure 14. L'effet de la magnétisation et la
salinité sur le nombre des feuilles des plantules de
tomates...................................................................................................30
Figure 15. Effet de la magnétisation des eaux
d'irrigation sur la croissance des plantules de tomates irriguées par
l'eau magnétisée de salinité 6g/l pendant un
mois.....................31
Figure 16. Effets de la salinité et de la
magnétisation sur la longueur de la tige............32
Figure 17. Effets de la salinité et de la
magnétisation sur la longueur des racines.........32
Figure 18 . Effets de la salinité et de la
magnétisation sur la masse de la matière fraiche des organes des
plantules de
tomates.....................................................................33
Figure 19. Effets de la salinité et de la
magnétisation sur la masse de la matière séche des organes
des plantules de
tomates.......................................................................33
Figure 20. Effets de la magnétisation de l'eau et
de la salinité sur les teneurs des pigments
chlorophylliens............................................................................................34
Figure 21. Effets de la magnétisation de l'eau et de la
salinité sur la formation du peroxydes d'hydrogène
(H2O2).....................................................................................35
Figure 22. Variation de l'accumulation de la proline selon le
traitement de l'eau et l'intensité du stress
salin............................................................................................36
Figure 23. Effets de la magnétisation de l'eau et de la
salinité sur l'accumulation des produits de peroxydation des
lipides
membranaires.........................................................37
Figure 24. Pourcentage de fuite d'électrolytes en
fonction du type de l'irrigation..........37
Liste des tableaux
Tableau 1. Qualité
physicochimique des différents types d'eaux
utilisées..............................22
Tableau 2. Concentration des
éléments majeurs (mg/l) de différentes
catégories
d'eau..................................................................................23
Tableau 3. Evolution du pH des eaux en
fonction du temps..............................24
Tableau 4. Analyse granulométrique
du sol.......................................................26
Tableau 5. Caractérisation
physico-chimique du sol au début de l'expérience (temps 0) et
à la fin de l'expérience (temps
40j)...........................................................27
Tableau 6. Effets de la salinité et la
magnétisation sur le contenu relatif en eau et sur le potentiel hydrique
foliaire..................................................................34
Introduction
La rareté des ressources des eaux de faible
salinité constitue un problème majeur en Tunisie. La
majorité des eaux d'irrigation dans la zone aride et semi aride en
Tunisie est d'origine souterraine. Les eaux des nappes phréatiques sont
fréquemment salées avec une salinité qui dépasse
généralement 3 g/l. Pour palier à ce problème, une
nouvelle technologie basée sur la magnétisation des eaux, peut
constituer une solution de recours permettant la valorisation de ces eaux en
agriculture.
Cette nouvelle technologie très peu définie
assure une magnétisation de l'eau le rendant vital. Afin de mieux
comprendre cette nouvelle notion, l'objet de cette étude consiste
à évaluer les effets de cette magnétisation sur les
caractéristiques physicochimiques de trois types d'eaux utilisées
au cours de cette étude à savoir :
· l'eau de robinet (faiblement chargé en sel de
l'ordre de 2 g/l) ;
· l'eau de puits légèrement saline (3,5
g/l)
· et une autre type d'eau de puits de forte
salinité 6g/l.
La valorisation de ces eaux en agriculture a été
testée sur des plantules de tomates et ceci a été
réalisé par l'évaluation des effets de ces eaux
magnétisées sur les paramètres physicochimiques du sol et
sur l'identification des réponses morphologiques et physiologiques de
ces plantules.
Ainsi, une première partie du travail consiste à
élaborer une synthèse bibliographique qui comporte deux
volets : le premier volet portera sur l'étude des différents
procédés de dynamisation des eaux, et la caractérisation
de ces eaux traitées. Le deuxième volet portera sur les effets de
l'utilisation des eaux salines sur le développement de
végétaux.
La deuxième partie est consacrée à la
description du matériel végétal, du sol, des eaux
utilisées, des conditions de culture et les méthodes d'analyse
utilisées dans ce travail.
La dernière partie regroupe l'ensemble des
résultats obtenus et leurs discussions.
ETUDE BIBLIOGRAPHIQUE
1. L'eau, principal constituant des êtres
vivants
L'eau est indispensable à la vie de tout organisme sur
terre. Toutes les plantes et les animaux sont composés en grande partie
d'eau. 60% du poids de notre corps est constitué d'eau. L'eau, couvre
environ 71 % de la surface de la terre. 97.2% de l'eau sur terre est
constituée d'eau de mer, 2.15% de glace et seulement 0.65% d'eau douce
directement utilisable (Hugonin, 2011).
Le premier secteur consommateur d'eau est l'agriculture avec
un taux de 70%, les industries présentent un taux de consommation voisin
de 20% et seuls les 10% restant servent à la consommation (Benamraoui,
2014). Vue la rareté de cette ressource vitale, le recours à des
eaux souterraines peu salées dans l'agriculture devient une
nécessité. Afin de valoriser ces ressources en eaux, la
dynamisation de ces eaux pourrait apporter un plus value par des
améliorations sur la structure et donc sur la qualité des
eaux.
2. Des eaux qui agissent sur le processus
vivant
Au cour du XX° siècle, différents
chercheurs ont mis au point des procédés pour améliorer le
potentiel vital de l'eau (Marshutz et al., 1996 ; Brower, 2005). Pour
cela, certains se sont inspirés des eaux ayant naturellement un
potentiel vital accru: les pluies d'orage, les sources ou écoulements de
glaciers de certaines régions du monde. Il s'agissait alors d'identifier
les caractères qui différencient ces eaux aux
propriétés particulières des eaux
« ordinaire », et d'essayer de les reproduire. Ensuite,
diverses expérimentations permettent de vérifier les
propriétés spécifiques de l'eau obtenues par le processus
de magnétisation.
2.1. Les pluies d'orage
Les agriculteurs, éleveurs et maraichers, connaissent
depuis longtemps les propriétés particulières des pluies
d'orages. Les animaux préfèrent l'eau boueuse des ornières
d'un chemin après un orage, alors que leurs abreuvoirs sont remplis
d'une eau bien propre. Après une pluie d'orage les
végétaux ont une croissance plus rapide. Ce
bénéfice de croissance peut être observé
objectivement en arrosant en parallèle des plantes identiques avec de
l'eau ordinaire d'un côté et de l'eau de pluie d'orage de l'autre
côté.
2.2. L'exposition au soleil
Un autre phénomène connu des maraîchers
est l'amélioration de la qualité de l'eau lorsque celle-ci est
exposée assez longuement au soleil. Cet effet est souvent
attribué au léger échauffement que cet ensoleillement
induit, mais si on amène l'eau à une température identique
par un autre moyen, on ne retrouve pas cet effet dynamisant.
2.3. L'eau des Hunzas


Depuis plusieurs décennies, des scientifiques du monde
entier se sont intéressés aux propriétés
exceptionnelles de l'eau de certaines régions en haute altitude. La plus
remarquable est probablement celles des Hunzas au Pakistan (Figure 1). Les
habitants de cette région de l'Himalaya ont coutume de mener une vie
active jusqu'à 100 ans et même davantage. Ils ne semblent pas
connaître la maladie et leur diète habituelle est en dessous des
besoins minimums définis par la diététique.
Figure 1. L'eau
des hunzas
Au cours du XXe siècle, différents chercheurs
ont mis au point des eaux magnétisées ayant des fonctions
bénéfiques sur le processus vivant ou sur la santé. Pour
cela, ils se sont inspirés des eaux naturellement
magnétisées, ou ils ont suivi une voie plus intuitive.
3. L'eau magnétisée
3.1. Définition
Magnétiser une eau, c'est lui céder les
propriétés vitales qui animent les eaux stagnantes tels que
l'eau de pluie, de rivière, de torrent, c'est réanimer cette eau
(Lin and Yotvat, 1990).
La magnétisation de l'eau est l'opération par
laquelle on restitue à l'eau ses qualités
énergétiques et vitales. Une eau restructurée est
une eau qui a retrouvé sa vitalité, donc la puissance de son
champ électro magnétique lui permettant de recréer des
liens ou structures caractérisant l'eau vivante (Figure 2).

Figure 2. Schéma du champ magnétique et
de la direction de l'écoulement de l'eau au cours du traitement
(Maheshwari and Grewal, 2009)
Une eau magnétisée, redynamisée sur le
plan moléculaire, retrouve son pouvoir inné d'absorption de
l'oxygène; elle est aussi moins tendue en surface. La
magnétisation permet d'obtenir une eau hautement
énergisée, contrairement à l'eau fournit par le
réseau public (ou par les eaux en bouteille) qui perd toute
"vitalité" (transport et stockage).
La magnétisation vise à rectifier la nature
subtile de l'eau qui peut produire des effets positifs sur la
santé.
La magnétisation de l'eau permet d'éclater les
groupements de molécules en de plus petits amas qui hydrateront mieux
les cellules du corps (Figure 3)
Figure 3. La structure de
l'eau dynamisée en micromolécules (Microcluster)
3.2. Les propriétés
de l'eau magnétisée
Les propriétés de l'eau magnétisée
sont les suivantes :
· Elle augmente considérablement sa
fréquence vibratoire qui passe de 1011 à 1015 hertz, la
fréquence de la lumière visible
· Elle favorise l'ionisation des molécules
d'eau.
· Plus des ions hydroxyle (OH-) sont créés
pour former des molécules alcalines, et réduire
l'acidité.
· Elle détruit les masses d'eau inertes pour
créer une majorité d'isomères trimères
· Elle transforme une eau oxydée en eau
réduite et produit des électrons libres
· La cristallisation de l'eau magnétisée
montre qu'elle présente de beaux cristaux (Figure 4).
|
 L'eau du robinet de tokyo présente l'eau
dynamisée est vivante et L'eau du robinet de tokyo présente l'eau
dynamisée est vivante et
des images chaotique
présente de beaux cristaux
|
Figure 4. Cristaux de
Masaru Emoto (un Médecin chercheur Japonais) (Emoto,
1999)
· La surface de tension d'une eau
magnétisée est abaissée ce qui lui confère des
propriétés plus mouillantes (Figure 5).
Figure 5.Tension superficielle
faible de l'eau magnétisée
4. Les effets de l'eau
magnétisée
Une eau magnétisée ou dynamisée est
facteur de vitalité et de santé pour les êtres vivants qui
la boivent, qu'il s'agisse d'humains, d'animaux ou de plantes. Elle est un
facteur d'harmonie pour les processus biologiques. Par exemple, si l'on soumet
une eau à rotations majoritairement à gauche (spin
inversé) à un procédé ou technique de dynamisation,
elle se rééquilibre sur le plan subatomique. Les substances
pathogènes régressent ou disparaissent chez le consommateur, et
son système immunitaire s'en trouve fortifié.
4.1.
Action sur l'organisme humain
L'eau magnétisée ou biodynamisée,
structurée, vitalisée, magnétisée hydrate 4 fois
plus qu'une eau normale et 6 fois plus rapidement.
1. Hydratation rapide au niveau cellulaire (revitalisation
complète du corps) ;
2. Oxygénation accrue au niveau cellulaire (Figure
6);

Figure 6. Effet de la consommation de l'eau
vitalisée sur le sang
Photos de
gauche :
Les globules sont agglutinés en forme de "rouleau",
ce qui ne permet pas une bonne oxygénation du corps, perte de leur
charge électrique, mauvaise absorption des nutriments...
Photos de droite :
10 minutes après avoir bu une eau
structurée, les globules rouges sont séparés, retrouvent
leur charge électrique, ce qui permet une meilleure oxygénation
du corps, et une meilleure absorption des nutriments. Diminution des maladies
cardio-vasculaire.
3. Diminution des radicaux libres
4. pH légèrement alcalin
5. Activation des enzymes. Support du système immunitaire.
6. Meilleur équilibre métabolique
7. Meilleure absorption des nutriments et de la communication
extra-cellulaire
8. Amélioration de l'élimination des déchets
intra-cellulaires
5.1. Action sur les animaux
L'eau magnétisée est bénéfique
aussi à la santé et au bien-être des animaux. Comme eau de
boisson, nous retrouvons les mêmes avantages qu'elle apporte à
l'organisme humain. Le traitement magnétique des eaux réduit la
consommation quotidienne d'eau par les oiseaux d'environ 5,46% (Al-Mufarrej et
al., 2005).
5.2. Action sur les plantes
L'eau est la source de vie pour les plantes : plus de 70%
de la plante est faite d'eau L'eau est fondamentale pour les
fonctions d'hydratation, de circulation de la sève.
L'eau magnétisée favorise :
Ø L'augmentation du pouvoir mouillant de l'eau dans les
tissus végétales.
Ø Une augmentation du taux de germination des graines
(Martines et al., 2002 ; Majd and Shabrangi, 2009). Ceci peut être
attribué à une augmentation de l'absorption de l'eau suite au
traitement magnétique (Majd and Shabrangi, 2009).
Ø Un élargissement et un développement
plus important des vaisseaux du xylème et de la stèle des
plantules irriguées par l'eau dynamisée par rapport aux plantules
irriguées par l'eau non dynamisée (Majd and Shabrangi, 2009).
Selon cet auteur, ceci peut être attribué à une
augmentation de l'activité de l'enzyme peroxydase qui entraine une
lignification des cellules et donc un passage rapide vers la structure
secondaire
Ø L'augmentation du développement foliaire et
racinaire (Aladjadjiyan, 2002).
Ø L'augmentation de la biomasse totale (Aladjadjiyan,
2002 ; El Sayed, 2014)
Ø La diminution d'utilisation des produits chimiques
(pesticides) ainsi que les produits de fertilisation
Généralement l'eau utilisée pour
l'irrigation est une eau de puits extrêmement riche en
calcaire, face a cette contrainte, l'eau dynamisée surtout par les
procédé à champ magnétique permet :
Ø D'éviter une bonne partie de ce
problème de médiocre fonctionnement des installations
d'irrigation dues aux formations calcaires (empêche ainsi toute
probabilité d'incrustation) ;
Ø En changeant la structure des cristaux de
CaCO3, minimise la formation de dépôts
blanchâtres sur la végétation imputable au calcaire et
facilite de cette manière la photosynthèse chlorophyllienne.
6. La salinisation des
sols
La Salinisation est définie par la FAO (2001), comme un
enrichissement en sels solubles de la surface et de la tranche
supérieure du sol lorsque la salinité dans les 20 cm sommitaux
dépasse 1 à 2% (20g de sel par Kg de sol). Les sels les
plus fréquents sont des chlorures, des sulfates, et des carbonates de
sodium.
6.1. Effets de la salinisation sur les
plantes
La salinité du sol ou de l'eau est causée par la
présence d'une quantité excessive de sels.
Généralement un taux élevé de Na+ et
Cl- cause le stress salin. Le stress salin a un triple effet: il
réduit le potentiel hydrique, cause un déséquilibre
ionique ou des perturbations en homéostasie ionique et provoque une
toxicité ionique (Ben Ahmed et al., 2009). Cet état hydrique
altéré conduit à une croissance réduite et
limitation de la productivité végétale. Depuis que le
stress salin implique aussi bien le stress osmotique qu'ionique (Hayashi et
Murata,1998 ; Parida et Das, 2005), l'arrêt de la croissance est
directement relié à la concentration des sels solubles ou au
potentiel osmotique de l'eau du sol (Parida et Das, 2005). La salinité
est un facteur environnemental très important qui limite la croissance
et la productivité (Allakhverdiev et al., 2000b ; Parida et Das,
2005). Durant le début et le développement du stress salin
à l'intérieur de la plante, tous les processus majeurs tels que :
la photosynthèse, la synthèse des protéines, le
métabolisme énergétiques... sont affectés. La
première réponse est la réduction de la vitesse
d'extension de la surface foliaire, suivi par l'arrêt de l'extension avec
l'intensification du stress (Parida et Das, 2005).
6.1.1.L'effet sur la croissance
La réponse immédiate du stress salin est la
réduction de la vitesse de l'expansion de la surface foliaire ce qui
conduit à l'arrêt de l'expansion si la concentration du sel
augmente (Wang et Nil, 2000). Le stress salin résulte aussi dans la
diminution de la biomasse sèche et fraîche des feuilles, tiges et
racines (Chartzoulakis et Klapaki, 2000). La salinité accrue est
accompagnée par une réduction significative dans la biomasse
racinaire, la hauteur de la plante, le nombre de feuilles par plante, la
longueur des racines et la surface racinaire chez la tomate (Mohammad et al.,
1998). Le taux élevé de NaCl se manifeste par une croissance dans
la biomasse des racines, tiges et feuilles et une augmentation dans le ratio
partie racinaire/partie aérienne chez le coton (Meloni et al., 2001).
6.2.2. L'effet sur l'eau dans la plante
Le potentiel hydrique et le potentiel osmotique des plantes
deviennent de plus en plus négatifs avec l'augmentation de la
salinité ainsi que la pression de la turgescence (Parida et Das, 2005).
6.2.3. L'effet sur les pigments
photosynthétiques
Le taux de la chlorophylle et des caroténoïdes des
feuilles diminue en général sous les conditions de stress salin.
Les feuilles les plus âgées commencent à développer
une chlorose et finissent par tomber pendant une période
prolongée de stress salin (Agastian et al., 2000). Par contre, Wang et
Nil (2000) ont rapporté que le contenu de la chlorophylle augmente sous
les conditions de salinité chez Amaranthus. Chez Grevilea, la
protochlorophylle, la chlorophylle et les caroténoïdes diminuent
significativement sous le stress salin, mais la vitesse du déclin de la
protochlorophylle et la chlorophylle est plus importante que celle de la
chlorophylle a et les caroténoïdes. Les pigments
anthocyanines augmentent significativement dans le cas de stress salin (Parida
et Das, 2005).
6.2.4. L'effet sur la photosynthèse
Le développement des plantes est le résultat de
l'intégration et la régulation des processus physiologiques dont
le plus dominant est la photosynthèse. La croissance du
végétal autant que la production de biomasse est une mesure de la
photosynthèse nette et comme les stress environnementaux affectent la
croissance donc affectent la photosynthèse. Le stress salin cause des
effets à long et à court terme sur la photosynthèse. Les
effets à court terme se manifestent après quelques heures
jusqu'à un à deux jours de l'exposition au stress et la
réponse est importante ce qui se manifeste par un arrêt complet de
l'assimilation du carbone. L'effet à long terme s'exprime après
plusieurs jours de l'exposition au sel et la diminution de l'assimilation du
carbone est due à l'accumulation du sel dans les feuilles en
développement (Parida et Das, 2005). La diminution de la vitesse
photosynthétique est due à plusieurs facteurs : (1) la
déshydratation des membranes cellulaires ce qui réduit leur
perméabilité au CO2, (2) la toxicité du sel,
(3) la réduction de l'approvisionnement en CO2 à cause
de la fermeture hydroactive des stomates, (4) la sénescence accrue
induite par la salinité et (5) le changement dans l'activité des
enzymes causé par le changement dans la structure cytoplasmique (Parida
et Das, 2005).
Matériel et Méthodes
2.1. I.Protocole expérimental de la dynamisation de
l'eau : La technologie « Delta
Water »
L'appareil « Delta Water » est une
technologie japonaise. Il est fournie par la société KESSEMTINI
et installé au laboratoire Eau, Energie et Environnement à
l'ENIS. Ce dispositif mis en place nous permet d'effectuer plusieurs
séries expérimentales afin d'évaluer et de vérifier
l'apport de ce procédé dans la dynamisation de l'eau
(Figure7).
Le principe du procédé Delta Water est
basé sur l'application d'un champ magnétique sur l'eau. Cette
application permet de donner un mouvement et une énergie à l'eau
qui stagne dans les conduites et/ou dans les citernes de réserve. Une
eau qui stagne est un milieu propice à l'oxydation et donc aux
multiplications des bactéries du Bio film, cela intensifie aussi le
dépôt de minéraux à l'intérieur des
conduites.


Figure 7. L'installation de l'appareil Delta
water
I.1.Caractérisation
physicochimique de l'eau
La caractérisation physicochimique est
nécessaire pour mettre en évidence la qualité d'une eau
magnétisée par Delta water en le comparant avec une eau
non traitée.
Cette caractérisation est constituée par
plusieurs paramètres physicochimiques :
· Mesure du pH ;
· Mesure de la conductivité
électrique ;
· Détermination de la concentration des
anions ;
· Détermination de la concentration des
cations ;
· Test de chauffage de l'eau ;
· Test de refroidissement de l'eau ;
· Test de congélation de l'eau.
1. Mesure du pH
Le pH (potentiel Hydrogène) mesure la concentration en
ions H+ de l'eau. Il traduit ainsi la balance entre acide et base
sur une échelle de 0 à 14, 7 étant le pH de
neutralité. Ce paramètre caractérise un grand nombre
d'équilibre physico-chimique et dépend de facteurs multiples,
dont l'origine de l'eau.
Le pH doit être impérativement mesuré sur
le terrain à l'aide d'un pH-mètre ou par colorimétrie.
2.Mesure de la conductivité
électrique
La conductivité mesure la capacité de l'eau
à conduire le courant entre deux électrodes. La plupart des
matières dissoutes dans l'eau se trouvent sous forme d'ions
chargés électriquement. La mesure de la conductivité
permet donc d'apprécier la quantité de sels dissous dans
l'eau.
La conductivité (ó) se mesure a l'aide d'un
conductimètre et l'unité de mesure communément
utilisé est le Siemens (S/cm) exprimé souvent en micro Siemens/cm
(ìS/cm) ou milli Siemens (mS/cm).
Généralement, le rapport entre
conductivité (ó) et concentration ionique s'exprime par
approximation de la façon suivante :
Salinité = ó * F
F : facteur de conversion qui varie en fonction de la
variation de la conductivité (ó). Dans la gamme des eaux potables
F = 0.75.
3. Déterminations des concentrations des
anions
La détermination des anions chlorure et sulfate dans
l'eau se fait par dosage par chromatographie ionique avec détecteur
conductivimétrique.
La concentration de ces ions est évaluée par
rapport à une gamme d'étalon. L'appareil consacré est de
type Schimadzu modèle HIC-6A. A l'aide d'une colonne chim-pack et un
détecteur par conductimètre se réalise le dosage des ions
Cl- et SO42-.
Par contre les bicarbonates (HCO3-) sont
déterminés par le dosage de l'échantillon d'eau par
l'acide chlorohydrique (HCl) avec l'addition de quelques gouttes de
méthyle orange
4. Déterminations des concentrations des cations
Les éléments majeurs cationiques (Ca, Mg, Na, K)
sont mesurés par absorption atomique. Après calcination,
l'échantillon subit une attaque acide par l'addition de 2 ml d'acide
nitrique et de 2 ml d'acide chlorydrique concentré. Après, il va
subir une évaporation à une température de 160°C pour
expulser toute trace de matière organique. L'absorption atomique est de
type Fisher Scientific EC3200.
Chaque élément est rayonné par un
faisceau de radiation monochromatique d'une lampe constituée par
l'élément lui-même. Une partie du faisceau incident est
absorbée par les atomes libres et le reste est émergé.
5. Test de chauffage d'eau
Ce test permet de suivre l'évolution de la
température de l'eau en fonction du temps pour confirmer ou pas
l'aptitude de l'eau dynamisée à monter plus vite en
température.
Dans notre cas, on va comparer la vitesse de transfert de
chaleur de l'eau de robinet (témoin) à celle de l'eau
dynamisée et de l'eau de puits (brute) à celle de l'eau
dynamisée.
Ø Mode opératoire
C'est une méthode banale de chauffage d'eau qui
consiste à chauffée de l'eau dans un bécher à
l'aide d'une plaque chauffante moyennant d'un thermomètre et un
chronomètre.
On a procédé de verser 200 ml de
l'échantillon d'eau (température : 20°C à T0) dans un
bécher puis en le place sur la plaque chauffante fixé à
150°C, au même temps on déclenche le chronomètre et on
mesure la température à des intervalles de temps variables afin
de tracer des courbes représentant l'évolution de la
température d'eau en fonction du temps.
6.Test de refroidissement de
l'eau
Ce test permet de suivre l'évolution de la
température de l'eau en fonction du temps afin de confirmer ou pas
l'aptitude de l'eau dynamisée à se refroidir moins vite que l'eau
ordinaire.
Dans notre cas, on va comparer la vitesse de refroidissement
de l'eau de robinet (témoin) à celle de l'eau dynamisée et
l'eau de puits (témoin) à celle de l'eau dynamisée.
Ø Mode opératoire
C'est une méthode qui consiste au début à
chauffée de l'eau dans un bécher à l'aide d'une plaque
chauffante jusqu'a ce que la température de l'échantillon d'eau
atteint 85°C puis on déclenche le chronomètre et on mesure
la température, moyennant d'un thermomètre, à des
intervalles de temps variables afin de tracer des courbes représentant
l'évolution de la température d'eau en fonction du temps .
7. Test de congélation de l'eau
Ce test permet de suivre l'évolution de la
température de l'eau en fonction du temps afin de comparer la vitesse de
congélation de l'eau dynamisée à celle de robinet
(témoin) et de l'eau de puits (témoin) à celle de l'eau
dynamisée.
Ø Mode opératoire
C'est une méthode banale de congélation d'eau
qui consiste à congelée de l'eau dans un bécher à
l'aide d'un réfrigérateur moyennant un thermomètre et un
chronomètre. On a procédé de verser 150 ml de
l'échantillon d'eau (température : 20°C à T0) dans un
bécher puis on le place dans le réfrigérateur, au
même temps on déclenche le chronomètre et on mesure la
température à des intervalles de temps variables afin de tracer
des courbes représentant la vitesse de congélation de l'eau.
II. Technique et
Conditions de culture
Le matériel végétal utilisé dans
cette étude est la tomate (Solanum lycopersicum L.). Notre
choix a été porté sur ce matériel pour deux
raisons : d'une part ; elle est ordinairement cultivée en
jardins intérieurs des villes ; d'autres part, c'est une
légumineuse d'importance économique.
Le présent travail a été entrepris en vue
de déterminer les modifications physicochimiques du sol et
morphologiques et physiologiques des plantules de
tomates irriguées par différents
types d'eaux. Les différentes eaux utilisées sont les
suivantes :
- Eau de robinet (salinité 2g/l)
- Eau de robinet magnétisée;
- Eau de puits de salinité 3,5 g/l
- Eau de puits de salinité 3,5 g/l
magnétisée
- Eau de puits de salinité 6 g/l
- Eau de puits de salinité 6 g/l
magnétisée
Les essais ont été développés sous
serre sur des plantules de tomates âgées d'un mois. Ces plantules
sont transplantées dans des pots en plastiques de capacité 3L et
sont remplis de sol agricole. L'irrigation de ces plantules a été
effectuée suivant un intervalle de 3 jours par 100 ml d'eau
distillée pour chaque pot. Pour chaque type de traitement on' a
utilisé 10 plantules (6 types de traitement x10 plantules = 60
plantules).
II.
1. Paramètres physicochimiques du sol
1.
La granulométrie
La granulométrie est déterminée suivant
la norme AFNOR X 31-107 (AFNOR, Qualité des sols, 1994) et permet de
déterminer l'importance pondérale des particules minérales
en différenciant les argiles (< 2 ìm), des limons
(2<d<50ìm) et des sables (50<d<2000ìm).
2.Détermination du pH
La mesure du pH se fait à l'aide d'un pH mètre,
sur une suspension de sol (ou boues) et d'eau distillée dans un rapport
de 1/2.5, après une agitation de deux heures et un repos de 18
heures.
3.Détermination de la
conductivité électrique (CE)
La CE est la mesure de la teneur en sel solubles d'une
solution, elle est mesurée à l'aide d'un conductimètre de
terrain (modèle WTW LF 90), équipé d'un dispositif de
compensation de température qui permet une lecture directe à la
température de référence de 20°C. L'appareil est
préalablement étalonné avec des solutions de chlorure de
potassium (KCl). Elle est mesurée, après agitation dans le
surnageant d'une suspension de sol/eau distillée ou de boue/eau
distillée dans les proportions 1/5 en poids. Les résultats sont
exprimés en ìS/cm à 20°C.
4. Matière
organique
Elle est déterminée en faisant la
différence entre la matière sèche obtenue par
évaporation à 105°C pendant 24 heures et les résidus
issus de la calcination à 550°C pendant 5 heures.
5. Le carbone organique total COT
La méthode de
détermination du carbone organique est basée sur l'oxydation de
ce dernier par le bichromate de potassium
(K2Cr2O7) en milieu acide. La quantité
de K2Cr2O7 utilisée excède la
quantité nécessaire pour l'oxydation du carbone. L'excès
de K2Cr2O7 qui n'a pas réagit est
ensuite dosé en retour par une solution de sulfate ferreux en
présence d'un indicateur redox.
Les résultats sont exprimés en % C. En
considérant les concentrations de sulfate ferreux et du bichromate de
potassium, chaque ml de bichromate de potassium qui réagit correspond
à 4 mg de C.
Le pourcentage de carbone dans l'échantillon
exprimé en % C est déterminé comme suit :
C= ((A-B)*0,004*10*100)/P*A
Où :
C : concentration de carbone organique (% C);
A : volume de sulfate ferreux utilisé pour le
témoin (ml);
B : volume de sulfate ferreux utilisé pour
l'échantillon (ml);
10 : volume de bichromate ajouté initialement;
0,004 : nombre de g de C par ml de bichromate;
P : poids de l'échantillon titré exprimé
sur base sèche (g);
100 : facteur pour obtenir un pourcentage.
6.Détermination du phosphore total (Pt)
Le phosphore dans le sol est présent sous la forme
organique et minérale. Le phosphore total contenu dans
l'échantillon, peut être mesuré après
minéralisation (transformation des composés phosphorylés
en orthophosphate facilement dosables). L'échantillon subit une attaque
par l'acide sulfonitrique et en présence de molybdate d'ammonium formant
un anion phosphomolybdique complexe, qui après réaction avec
l'acide ascorbique donne une coloration bleu. La densité optique est
mesurée par colorimétrie à 880 nm. Les résultats
sont exprimés en mg/l d'échantillon grâce à une
courbe d'étalonnage établit par une solution de phosphate.
II.2.Les paramètres
étudiés pour le matériel végétal
II.3.1.Test de germination
Ce test permet de mesurer l'indice de germination des graines
arrosées par l'eau non magnétisée et celle
magnétisée, c'est-à-dire leur aptitude à germer
avec l'eau magnétisée
Dans notre cas, on a utilisé des graines de tomate et
on a suivie leur germination afin de déterminer :
-L'effet de la magnétisation de l'eau sur la
germination et de voir s'il y a un apport positif de l'utilisation de l'eau
magnétisée par rapport à celle non
magnétisée
- L'effet de la salinité sur la germination et ceci on
comparant les résultats relatifs à l'eau de robinet et celles
relatifs aux eaux de puits à différentes salinités (3,5
et 6 g/l).
Cette méthode consiste à mettre 10 grains de
tomates dans une boite de pétri (10 cm de diamètre), dans la
quelle on place un papier filtre afin de préserver le milieu humide.
Les grains contenues dans chaque boite de pétri sont arrosées par
5 ml de l'échantillon d'eau dynamisée, de robinet, en même
temps nous avons cultivés un témoin arrosé avec le
même volume d'eau distillée
Enfin on place ces boites de pétri dans un incubateur
à l'obscurité et à une température de 25°C
durant 5 jours.
L'indice de germination est qualifié par la
règle suivante :
Avec :
NE : nombre de graines germées
arrosées par l'échantillon d'eau étudiée ;
NT : nombre de graines germées dans le
témoin irrigué par l'eau distillée ;
LE : la moyenne de la longueur de la radicule
des graines germées pour l'échantillon d'eau
étudiée
LT : la moyenne de la longueur de la radicule
des graines germées pour le témoin (irrigué par l'eau
distillée) ;
On note que la graine n'est appréciée
germée que si la longueur de sa racine dépasse 5 mm.
II.3.2.Paramètres
morphologiques
1.Mesure de la croissance en
longueur
Les plantules ont été récoltées en
séparant les racines des tiges. Les systèmes racinaires ont
été lavés soigneusement à l'eau puis
essorés rapidement avec du papier filtre. Les longueurs des parties
aériennes et souterraines ont été mesurées à
l'aide d'une règle graduée. Les valeurs données sont les
moyennes des trois répétitions / type d'irrigation.
2. Mesure de la croissance
pondérale
La biomasse exprimée en gramme a été
effectuée par pesée de la matière fraîche, puis de
la matière sèche après étuvage à 60 °C
jusqu'à l'obtention d'un poids constant (48 h).
II.3.3.
Paramètres physiologiques
1.Mesures de la photosynthèse et de la
transpiration
Les mesures de la photosynthèse et de la transpiration
ont été effectuées à l'aide d'un analyseur de gaz
« CO2 » à infrarouge. Il s'agit d'un
appareil portable de marque (CID 301 PS, Vancouver, Washington-USA),
calibré automatiquement et fonctionnant par absorption de la
lumière. Seule la feuille est introduite dans la chambre de mesure
après avoir estimé sa surface foliaire selon la méthode
proposée par Mabrouk et Carbonneau (1996).
2.Peroxydation lipidique
La peroxydation lipidique a été
évaluée par la mesure des substances réagissant avec
l'acide thiobarbiturique (TBARS), qui comprennent des aldéhydes (dont le
MDA) et des lipides hydroperoxydés. 125 ul d'extrait, 50 ul de TBS et
125 ul de TCA 20% BHT 1% ont été mélangés pour
déprotéiniser les extraits. Après agitation et
centrifugation (1000g pendant 10 min), le surnageant a été
prélevé. 200 ul du surnageant ont été
mélangés avec 40 ul de HCl (0,6 M) et 160 ul de Tris-TBA (Tris 26
mM, acide thiobarbiturique 120 mM). Après agitation, incubation à
80?C (10 min), la densité optique a été mesurée
à 530 nm. La quantité des TBARS a été
calculée en utilisant un coef?cient d'extinction de 0,156
mM-1 cm-1.
3.Dosage de la proline
La détermination du contenu des feuilles en proline est
effectuée selon la méthode Bates et al., (1973).
4. Dosages des pigments chlorophylliens
L'extraction des pigments chlorophylliens est effectuée
par broyage de 50 mg de matière fraiche suivi d'une centrifugation
à 2700 tr/mn pendant 10 min. Le surnageant est prélevé et
une lecture de son absorbance dans les longueurs d'onde suivantes :
663nm ; 645 nm et 470nm.
Les teneurs en chlorophylles sont déterminées
suivant l'équation de Lichtenthler1987 :
Chla= (11, 24*Do663) - (2, 04 *Do645)
Chlb = (20, 13* Do645) - (4, 19*
Do663)
Chl(a+b) = (7,05* Do663) +(18,09*
Do645)
Caroténoides = 1000* Do470-(1, 9* Chla -63,
14*Chlb)/214
5.Détermination du contenu
relatif en eau (RWC)
Le contenu relatif en eau (RWC) est une caractéristique
de l'état hydrique de la plante faisant appel à la mesure de la
quantité d'eau contenue dans les organes végétaux
(feuilles). La technique de détermination de ce paramètre
consistait à mesurer les poids frais, saturé et sec des tissus
végétaux ce qui nous permet de déduire :
RWC = (Pf - Ps)/ (Psat - Ps) x 100 (Laouar, 1977)
Où Pf, Ps et Psat désignent respectivement le
poids frais (en mg), le poids sec et le poids à la saturation de
l'échantillon. La saturation est réalisée sur des feuilles
entières; elles sont mises à l'obscurité à une
température de 5°C, pétiole trempant dans l'eau, sous un
bêcher tapissé à l'intérieur avec du papier filtre
humide. Le temps de saturation des feuilles est de l'ordre de 24 heures pour
obtenir le poids à la saturation. La dessiccation est faite dans
l'étuve à 90°C pendant 48 heures.
6.
Analyse de la composition minéralogique
Le matériel végétal ayant servi à
la détermination de la biomasse est soumis à une extraction
à chaud en présence d'un mélange nitroperchlorique (HNO3/
HClO4; 2V/ 1V). Le rapport matière végétale sèche /
mélange acide est de 1/15 (W /V) [1 g de MS nécessitent 15 ml du
mélange acide]. Après refroidissement, les minéralisats
sont recueillis dans des fioles de 25 ml qu'on ajuste à l'aide de l'eau
bidistillée.
7.Le potentiel hydrique foliaire
Le potentiel hydrique foliaire est mesuré par la
technique de la chambre à pression de Scholander (modèle SKPM
1400, Skye Instruments, Powys, UK). La feuille, fraîchement
récoltée, est insérée dans un bouchon pour en
assurer son étanchéité et immédiatement
placée dans la chambre. L'extrémité coupée
dépasse de quelques millimètres à l'extérieur du
bouchon afin de pouvoir observer l'affleurement de la sève au niveau de
la section des vaisseaux. La pression appliquée est augmentée
doucement dans la chambre jusqu'à ce que la sève apparaisse. La
pression qui provoque la sortie de la première goutte, exprimée
en MPa correspond à l'opposé du potentiel hydrique de la feuille.
Pour plus de précision, l'observation se fait à la loupe
binoculaire.
8.La perméabilité
membranaire
La perméabilité membranaire a été
mesurée par le test de fuite d'électrolytes. Ce dernier est
basé sur la mesure de l'électroconductivité d'un milieu
aqueux où des échantillons de feuilles ont
séjourné. L'efflux d'électrolytes a été
mesuré selon le protocole de Campos et al. (2003). Ainsi, 1 g de
feuilles ont été coupés en petits morceaux de 5 mm de
longueur et mis dans des tubes à essai contenant 10 ml d'eau
distillée désionisée et, incubées à la
température ambiante sur un agitateur rotatif pendant 24 heures.
Ensuite, la conductivité électrique du milieu initial (EC1)
était évaluée. Les échantillons ont
été placés dans une étuve (90 ° C) pendant 2
heures pour expulser tous les électrolytes. Les échantillons ont
été refroidis à 25 ° C et seconde conductivité
électrique (CE2) a été mesurée.
Fuite d'électrolyte totale (%) = (CE1 / CE2) ×
100
9. Détermination de la teneur de
H2O2
La teneur en H2O2 des tissus a
été mesurée par spectrophotométrie (Cecil,
Modèle N ° CE7200), selon Loreto et Velikova (2001). Ainsi, 1 g de
l'échantillon a été homogénéisé dans
3 ml d'acide trichloroacétique (TCA) (1%) et centrifugé à
10 000 g pendant 10 min à 4 ° C. Ensuite, 0,75 ml du surnageant a
été ajouter au tampon phosphate 0,75 ml de 10 mM (pH 7,0)
contenant 1,5 ml de 1 M KI. Une lecture de l'absorbance a été
mesurée à 390 nm.
RESULTATS ET DISCUSSION
2.2. I. Estimation de l'efficacité de l'appareil de
magnétisation : Delta Water
2.3. I.1.Etude physico-chimique des eaux
utilisées
Pour étudier l'effet combiné de la
salinité et de la magnétisation des eaux sur le
développement des plantes, une caractérisation physicochimique
des eaux utilisées au cours de cette étude a été
effectuée et a intéressé l'analyse des
éléments majeurs, le pH et la salinité (Tableau 1)
Pour cette étude on a utilisé 3 types
d'eaux :
- l'eau de robinet de salinité 2g/l de la zone urbaine
de Sfax durant la période du printemps 2015 ;
- l'eau de puits de la nappe phréatique de Sfax de
salinité 3,5g/l ;
- et l'eau de puits de la nappe phréatique de Sfax de
salinité 6g/l
Ces trois types d'eaux ont subi une magnétisation par
l'appareil de magnétisation de l'eau Delta Water.
Tableau 1. Qualité
physicochimique des différents types d'eaux
utilisées
|
Eau de robinet de salinité 2g/l
|
Eau de puits de salinité 3,5g/l
|
Eau de puits de salinité 6g/l
|
|
non magnétisée
|
magnétisée
|
non magnétisée
|
magnétisée
|
non magnétisée
|
magnétisée
|
|
Ph
|
7,52
|
7,75
|
7,24
|
7,46
|
7,14
|
7,46
|
|
Conductivité (ms/cm)
|
2,53
|
2,37
|
4,66
|
4,5
|
8,13
|
7,99
|
|
Salinité (g/l)
|
2,1
|
2
|
3,49
|
3,37
|
6,09
|
5,99
|
La caractérisation
physicochimique de ces eaux utilisées, dans notre
expérimentation, avant et après magnétisation montre que
la magnétisation entraine une légère augmentation du pH et
une légère diminution de la conductivité électrique
(Tableau 1). Cette légère diminution du pH ne dépasse pas
les 0,2 unités pour les différents types d'eaux.
2.4. I.2.Composition
minéralogique de l'eau
A partir de l'analyse de la composition minéralogique
des échantillons d'eaux utilisées pendant cette étude on
peut tirer les deux points suivants (Tableau 2) :
-Les deux types d'eaux de puits utilisées
présentent des concentrations élevées en Ca2+,
Mg2+ et K+ par rapport à l'eau de robinet.
-La magnétisation de l'eau montre des variations non
significatives des cations et des anions analysées pour les
différents types d'eaux..
Tableau 2. Concentration des
éléments majeurs (mg/l) de différentes catégories
d'eau
|
Eau de robinet
2g/l
|
Eau de puits de salinité 3,5g/l
|
Eau de puits de salinité 6g/l
|
|
non magnétisée
|
magnétisée
|
non magnétisée
|
magnétisée
|
non magnétisée
|
magnétisée
|
|
Ca2+ (mg/l)
|
55
|
49
|
74
|
72
|
149
|
149
|
|
Mg2+ (mg/l)
|
43
|
42
|
77
|
75
|
141
|
140
|
|
K+ (mg/l)
|
9
|
11
|
12
|
13
|
14
|
14
|
|
Na+ (mg/l)
|
390
|
381
|
560
|
550
|
894
|
900
|
|
Cl-(mg/l)
|
490
|
480
|
500
|
490
|
728
|
750
|
|
SO42-(mg/l)
|
400
|
390
|
1000
|
950
|
1445
|
1453
|
|
HCO3-(mg/l)
|
225
|
240
|
300
|
334
|
324
|
339
|
2.5. I.3.Evoluation du pH en fonction du temps
Le suivi de l'évolution du pH des différentes
catégories d'eaux utilisées a été
effectué dans des intervalles de 30 mn pendant 2h (Tableau 3).
D'après ces résultats, on signale une légère
augmentation progressive des valeurs du pH des eaux magnétisées
par rapport à celles non magnétisées. Cette augmentation
est de l'ordre de 0.2 unité.
Tableau 3. Evolution du pH des eaux en fonction du
temps
|
Eau de robinet de salinité 2g/l
|
Eau de puits de salinité 3,5g/l
|
Eau de puits de salinité 6 g/l
|
|
N.T.
|
T.
|
N.T.
|
T.
|
N.T.
|
T.
|
|
T= 0
|
8.07
|
8.28
|
7.21
|
7.60
|
7.16
|
7.54
|
|
T=30
|
8.06
|
8.27
|
7.20
|
7.63
|
7.14
|
7.58
|
|
T=60
|
8.06
|
8.28
|
7.21
|
7.62
|
7.16
|
7.59
|
|
T=90
|
8.07
|
8.27
|
7.21
|
7.62
|
7.16
|
7.59
|
|
T=120
|
8.06
|
8.27
|
7.21
|
7.61
|
7.16
|
7.59
|
N.T. :non magnétisée ; T :
traitée par magnétisation
2.6. I.4.Test de chauffage de l'eau
Ce test est réalisé pour étudier la
vitesse de transfert de chaleur en fonction du temps dans l'eau
magnétisée et l'eau non magnétisée. D'après
la figure 8, on constate que la vitesse de transfert de chaleur de l'eau
magnétisée est pratiquement comparable à l'eau non
magnétisée que ce soit pour les eaux légèrement
salées ou fortement salées.

Figure 8. Evolution de la température des eaux
magnétisées (T) et non magnétisées (N.T.) suite
à un chauffage électrique.
(N.T. :non
magnétisée ;T :magnétisée)
I.5.Test de refroidissement de l'eau
Cette expérience est réalisée pour
comparer la vitesse de refroidissement de l'eau. En effet, après le
chauffage des 6 échantillons d'eaux nous avons effectué la mesure
de la température en continue pour évaluer la vitesse de chute de
la température.
L'examen de la figure 9 montre que le refroidissement des 6
types d'eaux est pratiquement presque identique. Il ressort de cette
expérience que cette technique d'évaluation du transfert de
chaleur ne montre pas une distinction claire entre l'eau
magnétisée et non magnétisée
 Figure 9. Evolution de la température de refroidissement
des eaux magnétisées et non
magnétisées. Figure 9. Evolution de la température de refroidissement
des eaux magnétisées et non
magnétisées.
2.7. I.6.Test de congélation de l'eau
Cette expérience est élaborée dans le but
de différencier la vitesse de congélation en fonction du temps
entre l'eau magnétisée et l'eau brute des 3 types d'eaux (eau de
robinet, eaux de puits avec une salinité. égale à 3.5 et
eaux de puits avec une salinité égale à 6 g/l. Avec ce
test, on étudie l'amélioration de la qualité physique de
l'eau apporté par la magnétisation qui peut influencer la
vitesse de transformation de l'eau d'un état physique à un
autre.
D'après la figure 10, on remarque qu'il y a une
légère différence significative entre la vitesse de
congélation des eaux traitées par magnétisation et celles
non magnétisées. En fait, la congélation des eaux
traitées est légèrement plus rapide que celles des eaux
non traitées.

Figure 10. Evolution de la température de
congélation de l'eau magnétisée et non
magnétisée
II.Caractérisation
physico-chimique du sol avant et après l'irrigation du sol par l'eau
magnétisée
II.1. Caractérisation physico-chimique du sol
avant l'irrigation du sol par l'eau magnétisée
1. Texture du sol
L'analyse granulométrique du sol montre une texture
limono-sableuse (tableau 4). On se référant à la
classification cité par Hénin (1969 in INITA, 2000), ce sol
appartient à la classe des textures grossières.
Tableau 4. Analyse
granulométrique du sol
|
Constituant
|
Sable
|
Limon
|
Argile
|
|
Proportion (%)
|
64.3 %
|
29%
|
6.3 %
|
2. Caractéristiques chimiques du
sol
Les analyses chimiques du sol avant l'irrigation par l'eau
magnétisée ont été regroupées dans le
tableau 5.
Le sol montre un pH légèrement alcalin avec une
faible conductivité électrique. La MO de ce sol de l'ordre de
0.75% montre qu'il s'agit d'un sol pauvre en MO. Cette gamme de concentration
est bien connue pour les sols du sud tunisien (MO<1%). La composition du sol
se montre pauvre en éléments fertilisants (N, P et K).
Tableau 5. Caractérisation chimique du sol
utilisé dans notre étude
|
Paramètres
|
Temps 0
|
|
pH
|
7.34
|
|
Matière organique (%)
|
0.75%
|
|
COT (%)
|
0.4 %
|
|
Conductivité (us/cm)
|
113
|
|
Phosphore total (mg /kg)
|
9.68
|
|
Azote total (mg /kg)
|
0.015
|
|
C/N
|
26,6
|
|
Mg (mg/kg)
|
597
|
|
Na (mg/kg)
|
141
|
|
K (mg/kg)
|
701,5
|
|
Ca (mg/kg)
|
914.5
|
|
Fe(mg/kg)
|
520
|
|
Mn (mg/kg)
|
130
|
|
Cu (mg/kg)
|
26
|
|
Zn (mg/kg)
|
78
|
|
Cr (mg/kg)
|
265
|
|
Pb (mg/kg)
|
25
|
|
Ni
|
<0 ,01
|
II.2. Caractérisation physico-chimique du sol
après l'irrigation par l'eau magnétisée
1. Evolution du pH
Le pH moyen du sol utilisé dans notre
expérimentation est de l'ordre de 7.34. Cette valeur de pH est
considérée comme légèrement basique. Ce domaine de
pH diminue la disponibilité de certains minéraux pour les
plantes. La matière organique présente dans le sol est
relativement faible avec une concentration de l'ordre de 0.7% (tableau 7) avec
0.015 ppm en azote et 9.68 ppm de phosphore.
L'évolution du pH en fonction du temps montre une
augmentation légère et progressive suivant pratiquement une
même allure que se soit pour le cas du sol irrigué par l'eau
normale ou par l'eau magnétisée. Après 30 jours
l'augmentation du pH atteint en moyenne 0,5 unité.
L'évolution du pH en fonction du temps montre une
augmentation légère et progressive suivant pratiquement une
même allure que se soit pour le cas du sol irrigué par l'eau
normale ou par l'eau magnétisée (Figure 11). Après 30
jours l'augmentation du pH atteint en moyenne 0,5 unité.

Figure 11. Evolution du pH des sols en fonction de la
magnétisation et de la salinité
2. Evolution de la conductivité
électrique
Pour le cas de la conductivité électrique, le
sol irrigué par les eaux normales sans traitement on enregistre une
augmentation progressive de la CE en fonction du temps (Figure 12). Par contre
le sol irrigué par des eaux magnétisées indique une
décroissance progressive de la CE en fonction du temps. Cette
décroissance est de l'ordre d'une unité de mS/cm pour l'eau de
robinet, 2 unités pour l'eau de salinité 3,5 g/l et de 3
unités pour le sol irrigué par l'eau de salinité 6g/l.

Figure 12. Evolution de la conductivité
électrique des sols en fonction de la magnétisation et de la
salinité
II. Réponses morphologiques et physiologiques des
plantules de tomates irriguées par des eaux de salinité
croissantes et magnétisées
II.1. Effets de la
salinité et de la magnétisation de l'eau sur la
germination
La figure 13 illustre l'effet de la salinité et la
magnétisation sur la germination. Ces résultats
montrent :
- un certain nombre de différences entre l'effet d'une
eau magnétisée et la même eau non magnétisée
sur la germination de graines de tomate. Les résultats montrent bien
l'action positive de la magnétisation de l'eau sur la germination.
- L'arrosage des graines de tomates par des eaux
magnétisées de salinité 3,5 g/l donne le meilleur indice
de germination. Ces résultats reflètent bien l'importance des
éléments minéralogiques présents dans ces eaux par
rapport aux eaux de salinité moins faibles (2 g/l).
-L'arrosage des graines par les eaux magnétisées
de salinité 6 g/l donne un indice de germination plus faible que les
eaux de salinité 3,5 g/l. Ces résultats témoignent
l'apport négatif de ces eaux sur la germination. L'excès de la
salinité a joué un rôle inhibiteur sur la germination.

Figure 13. L'effet de la magnétisation et la
salinité sur la germination des graines de tomates pour
différents types d'eaux
II.2. Effets de la
magnétisation de l'eau et de la salinité sur la
croissance des plantules de tomate
1.Effets de la
magnétisation et da la salinité sur le nombre de feuilles
Le nombre de feuilles est un indice de bonne production en
biomasse par la plante et de bonne alimentation en eau et en sels
minéraux (Derrouiche, 2012).
La figure 14 représente le nombre de feuilles des
plantules de tomate relatif aux différents types d'eaux. Les
résultats montrent que :
· Le nombre des feuilles est plus élevé
chez les plantules traitées par les eaux des puits
· La magnétisation à un effet positif sur
le nombre des feuilles. Cet effet positif est d'autant plus important avec
l'eau magnétisée de salinité 3,5g/l.

Figure 14. L'effet de la magnétisation et la
salinité sur le nombre des feuilles des plantules de tomates
1. Effets de la magnétisation et da la
salinité sur la croissance en longueur des plantules
La magnétisation de l'eau à un effet positif sur
la croissance des plantules même avec la plus forte salinité
utilisée dans cette étude qui est 6g/l (Figure 15).
La mesure de la longueur totale de la tige et de la racine
montre une augmentation de la longueur de ces organes suite à
l'irrigation par les eaux magnétisées (Figures 16 et 17). Le
pourcentage d'augmentation de ces paramètres est de l'ordre 2 fois plus
important chez les plantules irriguées par l'eau
magnétisée de salinité 6g/l par rapport à l'eau non
magnétisée de même salinité.

Eau de S=6 magnétisée
Eau de S=6 non magnétisée
Figure 15. Effet de la magnétisation des eaux
d'irrigation sur la croissance des plantules de tomates irriguées par
l'eau magnétisée de salinité 6g/l pendant un
mois.

Figure 16. Effets de la salinité et de la
magnétisation sur la longueur de la tige
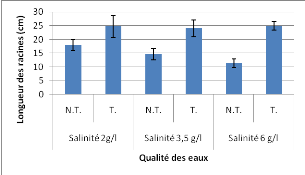
Figure 17. Effets de la salinité et de la
magnétisation sur la longueur des racines
3. Effets de la salinité et la
magnétisation sur la production de biomasse
Les résultats relatifs aux effets de la salinité
et de la magnétisation sur la croissance (exprimée en masse de
matière fraiche ou séche par organe) après un mois de
traitement sont illistrés par les figures 18 et 19.
La première conclusion importante que l'on peut etre
tenté de déduire à la lumière de ces
résultats est l'effet stimulant de la magnétisation et de la
forte salinité sur la production de biomasse des trois organes
analysées. Cette stimulation de la production de biomasse interesse
surtout les feuilles.

Figure 18 . Effets de la salinité et de la
magnétisation sur la masse de la matière fraiche des organes des
plantules de tomates.
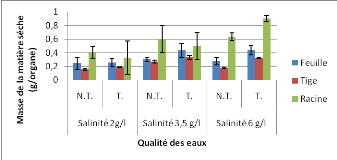
Figure 19. Effets de la salinité et de la
magnétisation sur la masse de la matière séche des organes
des plantules de tomates.
4. Effets de la salinité et la
magnétisation sur le contenu relatif en eau et sur le potentiel hydrique
foliaire
D'après le tableau 6, on remarque que les plantules
irriguées par les eaux magnétisées sont plus
hydratées que les plantules irriguées par les eaux non
magnétisées. Ces résultats sont aussi confirmés par
les résultats obtenus pour le potentiel hydrique foliaires. Pour le
potentiel hydrique foliaire, il est connu que, chaque fois que la
salinité de l'eau d'irrigation augmente, la plante doit exercer plus
d'énergie par unité d'eau absorbée, comparativement
à une plante irriguée avec de l'eau douce. En effet,
l'augmentation de la salinité dans notre cas d'étude n'a pas
entrainé un effet négatif sur l'état hydrique des
plantules.
Tableau 6. Effets de la salinité et la
magnétisation sur le contenu relatif en eau et sur le potentiel hydrique
foliaire
|
Salinité 2g/l
|
Salinité 3,5 g/l
|
Salinité 6 g/l
|
|
N.T.
|
T.
|
N.T.
|
T.
|
N.T.
|
T.
|
|
Contenu relatif des feuilles en eau (%)
|
28,4#177;4,32
|
55,35#177;8,6
|
34,58#177;2,11
|
39,34#177;3,25
|
51,65#177;5,8
|
63,27#177;6,8
|
|
Potentiel hydrique foliaire (MPa)
|
-4,5
|
-2,5
|
-3
|
-2
|
-3
|
-2
|
II.3.
Effets de la magnétisation de l'eau et de la salinité sur la
réponse biochimique des plantules de tomate
1. Effets de la magnétisation de l'eau et de la
salinité sur les teneurs des pigments chlorophylliens
Lors de notre travail, l'apport excessif de sel dans le
substrat suite à l'irrigation par les eaux de salinité 3,5 et 6
g/l a eu une répercussion négative sur la synthèse de la
chlorophylle (Figure 20). En effet, les sels peuvent interférer avec les
processus photosynthétiques d'une manière direct via une
inhibition des enzymes de synthèse de la chlorophylle. La diminution de
l'activité photosynthétique, lors d'un stress salin, est en
relation avec la fermeture des stomates.
La comparaison des teneurs en chlorophylles des plantules
irriguées par l'eau magnétisées à celle non
magnétisées montre bien l'apport positive de la
magnétisation sur les teneurs des pigments chlorophylliens.

Figure 20. Effets de la magnétisation de
l'eau et de la salinité sur les teneurs des pigments
chlorophylliens
2. Effets de la magnétisation de l'eau et de la
salinité sur la formation des peroxydes d'hydrogène
(H2O2)
L'irrigation des plantules de tomates par les eaux de puits
salines entraine une augmentation de la formation de H2O2
dans les feuilles et les racines (Figure 21). Ces résultats semblent en
concordance avec d'autres travaux réalisés sur l'effet du stress
salin sur les plantes ayant montré que ce stress induit la production et
la formation des peroxydes d'hydrogène (H2O2). Ces formes causent des
dommages oxydatifs à différentes composantes cellulaires tels que
les lipides membranaires, les protéines et les acides nucléiques
(Halliwell et Gutteridge, 1989).
La magnétisation de l'eau a entrainé une
diminution de la formation de H2O2. Ces résultats
montrent que le traitement magnétique induit chez les plantes
irriguées par les eaux magnétisées des réponses
biochimiques ayant un rôle crucial dans la réduction des effets
nuisibles du stress salin.

Figure 21. Effets de la magnétisation de l'eau
et de la salinité sur la formation du peroxydes d'hydrogène
(H2O2).
3.Effets de la magnétisation de l'eau et de la
salinité sur l'accumulation de la proline
L'accumulation de la proline a été
démontrée chez de nombreuses espèces et dans
différentes situations de stress (osmotiques, hydriques, thermiques)
(Blum, 1996). Plus le niveau de stress appliqué augmente plus les
teneurs en proline deviennent plus marquées (Savouré et
al., 1995). Généralement les teneurs en acides
aminés (surtout la proline) à l'état libre s'accroissent
rapidement chez de nombreuses espèces végétales soumises
à un stress salin (Levigneron et al.,. 1995). La proline est
l'osmolyte le plus commun pour les plantes (Erskine et al.,
1996). Les plantules de tomates soumises à l'irrigation par les
différents types d'eaux non magnétisées répondent
de la même manière à la production de la proline (Figure
22). Ce pendant, la magnétisation a entrainé une diminution de la
formation de la proline ce qui se traduit par le fait que la
magnétisation à neutraliser les effets ioniques et osmotiques de
l'accumulation du sel.

Figure 22. Variation de l'accumulation de la proline
selon le traitement de l'eau et l'intensité du stress salin
4. Effets de la magnétisation de l'eau et de la
salinité sur la peroxydation membranaire
Le malondialdehyde (MDA) est un marqueur de l'oxydation des
lipides (Esterbauer, 1993). Le dosage des MDA représente donc une
première approche de l'exploration du stress oxydant. Suite à
l'irrigation des plantules de tomate par les eaux magnétisées on
constate une diminution de la formation du MDA et cet effet est d'autant plus
marqué avec la salinité la plus élevée (Figure 23).
On peut tirer que la magnétisation des eaux salines diminue le stress
oxydatif.

Figure 23. Effets de la magnétisation de l'eau
et de la salinité sur l'accumulation des produits de
peroxydation des lipides membranaires
5. Effets de la magnétisation de l'eau et de la
salinité sur l'intégrité membranaire
Les résultats de la Figure 24 montrent que le
pourcentage de fuite d'électrolytes est plus élevé chez
les plantes stressées (plantes irriguées par l'eau de
salinité 3.5 et 6 g/l) que chez les plantes irriguées par les
eaux de salinité 2 g/l. L'irrigation par l'eau magnétique montre
que ce traitement a diminué le pourcentage de fuite d'électrolyte
par rapport aux plantules irriguées par l'eau non
magnétisées.

Figure 24. Pourcentage de fuite d'électrolytes
en fonction du type de l'irrigation
Conclusion
L'objectif de ce travail consiste à explorer (i) les
avantages de l'irrigation par les eaux magnétisées sur les
caractéristiques du sol et (ii) ses effets sur la croissance et le
développement des plantules de tomate.
Les essais ont été réalisés sous
serre. Différents paramètres caractérisant le substrat de
culture et des paramètres morphologiques et physiologiques
caractérisant le matériel végétal ont
été déterminés.
Les résultats de la caractérisation des
substrats utilisés ont montré que l'irrigation par les eaux
salines magnétisées entraine un effet bénéfique en
diminuant la conductivité électrique du sol. Les résultats
rapportés dans ce mémoire, permet de ressortir que la
magnétisation de l'eau donne un plus value même pour les eaux
souterraines salines.
En ce qui concerne, l'effet de la magnétisation sur les
caractéristiques du matériel végétal les
résultats montrent des effets bénéfiques sur la croissance
et les paramètres biochimiques et physiologiques des plantules de
tomates.
   
| 


