|
Sommaire
I-Généralités sur les
matériaux
1
1-Matière première
2
Matériau
2
Les types de matériaux
2
les métaux
3
Les alliages
4
Les
polymères
4
Les céramiques
6
Les matériaux composites
7
Généralités sur les
biomatériaux
9
Généralités
9
Définitions
10
Les différents types de
biomatériaux
10
Métaux purs
11
Alliages métalliques
11
Céramiques
16
Polyméres
22
Matériaux naturels :
30
Corail
30
collagène
31
Méthodes de synthèse des
biomatériaux pour la reconstruction osseuse
32
1-
Méthode par fusion.
32
2- Méthode sol-gel
33
Propriétés mécaniques des
biomatériaux
37
Cet exposé
présente les biomatériaux en
commençant par une définition, un
historique, les différents matériaux
utilisés par domaine d'application biomédicales et
industriels, des exemples d'application tels que la
prothèse dentaire, la prothèse de la hanche ou la prothèse
du genou. Pendant de nombreuses années le développement
des biomatériaux s`est focalisé sur la
synthèse ou l'utilisation de produits inertes avec l'objectif principal
d'une biotolérance au niveau des sites d'implantation. Désormais,
la recherche se dirige vers des matériaux Bio-actifs,
Bio-résorbables qui interagissent avec l'organisme.
Généralités sur les
matériaux
Matière première
Une matière
première est une substance d'origine naturelle qui doit être
transformée afin d'être utilisée dans la fabrication d'un
objet technique. La matière
nécessaire à la
fabrication d'un objet
provient toujours, au départ, d'une substance que l'on retrouve dans la
nature. Cette substance doit être transformée avant de pouvoir
entrer dans la composition d'un objet. Les matières premières
peuvent être d'origine végétale, animale, minérale
ou ligneuse.
Matériau
Un matériau est une substance qui
provient de la transformation d'une matière première et qui se
retrouve sous une forme adéquate pour entrer dans la fabrication d'un
objet technique.
Lors de la fabrication d'un objet, tout ce qui se retrouve
dans le produit final constitue un matériau de cet objet. Les
matériaux proviennent de matières premières qui ont
été transformées afin de leur donner des formes ou
des
propriétés
mécaniques adéquates à la fabrication d'un objet.
On classe souvent les matériaux en différentes
catégories : les
métaux, les
céramiques,
les polymères, les
matières
plastiques et les
matériaux
composites.
Les types de
matériaux
Il existe différents types de
matériaux qui possèdent tous des caractéristiques et
des propriétés mécaniques qui leurs sont propres. Sur le
marché existe des milliers de matériaux différents. Lors
de la fabrication d'un objet technique, il importe de choisir celui qui
répondra le mieux à nos besoins en fonction des
caractéristiques qu'il possède. Il existe plusieurs
catégories de matériaux différents, Il existe des
matériaux naturels comme :
ü les minéraux : ils sont extraits du sol (eau,
terre, sable...),
ü les organiques d'origine végétale (bois,
coton, lin...),
ü les organiques d'origine animale (laine, viande, lait,
corne...).
Il existe aussi des matériaux artificiels ; ils
n'existent pas dans la nature. Il faut donc un travail humain pour transformer
des matériaux naturels afin de créer de nouveaux
matériaux. C'est ce qu'on appelle les matériaux de
synthèse.
ü les métaux que l'on extrait à partir des
minéraux (cuivre, zinc, argent, aluminium, plomb...),
ü les alliages qui sont des mélanges de plusieurs
métaux (bronze, laiton, ...),
ü les plastiques que l'on crée à partir
d'éléments naturels comme le bois, le charbon et le
pétrole... (PVC, caoutchouc, polystyrène, polyamide, Nylon...).
Classes de matériaux
On classe généralement les matériaux
en quartes grandes catégories :
ü Les métaux et les
alliages,
ü Les polymères et
matières plastiques,
ü Les
céramiques,
ü Les matériaux
composites.
Les
métaux
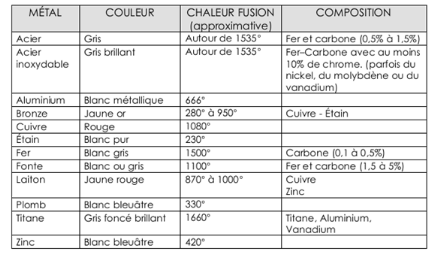
Un métal est un matériau extrait d'un
minerai. C'est une substance généralement brillante, qui conduit
bien l'électricité et la chaleur. Tout comme les
bois, les métaux
proviennent de la nature. On les extrait dans les mines, à partir de
minerais retrouvés dans la
croûte terrestre. Il
faut donc séparer le métal désiré des autres
substances retrouvées dans les minerais. On retrouve les métaux
dans la partie gauche du
tableau
périodique (à l'exception de l'hydrogène). Ce
sont généralement des substances brillantes, qui conduisent
l'électricité et la chaleur. Certains métaux
résistent à la corrosion, d'autres non, de même que
certains sont magnétiques et d'autres non.
Les alliages
Un alliage est un
mélange
homogène de deux ou plusieurs métaux dans le but
d'obtenir des propriétés mécaniques précises. Les
métaux sont rarement utilisés à l'état pur. Un
alliage permet de combiner les propriétés des différents
métaux qui sont mélangés. On peut donc créer des
matériaux qui possèdent exactement les propriétés
adaptées à des besoins très précis. On peut, par
exemple, augmenter la dureté d'un métal et ainsi accroître
sa résistance à l'usure tout en conservant une bonne
malléabilité. On classe généralement les alliages
en deux catégories : les alliages ferreux et les alliages non ferreux.
Pour déterminer rapidement si un alliage est ferreux ou non, il suffit
d'approcher un aimant de l'alliage en question. Si l'alliage est ferreux, il
attirera l'aimant alors qu'il n'y aura pas d'attraction s'il s'agit d'un
alliage non ferreux.
Les polymères
Molécule de masse moléculaire
élevée constituée de monomères unis les uns aux
autres par des liaisons covalentes. Il existe de nombreux matériaux
polymères utilisés dans les biomatériaux. Les deux grandes
tendances pour l'usage de ces matériaux concernent :
-
La recherche de polymères fonctionnels
Susceptibles d'avoir une fonction chimique à
l'interface matériau-tissu vivant. C'est par exemple en fixant sur le
polymère des particules ionisés permettant une meilleure
reconstruction osseuse ou ligamentaire.
Cette fonctionnalité peut aussi prendre source dans la
modification de l'état de surface du polymère.
-
La recherche de polymères résorbable
Tels que les copolymères d'acide lactique et
glycolique utilisables en chirurgie orthopédique et
traumatologique, ou les polyanhydrides ou les polyaminoacides qui sont
utilisés dans les formes retard de médicaments.
Les matières plastiques
Un plastique est un matériau
synthétisé à partir de polymères. L'utilisation des
matières plastiques est beaucoup plus récente que celle du bois
ou des métaux. La première matière plastique ayant
été utilisée était simplement un caoutchouc naturel
produit par certains végétaux. C'est en 1839 que Charles Goodyear
a inventé le procédé de vulcanisation qui permet de
fabriquer du caoutchouc artificiel à partir du soufre. Depuis, de
nombreux plastiques ont été synthétisés en
laboratoire par des réactions de polymérisation.
Les matières plastiques ne se retrouvent pas à
l'état naturel, sauf dans le cas des caoutchoucs naturels. Elles doivent
être synthétisées en laboratoire. Pour ce faire, on utilise
des substances provenant du raffinage des combustibles fossiles (du
pétrole et du gaz naturel). Ces substances, nommées
monomères, sont assemblées en une longue chaîne de
molécules, appelée polymère, lors du procédé
de polymérisation. On classe les matières plastiques en trois
catégories : les
thermoplastiques,
les
thermodurcissables et
les
élastomères.
Thermoplastiques
Un thermoplastique est une matière plastique
qui, sous l'effet de la chaleur, fond ou ramollit suffisamment pour pouvoir
être remodelée un nombre infini de fois, et ce, sans que ses
propriétés mécaniques soient modifiées.
Les thermoplastiques ont la propriété de ramollir
à la chaleur et de durcir au froid. Il est donc possible de leur donner
une nouvelle forme, et ce, à répétition, sans affecter
leurs propriétés mécaniques initiales. Cette
particularité permet un recyclage plus facile de cette catégorie
de plastique, en comparaison avec celui des deux autres types. Les
thermoplastiques sont de loin les plastiques les plus utilisés,
représentant plus des trois quarts de toutes les matières
plastiques produites dans le monde.
Thermodurcissables
Un thermodurcissable est une matière plastique
qui reste dure en permanence, même sous l'effet de la chaleur. Sa perte
d'élasticité est irréversible.
Contrairement aux thermoplastiques qui ramollissent sous l'effet
de la chaleur, les thermodurcissables ont perdu cette propriété
lors de leur fabrication. Ainsi, un thermodurcissable conserve la même
rigidité sous l'action de la chaleur jusqu'à l'atteinte de sa
température de décomposition. Aussi, une fois produit, on ne peut
plus modifier la forme d'un thermodurcissable. Les thermodurcissables sont
difficiles à recycler; au Québec, ils ne le sont pas. Ces limites
expliquent, en partie, le fait qu'ils soient moins utilisés que les
thermoplastiques.
Élastomères
Un élastomère est une matière
plastique qui possède les propriétés du caoutchouc
naturel, principalement une grande élasticité et une grande
extensibilité. On distingue généralement les
élastomères naturels des élastomères
synthétiques. Les premiers proviennent du latex
sécrété par certains végétaux, par exemple
par l'hévéa. Ils sont toutefois beaucoup moins utilisés
que les élastomères synthétiques qui sont, quant à
eux, produits en laboratoire grâce au procédé de
vulcanisation. Ce procédé consiste à ajouter du soufre au
caoutchouc, permettant ainsi d'en réduire l'élasticité,
mais d'en améliorer la résistance. Malgré leurs
propriétés mécaniques avantageuses, les
élastomères ont l'inconvénient d'être des
matières plastiques difficiles à recycler.
Les céramiques
Une céramique est un matériau solide
obtenu par le chauffage d'une substance minérale, comme le sable ou
l'argile. La catégorie des céramiques est aussi utilisée
depuis fort longtemps. Traditionnellement, les objets en céramique
servaient surtout en cuisine, pour de la vaisselle et des pots, et en art. Ils
étaient faciles à produire grâce aux techniques de poterie
et la
matière
première utilisée était abondante. Toutefois, ces
céramiques avaient une faible résistance mécanique; elles
cassaient donc facilement. De nos jours, les industries emploient de meilleures
matières premières et des procédés de fabrication
plus complexes. Les céramiques modernes sont beaucoup moins fragiles et
elles peuvent ainsi être utilisées dans de nombreux domaines.
Les matériaux
composites
Un matériau composite peut être défini
comme l'assemblage de plusieurs matériaux de natures différentes
à l'échelle microstructurale. Les composites sont le plus souvent
constitués d'une matrice dans laquelle on a dispersé de
façon contrôlée ou non des renforts (fibres). La matrice
maintient les renforts et assure les transferts de charge, tandis que les
renforts apportent principalement leurs caractéristiques
mécaniques élevées (modules et limites
d'élasticité, résistance
mécanique...). Cette association a pour but
d'obtenir un matériau dont les propriétés
spécifiques (propriétés mécaniques
rapportées à la masse volumique) sont supérieures à
celles de la matrice non renforcée
Dans un matériau composite, un des matériaux de
départ servira de matrice alors que l'autre servira de
renfort. La matrice forme le squelette du matériau composite et lui
donne sa forme. Les fibres de renfort sont insérées à
l'intérieur de la matrice afin d'en modifier les
propriétés.
Selon leur composition et la façon dont elles sont incorporées,
les fibres de renfort modifient de diverses façons les
propriétés de la matrice en la rendant, par exemple, plus
légère ou plus résistante.
Différents types de composites
La nature du matériau constituant la matrice permet de
répertorier trois grandes classes de composites. Elles sont
considérées ici par ordre croissant de tenue en
température : les composites à matrice polymère (C.M.P.),
les composites à matrice métalliques (C.M.M) et les composites
à matrice céramique (C.M.C.), il est alors possible d'associer
à ces trois types de matrices soit des renforts discontinus, dont toutes
les dimensions sont très inférieures aux dimensions de la
pièce, soit des renforts continus, dont au moins une dimension est du
même ordre de grandeur qu'une dimension de la pièce. Les
matériaux utilisés, comme renforts sont des fibres qui
présentent de bonnes propriétés mécaniques
intrinsèques (carbone, alumine, silice, kevlar, acier...). Selon
l'application envisagée, l'assemblage de ces fibres peut être
unidimensionnel (plis unidirectionnels), bidimensionnel (plis tissés,
mats à fibres coupées de quelques centimètres ou à
fibres continues) ou tridimensionnel (tissus multidimensionnels)
Les Composites à Matrice Polymère
(C.M.P)
La fabrication des C.M.P. emploie deux types de matrices : les
résines thermodurcissables qui représentent 3/4 des C.M.P.
actuels (époxyde, polyester, vinyles ter, polyuréthane...) et les
résines thermoplastiques (polypropylène, polyamide...) qui sont
moins utilisées mais en pleine progression du fait notamment d'une plus
grande recyclabilité (réutilisation après broyage). Les
matrices polymères renforcées par des fibres de verre,
employées notamment dans les produits de grande diffusion, sont d'une
grande importance industrielle. Les fibres de carbone et de Kevlar sont
utilisées dans une moindre mesure pour des applications hautes
performances dans l'aéronautique et l'aérospatiale. D'autres
types de renforts sont employés tels que des billes (verre,
élastomère...) et des charges (fibres broyées,
poudres...). Les pièces en composite à matrice polymère
prennent des formes variées (coques, plaques, pièces de
révolution...) grâce aux nombreux procédés de
formage mis au point (moulage, pultrusion, estampage, enroulement
filamentaire). Ces composites permettent un allègement des
pièces de structure habituellement fabriquées en alliages
métalliques. L'utilisation des C.M.P. reste limitée au domaine de
températures inférieures à 200°C.
Les Composites à Matrice Métallique
(C.M.M)
Pour des applications plus haute température, on fait
appel aux composites à matrice métallique (C.M.M) jusqu'à
600°C. Les métaux ou alliages métalliques utilisés
dans la fabrication des C.M.M., sont généralement choisis en
fonction de leurs propriétés spécifiques dans
l'état non renforcé. Ainsi, l'aluminium, le titane et le
magnésium sont les métaux les plus couramment utilisés.
Les procédés de fabrication des C.M.M. diffèrent selon que
la matrice se trouve lors de l'introduction des renforts à l'état
liquide (forgeage liquide, fonderie moyenne pression), dans un état
semi-solide ou dans l'état solide (métallurgie des poudres). Les
C.M.M. présentent de bonnes caractéristiques mécaniques
spécifiques, une bonne résistance en température et aux
chocs thermiques ainsi qu'une bonne résistante à l'usure et
à l'abrasion.
Les Composites à Matrice Céramique
(C.M.C.)
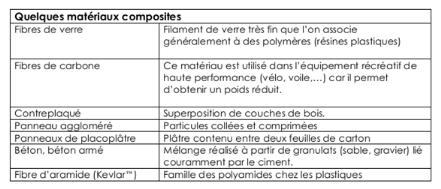
Enfin, lorsque les températures d'utilisation sont
supérieures à 1000°C on a recours aux composites à
matrice céramique (céramiques industrielles). Leur renfort est
généralement constitué de fibres longues en carbone, en
silice ou en carbure de siliciums, assemblées par tissage
multidimensionnel. Ces matériaux sont développés dans le
domaine aérospatial. D'autres par contre sont utilisés pour
l'ingénierie bâtiment. Aujourd'hui les recherches sont actives sur
les possibilités de combinaison des fibres naturelles comme renfort dans
les matériaux composites à matrice céramique.
Les
biomatériaux
Généralités
Dès l'antiquité, les hommes utilisaient des
pièces métalliques comme implants dentaires
Au début du XXème siècle, l'utilisation
de céramiques, d'alliages métalliques et de polymères a
permis d'obtenir de meilleures performances et une meilleure
fonctionnalité. Des vies ont été sauvées ou
améliorées grâce aux stents cardiovasculaires, aux implants
dentaires, aux prothèses de hanche ou aux lentilles de contact.
Un biomatériau est essentiellement un matériau
qui est utilisé et adapté pour les applications médicales.
Ils peuvent avoir une fonction bénigne, comme être utilisé
pour remplacer des valves du coeur, mais ils peuvent aussi être bioactifs
et utilisés à des fins plus interactives, comme des implants de
hanche couverts d'une couche d'
hydroxy-apatite
(matériau composant les os, il permet une meilleure compatibilité
avec les tissus du corps ; la hanche de Furlong, par Joint Replacement
Instrumentation Ltd, Scheffield en est un bon exemple - de tels implants sont
en pleine évolution depuis les vingt dernières années).
Par ailleurs, les biomatériaux sont aussi utilisés dans les
applications
dentaire, chirurgicale et
la délivrance de produits médicamenteux (grâce à des
outils introduits dans le corps et permettant de délivrer des substances
médicales de manière prolongée). Un biomatériau
est un matériau non viable, d'origine naturelle ou artificielle
,utilisé dans l'élaboration de dispositifs médicaux
destinés à être mis en contact avec des tissus
biologiques. Par tissu biologique on entend non seulement les tissus de
soutien tels que la peau, l'os la dent..., mais aussi le sang, qui
contient divers types de cellules (globules rouges, globules blancs)
ainsi que diverses substances permettant la formation d'un caillot en cas
de blessure (plaquettes, fibrine...).
Les biomatériaux ont été
développés pour préserver l'intégrité et le
confort de vie des personnes souffrant de déficiences fonctionnelles
graves ou victimes de blessures ou de brûlures. L'objectif de leur
développement est de permettre la fabrication de dispositifs
d'assistance corporelle capables de remplacer les fonctions des organes
lésés. Les biomatériaux recouvrent une grande
variété d'applications biomédicales puisqu'ils peuvent
être à la fois des matériaux de réparation des
lésions tissulaires, des matériaux implantables et être
constitutifs de systèmes d'assistance extra corporelle. Ils ne se
définissent donc pas par une nature particulière mais par l'usage
auquel on les destine : ils regroupent aussi bien des matériaux issus du
génie de l'homme (métaux, alliages métalliques,
céramiques, polymères) que des matériaux d'origine
naturelle (corail, os de bovin). Les biomatériaux sont les
matériaux utilisés pour fabriquer les prothèses, les
implants et le matériel utilisé en chirurgie. Conçus pour
ne pas être rejetés par notre organisme (peau, sang, os...), ils
peuvent être naturels (collagène, cellulose...) ou
synthétiques (métaux, alliages, céramique, matières
plastiques, ...). Les couronnes dentaires ou les lentilles de contact utilisent
des biomatériaux.
La chirurgie réparatrice et celle de la
suppléance fonctionnelle constituent le domaine d'application le plus
important des biomatériaux. D'autres spécialités
médicales recourent également à des outils d'investigation
ou d'intervention endoscopique impliquant l'emploi de matériaux
appelés aussi à être confrontés au milieu
biologique. Cette situation de travail sous contrainte biologique est le
dénominateur commun à tous les biomatériaux.
Définition
Selon la conférence de consensus de Chester
(1991) organisée Chester par la Société Européenne
pour les Biomatériaux est considéré comme
biomatériau « tout matériau qui interagit avec les
systèmes biologiques pour évaluer, traiter, renforcer ou
remplacer un tissu, organe ou une fonction de l'organisme ».
Il est convenu qu'un biomatériau peut être en
contact avec un tissu du corps humain de manière continue ou
intermittente afin de remplacer ou de restaurer une ou plusieurs fonctions.
Dans cette définition, quelque peu restrictive, sont exclus les
instruments chirurgicaux et les prothèses externes, tels les membres
artificiels. La définition d'un biomatériau n'inclut pas
uniquement les biomatériaux artificiels qui sont construits à
base de métaux ou de céramique. Un biomatériau peut aussi
être une autogreffe, allogreffe ou xénogreffe utilisée
comme une transplantation de matériaux. Cette définition appelle
les commentaires suivants : le biomatériau n'étant pas un
médicament, il n'est pas soumis aux mêmes exigences
administratives, il doit cependant s'intégrer dans une procédure
d'autorisation de mise sur le marché (AMM) qui à l'heure des
procédures communautaires européennes implique le marquage CEE.
La notion d'utilisation temporaire permet d'intégrer sous une même
définition des éléments prothétiques dont
l'ambition est d'être implantée le plus longtemps possible et des
membranes d'hémodialyse en contact avec le sang pendant quelques heures.
Les différents types
de biomatériaux
Les biomatériaux peuvent être classés en
deux grandes catégories : biomatériaux d'origine non vivante
(métaux, céramiques, polymères de synthèse) et
biomatériaux d'origine biologique (végétale ou
animale).
Les biomatériaux peuvent être utilisés en
tant que substituts osseux ou comme revêtements prothétiques. Ils
se déclinent en quatre types : les métaux et les alliages,
les polymères, les céramiques, et les matériaux naturels
(corail, nacre, ...). L'étude de ces différents types permet la
création d'un lien chimique entre le matériau et les tissus
organiques. Cette liaison résulte d'une bio activité
caractérisée par une succession de réactions
physico-chimiques (dissolution, précipitation) à l'interface
implant / tissu receveur.
-
Biomatériaux métalliques :
ü Métaux purs (Au, Pt, Ti, Ta, Co,....),
ü Alliages métalliques (acier inoxydable,...).
-
Biomatériaux en céramiques :
ü Céramiques bio-inertes (oxydes, carbures,
carbone,...),
ü Céramiques bioactives (hydroxyapatite, verres
bioactifs, â-TCP, vitrocéramiques).
-
Biomatériaux à base de polymères de
synthèse :
ü Prothèses ligamentaires,
ü Polyéthylène,
ü Polydiméthylsiloxane (PDMS),
ü Matériaux d'ancrage et de comblement.
-
Biomatériaux d'origine naturelle :
ü Origine animale (collagène, chitine),
ü Origine végétale (cellulose,...).
Métaux pur
Ils sont assez peu utilisés. Nous ne citerons et
décrirons que le titane pur. Il existe quatre grades de titane pur
dépendant de la teneur en impuretés (carbone, azote,
oxygène, et fer). La résistance dépend de la teneur en
oxygène. En dessous de 882 °C, la structure cristalline est
essentiellement á (structure hexagonale compacte) avec une
résistance relativement faible et une grande ductilité, au-dessus
de cette température c'est la phase â qui est prédominante
sa structure est de type cubique centrée. La composition et les
caractéristiques mécaniques.
La biocompatibilité du titane pur est
excellente, la couche de passivation étant par nature peu
réactogène. Ce matériau est utilisé actuellement
dans la fabrication d'implants rachidiens, son intérêt majeur
réside dans cette indication à caractère non
ferromagnétique qui permet une évaluation postopératoire
par imagerie par résonance magnétique nucléaire. Des
implants de prothèse totale de hanche tant cotyloïdiens que
fémoraux ont été réalisés : c'est le
caractère inerte et donc réhabilitable par le tissu osseux qui
est utilisé dans cette indication.
Alliages
métalliques
ü Aciers inoxydables traditionnels (316L...) et
avancés (350, 22-13-5...)
ü Alliages chrome-cobalt (avec ou sans W, Mo, Ni)
ü Alliages de titane (TIAL6V4,
TIAL5Fe2.5 ...)
Selon l'état allotropique
(c'est-à-dire l'arrangement spatial des cristaux) du fer qui est le
principal composant de cet alliage on distingue les aciers ferritiques,
martensiques et austénitiques. Ce sont ces derniers qui remplissent les
conditions requises pour un usage chirurgical : l'état
austénitique est favorisé par la présence d'une grande
quantité de nickel (10-14 %), le fer est sous une forme cubique face
centrée (forme ã).
Selon la composition initiale et par convention
d'écriture on distingue quatre séries d'acier, la série
200 est composée (outre le fer) principalement de chrome, nickel et
manganèse, la série 300 de chrome et de nickel, la série
400 de chrome et la série 500 pauvre en chrome.
Tous les aciers actuellement utilisés dans le
domaine sont forgés, les alliages coulés sont inutilisables en
raison de leur hétérogénéité et de la taille
grossière des grains qui leur confèrent des qualités
mécaniques insuffisantes et une faible résistance à la
corrosion.
Il existe une relation étroite entre les
conditions de fabrication et les qualités de l'alliage d'acier
inoxydable tant sur les qualités mécaniques que sur les
capacités à résister à la corrosion. Il faut
insister sur l'intérêt des alliages écrouis qui gardent
leur ductilité et leur résistance malgré la
déformation.
L'acier inoxydable reste, parmi les alliages
utilisés en pratique courante, le moins résistant à la
corrosion localisée. Les études sur implants retirés
montrent en effet l'extrême fréquence de la corrosion (en fond de
crevasse ou par frottement le plus souvent) même si celle-ci a
exceptionnellement justifié l'ablation du matériel.
Tant au niveau des implants temporaires
(ostéosynthèse) que des implants définitifs
(éléments de prothèse) l'acier a été et est
encore le métal le plus utilisé en particulier dans sa forme
316L.
Alliages de chrome-cobalt : les Stellites
L'utilisation de ces alliages est ancienne en
chirurgie orthopédique ont utilisé le Vitallium, l'alliage
Francobal.
Le mode de préparation de l'alliage au
même titre que la composition influence les propriétés
mécaniques. Les alliages coulés traditionnellement ont
été améliorés par des techniques de refonte sous
vide permettant de diminuer la taille des grains. Les alliages forgés
ont d'excellentes qualités mécaniques, les premières
étapes de mise en forme de l'implant sont réalisées
à des températures élevées, puis plus on se
rapproche de la forme finale plus la température de travail diminue
réalisant alors un écrouissage à froid. Les
propriétés mécaniques des différents alliages de
chrome-cobalt.
La résistance à la corrosion de ces
alliages est excellente. La tolérance tissulaire est également
excellente et tout à fait superposable à la réponse aux
aciers inoxydables. Au total, l'ensemble des qualités de cet alliage le
destine tant à la formation d'implants temporaires (plaques
d'ostéosynthèse) que d'implants définitifs
(prothèse de hanche ou de genou).
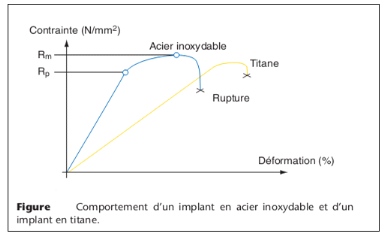
Titane
Le titane (Ti) a une résistance à la
corrosion très élevée tout en étant biocompatible.
En dépit de la longue et large utilisation des implants en titane,
pratiquement aucun effet secondaire en rapport avec la biocompatibilité
n'a été rapporté ou publié. En ce qui concerne
l'acier inoxydable, le titane a deux différences apparentes :
Densité : le titane a une densité de 4,5
g/cm3 comparée à 7,9 à 8,3 g/cm3
pour les aciers inoxydables ; le titane a une plus grande
élasticité que l'acier inoxydable
Alliage de titane
Le titane possède en fonction de la température
deux états allotropiques : á, structure hexagonale compacte et
â, qui est une structure cubique centrée. L'aluminium (6 %) et le
vanadium (4 %) ajoutés au titane permettent aux deux formes á et
â de coexister à température ambiante. Ainsi est
formé un alliage biphasique (á-â). Le taux relatif de
chacune des phases et les modes de préparation de l'alliage ont une
grande influence sur les qualités mécaniques. Une microstructure
régulièrement homogène est obtenue par recuit.
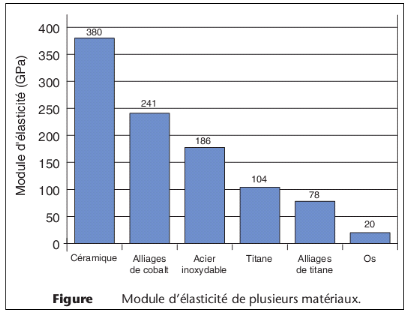
Les qualités mécaniques de l'alliage
TiAl6V4 sont superposables voire supérieures
à celles des autres alliages utilisés. De plus, il
présente l'avantage d'avoir un module d'Young deux fois moins
élevé que celui du CrCo ou de l'acier ; il reste toutefois dix
fois supérieur à celui de l'os. Les propriétés en
fatigue, deux fois supérieures à celles de l'acier ou du CrCo,
représentent un avantage très important pour la fabrication
d'implants destinés à être définitifs. La faible
différence entre la contrainte à la rupture et la limite
élastique constitue son défaut mécanique majeur, en effet
il est peu déformable plastiquement avant rupture. Les
conséquences de ce fait mécanique sont retrouvées en
clinique lors de l'utilisation de vis en TiAl6V4 : lors
du serrage d'une vis une déformation plastique se produit, quand de
l'acier est utilisé, les contraintes à la rupture et la limite
élastique sont suffisamment éloignées pour permettre la
déformation, ce n'est pas le cas avec le TiAl6V4
la vis pouvant alors se rompre lors du serrage.
Les propriétés de frottement du titane
sont insuffisantes pour en faire un matériau de frottement. Le film
oxydé de passivation trop fin (100 A) disparaît lors du frottement
et il y a alors dissolution du métal (potentiel normal = -1,6), et
relargage d'oxyde de titane qui agit comme un abrasif ; d'autre part le titane
est un matériau autosoudant. Des modifications de la surface peuvent
être réalisées pour durcir celle-ci et permettre son
utilisation en frottement : il peut s'agir par exemple d'implantation ionique,
ou de nitruration gazeuse ou ionique.
La tolérance tissulaire de l'alliage de
TiAl6V4 est très bonne sous forme massive. Les
atomes d'aluminium et le vanadium, au potentiel toxique, contenus dans cet
alliage sont dispersés et ne sont pas libérés, dans les
conditions normales d'utilisation, dans le milieu. Il n'y a pas eu dans la
littérature de phénomène immunoallergique
rapporté.
L'utilisation principale de l'alliage de titane est pour nous
la réalisation de tiges de prothèses totales de hanche. Pour
éviter les phénomènes de freeting-corrosion, les tiges de
prothèses de hanches lisses sont recouvertes artificiellement d'une
couche d'oxyde par anodisation. Cette couche de 5 000 A donne une coloration
verte ou bleue au métal.
Le titane-niobium présente des
caractéristiques similaires au TiAl6V4, il a
été développé pour ne pas utiliser le vanadium dont
la toxicité à l'état d'alliage est plus supposée
que réelle. Citons le nitinol qui est un alliage de Ni et de Ti et qui
présente la particularité d'être à mémoire de
forme. Dans certaines conditions de température, il peut reprendre une
forme donnée. Le taux de Ni est élevé ce qui peut
entraîner des réactions d'intolérance. Il a
été utilisé pour la réalisation d'agrafes
d'épiphysiodèse ou de fixation d'ostéotomie et des
fixations rachidiennes.
Module de Young
Le module de Young ou module d'élasticité
(longitudinale) ou encore module de traction est la constante qui relie la
contrainte de
traction (ou de
compression) et la
déformation
pour un
matériau
élastique
isotrope.
Le physicien britannique
Thomas Young (
1773-
1829) avait remarqué que
le rapport entre la
contrainte
de traction appliquée à un matériau et la
déformation
qui en résulte (un allongement relatif) est constant, tant que cette
déformation reste petite et que la
limite
d'élasticité du matériau n'est pas atteinte. La
loi
d'élasticité est la
loi de Hooke :
|
 = =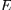 ?
?
|
Où :
 · est la
contrainte
(en unité de pression) ; · est la
contrainte
(en unité de pression) ;
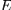 · est le module de Young (en unité de pression) ; · est le module de Young (en unité de pression) ;
· ? est l'allongement relatif, ou
déformation
(
adimensionnel).
Céramiques
Généralités
En science des matériaux est un
céramique tout élément solide, inorganique et non
métallique.

On distingue les céramiques bio-inertes qui
ne développent pas de lien avec le tissu osseux, et les
céramiques bioactives qui elles créent un lien entre l'os et le
matériau par la formation in vivo d'une couche d'apatite
carbonatée. Les céramiques inertes sont utilisées comme
matériau de frottement, les céramiques bioactives comme
matériau de comblement ou d'accrochage en recouvrement de surface.
Figure 3 : Structure macroporeuse d'une céramique
biphasée.
Céramique inertes
Alumine
A la suite des travaux de dentistes
comme Sandhaus, Boutin fut le premier à utiliser ce matériau en
orthopédie. Il implante la première prothèse
alumine-alumine en 1970. Il fut suivi par des auteurs germaniques (Griss,
Mittelmeier, Salzer), japonais (Shikita, Kawahara), italiens (Pizzoferato). De
cette période (en particulier pendant la période 1970-1977)
à aujourd'hui des améliorations ont permis d'augmenter la
fiabilité de ce matériau en améliorant sa qualité
ainsi que ses systèmes de fixation. L'alumine est obtenue par frittage
(compression à chaud [1 600 à 1 800 °C]) de poudre d'oxyde
d'alumine pur ou de mélange d'oxydes. Le frittage permet d'obtenir une
forte liaison entre les particules. Ainsi est réalisé un
matériau dense à structure polycristalline très fine,
chimiquement inerte et thermodynamiquement stable donc quasi insensible
à la corrosion.
Caractéristiques mécaniques
L'alumine haute densité est normalisée (AFNOR,
ISO). L'alumine dite de qualité médicale est pure, dense,
polycristalline. Elle est particulière par sa pureté
supérieure à 99.7, par sa densité supérieure
à 3.94. Il est essentiel que la taille des grains soit petite et qu'ils
soient régulièrement répartis. De plus, leur mise en forme
doit être particulièrement soigneuse (vitesse de rotation des
instruments tranchants ou perforants, contrôles qualité
permanents). C'est de l'ensemble de ces exigences que dépendra la
sécurité de l'alumine orthopédique. Les
caractéristiques des principales alumines. De ces
caractéristiques brutes, un certain nombre d'observations et de
conclusions doivent être faites sur trois principaux
éléments : les résistances mécaniques, le
comportement dans le frottement, et le vieillissement.
Résistance
mécanique
Elle est excellente en compression et relativement
faible en tension, ce qui caractérise les matériaux à
comportement « fragile ». Il est cependant possible de
réaliser des matériaux pour lesquels on contrôle
suffisamment l'existence de fissures initiales et surtout la taille de ces
fissures initiales. La facilité et la rapidité de propagation
d'une fissure - une fois celle-ci initiée - est une
caractéristique essentielle de ce matériau, elle est
exprimée par la constante K1c. La faible taille des grains (et surtout
la faible dispersion dans la taille des grains), le contrôle
qualité, la disparition des fissures lors du frittage, et une meilleure
connaissance du matériau ont rendu ce risque de fracture pratiquement
nul. En dehors des qualités intrinsèques du matériau
d'autres paramètres interviennent ce sont :
La taille de la tête fémorale (32 mm est une
sécurité, 28 mm est possible, 26 mm est risqué) ;
la fixation de la tête à la queue fémorale
qui est au mieux assurée par un cône-mors à rugosité
élevée permettant une meilleure répartition des charges
par augmentation de la surface de contact ;
Les précautions de stérilisation qui
devront éviter les refroidissements rapides après chauffage ;
Enfin, les précautions lors de l'implantation
chirurgicale (pas d'impaction forcée au marteau de la tête sur le
cône.
Biocompatibilité
La céramique d'alumine est un des
matériaux les plus biocompatibles, elle est souvent utilisée
comme matériau témoin. L'évaluation dans les tissus mous
et dans l'os peut être résumée comme suit :
La réaction après implantation dans les muscles
est faible aboutissant à long terme à une capsule fibreuse
paucicellulaire et riche en fibres collagènes ; les macrophages,
témoins de la permanence de l'irritation sont absents à long
terme ;
Après implantation en tissu osseux non chargé,
l'alumine est rapidement entourée d'os tissé non mature ; en 2
à 4 mois, cet os se différencie en tissu osseux mature qui vient
en contact étroit avec l'implant. A long terme, les résultats
sont inconstants avec pour certains des implants entourés de tissu
fibreux ou chondroïde. Des implantations sous forme de spacers ou de
prothèses ont montré que les zones chargées en compression
présentaient un contact osseux étroit
Zircone
Dans le cadre des prothèses de
hanche, l'alumine a donné satisfaction. Son caractère fragile, sa
faible résistance aux contraintes en traction imposent toutefois un
diamètre de tête fémorale minimal (28 ou 32 mm selon les
auteurs) pour éliminer les risques de fracture. C'est pourquoi des
céramiques plus résistantes ont été
développées ; parmi celles-ci la zircone est apparue
particulièrement intéressante.
Caractéristiques
mécaniques
Résistance mécanique
Elle est excellente, ceci s'explique par ses
caractéristiques physicochimiques. L'oxyde de zircone se présente
sous trois phases possibles : la phase cubique est stable mais fragile, la
phase tétragonale est résistante mais instable pouvant se
transformer en phase monoclinique. A 1100 °C la zircone se transforme en
phase tétragonale puis à partir de 2000 °C en phase cubique.
Le changement de phase est associé à des variations de volume.
L'addition d'oxyde de calcium, de magnésium ou d'ytrium permet d'aboutir
à une stabilisation du matériau. La zircone stabilisée par
l'oxyde d'ytrium est particulièrement intéressante car obtenue
par frittage à des températures qui correspondent à la
phase tétragonale (donc résistante). De plus, lors de
l'initiation d'une fissure, les grains à structure tétragonale se
transforment en fond de fissure en grains à structure monoclinique plus
volumineux permettant un arrêt de la propagation de la fissure. Cette
caractéristique explique que les têtes fémorales en zircone
présentent une résistance à l'impact quatre à huit
fois supérieure quand elles sont comparées à des
têtes en alumine. Les principales caractéristiques
comparées de la zircone et de l'alumine.
Biocompatibilité
Elle a été étudiée
quantitativement par Christel et coll. En tissu mou et en tissu osseux : la
réaction observée est superposable à celle observée
au contact de l'alumine. Toutefois, on ne dispose pas pour ce matériau
d'étude à long terme ni d'étude de la réaction aux
particules d'usure qui sont beaucoup plus petites que les particules d'alumine
(0,1 ìm contre 2 ìm).
Céramiques bioactives
Hydroxyapatite et phosphate tricalcique
L'hydroxyapatite (HA) est le constituant naturel
anorganique de la matrice osseuse. Sa formule chimique est :
Ca10(PO4)6(OH)2. Il peut être
synthétisé, mais présente alors avec l'HA naturelle des
différences (présence en très faible quantité
d'ions Mg, Na, K, Cl, et F dans l'os ; taille des cristaux). L'HA et ses
dérivés ont en commun la propriété
d'ostéoconduction au contact du tissu osseux. Selon le rapport P/Ca et
la structure on distingue :
ü phosphates tricalciques â (â TCP) :
Ca3(PO4)2 ;
ü hydroxyapatite (HA) :
Ca10(PO4)6(OH)2 ;
ü composites (HA + â-TCP) ;
ü d'autres composés comme la brushite, le
phosphate octocalcique ou le phosphate tétracalcique existent, mais nous
ne les détaillerons pas.
Les blocs massifs de céramiques de phosphate
de calcium sont préparés par compaction d'une poudre suivie d'un
frittage à très haute température (> 1000 °C). Ils
induisent une ostéoconduction, c'est-à-dire qu'ils servent de
support aux cellules ostéoformatrices et sont colonisés de
façon centripète par un néotissu osseux. L'os
néoformé en contact étroit avec le matériau prend
progressivement la place du matériau qui est le siège d'une
dégradation par un mécanisme cellulaire de phagocytose et
extracellulaire de dissolution.
La porosité et la solubilité sont des
paramètres fondamentaux. En effet, la repousse osseuse ne peut
s'effectuer qu'avec une porosité de 40 à 50 % et une taille de
pores située entre 100 et 300 ìm. Ces céramiques
présentent une microporosité intrinsèque (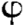 < 100
ìm) et une macroporosité (100 ìm < < 100
ìm) et une macroporosité (100 ìm < 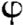 < 600
ìm) à la base de la néoformation osseuse. Quant à
la solubilité, elle dépend du rapport Ca/P. Il est égal
à 1,5 pour les âTCP qui sont solubles et entièrement
dégradables et à 1,67 ou plus pour les HA qui sont insolubles et
peu ou pas dégradables. < 600
ìm) à la base de la néoformation osseuse. Quant à
la solubilité, elle dépend du rapport Ca/P. Il est égal
à 1,5 pour les âTCP qui sont solubles et entièrement
dégradables et à 1,67 ou plus pour les HA qui sont insolubles et
peu ou pas dégradables.
L'utilisation de ces biocéramiques est
limitée par des propriétés mécaniques faibles
(fragilité due à la porosité, résistance
mécanique faible). En pratique, certaines conditions doivent être
respectées de façon stricte par le chirurgien, ce qui limite
leurs indications. Ces conditions sont :
ü contact étroit avec l'os ;
ü absence de contrainte et de mouvements à
l'interface.
Bioverres
Les bioverres sont une des classes de
céramiques bioactives. Un lien chimique est donc recherché entre
l'os et le matériau. C'est depuis les années 1970 que Hench a
étudié et développé différents types de
bioverres. D'autres auteurs ont ensuite recherché des formulations
différentes ayant la même action de liaison à l'os.
La caractéristique commune à tous les
bioverres quelle que soit leur composition est de présenter à
l'interface des modifications qui aboutissent à la formation, à
la surface du bioverre, d'une couche d'hydroxyapatite carbonatée qui
chimiquement et structurellement est identique à la phase
minérale de l'os, cette équivalence serait responsable du lien
entre os et matériau. Les études les plus poussées ont
été réalisées sur des verres à base de
silice (verres de Hench). Histologiquement, l'interface est formée de
l'implant à l'os d'une couche riche en silice et d'une couche
d'hydroxyapatite carbonatée ; une zone composite de 100 ìm
d'épaisseur en moyenne est formée de fibres collagènes
venant du tissu osseux et d'hydroxyapatite. L'interface composite est similaire
à celle que l'on observe à la jonction tendon-os entre un
matériau à module d'Young faible et un matériau à
module d'Young plus élevé. Mécaniquement, le lien entre os
et matériau est suffisamment solide pour que lors des tests
mécaniques, la rupture intervienne préférentiellement soit
dans l'os, soit dans le bioverre mais pas à l'interface.
Les verres bioactifs les plus étudiés et
utilisés sont composés principalement d'oxydes de silicium
(SiO2), de sodium (Na2O), de calcium (CaO) et de
Phosphore (P2O5). Le verre le plus utilisé et
le plus bioactif est le verre noté bioverre 45S5 de L.L.
Hench (composé en % massique de 45% de SiO2, 24,5% de
Na2O, 24,5% de CaO et 6% de P2O5). Ce bioverre
est classé sur toute la gamme des matériaux bioactifs
dans la classe A, qui correspond à l'indice de
bioactivité le plus élevé. Cette bioactivité
est due à la capacité du bioverre lorsqu'il est
immergé dans le milieu physiologique, de former de l'hydroxyapatite
carbonatée (HAC). Cette couche HAC permet un accrochage chimique en
environ 12 heures de l'implant à l'os. La bioactivité du
bioverre 45S5 lui confère des propriétés
d'ostéoconduction, d'ostéostimulation et de résorption.
Propriété structurale : Les phases
cristallines
La cristallographie des bioverres joue un rôle
important sur leur bioactivité et leur résistance
mécanique. Le bioverre a été traité thermiquement
à différente température puis analysé par
diffraction des rayons X afin d'identifier les phases cristallines en fonction
de la température comme représenté sur la figure
ci-dessous :
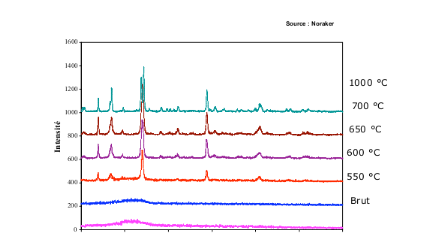
Figure X : Diagrammes de diffraction X du bioverre 45S5 en
fonction de la température du traitement thermique.
L'analyse des diagrammes de diffraction X (Figure 00) indique
que le bioverre présente une structure amorphe jusqu'à
550°C. Au delà de cette température, le traitement
thermique provoque l'apparition de deux phases cristallines, la
première, majoritaires apparaît à partir de 600°C :
Na2Ca2(SiO3)3 et la seconde
à partir de 700°C : Na2CaSi3O8.
Le bioverre 45S5 est un Matériau bioactif qui permet
l'Ostéointégration (ostéoproduction) et
l'ostéoconduction. Il est biocompatible, 100 % Synthétique et
entièrement Biorésorbable. Cependant malgré les nombreuses
propriétés de ce matériau, des limites technologiques sont
identifiable et notamment au niveau de niveau de sa fragilité et de sa
mise en forme. Afin de lever le verrou technologique, la tendance est
d'associer une phase polymère résorbable à une phase
minérale.
Les propriétés mécaniques des
bioverres sont modestes, en particulier la résistance en flexion, aussi,
l'utilisation sous forme massive est-elle réservée à des
zones peu ou pas sollicitées. Ainsi le Bioglass a une résistance
en flexion de moins de 7 kg/mm2 qui est améliorée
après cristallisation ; le Cervical présente une
résistance en flexion de 10 kg/mm2 ; la vitrocéramique
d'apatite-wollastonite est la plus résistante avec une
résistance en flexion de 23 kg/mm2. Plusieurs approches
permettent IV- Elaboration des bio- verres poreux à visée
orthopédique
Les substituts osseux biphasés en hydroxyapatite
et phosphate tricalcique sont considérés comme l'alternative
majeure aux greffes autologues. Contrairement à l'os autologue,
ces matériaux ont plusieurs inconvénients. D'une part, ils sont
partiellement résorbables, d'autre part, ils sont
ostéoconducteurs mais pas ostéoinducteurs. De plus, le
comportement mécanique de ces matériaux reste très
fragile.
Le développement d'une nouvelle structure poreuse
d'implants à partir de bio-verre pour application de substitution
osseuse permet de remédier à ces inconvénients. Une
alternative prometteuse est alors la réalisation de bio- verres
poreux, plus facilement résorbables en surface, et qui permettent
alors les processus de dissolution de Calcium et Phosphore, puis de re-
précipitation en surface d'hydroxyapatite de composition plus proche de
la partie minérale de l'os. Ces verres bios- actifs, sont
déjà utilisés dans le domaine dentaire comme
granulés et dans le revêtement de prothèses
métalliques. Ils ne sont cependant pas encore utilisés en
orthopédie pour la réalisation de substituts poreux, à
cause de verrous technologiques à leur fabrication. La
société NORAKER développe un procédé de
fabrication permettant de réaliser des bio-verres poreux, dans des
gammes de porosités identiques aux substituts osseux en
hydroxyapatite. Ce procédé permet de réaliser des
substituts osseux avec une porosité contrôlée, à
l'échelle nanométrique, micrométrique et macroscopique.
Les résultats montrent des propriétés mécaniques
supérieures à celles des hydroxyapatites poreuses pour un
même taux de porosité, ainsi que des propriétés
biologiques plus intéressantes, de part la formation d'hydroxyapatite
naturelle à leur surface.

Figure 8 : Exemple de substituts osseux
développé par la société NORAKER.
d'utiliser les propriétés biologiques des
bioverres : le recouvrement de matériaux ayant de meilleures
qualités mécaniques (céramiques, métaux), ou
l'utilisation de composites faits de fibres métalliques dans un substrat
de bioverre.
Quelques applications cliniques ont été
réalisées à l'aide de ces matériaux. Il faut citer,
le remplacement vertébral, le comblement osseux après
exérèse tumorale ou la réalisation de butée
d'épaule pour luxation récidivante.
Phosphates de calcium
Les phosphates de calcium sont des céramiques
biocompatibles. Ils sont ostéoconductifs grâce à leur
ressemblance avec la phase minérale de l'os. Ils
possèdent aussi la propriété d'être
biodégradables. Parmi les phosphates de calcium, l'hydroxyapatite
(HA) et le â-tricalcium phosphate (â-TCP) sont souvent
utilisés comme matériaux de comblement osseux. Ils peuvent
être utilisés sous forme de particules macroporeuses pour
améliorer l'ostéointégration et la
biodégradation en augmentant la surface spécifique. En
effet, la macroporosité favorise la repousse de l'os en permettant
l'invasion par des précurseurs vasculaires et des cellules osseuses
(Knabe et al. 2008). Ils peuvent aussi être implantés sous forme
de blocs de taille millimétrique avec macroporosité
interconnectée (Weiss et al., 2003). Il existe de nombreuses autres
formes de phosphates de calcium (les plus importants sont
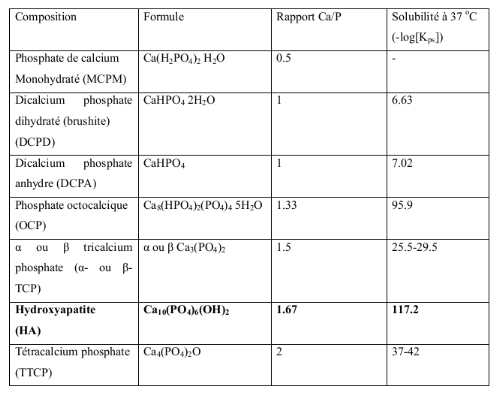
rassemblés dans le Tableau III -Mihailescu IN et al., 2010).
Certains de ces phosphates de calcium, dont le DCPD (brushite), DCPA,
OCP, â-TCP et ACP sont parfois trouvés dans les tissus
vivants dans des conditions normales ou pathologiques.
Utilisation du phosphate tricalcique â
Les céramiques de phosphate de calcium sont de plus en
plus utilisées en chirurgie osseuse.
En particulier, Le phosphate tricalcique â a
été utilisé en traumatologie dans 24 cas. La
classification du GESTO (Association pour l'étude des greffes et
substituts tissulaires en orthopédie) prenant en compte le type, la
nature et la taille de la perte de substance a été couplée
à une échelle qualitative de l'intégration.
Le phosphate tricalcique â apparaît comme un
substitut osseux de choix pour le comblement des pertes de substance osseuse
modérées observées en traumatologie.
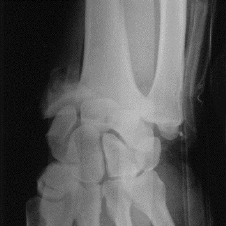
Figure X : Homme de 48 ans. Fracture comminutive du
poignet.
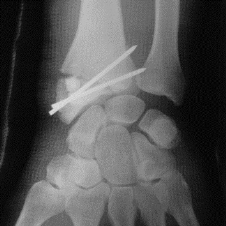
Figure X : Comblement de la perte de substance
osseuse styloïdienne par deux 2 cubes de
5 × 5 × 5 mm de Biosorb et
ostéosynthèse par embrochage.
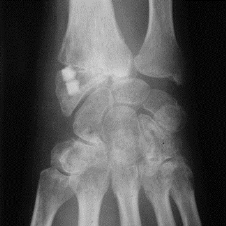
Figure X : Cinq mois postopératoires. Ablation des
broches. Intégration périphérique des implants.
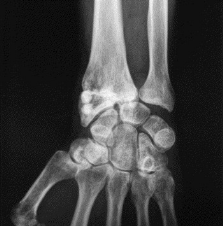
Figure X : Neuf mois postopératoires. Bonne
intégration des implants prenant un aspect floconneux.
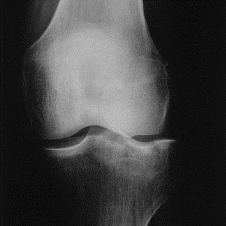
Figure X : Femme de 63 ans. Fracture enfoncement du
plateau tibial externe.
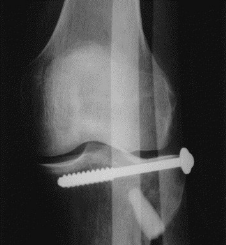
Figure 6 : Aspect postopératoire.
Relèvement du plateau tibial et comblement de la perte de substance
osseuse par un implant de Biosorb qui sert d'étai sous-chondral.
Ostéosynthèse par vis.
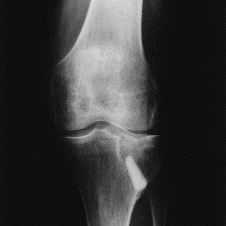
Figure X : Dix mois après l'opération.
Ablation du matériel. Aspect radiographique du substitut
inchangé.
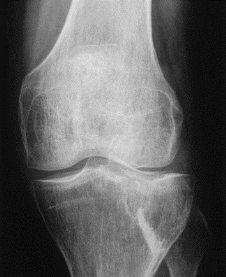
Figure X : Vingt-cinq mois après
l'opération. Bonne intégration du substitut qui est presque
totalement résorbé.
Tableau III : Différents phosphates de calcium :
formules chimiques, rapport Ca/P et solubilité.
Polymères
De par le grand éventail de propriétés
qu'il est possible de donner à ces matériaux, ils constituent une
classe dont les applications thérapeutiques sont extrêmement
variées allant des matériaux servant à l'ancrage dans
l'os, aux matériaux servant de prothèse ligamentaire.
Généralités
Composition chimiques
Les polymères sont constitués de la
répétition de monomères, molécules organiques
à base d'atome de carbone (ou de silice pour les silicones). La
polymérisation s'effectue suivant deux procédés
principaux, addition ou condensation, à la base de la structure
tridimensionnelle de la macromolécule, de ses propriétés
physicochimiques et mécaniques. Le poids moléculaire et le
degré de ramification de la molécule régissent la
mobilité et l'arrangement spatial des chaînes entre elles. Les
branchements augmentent l'encombrement spatial de la molécule ce qui
diminue la densité et le taux de cristallinité du
matériau. A très haut poids moléculaire, le taux de
cristallinité atteint un maximum puis diminue.
Propriétés
mécaniques
Il est bien sûr possible de
caractériser le comportement mécanique de ces matériaux
par une courbe contrainte-déformation permettant de déterminer
module d'Young et rigidité. Mais, cette caractérisation est
incomplète, les polymères ont en effet un comportement
viscoélastique, les propriétés mécaniques
étant fonction de la vitesse d'application de la charge. D'autres
conditions comme la température et le milieu ambiant influencent les
propriétés mécaniques. La comparaison de différents
matériaux polymériques impose donc plus qu'ailleurs la
vérification des conditions d'expérimentation.
Plus la cristallinité est élevée
(organisation régulière, chaînes parallèles,
liaisons interchaîne fortes), meilleures sont les
propriétés mécaniques et plus la ductilité baisse.
L'effet d'augmentation du poids moléculaire est de réduire la
mobilité entre les chaînes et d'améliorer la
résistance à la rupture, en contrepartie, le taux de
cristallinité baisse. A la différence des métaux, nombre
de ces paramètres sont modulables par divers procédés
contrôlant la production des matières premières (poids
moléculaire, taux de cristallinité, additifs). Les
paramètres de mise en forme (température, pression, forme) sont
également contrôlables et permettent des variations de
propriétés.
Biocompatibilité
Les polymères utilisés en
orthopédie sont, sous forme massive, bien tolérés, ils
sont encapsulés par une membrane fibreuse dont l'épaisseur peut
être variable, fonction de la composition chimique du matériau, de
sa forme géométrique, de ses propriétés de surface
ou encore des contraintes locales à l'interface. En
général, les réactions d'intolérance ne proviennent
pas du matériau lui-même mais de la présence de
composés de bas poids moléculaire. Ces composés peuvent
être libérés par une hydrolyse in vivo, lors de la
stérilisation, ou lors de frottements aboutissant à la formation
de débris d'usure ; les additifs nécessaires à la
fabrication peuvent également être toxiques. La quantité,
la forme et la taille des débris sont des paramètres importants
dans les réactions d'intolérance en particulier pour la formation
des granulomes aux débris d'usure.
Différents travaux menés chez
l'animal ont conclu que l'induction de sarcomes n'est rapportée que chez
certaines espèces animales (rats, souris), après un délai
important et que la forme de l'implant (film) constitue le paramètre le
plus important (Oppenheimer). Chez l'homme des observations de tumeurs au
contact de polymères ont été rapportées mais un
lien direct de cause à effet entre tumeur et matériau est
difficile à établir.
Matériaux résorbables
Les matériaux biorésorbables ont pour
caractéristique d'assurer une aide thérapeutique limitée
dans le temps. Ainsi, un matériau pour ostéosynthèse
évite une reprise chirurgicale pour ablation du matériel, il doit
présenter des caractéristiques mécaniques suffisantes pour
assurer la stabilité initiale de la fracture puis être
résorbé après consolidation osseuse ; la progressive
réorientation des contraintes du matériel vers l'os
représente un autre avantage théorique. D'autres exemples
existent comme des bouchons diaphysaires, certains types de ciments
chirurgicaux, ou des matériaux de comblement osseux.
Parmi les polymères synthétiques, on
individualise les polyesters à base d'acide glycolique ou lactique :
acides polylactiques (PLA) et polyglycoliques (PGA). Ils sont connus de longue
date comme fils de suture, et peuvent être utilisés comme
matériel d'ostéosynthèse. Ce sont des polymères
poreux dérivés de monomères cycliques qui
présentent une excellente biocompatibilité. Ils se
présentent sous forme massive (plaques, broches, vis). Ils se
dégradent après 6 mois, d'autant moins vite que la teneur en
acide lactique augmente. Leurs propriétés mécaniques sont
modulables par structure, sans additifs. La dégradation des
propriétés mécaniques et la vitesse d'élimination
sont ajustables par modification de la structure configurationnelle
(cristallinité et teneur en composés dextrogyres) et sont
compatibles avec la guérison des fractures ; cependant ils
présentent une certaine fragilité au choc et une
résistance en fatigue peu importante ce qui limite leur utilisation en
orthopédie. Ils peuvent être renforcés par des fils de
Nylon ou d'autres renforts comme des fibres de carbone.
Nous avons précédemment vu les
différents mécanismes de dégradation des polymères.
La dégradation enzymatique est le mécanisme de
prédilection des matériaux résorbables en
orthopédie. Il existe une réaction inflammatoire avec recrutement
de cellules macrophagiques (polynucléaires et macrophages)
sécrétant des enzymes lysosomiales (phosphatases acide et
alcaline), les débris restants sont ensuite phagocytés par les
cellules macrophagiques.
Matériaux de frottement
Les polymères sont très utilisés comme
surface de frottement. Ils sont un des éléments du couple de
frottement, et sont utilisés alors en conjonction avec des métaux
ou des céramiques inertes. Etant de façon presque constante le
matériau le moins solide, il est exposé aux
phénomènes d'usure et de fluage. Les conditions de fonctionnement
articulaire et le dessin des implants influencent grandement ces
phénomènes indésirables qui limitent, par
l'intermédiaire de phénomènes biologiques et
mécaniques, la survie à long terme de ces implants. Nous ne
développerons pas la tribologie des surfaces articulaires que l'un
d'entre nous a plus complètement traitées ailleurs.
Polyéthylènes
Le polyéthylène à très haute
densité est actuellement la seule surface de frottement
polymérique méritant un développement complet. Nous
citerons par souci historique le polyétrafluroéthylène
(Téflon) utilisé par Charnley au début de son
expérience et abandonné pour usure précoce et dramatique,
et le polyoxyéthylène (Delrin).
Le polyéthylène existe sous plusieurs
formes : LDPE (polyéthylène de basse densité), HDPE
(polyéthylène de haute densité), et UHMWPE
(polyéthylène de très haute densité). Outre ses
qualités de frottement, l'UHMWPE présente des qualités qui
le font actuellement utiliser de façon quasi exclusive ; ce sont : sa
résistance aux impacts, sa bonne tenue en fatigue et son excellente
biocompatibilité. Toutefois, ses limitations sont également bien
connues, ce sont : sa sensibilité au fluage, sa faible capacité
à résister à l'usure et sa sensibilité à
l'oxydation.
Il s'agit d'une molécule hydrophobe du groupe
des polyoléfines. Son poids moléculaire est pour la forme de
très haute densité de 2.106 g/mol. Il a été
initialement obtenu à partir d'éthylène gazeux à
haute pression en présence d'un catalyseur (peroxyde) destiné
à initier la polymérisation (obtention de
polyéthylène basse densité). Le polyéthylène
haute densité est obtenu par utilisation d'un catalyseur de Ziegler
à basse pression.
Un certain nombre de paramètres observés
pour un polyéthylène de très haute densité. Une
amélioration des propriétés du polyéthylène
a pu être obtenue par forgeage, incorporation de fibres de carbone ou par
réticulation-greffage, mais à ce jour aucune de ces
améliorations n'a permis une avancée significative
comparativement à un UHMWPE.
La stérilisation des pièces en
polyéthylène ne peut être une stérilisation
sèche (température supérieure à la
température de fusion), une stérilisation à la vapeur
(risque d'induire des variations de structure physique dans le
polyéthylène) ou une stérilisation chimique par oxyde
d'éthylène (gaz occlus dans les pièces). Seule une
radiostérilisation à 2,5 mrad est utilisable tout au moins
pendant une dizaine d'années. Mais on l'accuse actuellement de favoriser
une dégradation oxydative du matériau.
Polydiméthylsiloxane (PDMS)
L'exemple en est l'élastomère de silicone
(Silastic). Les implants de silicone font partie d'une classe de
polymères synthétiques dont la structure repose sur la
séquence Si-O-Si. A partir de cette structure chimique, une très
large variété de matériaux peuvent être
élaborés et utilisés dans des domaines aussi variés
que l'ophtalmologie, la neurochirurgie, la chirurgie cardiovasculaire ou
plastique (cathéters, drains, seringues, prothèses).
Leur utilisation dans le domaine de
l'orthopédie est due aux travaux de Swanson qui a
développé dans les années 1970 le principe d'utilisation
d'un polymère flexible, l'élastomère de silicone
(Silastic) comme implant d'interposition dynamique après
résections-arthroplasties des petites articulations des
extrémités. L'élastomère de silicone ne contient
aucun additif, ses propriétés physicochimiques sont fonction
essentiellement de la microstructure de la macromolécule (taux de
copolymérisation avec le phénylméthylsiloxane,
degré de ramification, taux de particule de silice). Il possède
une excellente biocompatibilité et une bonne résistance à
l'oxydation. Cependant, sa surface est facilement contaminée par des
phénomènes électrostatiques qui peuvent augmenter la
réaction inflammatoire. Le problème essentiel réside en
fait dans son médiocre comportement en fatigue. Des fractures des
implants surviennent avec libération de débris et de particules
de silice qui déclenchent une réaction à corps
étrangers à médiation cellulaire (macrophages) aboutissant
à long terme à une ostéolyse secondaire. Ces
phénomènes ont été suffisamment importants pour
justifier une désaffection pour ce type d'implant. Une des raisons de
ces problèmes mécaniques est due à une absorption
lipidique, proportionnelle pour certains au nombre de microfissures de
surface.
Matériaux d'ancrage et de comblement
Dans ce chapitre nous inclurons le
polyméthylmétacrylate (PMMA) qui reste, malgré le
développement des ancrages dits biologiques, une option
thérapeutique majeure pour la fixation initiale et à long terme
des implants prothétiques. En effet, les résultats de la
prothèse totale de hanche ont été transformés
depuis que Charnley, sur les conseils du dentiste D Smith, a utilisé le
PMMA comme ciment de fixation des éléments prothétiques
dans l'os.
Ce « ciment chirurgical » assure une
adaptation morphologique des implants à l'os, une transmission et une
répartition des contraintes en procurant une stabilité
immédiate sans douleur et autorisant une reprise précoce de
l'appui. Outre le rôle majeur de fixation, les indications d'utilisation
du ciment se sont étendues, servant de matériau de comblement
dans les fractures pathologiques ou dans les pseudarthroses avec perte de
substance, matériau d'interposition dans les
désépiphysiodèses, ou matériau de support
médicamenteux dans les ostéites ou les tumeurs.
Composition
Il est présenté sous la forme d'une
poudre et d'un liquide. Les compositions globales et en additifs de
différents ciments acryliques.
ü La poudre est composée :
De particules de PMMA, de copolymères de
méthylmétacrylate et d'autres monomères (styrène).
Il s'agit de granules de 10 à 40 ìm de diamètre ;
D'un opacifiant radiologique (sulfate de baryum ou dioxyde de
zircone). Ils sont obligatoires et servent à observer l'évolution
de la fixation ;
De benzoïlperoxyde, qui est initiateur de la
polymérisation.
ü Le liquide est composé de :
Monomère de métacrylate de méthyle ;
N, N-diméthyl-p-toluidine (DMPT) : qui contrôle
la vitesse de réaction de polymérisation ; hydroquinone qui
est un antioxydant qui stabilise le monomère de MMA. Celui-ci sous
l'influence des rayons UV ou de l'oxygène.
Interrelation os-ciment
Il n'y a ni réaction chimique ni aucune
adhérence entre os et ciment. La tenue des implants est simplement
liée à la pénétration du ciment dans les
anfractuosités de l'os récepteur. Charnley a montré que la
nécrose osseuse après introduction de ciment pouvait atteindre
500 ìm, cette couche après un passage par du tissu fibreux
s'ossifiait en 1 an environ.
Propriétés
physiques
Propriétés
mécaniques
Les propriétés des ciments sont fonction d'un
nombre important de paramètres. Aussi, la comparaison des
résultats de la littérature devra prendre en compte de
façon très soigneuse les conditions d'expérimentations.
Les valeurs moyennes de l'ensemble des ciments sont
comparables :
ü module d'Young 2 000 MPa ;
ü résistance à la rupture en traction 25
MPa, en compression 80 MPa ;
ü élongation avant rupture 5 % ;
ü résistance à la fatigue (108 cycles) 14
MPa.
De nombreux facteurs sont susceptibles d'influencer les
propriétés physicochimiques du ciment, parmi ceux-ci :
Température ambiante : plus la température
ambiante est chaude, plus le temps entre la phase pâteuse et la
polymérisation est court ;
Rapport poudre/liquide : il fait changer le rapport
monomère/polymère sachant que plus la quantité de
monomère est grande plus la chaleur est dégagée ;
Moment où le ciment est placé dans l'os : la
viscosité quand elle est basse permet une bonne
pénétration dans les anfractuosités osseuses mais le
monomère que l'on sait toxique est relargué de façon
préférentielle pendant le mélange et la phase
exothermique. Il s'agit donc de trouver un moyen terme et le ciment doit
être introduit pendant la phase de « travail », moment
où la viscosité est suffisamment faible pour
pénétrer l'os, et le monomère de la phase de
mélange déjà relargué ;
Taille, épaisseur et poids. A poids égal une
boule (rapport surface/volume faible) dégagera plus de chaleur qu'une
feuille (rapport surface/volume important) ;
Conditions de préparation et d'implantation : dans des
conditions opératoires, la porosité des ciments acryliques est de
l'ordre de 8 %. Ces pores sont responsables d'une baisse des qualités
mécaniques par un effet de concentration de contraintes. Une diminution
de la porosité peut être obtenue par centrifugation du ciment. De
même, l'inclusion d'eau, de sang, de moelle osseuse dans le ciment
diminue les qualités mécaniques par lamination ;
Additifs : des antibiotiques peuvent être ajoutés
au ciment. Sous certaines réserves, les qualités
mécaniques ne sont pas ou peu modifiées par l'ajout
d'antibiotiques (1 g d'antibiotique pour 40 g de polymère diminuent de 4
% la résistance en compression). Toutefois, l'antibiotique doit
être mélangé de façon homogène sous forme de
poudre et non de liquide qui risquerait comme dans l'inclusion d'eau ou de sang
de réaliser une inclusion, source de phénomène de
concentration de contraintes. La diffusion de l'antibiotique est
essentiellement locale mais peut être prolongée (une concentration
bactéricide a été retrouvée jusqu'à 7 mois
dans de l'os cortical de chien), la diffusion sérique reste
négligeable. Le relargage maximal se fait dans les premiers jours.
L'activité antibactérienne dépend de la sensibilité
du germe, mais les doses locales d'antibiotiques sont importantes et ne
correspondent pas aux critères habituellement admis pour les
antibiogrammes.
Propriétés mécaniques des
interfaces
La résistance de l'interface os-ciment est
directement liée à l'importance de la surface en contact.
L'utilisation de ciment de basse viscosité améliore la
pénétration dans les pores de l'os et donc les qualités
mécaniques de l'interface.
De la même manière l'interface
métal-ciment ou polyéthylène-ciment est
améliorée par tous les traitements visant à augmenter les
surfaces en contact
Matériaux d'origine biologique
Le principe de ces matériaux est de
créer un support naturel capable de guider une repousse tissulaire
spécifique suppléant à terme la fonction déficiente
initiale. L'avantage principal de ces matériaux serait la
possibilité d'adaptation inhérente au tissu vivant. Le principal
matériau biologique reste l'os. Les cas du collagène et du corail
seront évoqués.
Matériaux
naturels
On distingue selon l'origine et le receveur :
ü les xénogreffes : greffes entre espèces
différentes (par exemple : os bovin sur homme) ;
ü les allogreffes : greffes entre individus
différents mais appartenant à une même espèce (par
exemple : tête fémorale de banque implantée pour une
reconstruction) ;
ü les autogreffes où le receveur est son propre
donneur.
L'autogreffe reste le meilleur matériau de
comblement de pertes de substances osseuses, mais elle nécessite une
chirurgie additionnelle avec les risques locaux et généraux que
cela comporte, d'autre part, sa quantité est limitée.
L'emploi des allogreffes est maintenant régi par une
réglementation sévère. L'origine, le mode de
prélèvement, la stérilisation et le mode de conservation
sont des paramètres indispensables à connaître. Le
prélèvement se fait stérilement sur des patients indemnes
de pathologies infectieuses (VIH, hépatite, CMV), les greffons sont
ensuite irradiés et conservés congelés. On peut obtenir
des greffons massifs de taille et de volume adéquat aux
propriétés mécaniques, bien qu'inférieures à
l'os frais, suffisantes. Ces greffes, quand elles sont massives ne sont
revascularisées qu'en surface, elles subissent une résorption
lente et leur réhabitation osseuse est incertaine. Elles doivent
nécessairement être ostéosynthésées de
façon stable ; l'association avec une autogreffe peut favoriser une
fusion avec l'os receveur.
Corail
C'est une céramique naturelle poreuse issue du
squelette corallien Porites. Il est constitué essentiellement de
carbonate de calcium sous forme de cristaux d'aragonite (carbonate de calcium
> 97 %, oligoéléments 0,5 à 1 %, acides aminés
0,07 %, eau < 0,5 %). L'architecture corallienne permet une
pénétration osseuse car elle est poreuse ; la porosité
ouverte et la taille des pores (150 ìm en moyenne) favorisent la
pénétration cellulaire et l'établissement d'une
néovascularisation).
Son implantation en tissu mou chez l'animal est bien
tolérée, elle provoque une colonisation par un tissu
conjonctivovasculaire puis une résorption très progressive entre
2 et 12 mois. Dans l'os, et sous certaines conditions ce tissu
conjonctivovasculaire se différencie en tissu osseux et on assiste
simultanément à une résorption très progressive du
corail (par l'anhydrase carbonique contenue dans les ostéoclastes). Les
contraintes locales régissent le remodelage osseux. En cas de
fragmentation, on assiste à des réactions puriformes
aseptiques.
Les propriétés mécaniques sont
fonction de la porosité. A porosité égale, le corail a une
contrainte à la rupture équivalente à celle de l'os
cortical, mais son module d'Young est plus élevé : il a un
comportement fragile. Son comportement mécanique est acceptable à
condition de protéger l'implantation par une ostéosynthèse
stable pendant une durée minimale de 1 an. En pratique, il est
utilisé comme comblement osseux dans les arthrodèses
vertébrales (antérieures et postérieures), dans les
ostéotomies d'addition, et en traumatologie dans les comblements osseux
après fracture du calcanéum ou des plateaux tibiaux.
Collagène
Le collagène est une protéine naturelle
présente dans les tissus de soutien (peau, os, vaisseaux...). Il est
constitué de la répétition d'unités de base, le
tropocollagène, polypeptide constitué de trois chaînes
formant un triple hélice, et du télopeptide, court fragment non
hélicoïdal. De nombreux types de collagènes ont
été décrits chez les mammifères dépendant du
taux d'hydroxylation, du taux de glycosilation, du nombre de liaisons
interchaînes et de la composition du télopeptide.
Le type I : présent dans les os et tendons, il
comprend deux chaînes á et deux chaînes â ; il n'y a
que 5 % de télopeptide.
Le type II : présent dans le cartilage hyalin,
il comprend trois chaînes á identiques, associées aux
glycoaminoglycanes ; il confère au cartilage hyalin ses
propriétés spécifiques.
Sans parler des auto-, des allo- ou des
xénogreffes tendineuses qui sont en fait un apport collagénique
spécialisé, en chirurgie orthopédique, le collagène
pur natif n'est utilisé qu'au stade de recherche. Il a été
utilisé dans le comblement de lacunes osseuses, dans la
réparation de surfaces articulaires, comme renfort ligamentaire et comme
agent hémostatique.
Les techniques de greffes osseuses
Sont maintenant couramment mises en oeuvre par les praticiens
tant en chirurgie orale qu'orthopédique. L'objectif
général est de promouvoir une régénération
osseuse. Sans remettre en cause l'efficacité incontestable des
autogreffes, cette technique présente des inconvénients majeurs
comme les douleurs résiduelles, la morbidité, les complications
diverses. Il faut de plus considérer que les quantités
disponibles sur le site donneur sont limitées et parfois de
qualité insuffisante pour une application chirurgicale
spécifique. Les progrès de la chimie et du génie des
procédés, des biotechnologies, ont permis de proposer une
alternative à l'utilisation des greffes osseuses naturelles. De
très nombreuses céramiques en phosphate de calcium,
destinées à remplacer les allogreffes, les autogreffes, et les
xénogreffes, sont mises à disposition des chirurgiens depuis
plusieurs années. Si l'efficacité de ces céramiques est de
plus en plus démontrée par les résultats cliniques qui
sont présentés par des équipes chirurgicales dans le monde
entier, il existe pourtant des différences importantes dans la
cinétique de résorption et de reconstruction osseuse aux
dépens du substitut osseux. Si ces différences de performance et
d'efficacité peuvent être liées au site opératoire,
au patient, à la technique chirurgicale, elles sont cependant
essentiellement liées aux caractéristiques chimiques
(hydroxyapatite HA, phosphate tricalcique TCP, biphasé mélange
HA/TCP) et structurales (micropores, macropores, surface spécifique des
cristaux constitutifs de la céramique). Depuis les trois
dernières décennies, de nombreuses d'études
précliniques et cliniques décrivent l'incidence de ces
caractéristiques sur la cinétique de résorption du
substitut osseux et de la reconstruction osseuse aux dépens du
biomatériau (quantité et architecture osseuse), et pourtant le
chirurgien utilisateur n'est pas suffisamment informé ou conscient de
ces différences fondamentales entre les diverses fabrications de
biocéramiques en phosphate de calcium misent à leur disposition,
qui conditionnent la réussite opératoire. Seule la maîtrise
des procédés de fabrication, la maîtrise des
propriétés structurales et pas seulement la nature chimique,
garantie une reproductibilité des résultats biologiques, et
répondre aux besoins chirurgicaux qui sont :
L'efficacité : biocompatibilité, pas de
réaction à corps étranger, remplacer les greffes
osseuses ;
La performance : résorption et substitution
osseuse, pour être plus efficace que les allogreffes morcelées et
aussi, sinon plus efficace (grâce à l'ingénierie
tissulaire) que l'autogreffe.

Figure 2 : Différentes formes disponibles de
substitut osseux de synthèse.
L'autogreffe est le « gold standard » de
la reconstruction osseuse. Elle est la seule capable de fournir des facteurs de
croissance ostéo-inducteurs, des cellules ostéogéniques et
un « échafaudage » ostéoconducteur. La
morbidité du site donneur est sa principale limite. Le risque de
transmission de maladie du donneur restreint le recours à l'allogreffe.
Les substituts synthétiques manquent de propriétés
ostéo-inductrices ou ostéogéniques. Les substituts osseux
composites combinent les propriétés
d'« échafaudage » avec des éléments
biologiques pour stimuler la prolifération et la différenciation
cellulaire et éventuellement, l'ostéogenèse. Nous donnons
un aperçu des greffons et substituts osseux disponibles pour des
applications cliniques.
La mise au point de nouveaux tissus exige une approche qui
associe la biologie du développement, la biologie cellulaire et
moléculaire à la médecine clinique, à la biochimie,
à l'immunologie, à l'ingénierie, et aux sciences des
matériaux. Tandis que de nombreux chercheurs essaient de reproduire des
structures endogènes pour créer de nouveaux tissus, de nombreuses
barrières doivent être surmontées pour créer des
tissus complexes, vascularisés, spécifiques du patient pour une
utilisation de remplacement et de réparation. Bien que la mise au point
de tissus à composants multiples exige la mise en oeuvre de nombreuses
idées, dans un souci de clarté nous limiterons cette revue aux
développements récents de l'application des structures
biorésorbables naturelles et synthétiques. Ici, nous mettons en
valeur des biomatériaux potentiellement utiles aux chirurgiens
plasticiens qui sont actuellement utilisés ou ont été
développés pour être utilisés pour des remplacements
et des réparations de la peau et des os.
L'ingénierie tissulaire, au carrefour des sciences du
vivant et des sciences de l'ingénieur, a pour but de remplacer,
maintenir ou améliorer la fonction de tissus humains, grâce
à des substituts tissulaires incluant des éléments
vivants. Il s'agit donc d'élaborer des tissus artificiels, en utilisant
(isolément ou en association) des cellules, des matrices et des facteurs
bioactifs. Leur association est un biomatériau hybride qui réunit
des composés biologiques (cellules, facteurs de croissance, ou
protéines d'adhésion) et des matériaux (polymères,
céramiques). Les applications sont larges, intéressant aussi bien
la peau que le foie ou la cornée, mais également l'appareil
locomoteur. Dans ce cadre c'est l'ingénierie du tissu osseux qui est la
plus développée, en partie grâce à l'avancée
des substituts osseux, mais le cartilage ou les tendons sont également
concernés. Cette technologie fait appel aux cultures de cellules
(cellules différenciées, ou plus souvent cellules souches de la
moelle osseuse), à des biomatériaux (matériaux poreux
à architecture contrôlée, mais également ciments),
à des facteurs de croissance (comme les bone morphogenetic
proteins), aux protéines intervenant dans l'adhésion
cellulaire (telles que la fibronectine, ou les séquences reconnues par
les sous unités d'intégrine), ou à la thérapie
génique (notamment en utilisant des cellules-souches
transfectées). L'ingénierie tissulaire et la stimulation de la
régénération tissulaire sont en plein essor sur le plan
expérimental et industriel, et les applications cliniques sont de plus
en plus nombreuses. Elles devraient se développer très largement
compte tenu du potentiel de ces technologies.
Figure 1 : Biomatériau injectable associant
le principal constituant minéral de l'os : hydroxyapatite (granules
noirs) et le principal composé organique : collagène
(astérisques).
Figure X : Biomatériau hybride :
cellules stromales ostéoprogénitrices (flèche) au sein
d'une architecture poreuse en hydroxyapatite (faciès de rupture).

Figure X : Ostéo-induction : formation
de tissu osseux (têtes de flèches) au sein d'un biomatériau
hybride, après un mois d'implantation en site intramusculaire
(microscopie optique, May-Grünwald-Giemsa ; barre : 140
ìm).
Les biomatériaux sont considérés comme
des dispositifs médicaux implantables. L'utilisation des
matériaux de reconstruction et de substitution osseuse est
sécurisée en Europe par la procédure du marquage CE et par
la matériovigilance, indépendante de la certification
imposée aux États-Unis par la Food and Drug Adminstration. Les
indications sont souvent concurrentielles avec les autogreffes, avec l'avantage
de limiter la morbidité liée au prélèvement
autologue. Les bénéfices recherchés peuvent être
fonctionnels, esthétiques ou mixtes. Les principales indications
conventionnelles sont présentées : otologiques,
rhinosinusiennes, traumatologie, laryngologie, rajeunissement facial, implants
et épithèses. Les principaux axes de recherche (renforcement des
propriétés thérapeutiques, matériaux vecteurs de
principe actif, ingénierie tissulaire...) sont discutés.
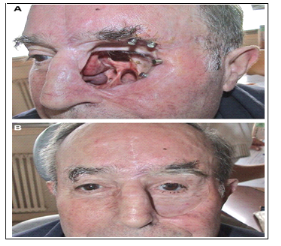
Figure X : A. Patient
opéré d'un adénocarcinome de l'ethmoïde gauche
multirécidivé, ayant nécessité une
exérèse de la base du crâne et une exentération.
Quatre implants en titane vissés ont été mis en place pour
permettre l'accrochage de l'épithèse. B. Aspect
de l'épithèse en place.
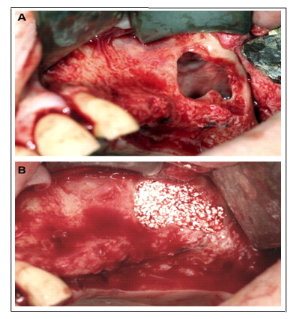
Figure X : Chirurgie de rehaussement du plancher du
sinus maxillaire (clichés du Dr Afchine Saffarzadeh, unité
d'implantologie du pôle odontologie du CHU de Nantes). L'intervention est
effectuée afin de rétablir une hauteur osseuse maxillaire
suffisante pour permettre la mise en place différée d'un implant
dentaire en regard de la cavité sinusienne. A. Aspect
peropératoire avant la mise en place du substitut osseux de MBCP.
B. Aspect en fin d'intervention, après comblement du
plancher sinusien maxillaire par le BCP mélangé avec de la colle
biologique
Méthodes de
synthèse des biomatériaux pour la reconstruction osseuse
Méthode par
fusion
En 1970, Hench découvre les verres bioactifs. Ce sont
des matériaux amorphes avec de faibles propriétés
mécaniques, lesquelles orientent leurs applications en tant que
revêtements prothétiques. La composition particulière qui
instaure la bioactivité est basée sur quatre oxydes : 45% de
SiO2 ,24.5% de Na2O, 24.5% de CaO, et 6% de
P2O5. Les verres bioactifs appartiennent à la
famille des céramiques bioactives (comme l'hydroxyapatite et autres
phosphates de calcium).
Le bioverre est dérivé d'un mélange de
matériaux bruts inorganiques. Ce mélange est transformé en
Un liquide homogène, fondu complètement et dénué
d'inclusions cristallines ou gazeuses, en le chauffant à Une
température située entre 1 300°C et 1 600°C selon
la composition en oxydes. Ce liquide est alors Transformé en une
substance amorphe, solide, en augmentant progressivement sa Viscosité
à température ambiante, sans lui permettre pour autant de
cristalliser. Une fois que la composition du bioverre a été
choisie, le mélange vitrifiable est placé à
l'intérieur d'un four, dans un creuset en métal
réfractaire (généralement en platine). En fait, la
transformation d'un Mélange hétérogène en un
liquide homogène se produit en plusieurs étapes. A l'issue de ces
dernières, le verre contient tout de même un grand nombre de
bulles dues à la décomposition, entre autres, de carbonates. Dans
le but d'homogénéiser cette masse fondue, une étape dite
d'affinage est nécessaire. Durant cette phase, la
propriété principale est la viscosité du liquide fondu.
Les bulles tendent à Atteindre la surface du verre et rencontrent
une résistance proportionnelle à la viscosité. Ainsi, une
Augmentation de température pouvant atteindre 1500 °C permet la
réduction de viscosité. Ensuite, le verre Est homogène
mais sa viscosité est trop basse pour qu'il puisse être
utilisé.
Une autre phase s'impose, durant laquelle la
température est réduite jusqu'à ce que le verre
acquière La viscosité nécessaire. Il est ensuite
réduit en poudre et refroidi dans des conditions contrôlées
jusqu'à ce qu'il atteigne la température ambiante. Il persiste,
cependant, un certain degré
d'hétérogénéité de la poudre. Ceci est
principalement dû au fait que, techniquement, la fusion du verre est
faite dans des creusets relativement petits (contenance: 1 kg). Aussi, un tel
processus ne peut garantir la même homogénéité
Obtenue lors de la fusion dans des plus grands récipients de
mélange.
Méthode
sol-gel
Le procédé sol-gel est sans doute le
plus simple et le moins onéreux. La méthode est basée sur
l'utilisation d'un sol obtenu à partir de précurseurs d'alkoxydes
métalliques ou organométalliques. Ce sol, solution contenant des
particules en suspension, polymérise à basse température
pour former un gel humide. Celui-ci sera densifié par recuit thermique
pour donner un produit inorganique sous forme de gel sec, de Verre ou de
polycristal.
Les atouts de la méthode sol-gel
résident dans le fait que les produits finaux peuvent être
très purs si Le précurseur lui-même a été
purifié. D'autre part, le processus chimique est mené à
basse température, on Parle de chimie douce, ce qui permet un meilleur
contrôle de la cinétique de la réaction.
Le procédé sol-gel présente
également l'avantage unique de permettre la préparation de
produits de même composition sous des formes radicalement
différentes comme des poudres, des fibres, des revêtements, des
monolithes, en faisant varier seulement quelques conditions
expérimentales.
En comparaison directe avec le traitement à
haute température, les bioverres obtenus par la méthode sol-gel
possèdent un plus faible module d'élasticité et une plus
haute ductilité, leur conférant une meilleure résistance
mécanique. De plus, les bioverres obtenus grâce à ce
processus présentent un rendement Supérieur de formation
d'hydroxyapatite, ils sont plus bioactifs. Ceci est du à une
homogénéité plus élevée mais
également à une surface de contact plus importante,
assurée par leur nanoporosité.
La figure 1 illustre la méthode de préparation des
bioverres à l'aide du procédé sol-gel.
En d'autres mots, on peut obtenir de petits matériaux
sans nécessairement passer par une étape de fusion. Cette
méthode ancestrale de polymérisation inorganique est compatible
avec la chimie organique. Cela permet l'élaboration de matériaux
hybrides organominéraux qui débouchent sur des applications
industrielles pouvant se positionner sur des marchés niches souvent
à hautes valeurs ajoutées.
Bien que le procédé sol-gel présente
beaucoup d'avantages sur les procédés conventionnels,
l'inconvénient majeur réside dans la grande teneur en groupes
hydroxyles (OH) ainsi qu'en impuretés organiques qui sont
indésirables pour certaines applications, par exemple pour obtenir des
fibres optiques de bonne qualité. Cependant, la relative
simplicité du procédé, particulièrement pour
obtenir des produits à composition très homogène ou des
revêtements, rend cette technique attractive.
Principaux états du système lors de la
transition sol-gel :
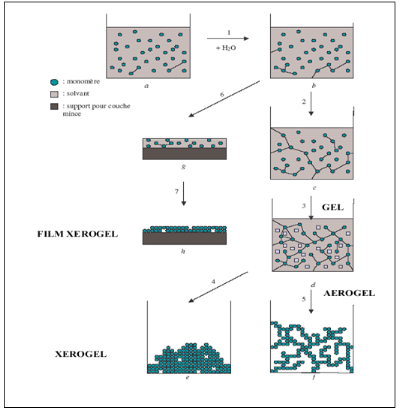
Figure 4 : Principales étapes d'une synthèse
d'un matériau par voie sol-gel.
La solution liquide contenant les réactifs
peut soit être appliquée « comme une peinture », soit
être transformée en un gel. Ce gel deviendra un solide poreux, un
verre, une céramique ou une poudre selon la méthode de
séchage utilisée.
Le premier état est celui de sols
hydrolysés et/ou condensés (a) : solution liquide d'alcoxydes
métalliques partiellement dissous dans un solvant. L'adjonction d'eau
(1) entraîne l'hydrolyse et les réactions de
polymérisation. Il se forme des oligomères et des
polymères en solution (b) (Figure 4).
La viscosité de la solution (2) augmente
jusqu'à l'obtention d'un gel au « tgel » (temps
nécessaire à l'obtention du gel après l'ajout d'eau aux
conditions considérées) (c). Le mot gel n'a de signification
qu'au niveau macroscopique, où il apparaît comme un solide, bien
que contenant encore une grande quantité de liquide interstitiel. Au
niveau moléculaire rien ne change. Le maillage du gel reste très
lâche juste après le point de gel, et les espèces non
liées au gel peuvent toujours diffuser et réagir
(polymérisation, dépolymérisation et greffage au
réseau).
Puis le gel vieillit (3), par greffages successifs
son maillage devient plus dense, les molécules et surtout les
macromolécules diffusent beaucoup plus difficilement. Cette
période peut durer plusieurs tgel (d). On peut parfois
observer une « synérèse » (c'est à dire une
expulsion du solvant).
Diverses méthodes de séchage peuvent ensuite
être employées :
· Le gel peut être séché dans
des conditions douces (4). Il durcit en se compactant : c'est un xérogel
(e) (formation des verres et céramiques denses).
· Le solvant peut être évaporé
dans des conditions supercritiques (5) (vitesse d'évaporation importante
et constante) pour former un gel très peu compact : c'est un
aérogel (f).
· Lorsque l'on n'en est encore qu'à
l'étape du sol, il est possible de répandre le sol sur une
surface (6 et 7) pour former des films de xérogels en couches minces
(par exemples les techniques de spin-coating ou dip-coating) (h).
Réactions en phase aqueuse :
Les synthèses en phase aqueuse se font selon deux
procédés différents : la méthode par double
décomposition et la méthode par neutralisation. Ces
procédés sont actuellement utilisés pour la production
industrielle d'apatite
La méthode par double décomposition (17,
42-46) consiste à ajouter de façon contrôlée
une solution du sel de cation Me dans une solution du sel de l'anion
XO4. Le précipité est ensuite lavé et
séché. Cette technique permet également d'obtenir
des apatites mixtes (contenant deux cations différents) avec une
maîtrise du rapport Me1/Me2. Les cations sont introduits
simultanément dans le réacteur avec le rapport Me1/Me2
désiré, cela permet d'éviter une
ségrégation lors de la précipitation. Les principaux
inconvénients de cette méthode viennent de sa mise en oeuvre qui
nécessite beaucoup de matériel et de sa vitesse de
synthèse qui est plutôt lente.
· La méthode par neutralisation consiste
à neutraliser une solution de lait de chaux en y ajoutant une
solution d'acide phosphorique. Cette réaction permet d'obtenir
rapidement de grandes quantités d'hydroxyapatite phosphocalcique avec
peu de matériel (42, 47). Il est également possible de
synthétiser des fluorapatites.
Réactions en phase solide :
La synthèse par réaction solide -
solide consiste à chauffer un mélange réactionnel,
constitué des divers sels des cations et des anions, dans un
rapport Me/XO4 égal à 1,67. Ce mélange doit
être parfaitement homogène pour permettre une
réaction totale. La synthèse d'une fluorapatite
phosphocalcique peut être effectuée, par exemple, à
partir de phosphate tricalcique et de fluorure de calcium selon la
réaction suivante :

Cette réaction s'effectue à 900
°C pendant plusieurs heures. Dans le cas d'une réaction
solide/gaz, le gaz provient soit de la sublimation d'un sel solide
contenu dans le mélange réactionnel (la synthèse
peut alors s'effectuer dans une enceinte fermée), soit par un
apport extérieur sous forme d'un balayage du gaz réactif par
exemple.
Les propriétés des
biomatériaux
Biocompatibilité
La notion de biocompatibilité est essentielle
dans le domaine des biomatériaux. On peut la définir de
façon "négative", par les propriétés que le
matériau ne doit pas avoir (pas de réaction
inflammatoire, pas de toxicité, ...), ou, à la suite d'une
évolution plus récente, de façon plus positive de
biocompatibilité élargie (et si possible mesurable),
définie comme "la capacité d'un matériau à
être utilisé avec une réponse de l'hôte
appropriée dans une application spécifique". Cette
biocompatibilité "élargie" débouche sur la notion
très actuelle de "bioactivité", par laquelle l'on souhaite que le
matériau ne soit pas nécessairement le plus inerte possible, mais
au contraire fasse réagir le tissu vivant.
La biofonctionnalité
Apprécie l'adéquation entre un
biomatériau et son utilisation clinique. Par exemple, un matériau
peut être très bien toléré sous forme massive, mais
son utilisation comme surface de frottement produit des particules de petite
taille dont la tolérance est différente.
Bio-activité
La bio-activité est définie comme la
propriété de permettre des réactions chimiques
spécifiques à l'interface implant-tissu receveur. Elle
dépend directement des propriétés chimiques et
physico-chimiques du matériau et s'oppose à la bio-inertie
(matériaux biocompatibles mais inertes).
En matière de tissu osseux, elle représente
l'établissement de liaisons chimiques entre l'implant et l'os
environnant, mais elle n'implique pas forcement l'existence d'une
ostéoconduction, ostéoinduction ou
ostéogénèse.
Biointégration
« L'aptitude d'un matériau à être
colonisé par les cellules vivantes ». Cette aptitude est
recherchée dans le cas des prothèses (prothèse de hanche
et de genou) et à exclure dans le cas des sondes (sondes urinaires).
Relargage
Tout biomatériau libère des ions par
dissolution dans le corps humain. Ce relargage lié à un
processus de dissolution augmente avec la corrosion. Si ces ions sont
métalliques, ils peuvent former des complexes métalloorganiques
capable d'induire des dysfonctionnements cellulaires. Le biomatériau
est profondément altérer. Dans le cas d'une prothèse, ce
processus peut aboutir à son descellement. Certains ions sont
connus pour être toxique pour certains organes le Cadmium et le Plomb
sont de puissants néphrotiques.
Porosité
La porosité correspond au rapport du volume des espaces
vides de matière sur le volume global du matériau. Elle est
exprimée en %. La porosité est dite continue si les pores sont
interconnectés entre eux et ouverte si les pores débouchent
à l'extérieur. La quantification de la porosité
dépend des matériaux considérés. En ce qui concerne
les matériaux utilisés comme substituts osseux, on parle de
macroporosité lorsque les pores font plus de 100 um de diamètre
et de microporosité si leur diamètre est inférieur
à 5 um et de mésoporosité quand les pores ont un
diamètre intermédiaire entre les deux valeurs qui
précèdent. Les rapports respectifs de la microporosité et
de la macroporosité ainsi que la taille des pores et leur
interconnection conditionnent les propriétés mécaniques et
la repousse osseuse dans le matériau.
Ces paramètres devront donc être
précisés séparément pour caractériser une
céramique. L'imagerie (microscopie électronique en balayage, MEB)
et la porosimétrie à mercure sont les outils les plus
appropriés pour préciser la micro et macroporosité ;
la compacité n'exprimant que la porosité globale
Ostéoconduction
C'est un processus tridimensionnel qui est observé
lorsque des structures poreuses sont implantées dans l'os (Charles et
cornell). Le matériau est un support passif contrairement à un
matériau ostéoinducteur qui contient des éléments
capables d'induire une production d'os.
Quelques propriétés
physico-chimiques
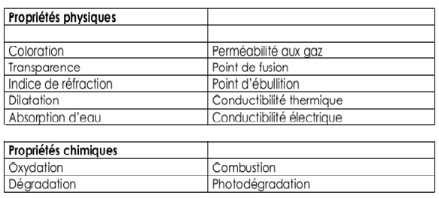
Propriétés mécaniques des
biomatériaux
Les essais pratiqués pour apprécier les
propriétés mécaniques peuvent se diviser en deux grands
groupes :
Les essais peu liés au temps dans lesquels la
déformation provoquée est peu liée à la
durée d'application de la force :
L'essai de traction, de compression ou de flexion,
détermine l'aptitude à la déformation d'un matériau
soumis à un effort progressif
L'essai de dureté fournit des renseignements sur
la résistance à la pénétration d'une pièce
dure soumise à un effort constant
L'essai de résilience caractérise la
résistance au choc
Les essais fortement liés au temps dans lesquels la
déformation provoquée dépend de la durée
d'application de la force :
-L'essai de fatigue étudie le comportement du
matériau vis à vis de sollicitations alternées bien
inférieures à la contrainte nécessaire pour le rompre
-L'essai de fluage mesure la déformation, en
fonction du temps, du matériau sous charge constante.
Essai de traction :
L'essai le plus fréquemment utilisé afin de
déterminer le comportement mécanique d'un matériau est
l'essai de traction. Cet essai est caractérisé par sa
facilité de mise en oeuvre et par la richesse des informations fournies.
On exerce une force de traction sur un barreau de dimension
standardisée, jusqu'à sa rupture, en suivant un processus de mise
en charge à une vitesse de déformation constante.
L'éprouvette d'essai est prélevée dans le
matériau à caractériser et usinée à des
dimensions normalisées, afin d'assurer une meilleure comparaison des
essais effectués dans différents laboratoires. Pour chaque type
de matériau, il existe un type d'éprouvette.
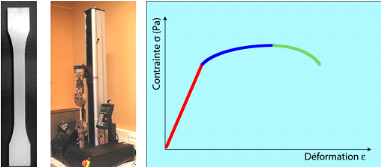
Figure 1. Eprouvette. Machine de traction. Courbe
contrainte-déformation
En enregistrant la force appliquée à
l'éprouvette par la machine de traction et son allongement progressif on
obtient un diagramme contrainte-déformation.
Diagramme contrainte-déformation en traction d'une
éprouvette en métal
L'application d'une force provoque initialement une
déformation élastique de l'éprouvette. Cela se traduit sur
le diagramme par une droite car la déformation est proportionnelle, pour
un métal, à la contrainte (loi de HOOKE).
Cette déformation élastique est réversible.
Si la contrainte est annulée, l'éprouvette revient
instantanément à sa forme initiale. Cette déformation
élastique est suivie d'une déformation irréversible
(permanente) appelée déformation plastique, qui se traduit sur le
diagramme par une courbe qui se termine au moment de la rupture de
l'éprouvette.

Figure 2. Courbe contrainte-déformation. Domaine
élastique et domaine plastique
Différents paramètres sont remarquables :
Le module d'élasticité E (ou module de YOUNG)
donné par la pente du domaine élastique du diagramme
contrainte-déformation
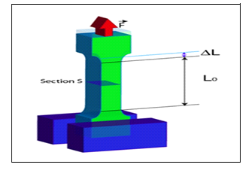
Figure 3 : Traction simple : force et allongement
Le module d'élasticité :
Si l'on raisonne, par simplification, sur un corps
parallélépipédique supposé à une seule
dimension dans un essai de traction dans un seul axe (uniaxiale, selon l'axe
des x), l'éprouvette subit un allongement (figure 3). Pour les petites
déformations, il existe une relation linéaire entre la contrainte
et la déformation :
óx = E.åx = E ÄL/L0= E (L- L0)/ L0
E est le module d'élasticité ou module de YOUNG
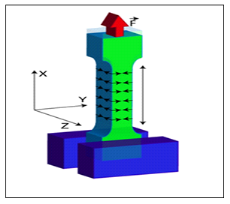
Figure 4 : déformations dans les trois directions
En réalité, l'éprouvette se
déforme dans les 3 directions ( figure 4).
Dans le sens Ox il y a un allongement, dans les sens Oy
et Oz il y a raccourcissement.
Dans ce cas de traction simple, si les contraintes óy et
óz sont nulles, les déformations åy et
åz ne le sont pas. Les 3 déformations sont
reliées par le coefficient de POISSON.
? x 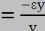 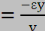 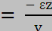 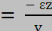
v est le coefficient de POISSON
La limite d'élasticité Re correspond à la
contrainte à partir de laquelle le matériau commence à se
déformer plastiquement. En pratique, bien que la définition soit
simple, cette limite est difficile à apprécier car le passage du
domaine élastique au domaine plastique se fait de façon
progressive. La difficulté de lecture donnerait des
interprétations erronées de cette limite d'un laboratoire
à l'autre. Pour s'en affranchir, on a déterminé une limite
conventionnelle d'élasticité à 0,2% (Re 0,2%). C'est la
contrainte pour laquelle on mesure une déformation plastique de 0,2%.
La résistance à la traction Rm se définit
comme la contrainte maximale atteinte durant l'essai de traction.
L'allongement à la rupture år que l'on peut lire
sur le diagramme ou sur l'éprouvette rompue.
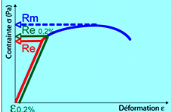
Figure 5 : Courbe contrainte-déformation. Limite
d'élasticité et résistance à la traction
On peut également définir certaines
caractéristiques déterminées par l'essai de traction :
La rigidité est fonction de l'énergie des liaisons
entre les atomes ou les molécules constituant le matériau. On
mesure la rigidité principalement par le module d'YOUNG.
Plus ce module est élevé, plus le matériau
est rigide.
La résistance caractérise la contrainte maximale
qu'un matériau supporte avant de se rompre. Cette résistance est
fonction de l'intensité des liaisons mais également de la forme
des pièces ou de ses défauts.
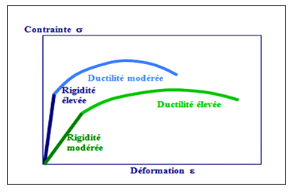
La ductilité correspond à la capacité d'un
matériau à se déformer de façon permanente avant de
se rompre. Plus l'allongement à la rupture est élevé, plus
le matériau est considéré comme ductile. A
l'opposé, lorsque la déformation permanent est très
réduite ou nulle, on parle d'un matériau fragile. Un
matériau fragile peut présenter une résistance très
élevée (figure 6).
Figure 6. Courbe contrainte-déformation. Deux
matériaux avec des rigidités et des ductilités
Différentes
La ténacité qui représente la
quantité d'énergie absorbée à la rupture par un
matériau. Elle caractérise la résistance à la
propagation brutale de fissures. Sa valeur est égale à l'aire de
la surface sous la courbe contrainte-déformation. Cette
caractéristique est importante pour les céramiques.
Figure 7. Courbe contrainte-déformation.
Ténacité = surface sous la courbe
Essais de dureté
La dureté peut être définie comme une mesure
de la résistance à la déformation plastique
localisée. Les méthodes de mesure de la dureté sont
basées sur la pénétration forcée d'un indenteur
à la surface d'un matériau. Une valeur de dureté est
déterminée par la mesure de la dimension ou de la profondeur de
l'empreinte faite par l'indenteur soumis à des charges et des vitesses
d'application contrôlées.
Essai de résilience ou rupture par
fragilité
L'aptitude d'un métal à ne pas se rompre par
fragilité c'est-à-dire à résister aux
sollicitations par choc s'appelle la « résilience ».
Principe :
Cet essai consiste à rompre en son milieu d'un seul coup
de mouton-pendule une éprouvette entaillée en U en son milieu et
reposant sur deux appuis.
Essai de Fatigue :
Les essais mécaniques ci-dessus cités (Traction -
Dureté - Résilience) constituent une étude en statique du
matériau. En effet, on cherche le plus souvent à travailler dans
le domaine élastique d'un matériau, et une étude statique
permet de déterminer la zone élastique.
Mais, lorsque les efforts varient avec le temps, c'est le
phénomène de fatigue qui intervient. Les pièces peuvent
rompre même si elles fonctionnent dans le domaine élastique.
On a constaté expérimentalement qu'un
matériau, soumis à des efforts répétés,
inférieurs à la charge de rupture, pouvait se rompre sans
déformation préalable.
Essai de fluage
Dans la déformation permanente l'éprouvette
après avoir subi un effort unitaire supérieur à sa limite
élastique prenait un allongement déterminé et conservait
une longueur constante pendant la maintien de la charge.
Mais si l'effort est prolongé et si, de plus,
l'éprouvette est portée température élevée,
un nouveau phénomène apparaît : la déformation
visqueuse.
La limite élastique baisse avec le temps, et
l'éprouvette s'allonge : on dit qu'elle « flue » et
le phénomène, appelé « fluage », se
poursuit après l'application de la contrainte.
Propriétés chimiques et
électrochimiques
Les propriétés chimiques et
électrochimiques des biomatériaux métalliques sont d'une
grande importance, puisque tant au laboratoire qu'en clinique ces
biomatériaux sont susceptibles de présenter différentes
forme d'altérations.
Schématiquement, il existe deux types
d'altérations :
§ En atmosphère sèche, nous parlerons des
«corrosions simples».
§ En atmosphère humide, on a présence d'un
électrolyte, nous parlerons de «corrosions
électrochimique».
Remarque :
Le terme corrosion désigne :
§ Le processus d'interaction métal/milieu ambiant.
§ La destruction partielle ou totale du matériau
métallique.
Corrosion chimique
Le métal est susceptible de réagir lorsqu'il est
directement en contact avec un gaz.
Exemple :
ü Fe + O2 (à haute
température)
ü La sulfuration de l'Ag (dans l'air polluée
par les composées sulfureux)
ü La sulfuration d'alliages dentaires
(chauffés en atmosphère réductrice)
Définition de l'oxydation
Au sens étroit, l'oxydation est la fixation
d'oxygène, le phénomène inverse (enlèvement
d'oxygène) étant la réduction.
Au sens large, l'oxydation correspond à la fixation
d'un élément électronégatif (oxygène,
halogène, soufre, azote...) ou à l'enlèvement d'un
élément électropositif (hydrogène ou
métal).
Au sens atomique, l'oxydation est une
dé-électronation, c'est-à-dire la perte d'électrons
par un atome ou un groupe d'atomes, le gain d'électrons constituant la
réduction.
Formation de la pellicule d'oxydation
Exemple : CuO
Lorsque le «Cu» est chauffé
à une température (500-800 c°), les molécules
d'O2 sont absorbées à la surface sous l'action des
attractions exercées par les atomes superficiels (on a la rupture des
molécules d'O2 qui vont s'adjoindre aux atomes de Cu) il se
forme à la surface une 1ère pellicule mono moléculaire
d'oxyde cuivreux Cu2O de couleur rouge vif, puis d'oxyde cuivrique
CuO de couleur noir.
Une fois la première pellicule formée, plusieurs
mécanismes sont possibles :
Type P
La croissance peut se faire à l'interphase
métal/oxyde pour les oxydes semi-conducteurs de type
«P» telle que : Cu2, NiO, FeO, CoO,
Cr2O3
Type N
La croissance de la pellicule peut également se faire
à l'interphase oxyde/air pour les semi-conducteurs de type
«N» : ZnO, CdO, TiO2.
Le ZnO ; produit de base de la plupart des biomatériaux
d'obturation et de scellement minéraux ou organique
Type bilatéral
Cette croissance peut se faire bilatéralement et
simultanément en son épaisseur : métal / oxyde / Air.
Classification des pellicules d'oxydation:
Elle est liée à la diffusion de la couche
d'oxydation, vue le rôle important de la pellicule d'oxydation dans le
mécanisme et l'évolution de la corrosion, on a pu constater 2
possibilités :
ü La diffusion du métal ou de l'O2
à travers la pellicule d'oxyde formée est impossible ou
très lente parce que le volume atomique de l'oxyde est supérieur
à celui du métal.
Exemple : Al, Sn, Cu, Fe, Mn, Cr.
ü La diffusion du métal ou de l'O2 est
possible à travers la couche d'oxyde parce que le volume atomique de
l'oxyde est inférieur à celui du métal
Exemple :
Na, Ba, Ca, K, Mg.
Dans le premier cas la pellicule aura le rôle protecteur
et sera susceptible d'arrêter la corrosion, alors que dans le second cas
elle évoluera de façon plus ou moins continue. En pratique, les
pellicules protectrices peuvent être épaisses visibles ou minces
invisibles.
Remarque
Pour les alliages précieux, comme les alliages
contenant d'or, de platine, ou d'argent par exemple, afin d'améliorer
leurs propriétés mécaniques, le
«Cu» contenu dans l'alliage peut, suite à un
chauffage s'oxyder en surface, diffuser à travers la couche d'oxyde, ce
qui nous donne une coloration disgracieuse (qui manque totalement de charme).
Afin d'éviter un tel déboire, il est préférable de
chauffer l'alliage d'or soi à l'abri de l'air (en présence d'un
gaz neutre, en milieu réducteur ou encore en faisant le vide) soit dans
un bain de sel, soit enfin on les protégeant par un flux (acide
borique).
Si le métal à été oxydé en
surface on pourra éliminer la pellicule d'oxydation formée en le
dissolvant par un acide (H2SO4 à 10%) c'est le
décapage.
Corrosion électrochimique (endobuccale)
L'interaction métal-salive engendre des micro-courants
entraînant l'altération partiel du matériau
métallique, ainsi que des manifestations pathologiques buccales, cette
interaction peut se produire entre :
ü Deux couronnes métalliques
séparées par la salive qui sert d'électrolyte, les
couronnes conçues en alliages différents. C'est la macro pile.
ü Au sein d'une même couronne, ou d'une même
reconstitution lorsqu'il y a un défaut cristallin en surface. C'est la
micro pile.
Macro pile
Deux couronnes métalliques séparées par
la salive qui sert d'électrolyte, les couronnes conçues en
alliages différents.
Exemple :
ü Une couronne en alliage d'or et l'autre en alliage de
nickel-chrome
ü Entre une couronne et une reconstruction métallique
Dans ce cas nous pouvons dire qu'il y a passage d'un courant
galvanique; à ce moment, les ions se déplacent vers le
métal le plus noble et les électrons vont vers le métal le
moins noble, on réalise se que l'on appelle une «macro
pile».
Micro pile
Au sein d'une même couronne, ou d'une même
reconstitution lorsqu'il y a un défaut cristallin en surface.
Exemple : Piqûre de surface au niveau d'une
couronne en or.
Les ions cuivre vont se déplacer vers la surface de
l'alliage d'Or et entraîne une coloration de la couronne (ternissement
local rouge et puis elle s'étend) on a alors une «micro
pile».
Conditions
Pour que ces phénomènes micro et macro pile
puissent se produire il faut:
Réaction d'oxydation
Que le potentiel de la réaction d'oxydation soit plus
négatif que le potentiel de la réaction de réduction
conjuguée car tout métal solide peut être considérer
comme un ensemble d'atomes ions et d'électrons, lorsque le métal
entre en contact avec l'électrolyte, les atomes-ions pourront passer en
solution sous forme d'ions hydratés à condition que
l'énergie libérée soit plus grande que l'énergie
nécessaire pour rompre la liaison atomes-ions électrons.
Cependant deux phénomènes peuvent se produire:
ü si les forces d'hydratation sont insuffisantes pour rompre
la liaison atome-ion-électron, dans ce cas une quantité de
cathions de la solution pourra être absorbée par la surface
métallique et constituer la couche la plus interne positive. La couche
externe étant constituée par les anions excédentaires de
la solution. Exemple:cas de l'or et du platine.
ü s'il y a absorption d'un gaz dissous dans
l'électrolyte (O2 par exemple), dans ce cas il n'y aura pas
de départ d'ions du métal ni absorption de cathions de la
solution.
Surface de séparation
Il faut que la surface de séparation
métal-électrolyte présente une
hétérogénéité électrochimique ou ont
lieu respectivement les réactions de dissolution du métal et les
réactions d'assimilation des électrons excédentaires
par les cations de la solution.
Facteurs de variation des potentiels d'électrode selon
Portevin et Chamdron
Les facteurs internes :
Selon la nature du métal :
Le platine (=Pt) et le lithium (=Li) présente une DDP de 4
volt
Selon la structure :
La corrosion se réalise le long des grains
cristallographiques, elle sera intense lorsque le grain est gros.
1. Selon l'état de surface :
En fonction du degré de polissage et de la propreté
de la surface
2. Selon les couches protectrices :
Les couches protectrices diminuent la valeur du potentiel de
quelque dixièmes du volte à 1 volt
3. Déformations et tensions mécaniques :
Les déformations et les tensions mécaniques
diminuent le potentiel des électrodes. (Toute variation de courbure,
angle vif, sillon peuvent engendrés les couples galvanique).
4. La fatigue :
Les tensions alternées peuvent provoquées le
phénomène de fatigue, il sera accentué lorsque le milieu
est corrosif.
Les facteurs externes
Facteurs chimiques :
ü «PH» des solutions d'électrolytes, la
corrosion est élevée en milieu acide, faible en milieu neutre,
elle est stable en milieu basique
ü Oxydants, ce sont la température, la concentration
de la solution et la durée d'exposition.
Effet de la corrosion
Effet chimique
Le ternissement de la surface est le 1er signe de l'oxydation
Effet physio mécanique
La corrosion peut être lente et uniforme ou
généralisée, elle peut-être localisée sous
forme de plaque ou de piqûre, la corrosion inter cristalline se situe en
profondeur et suit le trajet des joins de grain.
La corrosion peut enfin être sélective et ne
concerne qu'un seul constituant de l'alliage.
Applications des biomatériaux
Evaluation préclinique de la biocompatibilité
Evaluer la biocompatibilité c'est assurer la
tolérance et la biofonctionnalité du produit. Il faudra donc
évaluer respectivement le retentissement local et général
de la mise en place du matériau dans l'organisme, mais aussi le
retentissement de l'organisme sur le matériau. La
biocompatibilité n'ayant pas de définition absolue, il faut, pour
qu'un nouveau matériau soit correctement évalué, le
comparer à des témoins dont la compatibilité ou
l'intolérance sont connues, il s'agit de matériaux dits de
référence (ou contrôles) : en orthopédie ces
matériaux de référence peuvent être le
polyéthylène, les métaux purs, la céramique
d'alumine. Les caractéristiques précises propres à
l'implant utilisé comme référence
(géométrie, état de surface...) doivent être
également connus.
Evaluation physicochimiques du matériau
Avant d'implanter un produit, il est nécessaire de le
caractériser. C'est la première étape qui conditionne les
suivantes. Les caractéristiques du matériau sous forme massive
sont :
La composition chimique y compris les adjuvants
nécessaires à la fabrication, et les impuretés ;
es propriétés physiques incluant souvent dans ce chapitre
les caractéristiques mécaniques. Lorsqu'il s'agit, par exemple,
d'un matériau utilisable en frottement, des tests sur simulateurs de
frottement (pion-disque ou disque-disque) ou sur simulateur articulaire sont
nécessaires. De cette façon, on peut mesurer les débris
libérés, le coefficient de frottement et les
éléments de dégradation du produit après plusieurs
millions de cycles.
Les propriétés de surface incluent en un terme
général des éléments comme la chimie de la surface,
les propriétés électriques de la surface et la structure
de la surface. Pour connaître les caractéristiques chimiques de la
surface des techniques comme la spectroscopie infrarouge ou la mesure de
l'angle de contact sont réalisées. La structure de la surface
peut être connue par une étude au microscope électronique
à balayage, la rugosité peut être calculée, enfin
des mesures du potentiel de surface et du potentiel zêta évaluent
une partie des propriétés électriques.
Evaluation du retentissement local
Il s'agit sans aucun doute d'une partie essentielle de
l'évaluation.
In vitro :La complexité
de la mise en oeuvre, le coût, et la complexité même du
modèle animal qui réalise un milieu biologique complexe font
préférer les méthodes in vitro aux méthodes in vivo
pour une première approche ou « screening » des
matériaux. Il est par ce biais possible d'évaluer rapidement et
à moindre coût un nombre important de matériaux et de
choisir de la sorte le moins toxique.
Ainsi les cultures cellulaires de mammifères sont
connues et utilisées dans le domaine depuis plus de 20 ans.
Initialement, la viabilité cellulaire était seule
étudiée, plus récemment des études fonctionnelles
qui analysent l'inhibition de la croissance cellulaire, plus récemment
encore des cultures cellulaires organotypiques permettent de rendre le
modèle un peu moins schématique.
Les méthodes morphologiques peuvent se séparer
en deux principales : celles reposant sur la diffusion ou la migration
d'éléments du matériau dans la culture cellulaire (essai
de contact direct, essai de diffusion dans l'agar) et les méthodes
cultivant les cellules dans un milieu où un extrait du matériau a
été placé. Des colorations vitales sont ensuite
appliquées et la cytotoxicité est ainsi mesurée.
In vivo : L'implantation
animale reste encore une étape obligée de l'appréciation
d'un matériau. De façon générale, il faut insister
sur le fait que les méthodes qualitatives ne sont plus de mise. Les
méthodes semi-quantitatives deviennent obsolètes même si
elles demeurent encore un élément de normalisation. Seules les
méthodes quantitatives doivent être utilisées.
En tissu mou :
L'évaluation quantitative de la réponse tissulaire en tissu
mou peut se faire par des méthodes morphologiques histologiques, et/ou
par des méthodes fonctionnelles. L'implantation animale se fait
préférentiellement dans le muscle (muscles paravertébraux,
quadriceps), le tissu cellulaire sous-cutané est moins souvent
utilisé comme site récepteur.
La quantification histologique repose classiquement sur la
mesure de l'épaisseur de la membrane d'encapsulation. Dans une
étude publiée par notre équipe une évaluation plus
fine a été proposée. Elle repose sur la quantification de
chaque type cellulaire et de leur localisation par rapport à la surface
de l'implant. Il a été observé grâce à ces
méthodes que les cellules n'étaient pas distribuées au
hasard dans la membrane mais qu'elles répondaient à une
distribution statistique d'un type particulier : la loi de Weibull.
Schématiquement, le nombre de cellules quel qu'en soit le type
croît rapidement à partir de l'interface pour diminuer de
façon progressive ensuite ; la courbe est donc en forme de cloche
asymétrique. Les paramètres de distribution de la loi de Weibull
permettent de décrire une partie de la réponse tissulaire.
L'évaluation fonctionnelle repose sur la modification
de la quantification des enzymes produites lors de la réponse
tissulaire. Des colorations spécifiques des enzymes sont
utilisées et la quantification est réalisée par analyse
d'image. La signification des différentes enzymes étudiées
est indiquée dans le.
D'autres techniques sont en développement comme le
marquage par des anticorps spécifiques qui permettent de marquer soit
des types cellulaires particuliers (macrophages, lymphocytes...) soit des
protéines particulières. La quantification se fait ensuite par
des techniques d'analyse d'image.
En tissu osseux : La fonction
de support du tissu osseux impose aux matériaux qui sont susceptibles de
s'y substituer temporairement ou définitivement des contraintes en
partie différentes de celles qui ont été
évoquées précédemment. Le problème
particulier de la repousse osseuse dans un matériau est
spécifique. Les évaluations dans ce cadre comprennent donc des
études mécaniques et des études histologiques.
Les paramètres mécaniques sont par exemple : la
tenue en cisaillement d'un implant dans de l'os (cortical ou spongieux), il
s'agit des « push-out » ou « pull-out tests », les
modifications des caractéristiques de l'os peuvent être
évaluées par les méthodes mécaniques classiques (cf
Biomécanique du traitement des fractures) ou par des méthodes
plus fines prenant en compte le caractère anisotropique de l'os
(microscopie acoustique). Enfin des modèles mathématiques tels
que les méthodes par éléments finis constituent des outils
souvent utiles, si le modèle est bien conçu.
Les études morphologiques intègrent les
appréciations de la repousse à l'aide de microradiographies et/ou
à l'aide de techniques histologiques (en ne décalcifiant pas
l'os). On évalue ainsi le taux de repousse osseuse au contact d'un
matériau ou dans les anfractuosités d'un matériau poreux.
Les méthodes d'analyse d'image permettent de quantifier ces
phénomènes.
Evaluation du retentissement de l'organisme sur le
matériau
Un matériau mis dans un environnement biologique se
dégrade, il s'agit de corrosion pour les matériaux
métalliques ou polymériques. Les matériaux
céramiques et polymériques sont susceptibles de relarguer des
produits détachables (comme les additifs nécessaires à la
fabrication des polymères, ou les impuretés contenues dans les
céramiques). Il faut donc étendre l'étude
précédemment évoquée aux produits de
dégradation qui par eux-mêmes sont susceptibles de
déclencher des effets indésirables.
Les principes de base de l'ostéosynthèse par
plaque et vis
Moyens d'ostéosynthèse vis et plaques
Nous allons maintenant détailler les différents
types de vis et de plaques disponibles ainsi que leur mode de
fonctionnement.
Ostéosynthèse par vis seule
Définition d'une vis en tant que moyen de
synthèse
Une vis est en général utilisée comme
moyen de traction assurant ainsi une compression entre deux fragments
osseux.
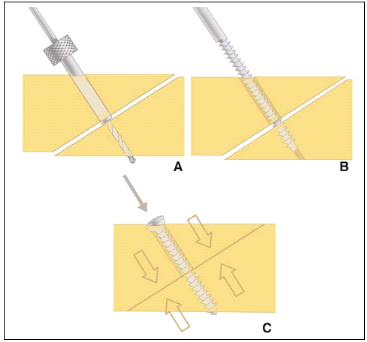
Figure 1. Le trajet de la vis est préparé à
l'aide d'une mèche (A). Un méchage d'un diamètre
légèrement supérieur à celui de la vis dans la
partie proche de la tête de la vis permet d'obtenir une compression
maximale (B, C).
La mise en place d'une vis dans un os nécessite au
préalable d'avoir préparé son trajet par un forage
réalisé au moteur. La mèche utilisée pour le forage
est d'un diamètre légèrement inférieur au
diamètre de la vis. Par exemple, l'utilisation d'une vis corticale d'un
diamètre de 3,5 mm nécessite un forage à l'aide d'une
mèche de 2,7 mm. Cette différence de diamètre permet ainsi
au filetage de la vis de pouvoir s'ancrer dans l'os.
Pour obtenir un effet de compression maximal, le diamètre
de forage doit être légèrement supérieur au
diamètre de la vis du côté de la tête de la vis (Fig.
1A) ; l'ancrage de la vis ne se faisant que dans la partie distale de la vis,
l'effet de traction en est renforcé. Le taraudage permet de créer
un pas de vis dans l'os (Fig. 1B, C). Sa nécessité reste
toutefois controversée [6-8].Il doit être réalisé de
préférence au moteur, sans notion de vitesse
préférentielle [7]. On doit toutefois prendre garde à
utiliser des mèches aiguisées, une mèche
émoussée produisant un échauffement de l'os et un risque
de nécrose osseuse. Certaines vis créent leur propre pas de vis
dans l'os : ce sont des vis autotaraudeuses.
Différents types de vis
Le nom d'une vis est défini par le type de vis et par le
diamètre extérieur du filetage principal. Le nom peut aussi
être défini par la manière dont une vis est
utilisée. Par exemple : une vis de traction peut être une vis
corticale ou une vis spongieuse.Toutes les vis sont disponibles dans
différentes tailles et longueurs.
Vis cor ticale (Fig. 2)
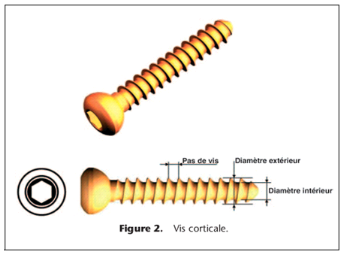
Le pas de vis des vis corticales est conçu pour obtenir
une bonne prise dans l'os cortical. La vis corticale est normalement
utilisée pour comprimer et fixer une plaque à l'os. Elle est en
général filetée sur toute sa longueur, mais peut
également être filetée sur une partie de sa longueur.
Vis spongieuse (Fig. 3)
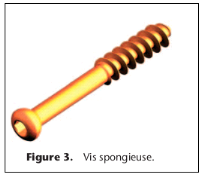
Les vis spongieuses ont un rapport diamètre
extérieur/âme de la vis (diamètre intérieur)
supérieur à celui des vis corticales afin d'avoir une meilleure
tenue dans l'os spongieux. Ce type de vis est surtout utilisé comme vis
de traction pour obtenir unecompression interfragmentaire dans les zones
épiphysométaphysaires. Pour cette raison une vis spongieuse est
normalement une vis dont le filetage est limité à une partie de
la vis. Mais le filetage peut se situer aussi sur toute la longueur de la
vis.
Vis canulées ou per forées
Les vis canulées ont la particularité d'être
creuses afin de permettre le passage en leur centre d'une broche qui sert de
guide. Cette broche permet également une plus grande précision
dans le positionnement de la vis. De plus, la broche est utilisée pour
mesurer la longueur de la vis avec une jauge. Les vis canulées ont pour
la plupart un filetage type spongieux parce qu'elles sont indiquées pour
les zones épiphysométaphysaires.
Vis qui per mettent un placement sous-articulaire
Pour le traitement des fractures ou la réalisation
d'ostéotomies dans les régions périarticulaires,
spécialement dans la main ou le pied, existent différents types
de vis qui permettent un placement sous-articulaire. Ces vis sont aujourd'hui
pour la plupart perforées.

Vis à double pas (type Herber t, Fig. 4). Ces vis
comportentun filetage dont le pas ainsi que le diamètre sont
différents à chaque extrémité. La partie centrale
de la vis est dépour vue de filetage. Le pas de vis conducteur est
supérieur au pas du deuxième filetage. L'insertion de la vis
permet d'obtenir une traction limitée et une compression maximale qui
est définie par la différence du pas entre les deux filetages.
Ces vis ont comme avantage l'enfouissement total de leur
tête elle-même et sont utilisées pour
l'ostéosynthèse en compression des os de petite taille
(scaphoïde, tête radiale, métacarpiens) ou la
réalisation d'ostéotomies (type Scarf). Il a toutefois
été montré que la compression exercée par ces vis
n'excédait pas 0,7 mm en tenant compte d'une force de compression
maximale de 8 Newton.
quelques vis utilisée dans
l'ostéosynthèse


Principe de l'ostéosynthèse par plaque
Définition d'une plaque
Une plaque est un système extramédullaire qui
permet, combiné avec des vis, de stabiliser une fracture jusqu'à
la consolidation de celle-ci. On distingue aujourd'hui principalement deux
types de plaques.
Plaques classiques
Elles sont seulement utilisées avec des vis standards (non
verrouillables). La stabilité obtenue dépend surtout du type de
montage choisi et de la friction obtenue entre plaque et os. Un modelage
précis de l'implant en cours d'inter vention est important.
Dans les plaques on distingue en outre les plaques droites
utilisées surtout dans les diaphyses et les plaques
préformées ou spéciales. Ces plaques sont adaptées
souvent aux zones épiphysométaphysaires. En particulier, les
plaques préformées offrent une stabilité angulaire, et ne
nécessitent plus un modelage précis peropératoire.
Ostéosynthèse classique
Système de fixation
Plaque à trou rond. La plaque à trou rond simple
était la première plaque disponible. Pour obtenir de la
compression interfragmentaire dans les fractures simples, cette plaque
était utilisée avec un tendeur de plaque, comme décrit sur
la Figure 11. Pour cette raison, ainsi que pour des raisons d'ordre technique
et les problèmes rencontrés lors de la mise en application, ce
système n'est plus utilisé en pratique courante.
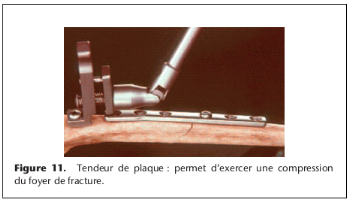
Plaque à trou excentré. Dans les années
1960, à partir des travaux d'Allgöwer [3], le concept de la plaque
à trou excentré dit DCP (dynamic compression plate) a
été introduit. L'avantage de ce type de plaque est qu'on peut
obtenir une compression interfragmentaire avec un simple placement excentrique
de la vis (Fig. 12). De plus, il est possible d'augmenter le débattement
de la vis par rapport à une plaque à trou rond. Ceci est
particulièrement intéressant dans les fractures obliques pour
pouvoir placer une vis orthogonalement par rapport au trait de fracture afin
d'obtenir une plus grande stabilité.
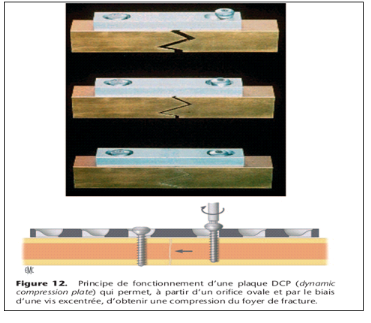
Ostéosynthèse moderne
Plaque à vis bloquée
Comme déjà mentionné, la tenue d'une vis
dépend largement de la qualité de l'os. Dans les années
1980 au sein de l'AO des développements ont débuté avec
l'idée de respecter mieux la biologie et d'améliorer la
stabilité [9-11]. L'idée de départ était de faire
une jonction verrouillable entre la plaque et la vis. Mais déjà
en 1886, Hansmann de Hambourg avait publié deux cas
d'ostéosynthèse avec une plaque offrant une stabilité
angulaire limitée [12]. Un autre pionnier est Reinhold de Paris qui a
breveté une plaque avec des vis verrouillées en 1931. Cette
plaque a d'ailleurs été produite industriellement et
commercialisée. D'autres produits plus récents ont
été utilisés dans la reconstruction maxillofaciale et
également pour le traitement des fractures (plaque Zespol [13, 14],
PC-Fix [15]. Pour les fractures diaphysaires simples il n'a pas
été possible de démontrer un avantage comparé
à des plaques conventionnelles). Dans les années 1990, le
développement de plaques verrouillables adaptées pour
l'utilisation dans les zones épiphysométaphysaires a permis de
démontrer la supériorité de ce type d'implant, surtout
dans l'os
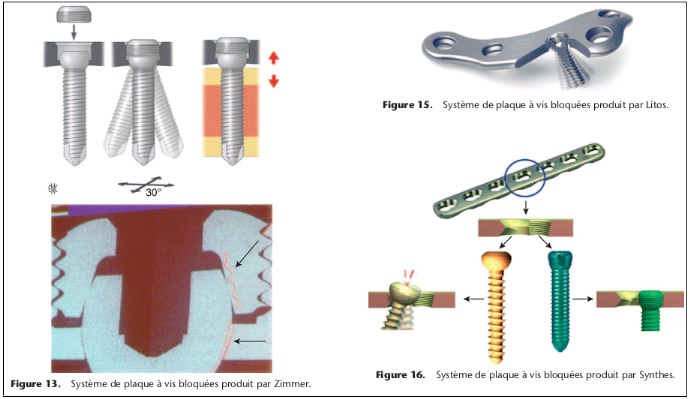
porotique et dans les fractures comminutives [16, 17] .
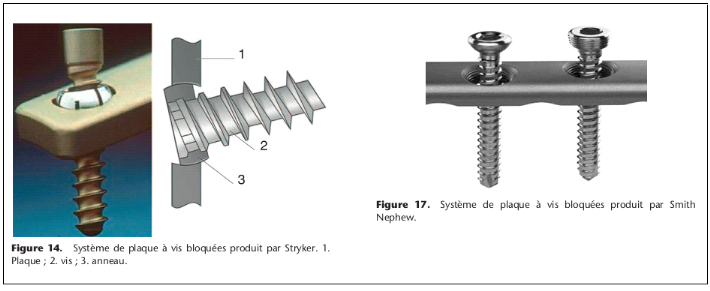
Domaines d'applications des différents types de
biomatériaux
Les domaines d'application des différents types de
biomatériaux sont très variés comme indiqués
ci-dessous.
Biomatériaux métalliques : Stomatologie
(Implants dentaires) ; chirurgie orthopédie (Implants, prothèses
de hanche...) Cardiologie vasculaire (Simulateur cardiaque, pompe
implantable).
Biomatériaux en céramiques : Stomatologie
(Implants dentaires) ; chirurgie orthopédie (Têtes de
prothèse de hanche, comblement et implants).
Biomatériaux à base de polymères :
ophtalmologie ; odontologie -stomatologie ; chirurgie orthopédie ;
cardiologie vasculaire ; urologie néphrologie ; dermatologie - chirurgie
esthétique.
Problèmes rencontrés selon les classes
des principaux biomatériaux
D'un point de vue de leur dégradation dans le corps
humain, et compte tenu de la multitude des biomatériaux et de leurs
applications, la plupart des problèmes rencontrés (et souvent
encore mal compris et résolus, car ils peuvent entrer en synergie ou en
compétition) sont multiples et variés. Le tableau suivant
répertorie les principaux dommages avérés par retour
clinique.
|
Classe de matériaux
|
Principaux problèmes rencontrés mal
résolus
|
|
Métaux et alliages métalliques
|
- Corrosion électrochimique et durabilité
- Mécanisme de dégradation non
électrochimique incluant les interactions protéine/métal
(biodégradation)
- Réactions immunitaires et
d'hypersensibilité
- Adaptation des propriétés
mécaniques
- Propriétés de frottement et problèmes
de débris
|
|
Céramiques
|
- Mécanismes de dégradation et
durabilité
- Résistance à la fissuration
- Activité de la surface
- Adhésion des protéines ou des cellules en
surface
|
|
Polymères et matière molle
|
- Instabilité au rayonnement gamma
(stérilisation)
- Vieillissement physique et chimique
- Manque de base de données, de standard
- Stabilité hydrolytique
- Effets des enzymes sur la dégradation
|
Conclusion
Pendant de nombreuses années le développement des
biomatériaux a été focalisé sur la synthèse
ou l'utilisation de produits inertes avec l'objectif principal d'une
biotolérance au niveau des sites d'implantation. L'orientation actuelle
est de profiter des progrès considérables du génie
tissulaire pour concevoir et optimiser des systèmes hybrides, associant
des matériaux inertes et des matrices cellulaires vivantes, avec la
perspective d'une amélioration fonctionnelle
déterminante.
Le suivi de la qualité des relations
des nouveaux biomatériaux utilisés en clinique humaine avec leur
environnement anatomique devrait être organisé de manière
à prévoir l'apparition d'effets indésirables,
événements qui doivent être déclarés et
documentés dans le cadre de la
matériovigilance.
Depuis 1994, la loi rend, en effet,
obligatoire la déclaration d'un incident en rapport avec un dispositif
médical tel qu'un biomatériau. En cas d'incident grave, la
Commission Nationale de Matériovigilance, qui dépend du
Ministère de la Santé, instruit une enquête afin
d'élucider les causes de l'incident et de prendre ensuite des mesures
correctives comprenant une modification du dispositif et une meilleure
information des utilisateurs.
Bibliographiques
|
|
[1]
|
ANDERSON JM, MILLER KM Biomaterial
compatibility and the macrophage. Biomaterials 1984 ;
5 : 5-10
|
|
[2]
|
BACO-GRANELL J, AGUIRRE-CANYADELL M, NARDI
J , et al. Malignant fibrous histiocytoma of bone at site
of total hip arthroplasty : a case report. J Bone Joint Surg 1984
; 66A : 30-40
|
|
[3]
|
BARDOS DI. Titanium and titanium alloys. In : Concise
encyclopedia of medical and dental materials. Pergamon press. Oxford. 1990 ; pp
360-365
|
|
[5]
|
BAUER TW, GEESINK RC, ZIMMERMAN R,
McMAHON JT Hydroxyapatite-coated femoral stem. J Bone
Joint Surg 1991 ; 73A : 1439-1452
|
|
[6]
|
BLACK J. Orthopaedic biomaterials in research and practice.
Churchill Livingstone. New York. 1988 ; 394 p
|
|
[7]
|
BLACK J Does corrosion matter ? J Bone
Joint Surg 1988 ; 70-B : 517-520
|
|
[8]
|
BOUTIN P, BLANQUAERT D Le frottement
alumine-alumine en chirurgie de la hanche. 1 205 arthroplasties totales.
Rev Chir Orthop 1981 ; 67 : 279-287
|
|
[9]
|
BOUTIN P, CHRISTEL P, DORLOT JM ,
et al. The use of dense alumina-alumina ceramic combination in total hip
replacement. J Biomed Mater Res 1988 ; 22 :
1203-1232
|
|
[10]
|
BURKE DW, GATES EI, HARRIS WH
Centrifugation as a method of improving tensile and fatigue properties of
acrylic bone cement. J Bone Joint Surg 1984 ; 66A
: 1265-1273
|
|
[11]
|
CARR AJ, MORRIS RW, MURRAY DW, PYNSENT
PB Survival analysis in joint replacement surgery. J Bone
Joint Surg 1993 ; 75B : 178-182
|
|
[12]
|
CHARNLEY J. Low friction arthroplasty. Springer-Verlag. New
York. Berlin. 1979
|
|
[13]
|
CHRISTEL P, CHABOT F, LERAY JL. Biodegradable composites for
internal faxation. In : Winter GD, Gibbons DF, Plenck H eds. Biomaterials. John
Wiley. New York. 1982 ; pp 271-280
|
|
[14]
|
CHRISTEL P, MEUNIER A A histomorphometric
comparison of the muscular tissue reactions to high-density polyethylene in
rats and rabbits. J Biomed Mater Res 1989 ; 23
: 1169-1182
|
|
[15]
|
CHRISTEL P, MEUNIER A, HELLER M, TORRE
JP, PEILLE CN Mechanical properties and short term in vivo
evaluation of yttrium-oxyde-partially-stabilized zirconia. J Biomed
Mater Res 1989 ; 23 : 45-61
|
|
[16]
|
CHRISTEL PS Biocompatibility of surgical-grade
dense polycristalline alumina. Clin Orthop 1992 ;
282 : 10-18
|
|
[17]
|
CLARKE IC, JUNG H, CHONG S, SERBOUSEK J. Mechanical evaluation
of 28 mm ceramic THR balls Bioceramico. Vol 1
|
|
[18]
|
COHEN J. Metal implants : historical background and biological
response to implantation. In : Rubin LR ed. Biomaterials in reconstructive
surgery. CV Mosby. St Louis. 1983 ; pp 49-61
|
|
[19]
|
COOK SD, RENZ BA, BARRACK RL , et
al. Clinical and metallurgical analysis ot retrieved internal fixation
devices. Clin Orthop 1985 ; 194 :
236-247
|
|
[20]
|
COOK SD, THOMAS KA, HARDING AF, COLLINS
CL, HADDAD RJ The in vivo performance of 250 internal
fixation devices : a follow-up study. Biomaterials 1987 ;
8 : 177-184
|
|
[21]
|
COOK SD, THOMAS KA, KAY JF, JARCHO
M Hydroxyapatite coated titanium for orthopedic implant apllications.
Clin Orthop 1988 ; 232 : 225-243
|
|
[22]
|
DAMIEN CJ, PARSONS RUSSEL Bone grafts and
bone grafts substitutes : a review of current technology and applications.
J Appl Biomat 1991 ; 2 : 187-208
|
|
[23]
|
DE LANGE GL, DE PUTTER C, DE WIJS FL
Histological and ultastructural appearance of the hydroxyapatitebone
interface. J Biomed Mater Res 1990 ; 24 :
829-845
|
|
[24]
|
DIGBY JM, WELLS AL Malignant lymphoma
with intranodal refractile particles after insertion of silicone prostheses.
Lancet 1981 ; 2 : 580
|
|
[25]
|
DORLOT JM, CHRISTEL P, MEUNIER A
Wear analysis of retrieved alumina heads and sockets of hip prostheses.
J Biomed Mater Res 1989 ; 23 : 299-310
|
|
[26]
|
DUCHEYNE P, BEIGHT J, CUCKLER JM, EVANS
B, RADIN S Effect of calcium phosphate coating
characteristics on early post-operative bone tissue ingrowth.
Biomaterials 1990 ; 11 : 531-540
|
|
[27]
|
DUCHEYNE P, CUCKLER JM Bioactive ceramic
prosthetic coatings. Clin Orthop 1992 ; 276
: 102-115
|
|
[28]
|
DUCHEYNE P, HENCH LL The processing and
static mechanical properties of metal fiber reinforced bioglass. J Mater
Sci 1982 ; 17 : 595
|
|
[29]
|
DUCHEYNE P, RADIN S, HEUGHEBAERT M,
HEUGHEBAERT JC Calcium phosphate ceramic coatings on porous
titanium : effect of structure and composition on electrophoretic deposition,
vacuum sintering and in vitro dissolution. Biomaterials 1990
; 11 : 244-254
|
|
[30]
|
ELLIES LG, NELSON DG, FEATHERSTONE JD
Crystallographic changes in calcium phosphates during plasma-spraying.
Biomaterials 1992 ; 13 : 313-316
|
|
[31]
|
EYERER P, ELLWANGER R, FEDEROLF HA, KURT M, MADLER H.
Polyethylene. In : Concise encyclopedia of medical and dental materials.
Pergamon press. Oxford. 1990 ; pp 271-280
|
|
[32]
|
FOWLER PJ, JOHNSON PQ. Knee ligament prostheses and
allografts. In : Insall JN ed. Knee surgery. Churchill-Livingstone. New York.
1993 ; pp 561-572
|
|
[33]
|
FRENCH HG, COOK SD, HADDAD RJ
Correlation of tissue reaction to corrosion in osteosynthetic devioes. J
Biomed Mater Res 1984 ; 18 : 817-828
|
|
[34]
|
GAUSSENS G. Les polyéthylènes et leurs
applications en orthopédie. In : Sedel L ed. Biomatériaux en
chirurgie orthopédique. Expansion scientifique française. Paris.
1986 ; pp 33-50
|
[35]. Ministère de la Recherche,
«Biomatériaux et suppléance fonctionnelle».Les
technologies pour la santé. (2005)
[36]. Cambier, «Les céramiques,
biomatériaux de choix pour la réalisation d'implants».
Euroceram News, [5] (2001)
[37]. Hench et al, «Bioactive Materials». Ceramic
International, [22] 493-507. (1996)
[38]. Hench, «Bioceramics». Journal of the American
Ceramic Society, 81 [7] 1705-28. (1998)
[39]: Y.L. Wang, K.Y. Zhang, Surf. Coat. Technol. 140 (2001)
155.
[40]: H.Y. Ha, S.W. Nam, T.H. Lim, I.H. Oh, S.A. Hong, J.
Membr. Sci. 111
(1996) 81.
[41]: L. Hu, T. Yoko, H. Kozuka, S. Sakka, Thin Solid Films
219(1992) 18.
[42] : Michel Munsch, Elaboration Et Etude De
Nanocomposites Adaptables STRASBOURG, JUIN (2001).
[43] Müller ME. Internal fixation for fresh fractures and
for non union. Proc R Soc Med 1963;56 :455-60.
[44] Muller ME, Allgöwer M, Willenegger H. Technique of
internal fixation of fractures. Heidelberg: Springer-Verlag; 1965.

| 

