|
Matériaux
naturels
On distingue selon l'origine et le receveur :
ü les xénogreffes : greffes entre espèces
différentes (par exemple : os bovin sur homme) ;
ü les allogreffes : greffes entre individus
différents mais appartenant à une même espèce (par
exemple : tête fémorale de banque implantée pour une
reconstruction) ;
ü les autogreffes où le receveur est son propre
donneur.
L'autogreffe reste le meilleur matériau de
comblement de pertes de substances osseuses, mais elle nécessite une
chirurgie additionnelle avec les risques locaux et généraux que
cela comporte, d'autre part, sa quantité est limitée.
L'emploi des allogreffes est maintenant régi par une
réglementation sévère. L'origine, le mode de
prélèvement, la stérilisation et le mode de conservation
sont des paramètres indispensables à connaître. Le
prélèvement se fait stérilement sur des patients indemnes
de pathologies infectieuses (VIH, hépatite, CMV), les greffons sont
ensuite irradiés et conservés congelés. On peut obtenir
des greffons massifs de taille et de volume adéquat aux
propriétés mécaniques, bien qu'inférieures à
l'os frais, suffisantes. Ces greffes, quand elles sont massives ne sont
revascularisées qu'en surface, elles subissent une résorption
lente et leur réhabitation osseuse est incertaine. Elles doivent
nécessairement être ostéosynthésées de
façon stable ; l'association avec une autogreffe peut favoriser une
fusion avec l'os receveur.
Corail
C'est une céramique naturelle poreuse issue du
squelette corallien Porites. Il est constitué essentiellement de
carbonate de calcium sous forme de cristaux d'aragonite (carbonate de calcium
> 97 %, oligoéléments 0,5 à 1 %, acides aminés
0,07 %, eau < 0,5 %). L'architecture corallienne permet une
pénétration osseuse car elle est poreuse ; la porosité
ouverte et la taille des pores (150 ìm en moyenne) favorisent la
pénétration cellulaire et l'établissement d'une
néovascularisation).
Son implantation en tissu mou chez l'animal est bien
tolérée, elle provoque une colonisation par un tissu
conjonctivovasculaire puis une résorption très progressive entre
2 et 12 mois. Dans l'os, et sous certaines conditions ce tissu
conjonctivovasculaire se différencie en tissu osseux et on assiste
simultanément à une résorption très progressive du
corail (par l'anhydrase carbonique contenue dans les ostéoclastes). Les
contraintes locales régissent le remodelage osseux. En cas de
fragmentation, on assiste à des réactions puriformes
aseptiques.
Les propriétés mécaniques sont
fonction de la porosité. A porosité égale, le corail a une
contrainte à la rupture équivalente à celle de l'os
cortical, mais son module d'Young est plus élevé : il a un
comportement fragile. Son comportement mécanique est acceptable à
condition de protéger l'implantation par une ostéosynthèse
stable pendant une durée minimale de 1 an. En pratique, il est
utilisé comme comblement osseux dans les arthrodèses
vertébrales (antérieures et postérieures), dans les
ostéotomies d'addition, et en traumatologie dans les comblements osseux
après fracture du calcanéum ou des plateaux tibiaux.
Collagène
Le collagène est une protéine naturelle
présente dans les tissus de soutien (peau, os, vaisseaux...). Il est
constitué de la répétition d'unités de base, le
tropocollagène, polypeptide constitué de trois chaînes
formant un triple hélice, et du télopeptide, court fragment non
hélicoïdal. De nombreux types de collagènes ont
été décrits chez les mammifères dépendant du
taux d'hydroxylation, du taux de glycosilation, du nombre de liaisons
interchaînes et de la composition du télopeptide.
Le type I : présent dans les os et tendons, il
comprend deux chaînes á et deux chaînes â ; il n'y a
que 5 % de télopeptide.
Le type II : présent dans le cartilage hyalin,
il comprend trois chaînes á identiques, associées aux
glycoaminoglycanes ; il confère au cartilage hyalin ses
propriétés spécifiques.
Sans parler des auto-, des allo- ou des
xénogreffes tendineuses qui sont en fait un apport collagénique
spécialisé, en chirurgie orthopédique, le collagène
pur natif n'est utilisé qu'au stade de recherche. Il a été
utilisé dans le comblement de lacunes osseuses, dans la
réparation de surfaces articulaires, comme renfort ligamentaire et comme
agent hémostatique.
Les techniques de greffes osseuses
Sont maintenant couramment mises en oeuvre par les praticiens
tant en chirurgie orale qu'orthopédique. L'objectif
général est de promouvoir une régénération
osseuse. Sans remettre en cause l'efficacité incontestable des
autogreffes, cette technique présente des inconvénients majeurs
comme les douleurs résiduelles, la morbidité, les complications
diverses. Il faut de plus considérer que les quantités
disponibles sur le site donneur sont limitées et parfois de
qualité insuffisante pour une application chirurgicale
spécifique. Les progrès de la chimie et du génie des
procédés, des biotechnologies, ont permis de proposer une
alternative à l'utilisation des greffes osseuses naturelles. De
très nombreuses céramiques en phosphate de calcium,
destinées à remplacer les allogreffes, les autogreffes, et les
xénogreffes, sont mises à disposition des chirurgiens depuis
plusieurs années. Si l'efficacité de ces céramiques est de
plus en plus démontrée par les résultats cliniques qui
sont présentés par des équipes chirurgicales dans le monde
entier, il existe pourtant des différences importantes dans la
cinétique de résorption et de reconstruction osseuse aux
dépens du substitut osseux. Si ces différences de performance et
d'efficacité peuvent être liées au site opératoire,
au patient, à la technique chirurgicale, elles sont cependant
essentiellement liées aux caractéristiques chimiques
(hydroxyapatite HA, phosphate tricalcique TCP, biphasé mélange
HA/TCP) et structurales (micropores, macropores, surface spécifique des
cristaux constitutifs de la céramique). Depuis les trois
dernières décennies, de nombreuses d'études
précliniques et cliniques décrivent l'incidence de ces
caractéristiques sur la cinétique de résorption du
substitut osseux et de la reconstruction osseuse aux dépens du
biomatériau (quantité et architecture osseuse), et pourtant le
chirurgien utilisateur n'est pas suffisamment informé ou conscient de
ces différences fondamentales entre les diverses fabrications de
biocéramiques en phosphate de calcium misent à leur disposition,
qui conditionnent la réussite opératoire. Seule la maîtrise
des procédés de fabrication, la maîtrise des
propriétés structurales et pas seulement la nature chimique,
garantie une reproductibilité des résultats biologiques, et
répondre aux besoins chirurgicaux qui sont :
L'efficacité : biocompatibilité, pas de
réaction à corps étranger, remplacer les greffes
osseuses ;
La performance : résorption et substitution
osseuse, pour être plus efficace que les allogreffes morcelées et
aussi, sinon plus efficace (grâce à l'ingénierie
tissulaire) que l'autogreffe.

Figure 2 : Différentes formes disponibles de
substitut osseux de synthèse.
L'autogreffe est le « gold standard » de
la reconstruction osseuse. Elle est la seule capable de fournir des facteurs de
croissance ostéo-inducteurs, des cellules ostéogéniques et
un « échafaudage » ostéoconducteur. La
morbidité du site donneur est sa principale limite. Le risque de
transmission de maladie du donneur restreint le recours à l'allogreffe.
Les substituts synthétiques manquent de propriétés
ostéo-inductrices ou ostéogéniques. Les substituts osseux
composites combinent les propriétés
d'« échafaudage » avec des éléments
biologiques pour stimuler la prolifération et la différenciation
cellulaire et éventuellement, l'ostéogenèse. Nous donnons
un aperçu des greffons et substituts osseux disponibles pour des
applications cliniques.
La mise au point de nouveaux tissus exige une approche qui
associe la biologie du développement, la biologie cellulaire et
moléculaire à la médecine clinique, à la biochimie,
à l'immunologie, à l'ingénierie, et aux sciences des
matériaux. Tandis que de nombreux chercheurs essaient de reproduire des
structures endogènes pour créer de nouveaux tissus, de nombreuses
barrières doivent être surmontées pour créer des
tissus complexes, vascularisés, spécifiques du patient pour une
utilisation de remplacement et de réparation. Bien que la mise au point
de tissus à composants multiples exige la mise en oeuvre de nombreuses
idées, dans un souci de clarté nous limiterons cette revue aux
développements récents de l'application des structures
biorésorbables naturelles et synthétiques. Ici, nous mettons en
valeur des biomatériaux potentiellement utiles aux chirurgiens
plasticiens qui sont actuellement utilisés ou ont été
développés pour être utilisés pour des remplacements
et des réparations de la peau et des os.
L'ingénierie tissulaire, au carrefour des sciences du
vivant et des sciences de l'ingénieur, a pour but de remplacer,
maintenir ou améliorer la fonction de tissus humains, grâce
à des substituts tissulaires incluant des éléments
vivants. Il s'agit donc d'élaborer des tissus artificiels, en utilisant
(isolément ou en association) des cellules, des matrices et des facteurs
bioactifs. Leur association est un biomatériau hybride qui réunit
des composés biologiques (cellules, facteurs de croissance, ou
protéines d'adhésion) et des matériaux (polymères,
céramiques). Les applications sont larges, intéressant aussi bien
la peau que le foie ou la cornée, mais également l'appareil
locomoteur. Dans ce cadre c'est l'ingénierie du tissu osseux qui est la
plus développée, en partie grâce à l'avancée
des substituts osseux, mais le cartilage ou les tendons sont également
concernés. Cette technologie fait appel aux cultures de cellules
(cellules différenciées, ou plus souvent cellules souches de la
moelle osseuse), à des biomatériaux (matériaux poreux
à architecture contrôlée, mais également ciments),
à des facteurs de croissance (comme les bone morphogenetic
proteins), aux protéines intervenant dans l'adhésion
cellulaire (telles que la fibronectine, ou les séquences reconnues par
les sous unités d'intégrine), ou à la thérapie
génique (notamment en utilisant des cellules-souches
transfectées). L'ingénierie tissulaire et la stimulation de la
régénération tissulaire sont en plein essor sur le plan
expérimental et industriel, et les applications cliniques sont de plus
en plus nombreuses. Elles devraient se développer très largement
compte tenu du potentiel de ces technologies.
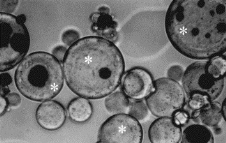
Figure 1 : Biomatériau injectable associant
le principal constituant minéral de l'os : hydroxyapatite (granules
noirs) et le principal composé organique : collagène
(astérisques).
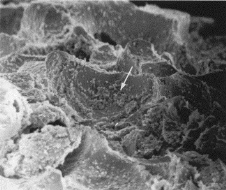
Figure X : Biomatériau hybride :
cellules stromales ostéoprogénitrices (flèche) au sein
d'une architecture poreuse en hydroxyapatite (faciès de rupture).

Figure X : Ostéo-induction : formation
de tissu osseux (têtes de flèches) au sein d'un biomatériau
hybride, après un mois d'implantation en site intramusculaire
(microscopie optique, May-Grünwald-Giemsa ; barre : 140
ìm).
Les biomatériaux sont considérés comme
des dispositifs médicaux implantables. L'utilisation des
matériaux de reconstruction et de substitution osseuse est
sécurisée en Europe par la procédure du marquage CE et par
la matériovigilance, indépendante de la certification
imposée aux États-Unis par la Food and Drug Adminstration. Les
indications sont souvent concurrentielles avec les autogreffes, avec l'avantage
de limiter la morbidité liée au prélèvement
autologue. Les bénéfices recherchés peuvent être
fonctionnels, esthétiques ou mixtes. Les principales indications
conventionnelles sont présentées : otologiques,
rhinosinusiennes, traumatologie, laryngologie, rajeunissement facial, implants
et épithèses. Les principaux axes de recherche (renforcement des
propriétés thérapeutiques, matériaux vecteurs de
principe actif, ingénierie tissulaire...) sont discutés.
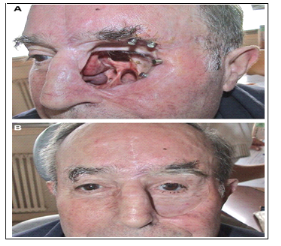
Figure X : A. Patient
opéré d'un adénocarcinome de l'ethmoïde gauche
multirécidivé, ayant nécessité une
exérèse de la base du crâne et une exentération.
Quatre implants en titane vissés ont été mis en place pour
permettre l'accrochage de l'épithèse. B. Aspect
de l'épithèse en place.
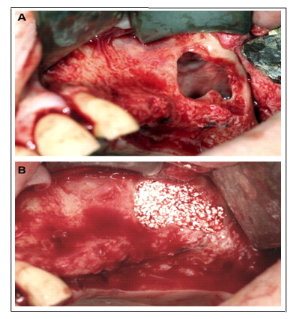
Figure X : Chirurgie de rehaussement du plancher du
sinus maxillaire (clichés du Dr Afchine Saffarzadeh, unité
d'implantologie du pôle odontologie du CHU de Nantes). L'intervention est
effectuée afin de rétablir une hauteur osseuse maxillaire
suffisante pour permettre la mise en place différée d'un implant
dentaire en regard de la cavité sinusienne. A. Aspect
peropératoire avant la mise en place du substitut osseux de MBCP.
B. Aspect en fin d'intervention, après comblement du
plancher sinusien maxillaire par le BCP mélangé avec de la colle
biologique
| 

