|
BURKINA FASO
Unité-Progrès-Justice
MINISTERE DES ENSEIGNEMENTS SECONDAIRE ET
SUPERIEUR
UNIVERSITE POLYTECHNIQUE CENTRE INTERNATIONAL
DE
DE BOBO-DIOULASSO RECHERCHE-DEVELOPPEMENT SUR
INSTITUT DU DEVELOPPEMENT RURAL L'ELEVAGE EN ZONE
SUBHUMIDE

MEMOIRE
présenté pour l?obtention du diplôme de
MASTER RECHERCHE EN ANALYSE DES POPULATIONS DES
ESPACES
FAUNIQUES ET HALIEUTIQUES
SPECIALITE :
Analyse des populations des espaces
fauniques
THEME : EVALUATION DE L'EFFET INSECTICIDE
D'UNE
APPLICATION EPICUTANEE DE FIPRONIL 1% SUR DES
GLOSSINES DE
LABORATOIRE (GLOSSINA PALPALIS
GAMBIENSIS, VANDERPLANK
1949)
Présenté par : SAWADOGO Boureima
Devant le jury composé de :
Professeur Adrien M. Gaston BELEM, Président
Professeur BOUGMA/YAMEOGO Valérie Marie Christiane, Membre
Docteur Jean-Baptiste RAYAISSE, Membre (Maître de stage)
Directeur de mémoire : Professeur
André T. KABRE
N° : -2015/MFH2 (Faune,
Halieutique)
Avril 2015
DEDICACE
Ce travail est entièrement dédié
à mon père adoptif
Timbila OUEDRAOGO
à qui je dois toute ma formation morale et
intellectuelle
REMERCIEMENTS
L'aboutissement de ce travail a nécessité des
soutiens multiformes de plusieurs personnes.
Qu'il nous soit permis de leur témoigner toute notre
reconnaissance.
Nous exprimons ainsi nos sincères remerciements aux
personnes suivantes :
- la Directrice Générale du centre international de
recherche-développement sur
l'élevage en zone subhumide (CIRDES), Docteur Valentine
YAPI-GNAORE, qui a
bien voulu nous accueillir dans son institution ;
- le Docteur Jean-Baptiste RAYAISSE du CIRDES, notre maître
de stage, qui nous a
toujours prodigué des conseils et des orientations
nécessaires pour la bonne marche de
l'étude ;
- le Professeur André KABRE de l'université
polytechnique de Bobo-Dioulasso (UPB),
notre Directeur de mémoire, pour son encadrement
académique ;
- la firme MERIAL pour le soutien financier et matériel
;
- monsieur Abdoulaye KABORE et mademoiselle Fatoumata COMPAORE
pour leur
accompagnement technique tout au long du stage ;
- tout le personnel de l'insectarium du CIRDES pour leur soutien
technique
multiforme ;
- les bouviers du CIRDES pour nous avoir assistés tout au
long du stage ;
- les stagiaires du CIRDES pour leur soutien moral et
intellectuel.
Aux autres personnes dont nous ne pourrions citer les noms ici de
peur d'oublier certains,
nous leur témoignons toute notre gratitude.
TABLE DES MATIERES
LISTE DES SIGLES ET ABREVIATIONS I
LISTE DES FIGURES II
LISTE DES TABLEAUX III
LISTE DES ANNEXES III
RESUME IV
ABSTRACT V
INTRODUCTION 1
I. ETUDE BIBLIOGRAPHIQUE 3
1.1. Généralités sur les glossines 3
1.2. Généralités sur le fipronil 12
II. METHODOLOGIE 14
2.1. Organisation du dispositif expérimental 14
2.2. Matériels utilisés 15
2.3. Démarche expérimentale 19
2.4. Paramètres expérimentaux
étudiés 22
2.5. Analyse des données 24
III. RESULTATS 26
3.1. Résultats du test de l'effet du fipronil 1% sur la
survie des glossines 26
3.2. Résultats du test de l'effet du fipronil 1% sur la
fécondité des glossines-mères et la viabilité
des
glossines-filles 35
3.2.1. La fécondité des glossines-mères
35
3.2.2. La viabilité des glossines-filles 39
IV. DISCUSSIONS 42
4.1. L'efficacité et la rémanence du fipronil 1%
sur la survie des glossines 42
4.2. L'effet du fipronil 1% sur la fécondité des
glossines 44
4.3. L'effet du fipronil 1% sur la viabilité des
glossines-filles 45
CONCLUSION ET PERSPECTIVES 46
BIBLIOGRAPHIE 47
SITES INTERNET CONSULTES 51
ANNEXES A
Annexe 1 : Tables de survie B
Annexe 2 : Synthèse des données brutes de
fécondité C
Annexe 3 : Scripts des analyses des analyses de survie sur R
3.0.3 D
Annexe 4 : Résumé du test t de Student sur les
variables de fécondité E
Annexe 5 : Fiches de collecte des données F

LISTE DES SIGLES ET ABREVIATIONS
ANOVA : Analyse de la variance
CIRDES : Centre International de
recherche-développement sur l'élevage en zone
subhumide
ddl : degré de liberté
DDT :
dichlorodiphényltrichloroéthane
Dv : durée moyenne de vie
GABA : acide gamma aminobutyrique
ID : indéterminable
INRS : Institut national de recherche et de
sécurité
Is : indice de survie cumulé
p : signification statistique
Pm : poids moyen
qi : indice de survie instantané
RR : risque relatif de mortalité
Ta : taux d'avortons
Te : taux d'éclosions
TE : témoin
Tp : taux de pontes
TP : temps post traitement
Tpmf : taux de pupes mal formées
TR : traité
÷2 : khi-deux
II
LISTE DES FIGURES
Figure 1 : Carte de répartition
géographique de Glossina palpalis et de Glossina fuscipes
4
Figure 2 : Représentation
schématique d'une glossine 5
Figure 3 : Cycle reproductif d'une glossine 7
Figure 4 : Pièges et écrans pour
la lutte contre les glossines 9
Figure 5 : Structure chimique du fipronil 12
Figure 6 : Application épicutanée
du fipronil 1% sur les animaux 14
Figure 7 : Présentation
schématique du dispositif expérimental de lâcher des
glossines 15
Figure 8 : Quelques photos du matériel
technique utilisé pour les expériences 18
Figure 9 : Capture des glossines à
l'étable et leur alimentation au laboratoire 20
Figure 10 : Quelques dispositions de conduite du
test sur la fécondité des glossines 21
Figure 11 : Courbe de survie globale sur 30
jours de suivi des glossines 27
Figure 12 : Courbe de survie globale sur 81
jours de suivi des glossines 28
Figure 13 : Graphe des probabilités de
mortalité en fonction des traitements 28
Figure 14 : Evolution de la durée moyenne
de vie des glossines initiales en fonction du
temps post-traitement 29
Figure 15 :
Evolution de la durée moyenne de vie des survivantes en fonction du
temps post-
traitement 29
Figure 16 : Courbe de survie globale sur 15
jours de suivi des colonies initiales 30
Figure 17 : Courbes de survie des glossines
initiales 30
Figure 18 : Courbe de survie globale sur 15
jours de suivi des survivantes 31
Figure 19 : Courbes de survie des glossines
survivantes 31
Figure 20 : Evolutions comparées des taux
de mortalité des témoins et des traités initiaux 33
Figure 21 : Evolutions comparées des taux
de mortalité des témoins et des traitées
survivantes 34
Figure 22 : Graphes des valeurs comparées
des paramètres de fécondité des glossines 35
Figure 23 : Variation des taux de ponte des
groupes de traitement en fonction du jour post-
traitement 35
Figure 24 : Evolution des moyens des pupes en
fonction des ordres de ponte 36
Figure 25 : Proportions des pupes par classe de
poids 37
Figure 26 : Courbe de survie globale des
glossines-filles 38
Figure 27 : Courbe de survie des trois colonies
de glossines-filles 38
Figure 28 : Evolutions comparées des taux
de mortalités en fonction des jours post-
émergence 39
III
LISTE DES TABLEAUX
Tableau 1 : Principales espèces et
sous espèces de glossines d'intérêt médical ou
vétérinaire 3
Tableau 2 : Estimateur de Kaplan-Meier de la
fonction survie de l'ensemble des glossines 26
Tableau 3 : Taux de mortalités des
glossines initiales 32
Tableau 4 : Taux de mortalités des
survivantes 33
Tableau 5 : Mortalités des glossines
en fonction des états de gorgement 34
Tableau 6 : Résultats des tests
statistiques sur les variables étudiés en rapport avec le
temps
post-traitement 36
Tableau 7 : Statistiques descriptives des
poids des pupes 36
Tableau 8 : Estimateur de Kaplan-Meier de la
fonction survie des glossines-filles 37
LISTE DES ANNEXES
Annexe 1 : Tables de survie B
Annexe 2 : Synthèse des données
brutes de fécondité C
Annexe 3 : Scripts des analyses de survie sur
R 3.0.3 D
Annexe 4 : Résumé du test t de
Student sur les variables de fécondité E
Annexe 5 : Fiches de collecte des
données F
Annexe 6 : Calendrier de l'étude I
IV
RESUME
En Afrique sub-saharienne, les Trypanosomoses Animales
Africaines (TAA ou Nagana) constituent l'une des contraintes pathologiques
majeures pour l'élevage des bovins. Face à ce contexte, diverses
méthodes de lutte anti-vectorielle sont employées dont le
traitement épicutané du bétail qui est beaucoup
apprécié par les éleveurs. C'est dans ce cadre que nous
nous sommes intéressés à l'évaluation de
l'efficacité du fipronil 1% sur la survie et la fécondité
des glossines, dont le but est d'offrir aux éleveurs des recommandations
de dose et de fréquence de traitement adaptées contre les
glossines.
L'étude a consisté, dans un premier temps,
à une application du fipronil 1% sur trois (03) bovins à raison
de 0,1 ml/kg de masse corporelle. Puis, des lâchers de glossines
mâles ténérales (Glossina palpalis gambiensis) ont
été effectués et leur survie a été suivie
jusqu'à l'obtention de cinq (05) taux de mortalité successifs
inférieurs à 50%. Ensuite, des glossines femelles
ténérales ont été alimentées sur des bovins
traités et non traités et leur performance de reproduction a
été suivie. Enfin, la survie des glossines-filles issues de ces
dernières a été suivie.
Cette étude a montré que le fipronil 1% a un
effet significatif sur la survie des glossines (p < 0,01). Il entraine une
mortalité massive des glossines (40%) dans les soixante-douze (72)
heures après que celles-ci aient été gorgées sur un
animal traité. Cependant, son efficacité diminue en fonction du
temps post-traitement qui a un effet significatif sur la survie des glossines
(p < 0,01).
Entre cinquante et un (51) et soixante-quatorze (74) jours du
temps post-traitement, les indices de survie des glossines initiales et
survivantes n'étaient pas significativement différents (p = 0,193
et p = 0,005 au seuil de signification 0,01), suggérant que la
rémanence du fipronil 1% sur les glossines pourrait donc être
située entre 51 et 74 jours.
Par ailleurs, le fipronil 1% s'est avéré
inefficace sur la perturbation des paramètres de reproduction qui ont
été testés, aucune différence significative au
seuil de 0,05 n'ayant été relevée au sein des deux groupes
de traitement sur les taux de pontes (p = 0,948), les poids des pupes (p =
0,422) et les taux d'éclosions (p = 0,743).
L'analyse de survie des glossines-filles a aussi montré
qu'il n'y a pas de différence significative au seuil de 10-2
entre les paramètres de survie des deux groupes de traitement
(p = 0,031) ; de ce fait, le fipronil 1% n'avait pas
d'incidence sur la survie de la descendance de nos échantillons de
glossines.
La rémanence obtenue pour le fipronil 1% est acceptable
comparativement à d'autres insecticides déjà
testés. Ceci pourrait donc susciter l'acceptation du fipronil 1% par les
producteurs.
Mots clés : efficacité -
épicutanée - fipronil - glossines - survie.
V
ABSTRACT
In sub-saharan Africa, African Animal Trypanosomiasis (AAT or
Nagana) are one of the major pathological constraints for the cattle breeding.
Facing this context, different methods of vector control are used whose
percutaneous treatment of cattle that is much appreciated by breeders. It is in
this context that we were interested to the evaluation of the efficacy of
fipronil 1% on survival and fecundity of tsetse flies, of which objective is to
offer breeders a dose recommendation and treatment frequency adapted against
tsetse flies.
The study consisted, at first, an application of fipronil 1%
over three (03) cattle at 0.1 ml / kg of body weight. Then the releases of
teneral tsetse male flies (Glossina palpalis gambiensis) have been
done and their survival was followed until obtaining five successive mortality
rate below 50%. Then teneral female tsetse flies were fed on treated and
untreated cattle and their reproductive performance was followed. Finally, the
progeny tsetse survival from the last has been followed.
This study showed that fipronil 1% has a significant effect on
the survival of tsetse flies (p ? 0.01). It causes mass mortality of tsetse
flies (40%) within seventy-two hours after they were fed on a treated animal.
However, its efficacy decreases depending on the time after treatment which has
a significant effect on the survival of tsetse flies (p ? 0.01). Between
fifty-one (51) and seventy-four (74) days after treatment time, survival
indices of initial and surviving tsetse flies were not significantly different
(p = 0.193 and p = 0.005 at significance level 0.01), suggesting that the
persistence of fipronil 1% on tsetse flies may be situated between 51 and 74
days.
Otherwise, fipronil 1% was inefficient on the disruption of
reproductive parameters that were tested, no significant differences at the
0.05 having been found in the two treatment groups on rates of punters (p =
0.948), on the pupal weight (p = 0.422) and on the hatching rates (p =
0.743).
Survival analysis of progeny tsetse flies also showed that
there was no significant difference between the survival parameters of the two
treatment groups (p = 0.031) at significance level 0.01; therefore, fipronil 1%
did not affect the survival of progeny in our samples of tsetse flies.
The durability obtained for fipronil 1% is acceptable compared
to other insecticides already tested. This could so generate accepting of
fipronil 1% by producers. Key words: efficacy - fipronil -
percutaneous - survival - tsetse flies.
1
INTRODUCTION
La prévention et le contrôle sont des
dispositions importantes de la lutte contre les trypanosomoses humaines et
animales. La mise en oeuvre de ces dispositions passe par diverses
méthodes de lutte anti-parasitaire et anti-vectorielle. La lutte
anti-vectorielle (LAV) reste la méthode de choix pour contrôler
les trypanosomoses. Elle repose essentiellement sur la pose de pièges
et/ou d'écrans imprégnés d'insecticides et des
applications épicutanées de formulations insecticides sur le
bétail (Cuisance et al., 1994). Dans ce sens, l'utilisation des
insecticides en application pour-on (traitement
épicutané) contre les glossines et autres vecteurs
mécaniques est particulièrement appréciée par les
communautés d'éleveurs (Bauer et al., 1992) parce qu'il
est directement appliqué sur le bétail, permet de lutter
simultanément contre d'autres ectoparasites comme les puces et les
tiques et ne nécessite pas d'installations lourdes, onéreuses et
fixes, et offrent une grande facilité et une bonne rapidité
d'utilisation. Cependant, le non-respect des normes d'utilisation (dose et
fréquence d'utilisation) peut conduire à de mauvais
résultats ou à la perte de l'animal avec des conséquences
économiques non négligeables. De plus, une utilisation non
raisonnée des insecticides dans le cadre de la LAV peut avoir des effets
directs et indirects sur l'environnement en affectant des organismes ou animaux
non visés, perturbant de la sorte le fonctionnement des
écosystèmes. Des études réalisées par
Douthwaite en 1992 ont montré que les traitements insecticides et
acaricides par pulvérisation contre les parasites et les vecteurs de
parasites peuvent avoir des impacts sur des animaux non visés, notamment
en :
- induisant une pollution de l'eau par les résidus ou
les eaux usées ;
- empoisonnant les poissons et les crustacés vivant
dans les eaux polluées ;
- atteignant d'autres êtres vivants de
l'écosystème, comme les bousiers nécessaires à
l'introduction des déjections dans la terre, ou des insectes
pollinisateurs.
C'est pourquoi, les traitements épicutanés sont
préconisés et beaucoup appréciés par les
communautés scientifiques.
Etant donné que les outils de la LAV, et plus
particulièrement les traitements épicutanés, sont
utilisés dans les conditions naturelles et domestiques, il est important
de déterminer la rémanence de ces traitements afin d'offrir aux
éleveurs des recommandations de fréquences de traitement
adaptées aux cibles. C'est ainsi que l'efficacité de nombreux
insecticides dans la lutte anti-vectorielle a été
déjà testée. Parmi ceux-ci, il y a la
deltaméthrine, le fluméthrine ,
l'alpha-cyperméthrine et l'amitraze dont les
rémanences sur les glossines sont
respectivement de trente (30)
jours, vingt (20) jours, vingt-cinq (25) jours et trois (03) jours
2
(Bouyer et al., 2004) et le triflumuron avec une
rémanence de six (06) à sept (07) mois dans les conditions de
terrain (Bancé et al., 2006). L'effet de la moxidectine a
été également testé sur Glossina palpalis
gambiensis et Glossina morsitans morsitans (Verdier, 2005). Une
étude comparée des effets du fipronil et de la
deltaméthrine a été déjà faite sur
Glossina morsitans morsitans et Glossina palpalis gambiensis
(Petit, 2002). Cette étude a consisté à l'exposition
des glossines au fipronil par contact tarsal (trois contacts de trente (30)
secondes à quarante (48) heures d'intervalle). Il en est ressorti que le
fipronil (300 mg/m2) a une efficacité de 40,8%. Compte tenu
des insuffisances constatées dans cette étude, cet auteur a
suggéré que des formulations se rapprochant de celles
utilisées dans les insecticides en « pour-on »
pourraient donner de meilleurs résultats. C'est ce qui donne de
l'intérêt à notre étude qui a pour but de
déterminer l'efficacité et la rémanence d'une application
pour-on du fipronil 1% sur les glossines, vecteurs de trypanosomoses.
L'étude permettra, spécifiquement de déterminer et
d'évaluer d'une part l'effet du fipronil 1% sur la survie des glossines
(Glossina palpalis gambiensis,Vanderplank 1949) de laboratoire, et
d'autre part sur leur fécondité. Tout ceci permettra
d'évaluer l'impact global du produit en tant qu'outil de lutte. Cette
étude a été conduite sous les hypothèses suivantes
:
- le fipronil 1% a un effet létal sur la survie des
glossines ;
- il existe une durée au bout de laquelle le fipronil
1% élimine 50% d'une population de glossines (TL 50) ;
- le fipronil 1% a une durée d'action limitée
(rémanence), c'est-à-dire que la persistance de son effet toxique
est limitée ;
- le fipronil 1% réduit les performances reproductives
des glossines.
Notre mémoire est structuré en quatre (04)
grandes parties :
- une première partie consacrée à
l'étude bibliographique sur les glossines et le fipronil ;
- une deuxième qui fait ressortir la méthodologie
de l'étude ;
- une troisième partie qui traite des résultats
obtenus au cours de l'étude ;
- une quatrième partie qui traite des discussions sur les
résultats obtenus.
3
I. ETUDE BIBLIOGRAPHIQUE
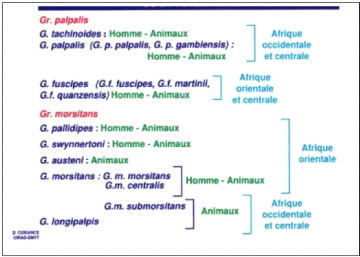
1.1. Généralités sur les glossines
1.1.1. Systématique, biogéographie et
morphologie des glossines
1.1.1.1. Systématique et biogéographie
Les glossines sont des insectes appartenant à l'ordre
des Diptères, au sous-ordre des Brachycères, à la famille
des Glossinidés et à la sous-famille des Glossininés qui
est composée d'un seul genre : le genre Glossina. Les glossines
sont exclusivement des mouches africaines et continentales. D'après
leurs particularités écologiques, leurs caractéristiques
morphologiques et leurs capacités vectorielles, elles sont
divisées en trois sous-genre ou «groupes» qui sont :
? les glossines du groupe Palpalis qui sont
généralement riveraines, confinées à la
végétation dense bordant les cours d'eau ou vivant dans des
bosquets péri-domestiques ;
? les glossines du groupe Morsitans
rencontrées dans les savanes boisées et les fourrés
denses, essentiellement dans les zones d'abondance de bétail ou de faune
sauvage ;
? les glossines du groupe Fusca qui vivent dans les
zones forestières (La Rocque et Cuisance, 2005).
Les principales espèces ou sous-espèces qui
représentent les vecteurs majeurs des trypanosomoses de l'homme et des
animaux domestiques et qui sont de ce fait d'un intérêt
médical ou vétérinaire sont indiqués dans le
tableau 1.
Tableau 1 : Principales espèces et
sous espèces de glossines d'intérêt médical ou
vétérinaire
(Cuisance, 1989)
4
Parmi les espèces de glossines ci-dessus citées,
c'est Glossina palpalis gambiensis appartenant au groupe Palpalis
qui fait l'objet de notre étude. Le groupe Palpalis est
principalement confiné aux régions très humides de
l'Afrique, les marais à palétuviers (mangrove), la forêt
ombrophile, les rives des lacs et les forêts galeries longeant les
rivières. Sur le plan biogéographique, Glossina palpalis
vit dans les régions humides d'Afrique occidentale, en partant du
Sénégal au Cameroun, ainsi qu'au sud, et le long de la côte
jusqu'en Angola (figure 1). Les secteurs qui en sont infestés, entre le
Cameroun et l'Angola, ont une longue frontière commune avec ceux de
Glossina fuscipes, les deux zones d'infestation ne se recouvrant
guère (Pollock, 1992). Particulièrement, Glossina palpalis
gambiensis occupe les zones de savane ouest africaine du
Sénégal à la frontière du Togo (Laveissière
et al., 2000).
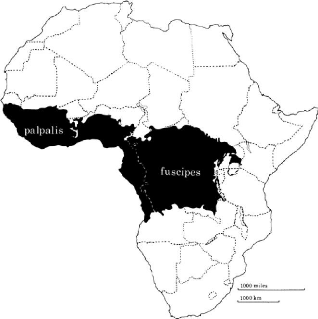
Figure 1 : Carte de répartition
géographique de Glossina palpalis et de Glossina fuscipes
(Pollock, 1992).
(La ligne blanche en pointillé marque la limite
approximative des zones infestées par chacune des deux
espèces).
5
1.1.1.2. Morphologie des glossines
La glossine présente toujours un teint brun ou
gris-brun; quelquefois, on trouve une légère touche de rose ou de
rouge roussâtre. Le corps porte en général des tâches
claires et foncées, ce qui rend l'insecte difficile à distinguer
lorsqu'il est posé sur l'écorce d'un arbre, un rocher ou sur le
sol. Au repos, la glossine a normalement l'air assez mince car ses ailes sont
repliées l'une sur l'autre (figure 2) au lieu de s'écarter vers
l'extérieur en faisant un certain angle avec le corps comme c'est le cas
chez la mouche domestique et la plupart des calliphorines. Immédiatement
après un repas de sang, l'abdomen de la glossine est gonflé,
arrondi et rouge. Les mâles sont en général plus petits que
les femelles. L'abdomen possède généralement des
tâches sombres sur fond clair jaunâtre. Les tarses des pattes
postérieures ont seulement les deux derniers segments recouverts de
poils noirs (on parle de « chaussette »). Les génitalia
mâles ont des forficules supérieurs très renflés
à l'apex, réunis par une membrane connective réduite. On
observe une paire de plaques anales fusionnées et une plaque sternale
sur les génitalia femelles.
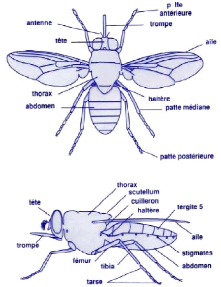
Figure 2 : Représentation
schématique d'une glossine face dorsale, ailes écartées et
vue latérale (Pollock, 1982).
6
1.1.2. Biologie des glossines
1.1.2.1. Ecologie
La plupart des espèces de glossines ont une
activité diurne et leurs déplacements se limitent à la
recherche de nourriture, de lieux de repos et de femelles pour les mâles.
Ainsi une glossine ne vole environ que trente à cinquante minutes par
jour pour les mâles et seulement cinq minutes pour les femelles (Bouyer,
2009). Les glossines passent donc la plupart de leur temps sur leurs lieux de
repos qui sont les faces inférieures des branches ou brindilles, les
trous, les dessous des grosses racines d'arbres et donc de façon
générale les lieux assez proches du sol. Plusieurs facteurs
climatiques (température, humidité ou hygrométrie et
lumière) influencent la vie des glossines. A des températures
inférieures à 16-17°C, les glossines ne peuvent mener une
vie active normale. A plus de 38°C, il se produit de lésions
létales chez les adultes, les pupes ne peuvent supporter des
températures de 32°C. La température minimale pour que ces
dernières se développent normalement ne doit pas être
inférieur à 16°C (Pollock, 1982). L'optimum
hygrométrique varie de 50% à 60% pour les espèces de
savanes et de 65% à 85% pour les espèces de forêt et de
galeries forestières (Itard, 1986).
1.1.2.2. Nutrition
Les glossines se nourrissent exclusivement de sang, avec une
préférence variant selon l'espèce. Glossina palpalis
gambiensis utilise les hôtes suivants pour se nourrir :
- des espèces disponibles en permanence : le varan et
le crocodile qui vivent en permanence à proximité de l'eau ;
- des espèces parfois disponibles : les bovidés
et le phacochère, quand ces animaux s'abreuvent ;
- l'homme, quand il fréquente l'habitat de la glossine
pour y pêcher, se laver, couper du bois ou cultiver des jardins
situés à proximité des cours d'eau (Pollock, 1996).
L'identification des repas de sang de Glossina palpalis
gambiensis dans la forêt de Kou (près de Bobo-Dioulasso) a
donné les résultats suivants : reptiles 58%, homme 24%, autres
primates 2%, guib 02%, autres bovidés 12%, autres mammifères 02%
(Pollock, 1996).
7
1.1.2.3. Reproduction
Le processus de reproduction de la glossine est le suivant :
la femelle produit des oeufs dont l'éclosion, qui s'effectue à
l'intérieur de son corps, donne des larves qui sont déjà
entièrement développées à leur expulsion du corps
de la femelle. Pour que les oeufs produits par la femelle soient
fécondés et donnent des larves, le mâle doit
secréter du sperme et l'introduire dans la femelle lors de
l'accouplement.
L'accouplement a lieu dans la semaine qui suit
l'éclosion des femelles, pour la plupart à l'âge de trois
jours. A cet âge, elles attirent le plus les mâles (qui sont
âgés en moyenne de six jours) grâce à des
phéromones spécifiques (Ripert et al., 1996). Une seule
insémination est suffisante pour toute la vie de la femelle, bien
qu'elle puisse s'accoupler plusieurs fois. Les spermatozoïdes sont
stockés dans les spermathèques de la femelle et peuvent survivre
pendant deux cent jours. Elles ne produisent que six (06) à dix (10)
larves dans leur vie, avec une fréquence d'une ponte tous les dix (10)
jours en moyenne (Bussieras et Chermette, 1991). La première larve est
déposée à seize jours d'âge en moyenne et il n'y a
pas d'arrêt de la ponte avant la mort de la femelle. La larve
expulsée s'enfonce de deux (02) à sept (07) cm de profondeur dans
le sol et se transforme en pupe en 15 minutes. La sortie du jeune adulte
s'effectue environ quatre à six semaines plus tard. La glossine est
alors appelée ténérale jusqu'à son premier repas
sanguin (figure 3).
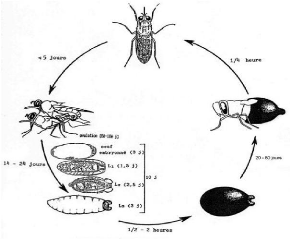
Figure 3 : Cycle reproductif d'une glossine
(Cuisance, 1989)
8
1.1.3. Stratégies de lutte anti-vectorielle
La lutte anti-vectorielle (LAV) vise à interrompre le
cycle de transmission des trypanosomes. Sa mise en oeuvre se justifie non
seulement par le nombre d'espèces animales sensibles, mais aussi par la
présence et l'importance des populations de réservoir sauvages ou
domestiques souvent incontrôlables (De La Rocque et Dia, 2001). En plus,
l'existence de souches de trypanosomes chimiorésistantes vis à
vis des trypanocides usuels (Geerts et Holmes, 1998) a redonné à
la lutte contre les vecteurs toute son importance. Cette lutte est surtout
dirigée contre les glossines qui en sont les vecteurs majeurs.
La LAV peut se faire par plusieurs méthodes
regroupées en deux grands groupes : les méthodes non chimiques et
les méthodes chimiques.
1.1.3.1. Méthodes non chimiques
Elles comprennent la lutte écologique, la lutte
biologique, la lutte mécanique et la lutte génétique.
- La lutte écologique : elle consiste à la
destruction de l'habitat des glossines par des
éclaircissements
forestiers et l'abattage du gibier, hôtes préférentiels des
glossines. Elle s'est avérée inefficace dans la mesure où
les glossines, en l'absence de leurs hôtes préférés
dont l'accès leur est interdit, sont capables de s'adapter aux animaux
d'autres espèces pour se nourrir de sang, augmentant ainsi le nombre
d'espèces animales qui doivent être détruites. Cette
méthode onéreuse, destructrice de l'environnement et moyennement
efficace est inacceptable aujourd'hui, car des moyens plus performants et plus
écologiques sont disponibles.
- La lutte biologique : elle se fait à travers
l'utilisation de prédateurs naturels et des
parasites des glossines.
Ce sont surtout des insectes : les araignées, les diptères
(azilidés) et les guêpes fossoyeuses qui sont prédateurs
des glossines adultes ; les fourmis, les oiseaux et les mangoustes qui sont
prédateurs des pupes. Les nématodes et arthropodes sont des
parasites des adultes (Atrevy, 1978) tandis que certains
hyménoptères et diptères sont des parasites des pupes
(Bussieras et Chermette, 1991). L'efficacité de cette méthode de
lutte exige que les organismes ennemis et les insectes cibles n'appartiennent
à la même aire géographique ou écologique (Leak,
1999). Cette méthode n'a pas d'application pratique à l'heure
actuelle. La recherche s'oriente beaucoup sur Bacillus
sp. et ses toxines qui seraient
utilisées dans la régulation des populations de glossines. Cette
bactérie et ses toxines sont sans effet sur les vertébrés
et les arthropodes non-cibles (Maillard et Provost, 1975).

- La lutte mécanique : elle consiste à la pose
de pièges de capture ou d'écrans imprégnés
d'insecticide, comme le piège biconique (Chalier et
Laveissière, 1973), le piège monoconique Vavoua
(Laveissière et Grébaut, 1990), le piège monoconique de
Lancien (Lancien, 1981) et l'écran de Laveissière et
al., 1987 (figure 4).
- La lutte génétique par stérilisation :
elle consiste au lâcher de mâles
préalablement
stérilisés physiquement par rayonnement
gamma ou chimiquement avec de l'aphoxide ou avec du métaphoxide. Ces
mâles, en surnombre par rapport aux mâles sauvages de
l'espèce cible, s'accouplent avec les femelles sauvages entraînant
des accouplements infertiles. Il est donc possible d'aboutir à une
diminution des populations de glossines et éventuellement à leur
élimination grâce à la stérilisation des
mâles. Cette méthode a donné de très bons
résultats dans la zone agropastorale de Sidéradougou au Burkina
Faso (Hargrove et Langley, 1990). Cependant, elle a l'inconvénient
d'être plus coûteuse et sa rentabilité repose sur un effet
définitif, possible uniquement dans le cas d'une population
isolée (Lefèvre et al., 2003).
|
Piège biconique de Chalier et al., 1973
|
Piège monoconique de Laveissière et Grébaut,
1990
|

9
Ecran de Laveissière et al., 1987 Piège
monoconique de Lancien, 1981
Figure 4 : Pièges et écrans pour
la lutte contre les glossines (clichés : Rayaissé, 2011)
10
1.1.3.2. Méthodes chimiques
De nombreuses méthodes sont utilisables pour la lutte
chimique :
- Les pulvérisations au sol de produits insecticides
rémanents dont la durée d'action doit
être
supérieure à celle de la pupaison ont été les
moyens les plus employés de 1945 jusqu'aux années 1970. Cette
méthode est lente et peut entraîner des problèmes de
pollution temporaire (Cuisance, 1992). De plus, le coût d'une telle
méthode est élevé et les molécules utilisées
(dichlorodiphényltrichloroéthane (DDT), dieldrine) ont
été condamnées par les bailleurs de fonds du fait de leur
rémanence et donc de leur accumulation possible dans les chaînes
trophiques ; ce qui fait que les traitements rémanents, que ce soit par
voie terrestre ou aérienne, ont presque totalement disparu.
- Les traitements séquentiels en nappe
d'aérosols non rémanents ont été utilisés
sur les
zones de savanes plates et ouvertes. De vastes territoires ont
été assainis (Nigéria, Zimbabwe, Cameroun), mais peu ont
été sauvegardés à cause des réinvasions. Ils
consistent en cinq à six traitements nocturnes espacés de dix
à quinze jours. Ils ne sont possibles que sur des zones à
végétation ouverte, non accidentées et où il y a
une inversion des températures suffisante la nuit pour permettre aux
gouttelettes d'insecticide de pénétrer la
végétation au niveau des lieux de repos nocturne des glossines.
Malgré leur grande efficacité, les conditions d'application de
ces méthodes font qu'elles sont peu employées aujourd'hui.
- Les pièges et écrans imprégnés :
à partir de 1974, l'abandon des insecticides
rémanents et les
progrès dans la connaissance sur la biologie des glossines, notamment
des facteurs attractifs visuels et olfactifs, ont donné au
piégeage une place de premier plan renforcée par
l'avènement des pyréthrinoïdes de synthèse (effet par
contact foudroyant). Ces méthodes sont aujourd'hui largement
utilisées et toute une panoplie de pièges et d'écrans en
tissu (bleu/noir) plus ou moins spécifiques sont disponibles. Les
pièges peuvent être imprégnés de molécules
insecticides ou stérilisantes (mimétiques de l'hormone
juvénile ou inhibiteurs de la mue). Ils ont apporté un grand
progrès (méthode simple, rapide, non polluante) mais sont soumis
à de fortes contraintes d'implantation et d'entretien. Plusieurs auteurs
ont décrit les bons résultats obtenus avec ces méthodes de
pièges et d'écrans imprégnés (Laveissière et
al., 1980; Dagnogo et Gouteux, 1983; Mérot et al.,
1984; Mawuena et Yacnambe, 1988; Lancien, 1991; Cuisance et al.,
1994). Cependant, elles ne permettent pas d'aboutir en général
à une véritable éradication des glossines mais à
leur contrôle et il faudra donc maintenir une action à très
long terme. L'efficacité de telles méthodes n'est pas la
même selon les espèces de glossines ; les imprégnations
doivent être renouvelées et le matériel est
vulnérable : vols, usure, destruction par les intempéries ou
les
11
animaux. En outre, l'attractivité des pièges
envers les glossines reste bien inférieure à celle du
bétail. Ainsi, si les glossines sont fortement attirées par le
bétail, celui-ci peut jouer le rôle de « pièges
vivants ».
- L'imprégnation insecticide : dans le
domaine vétérinaire, l'imprégnation insecticide
du
pelage du bétail transforme le cheptel en «pièges
vivants» (par bains, par pulvérisations, ou par application
pour-on ou traitement épicutané). Cette méthode,
très efficace contre la plupart des arthropodes piqueurs, est
très prisée des éleveurs africains.
Pour la lutte contre les glossines, les applications
pour-on sont un bon complément aux autres modes de lutte que
sont la pose d'écrans et/ou de pièges imprégnés
d'insecticides. Elles bénéficient d'une bonne perception par les
éleveurs qui peuvent rapidement constater leur efficacité, ce qui
facilite leur adoption (Bouyer et al., 2004).
12
1.2. Généralités sur le fipronil
1.2.1. Historique et propriétés
physico-chimiques
Le fipronil est un biocide de la famille des
phénylpyrazolés (Bloomquist, 1996), découvert et
développé entre 1985 et 1987 et mis sur le marché en 1993.
Il était destiné dans un premier temps à l'usage
domestique (lutte contre les cafards et les fourmis) et à l'usage
phytosanitaire pour le traitement des sols et des semences. Par la suite,
l'usage fût développé en médecine
vétérinaire pour le traitement antiparasitaire chez les animaux
de compagnie, contre les puces et les tiques (Ramesh, 2007).
Le fipronil, à l'état pur, est une poudre
blanche dont la solubilité est faible dans l'eau, mais très
élevée dans les solvants organiques. Son nom chimique est
5-amino-1-[2,6-dichloro-4-(trifluoromethyl)phenyl]-4-
(trifluoromethylsulfinyl)-1H-pyrazole-3-carbonitrile, son poids
moléculaire est de 437,15 g/mol et son point de fusion est de 203°C
(INRS, 2012).
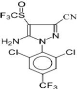
Figure 5 : Structure chimique du fipronil
(C12H4Cl2F6N4OS) (INRS, 2012).
1.2.2. Importance du fipronil
L'importance du fipronil se situe au moins à un double
niveau, un niveau sanitaire et un niveau économique.
Sur le plan sanitaire, les tests ont prouvé que le
fipronil est efficace sur plus de deux cent cinquante insectes nuisibles ; ce
qui lui vaut le qualificatif d'insecticide à large spectre (Hamon et
al., 1996).
Sur le plan économique, les antiparasitaires
représentent 34% du marché mondial des médicaments
vétérinaires et le fipronil est le numéro 1 de sa
catégorie ; ce qui en fait le médicament
vétérinaire le plus vendu au monde (Mrad, 2011).
1.2.3. Mode d'action et toxicité
Comme la plupart des insecticides, le fipronil agit au niveau
du système nerveux central des insectes. Il bloque le passage des ions
chlorures dans les cellules nerveuses par inhibition des
13
récepteurs à l'acide gamma aminobutyrique (GABA)
et des récepteurs au glutamate (Barbara et al., 2005; Jansen et
al., 2007). Le GABA permet, dans les conditions normales, la
pénétration des ions chlorures par les canaux chlorures dans la
cellule nerveuse entraînant ainsi une dépolarisation de celle-ci
et une baisse de son activité électrique. Le fipronil
empêche donc la régulation de l'activité électrique
des cellules nerveuses des insectes. Ce qui entraîne leur mort à
partir d'une certaine dose. L'affinité du fipronil pour les
récepteurs GABA et glutamique des invertébrés est bien
supérieure à celle des mammifères (chez qui les ions
chlorures arrivent à passer), ce qui confère à cette
molécule une toxicité sélective très
intéressante (Cole et al., 1993).
1.2.4. Utilisation du fipronil
Le fipronil est largement utilisé dans
différents domaines, comme dans la lutte contre les ectoparasites
(puces, tiques...) des animaux de compagnie (Postal et al., 1995;
Chadwick, 1997). Il est aussi employé en agrochimie dans la lutte contre
les ravageurs des cultures tels les criquets, sautereaux, taupins (Lacombe,
1993; Mouhim et al., 1996), et dans la lutte contre les parasites du
bétail (Davey et al., 1998; Araujo et al., 1998). On
l'utilise également pour l'hygiène publique contre les mouches et
les blattes (Kaakeh et al., 1997; Scott et Wen, 1997).
1.2.5. Efficacité du fipronil sur les insectes
Des études ont montré que le fipronil est
efficace contre les puces et les tiques adultes provoquant leur mort dans les
vingt-quatre heures suivant l'exposition (
http://www.fluoridealert.org/pesticides/lufenuron.fipronil.pets.htm).
Chez le chien, un traitement unique procure une protection contre
les puces pour une durée de un à trois mois et contre les tiques
pour une durée d'un mois. Chez le chat, le produit protège contre
les puces pendant un à trois mois et contre les tiques pendant dix-sept
à trente jours. (
http://www.cbip-vet.be/fr/frinfos/frfolia/14FVF1a.php).
Cette efficacité est maintenue même après
lavage, à condition de ne pas l'effectuer dans les deux jours suivant
l'application.
Dans la lutte antiacridienne, les études sur le terrain
ont montré que le fipronil même utilisé à de faibles
doses avait une rémanence très intéressante (Mouhim et
al., 1998).
L'efficacité du fipronil sur d'autres insectes
parasites du bétail (puces et tiques) et sa rémanence à
faible dose en font une molécule particulièrement
intéressante à tester en laboratoire sur les glossines en
observant son action sur leur survie et leur fécondité.
14
II. METHODOLOGIE
2.1. Organisation du dispositif expérimental
2.1.1. Préparation des animaux
Les animaux choisis pour les expériences étaient
des bovins ne présentant aucune lésion cutanée. Un
traitement trypanocide à l'acéturate de diminazène
(bérénil) leur a été administré avant qu'ils
ne soient placés dans des box individuels pour au moins sept jours
d'acclimatation avant le début des expériences. Ils ont
été identifiés par des boucles auriculaires et
pesés. L'alimentation, destinée au maintien des animaux pendant
l'étude, était ad libitum et constituée de
fourrages, de tourteaux et d'eau.
2.1.2. Application épicutanée du fipronil
1%
Bien avant les lâchers, une application
épicutanée ou application pour-on du fipronil 1% a
été faite sur trois (03) animaux à raison de 0,1 ml/kg de
masse corporelle (figure 6). L'application pour-on a consisté
à déverser sur la ligne dorsale de l'animal la dose
mesurée du fipronil qui diffuse rapidement sur la plus grande partie du
corps. Elle a été faite sept (07) jours avant le début des
lâchers.
Figure 6 : Application
épicutanée du fipronil 1% sur les animaux
2.1.3. Préparation de l'étable
Dans le souci de randomiser les boeufs et les groupes de
glossines, l'étable a été organisée suivant la
logique d'un plan d'expérience en blocs aléatoires complets car
nous avions une hétérogénéité de blocs
différant du traitement. Au sein de ces blocs, les animaux ont
été positionnés de manière à ce que tous les
traitements soient présents de façon rotative dans chacun des
blocs.
L'étable est en forme de U, de dimensions 8m * 4m * 2m
et a des murs internes qui séparent les deux blocs qui abritent les
animaux des différents groupes de traitement (traité et
témoin).
15
Ces portions sont cloisonnées afin d'obtenir des
espaces plus restreints favorisant ainsi le contact entre les glossines et
l'animal.
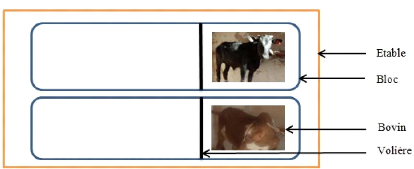
Figure 7 : Présentation
schématique du dispositif expérimental de lâcher des
glossines
2.1.4. Préparation du laboratoire
Avant le début des expériences, tout le
dispositif expérimental a été convenablement
installé au laboratoire. Il était composé
d'hygromètre, de thermomètre, de charriots de stockage, de
plaques chauffantes, de filets et de cages. Les quatre derniers dispositifs ont
été minutieusement étiquetés et rangés en
fonction des traitements et des colonies de glossines.
2.2. Matériels utilisés
2.2.1. Matériel biologique
Le matériel biologique utilisé est constitué
de glossines, de boeufs et de sang.
? Les glossines : ce sont des glossines (Glossina palpalis
gambiensis, Vanderplanck
1949) de laboratoire, mâles et femelles
d'un jour d'âge, toutes ténérales (n'ayant pas encore pris
de repas de sang après la sortie du puparium).
Cette espèce a été retenue pour cette
étude à cause de son importance épidémiologique en
Afrique de l'Ouest. En effet, en ce qui concerne la trypanosomiase humaine
(maladie du sommeil) à Trypanosoma gambiense, Glossina
palpalis gambiensis est le vecteur le plus important en Afrique de l'Ouest
(Pollock, 1996). Il est également un vecteur notable de la
trypanosomiase animale. Les bovins qui se rendent vers les fleuves et les
ruisseaux pour s'abreuver s'y trouvent en contact étroit avec cette
glossine.
? Les boeufs : ce sont des zébus de race ndama et de
poids moyen cent (100)
kilogrammes.
16
+ Le sang : c'est le sang de bovins et de porcs recueilli
à l'abattoir de Bobo-Dioulasso et
qui sert à l'alimentation des glossines une fois qu'il
est traité (stérilisation par irradiation et ajout d'un gramme de
glucose par litre de sang).
2.2.2. Matériel technique
Le matériel technique est composé de fipronil
1%, de filets moustiquaires, de moustiquaires de couverture (volières),
de cages à glossines, d'un thermo-hygrograhe (hobo), d'un charriot de
stockage, de deux plaques chauffantes, d'une balance, de deux membranes, de
parafilm, d'un humidificateur, d'un climatiseur, d'un
réfrigérateur, d'une étuve et d'une
étagère.
+ Le fipronil (figure 8.a) : il a été
utilisé à raison d'une dose de 0,1 ml/kg de masse
corporelle
des bovins.
+ Les moustiquaires : ce sont les filets moustiquaires et les
moustiquaires de couverture.
Les filets moustiquaires ont été
utilisés pour la capture des glossines lâchées tandis que
les
moustiquaires de couverture permettaient d'isoler les animaux
exposés aux glossines à
l'étable.
+ Les cages à glossines (cages Roubaud) et les cages
d'éclosion (figure 8.b).
Les cages Roubaud sont des cadres métalliques de 13 cm * 8
cm* 5 cm insérés :
- lors du test sur la survie, dans des manchons en tissu
moustiquaire noir pour la contention des glossines alimentées sur les
animaux traités et dans des manchons en tissu moustiquaire blanc pour
les glossines alimentées sur les animaux témoins ;
- lors du test sur la fécondité, dans des
manchons en tissu moustiquaire vert pour la contention des glossines
femelles.
Les cages d'éclosion de 30 cm * 25 cm * 15 cm ont
été utilisées lors du test sur la fécondité
pour le suivi des émergences.
+ Le thermo-hygrographe (figure 8.e) : c'est un appareil qui a
été utilisé pour le contrôle
des conditions
climatiques (température et hygrométrie) au laboratoire.
+ L'humidificateur et le climatiseur : ces appareils ont
été installés au laboratoire pour
favoriser le maintien
de bonnes conditions climatiques (figure 8.c et figure 8.d).
+ Le charriot de stockage (figure 8.f) : c'est un support sur
lequel étaient déposées les
cages contenant les
glossines ; il servait également de pondoir.
+ L'étagère (figure 8.h) : c'est aussi un support
pour les cages d'éclosion.
+ Les plaques chauffantes (figure 8.g) : les plaques chauffantes,
au nombre de deux,
permettaient de chauffer le sang afin d'alimenter quotidiennement
les glossines suivies.
+ La balance : elle a servi aux pesées des pupes.
17
? Les membranes : celles utilisées étaient en
silicone et servaient de support pour
l'alimentation des glossines au laboratoire. Elles sont
étalées sur des plateaux en aluminium déposés sur
les plaques chauffantes
? Le parafilm : il était utilisé lors du test
sur la fécondité pour l'alimentation des
glossines à
l'étable. Pendant l'alimentation, le parafilm est ceint sur la partie du
boeuf préalablement rasée afin d'éviter tout contact entre
le boeuf et les glossines qui s'alimentaient par perforation du parafilm
à l'aide de leur proboscis.
? Le réfrigérateur : il permettait
d'anesthésier les glossines afin de favoriser le
comptage.
? L'étuve : elle servait à la
stérilisation à 105°C du matériel d'alimentation
des
glossines.

f : Charriot de stockage g : Plaques chauffantes h :
Etagère avec des cages d'éclosion
c : Humidificateur d : Climatiseur e : Hobo
a : Fipronil b : Cage d'éclosion (à gauche)
et cages
Roubaud (à droite)
18
Figure 8 : Quelques photos du matériel
technique utilisé pour les expériences
19
2.3. Démarche expérimentale
2.3.1. Conduite du test de l'effet du fipronil 1% sur la
survie des glossines
2.3.1.1. Lâcher des glossines sur les bovins à
l'étable
Pour évaluer l'effet du fipronil 1% sur la survie des
glossines, des lâchers de glossines ténérales mâles
de Glossina palpalis gambiensis ont été effectués
au deuxième jour de leur émergence sur des animaux placés
en étable sous moustiquaire pendant deux heures. Bien avant les
lâchers, une application pour-on du fipronil 1% a
été faite sur trois (03) animaux à raison de 0,1 ml/kg de
masse corporelle (figure 6).
Le premier lâcher a eu lieu sept (07) jours après
l'application pour-on du fipronil 1% sur les animaux. Quarante-huit
(48) heures après le traitement, les animaux ont été
exposés au soleil pendant trois heures et arrosés
entièrement avec cinquante litres d'eau pour se rapprocher des
conditions naturelles de la saison des pluies et de l'effet du trempage des
pattes lors de l'abreuvement. Cette douche a été
répétée tous les deux jours pendant un mois.
A chaque lâcher, deux animaux (un traité et un
non traité) étaient introduits dans chaque bloc de
l'étable et chacun d'eux a été exposé à cent
glossines pendant les deux heures que dure l'expérience. L'enceinte de
l'étable était arrosée une heure avant chaque lâcher
pour assurer la survie des glossines en augmentant l'humidité
ambiante.
2.3.1.2. Recapture des glossines et leur suivi au
laboratoire
A l'issue de ces séances de lâchers, les
glossines ont été minutieusement recapturées à
l'aide de filet moustiquaire (figure 9.a), classées en fonction de leur
état de gorgement et transférées au laboratoire où
les conditions de température et d'hygrométrie étaient en
moyenne de 25°C et 75%. La paralysie ou la mort a été
notée deux heures après la recapture. Les glossines encore
paralysées deux heures après la recapture ont été
considérées mortes comme si elles étaient en conditions
naturelles (prédation et dessèchement). Le reste du suivi
(recensement de la mortalité) a été fait de manière
quotidienne, vu le mode d'action du fipronil n'a aucun effet Knock
Down, c'est-à-dire qui ne tue pas immédiatement, mais
lentement. La mortalité a été ainsi suivie sur les deux
lots de glossines pendant deux semaines après leur première
alimentation sur les animaux des groupes respectifs. Ces glossines ont
été alimentées durant ces quinze (15) jours de suivi avec
le sang utilisé pour l'alimentation des glossines de l'insectarium du
CIRDES (figure 9.b).
Au bout des quinze jours de suivi, les glossines survivantes
ont été alimentées de nouveau sur les animaux et un
nouveau cycle de suivi de la mortalité a été fait.
20
Les expositions se sont poursuivies jusqu'à obtention
de cinq (05) taux successifs de mortalité inférieurs à
50%. C'est à ce stade que le test de l'effet du fipronil 1% sur la
fécondité des glossines femelles a été
entamé.

Glossines traitées
Glossines témoins
a : Capture des glossines après lâcher b :
Alimentation des glossines au laboratoire
Figure 9 : Capture des glossines à
l'étable et leur alimentation au laboratoire
2.3.2. Conduite du test de l'effet du fipronil 1% sur la
fécondité des glossines
Le test sur la fécondité des glossines a
été réalisé avec trois (03) colonies de glossines
comprenant chacune deux cent (200) glossines femelles (cent témoins et
cent traitées). Pour chaque colonie, les glossines femelles ont
été réparties dans trois cages Roubaud et mises en
alimentation sur un animal de chaque groupe (traité et non
traité) au travers d'une membrane de parafilm qui empêche le
contact direct entre les tarses de la glossine et la peau de l'animal (figure
10.a). Le repas sanguin est pris par perforation du film fin et de la peau par
le proboscis. Après cette alimentation qui a duré dix minutes,
ces femelles ont été retirées et gardées au
laboratoire, pour être mises en accouplement avec des mâles nourris
au sang sain. L'accouplement des femelles a été fait trois jours
après leur éclosion avec des mâles âgés de 06
jours au ratio d'un mâle pour trois femelles.
Ces femelles mises en alimentation sur les animaux ont
été nourries six jours sur sept par semaine (trois fois sur les
animaux et les trois autres fois avec le sang « standard » de
l'insectarium).
Pendant la pupaison, les pupes pondues ont été
quotidiennement collectées dans des bacs (figure 10.e). Le charriot de
stockage ainsi que les bacs ont été identifiés par ordre
de pontes et par traitement. Lors des collectes (figure 10.c), les pupes ont
été observées, comptées, pesées (figure
10.d) et conservées au laboratoire (où les conditions
d'élevages sont optimales)
21
en attendant leurs éclosions. Les éclosions de
toutes les pupes collectées ont été suivies
quotidiennement (figure 10.b). Après chaque éclosion quotidienne,
les glossines-filles ont été récupérées et
mises en cages. Par la suite, leur survie a été suivie en
conditions de diète alimentaire, c'est-à-dire qu'elles
n'étaient pas nourries durant le suivi.
Le suivi de la survie été réalisée
quotidiennement par lot d'émergences.

a : Alimentation des glossines à
l'étable
c : Collecte des pupes d : Pesée des
pupes
b : Suivi des éclosions
e : Pupes collectées
Figure 10 : Quelques dispositions de conduite
du test sur la fécondité des glossines
22
2.4. Paramètres expérimentaux
étudiés
Les paramètres étudiés dans ces
expériences sont l'indice de survie (Is), la durée moyenne de vie
(Dv), la durée de survie médiane ou temps létal 50 (TL
50), le risque relatif de mortalité (RR), le taux d'avortons (Ta), le
taux de ponte ou de production de pupes (Tp), le taux de pupes mal
formées (Tpmf), le taux d'émergences ou d'éclosions (Te)
et le poids moyen d'une pupe (Pm).
2.4.1. Paramètres de survie
2.4.1.1. L'indice de survie ou probabilité de
survie
L'indice de survie au temps ti est exprimée par :
qi =
où qi est l'indice de survie au
temps ti ; ni est le nombre de glossines vivantes au temps ti et
di le nombre de glossines mortes au temps ti. La probabilité de survie
ou indice de survie cumulé est déterminé par la
formule Is(t) = fl
2.4.1.2. La durée de survie médiane ou temps
létal 50
Dans la présente étude, la médiane de
survie a été également déterminée. Elle est
définie par le temps à partir duquel 50% des glossines
présente l'événement (mortalité). Autrement dit,
c'est le temps létal pour 50% des individus (TL 50) ou le délai t
pour lequel Is (t) = 0,5. Elle est obtenue à partir des courbes de
survie par projection de l'indice de survie 0,5 sur la courbe et sur l'axe des
abscisses.
2.4.1.3. Le risque relatif de mortalité
Les statistiques descriptives du logiciel R ont permis de
calculer, dans chaque groupe (témoin et traité), le taux relatif
de morts. Le rapport des taux relatifs de morts de chacun des deux
groupes de traitement s'appelle le risque relatif de
mortalité (RR) qui est égal à où Mtr
= nombre de glossines mortes au sein des traitées, Vtr
= nombre initial de glossines traitées, Mte = nombre de glossines mortes
au sein des témoins et Vte = nombre initial de glossines témoins.
Cela a permis de conclure que le risque de mourir dans le groupe traité
est x fois supérieur à celui dans le groupe témoin.
|
Te =
|
nombre de mouches écloses nombre de pupes pondues
|
x 100
|
23
2.4.1.4. La durée moyenne de vie
Dans notre étude, la durée moyenne de vie des
glossines soumises aux expériences représente l'un des
indicateurs de l'efficacité du fipronil 1%. Sa détermination sous
le logiciel R a permis de comparer la longévité des deux groupes
de traitement (témoin et traité).
2.4.2. Paramètres de fécondité
L'effet du fipronil 1% sur la fécondité des
glossines a été étudié lorsque nous avions obtenu
successivement cinq taux de survie supérieurs à 50% lors du
premier test.
Les variables retenues pour l'étude des
paramètres de reproduction sont : le taux d'avortons, le taux de
production de pupes, le taux de pupes mal formées, le taux
d'éclosion et le poids moyen d'une pupe.
2.4.2.1. Le taux d'avortons
Est considérée comme avorton, toute larve
expulsée avant terme. Les taux d'avortons (Ta) ont été
calculés par rapport au nombre de pupes pondues.
nombre d'avortons
Ta = nombre de pupes x 100
2.4.2.2. Le taux de production de pupes ou taux de
ponte
L'ensemble des pupes normales et des pupes mal formées
constitue la production totale de pupes. Les taux de ponte (Tp) ont
été calculés par rapport au nombre de femelles en
ponte.
|
Tp =
|
nombre total de pupes
nombre de femelles en ponte x 100
|
2.4.2.3. Le taux de pupes mal formées
Le nombre de pupes mal formées est obtenu par comptage.
Le calcul du pourcentage de pupes mal formées (Tpmf) est en fonction du
nombre total de pupes.
|
T p f =
|
nombre de pupes mal formées
nombre total de pupes x 100
|
2.4.2.4. Le taux d'éclosion
Il est évalué à partir du nombre de
glossines émergents. Les taux d'éclosions (Te)
sont calculés en rapport avec le nombre de pupes pondues.
24
2.4.2.5. Le poids oyen d'une pupe
P =
nombre de pupes pondues
Le poids moyen d'une pupe a été
déterminé par comptage et par pesage des pupes pondues. poids
total des pupes
En plus du poids moyen de la pupe, les effectifs des pupes par
classe de poids ont été déterminés. Pour se faire,
trois classes ont été retenues (poids ? 25 mg, poids = 25 mg et
poids > 25 mg) sachant que le poids moyen de référence d'une
pupe à l'insectarium du CIRDES est de vingt-cinq (25) mg.
2.5. Analyse des données
L'ensemble des données relatives aux paramètres
de survie et de fécondité ont été d'abord
enregistrées, organisées et synthétisées dans le
logiciel Microsoft Excel 2010, puis analysées à l'aide des
logiciels suivants :
- le logiciel R 3.0.3 (R Development Core Team, 2013) pour les
analyses de survie ; - le logiciel Statistica 7.1 pour l'analyse des
résultats du test sur la fécondité.
2.5.1. Analyse des données sur la survie
Une analyse de survie des glossines a été faite
par la méthode de Kaplan-Meier (Kaplan EL et Meier P., 1958) afin de
cerner tous les paramètres statistiques liés à
l'efficacité du fipronil 1%. Cette analyse a concerné aussi bien
les glossines ayant subi le test sur la survie que les glossines-filles issues
des glossines utilisées pour le test sur fécondité.
La première étape de l'analyse de survie a
consisté à établir des tableaux comportant toutes les
informations nécessaires pour la description de la fonction de survie.
Les analyses statistiques ont été réalisées
à l'aide de l'estimateur non-paramétrique de Kaplan-Meier, le
modèle de Cox (Cox, 1972), le test du Khi-deux de Pearson et le test de
Wilcoxson.
La méthode de Kaplan-Meier a permis d'estimer l'indice
de survie au cours du suivi, définie par la fonction de survie Is (t).
La fonction Is (t) est une fonction en escalier décroissante, constante
entre deux temps de mortalité consécutifs, avec une marche
à chaque temps de mortalité observée.
Le principe de l'estimation de Kaplan-Meier repose sur
l'idée que « être encore en vie après un instant t,
c'est être en vie juste avant cet instant t et ne pas mourir à cet
instant ». Le fait d'être en vie juste avant l'instant t permet de
calculer le taux de survie à cet instant. Le cumul des taux de survie
aux différents instants donne le taux de survie cumulée. Ce taux
se traduit par une courbe dite la courbe de survie ou courbe de Kaplan-Meier
qui illustre l'évolution de
25
la survie en fonction du temps, avec en ordonnées la
probabilité cumulée de survie (entre zéro et un) et en
abscisses la durée du suivi en unités de temps.
Le modèle de Cox, utilisé dans la
première phase de notre étude, a permis de déterminer
d'une part la significativité statistique de l'effet du fipronil 1% et
du temps post traitement sur la survie des glossines, et d'autre part
l'interaction entre les variables 'traitement'' et 'temps
post-traitement''. Ces mêmes paramètres ont été
déterminés dans la seconde phase de l'étude (pour ce qui
concerne la survie des glossines filles) à l'aide du test de
Wilcoxson.
Quant au test du Khi-deux de Pearson, il a permis de tester
pour chaque groupe de traitement la significativité de la
différence entre les effectifs des glossines engorgées mortes et
non engorgées mortes.
Les analyses de survie ont permis de tracer des courbes de
survie qui ont donné une estimation de la proportion de glossines qui
seront encore en vie ou qui n'auront pas présenté le
phénomène étudié (la mort) après la
période de suivi. De façon plus explicite, elles ont permis :
- d'obtenir une courbe de survie : description graphique des
taux de mortalité dans les deux groupes de traitement (témoin et
traité) ;
- de déterminer la probabilité de mortalité
pendant la période de suivi ;
- de comparer la probabilité de mortalité entre les
deux groupes de traitement ;
- de mesurer l'influence du fipronil 1% sur la probabilité
de mortalité ;
- de déterminer le temps létal 50 du fipronil 1%
;
- de situer la rémanence du fipronil 1%.
2.5.2. Analyse des données sur la
fécondité
Les variables relatives à la fécondité
ont été étudiées sur chacune des trois (03)
colonies qui ont fait l'objet du test. Pour chaque colonie, ces variables ont
été encore étudiés par ordre de ponte. A cet effet,
trois pontes successives ont été examinées.
L'analyse des résultats a été faite
à l'aide du test t de Student qui a permis d'analyser les moyennes des
taux des différentes variables au sein des deux groupes de traitement
(traité et témoin).
26
III. RESULTATS
3.1. Résultats du test de l'effet du fipronil
1% sur la survie des glossines
Au cours de ce test, mille huit cent (1800) glossines ont
été lâchées dont mille sept cent quarante-quatre
(1744) capturées (huit cent quatre-vingt-neuf (889) témoins et
huit cent cinquante-cinq (855) traitées) et suivies quotidiennement au
laboratoire. Ce suivi a consisté au décompte des
mortalités quotidiennes dans chaque groupe de glossines (colonies).
Les colonies initiales ont été alimentées
sur les bovins (témoins et traités) et suivies au laboratoire
pendant quinze jours.
Les survivantes de ces colonies ont été
réalimentées sur les mêmes animaux et suivies à
nouveau durant quinze jours. Au bout de ce suivi global de trente jours, deux
cent trente-six (236) glossines mortes ont été
enregistrées au sein des témoins et cinq cent quatre-vingt (580)
mortes au sein des traitées. Les données collectées ont
permis de déterminer les indices de survie chaque fois qu'au moins un
« mort » est enregistré. Celles relatives à
l'estimateur de Kaplan-Meier de la fonction de survie sont inscrites dans le
tableau 2.
Tableau 2 : Estimateur de Kaplan-Meier de la
fonction survie de l'ensemble des glossines
Paramètres de survie Traitement
Témoins Traitées
Durée moyenne de vie 25,95 jours 15,15
jours
Indice de survie 0,73 0,32
Médiane de survie ou temps létal 50
ID 51 jours
Risque relatif de mortalité 2,52
ID = Indéterminable. Cela signifie que
la médiane de survie ne pouvait pas être déterminée
chez les témoins, car le taux de mortalité chez ces derniers a
été inférieur à 50 % durant le suivi.
L'analyse de l'ensemble des données
réalisée avec le logiciel R 3.0.3 a montré qu'il y a un
effet significatif du fipronil 1% sur la survie des glossines (p ? 0,01). Sous
R, les p-values des trois tests (Likelihood ratio test, Wald test et logrank
test), qui sont toutes égales à zéro, sont très
inférieures à 5%; ce qui montre que l'ajustement du modèle
de Cox utilisé est très pertinent au seuil de 5% : ceci confirme
donc l'existence d'une influence significative des variables
'traitement'' et 'jour post-traitement'' sur la survie
des glossines.
27
En effet, pendant le suivi de trente jours (deux fois quinze
jours), les glossines témoins ont vécu en moyenne 25,95 jours
tandis que les traitées ont vécu en moyenne 15,15 jours
d'où une réduction de 49,5% de la durée de vie des
traitées.
Egalement, la mortalité des glossines traitées
est élevée dès les trois premiers jours de leur
alimentation avec un taux de 40% de mortalité (figure 11), puis elle
tend à se stabiliser par la suite. Elle est surtout très forte au
second jour de l'ingestion du sang traité.
De plus, la probabilité de mortalité pour les
glossines traitées est de 0,68 et celle des témoins 0,27 (figure
13) d'où un risque relatif de mortalité des traitées
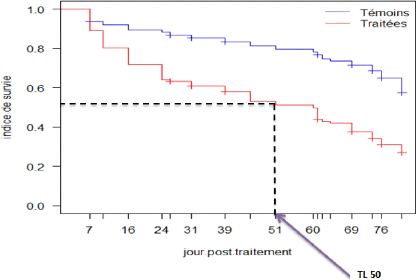
estimé à 2,52. Le temps létal 50 est estimé
à cinquante et un 51 jours pour des glossines s'étant
alimentées deux fois sur un animal traité, c'est-à-dire
que du 1er au 51ème jour après le
traitement, le fipronil 1% a pu éliminer 50% de la population de
glossines utilisée (figure 12).
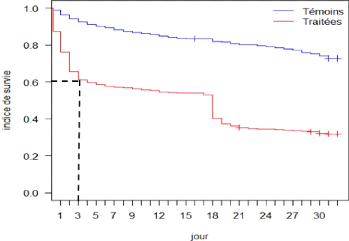
Figure 11 : Courbe de survie globale sur
trente jours de suivi des glossines
28
Figure 12 : Courbe de survie globale sur
quatre-vingt-un jours de suivi des glossines
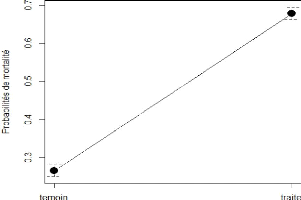
Figure 13 : Graphe des probabilités de
mortalité en fonction des traitements
Par ailleurs, les analyses portées sur les colonies
initiales et les colonies survivantes ont permis d'établir qu'il existe
une interaction significative entre la variable 'traitement '
(traitées et témoins) et la variable 'jour
post-traitement'' (p ? 0,01). Autrement dit, le temps post-traitement influence
la durée moyenne de vie des glossines traitées et des glossines
témoins de manière différente (pour les initiales : 13,4
jours pour les témoins et 9,12 jours pour les traitées sur quinze
jours de suivi (figure 14); pour les survivantes : 14,082 jours pour les
témoins et 9,779 jours pour les traitées (figure 15)). En effet,
la survie des glossines traitées s'améliore avec l'avancée
du temps post-traitement, tandis que celle des glossines témoins est
indépendante du temps post-traitement.
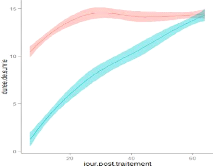
Figure 14 : Evolution de la durée
moyenne de vie des glossines initiales en fonction du temps post-traitement
29
Figure 15 : Evolution de la durée
moyenne de vie des survivantes en fonction du temps post-traitement
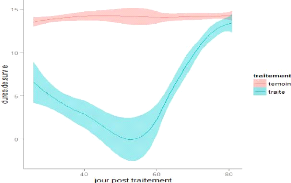
Il y a également un effet significatif du temps
post-traitement sur la survie des glossines traitées (p ? 0,01),
c?est-à-dire que plus le temps post-traitement avance, meilleure est la
survie des glossines traitées (figures 16, 17, 18 et 19).
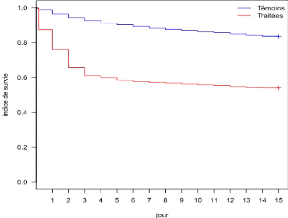
Figure 16 : Courbe de survie globale sur
quinze jours de suivi des glossines initiales
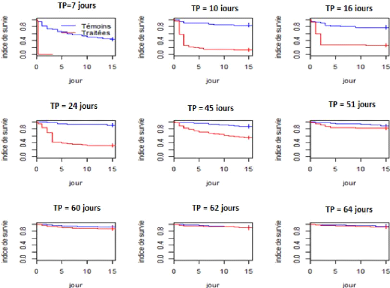
30
Figure 17 : Courbes de survie des glossines
initiales (TP = temps post-traitement)
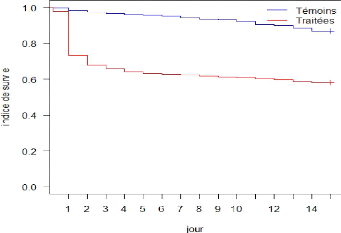
31
Figure 18 : Courbe de survie globale sur
quinze jours de suivi des survivantes
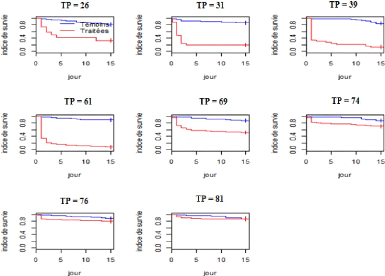
Figure 19 : Courbes de survie des glossines
survivantes (TP = temps post-traitement)
32
La rémanence du fipronil 1% a été suivie
aussi bien au niveau des glossines initiales qu'au niveau des survivantes.
Au niveau des initiales, à partir du
7ème jour post traitement, la significativité
statistique entre les indices de survie des glossines témoins et des
glossines traitées a progressivement baissé jusqu'au
51ème jour post traitement où la différence
n'était plus significative du point de vue statistique avec une p-value
de 0,193 (figure 17).
Au niveau des survivantes, nous avons constaté presque
la même tendance et c'est à partir du 74ème jour
post traitement que la différence entre les indices de survie des
glossines témoins et des glossines traitées n'était plus
significative du point de vue statistique avec une p-value de 0,005 (figure
19).
Ces deux niveaux de rémanence nous ont permis de
conclure que la rémanence du fipronil 1% est située entre
cinquante et un (51) et soixante-quatorze (74) jours (soit environ deux mois)
quand on sait que dans la nature les glossines peuvent s'alimenter plus d'une
fois sur des animaux.
Les résultats relatifs aux mortalités
enregistrées lors des suivis au laboratoire sont dans les tableaux 3 et
4.
Tableau 3 : Taux de mortalités des
glossines initiales
|
Colonie
|
Jour post
traitement
|
Nombre initial
de glossines
|
Nombre de
glossines mortes
|
Taux de mortalité
|
|
|
TE
|
TR
|
TE
|
TR
|
TE
|
TR
|
|
Colonie 1
|
7
|
100
|
92
|
56
|
92
|
56% (1)
|
100% (2)
|
|
Colonie 2
|
10
|
97
|
90
|
15
|
78
|
15,46%
|
86,67%
|
|
Colonie 3
|
16
|
96
|
95
|
21
|
70
|
21,88%
|
73,68%
|
|
Colonie 4
|
24
|
100
|
98
|
9
|
66
|
9%
|
67,35%
|
|
Colonie 5
|
45
|
99
|
91
|
12
|
41
|
12,12%
|
45,05%
|
|
Colonie 6
|
51
|
98
|
93
|
11
|
16
|
11,22%
|
17,20%
|
|
Colonie 7
|
60
|
99
|
98
|
8
|
12
|
8,08%
|
12,24%
|
|
Colonie 8
|
62
|
100
|
98
|
9
|
10
|
9%
|
10,20%
|
|
Colonie 9
|
64
|
100
|
100
|
6
|
8
|
6%
|
8%
|
TE = témoin ; TR =
traité
Tableau 4 : Taux de mortalités des
survivantes
|
Colonie
|
Jour post
traitement
|
Nombre initial
de glossines
|
Nombre de
glossines mortes
|
Taux de mortalité
|
|
|
TE
|
TR
|
TE
|
TR
|
TE
|
TR
|
|
Colonie 1
|
26
|
82
|
12
|
15
|
8
|
18,29%
|
66,67%
|
|
Colonie 2
|
31
|
75
|
25
|
10
|
20
|
13,33%
|
80%
|
|
Colonie 3
|
39
|
91
|
29
|
14
|
25
|
15,38%
|
86,21%
|
|
Colonie 4
|
61
|
87
|
50
|
9
|
46
|
10,34%
|
92%
|
|
Colonie 5
|
69
|
82
|
73
|
10
|
35
|
12,19%
|
47,95%
|
|
Colonie 6
|
74
|
89
|
82
|
11
|
24
|
12,36%
|
29,27%
|
|
Colonie 7
|
76
|
86
|
85
|
10
|
17
|
11,63%
|
20%
|
|
Colonie 8
|
81
|
90
|
90
|
10
|
12
|
11,11%
|
13,33%
|
(1) et (2) : les forts taux
de mortalité constatés étaient liés aux mauvaises
conditions climatiques de départ au laboratoire.
Pour chaque colonie initiale, il ressort que la
mortalité des glossines soumises au fipronil 1% (glossines
traitées) est supérieure à celle des glossines
témoins (tableau 3). Ces données montrent un effet très
net du fipronil 1% sur la survie des glossines. De même, la
mortalité est assez constante et relativement faible au sein des
témoins tandis que la mortalité est élevée et
descendante chez les traitées (figure 20).
Les survivantes présentent également une
mortalité constante chez les glossines témoins. Cependant, le
fipronil 1% a un effet sur la survie des traitées (tableau 4). Mais cet
effet s?amenuise avec le temps post-traitement. Ce qui entraine une
réduction progressive de la mortalité au sein des glossines
traitées, améliorant davantage leur survie (figure 21).
|
Taux de mortalité
|
120% 100% 80% 60% 40% 20%
0%
|
|
Témoins Traitées
|
33
|
7 jours
|
10 jours
|
16 jours
|
24 jours
|
45 jours
|
51 jours
|
60 jours
|
62 jours
|
64 jours
|
Jours post traitement
Figure 20 : Evolutions comparées des
taux de mortalité des témoins et des traités initiaux
|
Taux de mortalité
|
100% 80% 60% 40% 20%
0%
|
|
26 31 39 61 69 74 76 81
Témoins Traitées
34
Jours post traitement (jour)
Figure 21 : Evolutions comparées des
taux de mortalité des témoins et des traitées
survivantes
Le dénombrement des mortalités en fonction des
états de gorgement montre que les effectifs de mortalité au sein
des glossines engorgées sont supérieurs à ceux obtenus au
sein des non engorgées (tableau 5). Le test du khi-deux de Pearson
réalisé montre qu'il y a une différence significative
entre les effectifs des glossines engorgées et non engorgées dans
chaque groupe de traitement (tableau 5), ce qui confirme que l'effet du
fipronil sur les glossines est liée à leur contact avec l'animal
pour la prise de sang.
Tableau 5 : Mortalités des glossines
en fonction des états de gorgement
Traitement Groupe Effectifs Test de khi-deux au seuil
de
signification 0,001 ; ddl = 1
|
|
Total de morts
|
Engorgées mortes
|
Non
engorgées mortes
|
X2
|
X2á
|
p
|
|
Témoins
|
Initial
|
147
|
98
|
49
|
11,291
|
10,827
|
7,788.10-4
|
|
Traitées
|
|
393
|
316
|
77
|
|
|
|
|
Témoins
|
Survivant
|
89
|
51
|
38
|
19,803
|
10,827
|
8,585.10-6
|
|
Traitées
|
|
187
|
154
|
33
|
|
|
|
|
Témoins
|
Ensemble
|
236
|
149
|
87
|
29,344
|
10,827
|
6,059.10-8
|
|
Traitées
|
|
580
|
470
|
110
|
|
|
|
3.2. Résultats du test de l'effet du fipronil
1% sur la fécondité des glossines-mères et la
viabilité des glossines-filles
3.2.1. La fécondité des
glossines-mères
Le test sur la fécondité des glossines a
débuté au 92ème jour post traitement, jour
auquel la première colonie a été alimentée sur les
animaux traités et non traités (témoins). La
deuxième colonie a été alimenté au
107ème jour post traitement et la troisième au
121ème jour post traitement.
Les tests de Student réalisés ont montré
qu'il n'y a pas de différences significatives au risque 5% entre les
variances des variables testées :
- dans les deux groupes de traitement (témoin et
traité) (tableau 6** et figure 22.A) ;
- dans les trois colonies de glossines (tableau 6* et figure
22.B).
|
A : en fonction des groupes de traitement
|
|
|
B : en fonction des groupes de traitement et des
colonies
|
|
35
Figure 22 : Graphes des valeurs comparées
des paramètres de fécondité
36
Tableau 6 : Résultats des tests
statistiques sur les variables étudiés en rapport avec le temps
post-traitement
|
Paramètres
de
fécondité
|
Jour post-
|
Traitement
signification 0,05traitement
|
Test de Student au seuil de
|
|
Témoin
|
Traité
|
Groupes
comparés
|
p-value
|
|
Taux
moyen de
ponte
(%)
|
108
|
1ère
colonie
|
92,472
|
1ère
colonie
|
88,761
|
TE et TR de la
1ère colonie
|
0,621 *
|
|
123
|
2ème
colonie
|
92,003
|
2ème
colonie
|
91,953
|
TE et TR de la
2ère colonie
|
0,991 *
|
|
136
|
3ème
colonie
|
90,563
|
3ème
colonie
|
93,744
|
TE et TR de la
3ère colonie
|
0,588 *
|
|
Ensemble
|
91,679
|
Ensemble
|
91,486
|
Ensemble TE et
|
0,948 **
|
|
Poids
moyen
d'une pupe
(mg)
|
108
|
1ère
|
24,861
|
TRcolonie
1ère
colonie
|
24,904
|
TE et TR de la
1ère colonie
|
0,934*
|
|
123
|
2ème
colonie
|
24,670
|
2ème
colonie
|
24,672
|
TE et TR de la
2ère colonie
|
0,998 *
|
|
136
|
3ème
colonie
|
24,343
|
3ème
colonie
|
24,574
|
TE et TR de la
3ère colonie
|
0,334 *
|
|
Ensemble
|
24,625
|
Ensemble
|
24,717
|
Ensemble TE et
|
0,422 **
|
|
Taux
moyen
d'avortons
(%)
|
108
|
colonie
|
00
|
TR1ère 1ère
colonie
|
00
|
TE et TR de la
1ère colonie
|
-
|
|
123
|
2ème
colonie
|
00
|
2ème
colonie
|
0,397
|
TE et TR de la
2ère colonie
|
0,374 *
|
|
136
|
3ème
colonie
|
00
|
3ème
colonie
|
00
|
TE et TR de la
3ère colonie
|
-
|
|
Ensemble
|
00
|
Ensemble
|
0,132
|
Ensemble TE et
|
0,332 **
|
|
Taux
moyen de
pupes
mal
formées
(%)
|
108
|
colonie
|
00
|
TR1ère 1ère
colonie
|
00
|
TE et TR de la
1ère colonie
|
-
|
|
123
|
2ème
colonie
|
00
|
2ème
colonie
|
00
|
TE et TR de la
2ère colonie
|
-
|
|
136
|
3ème
colonie
|
00
|
3ème
colonie
|
00
|
TE et TR de la
3ère colonie
|
-
|
|
Ensemble
|
00
|
Ensemble
|
00
|
Ensemble TE et
TR
|
|
|
Taux
moyen
d'éclosion
(%)
|
|
138colonie
1ère
|
98,858
|
1ère
colonie
|
98,725
|
TE et TR de la
1ère colonie
|
0,902 *
|
|
153
|
2ème
colonie
|
98
|
2ème
colonie
|
99
|
TE et TR de la
2ère colonie
|
0,532 *
|
|
167
|
3ème
colonie
|
98,666
|
3ème
colonie
|
98,389
|
TE et TR de la
3ère colonie
|
0,840 *
|
|
Ensemble
|
98,508
|
Ensemble
|
98,705
|
Ensemble TE et
TR
|
0,743 **
|
TE = témoin ;
TR=traité
En définitive, le fipronil 1% n'a pas d'effet sur les
performances de reproduction des glossines femelles. En effet, pour toutes les
variables étudiées, le test t de Student a donné des
p-value supérieures au seuil de signification 0,05.
3.2.1.1. Les taux de ponte
Le but de l'analyse de la variable 'taux de ponte''
était de vérifier l'effet du fipronil 1% sur les performances et
la qualité de la pupaison au 108ème,
123ème et 136ème jour post traitement qui
correspondent respectivement aux périodes de ponte de la 1ère,
2ème et 3ème colonie. Ainsi, le suivi des
trois périodes de pupaison des trois colonies a permis de
récolter six cent soixante-neuf (669) pupes témoins et six cent
soixante-sept (667) pupes traitées, soit des taux de ponte globale de
91,68 % pour les glossines témoins et 91,49 % pour les traitées.
Aucune pupe mal formée n'a été constaté dans les
deux groupes de traitement. Cependant, une seule pupe relevant du groupe des
traitées de la deuxième colonie a avorté. Aucun
écart significatif n'a été observé dans les taux de
ponte des deux groupes de traitement suivis (tableau 6 et figure 22.A). Les
variations des taux de ponte sont indépendantes de l'évolution
des jours post-traitement (figure 23). Ce qui signifie qu'il n'y avait pas
d'interaction entre le jour post-traitement et la pupaison. Par
conséquent, le fipronil 1% n'a eu aucun effet sur la ponte des glossines
à partir de quatre-vingt-douze jours post-traitement, date à
laquelle la première colonie a été alimentée sur
les animaux. Les différents tests statistiques réalisés
confirment cet état de fait. En effet, le test t de Student a
accepté l'hypothèse nulle d'égalité des variances
des variables étudiés (taux de pontes, taux d'avortons et taux de
pupes mal formées) sur les deux groupes de traitement (tableau 6).
|
Taux de
ponte (%)
|
120 100 80 60 40 20
0
|
|
Témoins Traitées
|
37
108 117 123 124 132 141 136 146 155
Temps post-traitement (jours)
Figure 23 : Variation des taux de ponte des
groupes de traitement en fonction du temps post-traitement
3.2.1.2. Les poids des pupes
Les pupes ont été pesées individuellement
et leurs poids ont été classés en trois groupes (poids ?
25 mg, poids = 25 mg et poids > 25 mg). L'ensemble des
données collectées ont permis de déterminer les poids
moyens des pupes pondues par chacune des colonies pour chaque groupe de
traitement (tableau 6). Le dépouillement des données statistiques
a révélé que le poids moyen des pupes témoins est
de 24,625 mg alors que celui des traitées est de 24,717 mg. Les poids
moyens des pupes décroissent en fonction des ordres de ponte : chez les
témoins, initialement de 24,861 mg, ils sont passés à
24,670 mg à la seconde ponte, puis à 24,343 mg à la
troisième ponte ; au sein des traitées, il a été
enregistré des poids moyens de 24,904 mg, 24,672 mg et 24,574 mg
respectivement à la 1ère, à la
2ème et à la 3ème ponte (tableau 6
et figure 24). Par ordre d'abondance, les pupes dont le poids est
inférieur à 25 mg représentent 47,089% pour les
témoins et 47,5 % pour les traitées, ensuite celles dont le poids
est supérieur à 25 mg représentent 38,004 % pour les
témoins et 38,85 % pour les traitées et enfin les pupes au poids
égal à 25 mg représentent 14,91% pour les témoins
et 13,78% pour les traitées (tableau 7 et figure 25).
Tableau 7 : Statistiques descriptives des
poids des pupes
|
JP
|
Colonie
|
Traitement
|
Taux de pupes au
poids < 25 mg (%)
|
Taux de pupes au
poids = 25 mg (%)
|
Taux de pupes au
poids > 25 mg (%)
|
|
109
124
137
|
1ère
colonie
2ème
colonie
3ème
colonie
|
Témoins Traitées Témoins Traitées
Témoins Traitées Tous les témoins Tous les
traités
|
44,659 43,028 44,527 46,192 52,081 53,269
46,46
46,77
|
13,775 16,380 17,263 14,668 13,684 10,300
15,06
14,22
|
41,566 40,593 38,210 39,536 34,236 36,431
38,48
39,16
|
JP = jours post-traitement
|
poids
moyen des
pupes (mg)
|
25 24,8 24,6 24,4 24,2 24
|
|
TE1 TE2 TE3 TR1 TR2 TR3
Colonies de traitement
38
Figure 24 : Evolution des poids moyens des
pupes en fonction des ordres de ponte
|
Taux de pupes
par classe de
poids (%)
|
60 50 40 30 20 10 0
|
|
Taux de pupes au poids < 25 mg
Taux de pupes au poids = 25 mg
Taux de pupes au poids > 25 mg
|
39
TE1 TE2 TE3 TR1 TR2 TR3
Colonies de traitement
Figure 25 : Proportions des pupes par classe
de poids
TE1 : pupes témoins de la
1ère ponte TE2 : pupes témoins de la
2ème ponte TE3 : pupes témoins de la
3ème ponte TR1 : pupes traitées de la
1ère ponte TR2 : pupes traitées de la
2ère ponte TR3 : pupes traitées de la
3ème ponte
3.2.2. La viabilité des glossines-filles
Une analyse de survie a été
réalisée sur les émergences afin d'étudier l'effet
du fipronil 1% sur la descendance des glossines qui ont fait l'objet du test
sur leur fécondité. Les données de survie,
analysées avec le logiciel R 3.0.3 par le test de Wilcoxson, ont
révélé que le fipronil 1% n'a pas d'effet sur la survie
des glossines-filles (p = 0,031 au seuil de signification 10-2). En
effet, les résultats obtenus sur les différents paramètres
de survie ne présentent pas de différences significatives entre
les deux groupes de traitement (tableau 8 et figure 26).
Tableau 8 : Estimateur de Kaplan-Meier de la
fonction survie des glossines-filles
Paramètres de survie Traitement
Témoins Traitées
Durée moyenne de vie 7,29 jours 7,41
jours
Médiane de survie ou temps létal 50
7 jours 7 jours
Risque relatif de mortalité 1
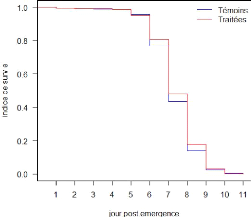
40
Figure 26 : Courbes de survie globale des
glossines filles
Des analyses réalisées sur chaque colonie ont
également montré qu'il n'y a pas de différences
significatives entre les durées de vie des deux groupes de traitement (p
= 0,00641, p = 0,128 et p = 0,705 respectivement pour la
1ère, la 2ème et la 3ème
colonie). En effet, les témoins et les traitées de la
première colonie ont vécu en moyenne respectivement 6,85 jours et
7,16 jours, ceux de la deuxième colonie 7,21 jours et 7,32 jours et ceux
de la troisième colonie 7,88 jours et 7,76 jours. Aussi, leur indice de
survie était presque similaire tout au long de leur durée de vie
(figure 27).
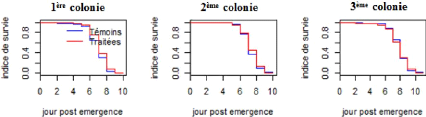
Figure 27 : Courbes de survie des trois
colonies glossines-filles
Pour l'ensemble des glossines suivies, la durée
maximale de vie était de onze (11) jours. Il y a aussi que 33,47 % de
témoins et 32,97 % de traitées ont vécu jusqu'au
7ème jour de leur émergence, puis 29,27 % de
témoins et 30,11 % de traitées ont vécu jusqu'au
8ème jour de leur émergence (figure 28).
|
Taux de
mortalité (%)
|
40 35 30 25 20 15 10 5 0
|
|
temoins traitées
1 2 3 4 5 6 7 8 9 10 11
Jours post émergences
41
Figure 28 : Evolutions comparées des
taux de mortalités en fonction des jours post-
émergence
42
IV. DISCUSSIONS
4.1. L'efficacité et la ré anence du fipronil
1% sur la survie des glossines
L'étude menée au laboratoire a montré que
le fipronil 1% appliqué au bétail par traitement
épicutané a un effet significatif sur la survie des glossines (p
? 0,01), en leur causant une mortalité massive (40%) dès
soixante-douze heures que celles-ci aient été gorgées sur
un animal traité. Il réduit considérablement la
durée moyenne de vie des glossines en entrainant leur mort
précoce ; cette réduction étant estimée à
49,5%. Son temps létal 50 est de 51 jours pour des glossines
s'étant alimentées 02 fois sur un animal traité, ce qui
signifie que du 1er au 51ème jour après le
traitement, le fipronil 1% a pu éliminer 50% de la population de
glossines utilisée.
Au laboratoire, les glossines vivent dans des conditions
climatiques optimales de température et d'hygrométrie relative et
sont à l'abri de tout prédateur. Elles sont nourries tous les
jours alors que dans la nature le nombre de repas hebdomadaires est plus proche
de deux (Ripert et al., 1996). Dans la nature, ces glossines
n'auraient peut-être pas survécu (Lefèvre et al.,
2003) ou survivraient moins. Par ailleurs, la fréquence à
laquelle les animaux ont été soumis au lavage est bien
supérieure à la réalité, ce qui peut conduire
à la diminution plus rapide de l'effet du produit. On pourrait donc
penser qu'en conditions réelles (dans la nature), le taux de
mortalité serait bien supérieur à celui observé au
laboratoire.
L'action létale du fipronil 1% est beaucoup plus forte
soixante-douze heures après le gorgement des glossines, donc bien
supérieure à celle sur les puces et les tiques chez lesquelles
elle est de vingt-quatre heures. (
http://www.fluoridealert.org/pesticides/lufenuron.fipronil.pets.htm).
Cependant, des mortalités n'ont pas été
observées dans l'intervalle de quatre heures de temps après
l'ingestion du sang traité. Le fipronil 1% n'a donc aucun effet
'Knock Down», mais tue lentement, confirmant ainsi les
résultats de Petit (2002).
La courbe de survie des glossines témoins initiales
(figure 14) présente une phase ascendante dans les vingt premiers jours
post-traitement. La même situation est constatée dans la figure
20. Cela s'explique par le fait qu'au début de nos expériences,
les conditions climatiques n'étaient pas totalement maitrisées
dans la salle de manipulation, ce qui a dû impacter sur la survie des
glossines.
La comparaison des indices de survie des glossines
traitées initiales et des traitées survivantes montre que les
mortalités sont élevées au niveau des initiales (46%)
contre 42% pour les
43
survivantes. Toute chose qui vient confirmer l'idée
selon laquelle l'efficacité du fipronil 1% diminue avec le temps
post-traitement.
Si à quarante-cinq (45) jours post-traitement, les taux
de survie des deux groupes (témoin et traité) de glossines
initiales sont significativement différents (p < 0,01), ils ne le
sont plus à cinquante et un (51) jours (p = 0,193 au seuil de
10-2), bien que ceux des témoins soient toujours
légèrement supérieurs. On pourrait donc situer la
rémanence du fipronil 1% sur les glossines aux alentours de cinquante et
un (51) jours dans cette première phase de quinze jours suivi.
Le suivi des survivantes a également montré
qu'autour du 74ème jour du temps post-traitement les effets
du fipronil 1% sur la survie des traitées et des témoins ne sont
pas significativement différents (p = 0,005 au seuil de
10-2). La rémanence du fipronil 1% dans cette seconde phase
de suivi pourrait être située à soixante-quatorze (74)
jours.
En définitive, l'on pourrait estimer la
rémanence du fipronil 1% entre 51 jours et 74 jours quand on sait que
dans la nature les glossines peuvent s'alimenter plus d'une fois sur des
animaux traités. Cette rémanence est acceptable comparativement
à d'autres insecticides tel
que la deltaméthrine, le fluméthrine,
l'alpha-cyperméthrine et l'amitraze qui ont
respectivement des
rémanences de trente (30) jours, vingt (20) jours, vingt-cinq (25) jours
et trois (03) jours (Bouyer et al., 2004). Ces rémanences
comparées à celle du fipronil 1% confirment l'efficacité
de celui-ci et pourraient susciter l'acceptation du fipronil 1% par les
communautés d'éleveurs.
Selon Challier et Laveissière (1978), la lutte par
application d'insecticides doit se faire de telle sorte que l'insecticide
présente une activité rémanente d'au moins deux mois. La
durée de deux mois est déterminée par la durée
maximale de la période du stade pupal. Il faut, en effet,
qu'après l'élimination de la fraction adulte de la population,
les individus qui éclosent des pupes déposées dans le sol
avant le traitement, trouvent, à leur éclosion, des
dépôts encore actifs d'insecticides. Ainsi, la rémanence
trouvée pour le fipronil 1% est satisfaisante dans la mesure où
elle convient aux assertions de Challier et Laveissiere (1978).
Laveissière et al. (2000) stipulent que :
« Pour qu'une glossine infectée puisse transmettre le trypanosome
à son tour, il faut qu'elle puisse survivre au moins 20 jours, temps
moyen pour que le parasite effectue son cycle chez l'insecte ».
En se basant sur cette affirmation de Laveissière et
al. (2000), nous pouvons dire que la durée moyenne de vie
obtenue pour les glossines traitées qui est de 15,15 jours est
satisfaisante en
44
ce sens que plus la longévité moyenne est faible
moins le taux de transmission des trypanosomes sera élevé.
4.2. L'effet du fipronil 1% sur la
fécondité des glossines
Les résultats obtenus ont montré que le fipronil
1%, testé sur les glossines femelles à partir du
92ème jour post-traitement, n'a pas d'effet sur les
performances de reproduction des glossines. Cela nous fait suggérer
trois hypothèses quant aux raisons de l'inefficacité du fipronil
1% sur la fécondité des glossines :
- hypothèse 1 : le fipronil 1% n'a effectivement pas
d'effet sur la fécondité ;
- hypothèse 2 : la période de réalisation
du test fût inappropriée (92ème jour
post-traitement) ; - hypothèse 3 : le mode d'alimentation des glossines
sur les animaux traités, mode qui ne favorise pas le contact direct
entre l'animal et la glossine.
Les deux dernières hypothèses semblent
être plus plausibles dans la mesure où les résultats du
test sur la survie ont révélé que la rémanence du
fipronil 1% est située entre cinquante et un et soixante-quatorze jours.
Ce qui signifie qu'à partir de cette période l'effet de
toxicité du fipronil 1% n'y était plus ou pas assez pour induire
une mortalité des glossines. Aussi, le test sur la survie a
également montré que le fipronil 1% agissait par contact. Cela a
été aussi constaté dans l'étude
réalisée par Petit (2002). Or, dans notre cas, aucun contact n'a
existé entre les glossines et l'animal ; elles s'alimentaient par
perforation d'un parafilm appliqué sur les animaux.
Cependant, on pourrait s'attendre à observer des effets
sur les paramètres de fécondité des glossines si :
- le test sur la fécondité avait
été entamé dès l'obtention du premier taux de
mortalité inférieur à 50% qui se situait entre le
45ème et le 51ème jour post-traitement ;
- le test sur la fécondité était
réalisé conjointement au test sur la survie, c'est-à-dire
qu'au bout des quinze premiers jours de suivi, utiliser les survivantes pour le
test sur la fécondité.
Si dans notre étude le fipronil 1% s'est
avéré inefficace, celle réalisée par Davey et
al., 1998, a par contre montré que le fipronil 1% a des effets
sur la fécondité des tiques (Boophilus microplus) chez
lesquelles le contrôle global de l'indice de reproduction est de 99,7% et
la réinfestation larvaire n'est possible pendant huit semaines
après le traitement.
Selon l'étude réalisée par Petit (2002),
l'effet du fipronil sur la pupaison est tel qu'il augmente la production des
pupes chez les glossines traitées. Par contre, il réduit les taux
d'émergences. Ces résultats n'ont pas été
constatés dans notre étude. Sur cette base, nous confirmons
45
davantage l'absence de l'effet du fipronil 1% à
92ème jour post-traitement sur la ponte et les
éclosions.
La même étude, qui n'a pas trouvé de
différences significatives entre les poids des pupes, a
révélé des poids moyens de 23,54 mg et 24,75 mg
respectivement pour des glossines (Glossina palpalis gambiensis)
témoins et traitées au fipronil par contact tarsal unique de 5
secondes. Or dans notre étude, nous avons obtenu 24,625 mg comme poids
moyen des pupes témoins et 24,717 mg pour les traitées. En
supposant qu'il n'y a pas de différences significatives entre ces deux
données, nous pouvons dire que nos résultats corroborent avec
ceux obtenu par Petit (2002).
4.3. L'effet du fipronil 1% sur la viabilité des
glossines-filles
Les analyses de survie des glossines-filles, dont les
émergences ont débuté à partir du
138ème jour post-traitement, n'ont
révélé aucun effet du fipronil 1% sur leur survie (p >
0,01). Ces résultats viennent davantage confirmer l'absence d'effet
constaté au niveau des performances de reproduction.
46
CONCLUSION ET PERSPECTIVES
Les résultats de la première phase de cette
étude ont montré que le fipronil 1% appliqué sur des
bovins affecte la longévité des glossines (Glossina palpalis
gambiensis). Ils mettent en exergue l'effet d'une dose létale du
fipronil 1% sur des glossines (Glossina palpalis gambiensis) se
nourrissant sur des bovins traités et confirment les effets de
l'insecticide fipronil déjà observés sur d'autres
arthropodes nuisibles (tiques) pour le bétail. Ces résultats
suggèrent deux idées :
- la première idée est que l'utilisation massive
du fipronil sur le terrain pourrait avoir un impact important sur la
transmission de la trypanosomose animale et de la maladie du sommeil en
contribuant à une réduction considérable de l'effectif des
glossines.
- la deuxième idée est que le fipronil 1% peut
constituer des moyens additionnels de lutte contre les trypanosomoses et
même contre d'autres maladies à vecteurs lorsque ces vecteurs ont
pour hôtes exclusifs ou occasionnels des animaux domestiques tels que les
bovins. Dans ces cas, des traitements périodiques (bimensuels) des
animaux au fipronil 1% à la dose de 0,1 ml/kg de masse corporelle
engendreraient une baisse notable de la transmission à travers une
réduction de la longévité de ces vecteurs.
Cependant, les résultats attendus à la seconde
phase de l'étude n'ont pas été atteints. En effet, les
tests réalisés sur la fécondité des glossines
à partir du 92ème jour post traitement ont
montré que le fipronil 1% n'a pas d'effet sur les performances de la
reproduction des glossines (pupaisons, éclosions et survie de la
descendance).
En guise de perspectives pour nos expériences
menées, nous préconisons que des études ultérieures
puissent :
V' appliquer cette étude en conditions de terrain afin
de prouver l'efficacité du fipronil 1% ;
V' être menées sur d'autres espèces de
glossines d'intérêt épidémiologique, notamment sur
les glossines du groupe Morsitans qui vivent dans des zones de savane où
il y a abondance de bétail.
47
BIBLIOGRAPHIE
Araujo F. R., Silva M. P., and Lopes A. A.,
1998. Severe cat flea infestation of dairy calves in Brazil.
Veterinary Parasitology, 1998, 80 (1), 83-86.
Atrevy F., 1978. Les glossines en
République Populaire du Bénin : importance pour l'élevage,
principe et méthodes d'éradication. Thèse de Doctorat
Vétérinaire, 1978. Ecole inter-Etats des sciences et
médecine vétérinaires de Dakar. 115 pages.
Bancé A.Z., Ouédraogo P.A. et
Dabiré R., 2006. Etude de la rémanence du triflumuron,
inhibiteur de la synthèse de la chitine, selon la nature du tissu
à l'égard de la mouche tsé-tsé Glossina
palpalis gambiensis, dans une perspective de lutte autocide. Tropicultura,
2006, 24, 1, 65-72.
Barbara G.S., Zube C., Rybak J., Gauthier M. and
Grünewald B., 2005. Acetylcholine, GABA and glutamate induce
ionic currents in cultured antennal lobe neurons of the honeybee, Apis
mellifera. J. Comp. Physiol. Springer-Verlag. A 191:823-836.
Bauer B., Kaboré I., Liebisch A., Meyer F. and
Petrich-Bauer J., 1992. Simultaneous control of ticks and tsetse flies
in Satiri, Burkina Faso, by the use of flumethrin pour-on for cattle.
Centre de Recherches sur les Trpanosomoses Animales (CRTA), Bobo-Dioulasso,
Burkina Faso.Trop. Med. Parasitol., 43, 41-46.
Bloomquist J. R., 1996. Ion channels as
targets for insecticides, Ann. Rev. Entomol., Web of Science. 41:163-190.
Bouyer J., 2009. La dispersion des glossines.
Insectes n°153 - 2009 (2). Institut national de la recherche agronomique
(INRA). 4 pages.
Bouyer J., Kaboré I., Stachurski F. et
Desquesne M., 2004. Lutte contre les ectoparasites des bovins.
Traitement épi cutané du bétail. Bobo-Dioulasso : centre
international de recherche-développement sur l'élevage en zone
subhumide (CIRDES). Fiche technique ; 12 pages
Bussieras J. et Chermette R., 1991.
Parasitologie Vétérinaire. Entomologie. Service de
Parasitologie. Ecole Nationale Vétérinaire d'Alfort: Maisons
Alfort. 163 pages.
Chadwick A.J., 1997. Use of a 0.25 per cent
fipronil pump spray formulation to treat canine cheyletiellosis. J. small Anim.
Prat., 1997, 38, 261-262.
Challier A. et Laveissiere C. 1973. Un
nouveau piège pour la capture des glossines (Glossina: Diptera,
Muscidae): description et essais sur le terrain. Cahiers ORSTOM. Série
Entomologie Médicale et Parasitologie, 11: 251-262.
Challier A. et Laveissiere C., 1978. La lutte
contre les vecteurs de la maladie du sommeil. A trypanosoma gambiense
dutton. Office de la recherche scientifique et technique outre-mer
(ORSTOM). Collection de référence. 7 pages.
Cole L. M., Nicholson R. A. and Casida J. E., 1993.
Action of phenylpyrazole insecticides at the GABA-gated chloride
channel. Pesticide Biochemistry and Physiology, 1993, Volume 46, Issue 1. 46
(1), 47-54.
Cox D. R., 1972. Regression models and life
table. Journal of the Royal Statistical Society, Series B 34: 187-202.
48
Cuisance D., 1989. Le piégeage des
tsé-tsé. Etudes et synthèses de l'Institut d'Elevage et de
Médecines Vétérinaires Tropicaux (IEMVT), n. 32.
Maisons-Alfort : Centre de coopération internationale en recherche
agronomique pour le développement (CIRAD), Montpellier (France). 172
pages.
Cuisance D., Barre N., DE Deken R., 1994.
Ectoparasites des animaux : méthodes de lutte
écologique, biologique, génétique et mécanique.
Rev. Scie. Techn. Off. Int. Epiz., 1994, 13 (4), 1305-1356.
Cuisance D., 1992. Impact sur l'environnement
de la lutte contre les tsé-tsé. Atelier sur les méthodes
de recherche en écologie des traitements anti-acridiens en Afrique, C.R.
de l'atelier CEE-CIRAD, Montpellier (France), nov. 1992, 109116.
Dagnogo M. et Gouteux J.P., 1983. Essai sur
le terrain de différents insecticides contre Glossina palpalis
(Robineau-Desvoidy) et Glossina tachinoides Westwood.1. Effet
répulsif de OMS 1998, OMS 2002, OMS 200, OMS 18 et OMS 570. Cahier
ORSTOM, sér. Ent. méd. Parasit., 1983, 21 (1), 29-34.
Davey R. B., Elmer H. Ahrens J. E., James G. S. Hunter
III and Jeannin P., 1998. Therapeutic and persistent efficacy of
fipronil against Boophilus microplus ( Acari: Ixodidae) on cattle.
Veterinary Parasitology (74) 1998 261-276.
Douthwaite R.J., 1992. Non targets effects of
insecticides used in tsetse control operations. (Les effets des insecticides
servant aux opérations de contrôle des mouches
tsé-tsé sur des non cibles). FAO, Revue animale mondiale. 70-71 :
8-14.
Geerts S. et Holmes P.H., 1998. Drug
management and parasite resistance in bovine trypanosomiasis in Africa.
PAAT Technical Sciences Series N?1, FAO, Rome (Italie). 31 pages.
Hamon H.M., Gamboa H. et Garcia M.J.E., 1996.
Le fipronil : une avancée majeure pour le contrôle du
charançon de la Colombie In : Actes Conférences coton Beltwide,
Nashville, Etats-Unis, vol 2, 9 au 12 jan, 1996. pp 990-994.
Hargrove J.W. and Langley P.A., 1990.
Sterilizing tsetse in the field : a successful trial. Bulletin of
Entomological Research / Volume 80 / Issue 04 / December 1990, pp 397-403.
Institut National de Recherche et de
Sécurité (INRS), 2012. Fiche toxicologique 286.
Fipronil. Edition 2012. Paris cedex. France. 8 pages.
Itard J., 1986. Les glossines ou mouche
tsé-tsé. CIRAD - Etudes et synthèses de l'EMVT.
Maisons-Alfort: Institut d'élevage et de médecine
vétérinaire des pays tropicaux.155 pages.
Janssen D., Derst C., Buckinx R., Van den Eynden J.,
Rigo J. M. and Van Kerkhove E., 2007. Dorsal unpaired median neurons
of Locusta migratoria express ivermectin-and fipronil-sensitive glutamate-gated
chloride channels. J. Neurophysiol. 97: 2642-2650.
Kaakeh W., Reid B.L. and Bennet G.W., 1997.
Toxicity of fipronil to german and american cockroaches. Entomologica
Experimentalis and Applicata, Kluwer Academic Publishers. Printed in Belgium.
1997, 84, 229-237.
Kaplan EL and Meier P., 1958. Non parametric
estimation from incomplete observations. Journal of the American Statistical
Association, Vol. 53, No. 282 (Jun., 1958), pp 457-81.
49
Lacombe J. P., 1993. Possibilités
d'utilisation du fipronil contre les Taupins. ANPP-Troisième
conférence internationale sur les ravageurs en agriculture. Montpellier
(France), déc. 1993, pp 7-9.
Lancien J. 1981. Description du piège
monoconique utilisé pour l'élimination des glossines en
République Populaire du Congo. Cahiers ORSTOM. Série Entomologie
Médicale et Parasitologie, 19:235-238.
Lancien J., 1991. Lutte contre la maladie du
sommeil dans le sud-est Ouganda par piégeage des glossines. ORSTOM. Ann.
Soc. Belg. Méd. Trop., 1991, 71 (Suppl.1), 35-47.
La Rocque S. et Cuisance D., 2005. La
tsé-tsé, une mouche singulière et dangereuse ! Institut
national de la recherche agronomique (INRA). Insectes 27 n°136 - 2005 (1).
5 pages.
La Rocque S. et Dia M. L., 2001. Les moyens
de lutte contre la trypanosomose animale. (3844) In Utilisation des
trypanocides en Afrique Sub-saharienne. Actes du séminaire sous
régional tenu du 06 au 09 février 2001. Dakar : École
Inter-États des Sciences et Médecine Vétérinaires
de Dakar (EISMV). 170 pages.
Laveissière C., Couret, D. et Kienon J.P.,
1980. Lutte contre les glossines riveraines à l'aide de
pièges biconiques imprégnés d'insecticides en zone savane
humide. Description du milieu, du matériel et de la méthode.
Cahiers ORSTOM,
sér. Ent. méd. et
Parasit., 1980, 18 (3), 201207.
Laveissière C., Couret D., Manno A. 1987.
Importance de la nature des tissus dans la lutte par piégeage
contre les glossines. Cahiers ORSTOM. Série Entomologie Médicale
et Parasitologie, 25(34) : 133-143.
Laveissière C., Grébaut P.
1990. Recherches sur les pièges à glossines (Diptera:
Glossinidae).Mise au point d'un modèle économique : Le
piège «Vavoua». Tropical Medicine and Parasitology, 41:185-
192.
Laveissière C., Grébaut P., Herder S. et
Penchenier L., 2000. Les glossines vectrices de la Maladie du Sommeil.
Institut de Recherche pour le Développement. Organisation de
Coordination pour la lutte contre les Endémies en Afrique centrale
(OCEAC), Yaoundé, Cameroun. 257 pages.
Leak, S. A., 1999. Tsetse biology and
ecology. Their role in the epidemiology and control of trypanosomosis. CABI
publishing, UK, 529 pages.
Lefevre P.-C., Blancou J. et Chermette R., 2003.
Principales maladies infectieuses et parasitaires du bétail.
Europe et régions chaudes : Maladies bactériennes. Mycoses.
Maladies parasitaires. Editions Médicales Internationales, Lavoisier,
2003 : Paris, 1695-1724.
Maillard J. C. et Provost A., 1975. Recherche
du pouvoir pathogène de Bacillus thuringiensis sur les glossines
(Diptera-Muscidae). Etude sur Glossina tachinoides en République du
Tchad. Revue d'Elevage et de Médecine vétérinaire des Pays
tropicaux, 1975, 28 (1) : 61-65.
Mawuena K. et Yacnambe S., 1988.
L'utilisation des pièges et écrans
imprégnés d'insecticide pour la lutte contre la trypanosomose
animale. Revue Elev. Méd. vét. Pays trop., 1988, 41 (1),
93-96.
50
Mérot P., Politzar H., Tamboura I, et Cuisance
D., 1984. Résultats d'une campagne de lutte contre les
glossines riveraines en Burkina par l'emploi d'écrans
imprégnés de deltaméthrine. Revue Elev. Méd.
vét. Pays trop., 1984, 37 (2), 175-184.
Mouhim A., Chihrane J. et Cherkaoui S., 1998.
Evaluation de la toxicité et de la rémanence du Fipronil
appliqué à faibles doses contre le Criquet marocain et sauteriaux
dans le massif de Siroua (Maroc). - Rapport de recherche du Centre national de
lutte antiacridienne (CNLAA). Maroc, 25 pages.
Mouhim A., Raji I. L., Cherkaoui S. et Ouzane M.,
1996. Effets du fipronil sur le criquet marocain (Dociostaurus
maroccanus) en association avec les sauteriaux et son impact sur les insectes
non-cibles. Rapport du Centre national de lutte antiacridienne (CNLAA). Maroc,
1996, 30 pages.
Mrad E., 2011. Les antiparasitaires externes
chez les carnivores domestiques. Thèse de doctorat en médecine
vétérinaire. Ecole nationale de médecine
vétérinaire de Sidi Thabet. 152 pages.
Petit L. M., 2002. Efficacité
comparée, en laboratoire, du fipronil et de la deltamethrine par contact
tarsal sur Glossina morsitans morsitans et Glossina palpalis
gambiensis. Thèse : 2002 - TOU 3 - 4116. Ecole nationale
vétérinaire de Toulouse (France). 95 pages.
Pollock J.N., 1992. Biologie,
systématique et répartition des tsé-tsé. Manuel de
lutte contre la mouche tsé-tsé, volume 1. FAO. Rome (Italie). 310
pages.
Pollock J.N., 1996. Ecologie et comportement
des tsé-tsé. Manuel de lutte contre la mouche
tsé-tsé volume 2. FAO. Rome (Italie). 117 pages.
Pollock J. N., 1982. Training manual for
tsetse control personnel. Volume I. Tsetse biology, systematics and
distribution; techniques. FAO. Rome (Italie). 274 pages.
Postal J.M., Jeanin P. and Consalvi P.J., 1995.
Field efficacy of a mechanical pump spray formulation containing 0.25%
fipronil in the traitement and control of flea infestation and associated
dermatological signs in dogs and cats. Vet. Dermatol., 1995, 6, 153-158.
Ramesh C., 2007. Insecticides and
molluscides. Veterinary Toxicology. Elsevier Science. 502 pages.
Rayaissé J. B., 2011. Development of
tools to control Palpalis group tsetse flies in West Africa. Thèse
présentée à la Faculté des Sciences. Institut de
Biologie de l?Université de Neuchâtel. 142 pages.
Ripert C., Pajot F -X., Vincendeau P. et Gomez E. F.,
1996. Epidémiologie des maladies parasitaires. Protozooses et
helminthoses, réservoirs, vecteurs et transmission. Tome 1. Protozooses.
Editions Médicales Internationales, 1996. 393 pages.
Scott J. G. and Wen Z., 1997. Toxicity of
fipronil to susceptible and resistant strains of german cockroaches
(Dictyoptera: Blattellidae) and house flies (Diptera: Muscidae). Journal of
Economic Entomology, 1997, 90 (5), 1152-1156.
Verdier C. J., 2005. Etude
expérimentale des effets de la moxidectine sur Glossina palpalis
gambiensis et Glossina morsitans morsitans. Thèse : 2005 -
TOU 3 - 4032. 175 pages.
51
SITES INTERNET CONSULTES
CBIPvet. Folia veterinaria 2014 n°1 (a).
URL :
http://www.cbip-
vet.be/fr/frinfos/frfolia/14FVF1a.php
(consulté le 25 juin 2014).
Fluoride Action Network. Lufenuron and Fipronil.
Current Uses in Pets. URL :
http://www.fluoridealert.org/pesticides/lufenuron.fipronil.pets.htm
(consulté le 25 juin 2014).
R Development Core Team, 2014. R: A language and
environment for statistical computing. R Foundation for Statistical Computing,
Vienna, Austria. ISBN 3-900051-07-0, URL:
http://www.R-project.org
(consulté le 15 juillet 2014).
A
ANNEXES
B
Annexe 1 : Tables de survie
Description détaillée de l'estimateur de
Kaplan-Meier de la fonction survie des différentes colonies de glossines
initiales
|
Colonies
|
Colonie 1
|
Colonie 2
|
Colonie 3
|
Colonie 4
|
Colonie 5
|
Colonie 6
|
Colonie 7
|
Colonie 8
|
Colonie 9
|
|
Période de lâcher (jour post traitement)
|
7
|
10
|
16
|
24
|
45
|
51
|
60
|
62
|
64
|
|
Traitement
|
TE
|
TR
|
TE
|
TR
|
TE
|
TR
|
TE
|
TR
|
TE
|
TR
|
TE
|
TR
|
TE
|
TR
|
TE
|
TR
|
TE
|
TR
|
|
Durée moyenne de vie (jours)
|
9,256
|
0,195
|
13,278
|
3,728
|
12,373
|
5,063
|
14,230
|
6,784
|
14,072
|
10,562
|
14,276
|
12,885
|
14,222
|
13,633
|
14,340
|
14,112
|
14,57
|
14,24
|
|
Indice de survie
|
0,46
|
0
|
0,85
|
0,13
|
0,78
|
0,26
|
0,91
|
0,33
|
0,88
|
0,55
|
0,89
|
0,83
|
0,92
|
0,88
|
0,91
|
0,90
|
0,94
|
0,92
|
|
p
|
< 0,01
|
< 0,01
|
< 0,01
|
< 0,01
|
< 0,01
|
0,193
|
0,32
|
0,759
|
0,568
|
|
Médiane de survie (jours post lâcher)
|
10
|
0,25
|
ID
|
2
|
ID
|
2
|
ID
|
3
|
ID
|
15
|
ID
|
ID
|
ID
|
ID
|
ID
|
ID
|
ID
|
ID
|
|
Risque relatif de mortalité
|
1,85
|
5,8
|
3,36
|
7,44
|
3,75
|
1,55
|
1,5
|
1,11
|
1,33
|
Description détaillée de l'estimateur de
Kaplan-Meier de la fonction survie des différentes colonies de
survivantes
|
Colonies
|
Colonie 1
|
Colonie 2
|
Colonie 3
|
Colonie 4
|
Colonie 5
|
Colonie 6
|
Colonie 7
|
Colonie 8
|
|
Période de lâcher (jour post traitement)
|
26
|
31
|
39
|
61
|
69
|
74
|
76
|
81
|
|
Traitement
|
TE
|
TR
|
TE
|
TR
|
TE
|
TR
|
TE
|
TR
|
TE
|
TR
|
TE
|
TR
|
TE
|
TR
|
TE
|
TR
|
|
Durée moyenne de
vie (jours)
|
13,634
|
7,167
|
13,669
|
4,020
|
14,307
|
4,172
|
14,092
|
3,080
|
14,061
|
9,046
|
14,359
|
11,701
|
14,174
|
12,663
|
14,256
|
13,378
|
|
Indice de survie
|
0,82
|
0,33
|
0,87
|
0,20
|
0,85
|
0,14
|
0,90
|
0,08
|
0,88
|
0,50
|
0,88
|
0,71
|
0,88
|
0,80
|
0,88
|
0,87
|
|
p
|
< 0,01
|
< 0,01
|
< 0,01
|
< 0,01
|
< 0,01
|
0,005
|
0,111
|
0,738
|
|
Médiane de survie (jours post lâcher)
|
-
|
3
|
-
|
1
|
-
|
1
|
-
|
1
|
-
|
15
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Risque relatif de mortalité
|
3,72
|
6,15
|
5,73
|
9,2
|
4,17
|
2,42
|
1,67
|
1,08
|
C
Description détaillée de l?estimateur de
Kaplan-Meier de la fonction survie des différentes colonies de glossines
filles
|
Colonies
|
|
Colonie 1
|
|
Colonie 2
|
|
Colonie 3
|
|
Début des émergences / jour post traitement
|
|
107
|
|
153
|
|
167
|
|
Traitement
|
TE
|
|
TR
|
TE
|
|
TR
|
TE
|
|
TR
|
|
Durée moyenne de vie (jours)
|
6,85
|
|
7,16
|
7,21
|
|
7,32
|
7,88
|
|
7,76
|
|
P
|
|
0,00641
|
|
0,128
|
|
0,705
|
Annexe 2 : Synthèse des données brutes de
fécondité
|
Colonie
|
Traitement
|
Ordre
de
pontes
|
Taux de
ponte
(%)
|
Taux de pupes
mal formées
(%)
|
Taux
d'avortons
(%)
|
Poids
moyen
(mg)
|
Taux de pupes
au poids < 25
mg
|
Taux de pupes
au poids = 25
mg
|
Taux de pupes
au poids > 25
mg
|
Taux
d'éclosions
(%)
|
|
1ère
|
Témoins
|
1ère
|
88,298
|
0
|
0
|
25,458
|
38,554
|
13,253
|
48,193
|
98,795
|
|
1ère
|
Traitées
|
1ère
|
77,083
|
0
|
0
|
24,973
|
41,892
|
13,514
|
44,595
|
97,297
|
|
1ère
|
Témoins
|
2ème
|
90,217
|
0
|
0
|
23,904
|
55,422
|
18,072
|
26,506
|
100
|
|
1ère
|
Traitées
|
2ème
|
91,398
|
0
|
0
|
24,965
|
40
|
17,647
|
42,353
|
100
|
|
1ère
|
Témoins
|
3ème
|
98,901
|
0
|
0
|
25,222
|
40
|
10
|
50
|
97,778
|
|
1ère
|
Traitées
|
3ème
|
97,802
|
0
|
0
|
24,775
|
47,191
|
17,978
|
34,831
|
98,876
|
|
2ème
|
Témoins
|
1ère
|
84,536
|
0
|
0
|
24,512
|
43,902
|
21,951
|
34,146
|
100
|
|
2ème
|
Traitées
|
1ère
|
95,789
|
0
|
0
|
24,297
|
57,143
|
13,187
|
29,67
|
100
|
|
2ème
|
Témoins
|
2ème
|
96,907
|
0
|
0
|
24,809
|
42,553
|
14,894
|
42,553
|
98,936
|
|
2ème
|
Traitées
|
2ème
|
91,304
|
0
|
1,19
|
25,667
|
33,333
|
13,095
|
54,762
|
97,619
|
|
2ème
|
Témoins
|
3ème
|
94,565
|
0
|
0
|
24,69
|
47,126
|
14,943
|
37,931
|
95,402
|
|
2ème
|
Traitées
|
3ème
|
88,764
|
0
|
0
|
24,051
|
48,101
|
17,722
|
34,177
|
100
|
|
3ème
|
Témoins
|
1ère
|
95,349
|
0
|
0
|
24,11
|
51,22
|
17,073
|
31,707
|
100
|
|
3ème
|
Traitées
|
1ère
|
94,318
|
0
|
0
|
23,88
|
63,855
|
10,843
|
25,301
|
96,386
|
|
3ème
|
Témoins
|
2ème
|
80
|
0
|
0
|
24,426
|
52,941
|
10,294
|
36,765
|
98,529
|
|
3ème
|
Traitées
|
2ème
|
95,349
|
0
|
0
|
25,268
|
42,683
|
9,756
|
47,561
|
98,780
|
|
3ème
|
Témoins
|
3ème
|
96,341
|
0
|
0
|
24,494
|
48,101
|
11,392
|
40,506
|
97,468
|
|
3ème
|
Traitées
|
3ème
|
91,566
|
0
|
0
|
25,575
|
30,263
|
11,842
|
57,895
|
100
|
D
Annexe 3 : Scripts des analyses des analyses de survie
sur R 3.0.3
######################## STATISTIQUES DESCRIPTIVES
#########################
surv<-read.table("survie.boureima.txt",header=T,dec=",")
summary(surv)
attach(surv)
table(jour.post.traitement)
surv2<-subset(surv,mort==1)
summary(surv2)
attach(surv2)
tapply(jour,traitement,mean)
######################## COURBES DE SURVIE
#################################
library(survival)
attach(surv)
model<-survfit(Surv(jour,mort)--traitement)
plot(model,ylab="indice de
survie",xlab="jour",col=c("blue","red"),axes=F)
box()
axis(1,at=c(1,2,3,4,5,6,7,8,9,10,11,12,13,14,15),label=c(1,2,3,4,5,6,7,8,9,10,11,12,13,14,15))
axis(2,las=1)
legend("topright",c("Témoins",
"Traitées"),col=c("blue","red"),bty="n",lty=c(1,1))
library(ggplot2)
none <- element_blank()
ggplot(surv,aes(x=jour.post.traitement,y=jour,fill=traitement,colour=traitement))+coord_cartesian()+stat_smoot
h()+theme(panel.grid.major = none,panel.grid.minor = none)+
theme(panel.background = none) + theme(panel.border = none) + theme(axis.line =
element_line(colour = "grey50"))
####################### ANALYSE STATISTIQUES ####
mod1<-coxph(Surv(jour,mort)--traitement*jour.post.traitement)
summary(mod1)
mod2<-coxph(Surv(jour,mort)--traitement)
summary(mod2)
####################### TEST DE WILCOXSON ######
library(survival)
attach(surv)
survdiff(Surv(jour.post.emergence,mort==1)--traitement,rho=1)
E
Annexe 4 : Résumé du test t de Student
sur les variables de fécondité
|
Tests t
Effets significatifs marqués à p <
0,05
Groupe 1: Témoins Groupe 2: Traitées
|
|
Moyenne
Témoins
|
Moyenne
Traitées
|
Valeur t
|
p
|
Ecart-type
Témoins
|
Ecart-type
Traitées
|
|
Taux de ponte (%)
|
91,679
|
91,486
|
0,066
|
0,948
|
6,364
|
6,085
|
|
Taux de pupes mal
formées (%)
|
00
|
00
|
-
|
|
00
|
00
|
|
Taux d'avortons (%)
|
00
|
0,132
|
-1
|
0,332
|
00
|
0,397
|
|
Poids oyen d'une
pupe (mg)
|
24,625
|
24,717
|
-0,824
|
0,422
|
0,493
|
0,682
|
|
Taux de pupes au
poids < 25 mg
|
46,647
|
44,940
|
0,421
|
0,680
|
5,851
|
10,669
|
|
Taux de pupes au
poids = 25 mg
|
14,652
|
13,954
|
0,418
|
0,682
|
3,940
|
3,109
|
|
Taux de pupes au
poids > 25 mg
|
38,701
|
41,238
|
-0,565
|
0,580
|
7,571
|
11,133
|
|
Taux d'éclosions (%)
|
98,545
|
98,773
|
-0,334
|
0,743
|
1,508
|
1,380
|
F
Annexe 5 : Fiches de collecte des données Fiche 1
: suivi de la survie (1er test)
|
ANIMAL N°..... LACHER N°
CAPTURE : GORGEES = .... NON GORGEES = ...
|
|
Traitement
|
Date de suivi
|
Jour post traitement
|
Nombre de morts
|
Nombre de vivants
|
Nombre de gorgées mortes
|
Nombre de non gorgées mortes
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fiche 2 : suivi de la survie
(2ème test)
Date d?émergence : Effectif initial des
émergences : ...
|
Date de suivi
|
Jour post émergence
|
Traitement
|
Nombre de morts
|
Nombre de vivants
|
G
Fiche 3 : suivi des pontes Pontes de la colonie
.....
Date d'accouplement : ....
Identités des boeufs : Témoins = ... ;
Traités = ...
|
Date de suivi
|
Effectif
|
Traitement
|
Ordre de pontes
|
Nombre de pupes pondues
|
Nombre de pupes mal formées
|
Nombre d'avortons
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fiche 4 : suivi des émergences Emergences
de la colonie ....
Date d'accouplement : ....
Identités des boeufs : Témoins = ... ;
Traitées = ... Ordre de ponte : ...
Nombre initial de pupes : témoins = ... ; traitées
= ...
|
Date
émergence
|
Effectif des
pupes
|
Traitement
|
Nombre de pupes
écloses/émergences
|
Nombre de pupes
non écloses
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H
Fiche 5 : suivi des pesées
Date de pesée :
Colonie : .
Traitement :
Ordre de pontes : .
|
N°
|
Poids individuel (mg)
|
Nombre de pupes par classe de poids
|
Poids moyen
d?une pupe
|
|
? 25 mg
|
= 25 mg
|
> 25 mg
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 


