|
DEDICACE
A nos chers parents Timothée MBIYAVANGA NZINUNU et
Jacqueline KIAMANGA ;
A tous nos frères et soeurs, cousins et cousines, neveux
et nièces pour votre apport moral et matériel, que ce travail de
fin d'études de graduat soit pour vous un motif de fierté et
d'honneur.
REMERCIEMENTS
Qu'il nous soit permis d'exprimer nos sentiments de profonde
gratitude à tous ceux qui ont contribué de près ou de loin
à la réalisation de ce travail, considéré à
juste titre comme la première phase de mes futures recherches.
Nous pensons aux autorités académiques et
à tout le corps enseignant de la Faculté des Sciences
Agronomiques de l'Université Pédagogique Nationale pour leur
encadrement et conseils durant notre parcours universitaire.
Nous remercions particulièrement le Chef de Travaux
INKABANGA TSEKE Alain, qui a bien voulu assurer la direction de ce travail avec
beaucoup de dévouements.
Ce même sentiment est présenté à
nos compagnons de lutte : MBANZA MPEMBELE Nerly, LUNGU MBUMI Glody, MIKA
KIPOY David, BOSANJA LIAMBI Faradja, MAZAMBA MOLIKI Alex, à NDENGILA
NSANSI Djeson pour leur esprit de sacrifice et contribution dans la
réalisation de ce travail.
Ce prélude paraitrait insuffisant si seulement si nous
omettions de remercier notre famille en général et en particulier
nos frères et soeurs dont Bienvenu MBIYAVANGA, Sarah MBIYAVANGA, Caleb
MBIYAVANGA, Eveline DIASONAMA, Adam MBIYAVANGA, Abel NZINUNU,
Ézéchiel MBIYAVANGA pour ce qu'ils veulent que nous soyons en
devenir, nous ne vous oublierons jamais.
Que toutes les personnes non citées mais ayant
contribué moralement, financièrement ou matériellement
à notre formation universitaire, soient bénies de l'Eternel Dieu,
maitre de temps et de circonstances.
MBIYAVANGA NZINUNU Michel
INTRODUCTION
Dans les pays en voie de développement ou sous
développé, la plupart de la population produit sa propre
nourriture et son alimentation en dépend. Les cultures produites dans
ces pays, permettent d'accéder à un revenu.Il est souvent
observé que les herbivores et diverses maladies peuvent dans des cas
sévères réduire les rendements à zéro et
occasionner l'abandon de la culture.
Les maladies virales ont déjà causé en
agriculture des pertes catastrophiques, tel que le cas de la feuilleblanche du
riz, la tristeza du citrus,la mosaïque du manioc et plusieurs autres
maladies causées par des virus (Ploetz, 2004).
Le transfert de ces virus est assuré par
différents organismes(lespucerons, les nématodes, les aleurodes,
les cicadelles, la mouche blanche etc.).Notre travail se focalise sur
Bemisia tabaci, appelé vulgairement mouche blanche. En moins de
dix ans, il est passé de ravageur secondaire àl'un de principaux
ravageursagricoles.
Bemisia tabaci estdevenu une sérieuse menace
qui préoccupe de plus en plus les producteurs agricoles dans le monde
entier. Mis à côté les dégâts trophiques
directs, l'insecte véhicule de nombreux virus sur différentes
cultures. Le rendement est amoindri car,la fonction photosynthétique et
la qualité des produits récoltés sont affectéespar
l'excrétion du miellat (Lida et al.,2009).
Certes, l'usage d'insecticidesde synthèse peut
réduire les pertes. Pourtant, dans nosrégions tropicales, il ya
peu d'insecticides efficaces disponibles. A ceci, s'ajoute le problème
du développement de la résistance de B. tabaci à
ces produits et dans le cas de petits producteurs, le coûtest trop
élevé (Nunes, 2006).
Face à ces nombreux ravageurs de plus en plus
résistants aux traitementsordinaires et aussila plus part d'insecticides
synthétiques ont des effets néfastes pour la santé
publique et l'environnement. Danscette optique, en vue de contribuer à
une gestion durable de l'environnement, il est préférable
d'utiliser les extraits de plantes dotées d'activités
insecticidesqui offrent une certaine potentialité de contrôle de
ces ennemis des cultures (Gomez et al., 1997).
De nombreuses plantes fournissent les insecticides naturels,
mais leurs étendues et leurs actions sont souvent spécifiques, ce
qui nous apoussé de centrer ces recherches sur l'usagedu neem
(Azadirachta indica).
Divers travaux ont mis en évidence les effets des
extraits de neem sur les ravageurs phytophages et auxiliaires agricoles ;
entre autres, Efficacité des extraits d'Azadirachta indica A.
Juss dans la conservation de Zeamays (L) et Vignaunguiculata
(L) Walpers. (BIBASUYA, 2014), Essai de tolérance des auxiliaires
agricoles aux biopesticidesà base de neem (Azadirachta indica
A. Juss) (LOKANDO, 2015). Ces études recommandent l'utilisation de
biopesticide à base de neem.
Le but de cette étude est de procéder au
contrôle de B. tabaci par l'utilisation des divers extraits de
neem (feuilles, graines et écorces) et d'établir une comparaison
d'effets par rapport au pesticide de synthèse (deltaméthrine)
face à ce même insecte.
Le dispositif complètementrandomisé a
été utilisé avec 3 extraits (feuilles, graines et
écorces) et unpesticide desynthèse (deltaméthrine) ont
constitué les traitements en dehors du témoin, en 4
répétitions soumis aux B. tabacicapturés sur les
plantes infectées et placés dans des bocaux.
Hormis l'introduction et la conclusion, ce travail comprend
trois chapitres. Le premier chapitre est axé aux
généralités sur Bemisia tabaci,
Azadirachtaindica etles pesticides ; le deuxième aborde le
milieu, les matériels et les méthodes
utilisés.Lesrésultats et leursinterprétations constituent
le troisième et dernier chapitre.
CHAPITRE I : GENERALITES SUR
BEMISIA TABACI, NEEM ET PESTICIDES
I.1. Bemisia tabaci et sa vie
I.1.1. Biologie de l'insecte
B. tabaci est un insecte homoptère de la
famille des Aleyrodidae, dont les membres sont communément
appelés mouches blanches en raison du dépôt cireux blanc
qui recouvre entièrement le corps et les ailes de l'adulte.
Les aleyrodidae ont un
développementnéométabole. Les oeufs sont pondus par les
femelles de façon dispersée à la surface inférieure
des feuilles. Ils sont accrochés au travers de l'épiderme
foliaire dans le mésophile, par un pédicelle (Gnankinéet
al., 2007).
Environ 1200 espèces de mouches blanches ont
été décrites, mais peu affectant les productions
agricoles. En terme économique, deux espèces sont
importantes ; Trialeurodesvaporariorum (Westwood) et Bemisia
tabaci (Brown, 1994).
Après l'éclosion,on a 4 stades larvaires,
séparés par des mues successives. Le premier est le seul mobile,
sa mobilité étant toutefois très réduite : la
larve rampe sur la feuille à la recherche d'un site nourricier
adéquat où elle se fixe et oùaura lieu tout le reste du
développementlarvaire. Les stades suivants s'accompagnent d'un
grossissement de larve et de quelques changements morphologiques. Le dernier
stade larvaire peut - êtrefacilement distingué du stade pupal bien
qu'aucune mue ne les sépare, notamment parce que les yeux rouges
deviennent beaucoup plus grand. L'adulte émerge d'une ouverture
médiane en forme de T dans la partie antérieure du puparium,
laissant sur la feuille une exuvie caractéristique de l'espèce
(Burban, 1991).
Contrairement à d'autres insectes, Bemisia
tabaci est une espèce difficile à identifier à cause
du manque de caractères morphologiques clairs et des variantesintra
spécifiques.Conséquemment, B. tabaciétait
considéré comme un complexe d'espèces (Nunes, 2006).
I.1.2.Reproduction et cycle de
vie
Cet insecte a une durée dedéveloppement
larvairetrès variable, dueprincipalement auxconditions climatiques et la
plante hôteconsidérée.L'accouplement a lieu sur la plante
hôte, de quelques heures à quelques jours
aprèsl'émergence des adultes.Les femelles fécondées
ont une descendance bisexuée tandis que les femelles vierges ont une
descendance uniquement mâle.
La fécondité de l'insecte varie de 20 à
plus de 400 oeufs selon le lieu et les conditions d'expérimentation. Le
cycle de vie de B. tabaci varie entre 1 et 2 mois.
La rapidité du développement et la
féconditéélevée sont deux facteurs importants dans
le statut de ravageurs et du vecteur B. tabaci.
Dans les pays tropicaux, les densités de populations de
B. tabaci sont en
généraltrèsélevées car le potentiel
reproductif optimal de B. tabacien considérant le facteur
thermique se situe entre 20 -30°C.
Étant un homoptèrepaurométabole, son
cycle de vie passe par un stade d'oeufs, un faux stade pupal et le stade
d'insecte adulte. Contrairement aux oeufs de T. vaporariorum de
couleur noir, ceux de B. tabaci sont d'une couleur vert jaunâtre
(Nunes, 2006).
I.1.3. Distribution
B. tabaci est très largement répandue
dans les zones tropicales et subtropicales, sur tous les continents (Lepoivre,
2001).
1.1.4. Plantes hôtes
Plus de 500 espèces de plantes appartenant à 74
familles différentes ont été recensées comme
hôte de B. tabacide par le monde. Les familles les plus
représentées sont les Légumineuses, Compositeae,
Malvaceae, Solanaceae, Euphorbiaceae, Convolvulaceae et Cucurbitaceae. Parmi
les plantes cultivées colonisées, nous pouvons citer l'aubergine,
le cotonnier, le gombo, le manioc, le niébé, la patate douce, le
tabac, la tomate, etc.(Nunes, op. cit).
I.1.5. Importance
économique
Son rôle majeur reste cependant lié à son
aptitude de vecteur de maladies virales des plantes. Plus de 19 virus ainsi que
de nombreuses maladies d'étiologie inconnue sont transmis par B.
tabaci. Ces virus appartiennent majoritairement aux groupes des
Geminivirus.
D'après Burban (1991), Les pertes de rendement dû
à ces maladies virales sont parfois considérables. On peut citer
l'exemple de mosaïque africaine du manioc, dont la perte de rendement est
d'environ 40% à l'échelle du continent africain. Il manque
cependant dans bon nombre de cas des données quantitatives sur les
pertes de rendement.
I.1.6. Systématique
Cet insecte a été décrit pour la
première fois en Grèce en 1889 sur la culture du coton, par la
suite observé en Floride dans la même décennie, mais il n'a
été considéré comme un problème jusqu'en
1986 (Nunes, op. cit).
Il a été dit que B. tabaci est un
homoptère, ordre d'insectes comprenant plus de trente mille
espèces dotées de pièces buccales piqueuses-suceuses,
d'ailes strictement égales et membraneuses et se nourrissant de plantes.
Parmi les homoptères les plus connus, il faut citer les
pucerons, les cigales, les cicadelles et les cochenilles. Les homoptères
présentent une grande variété de tailles et de formes. La
plupart subissent des métamorphoses incomplètes. Nombreuses
espèces sont des ravageurs des cultures et des vergers (Asanzi et Ndju,
2015).
La position systématique de cette mouche blanche se
présente comme suite ;
v Règne : Animalia
v Phylum : Arthropoda
v Embranchement : Artropoda
v Sous - embranchement : Hexopoda
v Classe : Insecta
v Sous - classe : Pterygota
v Infra - classe : Neoptera
v Super - ordre : Hemipteroidea
v Ordre : Hemiptera
v Sous - ordre : Sternorhyncha
v Famille : Aleyrodidées
v Espèce : Bemisia tabaci ; Synonyme
B. gossypiperda
Source :Asanzi et Ndju, 2015
I.1.7. Anatomie
Lesailes sont minuscules, les adultes ayant de 1 à 3 mm
de long. Ils ont des pièces buccales piqueuses suceuses, deux paires
d'ailes semblables recouvertes d'une poussière cireuse blanche d'aspect
farineux, d'où leur nom tiré du grec, qui signifie
« farine de froment » qui recouvre également le
corps de l'imago, d'où le nom de mouches blanches (Deguine et
al.,, 2008).
I.1.8. Vol
Le B. tabaci organise deux types de vol :
1. Le migrateur:Où le déplacement deB.
tabacidépend des courants d'air élevé pour coloniser
de nouveaux champs. Ce type de vol permet à l'insecte de parcourir
jusqu'à 7km de son point d'origine.
2. Les vols courts faits à l'intérieur de la
parcelle, est dû à la vitesse de dissémination des
geminivirus dans les champs. Il semblerait que les mouvements à
l'intérieur de la parcelle seraient le principal moyen de
dissémination des épidémies virales (Cohen et Ben 1986,
cité par Nunes, 2006).
I.1.9.
Déprédation
Le B. tabaci peut agir sur son hôte de trois
manièresdifférentes. Se nourrissant dans le phloème, il
peut directement affaiblir ses plantes hôtes. Ses larves exsudent un
miellat collant qui peut diminuer la valeur de certaines récoltes, comme
dans le cas du coton (Burban, 1991).
En suçant le tissu des feuilles,les larves et les
adultes de B. tabaci peuvent directement causer des dommages, c'est ce
qui favorise l'affaiblissementde la plante, cette extraction de la sève
provoque des altérations toxiques (Brown, 1994).
Cependant, les dommages causés par la transmission de
virus sont les plus importants. L'adulte de B. tabaci est un vecteur
important de plusieurs types de virus tels que les potyvirus, les comovirus,
les potexvirus, les Geminivirus, les carlavirus, les luteovirus, lesnepovirus,
et les closterovirus.Pourtant, sont les geminivirus (Geminiradea), la
principale famille virale causant des pertes importantes dues à leur
dissémination rapide à travers le phloème de la plante
(Nunes, 2006).
I.1.10. Cycle d'infection et
transmission de virus
Dans le cas de Begomovirus l'inoculation constitue la
premièreétape à l'infectiondes cellules de la plante par
le vecteur B. tabaci. Cependant une interaction virus
hôtespécifique est nécessaire pour que l'infection du
Begomovirus se produise. La deuxièmeétape est le
déplacement du virus vers le noyau de la cellule où la
réplication et la transcription du génome se produit.Le mouvement
de la particule du virus est entièrementdépendant de la
protéine qui l'enveloppe et des interactions avec le réseau de
transport de l'hôte.Le processus de réplication constitue la
dernièreétape.
Comme Gutierrez a pu constater, le Begomovirus,adopte une
stratégie d'enroulement avec des protéines virales qui permetde
décoder les composantes du génome (Gutierrez 2000, cité
par Nunes, 2006).
Le temps nécessaire pour l'acquisitionde Begomovirusse
situe entre 10 et 60 minutes, tandis que la transmissionse fait entre 10 et
30minutes. Après l'acquisition, les Begomoviruspeuvent être
variables à l'intérieur de B. tabacientre 5 à 20
jours, quelque fois durant toute la vie (Brown, 1994).
I.2. BIOPESTICIDE A BASE DE
NEEM
I.2.1. Définition du
biopesticide
Les biopesticides sont définis comme des
substances chimiques naturelles destinées à lutter contre
les parasites microscopiques, végétaux et animaux nuisibles aux
cultures, aux récoltes, etc. Ils sontfabriqués par voie naturelle
ayant une action soit toxique, soit répulsive sur les bio agresseurs
tout en respectant les normes écologiques (Anonyme, 2010).
I.2.2. Origine et description du
neem
Le margousier (neem) est un arbre originaire d'inde (sud
Himalaya), dicotylédone appartient à la famille des
Meliaceae.C'est une plante qui peut atteindre 30 m de hauteur et vivre 2
siècles, mais qui est en général plus petit (5 à 10
m). Son feuillage persistant est imparipenné 5 à 8 paires de
folioles falciformes à base très inégale.
Dès le mois de mai, le neem fait apparaitre des fleurs
blanches ou violettes en forme d'étoile, odorantes et disposées
en grappes descendantes. Les fleurs en panicules sont blanches ou
jaunâtres, le fruitest une drupe ellipsoïdale de 1 à 2 cm,
jaune à maturité et une graine jaune vert à
maturité. Elles se transforment en petits fruits jaunes comestibles,
petites drupes jaunâtres semblables à des olives contenant une ou
deux graines récoltées au moment de la mousson. Il y a 4000 -
4500 graines par kg (Kassimi et al., 2013).
I.2.3. Exigences
écologiques
Cet arbre résiste bien à lasècheresse, il
se développe correctement avec 450 à 1150 mm de pluviosité
annuelle, mais résiste à 150 mm. La température optimale
de développement est d'environ 26 °C. Les jeunes plantes ne
supportent pas le gel. Il se développe sur les sols très pauvres
(sables lessivés) et tolère la salinité. Le pH optimal est
de 5 à 6,8. Il ne tolère pas l'hydromorphie (Anonyme, 2010).
I.2.4. Classification
botanique
Le neem est une plante pérenne appartenant au (à
la ou l') :
v Règne :Plantae
v Division : Magnoliophyta
v Classe : Magnoliopsida
v Ordres : Sapindales
v Famille : Meliaceae
v Genre : Azadirachta
v Espèce : Azadirachta indica
Synonymes :
v Antelaeaazadirachta (L.) Adelb.
v Melia azadirachta L.
v Melia indica (A. Juss.) Brandis
Source : Ghedira et Goetz, 2014
I.2.5. Utilisation de neem
L'utilisation de neem ne se limite pas au traitement
insecticide, en effet, il est considéré depuis des siècles
comme sacré en Inde, ses feuilles entrent dans la composition de
tisanes, de crèmes, etc. L'Azadirachta est également
transforméen dentifrice, spermicide, crèmes anti - moustique,
shampoing antipelliculaire. Il est actuellement importé en Australie et
au Japon pour le transformer en médicament et traitements
(aromathérapie).
Parmi toutes ses qualités, le pouvoir insecticide du
neem est sûrement le plus prometteur du point de vue
économique.
L'amande que l'on extrait du noyau est transformée en
huile après pressage à froid, sans ajout de solvant, elle est
ensuite filtrée sur papier buvard. Cette huile que les agriculteurs
d'inde usent comme fertilisant, pesticides. Les feuilles peuvent servir comme
fourrage pour leschèvres et les chameaux (malgré une
légère amertume), elle contient 15% de protéines. En Asie,
les feuilles et brindilles sont utilisées comme pailles sur les
cultures. Le résidu de l'extraction de l'huile des graines est
utilisé comme engrais (Ghedira et Goetz, 2014).
I.2.6. Composition chimique et
propriétés
La composition et l'extraction des différents
composés chimiques contenus dans le neem mettent en évidencela
présence de nombreux principes actifs, dont les actions
complémentaires sont la source des propriétésinsecticides
du neem.
Les extraits de graines de neem renferment un mélange
de plus de 168 composés constitués d'un groupe de 7
surséances proches incluant l'Azadirachthine.Il s'agit de
terpénoides (structures multi cycliques). L'Azadiracthine A :
C35H44O16est considéré
très largement le principal composé à
propriétésinsecticides du neem.Il a néanmoins
été prouvé qu'il ne suffisait pas, à lui seul, pour
expliquer les remarquablespropriétés du neem.Azadirachtine
B :C33H42O16(Neem.fr, 2016).
Cependantla quantité d'Azadirachtinecontenue dans les
graines varie considérablement selon les conditions climatiques, du sol,
le génotype de l'arbre, d'une année à l'autre et un arbre
peut produire des extraits qui contiennent des concentrations
différentes.
L'Azadirachtine est un composé d'origine naturelle de
la famille des limonoïdes. C'est un
métabolitesecondaireprésent dans l'huile extraite des graines
d'Azadirachta indicaaussi présent dans toutes les parties de
M.azadirachta. C'est un tétratriterpenoïde hautement
oxydé. Il présente une grande variété de fonctions
oxygénées comme les éthersoenoliques, acétals,
hermiacétals et oxitranestétra substitués ainsi que des
éthers carboxyliques.
Les composants naturels du neem permettent des applications
très diverses. Dans la production agricole ou forestière, l'huile
de neem permet la mise en place de procédés efficaces et
respectueux de l'environnementpour les cultures (Neem.Fr, 2016).
I.2.7. Effets sur les insectes
Les biopesticides à base de neem permettent de lutter
contre plus de 400 espèces d'insectes ravageurs, dont certaines sont
résistantes aux pesticides chimiques.
L'application de ce produit sur les larves d'insectes provoque
leur mort à différents stades de leur développement, ainsi
que des malformations telles quelaréduction de la
longévité et la fécondité chez les adultes
(Neem.Fr, 2016).
Ses propriétés ovicides et larvicides lui
permettant d'affecter la ponte des femelles de certains arthropodes ainsi que
la mue et la croissance des larves, affaiblissant ainsi la résistance de
ces insectes. L'huile de neem n'est pas toxique pour les animaux à sang
chaud et les êtreshumains.
L'effet de la molécule d'Azadirachtine sur les insectes
serésume en trois points essentiels :
- Elle bloque la sécrétion hormonale et
arrête le développement morphologique de l'insecte ;
- Elle agit par le biais de la respiration sur pratiquement
tous les tissus de l'insecte (tissus musculaires, nerveux, glandulaires, etc.)
et en conséquence, l'insecte perd la coordination de ses mouvements et
le contrôle de son corps ;
- Elle agit aussi comme un agent anorexique, l'insecte ne
mange plus et meurt.
Ces effets ont été observés chez
plusieurs types de familles d'insectes : Les lépidoptères
(papillons), les diptères (mouches, taons, moustiques,..), les
orthoptères (sauterelles, criquets,..), les hyménoptères
(très faible pour les abeilles) et certaines espèces de pucerons
(Kassimi et al., 2013).
I.3. PESTICIDES
Par définition, les pesticides sont
des substances chimiques,naturelles ou de synthèse,
destinées à lutter contre les parasites végétaux et
animaux nuisibles aux cultures, aux récoltes et à l'homme. Ils
sont utilisés en agriculture, mais également dans les lieux
d'habitation et dans les égouts pour luttercontreles animaux nuisibles
et les organismes responsables de maladies (Anonyme, 2010).
I.3.1. Classification
Nous pouvons les classer selon la nature des
espèces nuisibles auxquelles ils sont destinés : herbicides
(contres les adventices), insecticides (contre les insectes nuisibles),
fongicides (ou anticryptogamiques, contre les champignons parasites),
acaricides (contre les acariens), nématicides (contre les
nématodes) et rodenticides (contre les rongeurs). Les trois
premières classes de pesticides constituent les plus importantes du
point de vue de leurs utilisations et de leurs quantités de production
(KUBANZIKO, 2009).Il est à noter que la classe des insecticides fait
partie de cette étude.
I.3.2. Insecticides
Lesinsecticides sont des substances actives ayant la
propriété de tuer les insectes nuisibles tout en
préservant les insectes utiles comme les abeilles. Parmi les
insecticides les plus connus figurent le DDT (interdit en France
depuis 1972) et le lindane (interdit en France depuis 1999), les deux
faisant partie de la liste rouge des polluants organiques
persistants (POP), recensés par le Programme des Nations Unies pour
l'Environnement (PNUE) et interdits dans de nombreux pays de l'Union
Européenne et les États-Unis.
Les quatre plus importantes familles chimiques
auxquelles appartiennent les insecticides organiques de synthèse
sont :
1. les organophosphorés, ce sont des inhibiteurs de
cholinestérases et par conséquent toxiques vis-à-vis des
ravageurs ;
2. les organochlorés, difficilement
biodégradables et fortement persistants dans l'environnement, ils sont
pour la plupart interdits ou retirés du marché;
3. les carbamates, dérivés de l'acide
carbamique, qui regroupent également des herbicides et un grand nombre
de fongicides ;
4. les pyréthrinoïdes de synthèse, voisins
des pyréthrines naturelles.
Ces substances toxiques pénètrent dans la cible
soit par contact, soit par ingestion, soit inhalation mais certains d'entre
elles peuvent pénétrer par deux ou trois voies différentes
(KUBANZIKO, op.cit).
I.3.3. Différentes familles
d'insecticides et leurs modes d'action
Au cours de ces dernières années de nombreuses
familles d'insecticides sont apparues.
Elles peuvent être classées par groupe selon
leurs modes d'action et la cible visée. Ces cibles sont variées
et correspondent à desenzymes, des protéines, des canaux, des
récepteurs... Certaines familles agissent sur lacroissance en perturbant
la mue des insectes, la famille des diacylhydrazines, d'autres commeles
benzoyluréestroublent leurs développements. Les insecticides
interviennentégalement dans la respiration cellulaire ou encore au
niveau des muscles pour une toute petitepartie d'entre eux. Cependant une
classe reste largement majoritaire de par son efficacité
élevée, elle correspond aux neurotoxiques.
Les neurotoxiques agissent au niveau du système nerveux
et renferment plusieurs famillesd'insecticides comme les organochlorés
ou les néonicotinoïdes.Etantla classe la plus importante, les
neurotoxiques,correspond à plus de 75% du marché mondial des
insecticides. Ils agissent au niveau du système nerveux des insectes en
perturbant la transmission synaptique. Les neurotoxiques ont l'avantage d'agir
rapidement et efficacement pour stopper les dégâts
engendrés dans les cultures. Ils agissent également sur les
insectes vecteurs de maladies humaines comme le moustique.
D'autresinsecticides sont également utilisés
mais la cible et le mode d'action restent incertains ouméconnus comme le
bifénazate. Toutes ces familles d'insecticides agissentdonc au niveau de
cibles bien distinctes (Louat, 2013).
I.3.4. La résistance chez
les insectes
Le contrôle à long terme des insectes ravageurs
occasionne la présence d'espèces résistantes. De plus,ces
phénomènes de résistance apparaissent très
tôt après l'application des insecticides commechez la mouche
domestique. On distingue plusieurs sortes des résistances : La
résistance comportementale, La résistance cuticulaire, La
résistance via une évolution des cibles de l'insecticide et
métabolique(Louat, op. cit).
CHAPITRE II : MILIEU,
MATERIELS ET METHODES
II.1. Milieu
II.1.1. Situation
géographique
Cetteexpérience a été menée dans
l'enceinte de la maison où loge la famille MBIYAVANGA se trouvant sur
l'avenue Feshi au numéro 17, quartier Kimbondo, dans la commune de Mont
-Ngafula.
La commune de Mont - Ngafulaest l'une des vastes commune qui
compose la ville province de Kinshasa. Elle est délimitée de part
et autres par le fleuve Congo, la commune de Ngaliema, la commune de Lemba, la
commune de Selembao, la commune de Ngaba et par la province du Kongo central
(Anonyme, 2016).
II.1.2. Relevés
climatiques
La ville province de Kinshasa a un climat tropical humide avec
une saison des pluies qui va de fin septembre à fin mai, celle-ci est
entrecoupée d'une petite saison sèchedemi - décembre
à mi - février et la grande saison sèche de fin mai
à fin septembre.
La ville province de Kinshasa est située à
15°15' de longitude Est, à 04° 22' de latitude sud et à
une altitude de 445 m, son indicatif est 64220.
Les autres informations climatiques pendant
l'expérimentation sont mentionnées dans le tableau
suivant :
Tableau 1 : Données climatiques pendant
l'expérience
|
Mois
|
Température
Moyenne
Mensuelle
(en °C)
|
Précipitationmoyenne mensuelle (en mm)
|
Humidité relative moyenne (en %)
|
|
Juin
|
23,7
|
2,8
|
83,4
|
Source : Anonyme, 2016
II.2. Matériels
II.2.1. Matériel de
base
Il a été composé des extraits de l'A.
Indica A. Juss (extraits des graines, feuilles et écorces),
ladeltaméthrine et les B. tabaciqu'on avait capturés
dans un champ de manioc infecté.
II.2.2. Deltaméthrine
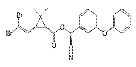
Insecticide de la famille des
pyréthrinoïdes,elleagit par contact et ingestion. La
deltaméthrine est utilisée pour lutter contre nombreux insectes
et à faible dose : les piqueurs suceurs tels que les pucerons, les
thrips, la mouche blanche, les cicadelles, les chenilles,etc.(Adamou
etal., 2010).
Formule
chimique:C22H19Br2NO3ou
Dans le cas de notre expérience, nous avons
utilisédeltaméthrine en poudre pour faciliter la manipulation. La
quantité prescrite est de 500 - 625g/ha. Nous avions utilisé 2g
pour contrôler 15 insectes.
II.2.3. Autres
matériels
Les autres matériels qui ont servi à notre
expérience sont les suivants :
Ø La capsule de peser : c'est un instrument qui a
facilité la pesée ;
Ø Une balance analytique de précision à
0.01 avait servi au pesage des échantillons ;
Ø Spatule : ce matériel en forme de
cuillère a aussi facilité les prélèvements ;
Ø Les boites de mayonnaises : ce sont des bocaux
en verre qui ont fait office de boite de pétri ;
Ø Un ordinateur : pour la saisie et les
traitements des textes ;
Ø Les sachets : certains ont été
utilisés comme emballage, d'autres ont servi à couvrir les
bocaux ;
Ø Mortier : ce matériel nous a permis de
broyer les extraits ;
Ø Tamis : aprèsnettoyage, il a permis de
tamiser les extraits broyés afin d'obtenir la poudre fine.
Ø Les feuilles de manioc : qui ont servi comme
aliment, que changions après chaque4 jours.
II.3. Méthodes
II.3.1. la préparation et
application des extraits de neem
Les extraits de la plante récoltés ont
été stockés dans un endroit sec et non ensoleillé
pour éviter à ce que l'azadirachtine s'évapore.
Avant l'utilisation, nous avons séché les
extraits pour diminuer la teneur en eau. Après séchage, nous
avions procédé au broyage et tamisage à l'aide d'un tamis
à maille de diamètre plus petite ensuitemis dans les bocaux
hermétiquement fermés, et placé dans un endroit frais et
sec, à l'abri de la lumière directe. Chaque bocal a
été étiqueté pour son identification facile.
Pour chaque unité expérimentale ou dans chaque
boite vide de mayonnaise, nous avions appliqué 12 g del'extrait
préalablementpréparé. La quantité correspondait
mieux pour influencer l'activité de 15B. tabacidurant la
périodeexpérimentale. Il a été incorporé 2
feuilles fraiches de manioc dans chaque unité expérimentale afin
d'alimenter les insectes.
II.3.2. Dispositif
expérimental
Le dispositifcomplètement randomisé (CRD) a
été choisi, pour cette expérimentation. C'est un
dispositif dans lequel les traitements sont affectés au hasard de telle
sorte que chaque unité expérimentale ait la même chance de
recevoir un quelconque traitement (LUKOMBO, 2015).
Le CRD a été choisi par ce qu'il est
approprié pour les expériences au laboratoire où les
effets des facteurs environnementaux sont facilementcontrôlés.
Cette expérience comportait 5 traitements et 4
répétitions, l'affectation des traitements a été
rendu possiblegrâce à un tirage au sort. La figure 1
présente le plan du dispositif expérimental
T2R2
T4R4
T1R4
T3R4
T2R1
T0R2
T3R3
T4R3
T4R1
T1R2
T3R1
T1R1
T2R4
T0R3
T3R2
T0R1
T4R2
T1R3
T0R4
T2R3
Figure 1 :Plan du dispositif
expérimental utilisé
Figure
Légende
R : répétition
T0 : traitement
0témoin contenant 15B. tabaci, sans extrait de neem et ni de
deltaméthrine ;
T1 : traitement 1 contenant
15 B. tabaci+ extrait des graines de neem ;
T2 : traitement 2 contenant
15 B. tabaci+ extrait de l'écorce de neem;
T3 : traitement 3 contenant
15 B. tabaci+ extrait des feuilles de neem ;
T4 : traitement 4 contenant
15 B. tabaci+ 2g de deltaméthrine.
II.3.3. Paramètres
d'études ou d'observation
Après une durée expérimentale de 14jours
(du 01 Juin au 14 Juin 2016), nous avions étudié, les
paramètres d'observations suivants :
· Le nombre d'insectes vivants à la fin de
l'expérimentation ;
· Le nombre d'insectes encorevigoureux après
l'expérimentation.
1° Nombre d'insectes vivants à la fin de
l'expérimentation
A la fin de l'expérimentation, nous avions
compté chaque lot pour voir les nombres d'insectes vivants et morts.
Cela a permis d'évaluerle degré d'efficacité et
l'influence de la dose d'extraits de neem et deltaméthrine
appliquée.
2° Nombre d'insectes encore vigoureux
après l'expérimentation
Nous avions séparé les insectes affaiblis des
vigoureux et enfin, ils ont encore fait l'objet d'un dénombrement.
II.3.4. Analyses statistiques
Nous avons procédé à l'analyse de
variance (ANOVA) selon le dispositif complètement randomisé (CRD)
et la comparaison des moyennes était faite sur base du test de la plus
petite différence significative (PPDS). Le calcul de coefficient de
variation a été réalisé pour évaluerle
degré deprécision de l'expérience. Le pourcentage a
été trouvé le cas échéant. A cet effet, le
lecteur voudra bien se référer aux formules consignées
dans les lignes qui suivent selon Asanzi (2015).
1°facteur de correction (F)
F=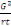 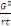 ou G = grand total, r = répétition, t = traitement ou G = grand total, r = répétition, t = traitement
2° Somme des carrés totale
(SCT) :
SCT =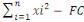 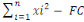
DLT = Degré de liberté total
DLT = rt-1
3° Somme des carrés traitements
(SCTrt)
SCTrt =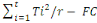 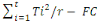
DLTrt= Degré de liberté traitement
DLTrt = t-1
4° Somme des carrés de l'erreur
(SCE)
SCE = DCT - DCTrt
DLE=Degré de liberté de l'erreur
DLE = DLT - DLTrt
Tableau 2 : Eléments de l'analyse de
variance pour le dispositif expérimentalcomplètement
randomisé (CRD)
|
Sources de variation
|
Degré de liberté
|
Somme des carrés
|
Carré moyen
|
Fcal
|
Ftab
|
|
0,05 0,01
|
|
Traitement
Erreur
Total
|
t-1
DLT-DLTRT
t.r-1
|
ScTrt
ScE
Sct
|
ScTrt/t-1
ScE/t(r-1)
|
CMTrt/CME
|
|
Sources : Asanzi, 2015
Si la valeur de F calculé est inférieure
à la valeur de F tabulaire au seuil de probabilité de 5% ;
la différence entre les traitements n'est pas significative (n.s.).
Donc, toutes les moyennes des traitements sous examen sont égales.
Par contre, si la valeur de F calculé est
supérieur à la valeur de F tabulaire au seuil de 5% et 1% ;
on dit que la différence est respectivement significative (*) et
hautement significative (**). Donc, il existe au moins une des moyennes des
traitements qui diffère des autres. Ainsi, pour confirmer la conclusion
de cette analyse de variance, il est recommandé d'examiner l'existence
de cette différence en appliquant le test de la plus petite
différence significative (ppds) ou la comparaison orthogonale.
La valeur de ppds obtenue sera comparée à la
différence en valeur absolue entre les moyennes de différents
traitements prises deux à deux. Si la valeur de ppds est
inférieure à cette différence, les deux moyennes sont
dites statiquement différentes. Dans le cas contraire, elles sont
égales.
ppds = t0,05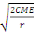 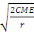
Où t0,05 : valeur tabulaire de Student
test ;
S2 : carré moyen de l'erreur ;
r : nombre de répétitions(Asanzi, 2015).
Le coefficient de variation (cv) est égal à la
racine carré du carré moyen de l'erreur (CME) divisée par
la grande moyenne,
CV = 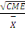 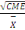 .100 .100
Le calcul de pourcentage (%) nous a permis d'apprécier
certaines données ou proportions. La formule suivante a
été utilisée à ce fait :
% = 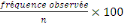 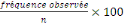
Où : % fréquence en pourcentage,
n = taille de l'échantillon, 100 = constante.
CHAPITRE III : PRESENTATION
ET DISCUSSIONS DES RESULTATS
III.1. Présentationet
interprétationdesrésultats
Les résultats ont été obtenus à
l'issu de l'expérimentation.
III.1.1. Nombre de B. tabaci morts
à la fin de l'expérience
Le nombre de B. tabaci morts à l'issu de
l'expérimentation, est repris dans le tableau suivant.
Tableau 7 : Nombre de B. tabaci
morts après expérimentation
|
Traitements
|
Nombre de B. tabaci mort à la fin de
l'expérimentation
|
Total
Trt
|
Moyenne
Trt
|
|
T0
T1
T2
T3
T4
|
1
14
13
13
15
|
3
13
12
12
15
|
2
15
12
13
15
|
2
14
13
13
15
|
8
56
50
51
60
|
2
14
12,5
12,75
15
|
|
Grand total (G)
|
|
|
|
|
225
|
|
|
Grande moyenne
|
|
|
|
|
|
11,25
|
Les résultats du tableau 7 renseignent qu'un total de
225B. tabaci sont morts après expérimentation. Le seuil
de mortalité peut êtreclassé de la manière
suivante : T4 > T1 > T3 >
T2 > T0.
Le tableau 8 contient l'analyse de variance sur le nombre de
B. tabaci morts après l'expérimentation.
Tableau 8 : Analyse de variance de
B. tabaci morts de l'essai conduit en CRD avec 5 traitements et 4
répétitions
|
Sources de variation
|
Degré de liberté
|
Sommes des Carrés
|
Carré moyen
|
Fcalculé
|
Ftabulaire
0,05 0,01
|
|
Traitement
Erreur
Total
|
4
15
19
|
444
5,75
449,75
|
111
0,38
|
292,10**
|
3,064,89
|
L'analyse de variance sur le nombre de B. tabaci qui
sont morts à la suite de l'expérimentation révèle
que la différence est significative du fait que F calculé est
supérieur au seuil de 5% et hautement significative au seuil de 1%. CV =
5,5% ; cette valeur étant inférieure à 20, il se
dégage une validité de l'expérience et précision
dans la comparaison des différents traitements.
La différence étant hautement significative,
nous avons procédé au test de la plus petite différence
significative (ppds).
Comparaison de moyennes :
Ppds = 2,13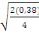 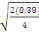 = 0,92 = 0,92
|
|
T0
|
T2
|
T3
|
T1
|
T4
|
|
Moyennes
|
2
|
12,5
|
12,7
|
14
|
15
|
|
T0
|
2
|
0
|
10,5
|
10,7
|
12
|
13
|
|
T2
|
12,5
|
-
|
0
|
0,19
|
1,5
|
2,5
|
|
T3
|
12,7
|
-
|
-
|
0
|
1,3
|
2,3
|
|
T1
|
14
|
-
|
-
|
-
|
0
|
1
|
|
T4
|
15
|
-
|
-
|
-
|
-
|
0
|
En comparant les moyennes,l'ordre croissant du traitement est
le suivant :
T0 < T2 = T3<
T1< T4
III.1.2. Nombre de B. tabaci
vivant aprèsexpérimentation
Le tableau suivant reprend le nombre de B. tabaci
vivants à la fin de l'expérimentation.
Tableau 3 : Nombre d'insectes vivants
après l'expérimentation
|
Traitements
|
Nombre de B. tabaci vivants à la fin de
l'expérimentation
|
Total
Trt
|
Moyenne
Trt
|
|
T0
T1
T2
T3
T4
|
14
1
2
2
0
|
12
2
3
3
0
|
13
0
3
2
0
|
13
1
2
2
0
|
52
4
10
9
0
|
13
1
2,5
2,25
0
|
|
Grande total (G)
|
|
|
|
|
75
|
|
|
Grand moyenne
|
|
|
|
|
|
3,75
|
Il ressort quele nombre moyen de B. tabaci vivants
pour tous les traitements, est 3,75 sur 15.
Tableau 4 : Analyse de variance de
B. tabaci vivantsde l'essai conduit en CRD avec 5 traitements et 4
répétitions
|
Sources de variation
|
Degré de liberté
|
Sommes des Carrés
|
Carré moyen
|
F calculé
|
F tabulaire
0,05 0,01
|
|
Traitement
Erreur
Total
|
4
15
19
|
444
5,75
449,75
|
111
0,38
|
292,10**
|
3,06 4,89
|
L'analyse de variance sur le nombre de B. tabaci
vivants après l'expérimentation, montreune différence
significative, puisque la valeur de F calculé est supérieure
à la valeur de F tabulaire au seuil de 5% et au seuil de 1%la
différence est hautement significative. LeCV = 16,51%
Ppds = 2,13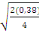 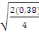 = 0,92 = 0,92
Comparaison de moyennes :
|
|
T4
|
T1
|
T3
|
T2
|
T0
|
|
Moyennes
|
0
|
1
|
2,25
|
2,5
|
13
|
|
T4
|
0
|
0
|
1
|
2,25
|
2,5
|
13
|
|
T1
|
1
|
-
|
0
|
1,25
|
1,5
|
12
|
|
T3
|
2,25
|
-
|
-
|
0
|
0,25
|
10,75
|
|
T2
|
2,5
|
-
|
-
|
-
|
0
|
10,5
|
|
T0
|
13
|
-
|
-
|
-
|
-
|
0
|
En comparant les moyennes, l'ordre croissant du traitement est
le suivant :
T4 < T1< T3 =
T2 < T0.
III.1.3. Nombre d'insectes vivant
et vigoureux après expérimentation
Le tableau 5 ci - après contient le nombre de B.
tabaci vigoureux, la moyenne de chaque traitement ainsi que la grande
moyenne (pour tous les traitements).
Tableau 5 : Nombre de B. tabaci
vigoureux
|
Traitements
|
Nombre de B. tabaci vivants et vigoureux à la
fin de l'expérimentation
|
Total
Trt
|
Moyenne
Trt
|
|
T0
T1
T2
T3
T4
|
13
0
1
1
0
|
12
1
2
2
0
|
13
0
3
2
0
|
12
0
2
1
0
|
50
1
8
6
0
|
12,5
0,25
2
1,5
0
|
|
Grand total (G)
|
|
|
|
|
65
|
|
|
Grande moyenne
|
|
|
|
|
|
3,25
|
Les résultats du tableau sur le nombre de B.
tabaci vivants et vigoureux après l'expérimentation, montre
que le nombre moyen de tous les traitements est de 3,25 sur un total de 15
B. tabaci. Le T1 et T4 présentent les moyennes les plus
faibles.
Tableau 6 : Analyse de variance du
nombre de B. tabaci vivants et vigoureux après
expérimentation
|
Sources de variation
|
Degré de liberté
|
Sommes des Carrés
|
Carré moyen
|
F calculé
|
F tabulaire
0,05 0,01
|
|
Traitement
Erreur
Total
|
4
15
19
|
439
4,75
443,75
|
109,75
0,32
|
342,96**
|
3,06 4,89
|
Cette analyse de variance du nombre de B. tabaci
vivants et vigoureux après l'expérimentation montre une
différencehautement significative des traitements mis sous analyse au
seuil de 5% et 1%. Ce qui revient à dire que les différents
traitements administrés ont influencé ce nombre de B. tabaci
de différente manière. CV = 17,31%
Comparaison de moyennes :
Ppds = 2,13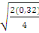 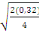 = 0,85 = 0,85
|
|
T4
|
T1
|
T3
|
T2
|
T0
|
|
Moyennes
|
0
|
0,25
|
1,5
|
2
|
12,5
|
|
T4
|
0
|
0
|
0,25
|
1,5
|
2
|
12,5
|
|
T1
|
0,25
|
-
|
0
|
1,25
|
1,75
|
12,25
|
|
T3
|
1,5
|
-
|
|
0
|
0,5
|
11
|
|
T2
|
2
|
-
|
|
-
|
0
|
10,5
|
|
T0
|
12,5
|
-
|
|
-
|
-
|
0
|
En comparant les moyennes, l'ordre croissant du traitement est
le suivant :
T4 = T1 < T3=
T2 < T0
III.1.4. Nombre de B. tabaci
vivants et non vigoureux
Le nombre de B. tabaci vivants et non vigoureux, est
consigné dans le tableau 9.
Tableau 9 :Nombre de B. tabaci
vivant et non vigoureux aprèsexpérimentation
|
Traitements
|
Nombre de B. tabaci vivants et non vigoureux à
la fin de l'expérimentation
|
Total
Trt
|
Moyenne
Trt
|
|
T0
T1
T2
T3
T4
|
1
1
1
1
0
|
0
1
1
1
0
|
0
0
0
0
0
|
1
1
0
1
0
|
2
3
2
3
0
|
0,5
0,75
0,5
0,75
0
|
|
Grand total (G)
|
|
|
|
|
10
|
|
|
Grande moyenne
|
|
|
|
|
|
0,5
|
Il ressort du tableau que 10B. tabaci au total
étaient vivants et non vigoureux.
L'analyse de variance des résultats du tableau 9 est
contenue dans le tableau 10.
Tableau 10 :Analyse de variance du
nombre de B. tabaci vivants et non
vigoureuxaprèsexpérimentation
|
Sources de variation
|
Degré de liberté
|
Sommes des Carrés
|
Carré moyen
|
F calculé
|
F tabulaire
0,05 0,01
|
|
Traitement
Erreur
Total
|
4
15
19
|
1,50
3,50
5
|
0,37
0,23
5
|
1,60n.s
|
3,06 4,89
|
De cette analyse de variance sur le nombre de B. tabaci
vivant et non vigoureux, il se dégage une différencenon
significative. La valeur de F calculé est inférieure à
Ftable. Tandisque le CV est égal à 96,6%
Tableau 11 : synthèse des résultats
de l'expérience
|
Traitement
|
B. tabaci morts
|
B. tabaci vivants
|
B. tabaci vivants et vigoureux
|
B. tabaci vivants non vigoureux
|
|
T0
|
2
|
13
|
12,5
|
0,5
|
|
T1
|
14
|
1
|
0,25
|
0,75
|
|
T2
|
12,5
|
2,5
|
2
|
0,5
|
|
T3
|
12,75
|
2,25
|
1,5
|
0,75
|
|
T4
|
15
|
0
|
0
|
0
|
|
ANOVA
|
**
|
**
|
**
|
n.s
|
|
Ppds
|
0,92
|
0,92
|
0,85
|
|
|
CV
|
5,5
|
16,51
|
17,31
|
96,6
|
Le tableau 11 résumeles résultats obtenus
après expérimentation.
III.2. Discussions
Les résultats obtenus avec l'utilisation des deux types
de pesticide ; le biopesticide (neem) et le pesticide de synthèse
(deltaméthrine), afin de pouvoir contrôler la prolifération
de B. tabaciet déterminer lapossibilité d'envisager une
lutte biologique face aux B. tabaci, peuvent être
confrontés de la manière suivante :
Concernant le nombre de B. tabaci mort à la
fin de l'expérience suite auxbiopesticides (T1, T2
et T3),157 étaient morts sur 180 soit87,2% de
mortalité. Tandis que le nombre de B. tabaci mort suite au
deltaméthrine, on a enregistré un taux de mortalité de
100% donc tous les 60 B. tabaci étaient morts.
Certes, ladeltaméthrine présente le taux de
mortalité le plus élevé par rapport aux traitements
à base de neem, par contre le traitement à base de graines de
neem à lui seul a accusé un taux de mortalité très
élevé 93,3% donc 14 sur 15 et le 6,7% restant étaient
vivants et non vigoureux. Ces résultats sontproches de celui de
deltaméthrine qui est de 100%. Ilsconfirment l'étude faite par
Bambara et Tiemtoré en 2008, qui montre que la graine contient le taux
le plus élevé en Azadirachtine par rapport aux feuilles et
écorces.
Etant donné que le traitement à base de graines
de neem s'est montré efficace face aux B. tabaci,
proche de pesticide de synthèse deltaméthrine, une lutte à
base de cebiopesticide est donc possible dans le cadre d'une agriculture
durable et respectueuxde l'environnement.
CONCLUSION
Cette étude portait sur la possibilité de
contrôlerB. tabaci en utilisant les extraits de neem et
deltaméthrine.
Face à de nombreux ravageurs de plus en plus
résistantsaux traitements ordinaires, actuellement les insecticides de
synthèses ont montré des effets néfastes pour la
santé publique et l'environnement (Gomez et al., 1997).C'est
pourquoi il était nécessaire de savoir si le biopesticides
pouvait anéantir les ravageurs de la même manière ou plus
que les insecticides de synthèse cas dedeltaméthrine.
Cinq traitements ont
étéexpérimentés. Il s'agit de :
ü T0 : traitement 0
témoin contenant 15 B. tabaci, sans extrait de neem et de
deltaméthrine;
ü T1 : traitement 1
contenant 15 B. tabaci+ 12 g d'extrait des graines de neem ;
ü T2 : traitement 2
contenant 15 B. tabaci+ 12 g d'extrait de l'écorce de
neem ;
ü T3 : traitement 3
contenant 15 B. tabaci+ 12 g d'extrait des feuilles de neem ;
ü T4 : traitement
4contenants15 B. tabaci+ 2g de deltaméthrine en poudre.
Il ressort de l'analyse de variance qu'au niveau de
traitements une différence hautement significative en ce qui concerne
les paramètresétudiés. Le coefficient de variation
calculé était inférieur à 20 presque dans tous les
cas.
Quant aux insecticides testés, la deltaméthrine
s'est avérée plus efficace, car on a enregistré 100% de
mortalité, tandis que l'insecticide à base de neemétait
aussi efficace à 87,2% de taux de mortalité, 8,3% d'insectes
vigoureux et 4,5% de non vigoureux. Les extraits de feuilles ont
présenté un taux de mortalité de 85%, l'écorce de
83,3 et 93,3 pour la graine. Ainsi donc, la résistance
deB.tabaci aux extraits de graine de neemétant moindre qu'au
deltaméthrine, l'utilisation de biopesticidesesttoutefoispossible et
doit être encouragée, car il est plus économique que le
pesticide de synthèse etpour une meilleure conservation de
l'équilibre de l'écosystème planétaire.
Il serait souhaitable de tester, si B. tabaci pouvait
développer une résistance face à cesdeux types de
pesticides, mais le temps académique nous a fait défaut.
C'est pourquoi, il convient de suggérer que des
études ultérieures soient menées à une durée
plus longue et en condition naturelleafin de préciser le degré
de résistance de B. tabaci face au biopesticides à base
de neem et face au pesticide de synthèse.
BIBLIOGRAPHIE
Anonyme, 2010: Mémento de l'agronome, P.691 - 1254
éd.Quae, Montpellier - France.
Anonyme, 2016 : Station Météorologique de
Kinshasa/Delvaux
Anonyme, 2016 : Rapport du bureau du quartier de
Kimbondo/Mont - ngafula
Adamou, R., Abdoulaye, A., Soumaïla, M., Moussa, I.,
Coly, A., Tine, A., &Ikhiri, K. (2010). Dégradation abiotique de la
Deltaméthrine et de l'Etofenprox dans les eaux naturelles du Niger.
J. Soc. Ouest-Afr. Chim, 29, 45-54.
Asanzi, M., 2015 : Cours de principes
d'expérimentations agricole, 3ème Graduat, Faculté des
Sciences Agronomiques, UPN/Kinshasa, inédit.
Asanzi, M. et Ndju, E. 2015 : Cours de zoologie agricole
générale, 3ème Graduat, Faculté des Sciences
Agronomiques, UPN/Kinshasa, inédit.
Bambara, D. et Tiemtore, J., 2008 : Efficacité de
Hyptisspicigeralam., Azadirachta indica A., Juss. Et Euphorbiabalsamifera Ait.
Sur le niébé Vignaunguculata L. Walp. In TROPICULTURA, 53-55
Bibasuya, B., 2014 : Efficacité des extraits de
Azadirachta indica A. juss dans la conservation de Zeamays (L) et
Vignaunguiculata (L) Walpers. TFC G3 Agronomie Générale,
faculté des sciences agronomiques, UPN/Kinshasa, inédit.
Brown, J. K. (1994). Currentstatus of Bemisia tabaci
as a plant pest and virus vector in agroecosystemsworldwide.FAO, Plant
Protection Bulletin, 42(1/2), 3-32.
Burban, C. (1991). Structuration des populations chez un
insecte polyphage: Bemisia tabaci (GENN.)(HOMOPTERA: ALEYRODIDAE)
(Doctoral dissertation, Université Montpellier II).
Deguine, J. P., Ferron, P., et Russell, D. (2008).
Protection des cultures: de l'agrochimie à
l'agroécologie. Editions Quae.
Ghedira, K., et Goetz, P. (2014). Azadirachta indica A.
Juss.--Neem, Meliaceae.Phytothérapie, 12(4),
252-257.
Gomez, P., Cubillo, D., Mora, G. A., etHilje, L. (1997).
Evaluación de posiblesrepelentes de Bemisia tabaci: II.
Extractosvegetales. ManejoIntegrado de Plagas (Costa Rica).
Gnankiné, O., Traoré, D., Sanon, A.,
Traoré, N. S., &Ouedraogo, A. P. (2007). Traitements insecticides et
dynamique des populations de Bemisia tabaciGennadius en culture
cotonnière au Burkina Faso. Cahiers Agricultures,
16(2), 101-109.
Kassimi, A., Elwatik, L., et Moumni, M. (2013). Action
insecticide de certaines huiles essentielles et végétales.
Afrique Science: Revue Internationale des Sciences et Technologie,
7(2).
Kubanziko, L., 2013 : Utilisation des pesticides sur les
cultures maraîchères. TFC G3 Agronomie Générale,
faculté des sciences agronomiques, UPN/Kinshasa, inédit.
Lepoivre, P. (2001). Editorial. Les systèmes de
production agricole et la protection des cultures à la croisée
des chemins. Biotechnologie, Agronomie, Société et
Environnement, 5(4), 195-199.
Leroux, P., Delorme, R., &Gaillardon, P. (2002).
Évolution des produits phytosanitaires à usages agricoles. II-Les
fongicides. Phytoma-La Défense des végétaux,
(545), 8-15.
Lida, H., Kitamura, T., & Honda, K. I. (2009).Comparison
of egg-hatching rate, survival rate and development time of the immature stage
between B-and Q-biotypes of Bemisia tabaci (Gennadius)(Homoptera:
Aleyrodidae) on various agricultural crops. AppliedEntomology and
Zoology, 44(2), 267-273.
Lokando, B., 2014 : Essai de tolérance des
auxiliaires agricoles au biopesticide à base de neem (Azadirachta
indica). TFC G3 Agronomie Générale, faculté des sciences
agronomiques, UPN/Kinshasa, inédit.
Louat, F. (2013). Etude des effets liés à
l'exposition aux insecticides chez un insecte modèle,
Drosophilamelanogaster (Doctoral dissertation, Université
d'Orléans).
Lukombo, L., 2015 : Cours de statistique et
biométrie, 3ème Graduat, Faculté des Sciences
Agronomiques, UPN/Kinshasa, inédit.
Nunes, C. (2006). Lutte contre la mouche blanche (Bemisia
tabaci) en milieu tropical. ProQuest, 7, 9 - 23, Québec -
Canada.
Ploetz, R. (2004). Les maladies et les ravageurs: leur
importance et leur gestion. Plant Cell, 8, pp
393-402.
www.neem.fr, 2016.
TABLE DES MATIERES
DEDICACE
........................................................................................i
REMERCIEMENTS
.............................................................................ii
INTRODUCTION
................................................................................1
CHAPITRE I : GENERALITES SUR BEMISIA
TABACI, NEEM ET PESTICIDES
3
I.1. Bemisia tabaci et sa vie
3
I.1.1. Biologie de l'insecte
3
I.1.2.Reproduction et cycle de vie
3
I.1.3. Distribution
4
1.1.4. Plantes hôtes
4
I.1.5. Importance économique
4
I.1.6. Systématique
4
I.1.7. Anatomie
5
I.1.8. Vol
5
I.1.9. Déprédation
6
I.1.10. Cycle d'infection et transmission de
virus
6
I.2. BIOPESTICIDE A BASE DE NEEM
6
I.2.1. Définition du biopesticide
6
I.2.2. Origine et description du neem
7
I.2.3. Exigences écologiques
7
I.2.4. Classification botanique
7
I.2.5. Utilisation de neem
8
I.2.6. Composition chimique et
propriétés
8
I.2.7. Effets sur les insectes
9
I.3. PESTICIDES
9
I.3.1. Classification
9
I.3.2. Insecticides
10
I.3.3. Différentes familles d'insecticides
et leurs modes d'action
10
I.3.4. La résistance chez les insectes
11
CHAPITRE II : MILIEU, MATERIELS ET
METHODES
12
II.1. Milieu
12
II.1.1. Situation géographique
12
II.1.2. Relevés climatiques
12
II.2. Matériels
13
II.2.1. Matériel de base
13
II.2.2. Deltaméthrine
13
II.2.3. Autres matériels
13
II.3. Méthodes
14
II.3.1. la préparation et application des
extraits de neem
14
II.3.2. Dispositif expérimental
14
II.3.3. Paramètres d'études ou
d'observation
15
II.3.4. Analyses statistiques
15
CHAPITRE III. PRESENTATION ET DISCUSSIONS DES
RESULTATS
18
III.1. Présentation et
interprétations des résultats
18
III.1.1. Nombre de B. tabaci morts
à la fin de l'expérience
18
III.1.2. Nombre de B. tabaci vivant
après expérimentation
19
III.1.3. Le nombre d'insectes vivant et vigoureux
après expérimentation
21
III.1.4. Nombre de B. tabaci vivants et
non vigoureux
22
III.2. Discussions
24
CONCLUSION
25
BIBLIOGRAPHIE
26
TABLE DES MATIERES
..................................................................... 28
| 


