|
ÉíÈÚÔáÇ
ÉíØÇÑÞãíÏáÇ
ÉíÑÆÇÒÌáÇ
ÉíÑæåãÌáÇ
République
Algérienne Démocratique et Populaire
|
íãáÚáÇ
|
ËÍÈáÇæ
|
íáÇÚáÇ
ãíáÚÊáÇ
ÉÑÇÒæ
|
Ministère de l'enseignement supérieur et
de la recherche scientifique

Éíáß
ÉÚíÈØáÇ
ÉÇíÍáÇæ
ãæáÚ
Université des Frères Mentouri
Constantine Faculté des Sciences de la Nature et de la Vie
ÉäíØäÓÞ
íÑæÊäã
ÉæÎáÇÇ
ÉÚãÇÌ
Département de Biochimie - Biologie Cellulaire et
Moléculaire
ÉíÜÜÆÜÜíÒÌáÇ
æ
ÉíæÜÜÜÜáÎáÇ
ÇÜÜíÌæáæíÈáÇ-
ÉÜíæíÍáÇ
ÁÇíãíßáÇ
ãÓÞ
Mémoire présentée en vue de
l'obtention du diplôme de Master
Domaine : Sciences de la Nature et de la
Vie
Filière : Sciences Biologiques
Spécialité : Physiologie
Cellulaire et Physio-Pathologie (PCPP)
N° d'ordre :
N° de série :
Intitulé :
Etude cytogénétique des avortements
spontanés à répétition dans la région de
Constantine
Présenté et soutenu par : KHALLEF
Sabrine Le 27/09/2020
Jury d'évaluation :
Président : ROUABAH Leila (Professeur -
Université des Frères Mentouri, Constantine 1).
Encadreur : REZGOUN Mohamed Larbi (MC-A -
Université des Frères Mentouri, Constantine 1).
Examinateurs : DALICHAOUCHE Imène (MC-B -
Université des Frères Mentouri, Constantine 1).
Année universitaire
2019 - 2020

Tout d'abord je tiens à remercier ALLAH le tout
puissant de m' avoir donné la santé, la volonté, le
courage et la patience pour mener à terme ma formation et pourvoir
réaliser ce travail de recherche.
En guise de reconnaissance, je tiens à remercier,
très sincèrement, le Professeur ROUABAH Leila, responsable de la
formation Master PCPP, j'ai eu l'honneur et la chance de
bénéficier de ses connaissances et compétences, de ses
précieux conseils et de son suivi tout au long de notre parcours
académique. son sens élevé du devoir, le fait d'être
toujours montré à l'écoute ainsi que sa rigueur
scientifique impose l'estime et le respect . je vous remercie infiniment .
Mes remerciements s'adressent particulièrement au
Docteur REZGOUN Mohamed Larbi, pour son encadrement de qualité, sa
motivation professionnelle, ses conseils et critiques constructives, ses
corrections, sa gentillesse et sa patience ainsi pour le temps qu'il a
consacré à la réalisation de ce travail.
Mes remerciements vont également au Docteur Assia
ikhlef et à toute l'équipe du centre de recherche en
biotechnologie-Constantine, qui m' ont ouvert les portes des structures dont
ils avaient la responsabilité et qui ont tout mis à ma
disposition pour me permettre de travailler dans les meilleures conditions.
Je tiens à remercier les membres du jury pour leur
présence, pour leur lecture attentive de ce mémoire, ainsi que
pour les remarques qu'ils m'adresseront lors de cette soutenance afin
d'améliorer mon travail. Ainsi mes enseignants, espérant que vous
allez voir, dans ce manuscrit, les fruits du dévouement avec lequel vous
avez fait preuve durant les enseignements que vous nous avez
prodigué.
J'adresse également des remerciement à tous les
enseignants de la faculté des sciences de la nature et de la vie -
université des frères Mentouri Constantine 1 en
général, et aux membres de l'équipe de formation PCPP en
particulier, et qui ont déployé leurs efforts pour assurer une
formation aussi complète, pour aider et soutenir toute la promotion de
PCPP le long du cycle .
De peur d'en avoir oublier, je souhaite remercier tous ceux
qui ont contribué de près ou de loin à
l'élaboration de ce mémoire ainsi qu'à la réussite
de ce parcours universitaire.

Je dédie entièrement ce travail à mon
père et à ma mère, mes piliers, mes exemples, mes premiers
supporteurs et ma plus grande force. Merci pour votre présence, votre
soutien, votre aide financière, et surtout votre amour, merci de n'avoir
jamais douté de moi. Tout ce que j'espère, c'est que vous soyez
fiers de moi aujourd'hui.
À la personne la plus idéale qui fut dans ce
monde je dédie ce travail, c'est vrai qu'elle n'est pas avec nous pour
récolter le fruit de ses sacrifices, mais, elle reste toujours la plus
présente, à l'âme de mon grand-père HACENE qui a
fait de moi ce que je suis.
À mon cher frère IHEB et à la meilleure
des soeurs RAHMA, qui font de mon univers une merveille, je leurs souhaite
beaucoup de bonheur et de réussite.
À ma cousine MERIAM que je considère comme une
deuxième soeur, son mari Nadjim, et ses enfants : Rofeida, Soheib, et
Aline pour leur sympathie, et leur bienveillance, que dieu les
protège.
À mes oncles Nacer Eddine, Taher et Mohamed mes tantes
MAHBOUBA, BARIZA, DRIFA,ZAHIA, NACERA, SAMIRA, SALIHA, Meriem et Fatima Zohra
pour leur soutien et leur tendresse .
À toutes mes cousines surtout Faiza, Loubna, kawter et
Ibtihel pour leur gentillesse .
À l'âme de mes grands-parents BABA DRISS, MAMA
ZOHRA et MAMA WARDA, mon oncle MAAMAR, et ma tante Hania que dieu les accueille
dans son vaste paradis.
À mon âme soeur et ma meilleure amie Ryma, qui
depuis des années m'encourage, me comprend et a toujours
été à mes côtés , que dieu lui donne du
bonheur, santé et réussite .
Enfin je dédie ce travail à tata Samia Dekkiche
pour son courage, sa sagesse, et sa force et à tata NAZIHA AZIEZ pour
son affection et son amour sincère pour moi.
À tous ceux qui m'aiment... je les remercie tous.

Ac : Anticorps
ACL : Anticorps anti-cardiolipine
ADN : Acide
Désoxyribonucléique
APL : Anticorps antiphospholipides
ARNm : Acide Ribonucléique messager
AMPc : Adénosine monophosphate
cyclique
AS : Avortement Spontané
ASR : Avortement spontané à
répétition
ASRM : American Society for Reproductive
Medicine
AZF : Azoospermic factor
CD : Cluster de différenciation
CGH : Hybridation Génomique
Comparative
Covid-19 : Coronavirus disease 19
DFG : Débit de Filtration
Glomérulaire
DPN : Diagnostic prénatal
EIC : Effet interchromosomique
FCSR : Fausse Couche Spontanée
à Répétition
FISH : Hybridation in situ par
fluorescence
FNS : Formule Numération Sanguine
FSH : Hormone folliculostimulante
GnRH : Gonadotrophin Releasing Hormone
HbA1c : Hémoglobine glyquée
HCG : Hormone Chronique Gonadotrope
HCGR : Human Chronique Gonadotropin
Receptor
HFM : Hémorragie Foeto-Maternelle
HLA : Human Leukocyte Antigen
IFME : Incompatibilité
Foeto-Maternelle Érythrocytaire
IFN : Interféron
IL : Interleukine
LA : Anticoagulant Lupique
LH : Hormone Lutéinisante
LIF : Leukimia Inhibitory Factor
MFIU : Mort foetale in utero
MMP : Métalloprotéinase
MUC : Mucine
NK : Natural Killer
OMS : Organisation Mondiale de la
Santé
PCO2 : Pression artérielle du dioxyde
de carbone
PCR : Réaction de
polymérisation en chaine
pH : potentiel Hydrogène
PBS : Phosphate Buffered Saline
PMA : Procréation Médicalement
Assistée
PNS : Polymorphisme Nucléotidique
Simple
qPCR : réaction quantitative de
polymérisation en chaine
RCIU : Retard de Croissance In
Utero
SA : Semaine d'aménorrhée
SAPL : Syndrome des anti-phospholipides
SOPK : Syndrome des ovaires polykystiques
SVF : Sérum de Veau Foetal
T3 : Triiodothyronine
T4 : Thyroxine
TA : Tension Artérielle
TBG : Thyroxine Binding Globulin
TCA : Taux de Céphaline Active
TH1 : Lymphocytes T-helpers1
TNF : Tumor Necrosis Factor
TP : Taux de prothrombine
TSH : Hormone thyréostimuline
VIH : Virus d'immunodéficience
humaine

Introduction Page 01
Partie bibliographique
Chapitre I : Physiologie et physiopathologie de la
reproduction chez l'humain
|
1- Rappel anatomique ..
|
03
|
|
1-1-
|
Le péritoine utérin
|
04
|
|
1-2-
|
Le muscle utérin .
|
05
|
|
1-3-
|
La muqueuse utérine
|
05
|
|
1-4-
|
Vascularisation utérine
|
06
|
|
1-5-
|
Le col utérin
|
07
|
|
1-6-
|
Histologie fonctionnelle des ovaires
|
07
|
|
|
1-6-1- Organisation générale
|
07
|
|
|
1-6-2- Folliculogénèse
|
08
|
|
|
1-6-3- Ovulation
|
08
|
|
|
1-6-4- Corps jaune
|
08
|
|
|
1-6-5- Physiologie ovarienne
|
08
|
|
2-
|
Les étapes d'implantation embryonnaire
|
09
|
|
2-1-
|
La fécondation
|
09
|
|
2-2-
|
Division cellulaire
|
09
|
|
2-3-
|
Le blastocyste
|
10
|
|
2-4-
|
implantation embryonnaire
|
11
|
|
2-5-
|
Cellules et molécules importantes dans le dialogue
materno-foetale
|
12
|
|
|
2-5-1- L'hCG
|
12
|
|
|
2-5-2- La LH
|
14
|
|
3-
|
Développement embryonnaire et grossesse
|
15
|
|
3-1-
|
La période embryonnaire
|
15
|
|
|
3-1-1- La gastrulation.
|
15
|
|
|
3-1-2- La neurulation .
|
15
|
|
|
3-1-3- La métamérisation
|
15
|
|
3-2-
|
Évolution définitive des feuillets
|
16
|
|
4-
|
Modifications physiologiques durant la grossesse
|
16
|
|
4-1-
|
Modifications cardiovasculaires
|
16
|
|
4-2-
|
Modifications endocrines
|
17
|
|
|
4-2-1- La thyroïde
|
17
|
|
|
4-2-2- La parathyroïde
|
17
|
|
4-2-3- L'hypophyse
4-2-4- La glande surrénale
4-3- Modifications du métabolisme
glucidique .
4-4- Modifications hématologique .
4-5- Modifications des fonctions rénales
...
4-6- Modifications respiratoire
4-6-1- Modifications anatomiques
4-6-2- Modifications fonctionnelles
4-7- Modifications hépatiques
4-8- Modifications de la coagulation
4-9- Modifications immunitaires
5- Physiopathologie de la reproduction chez
l'humain ..
|
17
18
18
19
19
20
20
20
21
21
21
22
|
Chapitre II : Les avortements spontanés à
répétition
1- Définition 24
2- Symptomatologie 24
24
24
25
25
2-1- La menace d'avortement ...
2-2- L'avortement proprement dit
3- Classification générale
3-1- L'avortement thérapeutique
3-2- L'avortement non médicalisé
25
3-3- L'avortement à
répétition .. 25
3-4- L'avortement inévitable
25
3-5- L'avortement manqué ..
25
4- Classification de fausses couches en fonction de ...
25
25
25
4-1- La chronologie
4-1-1- Fausses couches spontanées
ultra-précoce ou infracliniques .....
4-1-2- Fausses couches spontanées
précoces 26
26
26
26
26
26
26
26
26
26
27
27
27
27
28
28
28
4-1-3- Fausses couches spontanées
tardives
4-2- Le stade évolutif
4-2-1- La FCS retardée ou grossesse
arrêtée
4-2-2- La mort foetale in utero .
4-2-3- La FCS menaçante ou menace de FC
...
4-2-4- La FCS en cours
4-2-5- La FCS complète
4-2-6- La FCS incomplète ou rétention
trophoblastique
5- Épidémiologie
6- Étiologie et hypothèse physiopathologique
6-1- Étiologie mécanique
6-1-1- Anomalie utérine
6-1-1-1- L'utérus cloisonné
6-1-1-2- Les synéchies
...
6-1-1-3- Les myomes
6-1-1-4- Autres malformations utérines
|
6-1-1-5- Endométriose
6-1-2- Les anomalies des annexes
6-2- Étiologie infectieuse
6-3- Étiologie endocrinienne
|
28
. 29
29
. 29
|
|
|
6-3-1- Syndrome des ovaires polykystiques
|
29
|
|
|
6-3-2- Insuffisance lutéale
|
30
|
|
|
6-3-3- Dysthyroïdies
|
30
|
|
|
6-3-4- Diabète
|
30
|
|
|
6-3-5- L'hyperprolactinémie
|
31
|
|
6-4-
|
Étiologie immunitaire
|
31
|
|
|
6-4-1- Syndrome des anti-phospholipides
|
. 31
|
|
|
6-4-2- Avortement immunologique
|
31
|
|
|
6-4-3- Le lupus
|
32
|
|
6-5-
|
Étiologie vasculaire et métabolique
|
33
|
|
|
6-5-1- L'hypertension et les maladies
vasculaires
|
33
|
|
|
6-5-2- Maladie coeliaque
|
33
|
|
6-6-
|
Thrombophilie
|
34
|
|
6-7-
|
Étiologie génétique
|
34
|
|
|
6-7-1- Anomalie chromosomique
|
34
|
|
|
6-7-2- Anomalie génique
|
35
|
|
6-8-
|
Étiologie fortuite et psychologique
|
35
|
|
6-9-
|
Autres étiologies
|
36
|
|
7-
|
La part de l'homme dans les ASR
|
36
|
|
8-
|
Démarche et prise en charge
|
37
|
|
8-1-
|
Interrogatoire
|
37
|
|
8-2-
|
Examen clinique
|
37
|
|
8-3-
|
Bilan paraclinique et prise en charge
|
37
|
|
8-4-
|
Bilan biologique
|
38
|
Chapitre III : Cytogénétique des
avortement spontané à répétition
1- Cytogénétique des avortements spontanés
à répétition 39
1-1- Caryotype du couple ..
39
1-2 Caryotype du produit de fausse couche .
39
2- Cytogénétique des avortements spontanés
à répétition .. 40
2-1- Les anomalies de structures
40
2-1-1- La translocation réciproque ..
40
2-1-2- Inversion chromosomique
41
2-2- Erreurs de méiose ..
41
2-3- Les anomalies de nombre ..
41
2-3-1- Les dysgonomies du chromosome X .
41
2-3-2- Les trisomies . 42
2-4- Erreurs de la mitose ..
43
2-4-1- La mosaïque placentaire et germinale
43
2-5- Erreurs de la fécondation .
44
2-5-1- Polyploïdie chromosomique
44
2-6- Les anomalies mineurs
44
45
45
46
46
47
47
49
49
49
50
50
51
51
2-6-1- Les variants chromosomiques
2-6-2- Biais de l'inactivation de l'X
2-7- Les troubles de gène unique et
polymorphisme nucléotidique simple
2-8- Fausses couches spontanées à
répétition inexpliquées
2-9- Prévalence des anomalies chromosomiques en
fonction du nombre de FCS
2-10- Implication paternelle
2-10-1- Fragmentation de l'ADN
2-10-2- Microdélétion du
chromosome Y
2-10-3- Aneuploïdie du sperme
2-10-4- Longueur des télomères
2-10-5- L'épigénétique du sperme
2-10-6- L'âge paternel
3- Le conseil génétique
Partie pratique
Patients et méthodes
1- Étude statistique
52
2- Étude cytogénétique
52
2-1- Matériel et réactifs
53
2-2- Méthodologie 55
Résultats
Résultats et discussion 59
Conclusion et perspectives . 78
Références bibliographiques
80
Résumés

Figure 01 : Localisation de l'utérus dans
le corps féminin . 03
02 : Anatomie de l'appareil génitale
féminin .. 04
03 : Vascularisation de l'utérus et des
annexes 06
04 : Les étapes de la fécondation
. 10
05 : Le blastocyste est composé d'une
masse cellulaire interne et d'une couche de cellule
trohphoblastique extérieur 10
06 : Les phases d'implantation embryonnaire
12
07 : Caryotype normal d'un individu de sexe
masculin (46,XY) (RHG) 58
08 : Caryotype normal d'un individu de sexe
féminin (46,XY) (RHG) 58
09 : Chromosomes métaphasiques d'un noyau
cellulaire (Couple 01 : Conjoint) 60
10 : Caryotype (46,XY) (RHG) (Couple 01 :
Conjoint) 60
11 : Chromosomes métaphasiques d'un noyau
cellulaire (Couple 01 : Conjointe) 61
12 : Caryotype (46,XY) (RHG) (Couple 0 :
Conjointe) 61
13 : Chromosomes métaphasiques d'un noyau
cellulaire (Couple 02 : Conjoint) 62
14 : Caryotype (46,XY) (RHG) (Couple 02 :
Conjoint) 62
15 : Chromosomes métaphasiques d'un noyau
cellulaire (Couple 02 : Conjointe) 63
16 : Caryotype (46,XY) (RHG) (Couple 02 :
Conjointe) 63
17 : Chromosomes métaphasiques d'un noyau
cellulaire (Couple 03 : Conjoint) 64
18 : Caryotype (46,XY) (RHG) (Couple 03 :
Conjoint) 64
19 : Chromosomes métaphasiques d'un noyau
cellulaire (Couple 04 : Conjoint) 65
20 : Caryotype (46,XY) (RHG) (Couple 04 :
Conjoint) 65
21 : Chromosomes métaphasiques d'un noyau
cellulaire (Couple 04 : Conjointe) 65
22 : Caryotype (46,XY) (RHG) (Couple 04 :
Conjointe) 65
23 : Distribution des anomalies autosomiques
(trisomies) détectées dans 1000 échantillons de
72
produits des fausses couches.....

Tableau I : Estimation de l'incidence des
anomalies caryotypiques à propos de 10 000 grossesse
70
1
Introduction
Une Fausse Couche Spontanée (FCS) ou un Avortement
Spontané (AS) est l'interruption naturelle ou accidentelle d'une
grossesse à un stade où l'embryon ou le foetus est incapable de
survivre. Les Avortements Spontanés à Répétition
(ASR) aussi appelés Pertes de Grossesses Récurrentes (RPL :
Recurrent Pregnancy Loss) ou Fausse Couche Spontanée à
Répétition (FCSR) sont définis par la survenue de trois
pertes embryo-foetales (ou plus) avant 24 Semaines d'Aménorrhée
(SA) (Merviel et al., 2005).
La définition des ASR a longtemps été
débattue et diffère selon les sociétés
internationales. Pour la société européenne d'embryologie
et de la reproduction humaine et le royal collège des
gynécologues et des obstétriciens, l'ASR fait
référence à trois pertes de grossesse consécutives,
y compris celles non visualisées. Cependant, selon la
société américaine de médecine de la reproduction,
elle est définie comme deux ou plusieurs pertes de grossesses cliniques
(documentées par écographie ou examen histo-pathologique) mais
pas nécessairement consécutives (El Hachem et al.,
2017).
La FCS est le plus souvent vécue douloureusement par
une patiente. C'est un évènement de vie potentiellement stressant
et traumatique. Selon l'Organisation Mondiale de la Santé (OMS), les AS
affectent 10 à 15% des grossesses déclarées ou
suspectées (Toupet et al., 2014). L'incidence des ASR varie
considérablement d'un rapport à l'autre en raison des
différences dans les définitions et les critères
utilisés, ainsi que dans les caractéristiques des populations
(Kolte et al., 2015). L'ASR primaire fait référence
à des pertes multiples chez une femme sans enfant viable auparavant,
tandis que l'ASR secondaire fait référence à des pertes
multiples chez une femme qui a déjà eu une grossesse
au-delà de 20 semaines. L'ASR tertiaire fait référence aux
pertes de grossesse multiples entre les grossesses normales (Silver et
al., 2011).
La plupart des membres de la communauté scientifique
ont préconisé de fixer à 20 semaines la durée
limite de la grossesse servant à définir l'avortement. En effet,
la durée-limite de la grossesse a relativement peu d'importance du point
de vue de la fréquence de l'avortement, car le nombre des morts foetales
entre 20 et 27 semaines est inférieur à celui des morts qui
surviennent avant 20 semaines. (OMS, 1970). Il importe encore de distinguer les
avortements précoces des avortements tardifs : les fausses couches
spontanées précoces sont des interruptions spontanées de
grossesses avant 14 semaines d'aménorrhée, avec 2 tableaux
cliniques différents, arrêt d'évolution de la grossesse
sans expulsion ou expulsion de l'embryon vivant mais non viable. Les fausses
couches tardives correspondent aux expulsions spontanées du foetus entre
la 14ème et la 22ème semaine
d'aménorrhée (Le Vavasseur et al., 2015).
2
Introduction
La classification étiologique des ASR est essentielle
pour comprendre le mécanisme physiopathologique, conduire les
explorations et décider d'un traitement. Les anomalies utérines,
les anomalies chromosomiques et génétiques, les perturbations
hormonales ou métaboliques, les causes infectieuses, les thrombophilies
héréditaires ou acquises, les anomalies immunologiques, les
causes masculines et les facteurs environnementaux sont les principaux facteurs
responsables d'ASR (Merviel et al., 2013). Les études
épidémiologiques montrent en effet que si le risque d'avortement
spontané est bien de 10 à 15% chez une femme qui n'a jamais fait
de fausse couche, il passe de 20 à 25% chez celle qui a
déjà fait une fausse couche, et à 30% chez une patiente
qui a présenté deux fausses couches et plus. Par ailleurs, ce
risque augmente significativement avec l'âge de la patiente (Diaby,
2006).
Les fausses couches spontanées à
répétition constituent un domaine de recherche très
intéressant qui mérite d'être exploré. À
travers ce modeste travail de recherche, nous nous sommes assignés les
objectifs suivants :
- Faire un rapport bibliographique actualisé sur l'aspect
physiopathologique et génétique
des avortements spontanées à
répétition en mettant l'accent sur les étiologies
possibles de ce dysfonctionnement. Les anomalies chromosomiques
associées seront largement détaillées.
- Réaliser une enquête
épidémiologique descriptive, prospective, par la
réalisation
d'un questionnaire avec des couples ayant vécus
des fausses couches spontanées à répétition,
recrutées au niveau du service de gynécologie du CHU Benbadis -
Constantine ainsi que de la maternité Sidi Mabrouk - Constantine.
- Contribuer à la détermination des
fréquences des fausses couches spontanées à
répétition
dans la région de Constantine ainsi que
l'étiologie sous-jacente de ce dysfonctionnement.
- Appliquer les techniques de diagnostic
cytogénétiques (caryotype standards et en bande R)
sur des
prélèvements sanguins issus de couples ayant subis des
avortements spontanées à répétition, et ce à
la recherche d'une étiologie cytogénétique à ce
dysfonctionnement.


Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
3
I- Physiologie de la reproduction chez l'humain 1- Rappel
anatomique
L'utérus est un organe musculeux creux médian,
impair et contractile en forme de poire inversée qui se situe dans la
région hypogastrique faisant partie du système de reproduction
féminin. Chez une femme adulte nullipare, sa taille moyenne est de 7,5
cm de long pour 5 cm de large, et 2,5 cm d'épaisseur, il est plus gros
après une grossesse, et s'atrophie après la ménopause. Il
est situé entre la vessie et le rectum dans un plan
antéro-postérieur et entre le plancher pelvien qui le soutient et
l'intestin, le cæcum, le colon sigmoïde, dans un plan vertical,
suspendu par son système ligamentaire (Le Moigne et Foucrier, 2009). Il
est séparé en 3 parties :
- Le fundus de l'utérus : la partie
supérieure en forme de dôme.
- Le corps de l'utérus : partie
centrale longitudinale.
- Le col de l'utérus : partie
inférieure qui débouche sur le vagin, et est
extra-péritonéale.
L'isthme est une région transitoire entre le corps et
le col de l'utérus. De part et d'autre de l'utérus, on trouve les
trompes de Fallope qui mènent aux ovaires d'environ 10 cm de long,
orientées postéro latéralement (figure 01) (Boury-Heyler
et al., 1981 ; Gerard et al., 2007).
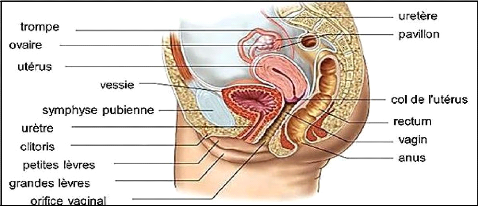
Figure 01 : Localisation de l'utérus
dans le corps féminin (vue de profil) (Courbiere, 2012).
L'utérus a pour origine la fusion de la portion caudale
des 2 canaux de Müller qui s'effectue lors de la 7ème
semaine de grossesse. Ces canaux sont aussi à l'origine des trompes
utérines, du col de l'utérus et du tiers supérieur du
vagin. Concernant l'appareil ligamentaire de l'utérus, vers le
3ème mois, le ligament inguinal va se différencier en
ligament rond en dessous de son croisement avec la corne utérine tandis
qu'au-dessus, il se différencie en ligament propre de l'ovaire (Devaud,
2008).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
4
L'utérus est constitué d'une paroi
utérine, épaisse et résistante qui comporte trois tuniques
: la séreuse, la musculeuse et la muqueuse (figure 02).
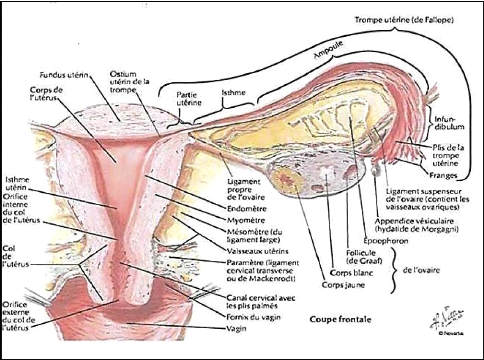
Figure 02 : Anatomie de l'appareil
génitale féminin (Courbiere, 2012).
1-1- Le péritoine utérin
Le péritoine utérin ou périmétrium
est d'autant plus adhérent qu'on s'approche du fundus. La limite de la
zone décollable est située sur la face antérieure à
la partie moyenne du corps utérin et sur la face postérieure
au-dessus de l'isthme. En avant, il recouvre la face vésicale du corps
et de l'isthme. Il se continue avec le péritoine vésical au
niveau du cul-de-sac vésico-utérin. En arrière, il
recouvre toute la face intestinale et descend jusqu'à la face
postérieure du vagin pour former le cul-de-sac recto-utérin ou
périmétrium est d'autant plus adhérant qu'on s'approche du
fundus (Le Moigne et Foucrier, 2009).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
5
1-2- Le muscle utérin
La majeure partie de l'utérus est constituée par
du muscle lisse, composé de faisceaux entrecroisés de cellules
musculaires lisses longues, fusiformes, groupées en couches mal
définies. Les faisceaux de fibres sont visibles sur la section
microscopique en coupes transversale, longitudinale et oblique. Le muscle est
vascularisé par un riche réseau d'artères et de veines
contenues dans du tissu conjonctif dense. Pendant la grossesse, le
myomètre augmente énormément de volume du fait des
divisions cellulaires (hyperplasie) et de la croissance cellulaire
(hypertrophie) (Abadijan, 2006).
Dans le corps, la proportion des cellules musculaires est
environ de 25% ; dans l'isthme et le col, au fur et à mesure qu'on
descend, les cellules musculaires deviennent plus rares. Le myomètre se
compose de trois couches mal individualisées :
- La couche moyenne, de loin la plus
développée, est particulièrement riche en vaisseaux.
- La couche interne, plus mince, se situe en
dessous de la muqueuse.
- La couche externe, également mince,
elle est formée de quatre lamelles qui contiennent
alternativement des tractus circulaires et longitudinaux (Maiga,
2002).
1-3- La muqueuse utérine
(endomètre)
L'endomètre, bordant la cavité utérine,
est constitué par un épithélium glandulaire cylindrique
simple, reposant sur un épais chorion de tissu conjonctif très
cellulaire appelé le chorion cytogène endométrial. Sous
l'influence des hormones (oestrogènes et progestérone),
sécrétées par l'ovaire durant le cycle ovarien,
l'endomètre subit des changements réguliers cycliques afin de
constituer un milieu favorable à l'implantation d'un ovule
fécondé (Abadijan, 2006). L'endomètre est divisé en
trois couches histologiques et physiologiques :
- La couche la plus profonde ou basale :
adjacente au myomètre, présente les changements
les moins importants durant le cycle menstruel et n'est pas
expulsée durant la menstruation.
- L'épaisse couche intermédiaire :
est caractérisée par un stroma à apparence
spongieuse ;
c'est la couche spongieuse.
- La couche superficielle : plus mince,
présente une apparence compacte ; c'est la couche
compacte. Les
couches compactes et spongieuses subissent des changements importants au cours
du cycle et disparaissent pendant la menstruation, de telle sorte qu'elles sont
réunies sous le terme de couche fonctionnelle (Abadijan, 2006).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
1-4- Vascularisation utérine
La vascularisation a un rôle fonctionnel et son
organisation est liée aux phénomènes de la menstruation.
Comme l'épithélium, elle subit des variations cycliques (figure
03).
a- Vascularisation artérielle
L'utérus est vascularisé essentiellement par les
artères utérines droites et gauches, branches collatérales
de l'artère hypogastrique et très accessoirement par les
artères ovariennes. L'artère utérine :
sinueuse, elle mesure 15 cm de longueur et 3 mm de diamètre,
elle forme de nombreuses anastomoses surtout en regard de l'aire placentaire.
Ces dimensions augmentent considérablement durant la grossesse (Zafra,
2015).
Après la délivrance (l'expulsion complète
du placenta), la rétraction de l'artère utérine
entraîne une augmentation de son diamètre.
L'artère ovarique : le calibre de
l'artère ovarique ou artère ovarienne va en augmentant de son
origine à la terminaison pour atteindre dans la région
sous-annexielle un calibre égal à celui de l'artère
utérine avec laquelle elle s'anastomose à plein canal. Elle
double et même triple pendant la grossesse (Kamina, 1995).
L'artère funiculaire : l'artère
funiculaire est pour l'utérus gravide peu importante sur le plan
fonctionnel (Kamina, 1995).
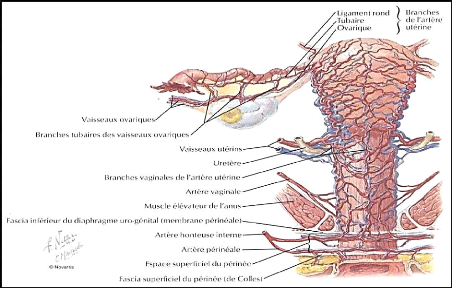
6
Figure 03 : Vascularisation de l'utérus
et des annexes (Kadri et al., 2013).
b-
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
7
Les veines : elles forment de chaque
côté de l'utérus le plexus utéro-vaginale et elles
se drainent dans la veine hypogastrique par les veines utérines (Zafra,
2015). Elles subissent une augmentation en nombre et en volume plus importante
que celles des artères.
c- Les lymphatiques : ceux du corps
utérin inclus :
- Un pédicule principal, utéro-ovarien, qui
aboutit aux noeuds latero-aortiques.
- Un pédicule accessoire qui aboutit aux noeuds iliaques
externes.
- Un pédicule inconstant qui suit le ligament rond
jusqu'aux noeuds inguinaux superficiels.
Ceux du col utérin comportent le pédicule
principal et aboutit aux noeuds iliaques externes et aux noeuds du promontoire.
Les lymphatiques du corps et du col sont anastomosés entre eux mais
aussi aux réseaux vaginal et annexiel.
d- L'innervation : les nerfs sont
regroupés en 2 pédicules au niveau du col et du corps :
- Pédicule cervico-isthmique.
- Pédicule corporel (Zafra, 2015).
1-5- Le col utérin
Le col est l'organe de la parturition, il se modifie, s'ouvre
et se dilate essentiellement pendant le travail. À partir de la
12ème SA, le col se porte progressivement en haut et en
arrière. Il est rose violacé, fait saillie dans le fond du vagin,
reliant ce dernier à la cavité utérine. Le col est
constitué d'un tissu conjonctif riche en collagène et pauvres en
cellules musculaires lisses, bordé par un épithélium
pavimenteux stratifié épais dans le côté où
il est exposé à un environnement hostile (Abadijan, 2006).
1-6- Histologie fonctionnelle des ovaires 1-6-1-
Organisation générale
L'ovaire est une glande sexuelle paire de la femme. Il produit
les ovocytes et sécrète les hormones sexuelles. De siège
intra péritonéal, cet organe mobile, est situé dans le
petit bassin, de part et d'autre de l'utérus, en arrière du
ligament large. C'est un organe ovoïde, long de 35 mm, large de 15
à 20 mm, épais de 10 à 15 mm. Il change d'aspect au cours
du cycle menstruel et en fonction de l'âge. Chez la femme en
période d'activité génitale, la surface de l'ovaire est
soulevée par des follicules, fissurée par des corps jaunes et
rétractée par des cicatrices. Sa vascularisation est
assurée par l'artère utéro-ovarienne et l'artère
utérine (Turpin, 1995 ; Courbiere, 2012). L'ovaire est constitué
de deux zones : médullaire et corticale.
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
8
- Zone médullaire : on lui distingue :
- Une zone hilaire : contient des reliquats
embryonnaires, des artères et veines
ovariennes, vaisseaux
lymphatiques, rameaux nerveux et des cellules ganglionnaires.
- Une zone parenchymateuse : faite de tissu
conjonctif lâche parcouru par les vaisseaux
qui se distribuent
à la corticale ou en proviennent.
- Zone corticale : c'est la région
superficielle, constituée du stroma cortical qui contient
les
organites ovariens (follicules et dérivés). Elle est
tapissée par l'épithélium ovarien.
1-6-2- Folliculogénèse
- Follicule primordial et primaire : le
follicule primordial est constitué d'un ovocyte
de 1er ordre entouré d'une couche de
cellules folliculeuses aplaties. Le follicule primaire est
caractérisé par les cellules folliculeuses devenant cubiques.
- Follicule secondaire : le follicule est
qualifié de secondaire au moment où
l'épithélium
folliculaire devient pluristratifié
formant ainsi la couche granuleuse. En outre, la zone pellucide apparaît
entre l'ovocyte et l'épithélium et au-delà de la membrane
basale, le stroma ovarien se transforme en thèque du follicule.
- Follicule tertiaire : il est
caractérisé par la présence d'une cavité (antrum)
dans la granulosa
et d'une thèque externe, couche fibreuse autour de
la thèque interne. Au terme de son développement, le follicule
est appelé follicule de De Graaf (Le Moigne et Foucrier, 2009).
1-6-3- Ovulation
Le follicule de De Graaf réagit à la
décharge d'hormones gonadotropes aboutissant à la
libération d'un ovule fécondable et permettant la constitution du
corps jaune.
1-6-4 -Corps jaune
Après l'expulsion de l'ovocyte, les trois couches de la
paroi folliculaire se réorganisent pour former une glande endocrine ; le
corps jaune. Il deviendra fonctionnel vers le sixième jour post
ovulatoire. En l'absence de fécondation, il régresse juste avant
les menstruations (Turpin, 1995).
1-6-5- Physiologie ovarienne
L'ovaire a une double fonction, exocrine (maturation et
émission cyclique de l'ovocyte) et endocrine (imprégnation
hormonale oestroprogestative de l'appareil génital féminin), sous
le contrôle des gonadotrophines hypophysaires : l'hormone
folliculostimulante (FSH) et l'hormone lutéinisante (LH) (Gougeon,
2008).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
9
L'activité ovarienne au cours du cycle comporte quatre
phases : la phase menstruelle qui marque le début de chaque cycle, la
phase folliculaire, la phase ovulatoire et la phase lutéale. La phase
folliculaire, qui dure de 12 à 16 jours, est marquée par le
recrutement d'un follicule primordial que sa maturation conduit à
devenir un follicule ovulatoire. Ce processus de recrutement se fait par le
passage du stade de follicule primordial à celui de follicule primaire,
puis se fait le passage au stade de follicule secondaire, le follicule continue
sa croissance inévitablement jusqu'à ce qu'il soit détruit
par atrésie ou qu'il ait ovulé. Les cinq stades ultérieurs
comportent la transformation en follicules préantraux de classe 1
marqués par l'apparition de cellules thécales. 70% de ces
follicules préantraux vont évoluer vers les stades
ultérieurs, passant par le stade de follicule antral débutant de
classe 2, puis de classe 3 et 4. Le passage de la classe 4 à la classe 5
a lieu pendant la phase lutéale du cycle précédent
l'ovulation, n'impliquant que des follicules prêts (qui dure jusqu'au
dernier jour du cycle ovarien). L'ovulation est caractérisée par
l'expulsion de l'ovocyte, ce qui suppose le développement d'une
activité protéolytique altérant la membrane basale et la
rupture des différentes couches de la thèque. Elle a
été précédée par un pic de l'LH lié
à l'augmentation rapide de l'oestradiol, durant 48 heures (Gougeon,
2008).
2- Les étapes d'implantation embryonnaire 2-1 - La
fécondation
La rencontre entre le spermatozoïde et l'ovocyte est
l'une des étapes essentielles de la reproduction. Elle nécessite
un ovocyte et un spermatozoïde tous deux compétents. Elle se
déroule généralement au tiers moyen supérieur de la
trompe de Fallope. Lors de la fécondation, le spermatozoïde entre
en contact avec la zone pellucide entourant l'ovocyte, cette zone pellucide
sert de barrière empêchant la polyspermie. La première
division a lieu très rapidement (durant les 24 premières heures)
et se déroule toujours dans la trompe. L'embryon n'atteint
l'utérus que durant le 5ème jour de son
développement. Il reste entouré des cellules de la corona
radiata jusqu'au stade blastocyste (Gridelet, 2015) (figure 04).
2-2- Division cellulaire (segmentation)
Les facteurs maternels précoces jouent un rôle
primordial durant le début du développement embryonnaire.
L'ovocyte supporte les premières divisions du zygote et fournit le
matériel protéique nécessaire jusqu'au stade 4-8 cellules.
Il apporte la grande majorité du cytoplasme et des composants
nucléaires de l'embryon. Les cellules embryonnaires, aussi
appelées blastomères, sont flexibles et totipotentes, autrement
dit, elles sont capables en se développant et en se multipliant de
donner tous les types cellulaires du corps humain (De Paepe et al.,
2014).
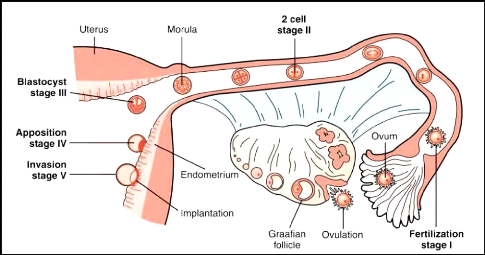
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
Figure 04 : Les étapes de la
fécondation (Strauss et Lessey, 2009).
2-3- Le blastocyste
Au stade blastocyste, l'embryon sort de la zone pellucide qui
l'entoure et ses cellules s'organisent, pour la première fois, en deux
types cellulaires différenciés, le premier, appelé
trophoblaste, qui forme une couche unicellulaire et forme le pourtour du
blastocyste, le second type forme la masse cellulaire interne cellules qui
donnent le futur foetus. Le trophoblaste est à l'origine du chorion qui
forme le placenta et la séparation entre l'embryon et les cellules
maternelles (De Paepe et al., 2013) (figure 05).
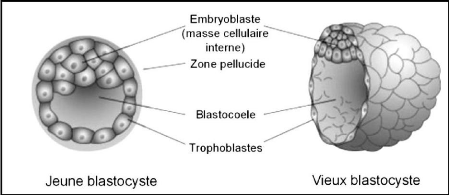
Figure 05 : Jeune vs vieux
blastocyste (Moore et Persaud, 2003).
10
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
11
2-4- Implantation embryonnaire
Le succès de l'implantation embryonnaire n'est pas
uniquement une préparation hormonale adéquate de
l'endomètre mais nécessite une interaction étroite,
synchronisée et réciproque entre les différentes cellules
de l'endomètre et l'embryon. C'est ce qui est appelé dialogue
materno-foetal durant la phase d'implantation. Ce dialogue s'établit
grâce à de nombreuses cytokines, facteurs de croissance,
chimiokines, récepteurs et molécules d'adhésion produits
et sécrétés par l'endomètre et par l'embryon
(Thouas et al., 2014). La plupart des grossesses biochimiques, qui
sont définies par l'incapacité de l'embryon à ce
développer correctement, et les fausses couches spontanées,
approximativement deux tiers, sont dues à une implantation
incomplète de l'embryon (Norwitz et al., 2000).
L'éclosion embryonnaire permet un contact direct avec les cellules
épithéliales de l'endomètre. Ce contact est appelé
phase d'apposition. Durant cette phase, de véritables contacts
dynamiques ont lieu entre le blastocyste et l'endomètre via des
molécules d'adhésion et des récepteurs :
- L'interleukine-1 (l'IL-1) :
sécrété par le blastocyste, elle augmente
l'expression d'intégrines
à la surface de l'endomètre
lui permettant d'interagir avec l'embryon.
- La mucine MUC-1 :
l'épithélium est recouvert sur toute sa surface
épithéliale de glycocalyx,
expliquant en partie sa nature non adhésive. Au niveau
du site d'implantation, une diminution de l'expression des mucines
(principalement de MUC-1) à la surface des cellules
épithéliales endométriales est observée et serait
impliquée dans le positionnement du blastocyste. (Brayman et
al., 2004).
- L'expression de selectines à la surface du blastocyste
ainsi que celles de sélectines
complémentaires à la surface de
l'épithélium endométrial durant la phase réceptive
(Genbacev et al., 2003).
Après la phase d'apposition vient la phase
d'adhésion, durant laquelle l'embryon et l'endomètre ont des
contacts plus précis via des molécules d'adhésion (et
principalement des intégrines). Le trophoblaste se sépare en deux
types cellulaires distincts : le syncytiotrophoblaste et le cytotrophoblaste
(Gridelet, 2015).
Le syncytiotrophoblaste forme la couche extérieure des
futures annexes embryonnaires qui est en contact avec les cellules
épithéliales de l'endomètre et la lumière de la
cavité utérine. Le cytotrophoblaste forme une couche interne qui
est en contact avec la masse cellulaire interne et le blastocoele. Le
syncytiotrophoblaste sécrète des enzymes lytiques et des facteurs
déclenchant l'apoptose des cellules épithéliales de
l'endomètre pour permettre l'invasion de l'embryon au sein de
l'endomètre qui correspond à la dernière phase de
l'implantation (Gridelet, 2015).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
12
L'invasion du blastocyste dans l'endomètre commence par
la liaison des cellules du syncytiotrophoblaste aux constituants de la membrane
basale et de la matrice extracellulaire de l'endomètre via les
intégrines. Le trophoblaste envahit ensuite le stroma conjonctif
sous-épithélial suite à une décomposition des
composants de la membrane basale et de la matrice extracellulaire. Cette
décomposition est liée à l'activation de
métalloprotéases (figure 06).
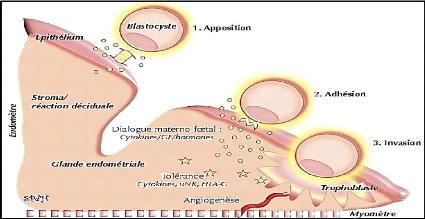
Figure 06 : Les phases d'implantation
embryonnaire (D'Hauterive, 2010).
L'endomètre joue donc un rôle important par
l'expression de protéines d'ancrage et par sa modification en
décidue lors de l'implantation. La placentation débute
après l'enfouissement total de l'embryon au sein de l'endomètre
et le placenta se forme suite à l'apparition de villosités dans
le trophoblaste (Gellersen al., 2007).
2-5 -Molécules et cellules importantes dans le
dialogue materno-foetal
À côté des molécules
d'adhésion qui représentent la « partie visible » du
dialogue existant entre le blastocyste et l'épithélium
endométrial, toute une série de molécules et de cellules
sont impliquées dans la régulation de l'implantation.
2-5-1- L'hCG
L'hormone chorionique gonadotrope (hCG) est une hormone
glycoprotéique de 36 à 40 kDa. Elle est composée de deux
sous-unités (á et â) liées par une liaison non
covalente. La sous-unité á, composée de 92 acides
aminés, est codée dans le chromosome 6 et est commune aux
différentes hormones de la famille des glycoprotéines dont font
partie la LH, la FSH et l'hormone thyréostimuline (TSH) (Policastro
et al., 1986).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
13
La sous-unité f3, qui est différente pour chaque
hormone, est codée sur différents gènes situés sur
le chromosome 19 (LH, hCG et TSH) ou sur le chromosome 11 (FSH). La
sous-unité f3 de l'hCG est codée dans 6 gènes
différents mais très similaires situés dans un groupe de
gènes sur le chromosome 19. L'hCG a une structure similaire à la
LH, mais contrairement à elle, l'hCG existe sous plusieurs formes,
connues comme l'hCG classique, l'hCG hyper-glycosylée et l'unité
f3 libre de l'hCG hyper-glycosylée (Cole, 2009 ; Fournier et
al., 2015). Chacune de ces 4 molécules ont des fonctions
physiologiques différentes.
Cette hormone a été appelée hormone
chorionique gonadotrope. La stimulation de la production de la
progestérone par le corps jaune a été longtemps la seule
fonction connue de l'hCG. La glycosylation des hormones aurait une influence
directe sur leur bioactivité. L'hCG hyper-glycosylée
interviendrait davantage dans l'implantation que l'hCG classique (Cole, 2009).
Trois équipes indépendantes ont montré que le blastocyste
pré-implantatoire sécrète l'hCG dans l'espace
utérin qui se lie à son récepteur hCGR sur la surface
déciduale. En réponse, la décidue se prépare pour
l'implantation (Srisuparp et al., 2001 ; D'Hauterive et al.,
2004). L'hCG augmente la sécrétion du Leukemia Inhibitory Factor
(LIF) et diminue celle de l'interleukine 6 par les cellules
endométriales, molécules connues pour leur influence sur
l'implantation embryonnaire (D'Hauterive et al., 2004). Il favorise la
différenciation des cytotrophoblastes en synciotiotrophoblastes. Il peut
réguler la synthèse des prostaglandines et la formation de
l'Adénosine monophosphate cyclique (AMPc). Une étude
publiée en 2013 a montré que les différentes formes d'hCG
stimuleraient l'invasion trophoblastique indépendamment du
récepteur classique à l'hCG, le LHCGR (Lee et al.,
2013). L'hCG a également des actions angiogéniques et
immunologiques, il augmente la formation des vaisseaux sanguins et la migration
et la maturation des péricytes (Berndt et al., 2006 ; Bourdiec
et al., 2013). L'hCG assure au placenta un approvisionnement en sang
maternel adéquat durant son invasion de l'endomètre fonctionnel
avec une nutrition optimale du foetus. L'hCG régule la
prolifération des cellules Natural killer utérines (uNK) (Bansal
et al., 2012). Ces cellules n'expriment pas le LHCGR et l'hCG agirait
directement sur ces cellules par un autre récepteur, le mannose
récepteur qui est exprimé par les uNK (Kane et al.,
2009). L'hCG agit également sur d'autres cellules immunitaires, les
monocytes, en promouvant leur fonction et leur sécrétion d'IL-8
(Kosaka et al., 2002), et aussi induisant les fonctions des
macrophages (Wan et al., 2007). En stimulant la fonction des
macrophages, l'hCG assainit l'endomètre en l'épurant des cellules
apoptotiques et en le défendant d'éventuelles infections, deux
mécanismes importants pour le maintien de la grossesse. Par ailleurs,
l'hCG influence la différentiation et la fonction des cellules
dendritiques, diminuant leur capacité à stimuler la
prolifération des LT (Wan et al., 2008).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
14
Au niveau des cellules nucléaires du sang
périphériques, l'hCG induit la sécrétion de
différentes cytokines, dont l'IL-1â et LIF et pourrait stimuler
l'invasion trophoblastique (Yu et al., 2015).
Finalement, l'hCG a différents effets sur les
lymphocytes T (Cluster de Différenciation CD4+), avec un impact positif
sur la prolifération des cellules T CD4+25+ et en attirant ces cellules
vers l'endomètre en début de grossesse (Khil et al.,
2007 ; Schumacher et al., 2009). Des études récentes
montrent par ailleurs qu'une trop grande quantité d'hCG, telle
qu'utilisée en Procréation Médicalement Assistée
(PMA) pour déclencher l'ovulation, serait délétère
pour la réceptivité utérine, tout est une question
d'équilibre (Evans et Salamonsen, 2013).
2-5-2- La LH
La LH est sécrétée par la glande
pituitaire et est une glycoprotéine hétérodimérique
avec une masse moléculaire de 28kDa comprenant deux sous-unités.
Cette hormone a un rôle essentiel dans la reproduction en induisant la
maturation ovocytaire et en provoquant l'ovulation durant le cycle menstruel.
La LH contrôle la production de la progestérone par le corps jaune
et si une grossesse survient chez l'être humain, l'hCG
sécrétée par les cellules embryonnaires supplante le
rôle de la LH pour la régulation de la production de la
progestérone. Pour l'établissement de la grossesse, la LH
favorise la décidualisation de l'endomètre. Des scientifiques ont
exploré les propriétés d'adhésion des lymphocytes
dans l'utérus murin et ont révélé que cette
adhésion était plus grande en présence de LH. Ces auteurs
ont suggéré que la LH pourrait activer les molécules
d'adhésion à la surface des précurseurs des cellules uNK,
ainsi qu'augmenter leur recrutement dans l'utérus. Ils suggèrent
encore que la LH pourrait avoir un impact sur le recrutement des cellules uNK
(Van Den Heuvel et al., 2005).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
15
3- Développement embryonnaire et grossesse 3-1- La
période embryonnaire
La période embryonnaire va de la quatrième
à la huitième semaine du développement, et au cours de
laquelle la gastrulation à lieu (Le Moigne et Foucrier, 2009).
3-1-1- La gastrulation
C'est la période de développement au cours de
laquelle se mettent en place les 3 feuillets primitifs de l'embryon, à
l'origine de tous les organes/tissus du nouveau-né et de l'adulte :
- Ectoderme ou ectoblaste, feuillet superficiel.
- Mésoderme ou mésoblaste, feuillet moyen.
- Endoderme ou endoblaste, feuillet inférieur (Bourenane,
2011).
Le domaine latéral forme l'ectoderme de surface,
précurseur de l'épiderme. L'endoderme qui donne naissance
à l'épithélium de surface des muqueuses digestive et
respiratoire ainsi qu'à l'épithélium glandulaire de
nombreuses glandes annexées à ces tractus. Les cellules
endothéliales des futurs vaisseaux sanguins de l'embryon dérivent
du mésoderme (Catala, 2002).
3-1-2- La neurulation
La neurulation primaire est la transformation de l'ectoderme
de la région sus-chordale en un tube neural primitif. La neurulation
secondaire, par opposition à la neurulation primaire, concerne le
développement de la partie terminale de la moelle
épinière. Rappelons que la ligne primitive produit avant de
disparaître (29ème jour), une structure
mésoblastique qui persiste et qui s'appelle l'éminence caudale.
Cette dernière sera à l'origine de la partie caudale du tube
neural et de l'élongation de la moelle épinière (Lowery et
Sive, 2004).
3-1-3- La métamérisation
Le mésoblaste para-axial est constitué de
cellules épiblastiques s'invaginant depuis le noeud primitif et depuis
la partie crâniale de la ligne primitive. Il forme une paire de
condensations cylindriques au contact immédiat de la notochorde.
Dès le début de la troisième semaine, ces cylindres vont
être segmentés en somitomères
(métamérisation) cranio-caudale. Les somitomères sont
constitués d'amas de cellules mésoblastiques prismatiques
pluristratifiés enroulés autour d'un axe central. C'est à
partir de ces somites que vont développer les 33 vertèbres de la
colonne vertébrale et les muscles squelettiques correspondants
(Lopez-Sanchez et al., 2001).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
16
3-2- Évolution définitive des
feuillets
Pendant le 2ème mois a lieu
l'organogénèse : les principaux organes se forment entre la
4ème et 8ème semaine. L'embryon de 8 semaines a des
membres, une face, des oreilles, un nez, des yeux, son coeur est
cloisonné, sa gonade différenciée. Son cerveau, son
estomac, son foie, ses reins sont fonctionnels. Durant la période
foetale, les organes qui se sont développés durant la
période embryonnaire (organogénèse) croissent et se
différencient. On estime que 90% des 4500 structures
répertoriées chez l'adulte apparaissent à l'état
d'ébauches déjà durant la période embryonnaire.
Dès la 8ème semaine, le foetus prend des allures
typiquement humaines, bien qu'à la fin du premier trimestre la
tête soit toujours proportionnellement plus grande. Les yeux en revanche
se déplacent vers l'avant, et tant le pavillon de l'oreille que la
crête du nez sont déjà formés. Il en va de
même pour les paupières qui sont nettement reconnaissables. Sur le
corps se développe le lanugo qui est un duvet très fin qui couvre
tout le corps du foetus, à l'exception des paumes des mains et des
plantes des pieds, et qui apparait dès la 18ème
semaine de grossesse. Ce duvet sera remplacé peu avant l'accouchement
par des cheveux terminaux (Moore et al., 2018).
4- Modifications physiologiques durant la
grossesse
La grossesse se caractérise par d'importants
ajustements physiologiques de tous les systèmes. Ces nouvelles
caractéristiques ne sont pas toujours à l'avantage de la
mère : elles permettent vraisemblablement une efficacité maximale
de la croissance et du métabolisme du foetus. Le foetus, par
l'intermédiaire des hormones placentaires déversées dans
la circulation maternelle, manipule les mécanismes homéostatiques
de la mère. Un grand nombre de modifications apparaissent tôt au
cours de la grossesse, anticipant les demandes métaboliques du foetus.
Il est utile de savoir quels paramètres biologiques sont
perturbés pour ne pas faire d'examens inutiles car
ininterprétables et pour ne pas les considérer comme
pathologiques et traiter à tort (Le Moigne et Foucrier, 2009).
4-1- Modification cardiovasculaires
Au cours du 1ier et 2ème
trimestre, les changements hémodynamiques apparaissent dès la
6ème semaine d'aménorrhée et sont
caractérisés par une augmentation du débit cardiaque
associé à une baisse des Résistances Vasculaires
Systémiques (RVS) et pulmonaires et une augmentation du volume
d'éjection systolique. Cette baisse d'RVS par la sécrétion
de la progestérone et d'autres facteurs qui est à l'origine de
cet état d'hyperdynamisme circulatoire. La baisse de la pression
artérielle stimule la sécrétion de la vasopressine,
l'hyper-débit est dû à l'augmentation de la volémie
qui est l'expression de la rétention hydrosodée par les
oestrogènes et de l'augmentation de la sécrétion
d'aldostérone puis à la tachycardie (Cabrol et al.,
2003, Thoulon, 2005).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
17
En parallèle, la progestérone permet
l'adaptation vasculaire à cette hypervolémie par un
relâchement des parois veineuses et des sphincters capillaires en
augmentant la capacité du lit vasculaire (Cabrol et al., 2003,
Thoulon, 2005).
Le coeur subit des modifications structurales semblables au
coeur d'un sportif de haut niveau. La taille des quatre cavités et
surtout de l'oreillette droite augmente dès la fin du premier trimestre.
Une hypertrophie ventriculaire gauche est également remarqué, et
une augmentation du diamètre des anneaux valvulaires pulmonaires et
tricuspides (Campos, 1993 ; Le Moigne et Foucrier, 2009).
4-2- Modifications endocrines 4-2-1- La
thyroïde
La TSH plasmatique diminue quand il y a le pic d'hCG
placentaire puis augmente en restant dans la normale. Il existe une
possibilité de goitre maternel par carence iodée car : il y a une
augmentation de la filtration glomérulaire et de l'excrétion
rénale d'iode, ou il y a des pertes d'iode au niveau du complexe
foeto-placentaire en fin de grossesse. L'hypertrophie de la glande est un
mécanisme compensateur, afin de maintenir la production hormonale.
L'hyper-oestrogènie entraîne un taux plus que doublé de la
protéine de transport, la Thyroxin Binding Protein (TBG) pendant la
grossesse. L'augmentation de la TBG accroît la liaison de thyroxine (T4)
et de triiodothyronine (T3). La production hormonale thyroïdienne augmente
d'au moins 40% dès le 1er mois, et atteint le seuil de 75% au
3ème mois. Il en résulte une augmentation de la
concentration de la T4 totale et à un moindre degré de la T3
totale proche de 1,5 fois la normale, apparaissant dès le début
de grossesse (Letombe, 2012).
4-2-2 La parathyroïde
Les modifications maternelles du métabolisme
phosphocalcique au cours de la grossesse sont importantes. Elles sont
principalement liées à la minéralisation rapide du
squelette foetal, une augmentation de l'absorption intestinale du calcium, une
diminution de l'excrétion rénale de calcium, une augmentation des
stocks calciques du squelette, une phosphoremie diminue jusqu'à la
30ème semaine d'aménorrhée, puis augmente
jusqu'au terme de la grossesse (Cabrol et al., 2003 ; Thoulon,
2005).
4-2-3- L'hypophyse
Le taux de prolactine sérique monte progressivement
pour être 5 à 10 fois plus élevé en fin de
grossesse. Plus sa production augmente, plus celles de FSH et de LH (qui sont
bas pendant la grossesse) diminuent. L'ocytocine augmente en cours de
grossesse, pour atteindre 165 ìg/ml.
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
18
Son rôle dans le déclenchement physiologique du
travail est discuté, sa sécrétion pendant le travail est
périodique et brève, et la fréquence des pics augmente au
fur et à mesure que le travail avance. L'ocytocine aurait un rôle
régulateur, mais non inducteur dans le déclenchement du travail
(Cabrol et al., 2003 ; Thoulon, 2005).
La progestérone collabore avec les oestrogènes
pour préparer l'endomètre à la nidation de l'ovule
fécondé. Un taux élevé de progestérone
inhibe également la libération de l'hormone de libération
des gonadotrophines hypophysaires (GNRH) et de prolactine. Lorsque la
concentration de progestérone baisse durant la grossesse ou que son
action est inhibée, une menstruation est déclenchée et
l'embryon est évacué en même temps que le revêtement
(Diaby, 2006).
4-2-4- La glande surrénale
L'unité foeto-placentaire sécrète une
grande quantité d'hormones stéroïdes ou peptidiques qui
modifient le fonctionnement des glandes endocriniennes maternelles. Les
stéroïdes sexuels augmentent oestrogènes,
progestérones et androgènes (élevés au
1ier trimestre et atteint leur maximum vers la
32ème SA), ainsi que l'hormone placentaire lactogène.
La synthèse des stéroïdes s'effectue à la fois dans
les surrénales maternelles et foetales. Le placenta ne synthétise
pas les stéroïdes, mais il joue un rôle important dans leur
métabolisme. Les catécholamines sont peu modifiées sauf
l'adrénaline et la noradrénaline qui diminuent. Le cortisol
plasmatique double dès le début de la grossesse. Mais, la
fraction libre restant stable, il n'y a pas de trouble clinique.
L'aldostérone (minéralo-corticoïdes) augmente
également car le système
rénine-angiotensine-aldostérone est stimulé pendant la
grossesse. Ce système est régulé par la volémie, la
natrémie et la kaliémie. La sécrétion est fortement
stimulée lors de l'accouchement (Cabrol et al., 2003 ; Thoulon,
2005).
4-3- Modification du métabolisme
glucidique
Au cours du 1ier et 2ème
trimestre, les métabolismes sont modifiés pour faire face aux
exigences du développement de l'oeuf et de ses annexes. Le
métabolisme de base augmente de 15 à 30% surtout, la prise de
poids est continue. Elle répond au développement de l'oeuf, de
l'utérus, des glandes mammaires, de l'eau et des électrolytes et
des réserves stockées. Le métabolisme glucidique est le
plus précocement et le plus profondément modifié pour
répondre aux besoins énergétiques. La prédominance
habituelle de l'hyper-insulinémie, en début de grossesse sera
responsable des hypoglycémies avec baisse de la tension
artérielle, le plus souvent associées à des fringales et
surtout à une acétonémie apparaissant au lever et se
traduisant par les nausées et les vomissements gravidiques classiques
(Catov et al., 2007).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
19
Au cours du 3ème trimestre, la croissance du
foetus devient exponentielle et ses besoins nutritionnels augmentent. Pour
s'adapter à cette nouvelle configuration, le métabolisme maternel
est réorienté vers un catabolisme : la progestérone, le
cortisol, les prolactines et la leptine induisent une diminution de la
réponse à l'insuline ayant pour conséquence une
augmentation des concentrations plasmatiques en acides gras libres et en
glycérol. Il en résulte une plus grande concentration de
nutriments maternels disponibles pouvant traverser le placenta et atteindre le
foetus (Catov et al., 2007).
4-4- Modifications hématologiques
Dès le 3ème mois de grossesse, la
masse sanguine augmente de façon précoce et progressive au cours
de la grossesse, avec une augmentation importante du volume plasmatique (+ 40%)
et dans une moindre mesure du volume globulaire (+ 15%). L'augmentation du
volume plasmatique n'est pas compensée par l'augmentation de
l'érythropoïèse, ce qui aboutit à une fausse
anémie par hémodilution. L'augmentation de
l'érythropoïèse nécessite un apport accru en fer et
en acide folique. La ferritine diminue au cours de grossesse (-35% au
3ème trimestre) du fait de la consommation foeto-placentaire.
L'hyperleucocytose, essentiellement à polynucléaires
neutrophiles, débute dès le 1ier trimestre et
s'accentue en fin de grossesse. Le taux des ions sodium (Na+),
potassium (K+) et chlore (Cl-) restent à peu
près stables, le calcium (Ca++) et le magnésium
(Mg++) diminuent à cause du transfert de ces
électrolytes de la mère au foetus et de l'augmentation de leur
filtration glomérulaire. La diminution du Ca++ entraine la
stimulation de la parathormone (Cabrol et al., 2003, Thoulon,
2005).
4-5- Modifications des fonctions
rénales
La grossesse normale entraîne des modifications
physiologiques de la fonction rénale et des compartiments liquidiens de
l'organisme.
- Augmentation du débit de filtration
glomérulaire (DFG) de 30 à 50% au cours
de la grossesse : elle
débute dès la 6ème SA, est maximale aux
2ème et 3ème trimestres puis diminue
à partir de la 36ème SA.
- L'augmentation du DFG s'explique par la forte augmentation
du flux plasmatique rénal,
auquel s'associent une diminution
précoce de l'albumine plasmatique et la diminution de la pression
oncotique (Le Moigne et Foucrier, 2009).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
20
- Augmentation de l'excrétion urinaire de sucres
réducteurs, de nombreux acides aminés
et de protéines, l'excrétion d'autres sucres
(lactose, fructose, xylose) est également augmentée pendant la
grossesse et une lactosurie est présente chez 50% des femmes enceintes
à terme. Il existe une protéinurie physiologique, pouvant aller
jusqu'à 300 mg/ 24 heures.
- L'augmentation de l'eau totale est de l'ordre de 7,5 kg. La
majeure partie de cette eau
est intracellulaire, mais il existe une
expansion associée des volumes extracellulaires. Le volume plasmatique
augmente de 50% pendant la grossesse. Cette hypervolémie est
perçue comme normale par les récepteurs volémiques
d'où l'inutilité des diurétiques ou de la restriction
sodée.
- L'osmolarité plasmatique diminue du fait de la
baisse de l'urée sanguine, une baisse modérée
de la
natrémie et une diminution du seuil osmotique de la soif (Letombe et
al., 2012; Pierre et al., 2009).
4-6- Modifications respiratoires 4-6-1- Modifications
anatomiques
Certaines modifications surviennent dès la
10ième à la 12ième SA,
c'est-à-dire bien avant que l'utérus refoule le diaphragme : les
cotes inferieures s'évasent, l'angle xiphoïdien passe de 70°
à 105°, le niveau du diaphragme s'élève de 4 cm, le
diamètre antéro-postérieur du thorax augmente de 2
à 3 cm. Il existe aussi une hypotonie des muscles abdominaux ainsi
qu'une congestion de l'arbre respiratoire (Cabrol et al., 2003,
Thoulon, 2005).
4-6-2- Modifications fonctionnelles
Il y a une augmentation du débit sanguin pulmonaire et
une augmentation de la captation de l'oxygène par minute. L'augmentation
des besoins en oxygène (pour le foetus et le placenta) est de 20
à 30%. L'élévation du taux de progestérone entraine
une augmentation du débit respiratoire avec une augmentation de la
ventilation alvéolaire d'où une hyperventilation qui entraine une
hypocapnie et une légère alcalose respiratoire. L'augmentation de
l'élimination du dioxyde de carbone (CO2) entraine une baisse de la
pression CO2 artériel. Il y a donc une polypnée et une hypocapnie
maternelles avec une tendance à l'alcalose respiratoire. Le potentiel
d'H+ (pH) reste cependant normal car il y a une augmentation de
l'excrétion rénale des bicarbonates et une diminution de leur
réabsorption. L'ensemble de ces phénomènes expliquent que
de nombreuses femmes enceintes se sentent facilement essoufflées (Cabrol
et al., 2003, Thoulon, 2005).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
21
4-7- Modifications hépatiques
Au niveau de la vésicule biliaire, la
progestérone entraine une hypotonie et donc une stase
vésiculaire. La vidange est donc ralentie. En parallèle, sous
l'effet des oestrogènes, la concentration en cholestérol est
accrue, augmentant l'indice de lithogénicité de la bile. Ces 2
phénomènes font que le risque de lithiase biliaire est
augmenté. Au 3ème trimestre, le foie n'est pas
palpable car il est refoulé par l'utérus en haut, à droite
et en arrière. Son volume est inchangé. Les conséquences
biologiques de ces modifications, surtout en fin de grossesse, sont multiples :
une augmentation des phosphatases alcalines de 2 à 15 fois la normale,
une augmentation des lipides et du fibrinogène ainsi qu'une diminution
de l'albumine, de la bilirubine et de la créatinine (Le Moigne et
Foucrier, 2009).
4-8- Modifications de la coagulation
La grossesse normale s'accompagne d'un état
d'hypercoagulabilité avec une augmentation du fibrinogène et des
facteurs VII, VIII et X, une diminution de l'activité fibrinolytique de
la protéine S. Une interprétation finaliste serait de
considérer la protection contre l'hémorragie du post-partum, au
prix du risque de thrombose.
- Facteurs de coagulation : les taux d'un
grand nombre d'entre eux (comme le fibrinogène
et le facteur VII
coagulant) augmentent considérablement dès le
3ème mois de grossesse pour atteindre un taux maximum au
3ème trimestre, mais les taux des facteurs XIII et XI
diminuent jusqu'à 50%.
- Activité fibrinolytique : elle
diminue progressivement au cours de la grossesse,
puis se normalise
rapidement après l'accouchement.
- La protéine S : sous sa forme
totale et libre diminue fortement en cours de grossesse
(Letombe et
al., 2012; Pierre et al., 2009).
4-9-Modifications immunitaires
Pour l'immunité humoral, la synthèse des
immunoglobulines (Ig) commence tôt complétant ainsi par le passage
transplacentaire de ces Ig l'arsenal immunologique du foetus. Par rapport
à la réponse immunitaire de type cellulaire, elle peut apparaitre
dès la 20ème semaine d'aménorrhée. En
effet, la grossesse constitue un paradoxe immunologique qui a permet la
formulation de plusieurs hypothèses afin de comprendre ce
mécanisme de tolérance de la greffe que constitue le foetus.
Parmi lesquelles, une hypothèse qui s'appuie sur le fait que le foetus
ne développe pas une maturité antigénique ne peut pas
être retenue car les antigènes apparaissent précocement
à la surface des cellules pendant la vie embryonnaire (Cabrol et
al., 2003 ; Bruyére et al., 2014).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
22
Une autre hypothèse qui consolide l'absence de la
réponse maternelle ou l'inaptitude de la mère à se
sensibiliser vis-à-vis des allo antigènes d'origine foetale ne
peut également être retenue comme hypothèse car cette
sensibilisation existe pour les antigènes du système ABO et du
système HLA (Human Leukocyte Antigen) (Poncelet et Sifer, 2011 ;
Bruyére et al., 2014).
5- Physiopathologie de la reproduction chez l'être
humain
L'infertilité est depuis plusieurs années,
considérée par l'organisation mondial de la santé comme
une pathologie à part entière, dans le cadre du concept de
santé reproductive qui reconnait à chaque être humain le
droit à la procréation (Poncelet et al., 2011). L'OMS
fournit diverses définitions pour l'infertilité. Certaines
définitions ont un caractère clinique, alors que d'autres ont
été élaborées dans des contextes
démographiques ou épidémiologiques (OMS, 2013).
Deux exemples d'une définition clinique de
l'infertilité de l'OMS :
- « Infertility is a disease of the reproductive system
defined by the failure to achieve
a clinical pregnancy after 12 months or more of regular
unprotected sexual intercourse ».
- « Infertility is the inability of a sexually
active, non-contracepting couple to achieve
pregnancy in one year »
(OMC, 2013c).
Les définitions démographiques ont pour but de
refléter les changements démographiques au sein d'une population
ainsi que les différences de fécondité entre diverses
populations (Gurunath et al., 2011 ; Poncelet et Sifer, 2011).
- « An inability to become pregnant with a live birth,
within five years of exposure based upon
a consistent union status, lack of contraceptive use,
non-lactating and maintaining a desire for a child » (OMC, 2013c).
Les définitions épidémiologiques se
rapportent la prévalence de l'infertilité médicale au sein
d'une population donnée. Ainsi, la mesure privilégiée est
l'absence de grossesse. L'exposition au risque de devenir enceinte doit
être prise en compte, bien qu'il soit défini de façon
variable d'une étude à l'autre (Gurunath et al.,
2011).
- « Women of reproductive age (15-49 years) at risk of
becoming pregnant (not pregnant, sexually active, not using contraception and
not lactating) who report trying unsuccessfully for a pregnancy for two years
or more » (OMC, 2013c).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
23
Malgré les variations de termes et de
définitions de l'infertilité, certains auteurs ont
signifié que l'infertilité correspondait davantage à la
définition de l'incapacité plutôt qu'à celle de la
maladie. Puisqu'une personne présentant une infertilité
idiopathique peut-être en parfaite santé physique et
émotionnelle malgré l'échec de la reproduction. En effet,
l'infertilité peut être causée par une maladie telle que
l'endométriose ou le cancer des testicules. Elle peut également
être causé par une dépression et des troubles
d'anxiété. Les défauts de différenciations des
spermatozoïdes, d'implantation embryonnaire, ou également un
dysfonctionnement utérin, les maladies endocrines, les anomalies du
cycle menstruel et tubaires, chez la femme, l'hypogonadisme
hypo-gonadotrophique, l'insuffisance testiculaire, et anomalies du spermogramme
chez l'homme sont parmi les causes de l'infertilité du couple (Poncelet
et Sifer, 2011 ; Khetarpal et Singh, 2012). L'infertilité peut
être causée par des anomalies de la fécondation, elles
surviennent si :
- L'un des gamètes est porteur d'une anomalie
chromosomique, celle-ci sera transmise
au zygote.
- Deux spermatozoïdes entrent ensemble dans l'ovocyte :
ce phénomène rare est à l'origine
d'un oeuf à 66
chromosomes + 3 chromosomes sexuels (triploïdie).
- Une erreur de réplication de l'ADN des pronucléus
qui survient au moment de l'amphimixie.
- La répartition des chromosomes au moment de la formation
des deux blastomères est inégale.
C'est l'étiologie retrouvée qui oriente la prise
en charge. Celle-ci peut être l'abstention thérapeutique, lorsque
l'infertilité est récente, la femme jeune et l'exploration
initiale négative. À l'autre extrême en cas de pathologies
sévères intéressant l'un ou les deux membres du couple, on
fait appel aux techniques les plus sophistiquées d'aide médicale
à la procréation (Poncelet et Sifer, 2011 ; Bry-Gauillard et
al., 2014).

1- Chapitre II Les Avortements Spontanés
à Répétition
24
Définition
L'Avortement spontané selon l'OMS correspond à
l'expulsion hors de l'organisme maternel d'un foetus de moins de 500 grammes ou
de 22 SA (Garcia-Enguidanos et al., 2002). Les avortements
spontanés apparaissent souvent de façon aléatoires, et
nombreuses sont les femmes qui vont en être touchées au cours de
leur vie. Plusieurs femmes recevront un diagnostic d'avortement spontané
suite à des saignements vaginaux et/ou des crampes utérines.
D'autres n'auront eu aucun signe avant-coureur de cet arrêt de grossesse
que sont les saignements ou les crampes, par exemple, et l'apprendront
seulement au moment de leur première échographie (Morin et Vanden
Hof, 2006). L'avortement spontané peut être classé, selon
ses caractéristiques cliniques, en différentes catégories
(Poncelet et Sifer, 2011).
2- Symptomatologie
Plusieurs signes peuvent être rencontrés en fonction
du stade évolutif. 2-1- La menace d'avortement
Métrorragie et coliques discrète : ces
métrorragies sont faites de sang rouge ou noir mais toujours sans
caillots. Un fait important est à signaler ici : l'absence de
contractions utérines et de fièvre. C'est une phase importante
car un traitement entrepris précocement peut sauver l'oeuf s'il est
vivant et génétiquement viable. À l'examen, le col est
long et fermé, l'utérus est d'une taille en rapport avec le terme
de la grossesse (Daftary, 2005).
2-2- L'avortement proprement dit
La patiente consulte pour des métrorragies
persistantes, d'un sang rouge avec des caillots et/ou des douleurs à
type de contractions utérines rythmées. À l'examen on
retrouve :
- Au speculum de saignements souvent abondants gênant
l'examinateur, le produit est expulsé
au niveau du vagin.
- Au toucher vaginal on retrouve un col modifié,
ramolli, raccourci, surtout ouvert
aux 2 orifices. L'utérus est d'un
volume inférieur ou supérieur au terme de la grossesse (Sennaoui
et al., 2015).
3- Chapitre II Les Avortements Spontanés
à Répétition
25
Classification générale 3-1- L'avortement
thérapeutique
C'est l'interruption de la grossesse décidée
par le médecin pour une raison médicale. Elle peut être
eugénique lorsqu'il existe une malformation foetale reconnue ou
suspectée. Elle peut se faire pour sauvetage maternel si
l'évolution de la grossesse engendrera un risque majeur pour la
santé ou la vie de la mère (Merger et al., 2003).
3-2- L'avortement non
médicalisé
Selon L'OMS, il est défini comme : « une
intervention visant à interrompre une grossesse non
désirée soit par des personnes qui ne possèdent pas les
compétences nécessaires soit dans un contexte où les
conditions sanitaires minimales n'existes pas ou les deux à la fois
» (OMS, 2019).
3-3- L'avortement à
répétition
Selon l'OMS, c'est la survenue de deux FCS ou plus ;
consécutifs chez la même patiente, également appelé
: maladie abortive (Lansac et al., 2002).
3-4- L'avortement inévitable
Le processus d'avortement est réellement
déclenché, la grossesse sera expulsée tôt ou tard ;
aucun retour en arrière n'est possible car la contractilité
utérine est intense et ne s'arrête qu'à l'expulsion du
produit de la grossesse en dehors de la cavité utérine (Daftary,
2005).
3-5- L'avortement manqué
C'est une rétention des produits de conception bien
après la mort reconnue du foetus avec une période d'une
durée de 2 mois de façon conventionnelle dans la
définition (Daftary, 2005).
4- Classification des fausses couches spontané
à répétition en fonction de 4-1- La
chronologie
4-1-1- Fausses couches spontanées
ultra-précoces ou infracliniques
Appelées aussi avortements menstruels spontanés,
ou nidations précocement abortives, survenant avant l'implantation du
blastocyste ou juste après l'implantation, ce type d'avortement
désigne tout avortement spontanée survenant dans les
7ème au 10ème jour suivant l'implantation
ovulaire, ce qui correspond aux 8ème au
17ème jour post-conceptionnel (Abbara, 2015).
Chapitre II Les Avortements Spontanés à
Répétition
26
4 1-2- Fausses couches spontanées
précoces
Qui survient à partir du 18ème jour
post-conceptionnel jusqu'à la fin du premier trimestre, après que
l'oeuf ait été bien implanté dans l'endomètre
utérin. La grossesse est cliniquement décelable
(Andriatsiaronimanga, 2005 ; Diacoumba, 2008).
4-1-3- Fausses couches spontanées
tardives
L'avortement spontané du 2ème
trimestre de la grossesse : c'est l'expulsion spontané au
2ème trimestre de la grossesse d'un foetus avant la
22ème SA ou moins de 500 grammes.
4-2- Le stade évolutif
4-2-1- La FCS retardée ou grossesse
arrêtée : il s'agit d'une découverte fortuite
d'une grossesse arrêtée au premier trimestre avec un embryon sans
activité cardiaque ou un oeuf clair.
4-2-2- La mort foetal in utéro :
avortement après 25 SA.
4-2-3- La FCS menaçante ou menace de FC :
présence de métrorragie au premier trimestre, absence
d'expulsion en cours avec un col fermé.
4-2-4- La FCS en cours ou inévitable :
associant douleur et métrorragie d'intensité croissante,
col ouvert et expulsion en cours.
4-2-5-La FCS complète : définie
par une disparition des douleurs, une diminution des saignements, col
fermé après une expulsion associée à une
vacuité utérine à l'échographie.
4-2-6-La FCS incomplète ou rétention
trophoblastique : avec rétention du produit de conception qui
se manifeste par la persistance de douleur et/ou de saignements secondaires
à la persistance d'une rétention retrouvée à
l'échographie (Agostini et al., 2006 ; Beucher, 2010).
5- Épidémiologie
L'incidence des ASR correspond au nombre des femmes qui
souffrent chaque année des pertes consécutives de grossesse dans
une population à risque. Les ASR sont fréquentes, concernant 15
à 20% des grossesses et au moins une femme sur quatre durant sa
période d'activité génitale présente une FCS
(Beucher et al., 2014). En outre, ces chiffres peuvent être
incertain, car certaines femmes ne se rendent pas compte qu'elles ont
avorté et d'autres ne consultent pas un médecin même en cas
de doute (Sennaoui et al., 2015).
Chapitre II Les Avortements Spontanés à
Répétition
27
Pour chaque année, de 2003 à 2012, une
étude a été menée sur l'incidence des ASR et qui a
été calculée dans deux différentes populations
à risque : la première population a inclus les femmes
âgées entre 18 et 42 ans, la deuxième population a inclus
les femmes enregistrées comme enceintes (qui ont accouché ou
ayant vécu des fausses couches). L'incidence des ASR dans les deux
populations a augmenté de 74% et 58%, respectivement, au cours de la
période d'étude (Rasmark et al., 2017).
6- Étiologie et hypothèse
physiopathologique 6-1- Étiologie mécanique
Des anomalies utérines seraient trouvées chez
jusqu'à 19% des femmes atteintes d'ASR et peuvent être
classées comme acquises ou congénitales. Les anomalies acquises
comprennent les myomes et les polypes de l'endomètre, les
synéchies tandis que l'utérus cloisonné est classé
parmi les anomalies congénitales (Jaslow et al., 2010).
6-1-1- Anomalie utérine
6-1-1-1- L'utérus cloisonné
Les avortements sont fréquents dans les utérus
cloisonnés. Plusieurs mécanismes sont proposés pour
expliquer les avortements :
- Un défaut de croissance de la taille de
l'utérus qui ne peut s'adapter à la grossesse,
théorie contredite par les résultats des
métroplasties abdominales qui réduisent cette taille.
- Une incompétence cervicale, parfois
secondaire aux manoeuvres instrumentales
lors des avortements précédents mais qui n'explique
pas les avortements du premier trimestre.
- Une vascularisation et une innervation anormale de
la cloison à l'origine
d'une implantation
défectueuse. Le site d'implantation est fondamental, les grossesses qui
s'implantent ailleurs que sur la cloison se déroulent normalement.
Les métroplasties abdominales bien qu'efficaces avaient
l'inconvénient théorique d'imposer une césarienne, mais
avaient surtout la réputation d'entraîner environ 30% de
stérilités post-opératoires. La métroplastie
contrôlée par hystéroscopie ou échographie est
efficace et sans danger. L'indication de la résection
hystéroscopique de la cloison sera posée dans un contexte
d'avortements à répétition, d'avortement au second
trimestre ou d'accouchement prématuré. Dans une série de
165 patientes dont 67 ont eu deux fausses couches et 98 au moins trois, on
retrouve à l'hystéroscopie 28% d'anomalies utérines dans
le premier cas et 32% dans le second (Weiss et al., 2005).
Chapitre II Les Avortements Spontanés à
Répétition
28
6-1-1-2-Les synéchies
Les synéchies correspondent à l'accolement par
adhérences des faces internes de l'utérus. Elles peuvent
être totales lorsqu'elles intéressent l'ensemble de la
cavité et l'isthme utérin ou être partielles lorsqu'elles
concernent une portion variable de la cavité utérine et/ou de
l'isthme (Bricou et al., 2009). Les synéchies sont
présentes chez environ 1,5% des patientes ayant un
antécédent opératoire et chez 7 à 21,8% des
patientes présentant des ASR (Ventolini et al., 2004).
6-1-1-3-Les Myomes
Le léiomyome, plus communément appelé
myome ou encore fibrome utérin, est une tumeur bénigne de
l'utérus humain, qui se développe aux dépens des cellules
musculaires lisses (Bazot et al., 2004). La transformation du
myomètre en fibrome implique des anomalies génétiques,
l'influence de facteurs de croissance locaux, et surtout l'action des
oestrogènes et de la progestérone. Les fibromes augmentent le
risque de fausse couche spontanée en début de grossesse (Bukulmez
et Doody, 2006). Cela concerne uniquement les femmes ayant de volumineux
fibromes sous-muqueux qui déforment la cavité utérine, ou
lors de la croissance rapide du volume du myome (Ouyang et al.,
2006).
6-1-1-4- Autres malformations utérines
- L'hypotrophie utérine : c'est un
utérus d'aspect rigoureusement normal mais
dont les dimensions sont réduites.
- L'hypoplasie utérine : c'est un
utérus dont les dimensions sont réduites et dont
la
morphologie et les proportions sont également modifiées. Les
dimensions et les proportions sont celles d'un utérus infantile ou
foetal.
- De béance cervico- isthmique :
c'est la rupture du verrou de la chambre utérine
(Diaby,
2006).
6-1-1-5- Endométriose
L'endométriose se définit par la
présence, en situation ectopique, de foyers composés d'un tissu
possédant les mêmes caractéristiques morphologiques et
fonctionnelles que l'endomètre (cellules glandulaires et stroma). Ces
foyers, en se comportant comme l'endomètre, sous l'influence des
hormones, entraînent des lésions et des signes spécifiques
de la maladie (Daraï et al., 2007 ; Poncelet et Sifer, 2011).
Chapitre II Les Avortements Spontanés à
Répétition
29
Sur de petites séries rétrospectives
étudiant son effet dans le cadre de cycles d'AMP, elle serait
associée à une diminution des taux d'implantation et à une
augmentation des taux de FCS allant jusqu'à 50% contre 2,8% en l'absence
d'adénomyose (Maheshwari et al., 2012).
6-1-2-Les anomalies des annexes
Plusieurs anomalies sont décrites dont la
majorité concerne : l'artère ombilicale unique, les noeuds du
cordon, les anomalies du placenta et l'hydramnios qui est un excès de
liquide amniotique. Ces anomalies sont associées à des
complications maternelles et foetales telles que : mort foetale ou le
décollement placentaire prématuré (Keita, 2008).
6-2- Étiologie infectieuse
Toute infection aigue peut provoquer des avortements. Ces
avortements peuvent récidiver si l'infection n'est pas découverte
et guérie. L'infection arrive soit :
- Par voie hématogène
(nécessité de traverser la barrière placentaire
au niveau des villosités) :
les infections virales seraient plus
fréquentes durant le 1ier trimestre car les virus et les
protozoaires traversent la barrière placentaire plus facilement que les
bactéries.
- Par voie ascendante : principalement les
infections bactériennes trans-cervicales
après le premier
trimestre (Poncelet et Sifer, 2011 ; Sennaoui et al., 2015).
6-3- Étiologie endocrinienne
6-3-1- Syndrome des ovaires polykystiques
Le Syndrome des Ovaires Poly-Kystiques (SOPK) est l'un des
désordres hormonaux féminins les plus communs. Ses composantes
sont multiples : reproductifs, métaboliques, néoplasiques et
cardiovasculaires, ont un impact majeur sur la santé publique.
L'excès d'androgène et la résistance à l'insuline,
probablement d'origine génétique, sont à la base d'une
grande partie de la symptomatologie clinique. La résistance à
l'insuline du SOPK semble s'accompagner d'un plus grand risque
d'intolérance au glucose, de diabète de type 2, d'anomalies
lipidiques et peut entraîner le développement de maladies
cardiovasculaires. En cas de traitement inducteur par citrate de
clomifène dans le cadre de SOPK anovulant, est mis en évidence un
taux de fausses couches d'environ 20%, potentiellement lié à
l'effet anti-oestrogénique responsable d'une atrophie
endométriale avec échec d'implantation. Toutefois, aucune
étude ne met en évidence un risque accru d'ASR en cas de SOPK. Il
est important en cas de SOPK avéré de rechercher un syndrome
métabolique associé (Koivunen et al., 2008).
Chapitre II Les Avortements Spontanés à
Répétition
30
6-3-2-Insuffisance lutéale
Après ovulation, le corps jaune sécrète
de la progestérone qui provoque une transformation
sécrétoire de l'endomètre pour que l'implantation puisse
se produire
avant que le placenta ne prenne le relais de la production de
progestérone. Cette dernière produite par le corps jaune fournit
également le soutien nécessaire à une grossesse
précoce. Un défaut dans la fonction du corps jaune est non
seulement associé à l'échec d'implantation, mais aussi
à une augmentation du risque de fausse couche (Haas et Ramsey, 2008).
Un dysfonctionnement en phase lutéale est
associé à une production de progestérone insuffisante et
à un risque d'échec d'implantation conséquent. Bien que
certaines estimations suggèrent qu'il peut représenter un
pourcentage important des cas d'infertilité, il reste peu de consensus
sur ses critères diagnostiques, l'étiologie ou la réponse
au traitement. La supplémentation par un progestatif est le traitement
le plus couramment utilisé lorsque la dysfonction de la phase
lutéale est suspectée. Cependant, comme la majorité des
études cliniques ont mis l'accent sur le soutien de la phase
lutéale en cours d'AMP (utilisation d'analogues de la GnRH ou aspiration
des cellules de la granulosa au cours de la ponction ovocytaire), on en sait
beaucoup moins sur le rôle des progestatifs chez les femmes
présentant une infertilité due à un dysfonctionnement de
la phase lutéale en dehors des cycles d'AMP. Malgré l'utilisation
répandue de ces progestatifs et de nombreuses années
d'expérience clinique, les essais contrôlés bien conduits
sont actuellement limitées et il semblerait qu'en cas de FCS sporadique,
les progestatifs soient inefficaces pour prévenir le risque de
récidive de FCS (Haas et Ramsey, 2008).
6-3-3- Dysthyroïdies
L'hyperthyroïdie est associée à une
augmentation du risque de fausse couche spontanée. De même que
l'hypothyroïdie auto-immune (maladie d'Hashimoto) par le biais des
anticorps antithyroïdiens anti-thyro-peroxydase (TPO) et anti
thyroglobuline. Une augmentation du risque de fausse couche spontanée a
également été mise en évidence en début de
grossesse en cas de TSH supérieure à 2,5 mUI/L (De Groot et
al., 2012).
6-3-4- Diabète
Le diabète équilibré n'est pas
responsable de FCS, alors qu'un diabète
déséquilibré est associé à une majoration du
risque de FCS (Jovanovic et al., 2005).
Chapitre II Les Avortements Spontanés à
Répétition
31
6-3-5- L'hyperprolactinémie
L'hyperprolactinémie est fréquemment
associée à des anomalies ovulatoires. Elle pourrait
également être imputée dans les ASR à une
altération de la folliculogénèse ou de la maturation
ovocytaire ou à une phase lutéale courte. Une étude
portant sur un sous-groupe de patientes ayant fait des ASR dans un contexte
d'hyperprolactinémie a montré l'efficacité de la
bromocriptine sur le maintien des grossesses ultérieures. Le rôle
délétère de l'hyperprolactinémie n'a pas
été confirmé par une autre série, dont le faible
effectif limite cependant l'intérêt (Gurbuz, 2003 ; Poncelet et
Sifer, 2011).
6-4- Étiologie immunitaire
6-4-1- Syndrome des anti-phospholipides
Le Syndrome des Anti-Phospho-Lipides (SAPL) est une
entité complexe associant des anomalies cliniques (de type thrombotique)
et biologiques (la présence d'anticorps de type anti-phospholipides). Il
se définit en obstétrique par l'association
d'antécédents de pertes foetales et de la présence
d'anticorps anti-phospholipides (anti-cardiolipides et/ou anticoagulant
circulant). Les Anti-Phospho-lipides (APL) pourraient nuire à la
formation du placenta. Les deux auto-anticorps les plus fréquents
l'anti-coagulant-lupique et l'anticorps anti-cardiolipine (ACL) sont
dirigés contre la phospho-sérine et la
phospho-éthanol-amine, protéines adhésives
impliquées dans la formation et l'invasion trophoblastique. Des APL
inhibent la synthèse d'hCG par du trophoblaste murin en culture. Ainsi,
les ASR, reconnues comme facteurs de risque de pathologies placentaires
thrombotiques tardives comme la prééclampsie ou l'hématome
rétro-placentaire pourraient être dues à des thromboses
placentaires précoces (Arvieux et Hachulla, 2002 ; Lejeune, 2003).
6-4-2- Avortement immunologique
Les Incompatibilités Foeto-Maternelles
Érythrocytaires (IFME) sont définies par la fixation
d'allo-anticorps maternels sur le globule rouge du foetus, anticorps transmis
pendant la grossesse et qui ont pour cible les antigènes de groupes
sanguins du foetus, d'origine paternelle. Les complexes immuns ainsi
formés provoquent une immuno-hémolyse tissulaire. Les anticorps
anti-érythrocytaires peuvent se développer au cours ou au
décours d'une grossesse par activation du système immunitaire
maternel, après une première étape de sensibilisation par
des hématies foetales porteuses de caractéristiques paternelles
parvenues dans la circulation maternelle (Cortey et al., 2012).
Chapitre II Les Avortements Spontanés à
Répétition
32
Ce passage d'hématies correspond à des
Hémorragie Foeto-Maternelle (HFM) qui sont spontanées et dans ce
cas occultes en cours de grossesse, avec une fréquence de 45% au
troisième trimestre. Les HFM peuvent être provoquées :
fausse-couche, interruption volontaire de grossesse, mort foetale in
utero, accouchement, etc. (Cortey et al., 2012). La grossesse
pourrait échouer par défaut d'anticorps bloquant.
L'hypothèse des anticorps bloquants a inspiré les traitements
immunologiques dont les fondements théoriques sont :
- La mère met en place une réponse immunitaire
cellulaire qui doit être bloquée.
- Les anticorps bloquants apparaissent dans toutes les grossesses
d'évolution normale.
- En l'absence de ces anticorps, il y a avortement.
L'identité des antigènes HLA entre les deux
partenaires a été accusée d'être
à l'origine du défaut de synthèse des facteurs
bloquants.
Des dysfonctionnements de l'immunité cellulaire sont
à l'origine de plusieurs hypothèses. Une orientation de la
réponse cellulaire T vers la voie T-helper1 (Th1) produirait des
cytokines responsables de l'avortement. Chez les femmes affectées, le
trophoblaste, le sperme, les microbes activeraient le système
immunitaire maternel qui produirait les cytokines Th1, les interférons
(IFN-y) et les (Tumor Necrosis Factor) TNF-a, capables d'inhiber la
prolifération, les fonctions du trophoblaste et la croissance
embryonnaire. TNF-a induit la formation de thromboses. Selon les séries,
50 à 80% des femmes souffrant d'ASR inexpliqués auraient une
réponse cellulaire anormale de typeTh1 vis-à-vis des
antigènes trophoblastiques. L'activité des cellules NK serait
plus élevée dans certains cas d'ASR (environ 12%). Ces
hypothèses (défaut de reconnaissance, absence de facteurs
bloquants, déficit en cytokines de type Th2, excès de cytokines
Th1, excès d'activité NK) n'ont pas trouvé de confirmation
pour l'instant (Poncelet et Sifer, 2011).
6-4-3- Le lupus
C'est une maladie d'origine auto-immune qui comporte des
manifestations cliniques extrêmement polymorphes,
cutanéo-viscérales, évoluant par poussées,
associées à la présence d'auto-anticorps dirigés
contre les constituants du noyau cellulaire. Concernant les FCS
répétées, toutes les études montrent que leur taux
est augmenté en cas de lupus, atteignant 20 à 30% des grossesses.
Les facteurs de risque de FCS précoces et de pertes foetales tardives
sont la présence d'anti-phospholipides et les antécédents
de perte foetale. Les études in vitro évoquent une
toxicité directe des anti-phospholipides sur le développement
embryonnaire et trophoblastique, avec des défauts d'invasion expliquant
les FCS précoces et les pathologies placentaires plus tardives (Molad
et al., 2005).
Chapitre II Les Avortements Spontanés à
Répétition
33
6-5- Étiologie vasculaire et
métabolique
6-5-1- L'hypertension et les maladies
vasculaires
Les maladies hypertensives peuvent avoir une influence
néfaste sur le développement ovulaire au début de la
grossesse et comporte aussi bien des risques d'avortements que d'hypotrophie et
de mort in utero. Facile à mettre en évidence, si
l'hypertension évidente, si la tension artérielle se
révèle normale dans les conditions de repos, il ne faudra pas
éliminer l'origine vasculaire car il arrive qu'elle soit en cause
lorsqu'ils existent des facteurs de risque tels que des
antécédents familiaux d'hypertension ou d'accidents vasculaires
chez les parents ou collatéraux, aggravés éventuellement
par le tabagisme. Chez ces patientes, il faudra découvrir l'origine
vasculaire par des tests a l'effort, l'épreuve du froid, le roll
overtest et l'étude des vaisseaux au niveau du fond d'oeil et de
l'endomètre qui peuvent être le siège de lésions
vasculaires importantes (Diaby, 2006).
6-5-2- Maladie coeliaque
La maladie coeliaque est un trouble auto-immun associé
à une intolérance au Gluten qui a pour effet la destruction
progressive des villosités de l'intestin grêle. Les
symptômes de la maladie coeliaque sont très divers et peuvent se
produire à tout âge. Parmi ces symptômes, la maladie
abortive est une circonstance rare de découverte de la maladie
coeliaque. En effet, 19,4% des femmes atteintes de cette maladie ont des
aménorrhées mais aussi, des oligo-hypo-ménorrhées,
dysménorrhées et des métrorragies (Stazi et Mantovani,
2000). Il existe aussi une forte corrélation entre maladie coeliaque et
fausses couches précoces, menaces d'avortement, toxémie
gravidique et retard de croissance intra-utérin. La pathogénie de
tous ces problèmes gynéco-obstétricaux reste
méconnue, mais les hypothèses sont partagées entre
l'origine auto-immune et la malnutrition (Eliakim et al., 2001). Dans
le cadre de la recherche de la physiopathologie de ces troubles, certains
auteurs se sont intéressés à des vitamines et
oligoéléments comme l'acide folique, le sélénium et
le zinc. Ceux-ci sont des nutriments essentiels pour la fonction reproductive
de la femme, et sont mal absorbés en cas de maladie coeliaque. Ces
auteurs ont montré, entre autres, que le déficit en zinc engendre
un trouble dans la sécrétion et l'action de la LH et celle de la
FSH ce qui perturbe le fonctionnement ovarien. Ceci peut expliquer en partie
les problèmes d'infertilité et de fausses couches précoces
engendrées par la maladie coeliaque. L'autre piste physiopathologique
explorée pour essayer de saisir le mécanisme de ces perturbations
de la vie génitale associées à la maladie coeliaque est
celle de l'auto-immunité. Dans ce sens, certains auteurs ont
comparé des sérums de femmes en bonne santé à ceux
de femmes atteintes de maladie coeliaque active avec des manifestations
gynéco-obstétricales (Shamaly et al., 2004).
Chapitre II Les Avortements Spontanés à
Répétition
34
Ils ont prouvé qu'il existait une relation entre la
présence d'anticorps anti endomysium et anti trans-glutaminase et ces
manifestations cliniques. Ces cas cliniques illustrent bien l'association entre
la maladie coeliaque et les fausses couches à répétition
(Shamaly et al., 2004).
6-6- Thrombophilie
En début de grossesse (5 à 7 SA), l'invasion
trophoblastique des artères spiralées utérines
entraîne l'apparition de bouchons vasculaires (plugs) conduisant
au maintien de l'hypoxie embryonnaire nécessaire à sa bonne
évolutivité. En effet, l'embryon est à ce stade
dépourvu des moyens de défense enzymatique contre les radicaux
libres de l'oxygène, et ces plugs luttent également
contre les variations tensionnelles maternelles et permettent la mise en route
du coeur embryonnaire et l'extraction des déchets embryonnaires vers les
premiers lacs intervilleux (Merviel et al., 2004).
Le problème est qu'en amont de ces plugs, les
éléments figurés du sang stagnent et peuvent conduire
à la formation d'un thrombus si la femme présente des facteurs de
risque comme une thrombophilie. Lorsque les plugs doivent commencer
à disparaître (à partir de la 8ème SA), les thrombus
restent et la grossesse s'interrompt par défaut de perfusion de
l'embryon. De même, ces thrombus peuvent empêcher la
deuxième colonisation trophoblastique des vaisseaux utérins, et
conduire à la survenue d'une pathologie vasculaire de la grossesse. Les
thrombophilies génétiques sont liées soit à un
déficit des inhibiteurs naturels de la coagulation (antithrombine III,
protéines S et C), soit à des mutations du gène de la
méthylène tétra-hydro-folates réductase, du
gène de la prothrombine (G20210A) ou du facteur V (mutation Leiden)
(Merviel et al., 2004).
6-7- Étiologie génétique
Les variables génétiques semblent jouer un
rôle complexe dans l'efficacité de la reproduction humaine.
Classiquement, les taux élevés d'erreurs chromosomiques ont
été parmi les principales étiologies de la perte foetale
et des études plus récentes ont commencé à mettre
en évidence le rôle important que des anomalies
monogéniques spécifiques peuvent jouer dans le maintien de la
grossesse (Kassie et al., 2015).
6-7-1- Anomalies chromosomiques
Les études cytogénétiques ont
montré que la plupart de ces anomalies sont des anomalies chromosomiques
numériques ou aneuploïdies (86%), et une minorité des cas
sont causés par des anomalies chromosomiques structurales (6%) ou
mosaïsme chromosomique (8%) (Goddijn et Leschot, 2000 ; Poncelet et Sifer,
2011).
Chapitre II Les Avortements Spontanés à
Répétition
35
Chapitre II Les Avortements Spontanés à
Répétition
On suppose que 50% des anomalies chromosomiques
détectées dans les avortements spontanés se produisent
de novo alors que les parents présentent des caryotypes normaux
(Carvalho et al., 2010). Les anomalies survenant de novo sont
donc accidentelles et ne sont donc en principe pas responsable d'ASR.
Cependant, l'incidence de certaines aneuploïdies méiotiques
augmentant avec l'âge maternel (Stephenson et al., 2002).
Les anomalies de nombre sont la majeur cause des FCS
sporadiques et répétées, parmi ces anomalies ; des
trisomies (16, 18, 21 ou 22), des triploïdies, polyploïdies et des
monosomies X. Les anomalies de structure représentent 3 à 4% des
aberrations chromosomiques et sont constituées de 3
variétés : la translocation, la mosaïque et les chromosomes
en anneau (Carvalho et al., 2010).
6-7-2- Anomalie génique
La mutation génique consiste en une altération
fine de la molécule ADN. Elle n'est donc pas visible, contrairement
à l'aberration chromosomique, jusqu'à présent il a
été détecté que les mutations des gènes de
structures responsables de la synthèse des enzymes, des protéines
et des récepteurs des cellules. Ainsi, des altérations graves
d'un ou plusieurs gènes, incompatible avec la vie sont non seulement
hautement probable mais a priori fréquentes en début
d'embryogenèse et seraient à l'origine d'avortement très
précoce, notamment infra clinique. Cette hypothèse est
étayée par divers arguments. Après avoir
éliminé toutes les causes connues d'avortements, y compris les
aberrations chromosomiques, il reste une proportion importante d'avortement
d'étiologie inconnue parmi lesquels le pathologiste constate surtout les
décès embryonnaires foetaux apparemment primitif in
utero. À l'origine de ces décès, il peut y avoir un
blocage d'une grande voie métabolique et surtout, en raison de la nature
dominante la transmission, des anomalies de structures des protéines
(Diaby, 2006 ; Coutton et al., 2012).
6-8- Étiologie fortuite et
psychologique
Sous ce qualificatif sont habituellement
désignées les causes qui peuvent avoir une influence non
prouvée médicalement mais auxquelles l'expérience donne un
certain crédit : la fatigue, le travail debout, les trépidations,
les longs voyages en voiture, etc. Il s'agit en général plus de
facteurs déclenchant ou favorisants que de causes véritables. Il
est certain qu'un utérus hypotrophique et hyper-contractile se
contractera plus facilement et plus souvent chez une femme ayant une importante
activité physique que chez une femme au repos ou ayant une vie calme :
d'où les prescriptions logiques de prudence qui en découleront
(Lejeune et Carbonne, 2007).
36
L'écoute des patientes, le décryptage du
traumatisme lié à l'annonce ou à la prise en charge des
échecs de grossesses antérieures, la pression subie et la
confiance qu'elles mettront dans la relation avec le médecin, augmentent
les chances de succès des grossesses futures, de l'avis de tous les
médecins qui les prennent en charge. Ce que les Anglo-Saxons appellent
le loving care, c'est-à-dire l'empathie et le suivi
rapproché en début de grossesse améliore de façon
significative le pronostic obstétrical (Lejeune et Carbonne, 2007).
6-9- Autres étiologies
- Le traumatisme unique, même violent, est une cause rare
d'avortement avant la douzième
semaine, l'utérus étant protégé de
la contusion par la ceinture osseuse. Mais, il peut être l'occasion de
l'interruption d'une grossesse déjà compromise.
En revanche, les microtraumatismes
répétés peuvent provoquer l'avortement. L'usage des engins
motorisés en fournit un exemple et le travail sur certaines machines
trépidantes en est un autre (Andriatsiaronimanga, 2005).
- La béance du col est une affection
obstétricale rare, caractérisée par une dilatation
cervicale
indolore au cours du deuxième trimestre de la grossesse
conduisant à l'expulsion du produit de la conception suite à une
destruction traumatique des fibres musculaires de l'orifice interne du col ou
suite à une inefficacité constitutionnelle congénitale.
L'incompétence cervico-isthmique a été décrite pour
la première fois par Palmer et Lacomme en 1947
(Abbara, 2016).
- Le facteur d'âge, lorsque la femme à
l'âge > 30 ans, ayant des antécédents de fausse
couches
spontanée, le surpoids ou le faible poids suite à des
mauvaises habitudes alimentaires (Toilibou, 2009).
7- La part de l'homme dans les FCSR
En effet, si 60% des fausses couches du premier trimestre sont
dues à des anomalies chromosomiques et qu'une majorité est
d'origine maternelle, la technique d'hybridation in situ en
fluorescence (FISH) sur les spermatozoïdes a montré une origine
paternelle dans 8 à 12% des cas, correspondant à une incidence
plus grande d'anomalies chromosomiques dans leurs gamètes. Une mesure de
la fragmentation de l'ADN spermatique peut également être
réalisée. Les causes de la fragmentation peuvent être
génétiques : insuffisance en enzymes de réparation,
augmentation des substances oxydantes secondaires à l'âge,
processus infectieux et inflammatoire, ou à des facteurs
environnementaux : toxiques, hydrocarbures, insecticides, chaleur, etc. Ces
anomalies sont associées au risque de FCS (Gil-Villa et al.,
2009).
Chapitre II Les Avortements Spontanés à
Répétition
37
Les études chromosomiques des spermatozoïdes
peuvent être établies et elles constituent une étiologie
non négligeable à ce dysfonctionnement (Auger et al.,
2009). Elle peuvent être faites :
- Par fécondation hétérospécifique :
c'est une technique qui permet de voir les spermatozoïdes
et d'apporter des renseignements sur leur forme et leur
structure.
- Par hybridation in situ : réalisée sur
le noyau en interphase.
- La mesure de la fragmentation d'ADN : pour l'identification des
cassures de l'ADN simple
et double brin au niveau de l'ADN des
spermatozoïdes.
- Par la recherche d'anticorps anti-spermatozoïdes :
suite à des traumatismes ou à une infection,
les hommes
peuvent développer une immunité contre leurs propres
spermatozoïdes, cela peut diminuer leur mobilité (Rives et
al., 2004 ; Auger et al., 2009 ; Belloc, 2014).
8- Démarche diagnostique et prise en charge 8-1-
Interrogatoire
Il est établi pour chercher et préciser :
l'âge maternel, l'indice de masse corporel, des antécédents
personnels gynécologiques, des antécédents
obstétricaux, ainsi que des antécédents personnels
thromboemboliques. La prise de toxiques, tabac, alcool, drogues ou
médicaments, ainsi que les habitudes alimentaires sont explorés
(Poncelet et Sifer, 2011 ; Lepage et al., 2015).
8-2- Examen clinique
Cet examen vise à rechercher : un surpoids ou une
anorexie, des signes d'hyperandrogénie, un syndrome
génétique, un examen des seins pour la recherche d'une
galactorrhée, un toucher vaginal qui peut orienter vers une
endométriose pelvienne ou vers un utérus poly-fibromateux.
L'examen au speculum pour rechercher la présence d'une malformation
vaginale ou cervicale pouvant évoquer une malformation utérine.
Un examen des testicules pour le conjoint est également
nécessaire (Poncelet et Sifer, 2011 ; Lepage et al., 2015).
8-3- Bilan paraclinique et prise en charge
Dosage d'anticoagulants circulants, test de céphaline
activée, protéines S et C, dosage d'anticorps (AC)
anti-nucléaires et anti-ADN, dosage d'AC anti-phospholipides, facteur
rhumatoïde, AC lympho-cytotoxiques, AC anti HLA (Poncelet et Sifer, 2011 ;
Lepage et al., 2015).
Chapitre II Les Avortements Spontanés à
Répétition
38
Examens chez la femme
- Sérologie : le virus
d'immunodéficience humaine (VIH), rubéole, toxoplasmose,
cytomégalovirus, herpès simplex virus,
hépatite B et C.
- Culture cervicale : aérobies,
anaérobies, chlamydia, gonocoque, Ureaplasma
urealyticum,
Mycoplasma hominis, listeria.
- Culture endométriale :
aérobies, anaérobies, chlamydia, gonocoque,
Ureaplasma
urealyticum, Mycoplasma hominis, listeria
(Lepage et al., 2015).
Examens chez l'homme
- Sérologie : VIH,
cytomégalovirus, hépatite B et C.
- Frottis urétral : chlamydia, gonocoque,
Ureaplasma urealyticum, Mycoplasma hominis.
- Spermoculture : chlamydia, gonocoque,
Ureaplasma urealyticum, Mycoplasma hominis,
aérobies, anaérobies (Lepage et al.,
2015).
8-4- Bilan biologique
- Bilan hormonal : dosage du TSH, LH et FSH,
dosage de la progestérone en phase lutéale,
dosage de la prolactine, dosage de la testostérone, et de
l'inhibine B.
- Glycémie à jeun et hémoglobine
glyquée (HbA1c), Numération de la Formule Sanguine
(FNS),
micro-albuminurie.
- Bilan de thrombophilie : Taux de Thrombine
(TP), Taux de Céphaline Activée (TCA),
fibrinogène,
recherche d'un déficit en protéine C ou en protéine S,
antithrombine III, recherche déficit en homocystéine, recherche
d'une résistance à la protéine C activée, recherche
d'une mutation du facteur II (Poncelet et Sifer, 2011 ; Lepage et al.,
2015).

Chapitre III Cytogénétique des avortements
spontanés à répétition
39
1- Cytogénétique des avortements
spontanés à répétition
Plus de 50% de femmes subissent une ou plusieurs fausses
couches au cours de leur vie. La plupart des fausses couches surviennent
à partir de la 12ème semaine de grossesse, ainsi, il a
été estimé que 15% des grossesses (cliniquement reconnues)
sont touchées (Rai et al., 2006). Les anomalies
génétiques aboutissent non seulement à une perte
spontanée de grossesse mais également à des pertes
récurrentes de celle-ci, en provoquant l'arrêt du
développement embryonnaire (Feichtinger et al., 2017). Les
désordres génétiques représentent approximativement
25% des causes connues, alors que dans les cas inexpliqués, l'incidence
peut être plus élevée. Ces désordres pourraient
impliquer le profil génétique des parents ou du foetus, c'est
pourquoi des tests doivent être effectués chez les deux parents
ainsi que dans le matériel de la fausse couche. L'analyse
cytogénétique des produits d'avortement spontané fournit
de précieuses informations sur la fréquence des anomalies
chromosomiques dans divers groupes ethniques, leur étiologie, les
risques de récidive et la suspicion d'une activité
mutagène (Molazadeh et al., 2014). Le caryotype présente
une très bonne sensibilité en ce qui concerne le dépistage
des anomalies chromosomiques de nombres et des aneuploïdies affectant les
chromosomes sexuels qui représentent la plupart des assortiments
chromosomiques foetaux anormaux. Il permet également le dépistage
d'autres aberrations chromosomiques, tant numériques que structurales,
selon une résolution de 10 millions de paires de bases (10 Mb) d'ADN
(Rickman et al., 2006).
1-1- Caryotype du couple
Il est un élément fondamental du bilan des ASR
et doit être proposé à partir de trois FCS
consécutives avec le même partenaire. Cet examen peut permettre de
découvrir chez les parents des anomalies chromosomiques
constitutionnelles équilibrées (translocations, inversions), ou
la présence d'aneuploïdies sexuelles (avant tout monosomie X,
surtout en cas de mosaïque [45, X0/46, XX]) (Jaslow et al.,
2010).
1-2- Caryotype du produit de fausse couche
Il a pour objectifs le diagnostic d'une anomalie chromosomique
embryonnaire, la recherche d'une répétition d'une même
anomalie ou la mise en évidence d'une anomalie chromosomique sporadique
(acquise de novo). L'inconvénient de cette technique est le
risque de contamination par des cellules d'origine maternelle. Les anomalies du
caryotype sont étiquetées chez 8,92% des couples ayant fait au
moins deux ASR, soit 15 sur 168. En effet, cette prévalence est
largement supérieure à l'incidence des anomalies chromosomiques
dans la population générale, communément estimée
à 0,7% (Franssen et al., 2005).
Chapitre III Cytogénétique des avortements
spontanés à répétition
40
La plupart de ces anomalies sont des anomalies chromosomiques
numériques ou aneuploïdies, et une minorité des cas sont
causés par des anomalies chromosomiques structurales ou mosaïsme
chromosomique (Goddijn et Leschot, 2000).
2- Cytogénétique des avortements
spontanés à répétition
2-1- Les anomalies de structure
Les anomalies de structure affectent la fonction normale du
gène touché ou la fonction d'autres gênes intervenant dans
la poursuite de la grossesse (Theisen et Shaffer, 2010). Ces anomalies peuvent
être des délétions, des duplications, des translocations ou
des inversions ; seules les translocations et les inversions jouent un
rôle majeur dans les fausses couches spontanées à
répétition. Toutefois, pendant la gamétogenèse, la
plupart des anomalies chromosomiques ont été
développées de novo, tandis qu'une faible proportion a
été héritée d'un parent qui a eu un
réarrangement équilibré (Goddijn et Leschot, 2000).
2-1-1- La translocation réciproque
La translocation est une mutation génétique
caractérisée par l'échange réciproque de
matériel chromosomique entre des chromosomes non homologues après
cassure sur chacun des chromosomes. Si chacun des parents est porteur d'une
translocation équilibrée, il est possible que leur enfant
hérite d'une translocation déséquilibrée dans
laquelle il y a un « morceau » de plus sur un chromosome et/ou un
« morceau » manquant sur un autre. Les patients porteurs de ces
translocations n'ont pas de phénotype particulier en dehors de troubles
de la fertilité. Ce type de translocation s'observe plutôt en cas
d'avortements à répétition ou de stérilité
(Sanlaville et Turleau, 2011).
On peut également retrouver des fusions centriques
aussi appelées translocations robertsoniennes. Elles se produisent entre
chromosomes acrocentriques (13, 14, 15, 21 et 22) par fusion centrique ou, le
plus souvent, par cassures dans les régions juxta-centromériques.
La perte du bras court des chromosomes transloqués n'a pas de traduction
clinique. Lors de la méiose, il existe un risque de formation de
gamètes déséquilibrés donnant des zygotes
trisomiques ou monosomiques pour la totalité d'un chromosome. Le type
des translocations contrôle le taux des risques des fausses couches
spontanées, ce risque est plus élevé si la femme est la
porteuse d'une translocation (Sanlaville et Turleau, 2011).
Chapitre III Cytogénétique des avortements
spontanés à répétition
41
2-1-2- Inversion chromosomique
Anomalie fréquente chez les couples avec ASR, suite au
crossing-over méiotique, des gamètes
déséquilibrés se forment, due à une inversion de
l'ordre des gènes. Par ailleurs, l'inversion péricentrique est
exposée à la formation de recombinants aneuploïdes, en
fonction de la taille du segment inversé. Un segment chromosomique de
plus de 100 Mpb, soit plus de 50% du chromosome, est à l'origine de
large recombinant dont le produit de conception résulte dans les
avortements. En revanche, aucun déséquilibre ne se produit pour
les petites inversions dont la taille est inférieure à 50 Mpb,
soit inférieure à 40% du chromosome. Dans le cas
intermédiaire, quelques gamètes recombinants seront formés
(Anton et al., 2005). À côté de la taille, la
probabilité du déséquilibre génétique
dépend du segment chromosomique impliqué dans l'inversion, plus
spécifiquement, les points de cassures générés. Le
risque reproductif au cours de l'inversion chromosomique soit multifactoriel et
qu'il s'y s'ajoute un effet interchromosomique (EIC) à l'origine de
l'augmentation des aneuploïdies (Demirhan et al., 2008).
2-2- Erreurs de méiose
Durant la méiose, le jeu diploïde parental
habituel de 46 chromosomes est réduit au nombre haploïde de 23
chromosomes. Des évènements non-disjonctionnels durant la
méiose I ou II, pouvant toucher aussi bien les ovocytes que les
spermatozoïdes, peuvent entraîner des produits de conception
monosomiques ou trisomiques suite à la formation d'un gamète avec
un chromosome en plus ou en moins par rapport au nombre haploïde. À
l'exception de la monosomie X complète, il apparaît que les
monosomies autosomiques sont létales au début du
développement embryonnaire et ne sont généralement pas
identifiées dans les grossesses évolutives (Haoud, 2014).
2-3- Les anomalies de nombre
De manière générale, la plupart des
anomalies chromosomiques rencontrées résulte soit d'une erreur
méiotique, soit une erreur mitotique (menant à un
mosaïcisme), soit d'une erreur lors de la fécondation (Haoud,
2014).
2-3-1- Les dysgonosomies du chromosome X
C'est une anomalie qui touche le nombre des chromosomes X et
est responsable majoritairement d'infertilité primaire. La plupart de
ces aneuploïdes résultent principalement des erreurs au cours de la
méiose chez la femme tandis que < 5% résultent des erreurs
méiotiques chez l'homme (Hassold et Hunt, 2009).
Chapitre III Cytogénétique des avortements
spontanés à répétition
42
Des études de Fécondation In Vitro
(FIV) ont suggéré que l'apparition des aneuploïdies
ovocytaires est menée suite à une sensibilité
élevée des ovocytes envers les désordres méiotique
et les changements chiasmatiques. Cette sensibilité ovocytaire est
liée à l'âge maternel avancé qui favorise
l'incidence des non-disjonctions chromosomiques (Chiang et al., 2012).
Généralement, les formes mosaïques sont plus
fréquentes chez le couple victimes d'ASR. Il s'agit le plus souvent
d'une monosomie (45;XO) ou d'une trisomie (47;XXY) respectivement chez les
femmes et les hommes. En revanche, parmi les dysgonosomies homogènes, le
syndrome triple X est aussi fréquent chez les femmes victimes d'ASR. Les
grossesses avec monosomie X ont un phénotype considérablement
variable et peuvent présenter une dysmorphie marquée. La plupart
de ces grossesses subit un arrêt de croissance embryonnaire
précoce et se présente sous forme d'un sac gestationnel vide, ou
sous forme d'un petit nodule nécrotique du tissu embryonnaire pendant au
bout du cordon ombilical (Solveig et Pflueger, 2005). Les monosomies
chromosomiques sont relativement rares, 9% des aneuploïdies correspondent
aux monosomie X et 0,5% d'associations trisomies-monosomie X (Stephenson et
al., 2002).
2-3-2- Les trisomies
Les trisomies sont relativement fréquentes et
représentent le groupe d'anomalies le plus souvent rencontrées
conduisant à une perte de grossesse spontanée. Environ le quart
des caryotypes de produits avortés spontanément sont trisomiques.
Toutes les trisomies autosomiques ont été rapportées dans
les différentes études menées à la seule exception
du chromosome 1, pour lequel, la trisomie semble létale avant même
l'implantation et aurait peu de chances de subsister assez longtemps pour
être mise en évidence dans les séries habituelles des AS.
La majorité des produits de conception trisomiques, même ceux avec
des caryotypes viables chez le nouveau-né, se termine par une
fausse-couche. Les trisomies autosomales sont fréquemment
détectées et représentent jusqu'à 60% de toutes les
aneuploïdies. La trisomie 16 suivie de la trisomie 22 sont toutefois les
plus fréquentes, tandis que la trisomie 1 est rarement
détectée dans les produits de la conception. La majorité
des trisomies autosomiques est d'origine maternelle, avec des erreurs lors de
la première division de la méiose plus fréquentes que lors
de la deuxième division de la méiose, mais ceci varie en fonction
du chromosome impliqué. La prédisposition à la
non-disjonction ne peut pas être la même pour tous les chromosomes
et le risque de récidive peut dépendre du chromosome
impliqué dans la trisomie, du parent apportant le chromosome
supplémentaire et du risque de base associé à l'âge
maternel (Sheth et al., 2013).
Chapitre III Cytogénétique des avortements
spontanés à répétition
43
2-4- Erreurs de la mitose
Une mauvaise ségrégation lors de la
première division mitotique peut donner lieu à une
tétraploïdie. Les conceptus tétraploïdes sont
généralement « éliminés » très
tôt lors de la grossesse, bien qu'il existe de rares exceptions. La
non-disjonction mitotique se traduit souvent par un mosaïcisme qui est
caractérisé par la présence de deux ou plusieurs
lignées cellulaires avec une constitution chromosomique
différente. Lorsque la non-disjonction se produit très tôt,
elle peut entraîner un modèle généralisé de
mosaïcisme, tandis que sa survenue plus tard dans la grossesse peut
conduire à un mosaïcisme limité à l'un des deux :
soit le foetus, soit le placenta (Haoud, 2014).
2-4-1- La mosaïque placentaire et
germinale
Le mosaïcisme placentaire confiné est un
problème potentiel, même chez le foetus à caryotype normal.
Sa présence a été associée à des niveaux de
hCG anormaux et est de mauvais pronostic quant à l'issue de la
grossesse, pouvant entraîner soit un Retard de Croissance In
Utéro (RCIU), soit une Mort Foetale In Utéro
(MFIU), soit à un avortement spontané (Kalousek et Barrett,
1994) Un caryotype foetal normal n'exclut pas une anomalie
cytogénétique dans le placenta pouvant être à
l'origine d'une interruption spontanée de la grossesse, ce qui
suggère la nécessité d'analyser à la fois le
caryotype foetal et celui des tissus placentaires dans les naissances mortes
inexpliquées. Des études moléculaires ont montré
que les aneuploïdies autosomiques en mosaïque peuvent provenir soit
d'erreurs mitotiques post-zygotiques soit d'erreurs méiotiques avec
correction post-zygotique avec perte subséquente de l'un des chromosomes
surnuméraires conduisant à la production d'une lignée
cellulaire euploïde ou bien duplication du chromosome en monosomie
à l'origine d'une lignée cellulaire euploïde responsable
d'une disomie uniparentale. La probabilité de survenue de l'un ou de
l'autre des mécanismes peut varier en fonction du chromosome
impliqué. Robinson et ses collègues suggèrent que les
trisomies en mosaïque impliquant les chromosomes 13, 18, 21, et X sont le
plus souvent dues à une perte somatique d'un chromosome
surnuméraire issu d'une non-disjonction méiotique. D'autre part,
la trisomie 8 en mosaïque peut avoir plus de probabilité de survie
lorsque la lignée aneuploïde survient tardivement comme le
résultat d'une erreur mitotique post-zygotique, dans un produit de
conception chromosomiquement normal à l'origine. Le mosaïcisme
placentaire pourrait être un facteur déterminant dans la survie
des embryons trisomiques. Des cas de trisomie 13 et 18 qui survivent à
terme semblent avoir une lignée de cellules diploïdes dans le
cytotrophoblaste. Par contre, le mosaïcisme ne semble pas être
à un facteur de survie dans le cas de la trisomie 21, sans doute
à cause des effets moins délétères de cette
trisomie sur la fonction placentaire (Kalousek et al., 1989).
Chapitre III Cytogénétique des avortements
spontanés à répétition
44
2-5- Les erreurs de la fécondation
Des erreurs survenant lors de la fécondation peuvent
conduire à des grossesses avec un lot chromosomique
supplémentaire complet (triploïdie) et des grossesses
diploïdes anormales dans lesquelles les deux lots chromosomiques
proviennent d'un seul et même parent (grossesse môlaire ou
môle hydatiforme). Un jeu chromosomique haploïde
supplémentaire d'origine maternel (digynie) ou paternel (diandrie) peut
entraîner un embryon triploïde. Un caryotype à 69,XYY est
indicatif de l'origine paternelle du lot chromosomique supplémentaire,
tandis qu'un caryotype 69,XXX ou 69,XXY, peuvent être le résultat
soit d'une digynie soit d'une diandrie. Différents
évènements peuvent conduire à la présence d'un jeu
chromosomique supplémentaire. Les triploïdies d'origine paternelle
résultent de la fécondation d'un ovule haploïde par deux
spermatozoïdes, ou de la fécondation de l'ovule par un
spermatozoïde diploïde (Haoud, 2014).
2-5-1- Polyploïdie chromosomique
Elle peut se traduire sous forme de triploïdie, (3n=69)
ou tétraploïdie (4n=92). La triploïdité est
relativement plus fréquente que la tétraploïdité,
représentant environ 10% de la perte de grossesse précoce.
L'embryon polyploïde se produit indépendamment de l'âge
maternel et peut résulter d'un ensemble d'haploïdes
supplémentaires, maternel ou paternel (Filges et al., 2015). La
dispermie est en général la cause commune de toutes les
triploïdies, mais elle peut être également le résultat
de la formation des ovocytes diploïdes provoqués par des erreurs
méiotiques maternelles. La tétraploïdie, quant à
elle, représente environ 2% des pertes précoces de grossesses et
est habituellement causée par des erreurs qui surviennent après
la fécondation. Des études ont révélé une
relation entre l'origine de la polyploïdie chromosomique et le
développement foeto-placentaire. Un ensemble de chromosomes
supplémentaires paternel est associé à un foetus en
croissance normale mais un grand placenta cystique, tandis que l'origine
maternelle de la polyploïdie est associée à un retard
sévère de croissance intra-utérine du foetus (Hardy et
al., 2015).
2-6- Les anomalies mineures
2-6-1- Les variants chromosomiques
Le nombre d'accidents abortifs augmentés chez le
couple, dont l'un est porteur du variant chromosomique, permet d'évoquer
leurs rôle important dans la genèse des troubles reproductifs. En
effet, ces variants concernent des gros satellites surajoutés sur des
chromosomes acrocentriques (13, 14, 15, 21 et 22) (Frikha et al.,
2012).
Chapitre III Cytogénétique des avortements
spontanés à répétition
45
L'élargissement de l'hétérochromosome de
ces derniers a été rapporté dans des études
concernant des couples colligés pour des troubles de la reproduction. Il
semble que l'hétérochromatine élargie a tendance à
s'agréger avec d'autres blocs hétérochromatiques par le
biais de ces séquences d'ADN satellites. Cela peut favoriser les
non-disjonctions et aboutir à des trisomies qui sont létales dans
plus de 50% des cas. Il est donc difficile d'exclure la contribution de telles
anomalies sur le produit de conception ; cependant, le rôle de
l'hétérochromatine et des variants, bien que possible, reste
hypothétique (Frikha et al., 2012).
2-6-2-Biais de l'inactivation de l'X
Certains couples font préférentiellement des FCS
sur les embryons mâles et ne donnent naissance qu'à des filles,
faisant évoquer l'hypothèse de maladies géniques
létales récessives liées à l'X transmises par la
mère. L'exemple le plus connu est celui de l'incontinenta
pigmenti, maladie létale chez l'individu de sexe mâle et
diagnostiquée chez les femmes porteuses à l'état
hétérozygote par l'existence de taches cutanées
pigmentées. Toutefois, d'autres maladies récessives liées
à l'X létales chez l'embryon mâle pourraient être
responsables de FCS précoces. Or, l'existence d'un X porteur d'une telle
mutation chez une femme entraîne un biais d'inactivation de ses
chromosomes X avec une inactivation préférentielle de l'X
muté souvent supérieure à 10/90. Ce
déséquilibre d'inactivation de l'X peut être mis en
évidence par biologie moléculaire qui différencient les
gènes méthylés ou non parmi les X d'origine maternelle et
paternelle. Toutefois, la limite entre normal et pathologique est difficile
à définir, d'autant plus que le taux d'inactivation de l'X varie
avec l'âge et avec le tissu étudié (Sharp et al.,
2000).
2-7- Les troubles de gène unique et polymorphisme
nucléotidique simple
La fécondation des ovocytes et l'implantation
d'embryons sont des processus très compliqués
contrôlés par des centaines de molécules codées par
plusieurs gènes. Toutefois, le dépistage de ces gènes est
potentiellement difficiles (Quintero-Ronderos et al., 2017). La
mutation de certains gènes, tel que le gène associé au
syndrome de Smith-Lemli-Opitz, au méthémoglobinémie ainsi
que le gène associé à l'anémie falciforme peuvent
être impliqué dans l'étiologie des ASR (Lazarin et
al., 2017). Le polymorphisme nucléotidique correspond à une
variation ou un remplacement d'un nucléotide qui se produit à une
position spécifique dans le génome. Certaines mutations sont
responsable de ce polymorphisme, ainsi, la majorité de ces variations ne
modifient pas la fonction cellulaire et n'ont donc aucun effet. Cependant,
d'autres Polymorphisme Nucléotidique Simple (SNP) ont été
découverts lors de la contribution au développement de certaines
pathologies sévères parmi lesquelles : les ASR (Salk et
al., 2018).
Chapitre III Cytogénétique des avortements
spontanés à répétition
46
Le gène qui code pour l'enzyme de l'oxyde nitrique
synthase endothéliale joue un rôle clef dans l'angiogenèse
utérine et placentaire et il est exprimé par les
syncytiotrophoblastes pendant la grossesse. Un polymorphisme au niveau de ce
gène pourrait modifier son expression et induire par conséquence
un avortement spontané (Azani et al., 2017 ; Zhao et
al., 2019).
Les gènes de la métalloproteinase-2
(MMP2) et de la métalloproteinase-9 (MMP9) sont
essentiels à la prolifération cellulaire, à l'apoptose et
à l'angiogenèse. Leur expression et activation par les
trophoblastes est indispensable pour une grossesse normale. Dans certains cas
d'ASR, plusieurs SNP ont été détectés au niveau des
séquences promotrices de ces gènes (Li et al., 2018).
2-8- Fausses couches spontanées à
répétition inexpliquées
En dehors des rares cas d'anomalies chromosomiques
létales mises en évidence sur la culture du trophoblaste, toutes
les FCS sont inexpliquées et l'enquête étiologique
précédemment décrite ne recherche que des facteurs
favorisants, dont certains sont accessibles à des traitements. Dans une
série publiée en 1996 par Stephenson et portant sur 197 couples
avec au moins trois ASR, aucun facteur potentiellement étiologique n'est
retrouvé dans 42,6% des cas (Stephenson, 1996). Environ la moitié
de ces fausses couches précoces inexpliquées pourraient
être en relation avec une cause génétique male. Dans les
autres cas, une réponse allo-immune du fait d'un défaut
d'induction de tolérance vis-à-vis des antigènes paternels
pourrait être à l'origine de la perte foetale (Stern et Chamley,
2006).
2-9- Prévalence des anomalies chromosomiques en
fonction du nombre de FCS
L'augmentation du risque d'avortement spontané avec le
nombre d'accidents antérieurs est un argument en faveur de la
réalité d'un syndrome d'ASR. En effet, si les
événements étaient indépendants, le risque d'avoir
deux AS successifs serait de 2,3% et pour trois AS de 0,34%. Or, après
un avortement, le risque moyen de récidive est de 20%, après deux
AS de 28%, après trois AS de 30% et de 45% après quatre. Le
risque d'AS augmente avec :
- La gravidité, quelle que soit l'issue des grossesses
précédentes : ainsi, on distingue
les ASR primaires (en
l'absence d'accouchements antérieurs) et les ASR secondaires
(après la naissance d'un enfant) ; toute naissance entre les AS
ramène le taux de récidive à 10% environ.
- L'âge des femmes (25% de risque après trois AS
pour un âge inférieur à 30 ans versus 52%
pour un
âge supérieur à 40 ans).
- La notion d'infertilité chez le couple.
Chapitre III Cytogénétique des avortements
spontanés à répétition
47
Par ailleurs, les études fondées sur
l'évaluation pronostique chez le couple souffrant d'ASR ont
constaté une décroissance du taux de naissances en fonction du
nombre de FCS. Cependant, certains auteurs ont noté une
décroissance de l'incidence des anomalies chromosomiques au fil de la
récurrence des ASR. D'autres ont constaté que la
prévalence des anomalies chromosomiques parentales est
indépendante du nombre de FCS (Carp et al., 2004).
2-10- Implications paternelles
Les ASR sont généralement abordés
à partir de facteurs maternels en raison de la relation maternelle
intime avec l'embryon en développement. Récemment, une plus
grande attention a été accordée à l'effet des
facteurs masculins sur les ASR. L'examen clinique en laboratoire des hommes
implique une analyse de routine du sperme pour en évaluer les
paramètres tels que la concentration, la motilité, la
viabilité et la morphologie du sperme. La morphologie des
spermatozoïdes fournit des informations importantes concernant le
processus de spermiogénèse qui présente un impact sur la
fonction du sperme et par conséquence, avoir un impact sur la
reproduction (Puscheck et al., 2007).
À la fin des années 1990, Bonde et al
ont rapportés que les hommes dont la morphologie des
spermatozoïdes était anormale avaient une possibilité
réduite de parvenir à une grossesse (Slama et al.,
2002). La qualité du sperme peut affecter le développement
embryonnaire précoce, que ce soit à cause d'un ADN anormal ou /et
une protéine membranaire du sperme anormale (Nagy et al.,
2000). La morphologie de la tête du sperme a un impact majeur sur
l'efficacité hydrodynamique du sperme. Plusieurs études ont
démontré qu'un taux élevé de morphologie anormale
des spermatozoïdes était corrélé à
l'échec de l'embryon à un stade précoce du clivage et
qu'un ADN défectueux dans le sperme influençait l'expression et
la régulation adéquates des gènes paternels au cours des
étapes précoces du développement embryonnaire (Gillies
et al., 2009).
2-10-1- Fragmentation de l'ADN
La fragmentation de l'ADN est la séparation ou la
rupture des brins d'ADN en morceaux. La présence d'une fragmentation
significative de l'ADN du sperme a des implications profondes sur
l'embryogenèse, la croissance prénatale et postnatale ainsi que
les malformations congénitales (Nanassy et al., 2003 ; Auger
et al., 2009).
La fécondation d'un ovocyte avec un spermatozoïde
endommagé peut entraîner une augmentation des dommages à
l'ADN dans le génome embryonnaire résultant, ce qui pourrait
entraîner des erreurs d'ADN à différents niveaux
d'embryogenèse. Cela peut se manifester soit comme léthal pour un
embryon et contribuer donc à des ASR (Lewis et Simon, 2010).
Chapitre III Cytogénétique des avortements
spontanés à répétition
48
Gopalkrishnan et al ont étudié plus en
détail les noyaux de sperme et la condensation de la chromatine du
sperme et ont observé une augmentation des vacuoles nucléaires du
sperme et une condensation anormale de la chromatine dans le groupe ASR
(Gopalkrishnan et al., 2000). L'échec de la
décondensation du sperme dans les ovocytes peut être la
conséquence d'une anomalie subtile du sperme comme des défauts
structurels ou biochimiques associés à l'empaquetage ou à
l'organisation de la chromatine pendant la spermatogenèse. Les dommages
liés à la chromatine précèdent la perte du
potentiel de fécondation et la mauvaise qualité de l'embryon,
entraînant une perte de grossesse (Saxena et al., 2008).
Grâce aux progrès de la génétique
moléculaire, il a été démontré que
l'intégrité de l'ADN du sperme affecte la fécondation, le
développement ultérieur de l'embryon, l'implantation et la
grossesse. Bien qu'un certain degré de dommages à l'ADN se
produise naturellement pendant le transport du sperme et puisse être
réparé dans le cytoplasme de l'ovocyte lors de
l'insémination, des issues de grossesse défavorables peuvent
survenir lorsque les dommages dépassent la capacité de
réparation du cytoplasme (Agarwal et al., 2016).
Les varicocèles sont une cause connue de dommages
à l'ADN des spermatozoïdes et de nombreux urologues
évalueront leur présence dans les couples atteints d'ASR. Des
facteurs modifiables supplémentaires qui ont été
associés à une augmentation de la génération
d'espèces réactives de l'oxygène et à une
fragmentation anormale de l'ADN des spermatozoïdes comprennent l'alcool,
le tabagisme, et certaines toxines environnementales. Une autre
possibilité que certains hommes aient une prédisposition
génétique inhérente non reconnue qui rend l'ADN de leurs
spermatozoïdes susceptible de se fragmenter. Cette possibilité doit
encore être étudiée en profondeur et nécessiterait
des évaluations génétiques raffinées, y compris
l'évaluation des modifications épigénétiques dans
le génome du sperme (Wang et al., 2012).
Il est largement admis que le développement de
l'embryon est soumis au contrôle maternel dès les premiers stades
et que les gènes paternels affectent le développement au stade 4
à 8 cellules. Par conséquent, à ce stade, les
conséquences des dommages à l'ADN paternel peuvent devenir
apparentes, altérant le développement embryonnaire (Nanassy et
Carrell, 2008).
Chapitre III Cytogénétique des avortements
spontanés à répétition
49
2-10-2- Microdélétion du chromosome
Y
La présence d'une oligospermie ou d'une azoospermie
sévère lors de l'analyse de routine du sperme justifie une
enquête plus approfondie, y compris une évaluation de la
microdélétion du facteur azoospermique (AZoospermic Factor AZF)
sur le chromosome Y (Perrin et al., 2005). Des chercheurs ont
étudié la prévalence des microdélétions du
chromosome Y dans leurs populations de couples atteints d'ASR. Trois
études ont montré une prévalence significativement plus
élevée de microdélétion du chromosome Y dans le
groupe ASR par rapport aux témoins et cette prévalence varie de
16% à 82% (Dewan et al., 2006). Très peu d'études
ont évoqués le mécanisme plausible par lequel la mutation
des facteurs azooseprmiques peut être impliquée dans les fausses
couches. Certaines de ces études mettent en cause des mutations de la
région AZF avec un défaut de la méiose, qui peut
être associée à une augmentation des pertes de grossesse
(Perrin et al., 2005). Une explication alternative est que ces
microdélétions sont des polymorphismes et qu'en raison de la
présence de zones palindromiques, il est probable qu'il y ait des
événements de croisement avec le chromosome X produisant une
anomalie génétique qui pourrait entraîner des ASR (Dewan
et al., 2006 ; Auger et al., 2009).
2-10-3-Aneuploïdie du sperme
L'aneuploïdie du sperme a été
détectée à un taux accru chez les partenaires masculins de
femmes atteintes d'ASR par rapport aux témoins dans plusieurs
études (Zidi-Jrah et al., 2003). Certains couples atteints
d'ASR ont un partenaire masculin avec des paramètres d'analyse du sperme
essentiellement normaux mais une aneuploïdie du sperme ou des anomalies
chromosomiques. Ainsi, les couples avec = 2 avortements spontanés
devraient avoir le partenaire masculin dépisté pour ces
conditions via un test FISH. Ce test vérifie les aneuploïdies des
chromosomes 13, 18, 21, X et Y. Les couples avec un test FISH positif pour
l'aneuploïdie du sperme peuvent choisir de subir un test
génétique préimplantatoire pour les défauts
monogéniques avec FIV (Auger et al., 2009 ; Ramasamy et
al., 2014).
2-10-4-Longueur des télomères
Les télomères ont une fonction
spécialisée dans le maintien de l'intégrité
chromosomique et dans les cellules germinales, on pense qu'ils aident à
la recombinaison méiotique et à l'appariement des chromosomes
homologues. Le raccourcissement des télomères dans les cellules
somatiques entraîne la perte de leur capacité de protection
physique de l'extrémité des chromosomes, ce qui entraîne
des translocations non réciproques, une instabilité
chromosomique, des délétions, une aneuploïdie et des
dommages à l'ADN (Murnane, 2006).
Chapitre III Cytogénétique des avortements
spontanés à répétition
50
Chapitre III Cytogénétique des avortements
spontanés à répétition
Thilagavathi et al ont émis l'hypothèse
que si les télomères sont connus pour jouer un rôle
important dans divers troubles, et pourraient jouer un rôle au niveau du
génome des spermatozoïdes et des ovules dans l'ASR
(inexpliquée). Leur étude impliquait des analyses de la longueur
des télomères de leucocytes obtenus à partir de 25 couples
ayant subi des ASR et 20 témoins fertiles. Les auteurs ont
découvert que la longueur moyenne relative des télomères
leucocytaires chez les hommes et les femmes atteints d'ASR était
significativement plus faible par rapport aux témoins. Ce fut une
découverte intéressante et a conduit à conclure que les
télomères raccourcis pourraient jouer un rôle dans l'ASR
inexpliquée. Cependant, cela devrait être davantage
justifié en analysant les longueurs des télomères au
niveau des cellules germinales (Thilagavathi et al., 2013).
2-10-5- L'épigénétique du
sperme
Le profil épigénétique des
spermatozoïdes pourrait fournir une information historique sur l'ensemble
du processus de spermatogenèse. Pendant la maturation du sperme, environ
90% des histones sont remplacées par des protamines, ce qui permet un
conditionnement plus efficace de la chromatine compactée et
protège également le sperme des dommages oxydatifs. Toute
modification de ce processus aurait un impact sur l'intégrité de
l'ADN du sperme et le rendrait vulnérable aux dommages à l'ADN
(Oliva, 2006). Des auteurs ont découvert que les spermatozoïdes des
partenaires masculins de femmes atteintes d'ASR contenaient de la protamine-1
et de la protamine-2 significativement plus élevés et que le
rapport d'acide ribonucléique messager (ARNm) de la protamine
était plus faible dans le groupe de cas. Les auteurs suggèrent
que non seulement les protamines sont importantes pour la fécondation,
mais qu'elles peuvent jouer un rôle supplémentaire dans
l'embryogenèse précoce; bien que par un mécanisme
incertain (Rogenhofer et al., 2017). Les microARN sont
également des ARN codants non protéiques qui induisent un
silencing génique post-transcriptionnel et assurent la
médiation de la répression traductionnelle (Lim et al.,
2005). Une étude comparative cas-témoins de couples avec ASR
inexpliqués a démontré des différences dans les
polymorphismes de microARN parentaux. Il s'agissait de la première
étude à les impliquer dans l'ASR (Amin-Beidokhti et al.,
2017).
2-10-6- L'âge paternel
Certaines études ont montré qu'avec
l'augmentation de l'âge paternel, le pourcentage de morphologie normale
des spermatozoïdes tend à diminuer. L'analyse du sperme d'hommes de
20 à 60 ans a démontré que l'âge était
négativement corrélé avec le pourcentage de morphologie
normale du sperme et qu'il a commencé à décliner
progressivement à l'âge de 30 ans ((Auger et al., 2009 ; Zhu
et al., 2011).
51
3- Le conseil génétique
Après exploration cytogénétique et
diagnostic d'aberrations chromosomiques chez l'un ou les deux partenaires
consultants pour un problème d'ASR, un conseil génétique
doit être proposé pour des fins, soit :
- De poser l'indication du prélèvement pour
exploration cytogénétique foetale, en déterminant
le
risque potentiel.
- D'avoir un enfant porteur d'une aberration chromosomique.
- D'expliquer au couple ce risque et les apports du Diagnostic
Pré-Natal (DPN).
- D'informer le couple sur les modalités pratiques de
cette exploration ainsi que ses limites
liées essentiellement au risque technique ainsi
qu'à l'interprétation rigoureuse des résultats.
- D'aider le couple à la prise de décision si
une anomalie a été décelée.
Ce conseil génétique doit être très
rigoureusement adapté au couple concerné ainsi qu'à
l'anomalie chromosomique parentale détectée. En effet, devant une
translocation réciproque, les problèmes qui se posent sont ceux
de l'évaluation du risque de déséquilibre à terme
et, selon l'intensité de ce dernier, du mode de prévention
à proposer (Frikha et al., 2012). Le conseil
génétique pour les porteurs d'inversion peut être
basé sur les principes suivants :
- Les inversions péricentriques des régions
hétérochromatiques ainsi que les inversions
paracentriques ont
un risque qui n'est pas différent de celui de la population
générale : l'examen chromosomique prénatal ne semble donc
pas indispensable.
- Les inversions péricentriques des régions
euchromatiques ne sont pas dénuées de risques
pour la descendance de leurs porteurs ; ce risque est
différent selon :
- La taille du segment inversé par rapport à la
taille du segment impliqué.
- Le sexe du porteur : les hommes auront plus de risque de
stérilité que les femmes.
- le mode de recrutement : il y aurait un risque plus
élevé pour les inversions recensées
à partir d'un enfant anormal et porteur d'une aneusomie
de recombinaison.
Il serait justifié dans ces cas de proposer un DPN.
Ainsi, le conseil génétique constitue un acte médical
assez particulier, au cours duquel le rôle du médecin
généticien ne se limite pas à poser un diagnostic ou
à le confirmer et à tirer des conséquences
immédiates pour la prise en charge. Le généticien doit
évaluer la probabilité qu'une anomalie chromosomique parentale
équilibrée se manifeste à nouveau ou sous une forme
déséquilibrée et qui aboutira soit à l'avortement,
soit à la naissance d'un enfant atteint. À l'issue de cette
consultation, le couple doit faire un choix et prendre une décision. Le
couple doit consulter avant de procréer car les étapes conduisant
à une évaluation correcte du risque génétique
peuvent demander un long laps de temps (Poncelet et Sifer, 2011 ; Frikha et
al., 2012).


52
Patients et méthodes
Notre travail de recherche est répartie en deux volets
complémentaires : une étude statistique suivie d'une étude
cytogénétique. Les couples enrôlés dans cette
étude sont recrutés au niveau du service de gynécologie du
CHU Benbadis ainsi que de la maternité Sidi Mabrouk - Constantine. Le
seul critère d'inclusion retenu est le fait que ces couples ont
vécus = 2 avortements spontanés répétés
inexpliqués. Nous avons exclu de cette prospection les couples qui ont
refusé de participer à cette étude.
1- Étude statistique
Ce volet de notre étude vise à prospecter sur
une cohorte de couples ayant vécus plusieurs fausses couches
spontanées à répétition, par la réalisation
d'un questionnaire (annexe I), les étiologies possibles
à ce dysfonctionnement de la santé reproductive. Plusieurs types
de données sont recueillis : les paramètres
anthropométriques de la femme, son état de santé, ses
habitudes alimentaires, l'aspect de l'utérus à
l'échographie. Les valeurs du bilan hormonal sont relevés. La
recherche du syndrome métabolique est faite. Des précisions
concernant le recours à une procréation médicalement
assistée sont demandées (nombre de tentatives, type de PMA, taux
de réussite). Des informations sur la santé reproductive du
conjoint sont également demandées. Enfin, des renseignements sur
la santé reproductive de la fratrie sont sollicités dans la
perspective d'une possible étiologie génétique familiale
héréditaire. Les données ainsi recueillies sont
traitées par Excel.
2- Étude cytogénétique
Ce volet de notre étude vise à l'application des
techniques de cytogénétique pour la réalisation du
caryotype sur des prélèvements sanguins issus de couples avec
antécédents plusieurs FCS. L'analyse cytogénétique
s'est faite au niveau de l'unité de cytogénétique du CRBt
- Constantine. Les prélèvements sanguins sont recueillis dans des
conditions stériles par ponction veineuse, dans des tubes de 4 ml
contenant l'héparine de lithium ou l'héparine de sodium comme
anticoagulants. Ces prélèvements sont acheminés dans
l'immédiat au CRBt pour la mise en culture cellulaire.
53
Patients et méthodes
2-1- Matériel et réactifs 2-1-1-
Matériel
- Tubes coniques de 15 ml (aliquotes du milieu de culture),
- Lames de microscope 26×76 mm (labbox®),
- Boites de rangement des lames,
- Micropipettes (20-200 ìl),
- Pipettes de transfert en plastique,
- Hotte à flux laminaire (ALS- STERIL-
HELIOS®),
- Hotte chimique (Shinsaeng®-model : SFH-2012
(UP)),
- Centrifugeuse à grande vitesse (SIGMA®
2-16 KL),
- Vortex (IKA®), (VELP®, WIZARD
Advanced IR Vortex Mixer),
- Station cytogénétique motorisé
(Leica® DM6000b) reliée à un ordinateur
disposant
d'un système de traitement d'image (logiciel
Cytovision®),
- Étuve (Memmert®),
- Réfrigérateur à 4°C,
- Congélateur à -20°C,
- Bain marie (Memmert®),
- Becher en verre (20 ml, 25 ml, 100 ml, 600 ml et 1000 ml),
- Becher en plastique (50 ml, 100 ml et 400 ml),
- Pince,
- Cuve à coloration (Hellendahl®),
- Papier absorbant,
- Éprouvettes graduées en verre (250 ml, 500
ml),
- Bac en verre,
- Portoir pour tube,
- Pipette graduée 0,5 ml,
- Présentoir de lames,
- Gant nitrile non stérile (non poudré),
- Embouts à Pipette (ISOLAB®
200ìl).
54
Patients et méthodes
2-1-2- Réactifs
- PBMax : préparé 8 ml, conservé à
-20 °C
- Thymidine (100 pl) : 0,6 g dans 100 ml de PBS (Phosphate
Buffered Saline)
- PBS : 1 comprimé de PBS dans 200 ml d'eau
bidistillée (Sigma®),
- Eau distillée,
- Eau minérale,
- Eau bidistillée,
- Acide acétique 100%,
- Éthanol pure 99-100°.
- Giemsa liquide Fluka®.
- Huile d'immersion,
- Sérum de Veau Foetal (SVF) (1,5 ml),
- RPMI 1640 Medium avec L-glutamine et sodium bicarbonate (6,5
ml),
- Colchicine (60 pl) : 0,1 g dans 100 ml d'eau
distillée,
- KCl : 5,6 g/l,
- Sodium phosphate monobasique di-hydraté
(NaH2PO4+2H2O) : 78 g de poudre de phosphate
+ 500 ml d'eau distillée
- Carnoy : 3V Éthanol +1V d'Acide acétique.
- Tampon de Gürr,
- Giemsa : 10 ml solution de Gürr + 5 ml de Giemsa + eau
minérale.
55
Patients et méthodes
2-2- Méthodologie 2-2-1-
Prélèvement
Tous nos prélèvements ont été
réalisés par des infirmiers par ponction veineuse dans des
conditions stériles et en utilisant des tubes héparinés au
lithium ou au sodium.
2-2-2- Mise en culture
- La mise en culture a été être
réalisée avec du sang frais le jour même du
prélèvement.
- Étiqueter les tubes du milieu de culture avec le
numéro d'organisation.
- Travailler sous hotte à flux laminaire horizontale,
ouvrir les tubes et éviter de passer les mains
au-dessus des tubes.
- Mettre 10 gouttes de sang dans le milieu de culture PBMax.
- Fermer les tubes et les incuber horizontalement
(légèrement inclinés) dans une étuve à
37°C
pour une période de 72 heures.
2-2-3- Synchronisation
- Ajouter 100 ul de Thymidine après 48h de mise en culture
et les remettre en culture. 2-2-4- Lavage
- Retirer les tubes de l'étuve,
- Procéder à la centrifugation des tubes à
1500 tours par minute (tpm) durant 5 minutes 30,
- Verser le surnageant, ajouter environs 1 ml de PBS (le PBS aide
à enlever la thymidine),
- Vortexer pour bien mélanger,
- Mettre 10 ml de PBS (jusqu'à l'étiquette) et bien
mélanger,
- Centrifuger une deuxième fois et procéder
à un deuxième lavage « aspiration du surnageant,
dilution au PBS, mélanger au vortex, rajouter du PBS et
remettre à la centrifugeuse ».
2-2-5- Remise en culture
- Après centrifugation rajouter 1,5 ml de RPMI et
vortexer, - Compléter avec 5 ml de RPMI et 1,5 ml de SVF.
56
Patients et méthodes
2-2-6- Blocage en métaphase
- Après incubation de 5h à 5h30, sous haute
à flux laminaire ajouter 60 ul de colchicine pure à l'aide d'une
micropipette (20-200 ìl) dans chaque tube, homogénéiser et
remettre à l'étuve en position horizontale pendant 30 minutes.
2-2-7- Choc hypotonique et préfixation
- Centrifuger les tubes de culture à 1500 tpm pendant 5
minutes 30. Sous hotte chimique, verser le surnageant et ajouter 1 à 2
ml de KCl à la concentration de 5,6 g/l préchauffé
à 37°C. - Vortexer et compléter avec 10 ml de KCl,
- Homogénéiser par retournements puis incuber en
position horizontale pendant 20 minutes.
2-2-8- Préfixation
- Procéder à la préparation du carnoy en
mélangeant 3V d'éthanol avec 1V d'acide acétique, -
Ajouter 0,5 ml à 1 ml de carnoy et homogénéiser par
retournements,
- Centrifuger les tubes de culture à 1500 tpm pendant 5
minutes 30, puis, sous la hotte, verser le surnageant.
2-2-9- Fixation
- Ajouter 1 à 2 ml de carnoy, vortexer et compléter
avec du carnoy,
- Homogénéiser par retournements et fixer à
température ambiante pendant 20 minutes,
- Centrifuger les tubes de culture à 1500 tpm pendant 5
minutes 30,
- Sous hotte chimique, verser le surnageant et refaire une de
deuxième fixation :
ajouter le carnoy, vortex, compléter jusqu'à 10 ml
et on met au réfrigérateur à 4°C.
2-2-10- Étalement
- Préchauffer jusqu'à 86°C. Placer les
lames dégraissées et les préchauffer en l'exposant
à l'humidité du bain marie. Laisser tomber deux gouttes de culot
à une certaine distance (~20 cm) de chaque lame, rincer au carnoy,
- Bien sécher les lames sur le bord du bain marie.
NB : Il faut savoir que les conditions
atmosphériques (température, humidité, pression
atmosphérique) influent sur la qualité des étalements.
57
Patients et méthodes
2-2-11- Coloration
- Coloration sans dénaturation
- Placer directement les lames séchées dans le
Giemsa pendant 5 minutes,
- Sortir les lames et les rincer avec l'eau du robinet.
- Coloration avec dénaturation et
(RHG)
- Réhydrater les lames dans de l'eau distillée
durant 5 min.
- Plonger les lames dans la solution phosphate (NaH2PO4+2H2O)
à 86°C pendant 14 minutes,
- Plonger les lames dans le Giemsa durant 5 minutes,
- Rincer les lames à l'eau du robinet.
2-2-12- Observation des lames après coloration
- Observer les lames sous microscope optique
et traiter les captures avec le logiciel installé. Après avoir
choisi les lames à colorer, elles sont ensuite observées et
étudiées par la station cytogénétique
motorisée relié à un ordinateur traitant les images par le
logiciel : Cytovision®. On observe premièrement avec
l'objectif (x10) puis, lorsqu'on repère une bonne mitose, on met une
goutte d'huile d'immersion et on passe à l'objectif (x63) et
après à l'objectif (x100).
2-2-13- L'interprétation des résultats
- La lecture des résultats et la
prononciation sur la présence d'une éventuelle anomalie se fait
par comparaison avec un caryotype de référence normal
(figures 07 et 08).
58
Patients et méthodes
Figure 07 : Caryotype normal d'un individu de
sexe masculin (46,XY) (RHG)
(Huret et al., 2003)
Figure 08 : Caryotype normal d'un individu de
sexe féminin (46,XX) (RHG)
(Huret et al., 2003).

59
Résultats et discussion
Dans notre travail de recherche, nous avons essayé de
réaliser une enquête épidémiologique descriptive,
prospective concernant les fausses couches spontanées à
répétition dans la région de Constantine. Plusieurs
raisons nous ont amené à porter la réflexion de ce sujet.
En effet, les fausses couches qui correspondent à des pertes
spontanées et consécutives de grossesses sont devenues un
phénomène traumatisant et assez courant dans la population
générale soit pour les grossesses cliniquement reconnues ou les
grossesses qui échouent avant d'être reconnues, ainsi
l'étiologie de la FCSR est souvent inconnue et il existe peu de
stratégies de diagnostic et de traitement fondées sur des
preuves. Les études épidémiologiques de ces
dysfonctionnements sont importantes pour comprendre le trouble et son
apparition dans la population et pour également identifier les facteurs
de risques.
Dans notre objectif de départ, nous nous sommes
engagé à suivre une démarche de recherche d'une
étiologie et l'identification des facteurs à l'origine des pertes
récurrentes grâce à l'utilisation des données
clinico-biologiques et du matériel génétique des parents
recrutés au niveau du CHU Benbadis et de la maternité Sidi
Mabrouk - Constantine pour la réalisation des caryotypes et les
différentes techniques cytogénétiques.
Pour l'enquête épidémiologique, nous avons
préparé un questionnaire visant à recueillir les
données cliniques et biologiques des femmes enrôlées dans
notre cohorte d'étude. Durant la période de notre stage qui a
commencé en février 2020, nous avons collecté 14
échantillons qui correspondent à des prélèvements
sanguins pour 7 couples ayant vécu des ASR, dont l'âge des
conjointes varie entre 32 ans et 39 ans. Ces échantillons ont
été mis en culture et traités afin de réaliser les
caryotypes et identifier les anomalies chromosomiques. Malheureusement, il a
été impossible de les réaliser et de traiter les
échantillons restants suite à l'apparition et à la
propagation de la pandémie du COVID-19 qui forçait l'arrêt
du travail. La mise en place de l'enquête épidémiologique
était aussi impossible pour la même raison. Malheureusement,
l'analyse cytogénétique en bande R n'a été
complétée que pour quatre couples. Sur ces quatre couples, le
conjoint présente un syndrome de Klinefelter typique (47,XXY) (figures
17 et 18). Pour les autres, les caryotypes étaient euploïdes :
aucune anomalie chromosomique de nombre ou de structure n'a été
relevée (figures 09, 10, 11, 12, 13, 14, 15, 16, 19, 20, 21 et 22).
Résultats et discussion
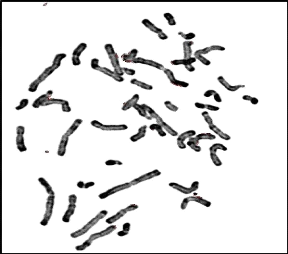
Figure 09 : Chromosomes métaphasiques
d'un noyau cellulaire éclaté et dispersé
(Grossissement 100×) (Couple 01 : Conjoint).
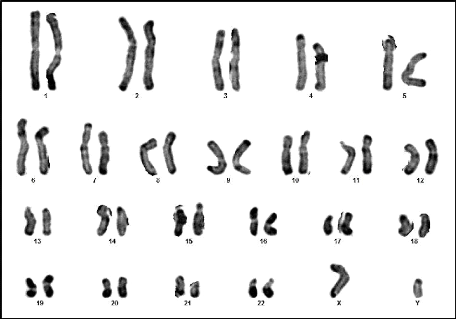
Figure 10 : Caryotype (46,XY) (RHG) (Couple 01
: Conjoint).
60
61
Résultats et discussion
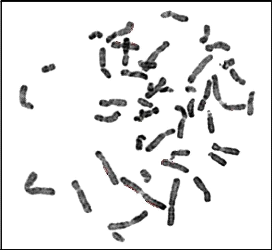
Figure 11 : Chromosomes métaphasiques
d'un noyau cellulaire éclaté et dispersé (Grossissement
100×) (Couple 01 : Conjointe).
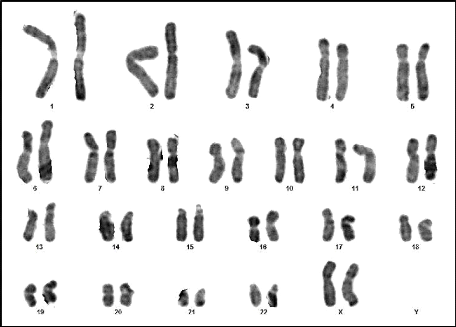
Figure 12 : Caryotype (46,XY) (RHG) (Couple 01
: Conjointe).
Résultats et discussion

Figure 13 : Chromosomes métaphasiques
d'un noyau cellulaire éclaté et dispersé
(Grossissement
100×) (Couple 02 : Conjoint).
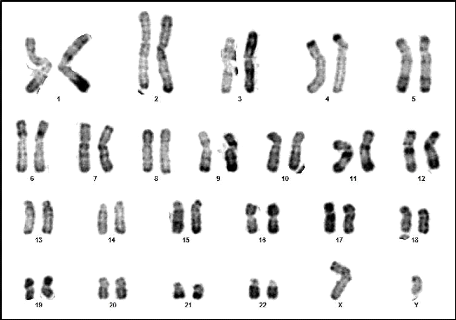
Figure 14 : Caryotype (46,XY) (RHG) (Couple 02
: Conjoint).
62
Résultats et discussion

Figure 15 : Chromosomes métaphasiques
d'un noyau cellulaire éclaté et dispersé
(Grossissement
100×) (Couple 02 : Conjointe).
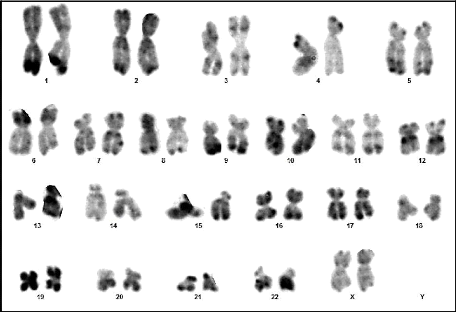
Figure 16 : Caryotype (46,XX) (RHG) (Couple 02 :
Conjointe)
63
Résultats et discussion

Figure 17 : Chromosomes métaphasiques
d'un noyau cellulaire éclaté et dispersé
(Grossissement 100×) (Couple 03 : Conjoint).
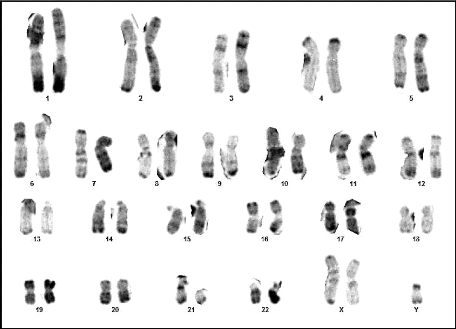
64
Figure 18 : Caryotype (47,XXY) (RHG) (Couple 03
: Conjoint)
Résultats et discussion

Figure 19 : Chromosomes métaphasiques
d'un noyau cellulaire éclaté et dispersé
(Grossissement 100×) (Couple 04 : Conjoint).
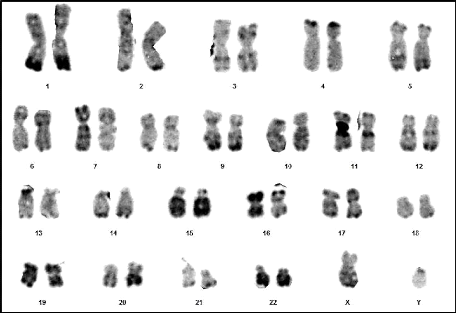
Figure 20 : Caryotype (46,XY) (RHG) (Couple 04
: Conjoint).
65
Résultats et discussion

Figure 21 : Chromosomes métaphasiques
d'un noyau cellulaire éclaté et dispersé
(Grossissement 100×) (Couple 04 : Conjointe).
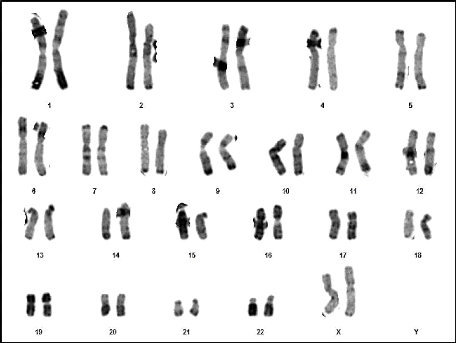
66
Figure 22 : Caryotype (46,XX) (RHG) (Couple 04 :
Conjointe).
67
Résultats et discussion
La reproduction humaine est un processus très frustrant
où 70% des conceptions humaines ne parviennent pas à atteindre la
viabilité, et environ 50% de toutes les grossesses sont perdues avant
les menstruations attendues (McCoy et al., 2015). Les ASR sont des
complications de la reproduction qui affectent 1 à 5% des couples qui
essayent d'avoir un enfant et environ 15 à 20% des grossesses
diagnostiquées (Lejeune 2006).
Dans une étude longitudinale, Regan et al,
suivaient 630 femmes de la population générale ayant l'intention
de tomber enceinte. Dès qu'une grossesse a été
suspectée ou que des symptômes d'avortement menaçants ont
été observés, des études échographiques en
série ont été réalisées pour documenter la
viabilité ou la perte. Parmi les 412 grossesses cliniquement reconnues,
il y a eu 357 grossesses réussies, 50 ont vécu des fausses
couches spontanées 2 grossesses ectopiques et 3 avortement induits.
À l'exclusion des grossesses extra-utérines et des avortements
provoqués, l'occurrence globale des fausses couches spontanées
reconnues était de 12% ce qui correspond précisément
à la fréquence fixée par Wilcox et al (Regan
et al., 1989).
Lorsque d'autres études ont montré une
prévalence plus élevée de la perte de grossesse, allant de
10 à 15%, une étude basée sur une population a
montré que 13,5% des grossesses à terme se sont terminées
par une perte foetale (Nybo Andersen et al., 2000). Il a
été montré que les ASR affectent environ 1% à 2%
des femmes, lorsqu'on parle de trois pertes consécutives de grossesses
avant 20 semaines de la dernière période menstruelle (Ford et
Schust, 2009). Larsen a signalé une prévalence de 0,8% à
1,4% si seulement les pertes cliniques sont inclues, lorsqu'on prend en
considération les pertes biochimiques, la prévalence augmente
entre 2 à 3% (Larsen et al., 2013). Si nous parlons de la FCSR
comme deux pertes consécutives avant 20 semaines de la dernière
période menstruelle, elle survient chez 1% à 3% de tous les
couples qui tentent de concevoir (Eshre, 2017).
Dans les études prospectives, le risque de perte de
grossesse augmente avec chaque perte d'environ 11% chez les nulligravides
à environ 40% après trois pertes ou plus (Magnus et al.,
2019). Les facteurs de risque connus de FCSR sont l'âge de la femme, les
pertes de grossesse antérieures, les anomalies chromosomiques
structurelles parentales, les anomalies utérines, les troubles
endocriniens, le syndrome des anti-phospholipides (APS) et la thrombophilie
héréditaire. L'âge avancé de la mère a
été considéré comme lié à la
réduction de la qualité et de la quantité des ovocytes
restants. Selon une vaste étude prospective sur ce constat, le risque de
fausse couche lié à l'âge dans les grossesses reconnues a
été évalué comme étant de : 13% en 12-19
ans, 11% en 20-24 ans, 12% en 25-29 ans, 15% en 30-34 ans, 25% en 35-39 ans,
51% en 40-44 ans, 93% en 45 ans (Rohilla et al., 2017).
68
Résultats et discussion
Même après des enquêtes approfondies, une
cause d'ASR est identifiée dans moins de 50% des couples (Alijotas et
Gimenez, 2013). Par conséquent, la majorité des cas restent sans
facteur de risque connu. Seuls l'âge de la femme et le nombre de fausses
couches antérieures se sont révélés être des
facteurs pronostiques pour la majorité des patientes (Eshre, 2017). En
dehors des fausses couches idiopathiques, les anomalies chromosomiques
représentent la cause la plus fréquente de FCS sporadique, et
elles sont retrouvées dans 50 à 70% des FCS du premier trimestre.
Elles sont mises en évidence par culture puis caryotype du trophoblaste
de la grossesse arrêtée. Néanmoins, cette technique reste
difficile avec un taux d'échec de culture important de 10 à 40%
(Lejeune, 2006). Par ailleurs, devant la répétition des FCS chez
un couple, la recherche de pathologies génétiques peut permettre
d'expliquer certains de ces accidents.
Des études cytogénétiques
réalisées en l'an 2000, ont monté que la plupart de ces
anomalies sont des anomalies chromosomiques numériques ou
aneuploïdies (86%), et une minorité des cas est causée par
des anomalies chromosomiques structurales (6%) ou mosaïcisme chromosomique
(8%) (Goddijn, 2000).
Dans une série de 422 caryotypes sur trophoblaste chez
des couples ayant fait auparavant au moins trois FCS, Stephenson et
al, retrouvent 54% d'anomalies chromosomiques dont 96% d'anomalies de
nombre (66,5% de trisomies, 10% de polyploïdies et triploïdies, 9% de
monosomies X et 0,5% d'association entre la trisomie 21 et la monosomie du
chromosome X) et 4% d'anomalies de structure (translocations
déséquilibrées) (Stephenson et al., 2002).
Ogasawara et al qui ont analysé les caryotypes
de 1284 couples, ont suggéré que la présence des
aberrations de caryotype parental définissent un groupe de risque
élevé de fausses couches, puisqu'entre 61% et 72% de leurs
patients ont eu des fausses couches ultérieures. La translocation
réciproque était l'anomalie la plus fréquente dans une
étude menée en 2012 sur 168 couples tunisiens : 6 couples sur
168, soit 40% des anomalies (Ogasawara et al., 2004).
Dans la majorité des cas, il n'y a pas de pertes
décelables de matériels chromosomiques, la translocation est
équilibrée et le phénotype est souvent normal, comme chez
les six patients porteurs de cette aberration chromosomique ; c'est ainsi que
la translocation est méconnue et sa révélation se fait par
la survenue d'accidents abortifs (Frikha et al., 2012).
69
Résultats et discussion
Les translocations ont également dominé toutes
les autres anomalies chromosomiques observées sur une population de 137
cas en Chine, la fréquence était de seulement 0,18% des patients
ayant des anomalies chromosomiques de structure parmi les 137 cas
étudié (Dong, 2014). En ce qui concerne l'étude de
Carp et al, sur 916 patients , 99 avaient des aberrations
chromosomiques (10,8%), 817 n'avaient aucune anomalie. parmi les 99 atteints :
68 des femmes ont vécu entre 3-4 fausses couches et 31 ont vécu
plus de 5 avortements. En ce qui concerne les anomalies détectées
: 31 avaient des translocations maternelles équilibrées et 21
avec des translocations équilibrées paternelles, 18
présentaient des mosaïques maternelles et 3 des mosaïques
paternelles, 6 autres patientes, 19 conjoints et un seul couple avaient des
inversions (Carp, 2004). Les inversions chromosomiques sont la seconde anomalie
fréquente chez les couples avec ASR. Dans une série de 51 couples
qui ont vécu des ASR, 7 patient parmi les 51 (13,7%) étaient
porteurs des anomalies de type inversion. (Stephenson, 2002).
Lors d'une étude de Demirhan en 2008, sur une
population de 157 patients porteurs d'inversions péricentriques du
chromosome 9, le taux abortif était significativement
élevé, de l'ordre de 31%. Cela suggère la
susceptibilité d'un locus situé au niveau du point de cassure
pour les phénotypes anormaux qui finissent dans le produit d'avortement.
(Demirhan, 2008). En effet, la région péri-centromérique
(p11q13) est celle impliquée dans ce déséquilibre
chromosomique. Elle est caractérisée par sa richesse en
hétérochromatine constitutive. Cette dernière est
caractérisée par son polymorphisme due au fait de
l'instabilité de l'ADN satellite, formé de courtes
séquences répétées en tandem en un très
grand nombre de fois. Cela rend l'hétérochromatine
transcriptionnellement inactive, ne participant pas à la recombinaison
génétique. On s'est longtemps demandé si
l'hétérochromatine avait un rôle précis dans le
génome humain car son polymorphisme important ne semblait pas avoir de
conséquence fonctionnelle ou phénotypique. Toutefois, elle serait
impliquée dans différents processus génétiques. En
dépit du contrôle de la fonction centromérique lors de la
ségrégation méiotique, l'hétérochromatine
intervient dans l'organisation des domaines nucléaires à la
périphérie ainsi qu'au contrôle
épigénétique. Plus spécifiquement, elle intervient
dans le contrôle de la transcriptabilité du génome. Ainsi,
des gènes habituellement localisés dans l'euchromatine peuvent
être réduits au silence lorsqu'ils sont placés à
proximité d'un domaine hétéro-chromatique. Cela pourrait
aboutir à l'extinction de gènes essentiels intervenant dans la
gamétogenèse, ce qui explique la récurrence des accidents
abortifs chez le couple portant l'inversion péricentrique du chromosome
9 (Frikha et al, 2012).
70
Résultats et discussion
D'autres anomalies chromosomiques de structure peuvent
être trouvées chez les patients présentant des ASR, parmi
lesquels les insertions et les réarrangements chromosomiques.
Dans une série de 51 couples, 3 couples parmi 51 (5,9%)
avaient une insertion et 1 couple (2%) avait le syndrome de chromosome 20 en
anneau (Stephenson, 2002).
Une étude en 1975 a porté sur 1500
échantillons de fausses couches, 61% d'eux ont contenaient un caryotype
anormal avec des trisomies, monosomie, triploïdie, ou
tétraploïdie (Boue, 1975). La plupart des aneuploïdies sont
d'origine maternelle et augmentent en fonction de l'âge (Nussbaum, 2016).
Franasiak et ses collaborateurs ont examiné les résultats du
dépistage génétique de la pré-implantation de 15
169 embryons biopsiés au stade du blastocyste qui ont été
attribués par 2701 patients (Franasiak, 2014), parmi les 6168
échantillons aneuploïdes, les erreurs impliquant un seul chromosome
étaient les plus fréquemment observées (63,7%), suivies de
2 chromosomes (19,9%) et de 3 chromosomes ou plus (16,3%). La
probabilité qu'un embryon soit qualifié d'anormal était
significativement associé à l'augmentation de l'âge de la
femme. Le taux d'aneuploïdie était également associé
à la structure chromosomique : les chromosomes acrocentriques
présentaient les taux d'aneuploïdie les plus élevés,
suivis des chromosomes métacentriques et enfin les chromosomes
submétacentriques (Franasiak, 2014).
Tableau I : Estimation de l'incidence des
anomalies caryotypiques
à propos de 10 000 grossesse (Nussbaum et
al., 2016).
|
Total
|
incidence
10,000
|
Avortement spontané (%)
1500 (15)
|
vivants
8500
|
|
Chromosomes normaux
|
9200
|
750 (8)
|
8450
|
|
Chromosomes anormaux
|
800
|
750 (94)
|
50
|
|
Anomalies spécifiques
|
|
|
|
|
Polyploïdie
|
170
|
170 (100)
|
0
|
|
45,X
|
140
|
139 (99)
|
1
|
|
Trisomie 16
|
112
|
112 (100)
|
0
|
|
Trisomie 18
|
20
|
19 (95)
|
1
|
|
Trisomie 21
|
45
|
35 (78)
|
10
|
|
Trisomie (autres)
|
209
|
208 (99.5)
|
1
|
|
47,XXY; 47,XXX; 47,XYY
|
19
|
4 (21)
|
15
|
|
Réarrangement déséquilibré
|
27
|
23 (85)
|
4
|
|
Réarrangement équilibré
|
19
|
3 (16)
|
16
|
|
Autres
|
39
|
37 (95)
|
2
|
71
Résultats et discussion
Les trisomies autosomales sont le résultat des erreurs
méiotiques maternelles, ces trisomies touchent majoritairement les
chromosomes 16, 22, 21, 15, 18 et 2 (Hardy, 2015). Une étude en Inde-New
Delhi sur 742 couples entre la période de 1990-2003 a donné les
résultats suivants : 9 sujets parmi les 742 couples (17,3%) ont
été porteurs des anomalies chromosomiques numériques, 3
sujets (33,3%) avaient une monosomie (45,X), 3 autres sujets (33,3%)
étaient porteurs du syndrome (46,XXX), et un sujet (13,2%) porteur la
mosaïque (46,XXY) (Dubey et al., 2005). Le mosaïsme est la
conséquence des erreurs mitotiques, et qui lors de sa présence
touche au moins deux lignées cellulaires d'un foetus au cours du
développement (Hardy et al, 2015). Ces anomalies peuvent aussi
survenir suite à un échec de recombinaison, d'une
séparation prématurée des chromatides soeurs mais la non
disjonction méiotique reste la cause la plus fréquente
d'aneuploïdie. Dans les produits de conception, au moins 50% de toutes les
fausses couches sont associées à des anomalies chromosomiques de
nombre : trisomie, polyploïdie et monosomie X. Une analyse
rétrospective cytogénétique standard des chromosomes
observés en bande GTG obtenus à partir de produits de conception
d'un total de 1000 échantillons a été
réalisée entre 2007 à 2015. Un total de 501 cas (50,1%)
présentant des anomalies chromosomiques ont été
identifiés. Les anomalies chromosomiques détectées
comprenaient 59,7% des trisomies, 22% des polyploïdies, 7,5% des
monosomies, 7% des anomalies structurelles déséquilibrées
et 3,8% des aneuploïdies doubles. Les trisomies autosomiques les plus
courantes étaient les trisomies des chromosomes 16, 21, 22, 13, 15 et
18. Les aneuploïdies des chromosomes sexuels ont été
représentées par le caryotype Turnérien typique (45,XO)
dans 38 cas, ce qui représente 10,7% de toutes les aneuploïdies.
D'autres aneuploïdies des chromosomes sexuels incluaient une polysomie du
chromosome X (de 2 à 5 copies) (0,8% de toutes les aneuploïdies).
Des aneuploïdies doubles ont été observées dans 19
cas, et des caryotypes mosaïques ont été observés
dans 61 cas (6,1%) (Larysa et al.,2017). La figure 23,
ci-après, illustre l'incidence des trisomies dans les produits de
fausses couches spontanées en fonction des autosomes
étudiés.
72
Résultats et discussion
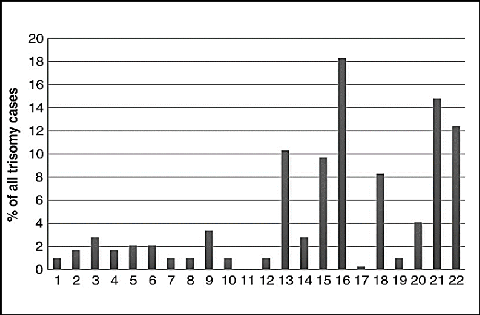
Figure 23 : Distribution des anomalies
autosomiques (trisomies) détectées dans
1000
échantillons de produits des fausses couches (Larysa et al,
2017).
Ces différences de fréquence des anomalies
chromosomiques détectées par la cytogénétique
conventionnelle pourraient être dues à un âge maternel plus
élevé dans ces groupes car il y'a une corrélation entre
l'âge maternel avancé et l'augmentation de la fréquence des
anomalies chromosomiques dans les ovocytes, les embryons
préimplantatoires et le produit de conception. La trisomie du chromosome
11 n'a pas été observée dans le groupe
étudié, bien qu'elle ait été rarement
décrite dans certaines études. La rareté de la trisomie du
chromosome 11 dans les produit de conception peut être expliquée
à la fois par la faible fréquence de non-disjonction
méiotique du chromosome 11 par rapport aux chromosomes (Rodriguez-Purata
et al., 2015). La fréquence globale de la monosomie du
chromosome X était de 7,5%. Une telle incidence semble assez constante
dans différentes études de différents groupes, ce qui peut
s'expliquer par le fait que le risque de monosomie X n'est pas influencé
par l'âge (Sahoo et al., 2017). Plusieurs études ont
montré que la non-disjonction chromosomique maternelle est la cause
prédominante de la double aneuploïdie (Li et al.,
2005).
73
Résultats et discussion
Dans une étude portant sur 1309 femmes qui ont
déjà subi deux ou plus de pertes de grossesse au cours du premier
trimestre, l'analyse chromosomique des produits de conception a montré
que la fréquence des caryotypes embryonnaires normaux a augmenté
à mesure que le nombre de fausses couches augmentait (Goldstein et
al., 2017).
Le risque de la survenue des ASR peut être
indépendant des anomalies chromosomiques maternelles, car des
études ont révélé la relation entre la
qualité du sperme et la capacité de l'embryon à atteindre
le stade blastocyste et sa progression vers l'implantation (Jeve, 2014).
Rubio et al après avoir analysé la constitution
chromosomique de 12 couples qui sont subi des ASR, ont signalé une
augmentation de la fréquence des diploïdies et des disomies dans
les échantillons spermiques des conjoints. Ces données ont
été confirmé par Carell et al (Carell et al.,
2003).
Agarwal et al ont suggéré que la
micro-délétion du facteur azoospermique (AZF) situé au
niveau du bras long du chromosome Y et qui est essentiel pour une
spermatogénèse normale peut augmenter le risque de la survenu des
anomalies chromosomiques et donc provoquer un avortement (Agarwal et al.,
2015). Une autre étude sur des échantillons de sperme de 11
partenaires qui ont vécu des ASR, a révélé une
augmentation significative des erreurs méiotiques du chromosome 16,
induisant ainsi l'augmentation de la survenue des disomies chez 60% des
patients. Ainsi, la non disjonction méiotique du chromosome 16
paternelle peut exercer une influence sur la survenu des aneuploïdies
foetales de façon similaire par rapport à la non disjonction
méiotique du chromosome 16 maternelle (Neusse, 2015).
Certaines mutations génétiques, telles que les
troubles autosomiques dominants conduisant à la dystrophie myotonique,
peut prédisposer les patients à l'infertilité ou
même aux ASR. Autres troubles autosomaux dominants associés aux
ASR parmi lesquels : la dysplasie squelettique mortelle, troubles du tissu
conjonctif ou des anomalies hématologiques, y compris les
altérations du fibrinogène, carence en facteur XIII ou
anémie falciforme. En 2004, Baek et al ont décrit 30
gènes impliqués dans des mécanismes d'immunité,
d'angiogenèse et d'apoptose montrant des différents niveaux
d'expression entre un groupe de femme à grossesse normal et un groupe de
patientes qui ont présenté des ASR (Baek, 2004). Xiaonhan et
al ont récemment publié une grande méta-analyse dans
laquelle 53 polymorphismes ou variants géniques de 37 gènes ont
été associés à ces dysfonctionnements de la
reproduction (Xiaonhan, 2017).
74
Résultats et discussion
Des techniques moléculaires telles que les puces ADN
microarray, l'hybridation génomique comparative et le
séquençage de nouvelle génération ont permis la
mise en évidence de gènes pouvant être associés aux
ASR, ces gène sont sujets à des polymorphismes
nucléotidiques, supposés délétères, qui
peuvent donc être la cause d'une fausse couche. Parmi les gènes
identifiés : AR, DNMT3, FOXP3, CGB5,
NLRP7, TIMP2 et CTNNA3 (Porras-Dorantes, 2017). Une
étude auprès de 428 cas entre 1990 et 2015 a évalué
l'effet de 472 variants dans 187 gènes. Les chercheurs ont
signalé une association entre la ASR et 21 variants des gènes
impliqués dans la réponse immunitaire (IFNG, IL10, KIR2DS2,
KIR2DS3, KIR2DS4, MBL, TNF), dans la coagulation (F2, F5, PAI-1,
PROZ), dans le métabolisme (GST1, MTHFR) et dans
l'angiogenèse (NOS3, VEGFA) (Pereza, 2017). Une
méta-analyse menée par Xu et al a montré que le
polymorphisme du gène VEGF associé à une
diminution des taux sériques de la protéine VEGF
angiogénique augmentent la susceptibilité maternelle
vis-à-vis les ASR et ce en vue du rôle crucial de la
protéine codée par ce gène dans l'angiogenèse
placentaire et l'implantation embryonnaire (Xu et al., 2015).
Des chercheurs ont mené des études pour
évaluer la relation entre les mariages consanguins et les ASR. Turki
et al, en Arabie saoudite, ont décrit une corrélation
statistiquement significative entre les mariages consanguins et les fausses
couches spontanées récurrentes (Turki et al., 2016).
L'effet de ces unions entre apparentés, particulièrement
répandus dans certains pays arabo-musulmans, sur les ASR, doit
être mieux précisé.
L'hybridation fluorescente in situ (FISH),
l'hybridation génomique comparative (CGH), la détection de
polymorphisme nucléotidique unique (SNP), la réaction de
polymérisation en chaine (PCR) quantitative (qPCR) sont des techniques
moléculaires capables de détecter les
microdélétions et les microduplications contrairement aux
anciennes techniques, et ils peuvent également détecter les
anomalies même en cas d'échec de culture ou de contamination.
Après avoir analysé les différences entre les techniques
de diagnostic prénatal, des auteurs ont rapporté des
fréquences de diagnostic de 2,5 à 4,2% avec le caryotype, alors
que des fréquences de 5,3 à 15% ont été
rapportées avec les autres techniques moléculaires. Par contre,
dans une revue systématique de Van den Berg et al, aucune
anomalie chromosomique n'a été détectée par les
techniques moléculaires, ce qui suggère que ces derniers
pourraient être utiles comme un outil complémentaire, mais ne
remplace jamais le caryotype (Chu et al., 2016).
75
Résultats et discussion
Les ASR inexpliqués peuvent être une condition
difficile et frustrante pour les patients et les cliniciens. En effet, il
existe deux types distincts d'ASR inexpliqués, les types I et II : l'ASR
inexpliqué de type I fait référence à des FCS qui
se produisent principalement par hasard, chez des femmes qui n'ont pas de
pathologie sous-jacente spécifique. Ce type a un pronostic relativement
bon par rapport aux femmes du même âge et aucune intervention n'est
nécessaire. Quant à l'ASR inexpliqué de type II, il fait
référence à des FCS qui surviennent en raison d'une
pathologie sous-jacente qui n'est pas actuellement identifiée par des
investigations cliniques de routine ou en raison de facteurs de risque
importants liés à l'environnement et au mode de vie. Ce type a un
pronostic plus mauvais, en comparaison avec le premier, pour les femmes du
même âge (Saravelos et Regan, 2014). Il est donc raisonnable de
supposer qu'une proportion de femmes atteintes d'ASR inexpliqués
(environ une sur trois) peut avoir des facteurs de risque environnementaux
importants ou des pathologies endogènes, non détectées par
les enquêtes de routine actuelles, augmentant ainsi le risque de survenu
de fausses couches spontanées à répétition
(Saravelos et Regan, 2014).
À titre d'exemples, plusieurs études ont
suggéré que des facteurs tels que l'obésité, le
tabagisme, l'alcool, la caféine et l'exposition à certains
risques professionnels peuvent augmenter le risque d'ASR, ce qui pourrait
principalement concerner le groupe des ASR inexpliqués. D'autres
études expérimentales ont montré une augmentation du
nombre de cellules tueuses naturelles utérines chez les femmes ayant
subi des ASR inexpliqués. Cependant, jusqu'à présent, ces
associations et leurs traitements associés restent sans fondement
(Saravelos et Regan, 2011 ; 2012).
Le plus souvent, la fausse couche ne nécessite pas de
prise en charge spécifique : pas de médicalisation, pas
d'hospitalisation car le processus d'expulsion se fait tout seul. Le col de
l'utérus s'ouvre, des débris ovulaires, l'embryon ou le foetus
est expulsé, sous l'effet de contractions utérines plus ou moins
douloureuses et accompagnées de saignements plus ou moins abondants.
Mais il arrive parfois que le processus d'expulsion est incomplet, ne se
produit pas spontanément. Dans ces cas, une prise en charge
médicalisée est nécessaire (CNGOF, 2006). Selon ces
mêmes recommandations, trois types de prise en charge sont
déterminées suivant les institutions, le choix sera laissé
à la patiente ou une méthode sera privilégiée en
fonction du type de fausse couche.
76
Résultats et discussion
- L'expectative : c'est l'attente de
l'expulsion spontanée de l'embryon sans intervention
médicalisée. Le délai de l'expulsion peut être
très long, ce qui est souvent difficile à vivre pour les couples.
Pour Lejeune et Carbonne (2007), elle est possible lorsque l'embryon n'est pas
visible ou qu'il mesure moins de 25 mm (vers 9 SA).
- Interventions médicales :
l'intervention médicamenteuse qui correspond à
l'utilisation de prostaglandines alors que l'intervention chirurgicale
correspondant à l'aspiration du contenu utérin après
dilatation cervicale favorisée par la prise de misoprostol quelques
heures avant l'intervention. À partir d'un certain âge
gestationnel, elle est remplacée par un curetage évacuateur
(CNGOF, 2006).
D'après le CNGOF, la prise en charge
hospitalière consiste à surveiller chez la patiente ses signes
vitaux, les pertes sanguines, les effets secondaires du traitement
médicamenteux s'il est donné. Elle permet de d'apporter une
couverture antalgique, de réaliser les soins post-opératoires
(évaluation de la douleur, signes vitaux, mobilisation, reprise de la
diurèse et du transit) de vérifier par échographie
l'expulsion totale de l'embryon ou du foetus. Un rendez-vous de contrôle
est prévu 1 mois après la fausse couche précoce. Il est
parfois possible que la prise en charge, expectative ou médicamenteuse,
ait lieu en ambulatoire. Elle est proposée en fonction de la
capacité de la patiente à comprendre l'information et à
appréhender les risques. Elle est informée au préalable
sur les démarches à suivre en cas de complications. Un
contrôle, le plus souvent, une semaine après l'expulsion est
prévu avec un contrôle échographique (CNGOF, 2006).
La présence d'une anomalie chromosomique
équilibrée chez un des parents constitue une des indications
principales du DPN. Ce diagnostic s'entend sur l'ensemble des techniques
permettant de reconnaître, à un moment plus ou moins
précoce de la vie intra-utérine, la pathologie dont l'embryon ou
le foetus est ou sera atteint, soit par l'étude de sa morphologie
(échographie), soit par des examens biologiques (caryotype, dosages
enzymatiques, biologie moléculaire). Différentes méthodes
sont actuellement envisagées pour l'étude
cytogénétique : choriocentèse (prélèvement
de villosités choriales), amniocentèse ou cordocentèse
(Frikha et al., 2012).
77
Résultats et discussion
L'approche thérapeutique adéquate pour anticiper
les anomalies chromosomiques chez le produit de conception serait un DPI. Cela
nécessite le recours à une FIV. Son grand avantage est de ne pas
générer d'interruption de grossesse puisque seuls les embryons
indemnes sont transférés dans l'utérus maternel. Il
apparaît donc comme une alternative au DPN pour les couples ayant eu
à vivre des interruptions de grossesse itératives ou
confrontés à une maladie liée à l'X. Il peut aussi
apparaître comme une solution pour l'homme ou la femme atteints qui ne
peuvent se résoudre à empêcher la naissance d'un enfant
ayant le même handicap ou qui n'envisagent pas de transmettre une
pathologie mineure ou à révélation tardive à leurs
enfants. Toutefois, en raison de la complexité des maladies
génétiques il reste en pratique limité à un petit
nombre de maladies et ne concerne qu'un faible nombre de couples (Hanson et
al., 2003).
Selon le Royal College of Obstetricians & Gynecologists,
le diagnostic génétique préimplantatoire permet de
détecter la présence d'éventuelles anomalies
génétiques ou chromosomiques dans les embryons conçus
après fécondation in vitro afin de sélectionner
et transférer un embryon sain, il a été proposé
comme traitement et solution pour les parents souffrant d'ASR et ceux qui sont
porteurs d'une translocation (RCOG, 2011). Cependant, la pertinence exact de
l'intérêt du DPI pour améliorer les taux de réussite
de grossesses menées à termes chez des couples porteurs
d'anomalies chromosomiques reste à confirmer. Lalioti et al ont
suggéré que le DPI réduit le taux des fausses couches chez
les couples atteints des FCSR induites par un déséquilibre
chromosomique chez les patients âgés plus de 35 ans (Lalioti,
2008). En conclusion, et en raison de l'absence des données suffisantes
et des preuves clairement établies, la conception assistée avec
le dépistage génétique préimplantatoire comme
traitement préventif proposé dans le cadre des ASR n'est pas
recommandée.

78
Conclusion et perspectives
Les avortements spontanés à
répétition sont un problème de santé reproductive
important affectant 2 à 5% des couples, mais les examens à la
recherche d'une étiologie et les traitements à proposer ne sont
pas consensuels. En effet, les pertes de grossesses récurrentes n'ont
pas été définies de manière cohérente vue le
manque de consensus concernant le nombre de fausses couches qui permettent une
définition appropriée et optimale. L'OMS définie les
fausses couches spontanées récurrentes comme « trois fausses
couches consécutives et plus avant la 20ème semaine
» alors que l'American Society for Reproductive Medicine (ASRM)
définit la survenue de deux fausses couches consécutives comme
fausses couches récurrentes. Les ASR sont considérés comme
une entité clinique nécessitant des tests diagnostiques et une
intervention thérapeutique qui reposent sur la connaissance des facteurs
de risque ainsi que la probabilité de trouver une étiologie
traitable pour la maladie. À l'heure actuelle, il existe un nombre
restreints d'étiologies acceptées pour les ASR. Il s'agit
notamment des anomalies chromosomiques parentales, de l'hypothyroïdie non
traitée, du diabète incontrôlé, de certaines
anomalies anatomiques utérines et du syndrome des anticorps
anti-phospholipides. D'autres étiologies probables ou possibles
comprennent des troubles endocriniens supplémentaires, des
thrombophilies héréditaires et/ou acquises, des anomalies
immunologiques, des infections et des facteurs environnementaux. En
dépit de tous ces étiologies possibles, la moitié des cas
d'ASR reste inexpliqués.
Dans l'ensemble, la majorité des échantillons
provenant des pertes spontanées ainsi que les caryotypes parentaux
présentent un certain type d'anomalie cytogénétique. Les
fréquences et les types spécifiques d'anomalies chromosomiques
trouvées dans les tissus obtenus à partir des pertes de grossesse
varient avec l'âge gestationnel du foetus au moment du
décès et avec l'âge maternel. Parmi les anomalies
caryotypiques parentales les plus fréquentes sont les translocations,
les inversions et les aneuploïdies en mosaïque. Les anomalies
monogéniques sont moins étudiées que les autres anomalies
tel que celles associées à l'angiogenèse, à la
thrombophilie, à la dystrophie myotonique et à la
régulation du système immunitaire.
Les effets des erreurs méiotiques paternelles, par
opposition aux erreurs maternelles, et de l'âge paternel sur le
résultat de la reproduction ne sont pas encore clairement
définis. Bien que des erreurs de non-disjonction se produisent dans une
moindre mesure dans le sperme que dans les ovocytes, les erreurs de division
des chromosomes paternels sont responsables majoritairement des trisomies, et
des disomies qui finissent par provoquer des pertes de grossesses.
79
Conclusion et perspectives
L'évaluation diagnostique des ASR doit inclure les
caryotypes maternels et paternels, l'évaluation de l'anatomie
utérine, du dysfonctionnement thyroïdien, de l'APS et de certaines
thrombophilies. Chez certaines femmes, une évaluation de la
résistance à l'insuline, de la réserve ovarienne, des
anticorps antithyroïdiens et des troubles de la prolactine peut être
indiquée.
Le traitement doit être orienté vers toute
étiologie traitable et peut inclure la fécondation in vitro
avec diagnostic génétique préimplantatoire, la
correction chirurgicale des anomalies anatomiques, la correction des troubles
endocriniens et de l'anticoagulation ou la supplémentation en acide
folique. Dans le cas des ASR inexpliqués, la progestérone s'est
avérée bénéfique chez les femmes qui avaient subi
au moins 3 pertes. Des conseils prénatals et un soutien psychologique
devraient être offerts à tous les couples souffrant d'ASR, car il
a été démontré que ces mesures augmentent les taux
de réussite des grossesses ultérieures.
À la lumière de notre travail de recherche, des
perspectives d'avenir peuvent être proposées :
- Organiser des ateliers de formation à l'échelle
nationale à l'intention du personnel
de santé, en particulier les
gynécologues-obstétriciens, qui sont les premiers
concernés. Cette formation doit porter sur la maîtrise de toutes
les étiologies ainsi que la meilleure prise en charge face à
chacune d'elle.
- Identifier les femmes qui peuvent être
prédisposées aux fausses couches même
si le nombre des
pertes vécu par la patiente est inférieur à 3.
- Il est nécessaire de corriger un diabète, une
dysthyroïdie pour la bonne évolution
d'une future grossesse et
demander systématiquement un bilan clinique et biologique le plus
complet possible compte tenu de la fréquence des ASR multifactoriels.
- Gérer le stress chez les patientes surtout si la
fausse couche reste inexpliquée,
et identifier les facteurs
psychologiques qui peuvent avoir un impact négatif sur le bon
déroulement de la grossesse.
- Mettre en place, de façon systématique, une
analyse cytogénétique pour les deux
partenaires de couples
ayant subi au moins deux FCS, particulièrement en l'absence d'une
étiologie confirmée par d'autres investigations cliniques et
biologiques.

80
Références bibliographiques
1. ABBASSI-GHANAVATI M, GREER L, CUNNINGHAM F et
al. 2009. Pregnancy and Laboratory Studies : A Reference Table
for Clinicians. Obstet Gynecol. 114 : 1326-31.
2. AGARWAL A, MAJZOUB A, ESTEVES SC et
al. 2016. Utilité clinique des tests de fragmentation de
l'ADN du sperme: recommandations de pratique basées sur des
scénarios cliniques.Andrologie translationnelle et urologie. 5
: 950-935.
3. AGARWAL S, AGARWAL A, KHANNA A et
al. 2015. Microdeletion of Y chromosome as a cause of
recurrent pregnancy loss. J Hum Reprod Sci .8:159-64
4. AGOSTINI A, DE TROYER J, CAPELLE M et
al.. 2006. Fausses couches précoces et rétentions
ovulaires: prise en charge immédiate.In : CNGOF. mises à jour
en Gynécologie et Obstétrique, Paris: CNGOF.
5. ALIJOTAS-REIG J et GARRIDO-GIMENEZ C.
2013. Current concepts and new trends in the diagnosis and management of
recurrent miscarriage. Obstet Gynecol Surv. 68 : 445-466.
6. ANDRIATSIARONIMANGA M. 2005. Les avortements
du premier trimestre de la grossesse. Thèse de doctorat en
ligne. Médecine Humaine: Antananarivo.79p.
7. ANTON E. 2005. Sperm studies in
heterozygote inversion carriers:a review. Cytogenet Genome Res.
111(3-4) : 297-304.
8. ARVIEUX J et HACHULLA E. 2002. Le
syndrome des antiphospholipides. Ann Cardiol Angeiol. 51 : 146-51.
9. AUGER J, AUER J, ALBERT M et al.
2009. Exploration de la fonction de reproduction versant masculin. Cahier de
formation Biologie Médicale N°42. Bioforma. Pagination
multiple. ISBN : 2-913633-54-4.
10. AZANI A, HOSSEINZADEH A, AZADKHAH R et
al. 2017. Association of endothelial nitric oxide synthase gene
variants (-786 T > C, intron 4 b/a VNTR and 894 G > T) with idiopathic
recurrent pregnancy loss: a case-control study with haplotype and in silico
analysis. European Journal of Obstetrics & Gynecology and
Reproductive Biology. 215 : 93-100.
11. BAEK KH. 2004. Aberrant gene expression
associated with recurrent pregnancy loss. Mol Hum Reprod. 10 :
291-7.
12. BANSAL AS. 2012, Mechanism of
human chorionic gonadotrophin-mediated immunomodulation in pregnancy.
Expert Rev Clin Immunol. 8 : 747-753.
13. BAZOT M, SALEM C, FROMENT V et
al. 2002. Pathologie myometriale. Encyclopédie
Medicale Chirugicale. Elsevier, Paris. 20 : 605-34.
14. BELLOC S. 2014.Evaluation de la
fragmentation de l'ADN spermatique. Le magazine d'information
biomédicale de roche diagnosctics France.1p
81
Références bibliographiques
15. BERNDT S. 2006. Angiogenic
activity of human chorionic gonadotropin through LH receptor activation on
endothelial and epithelial cells of the endometrium. FASEB J. 20 :
2630-2632 .
16. BEUCHER G.2010. Prise en charge des
fausses-couches spontanées du premier trimestre. J
GynecolObstetBiolReprod. 39S, F3-F10.
17. BOUE J, BOUE A, LAZAR P et al.
1975. Retrospective and prospective epidemiological studies epidemiological
studies of 1500 karyotyped spontaneous human abortions. Teratology.
12(1) : 11-26.
18. BOURDIEC, BEDRAD D , RAO CV et
al. 2013. Human chorionic gonadotropin regulates endothelial cell
responsiveness to interleukin 1 and amplifies the cytokine-mediated effect on
cell proliferation, migration and the release of angiogenic factors. Am J
Reprod Immunol. 70. 127-138 .
19. BOURENANE N. 2011. Cours
d'embryologie générale descriptive 1ère
année médecine. Université de Badji Mokhtar
Annaba.127p.
20. BOURY-HEYLER Cl , MAULEON P , ROCHET Y et
al.1981. Utérus et Fécondité.
Masson.
21. BRAYMAN M , THATHIAH A, CARSON DD et al.
2004. MUC1: a multifunctional
cell surface component of
reproductive tissue epithelia. Reprod. Biol. Endocrinol. 2-4.
22. BRICOU A, DEMARIA F, BOQUET B et
al. 2009. Synéchies utérines. Elsevier
Masson. 13p.
23. BRYERE M.2014. Modifications
physiologiques de la femme enceinte.In :Pathologies maternelles et
grossesse.Elsevier Masson.2014.488p.
24. BRY-GUILLARD H ,MASSIN N , YOUNG J et
al. 2014. Infertilité du couple : étiologie et
prise en charge. Elsevier Masson. 15p.
25. BUKULMEZ O et DOODY K J. 2006. Clinical
features of myomas. Obstet Gynecol Clin N Am..33. pp.69-84.
26. CAMPOS O, ANDRADE JL, BOCANEGRA J, et
al.1993. Physiologic multivalvular regurgitation during pregnancy
: A longitudinal Doppler echocardiographic study. Int J Cardiol. 40 :
265-72.
27. CARP H, FELDMAN B, OELSNER G, et
al. 2004. Parental karyotype and subsequent live births in
recurrent miscarriage. Fertil Steril. 81 : 1296-301.
28. CARRELL DT, LIU L, PETERSON CM et
al. 2003. Sperm DNA fragmentation is increased in couples with
unexplained recurrent pregnancy loss. Arch Androl. 49(1) : 49-55.
82
Références bibliographiques
29. CARVALHO B, DORIA S, RAMALHO C et
al. 2010. Aneuploidies detection in miscarriages and fetal deaths
using multiplex ligation-dependent probe amplification: an alternative for
speeding up results? Eur J Obstet Gynecol Reprod Biol
2010.153.151-5.
30. CATALA M. 2002. La differenciation de
l'endoderme: un nouveau role pour les cellules
endothéliales.Medecine/science. 18(2) : 135-37.
31. CATOV JM, PATRICK TE, POWERS RW et
al. 2007. Maternal leptin across pregnancy in women with
small-forgestational-Age infants. Am J Obstet Gynecol.196 :
558.e1-e8.
32. CNGOF : Collège National des
Gynécologues et Obstétriciens Français.
2006. Prévention de l'allo-immunisation
Rhésus-D foeto-maternelle.
Gynécologie Obstétrique
& Fertilité. 4(34) : 360-365.
33. CHIANG T, SCHULTZ RM, LAMPSON MA et al
.2012. Meiotic origins of maternal age-related aneuploidy.
Biology of Reproduction. 86 : 1-7.
34. CORTEY A , MAILLOUX A, HUGUET-JACQUOT S et
al. 2012. Incompatibilités foeto-maternelles
érythtrocytaires. EMC pédiatrie. 7(3) : 18-2.
35. COURBIERE B. 2012. Anatomie et
physiologie de l'appareil reproducteur. Elsevier Masson. Cycles de la vie
et grandes fonctions. Marseille. 244p.
36. COUTTON C, SATRE V, ARNOULT C et
al. 2012. Génétique de l'infertilité
masculine : les nouveaux acteurs. Médecine/Sciences. 28 :
513-8.
37. D'HAUTERIVE P S. 2004. Human chorionic
gonadotropin and growth factors at the embryonic-endometrial interface control
leukemia inhibitory factor (LIF) and interleukin 6 (IL-6) secretion by human
endometrial epithelium. Hum. Reprod. 19 : 2633-2643.
38. D'HAUTERIVE PS. 2006. Les phases
d'implantations embryonnaires.In:JEAN PIERRE DADOUNE. Biologie de la
reproduction. Ellipses Marketing. 157.
39. DARAI E. 2007. Les traitements
médicamenteux de l'endométriose génitale (en dehors de
l'adénomyose). J. Gynécol Obstét Biol Reprod. 36
: 201-234.
40. DE PAEPE C, KRIVEGA M, CAUFFMAN G et
al. 2014. Totipotency and lineage segregation in the human
embryo. Molecular human reproduction. 20(7) : 599-618.
41. DEGROOT L, ABALOVICH M, ALEXANDER EK et
al. 2012. Management of thyroid dysfunction during pregnancy and
postpartum: an Endocrine Society Clinical Practice Guideline. J Clin
Endocrinol Metab. 97 : 2543-65.
42. DEMIRHAN O, PAZARBASI A, SULEYMANOVA-KARAHAN et
al. 2008. Correlation of clinical phenotype with a pericentric
inversion of chromosome 9 and genetic counseling. Saudi medical
journal. 29(7) : 946-51.
43. DEVAUD J. 2008. L'uterus. Le collége
d'etude ostéopathique. Montréal.28p.
83
Références bibliographiques
44. DEWAN S, PUSCHEK EE, COULAM CB et
al. 2006. Microdélétions du chromosome Y et fausses
couches récurrentes. Fertil Steril. 85 : 441-5.
45. DIABY A.2006. Fausses couches
spontanées à répétition à l'hôpital
Mère-Enfant. Thèse de Doctorat. Université de
Bamako.
46. DIACOUMBA M .2008.Avortement
spontané : Prise en charge aux centres de santé de
référence des communes V et VI du strict de
Bamako.Thése de Médecine. Université de
Bamako.
47. DONG Y, LI LL, WANG RX et al.
2014. Reproductive outcomes in recurrent pregnancy loss associated with a
parental carrier of chromosome abnormalities or polymorphisms. Genet Mol
Res .13(2) : 2849-2856.
48. ELIAKIM R et SHERER DM. 2001. Celiac
Disease.fertility and pregnancy. Gynecol Obstet Invest. 51(1): 3-7.
49. ESHRE GUIDELINE. 2017. Recurrent
Pregnancy Loss. ESHRE Early Pregnancy Guideline Development Group
Version 2.0.
50. FEICHTINGER M, WALLER E, HARTMANN B et
al. 2017. Transcervical embryoscopic and cytogenetic findings
reveal distinctive differences in primary and secondary recurrent pregnancy
loss. Fertil Steril. 107(1) : 144-9.
51. FILGES I, MANOKHINA I, PENAHERRERA MS et al
.2015. Recurrenttriploidy due to a failure to complete maternal
meiosis II. whole-exome sequencing reveals candidate variants. Molecular
Human Reproduction . 21.339-346.
52. FORD, HOLLY B, T DANNY J et al.
2009. Recurrent Pregnancy Loss: Etiology, Diagnosis, and Therapy. Reviews
in Obstetrics & Gynecology. 2 : 76?83.
53. FOURNIER A, LAFFITTE A, PARANT O et
al. Modifications de l'organisme Maternel au cours de la
grossesse. Encyclopedie Medico-Chirurgicale : Gynecologie-Obstetrique.
5-008-A-10.
54. FOURNIER T , GUIBOURDENCHE J , EVAIN-BRION D
et al. 2015. hCGs : Different sources of production
, different glycoforms and functions. Placenta. 36 : S60-S65.
55. FRANASIAK JM, FORMAN EJ, HONG KH et
al. 2014. The nature of aneuploidy with increasing age of the
female partner: a review of 15,169 consecutive trophectoderm biopsies evaluated
with comprehensive chromosomal screening. Fertil Steril. 101 :
656-63.
56. FRANSSEN MT. 2005. Selective chromosome
analysis in couples with two or more miscarriages: case-control study.
BMJ. 331(7509) : 137-41.
57. FRIKHA R, BOUAYED NA, REBAI T et
al. 2012. Prévalence des anomalies
cytogénétiques parentales au cours de l'avortement
spontané récurrent : à propos de 168 couples.
Immuno-analyse et biologie spécialisée. 223-232.
84
Références bibliographiques
58. GELLERSEN B , BROSENS IA , et al
.2007.Decidualization of the human endometrium: mechanisms,
functions, and clinical perspectives. Semin Reprod Med. 25 :
445-53.
59. GENBACEV OD.
2003.Trophoblast L-selectin-mediated adhesion at the
maternal-fetal interface. Science. 299 : 405-8.
60. GERARD J, BRYAN D, DERRICKSON B et
al. 2007. Principes d'anatomie et de physiologie. De
Boeck. (pp. 840-846).
61. GILLIES EA et GREEN RB. 2009. Propulsion
hydrodynamique du sperme humain. J Fluid Mech. 625: 444-73.
62. GIL-VILLA AM, CARDONA-MAYA W, AGARWAL A et
al. 2009. Role of male factor in early recurrent embryo loss: do
antioxidants have any effect? Fertil Steril. 92 : 565-71.
63. GODDIJN M et LESCHOT NJ. 2000. Genetic
aspects of miscarriage. Baillieres Best Pract Res Clin Obstet Gynaecol
.14 : 855-65.
64. GOLDSTEIN M, SVIRSKY R, RECHES A et
al. 2017. Does the number of previous miscarriages influence the
incidence of chromosomal aberrations in spontaneous pregnancy loss? J
Matern Fetal Neonatal. 30 : 2956-2960.
65. GOPALJRISHNAN K , PADWAL V et
al. 2000. Mauvaise qualité du sperme car elle affecte les
fausses couches répétées. Arch Androl. 45(1) :
111-17.
66. GOUGEON A. 2008. Anatomie, embryologie
et physiologie de l'ovaire. Endocrinologie-Nutrition.
67. GRIDELET V. 2015. L'implantation
embryonnaire : étude des récepteurs endométriaux à
l'hCG/LH blastocytaire et interet de la mesure du G-CSF folliculaire.
Science biomédicales et pharmaceutique. liége. Belgique.
Université de Liége.
68. GURBUZ B, YALTI S, FICICIOGLU C et
al. 2003. Hormone levels in women with recurrent pregnancy loss.
Gynecol Endocrinol. 17 : 317-21.
69. GURUNATH S, PANDIAN Z, ANDERSON R et
al. 2011. Defining infertility: a systematic review of prevalence
studies. Hum reprod update. 17 : 575-88.
70. HAOUD K. 2014. Etude de la
prévalence des aneuploidies dans les produits d'avortements
spontanés : Interet des techniques moléculaires FISH et MLPA pour
la detction des remaniements chromosomiques. Thése de doctorat en
ligne. Université Djillali Liabès.
71. HARDY K et HARDY PJ. 2015. 1st trimester
miscarriage: four decades of study. Translational Pediatrics. 4 :
189-200.
85
Références bibliographiques
72. HASSOLD T et HUNT P. 2009. Maternal age
and chromosomally abnormal pregnancies: what we know and what we wish we knew.
Current Opinion in Pediatrics. 21 : 703-708.
73. HILL JA. 1995. T-helper 1-type immunity
to trophoblast: evidence for a new immunological mechanism for recurrent
abortion inwomen. Am J Reprod Immunol. 10 : 114-120.
74. HURET J, DESSEN P et BERNHEIM A. 2003.
Atlas of Genetics and Cytogenetics in Oncology and Haematology, year 2003.
Nucleic acids research. 31(1) : 272-274.
75. HYDE, KASSIE J, DANNY et al.
2015. Genetic considerations in recurrent pregnancy loss. Cold spring
Harbor perspectives in Medecines. 5 : 3.
76. JASLOW CR, CARNEY JL, KUTTEH H et
al. 2010. Diagnostic factors identified in 1020 women with two
versus three or more recurrent pregnancy losses. Fertil Steril. 93 :
1234-43.
77. JASLOW C. 2014. Facteurs utérins.
Obstet Gynecol Clin North Am. 41(1) : 57-86.
78. JEVE YB et DAVIES W. 2014. Evidence-based
management of recurrent miscarriages. J Hum Reprod Sci.7 : 159-69.
79. JOVANOVIC L, KNOPP RH, KIM H et
al. 2005. Elevated pregnancy losses at high and low extremes of
maternal glu- cose in early normal and diabetic pregnancy: evidence for a
protective adaptation in diabetes. Diabetes Care. 28 : 1113-7.
80. KADRI A, MAHLIA N, MESSAOUDENE S et
al. 2014. Le cancer de l'utérus : etude descriptive et
rétrospective des cas enregistrés entre l'année 2011 et
2013. Memoire de fin d'études. Université Abou Bakr
Belkaid.
81. KALOUSEK DK, BARETT IJ, et MC GILLIVRAY
BC. 1989. Placental mosaicism and intrauterine survival of trisomies
13 and 18. Am. J. Hum. Genet. 44 : 338-343.
82. KALOUSEK DK, PANTZAR T, TSAI M et
al. 1994. Early spontaneous abortion: morphologic and karyotypic
findings in 3912 cases. Birth Defects Orig Artic Ser. 29 : 53-61.
83. KAMINAP. 1984. Anatomie
gynécologique et obstétricale. Maloine - Paris.
4ème edition. 217-256.
84. KANE N, KELLY R, SAUNDERS PT et
al. 2009. Proliferation of uterine natural killer cells is
induced by human chorionic gonadotropin and mediated via the mannose receptor.
Endocrinology. 150 : 2882-2888.
85. KHETARPAL A et SINGH S. 2012.
Infertility:Why can't we classify this inability as disability? The
Australasian Medical Journal. 5 : 334.
86
Références bibliographiques
86. KHIL LY. 2007. Human chorionic
gonadotropin is an immune modulator and can prevent autoimmune diabetes in NOD
mice. Diabetologia. 50 : 2147-2155.
87. KOIVUNEN R, POUTA A, FRANKS S et
al. 2008. Fecundability and spontaneous abortions in women with
self- reported oligo-amenorrhea and/or hirsutism: Northern Finland Birth Cohort
1966 Study. Hum Reprod. 23 : 2134-9.
88. KOLTE AM, BERNARDI LA, CHRISTIANSEN OB et
al. 2015. Groupe d'Intérêt Spécial ESHRE,
Terminologie de la grossesse précoce pour la perte de grossesse avant la
viabilité: une déclaration de consensus du groupe
d'intérêt spécial ESHRE sur la grossesse précoce.
Hum Reprod. 30(3): 495-498.
89. KOSAKA K. 2002. Human chorionic
gonadotropin (HCG) activates monocytes to produce interleukin-8 via a different
pathway from luteinizing hormone/HCG receptor system. J. Clin. Endocrinol.
Metab. 87 : 5199-5208.
90. LALIOTI MD. 2008. Can implantation
genetic diagnosis overcome recurrent pregnancy failure? Curr Opin Obst
Gynecol. 20 : 199-204.
91. LANSAC P et LE COMTE H. 2002. Interruption
volontaire de grossesse .in : Jacques Lansac .Gynécologie pour le
praticien 6è édition. Paris . 456-472.
92. LARSEN EC, CHRISTIANSEN OB, KOLTE AM et
al. 2013. New insights into mechanisms behind miscarriage.
BMC medicine. 11(1) : 154.
93. LAZARIN GA, HAQUE IS, EVANS EA et
al. 2017. Smith-Lemli-Opitz syndrome carrier frequency and
estimates of in utero mortality rates. Prenatal diagnosis. 37(4) :
350-355.
94. LE VAVASSEUR, FRAISON JB et BOURGARIT-DURAND
A. 2015. Comment j'explore des fausses couches à
répétition ? . mt. 21(3) : 233-7.
95. LEE CL. 2013. Human chorionic
gonadotropin and its free beta-subunit stimulate trophoblast invasion
independent of LH/hCG receptor. Mol Cell Endocrinol. 375 : 43-52.
96. LE MOIGNE A et FOUCRIER J. 2009.
Biologie du développement. 7ième édition.
Collection Sciences-Sup. Dunod, Paris. Pagination multiple. ISBN :
978-2-10-054127-0.
97. LEJEUNE V. 2005. Fausses couches
spontanées précoces répétées: quelle prise
en charge proposer en 2006 ?. Gynécologie obstétrique &
fertilité. 34(10) : 927-937.
98. LEJEUNE V et CARBONNE B. 2007.
Fausses-couches et morts foetales. Paris Masson.
99. LEJEUNE V et CARBONNE B. 2007.
Voluminous fetal chylous ascites: a case of complete spontaneous prenatal
regression. Fetal diagnosis and therapy. 22(2) : 81-84.
100. LEPAGE J et LUTON D. 2015. Fausses
couches spontanés à répétition.
EMC-traité de médecine - Akos. 10(2) : 3-1320.
87
Références bibliographiques
101. LETOMBE B, CATTEAU-JONARD S et ROBIN G.
2012. Endocrinologie en gynécologie et obstétrique. Elsevier
Health Sciences.
102. LEWIS SE et SIMON L. 2010. Implications
cliniques des dommages à l'ADN du sperme. Hum Fertil (Camb). 13
: 201-7.
103. LI L, LIU J, QIN S et al.
2018. The association of polymorphisms in promoter region of MMP2 and
MMP9 with recurrent spontaneous abortion risk in Chinese population.
Medicine (Baltimore). 97.
104. LIM LP, LAU NC, GARRETT-ENGELE P et
al. 2005. L'analyse des puces à ADN montre que certains
microARN régulent à la baisse un grand nombre d'ARNm cibles.
Nature. 433 : 769-73.
105. LOPEZ-SANCHEZ C, GARCIA -MARTINEZ V et
al. 2001. Localization of Cells of the Prospective Neural Plate,
Heart and Somites within the Primitive Streak and Epiblast of Avian Embryos at
Intermediate Primitive-Streak Stages. Cells Tissues Organs. 169(4) :
334-46.
106. LOWERY LA et SIVE H. 2004. Strategies
of vertebrate neurulation and a re-evaluation of teleost neural tube formation.
Mechanisms of development. 121(10) : 1189-1197.
107. MAGNUS MC, WILCOX AJ, MORKEN N et
al. 2019. Role of maternal age and pregnancy history in risk of
miscarriage: prospective register-based study. BMj. 364 : 869-1876.
108. MAHESHWARI A, GURUNATH S, FATIMA F et
al. 2012. Adenomyosis and subfertility: a systematic review of
prevalence, diagnosis, treatment and fertility outcomes. Hum Reprod
Update. 18 : 374-92.
109. MAIGA CK. 2002. Diagnostique
étiologique des métrorragies non gravidiques dans le service de
gyneco-obstétrique de L'Hôpital National du Point G : cas de 284
Dossiers . Thèse de médecine. P2-90.
110. MANDELBROT L et LE GARDEUR H. 2014.
Interprétation des examens biologiques pendant la grossesse. In :
Pathologies maternelles et grossesse. Elsevier Masson..488p.
111. MCCOY RC, DEMKO ZP, RYAN A et
al. 2015. Evidence of selection against complex mitotic-origin
aneuploidy during preimplantation development. PLoS Genetics. 11(10) :
e1005601.
112. MERGER R, LEVY J et MELCHIOR J. 2003.
Avortement provoqué clandestin. Précis d'obstétrique
6ème édition. Masson - Paris. 583 :
222-225.
113. MERVIEL P, CARBILLON L, CHALLIER JC et
al. 2004. Pathophysiology of preeclampsia : links with
implantation disorders. Eur J Obstet Gynecol Reprod Biol. 115 :
134-147.
114. MERVIEL P et LANTA S. 2005.
Avortements spontanés répétition.
Gynécologie-Obstétrique. 2(3) : 278 -296.
88
Références bibliographiques
115. MOLAD Y, BORKOWSKI T, MONSELISE A, et
al. 2005. Maternal and fetal outcome of lupus pregnancy:a
prospective study of 29 pregnancies. Lupus. 14 : 145-51.
116. MOLAZADEH M, KARIMZADEH H , AZIZI MR et al
.2014. Prevalence and clinical significance of antinuclear
antibodies in Iranian women with unexplained recurrent miscarriage. Iranian
Journal of Reproductive Medicine.12. 221-226.
117. MOORE KL, PERSAUD TN et TORCHIA MG.
2018. The Developing Human-E-Book : Clinically Oriented Embryology.
Elsevier Health Sciences.
118. MORIN L et VAN DEN HOF MC. 2006. SOGC
clinical practice guidelines. Ultrasound evaluation of first trimester
pregnancy complications. Number 161, June 2005. International journal of
gynaecology and obstetrics: the official organ of the International Federation
of Gynaecology and Obstetrics. 93(1) : 77-81.
119. MURNANE JP. 2006.
Télomères et instabilité chromosomique.
Réparation d'ADN (Amst). 5 : 1082-92.
120. NAGY ZP, VERHYEN G, TOURNAYE H et
al. 1998. Applications spéciales de l'injection
intracytoplasmique de spermatozoïdes: l'influence du nombre de
spermatozoïdes, de la motilité, de la morphologie, de la source et
des anticorps du sperme sur le résultat de l'ICSI. Hum Reprod.
13 : 143-54
121. NAMAN K. 2008. Prise en charge des
avortements spontanés au centre de santé de
référence de la commune V du district de Bamako à propos
de 156 cas. Thése de doctorat .Université de Bamako.
122. NANASSY L et CARRELL DT. 2008. Effets
paternels sur l'embryogenèse précoce. J Exp Clin Assist
Reprod. 5- 2.
123. NEUSSE M, ROGENHOFER N, DÜRL S et
al. 2015. Increased chromosome 16 disomy rates in human
spermatozoa and recurrent spontaneous abortions. Fertility and
sterility. 104(5) : 1130-1137.
124. NORWITZ ER, HOYTE LP, JENKINS KJ et
al. 2000. Separation of conjoined twins with the twin
reversed-arterial-perfusion sequence after prenatal planning with
three-dimensional modeling. New England Journal of Medicine. 343(6) :
399-402.
125. NUSSBAUM RL. 2001. Principles of
clinical cytogenetics. Thompson and Thompson genetics in medicine.
140.
126. NYBO ANDERSEN AM, WOHLFAHRT J, CHRISTENS P
et al. 2000. Maternal age and fetal loss: population-based
register linkage study. Bmj . 320 : 1708-1712.
127. OCAK Z, ÖZLÜ T et al
. 2013. Association of recurrent pregnancy loss with chromosomal
abnormalities and hereditary thrombophilias. Afr Health Sci. 13(2) :
447-452.
128. OLIVA R. 2006. Protamines et
infertilité masculine. Hum Reprod Update. 12 : 417-435.
89
Références bibliographiques
129. OUYANG DW, ECONOMY KE, NORWITZ ER et
al. 2006. Obstetric complications of fibroids. Obstetrics and
Gynecology Clinics. 33(1) : 153-169.
130. PATARROYO CF, VAIMAN D, GRIS JC et
al. 2017. Novel genes and mutations in patients affected by
recurrent pregnancy loss. PLoS One. 12(10) : e0186149.
131. PEREZA N, OSTOJIC S, KAPOVIC M et
al. Systematic review and meta-analysis of genetic association
studies in idiopathic recurrent spontaneous abortion. Fertil Steril.
107 : 150-9.
132. PERRIN J, METZLER-GUILLEMAIN C, KARSENTY G
et al. 2006. Arrêt méiotique au stade
midpachytène chez un patient avec délétion complète
du facteur b d'azoospermie du chromosome Y. Fertil Steril. 85-494.
133. PIERRE F et BERTRAND J. 2009.
Obstetrique. In : Collection Memento. 2ème edition.
Paris - Maloine.
134. POLICASTRO PF, DANIELS-MCQUEEN S , CARLE G
et al . 1986. A map of the hCG beta-LH beta gene cluster.
J Biol Chem. 261. 5907-5916.
135. PONCELET C et SIFER C. 2011.
Physiologie, pathologie et thérapie de la reproduction chez
l'humain. Springer-Verlag France. 693p. ISBN : 2-8178-0060-5.
136. PONS WD et GOFFINET F. 2003. Traite
d'Obstétrique. In : Medecine-Sciences. Flammarion.
Garcia-Enguidanos.
137. PORRAS-DORANTES A, BRAMBILA-TAPIA AJL,
LAZCANO-CASTELLANOS AB et al. 2017. Association between
G1733A (rs6152) polymorphism in androgen receptor gene and recurrent
spontaneous abortions in Mexican population. J Assist Reprod Genet.
34(10) : 1303-1306.
138. PUSCHEK EE et JEYENDRAN RS.2007. L'impact
du facteur masculin sur les fausses couches récurrentes. Curr Opin
Obstet Gynecol. 19 : 222-28.
139. RAI R et REGAN L. 2006. Recurrent
miscarriage. Lancet. 368(9535) : 601-11.
140. RAMASAMY R, BESADA S, LAMB D et
al. 2014. Hybridation fluorescente in situ du
sperme humain: diagnostics, indications et implications thérapeutiques.
Fertil Steril. 102 : 1534-9.
141. RASMARK K, ROEPKE E, MATTHIESEN L et
al. 2017. Is the incidence of recurrent pregnancy loss increasing
? a retrospective register-based study in Sweden. Acta Obstet Gynecol Scand
. 96 : 1365-1372.
142. REGAN L, BRAUDE PR., TREMBATH PL et
al. 1989. Influence of past reproductive performance on risk of
spontaneous abortion. British Medical Journal. 299(6698) : 541-545.
143. RICKMAN L, FIEGLER H, SHAW-SMITH C et
al. 2006. Prenatal detection of unbalanced chromosomal
rearrangements by array CGH. J Med Genet. 43(4) : 353-61.
90
Références bibliographiques
144. RIVES N, MOUSSET-SIMEON N, SIBERT L et
al. 2004. Anomalies chromosomiques du
spermatoizoide.Gynécologie Obstétrique fertilité et
sénologie. 32(9) : 771-778.
145. ROGENHOFER N, OTT J, PILATZ A et
al. 2017. Les fausses couches récurrentes
inexpliquées sont associées à une teneur aberrante en ARNm
protamine du sperme. Hum Reprod. 32 : 1574-82.
146. ROHILLA M et MUTHYALA T. 2017. Recurrent
Pregnancy Loss (RPL) - Causes and Management. J Gynecol Neonatal Biol.
3 : 5-8.
147. RONGIERES C, SANANES N et BONNE S.
2014. Fausses couches précoces à répétition :
quelles sont les chances de naissance vivante ? Etude retrospective sur 10
ans. Journal de gynécologie obstétrique et Biologie de la
reproduction.7p.
148. RCOG : ROYAL COLLEGE OF OBSTETRICIANS &
GYNAECOLOGISTS. 2011. The investigation and treatment of couples with
recurrent first-trimester and second-trimester miscarriage. Green-top
Guideline. No. 19.
149. SALK JJ, SCHMITT MW et LOEB LA. 2018.
Enhancing the accuracy of next-generation sequencing for detecting rare and
subclonal mutations. Nature Reviews Genetics. 19(5) : 269.
150. SANLAVILLE D et TURLEAU C. 2011. Types,
fréquences et mécanismes de formation des anomalies
chromosomiques. Collége national des enseignants et praticiens de
génétique médicale. 32p.
151. SARAVELOS SH et REGAN L. 2011. The
importance of preconception counseling and early pregnancy monitoring. In
Seminars in reproductive medicine. 29(06) : 557-568. Thieme
Medical Publishers.
152. SARAVELOS SH et REGAN L. 2012. Early
pregnancy failure after assisted reproductive technology. Pregnancy after
Assisted Reproductive Technology. 51-65.
153. SARAVELOS SH et REGAN L. 2014. Unexplained
recurrent pregnancy loss. Obstetrics and Gynecology Clinics. 41(1) :
157-166.
154. SAXENA P, MISRO MM, CHAKI SP et
al. 2008. Les spermatozoïdes anormaux fonctionnent-ils comme
un indicateur chez les couples en perte de grossesse? Fertil
stérile. 90(5) : 1854-58.
155. SCHUMACHER A. 2009. Human chorionic
gonadotropin attracts regulatory T cells into the fetal-maternal interface
during early human pregnancy. J Immunol. 182 : 5488-5497.
156. SENNAOUI K, OUDA FZ, HASHAS Z et
al. 2015. Fausses couches spontanées. biologie
médicale. Université Aboubakar Belkaid - Tlemcen.
91
Références bibliographiques
157. SHAMALY H, MAHAMEED A, SHARONY A et
al. 2004. Infertility and celiac disease: do we need more than
one serological marker? Acta Obstet Gynecol Scand. 83(12) : 1184-8.
158. SHARP A, ROBINSON D, JACOBS P et
al. 2000. Age and tissue specific variation of X chromosome
inactivation ratios in normal women. Hum Genet. 107 : 343-9.
159. SLAMA R, EUSTACHE F, DUCOT B et
al. 2002. Temps de grossesse et paramètres de sperme: une
étude transversale parmi les couples fertiles de quatre villes
européennes. Hum Reprod. 17 : 503-15.
160. SOLVEIG M et PFLUEGER V. 2005.
The Cytogenetics of Spontaneous Abortion. The Principles of
Clinical Cytogenetics. 323-345. Humana Press, Totowa, NJ.
161. SRISUPARP S, STRAKOVA Z, FAZLEABAS AT et
al. 2001. The role of chorionic gonadotropin (CG) in blastocyst
implantation. Arch Med Res. 32 : 627-634.
162. STAZI AV et MANTOVANI A. 2000. A risk
factor for female fertility and pregnancy: celiac disease. Gynecol
Endocrinol. 14(6) : 454-63.
163. STEPHENSON MD, AWARTANI K, ROBINSON WP et
al. 2002. Cytogenetic analysis of miscarriages from
couples with recurrent miscarriage: a case-control study. Hum Reprod.
17(2) : 446-51.
164. STEPHENSON MD. 1996. Frequency of
factors associated with habitual abortion in 197 couples. Fertil Steril.
66 : 24-9.
165. STERN C et CHAMLEY L. 2006.
Antiphospholipid antibodies and coagulation defects in women with implantation
failure after IVF and recurrent miscarriage. Reprod Biomed Online. 13
: 29-37.
166. STRAUSS III et LESSEY. 2009. Les
étapes de la fécondation. In : Jerome.F, Robert.L Barbierie,
Antonio.R. The ovarian life cycle.1008p.
167. SUGIURA-OGASAWARA M, OZAKI Y, SATO T et
al. 2004. Poor prognosis of recurrent aborters with either
maternal or paternal reciprocal translocations. Fertil Steril. 81 :
367e73.
168. THEISEN A et SHAFFER LG. 2010.
Disorders caused by chromosome abnormalities. The Application of Clinical
Genetics. 3 : 159-174.
169. THILAGAVATHI J, KUMAR M, MISHRA SS et
al. 2013. Analyse de la longueur des télomères du
sperme chez les hommes souffrant d'infertilité idiopathique. Arch
Gynecol Obstet. 287 : 803-7.
170. THOUAS GA. 2014. Soluble Ligands and their
Receptors in Human Embryo Development and Implantation. Endocr. Rev.
36(1): 92-130.
171. THOULOUN JM. 2005. Petits maux de la
grossesse. Encyclopedie Medico-Chirurgicale :Gynecologie-Obstetrique.
2(3) : 227-237.
92
Références bibliographiques
172. TURKI RF, ASSIDI M, BANNI HA et
al. 2016. Associations de fausses couches
récurrentes avec anomalies chromosomiques, polymorphismes
alléliques de la thrombophilie et / ou consanguinité en Arabie
Saoudite. BMC Med Genet. 17 (Suppl 1) : 69.
173. TURPIN AL. 1995. Anatomie, embryologie
et histologie de l'ovaire. Encyclopédie Medicale Chirugicale.
Endocrinologie- Nutrition.
174. VAN DEN HEUVEL MJ. 2005. A review of
trafficking and activation of uterine natural killer cells. Am J Reprod
Immunol. 54 : 322-331.
175. VAN DEN HEUVEL MJ. 2005.
Menstrual cycle hormones induce changes in functional interactions between
lymphocytes and decidual vascular endothelial cells. J. Clin. Endocrinol.
Metab. 90 : 2835-2842.
176. VENTOLINI G, ZHANG M, GRUBER J et
al. 2004. Hysteroscopy in the evaluation of patients with
recurrent pregnancy loss: a cohort study in a primary care population. Surg
Endosc. 18 : 1782-4.
177. VINATIER D et DUFOUR P et al.
1997. Avortements spontanés à répétition.
Journal de gynécologie obstétrique et biologie de la
reproduction. 513-5.
178. WAN H. 2007. Chorionic
gonadotropin can enhance innate immunity by stimulating macrophage function.
J Leukoc Biol. 82 : 926-933 .
179. WAN H. 2008. Chorionic gonadotropin
induces dendritic cells to express a tolerogenic phenotype. J Leukoc
Biol. 83 : 894-901.
180. WANG YJ, ZHANG RQ, LIN YJ et
al. 2012. Relation entre la varicocèle et les
dommages à l'ADN du sperme et l'effet de la réparation de la
varicocèle : une méta-analyse. Reprod Biomed Online. 25
: 307-14.
181. WEISS A, SHALEV E, ROMANO S et
al. 2005. Scopy may be justified after two miscarriages. Hum
Reprod. 20 : 2628-31.
182. WILCOX AJ, WEINBERG CR, OCONNOR JF et
aI. 1988. Incidence of early loss of pregnancy. N Engl J Med.
319 : 189-194.
183. XIAOHAN S, XIAOCHUAN X, YINGXIAN J et
al. 2017. Maternal genetic polymorphisms and unexplained
recurrent miscarriage: a systematic review and meta-analysis. Clin
Genet. (2) : 265-84.
184. XU X, DU C, LI H et al. 2015.
Association of VEGF genetic polymorphisms with recurrent spontaneous abortion
risk: a systematic review and meta-analysis. PLoS One. 10(4) :
e0123696.
185. YU N. 2015. HCG-Activated Human
Peripheral Blood Mononuclear Cells (PBMC) Promote Trophoblast Cell Invasion.
Nature. 1-12 .
93
Références bibliographiques
186. ZENNOUHI H. 2017. L'avortement non
médicalisé à propos de 451 cas. Thése de
médecine en ligne. Université Sidi Mohammed Ben Abdellah.
187. ZHU QX, MEADS C, LU ML et al
2011. Point tournant de l'âge pour la qualité du
sperme: une étude basée sur la population chez les hommes
chinois. Fertil stérile. 96 : 572-76.
188. ZIDI-JRAH I, HAJLAOUI A, MOUGOU-ZERELLI S et
al. 2012. Relation entre l'aneuploïdie du sperme,
l'intégrité de l'ADN du sperme, le conditionnement de la
chromatine, les paramètres traditionnels du sperme et les fausses
couches récurrentes. Fertil Steril. 2(105) : 58-64.
Webographie
1. ABADIJAN G. 2006. L'histologie des organes :
appareil génital féminin. Cours en ligne. Beirut.
Université saint joseph.
URL :
http://www.epathologies.com/acad/h
cd/index.html
2. ABBARA A. 2015. Lexique de la
médecine de la reproduction. Cours en ligne. URL :
http://www.aly-abbara.com/livre
gyn obs/termes/reproduction definitions.html
3. DULAY A. 2019. Hydramnios. Cours en
ligne.
URL :
https://www.msdmanuals.com/fr/professional/gyn%C3%A9cologie-et-obst%C3%A9trique/anomalies-de-la-grossesse/hydramnios
4. OMS. 1970. L'avortement spontané ou
provoqué.
URL :
https://apps.who.int/iris/bitstream/handle/10665/38299/WHO
TRS 461 fre.pdf.
5. OMS. 2013. WHO infertility definitions and
terminology.
URL :
http://www.who.int/reproductivehealth/topics/infertility/definitions/en/.
6. UZEL. 2014. Utérus non gravide
cours en ligne. Université catholique de Lille. URL:
https://f.hypotheses.org/wpcontent/blogs.dir/1588/files/2014/01/guide
redaction bi blio.pdf. consulté

Généralités
1- Nom et prénom : 2-
Age : .
3- Adresse :
4- Votre niveau d'études (une seule réponse
possible) :
· Études primaires
· Études
secondaires longues
· Études secondaires courtes
·
Études supérieures
5- Votre profession : .
Paramètres anthropométriques de la
femme
6- Poids minimal : kg 7- Poids maximal :
kg
- à quel âge ; - à quel âge ;
8- Poids avant la grossesse : kg 9- Poids actuellement :
kg
10- Prise de poids depuis le début de la grossesse :
11- Taille : . cm 14- Tour de hanche : Cm
12- IMC : 15- RTH (rapport taille hanches) :
13- Périmètre abdominal : cm
37- Avez-vous déjà consulté
une diététiste ou un spécialiste pour contrôler
votre alimentation durant votre grossesse D Oui D Non
État de sante
16- Avez-vous des problèmes de
santé ? DOui DNon
· Si oui, lesquels ?
17- Dans votre famille, existe-t-il d'autres
personnes obèses ? DOui
DNon
18- Avez-vous eu dans l'enfance des problèmes de surpoids
? DOui
DNon
19- avez-vous une contraception ? DOui DNon
· Laquelle : .
20- À quel âge avez-vous eu vos premières
règles ? ans
21- Quelle est la fréquence de vos
menstruations ?
Exemple : moyenne de 28 jours / varie de 26 à 35 jours
22- Quelle est la durée de vos règles ?
jours
23- Quelle est la date du terme ?
24- La grossesse actuelle est-elle votre
première grossesse ? DOui
DNon
25- Combien de fois avez-vous été enceinte
?
26- Combien de fois avez- vous fais de
fausses couches ?
27- Combien d'enfants avez-vous ?
28- Prenez-vous des médicaments ?DOui
DNon Lesquels :
29- Avez-vous du diabète ? DOui
DNon
· Quel type :
· Depuis combien de temps ?
30- Avez-vous du diabète gestationnel
?
31- Avez-vous du HTA gravidique ?
32- Êtes-vous immunisée contre la
toxoplasmose ?
33- Êtes-vous immunisée contre la rubéole
?
34- Prenez-vous des compléments en vitamines ? DOui
DNon
· Lesquels ? ;
.................................
.................................
35- Prenez-vous des compléments en fer, iode ? D Oui D
Non
36- Prenez-vous des compléments en vitamine B9 ou acide
folique
D Oui D Non
38- Votre mariage est-il consanguin D Oui D Non
39- Avez-vous déjà fait un caryotype ? D Oui D
Non
Si oui :
Habitudes alimentaires
40- Mangez-vous plus depuis que vous êtes enceinte ? DOui
DNon
41- Combien de repas mangez-vous en moyenne chaque jour ?
· De 0 à 1 repas
· 3 repas
· 2 repas
· Plus de 3 repas
42- Prenez-vous généralement des
collations entre les repas ?
· Toujours
· Parfois
· Jamais
· Souvent
· Rarement
43- Suivez-vous un régime spécial
? : DOui DNon
· Pourquoi ? ;
· Qui vous l'a conseillé ?
44- Consommez-vous des aliments en quantités
différentes depuis le début de votre
grossesse ?
45- Combien de portions de fruits et légumes
consommez-vous en moyenne chaque jour ? (Une portion est soit un fruit ou
légume moyen ou encore une demi tasse de jus de fruits ou de
légumes)
·
· 3 à 5 portions
· 6 portions et plus
0 à 1 portion
· 2 à 4 portions
46- Allez-vous au fastfood, au restaurant,...? DOui DNon
47- À quelle fréquence consommez-vous des aliments
de type restauration rapide? (Restauration rapide, mets congelés, repas
minute, etc.)
· Moins d'une fois par semaine
· 4-5 fois par
semaine
· 1 fois par semaine
· 6 fois par semaine et
plus
· 2-3 fois par semaine
48- Fumez-vous ? DOui DNon
49- Pratiquez-vous une activité physique ? DOui DNon
50- De quels types (marche, natation,...) ? :
51- Combien d'heures par semaine ? :
52- Sur une échelle de 0 à 10, à combien
évaluez-vous votre niveau de stress ?
Aspect échographique de
l'utérus
Bilan hormonal
FSH : LH : LH/FSH : Testostérone :
Prolactine :
Syndrome métabolique
Glycémie à jeun : Glycémie post
prandial : Hémoglobine glyquée (HbA1c) :...
LDL : HDL : Triglycérides : Tension
artérielle : ...../....
Dysfonctionnement de la thyroïde D Oui D Non
Recours à une procréation
médicalement assistée
1- Avez-vous eu recours à la procréation
médicalement assistée? EliOui EliNon
Si oui, précisez
quel type (insémination artificielle, FIV, ICSI) ?
Si oui, combien de fois ?
2- La procédure de PMA suivi a abouti à une
grossesse ? EliOui EliNon
Si oui, cette grossesse a été menée
à terme ? EliOui EliNon
Si non, à quel moment s'est produit l'avortement ?
3- Les causes de l'avortement vous ont été
expliquées par votre médecin ? EliOui EliNon Si oui, lesquelles
?
Santé reproductive du conjoint
1- Age :
2- Votre mari a un problème de santé quelconque ?
EliOui EliNon
Si oui, lequel ?
Quel est le traitement suivi ?
3- Votre mari a un problème de fertilité
diagnostiqué par un médecin ? EliOui EliNon
Si oui, lequel
?
Suit-il un traitement pour son problème de
fertilité ? EliOui EliNon
Si oui, lequel ?
4- Votre mari a des personnes souffrant de problème de
fertilité dans sa famille ?
EliOui EliNon
Si oui, quel le lien de parenté avec lui ?
5- Spermogramme EliOui EliNon
Si oui :
6- Spermo-cytogramme EliOui EliNo
Si oui :
7- Spermoculture EliOui EliNon
Si oui :
8- Avez-vous déjà réalisé un
caryotype ? EliOui EliNon
Si oui
Santé reproductive de la fratrie
1- Vos parents ont eu un problème de fertilité
(difficultés à concevoir) ? EliOui EliNon
Si oui, précisez ?
2- Avez-vous des frères qui souffrent d'un
problème de fertilité ? EliOui EliNon
Si vous le savez, lequel ?
3- Avez-vous des soeurs qui souffrent d'un problème de
fertilité ? EliOui EliNon
Si vous le savez, lequel ?
4- Avez-vous des soeurs ayant subi plusieurs fausses couches ?
EliOui EliNon
Si oui, précisez ? .
5- Avez-vous des cousines ayant subi plusieurs fausses couches ?
EliOui EliNon
Si oui, précisez ? .

Keywords: recurrent pregnancy loss, cytogenetic,
chromosomal abnormalities.
Cytogenetic study of recurrent pregnancy loss in the
region
of Constantine
Abstract:
Recurrent pregnancy loss is defined as the loss of at least 3
or more clinical pregnancies before the 22th week of amenorrhea in
women under the age of 40 years old. 80% of these patients have an identifiable
cause justifying an etiological approach. The main etiological classes are :
anatomical factors, genetic factors, thrombophilic and endocrine disorders,
immunological factors and idiopathic pregnancies.
Recurrent pregnancy loss affects 1-5% of couples trying to get
a child, and 10-20% of clinically recognized pregnancies, 5% of women
experiencing pregnancies suffer from 2 consecutive losses, while 1% of them
suffer from 3 consecutive losses or even more. RPL are idiopathic in 50% of
cases where genetic disorders account for 25% of known causes. The most common
disorders observed in embryos karyotypes are trisomy, X chromosome monosomy,
and polyploidy. Most of these disorders result from meiotic errors during germ
cells division. In addition, the existence of maternal or paternal chromosomes
abnormalities (translocations or inversions ) increases the risk of RPL due to
the transmission of an unbalanced genetic material to the embryo.
In our research work, we applied cytogenetic techniques as a
strategy of diagnostic using standard karyotype and R-Banding, performed on
blood samples of couples who has been affected by RPL, in order to detect a
possible genetic defect. Of the four couples for whom cytogenetic analysis was
performed, one partner presented with typical Klinefelter syndrome (47,XXY).
For the others, the karyotypes were euploid: no chromosomal abnormalities in
number or structure were noted.
Abortion disease presents etiological problems that are often
difficult to solve. Parental genomic aberrations are specific eventualities
since they lead to a particular medical management. However, as half of the
cases of RPL are unexplained , an intensive follow up of patients is
recommended in order to have best pregnancy outcome.
|
Éä ä Þ
ÉÞ
Øäãí
|
í
ÑÑßÊãáÇ
íÆÇÞáÊáÇ
ÖÇåÌáÅá
ÉíæáÎ
ÉíËÇÑæ
ÉÓÇÑÏ
|
:ÕÎáãáÇ
|
ÑãÚáÇ äã
ÉÛáÇÈáÇ
|
ÉÑãáÇ
|
äÇÏÞÈ
ÑÑßÊãáÇ
|
íÆÇÞáÊáÇ
|
ÖÇåÌáÅÇ
ÑÚí
|
|
ÏÞæ .ÇåíÏá
ËãØáÇ
|
ÚÇØÞäÇ
|
äã ÇÚæÈÓ22
|
äã áÞñ
|
ÏÚÈ ßáÐæ
ÑËß æ
|
ÊÇÑã ËáÇË
ÇåäíäÌá ÉäÓ 40
äã áÞ
áãÇæÚ
ÊÇÈÇÕãáÇ äã
%80 ÏäÚ ÏÌæ
ÉíáÇÊÊã
áãÇæÚ
ãÍÑáÇ í
ÊÇåæÔÊÈ
ÉÕÇÎ
ÉíÍíÑÔÊ
áãÇæÚ :ÇåäíÈ
äã íÆÇÞáÊáÇ
ÖÇåÌáÅÇ
ËæÏÍ ÑÇÑßÊ
ÊÑÑÈ ÉÏíÏÚ
ÖÚÈáÇ ÏäÚ
ËÏÍíæ
ÉíÚÇäã
áãÇæÚ ãÏáÇ
ÑËÎÊ ØÑ
áãÇæÚ
ÁÇãÕáÇ
ÏÏÛáÇ
ÊÇÈÇÕÅ
ÊÇíÛÈÕáÇÈ
ÉÕÇÎ ÉíËÇÑæ
.ÈÈÓáÇ
áæåÌã
ÖÇåÌáÅÇ
ìÞÈí ä äåäã
äã %20- 1 0 äã ÈíÕí
Çãß ÈÇÌäáÅÇ
í äíÈÛÇÑáÇ
ÌÇæÒáÇäã % 5-
1äã
ÑÑßÊãáÇíÆÇÞáÊáÇÖÇåÌáÅÇÈíÕí
äí ÖÇåÌáÅ
äÖÑÚÊí ÏÞ
áãÇæÍáÇ
ÁÇÓäáÇ äã % 5
ÉÈÓää ÊÇÈËÅ
ãÊ Çãß
ÇíÑíÑÓ
ÇåÏíßÊ ãÊ
íÊáÇ áãÍáÇ
ÊáÇÇÍ .ÑËß æ
ÖÇåÌÅ ÊáÇÇÍ
ËáÇËá
äÖÑÚÊí äåäã %1
ÉÈÓäæ
äííáÇÊÊã ãá
ÉáæåÌã
áãÇæÚæ
ÈÇÈÓá ËÏÍÊ
ÑÑßÊãáÇ
íÆÇÞáÊáÇ
ÖÇåÌáÅÇ
ÊáÇÇÍ äã % 50 åä
ÊÈË ÉÏíÏÚ
ÊÇÓÇÑÏ ÈÓÍ
ÊÍãÓ ÏÞáæ
.ÑßÐáÇ
ÉáÇÓáÇ
áãÇæÚáÇ
ÚíãÌ äíÈ äã % 25
ÉÈÓä ÇåÏÍæá
ÉíËÇÑæáÇ
áãÇæÚáÇ
áËãÊ ÇãäíÈ
ÇåÏíÏÍÊ ãÊí
ÈÇÑØÖáÇÇ
ÇÐå äÚ
ÉáæÄÓãáÇ
ÉíÛÈÕáÇ
ÊÇåæÔÊ áÇ
ÏíÏÍÊÈÉÏæÞãáÇ
ÉäÌáÇ äã
ÏíÏÚáÇ ìáÚ
ÉÒÌäãáÇ
ÉíææäáÇ
ØÇãäáÇ äÚ
ÌÊäÊ
ÊÇåæÔÊáÇ åÐå
ãÙÚã
.ÊÇíÛÈÕáÇ
ÏÏÚÊ æ X
íÛÈÕáÇ íÏÇÍ
ááÎáÇ
íÛÈÕáÇ
ËíáËÊáÇ
ÇåäíÈ äã
íÊáÇæ
ÉíæíäÈ
ÊÇåæÔÊ ÏæÌæ
äÅ ßáÐ ìáÅ
ÉÇÖáÅÇÈ
.ÇåãÇÓÞäÇæ
ÉíãæËÑÌáÇ
ÇíáÇÎáÇ æãä
ÁÇäË ÕäãáÇ
ãÇÓÞäáÇ Ç í
ÁÇØÎ
ÉÈÇÕáÅÇ ÑØÎ
äã ÏíÒí
ÉíÛÈÕáÇ
ÚÞÇæãáÇ
áÏÇÈÊ æ
íÛÈÕáÇ
áÇÞÊäáÇÇ æ
ÈáÇÞäáÇÇß
ãáÇ æ ÈáÇ
ÊÇíÛÈÕÈ
ÉÕÇÎ .äíäÌáá
ÉãíáÓ ÑíÛæ
ÉäÒÇæÊã ÑíÛ
ÉíËÇÑæ ÉÏÇã
áÇÞÊäÇ ÈÈÓÈ
ßáÐæ
ÑÑßÊãáÇ
áãÍáÇ äÇÏÞÈ
äã ãåÄÇÓä
ÊäÇÚ ÌÇæÒ ãÏ
ÊÇäíÚ ìáÚ
ÉíÕíÎÔÊ
Éíææä ØÇãä
ÁÇÑÌÅ
áãÚáÇ ÇÐåá
ÇäÒÇÌäÅ
ááÇÎ ãÊ ÏÞá
äíÈ äã
.ááÇÊÎáÇÇ
ÇÐåÈ
ÉÈÇÕáÅá ÊÏ
ÉíËÇÑæ
áãÇæÚ æ
ÊÇåæÔÊ äÚ
ËÍÈáÇ ÖÑÛá
ßáÐæ
ÑÑßÊãáÇ
ÖÇåÌáÅÇ
ÑÊáíäíáÇß
ÉãÒáÇÊã äã
ÁÇßÑÔáÇ ÏÍ
íäÇÚí ãåá
íæáÎáÇ
íËÇÑæáÇ
áíáÍÊáÇ
ÁÇÑÌÅ ãÊ
äíÐáÇ
ÉÚÈÑáÇ
ÌÇæÒáÇ æ
ÏÏÚáÇ í
ÊÇãæÓæãæÑßáÇ
í ÐæÐÔ í
ÙÍáÇõí ãá
ÉíææäáÇ
ØÇãäáÇ
äíÑÎáÂá
ÉÈÓäáÇÈ .(47,XXY)
ÉíÌÐæãäáÇ
.ÈíßÑÊáÇ
ÏíÏÍÊÈ
äÇíÍáÇ äã
ÑíËß í
ÉÞáÚÊã
ÊÇÈæÚÕæ
ÊÇíÏÍÊ ÕÇÎ
áßÔÈ
ÑÑßÊãáÇ
íÆÇÞáÊáÇ
ÖÇåÌ áÅÇ
åÌÇæí íÊáÇ
áãÇæÚáÇ ãå
ìÏÍÅ ÁÇÈáÂÇ
ìÏá
ÉíËÇÑæáÇ
龒򇂾
ÉíÛÈÕáÇ
ÊÇåæÔÊáÇ
ÑÈÊÚÊ Çãß åá
ÉíÏÄãáÇ
ÈÇÈÓáÇæ
áãÇæÚáÇ ä
íÑæÑÖáÇ äã
ÈÈÓá Ç
ÉáæåÌã
ÖÇåÌáÅÇ
ÊáÇÇÍ Õä ä
ÇãÈæ ßáÐ Úãæ
.ÉÕÇÎ ÉíÈØ
ÉíÇäÚæ ÌáÇÚ
ÈáØÊÊ
ÏíáÇæãáÇ
ÉÈÓä ÚÑæ
ÖÇåÌÅ í íÏÇÊ
áÌ äã ßáÐæ
ÉÕÇÎáÇ
áãÍáÇ
ÊáÇÇÍá
ÉáãÇÔæ ÉËßã
ÉÚÈÇÊã ßÇäå
äæßí
.炒ꇂ
.
ÊÇãæÓæãæÑßáÇ
ÐæÐÔ ÉíæáÎáÇ
ÉËÇÑæáÇ ãáÚ
ÑÑßÊãáÇ
íÆÇÞáÊáÇ
ÖÇåÌáÅÇ
:ÉíÍÇÊãáÇ
ÊÇãáßáÇ
|
Année universitaire : 2019 - 2020
|
Présenté par : KHALLEF Sabrine
|
|
Etude cytogénétique des avortements
spontanés à répétition
dans la région de
Constantine
|
|
Mémoire pour l'obtention du diplôme de
Master
Physiologie Cellulaire et Physio-Pathologie (PCPP)
|
|
Les avortements spontanées à
répétition (ASR) sont définies par au moins trois
épisodes de perte de grossesse, de moins de 22 semaines
d'aménorrhée, chez une patiente de moins de 40 ans. Ces patientes
présentent pour 80% d'entre elles une cause identifiable justifiant une
démarche étiologique. Les principales classes étiologiques
sont les suivantes : anatomiques, chromosomiques, endocrinologiques,
thrombophiliques, immunologiques et idiopathiques. Ces FCSR touchent environ 1
à 5% des couples désirant avoir un enfant et 10 à 20% des
grossesses cliniquement reconnues, 5% des femmes durant leur activité
génitale présentent 2 fausses couches consécutives, alors
que 1%
présentent 3 fausses couches ou plus. Les ASR sont
idiopathiques pour 50% des cas,
alors que l'étiologie
génétique représente 25% des causes connues. Les anomalies
chromosomiques les plus fréquentes dans les caryotypes des produits de
fausses couches sont les trisomies, la monosomie X et la polyploïdie. La
plupart résultent des erreurs méiotiques aléatoires
lors
de la division des cellules germinales. Par rapport aux
parents, l'existence d'anomalies
chromosomiques maternelles ou paternelles
de structure (translocations ou inversions) augmente le risque des ASR et cela
suite à une transmission d'un matériel génétique
déséquilibré.
Dans ce travail de recherche, nous avons appliqué les
techniques de diagnostic cytogénétique (caryotype standards et en
bande R) sur des prélèvements sanguins issus de couples dont les
femmes ont subis des ASR, et ce à la recherche d'une possible
étiologie cytogénétique à ce dysfonctionnement. Sur
les quatre couples pour lesquels l'analyse cytogénétique a
été réalisée, un des conjoints présente un
syndrome Klinefelter typique (47,XXY). Pour les autres, les caryotypes
étaient euploïdes : aucune anomalie chromosomique de nombre ou de
structure n'a été relevée.
La maladie abortive pose des problèmes
étiologiques souvent difficiles à résoudre.
Les
aberrations chromosomiques parentales constituent une éventualité
étiologique assez particulière puisqu'elles débouchent sur
une prise en charge médicale spéciale. Cependant, puisque la
moitié des cas restent inexpliquées, un suivi intensif et
approfondi des grossesses évolutives est recommandé afin
d'augmenter d'une façon significative le taux de naissance vivantes.
|
|
Mots-clefs : avortements spontanées
à répétition, cytogénétique, anomalies
chromosomiques.
|
|
Laboratoire de recherche : Biologie
Moléculaire et Cellulaire (UFM - Constantine 1).
|
|
Président : ROUABAH Leila (Professeur -
Université des Frères Mentouri, Constantine 1).
Encadreur : REZGOUN Mohamed Larbi (MC-A -
Université des Frères Mentouri, Constantine 1).
Examinateur : DALICHAOUCHE Imène (MC-B -
Université des Frères Mentouri, Constantine 1).
|
| 


