|
MEMOIRE DE FIN DE FORMATION POUR L'OBTENTION DU
DIPLÔME DE MASTER EN MICROBIOLOGIE MOLECULAIRE ET MEDICALE
(MASTER-3M)
Cytotoxicité larvaire et activités
antimicrobiennes des extraits de Adansonia digitata L., Tamarindus
indica L.et de Acacia nilotica L. Delilesur des souches
microbiennes multirésistantes au Bénin
THEME
Réalisé par :
AMADOU Afoussatou
Directeur :
Dr (MC) Jean Robert KLOTOE
Physiologiste-Pharmacologue
Maître de Conférences des Universités
(CAMES),
Enseignant-Chercheur aÌ l'Ecole Nationale des Sciences
de Natitingou/UNSTIM
Membres du jury
Président du jury : Pr
BANKOLE S. Honoré, Professeur titulaire des Universités du CAMES,
Rapporteur : Dr Jean Robert
KLOTOE,Maître de Conférences en Physiologie-Pharmacologie, ENS
Natitingou/UNSTIM
Examinateur : Dr DEGBE Cyriaque,
Maître-assistant des Université du CAMES, Bénin
Année Académique :
2021-2022
2ème Promotion
DEDICACE
Mon père AMADOU Abdou Razack et ma mère
ALEDJI Naïmath Augustine,
Je leurdédie ce travail pour leur dur labeur, l'amour et
la protection qu'ils m'accordent. Que Dieu les protège, veille sur eux
et leur accorde une longue vie afin qu'ils jouissent de leurs efforts.
Honorables respects et profondes gratitudes à vous.
REMERCIEMENTS
Ce travail de recherche est le fruit de nombreuses
collaborations pluridisciplinaires. Il se situe à la frontière
entre la microbiologie, la biologie moléculaire et la pharmacologie
ayant une finalité thérapeutique.
· Dieu le Père, le Tout
Puissant, qui m'a donné la force et la patience d'accomplir ce
modeste travail. Lui qui a toujours été mon guide et soutien, qui
me comble chaque jour au-delà de mes espérances et sans qui je ne
suis rien. Que son nom soit glorifié.
Mes chaleureux remerciements et reconnaissances à tous
ceux qui ont apporté leur concours à la réalisation de ce
mémoire en occurrence :
· Au directeur du mémoire Dr KLOTOE Jean
Robert, Maître deConférences (CAMES)en
Physiologie-Pharmacologie,
Pour votre disponibilité, compréhension, et
avoir accepté de diriger ce travail. J'ai beaucoup appris de vous
grâce à votre patience et humilité qui m'ont toujours
impressionnée. Trouvez ici le témoignage de ma profonde gratitude
et de ma reconnaissance.
· Dr DOUGNON Victorien Tamègnon,
Maître-Assistant en Microbiologie,
Pour le choix de la formation et l'accompagnement dans mon
cursus universitaire et de recherche. Trouvez ici le témoignage de ma
profonde gratitude et de ma reconnaissance.
· M. FANOU Brice,
Pour la sympathie, la simplicité et l'amour du travail.
Puissiez trouver ici mes sincères gratitudes pour votre contribution
à ce travail.
· Dr AGBANKPE Jerrold, Dr FAH Lauris, Dr DEGUENON
Esther, Dr KOUDOKPON Hornel, Dr AGBODJENTO Eric, Dr AYENA Césaire, Dr
SOHA Arnaud, Dr LEGBA Boris, M. OHOUKO Fréjus,
Pour la sympathie, simplicité et l'amour du travail.
Puissiez trouver ici mes sincères gratitudes pour votre contribution
à ce travail.
· Aux enseignants et à tous les membres de
l'administration de l'Unité de Recherche en Microbiologie
Appliquée et Pharmacologie des substances naturelles
(URMAPha),
Pour leur aide au bon déroulement de la formation.
· Aux membres de l'Unité de Recherche en
Microbiologie Appliquée et Pharmacologie des substances naturelles en
occurrence ASSOGBA Phénix, FABIYI Kafayath, HOUNSA Edna, ANIAMBOSSOU
Alidah, GBOTHE Elodie, GBAGUIDI Candide, SINTONDJI Kévin, DANSI SOCLO
Flocas, CODJIA Ida, BALARABE Roubaya, AKOTEGNON Rémi, SOVEGNON
Toussaint, HOUNKANRIN Manoir, HOUEDJISSIN Jaurès, VODOUNNON
Kévine, AHOUANDJINOU Sophonia,
Pour l'ambiance harmonieuse qui règne entre nous,pour
votre contribution dans la réalisation de ce travail. Longue vie
à l'équipe.
· Mon Grand-père AMADOU
Djibril,
Un homme unique, sage, rempli de bonté et de
bienveillance. Merci pour tes prières et ton amour. Que Dieu puisse
t'accorder une longue vie.
· Ma grande soeur Mme BOUKARY AMADOU Nassiratou
et son époux M. BOUKARY Bio Habib,
Pour leur hospitalité, leurs soutiens financier et
moral, leurs conseils et encouragements. Puisse Dieu vous le leur rendre au
centuple. Toute ma gratitude.
· Mes frères et soeursFalilath, Saliou,
Issa, Mouhamed, Amidath, Aimane, Abdoul Aziz, Akim, Madjidou sans oublier mes
neveux Abchir, Mafouz, Raghdane et nièces Rifaat, Himayath et
Rafiath.
Pour votre soutien moral, trouvez ici l'expression de la
complicité et de l'affection qui nous ont toujours
liées. Plein succès à vous.
· SARRE KOTO Wadjid, TCHANKPAN Franchesco Fred et
YACOUBOU Aminath,
· Pour leurs amitiés inconditionnelles, leurs
conseils et sincérités. Du fond du coeur, merci.
· AFATON Anny, DJOHOUN Yédia, HOUEFONDE
Merveille, GABA Hosanna, ALODE Rosette, HOUEFONDE Adonias,ADJAHI Alda,
Pour l'aide technique dans l'accomplissement de ces travaux.
Mes sincères remerciements.
· Tous mes condisciplesde formation et tous ceux
qui de près ou de loin ont contribué à la
réalisation de ce travail,
Je leur présente mes sincères remerciements.
HOMMAGES
ü A son Excellence le Président du
Jury,
C'est un grand honneur que vous nous faites en acceptant de
présider notre Jury de soutenance de mémoire de fin de formation.
Vos remarques et contributions seront prises en compte pour améliorer la
qualité de ce travail.
Respectueux
Hommages?!
ü Aux Honorables Membres du Jury,
Nous sommes touchée par l'honneur que vous nous faites
en acceptant de siéger dans notre Jury de soutenance du mémoire
de fin de formation.
Profonde gratitude et sincères
considérations?!
SIGLES ET ABREVIATIONS
|
A. digitata
|
:
|
Adansonia digitata
|
|
A. nilotica
|
:
|
Acacia nilotica
|
|
ADN
|
:
|
Acide Désoxyribonucléique
|
|
AMP
|
:
|
Amphoteìricine B
|
|
BLSE
|
:
|
Bêtalactamases à Spectre Elargi
|
|
C. albicans
|
:
|
Candida albicans
|
|
C. krusei
|
:
|
Candida krusei
|
|
C. glabrata
|
:
|
Candida glabrata
|
|
C. parapsilosis
|
:
|
Candida parapsilosis
|
|
CMI
|
:
|
Concentration Minimale Inhibitrice
|
|
CMB
|
:
|
Concentration Minimale Bactéricide
|
|
CMF
|
:
|
Concentration Minimale Fongicide
|
|
CL
|
:
|
Concentration Létale
|
|
CLT
|
:
|
Clotrimazole
|
|
DI
|
:
|
Diamètre d'inhibition
|
|
DL
|
:
|
Dose Létale
|
|
EA
|
:
|
Extrait Aqueux
|
|
E. coli
|
:
|
Escherichia coli
|
|
E. cloacae
|
:
|
Enterobacter cloacae
|
|
EE
|
:
|
Extrait Ethanolique
|
|
EPAC
|
:
|
Ecole Polytechnique d'Abomey-Calavi
|
|
HPLC
|
:
|
Chromatographie en Phase Liquide
|
|
FAST
|
:
|
Faculté des Sciences et Techniques
|
|
FLU
|
:
|
Fluconazole
|
|
ITR
|
:
|
Itraconazole
|
|
IMP
|
:
|
Imipénème
|
|
KET
|
:
|
Keìtoconazole
|
|
K. pneumoniae
|
:
|
Klebsiella pneumoniae
|
|
K. oxytoca
|
:
|
Klebsiella oxytoca
|
|
LARBA
|
:
|
Laboratoire de Recherche en Biologie appliquée
|
|
MH
|
:
|
Müller-Hinton
|
|
Mg
|
:
|
Milligramme
|
|
Ml
|
:
|
Millilitre
|
|
mm
|
:
|
Millimètre
|
|
nm
|
:
|
Nanomètre
|
|
NYS
|
:
|
Nystatine
|
|
ug
|
:
|
microgramme
|
|
OMS
|
:
|
Organisation Mondiale de la Santé
|
|
P. a
|
:
|
Pouvoir antibiotique
|
|
R
|
:
|
Résistante
|
|
S
|
:
|
Sensible
|
|
S. aureus
|
:
|
Staphylococcus aureus
|
|
SARM
|
:
|
Staphylococcus aureus Résistantes à la
Méticilline
|
|
SCN
|
:
|
Staphylocoque à Coagulase Négative
|
|
SFM
|
:
|
Société Française de la Microbiologie
|
|
STZ
|
:
|
Streptozotocine
|
|
T. indica
|
:
|
Tamarindus indica
|
|
UAC
|
:
|
Université d'Abomey-Calavi
|
|
U.R.M.A.Pha
|
:
|
Unité de Recherche en Microbiologie appliquée et
Pharmacologie des substances naturelles
|
|
UFC
|
:
|
Unité Format Colonie
|
|
V/V
|
:
|
Volume par volume
|
LISTE DES TABLEAUX
Tableau I : Taxonomie de Adansonia
digitata L. (Azad, 2018)
3
Tableau II : Utilisations
ethnomédicales de Adansonia digitata L.
12
Tableau III : Classificaition taxonomique
de Tamarindus indica L.
17
Tableau IV : Utilisation
traditionnelle
19
Tableau V : Classification taxonomique de
Acacia nilotica (L.) Willd. ancien Delile
24
Tableau VI : Correspondance entre CL50 et
toxicité
33
Tableau VII : Profil de résistance
des souches bactériennes multirésistantes utilisées
34
Tableau VIII : Profil des gènes de
résistance des souches bactériennes multirésistantes
utilisées
34
Tableau IX : Interprétation des
mesures de diamètre d'inhibition
35
Tableau X : Profil des souches fongiques
utilisées
36
Tableau XI : Facteurs de virulence des souches
fongiques
36
Tableau XII : Aspects de souches de
Candida sur milieu ChromAgar Candida (Conda, Espagne) et sur
milieu TRM.
37
Tableau XIII : Norme utilisée pour
la lecture des résultats des tests d'antibiogramme des extraits
végétaux.
40
Tableau XIV : CL50 des
extraits de plante
48
Tableau XV : Activité
antibactérienne des extraits aqueux et éthanolique des
différentes parties de Adansonia digitata sur les souches
bactériennes multirésistantes
50
Tableau XVI : Activité
antifongique des extraits aqueux et éthanolique des différentes
parties de Adansonia digitata sur les souches de Candida
51
Tableau XVII : Activité
antibactérienne des extraits aqueux et éthanolique des
différentes parties de Tamarindus indica sur les souches
bactériennes multirésistantes
52
Tableau XVIII : Activité
antifongique des extraits aqueux et éthanolique des différentes
parties de Tamarindus indicasur les souches de Candida
53
Tableau XIX : Activité
antibactérienne des extraits aqueux et éthanolique des
différentes parties de Acacia nilotica sur les souches
bactériennes multirésistantes
54
Tableau XX : Activité antifongique
des extraits aqueux et éthanolique des différentes parties de
Acacia nilotica sur les souches deCandida
55
Tableau XXI : CMI, CMB et du pouvoir
antibiotique des extraits de plante
66
Tableau XXII : CMI, CMF et du pouvoir
antifongique des extraits de plante
67
LISTE DES FIGURES
Figure 1 : Baobab
ou Adansonia digitata L.
3
Figure 2. Représentation des
activités pharmacologiques de Adansonia digitata
15
Figure 3 : Tamarindus indica
(fruits & écorces).
18
Figure 4 : Propriétés
pharmacologiques de Tamarindus indica
21
Figure 5 : Acacia nilotica (L.)
Willd. ancien Delile
24
Figure 6 : Propriétés
pharmacologiques de Acacia nilotica (L.) Willd. ancien Delile
26
Figure 7 : Illustration de la
méthode d'évaluation du pouvoir antimicrobienne des extraits de
plante étudiés (Cas d'un extrait aqueux)
40
Figure 8 : Rendement à
l'extraction des plantes étudiées
44
Figure 9 : Sensibilité des larves
de Artemia salina aux extraits de Acacia nilotica
45
Figure 10 : Sensibilité des larves
de Artemia salina aux extraits Adansonia digitata
46
Figure 11 : Sensibilité des larves
de Artemia salina aux Tamarindus indica
47
Figure 12 : Pourcentage d'activité
antibactérienne des différents extraits des différentes
plantes étudiées sur les bactéries présentant le
gène mecA
56
Figure 13a : Pourcentage
d'activité antibactérienne des différents extraits des
différentes plantes étudiées sur les bactéries
présentant le gène BlaSHV
56
Figure 14 : Pourcentage d'activité
antifongique des différents extraits des différentes plantes
étudiées sur les champignons présentant la
résistance au fluconazole
60
Figure 15a : Pourcentage
d'activité antifongique des différents extraits des
différentes plantes étudiées sur les champignons
présentant la virulence au facteur lécithinase
61
Figure 16 a : Pourcentage de
déstabilisation des extraits de plante sur la membrane des souches
S. aureus résistantes à la méthiciline en
fonction des concentrations
68
RÉSUMÉ
La résistance aux antimicrobiensdemeure une
préoccupation majeure de santé publique. Les plantes
médicinales constituent l'une des alternatives pour la découverte
de nouvelles molécules antimicrobiennes efficaces et sûres. Au
Bénin, Adansonia digitata L., Tamarindus indica L.
et Acacia nilotica (L) Delile sont trois plantes utilisées
traditionnellement pour le traitement des infections. Cette étude a
visée à contribuer à la lutte contre la résistance
aux antimicrobiens au Bénin.
L'étude a porté sur les extraits aqueux et
éthanolique des feuilles, écorces et fruits des plantes
sélectionnées. La cytotoxicité larvaire a
été évaluée par la sensibilité des larves de
Artemia salina aux extraits préparés. Les tests
antibactériens et antifongiques ont été
réalisés par la méthode de diffusion sur gélose des
extraits sur les souches bactériennes résistantes de
Staphylocoque à Coagulase Négative (SCN), Staphylococcus.
aureus, Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca,
Enterobacter cloacae et les souches fongiques de Candidaalbicans,
Candidakrusei, Candidaparapsilosis,Candidaglabrata. Ensuite, les
Concentrations Minimales Inhibitrices (CMI), Bactéricides (CMB) et
Fongicides (CMF) ont été déterminées par la
méthode de micro-dilution pour les deux extraits les plus actifssur les
souches testées. Le mécanisme d'action de l'effet antimicrobien
des extraits actifs a été recherché par la méthode
d'action sur la membrane cytoplasmique.
Les résultats obtenus ont indiqué une absence de
cytotoxicité larvaire des différents extraits testés
à l'exception des extraits de fruits et de feuilles de A.
digitata qui ont présenté une toxicité
modérée. Concernant l'activité antibactérienne, les
souches de Staphylocoque à Coagulase Négative (SCN) et S.
aureus résistantes à la méticilline ont
été inhibées par la plupart des extraits testés.
Sur les souches entéropathogènes, les extraits aqueux des fruits
des plantes testées ont inhibé la croissance de la
totalité des souches testées. En plus de cet extrait, l'extrait
éthanolique d'écorce de T. indica a inhibé la
croissance de toutes ces souches à l'exception de K.
pneumoniae. De même, respectivement les extraits éthanoliques
du fruit de A. nilotica et de A. digitata ont
été actifs sur les souches entéropathogènes.
Concernant l'activité anti-candidosique, seuls les extraits aqueux des
fruits et feuilles de A. nilotica, de même, l'extrait
éthanolique de l'écorce de A. digitata ont
présenté une activité antifongique sur la majorité
des souches fongiques testées. Les données obtenues sur le
mécanisme d'action ont mis en évidence le potentiel de
déstabilisation de la membrane des souches bactériennes des
extraits testés avec un meilleur effet par rapport à
l'Imipénème utilisé comme molécule de
référence.
Ces données mettent en lumière le potentiel
antimicrobien des plantes étudiées et justifient leur usage en
médecine traditionnelle.
Mots clés : Antimicrobien?;
Candida?; Entérobactérie?; plante médicinale,
Bénin
ABSTRACT
Antimicrobial resistance remains a major public health
concern. Medicinal plants are one of the alternatives for the discovery of new
effective and safe antimicrobial molecules. In Benin, Adansonia digitata
L., Tamarindus indica L. and Acacia nilotica (L) Delile are three plants
traditionally used for the treatment of infections. This study aimed to
contribute to the fight against antimicrobial resistance in Benin.
The study focused on the aqueous and ethanolic extracts of
the leaves, barks and fruits of the selected plants. Larval cytotoxicity was
assessed by sensitivity of Artemia salina larvae to the prepared
extracts. Antibacterial and antifungal tests were performed by agar diffusion
method of the extracts on resistant bacterial strains of Coagulase Negative
Staphylococcus (CNS), Staphylococcus. aureus, Escherichia coli, Klebsiella
pneumoniae, Klebsiella oxytoca, Enterobacter cloacae and fungal strains of
Candida albicans, Candida krusei, Candida parapsilosis, Candida
glabrata. Then, the Minimum Inhibitory Concentrations (MIC), Bactericides
(BMC) and Fungicides (FMC) were determined by the micro-dilution method for the
two most active extracts on the tested strains. The mechanism of action of the
antimicrobial effect of the active extracts was investigated by the cytoplasmic
membrane action method.
The results obtained indicated no larval cytotoxicity of the
different extracts tested except for the fruit and leaf extracts of A.
digitata which showed a moderate toxicity. Concerning the antibacterial
activity, the strains of Coagulase Negative Staphylococcus (SCN) and S.
aureus resistant to methicillin were inhibited by most of the tested
extracts. On enteropathogenic strains, aqueous extracts from the fruits of the
plants tested inhibited the growth of all the strains tested. Besides this
extract, the ethanolic extract of T. indica bark inhibited the growth
of all these strains except K. pneumoniae. Similarly, ethanolic
extracts of the fruit of A. nilotica and A. digitata were
active on enteropathogenic strains respectively. Concerning the anti-candidus
activity, only the aqueous extracts of the fruits and leaves of A.
nilotica, and the ethanolic extract of the bark of A. digitata
showed antifungal activity on the majority of the fungal strains tested. The
data obtained on the mechanism of action highlighted the membrane
destabilization potential of the bacterial strains of the tested extracts with
a better effect compared to Imipenem used as reference molecule.
These data highlight the antimicrobial potential of the
studied plants and justify their use in traditional medicine.
Key words: Antimicrobial; Candida;
Enterobacteria; medicinal plant, Benin.
SOMMAIRE
|
INTRODUCTION...................................................................................
|
01
|
|
PARTIE 1 : SYNTHESE
BIBLIOGRAPHIQUE :..............
................... .........
|
04
|
1. ÉTAT DES LIEUX SUR LA RÉSISTANCE
ANTIMICROBIENNE
1.1
Généralités sur la résistance aux antimicrobiens
1.2
Épidémiologie de la résistance aux antimicrobiens
1.3 Mécanismes de la résistance aux
antimicrobiens
2. MONOGRAPHIE DES PLANTES
ÉTUDIÉES
2.1 Adansonia digitata L.
2.2. Tamarindus indica L.
2.3. Acacia nilotica(L.) Willd. ancien
Delile
|
|
|
PARTIE 2 : MATÉRIEL ET
MÉTHODES........................................................
|
29
|
|
1. CADRE
2. MATÉRIEL
3. MÉTHODES
|
|
|
PARTIE 3 : RÉSULTATS ET
DISCUSSION.......................................................
|
39
|
|
1. RÉSULTATS
2. DISCUSSION
|
|
|
CONCLUSION.....................................................................................
|
57
|
|
REFERENCES
BIBLIOGRAPHIQUES......................................................
|
62
|
INTRODUCTION
L'émergence de la résistance aux antimicrobiens
(RAM) constitue un réel problème de santé publique dans le
monde (Maurizio et al., 2017). Elle est observée dans les
domaines sanitaire et environnemental-(Essack et al., 2016). Selon
l'OMS, en Afrique, la charge de morbidité liée à la
résistance aux antimicrobiens est marquée essentiellement par
l'augmentation de la mortalité, du taux d'admission aux soins intensifs
et la durée de séjour en établissement de soins (Ogbolu
et al., 2011 -; Essack et al., 2016). Très
observée au sein des bactéries, leur impact n'est pas
négligeable sur les autres microorganismes dont particulièrement
les champignons. Au rang des bactéries en Afrique subsaharienne, selon
une étude de l'Organisation Mondiale de la Santé, une forte
résistance a été observée au niveau des familles
d'antibiotiques telles que : les céphalosporines, les
fluoroquinolones et les carbapénèmes sur les souches de
Escherichia coli etKlebsiella pneumoniae.De même, la
majoritédes souches de Staphylococcus aureusa également
développé une résistante à la méticilline
(OMS, 2014). Cette remarque s'est faite aussi au niveau des espèces
fongiques. En effet, entre 2000 et 2014, la prévalence a
été doublée avec une tendancecroissante au cours de ces
dernières années(Alanio et al., 2014). Les azolés
représentent les antifongiques ayant présenté les plus
forts taux de résistance. D'après Alanio, entre 2000 et 2014, il
a été rapporté que 31 % des isolats de C.
glabrata étaient résistants au fluconazole, habituellement
très actif sur les souches fongiques(Alanio et al., 2014).
Pour faire face à la RAM, la recherche de nouvelles
moléculesantimicrobiennes s'avère nécessaire. Des efforts
sont orientés vers les plantes médicinales au pouvoir
antimicrobien. Dans ce sens, la recherche de molécules bioactives
extraites des plantes médicinales constitueunealternative
prometteuse.Parmi ces dernières, Acacia nilotica,
Tamarindus indica et Adansonia
digitata '''''''''''''' (Diattaet al.,2019;
Datsugwai et Yusuf, 2017; Kumar et al., 2015; Escalona Arranz et
al.,2010) sont trois espècesdont les parties feuilles,
écorces et fruits ont été indiquées dans le
traitementdes infections.Les multiples vertus des parties de ces plantes
attestées par des études scientifiques montrent leurs potentiels
thérapeutiques- -'''(Abdelrhman et Adam, 2020; Ajiboye et
al., 2020; Akoma et al., 2018; Escalona-Arranz et al.,
2016; Eyong et al., 2015; Ambe et al., 2015). Ce potentiel
serait expliqué par l'effet des composés chimiques
présents dans les parties de plante et quantitativement variables selon
le type de solvant utilisé pour l'extraction(Abdalla et al.,
2020 ; Datsugwai et Yusuf, 2017).Les études
phytochimiques effectuées sur Adansonia digitata ont mis en
évidence la richesse de cette plante en leucoanthocyanines, glycosides,
stéroïdes, stérols, polyterpènes, alcaloïdes et
saponines (Datsugwai et Yusuf, 2017; Braca et al., 2018).
La plupart de ces composés chimiques ont été
identifiés dans Tamarindus indica-(Adeniyi et al.,
2017; Mehdi et al., 2019). Par ailleurs, 'Lebri et al. (2015)
ont mentionné que la présence des alcaloïdes à une
dose élevée serait à l'origine de la toxicité de la
plante.
Les études scientifiques effectuées sur les
plantes (Acacia nilotica, Tamarindus indica et Adansonia
digitata) ont prouvé leurs effets antimicrobiens sur des travaux
sur des souches de références et des souches cliniques
-(Assam et al.,
2020?; Essack et al., 2016?; Escalona-Arranz et al., 2010).
Du fait des vertus thérapeutiques attribuées à ces plantes
dans la lutte antimicrobienne et de l'existence d'une probable toxicité
à une certaine dose après consommation, il est nécessaire
de se poser les questions suivantes : est-il possible que
l'activité biologique d'une plante médicinale variesuivant ses
différentes parties?? L'effet antibactérien des plantes
médicinales peut-il varier suivant les profils de résistance des
souches étudiées?? Les limitesd'investigation scientifique sur
l'évaluation des effets antimicrobiens permettraient-elles d'aller vers
l'élucidation du mécanisme d'action de l'effet
antibactérien de ces plantes??
Dans l'optique de répondre à ces questions, la
présente étude vise en objectif général à
contribuer à la lutte contre la résistance aux antimicrobiens au
Bénin.Spécifiquement, il s'est agi de :
- explorer les activités antibactérienne et
antifongique des extraits de différentes parties des plantes
sélectionnées sur des souches présentant différents
profils de résistance et de virulence?;
- déterminer le degré de cytotoxicité des
extraits des différentes parties de ces plantes sur les larves de
Artemia salina Leach?;
- rechercher le mécanisme d'action de l'effet
antimicrobien des extraits les plus actifs sur les souches testées.
I. SYNTHESE
BIBLIOGRAPHIQUE
II. SYNTHESE
BIBLIOGRAPHIQUE
1.1. État des lieux sur la résistance aux
antimicrobiens
1.1.1. Généralités
sur la résistance aux antimicrobiens
La résistance aux antimicrobiens est un
phénomène qui survient soit naturellement soit de manière
acquise(Maurizio et al., 2017). Elle conduit à des
modifications du génome de la bactérie. Les bactéries en
jeu se retrouvent aussi bien dans les liquides biologiques que dans les
échantillons de l'environnement '(OMS, 2020). Elles se trouvent chez
l'être humain, l'animal, dans les aliments et dans
l'écosystème terrestre. Le transfert entre les
écosystèmes peut-être direct ou indirect. Elles peuvent se
propager d'une personne à l'autre, de l'homme à l'animal, ainsi
qu'à partir des aliments d'origine animale
''''''' ''' ' ' ' ' '''(Baka
et al., 2015).
L'émergence et la diffusion de la résistance aux
antibiotiques représentent une menace pour la santé publique
(Diene et al., 2013). Elle est devenue de plus en plus alarmante dans
les pays en développement où les maladies infectieuses, la
pauvreté et la malnutrition sont persistantes. Bien que l'apparition de
la résistance à un antibiotique soit un phénomène
biologique naturel, un bon nombre de facteurs liés au
sous-développement contribuent non seulement à amplifier le
processus, mais aussi à la diffusion de cette résistance (Ogbolu
et al., 2011). Les facteurs sont tels que : les conditions
socio-économiques défavorables, le manque de ressources humaines
qualifiées, le manque d'infrastructure pour le diagnostic
étiologique et l'évaluation de la résistance aux
antibiotiques, l'absence de réseaux nationaux et régionaux de
surveillance de la résistance, l'usage inapproprié et la
filière non sécurisée des antibiotiques et
l'antibiothérapie dans la filière animale (Ouedraogo et al.,
2017). La résistance aux antibiotiques dans la région de
l'Afrique de l'Ouest à l'image de ceux décrits à travers
le monde concerne principalement les bactéries produisant des
Bêtalactamases à Spectre Elargi (BLSE) avec émergence des
entérobactéries résistantes aux carbapénèmes
ainsi que Staphylococcus aureus à la méticilline (Sbiti
et al., 2017).
Du côté de la résistance aux
antifongiques, Candida développe plusieurs mécanismes
moléculaires pour résister à l'actiondes
médicaments antifongiques(Cuenca-Estrella, 2014). Cette
résistance est souvent occasionnée par le prolongement du
traitement aux antifongiques(Sendi et Zimmerli, 2012). La surexpression ou la
mutation des enzymes cibles ainsi que l'activation transcriptionnelle des
gènes codant pour les pompes d'efflux de médicaments des
superfamilles sont quelques-uns des facteurs impliqués dans le
développement de la résistance aux médicaments-(Dannaoui
et al., 2010). Par exemple, l'utilisation prolongée
d'azolé comme le fluconazole est à l'origine de l'une des
majeures résistances détectées (Cuenca-Estrella, 2014).
1.1.2. Épidémiologie de la
résistance aux antimicrobiens
La charge de morbidité liée à la
résistance aux antimicrobiens est marquée essentiellement par
l'augmentation de la mortalité, du taux d'admission aux soins intensifs
et la durée de séjour en établissement de soins(Ogbolu
et al., 2011). Pour Staphylococcus aureus, la
résistance aux médicaments de première intention est
également très répandue. On estime que les personnes
infectées par Staphylococcus aureus résistant à
la méthicilline (SARM) ont une probabilité de 64 % plus
élevée de mourir que celles qui ont une forme non
résistante de cette infection(Isendahl et al., 2012?; Diene
et al., 2013).
En 2014, selon le rapport sur la surveillance de la
résistance aux antimicrobiens publié, les niveaux
élevés de résistance aux céphalosporines de
3ème génération ont été
rapportés pour E. coli (70 %)et K. pneumoniae
(77 %) dans la région africaine (OMS, 2014). Le dernier
recours reste les carbapénèmes quoique des données
rapportent un taux de 54 % de résistance de K. pneumoniae
vis-à-vis de cette classe d'antibiotique. La diminution de la
sensibilité de K. pneumoniae à la pénicilline a
été rapportée dans toutes les régions membres de
l'OMS.
1.1.3. Situation de la résistance
aux antimicrobiens en Afrique
1.1.3.1. Résistance antibactérienne
De nos jours, il est remarqué que plusieurs
bactéries montrent un profil de multirésistance vis-à-vis
des antibiotiques usuels(Serragui et al.,2013). Ces résistances
variables sontémergentes et constituent une préoccupation majeure
pour le système de santé. Trois types de résistance ont
couramment été observés à savoir la
résistance au BLSE, au Carbapénème et Staphylococcus
aureus résistant à la méticilline. La
résistance au BLSE est en constante évolution et variable de 10
et 100 % chez les sujets sains dans les pays d'Afrique de l'Ouest
(Isendahl et al., 2012). La prévalence est variable selon les
régions de l'Afrique et l'échantillon soit 10 % de E.
coli BLSE en coproculture chez les enfants au Sénégal (Sbiti
et al., 2017), 32,6 % chez des enfants de moins de 5 ans en
Guinée-Bissau (Isendahl et al.,2012), 63 % chez le
personnel hospitalier et 100 % chez les enfants au Mali (Tandé
et al., 2009).
Cette résistance est due à l'émergence de
l'enzyme CTX-M variable selon les pays de l'Afrique (Hara et al.,
2015), type 14 au Mali (Duval et al., 2009), type 3 au Nigeria
(Ogbolu et al., 2011) et au Sénégal(Breurec et
al., 2013). Les autres enzymes décrites sont SHV-3 et SHV-12
(Brolund,2014), apparues ces dernières années et
détectées dans divers isolats. Cette résistance au BLSE
entraine des résistances à plusieurs familles d'antibiotiques,
notamment au cotrimoxazole, aux fluoroquinolones et aux aminosides
(Tandé et al., 2010). Cette multirésistance des
entérobactéries BLSE a entrainé la prescription des
carbapénèmes en clinique. Au Nigeria, il est rapporté des
prévalences variables selon le niveau des soins (Ogbolu et al.,
2011). Cette résistance a également été
notifiée en Sierra Leone (Leski et al., 2013)et au
Sénégal (Diene et al., 2013). Quant aux
Staphylococcus aureus résistantes à la
méticilline, leur émergence et diffusion sont dues aux
complications observées ces dernières années dans le
traitement des souches S. aureus dans les infections communautaires et
hospitalières-(Masim et al., 2021). Les clones
spécifiques circulant dans le cas de cette résistance en Afrique,
sont principalement le ST5 et le ST15 (Schaumburg et al., 2014). La
prévalence de cette résistance varie de 20 à 47 %en
communauté et dans les hôpitaux (Breurec et al., 2011,
Ahoyo et al., 2006). Ces prévalences témoignent de
l'ampleur de la résistance bactérienne dans la région de
l'Afrique.
1.1.3.2. Résistance antifongique
La prévalence de la résistance aux fongicides
est en augmentation au cours de ces dernières années. Elle
constitue, á l'instar de la résistance aux antibiotiques, un
problème mondial croissant, qui entraine des défis et des
coûts importants pour le système de santé (Ben Ayed
et al., 2019). Ceci aggrave la situation déjà difficile
sur le plan thérapeutique des infections fongiques. Ainsi, persistant
aux cours des infections sous-jacentes due à l'état toxique des
souches, la pharmacorésistance de l'infection à
Candida est répandue avec une résistance associée au
fluconazole, à l'amphotéricine B, au voriconazole et à la
caspofungine (Wang et al., 2019?; Hmida et al., 2018?; Allen,
2010). Cette résistance est à l'origine des échecs
thérapeutiques, de l'allongement du séjours dans les
établissement de soins et aux frais supplémentaires des soins de
santé (Ouedraogo et al., 2017). Outre les facteurs de
résistance, les levures du genre Candida seraient aÌ l'origine
d'un certain nombre de phénomène dont la production de quelques
facteurs de virulence qui leur permettraient d'infecter l'hôte et de
prouver leur pathogénicité(Gonçalves et al.,
2016).
1.1.4. Mécanismes de la
résistance aux antimicrobiens
1.1.4.1. Résistance antibactérienne
L'antibiorésistance constitue un défi à
relever à l'échelle mondiale. Il s'agit d'un menace de
santé publique touchant particulièrement les domaines de la
santé individuelle et collective, de l'environnement avec de grands
impacts sur l'économie des pays (Cuenca-Estrella, 2014). Ces
résistances peuvent être naturelles ou acquises. La
résistance naturelle survenue via une mutation génétique
affecte le chromosome de la bactérie, permettant à cette
dernière de contourner l'effet délétère de
l'antibiotique (Wang et al., 2019?; Hmida et al., 2018?;
Breurec et al., 2011). Elle concerne en général qu'un
antibiotique ou une famille d'antibiotiques (Ben Ayed et al.,
2019). Elles peuvent aussi être liées à l'acquisition
de matériel génétique (plasmide) porteur d'un ou plusieurs
gènes de résistance, en provenance d'une autre bactérie.
Les résistances plasmidiques peuvent quant à elles, concerner
plusieurs antibiotiques, voire plusieurs familles d'antibiotiques. C'est la
résistance la plus répandue des résistances acquises
(80 %) (Hmida et al., 2018).
1.1.4.2. Résistance antifongique
Le
mécanisme de résistance aux antifongiques est variable selon la
classe de l'antifongique. Dans le cas de la résistance aux
polyènes, les mécanismes mis en place par Candida sont variables
et agissent par déplétion en ergostérol, par augmentation
de la proportion des glucanes de la paroi fongique, par augmentation de
l'activité catalasique et par formation de biofilm(Allen, 2010). Au sein
des Azolés, plusieurs types de mécanismes sont mis en jeu
à savoir : la modification de la cible, la surexpression de la
cible, l'altération des transporteurs, l'augmentation des voies
impliquées dans la réponse au stress, la modification des enzymes
responsables de la formation des métabolismes toxiques, la modification
de gènes activateurs transcriptionnels des gènes de
résistances, la formation de biofilm et le réarrangement
chromosomique(Gonçalves et al., 2016). Au rang des
echinocandines, la modification de la cible et l'augmentation des voies
impliquées dans la réponse au stress sont les mécanismes
utilisés par les souches de Candida. Le mécanisme de modification
des enzymes responsables de la formation des métabolites toxiques est
celui utilisé par la classe des analogues pyrimidiques (Cuenca-Estrella,
2014).
En mycologie médicale et vétérinaire, on
distingue deux types de résistance : (i) la résistance
intrinsèque, naturellement présente chez toutes les souches d'une
mêmeespèce ou d'un même genre et (ii) la résistance
acquise, induite par un processus de sélection génétique
sous l'effet de l'application répétée d'un antifongique.
La résistance intrinsèque peut être due àÌ
une absence de concentration de l'antifongique dans la cellule ou aÌ une
faible affinité de l'antifongique pour sa cible(Gonçalves et
al., 2016?; Guinea, 2014). Ce processus est bien connu
pour la levure Candida krusei, naturellement résistante au
fluconazole. L'emploi fréquent de cet antifongique en médecine
humaine, en prophylaxie ou en traitement curatif lors des candidoses a eu pour
conséquence, le remplacement progressif de l'espèce
endogène sensible, Candida albicans, par d'autres
espèces du genre Candida (dont C. krusei, C. glabrata ou C.
parapsilosis) (Guinea, 2014). La résistance acquise est un
processus dynamique qui peut potentiellement être observé chez
n'importe quelle espèce fongique et vis-à-vis de n'importe quelle
molécule antifongique(Gonçalves et al., 2016). Les
mécanismes moléculaires qui rendent compte de ce mode de
résistance incluent : (i) la modification de la cible de
l'antifongique (liée à une ou plusieurs mutations du gène
codant pour la cible)?; (ii) la surexpression de la cible de l'antifongique
(par exemple liée à une modification du promoteur du gène)
et (iii) la surexpression de pompes membranaires d'efflux (qui réduisent
rapidement la concentration d'antifongiques dans la cellule fongique)
(Cuenca-Estrella, 2014).
1.2. Monographie des plantes étudiées
La phytothérapie repose en partie sur une pratique
traditionnelle, fondée sur l'utilisation ancestrale et locale des
plantes. Les plantes ont toujours été une source importante de
nutrition et d'utilisation thérapeutique contre un grand nombre
d'affections humaines. Des études phytochimiques récentes sur les
plantes médicinales ont confirmé leur efficacité (Singh
et al.,2017) qui repose sur la qualité de la préparation
(ou extrait) de plante utilisée (Gingembre,2015).Les plantes
médicinales renferment en effet de nombreux composés actifs qui
ont des activités thérapeutiques complémentaires ou
synergiques. Ces principes actifs ont été étudiés
et reproduits chimiquement pour être incorporés de nos jours dans
de nombreux médicaments dont la consommation pose de nombreux
problèmes comme les échecs thérapeutiques liés le
plus souvent au développement des mécanismes de
résistances.
Délaissée à tort pendant plusieurs
décennies, aujourd'hui la population semble plus sensible et plus
favorable à l'utilisation de la médecine naturelle
'''''''''''(Hoellinger, 2017). Parmi ces alternatives d'utilisation, figurent
Adansonia digitata L., Tamarindus indica L. et Acacia nilotica L. qui
ont été explorées dans la présente étude.
1.2.1. Adansonia
digitata L.
1.2.1.1. Description botanique
Le baobab et ses espèces apparentées,
appartiennent à la famille des Malvaceae et au genre Adansonia --(Azad,
2018) comme présenté dans le tableau I. Sous plusieurs
appellations selon la culture et la région, certaines espèces
sont utilisées localement pour leurs feuilles, leurs bois, leurs fruits,
leurs graines ou leur gomme-(Abdelrhman et Adam, 2020). Le baobab africain
(A. digitata) est présent à l'état naturel dans
la plupart des pays du Sahara sous forme d'arbre épars dans la savane,
et est également présent dans les habitations humaines(Kumar
et al., 2016a). A. digitata, très ramifié est
un arbre massif à feuilles caduques. L'espèce adulte peut
atteindre 20-30 m de haut avec un diamètre de 2-10 m. Le tronc
est souvent de grande circonférence-(Kebenzikato et al., 2015).
L'écorce est lisse, brun rougeâtre à gris, douce et
possède des fibres longitudinales. A. digitata produit un
système de racines latérales étendu jusqu'à
50 m du tronc '''''(Kouyaté et al., 2011). L'origine du
baobab fait encore l'objet de débats. Le baobab a été
introduit dans de nombreuses régions tropicales et subtropicales :
les pays d'Afrique centrale, de nombreux pays asiatiques, le Moyen-Orient et
les Antilles. La figure 1 ci-dessous (a, b, c, d, e, f) présente
les différentes parties de l'espèce A. digitata.
Tableau I : Taxonomie de Adansonia
digitata L. --(Azad, 2018)
https://www.prota4u.org/database/protav8.asp?g=psk&p=Tamarindus+indica+L
1d
1c
1b
1a
   
1e
1f
1e
 
Figure 1 : Baobab ou Adansonia
digitata L. (Seed for Africa, 2018)
Légende : 1a : arbre?;
1 b et c : fruit?; 1d : graine?; 1e : feuille?;
1f :écorce
1.2.1.2. Utilisations
ethnomédicales
Le baobab africain (Adansonia digitata L.,
Malvaceae) est un arbre emblématique -(Bussmann et al.,
2021) possédant plusieurs usages traditionnels à travers
différents villages africains ''-(Shehu et al., 2019?;
Abdoulaye et al., 2018?; Nwodo et al., 2015). Il est
principalement utilisé pour l'alimentation. Les fruits, les fleurs, les
feuilles, les pousses, les racines des plantules et même les racines de
l'arbre sont comestibles. Tous les produits obtenus à partir du baobab
contribuent aux revenus et aident à réduire la pauvreté,
à améliorer les moyens de subsistance -(Bussmann et al.,
2021). Outre les utilisations industrielles, les baobabs africains,
énormes et creux, sont utilisés à d'autres fins, comme la
fourniture d'abris, le stockage de l'eau, ainsi que comme prisons ou sites
funéraires. Certains servent de lieux de rencontre religieux,
d'écuries, de salles de stockage, de tours de guetet de restaurants
(Pettigrew et al., 2012).Dans la littérature, plusieurs
études ont révélé des utilisations multiples des
différentes parties de Adansonia digitata variant selon les
régions de l'Afrique présenté dans le tableau II.
Tableau II : Utilisations
ethnomédicales de Adansonia digitata L.
|
Partie
|
Utilisation traditionnelle
|
Région
|
Références
|
|
pulpes du fruit
|
Composant d'assaisonnement et d'apéritif
Fumée âcre utilisée pour éloigner
les insectes gênants pour le bétail
Traitement de la diarrhée infantile, tuberculose,
cicatrisant des plaies
|
Afrique de l'ouest
|
-(Bussmann et al., 2021)
(Orwa et al., 2009)
-(Sharma et Jain, 2015)
|
|
feuilles
|
Utilisées comme des épinards,
Ingrédient fonctionnel (épaississant) des soupes
et des sauces
Utilisées comme antiasthmatique, diurétiques,
diaphorétique, anti-diaphorétiques, tonique, contre la
fièvre, diarrhée et dysenterie, lumbago, ophtalmie
|
Afrique centrale
Afrique centrale et de l'ouest
|
(Olayemi et al., 2017)
'''''(Kouyaté et al., 2011)
(Sidibé et Williams, 2002)
|
|
fruits
|
Consommées comme une friandise, pour fabriquer des
boissons rafraîchissantes et des glaces, ou utilisée pour
adultérer et faire cailler le lait
|
Afrique de l'ouest?; sud?; centrale
|
-(Abdelrhmanet Adam, 2020)
|
|
graines
|
une huile comestible au goût agréable, et
l'extraction de l'huile donne une farine d'huile
|
Afrique centrale
|
-(Kebenzikato et al., 2015)
|
|
écorces
|
utilisée comme fibre ou comme bois de chauffage
Galactagogue, contre poison du strophantus, contre la carie dentaire, la
gingivite, le paludisme, la rougeole, la gastrite, l'oléagineuse
|
Afrique centrale
|
-(Shehu et al., 2018)
|
|
racines
|
consommées en période de famine
servent de fortifiantes, d'antipaludéen, de stimulant
de l'activité sexuelle
|
Afrique de sud
|
(Orwa et al., 2009)
-(Bussmann et al., 2021)
|
1.2.1.3. Phytochimie de Adansonia
digitata L.
En général et malgré la variation des
données rapportées, la revue de la littérature a
révélé une grande variation dans les valeurs
rapportées des contenus nutritifs de la partie du baobab. Des
études ont montré que la pulpe du baobab est riche en vitamine C.
Les feuilles ont présenté une richesse en protéines de
bonne qualité, la plupart des acides aminés essentiels sont
présents dans les feuilles en minéraux. Quant à la graine,
elle est riche en graisses (Chadare et al.,2009). Une
variété de produits chimiques a été isolé et
caractérisés à partir de A. digitata. Ils
appartiennent aux classes des terpénoïdes, des flavonoïdes,
aux tanins des stéroïdes, des vitamines, des acides aminés,
des glucides et des lipides ( -Ajiboye et al.,
2020?; Eltahir et Elsayed, 2019?; Datsugwai et Yusuf, 2017). Plusieurs
études antérieures ont montré la présence des
térébentoïdes, phénoliques et alcaloïdes dans
l'extrait de A. digitata (Chadare et al., 2009).
En outre, la pulpe dans les fruits contient des
stérols, des saponines et des triterpènes qui sont
utilisés en médecine en raison de leurs effets
analgésiques et de réduction de la température
(antipyrétiques) -(Eltahir et Elsayed, 2019). La pulpe de baobab est un
produit végétal alimentaire très riche en micronutriments
(vitamine C, qui est un antioxydant, fer, cuivre (oligoéléments),
calcium, potassium, sodium et magnésium) et en polyphénols.
Ajiboye et al. (2020) ont révélé la
présence de phosphore, magnésium, calcium et le potassium dans
les principaux éléments minéraux présents dans les
graines. Quant à l'écorce de A. digitata, -Abdelmageed
(2019)a révélé la présence de tanins, de pigments
et de glycosides de terpène.
1.2.1.4. Toxicité
La toxicité aiguë de l'extrait aqueux de la pulpe
des fruits a été évaluée sur des rats. Les
résultats de l'étude ont montré une toxicité de
l'extrait par voie orale à 5000 mg/kg -(Muhammad et al.,
2016). D'autres chercheurs ont trouvé une DL50 de
8000 mg/kg par voie IP chez les rats. L'étude de
cytotoxicité de l'extrait aqueux et éthanolique a
révélé des effets significatifs signalant que les
composés solubles sont toxiques pour les cellules dermiques
-(Abdelmageed, 2019).Les études sur la toxicité des autres
parties de la plante restent à explorer. Les données existantes
permettent de tirer une conclusion partielle sur les fruits qui
s'avèrent moins toxiques par rapport à certains produits de
référence -''(Abdelmageed, 2019?; Abdoulaye et al.,
2018).
1.2.1.5. Propriétés
pharmacologiques
Adansonia digitata a montré à travers
plusieurs études qu'il possède des propriétés
pharmacologiques multiples. Les extraits et les composés actifs
isolés de différentes parties de la plante ont
présenté des activités antibactériennes,
antioxydantes, anti-inflammatoires, anticancéreuses, antivirales,
antifongiques, antidiarrhéiques, antidépresseurs,
anthelminthiques et antiprotozoaires ---(Atuadu et al.,
2021?; Ajiboye et al., 2020?; Yunusa et al., 2020?; Dhanasree
et al., 2020?; Gimba et al., 2019?; Shehu et al.,
2018?; Muhammad et al., 2016) (Figure 2).

Figure 2. Représentation des
activités pharmacologiques de Adansonia digitata
1.3.1.5.1. Activité
antioxydante
Les composés polyphénoliques, les vitamines E et
C, et les caroténoïdes sont considérés comme des
nutriments efficaces dans la prévention des maladies liées au
stress oxydatiftelles que l'inflammation, les maladies cardiovasculaires, le
cancer et les troubles liés au vieillissement (Dhanasree et
al., 2020?; Duhaimi et al., 2020?; Datsugwai et Yusuf, 2017). La
capacité antioxydante élevée des produits
dérivés de Adansonia digitata montre leur potentiel
thérapeutique, nutraceutique et cosmétique. L'extrait
méthanolique des feuilles a démontré une activité
antioxydante in vitro(Kabbashi et al., 2014).
L'activité antioxydante de la pulpe des fruits a été
démontrée par Nwodo et al. (2015). Braca et al.
(2018) ont aussi démontré l'activité antioxydante de
l'extrait butanolique de la pulpe des fruits. Selon Dhanasreeet al.
(2020),l'activité anti-radicale DPPH des extraits des
écorces a été démontrée. En outre, compte
tenu de la très haute capacité antioxydante de certaines parties
de la plante, il a été proposé l'utilisation de la fibre
rouge comme un nouvel ingrédient a valeur ajoutée pour la
préparation d'aliments et/ou l'application nutraceutique dans la
promotion de la santé (Vertuani et al.,2002).
Une étude a comparé la capacité
antioxydante globale (IAC), correspondant à la somme de la
capacité des antioxydants hydrosolubles et lipidiques correspondants,
des produits végétaux du baobab avec ceux de l'orange. La valeur
IAC des fibres rouges de baobab est restée très supérieure
à celle des pulpes des fruits frais d'orange montrant que les fibres
rouges ont une propriété antioxydantes très riche que
l'orange (Besco et al., 2007).
1.2.1.5.2.
Activités antibactériennes et antifongiques
Les différences dans les activités
antibactériennes ont été notées entre les divers
extraits et pourraient être liées aux différences dans leur
composition phytochimique -(Suliman et Nour, 2020?; Eltahir et Elsayed, 2019).
Lagnika et al. (2012) a montré que tous les extraits de
Adansonia digitata ont inhibé la croissance de S. aureus
résistant à la méthicilline (SARM) et S.
epidermidis à 10 mg/ml. A. digitata a
montréune certaine activité antibactérienne contre
Staphylococcus aureus, Streptococcus faecalis, Bacillus subtilis et
Escherichia coli. Le résultat des activités
antibactériennes de l'écorce de la tige des extraits bruts
d'éther de pétrole, d'éthanol et d'eau de Adansonia
digitata contre les isolats de test à diverses concentrations a
révélé que tous les extraits étaient sensibles aux
différentes souches testées. A l'exception de Escherichia
coli qui était résistante aux trois extraits à toutes
les concentrations testées (Ajiboye et al.,
2020).
L'activité antimicrobienne intéressante des
extraits de Adansonia digitata pourrait être due à la
présence de tanins et de flavonoïdes, car ceux-ci ont
déjà été signalés comme possédant des
activités antimicrobiennes (Datsugwai et Yusuf, 2017). Les
tanins sont des agents antimicrobiens connus qui pourraient inhiber la
croissance des microorganismes en précipitant la protéine
microbienne et en les privant ainsi des protéinesnutritionnelles
nécessaires à leur croissance et à leur
développement (Jame, 2019). Les flavonoïdes ont également
été signalés posséder de nombreuses
propriétés utiles, y compris les antimicrobiens (Kumar et
al., 2015). Ces activités sont associées à la
présence de flavonoïdes, tanins et alcaloïdes. Il convient
toutefois de mentionner que la détection des classes phytochimiques
bioactives dans une plante n'est pas une garantie pour tout bien biologique,
car cela dépendra des types de composés, ainsi que de leurs
concentrations et de leur interaction possible avec d'autres constituants.
La majorité des études réalisées
ont montré l'efficacité des extraits de Adansonia digitata
sur les souches cliniques et de références -(Eltahir et
Elsayed, 2019?; Kumar et al., 2016). Des études ayant
abordé l'effet sur les souches multirésistantes restent rares. Ce
qui devrait pousser à orienter les futures recherches vers ce domaine
non exploité.
1.2.2. Tamarindus indica L.
1.2.2.1. Description botanique
Tamarindus indicaL. (famille des Leguminosae),
communément appelé tamarin, est une espèce d'arbre
fruitier à feuilles persistantes indigène d'Afrique
cultivée dans de nombreux pays du monde. Tamarindus est un genre
monospécifique-(Menezes et al., 2016). Il est une espèce
légumineuse polyvalente, tropicale et à feuilles persistantes de
la sous-famille des Caesalpiniaceae, originaire d'Afrique et d'Asie du Sud
--(Azad, 2018). La classification taxonomique est présentée dans
le tableau III ci-dessous.
Tableau III :
Classificaition taxonomique de Tamarindus indica L.
|
Taxonomy
|
|
Règne
|
Plantae
|
|
Division
|
Magneliophyto
|
|
Classe
|
Magnoliopsida
|
|
Ordre
|
Fabales
|
|
Famille
|
Fabaceae
|
|
Genre
|
Tamarindus
|
|
Espèces
|
Tamarindus indica L.
|
Il pousse bien jusqu'à 1500 m au-dessus du niveau
de la mer où les précipitations annuelles sont supérieures
à 1500 mm. Il peut pousser dans des conditions de sol
variées. Les différentes parties présentées dans la
figure 3 ci-dessous ont une utilité variable selon la population.
T. indica est très populaire pour ses fruits délicieux
et appétissants (Chimsah et al., 2020). La pulpe molle,
succulente, juteuse et mûre est généralement
utilisée en confiserie et à la maison comme ingrédient de
chutnies, pickles, curry, conserves, boissons et sorbets. Les fruits du tamarin
ont plusieurs valeurs nutritives, électrolytes, phytonutriments,
vitamines et minéraux --(Azad, 2018).
3 b
3a
 
3c
3d
 
Figure 3 : Tamarindus indica (fruits
&écorces).
https://www.feedipedia.org/node/249
Légende : 3a :
écorce?; 3 b : feuille?; 3c et d : fruit
1.2.2.2. Propriétés
ethnopharmacologiques
Tamarindus indica, également connu sous le nom
de tamarin, est un arbre fruitier tropical qui pousse naturellement dans de
nombreuses régions tropicales et subtropicales. Les différentes
parties ont une utilité variable selon la population. En
référence au tableau IV. En raison de son goût aigre,
la pulpe du fruit est largement utilisée pour ajouter de la saveur en
cuisine, mais également dans la production des jus de fruits. De
nombreuses allégations ont été faites sur l'utilisation
médicinale des pulpes de tamarin, y compris comme agents laxatifs,
expectorants, antipyrétiques et antimicrobiens (Amsaveni et Sudha,
2009?; John et al., 2004?; Metwali, 2003).
Les feuilles tendres de T. indica sont
traditionnellement utilisées avec les lentilles dans le sud de l'Inde,
remplaçant le fruit du tamarin. Les feuilles sont également
utilisées pour traiter les infections de la gorge, la toux, la
fièvre, les infections intestinales par les vers, les problèmes
urinaires et les affections hépatiques.
Les feuilles et la pulpe agissent comme un cholagogue, un
laxatif et un anticongestant et présentent une activité
antioxydante dans le foie en plus de leurs propriétés
réductrices du sucre dans le sang -(Ahmad et al., 2018).
Cet arbre a longtemps été populaire pour son
bois de bonne qualité et pour la fabrication d'objet décoratif,
en particulier dans les pays asiatiques et africains. Cet arbre est
remarquablement exempt de toute attaque d'insectes et de maladies probablement
dues à certaines propriétés chimiques de ces
différentes parties (Parvez et al., 2004a).
Tableau IV : Utilisation
traditionnelle
|
Partie
|
Utilisation traditionnelle
|
Localisation
|
Références
|
|
Fruits
|
Bortive, douleurs abdominales, fièvre, urolithiasis,
post-partum, douleurs
|
Afrique du Sud et de l'Ouest
|
Grollier, 1998
|
|
Feuilles
|
Constipation, infections de la gorge, toux, la fièvre,
les infections intestinales par les vers, les problèmes urinaires et les
affections hépatiques
|
Afrique centrale?; Africa de l'Est
|
----------------Parvez et al., 2004
|
|
Pulpes
|
Cholagogue, un laxatif et un anticongestant
|
Afrique du Sud
|
Menezes et al., 2016
|
|
Racines
|
Ulcères, bouillonnement
|
Inde et Afrique
|
Kayode et al., 2018
|
D'après une étude menée au Bénin,
le tamarin offre une source de vitamines et est souvent ajouté comme
composant aigre à la nourriture. La bouillie de fruits et/ou le jus de
fruits sont consommés quotidiennement par chaque groupe ethnique (Van
Der Stege et al., 2011).
1.2.2.3. Phytochimie de Tamarindus
indica
La composition chimique en acides aminés, en acides
gras et en minéraux des parties de la plante de tamarin a
été rapportée. Les différences dans les valeurs
trouvées dans la littérature sont probablement dues à des
différences dans les souches génétiques, les stades de
maturité auxquels les parties de la plante ont été
récoltées, les conditions de croissance (Glewet al.,
2005), les techniques de récolte et de manipulation ainsi qu'aux
différences dans les méthodes d'analyse.
Les graines de tamarin contiennent des composés
polyphénoliques comme l'épicatéchine, les polymères
de procyanidine. En outre, les travaux de Maiti et al. (2005) ont
montré que l'extrait aqueux de graines de tamarin s'est
avéré avoir de puissantes activités antidiabétiques
et antihyperlipidémiques chez le rat mâle diabétique induit
par la streptozotocine (STZ). L'analyse de l'extrait de méthanol de la
pulpe de fruit de tamarin par HPLC a révélé la
présence prédominante de proanthocyanidines, de catéchine
et d'épicatéchine (Sudjaroen et al., 2005). Les
études réalisées par Sole et al. (2013)
rapportent que l'HPLC analytique en phase inversée de l'extrait de
graines de tamarin a révélé la présence de
flavonoïdes, de catéchine et d'épicatéchine. Les
résultats de -Adeniyi et al. (2017) sur la présence de
tanin est contradictoire à ceux trouvés par d'autres chercheurs.
Ceci suggère une étude approfondie sur la présence de ce
composé chimique dans la plante.
1.2.2.4. Toxicité
Concernant la toxicité des extraits de T.
indica, très peu d'études ont été
réalisées. Escalona-Arranz et al. ont observé en
clinique chez les rats traités avecT. indica, l'absence de
signes cliniques pouvant être associés à des effets
toxiques systémiques. Il a démontré que l'aspect des
muqueuses ou des yeux est resté normal, de même que le
comportement des animaux et leur activité somatomotrice. Les animaux en
expérimentation ont maintenu voir augmenter de poids et les
alimentations quotidiennes étaient normales. La totalité des
animaux a survécu à l'expérimentation faite. Aucune
différence n'a été observée sur le plan
histopathologique entre les animaux ayant reçu le traitement et le
groupe témoin. Les extraits ont donc été qualifiés
comme non toxiques dans l'échelle des substances de classe toxique
(OECD/OCDE 4) (Traoré, 2020?; Escalona-Arranzet al.,
2016).
1.2.2.5. Propriétés
pharmacologiques
Tamarindus indica a une utilisation innombrable dans
la médecine traditionnelle à base de plantes. La valeur
pharmacologique du tamarin responsable de son efficacité
thérapeutique est déjà mentionnée dans la
littérature traditionnelle -(Ahmad et al., 2018?; Meher et
al., 2014?; Kodlady et al., 2012).
Diverses activités pharmacologiques in vitro et in
vivo ont été rapportées pour les extraits et les
constituants bioactifs isolés de Tamarindus indica. Les
extraits et les composés actifs isolés de différentes
parties de Tamarindus indica ont présenté une
activité antibactérienne, antioxydante, anti-inflammatoire,
anticancéreuse, antidiabétique, antivirale,
antiépileptique, antifongique, antidiarrhéique, antiasthmatique
et antiradikalinen --''''''''''''''(Chimsah et al., 2020?;
Havyarimana, 2020?; Traoré, 2020?; Mehdi et al., 2019?;
Abdallah et Muhammad, 2018?; Mbaye et al., 2016?; Escalona-Arranz
et al., 2010?; Meher et al., 2014) (Figure 4).
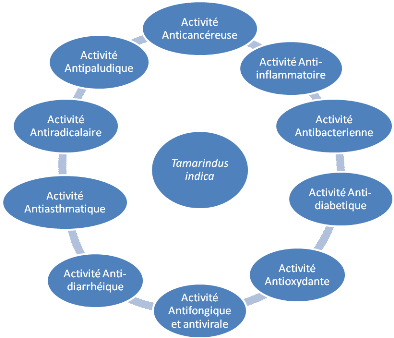
Figure 4 :Propriétés
pharmacologiques de Tamarindus indica
1.2.2.5.1. Activité antioxydante
L'activité antioxydante de l'extrait et des fractions
des feuilles de T. indica L par la méthode du DPPH ont
montré que ceux-ci inhibent significativement le DPPH à toutes
les concentrations testées. Ceci peut s'expliquer par l'extraction des
polyphénols par les solvants polaires '(Mbaye et al., 2017).
Les fruits, les feuilles et les graines sont des sources
naturelles d'antioxydants et plusieurs études ont parié sur cette
alternative pour remplacer les antioxydants synthétiques '(Mbaye et
al., 2017?; Escalona-Arranz et al., 2016). L'étude des
effets d'un extrait méthanolique de l'enveloppe de la graine de T.
indica sur des rats Wistar a montré une diminution de
l'activité des enzymes telles que la superoxyde dismutase, de la
catalase et de la peroxydase. D'après cette étude, l'extrait
protège et restaure l'architecture hépatique. Les auteurs
suggèrent que ce produit pourrait être étudié en
tant que complément de santé et applicable en alimentation pour
la conservation des produits (Menezes et al., 2017).
1.2.2.5.2. Activités antibactérienne et
antifongique
Tamarindus indica est connu pour son activité
antimicrobienne à large spectre contre les différentes souches de
bactéries nuisibles, en raison de la présence de constituants
chimiques importants sur le plan thérapeutique. Des études ont
montré l'activité antimicrobienne potentielle de
différentes parties de T. indica contre diverses souches de
bactéries -'''''''''''''' (Diatta et al., 2019?;
Abdallah et Muhammad, 2018?; Escalona-Arranz et al., 2010). L'extrait
de méthanol et d'acétone de T. indica a montré
une activité antimicrobienne puissante contre Klebsiella
pneumoniae. Quant aux extraits aqueux, éthanolique et
acétonique, il a été révélé une
activité antimicrobienne puissante contre Salmonella Typhi et
Staphylococcus aureus -(Abdallah et Muhammad, 2018). Les feuilles
fraîches et séchées au soleil, ainsi que l'extrait
éthanolique et l'huile essentielle pure des feuilles de tamarinier ont
été testés sur Salmonella typhimurium, Pseudomonas
aeruginosa et Candida albicans. Le résultat a
démontré que parmi toutes les préparations, l'huile
essentielle a montré un bon spectre d'activité antimicrobienne
(Escalona-Arranzet al., 2010). L'activité antimicrobienne de
cet extrait végétal a été réalisée
contre des bactéries à Gram positif et à Gram
négatif par la méthode de diffusion en puits. La grande zone
d'inhibition a été observée sur les Gram positifs. Dans
les cas d'infection urinaire, des bactéries pathogènes
isolées chez des femmes ont montré une activité
antibactérienne maximale contre différentes souches de
bactéries. D'autres études réalisées sur les
extraits de feuilles et de fruits de T. indica testés contre
les isolats cliniques de Escherichia coli et de Shigella spp dans les
selles ont montré que l'extrait éthanolique a une activité
maximale par rapport à l'extrait aqueux (Escalona-Arranz et
al., 2010).
Une étude in vitro avec des extraits de
Tamarindus indica sur les souches multirésistantes a
montré un effet bactériostatique de l'extrait sur ces souches
(Kothari, 2014). Le potentiel antimicrobien des extraits de graines de la
plante contre le staphylocoque doré multirésistant à la
méthicilline (MDR-MRSA) a montré une efficacité avec les
extraits éthanolique, méthanolique et acétonique (Yang et
Zezhi, 2009). Ces extraits ont été capables d'obtenir une
destruction presque totale des biofilms de S. mutans à des
concentrations allant de 600 à 2000 ìg/ml(Patel et al.,
2013). Ces études réalisées ont montré la
capacité des extraits de T. indica sur les souches
résistantes. D'autres souches microbiennes méritent d'être
explorées afin d'élucider les chercheurs et d'orienter vers une
alternative durable face à la résistance antimicrobienne.
1.2.3. Acacia
nilotica(L.) Willd. ancien Delile
1.2.3.1. Description botanique
L'arbre de Acacia nilotica peut se présenter
sous forme d'arbuste ou comme un vrai arbre, capable d'atteindre 15 à
20 m de hauteur (ssp. R. Non nilotique, R. Non
tomentosa et R. Non indique). Le feuillage est dense,
de forme hémisphérique ou plate, et les branches ont des
épines jusqu'à 5 cm de long. Ils sont bipinnate, consistant
entre 12-30 paires de folioles, glabre ou pubescent, jusqu'à
7 mm de longueur et 0,5-1,5 mm de largeur. Les fleurs sont jaune vif,
les gousses de couleur grise au brun, avec une forme variable dans
différentes sous-espèces, contenant de 6 à
16 semences. Pendant la saison sèche, ils ont tendance à
perdre leurs feuilles, bien que la sous-espèce fluviatili peut
se comporter comme plantes vertes. La classification taxonomique
présentée dans le tableau V révèle qu'il y a neuf
sous-espèces reconnues dont trois sous le continent indien et six du
continent Africain (Singh et al., 2010).
Tableau V :
Classification taxonomique de Acacia nilotica(L.) Willd.
ancien Delile
|
Taxonomie
|
|
Règne
|
Plantae
|
|
Division
|
Angiosperme
|
|
Classe
|
Magnoliopsida
|
|
Ordre
|
Fabales
|
|
Famille
|
Mimosaceae
|
|
Genre
|
Acacia
|
|
Espèces
|
Acacia nilotica (L.) Willd.
ancien Delile
|
5b
5a
 
5d
5c
 
Figure 5 :
Acacia nilotica(L.) Willd. ancien Delile
Légende : 5a : feuille?;
5b : fruit sec?; 5c écorce ; 5d : fruit frais.
1.2.3.2. Utilisations cliniques
traditionnelles de Acacia nilotica(L.) Willd. ancien Delile
Acacia nilotica est utilisé dans de nombreuses
cultures pour traiter la bronchite, les douleurs thoraciques, le rhume, la
diarrhée, la dysenterie, la fièvre, les hémorragies, la
lèpre, les troubles oculaires, la pneumonie, les maux de gorge, la
syphilis, la candidose buccale, les infections fongiques de la peau, le
paludisme et la rage de dents (Kubmarawa et al., 2007).
La décoction de l'écorce est utilisée
pour traiter les complications pré, intra et post-partum -(Kaingu et
al., 2011) et la décoction chaude de l'écorce de racine est
utilisée pour les complications gastro-intestinales et la
babésiose. Les fruits sont utilisés contre la gale.
1.2.3.3. Phytochimie de Acacia
nilotica(L.) Willd. ancien Delile
Les extraits de Acacia nilotica ont une composition
chimique variée selon le type d'extrait et la partie
étudiée. Les études ont montré la présence
des sucres, des protéines, des acides aminés libres dans les
extraits de pulpe, ainsi que les tanins, les flavonoïdes, les coumarines,
les anthocyanes, les leucoanthocyanes et les mucilages ont été
trouvés abondants dans les extraits de pulpe. Dans le fruit, il a
été noté la présence de glycosides, des
flavonoïdes et des terpénoïdes. Les tanins étaient
présents dans les extraits méthanolique et aqueux (Abdalla et
al., 2020). Les feuilles et les racines contiennent des alcaloïdes,
de saponines, de glycosides cardiaques, des tanins et flavonoïdes (Jame,
2019).
1.2.3.4. Toxicité
D'après les études de toxicité
réalisées sur cette plante, il a été
démontré que l'extrait éthanolique des feuilles de
Acacia nilotica n'exerce aucune activité hémolytique sur
le rat et l'homme, et qu'il est non toxique(Ilavarasan et al.,2017).
Néanmoins, des composés chimiques présents dans la plante
à certaines doses pourraient causer des dommages aux systèmes du
corps?; ainsi, plus la dose administrée est élevée, plus
les lésions causées sont importantes. Des études
passées en revue ont rapporté qu'une exposition à long
terme de la plante et surtout de l'écorce pourrait induire des effets
toxiques de certaines parties sur les principaux systèmes d'organes tels
que le foie et les reins(Kalaivani et al., 2011). Dans l'ensemble, en
raison de la demande croissante et remarquable que l'utilisation
thérapeutique des différentes parties de A. nilotica a
suscitée, ainsi que de son énorme potentiel dans un avenir
proche, des études toxicologiques plus avancées devraient
être réalisées pour clarifier l'innocuité de
l'espèce (Maman et al., 2019).
1.2.3.5. Propriétés
pharmacologiques
Diverses activités pharmacologiques in vitro et in
vivo ont été rapportées pour les extraits et les
constituants bioactifs isolés de A. nilotica. Les extraits et
les composés actifs isolés de différentes parties de
A. nilotica ont présenté des activités
antibactériennes- - (Elamary et al., 2020),
antioxydantes, anti-inflammatoires(Jame, 2019a), anticancéreuses,
chimiopréventives, antidiabétiques, antivirales,
antiépileptiques, antifongiques, antidiarrhéiques(Al-Juhaimi
et al., 2020), cicatrisantes, insecticides, anthelminthiques(Farzana
et al., 2014) et antiprotozoaires (Figure 6).
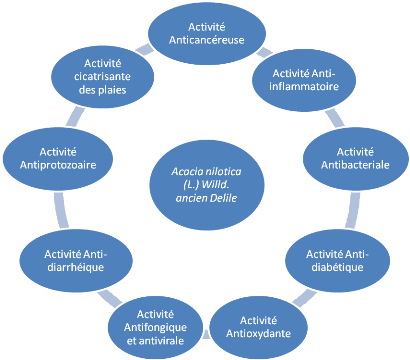
Figure 6 : Propriétés
pharmacologiques de Acacia nilotica(L.) Willd. ancien Delile
1.2.3.5.1. Activité antioxydante
La détermination des activités antioxydantes qui
sont traditionnellement utilisées dans le traitement du cancer permet
d'identifier des composés phénoliques importants pour neutraliser
les radicaux libres et ainsi réduire les dommages cellulaires. D'autres
études ont démontré que diverses parties de A.
nilotica peuvent présenter des activités antioxydantes.
Kalaivani et al., (2011) ont détecté un composé
antioxydant actif (gallate d'éthyle) dans l'extrait éthanolique
de feuilles de Acacia nilotica Wild. Ex. Del.
D'autres activités antioxydantes de Acacia
nilotica ont été détectées dans l'extrait
éthanolique des feuilles (Jame, 2019a) et des gousses. Singh et al.
(2010) ont décrit l'activité antioxydante de l'extrait
aqueux de l'écorce.
1.2.3.5.2. Activité antibactérienne et
antifongique
L'étude sur l'activité antimicrobienne des
extraits de A. nilotica en tant qu'agent antimicrobien naturel a
été élucidée sur des isolats de source alimentaire
et clinique. Il a été démontré que les extraits
testés ont des effets antimicrobiens substantiels contre les souches
bactériennes résistantes aux antibiotiques de E. coli et
de Salmonella ----(Sadiq et al., 2017). L'extrait de la plante a
réduit de manière significative l'activité du biofilm de
E. coli, K. pneumoniae, P. mirabilis, et P. aeruginosa, des isolats
multirésistants des échantillons uropathogènes et
contenant des gènes de résistance blaTEM, blaSHV et blaCTX
- - (Elamary et al.,2020). De la même
manière, Khan et al. (2009) a exposé l'activité
antifongique d'extraits éthanoliques contre des souches
multirésistantes de Candida. L'utilisation d'extrait méthanolique
et aqueux de gousses de Acacia nilotica a exposé une
activité antibactérienne contre Escherichia coli,
Staphylococcus aureus et Salmonella typhi (Farzana et al., 2014).
De même, les extraits éthanoliques bruts ont montré des
activités antimicrobiennes contre les souches multirésistantes
de Escherichia coli et Klebsiella pneumoniae(Khan et al.,
2009).
II. MATÉRIEL ET
MÉTHODES
2.1.
CADRE D'ÉTUDE
2.1.1.
Cadre institutionnel
L'Unité de Recherche en Microbiologie appliquée
et Pharmacologie des substances naturelles (U.R.M.A.Pha) a été
créée en 2017 en tant qu'unité de recherche
transfacultaire. Elle est physiquement et administrativement située dans
l'Université d'Abomey-Calavi, au sein du Laboratoire de Recherche en
Biologie Appliquée (L.A.R.B.A) de l'Ecole Polytechnique d'Abomey-Calavi
(EPAC). Sa vision est d'être une unité nationale d'excellence
où les scientifiques travaillent ensemble pour trouver des solutions aux
problèmes sanitaires et environnementaux d'importance majeure au
Bénin et en Afrique.
En tant qu'unité d'enseignement, U.R.M.A.Pha forme des
biologistes spécialistes d'un master en Microbiologie moléculaire
et Médicale de qualité depuis 2019. Elle offre une formation
théorique et pratique enseignée par des spécialistes
nationaux et internationaux.
2.1.2.
Cadre technique
L'unité se présente sous deux blocs et est
structurée comme suit : l'administration, la salle des cours, la
salle de conférence, les laboratoires, la salle de production, le
réfectoire, l'animalerie et des bureaux des membres de l'équipe.
L'administration comporte les bureaux des responsables, du secrétariat
et d'une salle d'accueil.
Les diverses manipulations dans le cadre de ce mémoire
ont été réalisées au sein du laboratoire
del'Unité de Recherche en Microbiologie appliquée et
Pharmacologie des substances naturelles (U.R.M.A.Pha). Le laboratoire se
distingue en des sections telles que : la microbiologie, la biochimie -
pharmacologie, la biologie moléculaire, la salle pluridisciplinaire et
la salle de bio-informatique. Chaque laboratoire est très
équipé et comporte deux paillasses dont la principale est
centrale et les paillasses secondaires qui ceinturent les laboratoires.
L'étude de type pluridisciplinaire a inclus plusieurs sections de
l'unité. Les séjours de manipulations ont été
effectués dans les sections de la microbiologie, de la biologie
moléculaire et de la pharmacologie.
2.2. MATÉRIEL
2.2.1.
Matériel végétal
Le matériel végétal a été
constitué les feuilles, les écorces et les fruits de Acacia
nilotica, Tamarindus indica et Adansonia digitata. Elles ont
été authentifiées à l'Herbier National du
Bénin sous les numéros YH 652/HNB pour Acacianilotica
(L.) Willd. Ex Delile?; YH 653/HNB pour Tamarindus indica
L. et YH 654/HNB pour Adansonia digitata L.
Les parties collectées sont les feuilles,
l'écorce et les fruits. Les parties de chaque plante ont
été soigneusement lavées dans de l'eau contenant du
Javel
(1/100ème) puis séchées
à la température du laboratoire pendant deux semaines. Une fois
séchées, ces parties ont été broyées et les
poudres obtenues ont été tamisées à l'aide d'une
maille de 0,2 mm. Elles ont ensuite été stockées dans
des récipients propres à la température du laboratoire.
2.2.2.
Matériel biologique
Les souches bactériennesmultirésistantes
isolées des échantillons de l'environnement hospitalier et
communautaire ont été prises dans la souchethèque de
URMAPha. Il s'agit des souches de : Klebsiella pneumoniae, Klebsiella
oxytoca, Escherichia coli, Enterobacter cloacae, Staphylococcus aureus,
Staphylococcus Coagulase Négative résistanteset des souches
de référence de Escherichia coli ATC5922 et S. aureus
ATC5922. Les souches bactériennes utilisées provenaient de
la souchethèque du Laboratoire de l'Unité de Recherche en
Microbiologie appliquée et Pharmacologie des substances naturelles
(U.R.M.A.Pha). Le critère de choix des souches a été
basé sur deux aspects à savoir : l'espèce et la
présence des gènes de résistance. Les espèces
bactériennes choisies sont les plus prédominantes dans les cas
d'infection clinique '(Akouétévi et al., 2017). Quant
aux gènes de résistance, d'après Ugbo et al.
(2020), les gènes BlaSHV?; BlaCTX (M1,
M2, M9, M15) sont les plus rencontrés d'après les
récentes études sur l'émergence de la résistance
aux antibiotiques en Afrique. Ainsi, chaque souche bactérienne choisie a
présenté deux à trois gènes de résistance.
Pour les bacilles à Gram négatif, deux types de résistance
ont été considérés à savoir : la
résistance aux BLSE et carbapénème (Duval et al.,
2009?; Isendahl et al., 2012). Quant aux Cocci Gram positifs, le
gène mecA a été considéré pour
Staphylococcus aureusrésistant à la Méticilline
(SARM) et Staphylococcus à Coagulase Négative résistantes
(SCN), car elles ont demeuré être une cause majeure des infections
nosocomiales et communautaires -(Masim et al., 2021). Le
tableau VII si dessous présente le profil de résistance des
souches bactériennes multirésistantes utilisées. Quant au
tableau VIII, il présente le profil des gènes de
résistance des souches bactériennes multirésistantes.
Tableau VI : Profil de
résistance des souches bactériennes multirésistantes
|
Souches bactériennes
|
Profil de résistance
|
|
K. pneumoniae
|
AMCR AMXR CTXR
CTRR ATZI IPMS ETPS
GENR CIPR
|
|
AMCR AMXR CTXR
CTRR ATZR IPMS ETPS
GENR CIPR
|
|
K. oxytoca
|
AMCR AMXR CTXR
CTRR ATZR IPMS ETPS
GENR CIPR
|
|
AMCR AMXR CTXR
CTRR ATZR IPMS ETPR
GENR CIPR
|
|
E. cloacae
|
AMCR AMXR CTXR
CTRR ATZR IPMS ETPS
GENR CIPR
|
|
AMCR AMXR CTXR
CTRR ATZR IPMS ETPS
GENR CIPR
|
|
E. coli
|
AMCR AMXR CTXR
CTRR ATZS IPMS ETPR
GENR CIPR
|
|
AMCR AMXR CTXR
CTRR ATZR IPMS ETPS
GENR CIPR
|
|
S. aureus
|
KS CNS CIP S CT
S NAR TOBS E S SS
|
|
KR CNI CIP S CT
R NAR TOBS E R SS
|
|
SCN
|
KS CNS CIP S
CTR NAS TOBS ER
SS
|
|
KR CNR CIPR
CTR NAR TOBI ER
SS
|
Légende :S :
Sensible, R : Résistant, AMC : Amoxiclave,
AMX : Amoxicilline, CTX : Ceftriaxone, CTR : Cotrimoxazole,
ATZ : Aztréonam, IPM : Imipénème, ETP :
Ertapénème, GEN : Gentamicine, CIP :
Ciprofloxacine, K : Kanamycine, CN?; CIP : Ciprofloxacine;
NA : Acide Nalidixique?; TOB : Tobramycine?; E : Erythromycine,
S : Streptomycine.
Tableau VII : Profil des
gènes de résistance des souches bactériennes
multirésistantes
|
Souches bactériennes
|
BlaSHV
|
BlaCTXM1
|
BlaCTXM2
|
BlaCTXM9
|
BlaCTXM15
|
|
K. pneumoniae
|
+
|
-
|
+
|
-
|
-
|
|
+
|
-
|
+
|
+
|
+
|
|
K. oxytoca
|
+
|
+
|
+
|
-
|
-
|
|
+
|
-
|
+
|
-
|
-
|
|
E. cloacae
|
-
|
+
|
-
|
+
|
+
|
|
+
|
+
|
+
|
-
|
+
|
|
E. coli
|
+
|
-
|
+
|
+
|
+
|
|
-
|
-
|
+
|
+
|
+
|
L'activité antifongique a été
effectuée sur des souches cliniques isolées des
échantillons de sécrétions
vaginalessélectionnéesdans la souchethèque
del'unité : C. albicans sensible et mulltirésistante?;
C. glabrata sensible et mulltirésistante?; C. parapsilosis sensible et
mulltirésistante, C. krusei sensible et mulltirésistante et
une souche de référence de C. albicans.Ces souches
provenaient de la souchetèque de l'Unité de Recherche en
Microbiologie appliquée et Pharmacologie des substances naturelles
(U.R.M.A.Pha). Les critères de choix des souches ont été
basés sur deux aspects à savoir : l'espèce et la
résistance aux antifongiques. Les espèces fongiques choisies ont
été celles majoritaires au cours des infections cervicovaginales
d'après une récente étude réalisée en 2020
ayant porté sur les profils eìpideìmiologique et
microbiologique des candidoses vulvovaginales diagnostiqueìes chez les
femmes reçues en consultation gynécologique aÌ
l'Hôpital de Menontin'(Montégro, 2021). Quant au choix de la
résistance, les souches ayant présenté au moins une des
résistances antifongiques les plus fréquentes
(Amphotéricine B et Fluconazole) (Hmida et al., 2018?; Wang
et al.,2019) ont été considérées. Les
facteurs de virulences de ces souches ont également été
déterminés et présentés dans le tableau XI.Les
interprétations des mesures de diamètre d'inhibition ont
été effectuées selon la grille ci-dessous
(Tableau IX) '(Bonouman-Ira et al., 2011?; Khan et al.,
2018). Le profil de résistance des souches est
présenté dans le Tableau X ci-dessous.
Tableau VIII :
Interprétation des mesures de diamètre d'inhibition
|
Antifongiques
|
Concentration des disques (mg)
|
Zone d'activité (mm)
|
|
Sensible
|
Intermédiaire/SDD
|
Résistante
|
|
|
|
|
|
|
Nystatine
|
100
|
=15
|
10-14
|
=10
|
|
|
|
|
|
|
Fluconazole
|
100
|
= 20
|
10-19
|
= 10
|
|
|
|
|
|
|
Amphotéricine B
|
50
|
>10
|
=10
|
< 10
|
|
|
|
|
|
|
Clotrimazole
|
10
|
= 20
|
10-19
|
= 10
|
|
|
|
|
|
|
Kétoconazole
|
10
|
= 20
|
10-19
|
= 10
|
|
|
|
|
|
|
Itraconazole
|
10
|
= 20
|
10-19
|
= 10
|
Tableau IX : Profil des souches
fongiques utilisées
|
Souches antifongiques
|
Profilde résistance
|
|
C. albicans S
|
ITRS NYSS
FLUSAmBSCLTSKETS
|
|
C. albicans R
|
ITRS NYSS FLUR
AmBRCLTSKETS
|
|
C. glabrata S
|
ITRS NYSS
FLUSAmBSCLTSKETS
|
|
C. glabrata R
|
ITRS NYSS FLUR
AmBRCLTSKETS
|
|
C. parapsilosiss S
|
ITRS NYSS
FLUSAmBSCLTSKETS
|
|
C.
parapsilosisR
|
ITRS NYSS FLUR
AmBSCLTRKETS
|
|
C. krusei S
|
ITRS NYSS
FLUSAmBSCLTSKETS
|
|
C. krusei R
|
ITRS NYSS
FLURAmBSCLTRKETS
|
Légende :Fluconazole (FLU);
Amphoteìricine B (AmB); Keìtoconazole (KET)?; Clotrimazole
(CLT)?; Itraconazole (ITR), Nystatine (NYS), Résistant (R), Sensible
(S).
Tableau X : Facteurs de virulence des
souches fongiques
|
Hémolysine
|
Lécithinase
|
Adhésion
|
Hydrophobicité
|
Biofilm
|
Exo polysaccharide
|
Gélatinase
|
|
C. krusei R
|
+
|
+
|
+
|
+
|
+
|
-
|
-
|
|
C. krusei (S)
|
+
|
+
|
+
|
+
|
+
|
-
|
-
|
|
C. albicans R
|
+
|
-
|
+
|
+
|
-
|
-
|
-
|
|
C. albicans (S)
|
+
|
+
|
+
|
+
|
+
|
-
|
-
|
|
C. glabrata R
|
+
|
+
|
+
|
+
|
+
|
-
|
-
|
|
C. glabrata (S)
|
+
|
-
|
+
|
+
|
+
|
+
|
-
|
|
C. parapsilosis R
|
-
|
-
|
+
|
+
|
-
|
-
|
+
|
|
C. parapsilosis (S)
|
-
|
+
|
-
|
+
|
+
|
-
|
-
|
Légende : + :
Présence?; - : absence
2.2.3.
Matériel technique et équipements
Dans le déroulement des activités, plusieurs
matériels ont été utilisés. Parmi ceux-ci, les
milieux de culture, les réactifs, les solvants organiques et les
colorants.
Pour l'isolement, le repiquage et la réalisation de
l'antibiogramme, les milieux Mueller Hinton, Mac Conckey, Potatose Dextrose
Agar et Eosine Methylen Blue ont été utilisés. De
même, les réactifs à savoir : les colorants de Gram,
le Bleu de Méthylène et le PBS (lavage cellulaire) ont
été utilisés. Quant aux solvants, l'eau distillée
et l'éthanol à 96° ont servi à préparer les
extraits. D'autres petits matériel ont servi aux manipuations à
savoir : les cônes, les micropipettes, les pipettes pasteurs, les
boîtes de Pétri et les microplaques de 96 puits. Par rapport
aux consommables, les disques d'antifongiques et d'antibiogrammes :
Fluconazole (100 ug), Amphoteìricine B (50 ug),
Keìtoconazole (10 ug), Clotrinazole (10 ug), Itraconazole
(10 ug), Nystatine (100 ug) ont été utilisés
pour les champignons. De même que, AMC (Amoxiclave), AMX (Amoxiciline),
CTX(Ceftriaxone), CTR(Cotrimoxazole), ATZ(Aztréoname),
IPM(Imipénème), ETP(Ertapénème), GEN (Gentamicine),
CIP(Ciprofloxacine),... ont été utilisés pour les
bactéries. D'autre matériel à savoir : les tubes
aÌ heìmolyse de 5 ml steìriles, les
eìprouvettes, les fioles jaugeìes, les beìchers, le bec
bunsen, la bouteille de gaz, les boîtes de Peìtri, les tubes
Eppendorf, les eìcouvillons, les lames et lamelles, les ensemenceurs
steìriles, le papier aluminium, les écouvillons, etc ont
également été utilisés.
Plusieurs eìquipements ont servi dans la
reìalisation de nos manipulations. Il s'est agi de : le microscope
à cameìra, le lecteur de plaque, le PSM, l'eìtuve, le
congeìlateur, la centrifugeuse, la balance de preìcision,
l'autoclave, l'agitateur et le vortex.
2.3.
MÉTHODES
2.3.1.
Extraction et préparation des extraits
Les extraits totaux aqueux et éthanoliques ont
été obtenus par une adaptation des méthodes mise au point
par '-Guédé-Guina et al. (1995) et Baxter et
al., (1998) utilisée par 'Klotoé et al. (2020).
Cinquante (50) grammes de poudre ont été macérés
dans 500 ml d'eau distillée/éthanol. Le mélange est
mis sous agitation continue de marque «?Stuart Bioblock Scientific
Fisher?» pendant 72 heures à la température ambiante.
L'homogénat obtenu a été filtré
trois fois sur du coton hydrophile et une fois sur le papier Wattman
No1. Ce filtrat a été ensuite séché
à 45 °C au four. La poudre ainsi obtenue est l'extrait total
aqueux utilisé.
2.3.1.1. Préparation des extraits de plante
Les extraits aqueux et éthanolique de chaque plante ont
été repris dans de l'eau distillée à raison de
100 mg pour 1 ml. La stérilité des solutions
mères d'extraits a été vérifiée en
ensemençant deux (02) aliquotes de chaque solution sur le milieu Mueller
Hinton et incubée à 37 °C pendant 24 heures.
L'absence de colonies sur le milieu Mueller Hinton après 48 heures
a confirmé la stérilité de ces solutions mères
d'extraits (Agbankpe et al., 2016).
2.3.1.2. Rendement à l'extraction
Le rendement de l'extrait brut est défini comme
étant le rapport entre la masse de l'extrait sec obtenue et la masse du
matériel végétal traité (Baxter et
al.,1998). Ce rendement a été calculé via
l'équation :

R(%) : Rendement en %
Me : Masse de l'extrait après l'évaporation
du solvant
Mv : Masse de la matière végétale
utilisée pour l'extraction
2.3.2.
Tests de cytotoxicité
L'effet cytotoxique des extraits a été
évalué suivant une adaptation de la méthode décrite
par Dougnon (2013). Les tests ont été réalisés sur
des larves obtenues par éclosion de 10 mg d'oeufs de Artemia
salina (ARTEMIO JBL GmbH D-67141 Neuhofem) sous agitation continue dans
1 l d'eau de mer pendant 72 h. A 1 ml de chaque dilution en
série géométrique de raison ½ d'extrait
préparé à partir d'une solution mère de
20 mg/ml, dans l'eau de mer, a été ajouté 1 ml
d'eau de mer contenant 16 larves. Le nombre de larves survivantes a
été dénombré après 24 h d'incubation.
La CL50a été déterminée
à partir de la droite de régression obtenue de la courbe
représentative du nombre de larves survivantes en fonction de la
concentration des extraits. Chaque essai a été
réalisé en double, suivi d'un témoin contenant 1 ml
d'eau de mer contenant 16 larves à laquelle est ajouté
1 ml d'eau distillée.
Pour interpréter ces résultats, des grilles de
corrélation associant le degré de toxicité à la
CL50 ont été proposées -(Moshi et al., 2004).
Tableau XI : Correspondance entre
CL50 et toxicité
|
CL50
|
Toxicité
|
|
CL50 > 0,1 mg/ml
|
- (Non-toxique)
|
|
0,1 mg/ml > CL50 _
0,050 mg/ml
|
+ (moins toxique)
|
|
0,050 mg/ml > CL50_0,01 mg/ml
|
++ (Toxicité
modérée)
|
|
CL50 < 0,01 mg/ml
|
+ + + (Forte toxicité)
|
2.3.3 Evaluation de l'activité antimicrobienne des
extraits des plantes
Dans cette partie de l'étude, le profil de
résistance aux antifongiquesdes souches cliniques isolées de
prélèvements des sécrétions cervico-vaginales et
des urines a été déterminé. Pour ce faire, les
souches jeunes obtenues après culture de 24 h sur la gélose
Potatose Dextrose Agar (PDA) ont été utilisées.
2.3.3.1. Confirmation des souches cliniques
Les souches présentant un profil de résistance
aux antibiotiques ont été vérifiées à la
biologie moléculaire pour la détermination des gènes de
résistance ont été confirmées par des tests
morphologiques (Gram contrôle) et des tests biochimiques de galerie de
Leminor. Le profil de résistance des souches a été
confirmé par la réalisation des tests l'antibiogramme avec les
disques concernés.
L'identification des levures a été
effectuée selon la méthode décrite par Ghaddar et al.
(2020) et légèrement modifiée. Elle se base sur
l'étude de l'aspect morphologique des souches à l'examen direct
sur milieu gélosé et la recherche de la production de tube
germinatif in vitro.
En effet, chaque isolat a d'abord
été examiné à l'examen direct dans une solution
physiologique entre lame et lamelle. Ensuite, le test de filamentation (test de
blastèse) consistant à incuber l'isolat dans du sérum
à 37 °C pendant trois (3 h) a été
réalisé pour chaque isolat. Enfin, les aspects des colonies
produites sur le milieu ChromAgar Candida (Conda, Espagne)
couplés de la réduction du sel de Tétrazolium sur milieu
Sabouraud au Tétrazolium (TRM ou Tetrazolium réduction Medium)
ont été notés (Tableau XII) après 24 h
à 48 h d'incubation à 37 °C.
Tableau XII : Aspects de souches de Candida
sur milieu ChromAgar Candida (Conda, Espagne) et sur milieu
TRM.
|
Espèces fongiques
|
Couleur au ChromAgar
|
Couleur au TRM
|
|
|
|
|
C. albicans
|
Vert clair
|
Rose pâle et luisant parfois à centre marron
|
|
C. glabrata
|
Rose luisant
|
Rose luisant (croissance lente)
|
|
C. krusei
|
Rose pâle à bord blanchâtre
|
Rose mât
|
|
C. parapsilosis
|
Beige ou jaunâtre
|
Rose violacé
|
|
|
|
2.3.3.2. Test d'activité antifongique des extraits de
plantes
L'identification des extraits actifs a été faite
par la méthode de diffusion en milieu solide selon Alsubhi et al.
(2019) et la détermination des concentrations minimales
inhibitrices (CMI) et fongicide (CMF) par la méthode de microdilution
selon Lagane (2007).
Préparation des milieux de culture
La gélose PDA a été
préparée, stérilisée, puis coulée dans les
boîtes de Pétri.
Préparation des suspensions
fongiques
Deux colonies moyennes de 24 h de la souche à
tester ont été cultivées sur gélose PDA et
prélevées et émulsionnées dans 5 ml de
solution saline à 9 %o. Les suspensions fongiques ainsi
préparées ont été ajustées à la
densité 0,5Mc Farland correspondant à 1,5X105UFC/mL.
Préparation des dilutions d'extraits
100 mg de chaque extrait a été
pesé et dissous complètement dans 1000 uL d'eau
distillée stérile. La suspension ainsi préparée a
ensuite été bien vortexée avant chaque utilisation.
Activité antifongique proprement
dite
En effet, deux plaques gélosées de Potatose
Dextrose Agar (PDA) ont été ensemencées avec la suspension
fongique préparée pour chaque type d'extrait. Six puits de
7 mm de diamètre ont ensuite été
réalisés de façon stérile dans les milieux
gélosés à l'aide de pipette Pasteur. Les cinq puits
périphériques ont servi de puits tests et le puits central
utilisé pour le contrôle négatif. Ainsi, 100 uL de
chaque extrait (Extraits aqueux ou hydro éthanolique) a
été mis dans les puits et 100 uL de Clotrimazole (CLT)
(100 ug/ml) dans les deux suivants dont un pour le témoin positif,
puis 100 uL d'eau distillée dans le second puits contrôle
négatif. Les plaques ainsi traitées ont été
couvertes, laissées deux heures sur la paillasse puis incubées
à 37 °C pendant 24 h. Les diamètres d'inhibition
observés autour des puits après l'incubation ont ensuite
été mesurés à l'aide d'un
doubledécimètre pour chaque type d'extrait étudié.
L'extrait le plus actif correspond à celui ayant présenté
le plus grand diamètre d'inhibition.
La détermination des concentrations minimales
inhibitrices (CMI) a été faite en milieu liquide selon Lavaee
et al. (2019). Les tests ont été réalisés
sur des dilutions successives (1/2?; 1/4?; 1/8?; 1/16?; et 1/32) d'extrait.
100 uL de chaque extrait dilué ont ensuite été
déposés dans les puits réalisés sur la
gélose PDA contenant la souche de 24H précédemment
ensemencée. Après 45 min de diffusion sur paillasse, les
boîtes de gélose ont été incubées à
37 °C pendant 24heures. Un témoin positif en remplacement de
l'extrait au Clotrimazole (CLT) a été mélangé
à l'inoculum fongique et pour le témoin négatif, seule
l'eau distillée stérile a été mise en contact avec
les puits. Cette partie de l'étude a été
réalisée suivant la méthode appliquée par
Lègba et al. (2017).
2.3.3.3. Test
d'activité antibactérienne des extraits de plantes
L'identification des extraits actifs a été faite
par la méthode de diffusion en milieu solide adaptée par Dougnon
et al. (2021) et Alsubhi et al. (2019). Quant à la
détermination des Concentrations Minimales Inhibitrices (CMI), elles ont
été déterminées par la méthode de dilution
en milieu liquide selon Lègba et al. (2017).
-
Préparation des milieux de culture
La gélose Muëller Hinton a été
préparée et stérilisée.
-
Préparation des suspensions bactériennes
Une
préculture bactérienne (1 colonie dans 5 ml d'eau
distillée stérile) de 18 h a été diluée
pour obtenir une turbidité de 0,5 sur l'échelle de McFarland
(soit 108 UFC/ml) et ramenée à
106 UFC/ml dans de l'eau distillée stérile.
Chaque inoculum a été ensemencé par écouvillonnage
sur des boîtes de Pétri contenant la gélose Mueller
Hinton'(CA-SFM, 2020).
-
Préparation des dilutions d'extraits
100 mg de chaque extrait ont été
pesés et dissous complètement dans 1 ml d'eau
distillée stérile. La suspension ainsi préparée a
ensuite été bien vortexée avant chaque utilisation.
-
Activité antibactérienne proprement dite
Àl'aide du bout de pipette Pasteur stérile des
puits ont été creusés dans la gélose MH. Ensuite,
à l'aide d'un cône stérile et d'une micropipette,
50 uL de chaque extrait a été déposé dans les
puits précédemment creusés. Un puits contenant de l'eau
distillée stérile a servi de témoin négatif. Des
disques d'antibiotiques standards de imipénème (10 ug/ml)
ont également été utilisés pour servir de
témoins positifs. Les boîtes ont été laissées
pendant 15 min à la température ambiante pour une
pré-diffusion avant d'être incubées à
37 °C pendant 24 h. Après la période d'incubation,
les boîtes ont été examinées pour noter les
éventuelles zones d'inhibition (diamètre mesuré en mm).
Tous les essais ont été réalisés en double.
V
T
N
A
Eaq
T
V
A
T
V
V
A
A
T
T
T
N
Eaq
HI
24H après
A
Figure 7 :
Illustration de la méthode d'évaluation du pouvoir antimicrobien
des extraits de plante étudiés (Cas d'un extrait
aqueux)
T= Tamarindus indica?;
V= Vitellaria paradoxa?; A=Adansonia
digitata?;N = Contrôle négatif?;
T = Contrôle positif?; Eaq = Extrait aqueux?;
HI = halo d'inhibition.
L'interprétation des résultats a
été faite suivant les normes de Tsirinirindravo et Andrianarisoa
(2009).
Tableau XIII : Norme
utilisée pour la lecture des résultats des tests d'antibiogramme
des extraits végétaux.
|
Diamètre de zone d'inhibition (?)
|
Degré de sensibilité du
germe
|
|
??7 mm
|
Insensible
|
|
7 mm =?? 8mm
|
Sensible
|
|
8 mm=??9mm
|
Assez sensible
|
|
?=9 mm
|
Très sensible
|
Source : OMS, 2002?; '''''''''Tsirinirindravo et Andrianarisoa, 2009
2.3.3.4
Détermination du pouvoir antibiotique/antifongique des extraits actifs
sur les souches testées
Seuls les extraits actifs sur la majorité des souches
bactériennes et fongiques testées ont été
utilisés. Ainsi, les extraits aqueux et éthanoliques du fruitde
Tamarindus indica, lesextraits aqueux des feuilles et fruits de
Acacia nilotica et les extraits éthanolique de l'écorce
etaqueux du fruit de Adansonia digitata ont été
utilisés. A cet effet, la formule CMB/CMI ou CMF/CMI a
été appliquée pour calculer le pouvoir antibiotique ou
antifongique (p.a.) de chaque extrait utilisé découlant des
concentrations inhibitrices obtenues.
2.3.4 Détermination
du pourcentage de déstabilisation des extraits actifs
Le mécanisme d'action de l'effet antibactérien a
été évalué pour les extraits ayant
présenté une inhibition sur toutes les souches
bactériennes testées. Ainsi, le test de
perméabilité de la membrane externe a été
effectué.Il a été déterminé
selon la méthode décrite par Hao et al., (2009). Dans
une microplaque de 96 puits, des concentrations de CMI et 2CMI de chaque
extrait ont été préparées en triplicata par
dilution en série. Cent microlitres (100ìl) de suspension de
chaque souche ont été ajoutés et la plaque a
été incubée à 37 °C pendant 24 h. Les
densités optiques ont été lues à 405 nm
(longueur d'onde à laquelle la forme complexe entre les
lipopolysaccharides et les cations divalents stabilisateurs de membrane absorbe
les cations divalents).Le pourcentage de déstabilisation a
été calculé à l'aide de la formule
ci-dessous :
%D = [(Ao - As) Ao] x 100
Avec %D : Pourcentage de déstabilisation?;
Ao : Absorbance du contrôle négatif?;
As : absorbance des échantillons testés.
L'imipénème a été utilisée
comme contrôle positif et a été préparée de
manière égale à la CMI (0,0781 ìg/mL) et 2CMI
(0,1562 ìg/mL). Le MHB et la suspension des bactéries ont
constitué le contrôle négatif tandis que le contrôle
de stérilité contenait MHB seul. Les puits contenant le bouillon
Mueller Hinton et les extraits seuls ont constitué le blanc. Un
graphique du %D par rapport à la concentration de l'extrait a
été tracé afin de déterminer la concentration qui
provoque une déstabilisation maximale de la membrane.
2.3.6.
Analyses statistiques
Les données collectées ont été
présentées en tableaux et en graphes avec respectivement les
logiciels Excel et Graph Pad. Les statistiques descriptives ont
été réalisées grâce au logiciel SPSS 20.
Le test ANOVA a été utilisé pour la comparaison des
moyennes. Les comparaisons ont été faites au seuil de
significativité de 5 %.
III. RÉSULTATS ET DISCUSSION
3.1. RÉSULTATS
3.1.1 Rendements à
l'extraction et test de stérilité
Du rendement à l'extraction des extraits
éthanoliques et aqueux des plantes étudiées
présentés dans la figure 8, il ressort que le rendement des
différents extraits a varié en fonction des plantes, des parties
utilisées et du type de solvant d'extraction.
Les extraits éthanoliques ont présenté un
meilleur rendement aux extraits aqueux, mais cette différence n'est
statistiquement pas significative. Les rendements à l'extraction entre
les différentes parties de ces plantes sont statistiquement similaires
avec p0,05 à l'exception des extraits du fruit de Adansonia
digitata. Les tests de stérilité ont
révélé l'absence de contamination de tous les extraits
testés (Figure 8).
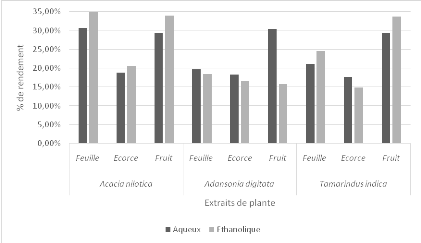
Figure 8 :
Rendement à l'extraction des plantes étudiées
3.1.2
Evaluation de la cytotoxicité des extraits
Les données du test de toxicité larvaire sont
présentées par les figures 9, 10 et 11. Il y ressort une
diminution des larves survivantes au fur et à mesure que la
concentration des extraits augmente.
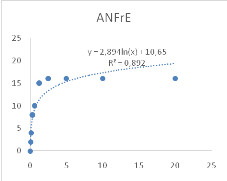 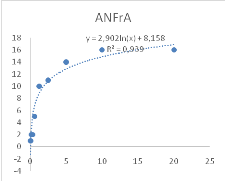
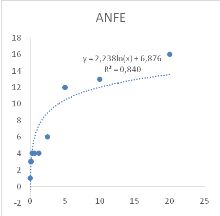 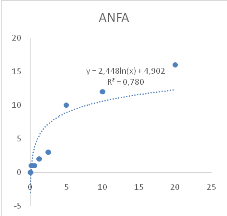
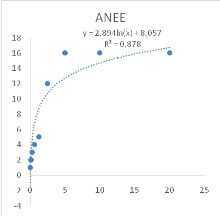 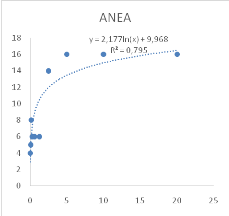
Figure 9 : Sensibilité des
larves de Artemia salina aux extraits de Acacia nilotica
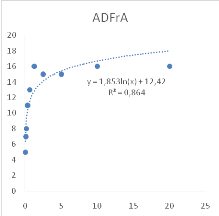 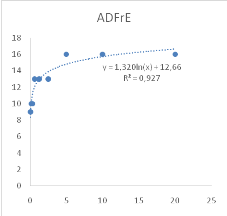 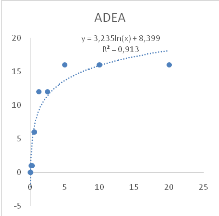 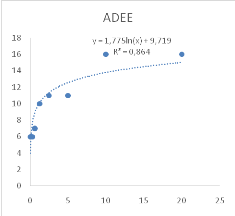
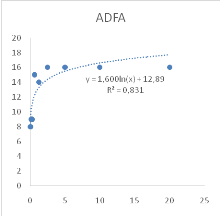 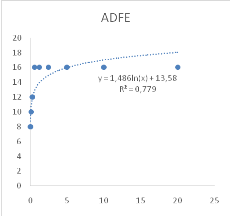
Figure 10 : Sensibilité des
larves de Artemia salina aux extraits Adansonia digitata
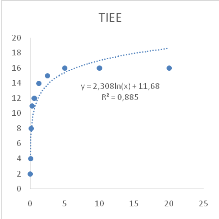 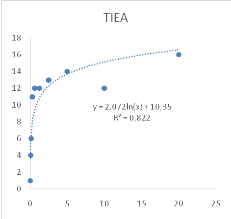
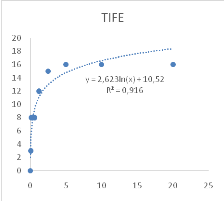 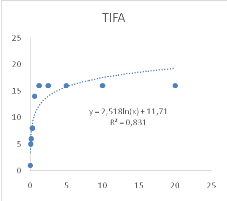
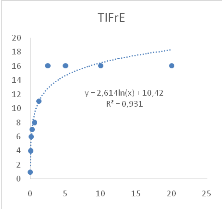 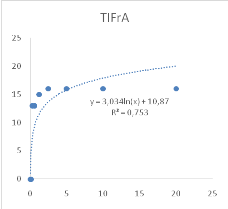
Figure 11 : Sensibilité des
larves de Artemia salina aux Tamarindus indica
Légende :TI : Tamarindus
indica, AN : Acacia nilotica; AD: Adansonia
digitata; FA : Feuille Aqueux?; FE : Feuille Ethanolique?; EE:
Ecorce Ethanolique?; EA : Ecorce Aqueux?; FrA : Fruit Aqueux?;
FrE : Fruit Ethanolique.
Le tableau XIV présente les
CL50 obtenues. Presque toutes les
CL50 sont supérieures à
0,1 mg/ml. Les extraits aqueux et éthanoliques de toutes les
plantes étudiées sont donc non toxiques à l'exception des
feuilles et des fruits de Adansonia digitata qui ont
présenté une toxicité modérée.
Tableau XIV :
CL50 des extraits de plante
|
Plantes
|
Extraits
|
CL50 (mg/ml)
|
R2
|
|
Acacia nilotica
|
Feuille
|
Aqueux
|
6,020,001
|
0,7805
|
|
Ethanolique
|
3,650,006
|
0,8401
|
|
Ecorce
|
Aqueux
|
0,750,01
|
0,7958
|
|
Ethanolique
|
1,660,003
|
0,8781
|
|
Fruit
|
Aqueux
|
1,940,011
|
0,9393
|
|
Ethanolique
|
0,490,005
|
0,8922
|
|
Adansonia digitata
|
Feuille
|
Aqueux
|
0,0630,01
|
0,8311
|
|
Ethanolique
|
0,0670,001
|
0,7791
|
|
Ecorce
|
Aqueux
|
1,360,006
|
0,9138
|
|
Ethanolique
|
0,900,0016
|
0,8542
|
|
Fruit
|
Aqueux
|
0,0690,006
|
0,8642
|
|
Ethanolique
|
0,0200,0001
|
0,9274
|
|
Tamarindus indica
|
Feuille
|
Aqueux
|
0,760,002
|
0,8312
|
|
Ethanolique
|
0,320,001
|
0,9164
|
|
Ecorce
|
Aqueux
|
0,720,004
|
0,8227
|
|
Ethanolique
|
0,350,002
|
0,8859
|
|
Fruit
|
Aqueux
|
0,350,001
|
0,7531
|
|
Ethanolique
|
0,730,006
|
0,9313
|
3.1.3. Effets des extraits
des plantes étudiéessur les souches bactériennes et
fongiques
Le tableau XV présente
l'activité des extraits aqueux et éthanolique des
différentes parties de Adansonia digitata sur les souches
bactériennes multirésistantes. Il ressort de ce tableau que
l'activité des extraits de Adansonia digitata varie en fonction
des souches bactériennes testées, des parties de la plante et du
solvant d'extraction utilisé. D'après l'analyse des
diamètres d'inhibition obtenus sur les différentes
bactéries, les extraits de l'écorce de Adansonia digitata
ont présenté les meilleures activités,
comparativement aux extraits des fruits et feuilles de la plante.Lesextraits
éthanoliques des écorces et des feuillesont été
plus actifs sur les souches bactériennes testées. Les extraits
éthanoliques des écorces et des feuilles ont été
actifs sur toutes les souchesS. aureus et SCN résistantes
à la méticilline testée. Par contre, aucune
activité n'a été observée avec les extraits aqueux
d'écorce. L'extrait éthanolique de fruit a été
actif sur les souches de Staphylocoque à Coagulase Négative
méticillino-résistantes testées, une seule des souches de
S. aureus résistantes et sur la souche de
référence S. aureus ATCC 25922.Seuls les
extraits éthanoliqueset aqueux respectivement de l'écorce, du
fruit ont inhibé presque toutes les souches bactériennes à
l'exception d'une des souches de K. pneumoniae et de K.
oxytoca.
Tableau XV : Activité
antibactérienne des extraits aqueux et éthanoliques des
différentes parties de Adansonia digitata sur les souches
bactériennes multirésistantes
|
Extracts
|
FA
|
FE
|
EA
|
EE
|
FrA
|
FrE
|
|
S. aureus
|
9#177;3
|
10#177;1
|
-
|
18#177;2
|
12#177;2
|
8#177;3
|
|
SCN
|
-
|
11#177;1
|
-
|
18#177;2
|
9#177;3
|
08#177;1
|
|
K. pneumoniae
|
-
|
9#177;3
|
-
|
12#177;4
|
10#177;1
|
9#177;2
|
|
K. oxytoca
|
-
|
-
|
-
|
12#177;4
|
8#177;3
|
-
|
|
E. coli
|
-
|
-
|
-
|
16#177;3
|
13#177;1
|
-
|
|
E. cloacae
|
-
|
-
|
-
|
15#177;1
|
13#177;4
|
-
|
|
S. aureus ATCC 25922
|
-
|
11#177;1
|
-
|
15#177;1
|
14#177;1
|
10#177;1
|
|
E. coli ATCC 25922
|
-
|
-
|
-
|
06#177;1
|
09#177;1
|
-
|
Légende : FA : Feuille
Aqueux?; FE : Feuille Ethanolique?; EA : Écorce Aqueux?;
EE : Écorce Ethanolique?; FrA : Fruit Aqueux?; FrE :
Fruit Ethanolique.
Le tableau XVI ci-dessous
présente l'activité antifongique des extraits aqueux et
éthanoliques des différentes parties de Adansonia digitata
sur les souches de Candida. Il ressort de l'analyse de ce tableau
que l'activité des extraits de Adansonia digitata varie en
fonction de la partie de la plante et du solvant utilisé pour
l'extraction. D'après l'analyse des diamètres d'inhibition
obtenus sur les différents champignons testés, les extraits ont
présenté une activité aussi bien avec les souches
sensibles qu'avec les souches résistantes. Seul l'extrait
éthanolique de l'écorce a présenté une
activité sur le plus grand nombre de souches testées (8/9). Les
extraits aqueux d'écorces et de fruits n'ont montré aucune
activité antifongique sur les souches testées. Les extraits
éthanoliques des fruits et des feuilles quant à eux n'ont
été actifs respectivement que sur une souchesensible de
Candida krusei et Candida albicans (1/9).
Tableau XVI :
Activité antifongique des extraits aqueux et
éthanoliques des différentes parties de Adansonia digitata
sur les souches de Candida
|
Extraits
|
FA
|
FE
|
EA
|
EE
|
FrA
|
FrE
|
|
C. albicans S
|
12
|
12
|
-
|
20
|
-
|
-
|
|
C. albicans R
|
-
|
-
|
-
|
-
|
-
|
-
|
|
C. glabrata S
|
-
|
-
|
-
|
11
|
-
|
-
|
|
C. glabrata R
|
06
|
-
|
-
|
11
|
-
|
-
|
|
C. krusei S
|
10
|
-
|
-
|
26
|
-
|
11
|
|
C. krusei R
|
-
|
-
|
-
|
14
|
-
|
-
|
|
C. parapsilosis S
|
-
|
-
|
-
|
10
|
-
|
-
|
|
C. parapsilosis R
|
-
|
-
|
-
|
20
|
-
|
-
|
|
C. albicans ATCC 90028
|
06
|
-
|
-
|
10
|
-
|
-
|
FA : Feuille Aqueux?; FE : Feuille Ethanolique?;
EA : Écorce Aqueux?; EE : Écorce Ethanolique?;
FrA : Fruit Aqueux?; FrE : Fruit Ethanolique
Le
tableau XVII présente l'activité des extraits aqueux et
éthanoliques des différentes parties de Tamarindus
indicasur les souches bactériennes multirésistantes. Il
ressort de ce tableau que l'activité des extraits de Tamarindus
indicavarie en fonction des souches bactériennes testées,
des parties de la plante et du solvant d'extraction utilisé.
D'après l'analyse des diamètres d'inhibition obtenus sur les
différentes bactéries, les extraits de fruits ont
présenté les meilleures activités (12/14 souches) que ceux
des feuilles (9/14) et écorces (8/14). Les extraits éthanoliques
des feuilles et écorces ont inhibé plus de souches que les
extraits aqueux. Sur les souches de Cocci Gram+, tous les extraits à
l'exception de l'extrait d'écorce aqueux ont été actifs
sur toutes les souches résistantes de S. aureus et de SCN
résistantes présentant le gène mecA. Sur les
souches entéropathogènes testées, les extraits du fruit
ont inhibé la croissance de presque toutes les souches
bactériennes à l'exception d'une souche de K.
pneumoniae. Les extraits éthanoliques de feuille et d'écorce
ont présenté une activité sur une des 2 souches de
K. pneumoniae. Parmi les souches testées, il est
remarqué que les extraits éthanoliques des feuilles et
d'écorce de Tamarindus indicaont été plus actifs
sur les souches ayant présenté 2 gènes de
résistance que sur les souches ayant plus de gènes (3-4
gènes de résistance).
Tableau XVII :
Activité antibactérienne des extraits aqueux et
éthanoliques des différentes parties de Tamarindus
indica sur les souches bactériennes multirésistantes
|
Extraits
|
FA
|
FE
|
EA
|
EE
|
FrA
|
FrE
|
|
S. aureus
|
10#177;2
|
12#177;2
|
-
|
13#177;1
|
18#177;2
|
09#177;2
|
|
SCN
|
12#177;4
|
13#177;2
|
-
|
13#177;1
|
15#177;3
|
11#177;3
|
|
K. pneumoniae
|
06#177;2
|
15#177;2
|
-
|
10#177;4
|
12#177;1
|
09#177;2
|
|
K. oxytoca
|
-
|
-
|
-
|
-
|
-
|
15
|
|
E. coli
|
-
|
07#177;2
|
-
|
-
|
13#177;2
|
07#177;3
|
|
E. cloacae
|
10#177;3
|
09#177;3
|
07#177;4
|
07#177;3
|
15#177;2
|
08#177;2
|
|
S. aureus ATCC 25922
|
-
|
10#177;1
|
-
|
11#177;1
|
13#177;1
|
15#177;1
|
|
E. coli ATCC 25922
|
-
|
-
|
-
|
12#177;2
|
10#177;2
|
09#177;1
|
FA : Feuille Aqueux?; FE : Feuille Ethanolique?;
EA : Écorce Aqueux?; EE : Écorce Ethanolique?;
FrA : Fruit Aqueux?; FrE : Fruit Ethanolique
Le tableau XVIIIci-dessous
présente l'activité antifongique des extraits aqueux et
éthanoliques des différentes parties de Tamarindus
indica sur les souches de Candida. Il ressort de l'analyse des
diamètres d'inhibition obtenus sur les différentes
bactéries que les extraits de Tamarindus indican'ont pas
inhibé la croissancedes souches fongiques testées. Seule la
souche de référence a été inhibée par la
majorité des extraits à l'exception des extraits
éthanolique d'écorce et de fruit. La souche de Candida
albicans a également été inhibée par l'extrait
éthanolique des feuilles et l'extrait aqueux de l'écorce de
Tamarindus indica.
Tableau XVIII :
Activité antifongique des extraits aqueux et
éthanoliques des différentes parties de Tamarindus indicasur
les souches de Candida
|
Extraits
|
FA
|
FE
|
EA
|
EE
|
FrA
|
FrE
|
|
C. albicans S
|
-
|
15
|
09
|
-
|
-
|
-
|
|
C. albicans R
|
-
|
-
|
-
|
-
|
-
|
-
|
|
C. glabrata S
|
-
|
-
|
-
|
-
|
-
|
-
|
|
C. glabrata R
|
-
|
-
|
-
|
-
|
-
|
-
|
|
C. krusei S
|
-
|
-
|
-
|
-
|
-
|
-
|
|
C. krusei R
|
-
|
-
|
-
|
-
|
-
|
-
|
|
C. parapsilosis S
|
-
|
-
|
-
|
-
|
-
|
-
|
|
C. parapsilosis R
|
-
|
-
|
-
|
-
|
-
|
-
|
|
C. albicans ATCC 90028
|
15
|
19
|
12
|
-
|
13
|
-
|
FA : Feuille Aqueux?; FE : Feuille Ethanolique?;
EA : Écorce Aqueux?; EE : Écorce Ethanolique?;
FrA : Fruit Aqueux?; FrE : Fruit Ethanolique
Le tableau XIX présente l'activité des
extraits aqueux et éthanoliques des différentes parties de
Acacia nilotica sur les souches bactériennes
multirésistantes. Il ressort de ce tableau que l'activité des
extraits de Acacia niloticaavarié en fonction des souches
bactériennes testées, des parties de la plante et du solvant
d'extraction utilisé. D'après l'analyse des diamètres
d'inhibition obtenus, les extraits aqueux des fruits et feuilles de Acacia
nilotica ont présenté une meilleure activité. Par
contre au niveau de l'écorce,c'est l'extrait éthanolique qui a
été plus actif. Par rapport aux souches
entéropathogènes résistantes testées, il a
été remarqué que les mêmes extraits ont
été plus actifs sur les souches ayant présenté
2 gènes de résistance que sur les souches ayant plus de
gènes (3-4 gènes de résistance) au niveau de chaque
espèce bactérienne.
Tableau XIX :
Activité antibactérienne des extraits aqueux et
éthanoliques des différentes parties de Acacia nilotica
sur les souches bactériennes multirésistantes
|
Extraits
|
FA
|
FE
|
EA
|
EE
|
FrA
|
FrE
|
|
S. aureus
|
23#177;2
|
13#177;2
|
19#177;1
|
22#177;2
|
23#177;1
|
-
|
|
SCN
|
23#177;2
|
-
|
16#177;1
|
17#177;1
|
20#177;2
|
-
|
|
K. pneumoniae
|
15#177;2
|
13#177;1
|
12#177;3
|
17#177;1
|
15#177;4
|
09#177;3
|
|
K. oxytoca
|
17#177;4
|
-
|
08#177;2
|
15#177;2
|
13#177;3
|
06#177;1
|
|
E. coli
|
20#177;1
|
11#177;4
|
08#177;2
|
10#177;4
|
21#177;1
|
-
|
|
E. coli
|
20
|
-
|
-
|
-
|
21
|
-
|
|
E. cloacae
|
20#177;2
|
-
|
-
|
20#177;1
|
18#177;4
|
12#177;4
|
|
S. aureus ATCC 25922
|
20#177;1
|
10#177;2
|
14#177;1
|
21#177;1
|
17#177;2
|
-
|
|
E. coli ATCC 25922
|
10#177;2
|
12#177;1
|
-
|
-
|
15#177;2
|
-
|
FA : Feuille Aqueux?; FE : Feuille Ethanolique?;
EA : Écorce Aqueux?; EE : Écorce Ethanolique?;
FrA : Fruit Aqueux?; FrE : Fruit Ethanolique
Le tableau XX ci-dessous présente
l'activité antifongique des extraits aqueux et éthanoliques des
différentes parties de Acacia nilotica sur les souches de
Candida. Il ressort de l'analyse de ce tableau que l'activité
antifongique des extraits de Acacia nilotica est variable en fonction
des extraits, des parties et des souches. L'extrait aqueux a
présenté une bonne activité sur toutes les souches de
Candida testées. Les extaits desparties écorces et fruits ont
présenté une activité sur toutes les souches
testées. Aucune activité antifongique n'a été
notée par rapport aux extraits éthanoliques des feuilles et des
fruits. L'extrait éthanolique de l'écorce a
présenté une activité sur les souches sensibles de Candida
et sur la souche de Candida glabrata résistante.
Tableau XX :
Activité antifongique des extraits aqueux et
éthanoliques des différentes parties de Acacia nilotica
sur les souches deCandida
|
Extraits
|
FA
|
FE
|
EA
|
EE
|
FrA
|
FrE
|
|
C. albicans S
|
15
|
-
|
16
|
10
|
12
|
-
|
|
C. albicans R
|
15
|
-
|
-
|
-
|
13
|
-
|
|
C. glabrata S
|
10
|
-
|
-
|
16
|
10
|
-
|
|
C. glabrata ®
|
15
|
-
|
10
|
13
|
14
|
-
|
|
C. krusei S
|
12
|
-
|
-
|
12
|
16
|
-
|
|
C. krusei ®
|
13
|
-
|
-
|
-
|
15
|
-
|
|
C. parapsilosis S
|
14
|
-
|
-
|
11
|
12
|
-
|
|
C. parapsilosis ®
|
17
|
-
|
-
|
-
|
19
|
-
|
|
C. albicans ATCC 90028
|
12
|
-
|
-
|
-
|
10
|
-
|
FA : Feuille Aqueux?; FE : Feuille Ethanolique?;
EA : Écorce aqueuse?; EE : Écorce Ethanolique?;
FrA : Fruit Aqueux?; FrE : Fruit Ethanolique
3.1.4. Activité
antibactérienne et antifongique des différents extraits des
plantes utilisées en fonction des profils de résistance et de
virulence
3.1.4.1. Activité
antibactérienne des différents extraits des plantes
utilisées en fonction des profils de résistance
La figure 13 ci-dessous présente le pourcentage de
bactérie présentant le gène mecA ayant été
inhibé par les différents extraits des différentes plantes
étudiées. Il ressort de cette figure que les différents
extraits testés ont une activité antibactérienne variable
selon la plante étudiée sur les bactéries
présentant le gène mecA. Les extraits aqueux et
éthanolique de feuille et de fruit des différentes plantes
utilisées ont inhibé 20-100 % des bactéries
présentant le gène mecA. Les extraits aqueux et
éthanoliques des écorces de A. nilotica ont
inhibé toutes les bactériesprésentant le gène
mecA. Quant aux plantes deA. digitata et de T. indica,
les extraits éthanoliques des écorces ont
présenté une meilleure activité inhibitrice (inhibition
à 100 %).
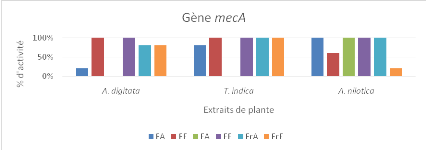
Figure 12 :
Pourcentage d'activité antibactérienne des
différents extraits des différentes plantes
étudiées sur les bactéries présentant le
gène mecA
La figure 13 ci-dessous présente le pourcentage
d'activité antibactérienne des différents extraits des
différentes plantes étudiées sur les bactéries
présentant les gènes BlaSHV, BlaCTXM1,
BlaCTXM2, BlaCTXM9 et BlaCTXM15. Il
ressort de ces figures 13a?; 13 b?; 13c?; 13 d et 13e que
les différents extraits testés ont une activité variable
selon la plante et les parties de la plante étudiées sur les
bactéries présentant les gènes de résistance
BlaSHV, BlaCTXM1, BlaCTXM2,
BlaCTXM9 et BlaCTXM15. Les commentaires
spécifiques associés à chaque figure sont
présentés en a?; b?; c?; d et e.
a. La figure 13a montre que tous les extraits de
Acacia nilotica ont présenté une activité
antibactérienne sur les bactéries présentant le
gène BlaSHV. HLe pourcentage d'activité des
extraits aqueux de fruit et éthanolique d'écorce est
élevé sur les bactéries n'ayant présenté ce
gène.
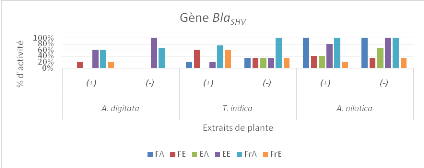
Figure 13a : Pourcentage
d'activité antibactérienne des différents extraits des
différentes plantes étudiées sur les bactéries
présentant le gène BlaSHV
b. Il ressort de la figure 13 b ci-dessous que
l'activité des extraits testés sur les souches présentant
les gènes BlaCTXM1est variable selon les parties des
différentes plantes étudiées. L'activité
antibactérienne des extraits des différentes parties de A.
nilotica sur les souches présentant le gène
BlaCTXM1 est moins importante que sur les souches n'ayant
pas présenté ce gène. Les extraits de A. digitata
(extraits éthanolique d'écorce et aqueux du fruit) et de
T. indica ont présenté une meilleure activité avec
les souches présentant le gène BlaCTXM1.
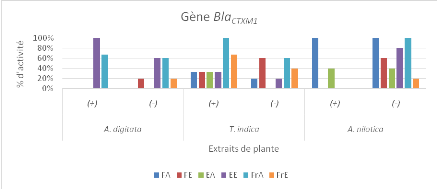
Figure 13 b : Pourcentage d'activité
antibactérienne des différents extraits des différentes
plantes étudiées sur les bactéries présentant le
gène BlaCTXM1
c. Quant à l'activité antibactérienne des
extraits des différentes plantes sur les souches bactériennes
présentant le gène BlaCTXM2 (fig 13c),
les extraits testés ont eu une activité variable selon les
parties des différentes plantes étudiées. Les souches
bactériennes ayant présenté le gène
BlaCTXM2ont une faible activité par rapport aux
souches n'ayant pas le gène. Les extraits aqueux de fruit des plantes
ont été actifs sur toutes les souches ne présentant pas le
gène BlaCTXM2. De même, les extraits
éthanolique d'écorce de A. digitata et A. nilotica et
extraits éthanoliques de fruit de T. indica et A. nilotica ont
été actifs sur toutes les souches n'ayant pas
présenté ce gène.
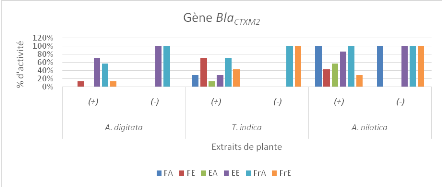
Fig 13c : Pourcentage d'activité
antibactérienne des différents extraits des différentes
plantes étudiées sur les bactéries présentant le
gène BlaCTXM2
Il ressort de la figure 13d ci-dessous que
l'activité antibactérienne des extraits testés
desdifférentes plantes sur les souches présentant le gène
BlaCTXM9 est variable selon le type d'extrait et la plante
étudiée. Les extraits ont été plus actifs sur les
souches bactériennes ne présentant pas le gène de
résistance BlaCTXM9. Cette activité a
ététotale avec les extraits aqueux de feuille et d'écorce
et éthanolique d'écorce de A. nilotica. Il est à
noter que l'extrait aqueux des fruits et l'extrait éthanolique des
écorces de toutes les plantes ont eu une meilleure activité
antibactérienne aussi bien sur les souches présentant le
gène BlaCTXM9 que celles qui ne l'ont pas
présenté.
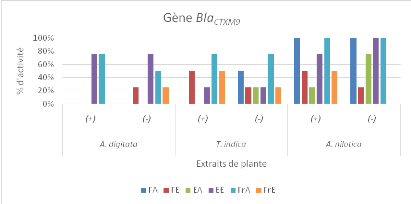
Fig 13d : Pourcentage d'activité
antibactérienne des différents extraits des différentes
plantes étudiées sur les bactéries présentant le
gène BlaCTXM9
La figure 13e ci-dessous ressort l'activité
antibactérienne associée aux différents extraits
testés sur les souches bactériennes présentant le
gène BlaCTXM15. On note de cette figure que
l'activité antibactérienne des extraits testés est
variable selon la partie et la plante testée. Concernant les plantes
A. nilotica et T. indica, les extraits testés ont eu plus
d'activité sur les souches n'ayant pas présenté le
gène BlaCTXM15. Par contre, concernant la plante
A. digitata, seull'extrait éthanolique d'écorce
testé a eu moins d'activité sur les souches ne présentant
pas le gène BlaCTXM15 que sur les souches l'ayant
présenté.
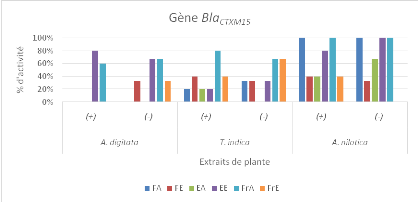
Fig 13e : Pourcentage d'activité
antibactérienne des différents extraits des différentes
plantes étudiées sur les bactéries présentant le
gène BlaCTXM15
3.1.4.2. Activité antifongique des
différents extraits des plantes utilisées en fonction de la
résistance au fluconazole
De l'étude du pourcentage d'activité
antifongique des extraits testés sur les souches fongiques
présentant une résistance au fluconazole, il ressort après
exploitation de la figure 14 ci-dessous que l'activité antifongique
des extraits varie selon le type d'extrait et les plantes testées. Les
extraits testés ont une bonne activité antifongique sur les
souches ayant présenté la résistance aux fluconazole que
sur celles sensibles à l'antifongique. Les extraits aqueux de feuille,
écorce et fruit de Adansonia digitata n'ont
présenté aucune activité sur les souches testées.
Seulement l'extrait éthanolique de feuille, d'écorce et l'extrait
aqueux de fruit de T. indica ont présenté une
activité sur les souches résistantes au fluconazole. Aucune
activité n'a été observée sur les souches sensibles
testées. L'activité antifongique des extraits aqueux de feuille,
écorce et fruits et l'extrait éthanolique de l'écorce de
A. nilotica est notée aussi bien avec les souches
résistantes que les souches sensibles.

Figure 14 : Pourcentage
d'activité antifongique des différents extraits des
différentes plantes étudiées sur les champignons
présentant la résistance au fluconazole
3.1.4.3. Activité antifongique
des différents extraits des plantes utilisées en fonction des
profils de virulence
La figure présente le pourcentage d'activité
antifongique des extraits sur les souches fongiques présentant les
facteurs de virulence lécithinase, hémolysine, Biofilm,
exopolysaccharide et adhésion.
a. D'après la figure 15a, les extraits aqueux de
fruit et d'écorce de A. digitata n'ont présenté
aucune activité antifongique sur les souches présentant le
facteur lécithinase. Seuls les extraits éthanoliques de feuille
et aqueux de l'écorce de T. indica ont présenté
une activité sur les souches ayant présenté la virulence
à la lécithinase. Quant à l'activité de A.
nilotica, les extraits testés ont présenté une
activité similaire aussi bien sur les souches présentant ou non
le facteur de virulence à la lécithinase.
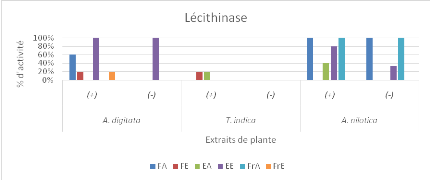
Figure 15a : Pourcentage
d'activité antifongique des différents extraits des
différentes plantes étudiées sur les champignons
présentant la virulence au facteur lécithinase
b. Les extraits aqueux de fruit et de l'écorce de
A. digitata n'ont présenté aucune activité
antifongique sur les souches présentant la virulence à
l'hémolysine (figure 15 b). Lesextraits éthanoliques et
aqueux de feuille, fruit et écorce de T. indica ont
présenté une faible activité sur les souches
présentant la virulence à l'hémolysine. Quant à
l'activité antifongique de A. nilotica, les extraits actifs
(extraits aqueux de feuille, écorce et fruit et l'extrait
éthanolique d'écorce) ont présenté une
activité sur essentiellement les souches virulentes testées.
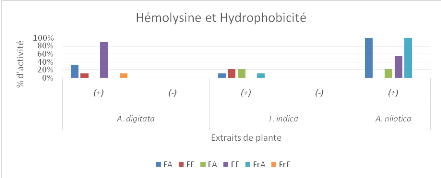
Fig 15b : Pourcentage d'activité antifongique des
différents extraits des différentes plantes
étudiées sur les champignons présentant la virulence au
facteur hémolysine
c. En ce qui concerne l'activité antifongique des
extraits sur les souches virulentes présentant le facteur biofilm
(figure 15c), les activités antifongiques des plantes T. indica
et A. digitata ont été notées avec les extraits
éthanoliques des feuilles. Par contre, seul l'extrait éthanolique
d'écorce a présenté une faible activité sur les
souches ne présentant pas la virulence à ce facteur. Quant
à la plante A. nilotica, les extraits aqueux de fruit et
d'écorce et l'extrait éthanolique d'écorce ont
présenté une activité vis-à-vis des souches ayant
présenté ou non le facteur de virulence biofilm.

Fig 15c : Pourcentage d'activité antifongique des
différents extraits des différentes plantes
étudiées sur les champignons présentant la virulence au
facteur biofilm
d. En ce qui concerne l'activité antifongique des
extraits sur les souches virulentes au facteur exo polysaccharide
(figure15 d), l'activité antifongique de l'extrait
éthanolique de l'écorce pour A. digitata et les extraits
aqueux de feuille, fruit et de l'extrait éthanolique d'écorce
pour A. nilotica ont été notées sur les souches
présentant le facteur exo polysaccharide. Par contre, seuls les extraits
aqueux de feuille et éthanolique d'écorce de T.
indicaont présenté une activité antifongique sur les
souches présentant la virulence à ce facteur.
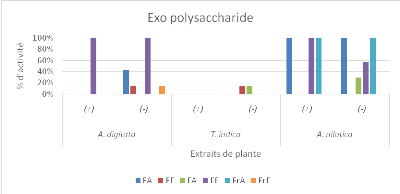
Fig 15d : Pourcentage d'activité antifongique des
différents extraits des différentes plantes
étudiées sur les champignons présentant la virulence au
facteur exo polysaccharide
e. Quant au facteur Adhésion (figure 15e), seuls les
extraits aqueux et éthanolique de feuille de T. indica, les
extraits aqueux et éthanolique de feuille, l'extrait éthanolique
de l'écorce et de fruit de A. digitata de même que les
extraits aqueux de feuille, de fruit et de l'écorce de A. nilotica
ont présenté une activité antifongique sur les
souches présentant le facteur adhésion. Seuls les extraits aqueux
et éthanolique de feuille de T. indica ont
présentéune activité antifongique sur toutes les souches
ne présentant pas le facteur de virulence Adhésion.
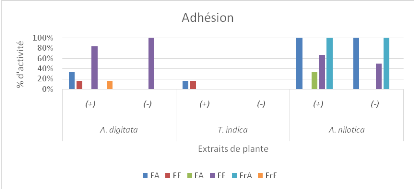
Fig 15e : Pourcentage d'activité antifongique
des différents extraits des différentes plantes
étudiées sur les champignons présentant la virulence au
facteur adhésion.
f. Quant au facteur de virulence Gélatine, la figure
montre que les extraits des plantes ont une activité variable selon les
souches fongiques virulentes testées. Seuls les extraits aqueux de
feuille et de fruit, de même que l'extrait éthanolique de
l'écorce de A. nilotica ont présenté une
activité antifongique sur les souches fongiques présentant le
facteur de virulence Gélatine.
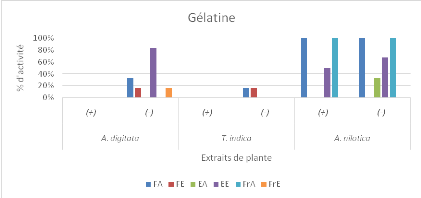
Fig 15f : Pourcentage d'activité antifongique des
différents extraits des différentes plantes
étudiées sur les champignons présentant la virulence au
facteur gélatine
3.1.5.
Détermination du pouvoir antibiotique ou antifongique des extraits de
plante
Le tableau XXI ci-dessous présente les
résultats des CMI, CMB et du pouvoir antibiotique des extraits
testés sur chaque souche bactérienne et fongique. Les
concentrations minimales bactéricides (CMB) et fongicides (CMF) ont
varié en fonction du type de l'extrait et des souches testées. Le
pouvoir antimicrobien (a.p) a été déterminé
grâce au rapport CMB/CMI.
Les Concentrations Minimales Inhibitrices (CMI) obtenues sont
variables en fonction des types de souches et d'extraits. Les CMI des extraits
aqueux de fruit et feuille de A. nilotica ont varié de 3,370,00
à 18,758,84 en fonction de la souche testée. L'extrait aqueux de
feuille a présenté un pouvoirbactériostatique (rapport
CMB/CMI égal à 4) sur les souches de K. oxytoca, E. cloacae
et K. pneumoniae ATCC 25922. Par contre, l'extrait aqueux de fruit a
présenté un pouvoir bactéricide (rapport CMB/CMI
inférieur à 1)sur les souches de E. coli, E. cloacae et K.
pneumoniaeATCC 25922. Les extraits aqueux et éthanolique des
fruits de T. indica ont présenté des CMI variables entre
6,750,00 et 12,50,00 en fonction des souches testées. Ces extraits ont
présenté un pouvoir bactériostatique sur les souches de
K. oxytoca, E. coli (extrait éthanolique de fruit), K.
pneumoniaeATCC 25922 et E. cloacae (extrait éthanolique de
fruit). Seul l'extrait aqueux du fruit a eu un pouvoir bactéricide sur
les souches deE. cloacae. En ce qui concerne les extraits de A.
digitata, les CMI des extraits aqueux de fruits et éthanolique
d'écorce ont présenté une CMI variable de 6,750,00
à 500,00. Les CMI et CMB de l'antibiotique de référence
sur souches Cocci Gram + ont étérespectivement de 6,750,00 et
12,50,00avec un pouvoir bactéricide. L'antibiotique de
référence a présenté un pouvoir
bactériostatique sur les souches d'entéropathogène avec
une CMI variant de 6,750,00 à 12,50,00.
Par rapport aux CMI, CMF et le pouvoir antifongique des
extraits testés sur les souches de Candida présentés dans
le tableau XXII, les CMI des extraits ont varié de 6,750,00
à 500,00 en fonction des souches. Les extraits ont
présenté des CMI faibles sur les souches sensibles par rapport
aux souches résistantes. L'antifongique de référence a
présenté un CMI variant de 6,750,00 à 12,50,00.Aucune CMF
et pouvoir antifongique n'ont été notés sur toutes les
souches de Candida testées.
Tableau XXI : CMI, CMB et
du pouvoir antibiotique des extraits de plante
|
Extraits
|
ANFrA
|
ANFA
|
TIFrA
|
TIFrE
|
ADFrA
|
ADEE
|
|
IMI
|
|
|
C
M
I
|
C
M
B
|
P.a
|
CMI
|
C
M
B
|
P.a
|
C
M
I
|
C
M
B
|
P.a
|
C
M
I
|
CMB
|
P.a
|
C
M
I
|
C
M
B
|
P.a
|
CM
I
|
CMB
|
P.a
|
C
M
I
|
C
M
B
|
P.a
|
|
S. aureus
|
12,50,00
|
-
|
-
|
12,50,00
|
-
|
-
|
12,50,00
|
-
|
-
|
6,750,00
|
-
|
-
|
9,63
4,07
|
-
|
-
|
50
|
-
|
-
|
12,5
|
6,75
|
1/2
|
|
SCN
|
12,50,00
|
-
|
-
|
12,50,00
|
-
|
-
|
12,50,00
|
-
|
-
|
6,750,00
|
-
|
-
|
12,5
0,00
|
-
|
-
|
500,00
|
-
|
-
|
12,5
|
6,75
|
1/2
|
|
K. pneumoniae
|
12,50,00
|
-
|
|
18,758,84
|
-
|
-
|
12,50,00
|
-
|
-
|
6,750,00
|
-
|
-
|
9,63
4,07
|
-
|
-
|
50
0,00
|
-
|
-
|
9,634,07
|
13,754,07
|
2
|
|
K. oxytoca
|
12,50,00
|
-
|
-
|
12,50,00
|
50
|
4
|
12,50,00
|
50
|
4
|
12,50,00
|
50
|
4
|
12,5
0,00
|
-
|
-
|
500,00
|
-
|
-
|
12,5
|
12,5
|
1
|
|
E. coli
|
9,634,07
|
12,5
|
2
|
12,50,00
|
-
|
-
|
9,634,07
|
-
|
-
|
6,750,00
|
50
|
7
|
12,5
0,00
|
50
|
2
|
500,00
|
-
|
-
|
12,5
|
25
|
2
|
|
E. cloacae
|
5,063,32
|
6,75
|
2
|
3,370,00
|
12,50,000
|
4
|
12,50,00
|
25
|
2
|
9,634,07
|
25
|
4
|
6,75
0,00
|
-
|
-
|
500,00
|
-
|
-
|
12,5
|
12,5
|
1
|
|
K. pneumoniae ATCC 25922
|
6,750,00
|
12,50,00
|
2
|
6,750,00
|
250,000
|
4
|
6,750,00
|
250,00
|
4
|
6,750,00
|
250,00
|
4
|
6,75
0,00
|
-
|
-
|
500,00
|
-
|
-
|
6,75
|
3,37
|
1/2
|
Légende : ANFA : Acacia
nilotica Feuille Aqueux?; ANFrA : Acacia nilotica Fruit
Aqueux?; ADEE : A. digitata Écorce Ethanolique?;
ADFrA : A. digitata Fruit Aqueux?; TIFrE : Tamarindus
indica Fruit Ethanolique?; TIFrA : Tamarindus indica Fruit
Aqueux ; IMI : ImipénèmeTableau XXII : CMI, CMF et
du pouvoir antifongique des extraits de plante
|
Extraits
|
ANFrA
|
ANFA
|
ADEE
|
|
|
CTZ
|
|
CMI
|
CMB
|
p.a
|
CMI
|
CMB
|
p.a
|
CMI
|
CMB
|
p.a.
|
CMI
|
CMB
|
p.a.
|
|
C. albicans S
|
12,50,00
|
-
|
-
|
250,00
|
-
|
-
|
500,00
|
-
|
-
|
12,50,00
|
-
|
-
|
|
C. albicans R
|
250,00
|
-
|
-
|
500,00
|
-
|
-
|
-
|
-
|
-
|
12,50,00
|
-
|
-
|
|
C. glabrata S
|
250,00
|
-
|
-
|
500,00
|
-
|
-
|
250,00
|
-
|
-
|
250,00
|
-
|
-
|
|
C. glabrata R
|
12,50,00
|
-
|
-
|
500,00
|
-
|
-
|
500,00
|
-
|
-
|
12,50,00
|
-
|
-
|
|
C. parapsilosis S
|
6,750,00
|
-
|
-
|
500,00
|
-
|
-
|
500,00
|
-
|
-
|
6,750,00
|
-
|
-
|
|
C. parapsilosis R
|
250,00
|
-
|
-
|
500,00
|
-
|
-
|
-
|
-
|
|
12,50,00
|
-
|
-
|
|
C. Krusei S
|
12,50,00
|
-
|
-
|
250,00
|
-
|
-
|
500,00
|
-
|
|
250,00
|
-
|
-
|
|
C. krusei R
|
250,00
|
-
|
-
|
500,00
|
-
|
-
|
500,00
|
-
|
|
250,00
|
-
|
-
|
|
C. albicans ATCC
|
12,50,00
|
-
|
-
|
250,00
|
-
|
-
|
500,00
|
-
|
|
6,750,00
|
-
|
-
|
Légende : ANFA : Acacia
nilotica Feuille Aqueux?; ANFrA : Acacia nilotica Fruit
Aqueux?; ADEE : A. digitata Écorce Ethanolique?;
CTZ : Cotrinazole.
3.1.6.
Détermination du pourcentage de déstabilisation des extraits sur
la membrane des souches
L'habilité des extraits de plante à
pénétrer la membrane des souches résistantes a
été évaluée pendant 24 h à deux
différentes concentrations (CMI et 2CMI). Il ressort d'après les
figures ci-après que les extraits ont présenté une
déstabilisation variable selon la souche testée par rapport
à la molécule de référence. A la CMI, le
pourcentage de déstabilisation sur les souches est plus
élevé qu'à la 2CMI. Les figures 16a?; 16 b?;
16c?; 16d?; 16e et 16f ci-après présentent les pourcentages de
déstabilisation des extraits de plantes actifs sur la membrane des
différentes souches de résistance. Les commentaires relatifs
à chaque figure sont présentés en a?; b?; c?; d?; e et
f.
a. Il ressort de la figure 16a que la
déstabilisation a été dépendante de la
concentration des extraits sur la membrane des souches de S.aureus
résistantes à la méthiciline (des souches ayant des
profils de résistantes différentes présentées en 1
et 2). Le pourcentage de déstabilisation des extraits à la CMI
n'a présenté aucune différence statistique par rapport
à la molécule de référence
(imipénème). Quant à la concentration 2CMI, la
déstabilisation a été généralement
supérieure à l'exception des extraits aqueux et
éthanolique du fruit de T. indica (P<0,05) par rapport
à la molécule de référence
(imipénème). La déstabilisation des extraits selon la
Concentration Minimale Inhibitrice (CMI) a montré qu'à CMI, le
pourcentage de déstabilisation est significativement supérieur
qu'à2CMI (p<0,05). Les meilleurs pourcentages de
déstabilisation aux concentrations CMI et 2CMI ont
été notés avec les extraits aqueux (CMI :
66,66#177;9,39 %?; 2CMI : 46,34#177;15,78 %) et
éthanolique (CMI : 47,11#177;14,93 %?; 2CMI :
47,11#177;14,93 %) du fruit de T. indica sur la membrane des
souches de S.aureus.
1
2
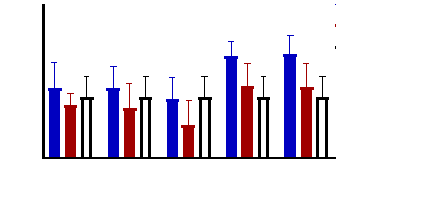 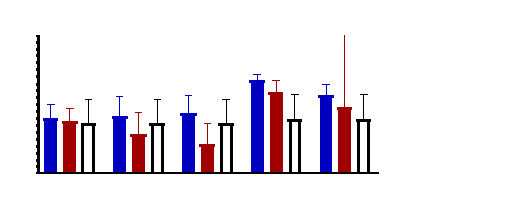
Figure 16 a :
Pourcentage de déstabilisation des extraits de plante sur la membrane
des souches S.aureus résistantes à la méthiciline
en fonction des concentrations
Légende :
Extrait 1 = A. digitata Fruit Aqueux?;
Extrait 2 = A. nilotica Fruit Aqueux?;
Extrait 3 = A. nilotica Feuille Aqueux?;
Extrait 4 = T. indica Fruit Ethanolique?;
Extrait 5 = T. indica Fruit Aqueux.
b. Il ressort de la figure 16 b que la
déstabilisation a été dépendante de la
concentration des extraits sur la membrane des souches de SCN
résistantes à la méthiciline (des souches ayant des
profils de résistantes différentes présentées en 1
et 2). Le pourcentage de déstabilisation des extraits à la CMI a
généralement été supérieur significativement
à la molécule de référence
(imipénème). Quant à la concentration 2CMI, la
déstabilisation a été généralement
significative à l'exception de l'extrait aqueux de la feuille de
A.niloticaayant présenté p>0,05 (non significatif).
La déstabilisation des extraits selon la Concentration Minimale
Inhibitrice (CMI) a montré qu'à CMI, le pourcentage de
déstabilisation est significativement supérieur qu'à 2CMI
(p<0,05). Les meilleurs pourcentages de déstabilisation aux
concentrations CMI et 2CMI ont été notés avec les
extraits éthanolique (CMI : 48,49#177;7,24 %?; 2CMI :
41,24#177;11,87 %) et aqueux (CMI : 45,39#177;13,72 %?;
2CMI : 27,14#177;11,88) du fruit de T. indica sur la membrane des
souches de SCNrésistantes à la
méthiciline.
1
2
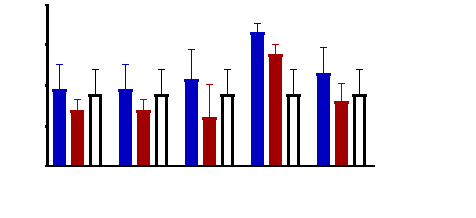 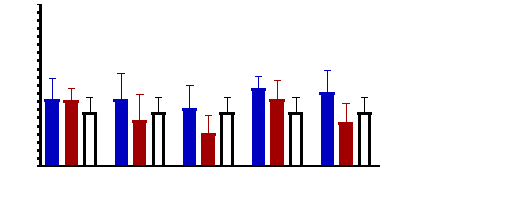
Fig 16b : Pourcentage de déstabilisation des
extraits de plante sur la membrane des souches Staphylococcus Coagulase
Négative résistantes à la méthiciline en
fonction des concentrations
Légende :
Extrait 1 = A. digitata Fruit Aqueux?;
Extrait 2 = A. nilotica Fruit Aqueux?;
Extrait 3 = A. nilotica Feuille Aqueux?;
Extrait 4 = T. indica Fruit Ethanolique?;
Extrait 5 = T. indica Fruit Aqueux.
c. Il ressort de la figure 16c que la
déstabilisation a été dépendante de la
concentration des extraits sur la membrane des souches de E. cloacae
résistantes (des souches ayant des profils de résistantes
différentes présentées en 1 et 2). Le pourcentage de
déstabilisation des extraits à la CMI a
généralement été significativementsupérieur
au pourcentage obtenu avec la molécule de référence
(imipénème). Quant à la concentration 2CMI, la
déstabilisation a été généralement
significativement inférieure à la molécule de
référence (imipénème) à l'exception des
extraits aqueux et éthanolique du fruit de T. indica
(P>0,05). La déstabilisation des extraits selon la Concentration
Minimale Inhibitrice (CMI) a montré qu'à CMI, le pourcentage de
déstabilisation est significativement supérieur qu'à 2CMI
(p<0,05). Les meilleurs pourcentages de déstabilisation aux
concentrations CMI et 2CMI ont été notés avec les
extraits aqueux de la feuille de A. nilotica(CMI :
66,96#177;9,86 %?; 2CMI : 20,54#177;9,99 %) et
éthanolique du fruit deT. indica(CMI :
77,20#177;4,10 %?; 2CMI : 61,42#177;8,06 %) sur la membrane des
souches de E. cloacae résistantes.
2
1
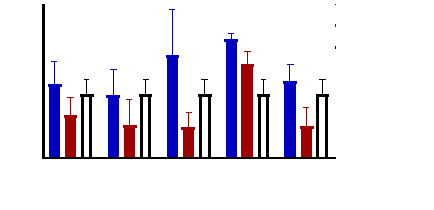 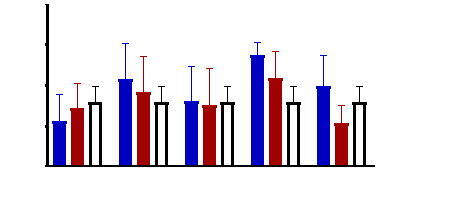
Fig 16c : Pourcentage de déstabilisation des
extraits de plante sur la membrane des souches de E.
cloacaerésistante en fonction des concentrations
Légende :
Extrait 1 = A. digitata Fruit Aqueux?;
Extrait 2 = A. nilotica Fruit Aqueux?;
Extrait 3 = A. nilotica Feuille Aqueux?;
Extrait 4 = T. indica Fruit Ethanolique?;
Extrait 5 = T. indica Fruit Aqueux.
d. Il ressort de la figure 16d que la
déstabilisation a été dépendante de la
concentration des extraits sur la membrane des souches de E. coli
résistantes (des souches ayant des profils de résistantes
différentes présentées en 1 et 2). Le pourcentage de
déstabilisation des extraits à la CMIa généralement
été significativement supérieurau pourcentage obtenu avec
la molécule de référence (imipénème). Quant
à la concentration 2CMI, la déstabilisation a
été significativementfaible comparativement à la
molécule de référence (P<0,05). La
déstabilisation des extraits selon la Concentration Minimale Inhibitrice
(CMI) a montré qu'à CMI, le pourcentage de déstabilisation
est significativement supérieur qu'à 2CMI (p<0,05). Les
meilleurs pourcentages de déstabilisation aux concentrations CMI et
2CMI ont été notés avec les extraits aqueux (CMI :
44,93#177;9,49 %?; 2CMI : 28,78#177;12,86 %) et
éthanolique (CMI : 54,87#177;6,34 %?; 2CMI :
43,85#177;13,40 %) de fruit de T. indica et l'extrait aqueux du
fruit de A. nilotica (CMI : 43,38#177;17,38 %?; 2CMI :
36,50#177;17,82 %) sur la membrane des souches de E. coli
résistantes.
2
1
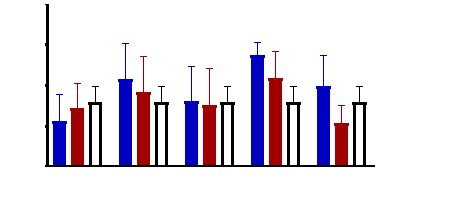 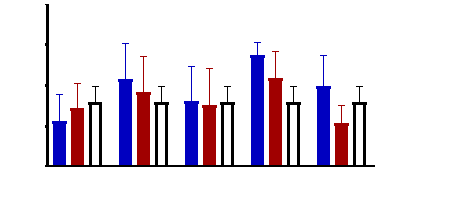
Fig 16d : Pourcentage de déstabilisation des
extraits de plante sur la membrane des souches de E. coli
résistantes à la méthiciline en fonction des
concentrations
Légende :
Extrait 1 = A. digitata Fruit Aqueux?;
Extrait 2 = A. nilotica Fruit Aqueux?;
Extrait 3 = A. nilotica Feuille Aqueux?;
Extrait 4 = T. indica Fruit Ethanolique?;
Extrait 5 = T. indica Fruit Aqueux.
e. Il ressort de la figure 16e que la déstabilisation a
étéindépendante de la concentration des extraits sur la
membrane des souches de K. pneumoniae résistantes (des souches
ayant des profils de résistantes différentes
présentées en 1?; 2 et la souche sensible de
référence en 3). Le pourcentage de déstabilisation des
extraits à la CMI a généralement été
significativement supérieur à la molécule de
référence (imipénème). Quant à la
concentration 2CMI, la déstabilisation a été
généralement significativement élevée(P<0,05)
à l'exception de l'extraitaqueux de feuille de A. nilotica
surla membrane d'une des souches testées. La déstabilisation des
extraits selon la Concentration Minimale Inhibitrice (CMI) a montré
qu'aucune différence significative n'a été observée
entre CMI et 2CMI (p>0,05). Le meilleur pourcentage de
déstabilisation obtenu aux concentrations CMI et 2CMI ont
été noté avec l'extrait éthanolique (CMI :
63,87#177;6,17 %?; 2CMI : 63,53#177;9,87 %) du fruit de T.
indica sur la membrane des souches de K. pneumoniae.
2
1
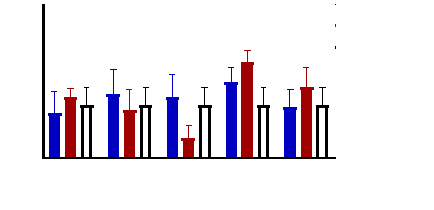 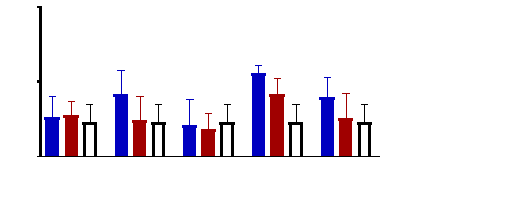
3
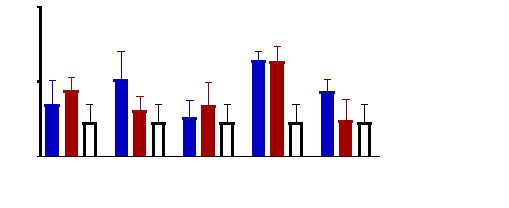
Fig 16e : Pourcentage de déstabilisation des
extraits de plante sur la membrane des souches de K. pneumoniae
résistantes à la méthiciline en fonction des
concentrations
Légende :
Extrait 1 = A. digitata Fruit Aqueux?;
Extrait 2 = A. nilotica Fruit Aqueux?;
Extrait 3 = A. nilotica Feuille Aqueux?;
Extrait 4 = T. indica Fruit Ethanolique?;
Extrait 5 = T. indica Fruit Aqueux.
f. Il ressort de la figure 16f que la
déstabilisation a été indépendante de la
concentration des extraits sur la membrane des souches de K. oxytoca
résistantes (des souches ayant des profils de résistantes
différentes présentées en 1 et 2). Le pourcentage de
déstabilisation des extraits à la CMI et 2CMI a
généralement été supérieur comparativement
à la molécule de référence
(imipénème) (P<0,05). La déstabilisation des extraits
selon la Concentration Minimale Inhibitrice (CMI) a montré qu'aucune
différence significative n'est observée entre CMI et 2CMI
(p>0,05). Les meilleurs pourcentages de déstabilisation aux
concentrations CMI et 2CMI ont été notés avec les
extraits éthanoliques du fruit de T. indica (CMI :
50,09#177;4,35 %?; 2CMI : 47,26#177;13,61 %) sur la membrane des
souches de K. oxytoca résistantes.
2
1
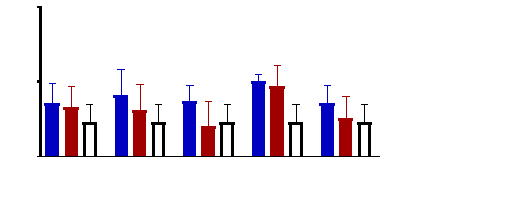 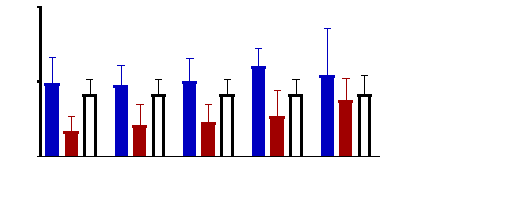
Fig 16f : Pourcentage de déstabilisation des
extraits de plante sur la membrane des souches de K. oxytoca
résistantes à la méthiciline en fonction des
concentrations
Souche K. oxytoca
3.2. Discussion
La présente étude vise à contribuer
à la lutte contre la résistance aux antimicrobiens au
Bénin. Il ressort de la présente étude que les extraits
éthanoliques et aqueuxde toutes les plantes ont présenté
des rendements à l'extraction variables selon la partie de la plante
étudiée. L'activité antimicrobienne évaluée
sur les souches entéropathogènes résistances aux BLSE et
les souches de S. aureus et SCN méticillino-résistantes
ont révélé que l'extrait éthanolique des
écorces et l'extrait aqueux des fruits de Adansonia digitata
ont présenté une meilleure activité sur les souches
de Staphylococcus aureus et Staphylococcus à Coagulase
Négative résistantes à la méticilline. En
conformité avec les résultats de Lagnika et al. (2012),
qui ont montré que tous les extraits de Adansonia digitata ont
inhibé la croissance de S. aureus résistante à la
méthicilline. Les mêmes extraits ont présenté
demeilleures zones d'inhibition sur les souches de K. pneumoniae, K.
oxytoca, E. coli et E. cloacae. D'après Ajiboye, A. digitata
a montréune certaine activité antibactérienne contre
Escherichia coli. Le résultat des activités
antibactériennes de l'écorce de la tige des extraits bruts
d'éthanol et d'eau de Adansonia digitata contre les isolats de
Escherichia coli a révélé une résistance
aux extraits à toutes les concentrations testées
(Ajiboye et al., 2020). Ces résultats sont
discutables d'autant plus que l'extrait éthanolique a inhibé la
croissance d'une des deux souches multirésistantes, mais est
resté sans effet sur la souche de référence E. coli.
Mais aussi, selon certains auteurs, l'activité de la plante varie
en fonction de la partie de la plante utilisée (Jame, 2019).Sur les
souches fongiques, l'extrait éthanolique des écorces de
Adansonia digitata a également présenté une bonne
activité antifongique sur toutes des souches résistantes et
virulentes cliniques testées (C. albicans, C. glabrata, C. krusei et
C. parapsilosis). L'activité antimicrobienneintéressante des
extraits de Adansonia digitata pourrait être due à la
présence de tanins et de flavonoïdes, car ceux-ci ont
déjà été signalés à l'origine des
activités antimicrobiennes (Datsugwai et Yusuf, 2017). Les
tanins sont des agents antimicrobiens connus qui pourraient inhiber la
croissance des microorganismes en précipitant la protéine
microbienne et en les privant ainsi des protéines nutritionnelles
nécessaires à leur croissance et à leur
développement (Jame, 2019). Quant aux flavonoïdes ayant
également été signalés possèdent de
nombreuses propriétés utiles, y compris les antimicrobiens et
antioxydantes (Kumar et al., 2015). Ces propriétés
confèrentà cet extrait (extrait éthanolique des
écorces de Adansonia digitata), une activité
antimicrobienne exploitable dans le contexte de la résistance
antimicrobienne.
En ce qui concerne les extraits de Tamarindus indica,
les extraits ont présenté une activité variable selon
les souches testées. Les extraits des feuilles (aqueux et
éthanolique), des écorces (étanolique) et des fruits
(aqueux et éthanolique) ont présenté une meilleure
inhibition sur toutes les souches de Staphylococcus aureus et de
Staphylocoque à Coagulase Négative résistantes
testées. Sur les souches entéropathogènes
résistantes testées, les extraits éthanolique des feuilles
et écorces ont montré une large zone d'inhibition sur les souches
de K. pneumoniae et sur une souche résistante aux BLSE de
E. coli et E. cloacae. Aussi, les extraits de fruit aqueux et
éthanolique ont présenté une bonne activité sur
toutes les souches entéropathogènes résistantes
testées. Quant à l'activité sur les champignons, seule une
souche de C. albicans résistante au fluconidazole a
été inhibée face à l'extrait éthanolique des
feuilles et l'extrait aqueux de l'écorce. Seule la souche de
référence a été inhibée par la
majorité des extraits. Les extraits éthanoliques de
l'écorce et de fruit n'ont eu aucune activité sur les souches
testées. Des études ont montré l'activité
antimicrobienne de différentes parties de T. indica contre
diverses souches de bactéries -'''''''''''''' (Diatta et
al., 2019?; Abdallah et Muhammad, 2018?; Escalona-Arranz et al.,
2010). D'après Abdallah et Muhammad, les extraits aqueux et
éthanolique ont été révélés
posséder une activité antimicrobienne puissante contre
Staphylococcus aureus -(Abdallah et Muhammad, 2018). Ce potentiel
antimicrobien des extraits de graines de la plante contre également le
staphylocoque doré multirésistant à la méthicilline
(MDR-MRSA) a été montré avec les extraits
éthanoliques (Yang et Zezhi, 2009). D'autres études
réalisées sur les extraits de feuilles et de fruits de T.
indica testés contre les isolats cliniques de Escherichia coli
dans les selles ont montré que l'extrait éthanolique a une
activité maximale par rapport à l'extrait aqueux (Escalona-Arranz
et al., 2010). Ces études réalisées en
conformité avec la présente étude ont prouvé la
capacité des extraits de T. indica sur les souches
résistantes et surtout des extraits de fruit de cette plante. Ces
résultats se justifieraient par la richesse en composés chimiques
de la plante.
En ce qui concerne Acacia nilotica, les extraits
aqueux des feuilles, des fruits et l'extrait éthanolique de
l'écorce ont présenté de meilleures activités sur
toutes les souches testées (bactéries et champignons).
L'activité des autres extraits a été variable selon la
souche résistante testée, mais majoritaire sur toutes les souches
de K. pneumoniae, sur une souche de E. coli et une souche de
E. cloacae résistantes aux BLSE. Les extraits
éthanoliques bruts ont montré des activités
antimicrobiennes contre les souches multirésistantes de Escherichia
coli et Klebsiella pneumoniaedans l'étude réalisée
par Khan et al. (2009). De même, l'extrait de la plante a
réduit de manière significative l'activité du biofilm de
E. coli, K. pneumoniae, des isolats multirésistants des
échantillons d'urines et contenant des gènes de résistance
blaTEM, blaSHV, blaCTX - - (Elamary et al., 2020). Ces
résultats sont similaires à ceux issus de la présente
étude. L'utilisation d'extrait aqueux de gousses de Acacia
nilotica a exposé une activité antibactérienne contre
Escherichia coli et Staphylococcus aureus (Farzana et al.,
2014). De la même manière, Khan et al. (2009) a
exposé l'activité antifongique d'extraits éthanoliques
contre des souches multirésistantes (MDR) de Candida. L'activité
antimicrobienne intéressante des extraits de Acacia nilotica
pourrait être due à la présence de tanins et de
flavonoïdes, car ceux-ci ont déjà été
signalés à l'origine des activités antibactériennes
et antifongiques de ceux-ci (Datsugwai et Yusuf, 2017).
En plus, l'activité antifongique des extraits sur les
souches de Candida présentant les facteurs de virulence
lécithinase, hémolysine, Biofilm, Exopolysaccharide et
adhésion a été variable selon les types de facteurs de
virulence en jeu. Selon Goncalves et al. (2016), ces facteurs sont
à l'origine de la pathogénicité des souches. Ainsi, la
capaciteì des Candida aÌ adhérer aux tissus (gra^ce aux
adheìsines qui sont des reìcepteurs proteìiques
situeìs sur la membrane de la levure), aÌ secréter des
protéases et les phospholipases (qui dégradent les tissus
eìpitheìliaux de l'ho^te pour favoriser l'invasion des levures),
aÌ changer de morphologie (passage de la forme levure aÌ la forme
filamenteuse), la capacitéì aÌ résister aux
antifongiques par la formation de biofilm, aÌ moduler la défense
de l'ho^te constituent les déterminants majeurs de leur
pathogeìniciteì (Sabra, 2013). En effet, d'après nos
résultats, il a été observé que les extraits aqueux
de fruit et d'écorce de A. digitata n'ont
présenté aucune activité antifongique sur les souches
présentant le facteur lécithinase et hémolysine. Par
contre, en ce qui concerne l'activité antifongique des extraits sur les
souches virulentes présentant le facteur biofilm, les extraits
ethanoliques des feuilles et aqueux d'écorce de A. digitata ont
montré une bonne activité. Quant aux facteurs exopolysaccharide
et adhésion, l'extrait éthanolique de l'écorce et du fruit
de A. digitata a présenté une meilleure activité.
Face aux souches présentant le facteur gélatine, tous les
extraits de A. digitata ont été non actifs. Quant
à l'activité antifongique de Acacia nilotica, les
extraits ont présenté une bonne activité aussi bien sur
les souches présentant et non le facteur lécithinase. Les
résultats sur les facteurs exo polysaccharide, adhésion et
gélatine sont similaires. Pour les extraits de T. indica sur
les souches fongiques, une faible activité a été
observée au niveau des souches présentant le facteur de virulence
Adhésion. Seuls les extraits éthanoliques de feuille et aqueux de
l'écorce de T. indica ont présenté une
activité sur les souches présentant la virulence à la
lécithinase. Aucune activité n'a été notée
sur les souches présentant la virulence à la gélatine en
ce qui concerne les extraits de T. indica. Ces résultats
prouvent que l'expression d'un facteur de virulence dépend de la souche
en cause de l'infection, car les facteurs en question peuvent être
liés conduisant à la virulence de la souche. Le facteur
adheìsion constitue la première étape de l'expression de
la virulence des Candida. Elle contribue aÌ la persistance du
microorganisme au sein de l'hôte et est essentielle dans
l'établissement de l'infection. Ce facteur est lié à
l'hydrophobicité des souches, car selon de nombreuses études,
plus les souches sont hydrophobes, plus elles adhèrent aux cellules
(Goncalves et al., 2016?; Goswami et al., 2017). Le facteur
biofilm quant à lui associé à l'exopolymérase
augmente la capaciteì des souches de Candida aÌ coloniser,
protéger les levures contre les attaques immunologiques (Mba et Nweze,
2020), favoriser la prolifération des espèces, la diffusion des
nutriments, protège les levures de la réponse immunitaire de
l'ho^te et est ainsi impliquée dans la majoriteì des infections
associées aux Candida.
En ce qui concerne le mécanisme d'action de ces
extraits, plusieurs souches ont été utilisées pour
étudier le mode d'action des extraits actifs en relation avec
différentes souches bactériennes testées. Dans la
présente étude, le test de perméabilité de la
membrane externe des bactéries a été adopté pour
évaluer le mode d'action des extraits aqueux et éthanoliques du
fruit de Tamarindus indica, les extraits aqueux des feuilles et fruits
de Acacia nilotica et les extraits éthanolique de
l'écorce et aqueux du fruit de Adansonia digitata contre K.
pneumoniae ATCC 25922, E. coli, S. aureus, SCN, E. cloacae, K. pneumoniae
et K. oxytoca des souches impliquées dans les maladies
infectieuses. Les données obtenues ont mis en évidence un
potentiel de déstabilisation de la membrane des souches
bactériennes des extraits testés avec un meilleur effet par
rapport à l'imipenème utilisé comme molécule de
référence. Ces observations reflètent que les extraits ont
un mode d'action important sur la déstabilisation de la membrane externe
des souches bactériennes testées. Aussi, la
déstabilisation a été dépendante de la
concentration des extraits sur la membrane des souches de S. aureus
et SCN résistantes à la méthiciline, E.
coli, E. cloacae mais, indépendante surla membrane des souches
de K. oxytoca et K. pneumoniae. Ceci signale que les extraits
pourraient être administrés à la CMI sur les souches de
S. aureus et SCN résistantes à la
méthiciline, E. coli, E. cloacae. Par contre elle pourrait
varier entre CMI et 2CMI sur les souches de K.oxytoca et K.
pneumoniae résistantes. L'effet de ces extraits sur la
déstabilisation membranaire des souches pourrait être
attribué à la composition phytochimique des extraits. En effet,
les composés phénoliques (flavonoïdes, tanins, etc.) et
terpénoïdes ont été rapportés être
à l'origine de la déstabilisation et de la perturbation des
interactions entre les molécules de lipopolysacharides. En effet, ces
composés phénoliques sont capables de déstabiliser la
membrane externe des bactéries en complexant les cations divalents qui
la stabilisent (Frirdich et Whitfeld 2005?; Vaara 1992). Cette action
antibactérienne résulte de l'éclatement de la membrane
cytoplasmique et des modifications de l'homéostasie ionique entre les
compartiments intracellulaire et extracellulaire des bactéries
Gramnégatifs (Trombetta et al., 2005). Ainsi, les
antigènes de la membrane responsables de la virulence des
bactéries seront affectés expliquant ainsi, l'effet
déstabilisant des extraits de ces plantes pour la membrane
bactérienne des souches testées.
L'étude de l'innocuité des extraits a
montré que tous les extraits ont une CL50
supérieure à 0,1 mg/ml à l'exception des
feuilles et des fruits de Adansonia digitata qui ont
présenté une toxicité modérée. Les extraits
de plantes étudiés sont donc non toxiques sur les larves de
Artemia salina selon l'échelle proposée par Moshi
-(Moshi et al., 2004). D'après l'étude de -Abdelmageed
(2019) ayant porté sur la cytotoxicité de l'extrait aqueux et
d'éthanol des fruits de Adansonia digitata, il a
été révélé que les composés solubles
dans ces extraits sont toxiques pour les cellules dermiques. Quant aux extraits
de Acacia nilotica et Tamarindus indica, non toxiques
étudiés sur les différentes parties de ces plantes, les
résultats sont en conformité avec ceux trouvés in vivo
par Escalona-Arranz et al. (2016) et
''''''''''''Traoré, (2020) pour Tamarindus indica.
Malgré la contradiction de certains auteurs ayant rapporté une
toxicité aiguë chez la souris de l'extrait brute aqueux de
l'écorce après quatorze jours d'étude (Escalona-Arranz
et al., 2016), les résultats de la présente étude
prouvent que la plante est non toxique. Acacia nilotica non toxique a
été confirmé par l'étude de Mamanet al.
(2019). Néanmoins, ces études mettent en doute la grande
richesse en composé chimique pouvant induire des effets toxiques.
Malgré la présence de ces composés chimiques, la
présente étude n'a montré aucune toxicité
cellulaire des extraits sur les larves de Artemia salina. Ces
résultats constituent une preuve de la non toxicité de la plante.
Aussi, le test de cytotoxicité constitue une présélection
pour déterminer non seulement le degré de cytotoxicité
d'un produit, mais aussi la présence de composés
anticancéreux potentiels. Ces données prouvent qu'il y a une
corrélation positive entre la mortalité des larves de Artemia et
la cytotoxicité contre les cellules KB (McLaughlin et al.,
1993). Malgré que certains auteurs prétendent qu'il n'y a pas de
corrélation entre le test de cytotoxicité et les effets
toxicologiques sur un animal entier (Lègba et al., 2018). De
plus, pour des auteurs ayant étudié l'effet de 20 extraits
de plantes testés in vivo (souris) et in vitro -(Parra
et al., 2001), une bonne corrélation (r = 0,85, P
<0,05) a été observée, ce qui suggère que
le test de cytotoxicité est une alternative relativement utile du
modèle de toxicité.
Les résultats issus de la présente étude
sont d'un grand intérêt, car ont permis de mettre l'accent sur
quelques plantes à fruit présentant une bonne activité
antimicrobienne sur les souches résistantes aux antimicrobiens.
D'après ces résultats, les extraits aqueux des fruits ont
présenté une meilleure activité antibactérienne.
L'extrait aqueux est très connu et consommé comme jus de fruit
par la population (Tamarindus indica, Adansonia digitata). Cet extrait
possède un grand potentiel thérapeutique démontré
par la présente étude et mérite d'être
valorisé pour un usage perpétué. Il serait
nécessaire de modérer cet usage, car ces plantes ne sont pas
exemptes de toxicité (Adansonia digitata). Néanmoins,
cette étude constitue un pont pour d'autres perspectivesd'études
orientées vers
l'étude du mécanisme d'extraction des
composés chimiques actifs sur les souches résistantes. Aussi, il
serait intéressant d'envisager d'éventuelle possibilité de
combinaison avec les médicaments inactifs pour la lutte contre la
résistance aux antimicrobiens.
CONCLUSION
Ce travail rentre dans le cadre de l'exploration des plantes
à fruit de la flore béninoise face à la résistance
aux antimicrobiens. Il a viséàétudier l'activité
antibactérienne et antifongique de l'écorce, de la feuille et du
fruit de Adansonia digitata L., Tamarindus Indica L.
et Acacia nilotica(L.) Willd. ancien Delilesur des
souchesrésistantes aux antimicrobiens. L'activité antimicrobienne
de ces plantes a été appréciée notamment sur des
souches bactériennes (Staphylocoque à Coagulase Négative
(SCN), S. aureus, E. coli, K. pneumoniae, K. oxytoca, E. cloacae) et
de Candida (C. albicans, C. krusei, C. parapsilosis, C.
glabrata)résistantes.
L'étude a ressortiune absence de cytotoxicité
larvaire des différents extraits testés à l'exception des
extraits de fruits et de feuilles de A. digitata qui ont
présenté une toxicité modérée. L'extrait
aqueux des fruits a présenté une meilleure activité
antibactérienne. Cet extrait très consommé comme jus de
fruit par la population (Tamarindus indica, Adansonia digitata)
possède un grand potentiel antimicrobien démontré par la
présente étude et mérite d'être valorisé pour
un usage perpétué. Les données obtenues sur le
mécanisme d'actionont confirmé le potentiel de
déstabilisation de la membrane des souches bactériennes des
extraits testés avec un meilleur effet par rapport à
l'Imipenème utilisé comme molécule de
référence.
Cette étude a ainsi démontré que
l'utilisation de ces plantes comme une alternative face à la
résistance aux antimicrobiens est justifiée. Les résultats
obtenus font de ces plantes de bons candidats pour le développement de
médicaments traditionnels améliorés dans le contexte de la
résistance aux antimicrobiens. Les fruits de ces plantes constitueraient
donc une bonne alternative à l'antibiothérapie face à la
résistance aux antimicrobiens observée ce jour. Il s'avère
très important d'effectuer diverses investigations sur les
propriétés nécessaires à une meilleure
qualification de ces plantes afin de minimiser tout risque à la
santé.
REFERENCES BIBLIOGRAPHIQUES
Abdalla, A. A., Mustafa, M. I., Makhawi, A. M.,
2020. Phytochemical screening and antimicrobial activities studies of
Acacia nilotica fruit cover | bioRxiv [WWW Document]. URLhttps :
//www.biorxiv.org/content/10.1101/2020.02.11.943456v1.abstract (accessed
9.9.21).
Abdallah, M.S., Muhammad, A., 2018. Antibacterial activity of
leaves and fruit extract of Tamarindus indica against clinical
isolates of Escherichia coli and Shigella at Potiskum Yobe state,
Nigeria. J Anal Pharma Res 7, 606-609.
Abdelmageed, M., 2019. Phytochemical analysis, antioxidant,
cytotoxicity and antibacterial activity of Adansonia digitata L. seeds
ethanol extract. J. Pharmacogn. Phytochem. 8, 776-781.
Abdelrhman, T.E.K., Adam, Y.O., 2020. Value chain analysis of
baobab (Adansonia digitata L.) fruits in blue Nile state, Sudan.
Agric. For. J. 4, 131-138.
Abdoulaye, T., Claude, K.A.L., Constant, A.A.R., Faustin,
K. A., Marcelline, A. N., Barthélémy, A. K., 2018.
Antibacterial and acute toxicity studies of culinary leaves from Adansonia
digitata L.(Malvaceae) and Amaranthus cruentus L.(Amaranthaceae)
growing in Côte d'Ivoire.
Adeniyi, O. V., Olaifa, F. E., Emikpe, B. O.,
Ogunbanwo, S. T., 2017. Phytochemical components and antibacterial
activity of Tamarindus indica Linn. extracts against some pathogens.
Biotechnol. J. Int. 1-9.
Agbankpe, J.Dougnon V., Koudokpon H., Klotoe J. R., Segbo J.et
Baba-Moussa L., 2016. In Vitro Antibacterial Effects of Crateva adansonii,
Vernonia amygdalina and Sesamum radiatum Used for the Treatment of
Infectious Diarrhoeas in Benin. J. Infect. Dis. Ther. 4.
https://doi.org/10.4172/2332-0877.1000281
Ahmad, A., Ahmad, W., Zeenat, F., Sajid, M., 2018.
Therapeutic, phytochemistry and pharmacology of Tamarindus indica: A review.
Int. J. Unani Integr. Med. 2, 14-19.
Ahoyo, A.-T., Baba-Moussa, L., Makoutode, M., Gbohoun, A.,
Bossou, R., Dramane, K., Sanni, A., Prévost, G., 2006. [Incidence of
meticillin-resistant Staphylococcus aureus in neonatal care unit of
departmental hospital centre of Zou Collines in Benin]. Arch. Pediatr. Organe
Off. Soc. Francaise Pediatr. 13, 1391-1396.
https://doi.org/10.1016/j.arcped.2006.07.004
Ajiboye, A. E., Sadiq, S. O., Adedayo, M. R.,
2020. Antimicrobial activity and phytochemical screening of Adansonia
digitata stem bark extract on some clinical isolates. Ife J. Sci. 22,
035--044. https : //doi.org/10.4314/ijs.v22i2.4
Akoma, O.A., Nma, N.Y., Musa, S.A., Salihu, A.B., 2018.
Nutritional and phytochemical composition of Vitellaria paradoxa (Shea
Fruit Pulp). Int. J. Biochem. Res. Rev. 1-7.
Akouétévi, G. T., Bouraïma, D.,
Simplice, D. K., Ségla, T., Yaovi, A., Comlan, de S., 2017.
Prévalence des souches d'entérobactéries productrices de
bêtalactamases à spectre élargi isolées au Togo et
de leur sensibilité aux antibiotiques | International Journal of
Biological and Chemical Sciences [WWW Document]. Int. J. Biol. Chem. Sci. URL
https : //www.ajol.info/index.php/ijbcs/article/view/161889 (accessed
10.10.21).
Alanio, Renaudat, Bretagne, 2014. Epidemiology of fungal
resistance: Impact of antifungal treatments.
Al-Juhaimi, F. Y., Almusallam, I.A., Ahmed, I.A.M.,
Ghafoor, K., Babiker, E.E., 2020. Potential of Acacia nilotica fruit
flesh extract as an anti-oxidative and antimicrobial agent in beef burger. J.
Food Process. Preserv. 44, e14504. https://doi.org/10.1111/jfpp.14504
Allen, U., 2010. Les antifongiques pour le traitement des
infections fongiques systémiques chez les enfants. Paediatr. Child
Health 15, 609-615.
Alsubhi, W., 2019. Antifungal Properties of Citrullus
colocynthis Leaves Extracts Against Vaginal Candida Infection. Adv. Environ.
Biol. https : //doi.org/10.22587/aeb.2019.13.2.1
Ambe, A.S.A., Ouattara, D., Tiebre, M.-S., Zirihi, G.N.,
N'Guessan, K.E., 2015. Diversité des plantes médicinales
utilisées dans le traitement traditionnel de la diarrhée sur les
marchés d'Abidjan (Côte d'Ivoire). . Vol. 16.
Amsaveni, V., Sudha, S.S., 2009. Antibacterial activity of
different plant extracts on Pseudomonas aeruginosa. Asian J.
Microbiol. Biotechnol. Environ. Sci. 11, 947-949.
Assam, J.P.A., Tcham, M.F.Y., Moni, N.E.D.F., Betote, D.P.H.,
Fossi, T. C., Penlap, B. V., 2020. Phytochemical screening,
Antimycobacterial activity of three medicinal Cameroonians plants and Acute
toxicity of hydroethanolic extract of Vitellaria paradoxa. J. Drug
Deliv. Ther. 10, 96-104. https://doi.org/10.22270/jddt.v10i1-s.3848
Atuadu, V., Benneth, B.-A., Oyem, J., Esom, E., Mba, C., Nebo,
K., Ezemeka, G., Anibeze, C., 2021. Adansonia digitata L. leaf extract
attenuates lead-induced cortical histoarchitectural changes and oxidative
stress in the prefrontal cortex of adult male Wistar rats. Drug Metab. Pers.
Ther. 36, 63-71.
Azad, S., 2018a. Tamarindo--Tamarindus indica, in:
Rodrigues, S., de Oliveira Silva, E., de Brito, E.S. (Eds.), Exotic Fruits.
Academic Press, pp. 403--412. https :
//doi.org/10.1016/B978-0-12-803138-4.00055-1
Baka, K.H., Bagueri, M., Lakmichi, M., Dahami, Z., Moudouni,
M., Sarf, I., 2015. État des lieux de l'antibio-résistance des
germes uropathogènes sur une décennie. Prog. En Urol., 109e
Congrès français d'urologie 25, 810-811.
https://doi.org/10.1016/j.purol.2015.08.188
Baxter, H., Harborne, J. B., Moss, G. P., 1998.
Phytochemical dictionary: a handbook of bioactive compounds from plants. CRC
press.
Ben Ayed, H., Koubaa, M., Hammami, F., Marrakchi, C., Rekik,
K., Ben Jemaa, T., Maaloul, I., Yaich, S., Damak, J., Ben Jemaa, M., 2019.
Performance of an Easy and Simple New Scoring Model in Predicting
Multidrug-Resistant Enterobacteriaceae in Community-Acquired Urinary Tract
Infections. Open Forum Infect. Dis. 6, ofz103.
https://doi.org/10.1093/ofid/ofz103
Besco, E., Braccioli, E., Vertuani, S., Ziosi, P., Brazzo, F.,
Bruni, R., Sacchetti, G., Manfredini, S., 2007. The use of
photochemiluminescence for the measurement of the integral antioxidant capacity
of baobab products. Food Chem. 102, 1352-1356.
Bonouman-Ira, V., Angora, E., Djohan, V., Vanga-Bosson, H.,
Sylla-Thanon, K., Beourou, S., Touré, A., Faye-Ketté, H., Dosso,
M., Koné, M., 2011. Profil de résistance des candida non albicans
à abidjan en 2015.
Braca, A., Sinisgalli, C., De Leo, M., Muscatello, B., Cioni,
P.L., Milella, L., Ostuni, A., Giani, S., Sanogo, R., 2018. Phytochemical
Profile, Antioxidant and Antidiabetic Activities of Adansonia digitata
L. (Baobab) from Mali, as a Source of Health-Promoting Compounds. Mol.
Basel Switz. 23, E3104. https://doi.org/10.3390/molecules23123104
Breurec, S., Guessennd, N., Timinouni, M., Le, T. a. H., Cao,
V., Ngandjio, A., Randrianirina, F., Thiberge, J.M., Kinana, A., Dufougeray,
A., Perrier-Gros-Claude, J.D., Boisier, P., Garin, B., Brisse, S., 2013.
Klebsiella pneumoniae resistant to third-generation cephalosporins in five
African and two Vietnamese major towns: multiclonal population structure with
two major international clonal groups, CG15 and CG258. Clin. Microbiol. Infect.
Off. Publ. Eur. Soc. Clin. Microbiol. Infect. Dis. 19, 349-355.
https://doi.org/10.1111/j.1469-0691.2012.03805.x
Breurec, S., Zriouil, S.B., Fall, C., Boisier, P., Brisse, S.,
Djibo, S., Etienne, J., Fonkoua, M.C., Perrier-Gros-Claude, J. D.,
Pouillot, R., Ramarokoto, C.E., Randrianirina, F., Tall, A., Thiberge, J.M.,
Working Group on Staphylococcus aureus infections, Laurent, F., Garin,
B., 2011. Epidemiology of methicillin-resistant Staphylococcus aureus
lineages in five major African towns: emergence and spread of atypical clones.
Clin. Microbiol. Infect. Off. Publ. Eur. Soc. Clin. Microbiol. Infect. Dis. 17,
160-165. https://doi.org/10.1111/j.1469-0691.2010.03219.x
Brolund, A., 2014. Overview of ESBL-producing
Enterobacteriaceae from a Nordic perspective. Infect. Ecol. Epidemiol. 4.
https://doi.org/10.3402/iee.v4.24555
Bussmann, R.W., Paniagua-Zambrana, N.Y., Njoroge, G.N., 2021.
Adansonia digitata L. M alvaceae. Ethnobot. Mt. Reg. Afr. 111-117.
CA-SFM, 2020. Comité de l'antibiogramme de la
Société Française de Microbiologie
Recommandations 2020.
Chadare, F.J., Linnemann, A.R., Hounhouigan, J.D., Nout,
M.J.R., Van Boekel, M. a. J.S., 2009. Baobab food products: a review on their
composition and nutritional value. Crit. Rev. Food Sci. Nutr. 49, 254-274.
https://doi.org/10.1080/10408390701856330
Chimsah, F. A., Nyarko, G., Abubakari, A. H., 2020.
A review of explored uses and study of nutritional potential of tamarind
(Tamarindus indica L.) in Northern Ghana.
Cuenca-Estrella, 2014. Antifungal drug resistance mechanisms
in pathogenic fungi: from bench to bedside--PubMed [WWW Document].
https://doi.org/10.1111/1469-0691.12495
Dannaoui, Desnos olovier, Garcia-Hermoso, et al.,
2010. Candida spp. with Acquired Echinocandin Resistance, France, 2004-2010
[WWW Document]. URL https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3310099/
(accessed 12.14.21).
Datsugwai, M.S.S., Yusuf, A.S., 2017. Phytochemical analysis
and antimicrobial activity of baobab (Adansonia digitata) leaves and
stem bark extracts on Staphylococcus aureus and Escherichia coli. J.
Biosci. Biotechnol. 6, 9-16.
Dhanasree, B., Anuradha, C. M., Nizamuddin, B. S.,
Kumar, C. S., 2020. Antioxidant biochemical enzyme activities of
Adansonia digitata L. in ulcer induced experimental male Wistar
rats.
Diatta, B.D., Houël, E., Gueye, M., Niass, O., Boetsch,
G., 2019. Activités antimicrobiennes des plantes utilisées comme
bâtonnets frotte-dents (cure-dents) par les Peul de la commune de
Tessékéré (Ferlo Nord, Sénégal). Int. J.
Biol. Chem. Sci. 13, 1444-1457. https://doi.org/10.4314/ijbcs.v13i3
Diene, S.M., Fall, B., Kempf, M., Fenollar, F., Sow, K.,
Niang, B., Wade, B., Raoult, D., Rolain, J.-M., 2013. Emergence of the OXA-23
carbapenemase-encoding gene in multidrug-resistant Acinetobacter baumannii
clinical isolates from the Principal Hospital of Dakar, Senegal. Int. J.
Infect. Dis. IJID Off. Publ. Int. Soc. Infect. Dis. 17, e209-210. https :
//doi.org/10.1016/j.ijid.2012.09.007
Dougnon, T.V., Hounsa, E., Agbodjento, E., Koudokpon, H.,
Legba, B., Fabiyi, K., Afaton, A., Sintondji, K., Akpode, B., Klotoé,
J.R., Tchobo, F., Bankole, H., Dougnon, T.J., 2021. Toxicological
Characterization of Ten Medicinal Plants of the Beninese Flora Used in the
Traditional Treatment of Diarrheal Diseases. Evid.-Based Complement. Altern.
Med. ECAM 2021, 6676904. https://doi.org/10.1155/2021/6676904
Dougnon, V., 2013. Cytotoxicity of Leaves and Fruits of
Solanum macrocarpon Linn (Solanaceae) against shrimp larvae (Artemia salina
Leach) 2, 6-9.
Duhaimi, F., Babtain, I., Ahmeda, M., Omer N.Alsawmahia Kashif
Ghafoora Oladipupo Q.Adiamob Elfadil E.Babikera, 2020. Assessment of oxidative
stability and physicochemical, microbiological, and sensory properties of beef
patties formulated with baobab seed (Adansonia digitata)
extract--ScienceDirect [WWW Document]. URL
https://www.sciencedirect.com/science/article/abs/pii/S0309174019311179
(accessed 6.18.21).
Duval, V., Maiga, I., Maiga, A., Guillard, T., Brasme, L.,
Forte, D., Madoux, J., Vernet-Garnier, V., De Champs, C., 2009. High prevalence
of CTX-M-type beta-lactamases among clinical isolates of Enterobacteriaceae in
Bamako, Mali. Antimicrob. Agents Chemother. 53, 4957-4958.
https://doi.org/10.1128/AAC.00675-09
Elamary, R.B., Albarakaty, F.M., Salem, W.M., 2020. Efficacy
of Acacia nilotica aqueous extract in treating biofilm-forming and
multidrug resistant uropathogens isolated from patients with UTI syndrome. Sci.
Rep. 10, 11125. https://doi.org/10.1038/s41598-020-67732-w
Eltahir, M. E., Elsayed, M. E., 2019. Adansonia
digitata: phytochemical constituents, bioactive compounds, traditional and
medicinal uses, in: Wild Fruits: Composition, Nutritional Value and Products.
Springer, pp. 133-142.
Escalona Arranz, J., Pérez-Rosés, R., Urdaneta,
I., Camacho, M., Rodriguez Amado, J.R., Licea-Jiménez, I., 2010.
Antimicrobial activity of extracts from Tamarindus indica L. leave.
Pharmacogn. Mag. 6, 242-7. https://doi.org/10.4103/0973-1296.66944
Escalona-Arranz, J.C., Perez-Rosés, R.,
Rodríguez-Amado, J., Morris-Quevedo, H.J., Mwasi, L.B.,
Cabrera-Sotomayor, O., Machado-García, R., Fong-Lórez, O.,
Alfonso-Castillo, A., Puente-Zapata, E., 2016. Antioxidant and toxicological
evaluation of a Tamarindus indica L. leaf fluid extract. Nat. Prod.
Res. 30, 456-459. https://doi.org/10.1080/14786419.2015.1019350
Essack, Desta, Abotsi, Agoba, 2016. Antimicrobial resistance
in the WHO African region: current status and roadmap for action | Journal of
Public Health | Oxford Academic [WWW Document]. URL
https://doi.org/10.1093/pubmed/fdw015 (accessed 11.2.21).
Eyong, K.O., Foyet, H.S., Baïrys, G., Ngosong Folefoc,
G., Acha Asongalem, E., Lagojda, A., Lamshöft, M., 2015. A new ursane
triterpenoic acid and other potential anti-inflammatory and anti-arthritic
constituents from EtOAc extracts of Vitellaria paradoxa stem bark. J.
Ethnopharmacol. 174, 277-286. https://doi.org/10.1016/j.jep.2015.08.014
Farzana, M. U. Z. N., Tharique, I. A.,
Sultana, A., 2014. A review of ethnomedicine, phytochemical and pharmacological
activities of Acacia nilotica (Linn) willd. J. Pharmacogn. Phytochem.
3, 84-90.
Ghaddar, N., Anastasiadis, E., Halimeh, R., Ghaddar, A., Dhar,
R., AlFouzan, W., Yusef, H., El Chaar, M., 2020. Prevalence and antifungal
susceptibility of Candida albicans causing vaginal discharge among
pregnant women in Lebanon. BMC Infect. Dis. 20, 32.
https://doi.org/10.1186/s12879-019-4736-2
Gimba, S.N., Anka, Z.M., Bulakarima, H.U., Kachallah, F.,
2019. Pharmacological Activities of Baobab (Adansonia digitata).
Gingembre, Z., 2015. Les plantes médicinales,
Officinale Roscoe Fleur. France.
Glew, R. S., Vanderjagt, D. J., Chuang, L. T.,
Huang, Y. S., Millson, M., Glew, R. H., 2005. Nutrient content of
four edible wild plants from West Africa. Plant Foods Hum. Nutr. 60, 187-193.
https://doi.org/10.1007/s11130-005-8616-0
Gonçalves, B., Ferreira, C., Alves, C. T.,
Henriques, M., Azeredo, J., Silva, S., 2016. Vulvovaginal candidiasis:
Epidemiology, microbiology and risk factors. Crit. Rev. Microbiol. 42, 905-927.
https://doi.org/10.3109/1040841X.2015.1091805
Grollier C., D.C., 1998. Principales caractéristiques
et voies de valorisation du tamarin [WWW Document]. URL
http://publications.cirad.fr/une_notice.php?dk=390334 (accessed 10.20.21).
Guede-Guina, F., Wangah-Manda, M., Bonga, G.M., De Souza, C.,
1995. Activité antimicrobienne d'un extrait végétal contre
les germes opportunistes au cours du SIDA. Rev Méd Pharm Afr 9,
13-19.
Guinea, n.d. Global trends in the distribution of Candida
species causing candidemia--PubMed [WWW Document]. URL
https://pubmed.ncbi.nlm.nih.gov/24506442/ (accessed 12.14.21).
Hao, G., Shi, Y.-H., Tang, Y.-L., Le, G.-W., 2009. The
membrane action mechanism of analogs of the antimicrobial peptide
Buforin 2. Peptides 30, 1421-1427.
https://doi.org/10.1016/j.peptides.2009.05.016
Hara, T., Sato, T., Horiyama, T., Kanazawa, S., Yamaguchi, T.,
Maki, H., 2015. Prevalence and molecular characterization of CTX-M
extended-spectrum â-lactamase-producing Escherichia coli from 2000 to
2010 in Japan. Jpn. J. Antibiot. 68, 75-84.
Havyarimana, C., 2020. Plantes anti-malaria et anti-moustiques
au Burundi?: Ethnobotanique et perspectives de conservation 62.
Hoellinger, P., 2017. Prévention des infections
urinaires par les plantes (other). Université de Lorraine.
Ilavarasan, R., Vadivelu, L., Vadivelu, L., Vadivelu, L.,
2017. Phytochemical and Quality Assessment of Acacia nilotica Linn and
Acacia leucophloea willd Flowers. Pharmacogn. J. 9, 721-724.
https://doi.org/10.5530/pj.2017.6.113
Isendahl, J., Turlej-Rogacka, A., Manjuba, C., Rodrigues, A.,
Giske, C.G., Nauclér, P., 2012. Fecal carriage of ESBL-producing E.
coli and K. pneumoniae in children in Guinea-Bissau: a
hospital-based cross-sectional study. PloS One 7, e51981.
https://doi.org/10.1371/journal.pone.0051981
Jame, R., 2019a. Phytochemical and Pharmacological Uses of
Acacia nilotica -A Review. Int. J. Biol. Chem. 6-10.
https://doi.org/10.11648/j.ijbc.20180302.11
John, J., Joy, M., Abhilash, E. K., 2004. Inhibitory
effects of tamarind (Tamarindus indica L.) on polypathogenic fungi.
Allelopathy J. 14, 43-49.
Kabbashi, A., Koko, W., Mohammed, S.E., Abuzeid, N., E. Osman,
E., Dahab, M., Fadul, E., Khalid, A., 2014. In vitro amoebicidal, antimicrobial
and antioxidant activities of the plants Adansonia digitata and
Cucurbit maxima. Med. Plant Res. 2, 50-57.
Kaingu, C. K., Oduma, J. A., Kanui, T.I., 2011.
Practices of traditional birth attendants in Machakos District, Kenya. J.
Ethnopharmacol. 137, 495-502.
Kalaivani, T., Rajasekaran, C., Suthindhiran, K., Lazar, M.,
2011. Free Radical Scavenging, Cytotoxic and Hemolytic Activities from Leaves
of Acacia nilotica (L.) Wild. ex. Delile subsp. indica (Benth.) Brenan
[WWW Document]. URL https://www.hindawi.com/journals/ecam/2011/274741/
(accessed 9.27.21).
Kayode, R.M., Azubuike, C. U., Laba, S.A., Dauda, A.O.,
Balogun, M.A., Ajala, S.A., 2018. Chemical composition and antimicrobial
activities of the essential oil of Adansonia digitata stem-bark and leaf on
post-harvest control of tomato spoilage. LWT 93, 58-63.
https://doi.org/10.1016/j.lwt.2018.03.014
Kebenzikato, A.B., Wala, K., Atakpama, W., Dimobé, K.,
Dourma, M., Woegan, A.Y., Batawila, K., Akpagana, K., 2015. Ethnobotanical
knowledge of baobab (Adansonia digitata L.) in Togo. Biotechnol.
Agron. Société Environ. 19, 247-261.
Khan, M., Ahmed, J., Gul, A., Ikram, A., Lalani, F. K.,
2018. Antifungal susceptibility testing of vulvovaginal Candida species among
women attending antenatal clinic in tertiary care hospitals of Peshawar.
Infect. Drug Resist. Volume 11, 447-456.
https://doi.org/10.2147/IDR.S153116
Khan, R., Islam, B., Akram, M., Shakil, S., Ahmad, A., Ali,
S.M., Siddiqui, M., Khan, A.U., 2009. Antimicrobial activity of five herbal
extracts against multi drug resistant (MDR) strains of bacteria and fungus of
clinical origin. Mol. Basel Switz. 14, 586-597.
https://doi.org/10.3390/molecules14020586
Klotoé, J.R., Agbodjento, E., Dougnon, V.T., Yovo, M.,
Sacramento, T.I., Déguénon, E., Dougnon, J.T., Atègbo,
J.M., 2020. Exploration of the Chemical Potential and Antioxidant Activity of
Some Plants Used in the Treatment of Male Infertility in Southern Benin. J.
Pharm. Res. Int. 1-12. https://doi.org/10.9734/jpri/2020/v32i430418
Kodlady, N., Patgiri, B.J., Harisha, C.R., Shukla, V.J., 2012.
Pharmacognostical and physicochemical analysis of Tamarindus indica Linn.
stem. J. Ayurveda Integr. Med. 3, 6-9.
https://doi.org/10.4103/0975-9476.93939
Kothari, V., 2014. In Vitro Antibacterial Activity of
Emblica officinalis and Tamarindus indica Seed Extracts against
Multidrug Resistant Acinetobacter baumannii. Int. J. Epidemiol. Infect. 2, 1-6.
https : //doi.org/10.12966/ijei.02.01.2014
Kouyaté, A.M., Decaluwé, E., Guindo, F.,
Diawara, H., Diarra, I., N'Diaye, I., Damme, P.V., 2011. Variabilité
morphologique du baobab (Adansonia digitata L.) au Mali.
Fruits 66, 247-255. https://doi.org/10.1051/fruits/2011032
Kubmarawa, D., Ajoku, G.A., Enwerem, N.M., Okorie, D.A., 2007.
Preliminary phytochemical and antimicrobial screening of 50 medicinal plants
from Nigeria. Afr. J. Biotechnol. 6.
Kumar, C. M. K., Yugandhar, P., Savithramma, N.,
2016. Biological synthesis of silver nanoparticles from Adansonia digitata
L. fruit pulp extract, characterization, and its antimicrobial properties.
J. Intercult. Ethnopharmacol. 5, 79-85.
https://doi.org/10.5455/jice.20160124113632
Kumar, C.M.K., Yugandhar, P., Suhrulatha, D., Savithramma, N.,
2015. Synthesis, characterization and antimicrobial studies of stem bark
mediated synthesis of silver nanoparticles from Adansonia digitata
(L.). J. Pharm. Sci. Res. 7, 76.
Lagane, C., 2007. Rôle de l'IL-13 et des ligands de
PPAR-gamma dans la réponse anti-infectieuse des macrophages murins et
des monocytes humains vis-à-vis de Candida Albicans. Implication de
PPAR-gamma (PhD Thesis). Université de Toulouse, Université
Toulouse III-Paul Sabatier.
Lavaee, F. c, Maryam Moshaverinia, F.L., Maryam Moshaverinia1,
Seyed Ali MalekHosseini2, Akram Jamshidzade3, Maryam, MalekHosseini, Akram
Jamshidzade3, Maryam Zarei1, Hadis Jafarian4, Pardis Haddadi5, Parisa Badiee4,
Akram Jamshidzade, Maryam Zarei, Hadis Jafarian, Pardis Haddadi,, Parisa
Badiee, 2019. Antifungal effect of sesame medicinal herb on Candida Species:
original study and mini-review.
Lebri, Bahi, Fofie, Lagou, Achibat, Yapi, et al.,
2015. Analyse phytochimique et évaluation de la toxicité
aiguë par voie orale chez des rats de l'extrait total aqueux des feuilles
de Abrus precatorius Linn (Fabaceae).
Lègba, B., Dougnon, V., Ahoyo, A., Agbankpè, J.,
Hounmanou, G., Aniambossou, A., Hounsa, E., Fabiyi, K., Amadou, A., Assogba,
P., Bankolé, H., Dougnon, J., Baba-Moussa, L., 2017. Exploration of the
antibacterial and chemical potential of some Beninese pharmacopoiea traditional
plants. Microbiol. Medica 32. https://doi.org/10.4081/mm.2017.6998
Leski, T. A., Bangura, U., Jimmy, D. H., Ansumana,
R., 2013. Identification of blaOXA-51-like, blaOXA-58, blaDIM-1, and blaVIM
Carbapenemase Genes in Hospital Enterobacteriaceae Isolates from Sierra Leone
[WWW Document]. URL https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3697688/
(accessed 10.1.21).
Maiti, R., Das, U.K., Ghosh, D., 2005. Attenuation of
hyperglycemia and hyperlipidemia in streptozotocin-induced diabetic rats by
aqueous extract of seed of Tamarindus indica. Biol. Pharm. Bull. 28,
1172-1176. https://doi.org/10.1248/bpb.28.1172
Maiti, R., Jana, D., Das, U.K., Ghosh, D., 2004. Antidiabetic
effect of aqueous extract of seed of Tamarindus indica in
streptozotocin-induced diabetic rats. J. Ethnopharmacol. 92, 85-91.
https://doi.org/10.1016/j.jep.2004.02.002
Maman Manzo, L., Ikhiri, K., Yu, L., 2019. Toxicity studies of
Acacia nilotica (L.): A review of the published scientific literature 8,
163-172. https://doi.org/10.15171/jhp.2019.26
Masim, M.L., Argimon, S., Espiritu, H.O., Magbanua, M.A.,
Lagrada, M.L., Olorosa, A.M., Cohen, V., Gayeta, J.M., Jeffrey, B., 2021.
Genomic surveillance of methicillin-resistant Staphylococcus aureus in
the Philippines, 2013-2014 | Western Pacific Surveillance and Response [WWW
Document]. URL https://ojs.wpro.who.int/ojs/index.php/wpsar/article/view/717
(accessed 10.1.21).
Maurizio, F., ELENA, R., Paola, R., Valerio, G., 2017.
Antimicrobial resistance: A global emerging threat to public health systems:
Critical Reviews in Food Science and Nutrition: Vol 57, No 13 [WWW
Document]. URL
https://www.tandfonline.com/doi/abs/10.1080/10408398.2015.1077192 (accessed
11.2.21).
Mbaye, A. I., Gueye, P. M., Fall, A.D., Kane,
M. O., Badji, K. D., Sarr, A., Diattara, D., Bassene, E., n.d.
Antioxidative activity of Tamarindus indica L. extract and chemical
fractions. Afr J Biochem Res 6.
McLaughlin, J. L., Chang, C.-J., Smith, D. L., 1993.
Simple bench-top bioassays (brine shrimp and potato discs) for the discovery of
plant antitumor compounds: review of recent progress, in: ACS Symposium Series
(USA).
Mehdi, M., Al-Arabi, F., Farooqui, M., Pradhan, V., 2019.
Phytochemical screening and antiamebic studies of Tamarindus indica of
leaves extract. Asian J. Pharm. Clin. Res.
https://doi.org/10.22159/ajpcr.2019.v12i2.29684
Maman Manzo, L., Ikhiri, K., Yu, L., 2019. Toxicity studies of
Acacia nilotica (L.): A review of the published scientific literature 8,
163-172. https://doi.org/10.15171/jhp.2019.26
Masim, M.L., Argimon, S., Espiritu, H.O., Magbanua, M.A.,
Lagrada, M.L., Olorosa, A.M., Cohen, V., Gayeta, J.M., Jeffrey, B., 2021.
Genomic surveillance of methicillin-resistant Staphylococcus aureus in
the Philippines, 2013-2014 | Western Pacific Surveillance and Response [WWW
Document]. URL https://ojs.wpro.who.int/ojs/index.php/wpsar/article/view/717
(accessed 10.1.21).
Maurizio, F., ELENA, R., Paola, R., Valerio, G., 2017.
Antimicrobial resistance: A global emerging threat to public health systems:
Critical Reviews in Food Science and Nutrition: Vol 57, No 13 [WWW
Document]. URL
https://www.tandfonline.com/doi/abs/10.1080/10408398.2015.1077192 (accessed
11.2.21).
Mbaye, A. I., Gueye, P. M., Fall, A.D., Kane,
M. O., Badji, K. D., Sarr, A., Diattara, D., Bassene, E., n.d.
Antioxidative activity of Tamarindus indica L. extract and chemical
fractions. Afr J Biochem Res 6.
McLaughlin, J. L., Chang, C.-J., Smith, D. L., 1993.
Simple bench-top bioassays (brine shrimp and potato discs) for the discovery of
plant antitumor compounds: review of recent progress, in: ACS Symposium Series
(USA).
Mehdi, M., Al-Arabi, F., Farooqui, M., Pradhan, V., 2019.
Phytochemical screening and antiamebic studies of Tamarindus indica of
leaves extract. Asian J. Pharm. Clin. Res.
https://doi.org/10.22159/ajpcr.2019.v12i2.29684
Maman Manzo, L., Ikhiri, K., Yu, L., 2019. Toxicity studies of
Acacia nilotica (L.): A review of the published scientific literature 8,
163-172. https://doi.org/10.15171/jhp.2019.26
Masim, M.L., Argimon, S., Espiritu, H.O., Magbanua, M.A.,
Lagrada, M.L., Olorosa, A.M., Cohen, V., Gayeta, J.M., Jeffrey, B., 2021.
Genomic surveillance of methicillin-resistant Staphylococcus aureus in
the Philippines, 2013-2014 | Western Pacific Surveillance and Response [WWW
Document]. URL https://ojs.wpro.who.int/ojs/index.php/wpsar/article/view/717
(accessed 10.1.21).
Maurizio, F., ELENA, R., Paola, R., Valerio, G., 2017.
Antimicrobial resistance: A global emerging threat to public health systems:
Critical Reviews in Food Science and Nutrition: Vol 57, No 13 [WWW
Document]. URL
https://www.tandfonline.com/doi/abs/10.1080/10408398.2015.1077192 (accessed
11.2.21).
Mbaye, A. I., Gueye, P. M., Fall, A.D., Kane,
M. O., Badji, K. D., Sarr, A., Diattara, D., Bassene, E., n.d.
Antioxidative activity of Tamarindus indica L. extract and chemical
fractions. Afr J Biochem Res 6.
McLaughlin, J. L., Chang, C.-J., Smith, D. L., 1993.
Simple bench-top bioassays (brine shrimp and potato discs) for the discovery of
plant antitumor compounds: review of recent progress, in: ACS Symposium Series
(USA).
Mehdi, M., Al-Arabi, F., Farooqui, M., Pradhan, V., 2019.
Phytochemical screening and antiamebic studies of Tamarindus indica of
leaves extract. Asian J. Pharm. Clin. Res.
https://doi.org/10.22159/ajpcr.2019.v12i2.29684
Meher, B., Dash, D., Roy, A., 2014. A review on:
Phytochemistry, phamracology and tradiional uses of Tamarindus indica
L. World J Pharm Pharm Sci 3, 229-240.
Menezes, A.P.P., Trevisan, S.C.C., Barbalho, M., Guiguer,
E. L., 2016. Tamarindus indica L. A plant with multiple medicinal
purposes 5.
Metwali, M.R., 2003. Study of antimicrobial potencies of some
Yemeni medicinal plants. Egypt. J. Microbiol. 38, 105-114.
Montégro, A., 2021. Les profils
épidémiologique et microbiologique des candidoses vulvovaginales
diagnostiquées chez les femmes reçues en consultation
gynécologique à l'hôpital de Mènontin.Mémoire
de fin de formation à l'Université d'Abomey-Calavi,
URMAPha.p100.
Morton, J. F., 1958. The Tamarind (Tamarindus indica
L.); Its Food, Medicinal and Industrial Uses, in: Proceedings of the
Florida State Horticultural Society. pp. 288-293.
Moshi, M.J., Cosam, J.C., Mbwambo, Z.H., Kapingu, M., Nkunya,
M.H., 2004. Testing beyond ethnomedical claims: brine shrimp lethality of some
Tanzanian plants. Pharm. Biol. 42, 547-551.
Muhammad, I.U., Jarumi, I.K., Alhassan, A.J., Wudil, A.M.,
Dangambo, M.A., 2016. Acute toxicity and hypoglycemic activity of aqueous fruit
pulp extract of Adansonia digitata L.(Afpead) on alloxan induced diabetic rats.
J. Adv. Med. Pharm. Sci. 1-6.
Nwodo, N.J., Ibezim, A., Ntie-Kang, F., Adikwu, M.U., Mbah,
C.J., 2015. Anti-Trypanosomal Activity of Nigerian Plants and Their
Constituents. Molecules 20, 7750-7771.
https://doi.org/10.3390/molecules20057750
Ogbolu, D.O., Daini, O.A., Ogunledun, A., Alli, A.O., Webber,
M.A., 2011. High levels of multidrug resistance in clinical isolates of
Gram-negative pathogens from Nigeria. Int. J. Antimicrob. Agents 37,
62-66. https://doi.org/10.1016/j.ijantimicag.2010.08.019
Olayemi, I.K., Samuel, O.M., Ukubuiwe, A.C., Ande, A.T.,
Adeniyi, K. A., Shittu, K.O., 2017. Larvicidal Activities of Leaf Extracts
of Adansonia digitata L.(Malvales : Malvaceae) and Ficus sur
Forssk (Rosales : Moraceae) against Culex quinquefasciatus Mosquito
(Diptera: Culicidae).
OMS, 2020. Résistance aux antimicrobiens [WWW
Document]. URL
https://www.who.int/fr/news-room/fact-sheets/detail/antimicrobial-resistance
(accessed 9.30.21).
Orwa et al., 2009. World Agroforestry Centre,
Kenya | Feedipedia [WWW Document], n.d. URL
https://www.feedipedia.org/node/1650 (accessed 9.7.21).
Ouedraogo, A.S., Jean Pierre, H., Bañuls, A.L.,
Ouédraogo, R., Godreuil, S., 2017. Emergence and spread of antibiotic
resistance in West Africa?: contributing factors and threat assessment.
Médecine Santé Trop. 27, 147-154.
https://doi.org/10.1684/mst.2017.0678
Parra, A.L., Yhebra, R.S., Sardiñas, I.G., Buela, L.I.,
2001. Comparative study of the assay of Artemia salina L. and the
estimate of the medium lethal dose (LD50 value) in mice, to determine oral
acute toxicity of plant extracts. Phytomedicine 8, 395-400.
Parvez, S. S., Parvez, M. M., Fujii, Y., Gemma, H.,
2004a. Differential allelopathic expression of bark and seed of Tamarindus
indica L. Plant Growth Regul. 42, 245-252.
https://doi.org/10.1023/B : GROW.0000026493.95805.a5
Patel, I., Patel, V., Thakkar, A., Kothari, V., 2013.
Tamarindus indica (Cesalpiniaceae), and Syzygium cumini (Myrtaceae)
Seed Extracts can Kill Multidrug Resistant Streptococcus mutans in Biofilm. J.
Nat. Remedies 13, 81-94. https://doi.org/10.18311/jnr/2013/101
Pettigrew, J.D., Bell, K.L., Bhagwandin, A., Grinan, E.,
Jillani, N., Meyer, J., Wabuyele, E., Vickers, C.E., 2012. Morphology, ploidy
and molecular phylogenetics reveal a new diploid species from Africa in the
baobab genus Adansonia (Malvaceae: Bombacoideae). Taxon 61, 1240-1250.
Sadiq, M.B., Tarning, J., Aye Cho, T.Z., Anal, A.K., 2017.
Antibacterial Activities and Possible Modes of Action of Acacia nilotica
(L.) Del. against Multidrug-Resistant Escherichia coli and Salmonella.
Molecules 22, 47. https://doi.org/10.3390/molecules22010047
Sbiti, M., Lahmadi, khalid, louzi, L., 2017. Profil
épidémiologique des entérobactéries
uropathogènes productrices de bêta-lactamases à spectre
élargi. Pan Afr. Med. J. 28, 29. https :
//doi.org/10.11604/pamj.2017.28.29.11402
Schaumburg, F., Alabi, A.S., Peters, G., Becker, K., 2014. New
epidemiology of Staphylococcus aureus infection in Africa. Clin. Microbiol.
Infect. Off. Publ. Eur. Soc. Clin. Microbiol. Infect. Dis. 20, 589-596.
https://doi.org/10.1111/1469-0691.12690
Seed for Africa, 2018. Adansonia digitata Baobab Tree--ZapMeta
[WWW Document]. URL
https://www.zapmeta.ws/ws?q=adansonia%20digitata%20baobab%20tree&asid=ws_gc_b5_3&abt=1&mt=b&nw=g&de=c&ap=&kid=aud-417710440247:kwd-377058538989&aid=48849036420&ac=858&cid=969191221&aid=48849036420&locale=en_US&gclid=CjwKCAjw_L6LBhBbEiwA4c46uoTYang4rSR0eHDnUuY1XUnoIzNokFbP2p-KETSTMmJSPx4cgiJjvRoCTksQAvD_BwE
(accessed 10.20.21).
Sendi, P., Zimmerli, W., 2012. Antimicrobial treatment
concepts for orthopaedic device-related infection. Clin. Microbiol. Infect. 18,
1176-1184. https://doi.org/10.1111/1469-0691.12003
Serragui, S., Derraji, S., Mahassine, F., Cherrah, Y., 2013.
Résistance bactérienne : états des lieux au Maroc.
Maroc Méd. 35.
Sharma, B. K., Jain, A.K., 2015. Adansonia digitata
L.(Malvaceae) a threatened tree species of medicinal importance. Med.
Plants-Int. J. Phytomedicines Relat. Ind. 7, 173-181.
Shehu, A., Magaji, M. G., Yau, J., Mahmud, B., Ahmed, A.,
2018. Antidepressant effect of methanol stem bark extract of Adansonia
digitata L. Malvaceae Mice Trop J Nat Prod Res 2, 87-91.
Shehu, A., Mustapha, S., Mansir, I.A., Magaji, M. G.,
2019. Involvement of anti-inflammatory mechanism in the antidepressant activity
of methanol stem bark extract of Adansonia digitata L.(Malvaceae).
Trop. J. Nat. Prod. Res. 3, 54-57.
Sidibé, M., Williams, J.T., 2002. Sidibé, M. and
Williams, J. T. (2002) Baobab Adansonia digitata. International
Centre for Underutilised Crops, Southampton. --References--Scientific Research
Publishing [WWW Document]. URL https://www.scirp.org/(S
[i43dyn45teexjx455qlt3d2q])/reference/ReferencesPapers.aspx?ReferenceID=1466022
(accessed 9.7.21).
Singh, G., Passari, A.K., Singh, B.P., Senthil, N., 2017.
Traditionally Used Medicinal Plants Belongs to Family Asteraceae for the
Treatment of Cancer in Mizoram, Northeast India 11.
Singh, R., Singh, B., Singh, S., Kumar, N., Kumar, S., Arora,
S., 2010. Umbelliferone--An antioxidant isolated from Acacia nilotica (L.)
Willd. Ex. Del. Food Chem. 120, 825-830.
https://doi.org/10.1016/j.foodchem.2009.11.022
Sole, S.S., Srinivasan, B.P., Akarte, A.S., 2013.
Anti-inflammatory action of Tamarind seeds reduces hyperglycemic excursion by
repressing pancreatic â-cell damage and normalizing SREBP-1c
concentration. Pharm. Biol. 51, 350-360.
https://doi.org/10.3109/13880209.2012.729067
Sudjaroen, Y., Haubner, R., Würtele, G., Hull, W.E.,
Erben, G., Spiegelhalder, B., Changbumrung, S., Bartsch, H., Owen, R.W., 2005.
Isolation and structure elucidation of phenolic antioxidants from Tamarind
(Tamarindus indica L.) seeds and pericarp. Food Chem. Toxicol. 43,
1673-1682. https://doi.org/10.1016/j.fct.2005.05.013
Suliman, M., Nour, A., 2020. Chemistry of Advanced
Materials 2(3) (2017) 34-43 Chemical Composition and Antibacterial
Activity of Crude Extracts from Sudanese Medicinal Plant Adansonia digitata L
Chemistry of Advanced Materials ISSN 2415-6213 ISSR Publisher. Open Access J.
Med. Aromat. Plants 4, 36-44.
Tandé, D., Boisramé-Gastrin, S., Münck,
M. R., Héry-Arnaud, G., Gouriou, S., Jallot, N., Nordmann, P.,
Naas, T., 2010. Intrafamilial transmission of
extended-spectrum-beta-lactamase-producing Escherichia coli and
Salmonella enterica Babelsberg among the families of internationally adopted
children. J. Antimicrob. Chemother. 65, 859--865.
https://doi.org/10.1093/jac/dkq068.
Traoré, Y., 2020. Etude phytochimique et
activité antiradicalaire des écorces de racines de Sarcocephalus
latifolius (Rubiacee) plante médicinale utilisée dans la prise en
charge de la douleur au Mali (Thesis). USTTB.
Tril, U., Fernández-López, J., Álvarez,
J.Á.P., Viuda-Martos, M., 2014. Chemical, physicochemical,
technological, antibacterial and antioxidant properties of rich-fibre powder
extract obtained from tamarind (Tamarindus indica L.). Ind. Crops
Prod. 55, 155--162. https://doi.org/10.1016/j.indcrop.2014.01.047
Tsirinirindravo, L., Andrianarisoa, B., 2009. Activités
antibactériennes de l'extrait des feuilles de Dalechampia
clematidifolia (Euphorbiaceae). Int. J. Biol. Chem. Sci. 3.
https://doi.org/10.4314/ijbcs.v3i5.51098
Ugbo, E.N., Anyamene, C.O., Moses, I.B., Iroha, I.R.,
Babalola, O.O., Ukpai, E.G., Chukwunwejim, C.R., Egbule, C.U., Emioye, A.A.,
Okata-Nwali, O.D., Igwe, O.F., Ugadu, I.O., 2020. Prevalence of blaTEM, blaSHV,
and blaCTX-M genes among extended spectrum beta-lactamase-producing
Escherichia coli and Klebsiella pneumoniae of clinical origin. Gene
Rep. 21, 100909. https://doi.org/10.1016/j.genrep.2020.100909
Van Der Stege, C., Prehsler, S., Hartl, A., Vogl, C.R., 2011.
Le tamarinier (Tamarindus indica L.) dans le régime alimentaire
traditionnel de l'Afrique de l'Ouest?: pas seulement un aliment de subsistance.
Fruits 66, 171-185. https : //doi.org/10.1051/fruits/2011025
Vertuani, S., Braccioli, E., Buzzoni, V., Manfredini, S.,
2002. Antioxidant capacity of Adansonia digitata fruit pulp and
leaves. Acta Phytother. 2.
Word Health Organization, 2014. Antimicrobial Resistance
Global Report on Surveillance.
Yunusa, S., Adamu, N. U., Garkuwa, U. A., Aliyu, A.,
2020. Anticonvulsant activity of methanol stem bark extract of Adansonia
digitata L.(Malvaceae) in rats. Ann Clin Toxicol 2020 3 1 1026.
Frirdich E, Whitfeld C (2005) Lipopolysaccharide inner core
oligosaccharide structure and outer membrane stability in human pathogens
belonging to the Enterobacteriaceae. J Endotoxin Res
11:133--144.https://doi.org/ 10.1179/096805105X46592.
Trombetta D, Castelli F, Sarpietro MG, Venuti V, Cristani M,
Daniele C et al (2005) Mechanisms of antibacterial action of three
monoterpenes. Antimicrob Agents Chemother 49:2474--2478.
https://doi.org/10.1128/AAC.49.6.
2474-2478.2005
Vaara M (1992) Agents that increase the permeability of the
outer membrane. Microbiol Rev 56:395--411
TABLE DES MATIERES
REMERCIEMENTS
III
HOMMAGES
V
SIGLES
ET ABRÉVIATIONS
VI
LISTE
DES TABLEAUX
VIII
LISTE
DES FIGURES
X
RÉSUMÉ
XI
ABSTRACT
XII
1.1
Généralités sur la résistance aux
antimicrobiens
xiii
1.2 Épidémiologie
de la résistance aux antimicrobiens
xiii
INTRODUCTION
1
I.
SYNTHESE BIBLIOGRAPHIQUE
4
II.
SYNTHESE BIBLIOGRAPHIQUE
4
1.1. ÉTAT DES LIEUX SUR LA
RÉSISTANCE AUX ANTIMICROBIENS
5
1.1.1.
Généralités sur la résistance aux
antimicrobiens
5
1.1.2.
Épidémiologie de la résistance aux
antimicrobiens
6
1.1.3. Situation de la
résistance aux antimicrobiens en Afrique
6
1.1.3.1. Résistance
antibactérienne
6
1.1.3.2. Résistance antifongique
7
1.1.4. MÉCANISMES DE LA
RÉSISTANCE AUX ANTIMICROBIENS
8
1.1.4.1. Résistance
antibactérienne
8
1.1.4.2. Résistance
antifongique
8
1.2. MONOGRAPHIE DES PLANTES
ÉTUDIÉES
9
1.2.1. Adansonia
digitata L.
10
1.2.1.1. Description botanique
10
1.2.1.2. Utilisations
ethnomédicales
12
1.2.1.3. Phytochimie de Adansonia digitata
L.
14
1.2.1.4. Toxicité
14
1.2.1.5. Propriétés
pharmacologiques
15
1.3.1.5.1. Activité antioxydante
15
1.2.1.5.2. Activités antibactériennes
et antifongiques
16
1.2.2. Tamarindus indica L.
17
1.2.2.1. Description botanique
17
1.2.2.2. Propriétés
ethnopharmacologiques
19
1.2.2.3. Phytochimie de Tamarindus
indica
20
1.2.2.4. Toxicité
21
1.2.2.5. Propriétés
pharmacologiques
21
1.2.2.5.1. Activitéantioxydante
22
1.2.2.5.2. Activités
antibactérienne et antifongique
23
1.2.3. Acacia nilotica (L.)
Willd. ancien Delile
24
1.2.3.1. Description botanique
24
1.2.3.2. Utilisations cliniques
traditionnelles de Acacia nilotica (L.) Willd. ancien Delile
25
1.2.3.3. Phytochimie de Acacia nilotica (L.)
Willd. ancien Delile
26
1.2.3.4. Toxicité
26
1.2.3.5. Propriétés
pharmacologiques
26
1.2.3.5.1. Activité antioxydante
27
1.2.3.5.2. Activité
antibactérienne et antifongique
28
II.
MATÉRIEL ET MÉTHODES
29
2.1. CADRE D'ÉTUDE
30
2.1.1. Cadre institutionnel
30
2.1.2. Cadre technique
30
2.2. MATÉRIEL
31
2.2.1. Matériel
végétal
31
2.2.2. Matériel biologique
31
2.2.3. Matériel technique et
équipements
35
2.3. MÉTHODES
36
2.3.1. Extraction et préparation des
extraits
36
2.3.1.1. Préparation des extraits de
plante
36
2.3.1.2. Rendement à l'extraction
36
2.3.2. Tests de cytotoxicité
37
2.3.3 Evaluation de l'activité
antimicrobienne des extraits des plantes
37
2.3.3.1. Confirmation des souches cliniques
38
2.3.3.2. Test d'activité antifongique des
extraits de plantes
38
2.3.3.3. Test d'activité
antibactérienne des extraits de plantes
40
2.3.3.4 Détermination du pouvoir
antibiotique/antifongique des extraits actifs sur les souches
testées
41
2.3.4 Détermination du pourcentage de
déstabilisation des extraits actifs
42
2.3.6. Analyses statistiques
42
III.
RÉSULTATS ET DISCUSSION
43
3.1. RÉSULTATS
44
3.1.1 Rendements à l'extraction et test
de stérilité
44
3.1.2 Evaluation de la cytotoxicité des
extraits
44
3.1.3. Effets des extraits des plantes
étudiées sur les souches bactériennes et fongiques
49
3.1.4. Activité antibactérienne
et antifongique des différents extraits des plantes utilisées en
fonction des profils de résistance et de virulence
55
3.1.4.1. Activité
antibactérienne des différents extraits des plantes
utilisées en fonction des profils de résistance
55
3.1.4.3. Activité antifongique des
différents extraits des plantes utilisées en fonction des profils
de virulence
60
3.1.5. Détermination du
pouvoir antibiotique ou antifongique des extraits de plante
64
3.1.6. Détermination du
pourcentage de déstabilisation des extraits sur la membrane des
souches
68
3.2. DISCUSSION
74
CONCLUSION
81
REFERENCES
BIBLIOGRAPHIQUES
83
TABLE
DES MATIERES
101
|
|



