|
REPUBLIQUE DU SENEGAL
Un Peuple-Un But-Une Foi

------------------------------------------------------------
Ministère De l'Enseignement Supérieur De La
Recherche
Et De L'innovation
------------------------------------------------------------
Direction Générale de l'Enseignement
Supérieur Privé
-------------------------------------------------------------------
AFRICAN MILLENIUM DEVELOPMENT
INSTITUTE
---------------------------------------------------------------

LA PRISE EN CHARGE DE L'HEPATITE B
Année : 2021/2022
Numéro : 2
Mémoire de Diplôme de Master II en Analyse
Biologique
Spécialité : Virologie
Présenté et soutenu
21/05/2022 à 14H à AMDI
Par
Youssouf Mohamed Youssouf
Né le 24/11/1993 à Djibouti
MEMBRES DU JURY
Président : Docteur Aliou BA
Enseignant-Chercheur ISRA/Thiès
Membres :
Monsieur Mbaye Coumba Mbothie Directeur AMDI /
Santé AMDI
Docteur Saliou NGOM
Enseignant-Chercheur UCAD
Docteur Bocar DIOP
Enseignant-Chercheur UCAD
DEDICACE
Je dédie ce travail à :
· A mes chers parents
Pour l'affection, la tendresse et l'amour dont vous m'avez
toujours entouré ;
Pour le sacrifice et le dévouement dont vous m'avez
toujours fait preuve ;
Pour l'encouragement sans limite que vous ne cessez de
manifester ;
Aucun mot, aucune phrase ne saurait exprimer mes profondes
sentiments d'amour et de respects ;
Que ce modeste travail soit considéré comme un
gage de reconnaissance envers vous ;
Mise à part ALLAH, c'est à vous que je dois ce
que je suis ;
Puisse le grand puissant vous donner santé, bonheur et
longue vie.
· A mon frère kassim
Pour l'encouragement et le soutien que vous ne cessez de
m'apporter ;
Je suis ton plus grand fan et tu resteras toujours un
modèle pour moi ;
Je te souhaite beaucoup de réussite que t'en a
déjà pleinement dans ta vie
· A ma famille
A tous ceux qui, de près ou de loin ont
contribué à la réalisation de ce travail, merci pour votre
soutien et amour.
· A mes amis les plus chers
Je m'estime toujours chanceux d'être entouré par
cette si bonne compagnie que vous êtes Vous étiez si
attentionnés et si présent dans ma vie, l'accomplissement de ce
travail est en grande partie grâce à vous tous
Merci pour votre soutien et affection, vous représentez
ma famille.
REMERCIEMENTS
Mes plus profonds remerciements vont vers mes parents Madame
Fatouma Kassim Abakari et M. Mohamed Youssouf que j'aime de tout mon coeur et
qui m'ont toujours soutenu moralement, financièrement et spirituellement
avec un grand amour depuis mon enfance jusqu'à présent.
Un grand merci à toute ma famille et plus
particulièrement au plus précieux de tous mes frère,
Kassim Mohamed et Hamadou Mohamed. Je n'oublierai jamais d'exprimer mes plus
sincères reconnaissances à mes amis Sophie Mahfoud, Amina Ahmed
et Abdoulkader Cheicko pour leurs soutiens morales et tout simplement pour
leurs présences dans ma vie.
Mes plus sincères remerciements vont à mon
encadreur : Dr Bocar DIOP
Votre disponibilité et votre aimable attention, en
dehors de vos qualités et compétences professionnelles sont
connues de tous. Nous gardons de vous l'image de l'enseignant toujours soucieux
d'inculquer à l'étudiant dans le sens de la vie et du travail
bien fait.
Veillez trouver ici l'expression de nos remerciements les plus
sincères et notre reconnaissance la plus profonde.
J'exprime mes vifs remerciements aussi au directeur d'AMDI
santé : M. MBODJ MBAYECOUMBA pour le bon accueil,
la bienveillance et l'expérience partagée.
Je remercie le corps professoral d'AMDI qui nous a permis
d'acquérir des connaissances.
Grand merci à vous tous !!!
Au président et aux membres du jury ; vous nous
faites un grand plaisir en acceptant de juger notre travail, malgré vos
multiples taches, nous vous témoignons notre gratitude et notre profond
respect.
SIGLES ET ABREVIATIONS
ADN : acide désoxyribonucléique
ADNccc : Adn circulaire covalemment clos
ARN : acide ribonucléique
AgHBs : antigène de surface du virus de
l'hépatite B
AgHBe : protéine virale de l'hépatite B
ASAT : aspartate - amino - transférase
ALAT : alanine - amino - transférase
PAL : phosphatase alcaline
PEG : polyéthylène glycol
CPF : cancer primitif du foie
GAMMA-GT : glutamyl-transférase ou
glutamyl-transpeptidase
ELISA : Enzyme Linked Immuno Sorbent Assay
VHB : Virus de l'Hépatite B
VHC : Virus de l'Hépatite C
VIH : Virus de l'Immunodéficience Humaine
LISTE DES FIGURES
Figure 1: Représentation schématique
de la particule de Dane.
2
Figure 2: Schéma illustrant la
multiplication du VHB dans l'hépatocyte.
10
Figure 3: Principales mutations dans la MHL
sélectionnées par les immunoglobulines spécifiques, les
anticorps monoclonaux, ou la vaccination. .
12
Figure 4: Histoire naturelle de l'infection par le
VHB (39).
16
Figure 5: Principe de test Immunologique par
Chimiluminescence
24
Figure 6: principe de test ELISA
26
Figure 7: Configuration du test de confirmation
pour la détection des AgHBs
29
LISTE DES TABLEAUX
Tableau I: le score de METAVIR
2
Tableau II: Représente les valeurs
consensuelles avec activation par le pyridoxal phosphate pour ASAT et ALAT
20
Tableau III: Représente les valeurs
consensuelles pour la Phosphatase Alcaline :
21
Tableau IV: Représente les valeurs normales
de la Bilirubine
21
Tableau V: Représente les valeurs normales
des Gamma-GT
22
Tableau VI: calendrier vaccinale de 0 à 11
mois
36
RESUME
Le virus de l'hépatite B (VHB) est transmis par
l'exposition des membranes muqueuses ou de la peau non intacte du sang ou
d'autres liquides organiques infectés. La transmission peut survenir
durant la période périnatale de la mère à l'enfant
et d'une personne à l'autre. La période d'incubation de
l'hépatite B aiguë est en moyenne de 75 jours, mais peut varier
d'environ 30 à 180 jours. La plupart des nouvelles infections sont
asymptomatiques. L'hépatite aiguë B concernent environ 1 % des
infections périnatales, 10 % des infections de la petite enfance et 30 %
des infections chez les personnes âgées de = 5 ans.
L'infection de l'hépatite B chronique a un spectre de
gravité clinique, allant d'asymptomatique à la cirrhose du foie
et au carcinome hépatocellulaire.
La prise en charge de l'hépatite B est basée sur
les antirétroviraux ex : Lamivudine, Interféron,
Adéfovir.
MOT-CLE : hépatite B, cirrhose du
foie, carcinome hépatocellulaire, vaccins.
ABSTRACT
Hepatitis B virus (HBV) is transmitted by exposure of infected
mucous membranes or non-intact skin to blood or other body fluids. Transmission
can occur during the perinatal period from mother to
child and person to person. The incubation period for acute hepatitis B is on
average 75 days, but can vary from about 30 to 180 days. Most new infections
are asymptomatic. Acute hepatitis B affects approximately 1% of perinatal
infections, 10% of infections in early childhood, and 30% of infections in
people aged = 5 years. Chronic hepatitis B infection has a spectrum of clinical
severity, ranging from from asymptomatic to liver cirrhosis and hepatocellular
carcinoma.
The management of hepatitis B is based on antiretroviral drugs,
eg Lamivudine, Interferon, Adefovir.
KEY-WORD: hepatitis B, liver cirrhosis,
hepatocellular carcinoma, vaccines.
TABLE DE MATIERES
DEDICACE
I
REMERCIEMENTS
II
SIGLES ET ABREVIATIONS
III
LISTE DES FIGURES
IV
LISTE DES TABLEAUX
V
RESUME
VI
ABSTRACT
VII
INTRODUCTION
1
CHAPITRE I : REVUE BIBLIOGRAPHIE
3
I.1. Historique
3
I.1.1. Origine
3
I.1.2. Définition
4
I.2. Epidémiologie
5
I.2.1. Epidémiologie dans le monde
5
I.2.2. Epidémiologie au
Sénégal
5
I.2.2.1. Morbidité
6
I.2.2.2. Mortalité
6
I.3. Etudes du VHB
6
I.3.1. classification
6
I. 3.2. Les caractéristiques structurales
du virus
7
I.3.2.1. La particule de Dane
7
I.3.2.1.1. Structure générale
7
I.3.3. Le cycle de réplication du VHB
9
I.3.4. Les variants phénotypique
11
I.3.4.1. Les mutants préC/C
11
I.3.4.2. Les mutants S
12
I.3.4.3. Les mutants P
13
I.4. Mode de transmission
13
I.4.1. Voies sanguines
13
I.4.2. Voie sexuelle
14
I.4.3. La transmission verticale
14
I.4.4. La transmission horizontale
14
I.5. La physiopathologie
14
I.5.1. La symptomatologie
15
I.5.1.1. Signe clinique
15
I.5.2. Histoire naturelle de l'infection
15
I.5.2.1. Phase aigue
16
I.5.2.2. Phase chronique
17
CHAPITRE II : DIAGNOSTIC ET TRAITEMENT
19
II.1.Diagnostic biologique
19
II.1.1.Exploration biochimique
19
II.1.1.1. Les transaminases
19
II.1.1.2. Dosage de la Phosphatase alcaline
20
II.1.1.3. La bilirubine totale
21
II.1.1.4. Gamma-GT
22
II.2. Exploration Sérologique
22
II.2.1. Tests de dépistage du VHB
22
II.2.1.1. Test immunologique micro-particulaire par
chimiluminescence (CMIA)
22
I.2.1.1.1. Principe de la technique
23
I.2.1.1.2. Résultats et
interprétation
24
II.2.1.2. Test ELISA
25
II.2.1.2.1. Principe de la technique
25
II.2.1.2.2. Procédure de dosage
26
II.2.1.2.3. Résultats et
interprétation
27
II.2.1.3. Tests de confirmation
28
II.2.1.3.1. Principe de la méthode
28
II.2.1.3.2. Procédure du test
28
II.2.1.3.3. Lecture des résultats
29
II.2.1.3.4. Interprétation des
résultats
30
II.3. Traitement et vaccination
30
II.3.1. Traitement curatif
30
II.3.2. Antiviraux actuellement disponibles
(30-2).
31
II.3.2.1. Interféron
31
II.3.2.2. Interféron standard.
31
II.3.2.3. Interféron
pégylée
31
II.3.2.4. Lamivudine
32
II.3.2.5. Adéfovir
32
II.3.3. Stratégie thérapeutique
32
II.3.3.1. Indications du traitement antiviral
32
II.3.4. Traitement préventif
33
II.3.4.1. Mesures générales
33
II.3.4.2. Immunisation passive
33
II.4. Vaccination
34
II.4.1. Différents types de vaccins
(30-2).
34
II.4.2. Protocole de vaccination (30-2-49-20).
35
II.4.3. Voie d'administration du vaccin (20)
36
II.4.4. Réponse immune
37
II.4.5. Stratégies vaccinales contre
l'hépatite B
37
II.5. Conclusion
38
II.6. Références
39
ANNEXES
43
INTRODUCTION
L'hépatite B est une infection virale qui
s'attaque au foie et peut entraîner aussi bien une affection aiguë
que chronique. (37)
Le virus responsable est le plus souvent transmis par la
mère à l'enfant lors de la naissance et de l'accouchement, ou par
contact avec du sang ou d'autres liquides biologiques, y compris des relations
sexuelles avec un partenaire infecté, des injections à risque ou
une exposition à des instruments piquants ou tranchants dans les
établissements de soins de santé, dans les communautés et
chez les consommateurs de drogues injectables.
En 2019, l'OMS estimait que 296 millions de personnes
vivaient avec une hépatite B chronique (définie comme la
présence de l'antigène de surface de
l'hépatite B).(37)
Cette même année, l'hépatite B avait
provoqué, selon les estimations, 820 000 décès,
principalement par cirrhose ou par carcinome hépatocellulaire
(c'est-à-dire par un cancer primitif du foie).
En 2019, 30,4 millions d'individus (10 % du total
estimé de la population vivant avec l'hépatite B) avaient
connaissance de leur infection, tandis que 6,6 millions (22 %)
depersonnes diagnostiquées étaient sous
traitement. D'après les dernières estimations de l'OMS, la
part des enfants de moins de 5 ans présentant une infection
chronique par le VHB est passée d'environ 5 % à l'ère
pré-vaccinale (période allant des années 1980 au
début des années 2000) à un peu moins de 1 % en
2019.(37)
Selon ces estimations de 2019, environ 1,5 million de
personnes contractaient une nouvelle infection par le virus de
l'hépatite B chaque année, malgré la
disponibilité d'un vaccin très efficace.
On dispose cependant de vaccins sûrs et efficaces pour
prévenir l'hépatite B.
Problématique :
_ Comment se manifeste l'infection par le VHB ?
_ À qui proposer, le dépistage du VHB ?
_ Quelles sont les personnes les plus exposées au VHB,
recommandé alors à se vacciner ?
Hypothèse 1 :_ la période
d'incubation (l'intervalle de temps entre le contact initial avec le virus et
l'apparition de la maladie) de l'hépatite B dure de 60 à 150
jours, les symptômes se manifestant en moyenne 90 jours après
l'exposition.
Hypothèse 2 :_ le plus souvent,
les tests sont utilisés pour poser un diagnostic étiologique
devant une hépatite aiguë ou chronique et pour rechercher
l'existence d'une coïnfection ou d'une surinfection par le virus de
l'hépatite D.Il est primordial, à la suite d'une détection
positive, de déterminer les différents paramètres
essentiels à l'orientation du clinicien dans ses décisions
thérapeutiques.
Hypothèse 3 : _ il est
recommandé de faire vacciner tous les nouveau-nés à la
naissance et les enfants de moins de 18 ans. On recommande également le
vaccin aux adultes souffrant de diabète et à ceux à haut
risque d'être infectés en raison de leur travail, leur mode de
vie, leurs conditions de vie ou leurs pays d'origine.
Les objectifs des recherches.
Objectifs générale :
Ø connaitre les grands principes du traitement et de la
surveillance de l'hépatite B.
Objectifs spécifique :
ü Connaitre les modes de transmission des
hépatites virales et les modalités de leur
prévention.
ü Prescrire et interpréter les examens
virologiques et sérologiques utiles au diagnostic.
ü Identifier les situations d'urgence et planifier leur
prise en charge
CHAPITRE I : REVUE
BIBLIOGRAPHIE
I.1. Historique
I.1.1. Origine
Le « premier traité de médecine »
datant de 3000 ans avant Jésus Christ décrivait
déjà les symptômes associés à une jaunisse
(7). Le développement de pratiques telles que la vaccination et la
transfusion (de la fin du 18ème siècle au milieu du 19ème
siècle) a permis l'émergence des concepts d'hépatite
sérique puis d'hépatite B. En effet en 1885, Lührman et Jehn
observèrent des épidémies de « jaunisse » au
sein de populations ayant récemment été immunisées
contre la variole à l'aide d'un vaccin consistant en une
préparation de lymphe humaine. A partir de ces observations,
Lührman suspecta le vaccin comme source de la maladie, observant pour la
première fois des « hépatites sériques »,
aujourd'hui connues sous le nom d'hépatites B et C (7).
En 1908, Mc Donald émit l'hypothèse de la nature
infectieuse virale des « hépatites sériques » ; un
virus étant considéré à l'époque comme un
agent subcellulaire infectieux pouvant être filtré. Des cas
similaires furent rapportés jusque dans les années 40,
renforçant l'idée d'une transmission des « hépatites
sériques » provoquée par des aiguilles contaminées
par du sang, l'administration de vaccins dérivés de tissus
humains et enfin l'administration de produits sanguins.
Durant la seconde guerre mondiale, la propagation des
hépatites virales chez de nombreux sujets transfusés motiva la
réalisation d'études aux Etats-Unis et en Angleterre,
basées sur la transmission d'hépatites infectieuses à des
sujets volontaires. Ainsi, en 1947, MacCallum proposa une distinction claire
entre les infections aiguës transmises par des aliments souillés
par le virus (transmission oro-fécale), ou « hépatites A
», et les hépatites sériques, ou « hépatites B
», dont le temps d'incubation est de plusieurs mois et qui conduisent
parfois à la chronicité (5).
En 1965, Blumberg étudièrent le polymorphisme
génétique des lipoprotéines sériques en
détectant la précipitation d'anticorps (Acs) contre certains
antigènes. En recherchant de façon systématique des
anticorps dirigés contre différentes formes de protéines
sériques chez des patients polytransfusés, ils
identifièrent un anticorps réagissant contre le sérum d'un
patient australien. Ce nouvel antigène présent dans le
sérum d'un patient aborigène ciblé par l'anticorps
présent dans le sérum du patient transfusé fut
appelé « Australia antigen » (Au) (6).
Plusieurs études permirent par la suite de relier la
présence de cet antigène avec le développement
d'hépatites. Il fut ainsi identifié comme un constituant du virus
responsable des hépatites sériques B alors appelé virus de
l'hépatite B (VHB) (32). L'analyse systématique des dons de sang
à la recherche de l'antigène (Au) aussi appelé
antigène HBs (Ag HBs), entrainant l'exclusion des lots
contaminés, permit de réduire de façon significative
l'incidence des hépatites « post transfusion » (35). A partir
d'échantillons sériques issus de patients porteurs de l'Ag HBs,
les premières images de virus en microscopie électronique furent
obtenues (46). Dane et al. observèrent trois types de particules virales
: des petites sphères et des bâtonnets de 20 nm de diamètre
environ, ainsi que des particules plus grosses de 45 nm, connues depuis sous le
nom de particules de Dane, correspondant au virus complet et infectieux. Dans
les années 70, des travaux ont permis d'établir la structure des
virions et d'aboutir à l'identification de la structure du génome
viral (23). La première séquence complète du génome
du VHB a été publiée en 1979 (22). Grâce à
ces découvertes le premier vaccin testé chez l'homme et efficace
contre le VHB fut mis au point en 1976, puis développé à
grande échelle par l'institut Pasteur et commercialisé sous le
nom « Hevac B » en 1981 (4). La première
génération de vaccins a été obtenue à partir
de plasmas riches en Ag HBs. Grâce au développement des techniques
de clonage, les vaccins obtenus par recombinaison génétique
firent ensuite leur apparition. Le premier vaccin basé sur l'utilisation
de protéines recombinantes de l'enveloppe virale, « Engerix B
», fut développé en 1985 et mis sur le marché en
1989. A partir de 1976, les traitements à base d'interféron
furent utilisés chez les patients infectés chroniquement
permettant ainsi de réduire la réplication du VHB (31). Suite
à la découverte de l'activité reverse transcriptase, ou
transcriptase inverse, de la polymérase virale par (13), les inhibiteurs
de polymérase virale firent leur apparition (13). Ces deux
catégories d'antiviraux, interféron et analogues
nucléos(t)idiques, sont toujours utilisés à ce jour dans
la prise en charge thérapeutique des malades atteints d'une
hépatite B chronique.
I.1.2.Définition
L'hépatite B est une infection causée par un
virus qui peut se transmettre par l'exposition sexuelle à du sang ou
à des liquides corporels, l'utilisation de drogues injectables ou les
contacts familiaux avec une personne atteinte d'hépatite B. (45)
Le virus cause une inflammation du foie (hépatite) et
peut provoquer à la longue une maladie chronique du foie.(45)
Les plus souvent les voies de transmission les plus
courantes de l'hépatite B sont les contacts sexuels et l'utilisation de
drogues injectables.
Toutes les personnes sexuellement actives peuvent courir le
risque de contracter l'hépatite B.
Dans les pays où l'hépatite B est
répandue, les pratiques médicales insalubres et la transmission
parent-enfant lors de l'accouchement sont les principales voies de
transmission.
L'intensité de l'hépatite B peut varier
largement : chez certaines personnes, elle provoque une maladie aiguë
(avec peu ou pas de symptômes) qui dure quelques semaines et se
résorbe toute seule; chez d'autres, il s'agit d'une infection chronique
plus grave qui dure toute la vie, entraînant une maladie du foie, une
insuffisance hépatique et un cancer du foie. (45)
Un simple test sanguin peut déterminer si une personne
a l'hépatite B en ce moment, si elle a déjà
été exposée à l'hépatite B ou si elle a
été vaccinée contre l'hépatite B. Il n'est pas
possible de guérir l'hépatite B, mais on peut la prévenir
grâce à l'immunisation. (45)
Il existe un traitement qui peut réduire le risque de
dommages hépatiques et le risque de transmettre le virus à
d'autres personnes.
I.2.
Epidémiologie
I.2.1. Epidémiologie
dans le monde
Dans le monde, on estime à 2,5 milliards le nombre de
personnes infectées ou ayant été infecté par le
virus de l'hépatite B (VHB), soit 1/3 de la population mondiale. Parmi
eux, 350 à 400 millions de personnes souffrent d'une hépatite
chronique (19).
L'histoire naturelle de l'infection par le VHB est variable,
allant d'un état de porteur inactif à une hépatite B
chronique, qui peut évoluer vers la cirrhose et le carcinome
hépatocellulaire.
L'infection par le virus B est responsable de plus
de 0,5-1 millions de décès par an et représentent
actuellement 5-10% des cas de transplantation hépatique.
Les patients
non traités atteints de cirrhose décompensée ont un
mauvais pronostic avec une probabilité de survie de 14-35% à 5
ans. L'incidence annuelle du carcinome hépatocellulaire liée au
VHB chez les patients est élevée, allant de 2% à 5%
lorsque la cirrhose est établie (19).
I.2.2. Epidémiologie au
Sénégal
85 % de la population sénégalaise ont au moins
un marqueur du virus de l'hépatite B(VHB)
I.2.2.1.
Morbidité
Après une infection aigue, 20 %
deviennent des porteurs chroniques. Ainsi 17% de la population
sénégalaise sont des porteurs chroniques dont 20 à
30% évoluent vers la cirrhose et le cancer du foie après un
délai moyen de 20 à 30 ans. Le VHB est le
2nd carcinogène après le tabac ; selon l'OMS
il est responsable de 80% des cancers du foie qui est le premier
cancer de l'homme(41).
I.2.2.2.Mortalité
La mortalité liée à l'Hépatite B
n'a pas été évaluée au Sénégal, mais
elle semble élevée. Elle est estimée à 1,5 à
2 millions /année dans le monde(41).
I.3. Etudes du VHB
I.3.1. classification
Les virus appartenant à la famille des Hepadnaviridae
(Hepatotropic DNA virus), tel que le VHB, possèdent un certain nombre de
caractéristiques communes concernant :
Ø leur structure : les particules virales sont
sphériques, de petite taille et enveloppées ; les particules
subvirales, correspondant à des enveloppes vides, sont produites en
grande quantité ;
Ø leur génome : il est constitué d'une
molécule d'ADN « relaxée » circulaire partiellement
bicaténaire dont la taille et l'organisation génétique
sont peu variables ;
Ø le mode de réplication de leur génome :
il implique une étape de transcription inverse à partir de leur
ARN viral ;
Ø leur tropisme essentiellement hépatocytaire :
les hepadnavirus sont considérés comme des virus
hépatotropes bien que de l'ADN viral soit aussi retrouvé dans
plusieurs tissus (11) ;
Ø leur étroite spécificité
d'hôte : le VHB n'infecte que l'homme et les primates.
Cette famille comprend deux genres distincts selon
l'espèce hôte du virus : les avihepadnavirus infectant les oiseaux
et les Orthohepadnavirus infectant les mammifères. Le
représentant type de la famille des Orthohepadnavirus est le VHB,
infectant naturellement l'homme mais aussi expérimentalement d'autres
primates (chimpanzé, gibbon, orang-outan, gorille) ainsi que le
Tupaïa belangeri. Cependant des souches virales infectant naturellement
les primates ont été mises en évidence (HBV cpz, HBV gbn,
HBV oru). Les virus isolés chez les primates sont regroupés
à proximité des différents génotypes du virus
humain sur les arbres phylogénétiques (14). Les génomes
des virus infectant le chimpanzé et le gorille présentant moins
de 5 % de différences sont regroupés sous le même
génotype, HBV cpz. Le premier hepadnavirus non humain, le WHV (Woodchuck
Hepatitis Virus) fut découvert chez les marmottes américaines
(29). Ultérieurement, toute une série de virus homologues furent
mis en évidence tels que : le GSHV (Ground Squirrel Hepatitis Virus), le
WMHBV (Wooly Monkey Hepatitis B Virus), l'ASHV (Arctic Squirrel Hepatitis
Virus).
I.3.2. Les
caractéristiques structurales du virus
Trois types de particules virales de morphologie distincte
sont observés en microscopie électronique dans le sérum de
patients infectés par le VHB : les particules de Dane ou particules
virales complètes et les particules dites subvirales (SVPs)
correspondant à des sphères et des bâtonnets (44).
I.3.2.1. La particule de
Dane
I.3.2.1.1. Structure
générale
Le virion infectieux, appelé particule de Dane, du nom
de son découvreur (44) est une petite particule sphérique de 45
nm de diamètre. Elle circule dans le sang à une concentration
pouvant atteindre 1010 particules par ml chez certains patients. Le
génome de ces particules est constitué d'une molécule
d'ADN circulaire partiellement bicaténaire d'environ 3200
nucléotides sur laquelle est fixée de manière covalente
une polymérase virale, ainsi que des protéines d'origine
cellulaire dont une sérine/thréonine kinase phosphorylant la
protéine HBc (9). La polymérase virale comprend quatre domaines
de N terminal en C terminal :
Ø une protéine N-terminale (TP) ou primase,
contenant le site d'attachement à la partie 5' du brin d'ADN en cours de
synthèse
Ø une région intermédiaire ou spacer
Ø un domaine requis pour l'activité
transcriptase inverse dont le site catalytique comprend une séquence en
acides aminés (aa) très conservée YMDD
Ø et un domaine RNase H qui dégrade la matrice
ARN lors de la synthèse du brin négatif d'ADN viral (49).
Le génome est entouré d'une capside
protéique icosaédrique, appelée « core »,
d'environ 30 nm de diamètre. Elle est formée par
l'auto-assemblage d'environ 200 antigènes HBc (Ag HBc) ou
protéines C (21 kDa) selon une symétrie icosaédrique T3 ou
T4 (21). L'antigène HBc est une protéine de 183 à 185 aa
en fonction du génotype viral, relativement conservée parmi les
différents génotypes viraux (24). Elle comprend deux
régions :
Ø une région N-terminale (149-151 aa) qui
possède un motif leucine zipper permettant la dimérisation de
l'Ag HBc et son assemblage en une structure capsidique
Ø une région C-terminale basique de 34
résidus qui contient quatre domaines riches en arginine n'intervenant
pas dans la formation de la nucléocapside : le premier est
nécessaire à l'encapsidation de l'ARN pré-génomique
(matrice pour la synthèse de l'ADN viral) associé à la
polymérase virale alors que les trois autres sont susceptibles
d'interagir avec l'ADN viral (24).
La nucléocapside virale est enveloppée par une
bicouche lipidique d'origine cellulaire dans laquelle sont
enchâssées des glycoprotéines de surface virales. L'exacte
composition en 32 lipides de l'enveloppe est inconnue, mais la présence
de cholestérol semble indispensable au processus d'infection, lors des
étapes suivant la fixation des virus à la surface des cellules
(36). L'enveloppe lipoprotéique est acquise lors du bourgeonnement
à partir du réticulum endoplasmique cellulaire. Les
glycoprotéines de taille variable sont les suivantes : la
protéine L (« Large »), la protéine M (« Middle
») et la protéine S (« Small »). Ces protéines L,
M et S sont présentes dans l'enveloppe du virus selon un ratio 1:1:4
(24). Les protéines M et L sont présents en quantités
équivalentes sur la particule de Dane et représentent environ 30
% des protéines d'enveloppe, laprotéine S étant
majoritaire (49). Ces trois protéines partagent une région
commune correspondant à l'antigène HBs. Elles sont
étroitement associées les unes avec les autres via la mise en
place de ponts disulfures intra- et inter-chaînes (16).

Figure
1: Représentation schématique de la particule
de Dane.
Source : (Pollicino, 2014)
I.3.3. Le cycle de
réplication du VHB
La réplication virale, élément capital
dans la décision thérapeutique pour l'hépatite Bse
caractérise par la positivité de l'ADN du virus. Les cellules
permissives sont les hépatocytes, bien que de l'ADN viral ait
été trouvé en faible quantité dans des sites extra
hépatiques, monocytes, lymphocytes B, lymphocytes T CD4+ et CD8+. C'est
sans doute à mettre en rapport avec les réinfections du greffon,
observées après transplantation de foie, en particulier chez les
patients atteints d'hépatite chronique sévère. Le cycle
d'infection par le VHB comporte deux phases :
Phase de réplication complète, qui se
déroule dans les cellules hépatiques avec libération de
virion dans le sérum. Elle se traduit par une double
antigénémie AgHBs et AgHBe. A cette phase ; le sujet atteint est
très contaminant.
Phase de réplication incomplète ou phase
d'intégration ; au cours de laquelle l'ADN du virus s'intègre
à l'ADN chromosomique hépatocytaire, une recombinaison
génétique est alors réalisée avec reprogrammation
des hépatocytes qui deviennent capables de produire l'AgHBs. Cette phase
ne s'accompagne plus de production de virion complet ni de l'expression
d'AgHBe/c sur les membranes hépatocytaires ; donc l'infection est
absente. La multiplication du VHB (figure 1), commence par L'attachement du
virus sur la cellule cible (hépatocyte), et la fixation se fait par
interaction entre l'antigène préS1 côté virus et par
l'albumine humaine polymérisée côté
hépatocyte. La nature du récepteur de l'HBV n'est, toutefois, pas
encore déterminée. Lors de son entrée dans
l'hépatocyte le virus perd son enveloppe. La capside rejoint le noyau de
l'hépatocyte et désassemble pour libérer son ADN. Dans le
noyau, l'ADN polymérase virale associée au virion ;
complète l'ADN génomique partiellement bicaténaire en ADN
bicaténaire circulaire surenroulé appelée ADNccc. Celui-ci
est transcrit par l'appareillage cellulaire en ARN messagers, traduits en 4
protéines (AgHBs, AgHBc, - ADN polymérase et protéine X),
et en ARN pré-génomique, particularité de l'HBV, qui est
rétrotranscript par l'ADN polymérase en nouvel ADN
génomique. L'encapsidation s'effectue dans le cytoplasme et seul l'ARN
pré-génomique, associé à la polymérase P,
est encapsidé car il est le seul à posséder le signal
d'encapsidation. L'ARN pré-génomique est copié en un ADN
(-) de 3182 nucléotides, grâce à la transcriptase inverse
virale, La synthèse du second brin d'ADN (+), à partir du brin
néo-synthétisé s'interrompt prématurément
donnant des brins courts, de tailles variables. La nucléocapside
acquiert ensuite son enveloppe. Cette étape se passe dans un
compartiment prégolgien (post-réticulum endoplasmique)
correspondant au site de maturation des protéines d'enveloppe. Le virion
ainsi formé par bourgeonnement de la membrane du Réticulum
Endoplasmique (RE) est libéré dans la voie exocytique. Certaines
nucléocapsides ne sont pas enveloppées et retournent dans le
noyau, avec libération du génome viral et redémarrage d'un
nouveau cycle de multiplication transcrit. Cette étape permet le
maintien d'un
"pool" d'ADNccc dans le noyau de l'hépatocyte, ce
quirend difficile l'élimination totale du virus par les traitements
antiviraux(50).

Figure
2:Schéma illustrant la multiplication du VHB dans
l'hépatocyte.
Source : (Weber B, 2005)
Le cycle de réplication des hepadnavirus fait
intervenir une transcriptase inverse, qui ne possède pas
d'activité 3' 5' exonucléasique et ne corrige donc pas ses
erreurs de transcription. Le taux d'erreur de cette enzyme, favorisé par
l'important niveau de production du VHB (environ 10 virions par jour), est
estimé à 10° paires de bases par jours.
I.3.4.Les variants
phénotypique
Le virus de l'hépatite B (VHB) est le seul virus
à ADN qui possède une étape de reverse transcription au
cours de son cycle de réplication. Les variants phénotypiques, ou
mutants, émergent au sein de la quasi-espèce virale sous l'effet
de la pression de sélection environnementale exercée par la
réponse immunitaire de l'hôte et/ou les mesures
thérapeutiques préventives ou curatives. Les variants
phénotypiques sont moins robustes que les variants génotypiques
car ces derniers deviennent majoritaires en l'absence de toute pression
sélective. Les mutants dont les capacités réplicatives
sont les mieux adaptées à la pression exercée, sont
sélectionnés. Si certaines mutations confèrent une
meilleure adaptation à l'hôte et à la pression de
sélection, du fait du chevauchement des cadres de lecture elles peuvent
aussi affecter potentiellement l'assemblage, la stabilité ou le pouvoir
infectieux du virion. En général, les mutants de
résistance aux antiviraux disparaissent rapidement au retrait de la
molécule (42).
I.3.4.1. Les mutants
préC/C
Ces mutants émergent sous la pression de la
réponse immune anti-HBe. Ils portent des mutations soit dans la
région préC, entraînant un arrêt de l'expression de
l'AgHBe, soit dans le promoteur du core, à l'origine d'une diminution de
l'expression de l'AgHBe (25, 38). Les patients infectés par un mutant
précore ont donc un profil sérologique particulier,
caractérisé par l'absence de détection de l'AgHBe («
patients AgHBe- »).Ces mutations n'affectent pas la synthèse de la
protéine HBc et ne semblent pas avoir d'impact sur la réplication
du VHB. Dans 95 % des cas, les variants défectifs en AgHBe
présentent une substitution de nucléotide en position 1896
(G1896A) transformant le codon 28 de la région préC en
codon-stop. La traduction se termine prématurément,
libérant un peptide tronqué qui est bloqué dans le
cytoplasme et dans le noyau des hépatocytes infectés. Cette
mutation est génotype-dépendante. En effet, chez les virus de
génotypes A, F et H, la substitution G1896A entraîneune
déstabilisation de la structure secondaire de la région epsilon
qui est délétère pour la réplication virale (43).
Sont également retrouvées des mutations dans le promoteur du
core, qui affectent principalement le site majeur de fixation de facteurs de
transcription situé sur le BCP. La double mutation A1762T - G1764A est
retrouvée chez environ 80 % des patients AgHBe+ ayant une
hépatite B chronique. Elle entraîne une diminution de la
transcription de l'ARN préC et par conséquent de la
synthèse de l'AgHBe.
I.3.4.2. Les mutants S
Certaines mutations peuvent modifier la conformation spatiale
de la MHL, permettant aux souches virales d'échapper à l'action
des anticorps anti-HBs. Ces mutants sont sélectionnés par la
réponse immune dirigée contre l'AgHBs, qu'elle soit induite par
la vaccination (10) ou liée à l'administration d'immunoglobulines
spécifiques (3,26) ou, plus rarement spontanée. Les mutations
d'échappement initialement décrites sont situées dans le
déterminant « a », témoignant de l'importance
fonctionnelle de cette région (Figure 3).

Figure
3:Principales mutations dans la MHL sélectionnées par
les immunoglobulines spécifiques, les anticorps monoclonaux, ou la
vaccination. 28 La substitution G145R est la mutation la plus
fréquemment retrouvée. Toutefois, de nombreuses autres mutations
ont été décrites en amont du déterminant « a
» (entre les aa 110 et 120), à l'origine d'une altération de
la conformation des épitopes.
Source :(Trepo C, 2014)
I.3.4.3. Les mutants P
La polymérase virale permet l'encapsidation de l'ARNpg
et la réplication du génome viral. Les mutations dans le
gène P sont donc supposées être létales la plupart
du temps. Blum et al. (47) ont décrit une mutation non-sens à
l'extrémité 5' du gène P, qui est associée à
un défaut d'encapsidation de l'ARNpg. La grande majorité des
mutations P a été détectée chez des patients sous
traitement antiviral. En effet, les molécules inhibitrices de la
polymérase de type analogues nucléosidiques sont à
l'origine de la sélection de variants résistants. Les mutations
sont localisées dans ou à proximité du site catalytique de
l'enzyme, i.e. dans la région C très conservée du domaine
RT de la polymérase (25). Le changement conformationnel de la
polymérase résultant de ces mutations est responsable de la
résistance du virus aux molécules antivirales. Par ailleurs, ces
mutations affectent un site essentiel de l'enzyme et sont donc à
l'origine d'une plus faible capacité réplicative du virus.
I.4. Mode de transmission
I.4.1.Voiessanguines
L'hépatite B peut être contractée au
contact du sang dans les situations suivantes (40):
· Perforation de la peau par des aiguilles, des
lancettes, des scalpels ou d'autres objets acérés
contaminés par du sang.
· Contact direct avec les plaies ouvertes d'une personne
infectée.
· Éclaboussure sur une peau
égratignée, écorchée, brûlée ou
présentant une éruption, même bénigne.
· Éclaboussures sur les muqueuses de la bouche, du
nez ou des yeux.
Dans une moindre mesure, même le contact indirect avec
une surface souillée de sang contaminé peut transmettre le VHB.
Le virus contenu dans du sang séché peut demeurer stable
jusqu'à 7 jours à une température de
25 °C(40). Les mains entrées en contact avec une surface
porteuse de sang contaminé, par exemple une paillasse de laboratoire,
des tubes d'analyse ou des instruments de laboratoire, peuvent transmettre le
VHB à la peau ou aux muqueuses(40).
I.4.2.Voie sexuelle
Une relation sexuelle (vaginale, anale ou
buccogénitale) non protégée avec une personne
infectée. En tout début d'infection par l'hépatite B,
le virus est présent également dans la salive. Il
existe alors un risque de transmission lors d'un baiser profond (1).
I.4.3. La transmission
verticale
70 à 90% si l'AgHBs de la mère est positive
(29).
Qui peut être:
· Anténatal ou in utero ou par voie
hématogène à partir de cellules endothéliales
· Périnatal, (mode majeur) par micro-transfusion
materno-foetale au cours de travail ou par contact des liquides biologiques
· Postnatal par le lait maternel ou une transmission
intrafamiliale
I.4.4. La transmission
horizontale(29).
· Orale (salive, sueur)
· Parentale:
· Par inoculation de sang et ses dérivés
(transfusion, hémodialyse)
· Inoculation avec matériel souille
· Sexuelle (40% selon la OMS)
I.5. La physiopathologie
La physiopathologie de l'infection à VHB est complexe.
En effet, la réplication virale n'est pas directement
cytopathogène pour l'hépatocyte, mais c'est la réaction de
l'hôte vis à vis du virus qui est déterminante. Il s'agit
d'une réponse à la fois humorale et cellulaire responsable des
lésions hépatiques et des symptômes(29).
I.5.1. La symptomatologie
On distingue l'hépatite virale aigue et
l'hépatite virale chronique. Dans les deux cas l'infection peut
être symptomatique ou non.
I.5.1.1.Signe clinique
Elle évolue en 3 phases:
· Incubation
Elle est silencieuse sa durée varie de 10 semaines en
moyenne. Cette infection est souvent asymptomatique dans plus de 90% des cas
surtout chez les sujets jeunes (29).
· La phase
pré-ictérique :qui dure 3 à 7 jours, elle
est absente dans 20% des cas. Elle est caractérisée par des
signes non spécifiques: céphalées, asthénie,
anorexie, fièvre, plus rarement les arthralgies, myalgies,
nausées, pesanteur de l'hypochondre droit, foie sensible à la
palpation et rash cutané. L'association céphalées,
arthralgies et rash cutané réalise la triade de Caroli qui est
caractéristique à cette phase (29).
· La phase ictérique : dure 2
à 6 semaines, caractérisée par un ictère
cutanéo-muqueux qui dure 2 à 3 semaines en moyenne avec des
urines foncées et des selles incomplètement
décolorées. Cet ictère s'accompagne rarement de prurit et
de fièvre. L'asthénie est constante et dure tout au long de la
phase ictérique ; une hépatomégalie sensible et plus
rarement une splénomégalie clou des angiomes stellaires. Une
perte de poids de 2 à 10 kg est classique.
· La phase de convalescence : voit la
disparition de l'ictère et des signes généraux avec une
reprise de l'appétit. La fatigue est en général le dernier
signe à disparaitre et peut persister pendant plusieurs mois.
I.5.2. Histoire naturelle de
l'infection
La sévérité de l'atteinte
hépatique observée lors d'une infection par le VHB varie
fortement selon les individus et notamment en fonction de l'âge au moment
de la contamination. Lors d'une contamination à l'âge adulte, dans
plus de 90 % des cas, les personnes infectées développent une
hépatite aigue très rapidement résolutive grâce au
contrôle du système immunitaire.
Chez certains individus ne parvenant pas à
éliminer le virus, l'infection devient chronique avec un risque accru de
développer des atteintes hépatiques sévères telles
que la cirrhose ou le carcinome hépatocellulaire. Le taux de passage
à la chronicité est bien plus important, nous le
développerons par la suite, lors d'une contamination à la
naissance ou très tôt dans l'enfance. Par ailleurs, dans moins de
1 % des cas, une réponse immunitaire trop intense conduit à un
tableau d'hépatite fulminante (figure 4).
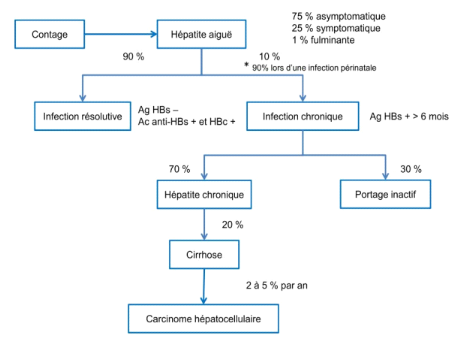
Figure 4:Histoire
naturelle de l'infection par le VHB (39).
Source : (Pol S, 2006)
I.5.2.1.Phase aigue
L'intensité des symptômes d'une infection aigue
varie beaucoup selon les individus. Dans 75 % des cas, l'infection aiguë
est asymptomatique, passe inaperçue et n'est pas diagnostiquée.
L'infection peut être symptomatique dans 25 % des cas chez les adultes,
10 % chez les enfants de moins de 5 ans et encore plus rarement chez les
enfants de moins d'un an (32).
La fréquence des signes cliniques augmente avec
l'âge au moment de la contamination. Après la contamination, la
période d'incubation est généralement longue (1 à 6
mois) (8).
Chez les patients symptomatiques, une phase
pré-ictérique (3 à 7 jours) survient, ensuite, au cours de
laquelle des symptômes non spécifiques sont observés : des
nausées, une asthénie, une anorexie, plus ou moins
accompagnées de fièvre, arthralgies et plus rarement de
manifestations cutanées de type urticaire (8). Puis, durant au moins
deux à trois semaines, les patients présentent un ictère
d'intensité variable accompagné ou non d'un prurit. Le taux des
transaminases et notamment l'alanine-amino-transaminase (ALAT) est
également très élevé (20 à 30 fois
supérieure à la normale) en raison d'une forte cytolyse
hépatique.
Dans le cas d'une résolution de l'infection, une
disparition de l'Ag HBs et une apparition des Ac anti-HBs protecteurs sont
observées dans le sérum des patients. Au cours de la phase de
convalescence, l'asthénie diminue progressivement et le taux des
transaminases se normalise (8).
Le tableau clinique d'hépatite fulminante est une
complication rarement observée, dans moins de 1 % des hépatites
aiguës. Elle correspond à une nécrose hépatocytaire
massive qui est fatale dans environ 80 % des cas en l'absence d'une
transplantation hépatique.
I.5.2.2. Phase chronique
Elle concerne environ deux tiers des porteurs de l'AgHBs. Elle
est définie par l'association du portage chronique de l'AgHBs et de la
présence des lésions hépatiques notamment la
nécrose hépatocytaire, l'inflammation et la fibrose (17).
Sur le plan clinique, elle est généralement
asymptomatique et découverte à l'occasion d'un bilan
systématique, parfois même au stade de cirrhose.
Lorsque les signes cliniques sont présents, ils sont
peu évocateurs asthénie, anorexie, gène sous costale et
plus rarement un prurit et un dans les formes cholestatiques (21).
Sur le plan biologique, cytolyse avec des transaminases entre
une et cinq fois la normale, prédominant sur les ALAT.
Sur le plan histologique, une biopsie hépatique permet
de poser le diagnostic de certitude.
Elle renseigne sur 3 éléments
fondamentaux :
· L'activité hépatique avec des
lésions de nécrose et d'inflammation portales,
péri-portales et lobulaires.
· La fibrose en fonction des lésions
cicatricielles, désorganisant progressivement la structure
parenchymateuse, jusqu'à aboutir à la cirrhose.
· Les lésions éventuellement
associées comme la stéatose, la surcharge en fer ou des
lésions d'hépatite alcoolique.
L'évaluation de l'activité cellulaire et de la
fibrose se fait au moyen de scores histologiques tels que le score de KNODELL
ou le score de METAVIR plus récent et mieux reproductible (Tableau
I).
Tableau I: le score
de METAVIR
|
Score METAVIR
|
|
Fibrose absente ou minime
|
F0 ou F1
|
|
Fibrose modérée
|
F2
|
|
Fibrose sévère
|
F3
|
|
Cirrhose
|
F4
|
Source :
https://www.elsevier.com/fr-fr/connect/medecine/fibrose-et-hepatite-chronique-c-education-therapeutique
CHAPITRE II : DIAGNOSTIC ET
TRAITEMENT
II.1.Diagnostic biologique
II.1.1.Exploration
biochimique
II.1.1.1.Les transaminases
Représenté par l'aspartate
aminotransférase (ASAT, appelée aussi transaminase
glutamate-oxaloacétate [TGO]) et l'alanine aminotransférase
(ALAT, appelée aussi transaminase glutamate-pyruvate [TGP]) (15).
Ø Intérêt : Le taux
élevé des transaminases dans le sang signe l'existence d'une lyse
cellulaire (cytolyse) comme dans les hépatites virales, microbienne ou
toxique. Le dosage des transaminases permet d'évaluer le degré de
souffrance cellulaire hépatique notamment les hépatocytes.
Ø Méthodes : « COBAS
INTEGRA® 400 Plus »
Enzymatique (technique cinétique).
Ø Principe :
§ dosage quantitative des deux enzymes principales
l'aspartate et l'alanine aminotransférase dans le sang.
§ Le pyridoxal phosphate agit comme coenzyme dans la
transamination, il garantit une activation enzymatique complète.
· POUR L'ASAT (TGO):
L'aspartate + 2-oxoglutarate AST
oxaloacétate + L-glutamate
Oxaloacétate + NADH + H+ MDH
L-malate +NAD+
· POUR L'ALAT (TGP) :
L-alanine + 2-oxoglutarate ALT pyruvate
+L-glutamate
Pyruvate + NADH +H+LDH L-lactate
+NAD+
Ø Valeurs consensuelles avec activation par le
pyridoxal phosphate pour ASAT et ALAT
Tableau
II:Représente les valeurs consensuelles avec activation par le
pyridoxal phosphate pour ASAT et ALAT
|
ALAT (dosage à 37°C)
|
ASAT (dosage à 37°C)
|
|
Homme
|
8 à 45 UI/L
|
10 à 40 UI/L
|
|
Femme
|
6 à 35 UI/L
|
10 à 35 UI/L
|
|
Nouveau-née
|
5 à 35 UI/L
|
20 à 80 UI/L
|
|
Enfant (4 à 14 ans)
|
10 à UI/L
|
10 à 35 UI/L
|
Source : (https://sante.journaldesfemmes.fr/fiches-anatomie-et-examens/2506218-transaminases-asat-alat-tgp-sgpt-elevees-basses-normes-causes/)
II.1.1.2.Dosage de la
Phosphatase alcaline
La phosphatase alcaline (PAL) est une enzyme présente
dans de nombreux tissus. Elle hydrolyse les phosphates organiques et
libère des phosphates minéraux insolubles indispensables pour la
calcification et la minéralisation du squelette osseux et joue
également un rôle de « transporteur » des radicaux
phosphates et d'autres substances (lipides et Ca2+ au niveau de l'intestin).
(12)
Ø Intérêt :
§ Joue le rôle de « transporteur » de
radicaux phosphates et d'autres substances (lipides et Ca2+ au niveau de
l'intestin). (12).
§ La mesure de son activité dans le sérum
participe au diagnostic et à la surveillance de nombreuses affections
d'origine, hépatique, cancéreuse ou osseuse. (12).
Ø Méthode : « COBAS
INTEGRA® 400 Plus »
Test in vitro pour la détermination quantitative de la
phosphatase alcaline dans le sérum et le plasma humains sur le
système COBAS INTEGRA® 400 Plus. Son l'élévation
confirme le signe de rétention hépatique (blocage au niveau du
foie).
Ø Principe de la méthode :
Basé sur le test colorimétrique selon une
méthode standardisée.
Tableau
III:Représente les valeurs consensuelles pour la Phosphatase
Alcaline :
|
Sexe
|
Homme
|
Femme
|
|
Valeurs (U/L)
|
40-130
|
35-105
|
Source : (Neffoussi, 2020)
II.1.1.3.La bilirubine
totale
La bilirubine provient principalement de la dégradation
de l'hémoglobine dans le sang ou les organes
hématopoïétiques (bilirubine totale, libre, ou
conjuguée), ensuite la bilirubine est transportée liée
à l'albumine jusqu'au foie où elle subit une conjugaison
(bilirubine conjuguée ou directe) pour devenir soluble et
excrétée dans la bile et les voies biliaires. La bilirubine
totale est la somme des fractions de la bilirubine non conjuguées et
conjuguées.(18)
Ø Intérêt :
§ Confirmer et évaluer le degré
d'Ictère.
§ Dépister les Maladies hépatiques : signes
d'hépatites, de cholestase.
§ Paramètre important dans le bilan
hépatique systématique.
§ Signe l'Anémie hémolytique et permet son
évaluation.
Ø Méthode : « COBAS
INTEGRA® 400 Plus »
Test in vitro pour la détermination quantitative de la
bilirubine totale, conjuguée ou libre dans le sérum et le plasma
humains par le système COBAS INTEGRA® 400 Plus.
Ø Principe :
Il est basé sur le dosage de la bilirubine totale et
conjuguée soit par réaction colorimétrique ou par la
spectrophotométrie directe.
Tableau
IV:Représente les valeurs normales de la Bilirubine
|
Désignation
|
Valeurs Enfant-Adulte
|
|
Bilirubine Totale
|
3-10 mg/l (5-17 umol/l)
|
|
Bilirubine libre (indirecte)
|
2-7 mg/l (3-12 umol/l)
|
|
Bilirubine conjuguée (directe)
|
1-3 mg/l (2-5 umol/l)
|
Source :
(https://www.doctissimo.fr/html/sante/analyses/ana_enzymes01.htm)
II.1.1.4.Gamma-GT
Cette enzyme catalyse le transfert du groupement
gamma-glutamyl sur d'autres peptides .On la retrouve élevée dans
certaines affections hépatobiliaires telles que : la cholestase intra et
extra hépatique, le processus expansif intra-hépatique (tumeur
bénigne ou maligne), l'hépatique aiguë secondaire à
l'intoxication éthylique (par l'alcool).(46)
Le dosage de cette enzyme a un double intérêt :
soit en association avec le dosage des autres activités enzymatiques
(transaminases et phosphatases alcalines) soit comme un examen de
dépistage témoignant d'une atteinte hépatique.(46)
Tableau
V:Représente les valeurs normales des Gamma-GT
|
GAMMA-GT (dosage 37°C)
|
|
Homme
|
15 à 55 UI/L
|
|
Femme
|
10 à 40 UI/L
|
|
Enfant
|
7 à 27 UI/L
|
Source :
(https://www.doctissimo.fr/html/sante/analyses/ana_enzymes03.htm)
II.2. Exploration
Sérologique
II.2.1.Tests de
dépistage du VHB
L'antigène de surface (AgHBs) est le marqueur
sérologique le plus couramment utilisé pour le dépistage
du VHB.
Dans la présente étude, la recherche de l'Ag HBs
est réalisée par le test immunologique micro-particulaire par
chimiluminescence (CMIA) sur l'Automate Architect i1000 d'Abbott.
II.2.1.1. Test immunologique
micro-particulaire par chimiluminescence(CMIA)
Le dosage par l'automate ARCHITECT (Abbott) est un dosage
immunologique micro-particulaire par chimiluminescence (CMIA) pour la
détection qualitative de l'Ag HBs dans le sérum.

Figure 2: Automate
Architect (Abbott) utilisé au laboratoire de Bactériologie
Virologie de Djibouti.
1. Un module d'analyse immunologie
2. Un passeur d'échantillons RSH
3. Un centre de contrôle
I.2.1.1.1. Principe de la
technique
Les méthodes CMIA permettent d'identifier les
antigènes et les anticorps associés aux infections
hépatiques virales. Dans la réaction finale, les conjugués
antigène-anticorps liés marqués àl'acridinium sont
utilisés pour générer un signal chimiluminescents. Le
principe de la chimiluminescence est le marquage des anticorps par des
composés chimiluminescents, capables, en présence du carboxamide
d'acridinium, de produire de la lumière proportionnellement à la
concentration en antigène (Figure 5).

Figure
5:Principe de test Immunologique par Chimiluminescence
Source : (
www.menarinidiag.co.uk).
En pratique, des anticorps monoclonaux, dirigés contre
l'Ag HBs, sont fixés sur des microparticules magnétiques, et mis
en incubation avec le sérum du patient. Des anticorps monoclonaux
dirigés contre l'Ag HBs marqués au carboxamide d'acridinium sont
rajoutés au milieu réactionnel. Les puits de la microplaque sont
exposés à un champ magnétique, qui sépare les
microparticules des anticorps. La solution est ensuite alcalinisée, ce
qui induit l'émission de lumière par le composé
chimiluminescents. La lumière mesurée est proportionnelle
à la concentration de l'Ag HBs dans la solution.
I.2.1.1.2. Résultats et
interprétation
Le test calcule le résultat sur la base du rapport
E/VS.
E/VS = URL (Unité Réduite de Lumière) de
l'Echantillon / Valeur URL Seuil.
- Calcul de la valeur seuil :
- Valeur URL moyenne du calibrateur 1 x 0,074 =
Valeur URL seuil
Les échantillons dont la valeur E/VS est
inférieure à 1,00 sont considérés comme
négatifs.
Les échantillons dont la valeur E/VS est
supérieure ou égale à 1,00 sont considérés
comme réactifs et doivent être réanalysés en
double.
Les échantillons réactifs de façon
répétable pour l'Ag HBs dans notre étude sont
analysés par le test immunoenzymatique de type ELISA (Enzyme Linked
Immuno Sorbent Assay) de 3 ième générations et test de
neutralisation. (33)
II.2.1.2. Test ELISA
La technique ELISA est réalisé à l'aide
du Kit « Murex HBs Ag version 3 », qui est d'une grande
sensibilité et d'une grande spécificité.(33)
II.2.1.2.1. Principe de la
technique
La technique ELISA utilisé se fait par le Kit «
Murex HBs Ag version 3 » (Abbott Diagnostics). Dans ce test
l'échantillon est préincubé dans des cupules recouvertes
d'un mélange d'anticorps monoclonaux de souris spécifiques de
différents épitopes du déterminant `'a'' de l'AgHBs. Des
anticorps de chèvre purifiés dirigés contre l'AgHBs
conjugués à la peroxydase de raifort sont alors ajoutés
à l'échantillon contenu dans la cupule. Lors des deux
étapes d'incubation, tout AgHBs présent dans
l'échantillon, forme un complexe
anticorps-antigène-anticorps-enzyme dans la cupule. (33)
S'il n'y a pas d'AgHBs, le conjugué ne sera pas
lié. Une solution contenant le substrat TMB (3,3',
5,5'-tétraméthylbenzidine) et de l'eau oxygénée est
ajoutée dans les cupules.
Les cupules qui contiennent de l'AgHBs, et donc du
conjugué lié, développeront une couleur violette qui vire
à l'orange lorsque la réaction enzymatique est stoppée par
de l'acide sulfurique.(33)
L'intensité de la coloration est
déterminée par spectrophotométrie et elle est directement
proportionnelle à la quantité d'AgHBs présent dans
l'échantillon.

Figure
6:principe de test ELISA
Source : (Fatima
B, 2016)
II.2.1.2.2. Procédure
de dosage
Une plaque (9F80-01) de 96 cupules, recouverte d'anticorps
monoclonaux de souris dirigés contre l'Ag HBs, est utilisée pour
ce dosage. (33)
Vingt-cinq microlitres (25ìL) de diluant pour
échantillon sont ajoutés dans chaque cupule. Ce diluant est un
tampon vert/brun avec des détergents et des protéines de
chèvre et de boeuf. Après addition de l'échantillon ou du
contrôle, cette couleur vire au bleu/vert, ce changement de coloration
peut varier d'un échantillon à l'autre mais doit toujours
être visible.
Ensuite, 75ìL d'échantillon à tester ou
de contrôle sont ajoutés dans les cupules. Le contrôle
négatif est un sérum humain normal, alors que le positif est un
sérum humain inactivé. Chacun des deux sérums est
dilué dans du tampon contenant des protéines d'origine bovine.
Le contrôle négatif est déposé dans
les puits A1 et B1, et le positif dans le puits C1. L'ajout des contrôles
dans les puits indiqués sur chaque plaque se fait après avoir
distribué les échantillons à tester. L'utilisation d'un
fond blanc est utile pour visualiser l'addition des échantillons. Ces
derniers doivent être soigneusement homogénéisés
avec le diluant pour échantillon.
La plaque est ensuite recouverte d'un couvercle et
incubée pendant 1 heure à 37°C dans des conditions
d'humidité.
A la fin du temps d'incubation on ajoute immédiatement
dans chaque puit 50ìL de conjugué. Ce dernier est de couleur
brune, il contient des AC (monoclonaux de chèvre) lyophilisés,
marqués à la peroxydase de raifort dans une base protéique
bovine.
Après incubation de la plaque, recouverte, pendant
30min à 37°C dans des conditions d'humidité, cette
dernière est lavée, automatiquement, par un liquide de lavage
qu'on prépare par la dilution de la Glycine/Borate au 1/20 à
l'eau distillée. Ce système automatique est programmé sur
5 cycles de lavage, le rôle de ce dernier est d'éliminer tous les
éléments non fixés. (33)
Après lavage de la plaque, 100ìL de solution
substrat sont immédiatement ajoutés dans chaque cupule. Cette
solution est préparée par l'ajout d'un volume de diluant du
substrat incolore à un volume égal de concentré de
substrat rose contenant de la 3,3', 5,5'- tétraméthylbenzidine
« TMB »et des stabilisants. La solution substrat devient pourpre au
contact les puits positifs.
La dernière incubation de la plaque se fait pendant 30
min à l'abri de la lumière. Une couleur pourpre proportionnelle
à la quantité d'AC devrait apparaître dans des puits
contenant des échantillons positifs.
Cinquante microlitres (50ìL) de solution d'arrêt
(acide sulfurique) sont ajoutés dans chaque cupule. Enfin, la lecture de
la densité optique est effectuée dans les 15 min à la
longueur d'onde 450nm. (33)
II.2.1.2.3. Résultats
et interprétation
Les échantillons fournissant une densité optique
inférieure à la valeur seuil sont considérés comme
initialement nom réactifs dans le dosage.
Les échantillons fournissant une densité optique
élevée sont considérés comme initialement
réactifs dans le dosage. Ces échantillons ont été
réanalysés en double en utilisant le prélèvement
d'origine. Les échantillons réactifs pour au moins une des
réanalyses sont considérés comme réactifs de
manière reproductible et présumés contenir l'Ag HBS et
doivent être confirmée par le test de confirmation. Les
échantillons non réactifs dans les deux puits lors de la
réanalyse sont considérés comme non réactif.
II.2.1.3. Tests de
confirmation
Tous les sérums positifs subissent un test de
confirmation par le Kit Murex HBsAg confirmatory Version 3, dont le
fonctionnement est basé sur l'utilisation d'un anticorps
spécifique de neutralisation des échantillons trouvés
réactifs par le test Murex HBs Ag. Contrairement au test Ag HBs qui
utilise des anticorps de chèvre et de souris, le réactif de
confirmation utilise un anticorps spécifique dérivé du
cheval (qui est génétiquement plus proche de l'homme que la
chèvre ou la souris), ce qui minimise le risque de confirmation
d'échantillon faussement positifs contenant des anticorps
anti-espèce.(33)
II.2.1.3.1. Principe de la
méthode
Deux cupules sont attribuées à chaque
échantillon à analyser, le test Murex AgHBs est effectué
selon la procédure habituelle (ELISA AgHBs), à la
différence près que le diluant échantillons est
remplacé par le réactif contrôle (sérum de cheval,
de chèvre, sérum bovin et humain non réactif à
l'AgHBs) dans la cupule contrôle et par le réactif
spécifique (anticorps spécifique de cheval dirigés contre
l'AgHBs) dans la cupule spécifique.
Au cours de la première incubation, l'Ac anti-HBs de
cheval du réactif spécifique entre en compétition avec
l'Ac de souris immobilisés sur la cupule pour se fixer sur l'AgHBs
présent dans l'échantillon et réduire ainsi la
quantité d'Ag HBs lié à la cupule, dans la cupule
contrôle, aucune compétition n'a lieu et l'Ag HBs se lie
normalement, le conjugué est ensuite ajouté et le test est
effectué de manière normale. Dans les échantillons
contenant l'Ag HBs, il y aura une différence significative entre la DO
obtenue dans la cupule de contrôle et celle obtenue dans la cupule
spécifique, si l'inhibition dans la cupule spécifique
dépasse 50% l'échantillon est considéré comme
confirmé réactif.(33)
II.2.1.3.2. Procédure
du test
Vingt-cinq microlitres (25ìL) de réactif
contrôle ou de réactif spécifique sont ajoutés dans
les cupules appropriées.
Le réactif contrôle est un tampon de couleur
jaune contenant du sérum de cheval, de chèvre, du sérum
bovin et humain non réactifs pour l'Ag HBs ainsi que des
détergents conservateurs : ProClin R 300 (0.05 %).
Le réactif spécifique est un tampon de couleur
rouge contenant des anticorps spécifiques de cheval dirigés
contre l'Ag HBs, ainsi que des détergents conservateurs : ProClin R 300
(0.05 %).
Soixante-quinze microlitres (75ìL) de contrôle
Murex Ag HBs et d'échantillon à analyser sont ajoutés dans
les cupules.
La plaque est ensuite remuée à l'aide d'un
agitateur pour plaques pendant 10 secondes. Elle peut également
être agitée manuellement en tapotant doucement sur le
côté pendant 10 secondes. (33)
A partir de cette étape le test est effectué
d'une manière normale (même procédure qu'ELISA)

Figure
7:Configuration du test de confirmation pour la détection
des AgHBs
Source : (Fatima B, 2016)
II.2.1.3.3. Lecture des
résultats
Pour la lecture des résultats, on calcule d'abord la
densité optique moyenne du contrôle négatif incubé,
avec le réactif spécifique et le réactif contrôle.
(33)
Exemple : DO du contrôle négatif avec le
réactif spécifique (NS) =0.08 DO du contrôle négatif
avec le réactif contrôle (NC) = 0.086
La moyenne du contrôle négatif = 0.083
La valeur seuil est ensuite calculée comme étant
égale à la densité optique moyenne des contrôles
négatifs + 0.05.
Le pourcentage d'inhibition du contrôle positif avec le
réactif spécifique est calculé comme suit :
ü Exemple : DO du contrôle positif avec le
réactif contrôle (PC) = 1.061 DO du contrôle positif avec
le réactif spécifique (PS) = 0.121 Inhibition par le
réactif spécifique : (PC- NC) - (PS- NS) x100 / (PC- NC) =
95.8%
L'inhibition des échantillons réactifs se
calcule selon l'exemple suivant :
ü DO de l'échantillon avec le réactif
contrôle (EC) = 0.648. DO de l'échantillon avec le réactif
spécifique (ES) = 0.099. L'inhibition par le réactif
spécifique = (EC -NC) - (ES- NS) x100 / (EC- NC) =96.6%
II.2.1.3.4.
Interprétation des résultats
Pour qu'un échantillon puisse être
considéré comme confirmé réactif par le test Murex
HBsAg, les critères suivants doivent être remplis (33) :
- la densité optique avec le réactif
contrôle doit être supérieure ou égale à la
valeur seuil.
- l'inhibition par le réactif spécifique
doit être supérieure ou égale à 50%.
Pour l'échantillon fortement réactif, les
pourcentages peuvent parfois dépasser les 100%. Si la densité
optique dans la cupule contrôle est inférieure à 2, les
échantillons fournissant une inhibition inférieure à 50%
par le réactif spécifique sont considérés comme
négatifs et donc faussement réactif par le test Murex HBsAg.
Un pourcentage d'inhibition négatif peut être
obtenu et doit également être considéré comme un
résultat négatif (le contrôle et le spécifique
seront tous négatifs).
II.3.Traitement et
vaccination
II.3.1.Traitement curatif
A la phase aiguée de l'hépatite virale B, le
traitement antiviral spécifique est inutile. Scules des mesures
symptomatiques peuvent être prises, associées à
l'éviction de l'alcool et des médicaments
métabolisés par le foie. Une transplantation hépatique
d'urgence est nécessaire dans la forme fulminante. (29)
Le traitement antiviral spécifique trouve sa place dans
l'hépatite chronique B, l'objectif étant d'obtenir l'arrêt
de la réplication virale, afin de prévenir l'évolution
naturelle de la maladie vers les complications. La réponse au traitement
comporte 3 phases:
· La première phase marquée par une
diminution de la réplication virale, traduite par une diminution de
l'ADN viral sérique. L'activité de l'hépatite chronique
régresse, la fibrose se stabilise et peut même diminuer.
· La deuxième phase intervient lorsque
l'activité antivirale est suffisamment forte et prolongée,
accompagnée d'une réponse immunitaire adaptée avec la
clairance des hépatocytes infectés. Une séroconversion HBe
peut intervenir et le risque de réactivation est faible troisième
phase marquée par une réplication virale complètement
interrompue (PADN indétectable). La séroconversion HBe en stabic,
l'AgHBs disparait avec ou sans apparition des anticorps anti-HBs. Le risque de
réactivation spontanée est nul et l'activité disparait
II.3.2. Antiviraux actuellement
disponibles (30-2).
Actuellement les 2 types de molécules utilisées
dans le traitement des hépatites B sont l'interféron alpha ou les
analogues de nucléosides ou des nucléotides
II.3.2.1.Interféron
Il existe sous deux formes: l'interféron standard et de
l'interféron alpha 2a sous forme pégylé.
Les interférons ont 3 types d'activité anti
virale inhibition de la transcription virale, Stimulation des lymphocytes TCD8
cytotoxiques et activité anti-tumorale. (30-2)
II.3.2.2. Interféron standard.
On distingue: l'interféron alpha 2a (Roféron
A®) et l'interféron alpha 2b (Intron
A®). Les posologies recommandées à l'heure
actuelle sont 5 million d'unités par jour ou 10 millions d'unités
trois fois par semaine, par voie sous cutanée. La durée du
traitement et de 24 semaines dans les cas d'hépatite chronique B AgHBe
positif et Les effets secondaires de l'interféron sont fréquents
et nombreux, mais peu graves et réversibles à l'arrêt du
traitement. On peut avoir un syndrome grippal, un syndrome dépressif, la
décompensation d'une psychose préexistante, une
dysthyroïdie.(30-2)
II.3.2.3. Interféron
pégylée
L'interféron pégylée est
l'interféron standard, conjugué à une molécule de
polyéthylène glycol (PEG), augmentant ainsi la demi-vie
plasmatique de la molécule. La concentration plasmatique est donc plus
stable, permettant une seule injection par semaine. L'IFN PEG administre en une
injection par semaine est plus efficace, dans le traitement de
l'hépatite B AgHBe positive chronique que L'IFN standard en trois
injections par semaine Il est mieux toléré que IIFN standard. Il
existe sous le nom d'interféron alpha 2a sous forme
pégylée (Pegasys®). (30-2)
II.3.2.4. Lamivudine
Est un analogue nucléosidique qui inhibe directement
l'ADN polymérase du VHB. Elle est commercialisée sous le nom de
Zeffix dosée à 100 mg. Les avantages de la lamivudine sont le
prise orale par comprimé à 100 mg, une excellente
tolérance un effet antiviral rapide Son inconvénient majeur est
l'apparition de souches résistantes à la Lamivudine.(30-2)
II.3.2.5. Adéfovir
La molécule administrée est l'Adéfovir
dipivoxil, commercialisée sous le nom de Hepsero®, C'est
un inhibiteur compétitif de l'ADN polymérase qui bloque la
synthèse de l'ADN du VHB.
VHB et qui entrainent le moins de résistant. De
nouvelles molécules sont en cours d'étude pour le traitement de
l'hépatite chronique.(30-2)
II.3.3.Stratégie
thérapeutique
Les tendances actuelles sont de traiter par INF PEG les
patients jeunes et ceux infectés par un génotype A ou B et
éventuellement de proposer un traitement par analogue pour les autres
patients. En cas d'échec ou de contre-indication au traitement par
interféron, les analogues nucléosidiques doivent être
utilisés.(30-2)
II.3.3.1. Indications du
traitement antiviral
· Le traitement antiviral ne s'envisage que dans le cadre
des hépatites B chroniques. Le principal facteur à prendre en
compte est la gravité de la maladie hépatique,
déterminée par la PBH.
· Le traitement est indiqué chez les patients
ayant une activité modérée ou sévère
(activité METAVIR=A2) et/ou une fibrose sévère (fibrose
METAVIR= F2)
· Les patients ayant une activité hépatique
minime et/une fibrose minime ne doivent pas être traités, mais
surveillés de façon régulière, afin d'instaurer un
traitement en cas d'apparition d'une activité modérée ou
sévère.
· Les patients AgHBs positifs avec des manifestations
extra hépatiques doivent être traités si la multiplication
virale est active et jugée responsable de ces manifestations. (30-2)
II.3.4.Traitement
préventif
La prévention de l'infection à VHB repose sur
des mesures d'ordre général, l'immunisation passive et la
vaccination.
II.3.4.1. Mesures
générales
Ces mesures Visent à éviter la survenue de
l'infection à VHB.(30-2)
Les mesures les plus pertinentes sont
· l'utilisation de préservatifs.
· l'éviction du don de sang des
échantillons positifs pour l'AgHBs, pour les anticorps anti HBc ou ayant
les transaminases élevées.
· l'utilisation de matériel
médico-chirurgical et dentaire à usage unique ou correctement
stérilisé.
· le port de gants lors des soins.
· promouvoir les programmes de réduction de
drogues illicites par voir veineuse.
· proscription absolue du partage interindividuel du
matériel pouvant être en contact avec le sang (brosse à
dents, rasoirs)
II.3.4.2. Immunisation
passive
L'immunisation passive repose sur l'injection
d'immunoglobulines spécifiques anti-HBs obtenues à partir de
sujets immunisés contre le VHB. Elle confère une protection
immédiate mais transitoire (environ 6 semaines) et permet de
réduire de 75% le risque d'hépatite B chez les patients ayant eu
un comptage pour le VHB(30-2) :
· Contamination accidentelle par piqure ou blessure par
des produits sanguins contenant l'AgHBs dans les 48 heures suivant.
· Contact sexuel avec un sujet infecté par le VHB.
· Sujet à risque élevé d'infection
par le VHB (hémodialysés) pour couvrir la période qui
précède la protection par la vaccination.
· Transplantation hépatique chez un porteur
chronique de l'AgHBs, en dehors virémie détectable avant la
transplantation.
· Nouveau-né de mère porteuse d'AgHBs
Les posologies recommandés de immunoglobulines
spécifique anti HBs sont: 500 UI en cas de contage accidentel, 30 Ul/Kg
chez in nouveau-né et 10 000 UI tous les mois chez les greffes
hépatiques infectés par le VHB et pendant une durée
prolongée afin de maintenir un taux d'anticorps supérieur
à 500 mU/ml.
II.4.Vaccination
Ce schéma justifie généralement
l'administration de plusieurs doses vaccinales:2 à 3 doses
espacées de 4 semaines au cours d'une primo-vaccination, suivis de
rappels d'entretien tous les 5 à 10 ans (cas des vaccins inertes
protéiques).
La réponse vaccinale et influencée par
différents facteurs :
· L'âge : la maturité immunologique
apparait généralement après le deuxième mois vie,
âge minimum actuel de la plupart des vaccinations. Avec l'âge, la
réponse immunitaire décroit, imposant la réalisation
régulière de rappels, mais est encore correcte, même chez
le sujet âgé (rappel tétanos, vaccin contre la grippe).
· Les déficits immunitaires: congénitaux ou
acquis, ils diminuent parfois beaucoup la réponse vaccinale.
· Les facteurs génétiques: complexes et
encore mal connus, ils peuvent influencer le niveau de réponse humorale
ou cellulaire.
II.4.1. Différents types
de vaccins (30-2).
?Vaccins plasmatiques : Ce sont les vaccins
de première génération. Ils sont préparés
à partir de l'AgHBs extrait du plasma de porteurs sains. Ils ont
été initiés et expérimentés par
l'équipe de Maupas au Sénégal, Leur innocuité et
leur efficacité étaient excellentes mais leur technique de
production les rendaient coûteux et de disponibilité difficile. Il
s'agit essentiellement de l'HEVAC B (institut Pasteur), l'HEPTAVAX B (MERCK).
?Vaccins recombinants: Ils sont produits par
génie génétique grâce au clonage de l'ADN virale son
expression dans différents systèmes cellulaires à savoir
la levure ou les cellules des mammifères. Depuis leur production, ils
remplacent les vaccins plasmatiques en raison de leur faible cout et de leur
facilité de production.
Les vaccins recombinants disponibles sont
l'Engerix® ou le Recombivax® derivés de
cellules de levure, le Genhevax B® dérivée de
cellules de mammifères. Il n'y a pas actuellement de preuve formelle de
la supériorité des vaccins recombinants sur les vaccins
plastiques en termes d'immunogénicité mais la production des
anticorps antipréS2 est plus précoce que celle des ant-HBs et
leur cinétique différente pourrait permettre d'espère une
couverture meilleure en titres d'anticorps et en durée.
II.4.2. Protocole de
vaccination(30-2-49-20).
· Un schéma vaccinal préférentiel en
trois injections est recommandé. Il doit respecter un intervalle d'au
moins 1 mois entre la première et la deuxième injection, et un
intervalle de 5 à 12 mois entre la deuxième et la
troisième injection.
· Un autre schéma est possible,
accéléré, avec injection à 0, 1, 2, 12 mois, qui
confère une protection plus rapide, et doit permettre une meilleure
complaisance,
· Dans des circonstances exceptionnelles, lorsqu'une
immunité encore plus rapide est nécessaire, (par exemple pour un
voyageur se rendant dans des zones de haute endémie qui commence un
schéma de vaccination contre hépatite B dans le mois
précédente le départ, et pour les étudiants en
filière de santé), un schéma de 3 injections
intramusculaires pratiquées à 0, 7 et 21 jours peut être
proposé. Lorsque ce schéma est appliqué, une dose de
rappel est recommandée 12 mois après la première
injection.
· Au-delà des injections du schéma
vaccinal, les doses de rappel ne sont pas recommandées chez les
personnes connues pour avoir répondu à la vaccination (Ac Anti
HBs > 10mUI/mL), même si le taux d'Ac Anti HBs est devenu
indétectable(30-2).
· . Chez les enfants nés de mère Ag HBs
positif, la vaccination doit être pratiquée impérativement
à la naissance dans les 24 premières heures. associée
à l'administration d'immunoglobulines Anti HBs dans 2 sites
différents. Deux schémas d'immunisation peuvent être suivis
un schéma vaccinal de trois injections (0, 1.6 mois), et un de quatre
injections (0, 1, 2,12 mois) qui confère une immunité plus
rapide. Cette prévention doit être évaluée par un
contrôle sérologique de l'Ag HBs et un titrage des Ac Anti HBs
à partir de l'âge de 9 mois,
· . En cas d'exposition avéré ou
supposée au virus de l'hépatite B exemple Piqûre avec une
aiguille contaminée), il faut administrer dans les 24 heures, la
première dose de vaccin simultanément avec des immunoglobulines
anti hépatite B en deux sites d'injection séparés.
· Le schéma de primo-vaccination 0, 1,2 et 12 mois
doit être préféré la vaccination contre le VHB
· Chez les patients porteurs du VIH, la vaccination
contre le VHB est recommandée chez tous les patients sans marqueurs du
VHB selon un schéma en fonction du taux de lymphocytes TCD4.
· Au Sénégal cette vaccination a
été introduite dans le PEV depuis 2006 sous une forme
conjuguée à 4 autres vaccins constituant ainsi un vaccin
pentavalent administré selon le calendrier suivant:
Tableau VI: calendrier vaccinale de 0
à 11 mois
|
Vaccins
|
Maladies cibles
|
Age
|
|
BCG
|
Tuberculose
|
De la naissance à 3 mois
|
|
VPO Zéro
|
Poliomyélite
|
De la naissance au 14 e jour
(2 semaine)
|
|
Pentavalent 1,
(VPO 1)
|
Diphtérie, Tétanos, Coqueluche, Hépatite
B, Infection à Haemophilus Influenzae Type B, Poliomyélite
|
6 semaines
|
|
Pentavalent 2,
(VPO 2)
|
10 semaines
|
|
Pentavalent 3,
(VPO 3)
|
14 semaines
|
|
VAR
|
Rougeole
|
9 mois
|
|
VAA
|
Fièvre jaune
|
9 mois
|
Source : (Marta, 2018)
II.4.3.Voie d'administration du
vaccin (20)
La voie d'administration des différents vaccins doit
être intramusculaire (IM) dans la région deltoïdienne chez
l'adulte, dans la partie antérolatérale de la cuisse ou
quadricipitale haute chez le nouveau-né et les jeunes enfants.
La voie IM fessière est formellement
déconseillée car elle peut être à l'origine d'une
réponse immunitaire plus faible.(20)
II.4.4. Réponse
immune
La réponse au vaccin contre l'hépatite B est
fondée sur le dosage de l'anticorps anti-HBs, un à deux mois
après la troisième injection vaccinale un taux d'anticorps
anti-HBs égal ou supérieur à 10 mUI/ml est
considéré comme protecteur suivant les normes françaises
et américaines (48).
II.4.5. Stratégies
vaccinales contre l'hépatite B
La vaccination simultanée des nourrissons, des
pré-adolescents et des sujets à risque permettrait de diminuer de
90% le portage du VHB (14). C'est dans ce cadre que l'OMS recommande depuis
1992 d'introduire la vaccination systématique de tous les nourrissons
dans les programmes nationaux de vaccination 20).
Au Sénégal un Programme National de Lutte contre
l'Hépatite B a été mis en place depuis 1999, dons le but
principal et d'obtenir une couverture vaccinale large et efficace des
populations exposes et à risque, en vue de l'éradication de cette
affection. Ainsi grâce à ce programme la vaccination anti
hépatite B a été introduite dans le Programme Elargi de
Vaccination (PEV) depuis 2006 (2-20).
En outre, dans nos pays de forte endémicité,
l'OMS recommande d'administrer la première dose de vaccin dès la
naissance. Cependant lorsqu'il n'y a pas de programme de Vaccination à
la naissance, comme c'est le cas au Sénégal les femmes enceintes
doivent faire un dépistage de l'AgHbs systématique au
troisième trimestre de la grossesse et les nouveau-nées de
mère porteuse de l'AgHBs devront être vaccinées à la
naissance, avec l'administration d'immunoglobulines, si celle-ci est
possible.
II.5. Conclusion
Le fait que l'homme soit l'unique réservoir du virus
permet d'envisager un contrôle efficace de l'infection par le VHB. Des
études menées dans de nombreux pays à forte endémie
ont montré une différence notable des prévalences des
porteurs de l'AgHBs avant et après vaccination. La capacité du
vaccin à réduire l'importance du portage chronique et donc celle
du réservoir du virus est certaine. Des couvertures vaccinales
élevées dans des pays de faible endémie (tels les USA ou
l'Italie par exemple) ont démontré l'efficacité du vaccin
pour diminuer le nombre des hépatites aiguës. Mais il convient
toutefois de rappeler que la diminution de l'incidence ne sera suivie qu'avec
retard d'une diminution sensible du nombre des personnes ayant une infection
chronique par le VHB, personnes qui constituent le réservoir d'infection
et chez qui surviendront les complications tardives (cirrhose, carcinome
hépatocellulaire). Ainsi, même dans les pays où les
chiffres d'incidence montrent une nette tendance à la diminution du
nombre de cas d'hépatite aiguë, le poids de la maladie, lié
aux contaminations passées, reste important en termes de complications
et de mortalité. On estime que 15% à 25% des patients atteints
d'hépatite B chronique vont mourir de cirrhose ou de carcinome
hépatocellulaire. Une étude menée aux Etats-Unis sur les
données nationales de mortalité de 1979 à 1998, montre un
taux de mortalité liée au virus de l'hépatite B augmentant
de 0,1 à 0,4 pour 100000 (chiffres ajustés sur l'âge). Sur
la même période, le nombre d'hospitalisations en relation avec le
virus de l'hépatite B a été multiplié par 4,9
(34).
Il apparaît donc impératif, au
Sénégal, d'améliorer l'application des recommandations
vaccinales, en particulier la vaccination des nourrissons et des
préadolescents, mais aussi des personnes avec un risque accru de
contracter l'hépatite B. L'application des mesures de prévention
autour des cas d'hépatite B aiguë et de portage chronique, mais
aussi la sérovaccination des nourrissons nés de mère
porteuse de l'antigène HBs doivent être renforcées (34).
II.6.
Références
1. Albin C, Robinson WS. Protein kinase
activity in hepatitis B virus. J Virol., 1980 ; 34: 297- 302
2. Bayer ME, Blumberg BS, Werner B. Particles
associated with Australia antigen in the sera of patients with leukaemia,
Down's syndrome and hepatitis. Nature., 1968 ; 218:1057-9
3. Blumberg BS, Gerstley BJ, Hungerford DA,
London WT, Sutnick AI. A serum antigen (Australia antigen) in Down's
syndrome, leukemia, and hepatitis. Ann Intern Med, 1967 ; 66 (5):924-31
4. Blumberg BS. Australia antigen and the
biology of hepatitis B. Science, 1977 ; 197 (4298):17-25
5. Protzer-Knolle U, Naumann U,
Bartenschlager R, Berg T, Hopf U, Meyer zum Buschenfelde KH, Neuhaus P, Gerken
G: Hepatitis B virus with antigenically altered hepatitis B surface antigen is
selected by high-dose hepatitis B immune globulin after liver transplantation.
Hepatology 1998, 27:254-263.
6. Blum HE, Galun E, Liang TJ, von Weizsacker
F, Wands JR: Naturally occurring missense mutation in the polymerase gene
terminating hepatitis B virus replication. J Virol 1991, 65:1836-1842.
7. BLACQUE-BELAIR, A, 1981, Dictionnaire
Médical clinique - Pharmacologique et Thérapeutique .In :
Hépatite viral, 3éme éd, Paris, (833-837) p.
8. Bremer CM, Bung C, Kott N, Hardt M, Glebe
D. Hepatitis B virus infection is dependent on cholesterol in the viral
envelope. Cell Microbio., 2009 ; 11 (2): 249-60
9. Bruss V, Hepatitis B virus morphogenesis.
World J Gastroenterol., 2007 ; 13 (1): 65-73
10. Blumberg BS, Alter HJ, Visnich S. A
«new» antigen in leukemia sera. JAMA, 1965 ; 191(7): 514-6
11. Carman WF, Zanetti AR, Karayiannis P,
Waters J, Manzillo G, Tanzi E, Zuckerman AJ, Thomas HC: Vaccine-induced escape
mutant of hepatitis B virus. Lancet 1990, 336:325-329.
12. CATIE- La
source canadienne de renseignements sur le VIH et l'hépatite C
https:// www .catie.ca/fr/lhepatite-b
13. CHEVROT.M, Phosphatase alcaline,
Laboratoire de biochimie, Groupe hospitalier
Pitié-Salpêtrière, Paris, France, 2017, Disponible sur :
< https://www.em-consulte.com/article/65797/phosphatase-alcaline >. [page
consultée le 21/06/2020].
14. Dane DS, Cameron CH, Briggs M. Virus-like
particles in serum of patients with Australia-antigen-associated hepatitis.
Lancet., 1970 ; 1 (7649):695-8
15. Dény P, Zoulim F. Hepatitis B
virus: from diagnosis to treatment. Pathol Biol. , 2010 ; 58 (4):245-53
16. Desmyter J, De Groote J, Desmet VJ,
Billiau A, Ray MB, Bradburne AF, Edv VG, De Somer P. Administration of human
fibroblast interferon in chronic hepatitis-B infection. Lancet., 1976 ; 2
(7987):645-7
17.
Epidémiologie de l'Hépatite B (hepatoweb.com)
18. Francois G, Kew M, Van Damme P, Mphahlele
MJ, Meheus A: Mutant hepatitis B viruses: a matter of academic interest only or
a problem with far-reaching implications? Vaccine 2001, 19:3799- 3815
19. FOUET.P, 1978, Abrégé
d'hépatologie, 1erTrim-MASSON, Paris (France), (29-30)p.
20. Galibert F, Mandart E, Fitoussi F,
Tiollais P, Charnay P. Nucleotide sequence of the hepatitis B virus genome
(subtype ayw) cloned in E. Coli. Nature., 1979, 281 (5733): 646-50
21. GUIDE DE GESTION DU PROGRAMME ELARGI DE
VACCINATION ET DE LA SURVEILLANCE EPIDEMIOLOGIQUE, Juin 2013
Ministère de sante Sénégal
22. Heermann KH, Goldmann U, Schwartz W,
Seyffarth T, Baumgarten H, Gerlich WH. Large surface proteins of hepatitis B
virus containing the pre-s sequence. J Virol., 1984 ; 52 (2):396- 402
23.
Hépatite B : Réponses SST (cchst.ca)
24. Kay A, Zoulim F. Hepatitis B virus
genetic variability and evolution. Virus Research., 2007 ; 127: 164-76.
25. Korba BE, Brown TL, Wells FV, Baldwin B,
Cote PJ, Steinberg H, Tennant BC, Gerin JL. Natural history of experimental
woodchuck hepatitis virus infection: molecular
virologic features of the pancreas, kidney, ovary and testis.
J Virol., 1990 ; 64 (9): 4499-506
26. Kim WR, Ishitani MB, Dickson ER. Rising
burden of hepatitis B in the United States: should the other virus beforgotten?
53rd Annual Meeting of the American Association for the Study of Liver Diseases
(AASLD). November 1-5, 2002. Boston,MA. Hepatology 2002; 36, 4(2) Abstract
A-223.
27. Liaw YF et al. Resultat of
lamivudine trials in Asia. J Hepatol 2003; 39: 111-115.
28. Mangold CM, Unckell F, Werr M, Streeck
RE. Secretion and antigenicity of hepatitis B virus small envelope proteins
lacking cysteines in the major antigenic region. Virology., 1995 ; 211 (2):
535-43
29. Marta N, HEPATITE B : ETUDE
EPIDEMIOLOGIQUE, Mémoire en vue de l'obtention du Diplôme
Inter-Universitaire International de Vaccinologie, UCAD, 2018.
30. Marcellin P, Asselah T, Boyer N.
Traitement de l'Hépatite Chronique B. Revu Prat 2005 ; 55 :
624-632.
31. Maupas P, Goudeau A, Coursaget P, Drucker
J, Bagros P. Immunisation against hepatitis B in man. Lancet., 1976 ; 1 (7974):
1367-70
32. MacCallum F. Homologous serum hepatitis.
Lancet., 1947 ; 2:691-2
33. Mme Fatima B, La
séroprévalence de l'hépatite virale B dans la
région de Marrakech, pour l'obtention du doctorat en médecine,
CADI AYYAD, 2016
34. M. Idrissa B, Etude de la réponse
vaccinale contre l'hépatite B chez les enfants âgé de 3
mois a 6 ans suivis à l'hôpital des enfants Albert Royer,
Université Cheik Anta Diop DakarHepatocellular carcinoma and type B
hepatitis.
35. Mondellh A, Evolution de la prise en
charge de l'hépatite B en Afrique subsaharienne : enjeux et
perspective, Université Toulouse III Paul Sabatier,
2014
36. Nebbia G, Peppa D, Maini MK Hepatitis B
infection: current concepts and future challenges. Q J Med, 2012 ;
105:109-13
37. Organisation Mondiale de la Santé.
[En ligne] 27 JUILLET 2020.
www.who.int/fr/news-room/fact-sheets/detail/hepatitis-b.
38. Pawlotsky JM: The concept of hepatitis B
virus mutant escape. J Clin Virol 2005, 34 Suppl 1:S125- 129.
39. Pol S. Histoire naturelle de l'infection
par le virus de l'hepatite B. La Presse Médicale., 2006 ; 35:308-16
40. Protzer-Knolle U, Naumann U,
Bartenschlager R, Berg T, Hopf U, Meyer zum Buschenfelde KH, Neuhaus P, Gerken
G: Hepatitis B virus with antigenically altered hepatitis B surface antigen is
selected by high-dose hepatitis B immune globulin after liver transplantation.
Hepatology 1998, 27:254-263.
41. Robinson WS, Clayton DA, Greenman RL. DNA
of a human hepatitis B virus candidate. J Virol., 1974 ; 14 (2):384-91
42. Schaefer S, Hepatitis B virus taxonomy
and hepatitis B virus genotypes. World J Gastroenterol., 2007 ; 13
(1): 14-21
43. Seeger C, Mason WS. Hepatitis B virus
biology. Microbiol Mol Biol Rev., 2000 ; 64 (1):51- 68
44.
SENEGAL : Programme National de Lutte contre les Hépatites - Les
chiffres (hepatites.sn)
45. Summers J, Mason WS. Replication of the
genome of à hepatitis-B like virus by reverse transcription of an RNA
intermediate. Cell., 1982 ; 29 (2): 403-15
46. Summers J, Smolec JM, Snyder R. A virus
similar to human hepatitis B virus associated with hepatitis and hepatoma in
woodchucks. Proc Natl Acad Sci U.S.A., 1978 ; 75 (9): 4533-7
47. Tong SP, Li JS, Vitvitski L, Kay A,
Treepo C: Evidence for a base-paired region of hepatitis B
virus pregenome encapsidation signal which influences the patterns of precore
mutations abolishing HBe protein expression. J Virol 1993, 67:5651-5655.
48. Trepo C. A brief history of hepatitis
milestones. Liver Int., 2014 ; 34 Suppl 1: 29-37
49. VIDAL, La transmission de
l'hépatite B.
https://www.vidal.fr/maladies/estomac-intestins/hepatite-b/causes.html?msclkid=33a9e1cca63511ecb542557f40c4b157
50. Weber B: Genetic variability of the S
gene of hepatitis B virus: clinical and diagnostic impact. J Clin Virol 2005,
32:102-112.
ANNEXES
Annexe 1 :Quelque matériel utilisé

Annexe 2 : les appareils et les réactifs

Annexe n°3 : Représente la technique
d'ELISA

Titre : LA PRISE EN CHARGE DE L'HEPATITE B
Nature : Mémoire de Master II en Biologie
Analyse Biologique (Spécialité : Virologie)
Prénom et Nom du Candidat : Youssouf
Mohamed Youssouf
Jury : Président : Docteur Aliou BA
Enseignant-Chercheur ISRA/Thiès
Membres :
Monsieur Mbaye Coumba Mbothie Directeur AMDI/SANTE
AMDI
Docteur Saliou NGOM
Enseignant-Chercheur UCAD
Docteur Bocar DIOP
Enseignant-Chercheur UCAD
Résumé
Le virus de l'hépatite B (VHB) est transmis par
l'exposition des membranes muqueuses ou de la peau non intacte du sang ou
d'autres liquides organiques infectés. La transmission peut survenir
durant la période périnatale de la mère à l'enfant
et d'une personne à l'autre. La période d'incubation de
l'hépatite B aiguë est en moyenne de 75 jours, mais peut varier
d'environ 30 à 180 jours. La plupart des nouvelles infections sont
asymptomatiques. L'hépatite aiguë B concernent environ 1 % des
infections périnatales, 10 % des infections de la petite enfance et 30 %
des infections chez les personnes âgées de = 5 ans.
L'infection de l'hépatite B chronique a un spectre de
gravité clinique, allant d'asymptomatique à la cirrhose du foie
et au carcinome hépatocellulaire.
MOT-CLE : hépatite B, cirrhose du
foie, carcinome hépatocellulaire, vaccins.
Abstract
Hepatitis B virus (HBV) is transmitted by exposure of infected
mucous membranes or non-intact skin to blood or other body fluids. Transmission
can occur during the perinatal period from mother to child and person to
person. The incubation period for acute hepatitis B is on average 75 days, but
can vary from about 30 to 180 days. Most new infections are asymptomatic. Acute
hepatitis B affects approximately 1% of perinatal infections, 10% of infections
in early childhood, and 30% of infections in people aged = 5 years. Chronic
hepatitis B infection has a spectrum of clinical severity, ranging from from
asymptomatic to liver cirrhosis and hepatocellular carcinoma.
KEY-WORD: hepatitis B, liver cirrhosis,
hepatocellular carcinoma, vaccines.

| 


