|

UNIVERSITE CHEIKH ANTA DIOP DE DAKAR

ECOLE INTER - ETATS DES SCIENCES ET MEDECINE
VETERINAIRES
(E.I.S.M.V.)

ANNEE 2009 N° 19
Synthèse des connaissances actuelles sur
les
avortements dans l'espèce bovine.
THESE
Présentée et soutenue publiquement
Le 23
Juillet 2009 à 15 heures
Devant la Faculté de Médecine,
de Pharmacie et d'Odonto-Stomatologie de
Dakar pour obtenir le grade de
DOCTEUR VETERINAIRE
(DIPLÔME D'ETAT)
Par
M. Pascal NYABINWA
Jury
Président: M. Emmanuel BASSENE
Professeur à la Faculté de Médecine, de
Pharmacie et d'Odonto-Stomatologie de Dakar
Directeur et Rapporteur: M. Germain
Jérôme SAWADOGO
de Thèse Professeur à
l'E.I.S.M.V. de Dakar
Membres: Mme Rianatou Bada ALAMBEDJI
Professeur à l'E.I.S.M.V. de Dakar
M. Serge Niangoran BAKOU
Maître de conférences agrégé à
l'E.I.S.M.V. de Dakar


COMITE DE DIRECTION
LE DIRECTEUR
D Professeur Louis Joseph PANGUI
LES COORDONNATEURS
D Professeur Germain Jérôme SAWADOGO
Coordonnateur des Stages et de la Formation Post-Universitaires
D Professeur Justin Ayayi AKAKPO Coordonnateur
Recherche /Développement
D Professeur Moussa ASSANE
Coordonnateur des Etudes
Année Universitaire 2008 - 2009

PERSONNEL ENSEIGNANT
~ PERSONNEL ENSEIGNANT EISMV
~ PERSONNEL VACATAIRE (PREVU)
~ PERSONNEL EN MISSION (PREVU)
~ PERSONNEL ENSEIGNANT CPEV (PREVU)
~ PERSONNEL ENSEIGNANT DEA-PA
A. DEPARTEMENT DES SCIENCES BIOLOGIQUES ET
PRODUCTIONS
ANIMALES
CHEF DE DEPARTEMENT: Ayao MISSOHOU,
Professeur
SERVICES
1. ANATOMIE-HISTOLOGIE-EMBRYOLOGIE
Serge N. BAKOU Maître de conférence
agrégé
Gualbert Simon NTEME ELLA Assistant
Mlle Sabine NGA OMBEDE Monitrice
Mr Bernard Agré KOUAKOU Moniteur
Mlle Rose Eliane PENDA Docteur Vétérinaire
Vacataire
2. CHIRURGIE -REPRODUCTION
Papa El Hassane DIOP Professeur
Alain Richi KAMGA WALADJO Assistant
Bilkiss V.M ASSANI Docteur Vétérinaire
Vacataire
Fabrice Juliot MOUGANG Docteur Vétérinaire
Vacataire
3. ECONOMIE RURALE ET GESTION
Cheikh LY Professeur
Adrien MANKOR Assistant
Mr Gabriel TENO Moniteur
4. PHYSIOLOGIE-PHARMACODYNAMIE-THERAPEUTIQUE
Moussa ASSANE Professeur
Rock Allister LAPO Assistant
Mr Sabra DJIGUIBET Moniteur
5. PHYSIQUE ET CHIMIE BIOLOGIQUES ET
MEDICALES
Germain Jérôme SAWADOGO Professeur
Mouiche MOULIOM Docteur Vétérinaire Vacataire
Mr Pascal NYABINWA Moniteur
6. ZOOTECHNIE-ALIMENTATION
Ayao MISSOHOU Professeur
Simplice AYESSIDEWEDE Assistant
Kouamé Marcel N'DRI Moniteur
B. DEPARTEMENT DE SANTE PUBLIQUE ET ENVIRONNEMENT
CHEF DE DEPARTEMENT: Rianatou BADA ALAMBEDJI, Professeur SERVICES
1. HYGIENE ET INDUSTRIE DES DENREES ALIMENTAIRES
D'ORIGINE ANIMALE (HIDAOA)
Malang SEYDI Professeur
Bellancille MUSABYEMARIYA Assistante
Khalifa Babacar SYLLA Assistant
Mr David RAKANSOU Docteur Vétérinaire Vacataire
Mr Eugène NIYONZIMA Moniteur
2. MICROBIOLOGIE-IMMUNOLOGIE-PATHOLOGIE
INFECTIEUSE
Justin Ayayi AKAKPO Professeur
Mme Rianatou ALAMBEDJ I Professeur
Philippe KONE Assistant
Jean Marc FEUSSOM KAMENI Docteur Vétérinaire
Vacataire
Abdel-Aziz ARADA IZZEDINE Docteur Vétérinaire
Vacataire
3. PARASITOLOGIE-MALADIES PARASITAIRES-ZOOLOGIE
APPLIQUEE
Louis Joseph PANGUI Professeur
Ou bri Bassa G BATI Maître-assistant
Paul Armand AZEBAZE SOBGO Docteur Vétérinaire
Vacataire
4. PATHOLOGIE MEDICALE-ANATOMIE PATHOLOGIQUE - CLINIQUE
AMBULANTE
Yalacé Yamba KABORET Professeur
Yaghouba KANE Maître-assistant
Mireille KADJA WONOU Assistante
Medoune BADIANE Docteur Vétérinaire (SOVETA)
Omar FALL Docteur Vétérinaire (WAYEMBAM)
Alpha SOW Docteur Vétérinaire (PASTAGRI)
Abdoulaye SOW Docteur Vétérinaire (FOIRAIL)
Ibrahima WADE Docteur Vétérinaire Vacataire
Charles Benoît DIENG Docteur Vétérinaire
Vacataire
Togniko Kenneth TCHASSOU Moniteur
Enock NIYONDAMYA Moniteur
5. PHARMACIE-TOXICOLOGIE
Félix Cyprien BIAOU Maître-Assistant (en
disponibilité)
Gilbert Komlan AKODA Assistant
Assiongbon TEKO AGBO Assistant
Abdou Moumouni ASSOUMY Moniteur
C. DEPARTEMENT COMMUNICATION
CHEF DE DEPARTEMENT: YALACE YAMBA KABORET,
Professeur
SERVICES
1. BIBLIOTHEQUE
Mariam DIOUF Documentaliste
2. SERVICE AUDIO-VISUEL
Bouré SARR Technicien
3. OBSERVATOIRE DES METIERS DE LELEVAGE
(OME)
D. SCOLARITE
El Hadji Mamadou DIENG Vacataire
Mlle Houénafa Chimelle DAGA Monitrice
Mlle Aminata DIAGNE Sécretaire
1.

PERSONNEL VACATAIRE (Prévu)
BIOPHYSIQUE
Boucar NDONG Assistant
Faculté de Médecine et de Pharmacie UCAD
2. BOTANIQUE
Dr Kandouioura NOBA Maître de Conférences
(Cours)
Dr Mame Samba MBAYE Assistant (TP)
Faculté des Sciences et Techniques UCAD
3. AGRO-PEDOLOGIE
Fary DIOME Maître-Assistant
Institut de Science et de la Terre (IST)
4. ZOOTECHNIE
Abdoulaye DIENG Docteur Ingénieur
Enseignant à ENSA - THIES
Léonard Elie AKPO Professeur
Faculté des Sciences et Techniques UCAD
Alpha SOW Docteur Vétérinaire Vacataire
El Hadji Mamadou DIUOF Docteur Vétérinaire
Vacataire
SEDIMA
5. H I D A O A
NORMALISATION ET ASSURANCE QUALITE
Mme Mame S. MBODJ NDIAYE Chef de la division Agro-alimentaire
de l'Institut Sénégalais de Normalisation
ASSURANCE QUALITE - CONSERVE DES PRODUITS DE LA PECHE
Abdoulaye DIAWARA Direction de l'Elevage du Sénégal
1.

PERSONNEL EN MISSION (Prévu)
TOXICOLOGIE CLINIQUE
Abdoulaziz EL HRAIKI Professeur
Institut Agronomique et Vétérinaire Hassan II
Rabat (Maroc)
2. PATHOLOGIE CHIRURGICALE
Mohamed AOUINA Professeur
Ecole Nationale de Médecine Vétérinaire de
TUNISIE
3. REPRODUCTION
Hamidou BOLY Professeur
Université de BOBO-DIOULASSO (Burkina Faso)
4. ZOOTECHNIE-ALIMENTATION ANIMALE
Jamel RKHIS Professeur
Ecole Nationale de Médecine Vétérinaire de
TUNISIE
1.

PERSONNEL ENSEIGNANT CPEV (Prévu)
MATHEMATIQUES
Abdoulaye MBAYE Assistant
Faculté des Sciences et Techniques UCAD
2. PHYSIQUE
Issakha YOUM Maître de Conférences
(Cours)
Faculté des Sciences et Techniques UCAD
André FICKOU Maître-Assistant
(TP)
Faculté des Sciences et Techniques UCAD
3. CHIMIE ORGANIQUE
Abdoulaye SAMB Professeur
Faculté des Sciences et Techniques UCAD
4. CHIMIE PHYSIQUE
Abdoulaye DIOP Maître de Conférences
Mame Diatou GAYE SEYE Maître de Conférences
Faculté des Sciences et Techniques UCAD
Rock Allister LAPO Assistant (TP)
EISMV - DAKAR
Momar NDIAYE Assistant (TD)
Faculté des Sciences et Techniques UCAD
5. BIOLOGIE VEGETALE
Dr Aboubacry KANE Maître-Assistant (Cours)
Dr Ngansomana BA Assistant Vacataire (TP)
Faculté des Sciences et Techniques UCAD
6. BIOLOGIE CELLULAIRE
Serge Niangoran BAKOU Maître de conférences
agrégé
EISMV - DAKAR
7. EMBRYOLOGIE ET ZOOLOGIE
Karomokho DIARRA Maître de conférences
Faculté des Sciences et Techniques UCAD
8. PHYSIOLOGIE ANIMALE
Moussa ASSANE Professeur
EISMV - DAKAR
9. ANATOMIE COMPAREE DES VERTEBRES
Cheikh Tidiane BA Professeur
Faculté des Sciences et Techniques UCAD
10. BIOLOGIE ANIMALE (T.P.)
Serge Niangoran BAKOU Maître de conférences
agrégé
EISMV - DAKAR
Oubri Bassa GBATI Assistant
EISMV - DAKAR
Gualbert Simon NTEME ELLA Assistant - DAKAR
11. GEOLOGIE
FORMATIONS SEDIMENTAIRES
Raphaël SARR Maître de Conférences
Faculté des Sciences et Techniques UCAD
HYDROGEOLOGIE
Abdoulaye FAYE Maître de Conférences
Faculté des Sciences et Techniques UCAD
12. CPEV TP
Travaux Pratiques
Houénafa Chimelle DAGA Monitrice

Mon Fils, n'oublie pas mon enseignement,
Garde en ton coeur
mes recommandations.
Grâce à mes conseils,
Tu
connaîtras le bien-être et une vie longue et heureuse.
Pratique
toujours la bonté et la fidélité;
Conserve-les comme
une parure autour de ton cou,
Grave-les dans ton coeur.
Alors Dieu et les
hommes t'aimeront et apprécieront ton bon sens.
Ne te fie pas
à ta propre intelligence, mais place toute ta conscience dans
le
Seigneur.
Appuie-toi sur lui dans tout ce que tu entreprends et il
guidera tes pas.
Accepte, mon fils, que le Seigneur soit ton
éducateur et ne dédaigne pas ses
reproches.
Pr
3:1-6;11
Merci à Dieu Créateur
Seigneur Mon Dieu tu es grand.
Tu t'habilles de splendeur et
de majesté,
Tu t'enveloppe d'un manteau de lumière.
Que ta
gloire, Seigneur, dure toujours!
Réjouis-toi de ce que tu as fait!
Ps.104, 1-2,31
«Par délibération, la faculté et
l'école ont décidé que les opinions émises dans les
dissertations qui leurs sont présentées, doivent être
considérées comme propres à leurs auteurs et qu'elles
n'entendent leur donner aucune approbation ni improbation».
LISTE DES ABREVIATIONS
á: Alpha
â: Beta
ù: Omega
al.: Abréviation de collaborateur (en latin)
b FGF: basic
Fibroblast Growth Factor
bPAG: Bovin Pregnancy Associated Glycoprotein
b PL: Lactogène
Placentaire Bovine
bTP-1: bovine Trophoblast
Protein Cm: centimètre
CMH: Complexe Majeur d'Histocompatibilité
CS: Somato-mammotrope
CSF-1: Colony Stimulating Factor 1 cTP-1: Caprine Trophoblast
Protein
DRT: Date de Réintroduction de la vache au sein du
Troupeau ECP: Early conception factor
EGF :
Epidermal Growth Factor
EPAF: Embyo
Platelet
Activating Factor EPF:
Early Pregnancy Factor
EPSI:
Endometrial
Prostaglandin Synthetase
Inhibitor
GnRH : Gonadotropin Releasing Hormon
IGF: Insulin growth
factor
IL: interleukines
I NEL: Index
Economique Laitier
INFô : Interferon tau
IVA1: Intervalle vêlage - 1ère
insémination J: jour
kDa: kilos Dalton
Kg: kilogramme
L: litre
LH: Hormone lutéotrope
LIF: Leukemia Inhibitory Factor
MEP: Mortalité embryonnaire précoce MET:
Mortalité embryonnaire tardive MG: Matières grasses
NEC: Note d'état corporel
NF: Non fécondation
ng: nanogramme
OSP: Oviduct
Specific Protein PAF:
Platelet Activating Factor
PAGs: Protéines Associées à la Gestation
PDGF: Platelet
Derived Growth Factor PGF2á :
Prostaglandine F2á
PL: Lactogène
Placentaire
PSP60: Pregnancy Sérum Protein 60 PSPB: Pregnancy Specific
Protein B
RIA: Radioimmuno assy (Dosage
radioimmunologique)
SCF: Colony Stimulation Factor
TGF-â: Transfoming Growth Factor â TP: Taux
protéique
TRIA1: Taux de réussite en 1ère
insémination UMP: Uridine-5-monophosphate
LISTE DES FIGURES
Figure 1: Stades du développement embryonnaire
pré-implantatoire. 6
Figure 2: Eclosion du blastocyste. 6
Figure 3: Profils plasmatiques de l'hormone lactogène
placentaire bovine chez la
mère et le foetus. 16
Figure 4:
Régulation de la biosynthèse des principales hormones
ovariennes.
[Source: UNCEIA, 2005] 18
Figure 5: La migration des cellules binucléées chez
la vache: 20
Figure 6: Profil moyen des PAGs au cours de la gestation 21
Figure 7: Concentration des PAGs post-partum chez 10 femelles
zébus 22
Figure 8: Régulation endocrinienne de la parturition.
26
Figure 9: Définition des échecs de gestation.
28
Figure 10: Mortalité embryonnaire en fonction de la taille
de la portée. 33
Figure 11: Influence de l'IVIA1 sur les paramètres de
reproduction 39
Figure 12: Relation note d'état/ ME 42
Figure 13: Relation entre la quantité, la nature des
matières azotées et la
reproduction 43
Figure 14: Facteurs de risque de mortalité embryonnaire.
44
Figure 15: Mortalité embryonnaire et INEL. 45
Figure 16: Etiologie des avortements bovins 51
Figure 17: Taux d'avortement en fonction de races 65
Figure 18: Conduite à tenir face à des
mortalités embryonnaires dans un troupeau. 70
Figure 19: Profils des
concentrations en PSPB lors de gestation normale et de
mortalité embryonnaire tardive 76
Figure 20: Concentration plasmatique de la PSPB chez des femelles
77
Figure 21: Concentrations moyennes de progestérone durant
les prélèvements. 79
Figure 22: Concentrations moyennes de PAGs durant les
prélèvements 80
Figure 23: Mortalité embryonnaire 45 jours post
insémination artificielle. 82
Figure 24: Protocole de vaccination de vache par utilisation de
Bovilis BVD. 92
Figure 25: Fiche de commémoratifs des avortements de
l'association pour l'étude del
la reproduction animale 93
LISTE DES TABLEAUX
Tableau I: Effets de divers facteurs sur le risque de
non-fécondation ou de mortalité
embryonnaire 32
Tableau II: Principales relations entre alimentation et troubles
de la reproduction 43
Tableau III: Effet de la BVD chez les femelles gestantes. 55
Tableau IV: Liste des mycoses abortives chez la vache 57
Tableau V: Fertilité et azote chez la vache 61
Tableau VI: Moments préférentiels d'apparition de
l'avortement dans l'espèce bovine
66
Tableau VII: Progestéronémie et état
physiologique d'une femelle 71
Tableau VIII: Correspondance entre différentes situations
après IA et les résultats
des dosages de la
progestérone et PAGs 78
Tableau IX: Fréquence de la
mortalité embryonnaire tardive déterminée par
échographie et palpation manuelle 84
Tableau X: Paramètres alimentaires à
contrôler lors de mortalité 89
LISTE DES PHOTOS
Photo 1: Avorton de BVD. 55
Photo 2: Avorton dans l'IBR. 56
Photo 4: Manifestation clinique de l'avortement mycosique 58
Photo 3: Avortement mycosique chez la vache 58
Photo 5 : Avorton de 2 mois dans la Trichomonose. 58
Photo 6: Manifestation clinique de l'avortement:la momification
59
LISTE DES ANNEXES
Annexe 1: Différents type de placenta en fonction des
espèces animales 132
Annexe 2: Plantes susceptible de contenir des
concentrations dangereuses de
nitrates 133
Annexe 3: Structure caractéristique des acides gras
indispensables .133
|
TABLE DES MATIERES
|
|
|
|
|
INTRODUCTION
|
|
|
1
|
|
PREMIERE PARTIE: LA PHYISIOLOGIE DE LA
GESTATION
|
ET
|
LES
|
|
AVORTEMENTS CHEZ LA VACHE
|
|
3
|
|
CHAPITRE:I: LA PHYSIOLOGIE DE LA GESTATION
|
|
4
|
|
I.1. Les principales phases de la gestation
|
|
4
|
|
I.1.1. La progestation
|
|
4
|
|
I.1.1.1. La traversée tubaire
|
|
4
|
|
I.1.1.2. Phase pré-implantatoire
|
|
4
|
|
I.1.1.2.1. Premières divisions cellulaires
|
|
5
|
|
I.1.1.2.2. Sortie de pellucide et phase d'élongation
|
|
6
|
|
I.1.1.3. Implantation
|
|
7
|
|
I.1.1.3.1. Déroulement
|
|
7
|
|
I.1.1.3.2. Régulation
|
|
7
|
|
I.1.1.3.3. Mécanismes immunologiques
|
|
7
|
|
I.1.2. La gestation proprement dite
|
|
8
|
|
I.1.2.1. Mécanisme du maintien de la gestation
|
|
8
|
|
I.1.2.1.1. Maintien du corps jaune
|
|
8
|
|
I.1.2.1.2. Tolérance immunologique de l'embryon
|
|
10
|
|
I.1. 2. 2. Adaptation de l'organisme maternel à la
gestation
|
|
11
|
|
I.1 .2.2.1. Modifications morphologiques
|
|
11
|
|
I.1.2.2.2. Modifications fonctionnelles
|
|
12
|
|
I.1.2.2.3. Modifications métaboliques
|
|
12
|
|
I.2. Durée de la gestation
|
|
13
|
|
I.3. Régulation hormonale de la gestation
|
|
13
|
|
I.4. Hormonologie de la gestation
|
|
14
|
|
I.4.1. Early Pregnancy Factor
|
|
14
|
|
I.4.2. Zygotine
|
|
15
|
|
1.4.3. Interféron tau bovin
|
|
15
|
|
I.4.4. Hormone chorionique somato-mammotrope
|
|
15
|
|
I.4.4. Progestérone
|
|
17
|
|
I.4.4.1. Définition
|
|
17
|
|
I.4.4.2. Biosynthèse
|
|
17
|
|
|
xvi
|
I.4.4.3. Régulation 17
I.4.5. Prostaglandine E 18
I.4.6.Trophoblastine 18
I.4.7. Protéines spécifiques de la gestation
19
I.4.7.1. Définition 19
I.4.7.2. Biosynthèse 20
I.4.7.3. Expression des PAGs durant la gestation 21
I.4.7.4. Expression des PAGs après la gestation 22
I.4.8. Facteurs de croissance 23
I.5. Déclenchement du part 23
I.5.1. Chute de la progestéronémie 23
I.5.2. Augmentation des oestrogènes 24
I.5.3. Augmentation de la cortisolémie 24
I.5.4. Augmentation de la concentration de la prostaglandine
24
I.5.5. Augmentation de la concentration d'ocytocine 25
I.5.6. Augmentatation de la concentration des PAGs 25
CHAPITRE II: LES MORTALITES EMBRYONNAIRES 28
II.1. Définition 28
II.2. Facteurs associés à la
mortalité embryonnaire 29
II.2.1. Facteurs gamétiques et embryonnaires
29
II.2.1.1. Facteurs liés aux gamètes 29
II.2.1.2. Causes génétiques 30
II.2.1.3. Sexe de l'embryon 33
II.2.1.4. Nombres d'embryon 33
II.2.2. Facteurs parentaux 34
II.2.2.1. Facteurs paternels 34
II.2.2.2. Facteurs maternels 34
II.2.2.2.1. Rôle de la progestérone 34
II.2.2.2.2. Anomalies de cyclicité post-partum 34
II.2.2.2.3. Rang de lactation 35
II.2.2.2.4. Maladies péri partum 36
II.2.2.2.5. Environnement de l'utérus et de l'oviducte
38
II.2.2.2.6. Protocole d'insémination 38
II.2.2.2.7. Age de l'animal 39
II.2.3. Facteurs environnementaux 40
II.2.3.1. Alimentation 40
II.2.3.2. La température et la saison 43
II.2.3.3. Production laitière 44
II.2.3.4. Palpation transrectale 45
II.2.3.5. Traitements hormonaux 46
II.2.3.6. Effet troupeau 46
II.2.4. Causes biologiques 47
II.2.4.1. Données cliniques 47
II.2.4.2. Effets indirects de la fécondation in vitro
47
II.2.4.2.1. Contamination de l'ovocyte 47
II.2.4.2.2. Contamination de l'embryon dans le tractus
génital 48
II.2.4.2.3. Contamination du matériel animal 48
II.3. Manifestations cliniques des mortalités
embryonnaires 49
CHAPITRE III: LES AVORTEMENTS CLINIQUES 50
III.1. Définition 50
III.2. Importance 50
III.2.1. Importance sanitaire 50
III.2.2. Importance économique 50
III.3. Etiologies 51
III.3.1. Agents biologiques 51
III.3.1.1. Causes bactériennes 51
III.3.1.1.1. Brucellose 51
III.3.1.1.2. Chlamydiose 52
III.3.1.1.3. Fièvre Q 52
III.3.1.1.4. Listériose 52
III.3.1.1.5. Leptospirose 53
III.3.1.1.6. Vibriose 53
III.3.1.1.7. Ureaplasmose et Mycoplasmose 53
III.3.1.2. Causes virales 54
III.3.1.2.1. Diarrhée Virale Bovine (BVD) / Maladie des
Muqueuses (MM) 54
III.3.1.2.2. Rhinotrachéite Infectieuse Bovine (IBR)
56
III.3.1.2.3. Blue tongue virus 57
III.3.1.2.4. Virus Akabane 57
III.3.1.3. Causes parasitaires 57
III.3.1.3.1. Mycoses 57
III.3.1.3.2. Trichomonose 58
III.3.1.3.3. Toxoplasmose 59
III.3.1.3.4. Néosporose 59
III.3.2. Causes non-biologiques 60
III.3.2.1. Facteurs alimentaires 60
III.3.2.1.1. Alimentation énergétique 60
III.3.2.1.2. Alimentation azotée 60
III.3.2.1.3. Constituants minéraux et les
oligo-éléments 61
III.3.2.1.4. Vitamines 63
III.3.2.1.5. Intoxications végétales 63
III.3.2.2. Facteurs physiques 65
III.3.2.3. Facteurs iatrogènes 65
III.3.2.4. Effet race 65
III.4. Moments d'apparition des avortements
66
DEUXIEME PARTIE : METHODES DE DIAGNOSTIC ET STRATEGIES DE
LUTTE CONTRE LES AVORTEMENTS 68
CHAPITRE I: METHODES DE DIAGNOSTIC DES AVORTEMENTS
69
I.1. Méthodes biochimiques 70
I.1.1. Dosage de la progestérone 70
I.1.1.1. Détermination de l'état physiologique des
femelles 71
I.1.1.2. Diagnostic de mortalité embryonnaire 72
I.1.2. Dosage des Protéines Associées
à la Gestation (PAGs) 73
I.1.2.1. Diagnostic de gestation 73
I.1.2.2. Diagnostic des avortements 74
I.1.3. Utilisation conjointe des dosages de
progestérone et PAGs 77
I.1.4. Early pregnancy factor 80
I.1.5. OEstrogènes 81
I.2. Moyens paracliniques 81
I.2.1. Diagnostic échographique 81
I.2.1.1. Diagnostic de gestation 81
I.2.1.2. Diagnostic de mortalité embryonnaire
81
I.2.2. Effet Doppler 83
I.3. Moyens cliniques 83
I.3.1. Palpation transrectale (Tableau IX) 83
I.3.2. Surveillance des chaleurs 83
CHAPITRE II: STRATEGIES DE LUTTE CONTRE LES AVORTEMENTS
85
II.1. Mesures de lutte offensive 85
II.1.1. Mesures thérapeutiques 85
II.1.1.1. Hormone 85
II.1.1.1.1. Augmentation de concentrations en
progestérone 85
II.1.1.1.2. Renforcement du signal embryonnaire
86
II.1.1.1.3. Inhibition de la synthèse de
PGF2á 86
II.1.1.1.4. Somatotropine bovine (bST) 87
II.1.1.2. Alimentation 87
II.1.1.2.1. Contrôle de l'apport énergétique
87
II.1.1.2.2. Contrôle de l'apport azoté 87
II.1.1.2.3. Contrôle des apports
minéralo-vitaminiques 88
II.1.1.2.4. Supplémentation en acide gras 88
II.1.2. Mesures d'assainissement du troupeau
90
II.2. Mesures de lutte défensive 90
II.2.1. Prévention de la transmission verticale 91
II.2.2. Prévention de contamination horizontale 92
CHAPITRE III: RECOMMANDATIONS 95
III.1. Aux autorités étatiques
95
III.2. Aux acteurs impliqués dans
l'amélioration des productions animales 95
III.2.1. Les différents programmes nationaux
d'amélioration génétique 95
III.2.2. Aux inséminateurs 95
III.2.3. Aux éleveurs 96
III.3. Aux chercheurs 96
CONCLUSION GENERALE 98
REFERENCES BIBLIOGRAPHIQUES 102
ANNEXES 132
INTRODUCTION
En matière de productions animales, les systèmes
d'élevage bovin pratiqués actuellement en Afrique subsaharienne
sont caractérisés par un niveau faible de productivité
pouvant être expliquée essentiellement par les contraintes
génétiques, alimentaires, sanitaires et climatiques.
Le faible potentiel génétique des races locales
et les sorties de devises pour l'importation du lait et des produits laitiers
ont contraint beaucoup de pays subsahariens à accroître la
production laitière nationale. Ainsi, l'amélioration de la
fertilité demeure un des objectifs prioritaires pour optimiser le
potentiel de reproduction et donc de production de l'élevage bovin.
En pratique, les politiques de développement de
l'élevage bovin dans les pays subsahariens ont opté pour une
politique d'intensification de la production laitière locale par
l'entremise d'un vaste programme d'amélioration génétique
du cheptel autochtone grâce notamment à la biotechnologie de
l'insémination artificielle (IA).
Malheureusement, l'analyse des résultats sur
l'insémination artificielle en Afrique subsaharienne a montré une
faiblesse des taux de réussite: au Sénégal: 44,3%
[NISHIMWE, 2008]; en Mauritanie: 46,45% [TENE, 2008];
en Guinée: 50% [KAMGA WALADJO et al., 2007];
au Cameroun: 38,09% [BADAI, 2008]; au Burkina-Faso: 38,61%
[NYANTURE, 2007]; au Mali: 55% et au Tchad: 45%
[BERTRAND, 2006].
Plusieurs facteurs sont à l'origine de ces faibles taux
d'IA; notamment la non maîtrise des paramètres de la reproduction
chez la vache, l'alimentation et surtout les avortements.
En effet, dans les élevages bovins laitiers, les
avortements se sont révélés comme les causes majeures de
pertes économiques car sans production de veaux il n'y a pas de
rentabilité économique de l'élevage et donc pas
d'intensification de la production [GATSINZI, 1989].
Ces fléaux économiques de l'élevage
peuvent se définir comme des pertes de gestation et regroupent les
mortalités embryonnaires, les avortements cliniques dûment
constatés par l'éleveur ou le vétérinaire, les
retours en chaleurs de l'animal ou encore les diagnostics de non-gestation
posés par le vétérinaire [HANZEN,
2008].
Les causes des avortements sont multiples, non infectieuses ou
infectieuses.
Dans les troupeaux de vaches laitières, les avortements
sont l'un des problèmes majeurs limitant la productivité, ils ont
une importance non négligeable. Ils rêvent un rôle important
en terme de santé publique. Ainsi, une part non négligeable des
avortements est due à des agents infectieux zoonotiques, et certaines de
ces zoonoses sont loin d'être bénignes d'un point de vue
médical [HAUREY, 2000]. De ce fait, leurs importances
sont également sanitaires; l'avortement d'une vache dans un
élevage doit toujours conduire le praticien à évoquer les
maladies abortives. Enfin, les avortements occasionnent des pertes
économiques sévères, ayant à la fois des effets
directs sur les animaux (pertes de veaux, stérilité, augmentation
des intervalles entre vêlages, diminution de la production
laitière) et des effets indirects sur les productions animales tels que
le coût des interventions vétérinaires et de la
reconstitution des cheptels [REKIKI et al., 2005].
Ainsi, pour une meilleure rentabilité économique
de l'élevage et l'intensification de la production; la connaissance des
facteurs associés aux avortements et les méthodes de diagnostic
constitue le meilleur moyen de les maîtriser au sein des élevages
bovins.
L'objectif général de notre travail est de
synthétiser les connaissances actuelles sur les avortements dans
l'espèce bovine.
De façon spécifique, il s'agit de:
> Faire le point des facteurs étiologiques des
mortalités embryonnaires et des avortements cliniques au sein de
l'élevage bovin;
> Dégager les méthodes de diagnostic des
mortalités embryonnaires et des avortements cliniques au sein du
troupeau;
> Dégager les stratégies de lutte contre les
avortements.
Ce travail basé sur une synthèse bibliographique
comprend 2 parties:
+ La première partie qui est consacrée à la
physiologie de la gestation et les avortements chez la vache
+ et une seconde partie est consacrée aux
méthodes de diagnostic et stratégies de lutte contre les
avortements. Enfin, des recommandations sont formulées à
l'endroit de tous les acteurs impliqués dans l'amélioration des
productions animales.
LA PHYSIOLOGIE DE LA GESTATION ET
LES AVORTEMENTS CHEZ LA VACHE
CHAPITRE I:
LA PHYSIOLOGIE DE LA
GESTATION
La gestation ou gravidité correspond à la
période de la vie de la femelle qui s'écoule entre la
fécondation et la mise bas. L'événement essentiel de la
gestation est la fécondation qui est la transformation de l'ovocyte en
oeuf, suite à la fusion avec le spermatozoïde.
Dans ce chapitre, nous évoquerons les phases de la
gestation, sa durée, sa régulation et sa biochimie.
I.1. Principales phases de la gestation
La gestation se divise en deux périodes à savoir la
progestation et la gestation proprement dite.
I.1.1. Progestation
La progestation correspond à la période pendant
laquelle l'oeuf issu de la fécondation mène une vie libre dans
l'utérus.
Elle comprend trois phases. Il s'agit respectivement de la
traversée tubaire, la phase pré-implantatoire et la nidation ou
implantation.
I.1.1.1. Traversée tubaire
Elle correspond au transit de l'oeuf depuis le lieu de la
fécondation jusqu'à l'utérus grâce aux contractions
de la trompe et les battements des cils de l'épithélium tubaire.
Pendant cette période la nutrition de l'oeuf est assurée par les
sécrétions de l'oviducte.
I.1 .1.2. Phase pré-implantatoire
Chez les ruminants, la durée de vie libre de l'embryon
est relativement longue ce qui le rend plus dépendant des
sécrétions utérines riches en sucres, en protéines
et en vitamines. Durant cette phase pré-implantatoire, l'embryon migre
de l'ampoule tubaire vers l'isthme puis il entre dans l'utérus.
A chaque stade du développement correspond un emplacement
de l'embryon qui baigne dans des sécrétions dont la composition
correspond à ses besoins.
Si cette correspondance stade du
développement/situation géographique n'est pas respectée
l'embryon ne peut survivre. Ainsi, tout embryon qui prend du retard dans son
développement est perdu [PIKO et CLEGG.,
1982].
Le développement embryonnaire pré-implantatoire
comprend 3 phases à savoir premières divisions cellulaires,
sortie de pellucide et phase d'élongation.
I.1.1.2.1. Premières divisions
cellulaires
Une trentaine d'heures après la fécondation, il
y a formation des deux premiers blastomères. Cette étape est
considérée comme critique pour le développement
ultérieur de l'embryon. En effet, une augmentation de quelques heures du
délai de reprise de cette division cellulaire entraîne un
développement moindre des embryons jusqu'au stade blastocyste
[BETTERIDGE et FLECHON, 1988].
En revanche, les embryons qui atteignent le stade 2 cellules,
36 heures après la fécondation [VAN SOOM et al.,
1992] voire le stade 4 cellules, 48 heures après la
fécondation se développent davantage que les autres jusqu'au
stade blastocyste [LONERGAN et al., 1992; LONERGAN,
1994].
Les divisions cellulaires aboutissent à la formation
d'une morula (32-36 cellules) qui va être l'objet du
phénomène de compaction le plus souvent observé 5 à
6 jours après la fécondation (au stade 64 cellules) [VAN
SOOM et al., 1992]. La compaction aboutit à la
formation d'une cavité blastocoelique et à l'expansion du
blastocyste (Figure 1).
En effet, les divisions suivantes sont asynchrones
[MASSIP et al., 1983] et aboutissent à la formation de
deux populations cellulaires: l'une de petite taille appelée bouton
embryonnaire [ZIOMEK et JOHNSON, 1981] et l'autre de grande
taille appelée trophoblaste [FEHILLY et WILLADSEN
,1986].
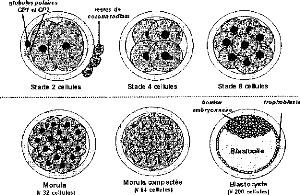
Figure 1: Stades du développement
embryonnaire pré-implantatoire. [VAN SOOM et al.,
1992]
I.1.1.2.2. Sortie de pellucide et phase
d'élongation
Le jeune blastocyste comprend une centaine de cellules
[PICARD et al., 1986]. Son diamètre est de 160
microns et l'épaisseur de sa zone pellucide de 12 microns
[LINARES et KING, 1980]. L'expansion du blastocyste par
accumulation de liquide entraîne une augmentation de 60% de son
diamètre. La zone pellucide s'amincit jusqu'à sa rupture. Il
s'agit donc de l'éclosion qui a lieu vers le 9ème -
10ème jour après fécondation (figure
2).
In vitro, un durcissement de la pellucide empêchant
toute éclosion est parfois observé. Cela aboutit à la mort
de l'embryon [THIBAULT ,1966].
La phase d'élongation débute vers le
2ème - 14ème jour. Le trophoblaste atteint
une longueur de 2,5 cm en moyenne au 16ème jour de gestation
[HANZEN et al., 1999a]. A 19 jours l'embryon est long
de 3-4 mm, le tube neural se ferme et le coeur commence à battre
[GAYRARD et al., 2003].

Figure 2: Eclosion du blastocyste. [Source:
THIBAULT ,1966]
I.1.1.3. Implantation I.1.1.3.1. Déroulement
L'implantation débute le 19ème jour.
Il s'agit d'une interaction entre l'utérus et le trophectoderme
aboutissant à la formation des structures placentaires. Elle se
déroule en plusieurs étapes: orientation et accolement du
blastocyste à l'endomètre, apposition et adhésion. Une
réduction de la taille des microvillosités des cellules du
trophoblaste favorise l'adhésion aux cellules endométriales. Au
cours de l'implantation, les cellules trophoblastiques binucléées
envahissent l'épithélium utérin et fusionnent avec des
cellules utérines formant ainsi un syncytium [LEISER, 1975; COOK
et HUNTER, 1978].
Pour que l'implantation réussisse, il doit y avoir une
synchronisation précise entre le stade du développement du
blastocyste et l'état de réceptivité endométriales.
Un asynchronisme de ces phases pourra entraîner la perte de l'embryon
[KING et al., 1980].
I.1.1.3.2. Régulation
Les follicules ovariens en croissance produisent des
oestrogènes qui permettent de préparer la maturation
endométriale. Puis le corps jaune secrète de la
progestérone en quantités croissantes, hormone indispensable
à l'implantation. Avant l'implantation, l'embryon émet divers
signaux tels que: Prostaglandine E2, PSPB (Pregnancy Specific Protein B), bPAG
(bovine Pregnancy Associated Glycoprotein), PSP60 (Pregnancy Serum Protein
60).
Ces signaux pourraient avoir un rôle dans les
mécanismes implantatoires. Cependant, la PSPB, bPAG et PSB60 sont les
plus précocement détectées dès 20- 25 jours de
gestation dans le sang et leurs concentrations augmentent au cours de la
gestation [CHEMLI et al., 1996].
I.1.1.3.3. Mécanismes immunologiques
Au moment de l'implantation, de fortes quantités
d'interleukines (IL) sont secrétées dans
l'utérus. Les plus importantes chez les ruminants sont IL-1, le
TGF-â (Transforming Growth Factor â), le CSF (Colony Stimulating
Factor) et le LIF (Leukemia Inhibitory Factor) maternel. Cette
sécrétion conduit à une régulation de
l'adhésion et de l'invasion trophoblastique [POLL,
2007].
I.1.2. La gestation proprement dite
La gestation commence avec la nidation et se termine par la
mise bas. C'est une période de la vie pendant laquelle le foetus se
développe dans l'utérus grâce au placenta chez les
mammifères supérieurs.
I.1.2.1. Mécanisme du maintien de la gestation
I.1.2.1.1. Maintien du corps jaune
Après l'ovulation, la cavité folliculaire se
remplit d'un caillot de sang; les cellules de la granulosa du follicule rompu
envahissent le caillot de sang et se transforment en d'autres types de
cellules, les cellules lutéales ou lutéiniques, pour former le
corps jaune qui va sécréter la progestérone.
En l'absence de fécondation, il y a lyse du corps jaune
sous l'action de la prostaglandine F2á (PGF2á) produite par
l'endomètre vers J16-J17. C'est la lutéolyse.
Par contre, lorsqu' il y a fécondation, la
sécrétion de progestérone par le corps jaune persiste
[HANZEN et al., 1999].
Ce maintien de la fonction lutéale est le
résultat de deux mécanismes. D' une part, le conceptus inhibe la
production de PGF2á et d'autre part, il diminue la sensibilité du
corps jaune à l'action lutéolytique de la PGF2á. Cela est
possible grâce à un facteur anti-lutéolytique
sécrété par le conceptus appelé Interféron
tau (IFNô). Ce facteur entraine une diminution du nombre de
récepteurs endométriaux aux oestrogènes et à
l'ocytocine. De plus, il contribuerait à diminuer l'amplitude et la
pulsatilité de la sécrétion de PGF2á en stimulant
la synthèse par l'endomètre d'un inhibiteur de la prostaglandine
synthétase, EPSI (Endometrial prostaglandin Synthetase I
nhibitor) [HANZEN et al., 1999].
La progestérone est absolument nécessaire au
maintien de la gestation dans toutes les espèces de mammifères
pourvues d'un placenta. Celui-ci est une structure cellulaire résultant
du contact entre la muqueuse de l'utérus et l'une des annexes
embryonnaires, le chorion, qui est l'enveloppe la plus externe de l'embryon
afin de permettre des échanges foeto-maternelles pendant la gestation
[SOUSA, 2002]
+ Types de placenta
En fonction du nombre du degré
d'interpénétration entre tissus maternels et tissus
embryonnaires, on distingue quatre (4) types de placenta (Annexe
1):
s" Le type épithélio-chorial chez les
équidés et les suidés
s" Le type conjonctivo-chorial ou syndesmo-chorial chez les
ruminants s" Le type endothélio-chorial chez les carnivores
s" Le type hémo-chorial chez les primates et les
rongeurs
Par ailleurs, la différence dans l'imbrication des tissus
embryonnaires et maternels permet de distinguer deux groupes d'espèces
animales:


Les adéciduées chez lesquelles, au moment de la
mise bas, il y a simple séparation entre tissus foetaux et tissus
maternels; il n'y a pas d'évacuation de tissus maternels et pratiquement
pas d'hémorragie. Cela se rencontre chez les équidés, les
suidés et les ruminants.
Les déciduées chez lesquelles, la mise bas se
traduit par l'expulsion d'une partie de la muqueuse utérine avec
hémorragie, cela est rencontré chez les carnivores, les primates
et les rongeurs [BERNARD, 2002].
+ Rôle du placenta
Le placenta joue un rôle capital au cours de la gestation.
Il rempli deux types de fonctions:
· Une fonction métabolique en permettant le
transport de nutriments: l'eau, l'oxygène, minéraux et les
matières organiques de la mère au foetus et le transfert des
déchets comme l'urée et le gaz carbonique du foetus à la
mère
· Une fonction endocrine intervenant dans le maintien de
la gestation par sécrétion de la progestérone,
d'oestrogène et la préparation de la lactation [SOUSA et
al., 2002].
I.1.2.1.2. Tolérance immunologique de l'embryon
L'embryon est composé à 50% de matériel
génétique paternel qui devrait être alors
considéré comme «non soi» par l'organisme maternel.
Ainsi, il serait susceptible d'être détruit au cours d'une
réaction immunitaire à médiation cellulaire faisant
intervenir les cellules T tueuses spécifiques ou les cellules NK
(Natural Killers). Cependant, il existe une protection de l'embryon contre le
rejet immunologique par les tissus maternels.
Les cellules NK utérines produisent des cytokines
telles que CSF-1 (Colony Stimulating Factor 1) favorisant la croissance
placentaire. De plus, l'antigénicité du trophoblaste est
réduite en début de gestation.
Chez les ruminants, les antigènes du Complexe Majeur
d'Histocompatibilité de classe 1 ne s'expriment pas sur les
gamètes et sur les cellules externes de l'embryon au début du
développement embryonnaire. Ils s'exprimeront plus tard lorsque les
couches externes du placenta se différencient mais cela reste faible.
Ainsi, les cellules T n'identifient pas le trophoblaste et donc l'embryon comme
un élément étranger. Pour finir, Il existe aussi une
immunosuppression à l'interface embryomaternelle. Le trophoblaste est
capable de neutraliser le complément, indispensable à l'action
des anticorps cytolytiques. Parallèlement, des mécanismes de
défense contre un rejet à médiation cellulaire existent
[POLL, 2007].
Par ailleurs, en présence de fortes concentrations de
progestérones à l'interface embryo-maternelle et grâce
à l'existence de protéines de surfaces toxiques pour les
lymphocytes T, les cellules du trophoblaste sont résistantes à la
lyse par les cellules tueuses et développent une résistance
à l'apoptose. Les cellules du placenta sécrètent
également des facteurs locaux immunosuppresseurs. Il s'agit de
l'INFô sécrété par le conceptus au début de
l'implantation.
I.1.2.2. Adaptation de l'organisme maternel à la
gestation
L'organisme maternel s'adapte à l'état de gestation
par des modifications morphologiques, fonctionnelles et métaboliques.
I.1.2.2.1. Modifications morphologiques
La gestation crée au niveau de l'organisme maternel un
état physiologique nouveau et entraîne une série de
modifications morphologiques plus spécialement localisées au
niveau des organes génitaux.
> L'utérus
L'utérus présente une série de
modifications de forme, de volume, de poids, de situation, de rapport et
d'aspect. Chez la vache où l'uniparité est pratiquement de
règle, le développement plus important de la corne gravide rend
l'utérus asymétrique dès le deuxième et surtout le
troisième mois de gestation. Les rapports de l'utérus avec les
viscères abdominaux et la paroi abdominale se modifient au fur et
à mesure que se poursuit l'état gestatif, il se loge entre la
face droite du rumen et la paroi abdominale chez la vache [DERI VAUX et
ECTORS, 1980].
L'augmentation du poids de l'utérus et sa distension
s'accompagnent d'un amincissement de la paroi musculaire. Les artères
utérine et utéro-ovarienne s'allongent, s'hypertrophient et
deviennent fluctueuses; l'artère utérine devient nettement
perceptible dans l'épaisseur du ligament large et l'ondée
sanguine, particulièrement importante à partir du
quatrième mois de gestation chez la vache.
> Le col utérin
Suite aux modifications utérines, le vagin s'allonge
progressivement et le col utérin finit par se situer en avant du bord
antérieur du pubis. Le col est obturé par un mucus consistant,
très épais qui est un produit de sécrétion des
glandes cervicales; constituant un bouchon muqueux dont la liquéfaction
se produit au moment de la parturition [GAYRARD, 2007].
> Les ovaires
Au niveau des ovaires, il y a la mise en place du corps jaune
gestatif ce qui entraîne l'arrêt des cycles ovariens.
> Les glandes mammaires
Les mamelles s'hypertrophient progressivement avec le
développement des canaux galactophores et des acini, et en fin de
gestation, les tissus pelviens s'oedématient et les ligaments
sacro-sciatiques se ramollissent et s'affaissent pour donner lieu à ce
qui est appelé «l'état croqué» [GAYRARD,
2007].
I.1.2.2.2. Modifications fonctionnelles
L'état de gestation entraîne d'importantes
modifications fonctionnelles au niveau de l'organisme maternel. Les fonctions
les plus concernées sont:
+ la respiration: la consommation d'oxygène par le
foetus entraîne une hypoxie avec comme résultat une
hyperventilation due essentiellement à une augmentation de la
fréquence respiratoire.
+ la circulation: il y a une irrigation plus importante de
l'utérus et des mamelles et une augmentation de la fréquence
cardiaque.
+ la fonction endocrine: il y a une hyperactivité des
glandes thyroïdes, surrénales et adénohypophyses.
+ la fonction rénale: il y a une augmentation de la
diurèse, une tendance à la rétention hydrique,
sodée et glycosurie. Ces modifications sont le résultat d'une
hyperactivité de la glande surrénale [GAYRARD,
2007].
I.1.2.2.3. Modifications métaboliques
L'état de gestation entraîne des modifications au
niveau du métabolisme qui se traduisent surtout par une augmentation de
l'anabolisme gravidique. La stimulation de l'anabolisme protidique
entraîne un bilan azoté positif; l'anabolisme des lipides et des
glucides est aussi augmenté. Cet anabolisme sert à la croissance
du foetus au dernier tiers de gestation vu que 75% du poids à la
naissance est acquis au dernier tiers de gestation [GAYRARD,
2007].
I.2. Durée de la gestation
La durée de gestation correspond au nombre de jours
écoulé entre la fécondation et la mise bas.
La durée de la gestation est variable en fonction de
l'espèce, de la race et de l'individu.
Chez la Holstein, elle est de 275 #177; 15 jours
[KAMGA-WALADJO, 2003]. Chez les montbéliardes,
DIOUF (1995) a observé une durée de gestation de
276#177;10 jours. De même, BADAI (2008) au Cameroun chez
la Holstein, Métisse Holstein et Métisse Montbéliarde a
observé respectivement la durée de gestation de 276,8 #177; 23,6
jours; 277,1 #177; 11,4 jours et 285,3 #177; 9,8 jours.
Notons que dans une même espèce, la durée de
gestation varie en fonction :
~ de la taille de la portée : chez la vache, la
durée de la gestation est plus courte en cas de naissance
gémellaire (de 3 à 6 jours) ;
~ de l'âge de la femelle: la durée de la gestation
est plus courte chez les primipares (de 2 à 3 jours chez la vache);
~ du sexe du foetus: chez la vache, la gestation est
allongée de 2 à 3 jours chez les foetus mâles
[DRAME, 1996].
Selon DIOUF (1991), la durée de
gestation est de 293 #177; 2jours chez le zébu, et de 288,2 #177; 6,8
jours chez la N'dama. KAMGA-WALADJO et al. (2006) en
Guinée, chez la N'dama ont observé une durée de gestation
de 280,1 #177; 8 jours, de 264,5 #177; 3,5 jours en gestation gémellaire
et de 255 jours pour une portée de triplé. Retenons que chez la
vache, la gestation dure en moyenne 282 jours, avec des extrêmes de 277
à 295 jours.
I.3. Régulation hormonale de la
gestation
Une fois que le signal embryonnaire est identifié par
l'organisme maternel, l'événement essentiel du maintien de la
progestation et de la gestation est la persistance du corps jaune pendant toute
ou une partie de la gestation, avec corrélativement la persistance d'une
production en quantité importante de la progestérone qui permet
le maintien de l'état de gestation par blocage de la
sécrétion de GnRH (Gonadotropin Releasing Hormon) empêchant
toute décharge ovulante de LH, ce qui suspend l'activité sexuelle
cyclique de la femelle.
Ainsi, un équilibre hormonal gravidique
s'établit, permettant le maintien de la gestation. Chez toutes les
espèces animales, la gestation est caractérisée par une
augmentation considérable de la progestéronémie; la
principale source de la progestérone en début de gestation est le
corps jaune.
Le foetus intervient dans le maintien de l'équilibre
hormonal gravidique en inhibant l'activité lutéolytique de la
PGF2á d'origine utérine. Dès le début de la
gestation, l'embryon inhibe cette activité lutéolytique de
l'utérus. Chez les ruminants, le trophoblaste sécrète une
protéine appelée la trophoblastine ou Trophoblastin Protein 1 qui
neutralise l'activité lutéolytique de la PGF2á
[MARTIAL cité par THIAM, 1996].
I.4. Hormonologie de la gestation
Diverses hormones (progestérone, cortisol,
prostaglandines, prolactine, hormone somatotrophine, etc..) et diverses
protéines et glycoprotéines sont impliquées dans divers
processus biologiques tels que l'établissement de gestation, le maintien
du corps jaune, la croissance foetale et mammaire.
I.4.1. Early Pregnancy Factor
De nature glycoprotéique, l'Early Pregnancy Factor
(EPF) encore appelé early conception factor (ECP)
apparaît quelques heures après la fécondation dans le sang
de la plupart des espèces animales dont la vache [NANCARROW et
al., 1981], la truie [MORTON et al., 1983],
et la brebis [CLARKE et al., 1980]. Ce
facteur existe en fait sous deux formes: l'une sécrétée
par l'ovaire ipsilatéral à la corne gestante (EPF-B)
[NANCARROW et al., 1981]et l'autre
synthétisée par l'oviducte (EPF-A) [MORTON et
al., 1980]. Leur synthèse ovarienne est initiée
par un petit peptide appelé zygotine [OROZCO et al.,
1986] et est donc indépendante de la présence du
placenta.
Il se pourrait que ce facteur contribue à diminuer
l'immunocompétence des lymphocytes en début de gestation et ainsi
faciliter la reconnaissance immunologique de l'embryon par l'organisme maternel
[MORTON et al., 1984]. La détermination de sa
concentration constituerait un bon moyen d'identification d'une
mortalité embryonnaire si ce n'était le manque de
reproductibilité de son évaluation plasmatique, imputable au fait
qu'elle est influencée par de nombreux facteurs biologiques.
I.4.2. Zygotine
Identifiée chez la brebis [MORTON et
al., 1979], la truie [MORTON et al.,
1983] et la vache [NANCARROW et WALLACE, 1980], la
zygotine ou EPAF (Embryo Platelet Activating Factor) possède des
propriétés chimiques, biochimiques et physiologiques comparables
à celles du PAF (Platelet Activating Factor), facteur produit notamment
par les neutrophiles, le foie et les muscles lisses [HANAHAN,
1986].
Elle induit la production par l'oviducte et l'ovaire porteur
du corps jaune d'un facteur précoce de la gestation appelé
EPF.
1.4.3. Interféron tau bovin
L'interféron tau (IFNô) bovin est une des
principales protéines sécrétées par le conceptus
bovin âgé de 16 à 25 jours [HELMER et
al., 1987]. Le mécanisme
d'action de l'IFNô inclut l'inhibition des récepteurs à
l'oestradiol, la réduction conséquente des récepteurs
d'ocytocine, et elle induit localement l'inhibition des
sécrétions de PGF2á et diminue la sensibilité du
corps jaune à l'action lutéolytique des PGF2á
[HANSEN et al., 1999].
Malgré l'importance de l'IFNô dans
l'établissement de la gestation chez la vache, cette protéine ne
présente pas d'intérêt en tant que test diagnostic de
gestation car aucune méthode ne permet de la détecter dans la
circulation sanguine maternelle [AYAD et al.,
2006].
I.4.4. Hormone chorionique somato-mammotrope
Le placenta produit une hormone lactogène placentaire
(PL), connue également sous le nom hormone chorionique
somato-mammotrope. Cette hormone présente une homologie structurelle et
fonctionnelle avec l'hormone de croissance et la prolactine (PRL)
[AYAD, 2006]. Les premières publications qui ont
rapporté l'existence d'une hormone placentaire à activité
endocrine multiple remontent aux travaux de SELYE et al.
(1933) lesquels, dès cette époque, ont montré
chez la rate le rôle non essentiel de l'hypophyse dans le maintien de la
gestation et le déclenchement de la lactation.
Chez la vache, l'existence d'une réponse
lactogénique au niveau des cotylédons à des stades
gestatifs divers a été décrite pour la première
fois en 1976 par BUTTLE et
FORSYTH.
Après cinq jours de culture, ces auteurs ont obtenu une
réponse lactogénique correspondant à environ 300ng de
prolactine bovine par millilitre de milieu. Cette glycoprotéine
possède plusieurs isoformes de masses moléculaires
s'étalant de 30 à 34kDa, elle est secrétée par les
cellules binucléées et trinucléées du placenta
[ARIMA et BREMEL, 1983]. Le dosage radioimmunologique (RIA) du
bPL (Lactogène placentaire bovine) a été décrit par
BECKERS et al.
(1982) pour mesurer les concentrations de l'hormone chez les
vaches et leurs foetus.
Le bPL devient dosable dans le sérum maternel à
un moment très variable selon les individus allant du
26ème au 110ème jour après
fécondation. Les concentrations maternelles de bPL augmentent
progressivement pour atteindre les valeurs de 1 à 2 ng/ml aux environs
de la parturition. Les faibles concentrations maternelles contrastent aussi
avec celles observées chez le foetus, lesquelles varient de 25 à
30 ng/ml au 90ème jour pour ensuite diminuer graduellement et
rester à 5 ng/ml à la période prénatale
(figure 3).
La liaison du bPL à des récepteurs
présents dans la glande mammaire, le foie, l'endomètre et le
corps jaune a été démontrée par
BECKERS (1983). Dans la glande mammaire, le
bPL paraît exercer une influence sur le développement du tissu
lobuloalvéolaire. Sa capacité lactogène a
été démontrée in vitro par FORSYTH
(1986). D'après HAYDEN et
al. (1979), la production
laitière chez les ovins est corrélée avec la
sécrétion de l'hormone entre la 1 1ème semaine
de gestation et la mise-bas.
L'apparition tardive de l'hormone lactogène placentaire
dans le sang maternel des bovins confère toutefois à ce dosage
peu d'intérêt pour le diagnostic de gestation et restreint son
utilisation à un diagnostic tardif de gestation.
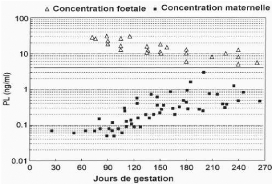
Figure 3: Profils plasmatiques de l'hormone
lactogène placentaire bovine chez la mère et le foetus.
[Source: BECKERS et al., 1982]
I.4.4. Progestérone
I.4.4.1. Définition
La progestérone est une hormone
stéroïdienne à 21 atomes de carbone, et d'un poids
moléculaire de 314 daltons; elle provient du cholestérol sanguin
et de l'acétate. La progestérone, la 20â (béta)
hydroxyprogestérone et la 1 7-hydroxyprogestérone constituent les
3 progestagènes naturels chez la vache et ont en commun les 4 cycles du
cyclopentanoperhydrophénanthrène ou noyau stérane. La
progestérone reste le chef de file des progestagènes et le plus
important sur le plan physiologique.
I.4.4.2. Biosynthèse
La progestérone est synthétisée et
secrétée essentiellement par les cellules lutéales du
corps jaune et le placenta mis en place suite à l'implantation de
l'embryon. Le principal précurseur est le cholestérol. La
transformation du cholestérol en progestérone passe par la
prégnénolone obtenue suite à 2 hydroxylations en
C20 et C22 et grâce à la cholestérol-20
desmolase qui scinde le cholestérol en acide isocaproïque et en
5â-prégnane-3á-ol-20 one (prégnénolone)
[HORTON et al., 1994].
I.4.4.3. Régulation
Le contrôle de la biosynthèse de la
progestérone dépend en grande partie de l'équilibre entre
les hormones secrétées par l'hypothalamus, l'hypophyse, l'ovaire
et l'utérus (Figure 4).L'hypothalamus secrète le GnRH qui
commande la libération épisodique des hormones gonadotropes LH
(Luteinizing Hormon) et FSH (Follicule Stimulating Hormon) dans la circulation
générale. La LH est sécrétée de façon
pulsatile par l'hypophyse et stimule la libération de l'oestradiol et de
la progestérone par l'ovaire.
Quant à la FSH, elle permet la croissance folliculaire.
Sa sécrétion est régulée par celle d'oestradiol et
d'inhibine secrétées par le follicule. La progestérone
exerce une rétroaction sur la sécrétion hypophysaire de
GnRH et affecte ainsi la synthèse de LH et de FSH. Ce feed-back
négatif de la progestérone cessera à la lutéolyse
et une nouvelle phase folliculaire sera initiée par la FSH.
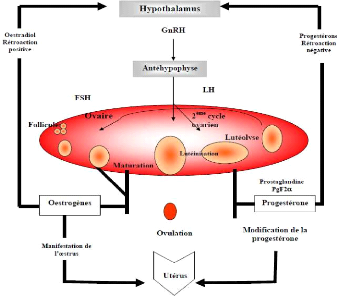
Figure 4: Régulation de la
biosynthèse des principales hormones
ovariennes.
[Source: UNCEIA, 2005]
I.4.5. Prostaglandine E
Le rôle exact de la prostaglandine E produite par les
blastocystes ovins et bovins [MARCUS, 1981; MILVAE et HANSEL, 1980]
reste à démontrer. Elle serait impliquée dans le
maintien de la gestation étant donné son effet lutéotrope
[SHELTON et al., 1990] et l'augmentation de sa
concentration dans la corne gestante après le 12ème
jour de gestation.
I.4.6. Trophoblastine
De nature protéique, la trophoblastine est
synthétisée par le trophectoderme [GODKIN et
al., 1984]. Ce facteur a été identifié
chez la brebis (oTP-1: ovine Trophoblast Protein -1) chez la chèvre
(cTP-1: caprine Trophoblast Protein-1) et chez la vache (bTP-1: bovine
Trophoblast Protein 1) [HELMER et al., 1987; MARTAL et
al., 1979; HEYMAN et al., 1984]. Une grande
homologie d'effets et de structures existent entre les trophoblastines de ces
espèces.
La trophoblastine est identifiée dans le liquide de
lavage de la cavité utérine vers le 8ème jour de gestation
chez la brebis [BAZER, 1989] et le 12ème
jour chez la vache [HUMBLOT et DALLA-PORTA, 1984; THATCHER et
al., 1985; BAZER, 1989]. Sa concentration augmente de
manière synchrone avec les changements morphologiques de l'embryon. Chez
la vache elle peut encore être détectée jusqu'au
38ème jour de gestation [BAZER, 1989].
I.4.7. Protéines spécifiques de la
gestation
I.4.7.1. Définition
Les protéines associées à la gestation
sont des molécules synthétisées par les cellules
binucléées du trophoblaste. Elles appartiennent à la
famille des protéases aspartiques. Elles possèdent une grande
similarité entre elles et sont au nombre de quatre à savoir la
PSPB (Pregnancy Specific Protein B), la PSP-60 (la protéine
sérique de gestation), la bPAG (Pregnancy Associated Glycoprotein) et la
SBU-3 identifiée pour la première fois par
GOGOLIN-EWENS et al.
(1986) et considérée comme restant
confinée dans les cellules binucléées.
Chez les bovins, la détection de ces protéines
associées à (ou spécifiques de) la gestation, dans la
circulation sanguine maternelle est utilisée couramment comme
méthode de diagnostic de gestation à partir du
30ème jour après la saillie ou l'insémination
artificielle [HUMBLOT et al., 1988 ; ZOLI et al.,
1992 ; MIALON et al., 1993].
Bien que des concentrations significatives de PAG puissent
être détectées chez certaines femelles à des stades
plus précoces, l'exactitude du diagnostic de gestation posé avant
le 30ème jour après la conception, peut être
compromise par des différences individuelles dans le profil de
sécrétion des PAGs par l'embryon en développement
[CHAVATTE-PALMER et al., 2006; SOUSA et al.,
2006], tout comme d'ailleurs par l'incidence élevée de
la mortalité embryonnaire durant cette période critique
[KUMMERFELD et al., 1978 ; SREENAN et DISKIN,
1983].
La mise au point de dosages radio-immunologiques chez la vache
[SASSER et al., 1986], la chèvre
[HUMBLOT et al., 1990], la brebis [RUDER et
al., 1988; EL AMIRI et al., 2004]
en rend l'intérêt particulièrement évident
pour le diagnostic de gestation et l'étude des avortements.
Par rapport au dosage de la progestérone, la
détermination de la concentration en PSPB ou PAG offre l'avantage de
pouvoir être réalisé quel que soit le stade de gestation
pour autant que le prélèvement ait été
effectué plus de 30 à 35 jours après
l'insémination. Le degré d'exactitude des diagnostics de
non-gestation est également plus élevé (85 %) [EL
AMIRI et al., 2004]. A l'inverse étant donné sa
demi-vie particulièrement longue surtout si la gestation a
été menée à son terme, il est impératif de
respecter au cours du postpartum une période d'attente de 100 jours pour
effectuer un diagnostic chez la vache [HUMBLOT et al., 1988;
HUMBLOT, 1991].
I.4.7.2. Biosynthèse
Les protéines et glycoprotéines associées
à la gestation sont synthétisées par les cellules
binucléées présentes dans les couches superficielles du
trophectoderme et plus précisément dans les granules de ces
cellules binucléées [ZOLI et al.,
1992]. Ces produits de synthèse sont stockés dans des
granules denses occupant plus de 50 % du cytoplasme [LEE et
AX, 1986] et relargués directement dans la circulation
maternelle après migration des cellules binucléées
(figure 5).
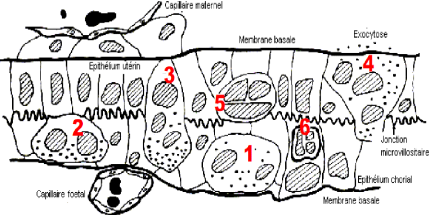
Figure 5: La migration des cellules
binucléées chez la vache: 1) cellule
binucléée; 2) contact avec les
microvillosités; 3) fusion avec les cellules
maternelles et formation de cellules trinucléées à vie
courte; 4) exocytose des granules; 5)
cellules trinucléées présentant un cytoplasme
réduit et un nucleus dense; 6) cellule
réabsorbée par le trophoctoderme [WOODING et WATHES,
1992].
I.4.7.3. Expression des PAGs durant la
gestation
Chez la vache gestante, les concentrations en PAG sont
détectables au plus tôt à partir des 1
9-22ème jours après conception pour atteindre des
concentrations de 3 à 6 ng/ml aux alentours des
33-37ème jours de gestation [PERENYI et al.,
2002], avec cependant de grandes variations individuelles. En
pratique, les prélèvements sont effectués à partir
du 35ème jour après la saillie parce que chez plus de
98% de vaches, la détection n'est possible qu'au 30ème
jour de l'insémination ou de la saillie fécondante [ZOLI
et al., 1992; LOPEZ GATIUS et al., 2007].
Le seuil de positivité est de 0,8 ng/ml chez les vaches
au 35ème jour de la conception. La concentration des PAGs
continue d'augmenter dans le sang maternel jusqu'au jour de la parturition.
Ainsi, TAINTURIER et al. (1996) ont
montré dans leur étude qu'à ce moment, les concentrations
atteignent 1400ng/ml alors que SOUSA et al.
(2003) ont montré des concentrations de l'ordre de
1018,04#177; 560,85 ng/ml chez le zébu azawak au Burkina- Faso
(Figure 6).
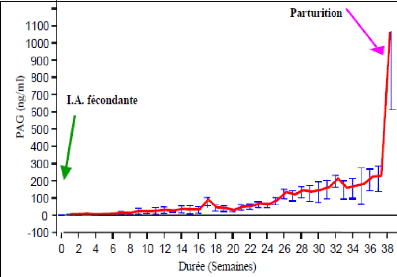
Figure 6: Profil moyen des PAGs au cours de la
gestation [Source: SOUSA, 2003]
I.4.7.4. Expression des PAGs après la
gestation
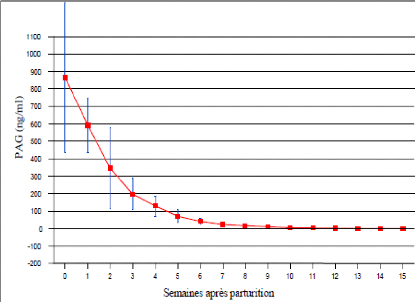
La cinétique des PAGs dans le sang maternel au cours du
post-partum se caractérise par la persistance d'une quantité
résiduelle importante de la protéine
(CHEMLI, 1999). Les PAGs ne disparaissent du
sang maternel qu'environ 120 jours après la parturition.
TAINTURIER (2000) indique que les concentrations passent de
1400 ng/ml à 165 ng/ml le 21ème jour du part, elles
disparaissent complètement entre 100 et 120 jours après la mise
bas alors que chez le zébu Azawak [SOUSA, 2003], de la
1ère semaine de parturition à la
6ème semaine les concentrations des PAG chutent
considérablement: elles passent de 1018,04 #177; 850,85 ng/ml à
41,27 #177; 14,85 ng/ml (Figure 7).
Figure 7: Concentration des PAGs post-partum
chez 10 femelles zébus
Azawak. [Source: SOUSA,
2003]
I.4.8. Facteurs de croissance
Des multiples facteurs contrôlent de manière
autocrine ou paracrine le développement des premiers stades de l'embryon
[HEYNER et al., 1993; GANDOLFI, 1994] et la
différenciation endométriale tels le transforming growth factor,
l'insulin growth factor I et II, l'epidermal growth factor [PARIA et
al., 1990], l'insuline, le platelet derived growth factor, le
basic fibroblast growth factor [LARSON et al., 1992],
mais aussi une multitude d'autres protéines plus
spécifiques à l'oviducte (Oviduct Specific Protein). Il est
prématuré d'en envisager l'utilisation dans les milieux de
culture des embryons car les premières tentatives
réalisées n'ayant enregistré aucune amélioration du
développement embryonnaire [FLOOD et al.,
1993].
I.5. Déclenchement du part
La parturition ou mise bas correspond à l'ensemble des
phénomènes mécaniques et physiologiques qui aboutissent
à l'expulsion du ou des foetus et de ses annexes hors des voies
génitales, chez une femelle parvenue au terme de sa gestation.
L'ensemble des phénomènes mécaniques qui contribuent au
processus de mise bas est placé sous un contrôle endocrinien
(Figure 8). Ainsi, la mise bas intervient suite à la rupture de
l'équilibre hormonal gravidique, dont l'axe hypothalamo-hypophysaire du
foetus en est l'origine.
Une étude menée par DERIVAUX et ECTORS
(1980) montre qu'au moment de la mise bas, on observe une chute de la
progestéronémie, un pic d'oestrogènes, de
corticostéroïdes, de prolactine et une légère baisse
de concentration de LH.
I.5.1. Chute de la
progestéronémie
La chute de la progestéronémie lève
l'inhibition exercée par cette hormone sur les contractions
utérines. La progestéronémie chez la vache passe de 7
à 8 ng/ml à 1 ng/ml au moment du part [DERIVAUX et
ECTORS, 1980]. En effet, cette baisse se produit en deux phases, il
s'agit d'abord d'une réduction assez marquée puis une chute
très brutale due à la lyse du corps jaune gestatif dans les
dernières 48 heures. Cette chute de la progestéronémie en
fin de gestation est aussi signalée par MORALES et
al.(1988).
I.5.2. Augmentation des oestrogènes
Elle a lieu environ quarante deux heures (42h) avant la mise
bas et suit la chute brutale de la progestérone. On observe un pic
jusqu' à 5 ng/ml. Les oestrogènes à l'absence de
progestérone en forte quantité ont une action d'une part de
stimuler les contractions utérines, et favoriser la synthèse de
la PGF2á (par le placenta et l'utérus) qui a un effet
contracturant de l'utérus et dilatateur du col utérin, et d'autre
part elle exerce une action au niveau de la symphyse pelvienne par un
phénomène d'imbibition, qui est à l'origine des
relâchements des parois.
I.5.3. Augmentation de la cortisolémie
La cortisolémie maternelle augmente avec la
difficulté du vêlage; on peut donc supposer que l'augmentation de
la concentration du cortisol est une réponse maternelle au stress de la
parturition. Ainsi, sa concentration chez la vache passe de 4 à 6ng/ml
le jour du part [DERIVAUX et ECTORS, 1980]. Le cortisol agit
surtout sur la production placentaire d'oestrogènes qui vont augmenter
au moment de la parturition.
I.5.4. Augmentation de la concentration de la
prostaglandine
La concentration de la prostaglandine subit une très
forte hausse au moment du part, ce qui favorise une augmentation à la
fois du tonus de base des contractions et de leur fréquence
[MARTIER et al., 1986]. Ce sont les
oestrogènes qui stimulent la synthèse de prostaglandines de type
E, qui jouent un rôle dans le ramollissement du col, et de type F, qui
vont lyser le corps jaune et donc stopper sa production de progestérone,
puis provoquer les premières contractions myométriales une fois
que la progestérone aura cessé de bloquer la parturition.
I.5.5. Augmentation de la concentration
d'ocytocine
Le pic de l'ocytocine est atteint au moment de l'expulsion du
foetus. Elle est due d'une part aux modifications hormonales, et d'autre part
à une incitation nerveuse reflexe, appelée«reflexe de
Fergusson», issue des organes génitaux et due à la
dilatation du col et du vagin. DERIVAUX et ECTORS (1986)
montrent qu'une fois le foetus est engagé dans la filière
pelvienne, la distension du col et du vagin conduit à la
libération de l'ocytocine qui est un contracturant utérin,
contribuant à l'expulsion du foetus et surtout à la
délivrance.
I.5.6. Augmentation de la concentration des
PAGs
La concentration des PAGs continue d'augmenter dans le sang
maternel jusqu'au jour de la parturition. Ainsi, TAINTURIER et
al. (1996) ont montré dans leur étude
qu'à ce moment, les concentrations atteignent 1400ng/ml alors que
SOUSA et al. (2003) ont
montré des concentrations de l'ordre de 1018,04 #177; 560,85 ng/ml chez
le zébu azawak au Burkina Faso (Figure 7, page 22).
Cette augmentation très rapide de la concentration des
PAGs dans la circulation périphérique dans les jours qui
précèdent la mise-bas pourrait être liée aux
modifications physiologiques relatives au déclenchement de la
parturition. Elle pourrait être à l'origine des changements
chimiques préparant l'expulsion du placenta après la
parturition.
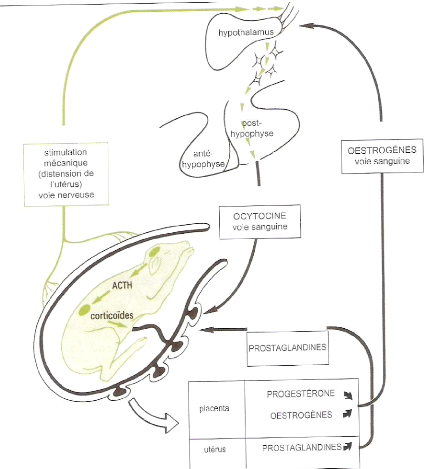
Figure 8: Régulation endocrinienne de la
parturition.
[Source: INSTITUT DE L'ELEVAGE,
2000]
Au terme de ce chapitre consacré à la
physiologie de la gestation, nous avons évoqué les principales
phases de la gestation, sa durée, sa régulation, ses hormones et
le déclanchement du part. Il en ressort que la gestation qui commence
par la fécondation et se termine par la mise bas, nécessite des
modifications endocriniennes, fonctionnelles, métaboliques et
morphologiques de l'organisme maternel tant qu'il n' y ait pas des pertes en
cours de gestation.
Paradoxalement, dans l'espèce bovine, la
fréquence des pertes en cours de gestation ou avortements sont
fréquentes et compromettent ainsi toute tentative d'amélioration
génétique bovine. Ces pertes de gestations regroupent les
mortalités embryonnaires, les avortements cliniques dûment
constatés par l'éleveur ou le vétérinaire, les
retours en chaleurs de l'animal ou encore les diagnostics de non- gestation
posés par le vétérinaire
.
CHAPITRE II: LES MORTALITES EMBRYONNAIRES
La période embryonnaire est classiquement
définie comme la période comprise entre la fécondation et
la fin de l'organogénèse, soit le 42ème jour de
gestation [GAYRARD et al., 2003]. Cette date
considérée comme marquant la fin de la période
embryonnaire est estimée au 45ème jour par
AYALON (1978). Il précise que
plusieurs auteurs incluent dans cette période les échecs de
fécondation au même titre que les échecs après la
fécondation dus surtout à la mortalité embryonnaire.
II.1. Définition
On distingue deux (2) types de mortalité embryonnaire: La
mortalité embryonnaire précoce (MEP) et la
mortalité embryonnaire tardive (MET).
La première ferait référence à la
période pour laquelle on ne dispose d'aucun moyen de diagnostic de
gestation soit environ les 20 premiers jours suivant l'insémination
[HANZEN, 2008a]. Cliniquement, on observe un retour en chaleur
de l'animal 18 à 24 jours après la mise à la reproduction.
La durée normale du cycle n'est donc pas modifiée.
La seconde correspond à une perte embryonnaire ayant
lieu entre le 16ème et le 42ème jour
après l'insémination (Figure 9). Cliniquement,
on constate un retour en chaleurs décalé entre 25 et 35 jours
après l'insémination. En effet, l'embryon a alors eu le temps
d'émettre un signal de maintien du corps jaune, dû à
l'action antilutéolytique de l'IFNô ce qui entraîne un
allongement du cycle sexuel [LEDOUX et al., 2006].

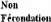
Figure 9: Définition des échecs de
gestation. [Source: DIZIER, 2008]
II.2. Facteurs associés à la mortalité
embryonnaire
De nombreux facteurs sont à l'origine de
mortalité embryonnaire. Certains sont parfois plus impliqués dans
un type de mortalité que dans l'autre. Cependant, il n'est pas possible
de mettre en évidence, à partir des données
collectées en élevage dans les différentes études,
les rôles respectifs des facteurs sur l'absence de fécondation ou
la MEP puisqu'aucun test biologique ne permet de les distinguer. Ces facteurs
peuvent être regroupés dans quatre (4) grandes catégories:
les facteurs gamétiques et embryonnaires, les facteurs parentaux,
facteurs biologiques et les facteurs environnementaux (Tableau
I)
II.2.1. Facteurs gamétiques et embryonnaires
II.2.1.1. Facteurs liés aux gamètes
Le zygote issu de la fécondation est composé de
matériel génétique et non génétique
provenant de l'oocyte et du spermatozoïde. L'oocyte apporte beaucoup plus
de matériel que le spermatozoïde si bien que le cytoplasme du
zygote est largement dérivé de l'oocyte et seules les
mitochondries maternelles (et non celles issues du spermatozoïde) sont
présentes dans le zygote.
Etant donné que le zygote dérive des
gamètes, il n'est pas étonnant que des erreurs dans la formation
ou les fonctions de l'oocyte et spermatozoïde puissent altérer la
survie de l'embryon [SNIJDERS et al., 2000].
~ L'oocyte
De nombreux facteurs altèrent la compétence de
l'oocyte et par conséquent la survie embryonnaire. Ainsi, les rations
composées d'une grande quantité de protéines
dégradables sont responsables d'une diminution de la compétence
qui passe de 23,2% d'oocyte arrivant au stade blastocyste à seulement
8,8% [HANSEN, 2002].
De même, une NEC (note d'état corporel) basse
comprise entre 1,5 et 2,5 ramène ce pourcentage à 3,0% contre
9,9% lorsqu'elle est entre 3,3 et 4 [SNIJDERS et al.,
2000].
La chaleur et la saison affectent aussi la compétence
de l'oocyte [AL KATANANI et al., 2002]. Selon le
même auteur, la chaleur entraîne par exemple une
augmentation du nombre de petits follicules. Pour finir, cette
proportion est de 17,6% pendant l'été contre 26,2% (P<0,001)
en hiver [SNIJDERS et al., 2000].
Ces facteurs altèrent la compétence de l'oocyte
en affectant directement le développement de l'oocyte ou en
empêchant les cellules folliculaires d'accomplir leur rôle. Le
follicule transmettrait des informations à l'oocyte lui permettant
d'acquérir sa compétence. Ainsi, la compétence de l'oocyte
est altérée lors de changements dans la dynamique folliculaire
[HANSEN, 2002].
~ Le rôle du spermatozoïde dans la
mortalité embryonnaire
Le spermatozoïde joue un rôle sur la
fertilité non seulement en modifiant le taux de fécondation mais
aussi en apportant à l'embryon des caractéristiques conditionnant
son aptitude à se développer. Peu de chose sont cependant connues
concernant l'impact du mâle sur la mortalité embryonnaire.
D'après HANZEN et al. (1999a), un sperme de
mauvaise qualité favoriserait la mortalité embryonnaire
précoce.
II.2.1.2. Causes génétiques
V' A l'échelle du gène
La reconnaissance maternelle de la gestation fait intervenir
de nombreuses protéines sécrétées par l'embryon et
la mère respectivement l'INFô et les récepteurs à
l'ocytocine par exemple. Ainsi, certaines altérations des gènes
codant pour l'INFô se traduisent par une synthèse de
protéines insuffisante ou ayant lieu à un stade inadéquat
du développement. Cela pourrait entraîner une mauvaise
reconnaissance maternelle de la gestation et se solder par la mort de l'embryon
[DUCOS, 2003].
Il peut également se produire des mutations naturelles
dont certaines sont responsables de mortalité embryonnaire. Des
gènes léthaux récessifs contribuent aussi à la
mortalité embryonnaire. Dans l'espèce bovine, c'est le cas
notamment de la déficience héréditaire en enzyme
uridine-5-monophosphate (UMP) synthétase, permettant la conversion de
l'acide orotique en UMP, précurseurs des nucléotides
pyrimidiques. Cette anomalie a été décrite principalement
dans la population Holstein Nord Américaine. Environ 2% des Holsteins
des Etats-Unis sont porteuses d'une forme autosomale récessive du
gène [DUCOS, 2003].
V' A l'échelle du chromosome
Dans l'espèce bovine, les anomalies chromosomiques
seraient responsables de 20% des cas de mortalité embryonnaire
[DUCOS, 2003]. Les anomalies de nombre sont rares et non
héréditaires.
Les anomalies de structure sont quant à elles plus
fréquentes. Elles concernent le plus souvent des embryons
âgés de moins de 7 jours et leur fréquence diminue avec
l'âge de l'embryon; c'est la preuve indirecte de leur implication dans la
mortalité embryonnaire permettant l'élimination d'embryons
anormaux.
Elles représenteraient une des causes majeures de
mortalité embryonnaire et foetale. Les remaniements de très loin
les plus fréquents sont les translocations Robertsoniennes ou fusion
centrique.
En effet, les translocations 1/29 et 7/21 sont les principales
décrites dans l'espèce bovine [KING et al.,
1995].
La translocation 1/29 est héritable et commune à
de nombreuses races de bovins mais plus particulièrement aux races Pie
Rouge suédoise, Charolaise et la population Blonde d'Aquitaine en France
[GUSTAVSSON, 1979]. Elle résulte d'une
ségrégation anormale des chromosomes lors de la méiose qui
entraîne la formation d'un chromosome submétacentrique issu de la
fusion de deux chromosomes non homologues acrocentriques (les chromosomes 1 et
29). Elle s'accompagnerait d'une baisse de 5 à 10% [DUCOS,
2003], ou de 3 à 8% [HANZEN, et al., 1999a]
de la fertilité des individus porteurs
hétérozygotes. Les taureaux porteurs de cette translocation sont
responsables d'un taux élevé d'embryons aneuploïdes et par
là même non viables [KAWARSKY et al.,
1996]
Quant à la translocation 7/21, elle
entraîne une réduction de 3 à 8 % de la fertilité
mais se traduit davantage par une mortalité embryonnaire que par une
absence de fécondation [HANADA et al.,
1995].
En pratique, la fécondation in vitro ou les traitements
de superovulation contribuent à augmenter la fréquence des
anomalies chromosomiques chez l'embryon. Ces méthodes favoriseraient la
polyspermie, l'absence d'émission du second globule polaire
[IWASAKI et al., 1992].
Tableau I: Effets de divers facteurs sur le
risque de non-fécondation ou de
mortalité embryonnaire
[Source: HANZEN et al.,
1999a]
II.2.1.3. Sexe de l'embryon
Une capacité de développement dépendante
du sexe a été démontrée chez les embryons bovins
produits in vivo et in vitro. Ainsi, les embryons de sexe mâle se
développeraient plus rapidement que ceux de sexe femelle tout au moins
jusqu'au stade de blastocyste [HANZEN et al.,
1999b].
En effet, 95 % des embryons sexés au
7ème jour de gestation se révèlent être
des mâles et ont une meilleure viabilité [AVERY et
al., 1991]. De même, lors de stress consécutif
à la chaleur, le sex ratio sera modifié en faveur du
sexe mâle que la gestation soit gémellaire ou non. RYAN et
al (1993) constatent en effet que, sous un climat chaud
(24-53°C), 54,1% des embryons sexés au 7ème jour
de gestation sont des mâles contre 45,9% des femelles
Etant donné l'absence de différences
significatives du sex-ratio habituellement rapportée à
l'encontre des veaux nouveau-nés, laisse supposer que les embryons de
sexe mâle seraient davantage exposés à une mortalité
embryonnaire ou foetale [BERG et al., 1992; HANZEN et
al., 1999a].
II.2.1.4. Nombres d'embryon
Chez les bovins, la double ovulation s'observe dans 75% des
cas sur le même ovaire. Selon les auteurs, elle s'accompagne ou non, en
cas de gestation, d'un plus grand risque de mortalité embryonnaire.
Cependant, la mortalité embryonnaire est plus souvent observée si
les deux embryons se développent dans la même corne utérine
et davantage encore si la corne droite est concernée [DAY et
al., 1995]. De même, une étude menée par
ROMANO (2004) montre qu'un grand risque de
mortalité embryonnaire est observé chez les vaches avec une
gestation gémellaire (Figure 10).
Figure 10: Mortalité embryonnaire en
fonction de la taille de la portée. [Source:
ROMANO, 2004]
II.2.2. Facteurs parentaux II.2.2.1. Facteurs
paternels
Diverses publications ont fait état de l'effet
négatif exercé par un sperme de mauvaise qualité sur le
risque de mortalité embryonnaire précoce [DEJARNETTE et
al., 1992; SETCHELL et al., 1988]. De même,
l'influence du taureau sur le développement embryonnaire a
été observée dans diverses expériences de
fécondation in vivo et in vitro [COLEMAN et al., 1987;
SHI et al., 1990].
Le taureau serait sans effet sur la fréquence de la
mortalité embryonnaire tardive évaluée par le taux de
non-retour entre 25 et 35 jours [HUMBLOT et DENIS, 1986] ou
par un suivi progestéronique [BALL, 1978].
II.2.2.2. Facteurs maternels
II.2.2.2.1. Rôle de la
progestérone
La relation entre l'insuffisance progestéronique et la
mortalité embryonnaire est encore incomplètement
élucidée [HANZEN et al., 1999b]. Il a
été démontré que la concentration
systématique en progestérone agit sur le volume des
sécrétions utérines, le taux de développement du
conceptus, la capacité pour l'embryon à produire le signal
anti-lutéolytique (INFô) et le développement du signal
lutéolytique (PGF2á) [McNEILL, et al.,
2006].
En effet, un retard dans l'augmentation post-ovulatoire de la
concentration en progestérone compromet le développement du
conceptus et par là même sa capacité à
sécréter l'INFô. DARWASH et LAMMING (1998)
constatent dans ces conditions une diminution du taux de
conception.
II.2.2.2.2. Anomalies de cyclicité
post-partum
V' Durée du proestrus
Les vaches avec des petits follicules ovulatoires ou celles
avec des proestrus courts ont un taux de gestation faible. Cela est à
relier à une exposition réduite à l'oestradiol avant
l'ovulation ce qui, d'après MANN et LAMMING (2000),
entraîne une augmentation de la capacité de réponse
endométriale à l'ocytocine et une meilleure libération de
prostaglandine.
y' Cycle à courte phase lutéale
Lors du 1er cycle post-partum, la phase
lutéale peut s'avérer plus courte (<12 jours), ce qui est
attribué à un manque d'exposition préalable à la
progestérone [INSKEEP, 2002] ou à l'oestradiol
au cours du proestrus [MANN et LAMMING, 2000]. Cette phase
lutéale plus courte est due à une sécrétion
utérine trop précoce de PGF2á de J4 à J9
après ovulation [HERNANDEZ et al., 2000]. Le
taux de gestation est alors extrêmement faible voire nul si la vache est
saillie lors de l'oestrus de ce 1er cycle post-partum.
Ce faible taux de gestation n'est pas dû à la non
fécondation car les auteurs observent que les ovocytes sont
fécondés. Par contre les embryons sont perdus au moment où
le corps jaune régresse prématurément puisque la
progestérone sécrétée par ce dernier est
essentielle au maintien de la gestation [HERNANDEZ et al.,
2000]
y' Anoestrus post-partum
Selon POLL (2007), .entre 11 et 38 % des
vaches laitières des exploitations avec des vêlages
répartis tout au long de l'année sont en anoestrus à
J50 post-partum Ainsi, l'état d'anoestrus constitue un risque
pour l'établissement et le maintien d'une gestation débutant au
cycle suivant. La majorité des études suggère que le taux
de MET est plus important pour des vaches en anoestrus avant
insémination [HERNANDEZ et al., 2000]. En
revanche, SANTOS et al.
(2004) montrent que les vaches en anoestrus présentent
moins de pertes embryonnaires que les vaches cyclées.
Au final, il semble que réduire le nombre de vaches en
anoestrus avant une 1ère insémination post-partum permettrait de
minimiser les pertes embryonnaires dans les troupeaux bovins [HERNANDEZ
et al., 2000].
II.2.2.2.3. Rang de lactation
En ce qui concerne l'étude du facteur «rang de
lactation», les auteurs observent que le taux de conception diminue
lorsque le rang de lactation augmente en particulier lorsque le nombre de
lactation est supérieur à 4 [GRIMARD et al.,
2006]. Ceci est en accord avec les observations de
SANTOS et al.
(2004) qui montrent que les primipares ont un taux de
conception à J31 de 45,9% contre 41,5% pour les
multipares.
De même, CHEBEL et al. (2004)
montrent que les pertes embryonnaires entre J21 et J42
après insémination sont plus élevées chez une vache
multipare que chez une primipare.
Ils précisent que cela peut être partiellement
expliqué par une incidence plus élevée de maladies
post-partum chez les vaches multipares (14,9% contre 6,2% pour les primipares).
Or ces maladies sont responsables d'une diminution du taux de conception.
D'après HUMBLOT (2003), les
fréquences de mortalités embryonnaires précoce et tardive
augmentent toutes deux avec le rang de lactation. Les taux de MEP sont de 29,3
% pour les primipares, 31 % pour les 2ème et
3ème lactations, et 37,5 % chez les vaches en
4ème lactation ou plus, respectivement, tandis que les taux
de MET sont de 13 %, 15 %, 17,5%, respectivement.
II.2.2.2.4. Maladies péri partum
+ Mammites
Les mammites sont l'une des affections les plus courantes chez
les vaches laitières. En plus de causer une baisse de production
laitière, une diminution de qualité du lait, des frais de
traitements et des réformes, les mammites diminuent les performances de
reproduction.
D'après SANTOS et al. (2004),
les performances de reproduction sont altérées lorsque la mammite
se déclare avant l'insémination ou entre le jour de
l'insémination (J0) et celui du diagnostic de gestation (J35). En effet,
lorsque la mammite se déclare avant l'insémination, l'intervalle
vêlage/1ère insémination augmente (P<0,01).
Ce délai est de 75,7#177;1,8 jours alors qu'il n'est que de 67,8#177;2,2
jours pour des vaches non infectées [SCHRICK et al.,
2001].
De plus, le taux de réussite en 1ère
insémination diminue lorsque la mammite apparaît avant J0 ou entre
J0 et J35 (P<0,01), alors qu'il n'est pas modifié
lorsqu'elle se déclare après le diagnostic de gestation
[SANTOS et al., 2004].
CHEBEL et al. (2004) observent
qu'une mammite clinique se déclarant entre le jour de
l'insémination et celui du diagnostic de gestation s'accompagne d'une
augmentation des échecs de gestation.
En effet, les vaches présentant une mammite ont 2,8
fois plus de risque de subir de la mortalité embryonnaire tardive entre
J31 et J45 [CHEBEL et al.,
2004]. Cependant, ils ajoutent que les performances de reproductions
sont encore plus sévèrement altérées lorsqu'une
mammite subclinique avérée devient par la suite clinique.
Le mécanisme par lequel une mammite subclinique ou
clinique interfère avec les performances de reproduction est inconnu.
Par conséquent, des mécanismes potentiels sont envisagés
par certains auteurs. Une hypothèse serait que la libération
d'endotoxines par les bactéries Gram - provoquent la
sécrétion de médiateurs de l'inflammation tels que la
PGF2á ce qui peut entraîner une régression lutéale
précoce.
Une autre hypothèse invoquée est que l'infection
par les bactéries à Gram- et à Gram+
peut s'accompagner d'une augmentation de température corporelle et donc
d'une libération de médiateurs de l'inflammation comme
PGF2á. Ces deux raisons peuvent donc expliquer la diminution du taux de
conception et l'augmentation des pertes embryonnaires lors de mammite clinique
et subclinique [SCHRICK et al., 2001; SANTOS et al.,
2004]. De plus, BARKER et al.
(1998) rapportent qu'il existe une inhibition de la GnRH par
les endotoxines. Il s'en suit un développement folliculaire insuffisant.
Cela peut mener à une production d'oestrogènes trop faible et
donc à une anovulation suite au blocage du pic de LH.
+ Autres maladies post-partum
D'autres affections telles qu'une rétention placentaire
ou une fièvre de lait interviennent dans la diminution du taux de
gestation. Une fièvre de lait est associée à une
diminution du taux de gestation à J39 et une rétention
placentaire semble entraîner une réduction de ce taux de gestation
à J39 [CHEBEL et al., 2004]. Une
vache qui n'a pas eu de fièvre de lait est 2,25 fois plus capable de
concevoir qu'une vache ayant eu une fièvre de lait. Pareillement, une
vache sans rétention placentaire a 1,2 fois plus de chance de concevoir
qu'une vache avec rétention placentaire.
D'après SANTOS et al.(2004), les
vaches présentant des problèmes de reproduction tels qu'une
endométrite subclinique vers J40 ont un taux de conception
faible.
II.2.2.2.5. Environnement de l'utérus et de
l'oviducte
Plusieurs auteurs ont étudié la composition du
milieu utérin et de l'oviducte. Lorsqu'un embryon
dégénéré est récolté, WIEBOLD
(1988) observe parallèlement une augmentation significative du
glucose, des protéines totales, du calcium, du magnésium, du
potassium, du zinc et du phosphore dans les secrétions
utérines. AYALON (1978) observe le
même type d'augmentation sauf en ce qui concerne les protéines
totales qui sont quant à elles plus élevées chez les
vaches fertiles que chez les vaches infertiles. Il précise que des
différences frappantes sont observées pour les concentrations en
ions particulièrement le 7ème jour après
l'oestrus. La concentration en ion calcium à J7 dans les liquides de
lavages utérins de vaches avec embryons anormaux est égale
à plus de 12 fois celle de vaches avec embryons normaux.
Des concentrations augmentées en potassium, zinc,
phosphore et calcium se retrouvent également dans les liquides issus de
lavages de l'oviducte. Cette augmentation pourrait être liée
à l'augmentation de la concentration plasmatique en oestradiol
observée chez les vaches «repeat-breeders» avec embryons
anormaux [AYALON, 1978].
II.2.2.2.6. Protocole d'insémination
+ Intervalle vêlage / 1ère
insémination
Plusieurs études s'accordent sur le fait que le taux de
conception augmente lorsque l'intervalle vêlage/ 1ère
insémination (IVA1) augmente. Ceci est à relier
à une diminution de la MEP lorsque l'IA est réalisée au
delà de 50 jours post-partum et à une diminution continue du taux
de MET qui passe de 15% à 10,5% [HUMBLOT, 2001] Ainsi,
d'après GRIMARD et al. (2006), le taux de
réussite en 1ère insémination
augmente significativement lorsque la 1ère
insémination a lieu après 90 jours post partum par rapport
à une insémination faite à moins de 70 jours post partum
(P<0,05).
Dans son étude en climat tempéré,
HUMBLOT (2001) observe que la mortalité embryonnaire
tardive tend à diminuer lorsque l'intervalle vêlage/
1ère insémination augmente (17% lorsque
l'insémination a lieu à moins de 70 jours post-partum contre 13%
à plus de 70 jours, P<0,005) (Figure 11).
Figure 11: Influence de l'IVIA1 sur les
paramètres de reproduction [Source: HUMBLOT,
2001]
+ Nombre d'inséminations et intervalle ovulation/
insémination
La fréquence de mortalité embryonnaire est
quatre (4) fois plus élevée chez les animaux
inséminés plus de trois (3) fois que chez les autres (20,3%
contre 5,2%) [HANZEN et al., 1999a]. Ainsi, seuls 9,8
% des vaches inséminées une seule fois présentent des
maladies post partum. En revanche, 17% des vaches avec plus de 6
inséminations ont des pathologies post-partum. Or les maladies
post-partum affectent également le taux de conception et sont
responsables de ME [HANZEN et al., 1999a].
De même, le moment de l'insémination par rapport
à celui de l'ovulation est très important. KASTELIC et
al. (1991) observent une fréquence de mortalité
embryonnaire plus élevée entre le 29ème et le
32ème chez les animaux inséminés deux (2) jours
avant l'ovulation au lieu du jour précédent l'ovulation.
D'après AYALON (1978), le taux de
fécondation chute suite à une augmentation de la mortalité
embryonnaire lorsque les vaches sont inséminées plus de 6 heures
après l'ovulation. Il est donc très important qu'il y ait une
bonne détection des chaleurs. II.2.2.2.7. Age de
l'animal
L'effet de l'âge de l'animal sur les pertes
embryonnaires et foetales a rarement été décrit. Il est
vrai que ce genre d'étude comporte un biais important, à savoir
le faible pourcentage, parmi les vaches âgées, des animaux qui ont
déjà présenté un avortement. En effet, le plus
souvent cette pathologie s'accompagne de la réforme de l'animal.
Selon les études, la mortalité embryonnaire est
plus fréquente chez les multipares ou chez les vaches avec plus de 5
lactations que les vaches entre la deuxième et la quatrième
lactation [THURMOND et PICANSO, 1993]. D'autres études
confirment la plus grande fréquence d'avortements chez les vaches
âgées de 3 et 4 ans [ BADAI, 2008; HABIMANA,
2008].
II.2.2.3. Facteurs environnementaux
II.2.2.3.1. Alimentation
+ Alimentation énergétique
Le statut métabolique de la vache, s'exprimant par son
état d'embonpoint, affecte la survie embryonnaire. En effet, une balance
énergétique négative entraînerait une concentration
en progestérone plus faible et donc augmenterait les pertes
embryonnaires [HANZEN et al., 1999a].
D'après AYALON (1978), une sous- alimentation
diminue les concentrations plasmatiques en progestérone ainsi que la
proportion de génisses avec un ovocyte fécondé d'aspect
normal. Cependant, la relation existante entre l'énergie contenue dans
l'alimentation et la mortalité embryonnaire ne s'expliquerait pas
seulement par le taux de progestérone.
Par exemple, ENJALBERT (2003) constate que
chez les génisses une suralimentation avant insémination suivie
d'une sous-alimentation diminue sensiblement le taux de survie des embryons
sans modifier la progestéronémie.
+ Impact de la note d'état corporel
Chez la vache laitière, les taux de vêlage
après insémination sont proches voire inférieurs à
50%. Pourtant, plusieurs expériences ont démontré que les
taux de fécondation étaient supérieurs à 80%
(jusqu'à 90%) [DISENHAUS et al., 2005; PONSART et al.,
2007]. Hormis les cas d'avortement d'origine pathologique, les cas de
mortalité foetale chez les bovins sont peu nombreux (5%). En revanche,
30 à 40 % des embryons meurent après fécondation
[PONTER et al., 2005]. D'autres auteurs mettent en
évidence la relation entre note d'état corporel et
mortalité embryonnaire.
y' Non-fécondation et mortalité
embryonnaire précoce
La mise à la reproduction trop précoce d'animaux
dont l'état corporel est trop dégradé ou pas encore
stabilisé augmente donc le risque de mortalité embryonnaire. Dans
l'étude de FRERET et
al. (2005), la perte
d'état entre 0 et 60 jours post-partum a eu un effet sur le taux de non
fécondation-mortalité embryonnaire précoce (NFMP). Ce taux
est de 41,7% pour une perte supérieure à un point, contre 29,8%
lorsque la perte est inférieure à un point. Remarquons qu'aucune
relation n'a été observée dans cette étude entre la
note d'état au vêlage et les performances de reproduction
après insémination artificielle.
Par ailleurs, PINTO et
al. (2000) mettent en évidence un
taux de gestation plus élevé dans la classe de vaches
présentant un taux protéique (TP) supérieur à
30g/kg par rapport aux autres femelles (47,1% et 41,3% respectivement). Ceci
est lié à une diminution des taux de NF-MEP pour les animaux de
cette classe (28,6% et 32,8% pour la classe TP bas).
y' Mortalité embryonnaire tardive
Les études montrent là encore un effet
néfaste d'un mauvais état corporel (excessif ou insuffisant) sur
la mortalité embryonnaire. Les taux de MET sont plus faibles chez les
vaches maigres ou en état correct que chez les vaches grasses au moment
de l'insémination, avec respectivement 13,5%, 15,1% et 24,5% de MET
[FROMENT, 2007].
De nombreux auteurs mettent alors en évidence le
rôle prépondérant du déficit
énergétique sur le taux de MET. Le suivi de la note d'état
en post-partum est alors important car le risque de mortalité
embryonnaire tardive est multiplié par 2,4 pour chaque unité
d'état corporel perdu durant le premier mois de lactation
[LOPEZGATIUS et al., 2002]. De même,
GRIMARD et al. (2006) observent qu'il y a plus de
mortalité embryonnaire tardive lorsque les vaches ont des notes
d'état au vêlage et à l'insémination
supérieures à 2,5 (P<0,05). Se basant sur une étude
similaire, HUMBLOT (2001) souligne l'existence d'une
interaction entre la note d'état corporel et la mortalité
embryonnaire (Figure 12). PINTO et al. (2000)
rapportent aussi que la NEC est un facteur exerçant un effet
très marqué sur la mortalité embryonnaire tardive.
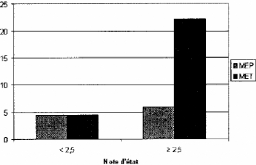
Figure 12: Relation note d'état/
ME [Source: HUMBLOT, 2001]
+ Influence de la composition de la ration
V' Excès d'azote dégradable
Dans les conditions normales, l'ammoniac est le
résultat de la dégradation ruminale de l'azote. Il est ensuite
transformé en urée dans le foie de façon presque totale ce
qui correspond à sa détoxification [POLL, 2007].
Cependant, l'augmentation de protéines dégradables dans
le rumen constituerait un risque d'augmentation de la concentration en ammoniac
et donc de l'urée plasmatique et urinaire. ENJALBERT (2003)
observe l'existence d'une relation négative entre la
fertilité et l'urémie. En effet, les vaches avec MET ont en
moyenne une urémie supérieure à celle de vaches gravides,
puis le taux de mortalité embryonnaire est sensiblement plus
élevé lors de la distribution de la ration la plus riche en azote
(Figure 13).
V' Déficits en minéraux et en
vitamines
Cela se produit lors d'un défaut d'apports dans la
ration ou alors ces déficits sont dus à des carences secondaires.
L'implication du cuivre est signalée pour la mortalité
embryonnaire. Ainsi, une supplémentation de magnésium,
manganèse, fer, cuivre et zinc sous forme organique diminuerait les
mortalités embryonnaires précoces [ENJALBERT, 2003].
Une carence en vitamine A favorise également la
mortalité embryonnaire (Tableau II).
Tableau II: Principales relations entre
alimentation et troubles de la reproduction
|
Troubles
|
Elément invoqué
|
|
Anoestrus et baisse d'activité ovarienne
|
Déficit énergétique Déficit en
phosphore
|
|
Défaut de fécondation Mortalité
embryonnaire
|
Fortes carences en énergie et azote Excès
d'azote (surtout dégradable) Déficit en phosphore et
oligo-éléments
|
|
Avortements
Mortinatalité
|
Carences en iode et vitamine A Excès d'azote
|
[Source: ENJALBERT, 2003]
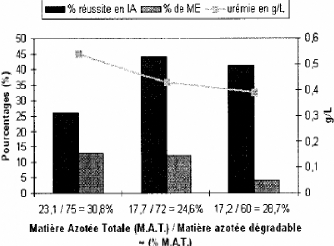
Figure 13: Relation entre la quantité, la
nature des matières azotées et la reproduction. [Source:
ENJALBERT, 2003]
II.2.2.3.2. La température et la
saison
Dans les régions tropicales et subtropicales, divers
auteurs ont enregistré une diminution de la fertilité au cours
des mois d'été coïncidant habituellement avec des
périodes prolongées de température élevée.
L'effet de la température sur les performances de reproduction se
traduirait par une diminution des signes de chaleurs, par la diminution de la
progestéronémie significativement plus basse selon certains
auteurs en été qu'en hiver.
Très récemment, CHEBEL et
al.(2004) ont observé que les vaches exposées
à la température avant insémination (entre 50 et 20 jours)
ont un taux de gestation inférieur de 31 à 33 % par rapport
à celles non exposées.
LEDOUX et al. (2006) ajoutent qu'un
stress thermique appliqué entre le 8ème et le
16ème jour de gestation perturbe le développement
embryonnaire (Figure 14). De même, EALY
et al. (1993) montrent que l'embryon
de vache serait davantage sensible à une augmentation de
température dans les 24 premières heures de gestation.
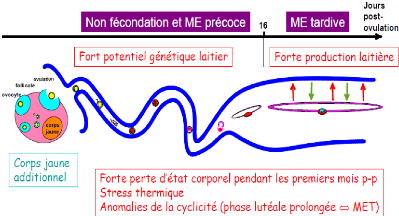
Figure 14: Facteurs de risque de
mortalité embryonnaire. [Source: PONSART et
al., 2007]
II.1.2.2.3.3. Production laitière
Un effet défavorable d'une production laitière
élevée sur le taux de MET est également observée.
Une augmentation des MET est notée chez les femelles hautes productrices
(18,7% pour les vaches produisant plus de 39 kg de lait par jour contre 13,5%
pour les classes de production moyenne ou faible (p<0,03). Il existe alors
une interaction forte avec l'état d'engraissement, cet effet
défavorable de la production laitière élevée
étant essentiellement observé chez les femelles en bon
état au moment de l'insémination artificielle [PINTO
et al., 2000].
Aussi, GRIMARD et al. (2006)
observent que le taux de gestation diminue significativement lorsque la
production laitière augmente et lorsque l'index de mérite
génétique (Index Economique Laitier: INEL) augmente (>27
points).
Une explication possible serait que l'augmentation de la
production laitière s'accompagne d'une augmentation du
métabolisme ce qui pourrait influencer les concentrations
périphériques en stéroïdes. Cela peut alors
être responsable d'une augmentation plus lente des concentrations en
progestérone pendant le début de dioestrus et donc de
mortalité embryonnaire. HUMBLOT (2001) ajoute que la
diminution du taux de fertilité pour les vaches à fort INEL est
due à une forte augmentation de la mortalité embryonnaire
précoce (29,1% pour un INEL = 27 contre 37,9% pour un INEL> 27,
P=0,01) (Figure 15).
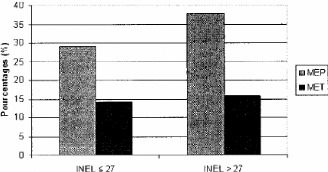
Figure 15: Mortalité embryonnaire et
INEL. [Source: HUMBLOT, 2001] II.2.2.3.4. Palpation
transrectale
La fréquence de la mortalité embryonnaire va
être influencée par divers facteurs liés à la
palpation manuelle du tractus génital. D'après PICARD-
HAGEN et al. (2003b), le pourcentage de pertes embryonnaires
après mise en évidence de la fluctuation liquidienne, recherche
de la vésicule amniotique et/ ou glissement des membranes annexielles
est de 10% environ. HANSEN et al. (1999) ont
montré que le diagnostic de gestation basé sur le glissement des
membranes foetales engendre davantage de pertes que la palpation de la
vésicule amniotique entre le 45ème et
70ème jour de gestation (6,3% contre 4,3 %) tandis que cette
seconde méthode induit plus de pertes entre le 30ème
et le 44ème jour de gestation(5,1 % contre 4,8%).
De même, ROMANO et al.(2007)
observent une fréquence de mortalité embryonnaire plus
élevée lors de diagnostic par glissement des membranes avant le
50ème jour de gestation.
II.2.2.3.5. Traitements hormonaux
Selon LULAI et al. (1994)
l'administration par erreur de prostaglandine à des animaux gestants
induit une mortalité embryonnaire précoce ou tardive voire un
avortement entre le 1 0ème et le 1 50ème
jour de gestation.
II.2.2.3.6. Effet troupeau
s" Influence de la taille du troupeau
D'après HUMBLOT
(2001), le taux de gestation diminue lorsque la taille du
troupeau augmente (46,9% pour un troupeau de moins de 40 vaches contre 39,4 %
pour un troupeau de plus de 40 vaches, P<0,01).
s" Influence de la Date de Réintroduction de la
vache au sein du Troupeau (DRT)
La date à laquelle la vache tarie est
réintroduite au sein du troupeau avant le vêlage est un facteur
ayant une influence sur les taux de mortalité embryonnaire et de
gestation des vaches du troupeau [HUMBLOT, 2001]. Ainsi,
lorsque la vache tarie est rentrée le jour du vêlage (DRT1), le
taux de gestation est de 45,5% alors qu'il est de 41,7 % lorsqu'elle est
rentrée de 5 à 15 jours avant vêlage (DRT2) et de 35 %
à plus de 15 jours avant vêlage (DRT3) (P<0,001).
L'augmentation de la MET due à une rentrée trop
précoce est différente selon que
l'on considère les
vaches à haut ou faible index génétique. En effet, les
vaches
DRT2 à INEL= 27 ne subissent aucune baisse de
fertilité en comparaison aux vaches DRT1. Au contraire, pour les vaches
DRT2 à INEL élevé (>27), les taux de mortalité
embryonnaires précoce et tardive augmente. Pour les vaches DRT3 à
INEL> 27, ces taux sont également supérieurs à ceux des
vaches DRT1. Les vaches
DRT3 à INEL= 27, ont une fertilité plus basse mais
cela est dû à l'augmentation du taux de MET uniquement qui est
alors proche de 20% [HUMBLOT, 2001].
II.2.2.4. Causes biologiques II.2.2.4.1. Données
cliniques
De nombreuses études ont été
consacrées aux germes spécifiques et non spécifiques du
tractus génital au cours du post-partum, chez les repeat-breeders, lors
d'endométrites ou d'avortements [BARTLETT et al.,
1986; VALLET et al., 1987; CHAFFAUX
et al. 1991; COHEN et al., 1995].
Quelques publications ont fait état d'une relation entre la
manifestation par l'animal d'une pathologie utérine et la
possibilité d'une interruption de la gestation. Ainsi, PAISLEY
et al. (1978) rapportent que parmi les 15
cas d'interruptions de gestation observés au cours des 100 premiers
jours suivant la fécondation, 73 % des animaux avaient été
traités pour endométrites, cervicites, repeat-breeding ou avaient
présenté un cycle allongé.
En effet, une étude de LOPEZ-GATIUS et
al. (1996) observe également une multiplication par 2,6 et
1,8 du risque d'interruption de gestation entre le 42ème et
le 150ème jour respectivement chez les animaux qui ont
présenté un pyomètre ou une rétention
placentaire.
II.2.2.4.2. Effets indirects de la fécondation in
vitro
Le recours de plus en plus fréquent au transfert
d'embryons et à la fécondation in vitro pose le problème
du rôle potentiel de ces méthodes dans la transmission
d'infections virales ou bactériennes et donc dans la mortalité
embryonnaire [GUERIN et al.,
1997].
II.2.2.4.2.1. Contamination de l'ovocyte
A ce jour, seule la contamination intracellulaire de l'ovocyte
par le parvovirus [BANE et al.,
1990] ou par le Campylobacter fetus [BIELANSKI et
DUBUC, 1994] a été démontrée. La
contamination intrafolliculaire de l'ovocyte par Leptospira interrogans
serovar hardjo a également été observée
après une induction expérimentale de l'infection
[BIELANSKI et SURUJBALLI, 1996].
On ne peut néanmoins exclure la possibilité pour
certains virus tels que le virus de la BVD, de l'IBR [BIELANSKI et
DUBUC, 1994] de pénétrer dans l'ovocyte au moment de la
fécondation, leur présence ayant été
démontrée dans le liquide folliculaire, les cellules granuleuse
ainsi que dans l'ovaire, l'oviducte ou l'utérus.
II.2.2.4.2.2. Contamination de l'embryon dans le tractus
génital
L'embryon transféré ou non peut être
contaminé lors de son transit dans l'oviducte ou la corne utérine
par des germes connus pour leur tropisme génital et leur capacité
de liaison à la membrane pellucide tels Brucella, Campylobacter spp,
Leptospira spp, Vibrio, l'In fectious Pustular Vaginitis virus, Haemophilus
somnus, Chlamydia, Mycoplasma bovis, Mycoplasma bovigenitalium,
neospora caninum, Listeria monocytogenes [BRITTON et al.,
1988; KANEENE et al., 1986; KAPOOR et al., 1989].
II.2.2.4.2.3. Contamination du matériel
animal
Le matériel animal (ovaires, cellules d'oviductes,
sperme, sérum) utilisé pour la fécondation in vitro peut
également constituer une source de contamination des embryons par un
virus [BIELANSKI et DUBUC, 1993; GUERIN et al., 1988;
GUERIN et al., 1989; BOOTH et al., 1992].
Ainsi, on ne peut exclure la possibilité que certains
virus tels les virus herpès bovins ou que certaines bactéries
comme E. Coli, Streptococcus spp. ou Mycoplasma spp. puissent rester
adhérents et contaminer l'embryon une fois celui-ci sorti de sa membrane
pellucide [ROSSI et al., 1990]. BIELANSKI et
DUBUC(1993); GUERIN et al. (1990) montrent
que certains virus tels le BVDv peuvent se fixer aux spermatozoïdes et
constituer une source d'infection lors de la fécondation in vivo ou in
vitro.
Il est communément admis que la membrane pellucide
d'embryons obtenus in vivo constitue une barrière de protection efficace
quelle que soit la taille de l'agent causal suspecté et la durée
d'exposition. Néanmoins, il n'est pas impossible de penser que la
différence de structure et de contenu protéique entre des
membranes pellucides obtenues in vivo et in vitro [RIDDELL et
al., 1993] puisse être responsable d'une modification de
leur résistance à l'infection [STRINGFELLOW et
WRATHALL,1995] et que la fécondation in vitro constitue un
facteur de risque supplémentaire d'infection et donc de mortalité
embryonnaire.
II.3. Manifestations cliniques des mortalités
embryonnaires
Les manifestations cliniques de la mortalité embryonnaire
dépendent du moment de son apparition.
En cas de mortalité embryonnaire précoce, les
conséquences cliniques sont frustres. Elles sont liées à
la possibilité de l'embryon d'avoir ou non le temps de
synthétiser le signal inhibiteur de la lutéolyse
(trophoblastine). Lorsqu'elle survient au 14-16ème jour de la
gestation, elle ne modifie pas la durée du cycle des femelles
[PINTO et al., 2000].
Concernant la mortalité embryonnaire tardive, l'absence
de battement cardiaque constitue l'un des signes les plus évidents
[KAHN et LEIDL, 1989]. Cliniquement, on constate un retour en
chaleur décalé entre 25 et 35 jours après
insémination.
Dans ces deux cas, l'embryon et ses enveloppes sont plus
fréquemment expulsés à travers le col utérin ou
résorbés [KASTELIC et GINTHER
,1989]
Au terme de ce chapitre consacré aux facteurs
associés à la mortalité embryonnaire, on constate que les
facteurs embryonnaires et gamétiques; les facteurs maternels et
environnementaux constituent les principales sources de mortalités
embryonnaires c'est-à-dire les pertes de gestations qui surviennent
avant 45ème jour post insémination. Par ailleurs, dans
l'espèce bovine, il existe aussi les avortements cliniques dûment
constatés par l'éleveur ou le vétérinaire. Ils
surviennent entre le 50ème et le 260ème de
gestation et font l'objet du chapitre suivant.
CHAPITRE III: LES AVORTEMENTS CLINIQUES
III.1. Définition
+ Définition courante: interruption de
gestation avant son terme normal suivi de l'expulsion du conceptus mort ou non
viable [HANZEN, 2008b].
+ Définition légale: En France,
d'après le décret du 24 décembre 1964, on considère
comme avortement dans l'espèce bovine l'expulsion du foetus ou du veau
mort-né ou succombant dans les 48 heures qui suivent la naissance
[HANZEN, 2008 b].
+ Définition pratique: interruption de
la gestation entre la fin de la période embryonnaire (fécondation
- 50ème jour de gestation environ) et le
260ème jour de gestation, suivie ou non de l'expulsion d'un
produit non viable. Après le 260ème jour de gestation,
on parlera de vêlage prématuré. Il convient de distinguer
l'avortement clinique (mise en évidence de l'avorton et/ou des
enveloppes foetales) de l'avortement non réellement constaté
(avortement supposé). Ce diagnostic d'avortement « supposé
» dit encore avortement « subclinique» peut être
posé sur la base de l'une ou l'autre information suivante relevé
après qu'un constat de gestation antérieur positif ait
été réalisé: diagnostic de gestation négatif
quelle que soit la méthode utilisée, détection d'un retour
en chaleurs, réinsémination de la vache, observation d'un retard
d'involution utérine [HANZEN, 2008b].
III.2. Importance
III.2.1. Importance sanitaire
En effet, une part non négligeable des avortements est due
à des agents infectieux zoonotiques, et certaines de ces zoonoses sont
loin d'être bénignes d'un point de vue médical (Brucellose,
chlamydiose, Fièvre Q, etc ) [HAUREY, 2000].
III.2.2. Importance économique
L'importance économique est considérable. Les
avortements cliniques limitent l'élevage à sa source et
constituent ainsi un frein aux tentatives d'amélioration
génétique. Selon GATSINZI (1989), sans
production de veau vivant et viable il n'y a pas de rentabilité
économique et donc pas d'intensification de la production bovine.
De plus, l'avortement, quelle que soit son origine est souvent
suivi de rétention placentaire, pouvant donner suite à des
métrites et de l'infertilité, voire de la
stérilité.
III.3. Etiologie
En élevage bovin, les avortements cliniques ont une
étiologie très variée (Figure 16). En effet, les agents
responsables de ces avortements sont de nature biologique tels les
bactéries, les virus, les parasites, les champignons et les levures
[DJABAKOU et al., 1985]; ou non biologiques comme les
facteurs nutritionnels, chimiques, physiques, génétiques ou
iatrogènes [KARABAGHALI, 1972; WOLTER, 1973].
|
Protoz: Protozoaire; Non Inf:
Non infectieux
|
Figure 16: Etiologies des avortements bovins
[Source: YAMINI cité par HANZEN,
2008b].
III.3.1. Agents biologiques III.3.1.1. Causes
bactériennes III.3.1.1.1. Brucellose
La brucellose est une maladie cosmopolite, zoonose due
à des bactéries du genre Brucella et se caractérise par
une évolution chronique affectant principalement les organes de
reproduction et se traduisant par de l'avortement plus
généralement vers le 6ème ou
7ème mois de gestation (80 % des animaux exposés au
germe avortent), la mortinatalité, la stérilité chez les
ruminants (surtout les bovins), qui de loin payent le plus lourd tribut
à cette entité pathologique [LEGEA, 1974].
Selon les différents auteurs, son dépistage a
été réalisé dans beaucoup de pays de l' Afrique
intertropicale. Au Tchad [DELAFOSSE et al., 2002],
une étude a montré une prévalence de 2,6%;. en Côte
d'Ivoire [THYS et al., 2005] la prévalence
était de 3,573% en élevage intensif et de 4,291% en
élevage traditionnel.
Au Togo, la prévalence est de 16,6% [AKAKPO et
al., 1981]. Au Sénégal, des enquêtes
sérologiques seules [CHAMBRON, 1965]; [MOUICHE,
2007a]; [HABIMANA, 2008], sérologiques et
bactériologiques [DOUTRE, et al., 1977] ont
montré des prévalences respectives de 13,3%, 1,17%, 1,5% et de
14,9%.
III.3.1.1.2. Chlamydiose
La Chlamydiose est une zoonose due à Chlamydia
abortus. Elle a été associée à des troubles de
la reproduction surtout les avortements dans les élevages bovins
d'Amérique du Nord, dans la plupart des pays d'Europe de l'Ouest et de
l'Est, en Afrique et dans beaucoup de régions d'Asie jusqu'à 10
à 20 % d'avortements [SHEWEN, 1986 ; GRAYSTON
et al., 1986; NABEYA et al., 1991].
Ainsi, STORZ et
WHITEMAN(1980); ARTHUR et al. (1996)
ont montré qu'une insémination avec du sperme
infecté par Chlamydia (C) abortus conduit à des
avortements dues soit aux effets directs de C. abortus sur l'ovocyte
fécondé soit à ses effets sur l'endomètre. Des
avortements ont été observés dès le
5ème mois de gestation, mais la majorité ont lieu plus
tard, principalement durant le dernier trimestre de gestation. Par contre dans
une infection expérimentale par voie intraveineuse, intramusculaire et
sous cutanée plusieurs vaches ont avorté respectivement dans les
5 à 36 jours, 1 à 4 mois qui ont suivi [STORZ et
WHITEMAN, 1980].
III.3.1.1.3. Fièvre Q
Maladie infectieuse, contagieuse affectant de nombreuses
espèces animales domestiques et sauvages, mais également l'homme.
Elle est due à une rickettsie, Coxiella burneti ; elle
évolue le plus souvent sous une forme inapparente et parfois avec des
troubles de la reproduction et l'avortement en fin de gestation. Son
caractère abortif a été confirmé par
KPOMASSI (1991) et AKAKPO et al.
(1994) au Togo puis par OLLOY (1992) au
Congo.
III.3.1.1.4. Listériose
C'est une maladie contagieuse, frappant diverses
espèces animales et l'homme, due à un germe spécifique,
Listeria monocytogenes. Chez la vache gestante, la bactérie
présente un tropisme pour les tissus foeto-placentaires. Habituellement,
l'avortement s'observe au cours des trois (3) semaines suivant la mise en
service d'un ensilage et
concerne le dernier trimestre de la gestation
[ANONYME, 2004]. Il se manifeste sous forme sporadique. Il est
plus fréquemment précédé et/ou suivi de signes
cliniques tels que la diarrhée, des troubles nerveux
(encéphalite), de la métrite et de l'amaigrissement. Il
s'accompagne également plus fréquemment de rétention
placentaire [MILLEMANN, 2000].
III.3.1.1.5. Leptospirose
C'est une maladie infectieuse, contagieuse due à
l'action pathogène des leptospires qui affectent les animaux et l'homme.
L'avortement leptospirosique peut être dû à une complication
de la forme ictéro-hémorragique ou à un germe
spécifique Leptospira interrogans serovar hardjo. Chez les
bovins, l'infection se manifeste essentiellement par les mortalités
embryonnaires précoces et les avortements cliniques [GAINES,
1989]. Ces derniers s'observent au cours des deux (2) derniers
trimestres de la gestation. L'infection peut également se traduire par
la naissance de veaux chétifs.
III.3.1.1.6. Campylobactériose
La vibriose ou campylobactériose est une infection
abortive vénérienne due à Campylobacter foetus var
venerealis chez la vache, se traduisant par un catarrhe
vagino-utérin responsable d'infécondité et de
mortalité embryonnaire, ainsi que par des avortements vers le
5ème - 6ème mois de gestation, parfois suivis de
rétention annexielle [HUMBER, 1995; HANZEN, 2008a].
III.3.1.1.7. Ureaplasmose et Mycoplasmose
Les ureaplasmes et mycoplasmes ont été
occasionnellement rendus responsables d'avortements sporadiques au cours de la
deuxième moitié de la gestation et d'infertilité suite
à l'inflammation du tractus génital.
Le pouvoir abortif de Mycoplasma (M) bovis a
été montré expérimentalement car l'injection
intra-utérine de cette bactérie provoque l'avortement des vaches
[BYRNE et al., 1999]. Il a aussi
été mis en évidence lors d'avortements en conditions
naturelles. Lors d'une enquête portant sur des troubles de la
reproduction incluant des avortements, des mortinatalités, des
non-délivrances et des endométrites dans un troupeau
récemment formé en Hongrie, M. bovis a été
isolé à partir de tissus de foetus avortés, notamment du
contenu abomasal ou de veaux mort-nés, de membranes placentaires et
d'écoulements vaginaux [BYRNE et al.,
1999].
STIPKOVITS et al.
(1983) ont mis en évidence une relation entre la
proportion d'échantillons de sperme contaminés par M. bovis
(37%) et Ureaplasma (33%) et le taux de
séropositivité des vaches ayant avorté,
inséminées par la semence des taureaux examinés (15-30%
pour les Ureaplasma et 33% pour Mycoplasma bovis). Les
avortements sont toujours sporadiques et la vache ne présente pas de
symptômes particuliers. La rétention placentaire est
fréquente.
III.3.1.2. Causes virales
Les conséquences d'une infection virale
dépendent du stade de gestation auquel l'infection a été
contractée. Le plus souvent au cours des deux premiers trimestres,
l'infection se traduira par une mortalité embryonnaire ou foetale,
l'avortement proprement dit pouvant s'observer selon un délai variable.
Il en résulte l'expulsion d'un foetus qui sera le plus souvent
autolysé.
Une infection contractée au cours du dernier trimestre,
s'accompagnera d'une réponse immunitaire suffisante pour permettre au
foetus de naître à terme ou si la réponse immunitaire est
excessive d'induire un état de stress chez le foetus qui dans ce cas
sera expulsé prématurément. Dans ce second cas l'autolyse
ne sera pas systématiquement observée [HANZEN,
2008b].
III.3.1.2.1. Diarrhée Virale Bovine (BVD) /
Maladie des Muqueuses (MM)
Une étude a montré que le taux d'avortement dans
les troupeaux où le virus circule est multiplié par 2 à 3
et un taux d'avortement de 20% peut être observé lors
d'introduction du BVD dans un élevage indemne [GROOMS,
2004].
En Afrique, des études montrent des prévalences
suivantes: Au Sénégal: 61 à 78 % [BERNARD et
BOIJRDIN, 1971;PROVOST et al., 1964] et 47%
[HABIMANA, 2008], au cours d'une enquête dans le nord
Cameroun et l'ouest Tchadien signalent que 75% des sérums des sujets
adultes sont positifs; au nord Nigeria: 13,4 % d'après OKEKE,
1976.
En Suisse, Il a été démontré
qu'une infection dans les 2 premiers mois de gestation s'accompagne du retour
en chaleurs tandis que l'infection vers le 5e mois de gestation
s'accompagne d'avortement ou de naissance des veaux malformés
[RUFENACHT, 2001]. Il en est de même pour une
insémination de la vache infectée qui s'accompagne d'un
échec.
En France, la prévalence des Infectés permanents
immunotolérants est comprise entre 0 et 2 %, alors que les foetus
infectés seraient entre 8 et 20 %. Il faut donc supposer que l'infection
tue un grand nombre de foetus, ou de veaux après la naissance
[ARCANGIOLI et MAILLAIRD, 2006].
La BVD-MM est donc responsable des troubles de la
reproduction. Il s'agit des avortements (Photo 1), des mortinatalités et
des naissances des veaux infectés (Tableau III).

Photo 1: Avorton de BVD.
[Source: GDS, 2008]
Tableau III: Effet de la BVD chez les femelles
gestantes.
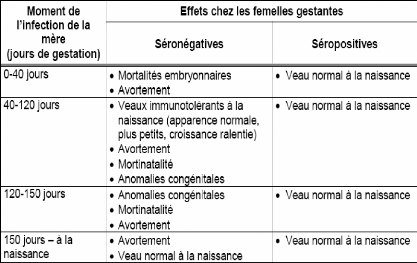
[Source: DESILETS A., 2003]
III.3.1.2.2. Rhinotrachéite Infectieuse Bovine
(IBR)
L'IBR est présente dans le monde entier [STRAUB,
1991] et près de 50% des cheptels de bovins adultes ont
déjà été en contact avec elle [SEAL,
2007].
Les avortements peuvent survenir à n'importe quel stade
de la gestation, mais plus fréquemment entre le 4ème
et le 8ème mois par suite de passage transplacentaire du
virus: le foetus est infecté et meurt par atteinte
généralisée de tous les organes. Les avortements peuvent
atteindre, dans un troupeau, un taux de 25 % à 60 % [YOUNGQUIST
et al., 2007]. L'infection des vaches durant le dernier
trimestre de la gestation peut conduire, en plus des avortements (Photo 2),
à des mortalités néonatales et des cas de mortalité
de veaux dans les 12 jours qui suivent la naissance.
En effet, si l'infection arrive sur une femelle gestante ne
possédant pas d'immunité contre le virus le foetus sera
infecté et l'avortement sera alors probable [YOUNGQUIST et
al., 2007].
Beaucoup d'auteurs ont rapporté l'existence de l'IBR
dans les élevages bovins africains. Ainsi, l'IBR a été
dépistée au Togo: 75% [ESPINASSE et al.,
1978], en Ethiopie: 41,8% [LEFEVRE, 1975] au
Sénégal oriental: 38%, en Casamance: 61% et dans le Ferlo: 48%
[BERNARD et BOURDIN, 1971], dans la région de
Thiès: 77,8% [HABIMANA, 2008].
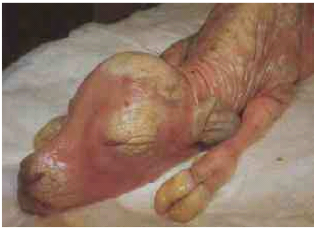
Photo 2: Avorton dans l'IBR. [Source:
ROY, 2007]
III.3.1.2.3. Blue tongue
L'infection du foetus par le virus de la blue tongue demeure
exceptionnelle. Contractée avant le 150ème jour de
gestation, elle se traduit par de la momification, de l'avortement ou la
naissance de veaux présentant des lésions du système
nerveux central (hydrocéphalie) ou plus caractéristique un
excès de développement de la muqueuse sur les incisives.
III.3.1.2.4. Virus Akabane
Dans la famille des Bunyaviridae, le virus Akabane
est largement répandu en Afrique, au Moyen-Orient, en Asie, en Australie
et est responsable des avortements et des mortinatalités chez les bovins
en particulier [MARRIOTT et al., 2000].
III.3.1.3. Causes parasitaires
III.3.1.3.1. Mycoses (Tableau IV)
Les avortements mycosiques sont dus à la localisation
placentaire de champignons (Aspergillus, Mucor, etc) absorbés
par voie digestive à la suite d'ingestion d'aliments (fourrages,
ensilages) mal conservés ou moisis [HANZEN, 2004]. Ces
avortements mycosiques sont généralement sporadiques et ont lieu
plus tardivement (7ème- 8ème mois de gestation) (Photo 3 et 4).
Ils sont souvent suivis de rétention annexielle.
Tableau IV: Liste des agents de mycoses
abortives chez la vache

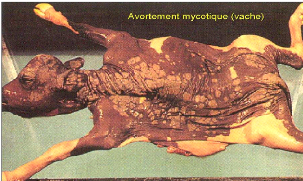
Photo 3: Avortement mycosique chez la vache
[Source: HANZEN, 2004]
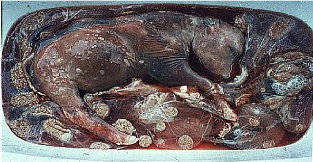
Photo 4: Manifestation clinique de l'avortement
mycosique [Source: HANZEN, 2004]
III.3.1.3.2. Trichomonose
C'est une affection vénérienne des bovins due
à Trichomonas foetus, qui entraîne chez la vache une
inflammation utéro-vaginale inductrice d'infécondité, de
mortalité embryonnaire, d'avortement précoce et de
pyomètre. L'avortement est caractérisé par sa
précocité (1er- 2ème mois) et par la lyse
foetale (Photo 5).
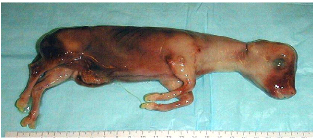
Photo 5 : Avorton de 2 mois dans la
Trichomonose. [Source: HANZEN, 2004]
III.3.1.3.3. Toxoplasmose
La toxoplasmose est une anthropozoonose de répartition
mondiale. Elle affecte l'homme et de nombreuses espèces animales
domestiques et sauvages. Elle est causée par Toxoplasma gondii,
protozoaire intracellulaire obligatoire capable de parasiter presque toutes les
cellules des animaux à sang chaud. Si une vache est contaminée
pendant la gestation, l'infection peut se traduire par un avortement (jusqu'
à 30 %) [HANZEN, 2004].
III.3.1.3.4. Néosporose
Elle est due à Neospora caninum et
caractérisée par les avortements (Photo 6) à trois (3)
mois de gestation jusqu' au terme; mais la majorité des avortements
surviennent entre 4 et 6 mois de gestation. Cependant dans une étude
californienne réalisée sur 170 cas, 30% des avortons ont entre 3
à 7 mois de gestation contre 78% qui ont entre 4 à 7 mois de
gestation [BRUGERE-PICOUX et al., 1998]. Ces
avortements ont été étudiés aussi bien sur des
troupeaux laitiers qu'allaitants.
Très récemment, une étude faite par
MUKAKANAMUGIRE (2008) a montré une prévalence de
16,92 % dans les exploitations bovines au Sénégal avec 45,4% des
avortons qui ont entre 3 à 7 mois de gestation contre 23,3% qui ont
entre 0 à 3 mois de gestation.

Photo 6: Manifestation clinique de
l'avortement: la momification
[Source: HANZEN,
2004]
Enfin, les mycoses, la trichomonose, la néosporose et
la toxoplasmose ne sont pas les seules affections parasitaires en cause dans
les avortements des bovins. Loin s'en faut car le rôle abortif des
trypanosomoses [DJABAKOU et al., 1985], de la
babésiose, et bien d'autres parasitoses sont tout aussi important
à considérer.
III.3.2. Causes non-biologiques
Les avortements non infectieux peuvent être dus à
des facteurs nutritionnels, chimiques, physiques, génétiques ou
iatrogènes.
III.3.2.1. Facteurs alimentaires
Dans les élevages africains, les troubles liés
aux performances de reproduction sont bien plus souvent causés par une
sous-alimentation que par une sur-alimentation. ENJALBERT
(2003) signale qu'une alimentation pauvre des vaches réduit le
taux de conception et augmente les avortements. Aussi, diverses publications
[PICARD et al., 2003a] ont rapporté des
avortements chez des animaux débilités ou consommant des rations
connues pour leur faible apport en énergie, en minéraux, en
oligoéléments et en vitamines.
III.3.2.1.1. Alimentation
énergétique
La fécondation paraît également sensible
à la glycémie et d'après LOISEL (1977),
la période critique se situe autour de l'insémination
(une semaine avant et deux semaines après). La carence
énergétique durant cette période s'accompagne d'une forte
mortalité embryonnaire précoce.
Pour qu'on observe des avortements, il faut une carence
très sévère, en particulier en fin de gestation.
D'autres auteurs mettent en évidence la relation entre
la note d'état corporel (NEC) et l'avortement. C'est le cas d'une
étude réalisée par LOPEZ-GATIUS et al.
(2002) portant sur les facteurs de risque d'avortement entre 30 jours
et 90 jours post insémination. Une perte d'état corporel
élevée entre le vêlage et trente jours (30jours)
post-partum autour d'une unité de NEC est associée à un
risque 2,4 fois plus élevé d'arrêt de gestation pendant la
période étudiée.
III.3.2.1.2. Alimentation azotée
Chez la vache, l'excès ou l'insuffisance d'apport de
protéines durant la gestation peut perturber la croissance foetale et
même atteindre la viabilité du foetus. HAURAY(2000)
montre que la carence azotée chez la vache est responsable
d'une diminution de la fertilité (Tableau V).
Tableau V: Fertilité et azote chez la
vache
|
Différence entre apports et besoins (g de MAD)
|
Taux de réussite en première IA
|
|
Inférieur à -200
|
43,0
|
|
de -200 à +200
|
72,0
|
[Source: HAURAY, 2000]
Cependant, plusieurs expériences montrent l'effet
abortif d'un excès azoté; ceci est particulièrement
possible lorsqu'il s'agit d'azote facilement dégradable, d'origine
végétale ou non protéique [HAURAY,
2000].
OLTJEN (1967) relate aussi des
avortements sur des vaches nourries avec des aliments à forte
concentration de protéines dégradables.
De même, MOUICHE
(2007a) montre que les vaches avortées avaient une
augmentation de la concentration en urée de 6,99#177;2,62mmol/l;
35ème jour post insémination artificielle, alors que
l'urémie plasmatique physiologique est comprise entre 3,8 et
6,5mmol/l.
III.3.2.1.3. Constituants minéraux et les
oligo-éléments
Une carence en minéraux ou en oligo-éléments
peut donc être responsable d'avortement; cependant, il faut que cette
carence soit très marquée.
+ Calcium et phosphore
Les métabolismes du calcium et du phosphore sont
intimement liés l'un à l'autre. Une augmentation du taux de
calcium gène l'assimilation du phosphore par l'organisme et provoque
donc une aphosphorose.
Cependant, une carence en calcium chez les vaches gestantes
provoque dans 50 à 60 % des cas d'avortements et de la
mortinatalité [KARABAGHLI, 1972]. De
même, FABIE (1983) montre qu'une aphosphorose est tenue
responsable, au moins en partie dans le déterminisme des troubles de la
reproduction en particulier les avortements.
+ Iode
Les besoins en Iode d'une femelle gestante sont de l'ordre de
0,4 à 0,8 mg/kg de matière sèche ingérée. Il
faut savoir que la thyroïde du foetus a besoin de cinq (5) fois plus
d'iode que celle de sa mère. C'est ainsi qu'une carence même
légère ne va pas affecter la mère, mais affectera le
foetus dans son développement et sa viabilité.
Il est bien évident que lors de carences
sévères, on observera à la fois des troubles chez le ou
les produits, mais également chez la mère [FABIEU,
1983]. SEIMIYA (1991) conclue qu'une carence en iode
durant la gestation provoque des avortements, de la mortinatalité et la
naissance de veaux faibles dans un troupeau.
+ Manganèse
Selon certains auteurs, la carence en manganèse serait
responsable d'avortements. Des observations de terrain ont été
effectuées dans les différents pays, aux Etats- Unis, des
avortements ont été observés sur des vaches pâturant
sur des prairies pauvres en manganèse [KARABAGHLI, 1972];
toujours aux Etats-Unis, des génisses nourries avec un aliment
contenant 1 0ppm(poids pour mille) de manganèse dans la matière
sèche présentent des retards à la puberté, une
altération des cycles, des chaleurs silencieuses, des avortements et une
baisse de lactation; en Hollande, des observations similaires ont
été faites; en France, de fréquents avortements ont
été observés sur des vaches pâturant en zone
carencée en manganèse, et le problème a été
résolu en quelques mois grâce à une supplémentation
en sulfate de manganèse [HAURAY, 2000].
+ Cuivre et Molybdène
La reproduction peut être altérée lors de
carence en Cuivre. Des chaleurs silencieuses, discrètes ou
retardées, des taux faibles de réussite en IA,
irrégularité des cycles, anoestrus ou suboestrus, des
mortalités foetales sont autant de signes d'appel peu spécifiques
d'une carence en Cu primaire ou secondaire à un excès en
Molybdène [ENNUYER et REMMY, 2008].
Le mode d'action de cette carence est encore peu connu. Elle
empêcherait la nidation et/ou favoriserait l'inflammation du tractus
génital et/ou provoquerait des avortements.
+ Zinc
Chez la vache, la carence en Zinc peut se manifester à
tous les stades de la reproduction [UNDERWOOD et SUTTLE,
1999]. On notera qu'une carence en Zinc même marginale est un
facteur de risque, d'avortements, de rétention placentaire, de
métrites et de fertilité amoindrie [ENJALBERT et
al., 2006].
+ Plomb
Le plomb est le plus universellement répandu des
métaux toxiques. La modalité d'intoxication la
plus fréquente est l'intoxication aigue due à la consommation ou
au léchage des objets étrangers, comme des particules de terre ou
des écailles de vieilles peintures sur les murs. La toxicité du
plomb est augmentée par des facteurs nutritionnels comme les
déficiences en protéines et en vitamines C et D.
L'intoxication est caractérisée par des troubles
nerveux centraux, des troubles de la reproduction, principalement par sa
toxicité pour les gamètes mâles et femelles, d'où
l'apparition de stérilité, d'avortements et de morts
néonatales [IARC, 1980].
III.3.2.1.4. Vitamines
+ Vitamine A
Une carence en vitamine A chez la femelle gestante est donc
caractérisée sur le plan clinique par la mortalité
embryonnaire, des avortements cliniques, la naissance des veaux non viable ou
malformés et fréquemment des rétentions placentaires. Ces
troubles sont accompagnés au niveau hormonal par une diminution de la
taille des corps jaunes, une diminution de concentration de progestérone
sérique pendant les cycles et à la mise bas.
+ Vitamine K
La vitamine K est activement synthétisée par la
flore intestinale; la carence ne s'observe que lors d'affections graves du tube
digestif ou lors d'insuffisance d'apport dans l'alimentation. L'avitaminose se
traduit par des hémorragies multiples, notamment au niveau du placenta,
et peut donc entraîner l'avortement.
III.3.2.1.5. Intoxications végétales
+ Plantes à effets oestrogèniques
De nombreuses plantes produisent des composés, comme
les isoflavones ou le coumestrol, qui possèdent une activité
oestrogénique, d'où le terme de phytooestrogènes
[ARQU I E, 2006].
De nombreux auteurs relatent que les phytooestrogènes
sont responsable d'une importante diminution des performances de reproduction
chez les animaux. Ce sont principalement les légumineuses
fourragères qui contiennent les phytooestrogènes notamment la
luzerne (Medico sativa), les trèfles blanc (Trifolium
repens), les trèfles souterrain (Trifolium subterranum) et
violet (Trifolium pratens, etc.).
Les phytooestrogènes sont des molécules dont la
structure chimique leur permet, après transformation ou non en
métabolites, de se fixer sur les récepteurs à
oestradiol.
Du point de vue pathogénique, les
phytooestrogènes agissent en perturbant l'équilibre du rapport
oestrogène/progestérone. Elles rendent donc la fécondation
difficile, ce qui est à l'origine des avortements chez les animaux
[KARABAGHLI, 1972].
+ Plantes à effets
antithyroïdiens
Les substances antithyroïdiennes d'origine
végétale sont quasiment caractéristiques de la famille des
crucifères (colza: Brassicus napus, le chou, etc....).
Les substances antithyroïdiennes contenues dans ces végétaux
sont des hétérosides soufrés ou glucosinolates. En effet,
ces substances ralentissent la croissance en diminuant la consommation
d'oxygène par les tissus et le métabolisme de base d'une part, et
d'autre part elles provoquent une perturbation de l'équilibre hormonal
mère-foetus et sont donc susceptibles d'entraîner l'avortement
[LE COZ, 1991].
+ Plantes et nitrates
L'intoxication par les nitrates réduits en nitrites
dans le rumen, par la flore ruminale, est possible en cas d'épandages
mal conduits en période de croissance rapide de plantes, et
l'utilisation irrationnelle de ces plantes dans l'alimentation animale
[TAINTURIER et al.,1996]. Il s'agit principalement de
plantes fourragères et plantes adventices susceptibles de concentrer
aisément les nitrates (Annexe 2).
L'intoxication chez la vache est caractérisée
surtout par l'avortement résultant de l'anoxie foetale,
conséquence de la transformation de l'hémoglobine en
méthémoglobine [LE COZ, 1991].
+ Intoxications par des végétaux
adventices
La consommation accidentelle de certaines espèces
végétales a également été rendue responsable
d'avortement quoique leur principe actif n'ait point toujours été
identifié. Ainsi en est-il du radis sauvage (Raphanus
raphanistrum), de cyprès (Cupressus macrocarpa),
d'indigotier (Indigo fera spicata), de diverses variétés
de pins (Pinus ponderosa, Pinus cubensis, Pinus
radiata).
SHORT et al. (1991) montrent que le
taux d'avortement est beaucoup plus élevé quand ces plantes sont
ingérées en grande quantité: 80, 90 et 100% chez les
animaux nourris respectivement de 0,7kg; 1,7kg et 2,4kg.
III.3.2.2. Facteurs physiques
La palpation manuelle de l'utérus entre le
35ème et le 60ème jour de gestation,
l'insémination ou l'irrigation d'un utérus gestant, la
présence de jumeaux, le transport, les interventions chirurgicales, des
coups ou des chutes dans des bâtiments èxigus, la torsion de
l'utérus et le déplacement du cordon ombilical,
températures ambiantes élevées constituent autant de
facteurs pouvant être responsables d'avortements [COSTARGENT,
1984].
III.3.2.3. Facteurs iatrogènes
Diverses substances sont connues pour leur effet abortif. Il
s'agit de: oestrogènes en début de gestation, corticoïdes en
fin de gestation, prostaglandines naturelles ou synthétiques entre le
40ème et le 150ème jour de gestation, les
purgatifs, la phénothiazine, les dérivés du benzimidazole,
les organophosphorés, etc
III.3.2.4. Effet race
Très récemment, une étude faite par
BADAI (2008) a montré que la race influence
significativement le taux d'avortement (P<0,005). Le taux le plus
élevé est noté chez la Holstein avec 16,3%. La
métisse Montbéliarde, la métisse Holstein, la Goudali et
la Charolaise ont un taux d'avortement respectivement de 5,3%; 3,2%; 5,1%;
7,7%. La figure 17 montre le taux d'avortement en fonction des races.
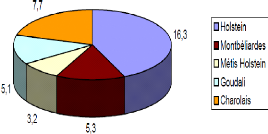
Figure 17: Taux d'avortement en fonction des
races [Source: BADAI, 2008].
III.2.4. Moments d'apparition des avortements
Dans la majorité des cas, l'expulsion de l'avorton sera
observée au cours du dernier tiers de la gestation. Cette règle
souffre d'exceptions. Le tableau VI montre le moment d'apparition des
avortements en fonction des agents responsables chez les bovins.
Tableau VI: Moments préférentiels
d'apparition de l'avortement dans l'espèce bovine

ME: Mortalité embryonnaire; A: Avortement

[Source: HANZEN, 2008b]
Dans cette première partie qui est consacrée
d'une part aux mécanismes physiologiques de la gestation, et d'autre
part aux facteurs étiologiques des avortements chez les bovins, il en
ressort que le développement embryonnaire est une suite
d'événements chronologiques orchestrés de façon
précise par différents hormones. Un certain nombre
d'étapes y sont cruciales et des erreurs à ces stades du
développement peuvent être fatales pour l'embryon. Le
développement embryonnaire relève en plus d'un ajustement aussi
bien morphologique qu'hormonal et nutritionnel entre l'embryon et son
environnement maternel. Ainsi, toute perturbation de cet équilibre
s'accompagne soit de mortalité embryonnaire ou avortement clinique
Les facteurs à l'origine de ces perturbations ont
été développés respectivement dans le chapitre II
et III de cette première partie. Il en ressort que les facteurs
biologiques surtout les maladies abortives, et les facteurs alimentaires sont
les principales sources des avortements dans les élevages bovins.
A la lumière de ces notions, il nous paraît
important d'aborder dans la seconde partie de ce travail, les méthodes
de diagnostic et stratégies de lutte contre les avortements au sein de
l'élevage bovin.
|
DEUXIEME PARTIE:
METHODES DE DIAGNOSTIC ET
STRATEGIES DE LUTTE CONTRE
LES AVORTEMENTS
|

CHAPITRE I: METHODES DE DIAGNOSTIC
DES
AVORTEMENTS
La quantification des avortements dans l'espèce bovine
n'est pas une chose aisée [HANZEN et al.,
1999a]. Il faut y voir le manque d'harmonisation de sa
définition et donc de la période considérée mais
également l'emploi de méthodes aussi différentes que
l'abattage des animaux, la récolte d'embryons, les dosages hormonaux, la
palpation transrectale ou l'échographie [POLL,
2007].
La méthode d'étude de la mortalité
embryonnaire par abattage des animaux est utilisée uniquement dans les
études expérimentales et n'est pas la technique employée
en pratique sur le terrain pour des raisons économiques
évidentes. Cependant, il s'agit de la méthode la plus fiable pour
étudier les échecs de fécondation et la mortalité
embryonnaire [AYALON, 1978]. De nombreux signaux sont
émis par le conceptus dès le premier mois de gestation mais
certaines molécules (cytokines, facteurs de croissance,
progestérone) ne sont pas spécifiques de la gestation
[POLL, 2007].
En outre, parmi les molécules spécifiques de
l'activité embryonnaire, certaines ne passent pas dans la circulation
périphérique maternelle et ne peuvent donc pas être
utilisées pour établir un constat de gestation. En effet, les
protéines embryonnaires, telles que l'IFNô, responsables du
maintien du corps jaune, restent localisées dans la cavité
utérine [PICARD-HAGEN et al., 2003a].
Ainsi, le diagnostic des avortements relève le plus
souvent de l'association de méthodes de diagnostic de nature hormonale,
échographique, palpation transrectale ou simple notation du retour en
chaleur de l'animal (figure 18).
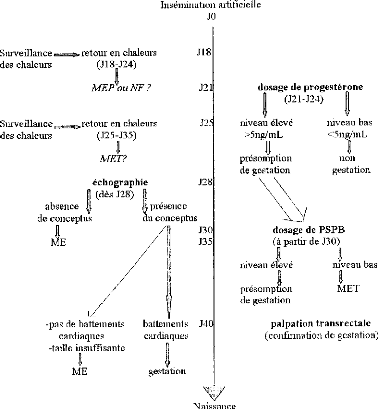
Figure 18: Conduite à tenir face à
des mortalités embryonnaires dans un troupeau.
[source: PICARD-HAGEN et al.,
2003b]
I.1. Méthodes biochimiques
I.1.1. Dosage de la progestérone
Le dosage de la progestérone consiste à estimer
sa concentration dans le sang ou dans le lait 21 à 24 jours après
l'insémination artificielle. La mesure de concentration de la
progestérone se fait par la méthode radio-immunologique; les
vaches suspectées gestantes ont un taux de progestérone qui se
maintient à un niveau supérieur à 1ng/ml dans le sang et
3,5ng/ml dans le lait [HASKOURI, 2001]. En effet, le dosage de
la progestérone permet de déterminer l'état physiologique
des femelles et de faire le diagnostic des avortements au sein du troupeau.
I.1.1.1. Détermination de l'état
physiologique des femelles
L'analyse des concentrations de la progestérone
plasmatique ou sérique périphérique permet de
déterminer l'état physiologique des femelles. En effet, la
concentration de la progestérone varie selon l'état physiologique
de la femelle. Le tableau VII montre la relation entre la
progestéronémie et l'état physiologique d'une femelle.
Tableau VII: Progestéronémie et
état physiologique d'une femelle
|
Moment du
prélèvement
|
Progestéronémie
|
Etat physiologique
|
|
Quelconque(1)
|
>0,5ng/ml
|
Cycle (phase lutéale)
ou gravide (2)
|
|
Un cycle après
insémination
|
<0 ,5ng/ml
|
Cyclique (période pré- ovulatoire) ou
anoestrus
|
|
<1ng/ml
<2ng/ml
|
Non gravide
|
|
>1ng/ml
>2ng/ml
|
Gravide (2)
|
|
(1) un seul prélèvement est insuffisant pour
déterminer l'état
physiologique
(2)Eventuellement corps jaune persistant (pseudo-gestation)
|
[Source: THIMONIER, 2000]
En pratique, une insémination en phase lutéale
peut être évitée par un dosage de la progestérone
juste avant l'insémination: si la concentration en progestérone
est élevée la vache est en phase lutéale et
l'insémination doit être reportée. Considérant que
l'exactitude des résultats positifs (nombre de femelles mettent
bas/nombre de positifs) n'est que de 70-75%, cela signifie qu'un pourcentage
important de vaches présentent une activité lutéale entre
J21et J24 mais ne mettent pas bas.
Ainsi, il est intéressant d'effectuer un diagnostic de
confirmation de gestation par dosage de PSPB, et/ou échographie, et/ou
palpation transrectale.
I.1.1.2. Diagnostic de mortalité
embryonnaire
Comme dans d'autres espèces domestiques, la
progestérone est, chez la vache, essentielle au maintien de la
gestation, une augmentation de la progestéronémie étant
favorable au développement de l'embryon [GEISERT et
al., 1992].
Diverses études expérimentales et essais
thérapeutiques sont venus confirmer la relation entre la
progestéronémie et le risque d'une mortalité embryonnaire.
Une association significative entre une faible concentration en
progestérone au cours de la phase périovulatoire et le taux de
survie embryonnaire a été observée chez la vache
[LEE et AX,1984].
Selon HANZEN (2008a), la concentration en
progestérone 21 à 24 jours après l'insémination est
inférieure chez les animaux qui présentent ultérieurement
une mortalité embryonnaire que chez les animaux gestants.
Afin d'estimer la fréquence de mortalité
embryonnaire précoce ou non fécondation l'observation des retours
en chaleurs n'est pas suffisante. Il est nécessaire de connaître
les concentrations de progestérone.
Le dosage s'effectue par des méthodes
radio-immunologiques ou des tests ELISA, sur les prélèvements
réalisés à J0, J21-24 après
l'insémination, moment où le résultat est différent
si l'animal est gravide ou non. La concentration inférieure à 1
ng/ml dans le sang ou inférieur à 3,5ng/ml dans le lait, indique
l'absence du corps jaune et par conséquent exclut l'hypothèse de
la gestation [POLL, 2007].
Ainsi, la mortalité embryonnaire précoce peut
être établie avec certitude si les dosages le jour de
l'insémination (J0) et celui réalisé à
J21 révèlent tous deux de faible concentrations en
progestérone (<3ng/ml à J0 et < 5ng/ml à J21).
La fréquence d'animaux non fécondés,
parmi ceux qui ont une concentration faible en progestérone, est peu
élevée et représente un facteur de biais incontournable
pour identifier les mortalités embryonnaires précoces.
En effet, les méthodes fondées sur le dosage de
signaux de reconnaissance maternelle très précoces, qui
permettraient d'identifier tôt les femelles fécondées ne
sont pas encore fiables. D'après HUMBLOT (2003), 30
à 50 % des vaches subissant une mortalité embryonnaire
précoce ne présentent pas de chaleurs au moment attendu, à
21-24 jours après insémination.
L'absence de gestation n'est détectée qu'au
cycle suivant, parfois même après plusieurs cycles. En absence de
dosage de la progestérone chez les animaux fécondés, qui
permettrait de révéler précocement l'état de non
gestation, la fréquence des mortalités embryonnaires
précoces est sous évaluée, et celle des mortalités
embryonnaires tardives est surestimée. La fréquence de MEP ou non
fécondation est de 20,5% à 43,6% et celle de mortalité
embryonnaire tardive est de 8 à 17,5%.[HUMBLOT,
2001].
L'essentiel de la mortalité embryonnaire étant
précoce, les dosages de progestérone présentent donc un
intérêt majeur. Un niveau élevé de
progestérone à J21 précédé d'un
niveau bas à J0 ne permet pas de dire avec certitude que la vache est
gravide. En effet, ce niveau élevé peut déterminer soit un
état de gestation, soit le maintien d'un corps jaune
sécrétant au 21ème jour (et donc en
réalité de la mortalité embryonnaire tardive)
[HUMBLOT, 2003].
Pour finir, le dosage de la progestérone est souvent
mitigé et considéré comme un diagnostic de non gestation
parce que dans certains cas, la forte concentration de la progestérone
peut-être due uniquement à une présence éventuelle
de kystes ovariens car ceux-ci sécrètent une quantité non
négligeable de progestérone [THIMONIER,
2000].
Outre ce problème, cette technique présente
d'autres contraintes à savoir la nécessité de
connaître le jour de l'insémination; il est impérativement
nécessaire de centrifuger le sang dans l'heure qui suit le
prélèvement parce que la vache a la particularité d'avoir
une enzyme (5-alpha-réductase) qui dégrade rapidement la
progestérone en un métabolite qui ne croise pas avec la RIA.
I.1.2. Dosage des Protéines Associées
à la Gestation (PAGs)
I.1.2.1. Diagnostic de gestation
L'étude réalisée par GOURO
en 1980 montre que les résultats sur le dosage
de la progestérone apportent très peu d'information sur les
relations foeto- maternelles. De plus, le dosage de la progestérone
comme diagnostic de gestation est souvent mitigé à cause de la
présence éventuelle de corps jaunes persistants. L'application du
dosage de la PAG et sa concentration peuvent refléter la
viabilité foeto-placentaire pour le diagnostic précoce de
gestation sur les bovins [TAINTURIER et al.,
1996].
Les PAGs sont de bons marqueurs de la gestation du fait
qu'elles sont stables dans le sang maternel, d'où leur
intérêt dans le diagnostic de gestation. En pratique, les
prélèvements sont réalisés à 35 jours
après l'insémination et à ce moment le seuil de
positivité est de 0,5 à 0,8ng/ml. Cette technique s'est
avérée très intéressante du fait de nombre
d'informations qu'elle fournit [SOUSA et al.,
2003].
Le diagnostic de gestation par dosage des PAGs présente
cependant un inconvénient majeur, puisqu'il n'est pas applicable aux
vaches n'ayant pas plus de 120 jours post-partum [DELAHAUT et
al., 1999].
Ceci s'explique par le fait qu'il existe une quantité
résiduelle des PAGs après la parturition comme l'a montré
la courbe de la cinétique des PAGs post-partum (Figure 7, page 22).
Ainsi, la période nécessaire pour que la PAG devienne
indétectable dans la circulation maternelle semble être due
à une longue demi-vie de cette glycoprotéine allant de 7,3
à 8,4 jours [SASSER et al., 1986].
I.1.2.2. Diagnostic des avortements
La détermination des concentrations en PAG par RIA dans
le sérum ou dans le plasma est actuellement employée comme
méthode sérologique spécifique pour le diagnostic de
gestation chez le bovin dès le 28ème jour après
la conception. Au-delà de ce délai, les dosages des PAGs peuvent
également être utilisés pour assurer le suivi de la
gestation notamment dans le cadre de l'étude de la mortalité
embryonnaire précoce ou tardive et de la mortalité foetale
[HUMBLOT et al., 1988 ; MIALON et al., 1993; SZENCI
et al., 2000].
Depuis quelques années, des investigations ont
porté sur l'étude des mortalités embryonnaires
après insémination artificielle, saillie naturelle ou transfert
d'embryon [BREUKELMAN et al., 2005]. Dans ces
études, des approches simultanées ont été
utilisées: les dosages de progestérone et de PAG et un suivi par
examen ultrasonographique. Ces études rapportent que les concentrations
en PAG chutent chez des vaches dont la gestation a été
initialement diagnostiquée par échographie comme positive et
ensuite négative suite à une mortalité embryonnaire ou
foetale [SOUSA et al., 2003].
Le dosage des protéines associées à la
gestation permet donc d'envisager des études sur la mortalité
embryonnaire précoce et l'avortement en vue d'en déterminer la
période et l'époque à laquelle ils surviennent.
Ainsi, le suivi de la gestation et l'étude des
avortements, ont fortement évolué grâce au
développement de différents systèmes de dosage RIA-PAG
homologues [HUMBLOT et al., 1988; ZOLI et al.,
1991] et hétérologues [PERENYI et al.,
2002; AYAD et al., 2007].
Les systèmes RIA homologues (RIA PAG, PSPB, PSP60) ont
été les premiers à être utilisés pour le
dosage de protéines associées à (ou spécifiques de)
la gestation chez la vache aussi bien sur des échantillons de
sérum et de plasma [ZOLI et al., 1991; MIALON et
al.,1994] qu'expérimentalement dans le lait
[METELO et al., 2002].
Quant aux systèmes hétérologues, ils ont
été développés plus récemment à
partir de l'utilisation de différents antisérums produits contre
différentes formes de PAG caprines et ovines.
Deux antisérums anti-PAG caprine (AS#706:
caPAG55+62; AS#708: caPAG55+59) ont
été utilisés avec succès pour le diagnostic de
gestation et pour l'étude de la mortalité embryonnaire
précoce chez la vache [PERENYI et al., 2002, AYAD
et al., 2007]. Chez la vache gestante, les concentrations en
PAG sont détectables au plus tôt à partir des 1
9-22ème jours après conception pour atteindre des
concentrations de 3 à 6 ng/ml aux alentours des
33-37ème jours de gestation. Par contre, lors des
avortements, la concentration de ces protéines chutent brutalement
[PERENYI et al., 2002, AYAD et al., 2006].
De même, une étude réalisée par
MOUICHE (2007a) montre que l'augmentation de la concentration de PAGs
chez les vaches gestantes et avortées de J0 (0,44 #177; 0,57 et 1,36
#177; 2,84 ng/ml) à J35 (4,7#177; 6,66 et 7,33
#177;5,77ng/ml) est significative (p< 0,05).
D'un point de vue pratique, cela signifie que cette
protéine est détectable dans la circulation
périphérique maternelle chez 98 à 99,2 % de femelles
gravides à partir du 30ème jour après la
conception [LOPEZ GATIUS et al., 2007].
Ainsi, le dosage des PAGs chez les bovins est effectué
à partir de prélèvements sanguins réalisés
plus de 30 jours après l'insémination à condition que
l'intervalle vêlage/insémination ait été
supérieur à 70 jours. L'exactitude des résultats positifs
est de 90% et celle des résultats négatifs est de 99,5%
[PICARD-HAGEN et al., 2003b].
Selon le même auteur, en cas de mortalité
embryonnaire précoce, des concentrations de PAG seront
détectées à J30 dans moins de 3% des cas.
HUMBLOT (2003) précise aussi que cette
protéine est habituellement non détectable lorsqu'elle est
quantifiée entre J24 et J30 en cas de
MEP. En revanche, en cas de mortalité embryonnaire tardive, des
concentrations de PAG inferieures à celles des animaux gestants peuvent
être détectées 30 jours après l'insémination
chez 20 à 30 % des femelles gestantes.
La figure 19 et 20 montrent les profils des concentrations
plasmatiques en PSPB pour une vache gestante et une vache ayant subi de la MEP
et MET.
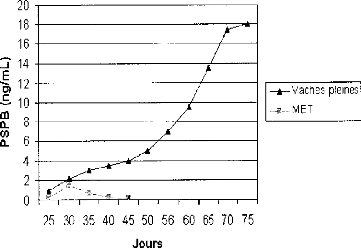
Figure 19: Profils des concentrations en PSPB
lors de gestation normale et de
mortalité embryonnaire tardive.
[Source: HUMBLOT, 2001]
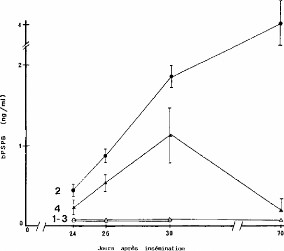
Figure 20: Concentration plasmatique de la PSPB
chez des femelles(1) ayant présenté une MEP ou
une NF; (2) gestantes et une MET sans(3) ou
avec sécrétion de
PSPB(4).[Source: HUMBLOT,
2001].
I.1.3. Utilisation conjointe des dosages de
progestérone et PAGs
Cette combinaison permet de différencier les cas de MEP
et MET. Il n'est cependant pas possible de faire la distinction entre non
fécondation (NF) et MEP, car, dans les deux cas, la concentration de
progestérone (P4) à J21-24 est faible et le constat de
gestation à J30-35 est négatif [PONSART et
al., 2003].
En pratique, des concentrations de progestérone
élevées 21-24 jours après insémination
associées à des concentrations en PAG faibles à 30 jours
déterminent une interruption de gestation en période
embryonnaire. Cependant, différentes configurations existent et sont
rapportées dans le tableau VIII.
Tableau VIII: Correspondance entre
différentes situations après IA et les résultats des
dosages de progestérone et PAGs
|
Progestérone à
J0
|
Progestérone à
J21-24
|
PSPB
à J35-35
|
Gestation à J60
|
Diagnostic
|
|
élevée
|
Élevée
|
non détectée
|
non détectée
|
Vache
inséminée à
un mauvais
moment
|
|
Faible
|
faible
|
non détectée
|
non détectée
|
MEP ou NF
|
|
Faible
|
Élevée
|
non détectée
|
non détectée
|
MET Avortement
|
|
Faible
|
Élevée
|
détectée
|
non détectée
|
MET Avortement
|
|
Faible
|
Élevée
|
détectée
|
Détectée
|
Gestation
|
[Source: GARES, 2003]
Il ressort de ce tableau que les vaches sont dites gestantes
lorsque la concentration en P4 est <3,5ng/ml à J0 et >5ng/ml entre
J21-J24, PAGs détectée à J35, puis
la palpation transrectale positive par la suite.
La mortalité embryonnaire précoce sera
invoquée lorsque: P4<5ng/ml entre J21-J24, puis ultérieurement
non gestante (retour en chaleur ou palpation transrectale).
La MET sera invoquée lorsque P4<3ng/ml à J0,
P4>5ng/ml entre J21 et J24 mais
déclarée non gestante après dosage de PAGs ou palpation
transrectale [PINTO et al.,
2000].
Compte tenu du fait que chez la vache gestante, la
concentration en progestérone et PAGs sont élevées pendant
toute la durée de la gestation; la détermination des avortements
cliniques peuvent s'effectuer par leurs dosages dans le sang car ces
avortements sont suivis d'une chute de concentration de ces hormones dans le
sang [GAYRARD, 2007].
Très récemment, une étude faite par
MUMPOREZE (2007) montre que sur les 35 vaches
diagnostiquées gestantes à J35 post IA, 8 ont
été diagnostiquées négatives aux dosages (P4 et
PAG) et à la palpation au 60ème jour post IA. Elles
représentent 22,85% et correspondent aux avortements; cela montre que
l'inséminateur avait réussi sa prestation à plus de 52,94%
(Figure 21 et 22).
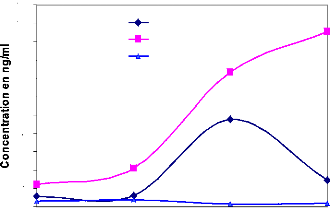
11
10
9
8
Avortées Gestantes Négatives
7
6
5
4
3
2
1
0
PAG J0 PAG J21 PAG J35 PAG J60
Jour de Prélèvements
Figure 21: Concentrations moyennes de
progestérone durant les prélèvements.
[Source: MUMPOREZE, 2007]
8
6
7
Avortées Gestantes Négatives
5
4
3
2
1
0
P4 J0 P4 J21 P4 J35 P4J60
Jour de prélèvements
Figure 22: Concentrations moyennes de PAGs
durant les prélèvements
[Source:
MUMPOREZE, 2007].
I.1.4. Early pregnancy factor
De nature glycoprotéique, l'Early Pregnancy Factor
(EPF) encore appelé Early Conception Factor apparaît quelques
heures après la fécondation dans le sang de la plupart des
espèces animales dont la vache [NANCARROW et
al.,1981], la truie [MORTON et al.,
1983], et la brebis [CLARKE et al., 1980]Ce
facteur existe en fait sous deux formes: l'une sécrétée
par l'ovaire ipsilatéral à la corne gestante (EPF-B)
[NANCARROW et al.,1981] et l'autre
synthétisée par l'oviducte (EPF-A) [MORTON et
al., 1980].
La détermination de sa concentration constituerait un
bon moyen d'identification des avortements si ce n'était le manque de
reproductibilité de son évaluation plasmatique, imputable au fait
qu'elle est influencée par de nombreux facteurs biologiques. Le dosage
de l'EPF permettrait d'identifier les vaches non-gestantes entre le
6ème et le 20ème jour suivant
l'insémination à partir d'un prélèvement de lait et
entre le 6ème jour et le 90ème jour suivant
l'insémination à partir d'un prélèvement de sang
[MORTON et al., 1984, OROZCO et al.,
1986].
I.1.5. OEstrogènes
Le placenta est une source importante d'oestrogènes.
Chez les ruminants, leur synthèse est faible au cours de la
première moitié de la gestation. Ils sont détectables
dès le 30ème jour de gestation dans le liquide
amniotique et le 50ème jour dans le liquide
allantoïdien. Le dosage des oestrogènes dans le lait est possible
à partir du 11 0ème jour de gestation. Sa
concentration constituerait un bon moyen de diagnostic de gestation et
d'interruption de gestation chez les ruminants [POLL,
2007].
I.2. Moyens paracliniques
I.2.1. Diagnostic échographique (Tableau
IX)
I.2.1.1. Diagnostic de gestation
En fonction du matériel utilisé et des
fréquences d'ultrasons, la date à laquelle un diagnostic de
gestation positif peut être affirmé varie. Avant 25 jours, le
diamètre transversal de l'allantochorion et de la vésicule
amniotique sont trop réduits pour que la vésicule embryonnaire
remplie de liquide soit visible. Le diagnostic peut être aisément
réalisé à partir du 28ème jour.
L'embryon apparaît alors sous la forme d'une petite tâche claire
dans une poche liquidienne. Les battements cardiaques sont visibles dès
J26-29 A ce stade, un diagnostic positif peut être pris en
compte. En revanche, si le résultat est douteux, un nouveau
contrôle échographique doit être réalisé une
semaine plus tard.
I.2.1.2. Diagnostic de mortalité
embryonnaire
A l'examen échographique, la mortalité
embryonnaire peut être mise en évidence avec certitude à
partir de 28-30 jours, date à laquelle l'embryon devient normalement
visible. Le diagnostic repose sur la mise en évidence de la
vésicule embryonnaire ou de l'embryon à un stade donné
lors d'un premier contrôle échographique et par la suite sur
l'absence de gestation lors d'un second contrôle.
Une étude faite par HANZEN et LAURENT
(1991), sur l'évaluation de l'incidence de la mortalité
embryonnaire dans l'espèce bovine, a montré que
l'échographie permet d'objectiver la prévalence de la
mortalité embryonnaire tardive en élevage bovin et, lors
d'examens répétés, d'en étudier la
pathogénie.
Plusieurs signes échographiques peuvent faire suspecter
une mortalité embryonnaire (Figure 23), notamment:
s" le diamètre maximal des zones anéchogènes
est inférieur à celui attendu pour le stade de gestation
supposé;
s" l'embryon est en pleine dégénérescence
(image moins échogènes qu'habituellement) voire introuvable ou
semblant désorganisé;
s" l'absence de battements cardiaques constitue le signe le
plus évident d'une mortalité embryonnaire. Celle-ci est
habituellement précédée d'une diminution de battements
cardiaques (200 à 150-100 battements par minute);
s" éventuellement, des débris plus
échogènes sont observés en suspension dans les
liquides.
Ainsi, pour permettre un diagnostic de mortalité
embryonnaire cette technique nécessite des examens échographiques
répétés pour surveiller le développement et la
viabilité de l'embryon.
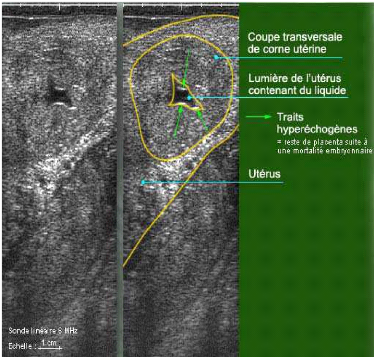
Figure 23: Mortalité embryonnaire 45
jours post insémination artificielle. [Source:
HANZEN et LAURENT, 1991]
I.2.2. Effet Doppler
C'est une méthode assez sûre pour poser un
diagnostic de gestation ou des avortements à partir du
4ème mois de gestation après l'insémination.
Elle est considérée comme une méthode assez chère
ne pouvant pas être à la portée de tous les éleveurs
africains. Cependant, l'effet Doppler permet de percevoir les battements
cardiaques du foetus. Pour cela l'absence de battements cardiaques constitue le
signe le plus caractéristique d'un avortement. Ainsi, l'étude
réalisée par HANZEN et al.
(1999a) relate une diminution des battements cardiaques de 200
à 150-1 00 battements par minute quelques jours avant la mort de
l'embryon.
I.3. Moyens cliniques
I.3.1. Palpation transrectale (Tableau IX)
Le diagnostic de gestation est fondé sur
l'identification d'une distension de la corne par les liquides, sur les
glissements des membranes annexielles ou sur la palpation de la vésicule
amniotique. L'accroissement précoce de la taille de l'utérus et
surtout de la corne gravide le rendant alors asymétrique est surtout
perceptible chez les primipares. L'asymétrie peut être nulle ou
négligeable les deux premiers mois de gestation chez les multipares. Une
modification de consistance des cornes est le premier signe de gestation
perceptible.
Néanmoins, une corne vide est de consistance charnue
alors qu'une corne gravide présente à partir du
35ème - 45ème jour une consistance
fluctuante due à l'accumulation de liquides dans la lumière
utérine.
I.3.2. Surveillance des chaleurs
Au niveau du troupeau, le critère global analysé
est le retour en chaleurs régulier ou irrégulier. En effet,
suivant le moment où la vache revient en chaleurs par rapport au jour de
l'insémination, il sera possible d'avoir déjà une
présomption d'un type de mortalité embryonnaire plutôt que
l'autre.
En cas de mortalité embryonnaire précoce, la
durée de cycle sexuel n'est pas modifiée. Si un retour en
chaleurs a lieu, il se fait alors entre le 1 8ème et le
24ème jour après la mise à la reproduction.
Cependant, cela ne permet pas de dire s'il ya eu non fécondation ou
mortalité embryonnaire précoce. Au contraire, lors de
mortalité embryonnaire tardive, l'embryon a eu le temps d'émettre
un signal anti-lutéolytique.
Ainsi, la lutéolyse et l'ovulation suivante se produisent
plus tard qu'au cours d'un cycle normal.
Généralement les retours en chaleurs s'observent
alors entre le 25ème et 35ème jour suivant
l'insémination. Dans ce cas une forte présomption de
mortalité embryonnaire tardive existe, si toute fois la vache mise
à la reproduction était bien en oestrus au moment de
l'insémination et la détection des chaleurs efficace. Cependant,
en raison des difficultés dans la détection des chaleurs, les
deux types de mortalité peuvent être facilement confondus si l'on
se base uniquement sur l'observation des retours en chaleurs.
Selon AYALON (1978), l'allongement des
intervalles entre l'insémination et le retour en chaleur ne doit en
aucun cas être retenu comme la principale preuve de l'existence de
mortalité embryonnaire. Ce même auteur précise que la
spécificité de détection des retours en chaleurs est
élevée en moyenne dans les élevages (90 à 95 %)
mais de grands écarts existent d'une exploitation à l'autre, par
contre la sensibilité de détection des retours est en revanche
très faible (50% en moyenne).
Tableau IX: Fréquence de la
mortalité embryonnaire tardive déterminée par
échographie et par palpation manuelle.
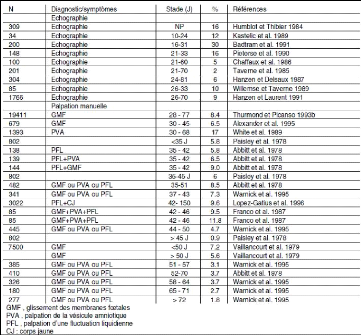
[Source: HANZEN, 2008b]
|
CHAPITRE II: STRATEGIES DE LUTTE CONTRE LES
AVORTEMENTS
|
Les faibles taux de gestation et les taux de d'avortements
plus élevés peuvent entraîner des pertes importantes pour
les éleveurs. L'investigation de ce problème est difficile car sa
cause sous-jacente apparaît souvent quelque temps avant qu'il ne soit
reconnu et il existe en général très peu de renseignements
diagnostiques. Très souvent, des vaches non gestantes et des taureaux
suspects sont vendus avant que l'on réalise l'ampleur du problème
ou que des échantillons de laboratoire soient prélevés.
Dans d'autres cas, les renseignements peu nombreux sur le troupeau peuvent
limiter le succès de l'investigation [GDS, 2008].
Malgré ces frustrations, les mesures de lutte contre les avortements
doivent essentiellement passer par la maîtrise de tous les facteurs
abortifs. Ces mesures sont principalement de nature offensive, mais aussi
défensive.
II.1. Mesures de lutte offensive
II.1.1. Mesures thérapeutiques
Différentes stratégies thérapeutiques ont
été développées pour parer à une
éventuelle perturbation de différentes étapes du
développement embryonnaire et foetale. Cependant, elles sont peu
nombreuses et encore peu utilisées sur le terrain. Ces stratégies
sont de nature hormonale, nutritionnelle ou zootechnique.
II.1.1.1. Hormone
II.1.1.1.1. Augmentation de concentrations en
progestérone + Mise en place d'un corps jaune
secondaire grâce à l'hCG
L'augmentation de la concentration en progestérone par
injections d'hCG (human Chorionic Gonadotropin) a été
démontrée par différents auteurs. Ainsi, SANTOS et
al.(2001) montrent que l'injection de 3300
UI d'hCG à des vaches le 5ème jour post IA augmente le
nombre de corps jaunes et les concentrations plasmatiques en
progestérone.
Ce traitement permet d'améliorer le taux de conception
en diminuant la mortalité embryonnaire précoce. De même,
PICARD-HAGEN et al. (2003b) ont montré que
l'injection d'hCG à J6 donnant lieu à la formation d'un corps
jaune, permet l'augmentation du taux de gestation des vaches traitées
(67,5%) par rapport à celui
des vaches témoins (45,0%) ainsi que celui des vaches
ayant reçu l'injection à J1 (42,5%).
+ Supplémentation en
progestérone
MANN et LAMMING (2000) ont montré
qu'une supplémentation en progestérone permet d'augmenter le taux
de conception lorsqu'elle est effectuée avant le 6ème
jour post IA chez la vache. Cela est d'autant plus évident lorsque l'on
réalise cette supplémentation sur des vaches à faible taux
de fertilité c'est-à-dire dont le taux de conception est
inferieure à 50%. D'autres auteurs ont montré
que la supplémentation en progestérone pendant les 4 premiers
jours suivant l'insémination augmente le développement
morphologique et l'activité de synthèse des conceptus
âgés de 14 jours [GARRET et al., 1998].
Ils concluent que la supplémentation en progestérone est efficace
uniquement sur des vaches dont les concentrations en progestérone se
situent entre 1 et 2ng/ml à J5 après insémination et
semble donc être une stratégie efficace pour limiter les
mortalités embryonnaires.
II.1.1.1.2. Renforcement du signal
embryonnaire
Des espoirs thérapeutiques sont fondés sur
l'utilisation de l'INFô pour diminuer la mortalité embryonnaire
observée lors de retard dans le développement du conceptus.
L'administration d'INFô par voie intra-utérine permet de maintenir
la sécrétion lutéale de progestérone pendant 8
à 10 jours supplémentaires chez des vaches. PICARD-HAGEN
et al. (2003b) relatent que les expérimentations
conduites sur des souris mais pas reproduites chez les bovins ont montré
que l'administration de l'INFô au moment de l'implantation diminue la
mortalité embryonnaire.
II.1.1.1.3. Inhibition de la synthèse de
PGF2á
PICARD-HAGEN et al. (2003b) ont
montré que les anti-inflammatoires non stéroïdiens tels que
la flunixine inhibent la formation de la cyclo-oxygénase 2 intervenant
dans la cascade de fabrication de la PGF2á, ce qui permettrait de
diminuer la mortalité embryonnaire.
II.1.1.1.4. Somatotropine bovine (bST)
Un traitement à base de bST améliore le taux de
fertilisation et entraîne une augmentation des concentrations circulantes
de l'hormone de croissance. Cela accélère le développement
embryonnaire jusqu'à J8 après la fécondation et augmente
ainsi le nombre de cellules par embryon. Il en résulte des embryons
mieux développés qui sont davantage capables de
sécréter l'INFô [MOREIRA et al., 2002].
D'après SANTOS et
al. (2001), l'amélioration du
taux de conception grâce à la bST est le résultat d'une
diminution de la mortalité embryonnaire chez les vaches traitées
entre J31 et J45 (8,4% lors de traitement avec
bST contre 14,1 % sans traitement, P = 0,06).
II.1.1.2. Alimentation
Différents paramètres alimentaires sont à
contrôler lors des avortements pour éviter l'apparition de
nouveaux cas au sein du troupeau (Tableau XI).
II.1.1.2.1. Contrôle de l'apport
énergétique
Le contrôle du bilan énergétique par
l'appréciation de l'équilibre de la ration est utile, mais ne
saurait suffire en fin de gestation, en raison des fortes variations de
consommation entre individus, de l'influence des modes de distribution des
fourrages, mais aussi des modalités de transition alimentaire. Ces
différents éléments devront donc être
appréciés. Ce contrôle passe par l'appréciation de
concentration de la glycémie chez la vache gestante. Il convient alors
de complémenter la ration des vaches gestantes par les
éléments énergétiques pour accroître le taux
de conception [VAITCHAFA, 1996].
II.1.1.2.2. Contrôle de l'apport
azoté
En ce qui concerne les excès azotés, l'analyse
des risques porte sur une étude critique des apports alimentaires et sur
les critères biochimiques, qui permettent de préciser le statut
nutritionnel des animaux. En cas de suspicion, il faudra donc réaliser
un contrôle biochimique des excès azotés en mesurant la
teneur en urée du sang ou de celle du lait en élevage laitier.
Des teneurs comprises entre 0, 25 et 0,32g/L de lait, entre
1,61 et 6,51g/L du sang sont normales. Toute teneur élevée en
urée sanguine, dans un contexte de fréquence élevée
d'avortement, doit être considérée comme un facteur de
risque potentiel. Il convient donc de réajuster la ration pour
prévenir de nouveaux cas d'avortement [ENJALBERT,
2003].
II.1.1.2.3. Contrôle des apports
minéralo-vitaminiques
L'analyse des risques lors de déséquilibre
minéral et vitaminique porte sur une étude critique des apports
alimentaires et sur les critères biochimiques, qui permettent de
préciser le statut nutritionnel des animaux. En cas de suspicion, une
analyse critique des apports peut être réalisée en
comparant les apports des aliments minéraux et vitaminés
administrés avec les recommandations courantes.
Il faudra toutefois tenir compte d'une marge de
sécurité dans l'évaluation du fait de la
méconnaissance des apports réalisée par les fourrages et
concentrés. De même, un dosage sanguin des
oligo-éléments (cuivre, zinc, iode, etc....) peut être
réalisé.
Cette démarche permet d'obtenir un bilan final qui peut
être interprété même en dehors d'une connaissance
précise des facteurs de risques de carences primaires ou
secondaires [ENJALBERT, 2003].
Dans ces conditions, les pierres à lécher et
concentrés minéraux vitaminiques sont les plus simples moyens de
satisfaire les besoins de l'alimentation minérale et vitaminique.
II.1.1.2.4. Supplémentation en acide
gras
Chez les vaches, la supplémentation d'un régime
avec des matières grasses augmente les concentrations de
progestérone [HAWKINS et al.,
1995]. De plus, ABAYASEKARA et
WATHES (1997) ont montré que la
croissance folliculaire est modifiée différemment en fonction du
type d'acide gras (AG) utilisé. Cependant, la supplémentation du
régime avec des AG des familles ù-3 (C 18:3) n'a pas permis de
modifier la croissance folliculaire ni le fonctionnement du corps jaune
(estimé par des dosages de progestérone) par rapport à une
supplémentation en AG des familles ù6 (C18:2) (Annexe 3).
Certains auteurs ont pourtant montré qu'un ajout
d'ù3 permettrait de diminuer la mortalité embryonnaire en
inhibant la production de PGF2á et donc en améliorant le
fonctionnement du corps jaune [STAPLES et
al., 1998]. Le même auteur
montre qu'une supplémentation en graisse à raison de 2-4% de la
ration influe significativement sur le statut reproducteur des
vaches.
Dans certaines études, il a été
démontré que l'ajout de l'acide á linolénique au
sein de la ration pourrait renforcer la reconnaissance maternelle de la
gestation et donc améliorer la survie embryonnaire [SANTOS et
al., 2004].
Tableau X: Paramètres alimentaires
à contrôler lors de mortalité embryonnaire.
|
Si:
|
Suspecter:
|
|
|
|
Abaissement supérieur à un point de la
NEC
après vêlage en moyenne de troupeau
|
Déficit énergétique
|
|
|
|
Mortalité embryonnaire associée à un retard
de reprise d'activité ovarienne
|
|
Urée sanguine élevée
|
Excès azotés
|
|
|
|
Urée dans le lait > 0,32g/L
|
|
Fréquence élevée de mortalités
embryonnaires
|
Carence en vitamines
oligo-éléments
|
ou
|
en
|
|
Dosage sanguin des oligo- éléments
anormal
|
|
Dosage sanguin des activités enzymatiques anormal
|
[Source: ENJALBERT, 2003]
II.1.1.2. Mesures d'assainissement du
troupeau
La transmission verticale des maladies abortives est à
l'origine de la persistance de l'infection dans le troupeau, comme
conséquence l'augmentation du taux d'avortement [HEMPHILL et
GETTSTEIN, 2000]. La mesure de lutte contre ce mode de contamination
serait la réforme de tous les animaux infectés. En pratique,
cette mesure n'est pas applicable sur les cheptels à forte
prévalence pour des raisons économiques et pratiques. Donc, il
est plus judicieux de ne pas garder les veaux congénitalement
infectés pour le renouvellement du troupeau [WOUDA,
1997].
Quant à la transmission horizontale, elle peut
être interrompue en détruisant le placenta, les liquides
amniotiques et avortons, ou en entreposant la paille ou les concentrés
destinés à l'alimentation du bétail dans des endroits
propres.
En pratique, il n'existe pas de traitement spécifique
contre les avortements. Les traitements sont spécifiques des germes
d'où la nécessité de faire un bon diagnostic
étiologique surtout de laboratoire et un antibiogramme permettant
d'assurer un traitement rapide de vache qui a avorté afin
d'éviter que les autres femelles gestantes du troupeau soient atteintes
et avortent à leur tour.
II.1.2. Mesures de lutte défensive
La prévention des avortements passe par la lutte contre
les causes infectieuses ou non infectieuses spécifiques pouvant les
provoquer. Pour mieux connaître ces causes et améliorer la lutte,
l'association Française pour l'étude de la reproduction animale
propose aux vétérinaires une fiche de commémoratifs sur
les avortements (Figure 25) .Ainsi, les mesures de lutte défensives
consistent à éviter une éventuelle contamination verticale
et/ou horizontale.
II.1.2.1. Prévention de la transmission
verticale
Pour cela, il s'agit de:
V' dépister les animaux infectés dans le
troupeau, de lier ces animaux entre eux par la généalogie afin de
distinguer les infections verticales des horizontales; Ceci permet d'identifier
plus sûrement les animaux à éliminer et ceux qu'il est
envisageable de conserver pour l'élevage;
V' faire l'hygiène de la reproduction: contrôle
de la monte publique, de l'insémination artificielle, transfert
d'embryon en utilisant les femelles séronégatives des infections
abortives;
V' s'assurer de certificat et garantie sanitaire des semences
V' lors d'avortements fréquents dans une exploitation,
il serait judicieux de soumettre un ou plusieurs avortons à un examen
direct à l'égard des agents infectieux abortifs et de tester
sérologiquement tous les bovins de l'exploitation;
Ce mode de contamination pourrait aussi être
prévenu par la vaccination des animaux avant insémination
artificielle ou saillie naturelle. A titre d'exemple, une étude
menée par MARCIAT (2008) a
montré l'importance de vacciner les animaux avant insémination
artificielle contre la BVD avec Bovilis BVD (Figure 24).
Ce vaccin a pour but de préparer l'organisme à
se défendre contre une infection ultérieure. Cette défense
sera, chez l'animal vacciné, plus efficace car plus rapide et plus
intense.
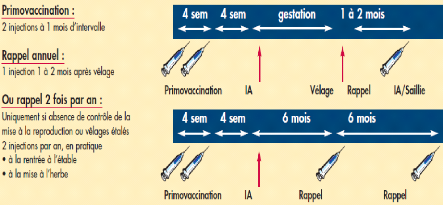
Figure 24: Protocole de vaccination de vache par
utilisation de Bovilis BVD. [Source: MARCIAT,
2008]
II.1.2.2. Prévention de contamination
horizontale
Pour une meilleure maîtrise des avortements dans
l'élevage bovin, l'application des mesures préventives de
contaminations horizontales est essentielle. Il s'agit de:
> Introduire seulement des bovins en provenance de cheptels
présentant
toutes garanties sanitaires, avec quarantaine et contrôle
individuel
(examen clinique et contrôle sérologique);
> Maintenir le cheptel à l'abri de contaminations de
voisinage (pas de contact avec les animaux d'autres troupeaux, pâturages
et points d'eau exclusifs, matériel exclusif, pas de divagation des
chiens, pas de contact avec d'autres espèces sensibles, fourrages
moisies, souillés et mal conserves, etc...) [ARQUIE,
2006];
> Désinfecter périodiquement des locaux
d'élevage et de traite;
> Contrôler régulier des cheptels afin de
dépister précocement les premiers cas d'avortement;
> Envoyer un échantillon de sang et des parties du
placenta ou à défaut du liquide utérin
(prélevé au niveau du col à l'aide d'un éco
uvillon) pour les examens bactériologiques et examens
sérologiques;
> Donner les consignes à l'éleveur pour limiter
les risques éventuels de transmission à l'Homme et aux animaux
sensibles;
> Isoler la vache et détruire efficacement l'avorton et
ses enveloppes avant que les chiens ou les oiseaux n'en aient fait leur
pitance.
> Complémenter les animaux par des concentrés ou
des blocs à lécher [ARQUIE, 2006].
Ce mode de contamination pourrait aussi être
prévenu en évitant l'accumulation de coumestrol dans les
pâtures, par le maintien de l'intégrité physique des grains
des céréales dans le but de limiter l'accès aux nutriments
qu'ils contiennent et par une maîtrise stricte des conditions
environnementales telles que l'humidité, l'oxygène et la
température. L'utilisation d'agents antifongiques (acide propionique par
exemple) peut apporter une garantie complémentaire lorsqu'un risque
prévisible existe. Une élimination des aliments ayant une trop
forte concentration en coumestrol devrait être réalisée
[GARES, 2003].

*
Figure 25: Fiche de commémoratifs des
avortements de l'association pour l'étude de la reproduction animale.
[Source: INSTITUT DE L'ELEVAGE,
2000]
Le présent travail a permis de faire une
synthèse d'une part des facteurs étiologiques des
mortalités embryonnaires et avortements cliniques, et d'autre part les
méthodes de diagnostic et moyens de lutte contre ces avortements au sein
d'une exploitation bovine. Il en ressort que les pertes attribuables aux
avortements de manière générale dans les élevages
bovins sont énormes. Ces pertes entravent considérablement le
développement de la filière bovine. Pour cela, nous formulons
quelques recommandations aux différents acteurs de la santé et
productions animales en Afrique subsaharienne pour limiter ce véritable
fléau économique dans les élevages bovins.
CHAPITRE III: RECOMMANDATIONS
III.1. Aux autorités étatiques
Nous recommanderons aux autorités étatiques:
~ De prendre des mesures qui s'imposent, surtout en ce qui
concerne les mouvements des animaux et d'essayer de mettre en place un
réseau de surveillance épidémiologique des maladies
abortives ayant une incidence économique surtout la BVD, IBR et la
néosporose;
~ D'organiser régulièrement des programmes de
dépistage des maladies à caractère abortif et sensibiliser
les éleveurs à y participer activement;
~ D'améliorer les infrastructures et les voies
d'accès aux éleveurs afin de faciliter l'accès aux
intrants alimentaires pour la complémentation des animaux.
III.2. Aux acteurs impliqués dans
l'amélioration des productions animales III.2.1. Les différents
programmes nationaux d'amélioration génétique
Nous recommanderons à ces différents programmes:
~ D'inciter les éleveurs à la
complémentation et à la stabulation des animaux;
~ D'assurer des formations techniques aux éleveurs
(gestion du troupeau, de la reproduction et de l'alimentation);
~ De sensibiliser les éleveurs à une meilleure
gestion des espaces pastoraux; ~ De dépister les maladies abortives
avant de réaliser l'IA;
~ De choisir rigoureusement les reproducteurs que ce soit pour
les mâles ou les femelles dans le but de réduire le facteur
génétique impliqué dans l'avortement.
~ De pratiquer la biotechnologie de 2ème
génération (le transfert d'embryon) car celle-ci permettrait de
contourner le problème de mortalité embryonnaire précoce
chez les races amélioratrices importées, chez qui le stress
thermique induit une mortalité très élevée.
III.2.2. Aux inséminateurs
Nous recommanderons aux inséminateurs:
~ De prendre toutes les précautions d'hygiène pour
ne pas être des acteurs de dissémination de maladies abortives;
~ De se former et s'offrir des pratiques de manière
continue en insémination artificielle;
~ De prendre de précaution lors de diagnostic de gestation
à J60;
~ De faciliter les soins et le suivi sanitaire du cheptel,
surtout en assurant un programme de déparasitage interne et externe des
animaux.
~ De sélectionner les vaches à inséminer
selon les critères fixées par les programmes d'IA.
III.2.3. Aux éleveurs
Nous recommanderons à ces derniers de:
~ S'assurer de l'état des animaux qu'ils vont
acquérir et de toujours s'inquiéter sur la cause des avortements
observés;
~ Supplémenter les animaux par l'apport de
concentrés et des aliments énergétiques surtout pendant
les périodes de faible productivité des pâturages
naturels;
~ Améliorer les conditions d'élevage surtout la
distribution des aliments et de l'eau;
~ Pratiquer l'hygiène dans les élevages pour
éviter les problèmes de reproduction liés à
l'environnement alimentaire;
~ Prendre soin de vaches ayant avorté car beaucoup de
maladies abortives surtout la brucellose est une zoonose majeure; et dans les
villages où le contact entre humains et animaux est permanent, nous
recommandons d'être prudents lors des manipulations des avortons.
~ Déclarer et appeler le vétérinaire le
plutôt possible en cas d'un avortement observé.
III.3. Aux chercheurs
Vu les recherches précédemment
réalisées, il est souhaitable de poursuivre les recherches et de
les renforcer au niveau de l'élevage. Pour cela, nous recommanderons aux
chercheurs:
~ D'évaluer l'impact hormonal sur les avortements dans
les 2 derniers
trimestres de gestation;
~ D'évaluer la toxicité de différentes
plantes rencontrées dans les zones de pâtures;
~ D'étudier l'impact économique des avortements au
sein du troupeau et à l'échelle nationale;
~ De faire une étude portant sur la relation entre les
concentrations des biomarqueurs de la gestation et les paramètres
nutritionnels pendant toute la durée de la gestation;
~ De faire une étude cytogénétique
permettant de révéler des anomalies chromosomiques à
l'origine des problèmes divers de reproduction dans le bétail.
CONCLUSION GENERALE
En Afrique tropicale, la sous alimentation est devenue un
problème majeur et de nombreux pays ont mis en place des moyens de
lutte, passant par les politiques de production animale. Ainsi,
l'élevage qui est l'un des piliers de ces politiques est
confronté à des contraintes, notamment des contraintes d'ordre
génétiques, alimentaires, sanitaires et climatiques. La
satisfaction de la demande en produits carnés et laitiers demeure ainsi
tributaire des importations. Pour pallier les dépenses énormes
liées à ces importations, nombreux pays ont adopté une
politique d'appui aux productions animales en vue d'une autosuffisance par
l'entremise d'un vaste programme d'amélioration génétique
du cheptel autochtone grâce notamment à la biotechnologie de
l'insémination artificielle.
Les résultats enregistrés par différents
programmes d'insémination artificielle montrent une faiblesse des taux
de réussite. Plusieurs contraintes sont la cause de ces
résultats. Parmi ces contraintes figure le problème de non
maîtrise des paramètres de reproduction chez la vache,
l'alimentation et surtout les avortements.
En effet, chez la vache, les avortements sont
économiquement très graves pour l'éleveur, car le foetus
c'est -à- dire le futur veau est perdu et limitent ainsi
l'élevage à sa source. Qui plus est, des affections de la
sphère génitale et une stérilité peuvent en
résulter, et cela pendant une période plus ou moins longue au
cours de laquelle la femelle improductive est une charge pour
l'éleveur [GATSINZI, 1989].
En plus de leur importance économique, les avortements
ont une importance sanitaire et hygiénique car une part importante des
avortements est due à des agents infectieux zoonotiques, et certaines
des ces zoonoses sont loin d'être bénignes d'un point de vue
médical (Brucellose, etc ).
L'objectif général de ce travail est de
synthétiser les connaissances actuelles sur les avortements au sein de
l'élevage bovin.
De façon spécifique, il s'agit de faire
l'état de lieu des facteurs étiologiques des mortalités
embryonnaires et des avortements cliniques; et enfin de dégager les
méthodes de diagnostic et les moyens de lutte contre ces avortements
dans les exploitations bovines.
Du point de vue étiologique, les causes majeures des
avortements sont nombreuses et multiples et varient en fonction de la
période ou du stade de la gestation.
Les facteurs étiologiques de mortalités
embryonnaires, certains sont parfois plus impliqués dans un type de
mortalité que dans l'autre. Ces facteurs peuvent être
regroupés dans quatre (4) grandes catégories: les facteurs
gamétiques et embryonnaires, les facteurs parentaux, facteurs
biologiques et les facteurs environnementaux.
Quant aux facteurs associés aux avortements cliniques,
ils sont nombreux et très variés. Ainsi, ces facteurs sont de
nature biologique tels les bactéries, les virus et les parasites; ou non
biologiques comme les facteurs nutritionnels, chimiques, physiques,
génétiques ou iatrogènes.
Notons que dès le premier mois de gestation, de
nombreux signaux spécifiques (PAGs, progestérone, EPF,
oestrogènes, etc....) et non spécifiques (protéines
totales, albumine, globuline, etc...) sont émis par le conceptus, mais
seuls les paramètres spécifiques de la gestation permettent de
surveiller les relations foetomaternelles ou de déterminer les
avortements pendant toute la durée de la gestation. Néanmoins,
différents auteurs montrent que la quantification des avortements au
sein des exploitations bovines relève le plus souvent de l'association
de plusieurs méthodes. Il s'agit de méthodes hormonales par des
dosages de progestérone, dosage de PAGs, dosage des oestrogènes,
dosage de l'EPF et dosage conjointe de progestérone et PAGs;
méthodes paracliniques (échographie et l'effet doppler) et enfin
les méthodes cliniques passant par la palpation transrectale et la
notation du retour en chaleur de l'animal.
Enfin, les avortements représentent une forte
composante de l'infertilité dans l'espèce bovine et ses impacts
économiques sont importants. Cependant, plusieurs stratégies de
lutte ont été proposées pour limiter ce fléau de
l'élevage bovin. Il s'agit d'une part de mesures offensives
principalement les mesures thérapeutiques (hormonales et alimentaires)
et les mesures d'assainissement du troupeau; et d'autre part de mesures
défensives qui consistent à éviter une éventuelle
contamination verticale ou horizontale
Ainsi, devant l'impérieuse nécessité de
gérer le potentiel reproducteur de la population animale et
d'accroître sa productivité par tous les moyens dont l'IA, il y a
lieu de revoir des stratégies de diagnostic et de lutte contre les
facteurs associés aux avortements dans l'espèce bovine. Ces
avortements méritent par conséquent une attention
particulière que ce soit au niveau des responsables chargés
d'élaborer les politiques de développement de l'élevage et
des organismes de recherche qui s'intéressent aux problèmes de
reproduction du bétail qu'au niveau des éleveurs dans la gestion
de leurs troupeaux pour mieux lutter contre ce fléau en Afrique
subsaharienne, car aucun programme d'IA malgré ses bonnes ambitions, ne
peut parvenir à ses fins avec le taux d'avortement élevé
en élevage bovin.
REFERENCES BIBLIOGRAPHIQUES
1. ABAYASEKARA D.R.E. et WATHES D.C.,
1999. Prostaglandins, Leukotrienes and Essential Fatty Acids,
61: 275-281.
2. AKAKPO A. J., TEOU K. L., KPONMASSI T. et ZELLER I.,
1994.
Epidémiologie des affections abortives des ruminants
au Togo : enquête sérologique sur la brucellose, la Chlamydiose,
la fièvre Q et la fièvre de la Vallée du Rift (125-137).
In Biotechnologies du diagnostic et de la prévention des maladies
animales.- Paris: Ed. AUPELF-UREF; John Libbey Eurotext.
3. AIRAULT P., 2000.
Productions laitières.
Afrique Agriculture (286): 208 - 31;
49 - 53.
4. AL KATANANI Y.M., PAULA- LOPEZ F.F. et HANSEN P. J.,
2002. Effect of season and exposure to heat stress on oocyte
competence in Holstein cows.
J. Dairy Sci., 85: 390-396.
5. ANONYME, 2004.
Listeriosis associated with silage feeding in sheep.
Vet.Rec., 154: 285-288.
6. ARCANGIOLI M. A. et MAILLARD R., 2006.
Clinique, Epidémiologie, Gestion sanitaire. Unité de Pathologie
du Bétail - ENVL, GDS: 69.
7. ARIMA Y. et BREMEL R.D., 1983.
Purification and characterization of bovine placental lactogen.
Endocrinology, 113: 2186-2194.
8. ARQUIE M., 2006.
Investigation des causes abortives dans trois élevages
ovins laitiers du bassin de Roquefort.
Thèse: Méd. Vét. Toulouse; 3.
9. ARTHUR G.H., NOAKES D.E., PEARSON H. et PARKINSON
T.J., 1996. Infectious forms of infertility in cattle
: Bacterial and protozoal agents (396-422). In: Noakes DE: Veterinary
reproduction and obstetrics. - London WB Saunders.
10. AVERY B., MADISON V. et GREVE T., 1991.
Sex and development in bovine in-vitro fertilized embryos.
Theriogenology, 35: 953-963.
11. AYAD A., SOUSA N.M., HORNICK J. L., TOUATI K.,
IGUER-OUADA M. et BECKERS J.F., 2006.
Endocrinologie de la gestation chez la vache : signaux
embryonnaires, hormones et protéines placentaires.
Ann. Méd. Vét., 150: 21
2-226.
12. AYAD A., SOUSA N.M., SULON J., HORNICK J. L., WATTS
J., LOPEZGATIUS F., IGUEROUADA M. et BECKERS J.F., 2007.
Influence of progesterone concentrations on trophoblast and
pituitary secretory functions during the first trimester of pregnancy in dairy
cattle.
Theriogenology, 67: 1503-1511.
13. AYALON N., 1978.
A review of embryonic mortality in cattle. Reprod. Fertil.
54: 483-493.
14. BADAI E., 2008.
Etude rétrospective (1980-1990) des
caractéristiques zootechniques des vaches en stabulation au centre de
recherches zootechniques de wakwa -Cameroun.
Thèse: Méd. Vét.: Dakar; 30.
15. BALL P. J. H., 1978.
The relationship of age and stage of gestation to the incidence
of embryo death in dairy cattle. Rev. Vet. Sci., 25:
120-122.
16. BANE D.P., JAMLES J. E., GRZADIL C. M. et MOLITOR
T.W., 1990. In vitro exposure of preimplantation porcine embryos to
porcine parvovirus. Theriogenology, 33: 553-561.
17. BARKER A. R., SCHRICK F. N., LEWIS M. J., DOWLEN H.
H. et OLIVER S.P., 1998.
Influence of clinical rnastitis during early lactation on
reproductive performance of jersey cows.
J. Dairy Sci., 81: 1285-1290.
18. BARTLETT P. C., KIRK J. H., WILKE M. A., KANEENE J.
B. et MATHER E.C., 1986.
Metritis complex in Michigan Holstein-Friesian cattle.
Incidence, descriptive epidemiology and estimated economic impact.
Prev.Vet.Med., 4: 235-248.
19. BAZER F. W., 1989.
Establishment of pregnancy in sheep and pigs.
Reprod.Fert.Dev.,1: 237-242.
20. BECKERS J. F., DE COSTER R., WOUTERS-BALLMAN P.,
FROMONTLIENARD C., VAN ZWALMEN P. et ECTORS F., 1982.
Dosage radioimmunologique de l'hormone placentaire somatotrope
et mammotrope bovine. Ann. Méd. Vét.,
126: 9-21.
21. BECKERS J.F., 1983.
L'hormone placentaire somato-mamotrope bovine.
(Thèse d'agrégation universitaire).
Université de l'État de Liège : Bruxelles, 207p.
22. BERG U., REICHENBACH H.D., LIEBRICH J. et BREM
G., 1992. Sex ratio of calves born after transfer of
in vitro produced embryos. Theriogenology, 37:191.
23. BERNARD E., 2002.
Diagnostic et suivi de gestation chez la chienne:
élaboration d'un document pédagogique.
Thèse: Méd. Vét.; Lyon: 37.
24. BERNARD G. et BOURDIN P., 1971.
Etat immunitaire actuel, naturel ou acquis du cheptel
sénégalais vis-à-vis de la peste bovine, de la maladie des
muqueuses, de la Rhinotrachéite infectieuse et de la maladie
respiratoire & virus parainfluenza III.
Rev. Elev. Méd. vét. Pays trop.,
24 : 183-189.
25. BERTRAND B., 2006.
Bilan et analyse de l'utilisation de l'insémination
artificielle dans les programmes d'amélioration génétique
des races laitières en Afrique soudano-sahélienne.
Thèse: Méd. Vét.: Lyon; 04.
26. BETTERIDGE K. J. et FLECHON J. E., 1988.
The anatomy and physiology of pre-attachment bovine embryos.
Theriogenology, 29: 155-1 87.
27. BIELANSKI A. et DUBUC C., 1993.
In vitro fertilization of bovine oocytes exposed to bovine
herpesvirus 1 (BHV-1). Reprod.Dom.Anim., 28:
285-288.
28. BIELANSKI A. et DUBUC C., 1994.
In vitro fertilization of ova from cows experimentally infected
with a non-cytopathoc strain of bovine viral diarrhea virus.
Anim.Reprod.Sci., 38: 215-221.
29. BIELANSKI A. et SURUJBALLI O., 1996.
Association of Leptospira borgpetersinii serovar hardjo type
hardjo bovis with embryos produced by in vitro fertilization.
Theriogenology, 46: 45-55.
30. BOOTH P. J., STEVENS D. A., COLLINS M. E. et
BROWNLIE J., 1992. Detection of bovine viral diarrhea virus in ovarian
and oviductal tissue. J.Reprod.Fert, Abstract series
(9): 28.
31. BORNAREL P. et AKAKPO A. J., 1982.
Brucelloses animales: Sondages sérologiques dans quatre
pays de l'Afrique de l'ouest (Benin, Cameroun, Haute Volta et Niger).
Méd. Afrique Noire: 829-836.
32. BREUKELMAN S.P., SZENCI O., BECKERS J.F., KINDAHL
H., MULDER E.J., JONKER F.H., VAN DER WEIJDEN B., REVY D., POGANY K., SULON J.,
NEMEDI I. et TA VERNE M.A., 2005.
Ultrasonographic appearance of the conceptus fetal heart rate
and profiles of pregnancy-associated glycoproteins (PAG) and prostaglandin
F2alpha-metabolite (PGF2alpha-metabolite) after induction of fetal death with
aglepristone during early gestation in cattle.
Theriogenology, 64: 917-933.
33. BRITTON A.P., MILLER R.B., RUHNKE H.L. et JOHNSON
W.M., 1988. The recovery of ureaplasmas from bovine embryos following
in vitro exposure and ten washes.
Theriogenology, 30: 997-1003.
34. BROCHART M., 1975.
Conséquence pathologiques des interactions
minéraux-vitamines sur la reproduction. In «Les minéraux et
les vitamines, Tome 2».
Ed.du Point Vétérinaire Maisons Alfort p.76.
35. BUTTLE H. L. et FORSYTH I.A., 1976.
Placental lactogen in cow. J. Endocrinol., 68:
141-146.
36. BYRNE W.J., BRENNAN P., MC CORMACK R. et BALL H.J.,
1999. Isolation of Mycoplasma bovis from the abomasal
contents of an aborted bovine fetus. Vet. Rec., 144
(8): 211-212.
37. CHAFFAUX S., LAKHDISSI H. et THIBIER M.,
1991.
Etude épidémiologique et clinique des
endométrites postpuerpérales chez les vaches laitières.
Rec.Méd.Vét; 167: 349-358.
38. CHAMBRON J., 1965.
La brucellose bovine au Sénégal.
Rev. Elev. Méd. Vét. Pays trop;
18: 19-38.
39. CHAVATTE-PALMER P., DE SOUSA N., LAIGRE P., CAMOUS
S., PONTER A.A., BECKERS J.F. et HEYMAN Y., 2006.
Ultrasound fetal measurements and pregnancy associated
glycoprotein secretion in early pregnancy in cattle recipients carrying somatic
clones.
Theriogenology, 66: 829-840.
40. CHEBEL R.C., SANTOS J.E.P., REYNOLDS J.P., CERRI
RL.A., JUCHEM S.O. et OVERTON M., 2004.
Factors affecting cunception rate after artificial Insemination
and pregnancy loss in lactating dairy cows.
Anim. Reprod. Sci., 84: 239-255.
41. CHEMLI J.; TAINTURIER D.; BECKERS J. F.; HAMDI L.,
1996.
Diagnostic de gestation chez les bovins par dosage d'une
protéine trophoblastique : la protéine bovine associée
à la gestation (BPAG. : bovine pregnancy associated protein) (179-192p).
In: Reproduction et 78 production laitière.-Tunis : SERVICED. -
294p.-(Actualité Scientifique AUPELF-URE F).
42. CHICOTEAU P., 1999.
La reproduction des bovins tropicaux.
Rec.Méd.Vét., 167(3/4): 241-247.
43. CLARKE F.M., MORTON H., ROLFE B.E. et GIDLEY-BAIRD
A.A., 1980. Partial characterization of early
pregnancy factor in the sheep.
J. Reprod. Immunol; 2: 97-101.
44. COHEN R.O., BERNSTEIN M. et ZIV G.,
1995.
Isolation and antimicrobial susceptibility of Actinomyces
pyogenes recovered from the uterus of dairy cows with retained membranes and
post parturient endometritis. Theriogenology,
43:1389-1397.
45. COLEMAN D.A., DAILEY R.E., LEFFEL R.E. et BAKER
R.D., 1987. Estrous synchronization and establishement of pregnancy in
bovine embryo transfer reci pients.
J. Dairy Sci., 70: 858-866.
46. COOK B. et HUNTER R.H.F.,1978.
Systemic and local hormonal requirements for implantation in
domestic animals. J.Reprod.Fert; 54: 471-482.
47. DARWASH K.O. et LAMMING G.E., 1998.
The importance of milk progesterone concentrations during early
pregnancy in the cow.
J. Anim. Breed, 2: 41-43.
48. DAY J.D., WEAVER L.D. et FRANTI C.E.,
1995.
Twin pregnancy diagnosis in Holstein cows discriminatory powers
and accuracy of diagnosis by transrectal palpation and outcome of twin
pregnancies.
Can.Vet. J., 36: 93-97
49. DEJARNETTE J.M., SAACKE R.G., BAME J. et VOLGER
C.J., 1992. Accessory sperm, Their importance to fertility and embryo
quality, and attempts to alter their numbers in artificially inseminated
cattle.
J. Anim. Sci., 70: 484-491.
50. DELAFOSSE F., GOUTARD E. et THEBAUD,
2002.
Epidémiologie de la tuberculose et de la brucellose des
bovins en zone périurbaine d'Abéché- Tchad. Revue
Élev. Méd. vét. Pays trop.55 (1):
5-13.
51. DELAHAUT PH., SULON J., ECTORS E. et BECKERS J.F.,
1999. Le diagnostic au service de la reproduction: Fertilité -
Gestation - Anoestrus. Cahiers Agricultures, 6 (2) :
137-148.
52. DERIVAUX J. et ECTORS F., 1980.
Physiologie de la gestation et obstétrique
vétérinaire.- Maisons Alfort: Editions du Point
Vétérinaire.-273p.
53. DERIVAUX J. et ECTORS F., 1986.
Reproduction chez les animaux domestiques. Louvain-la-neuve: cobaye. -1141
p.
54. DESILETS A., 2003.

La diarrhée virale bovine /Maladie des muqueuses
(BVD-MD) : quelques réponses à vos questions (147). In
International Symposium Bovine Viral Diarrhea Virus. A 50 Year Review.
55. DIOUF M. N., 1991.
Endocrinologie sexuelle chez la femelle N'Dama au
Sénégal. Thèse : Méd. Vét. : Dakar ; 31.
56. DIOUF O., 1995.
Autosuffisance du Sénégal en protéine
animale. Stratégie mises en oeuvre, proposition pour une
amélioration de la couverture des bovins.
Thèse : Méd. Vét. : Dakar ; 3.
57. DISENHAUS C., GRIMARD B., TROU G. et DELABY L.,
2005.
De la vache au système : s'adapter aux différents
objectifs de reproduction en élevage laitier? Renc.
Rech.Ruminants, 12: 125-135.
58. DIZIER M.S., 2008.
Baisse de fertilité des bovins laitiers :
mécanisme biologiques impliqués. [En ligne] Accès
internet:
www.inst-elevage.asso.fr/html1/IMG/pdf1-MSDBiologie.pdf
(Page consultée le 03/03/2009).
59. DJABAKOU K., 1985.
Les avortements provoqués par Trypanosome con
golense chez les vaches Ndama et
baoulé. Trypano.
et Prod.An. Lome: 1- 4.
60. DOUART A. et SIMON A., 1997. BVD :
Diagnostic et contrôle de l'infection. Point Vét.
28:1985-1993.
61. DOUTRE M. P., FENSTERBANK R. et SAGNA F.,
1977.
Étude de la brucellose bovine dans un village de
Basse-Casamance (Sénégal). Diagnostic sérologique et
bactériologique.
Revue Élev. Méd. vét. Pays trop.
30:345-351.
62. DRAME D. 1996.
Etat corporel de la vache laitière : Etude descriptive au
cours du poste partum; Mémoire DEA: Sciences vétérinaires
: Liège (Fac. Méd. Vét.). (page10)
63. DUCOS A., 2003.
Les causes génétiques des mortalités
embryonnaires. Bulletin des GTV, 21: 48-52.
64. EALY A.D., DROST M. et HANSEN P.J.,
1993.
Developmental changes in cmbryonic resistance to adverse effects
of maternaI heat stress in cows.
Dairy Sci., 76: 2899-2905.
65. EL AMIRI B., REMY B., SOUSA N.M., et BECKERS J.F.,
2004.
Isolation and characterization of eight pregnancy-associated
glycoproteins present at high levels in the ovine placenta between day 60 and
day 100 of gestation.
Reprod. Nutr. Dev., 44:169-181.
66. ENJALBERT F., 2003.
Alimentation et reproduction chez la vache laitière.[En
ligne]Accès internet
www.luzernes.org/docs/Fertilit%E9%20ENJALBERT.doc
(Page consultée le 25/02/2009).
67. ENJALBERT F., 2005.
Carences en oligo-éléments ou en vitamines. Point
Vét., 36 (N° Spécial): 106-110.
68. ENNUYER M. et REMMY D., 2008.
Troubles de la reproduction des bovins. Avortements et
infécondité : pistes infectieuses et alimentaire. Point
Vét., 39(239): 73-77.
69. ERB R.E. et HOLTZ E.W., 1958.
Factors associated with estimated fertilization and service
efficiency of cows. J.Dairy Sci., 41: 1541-1 552.
70. ESPINASSE J., LE LAYEC Cl. et FAYE P.,
1978.
Hémagglutination passive, application de la
méthode au diagnostic sérologique des affections respiratoires
virales des jeunes bovins.
Rev. Méd. vét., 154:
227-232.
71. FABIE D., 1983.
Depuis la mise en oeuvre d'un plan de prophylaxie
antibrucellique, évolution dans le temps des avortements brucelliques
par rapport au pourcentage global des avortements et des avortements non
brucelliques et recherche étiologique.
Thèse: Méd.vét.Toulouse; 82.
72. FEHILLY C.B., et WILLADSEN S.M., 1986.
Embryo manipulation in farm animals.
Oxford Reviews for reproductive Biology,
8: 379-413.
73. FERRANDO R., 1972.
Alimentation et stérilité,
in«Stérilité et avortements des espèces
bovines». Inf. Tech.Serv. Vet.: 5-12.
74. FLOOD M.R., GAGE T.L. et BUNCH T.D.,
1993.
Effect of various growth-promoting factors on preimplantation
bovine embryo development in vitro. Theriogenology,
39: 823 - 833.
75. FORSYTH I.A., 1986. Variation among species
in the endocrine control of growth and function: the role of prolactin, growth
hormone and placental lactogen.
J. Dairy. Sci., 69: 886-903.
76. FRANCO O.J., DROST M., THATCHER M.J., SHILLE V.M. et
THATCHER W.W., 1987.
Fetal survival in the cow after pregnancy diagnosis by palpation
per rectum Theriogenology, 27: 631 -644.
77. FRANQUINET R., FOUCRIER J.,
2003. Embryologie descriptive. DUNOD, 2e
édition.- 157p.
78. FRAY MD., PATON DJ. et ALENIUS S., 2000.
The effects of bovine viral diarrhoea virus on cattle
reproduction in relation to disease control. Anim. Reprod. Sci.,
60-61, 615-627.
79. FRERET S., CHARBONNIER G., CONGNARD V., JEANGUYOT
N., DUBOIS P., et LEVERT J., 2005.
Expression et détection des chaleurs, reprise de la
cyclicité et perte d'état corporel après vêlage en
élevage laitier. Renc. Rech.Ruminants, 12:
149-1 52.
80. FROMENT P., 2007.
Note d'état corporel et reproduction chez la vache
laitiere. Thèse: Méd. Vét.: Alfort; 112.
81. GAINES J.D., 1989.
Investigating the role of infectious diseases and toxins in the
subfertile dairy herd. Vet. Med.: 1195-1199.
82. GALLOIS N., 1988.
Les avortements mycosiques chez les femelles domestiques.
Thèse: Méd. Vét., Lyon; 209.
83. GANDOLFI F., 1994.
Autocrine, paracrine and environmental factors influencing
embryonic development from zygote to blastocyst. Theriogenology,
41: 95-100.
84. GARRET J.E., GEISERT R.D., ZAVY M.T. et MORGAN G.L.,
1998
Evidence for maternel regulation of early conceptus growth and
development in beef cattle. J.reprod.Fertil., 84:437-446.
85. GARES H.V., 2003.
Les interruptions de gestation d'origine infectieuse en
élevage bovin laitier à l'île de la réunion.
Thèse. Méd. Vét. Toulouse;3.
86. GATSINZI T., 1989.
Infertilité bovine en Afrique tropicale : contribution
à l'étude de son impact économique.
Thèse: Méd.vét.Dakar; 56.
87. GAYRARD V., PICARD-HAGEN N., BERTHELOT X. et HUMBLOt
P., 2003. La gestation chez les ruminants: comment l'embryon se
développe et se maintien dans l'utérus. Bulletin des
GTV: 21-30.
88. GDS., 2008.
Cartes BVD [en ligne] Accès internet:
http://www.gds38.asso.fr/web/gds.nsf/97cf3f4f3fcb8f8bc1256c0f004d4913/276cbb62
6f8ff284c1 256c87003c3e9e!OpenDocument (Page consultée le 10/04/
2009)
89. GEISERT R.D., SHORT E.C. et ZAVY M.T.,
1992. Maternal recognition of pregnancy.
Anim. Reprod.Sci., 28: 287-298.
90. GODKIN J.D., BAZER F.W., THATCHER W.W. et ROBERTS
M., 1984. Proteins released by culture day 15-16
conceptus prolong luteal maintenance when introduced into the lumen of cyclic
ewes. J.Reprod.Fert., 71:57-64.
91. GOGOLIN-EWENS K.J., LEE C.S., MERCER W.R.,
MOSEBYA.M. et BRANDON M.R., 1986.
Characterization of a sheep trophoblast-derived antigen first
appearing at implantation.
Placenta,7: 243-255.
92. GOURO S.A., 1980. Le diagnostic de la
gestation chez la femelle zébu.- Paris : A.C.C.T. : 1-4
93. GRAYSTON J.T., KUO C.C., WANG S.P. et ALTMAN J.,
1986.
A new Chlamydia psittaci strain, twar, isolated in acute
respiratory tract infections. New Engl. J. Med. 315:
161-168.
94. GRIMARD B., FRERET S., CHEVALLIER A., PINTO A.,
POMMRT C. et HUMBLOT P., 2006.
Genetic and environmental factors influencing first service
conception rate and late embryonic/foetal mortality in low fertility dairy
herds.
Anim. Reprod. Sci., 91: 31-44.
95. GROOMS D., 2004.
Reproductive consequences of infection with bovine viral
diarrhea virus. Vet Clin Food Anim, 20: 5-19.
96. GROSS T.S., THATCHER W.W., O'NEILL C. et
DANET-DESNOYERS G., 1990.
Platelet-activating factor alters the dynamics of prostaglandin
and protein synthesis by endometrial explants from pregnant and cyclic cows at
day 17 following oestrus. Theriogenology, 34:
205-218.
97. GUERIN B., LEGUIENNE B. et THIBIER M.,
1988.
Absence de contamination microbiologique des embryons bovins
fécondés in vitro. Bull.Acad. Vet .France;
61: 513-520.
98. GUERIN B., LEGUIENNE B., ALLIETTA M., HARLAY T. et
THIBIER M., 1990. Effets de la contamination par le BHV-1 sur la
maturation et la fécondation in vitro des ovocytes des bovins. Rec.
Méd. Vét., 166: 911-917.
99. GUERIN B., LE GUIENNE B., CHAFFAUX S., HARLAY T.,
ALLIETTA M. et THIBIER M., 1989.
Contamination des ovocytes et des embryons
fécondés in vitro après infection expérimentale de
vaches donneuses par le virus bovin de type 1 (BHV-1). Rec. Méd.
Vét.,165: 827-833
100. GUERIN B., NIBART M., MARQUANT B., LE GUIENNE B. et
HUMBLOT P., 1997.
Sanitary risks related to embryos transfer in domestic
species.
Theriogenology, 47: 33 - 42.
101. GUSTAVSSON I., 1979.
Distribution and effects of 1/29 Robertsonian translocation in
cattle. J. Dairy Sci., 62: 825-835.
102. GUTIERREZ A., DELAFUENTE J., FUENTES S., PAYAS A.,
UGARTE C. et PINTADO B., 1995.
Influence of biopsy sexing and in-vitro culture on losses of
female mouse and bovine embryos animal. Biotechnology,
6: 101-109.
103. HABIMANA S., 2008.
Evaluation de la séroprévalence et impact des
maladies abortives sur la réussite de l'Insémination artificielle
bovine au Sénégal.
Thèse: Méd. Vét.: Dakar; 36.
104. HAMILTON W.J. et LAING J.A., 1946.
Development of the egg of the cow up to the stage of blastocyst
formation. Journal of Anatomy, 80:194-204.
105. HANADA H., GESHI M. et SUZUKI O., 1995.
Additional evidence of the formation of unbalanced embryos in
cattle with the 7/21 Robertsonian translocation. Theriogenology,
44: 499-505.
106. HANAHAN D.J., 1986.
Platelet activating factor, a biologically active
phosphoglyceride. Annu.Rev.Biochem. 55: 483-509.
107. HANSEL W., STOCK A. et BATTISTA P.J.,
1989.
Low molecular weight lipid-soluble luteotrophic factor by
conceptuses in cows. J. Reprod. Fertil. Suppl., 37:
11-17.
108. HANSEN P.J., 2002.
Embryonic mortality in cattle from embryo's perspective.
Anim. Sci., 80 (E.SuppI.2): E33 E44.
109. HANSEN T.R., AUSTIN K.J., PERRY D.J., PRU J.K.,
TEIXEIRA M.G. et JOHNSON G.A., 1999.
Mechanism of action of interferon-tau in the uterus during early
pregnancy. J.Reprod. Fertil., 54: 329-339.
110. HANZEN C. et LAURENT Y., 1991.
Application de l'échographie bidimensionnelle au
diagnostic de gestation et à l'évaluation de l'incidence de la
mortalité embryonnaire dans l'espace.
Ann. Méd. Vét., 135:
481- 487.
111. HANZEN C., 2004:
Les avortements chez les ruminants et les espèces
équine et porcine. [En ligne] Accès internet:
www.tilosine.googlepages.com/avortements-sidvet.ppt
(Page consultée le 20/06/2009).
112. HANZEN C.H., 2008a.
Le constat de gestation chez les ruminants. [En ligne]
Accès internet:
www.fmv.ulg.ac.be/oga/notes/R05Constatgestation2008.pdf
(Page consultée le 20/02/2009).
113. HANZEN C.H., 2008b.
L'infertilité dans l'espèce bovine: un
syndrome. [En ligne]Accès internet :
www.fmv.ulg.ac.be/oga/notes/200809/R16Infertilitebovine2009.pdf
(page consultée le 6/03/2009).
114. HANZEN C.H., LOURTIE O., DRION P.V., DEPIERREUX C.
et CHRISTIANS E., 1999a.
La mortalité embryonnaire: Aspects cliniques et facteurs
étiologiques dans l'espèce bovine. Ann. Méd.
Vét; 143: 91-118.
115. HANZEN C.H., LOURTIE O., ORION P.V., DEPIERREUX
C. et CHRISTIANS E., 1999b.
La mortalité embryonnaire: Implications hormonales.
Ann. MM. Vet., 143: 179-189.
116. HASKOURI H., 2001.
Gestion de la reproduction chez la vache: Insémination
artificielle et détection des chaleurs chez la vache.-Rabat: Institut
Agronomique et Vétérinaire Hassan II, Dép.
Reprod.Anim.Insém.Artif., Maroc.-11p.
117. HAURAY K., 2000.
Avortements d'origine alimentaire chez les bovins. Thèse:
Méd. Vét.: Lyon; 98.
118. HAWKINS D.E., NISWENDER K.D., OSS G.M., MOELLER
C.L., ODDE K.G., SAWYER H.R. et NISWENDER G.D., 1995.
Effet de la modification du rapport acides gras
ù3/ù-6 dans le régime de vaches laitières sur la
composition en acides gras du lait et la croissance folliculaire ovarienne.
J. Anim. Sci. 73: 541-545.
119. HAYDEN T.J., THOMAS C.R., FOSYTH I.A.,
1979.
Effect of number of young born (litter size) on milk yield of
goats: role for placental lactogen.
J. Dairy. Sci., 62: 53-57.
120. HELMER S.D., HANSEN P.J., ANTHONY R.V., THATCHER
W.W., BAZER F.W. et ROBERTS R.R., 1987.
Identification of bovine trophoblast protein 1, a secretory
protein immunologically related to ovine trophoblast protein1.
J.Reprod. Fert., 79: 83-91.
121. HEMPHILL A. et GOTTSTEIN B., 2000. A
European perspective on Neospora caninum. International Journal of
parasitology, 30: 877- 924.
122. HERNANDEZ-FONSECA H.J., SAYRE B.L., BUTCHER R.L. et
INSKEEP E.K. 2000.
Embryotoxic effects adjacent and opposite to the early
regressing bovine corpus uteurn.
Theriogenelogy, 54: 83-91.
123. HEYMAN Y., CAMOUS S., FEVRE J., MEZIOU W. et MARTAL
J., 1984. Maintenance of corpus luteum after uterine transfer of
trophoblastic vesicles in cyclic cows and ewes.
J. Reprod. Fert., 70: 533-540.
124. HEYNER S., SHAH N., SMITH R.M., WATSON A.J. et
SCHULKTZ G.A., 1993.
The role of growth factors in embryo production.
Theriogenology, 39: 151 -161.
125. HORTON H.R., MORAN L.A., OCHS R.S, RAWN J.D. et
SCRIMGEOUR K.G., 1994.
Principe de Biochimie.-Bruxelles: De Boek-Wesmael S.A.-
720p.
126. HUMBLOT P. et DENIS J.B., 1986.
Sire effects on cow fertility and late embryonic mortality in
the Montbeliard breed. Livest. Prod. Sci.,
14:139-148.
127. HUMBLOT P. et DALLA- PORTA M.A., 1984.
Effect of conceptus removal and intrateurine administration of
conceptus tissue on luteal function in the cow. Reprod Develop.,
24:529-541.
128. HUMBLOT P., 1991.
Signaux embryonnaires et contrôle de la gestation des
ruminants. Rec. Med. Vet., 167: 93-202.
129. HUMBLOT P., 2001.
Use of pregnancy specific proteins and progesterone assays to
monitor pregnancy and determine the timing, frequencies and sources of
embryonic mortality in ruminants.
Theriogenology, 56: 141 7-1433.
130. HUMBLOT P., 2003.
Diagnostic des mortalités embryonnaires:
l'intérêt des dosages hormonaux. Bulletin des GTV,
21: 43 47.
131. HUMBLOT P., CAMOUS S., MARTAL J., CHARLERY J.
JEANGUYOT N., THIBIER M. et SASSER R.G., 1988.
Pregnancy-specific protein B, progesterone concentrations and
embryonic mortality during early pregnancy in dairy cows. J. Reprod.
Fertil., 83: 215-223.
132. HUMBLOT P., DE MONTIGNY G., JEANGUYOT N., TETEDOIE
F., PAYEN B., THIBIER M. et SASSER R.G., 1990.
Pregnancy specific Protein B and progesterone concentrations in
French Alpine goats throughout gestation. J. Reprod.
Fert.,89: 205-212.
133. HUMBUR A., 1995.
Etude bibliographique des causes infectieuses et parasitaires
d'avortement chez les petits ruminants.
Thèse: Méd. Vét., Lyon; 45.
134. INSTITUT D'ELEVAGE, 2000. Maladies des
bovins. Editions France agricole, 3e .édition.-p 277.
135. IWASAKI S., HAMANO S., KUWAYAMA M., YAMASHITA M.,
USHIJIMA H., NAGAOKA S. et NAKAHARA T., 1992.
Developmental changes in the incidence of chromosome anomalies of
bovine embryos fertilized in vitro.
J. Exp. Zool., 261: 79-85.
136. KAGERUKA, 1965.
A propos des avortements des bovidés. Ann.
Méd. Vét. 109: 413-436.
137. KAHN W. et LEIDL W., 1989.
Ultrasonic characteristics of pathological conditions of the
bovine uterus and ovaries. Diagnostic ultrasound and animal reproduction.
M.M. Taverne and A.H. Willemse (Eds), Kluwer Academic
Publisher, 53-65.
138. KAMGA-WALADJO. A. R., 2003.
Performances zootechniques des N'dama et des produits de
l'insémination artificielle bovine en république de
Guinée.
Mémoire DEA : Productions Animales : Dakar (EISMV) ;
12.
139. KANEENE J.B., COE P.H., GIBSON C.D., YAMINI B.,
MARINEZ R.O. et MORROW D.A., 1986.
The role of Haemophilus somnus in bovine early embryonic death.
I. The effect of the organism on embryos by day 8 postbreeding.
Theriogenology, 26:189-198.
140. KAPOOR P.K., GARG D.N. et MAHAJAN S.K.,
1989.
Isolation of Mycoplasma mycoides subsp. mycoïdes (LC
variant, Y-goat) from naturally aborted bovine fetuses.
Theriogenology, 32: 683-689.
141. KARABAGHALI H., 1972.
Contribution a l'étude des avortements du cheptel bovin
en Algérie. Thèse: Méd.Vét : Lyon; 38
142. KASTELIC J.P. et GINTHER O.J., 1989.
Fate of conceptus and corpus luteum after induced embryonic loss
in heifers. J.A.V.M.A., 194: 922-928.
143. KASTELIC J.P., NORTHEY D.L. et GINTHER,
1991. Spontaneous embryonic death on day 20 to 40 in heifers.
Theriogenology, 35: 351-363.
144. KAWARSKY S.J., BASRUR P.K., STUBBINGS R.B., HANSEN
P.J. et KING W.A., 1996.
Chromosomal-abnormalities in bovine embryos and their influence
on development. Biol. Reprod., 54: 53-59.
145. KING B.D., BO G.A., LULAI C., KIRKWOOD R.N., COHEN
R.D.H. et MAPLETOFT R.J., 1995.
Effect of zeranol implants on age at onset of puberty, fertility
and embryo fetal mortality in beef heifers.
Can. J.Anim. Sci., 75: 225-230.
146. KING G.J., ATKINSON B.A. et ROBERTSON
H.A., 1980.
Development of the bovine placentome from days 20 to 29 of
gestation. J.Reprod.Fert. 59: 95-1 00.
147. KNICKERBOCKER J.J., WILTBANK M.C. and NISWENDER
G.D., 1988. Mechanisms of luteolysis in domestic livestock.
Domest.Anim. Endocrinol. 5:591-107.
148. KOUAMO J., 2006.
Evaluation technico-économique des stratégies
d'insémination artificielle en zone sylvo-pastorale : cas de la
région de Louga.
Thèse: Méd. Vet. : Dakar; 18.
149. KPOMASSI T., 1991.
Epidémiologie des affections abortives des bovins au Togo
Enquête sérologique sur la Brucellose, la Chlamydiose et la
Fièvre Q.
Thèse: Méd.Vét.: Dakar; 11.
150. KUMMERFELD H.L., OLTENACU E.A. et FOOTE R.H.,
1978.
Embryonic mortality in dairy cows estimated by nonreturns to
service, estrus, and cyclic milk progesterone patterns.
J. Dairy. Sci. 61:1773-1777.
151. LAMOTHE P. et GUAY P., 1970.
Electrolytes des secrétions intra-utérines bovines
lors d'infertilité sine materia. Can.J.comp.Med.,
34:167-176.
152. LARSON R.C., IGNOTZ G.G. et CURRIE W.B.,
1992.
Platelet derived growth factor (PDGF) stimulates development of
bovine embryos during the fourth cell cycle. Development,
115: 821-826.
153. LE COZ R., 1991. Toxicité et
détoxication des grains de colza. Thèse, Méd. vét.
Nantes, 111.
154. LEDOUX D., HUMBLOT P., CONSTANT F., PONTER A. et
GRIMARD B., 2006.
Echecs précoces de gestation chez la vache
laitière. Point Vet, 37 (numéro
spécial reproduction des ruminants): 50-55.
155. LEE A.J. et AX R.L., 1984.
Milk progesterone of dairy cows injected with gonadotrophin
releasing hormone at the first postpartum breeding?
Proc. 10th Int. Cong.Anim.Reprod.and A.I.
Urbana, 2,401.
156. LEFEVRE P.C., 1975.
Note sur la Rhinotrachéïte infectieuse des bovins en
Éthiopie : Enquête sérologique préliminaire.
Rev. Elev. Méd. Vet. Pays trop.,
28 (2): 103-104.
157. LEGEA Y., 1974.
Recours de l'acheteur d'un animal brucelllque (loi du 21/12/72).
Thèse: Méd.Vét: Lyon; 064.
158. LEISER R.,1975.
Kontaktaufnahme zwischen trophoblast und utersepihel warhend der
fruhen implantation beim rind. Anat. Histol. Embryol.
,4: 63-86.
159. LINARES T. et KING W.A., 1980.
Morphological study of the bovine blastocyst with phase contrast
microscopy. Theriogenelogy. 14:123-133.
160. LONERGAN P., 1994.
Growth of preimplantation bovine embryos.
Acta.Vet.Scand. 35: 307-320.
161. LONERGAN P., FAIR T. et GORDON I.,
1992.
Effects of time of transfer to granulosa cell monolayer and
cell stage at 48 hours post-insemination on bovine oocyte developpement
following IVM/IVF/IVC. 8th Scientific meeting of the European Embryo
Transfer Association, Lyon 11-12th September.-1 36.
162. LOPEZ RUIZ L., ALVAREZ N., NUNEZ I., MONTES I.,
SOLANO R., FUENTES D., PEDROSO R., PLAMA G.A. et BREM G.,1996.
Effect of body condition on the development competence of
IVM/IVF bovine oocytes. Theriogenology, 45: 292,
(Abs).
163. LOPEZ-GATIUS F., GARBAYO J.M., SANTOLARIA P., YANIZ
J., AYAD A., SOUSA N.M. et BECKERS J.F., 2007.
Milk production correlates negatively with plasma levels of
pregnancy associated glycoprotein (PAG) during the early fetal period in high
producing dairy cows with live fetuses.
Domest. Anim. Endocrinol., 32:
29-42.
164. LOPEZ-GATIUS F., SANTOLARIA P., YANIZ J., RUTLAND
J. et LOPEZBEJAR M., 2002.
Factors affecting pregnancy loss from gestation day 38 to 90 in
lactating dairy cows from a single herd.
Theriogenology, 57: 1251-1261.
165. LULAI C., KASTELIC J.P., CARRUTHERS T.D. et
MAPLETOFT R.J., 1994.
Role of luteal regression in embryo death in cattle.
Theriogenology, 41: 1081-1089.
166. MANN G.E. et LAMMING G.E., 2000.
The raie of sub-optimal preovulatory estradiol secretion in
aetiology of prernature luteolysis during the shortest rus cycle in the cow.
Anim. Reprod. Sci., 64:171-180.
167. MARCIAT, 2008.
Lutte contre la BVD.[En ligne] Accès internet :
http://www.gds38.asso.fr/web/gds.nsf/97cf3f4f3fcb8f8bc1256c0f004d4913/276cbb62
6f8ff284c1 256c87003c3e9e!OpenDocument (Page consultée le 01/06/
2009).
168. MARCUS G.J., 1981.
Prostaglandin formation by the sheep embryo and endometrium as
an indication of maternal recognition of pregnancy.
Biol. Reprod. 25: 56-64.
169. MARRIOTT A.C., WARD V.K., HIGGS S. et NUTTALL P.A.,
2000.
RNA probes detect neucleotide sequence homology between members
of two different nairovirus serogroups. Virus Res.,
16: 77-81.
170. MARTAL J., LACROIX M.C., LOUDES C., SAUNIER M. et
WINTENBERGERTORRES., 1979.
Trophoblastin, an antiluteolytic protein present in early
pregnancy in sheep. J.Reprod. Fert., 56: 63-73.
171. MARTINI M., BALDELLI R., et PAULUCCI DE CALBOLI L.,
1994.
An epidemiological study on Q fever in the Emilia-Romagna region,
Italy. Zbl. Bakt., 280: 416-422.
172. MASSIP A., ZWIJSEN W. et MULNARD J.,
1983.
Cinematographic analysis of the cleavage of the cow egg from
2-cell to 1 6-cell stage. Arch. Biol. 94: 99-1 06.
173. MC ALLISTER MM., UFFMAN EM., IETALA SK., ONRAD A.,
NDERSON M. et ALMAN M., 1996.
Evidence suggesting a point source exposure in an outbreak of
bovine abortion due to neosporosis.
Vet. Diagn. Invest., 8: 355-357.
174. MCNEILL RE., DISKIN M.G., SREENAN J.M. et IVLORRIS
D.G., 2006.
Associations between milk progesterone concentration on
different days and with embryo survival during the early luteal phase in dairy
cows.
Theriogenology, 65:1435-1441.
175. METELO R. SULON J., MOREIRA DA SILVA F. Et BECKERS
J.F., 2002.
Preliminary results for measuring bovine PAG in milk simples.
In : 7ème Journée de Rencontre Bio forum,
Bio-Liège, Association des B iotechnolog istes Liégeois,
Liège, 32 (Abstract).
176. MIALON M.M., CAMOUS S., RENAND G., MARTAL J. et
MENISSIER F., 1993.
Peripheral concentrations of a 60-kDa pregnancy serum protein
during gestation and after calving and in relationship to embryonic mortality
in cattle.
Reprod. Nutr. Dev.; 33: 269-282.
177. MIALON M.M., RENAUND G. , CAMOUS S., MARTAL J. et
MENISSIER F., 1994.
Detection of pregnancy by radioimmunoassay of a pregnancy serum
protein (PSP60) in cattle. Reprod.Nutr.Devlop ; 34:
65-72.
178. MILLEMANN Y., REMY D., et BRUGERE-PICOUX J.,
2000.
La listériose des ruminants: diagnostic, traitement et
prévention. Point vét., 31(208): 317-
322.
179. MILVAE R.A. et HANSEL W.,
1980.
The effects of prostacyclin (PGI2) and 6-Keto-PGF on bovine
plasma progesterone and LH concentrations. Prostaglandins,
20: 641-646.
180. MITCHELL D., 1960. Bovine abortion. An
analysis of 227 cases. Can. Vet.J.,1: 337-343.
181. MONTY B. M., 2004.
Early embryo death in cattle thermal stress. Les colloques
de l'InRA, 20:283-300.
182. MORALES J.R., PEDROSO R. et SOLANO R.,
1988.
Effects of a subtropical climate on the fertility of dairy
cattle in Cuba. In: livestock
reproduction in latin America. Proceeding of
the final researchs coordination meeting
183. MOREIRA F., BADINGA L., BURNLEY C., et THATCHER
W.W., 2002.
Bovine somatotropin in creases embryonic development in
superovulated cows and improvespost-transfer pregnancy rates when given to
lactating recipient cows. Theriogenology, 57: 1371-1 387.
184. MORTON H., 1984.
Early pregnancy factor (EPF), a link between fertilization and
immunomodulation. Aust. J. Biol. Sci.; 37:
393-407.
185. MORTON H., MORTON D.J. et ELLENDORF F.,
1983.
The appearance and characteristics of early pregnancy factor in
the pig. J. Reprod. Fert., 68: 437- 446.
186. MORTON H., NANCARROW C.D., SCARAMUZZI R.J., EVISON
B.M. et CLUNIE G.J.A., 1979.
Detection of early pregnancy in sheep by the rosette inhibition
test. J. Reprod. Fertil., 56: 75-80.
187. MORTON H., ROLFE B.E., MCNEILL L., CLARKE P.,
CLARKE F.M. et CLUNIE G.J.A., 1980.
Early Pregnancy Factor. Tissues involved in its production in
the mouse J. Reprod. Immunol., 2: 73-82.
188. MOUICHE M., 2007a.
Etude de la relation entre le statut nutritionnel des vaches
inséminées et leur état physiologique par dosage d'un
biomarqueur de gestation : Les Protéines Associées à la
Gestation (PAGs).
Thèse: Méd. Vét.: Dakar; 13
189. MOUICHE M., 2007b.
Etude du profil électrophorètique des
protéines sériques des vaches ayant avorté après
insémination artificielle au Sénégal Mémoire DEA:
Productions Animales : Dakar (EISMV); 7
190. MUMPOREZE N., 2007.
Comparaison de trois méthodes de diagnostic de
gestation après insémination artificielle par dosage des
protéines associées à la gestation, par dosage de la
progestérone et par la palpation rectale.
Thèse: Méd. Vét.: Dakar; 14
191. MUKAKANAMUGIRE A., 2008.
Séroprévalence de la Néosporose et
incidence sur les paramètres de la reproduction dans les élevages
bovins laitiers périurbains de Dakar (Sénégal).
Thèse : Méd. Vét.: Dakar ; 1.
192. NABEYA M., KANEKO K., OGINO H., NAKABAYASHI D.,
WATANABE T., MURAYAMA J., HAYASHI K., FUKUSHI H., YAMAGUCHI T., HIRAI K.l.,
INABA Y., et MATUMOTO M., 1991.
Abortion in Japanese cows caused by Chlamydia psittaci.
Vet. Microbiol., 29 (3-4): 261-5.
193. NANCARROW C.D. et WALLACE A.L.C., 1980.
Detection of fertilization in sheep and cattle, serological
estimation and description of properties of an early pregnancy factor.
Proc. 9th Int. Congr. Animal Reproduction and Artificial
Insemination, Madrid, 3, 85, Abst. 2- 23.
194. NANCARROW C.D., WALLACE A.L.C. et GREWAL
A.S., 1981.
The early pregnancy factor of sheep and cattle. J. Reprod.
Fertil., Suppl.; 30: 191-1 99.
195. NISHIMWE K., 2008.
Evaluation des facteurs de variation du taux de réussite
de l'insémination artificielle bovine en milieu traditionnel au
Sénégal.
Thèse: Méd. Vét.: Dakar ; 50.
196. NYANTURE M., 2001.
L'Insémination artificielle en zone périurbaine
de Ouagadougou : Bilan et perspective. Mémoire de fin d'étude.
Ecole Nationale d'Elevage et de Santé Animale (ENESA) Ouagadougou;
13.
197. OKEKE E. N. ,1976.
Une étude sur les maladies à caractère
bovipestique au Nigeria : évidence préliminaire :
sérologique pour l'existence de diarrhée bovine virale.
Bull. anim.: Prod. Afr., 24: 5-8.
198. OLLOY A., 1992.
Contribution à l'étude
épidémiologique des maladies infectieuses abortives chez les
bovins au Congo.
Thèse : Méd. Vét.: Dakar; 26.
199. OROZCO C., PERKINS T. et CLARKE F.M.,
1986.
Platelet-activating factor induces early pregnancy factor in
female mice. J. Reprod. Fertil., 78: 549-555.
200. PAISLEY L.G., LARRY G., DUANE MICKELSEN W. et FROST
O.L., 1978.
A survey of the incidence of prenatal mortality in cattle
following pregnancy diagnosis by rectal palpation.
Theriogenology, 9: 481- 489.
201. PARIA B.C. et DEY S.K., 1990.
Preimplantation embryo development in vitro, cooperative
interactions among embryos and role of growth factors.
Proc. Natl.A cad. Sci. USA, 87:
4756-4760.
202. PERÉNYI Z., SZENCI O., DRION P.V.,
BANGA-MBOKO H., SOUSA N.M., EL AMIRI B. et BECKERS J.F., 2002.
Aspartic proteinase members secreted by the ruminant
placenta: specificity of three radioimmunoassay systems for the measurement of
pregnancy-associated glycoproteins.
Reprod. Dom. Anim, 37: 324-329.
203. PICARD I, GREVE T., KING W.A., BETTERIDGE K.J. et
HOLMJORGENSEN P., 1986.
Bissection of post compaction bovine embryos, the difference in
viability between the two monozygotic halves.
Acta. Vet. Scand., 27: 33-48.
204. PICARD-HAGEN N., GAYRARD V. et BERTHELOT X.,
2003a.
Les causes de la mortalité embryonnaire chez les
ruminants. Bulletin des GTV, 21: 39-42.
205. PICARD-HAGEN N., GAYRARD V., BERTHELOT X. et
HUMBLOT P., 2003b.
Méthodes de contrôle de la gestation et des
mortalités embryonnaires chez les ruminants.
Bulletin des GTV, 21: 31-36.
206. PIKO L. and CLEGG K.B., 1982.
Quantitative changes in total RNA, total poly (A), and ribosomes
in early mouse em bryos.
Dev. Hiol., 89: 362-378.
207. PINTO A., BOUCA P., CHEVALLIER A., FRERET S.,
GRIMARD B., et HUMBLOT P., 2000.
Source de variation de la fertilité et des
fréquences de mortalité embryonnaire chez la vache
laitière.
Renc. Rech. Ruminants, 7: 213-215.
208. POLL C., 2007.
La mortalité embryonnaire chez les bovins. Thèse:
Méd.Vét.: Lyon; 77.
209. PONSART C., DUBOIS P., CHARBONNIER G., LEGER T.,
FRERET S. et
HUMBLOT P., 2007.
Evolution de l'état corporel entre 0 et 120 jours de
lactation et reproduction des vaches laitières hautes productrices.
In: Journées nationales des GTV. Nantes:
347-356.

210. PONTER A., GUELOU K. et DUVAUX-PONTER C.,
2005.
Influence de l'alimentation sur la mortalité
embryonnaire. Point Vet., 36:100-105.
211. PROVOST A., BGGEL K., BORREDON C. et MAURICE,
1964.
La maladie des muqueuses en Afrique Centrale. Observations
cliniques et épizootiologiques.
Rev. Elev. Méd. vét. Pays-trop.,
20: 27- 49.
212. PROVOST A., BORREDON C. et FEREOL C.,
1964.
Note sur la rhinotrachéite infectieuse bovine en Afrique
Centrale. Isolement du virus ; enquête sérologique. Rev.Elev.
Méd. vét. Pays trop.,17.
213. RADIGUE E., LEBRETON P., GARNIER C. et NOWAK N.,
2009.
Les avortements mycosiques des bovins seraient ils
révélateurs de la carence en iode? Accès
internet :
www.academie-veterinairedefrance.org/academie/2009/radigue.pdf
(Page consultée 27/04/2009).
214. REKIKI F.A., THABTI I., DLISSI P., RUSSO R.,
SANCHIS M., PEPIN A., RODOLAKIS et HAMMAMI S., 2005.
Enquête sérologique sur les principales causes
d'avortements infectieux chez les petits ruminants en Tunisie. Revue
Méd. Vét., 156 (7): 395-401.
215. RIDDELL K.P., STRINGFELLOW D.A., GRAY B.W., RIDELL
M.G., WRIGHT J.C. et GALIK P.K., 1993.
Structural and viral association comparisons of bovine zonae
pellucidae from follicular oocytes day-7 embryos and day-7 degenerated ova.
Theriogenology, 40: 1281-1291.
216. ROMANO J.E, THOMPSON JA, KRAEMER DC, WESTHUSIN ME,
FORREST
DW. et TOMASZWESKI
MA., 2007.
Early pregnancy diagnosis by palpation per rectum: Influence on
embryo/fetal viability in dairy cattle.
Theriogenology, 67: 486-493.
217. ROMANO J.E., 2004.
Early pregnancy diagnosis and embryo/fetus mortality in cattle.
Doctor of philosophy: Texas A&M University; 50.
218. ROSSI C.R., BRIDGMAN B.S. et KIESEL G.K.,
1990.
Viral contamination of bovine fetal lung cultures and bovine
fetal serum. Am. J. Vet. Res., 41:1680-1 681.
219. ROY C., 2007.
Rh i notrachéïte Infectieuse Bovine (I BR).
Séminaire en sciences animales SAN-12474.
220. RUDER C.A., SASSER R.G., DAHMEN J.J. et STELLFLUG
J.N., 1988.
Detection of pregnancy in sheep by radioimmunoassay of sera for
pregnancy specific protein B.
Theriogenology, 29: 905-911.
221. RUFENACHT J., 2001.
The effect of infection with bovine viral diarrhea virus on the
fertility of Swiss dairy cattle
Theriogenology.;
56:199-210.
222. RUFENACHT J., 2001.
The effect of infection with bovine viral diarrhea virus on the
fertility of Swiss dairy cattle.
Theriogenelogy.; 56: 199-210.
223. RYAN D.P., PRICHARD J.F., KOPEL E.,et GODKE R.A.,
1993.
Comparing early embryo mortality in dairy cows during hot and
cool seasons of the year.
Theriogenology, 39: 719-737.
224. SANTOS J.E.P., CERRI RL. A., BALLOU M.A.,
HIGGINBUTHAM G.E. et KIRK J.H., 2004.
Effect of timing of first clinical mastitis occurrence on
lactational and reproductive performance of Holstein dairy cows.
Anim. Reprod. Sci., 80: 31-45.
225. SANTOS J.E.P., THATCHER W.W., POOL L. et OVERTON M.
W., 2001.
Effect of human chorionic gonadotropin on luteal function and
reproductive performance of high-producing lactating Holstein dairy cows.
J. Anim. Sci., 79: 2881-2894.
226. SASSER G. R.; RUDER C.A.; IVANI K. A. et BUTLER J.
E., 1986. Detection of pregnancy bip RIA of a Novel pregnancy Specific
protein in serum of cows and profil of serum concentration during gestation.
Biology of reproduction, 35:
936-942.
227. SCHRIEK F.N., HOCKETT M.E., SAXTON A.M., LEWIS
M.J., DOWLEN H.H. et OLIVER S.P., 2001.
Influence of subclinicai mastitis during early lactation on
reproductive pararneters. J. Dairy Sci., 84:
1407-1412.
228. SEAL, 2007.
Infectious Bovine Rhinotracheitis. Beef Cattle Handbook.
BCH-3220.[En ligne]. Accès internet
http://www.iowabeefcenter.org/pdfs/bch/03220.pdf.
(Page consultée le 19/05/2009).
229. SELYE H., COLLIP J.B. et THOMSON D.L.,
1933.
The effect of hypophysectomy upon pregnancy and lactation.
Proc. Soc. Exp. Biol. Med. N.Y., 30: 589-592.
230. SETCHELL B.P., D'OCCHIO M.J., HALL M.S., LOURIE
M.S., TUCKER M.J. et ZUPP J.L., 1988.
Is embryonic mortility increased in normal female rats mated to
subfertile males? J. Reprod. Fertil., 83: 567-574.
231 . SHELTON K., PARKINSON T.J., HUNTER M.G., KELLY R.W.
et LAMMING G.E., 1990.
Prostaglandin E2 as potential luteotrophic agent during early
pregnancy in cattle. J. Reprod. Fert. 90: 11-17.
232. SHEWEN PE., 1986.
Chlamydial infection of the bovine reproductive system
(279-282.): In: Morrow DA (ed): Current therapy in therionogenology. 2.
Diagnosis, treatment and prevention of reproductive diseases in small and large
animals, ed 2. Philadelphia, WB Saunders.
233. SHI K.S., LU K.H. et GORDON I., 1990.
Effect of bulls on fertilization of bovine oocytes and their
subsequent development in vitro.
Theriogenology, 33: 320-324.
234. SINGH E.L., 1998.
The potential of semen and embryos for introducing pathogens
into the uterus (72- 79): In 11the Intern. Cong.Anim. Reprod.A .
I, Dublin.
235. SMITH, 1990.
Large Animal Internal Medecine. The C.V. Mosby Company. 1787
p.
236. SNIJDERS S.E.M., DILLON P., O'CALLAGHAN D. et
BOLAND M.P., 2000.
Effect of genetic merit, body condition and lactation number on
in vitro oocyte development in dairy cows.
Theriogenology, 53: 981-989.
237. SOUSA N. M., AYAD A., BECKERS J.F. et GAJEWSKI Z.,
2006.
Pregnancy-associated glycoproteins (PAG) as a pregnancy markers
in the ruminants. J. Physiol. Pharmacol., 57 (supp
8): 158-1 71.
238. SOUSA N.M., ZONGO M., PITALAW., BOLY H.,
SAWADOGO L.,SANON M., FIGUEIREDO J.R., GONCALVES P.B.D., EL AMIRI B.,
PERÉNYI Z. et BECKERS J.F., 2003.
Pregnancy-associated glycoprotein concentrations during
pregnancy and the postpartum period in Azawak zebu cattle.
Theriogenology, 59: 1131-1142.
239. SOUSA N.M., FIGUEIREDO J.R., EL AMIRI B.,
BANGA-MBOKO H. et BECKERS2 J.F., 2002.
Influence potentielle des hormones et protéines
synthétisées au cours de la gestation sur l'état
immunitaire de la mère.
Ann. Méd. Vét., 147:
71-83.
240. SREENAN J.M. et DISKIN M.G., 1983.
Early embryonic mortality in the cow: its relationship with
progesterone concentration. Vet. Rec., 112:
517-521.
241 . STAPLES C.R., BURKE J.M. et THATCHER W.W.,
1998.
Influence of supplemental fats on reproductive tissues and
performance of lactating cows.
J. Dairy Sci., 81: 856 - 871.
242. STIPKOVITS L., ESZAROS J., PAZMANY B. et VARGA Z.,
1983.
Isolation of mycoplasmas from bull semen and serological
examination of aborted cows sera for presence of mycoplasma antibodies.
Arch. Exper. Vet. Med., Leipzig, 37
(3): 429-433.
243. STORZ J. et WHITEMAN C.E., 1980.
Chlamydia-induced bovine abortions: cause,
pathogenesis, and detection (560-565). In: Reports and summaries. Xith
International Congress on diseases of cattle, Tel Aviv.
244. STRAUB, 1991.
BHV-1 Infections: Relavance and spread in Europe.
Comparative Immunology, Micro biology and Infectious Diseases,
14: 175-186.
245. STRINGFELLOW D.A. et WRATHALL A.E.,
1995.
Epidemiologic implications of the production and transfer of IVF
embryos. Theriogenology, 43: 89-96.
246. SZENCI O., P. HUMBLOT, J.F. BECKERS, G. SASSER, J.
SULON, R.,
BALTUSEN, J. VARGA, CS. A. BAJCSY et M. A. M. TAVERNE.,
2000.
Plasma Profiles of Progesterone and Conceptus Proteins in Cows
with Spontaneous Embryonic/Fetal Mortality as Diagnosed by Ultrasonography.
Veterinary. Journal; 159: 287-290.
247. TAINTURIER D. ; BEDEL M. ; BECKERS J. F. et FIENI
F., 1996.
Cinétique de la bPAG (Bovine Pregnancy Associated
Glyco Protin) dans le plasma et dans le lait au cours des trois mois suivant le
part chez la vache laitière (129-134). In : Reproduction et
production laitière. - Tunis: SERVICED. -294 (Actualité
Scientifique A UPELF-UREF).
248. TAINTURIER D., FIENI F., BRUYAS J.F. et BATTUT I.,
1997.
Conduite à tenir devant un avortement dans un
élevage bovin. Point Vét., 28 (1
83):1239-1 243.
249. TAINTURIER D., FIENI F., BRUYAS J.F. et BATTUT I.,
1996.
Etiologie des avortements bovins.
Le point vétérinaire, 28 (138):
1230-1231.
250. THATCHER W.W., KNICKERBOCKER J.J., BARTOL F.F.,
BAZER F.W., ROBERTS R.M. et DROST M., 1985.
Maternal recognition of pregnancy in relation to the survival of
transferred embryos, endocrine aspects.
Theriogenology, 23:129-143.
251 . THIAM O., 1996.
Intensification de la production laitière par
l'insémination artificielle dans quatre unités de production du
Sénégal.
Thèse: Méd. Vét.: Dakar; 42.
252. THIBAULT C., 1966.
La culture in vitro de l'oeuf de vache.
Ann. Biol. Anim. Bioch. Biophys.,6:
159-164.
253. THIMONIER J., 2000.
Détermination de l'état physiologique des femelles
par analyse des niveaux de progestérone.
INRA Prod.Anim.13: 177-183.
254. THURMOND M.C. et PICANSO J.P., 1993.
Fetal loss associated with palpation per rectum to diagnose
pregnancy in cows. J.A.V.M.A., 203: 432-435.
255. THYS E., 2005.
Etude de la prévalence de la brucellose bovine en zone
forestière de la Côte d'Ivoire. Revue Élev. Méd.
vét. Pays trop., 58: 205-209.
256. TRUEMAN K.F., 1986.
Bovine abortion due to prenatal Babesia bovis
infection.
257. UNCEIA, 2005.
Reprod guide: Département recherche et
développement, groupe fertilité femelle.
258. UNDERWOOD E. J. et SUTTLE N.F., 1999.
The mineral nutrition of livestock.
In: 3ème edition, CABI publishing, oxon, UK,
614.
259. VAITCHAFA P., 1996.
Etude des effets de la production laitière sur les
paramètres de reproduction chez la femelle zébu dans les petits
élevages traditionnels en zone périurbaine.
Thèse: Méd. Vét., Dakar: 36.
260. VALLET A., CARTEAU M., SALMON A., et CHATELIN Y.,
1987.
Epidémiologie des endométrites des vaches
laitières. Rec.Méd. Vet.,
163:189-194.
261 . VAN SOOM A., VAN VLAENDEREN I., MAMOUDZADEH A.R.,
YSEBAERT M.T., DELUYKER H. et DE KRUIF A.,1992.
Compaction rate of in vitro fertilized bovine embryos related to
the interval from insemination to first cleavage.
Theriogenology, 38: 905-919.
262. WIEBOLD J. L., 1988.
Embryonic mortality and the uterine enviromnent in first-service
lactating dairy cows. J. Reprod. Felt., 84:
393-399.
263. WOODING F.B. et WATHES D.C., 1992.
Binucleate cell migration in the bovine placentome. J.
Reprod.Fertil., 59: 425-430.
264. WOUDA W., DUBEY J.P. et JENKINS M.C.,
1997.
Serological diagnosis of bovine foetal neosporosis. J.
Parasitology, 83 (3): 545 - 547.
265. YOUNGQUIST, THRELFALL et WALTER R.,
2007.
Current Therapy in Large Animal. Theriogenology 2.
Second Edition. 1061.
266. ZIOMEK C.A. et JOHNSON M.H., 1981.
Properties of polar and apolar cells from the 16 cell mouse
morula. Roux's Arch.Dev. Biol., 190: 287-296.
267. ZOLI A. P., GUILBAULT L. A., DELAHAUT P., BENITEZ
ORTIZ W. et BECKERS J. F., 1992.
Radioimmunoassay of a bovine pregnancy-associated glycoprotein in
serum: its application for pregnancy diagnosis.
Biol.Reprod. 46: 83-92.
268. ZOLI A.P., BECKERS J.F., WOUTERS-BALLMAN P.,
CLOSSET J., FALMAGNE P. et ECTORS F., 1991.
Purification and characterization of a bovine pregnancy-
associated glycoproteins. Biol. Reprod., 45: 1-10.
269. ZWART D., 1966.
The virus of infectious bovine rhinotracheitis in northern
Nigeria. Bull. epizoot. Dis. Afr.,14: 405-408.
ANNEXES
Annexe 1: Différents type de placenta en
fonction des espèces animales
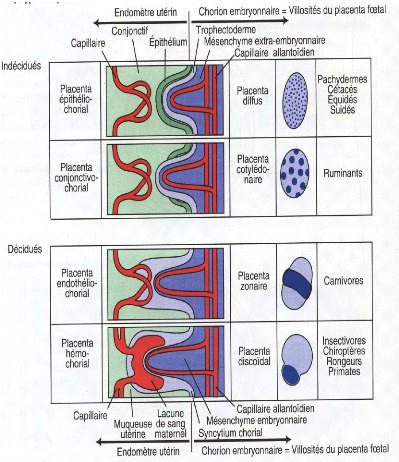
Annexe 2: Plantes susceptible de contenir des
concentrations dangereuses de nitrates
[Source: CLARKE cité par HAURAY,
2000
Annexe 3: Structure caractéristique des acides
gras indispensables.
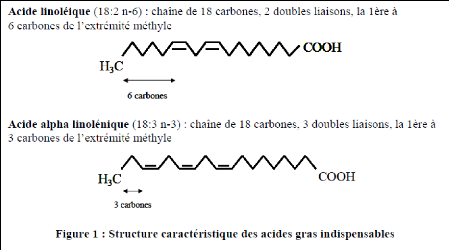
SERMENT DES VETERINAIRES DIPLOMES DE DAKAR
«Fidèlement attaché aux
directives de Claude BOURGELAT, fondateur de l'enseignement
vétérinaire dans le monde, je promets et je jure devant mes
maîtres et mes aînés:
~ d'avoir en tous moments et en tous lieux le souci de la
dignité et de l'honneur de la profession vétérinaire;
~ d'observer en toutes circonstances les principes de
correction et de droiture fixés par le code de déontologie de mon
pays;
~ de prouver par ma conduite, ma conviction, que la fortune
consiste moins dans le bien que l'on a, que dans celui que l'on peut faire;
~ de ne point mettre à trop haut prix le savoir que je
dois à la générosité de ma patrie et à la
sollicitude de tous ceux qui m'ont permis de réaliser ma vocation.
« Que toute confiance me soit retirée s'il
advient que je
me parjure.»
LE (LA) CANDIDAT (E)
VU
VU LE PROFESSEUR RESPONSABLE
LE DIRECTEUR DE L'ECOLE INTER-ETATS DES
DE L'ECOLE INTER-ETATS SCIENCES ET MEDECINE
DES SCIENCES ET MEDECINE VETERINAIRES DE
DAKAR
VETERINAIRES DE DAKAR
|
VU
LE DOYEN
DE LA FACULTE DE MEDECINE
ET DE
PHARMACIE
DE L'UNVERSITE CHEIKH ANTA DIOP
DE DAKAR
|
LE PRESIDENT
DU JURY
|
VU ET PERMIS D'IMPRIMER
DAKAR, LE
LE RECTEUR, PRESIDENT DE L'ASSEMBLEE
DE L'UNIVERSITE
CHEIKH ANTA DIOP
DE DAKAR
|
Synthèse des connaissances actuelles sur les
avortements dans l'espèce Bovine.
|
|
RESUME
|
|
L'amélioration de la fertilité demeure un des
objectifs prioritaires pour optimiser le potentiel de reproduction et donc de
production en élevage bovin. Au cours de ces dernières
années, l'analyse des résultats sur l'IA a montré une
faiblesse des taux de réussite. Ces échecs de gestation restent
dus en grande partie à des avortements.
A cet effet, plusieurs facteurs étiologiques ont
été répertoriés comme responsables des
mortalités embryonnaires et avortements cliniques principalement les
facteurs gamétiques, facteurs embryonnaires, facteurs parentaux,
facteurs environnementaux, facteurs alimentaires et facteurs biologiques.
L'évaluation de ces avortements dans l'espèce
bovine relève le plus souvent de l'association de plusieurs
méthodes, notamment les méthodes hormonales, méthodes
cliniques et les méthodes paracliniques.
Sachant que les avortements représentent une forte
composante de l'infertilité dans l'espèce bovine, l'application
des stratégies de lutte contre les facteurs étiologiques
s'avère très nécessaire pour éradiquer ce
fléau au niveau des exploitations bovines.
Mots clés: Bovin, Gestation, Mortalités
embryonnaires, Avortements cliniques
|
|
Synthesis of the current knowledge on pregnancy losses in
the bovine sort.
|
|
SUMMARY
|
|
The improvement of the fertility lives one of the priority
objectives to optimize the potential of reproduction and the production in
bovine breeding
During these last years, the analysis of the results on the IA
showed a weakness of the rates of success. These failures of pregnancy remain
due largely to abortions.
For that purpose, several factors were listed as people in charge
of embryonic mortalities and clinical abortions mainly; embryonic factors,
parental factors,
environmental factors, food factors and biological
factors.
The evaluation of these abortions in the bovine sort recovers
mostly from the association of several methods, in particular the hormonal
methods, clinical methods and the paraclinic methods.
Knowing that abortions represent a strong constitute of the
infertility in the bovine sort, the application of the strategies of fight
against factors turns out very necessary to eradicate this plague at the level
of the bovine farm.
Keywords: bovine, pregnancy, embryonic
Mortalities, clinical pregnancy loss.
|
|
Auteur: Pascal NYABINWA
E-mail:
nyabpas@yahoo.fr, Tél:
+250788642733, +250783474801 (RWANDA)
|
|
| 


