III.3.1.2. Causes virales
Les conséquences d'une infection virale
dépendent du stade de gestation auquel l'infection a été
contractée. Le plus souvent au cours des deux premiers trimestres,
l'infection se traduira par une mortalité embryonnaire ou foetale,
l'avortement proprement dit pouvant s'observer selon un délai variable.
Il en résulte l'expulsion d'un foetus qui sera le plus souvent
autolysé.
Une infection contractée au cours du dernier trimestre,
s'accompagnera d'une réponse immunitaire suffisante pour permettre au
foetus de naître à terme ou si la réponse immunitaire est
excessive d'induire un état de stress chez le foetus qui dans ce cas
sera expulsé prématurément. Dans ce second cas l'autolyse
ne sera pas systématiquement observée [HANZEN,
2008b].
III.3.1.2.1. Diarrhée Virale Bovine (BVD) /
Maladie des Muqueuses (MM)
Une étude a montré que le taux d'avortement dans
les troupeaux où le virus circule est multiplié par 2 à 3
et un taux d'avortement de 20% peut être observé lors
d'introduction du BVD dans un élevage indemne [GROOMS,
2004].
En Afrique, des études montrent des prévalences
suivantes: Au Sénégal: 61 à 78 % [BERNARD et
BOIJRDIN, 1971;PROVOST et al., 1964] et 47%
[HABIMANA, 2008], au cours d'une enquête dans le nord
Cameroun et l'ouest Tchadien signalent que 75% des sérums des sujets
adultes sont positifs; au nord Nigeria: 13,4 % d'après OKEKE,
1976.
En Suisse, Il a été démontré
qu'une infection dans les 2 premiers mois de gestation s'accompagne du retour
en chaleurs tandis que l'infection vers le 5e mois de gestation
s'accompagne d'avortement ou de naissance des veaux malformés
[RUFENACHT, 2001]. Il en est de même pour une
insémination de la vache infectée qui s'accompagne d'un
échec.
En France, la prévalence des Infectés permanents
immunotolérants est comprise entre 0 et 2 %, alors que les foetus
infectés seraient entre 8 et 20 %. Il faut donc supposer que l'infection
tue un grand nombre de foetus, ou de veaux après la naissance
[ARCANGIOLI et MAILLAIRD, 2006].
La BVD-MM est donc responsable des troubles de la
reproduction. Il s'agit des avortements (Photo 1), des mortinatalités et
des naissances des veaux infectés (Tableau III).

Photo 1: Avorton de BVD.
[Source: GDS, 2008]
Tableau III: Effet de la BVD chez les femelles
gestantes.
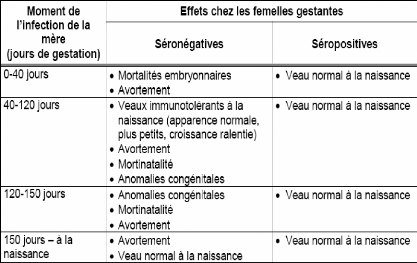
[Source: DESILETS A., 2003]
III.3.1.2.2. Rhinotrachéite Infectieuse Bovine
(IBR)
L'IBR est présente dans le monde entier [STRAUB,
1991] et près de 50% des cheptels de bovins adultes ont
déjà été en contact avec elle [SEAL,
2007].
Les avortements peuvent survenir à n'importe quel stade
de la gestation, mais plus fréquemment entre le 4ème
et le 8ème mois par suite de passage transplacentaire du
virus: le foetus est infecté et meurt par atteinte
généralisée de tous les organes. Les avortements peuvent
atteindre, dans un troupeau, un taux de 25 % à 60 % [YOUNGQUIST
et al., 2007]. L'infection des vaches durant le dernier
trimestre de la gestation peut conduire, en plus des avortements (Photo 2),
à des mortalités néonatales et des cas de mortalité
de veaux dans les 12 jours qui suivent la naissance.
En effet, si l'infection arrive sur une femelle gestante ne
possédant pas d'immunité contre le virus le foetus sera
infecté et l'avortement sera alors probable [YOUNGQUIST et
al., 2007].
Beaucoup d'auteurs ont rapporté l'existence de l'IBR
dans les élevages bovins africains. Ainsi, l'IBR a été
dépistée au Togo: 75% [ESPINASSE et al.,
1978], en Ethiopie: 41,8% [LEFEVRE, 1975] au
Sénégal oriental: 38%, en Casamance: 61% et dans le Ferlo: 48%
[BERNARD et BOURDIN, 1971], dans la région de
Thiès: 77,8% [HABIMANA, 2008].
Photo 2: Avorton dans l'IBR. [Source:
ROY, 2007]
III.3.1.2.3. Blue tongue
L'infection du foetus par le virus de la blue tongue demeure
exceptionnelle. Contractée avant le 150ème jour de
gestation, elle se traduit par de la momification, de l'avortement ou la
naissance de veaux présentant des lésions du système
nerveux central (hydrocéphalie) ou plus caractéristique un
excès de développement de la muqueuse sur les incisives.
III.3.1.2.4. Virus Akabane
Dans la famille des Bunyaviridae, le virus Akabane
est largement répandu en Afrique, au Moyen-Orient, en Asie, en Australie
et est responsable des avortements et des mortinatalités chez les bovins
en particulier [MARRIOTT et al., 2000].
III.3.1.3. Causes parasitaires
III.3.1.3.1. Mycoses (Tableau IV)
Les avortements mycosiques sont dus à la localisation
placentaire de champignons (Aspergillus, Mucor, etc) absorbés
par voie digestive à la suite d'ingestion d'aliments (fourrages,
ensilages) mal conservés ou moisis [HANZEN, 2004]. Ces
avortements mycosiques sont généralement sporadiques et ont lieu
plus tardivement (7ème- 8ème mois de gestation) (Photo 3 et 4).
Ils sont souvent suivis de rétention annexielle.
Tableau IV: Liste des agents de mycoses
abortives chez la vache

Photo 3: Avortement mycosique chez la vache
[Source: HANZEN, 2004]
Photo 4: Manifestation clinique de l'avortement
mycosique [Source: HANZEN, 2004]
III.3.1.3.2. Trichomonose
C'est une affection vénérienne des bovins due
à Trichomonas foetus, qui entraîne chez la vache une
inflammation utéro-vaginale inductrice d'infécondité, de
mortalité embryonnaire, d'avortement précoce et de
pyomètre. L'avortement est caractérisé par sa
précocité (1er- 2ème mois) et par la lyse
foetale (Photo 5).
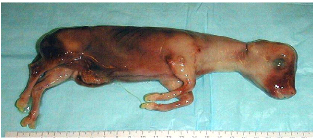
Photo 5 : Avorton de 2 mois dans la
Trichomonose. [Source: HANZEN, 2004]
III.3.1.3.3. Toxoplasmose
La toxoplasmose est une anthropozoonose de répartition
mondiale. Elle affecte l'homme et de nombreuses espèces animales
domestiques et sauvages. Elle est causée par Toxoplasma gondii,
protozoaire intracellulaire obligatoire capable de parasiter presque toutes les
cellules des animaux à sang chaud. Si une vache est contaminée
pendant la gestation, l'infection peut se traduire par un avortement (jusqu'
à 30 %) [HANZEN, 2004].
III.3.1.3.4. Néosporose
Elle est due à Neospora caninum et
caractérisée par les avortements (Photo 6) à trois (3)
mois de gestation jusqu' au terme; mais la majorité des avortements
surviennent entre 4 et 6 mois de gestation. Cependant dans une étude
californienne réalisée sur 170 cas, 30% des avortons ont entre 3
à 7 mois de gestation contre 78% qui ont entre 4 à 7 mois de
gestation [BRUGERE-PICOUX et al., 1998]. Ces
avortements ont été étudiés aussi bien sur des
troupeaux laitiers qu'allaitants.
Très récemment, une étude faite par
MUKAKANAMUGIRE (2008) a montré une prévalence de
16,92 % dans les exploitations bovines au Sénégal avec 45,4% des
avortons qui ont entre 3 à 7 mois de gestation contre 23,3% qui ont
entre 0 à 3 mois de gestation.

Photo 6: Manifestation clinique de
l'avortement: la momification
[Source: HANZEN,
2004]
Enfin, les mycoses, la trichomonose, la néosporose et
la toxoplasmose ne sont pas les seules affections parasitaires en cause dans
les avortements des bovins. Loin s'en faut car le rôle abortif des
trypanosomoses [DJABAKOU et al., 1985], de la
babésiose, et bien d'autres parasitoses sont tout aussi important
à considérer.
III.3.2. Causes non-biologiques
Les avortements non infectieux peuvent être dus à
des facteurs nutritionnels, chimiques, physiques, génétiques ou
iatrogènes.
III.3.2.1. Facteurs alimentaires
Dans les élevages africains, les troubles liés
aux performances de reproduction sont bien plus souvent causés par une
sous-alimentation que par une sur-alimentation. ENJALBERT
(2003) signale qu'une alimentation pauvre des vaches réduit le
taux de conception et augmente les avortements. Aussi, diverses publications
[PICARD et al., 2003a] ont rapporté des
avortements chez des animaux débilités ou consommant des rations
connues pour leur faible apport en énergie, en minéraux, en
oligoéléments et en vitamines.
III.3.2.1.1. Alimentation
énergétique
La fécondation paraît également sensible
à la glycémie et d'après LOISEL (1977),
la période critique se situe autour de l'insémination
(une semaine avant et deux semaines après). La carence
énergétique durant cette période s'accompagne d'une forte
mortalité embryonnaire précoce.
Pour qu'on observe des avortements, il faut une carence
très sévère, en particulier en fin de gestation.
D'autres auteurs mettent en évidence la relation entre
la note d'état corporel (NEC) et l'avortement. C'est le cas d'une
étude réalisée par LOPEZ-GATIUS et al.
(2002) portant sur les facteurs de risque d'avortement entre 30 jours
et 90 jours post insémination. Une perte d'état corporel
élevée entre le vêlage et trente jours (30jours)
post-partum autour d'une unité de NEC est associée à un
risque 2,4 fois plus élevé d'arrêt de gestation pendant la
période étudiée.
III.3.2.1.2. Alimentation azotée
Chez la vache, l'excès ou l'insuffisance d'apport de
protéines durant la gestation peut perturber la croissance foetale et
même atteindre la viabilité du foetus. HAURAY(2000)
montre que la carence azotée chez la vache est responsable
d'une diminution de la fertilité (Tableau V).
Tableau V: Fertilité et azote chez la
vache
|
Différence entre apports et besoins (g de MAD)
|
Taux de réussite en première IA
|
|
Inférieur à -200
|
43,0
|
|
de -200 à +200
|
72,0
|
[Source: HAURAY, 2000]
Cependant, plusieurs expériences montrent l'effet
abortif d'un excès azoté; ceci est particulièrement
possible lorsqu'il s'agit d'azote facilement dégradable, d'origine
végétale ou non protéique [HAURAY,
2000].
OLTJEN (1967) relate aussi des
avortements sur des vaches nourries avec des aliments à forte
concentration de protéines dégradables.
De même, MOUICHE
(2007a) montre que les vaches avortées avaient une
augmentation de la concentration en urée de 6,99#177;2,62mmol/l;
35ème jour post insémination artificielle, alors que
l'urémie plasmatique physiologique est comprise entre 3,8 et
6,5mmol/l.
III.3.2.1.3. Constituants minéraux et les
oligo-éléments
Une carence en minéraux ou en oligo-éléments
peut donc être responsable d'avortement; cependant, il faut que cette
carence soit très marquée.
+ Calcium et phosphore
Les métabolismes du calcium et du phosphore sont
intimement liés l'un à l'autre. Une augmentation du taux de
calcium gène l'assimilation du phosphore par l'organisme et provoque
donc une aphosphorose.
Cependant, une carence en calcium chez les vaches gestantes
provoque dans 50 à 60 % des cas d'avortements et de la
mortinatalité [KARABAGHLI, 1972]. De
même, FABIE (1983) montre qu'une aphosphorose est tenue
responsable, au moins en partie dans le déterminisme des troubles de la
reproduction en particulier les avortements.
+ Iode
Les besoins en Iode d'une femelle gestante sont de l'ordre de
0,4 à 0,8 mg/kg de matière sèche ingérée. Il
faut savoir que la thyroïde du foetus a besoin de cinq (5) fois plus
d'iode que celle de sa mère. C'est ainsi qu'une carence même
légère ne va pas affecter la mère, mais affectera le
foetus dans son développement et sa viabilité.
Il est bien évident que lors de carences
sévères, on observera à la fois des troubles chez le ou
les produits, mais également chez la mère [FABIEU,
1983]. SEIMIYA (1991) conclue qu'une carence en iode
durant la gestation provoque des avortements, de la mortinatalité et la
naissance de veaux faibles dans un troupeau.
+ Manganèse
Selon certains auteurs, la carence en manganèse serait
responsable d'avortements. Des observations de terrain ont été
effectuées dans les différents pays, aux Etats- Unis, des
avortements ont été observés sur des vaches pâturant
sur des prairies pauvres en manganèse [KARABAGHLI, 1972];
toujours aux Etats-Unis, des génisses nourries avec un aliment
contenant 1 0ppm(poids pour mille) de manganèse dans la matière
sèche présentent des retards à la puberté, une
altération des cycles, des chaleurs silencieuses, des avortements et une
baisse de lactation; en Hollande, des observations similaires ont
été faites; en France, de fréquents avortements ont
été observés sur des vaches pâturant en zone
carencée en manganèse, et le problème a été
résolu en quelques mois grâce à une supplémentation
en sulfate de manganèse [HAURAY, 2000].
+ Cuivre et Molybdène
La reproduction peut être altérée lors de
carence en Cuivre. Des chaleurs silencieuses, discrètes ou
retardées, des taux faibles de réussite en IA,
irrégularité des cycles, anoestrus ou suboestrus, des
mortalités foetales sont autant de signes d'appel peu spécifiques
d'une carence en Cu primaire ou secondaire à un excès en
Molybdène [ENNUYER et REMMY, 2008].
Le mode d'action de cette carence est encore peu connu. Elle
empêcherait la nidation et/ou favoriserait l'inflammation du tractus
génital et/ou provoquerait des avortements.
+ Zinc
Chez la vache, la carence en Zinc peut se manifester à
tous les stades de la reproduction [UNDERWOOD et SUTTLE,
1999]. On notera qu'une carence en Zinc même marginale est un
facteur de risque, d'avortements, de rétention placentaire, de
métrites et de fertilité amoindrie [ENJALBERT et
al., 2006].
+ Plomb
Le plomb est le plus universellement répandu des
métaux toxiques. La modalité d'intoxication la
plus fréquente est l'intoxication aigue due à la consommation ou
au léchage des objets étrangers, comme des particules de terre ou
des écailles de vieilles peintures sur les murs. La toxicité du
plomb est augmentée par des facteurs nutritionnels comme les
déficiences en protéines et en vitamines C et D.
L'intoxication est caractérisée par des troubles
nerveux centraux, des troubles de la reproduction, principalement par sa
toxicité pour les gamètes mâles et femelles, d'où
l'apparition de stérilité, d'avortements et de morts
néonatales [IARC, 1980].
III.3.2.1.4. Vitamines
+ Vitamine A
Une carence en vitamine A chez la femelle gestante est donc
caractérisée sur le plan clinique par la mortalité
embryonnaire, des avortements cliniques, la naissance des veaux non viable ou
malformés et fréquemment des rétentions placentaires. Ces
troubles sont accompagnés au niveau hormonal par une diminution de la
taille des corps jaunes, une diminution de concentration de progestérone
sérique pendant les cycles et à la mise bas.
+ Vitamine K
La vitamine K est activement synthétisée par la
flore intestinale; la carence ne s'observe que lors d'affections graves du tube
digestif ou lors d'insuffisance d'apport dans l'alimentation. L'avitaminose se
traduit par des hémorragies multiples, notamment au niveau du placenta,
et peut donc entraîner l'avortement.
III.3.2.1.5. Intoxications végétales
+ Plantes à effets oestrogèniques
De nombreuses plantes produisent des composés, comme
les isoflavones ou le coumestrol, qui possèdent une activité
oestrogénique, d'où le terme de phytooestrogènes
[ARQU I E, 2006].
De nombreux auteurs relatent que les phytooestrogènes
sont responsable d'une importante diminution des performances de reproduction
chez les animaux. Ce sont principalement les légumineuses
fourragères qui contiennent les phytooestrogènes notamment la
luzerne (Medico sativa), les trèfles blanc (Trifolium
repens), les trèfles souterrain (Trifolium subterranum) et
violet (Trifolium pratens, etc.).
Les phytooestrogènes sont des molécules dont la
structure chimique leur permet, après transformation ou non en
métabolites, de se fixer sur les récepteurs à
oestradiol.
Du point de vue pathogénique, les
phytooestrogènes agissent en perturbant l'équilibre du rapport
oestrogène/progestérone. Elles rendent donc la fécondation
difficile, ce qui est à l'origine des avortements chez les animaux
[KARABAGHLI, 1972].
+ Plantes à effets
antithyroïdiens
Les substances antithyroïdiennes d'origine
végétale sont quasiment caractéristiques de la famille des
crucifères (colza: Brassicus napus, le chou, etc....).
Les substances antithyroïdiennes contenues dans ces végétaux
sont des hétérosides soufrés ou glucosinolates. En effet,
ces substances ralentissent la croissance en diminuant la consommation
d'oxygène par les tissus et le métabolisme de base d'une part, et
d'autre part elles provoquent une perturbation de l'équilibre hormonal
mère-foetus et sont donc susceptibles d'entraîner l'avortement
[LE COZ, 1991].
+ Plantes et nitrates
L'intoxication par les nitrates réduits en nitrites
dans le rumen, par la flore ruminale, est possible en cas d'épandages
mal conduits en période de croissance rapide de plantes, et
l'utilisation irrationnelle de ces plantes dans l'alimentation animale
[TAINTURIER et al.,1996]. Il s'agit principalement de
plantes fourragères et plantes adventices susceptibles de concentrer
aisément les nitrates (Annexe 2).
L'intoxication chez la vache est caractérisée
surtout par l'avortement résultant de l'anoxie foetale,
conséquence de la transformation de l'hémoglobine en
méthémoglobine [LE COZ, 1991].
+ Intoxications par des végétaux
adventices
La consommation accidentelle de certaines espèces
végétales a également été rendue responsable
d'avortement quoique leur principe actif n'ait point toujours été
identifié. Ainsi en est-il du radis sauvage (Raphanus
raphanistrum), de cyprès (Cupressus macrocarpa),
d'indigotier (Indigo fera spicata), de diverses variétés
de pins (Pinus ponderosa, Pinus cubensis, Pinus
radiata).
SHORT et al. (1991) montrent que le
taux d'avortement est beaucoup plus élevé quand ces plantes sont
ingérées en grande quantité: 80, 90 et 100% chez les
animaux nourris respectivement de 0,7kg; 1,7kg et 2,4kg.
III.3.2.2. Facteurs physiques
La palpation manuelle de l'utérus entre le
35ème et le 60ème jour de gestation,
l'insémination ou l'irrigation d'un utérus gestant, la
présence de jumeaux, le transport, les interventions chirurgicales, des
coups ou des chutes dans des bâtiments èxigus, la torsion de
l'utérus et le déplacement du cordon ombilical,
températures ambiantes élevées constituent autant de
facteurs pouvant être responsables d'avortements [COSTARGENT,
1984].
III.3.2.3. Facteurs iatrogènes
Diverses substances sont connues pour leur effet abortif. Il
s'agit de: oestrogènes en début de gestation, corticoïdes en
fin de gestation, prostaglandines naturelles ou synthétiques entre le
40ème et le 150ème jour de gestation, les
purgatifs, la phénothiazine, les dérivés du benzimidazole,
les organophosphorés, etc
III.3.2.4. Effet race
Très récemment, une étude faite par
BADAI (2008) a montré que la race influence
significativement le taux d'avortement (P<0,005). Le taux le plus
élevé est noté chez la Holstein avec 16,3%. La
métisse Montbéliarde, la métisse Holstein, la Goudali et
la Charolaise ont un taux d'avortement respectivement de 5,3%; 3,2%; 5,1%;
7,7%. La figure 17 montre le taux d'avortement en fonction des races.
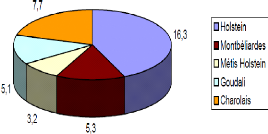
Figure 17: Taux d'avortement en fonction des
races [Source: BADAI, 2008].
III.2.4. Moments d'apparition des avortements
Dans la majorité des cas, l'expulsion de l'avorton sera
observée au cours du dernier tiers de la gestation. Cette règle
souffre d'exceptions. Le tableau VI montre le moment d'apparition des
avortements en fonction des agents responsables chez les bovins.
Tableau VI: Moments préférentiels
d'apparition de l'avortement dans l'espèce bovine

ME: Mortalité embryonnaire; A: Avortement

[Source: HANZEN, 2008b]
Dans cette première partie qui est consacrée
d'une part aux mécanismes physiologiques de la gestation, et d'autre
part aux facteurs étiologiques des avortements chez les bovins, il en
ressort que le développement embryonnaire est une suite
d'événements chronologiques orchestrés de façon
précise par différents hormones. Un certain nombre
d'étapes y sont cruciales et des erreurs à ces stades du
développement peuvent être fatales pour l'embryon. Le
développement embryonnaire relève en plus d'un ajustement aussi
bien morphologique qu'hormonal et nutritionnel entre l'embryon et son
environnement maternel. Ainsi, toute perturbation de cet équilibre
s'accompagne soit de mortalité embryonnaire ou avortement clinique
Les facteurs à l'origine de ces perturbations ont
été développés respectivement dans le chapitre II
et III de cette première partie. Il en ressort que les facteurs
biologiques surtout les maladies abortives, et les facteurs alimentaires sont
les principales sources des avortements dans les élevages bovins.
A la lumière de ces notions, il nous paraît
important d'aborder dans la seconde partie de ce travail, les méthodes
de diagnostic et stratégies de lutte contre les avortements au sein de
l'élevage bovin.
|
DEUXIEME PARTIE:
METHODES DE DIAGNOSTIC ET
STRATEGIES DE LUTTE CONTRE
LES AVORTEMENTS
|

CHAPITRE I: METHODES DE DIAGNOSTIC
DES
AVORTEMENTS
La quantification des avortements dans l'espèce bovine
n'est pas une chose aisée [HANZEN et al.,
1999a]. Il faut y voir le manque d'harmonisation de sa
définition et donc de la période considérée mais
également l'emploi de méthodes aussi différentes que
l'abattage des animaux, la récolte d'embryons, les dosages hormonaux, la
palpation transrectale ou l'échographie [POLL,
2007].
La méthode d'étude de la mortalité
embryonnaire par abattage des animaux est utilisée uniquement dans les
études expérimentales et n'est pas la technique employée
en pratique sur le terrain pour des raisons économiques
évidentes. Cependant, il s'agit de la méthode la plus fiable pour
étudier les échecs de fécondation et la mortalité
embryonnaire [AYALON, 1978]. De nombreux signaux sont
émis par le conceptus dès le premier mois de gestation mais
certaines molécules (cytokines, facteurs de croissance,
progestérone) ne sont pas spécifiques de la gestation
[POLL, 2007].
En outre, parmi les molécules spécifiques de
l'activité embryonnaire, certaines ne passent pas dans la circulation
périphérique maternelle et ne peuvent donc pas être
utilisées pour établir un constat de gestation. En effet, les
protéines embryonnaires, telles que l'IFNô, responsables du
maintien du corps jaune, restent localisées dans la cavité
utérine [PICARD-HAGEN et al., 2003a].
Ainsi, le diagnostic des avortements relève le plus
souvent de l'association de méthodes de diagnostic de nature hormonale,
échographique, palpation transrectale ou simple notation du retour en
chaleur de l'animal (figure 18).
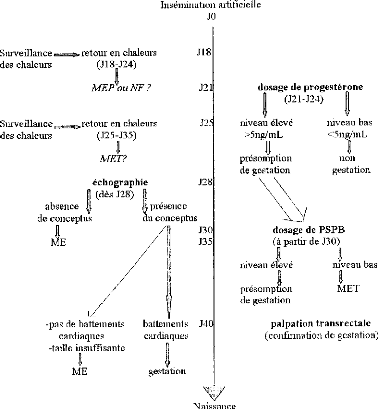
Figure 18: Conduite à tenir face à
des mortalités embryonnaires dans un troupeau.
[source: PICARD-HAGEN et al.,
2003b]
I.1. Méthodes biochimiques
I.1.1. Dosage de la progestérone
Le dosage de la progestérone consiste à estimer
sa concentration dans le sang ou dans le lait 21 à 24 jours après
l'insémination artificielle. La mesure de concentration de la
progestérone se fait par la méthode radio-immunologique; les
vaches suspectées gestantes ont un taux de progestérone qui se
maintient à un niveau supérieur à 1ng/ml dans le sang et
3,5ng/ml dans le lait [HASKOURI, 2001]. En effet, le dosage de
la progestérone permet de déterminer l'état physiologique
des femelles et de faire le diagnostic des avortements au sein du troupeau.
I.1.1.1. Détermination de l'état
physiologique des femelles
L'analyse des concentrations de la progestérone
plasmatique ou sérique périphérique permet de
déterminer l'état physiologique des femelles. En effet, la
concentration de la progestérone varie selon l'état physiologique
de la femelle. Le tableau VII montre la relation entre la
progestéronémie et l'état physiologique d'une femelle.
Tableau VII: Progestéronémie et
état physiologique d'une femelle
|
Moment du
prélèvement
|
Progestéronémie
|
Etat physiologique
|
|
Quelconque(1)
|
>0,5ng/ml
|
Cycle (phase lutéale)
ou gravide (2)
|
|
Un cycle après
insémination
|
<0 ,5ng/ml
|
Cyclique (période pré- ovulatoire) ou
anoestrus
|
|
<1ng/ml
<2ng/ml
|
Non gravide
|
|
>1ng/ml
>2ng/ml
|
Gravide (2)
|
|
(1) un seul prélèvement est insuffisant pour
déterminer l'état
physiologique
(2)Eventuellement corps jaune persistant (pseudo-gestation)
|
[Source: THIMONIER, 2000]
En pratique, une insémination en phase lutéale
peut être évitée par un dosage de la progestérone
juste avant l'insémination: si la concentration en progestérone
est élevée la vache est en phase lutéale et
l'insémination doit être reportée. Considérant que
l'exactitude des résultats positifs (nombre de femelles mettent
bas/nombre de positifs) n'est que de 70-75%, cela signifie qu'un pourcentage
important de vaches présentent une activité lutéale entre
J21et J24 mais ne mettent pas bas.
Ainsi, il est intéressant d'effectuer un diagnostic de
confirmation de gestation par dosage de PSPB, et/ou échographie, et/ou
palpation transrectale.
I.1.1.2. Diagnostic de mortalité
embryonnaire
Comme dans d'autres espèces domestiques, la
progestérone est, chez la vache, essentielle au maintien de la
gestation, une augmentation de la progestéronémie étant
favorable au développement de l'embryon [GEISERT et
al., 1992].
Diverses études expérimentales et essais
thérapeutiques sont venus confirmer la relation entre la
progestéronémie et le risque d'une mortalité embryonnaire.
Une association significative entre une faible concentration en
progestérone au cours de la phase périovulatoire et le taux de
survie embryonnaire a été observée chez la vache
[LEE et AX,1984].
Selon HANZEN (2008a), la concentration en
progestérone 21 à 24 jours après l'insémination est
inférieure chez les animaux qui présentent ultérieurement
une mortalité embryonnaire que chez les animaux gestants.
Afin d'estimer la fréquence de mortalité
embryonnaire précoce ou non fécondation l'observation des retours
en chaleurs n'est pas suffisante. Il est nécessaire de connaître
les concentrations de progestérone.
Le dosage s'effectue par des méthodes
radio-immunologiques ou des tests ELISA, sur les prélèvements
réalisés à J0, J21-24 après
l'insémination, moment où le résultat est différent
si l'animal est gravide ou non. La concentration inférieure à 1
ng/ml dans le sang ou inférieur à 3,5ng/ml dans le lait, indique
l'absence du corps jaune et par conséquent exclut l'hypothèse de
la gestation [POLL, 2007].
Ainsi, la mortalité embryonnaire précoce peut
être établie avec certitude si les dosages le jour de
l'insémination (J0) et celui réalisé à
J21 révèlent tous deux de faible concentrations en
progestérone (<3ng/ml à J0 et < 5ng/ml à J21).
La fréquence d'animaux non fécondés,
parmi ceux qui ont une concentration faible en progestérone, est peu
élevée et représente un facteur de biais incontournable
pour identifier les mortalités embryonnaires précoces.
En effet, les méthodes fondées sur le dosage de
signaux de reconnaissance maternelle très précoces, qui
permettraient d'identifier tôt les femelles fécondées ne
sont pas encore fiables. D'après HUMBLOT (2003), 30
à 50 % des vaches subissant une mortalité embryonnaire
précoce ne présentent pas de chaleurs au moment attendu, à
21-24 jours après insémination.
L'absence de gestation n'est détectée qu'au
cycle suivant, parfois même après plusieurs cycles. En absence de
dosage de la progestérone chez les animaux fécondés, qui
permettrait de révéler précocement l'état de non
gestation, la fréquence des mortalités embryonnaires
précoces est sous évaluée, et celle des mortalités
embryonnaires tardives est surestimée. La fréquence de MEP ou non
fécondation est de 20,5% à 43,6% et celle de mortalité
embryonnaire tardive est de 8 à 17,5%.[HUMBLOT,
2001].
L'essentiel de la mortalité embryonnaire étant
précoce, les dosages de progestérone présentent donc un
intérêt majeur. Un niveau élevé de
progestérone à J21 précédé d'un
niveau bas à J0 ne permet pas de dire avec certitude que la vache est
gravide. En effet, ce niveau élevé peut déterminer soit un
état de gestation, soit le maintien d'un corps jaune
sécrétant au 21ème jour (et donc en
réalité de la mortalité embryonnaire tardive)
[HUMBLOT, 2003].
Pour finir, le dosage de la progestérone est souvent
mitigé et considéré comme un diagnostic de non gestation
parce que dans certains cas, la forte concentration de la progestérone
peut-être due uniquement à une présence éventuelle
de kystes ovariens car ceux-ci sécrètent une quantité non
négligeable de progestérone [THIMONIER,
2000].
Outre ce problème, cette technique présente
d'autres contraintes à savoir la nécessité de
connaître le jour de l'insémination; il est impérativement
nécessaire de centrifuger le sang dans l'heure qui suit le
prélèvement parce que la vache a la particularité d'avoir
une enzyme (5-alpha-réductase) qui dégrade rapidement la
progestérone en un métabolite qui ne croise pas avec la RIA.
I.1.2. Dosage des Protéines Associées
à la Gestation (PAGs)
I.1.2.1. Diagnostic de gestation
L'étude réalisée par GOURO
en 1980 montre que les résultats sur le dosage
de la progestérone apportent très peu d'information sur les
relations foeto- maternelles. De plus, le dosage de la progestérone
comme diagnostic de gestation est souvent mitigé à cause de la
présence éventuelle de corps jaunes persistants. L'application du
dosage de la PAG et sa concentration peuvent refléter la
viabilité foeto-placentaire pour le diagnostic précoce de
gestation sur les bovins [TAINTURIER et al.,
1996].
Les PAGs sont de bons marqueurs de la gestation du fait
qu'elles sont stables dans le sang maternel, d'où leur
intérêt dans le diagnostic de gestation. En pratique, les
prélèvements sont réalisés à 35 jours
après l'insémination et à ce moment le seuil de
positivité est de 0,5 à 0,8ng/ml. Cette technique s'est
avérée très intéressante du fait de nombre
d'informations qu'elle fournit [SOUSA et al.,
2003].
Le diagnostic de gestation par dosage des PAGs présente
cependant un inconvénient majeur, puisqu'il n'est pas applicable aux
vaches n'ayant pas plus de 120 jours post-partum [DELAHAUT et
al., 1999].
Ceci s'explique par le fait qu'il existe une quantité
résiduelle des PAGs après la parturition comme l'a montré
la courbe de la cinétique des PAGs post-partum (Figure 7, page 22).
Ainsi, la période nécessaire pour que la PAG devienne
indétectable dans la circulation maternelle semble être due
à une longue demi-vie de cette glycoprotéine allant de 7,3
à 8,4 jours [SASSER et al., 1986].
I.1.2.2. Diagnostic des avortements
La détermination des concentrations en PAG par RIA dans
le sérum ou dans le plasma est actuellement employée comme
méthode sérologique spécifique pour le diagnostic de
gestation chez le bovin dès le 28ème jour après
la conception. Au-delà de ce délai, les dosages des PAGs peuvent
également être utilisés pour assurer le suivi de la
gestation notamment dans le cadre de l'étude de la mortalité
embryonnaire précoce ou tardive et de la mortalité foetale
[HUMBLOT et al., 1988 ; MIALON et al., 1993; SZENCI
et al., 2000].
Depuis quelques années, des investigations ont
porté sur l'étude des mortalités embryonnaires
après insémination artificielle, saillie naturelle ou transfert
d'embryon [BREUKELMAN et al., 2005]. Dans ces
études, des approches simultanées ont été
utilisées: les dosages de progestérone et de PAG et un suivi par
examen ultrasonographique. Ces études rapportent que les concentrations
en PAG chutent chez des vaches dont la gestation a été
initialement diagnostiquée par échographie comme positive et
ensuite négative suite à une mortalité embryonnaire ou
foetale [SOUSA et al., 2003].
Le dosage des protéines associées à la
gestation permet donc d'envisager des études sur la mortalité
embryonnaire précoce et l'avortement en vue d'en déterminer la
période et l'époque à laquelle ils surviennent.
Ainsi, le suivi de la gestation et l'étude des
avortements, ont fortement évolué grâce au
développement de différents systèmes de dosage RIA-PAG
homologues [HUMBLOT et al., 1988; ZOLI et al.,
1991] et hétérologues [PERENYI et al.,
2002; AYAD et al., 2007].
Les systèmes RIA homologues (RIA PAG, PSPB, PSP60) ont
été les premiers à être utilisés pour le
dosage de protéines associées à (ou spécifiques de)
la gestation chez la vache aussi bien sur des échantillons de
sérum et de plasma [ZOLI et al., 1991; MIALON et
al.,1994] qu'expérimentalement dans le lait
[METELO et al., 2002].
Quant aux systèmes hétérologues, ils ont
été développés plus récemment à
partir de l'utilisation de différents antisérums produits contre
différentes formes de PAG caprines et ovines.
Deux antisérums anti-PAG caprine (AS#706:
caPAG55+62; AS#708: caPAG55+59) ont
été utilisés avec succès pour le diagnostic de
gestation et pour l'étude de la mortalité embryonnaire
précoce chez la vache [PERENYI et al., 2002, AYAD
et al., 2007]. Chez la vache gestante, les concentrations en
PAG sont détectables au plus tôt à partir des 1
9-22ème jours après conception pour atteindre des
concentrations de 3 à 6 ng/ml aux alentours des
33-37ème jours de gestation. Par contre, lors des
avortements, la concentration de ces protéines chutent brutalement
[PERENYI et al., 2002, AYAD et al., 2006].
De même, une étude réalisée par
MOUICHE (2007a) montre que l'augmentation de la concentration de PAGs
chez les vaches gestantes et avortées de J0 (0,44 #177; 0,57 et 1,36
#177; 2,84 ng/ml) à J35 (4,7#177; 6,66 et 7,33
#177;5,77ng/ml) est significative (p< 0,05).
D'un point de vue pratique, cela signifie que cette
protéine est détectable dans la circulation
périphérique maternelle chez 98 à 99,2 % de femelles
gravides à partir du 30ème jour après la
conception [LOPEZ GATIUS et al., 2007].
Ainsi, le dosage des PAGs chez les bovins est effectué
à partir de prélèvements sanguins réalisés
plus de 30 jours après l'insémination à condition que
l'intervalle vêlage/insémination ait été
supérieur à 70 jours. L'exactitude des résultats positifs
est de 90% et celle des résultats négatifs est de 99,5%
[PICARD-HAGEN et al., 2003b].
Selon le même auteur, en cas de mortalité
embryonnaire précoce, des concentrations de PAG seront
détectées à J30 dans moins de 3% des cas.
HUMBLOT (2003) précise aussi que cette
protéine est habituellement non détectable lorsqu'elle est
quantifiée entre J24 et J30 en cas de
MEP. En revanche, en cas de mortalité embryonnaire tardive, des
concentrations de PAG inferieures à celles des animaux gestants peuvent
être détectées 30 jours après l'insémination
chez 20 à 30 % des femelles gestantes.
La figure 19 et 20 montrent les profils des concentrations
plasmatiques en PSPB pour une vache gestante et une vache ayant subi de la MEP
et MET.
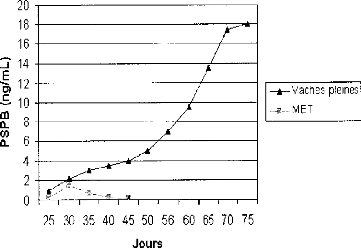
Figure 19: Profils des concentrations en PSPB
lors de gestation normale et de
mortalité embryonnaire tardive.
[Source: HUMBLOT, 2001]
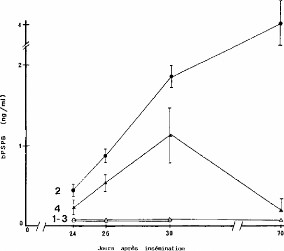
Figure 20: Concentration plasmatique de la PSPB
chez des femelles(1) ayant présenté une MEP ou
une NF; (2) gestantes et une MET sans(3) ou
avec sécrétion de
PSPB(4).[Source: HUMBLOT,
2001].
I.1.3. Utilisation conjointe des dosages de
progestérone et PAGs
Cette combinaison permet de différencier les cas de MEP
et MET. Il n'est cependant pas possible de faire la distinction entre non
fécondation (NF) et MEP, car, dans les deux cas, la concentration de
progestérone (P4) à J21-24 est faible et le constat de
gestation à J30-35 est négatif [PONSART et
al., 2003].
En pratique, des concentrations de progestérone
élevées 21-24 jours après insémination
associées à des concentrations en PAG faibles à 30 jours
déterminent une interruption de gestation en période
embryonnaire. Cependant, différentes configurations existent et sont
rapportées dans le tableau VIII.
Tableau VIII: Correspondance entre
différentes situations après IA et les résultats des
dosages de progestérone et PAGs
|
Progestérone à
J0
|
Progestérone à
J21-24
|
PSPB
à J35-35
|
Gestation à J60
|
Diagnostic
|
|
élevée
|
Élevée
|
non détectée
|
non détectée
|
Vache
inséminée à
un mauvais
moment
|
|
Faible
|
faible
|
non détectée
|
non détectée
|
MEP ou NF
|
|
Faible
|
Élevée
|
non détectée
|
non détectée
|
MET Avortement
|
|
Faible
|
Élevée
|
détectée
|
non détectée
|
MET Avortement
|
|
Faible
|
Élevée
|
détectée
|
Détectée
|
Gestation
|
[Source: GARES, 2003]
Il ressort de ce tableau que les vaches sont dites gestantes
lorsque la concentration en P4 est <3,5ng/ml à J0 et >5ng/ml entre
J21-J24, PAGs détectée à J35, puis
la palpation transrectale positive par la suite.
La mortalité embryonnaire précoce sera
invoquée lorsque: P4<5ng/ml entre J21-J24, puis ultérieurement
non gestante (retour en chaleur ou palpation transrectale).
La MET sera invoquée lorsque P4<3ng/ml à J0,
P4>5ng/ml entre J21 et J24 mais
déclarée non gestante après dosage de PAGs ou palpation
transrectale [PINTO et al.,
2000].
Compte tenu du fait que chez la vache gestante, la
concentration en progestérone et PAGs sont élevées pendant
toute la durée de la gestation; la détermination des avortements
cliniques peuvent s'effectuer par leurs dosages dans le sang car ces
avortements sont suivis d'une chute de concentration de ces hormones dans le
sang [GAYRARD, 2007].
Très récemment, une étude faite par
MUMPOREZE (2007) montre que sur les 35 vaches
diagnostiquées gestantes à J35 post IA, 8 ont
été diagnostiquées négatives aux dosages (P4 et
PAG) et à la palpation au 60ème jour post IA. Elles
représentent 22,85% et correspondent aux avortements; cela montre que
l'inséminateur avait réussi sa prestation à plus de 52,94%
(Figure 21 et 22).
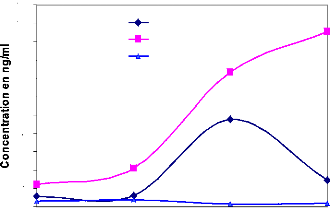
11
10
9
8
Avortées Gestantes Négatives
7
6
5
4
3
2
1
0
PAG J0 PAG J21 PAG J35 PAG J60
Jour de Prélèvements
Figure 21: Concentrations moyennes de
progestérone durant les prélèvements.
[Source: MUMPOREZE, 2007]
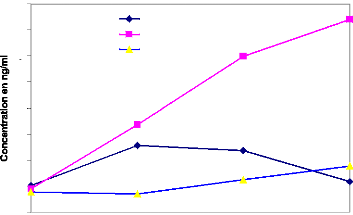
8
6
7
Avortées Gestantes Négatives
5
4
3
2
1
0
P4 J0 P4 J21 P4 J35 P4J60
Jour de prélèvements
Figure 22: Concentrations moyennes de PAGs
durant les prélèvements
[Source:
MUMPOREZE, 2007].
I.1.4. Early pregnancy factor
De nature glycoprotéique, l'Early Pregnancy Factor
(EPF) encore appelé Early Conception Factor apparaît quelques
heures après la fécondation dans le sang de la plupart des
espèces animales dont la vache [NANCARROW et
al.,1981], la truie [MORTON et al.,
1983], et la brebis [CLARKE et al., 1980]Ce
facteur existe en fait sous deux formes: l'une sécrétée
par l'ovaire ipsilatéral à la corne gestante (EPF-B)
[NANCARROW et al.,1981] et l'autre
synthétisée par l'oviducte (EPF-A) [MORTON et
al., 1980].
La détermination de sa concentration constituerait un
bon moyen d'identification des avortements si ce n'était le manque de
reproductibilité de son évaluation plasmatique, imputable au fait
qu'elle est influencée par de nombreux facteurs biologiques. Le dosage
de l'EPF permettrait d'identifier les vaches non-gestantes entre le
6ème et le 20ème jour suivant
l'insémination à partir d'un prélèvement de lait et
entre le 6ème jour et le 90ème jour suivant
l'insémination à partir d'un prélèvement de sang
[MORTON et al., 1984, OROZCO et al.,
1986].
I.1.5. OEstrogènes
Le placenta est une source importante d'oestrogènes.
Chez les ruminants, leur synthèse est faible au cours de la
première moitié de la gestation. Ils sont détectables
dès le 30ème jour de gestation dans le liquide
amniotique et le 50ème jour dans le liquide
allantoïdien. Le dosage des oestrogènes dans le lait est possible
à partir du 11 0ème jour de gestation. Sa
concentration constituerait un bon moyen de diagnostic de gestation et
d'interruption de gestation chez les ruminants [POLL,
2007].
I.2. Moyens paracliniques
I.2.1. Diagnostic échographique (Tableau
IX)
I.2.1.1. Diagnostic de gestation
En fonction du matériel utilisé et des
fréquences d'ultrasons, la date à laquelle un diagnostic de
gestation positif peut être affirmé varie. Avant 25 jours, le
diamètre transversal de l'allantochorion et de la vésicule
amniotique sont trop réduits pour que la vésicule embryonnaire
remplie de liquide soit visible. Le diagnostic peut être aisément
réalisé à partir du 28ème jour.
L'embryon apparaît alors sous la forme d'une petite tâche claire
dans une poche liquidienne. Les battements cardiaques sont visibles dès
J26-29 A ce stade, un diagnostic positif peut être pris en
compte. En revanche, si le résultat est douteux, un nouveau
contrôle échographique doit être réalisé une
semaine plus tard.
I.2.1.2. Diagnostic de mortalité
embryonnaire
A l'examen échographique, la mortalité
embryonnaire peut être mise en évidence avec certitude à
partir de 28-30 jours, date à laquelle l'embryon devient normalement
visible. Le diagnostic repose sur la mise en évidence de la
vésicule embryonnaire ou de l'embryon à un stade donné
lors d'un premier contrôle échographique et par la suite sur
l'absence de gestation lors d'un second contrôle.
Une étude faite par HANZEN et LAURENT
(1991), sur l'évaluation de l'incidence de la mortalité
embryonnaire dans l'espèce bovine, a montré que
l'échographie permet d'objectiver la prévalence de la
mortalité embryonnaire tardive en élevage bovin et, lors
d'examens répétés, d'en étudier la
pathogénie.
Plusieurs signes échographiques peuvent faire suspecter
une mortalité embryonnaire (Figure 23), notamment:
s" le diamètre maximal des zones anéchogènes
est inférieur à celui attendu pour le stade de gestation
supposé;
s" l'embryon est en pleine dégénérescence
(image moins échogènes qu'habituellement) voire introuvable ou
semblant désorganisé;
s" l'absence de battements cardiaques constitue le signe le
plus évident d'une mortalité embryonnaire. Celle-ci est
habituellement précédée d'une diminution de battements
cardiaques (200 à 150-100 battements par minute);
s" éventuellement, des débris plus
échogènes sont observés en suspension dans les
liquides.
Ainsi, pour permettre un diagnostic de mortalité
embryonnaire cette technique nécessite des examens échographiques
répétés pour surveiller le développement et la
viabilité de l'embryon.
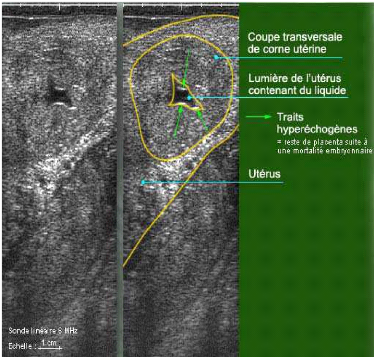
Figure 23: Mortalité embryonnaire 45
jours post insémination artificielle. [Source:
HANZEN et LAURENT, 1991]
I.2.2. Effet Doppler
C'est une méthode assez sûre pour poser un
diagnostic de gestation ou des avortements à partir du
4ème mois de gestation après l'insémination.
Elle est considérée comme une méthode assez chère
ne pouvant pas être à la portée de tous les éleveurs
africains. Cependant, l'effet Doppler permet de percevoir les battements
cardiaques du foetus. Pour cela l'absence de battements cardiaques constitue le
signe le plus caractéristique d'un avortement. Ainsi, l'étude
réalisée par HANZEN et al.
(1999a) relate une diminution des battements cardiaques de 200
à 150-1 00 battements par minute quelques jours avant la mort de
l'embryon.
I.3. Moyens cliniques
I.3.1. Palpation transrectale (Tableau IX)
Le diagnostic de gestation est fondé sur
l'identification d'une distension de la corne par les liquides, sur les
glissements des membranes annexielles ou sur la palpation de la vésicule
amniotique. L'accroissement précoce de la taille de l'utérus et
surtout de la corne gravide le rendant alors asymétrique est surtout
perceptible chez les primipares. L'asymétrie peut être nulle ou
négligeable les deux premiers mois de gestation chez les multipares. Une
modification de consistance des cornes est le premier signe de gestation
perceptible.
Néanmoins, une corne vide est de consistance charnue
alors qu'une corne gravide présente à partir du
35ème - 45ème jour une consistance
fluctuante due à l'accumulation de liquides dans la lumière
utérine.
I.3.2. Surveillance des chaleurs
Au niveau du troupeau, le critère global analysé
est le retour en chaleurs régulier ou irrégulier. En effet,
suivant le moment où la vache revient en chaleurs par rapport au jour de
l'insémination, il sera possible d'avoir déjà une
présomption d'un type de mortalité embryonnaire plutôt que
l'autre.
En cas de mortalité embryonnaire précoce, la
durée de cycle sexuel n'est pas modifiée. Si un retour en
chaleurs a lieu, il se fait alors entre le 1 8ème et le
24ème jour après la mise à la reproduction.
Cependant, cela ne permet pas de dire s'il ya eu non fécondation ou
mortalité embryonnaire précoce. Au contraire, lors de
mortalité embryonnaire tardive, l'embryon a eu le temps d'émettre
un signal anti-lutéolytique.
Ainsi, la lutéolyse et l'ovulation suivante se produisent
plus tard qu'au cours d'un cycle normal.
Généralement les retours en chaleurs s'observent
alors entre le 25ème et 35ème jour suivant
l'insémination. Dans ce cas une forte présomption de
mortalité embryonnaire tardive existe, si toute fois la vache mise
à la reproduction était bien en oestrus au moment de
l'insémination et la détection des chaleurs efficace. Cependant,
en raison des difficultés dans la détection des chaleurs, les
deux types de mortalité peuvent être facilement confondus si l'on
se base uniquement sur l'observation des retours en chaleurs.
Selon AYALON (1978), l'allongement des
intervalles entre l'insémination et le retour en chaleur ne doit en
aucun cas être retenu comme la principale preuve de l'existence de
mortalité embryonnaire. Ce même auteur précise que la
spécificité de détection des retours en chaleurs est
élevée en moyenne dans les élevages (90 à 95 %)
mais de grands écarts existent d'une exploitation à l'autre, par
contre la sensibilité de détection des retours est en revanche
très faible (50% en moyenne).
Tableau IX: Fréquence de la
mortalité embryonnaire tardive déterminée par
échographie et par palpation manuelle.
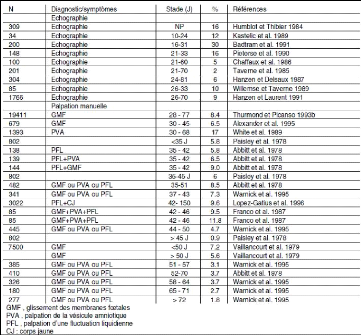
[Source: HANZEN, 2008b]
|
CHAPITRE II: STRATEGIES DE LUTTE CONTRE LES
AVORTEMENTS
|
Les faibles taux de gestation et les taux de d'avortements
plus élevés peuvent entraîner des pertes importantes pour
les éleveurs. L'investigation de ce problème est difficile car sa
cause sous-jacente apparaît souvent quelque temps avant qu'il ne soit
reconnu et il existe en général très peu de renseignements
diagnostiques. Très souvent, des vaches non gestantes et des taureaux
suspects sont vendus avant que l'on réalise l'ampleur du problème
ou que des échantillons de laboratoire soient prélevés.
Dans d'autres cas, les renseignements peu nombreux sur le troupeau peuvent
limiter le succès de l'investigation [GDS, 2008].
Malgré ces frustrations, les mesures de lutte contre les avortements
doivent essentiellement passer par la maîtrise de tous les facteurs
abortifs. Ces mesures sont principalement de nature offensive, mais aussi
défensive.
II.1. Mesures de lutte offensive
II.1.1. Mesures thérapeutiques
Différentes stratégies thérapeutiques ont
été développées pour parer à une
éventuelle perturbation de différentes étapes du
développement embryonnaire et foetale. Cependant, elles sont peu
nombreuses et encore peu utilisées sur le terrain. Ces stratégies
sont de nature hormonale, nutritionnelle ou zootechnique.
II.1.1.1. Hormone
II.1.1.1.1. Augmentation de concentrations en
progestérone + Mise en place d'un corps jaune
secondaire grâce à l'hCG
L'augmentation de la concentration en progestérone par
injections d'hCG (human Chorionic Gonadotropin) a été
démontrée par différents auteurs. Ainsi, SANTOS et
al.(2001) montrent que l'injection de 3300
UI d'hCG à des vaches le 5ème jour post IA augmente le
nombre de corps jaunes et les concentrations plasmatiques en
progestérone.
Ce traitement permet d'améliorer le taux de conception
en diminuant la mortalité embryonnaire précoce. De même,
PICARD-HAGEN et al. (2003b) ont montré que
l'injection d'hCG à J6 donnant lieu à la formation d'un corps
jaune, permet l'augmentation du taux de gestation des vaches traitées
(67,5%) par rapport à celui
des vaches témoins (45,0%) ainsi que celui des vaches
ayant reçu l'injection à J1 (42,5%).
+ Supplémentation en
progestérone
MANN et LAMMING (2000) ont montré
qu'une supplémentation en progestérone permet d'augmenter le taux
de conception lorsqu'elle est effectuée avant le 6ème
jour post IA chez la vache. Cela est d'autant plus évident lorsque l'on
réalise cette supplémentation sur des vaches à faible taux
de fertilité c'est-à-dire dont le taux de conception est
inferieure à 50%. D'autres auteurs ont montré
que la supplémentation en progestérone pendant les 4 premiers
jours suivant l'insémination augmente le développement
morphologique et l'activité de synthèse des conceptus
âgés de 14 jours [GARRET et al., 1998].
Ils concluent que la supplémentation en progestérone est efficace
uniquement sur des vaches dont les concentrations en progestérone se
situent entre 1 et 2ng/ml à J5 après insémination et
semble donc être une stratégie efficace pour limiter les
mortalités embryonnaires.
II.1.1.1.2. Renforcement du signal
embryonnaire
Des espoirs thérapeutiques sont fondés sur
l'utilisation de l'INFô pour diminuer la mortalité embryonnaire
observée lors de retard dans le développement du conceptus.
L'administration d'INFô par voie intra-utérine permet de maintenir
la sécrétion lutéale de progestérone pendant 8
à 10 jours supplémentaires chez des vaches. PICARD-HAGEN
et al. (2003b) relatent que les expérimentations
conduites sur des souris mais pas reproduites chez les bovins ont montré
que l'administration de l'INFô au moment de l'implantation diminue la
mortalité embryonnaire.
II.1.1.1.3. Inhibition de la synthèse de
PGF2á
PICARD-HAGEN et al. (2003b) ont
montré que les anti-inflammatoires non stéroïdiens tels que
la flunixine inhibent la formation de la cyclo-oxygénase 2 intervenant
dans la cascade de fabrication de la PGF2á, ce qui permettrait de
diminuer la mortalité embryonnaire.
II.1.1.1.4. Somatotropine bovine (bST)
Un traitement à base de bST améliore le taux de
fertilisation et entraîne une augmentation des concentrations circulantes
de l'hormone de croissance. Cela accélère le développement
embryonnaire jusqu'à J8 après la fécondation et augmente
ainsi le nombre de cellules par embryon. Il en résulte des embryons
mieux développés qui sont davantage capables de
sécréter l'INFô [MOREIRA et al., 2002].
D'après SANTOS et
al. (2001), l'amélioration du
taux de conception grâce à la bST est le résultat d'une
diminution de la mortalité embryonnaire chez les vaches traitées
entre J31 et J45 (8,4% lors de traitement avec
bST contre 14,1 % sans traitement, P = 0,06).
II.1.1.2. Alimentation
Différents paramètres alimentaires sont à
contrôler lors des avortements pour éviter l'apparition de
nouveaux cas au sein du troupeau (Tableau XI).
II.1.1.2.1. Contrôle de l'apport
énergétique
Le contrôle du bilan énergétique par
l'appréciation de l'équilibre de la ration est utile, mais ne
saurait suffire en fin de gestation, en raison des fortes variations de
consommation entre individus, de l'influence des modes de distribution des
fourrages, mais aussi des modalités de transition alimentaire. Ces
différents éléments devront donc être
appréciés. Ce contrôle passe par l'appréciation de
concentration de la glycémie chez la vache gestante. Il convient alors
de complémenter la ration des vaches gestantes par les
éléments énergétiques pour accroître le taux
de conception [VAITCHAFA, 1996].
II.1.1.2.2. Contrôle de l'apport
azoté
En ce qui concerne les excès azotés, l'analyse
des risques porte sur une étude critique des apports alimentaires et sur
les critères biochimiques, qui permettent de préciser le statut
nutritionnel des animaux. En cas de suspicion, il faudra donc réaliser
un contrôle biochimique des excès azotés en mesurant la
teneur en urée du sang ou de celle du lait en élevage laitier.
Des teneurs comprises entre 0, 25 et 0,32g/L de lait, entre
1,61 et 6,51g/L du sang sont normales. Toute teneur élevée en
urée sanguine, dans un contexte de fréquence élevée
d'avortement, doit être considérée comme un facteur de
risque potentiel. Il convient donc de réajuster la ration pour
prévenir de nouveaux cas d'avortement [ENJALBERT,
2003].
II.1.1.2.3. Contrôle des apports
minéralo-vitaminiques
L'analyse des risques lors de déséquilibre
minéral et vitaminique porte sur une étude critique des apports
alimentaires et sur les critères biochimiques, qui permettent de
préciser le statut nutritionnel des animaux. En cas de suspicion, une
analyse critique des apports peut être réalisée en
comparant les apports des aliments minéraux et vitaminés
administrés avec les recommandations courantes.
Il faudra toutefois tenir compte d'une marge de
sécurité dans l'évaluation du fait de la
méconnaissance des apports réalisée par les fourrages et
concentrés. De même, un dosage sanguin des
oligo-éléments (cuivre, zinc, iode, etc....) peut être
réalisé.
Cette démarche permet d'obtenir un bilan final qui peut
être interprété même en dehors d'une connaissance
précise des facteurs de risques de carences primaires ou
secondaires [ENJALBERT, 2003].
Dans ces conditions, les pierres à lécher et
concentrés minéraux vitaminiques sont les plus simples moyens de
satisfaire les besoins de l'alimentation minérale et vitaminique.
II.1.1.2.4. Supplémentation en acide
gras
Chez les vaches, la supplémentation d'un régime
avec des matières grasses augmente les concentrations de
progestérone [HAWKINS et al.,
1995]. De plus, ABAYASEKARA et
WATHES (1997) ont montré que la
croissance folliculaire est modifiée différemment en fonction du
type d'acide gras (AG) utilisé. Cependant, la supplémentation du
régime avec des AG des familles ù-3 (C 18:3) n'a pas permis de
modifier la croissance folliculaire ni le fonctionnement du corps jaune
(estimé par des dosages de progestérone) par rapport à une
supplémentation en AG des familles ù6 (C18:2) (Annexe 3).
Certains auteurs ont pourtant montré qu'un ajout
d'ù3 permettrait de diminuer la mortalité embryonnaire en
inhibant la production de PGF2á et donc en améliorant le
fonctionnement du corps jaune [STAPLES et
al., 1998]. Le même auteur
montre qu'une supplémentation en graisse à raison de 2-4% de la
ration influe significativement sur le statut reproducteur des
vaches.
Dans certaines études, il a été
démontré que l'ajout de l'acide á linolénique au
sein de la ration pourrait renforcer la reconnaissance maternelle de la
gestation et donc améliorer la survie embryonnaire [SANTOS et
al., 2004].
Tableau X: Paramètres alimentaires
à contrôler lors de mortalité embryonnaire.
|
Si:
|
Suspecter:
|
|
|
|
Abaissement supérieur à un point de la
NEC
après vêlage en moyenne de troupeau
|
Déficit énergétique
|
|
|
|
Mortalité embryonnaire associée à un retard
de reprise d'activité ovarienne
|
|
Urée sanguine élevée
|
Excès azotés
|
|
|
|
Urée dans le lait > 0,32g/L
|
|
Fréquence élevée de mortalités
embryonnaires
|
Carence en vitamines
oligo-éléments
|
ou
|
en
|
|
Dosage sanguin des oligo- éléments
anormal
|
|
Dosage sanguin des activités enzymatiques anormal
|
[Source: ENJALBERT, 2003]
II.1.1.2. Mesures d'assainissement du
troupeau
La transmission verticale des maladies abortives est à
l'origine de la persistance de l'infection dans le troupeau, comme
conséquence l'augmentation du taux d'avortement [HEMPHILL et
GETTSTEIN, 2000]. La mesure de lutte contre ce mode de contamination
serait la réforme de tous les animaux infectés. En pratique,
cette mesure n'est pas applicable sur les cheptels à forte
prévalence pour des raisons économiques et pratiques. Donc, il
est plus judicieux de ne pas garder les veaux congénitalement
infectés pour le renouvellement du troupeau [WOUDA,
1997].
Quant à la transmission horizontale, elle peut
être interrompue en détruisant le placenta, les liquides
amniotiques et avortons, ou en entreposant la paille ou les concentrés
destinés à l'alimentation du bétail dans des endroits
propres.
En pratique, il n'existe pas de traitement spécifique
contre les avortements. Les traitements sont spécifiques des germes
d'où la nécessité de faire un bon diagnostic
étiologique surtout de laboratoire et un antibiogramme permettant
d'assurer un traitement rapide de vache qui a avorté afin
d'éviter que les autres femelles gestantes du troupeau soient atteintes
et avortent à leur tour.
II.1.2. Mesures de lutte défensive
La prévention des avortements passe par la lutte contre
les causes infectieuses ou non infectieuses spécifiques pouvant les
provoquer. Pour mieux connaître ces causes et améliorer la lutte,
l'association Française pour l'étude de la reproduction animale
propose aux vétérinaires une fiche de commémoratifs sur
les avortements (Figure 25) .Ainsi, les mesures de lutte défensives
consistent à éviter une éventuelle contamination verticale
et/ou horizontale.
II.1.2.1. Prévention de la transmission
verticale
Pour cela, il s'agit de:
V' dépister les animaux infectés dans le
troupeau, de lier ces animaux entre eux par la généalogie afin de
distinguer les infections verticales des horizontales; Ceci permet d'identifier
plus sûrement les animaux à éliminer et ceux qu'il est
envisageable de conserver pour l'élevage;
V' faire l'hygiène de la reproduction: contrôle
de la monte publique, de l'insémination artificielle, transfert
d'embryon en utilisant les femelles séronégatives des infections
abortives;
V' s'assurer de certificat et garantie sanitaire des semences
V' lors d'avortements fréquents dans une exploitation,
il serait judicieux de soumettre un ou plusieurs avortons à un examen
direct à l'égard des agents infectieux abortifs et de tester
sérologiquement tous les bovins de l'exploitation;
Ce mode de contamination pourrait aussi être
prévenu par la vaccination des animaux avant insémination
artificielle ou saillie naturelle. A titre d'exemple, une étude
menée par MARCIAT (2008) a
montré l'importance de vacciner les animaux avant insémination
artificielle contre la BVD avec Bovilis BVD (Figure 24).
Ce vaccin a pour but de préparer l'organisme à
se défendre contre une infection ultérieure. Cette défense
sera, chez l'animal vacciné, plus efficace car plus rapide et plus
intense.
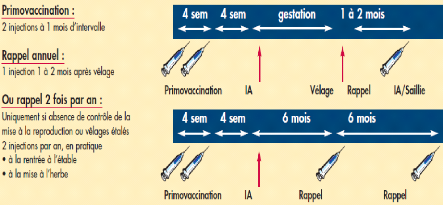
Figure 24: Protocole de vaccination de vache par
utilisation de Bovilis BVD. [Source: MARCIAT,
2008]
II.1.2.2. Prévention de contamination
horizontale
Pour une meilleure maîtrise des avortements dans
l'élevage bovin, l'application des mesures préventives de
contaminations horizontales est essentielle. Il s'agit de:
> Introduire seulement des bovins en provenance de cheptels
présentant
toutes garanties sanitaires, avec quarantaine et contrôle
individuel
(examen clinique et contrôle sérologique);
> Maintenir le cheptel à l'abri de contaminations de
voisinage (pas de contact avec les animaux d'autres troupeaux, pâturages
et points d'eau exclusifs, matériel exclusif, pas de divagation des
chiens, pas de contact avec d'autres espèces sensibles, fourrages
moisies, souillés et mal conserves, etc...) [ARQUIE,
2006];
> Désinfecter périodiquement des locaux
d'élevage et de traite;
> Contrôler régulier des cheptels afin de
dépister précocement les premiers cas d'avortement;
> Envoyer un échantillon de sang et des parties du
placenta ou à défaut du liquide utérin
(prélevé au niveau du col à l'aide d'un éco
uvillon) pour les examens bactériologiques et examens
sérologiques;
> Donner les consignes à l'éleveur pour limiter
les risques éventuels de transmission à l'Homme et aux animaux
sensibles;
> Isoler la vache et détruire efficacement l'avorton et
ses enveloppes avant que les chiens ou les oiseaux n'en aient fait leur
pitance.
> Complémenter les animaux par des concentrés ou
des blocs à lécher [ARQUIE, 2006].
Ce mode de contamination pourrait aussi être
prévenu en évitant l'accumulation de coumestrol dans les
pâtures, par le maintien de l'intégrité physique des grains
des céréales dans le but de limiter l'accès aux nutriments
qu'ils contiennent et par une maîtrise stricte des conditions
environnementales telles que l'humidité, l'oxygène et la
température. L'utilisation d'agents antifongiques (acide propionique par
exemple) peut apporter une garantie complémentaire lorsqu'un risque
prévisible existe. Une élimination des aliments ayant une trop
forte concentration en coumestrol devrait être réalisée
[GARES, 2003].

*
Figure 25: Fiche de commémoratifs des
avortements de l'association pour l'étude de la reproduction animale.
[Source: INSTITUT DE L'ELEVAGE,
2000]
Le présent travail a permis de faire une
synthèse d'une part des facteurs étiologiques des
mortalités embryonnaires et avortements cliniques, et d'autre part les
méthodes de diagnostic et moyens de lutte contre ces avortements au sein
d'une exploitation bovine. Il en ressort que les pertes attribuables aux
avortements de manière générale dans les élevages
bovins sont énormes. Ces pertes entravent considérablement le
développement de la filière bovine. Pour cela, nous formulons
quelques recommandations aux différents acteurs de la santé et
productions animales en Afrique subsaharienne pour limiter ce véritable
fléau économique dans les élevages bovins.
| 


