
UNIVERSITE D'ABOMEY-CALAVI
FACULTE DES SCIENCES AGRONOMIQUES
Département
des Sciences Techniques de la Production Végétale
Thème
Interaction de Baculovirus MaviNPV et
du Parasitoïde
(Apanteles taragamae
(Viereck)) (Hymenoptera :
Braconidae) pour
le contrôle de Maruca vitrata
Fabricius
(Lepidoptera : Pvralidae).
Thèse
Pour l'obtention du diplôme d'Ingénieur
Agronome
Option : Sciences et Techniques de Production
Végétale
Présentée et soutenue par
:
Donlossimi Wilfried LALEYE
Le 19 Décembre 2007
Superviseur
Prof. Dr. Ir. ATACHI Pierre FSA/UAC Maître de
Conférences CAMES Co-Superviseur
Dr. TAMO Manuele Chercheur à IITA
Président du Jury : Prof AHOHUENDO
Bonaventure Rapporteur : Prof ATACHI
Pierre
Examinateur 1 : Dr. ZANNOU Elisabeth
Examinateur 2 : Dr. TAMO Manuele

UNIVERSITE D'ABOMEY-CALAVI
FACULTE DES SCIENCES
AGRONOMIQUES
Département des Sciences Techniques de la
Production Végétale
Topic
Interaction of Baculovirus MaviNPV and
Parasitoïd
(Apanteles taragamae (Viereck))
(Hymenoptera :
Braconidae) to control
Maruca vitrata Fabricius
Thesis
Submitted of the Requirement for the Degree of "
Ingenieur Agronome"
Option : Sciences et Techniques de Production
Végétale
Présented by :
Donlossimi Wilfried
LALEYE
Supervisor
Prof. Dr. Ir. ATACHI Pierre FSA/UAC
Maître de
Conférences CAMES
Co-Supervisor
Dr. TAMO Manuele Chercheur à IITA
Chairman: Prof AHOHUENDO Bonaventure
Reportor : Prof ATACHI Pierre
Examinator 1 : Dr. ZANNOU Elisabeth
Examinator 2 : Dr. TAMO Manuele
CERTIFICATION
Je certifie que ce travail a été effectué
par Wilfried D. LALEYE, étudiant à la Faculté des Sciences
Agronomiques (FSA) de l'Université d'Abomey-Calavi (UAC),
Département de Production Végétale (DPV).
Le Superviseur:
Pr. Dr. Ir. Pierre ATACHI
Professeur d'Entomologie à la Faculté des Sciences
Agronomiques de l'Université d'Abomey-Calavi (UAC)

DEDICACE
A Dieu le Père Tout Puissant
La nature et tout ce qui s'y trouve, témoignent de ta
puissance et de ta grandeur.
Ma vie de chaque jour me le confirme pour toujours. Ce travail
n'est que l'aboutissement d'un long chemin que tu as si bien fait avec moi.
J'en fais une action de grâce pour Toi ; et c'est alors qu'il devient
aussi prière envers Toi pour le nouveau parcours qui commence pour moi
et que je ferai avec Toi comme par le passé.
- A ma très chère Mère
Si tant est le choix de Dieu de faire de toi, dame vaillante et
battante, l'être chère de ma vie, il ne cessera de t'apporter son
soutien.
Ces sacrifices consentis pour moi jusqu'à ce jour,
ainsi que tous ces enseignements qui témoignent de ton coeur très
vertueux, seront pour moi une source intarissable de recette pour la vie.
Vois en ce travail, une action que tu as accomplie.
- A mon très cher Père
Même du plus profond de mes moments difficiles, je n'ai
pas cessé de voir en toi le père dont je suis fier plus qu'une
fierté, c'est une grâce pour moi que Dieu t'ait choisi. Ta
bravoure, ton sens de responsabilité me sont d'une grande utilité
pour affronter la vie.
Vois en ce travail, un symbole de tes sacrifices et de l'amour
d'un fils pour son père.
REMERCIEMENT
La réalisation de ce travail a été possible
grâce aux personnes qui nous ont prêté leur précieux
concours. Nous tenons alors à exprimer nos vifs remerciements:
Au Pr. Pierre ATACHI, Entomologiste à la Faculté
des Sciences Agronomiques de l'Université d'Abomey-Calavi pour la
qualité de son encadrement, sa participation active, son esprit critique
et sa rigueur scientifique. Nous lui témoignons notre sincère
gratitude;
Au Dr. Manuele, TAMÒ, Agro-écologiste, chercheur
à l'IITA qui en dépit de ses multiples occupations, a
accepté de superviser notre travail et a été attentif
à nos multiples préoccupations tout au long du stage. Nous lui en
sommes reconnaissant;
A Mr. Cyriaque AGBOTON, Ingénieur Agronome, Assistant
de Recherche à l'IITA, pour son assistance pratique et permanente
à ce travail. Qu'il trouve à travers ce travail l'expression de
notre profonde gratitude;
A tout le personnel et aux stagiaires de la section
niébé: Déo-Guide RUREMA, Sounkoura ADETONAH, Bernard
HETTIN, Mamadou AHANCHEDE, Casimir AS SOU, Mathias AZOKPOTA, Basile DATO,
Pascal AGOUCHEME, pour vos aides morales et techniques dans la
réalisation de ce travail.
Nos sincères remerciements vont également à
:
- El-Hadj Séfou ADETONAH, nous vous disons merci pour
votre compréhension et votre sens de reconnaissance et d'humanisme.
- Biaugusta V. MONGBO, je te témoigne ici toute ma
reconnaissance pour ta présence, ta compréhension et surtout tes
conseils durant les moments difficiles de la rédaction de cette
thèse. Que Dieu Tout Puissant te bénisse.
- mes familles LALEYE et NOUHOUDOHOUN, qui depuis ma naissance
ont veillé sur
moi et m'ont soutenu durant toute ma formation, je vous adresse
un grand merci.
- toutes les familles MONGBO et NOUTAÏ pour leur sympathie
et leur esprit de solidarité
et de fraternité.
- Benjamin DATINON et François ONIKPO pour leurs
précieux conseils et leurs totales disponibilités.
- Prisca ASSOGBA et Judith HONFFOGA, pour votre entière
disponibilité, vos aides et conseils ont été d'une grande
utilité. Soyez en remerciées.
- tous mes frères et soeurs et particulièrement
Nadine et Damien LALEYE, Fiacre GANZO, Ghislain HOUEKPETON, je vous dis merci
pour les luttes que nous menons ensemble. Que Dieu vous aide dans vos diverses
tâches.
- la famille MEDJA pour les multiples conseils et soutiens
indéfectibles. Que Dieu vous le rendre au centuple.
- mes amis Maurice ADJAN, Nadège A. AKALOGOUN,
Gérard ADOHO, Marcel GUIDI - tous nos professeurs et aux personnels non
enseignants de la Faculté des Sciences Agronomiques pour votre
contribution à notre formation.
- Pr. AHOHUENDO Bonaventure, Chef du département PV/FSA
d'alors, notre grande reconnaissance pour votre disponibilité et vos
conseils
Si je ne puis citer tout le monde, aucun n'est oublié.
TABLE DES MATIERES
n° page
CERTIFICATION .. i
DEDICACE .. ii
REMERCIEMENTS iii


. viii
TABLE DES MATIERES . v
LISTE DES TABLEAUX
LISTE DES FIGURES . ix

LISTE DES PHOTOS x

LISTE DES ANNEXES xi
LISTE DES SIGLES ET ABREVIATIONS xii

RESUME .. xiv
ABSTRACT .. xv
INTRODUCTION 1
PREMIERE PARTIE : REVUE DE LITTERATURE . 5
1.1 Niébé : Vigna unguiculata (L) Walp 6
1.1.1 Botanique - origine- Dispersion géographique 6
1.1.2 Ecologie et production 6
1.1.3 Importance et utilisation 11
1.1.4 Insectes ravageurs de niébé 11
1.2 Insectes : Maruca vitrata (Fabricius) 15

1.2.1 Systématique - Origine - Distribution 15
1.2.2 Description 17
1.2.3 Biologie et écologie . 18
1.2.4 Ennemis naturels 22

1.2.5 Parasitoïdes . 22

1.2.6 Dégâts et importance économique 23
1.3 Méthodes de lutte contre M. vitrata 25
1.3.1 Pratiques traditionnelles 26
1.3.2 Lutte culturale . 26

1.3.3 Lutte chimique . 26
1.3.4 Résistance variétale 27
1.3.5 Lutte biologique .. 27
1.3.6 Lutte intégrée .. 28
1.3.7 Lutte microbiologique . 28

1.4 Virus entomopathogènes . ..... 29
1.4.1 Baculovirus . 30
1.5. le parasitoïde Apanteles taragamae
DEUXIEME PARTIE : Matériels et méthodes 37
2.1 Cadre d'étude .. 38
2.2 Matériel ... 38
2.2.1 Matériel entomologique 38

2.2.2. Matériel entomopathogène . 38

2.3. Condition de laboratoire 38
2.4. Méthodes 39
2.5. Matériel de laboratoire 40

2.5.1. Formation à la station de l'Institut International
d'Agriculture
Tropicale (IITA) . 40
2.5.2. Production en masse de Maruca vitrata 41
2.5.3. Préparation du milieu nutritif artificiel de
Maruca vitrata 41
2.5.4. Obtention et multiplication des adultes de Apanteles
taragamae 43

2.5.5. Production purification et comptage du virus MaviNPV .
43


2.6. Protocole des expériences 46
2.6.1.
Expérience 1 : Evaluation des différentes méthodes de
Contamination du parasitoïde Apanteles taragamae
47
2-6-2 Analyses statistiques . 49

TROISIEME PARTIE : RESULTATS . 50
3.1- Acquisition et Transmission du virus par les
parasitoïdes aux chenilles de
Maruca. vitrata Fabricius à partir des
différentes méthodes de Contamination. 51
3.1.1 - Comparaison de la mortalité des chenilles 51

3.1.2 - Comparaison de l'existence de virus dans les chenilles
mortes . 53

3.1.3- Comparaison de l'émergence des parasitoïdes
55
QUATRIEME PARTIE : DISCUSSION .. 58
4.1. Effet d'acquisition et de transmission du virus 59
4.1.1. Mortalité 59

4.1.2. Présence de virus 59
4.1.3 Influence des délais d'inoculation .. 60
CONCLUSION ET RECOMMANDATIONS 61

REFERENCES BIBLIOGRAPHIQUES 63
ANNEXES . 75
LISTE DES TABLEAUX
TABLEAUX PAGE
Tableau 1: Evolution des superficies, productions et rendements
du niébé dans le
monde de 1980 à 2004 . 8
Tableau 2 : Evolution des superficies, productions et rendements
du niébé en
Afrique de 1980 à 2004 . 9
Tableau 3: Evolution des superficies emblavées,
productions et
rendements de la culture de niébé au Bénin
de 1980 à 2004 10
Tableau 4: Insectes ravageurs du niébé, date
d'apparition dans la
culture et organes végétatifs attaqués
14
Tableau 5 : Quelques plantes- hôtes de M.vitrata
20
44
52
Tableau 6 : La composition du milieu artificiel d'élevage
de M. vitrata et les Rôles de quelques composantes
Tableau 7a : Mortalité des chenilles de Maruca
vitrata en fonction de différentes méthodes de
contamination : 2h et 24h après l'inoculation par le virus
Tableau 7b : Présence de Virus dans les chenilles de
Maruca vitrata en fonction de différentes
méthodes de contamination : 2h et 24h après
l'inoculation par le virus 54
Tableau 7c : Analyse de la variance à
deux critères de classification, modèle croisé mixte,
des
paramètres de mortalité, d'émergence des
larves de Maruca et de leur infection au
virus dans un essai de 4 traitements suivant deux temps (2H et
24 H) 56
Tableau 7d: Analyse de la variance à deux critères
de classification, modèle croisé mixte, des paramètres de
mortalité, d'émergence des parasitoïdes et de leur infection
au virus 57
dans un essai de 4 traitements suivant deux temps (2H et 24 H)
.
LISTE DES FIGURES
FIGURE PAGES
Figure 1 : Périodes d'activité des principaux
insectes ravageurs du niébé . 13
Figure 2 : Répartition géographique de M.
vitrata en Afrique 16
Figure 3 : Polyèdres de NPV (laissés) et une
section transversale d'un MNPV..... 31
Figure 4 : Schéma d'un virus bourgeonné (BV) et
d'un virus dérivé par occlusion (ODV) 31
Figure 5 : Culture de cellules infectées par un
Baculovirus 32
Figure 6 : Diagramme montrant le cycle d'infection d'un insecte
hôte par le NPV. 34
Figure 7 : Cycle de réplication des Baculovirus . 35
LISTE DES PHOTOS
PHOTOS PAGES
Photo 1 : Les cinq stades larvaires de M. vitrata (Photo
réalisée par Georgen, IITA) 17
Photo 2 : Adultes de M. vitrata (Photo
réalisée par Goergen, IITA) 18
Photo 3 : Adulte de Apanteles
taragamae.............................................................
24
LISTE DES ANNEXES
ANNEXE 1 : La structuration des moyennes de la
Mortalité (moyennes#177;erreur
standard) issues de l'analyse de la variance suivant le test
de
Student, Newman et Keuls 76
ANNEXE 2 : La structuration des moyennes de la présence de
Virus
(moyennes#177;erreur standard) issues de l'analyse de
la variance
suivant le test de Student, Newman et Keuls 77
ANNEXE 3 : La structuration des moyennes de l'Emergence des
parasitoïdes
(moyennes#177;erreur standard) issues de l'analyse de la variance
suivant
le test de Student, Newman et Keuls 78
ANNEXE 4 : Analyse de
la variance à deux critères de classification, modèle
croisé
mixte, des paramètres de mortalité,
d'émergence des adultes de
Apanteles taragamae et de leur infection au virus dans
un essai de 4 traitements suivant deux temps (2H et 24 H) 79
ANNEXE 5: Les principaux ennemis naturels de
M. vitrata 80
LISTE DES SIGLES ET ABREVIATIONS
ANOVA : Analyse des variances
ADN : Acide Désoxyribo
Nucléique
ARN : Acide Ribo Nucléique
AVRDC : Asian Vegetable Research Development
Center
BV : Budded Virus
C : Concentration
DPV : Département de Production
Végétale
FAO : Organisation des Nations Unies pour
l'Alimentation et l'agriculture
FSA : Faculté des Sciences
Agronomiques
GLM : Generalized Linear Model
GV : Granulosis Virus
IFDC : International Fertility Development
Center
IITA : Institut International d'Agriculture
Tropicale
m : Mètre
MNPV : Multiple Single Nuclear Polyedrosis
Virus
MaviNPV : Maruca Vitrata Nuclear
Polyhedrosis Virus
mm : Millimetre
mm2 : millimètre au
carré
NPV : Nuclear Polyhedrosis Virus
OB : Occlusion Body
OBOPAF : Observatoire des opportunités
d'Affaires du Bénin
ODV : Virus Dérivés par
Occlusion
ONASA : Office National de la
Sécurité Alimentaire
ONU : Organisation des Nations Unies
OUA-CSTR-CPI : Organisation de l'Unité
Africaine-Commission Scientifique et
Technique de la Recherche-Conseil Phytosanitaire Interafricain
PNUD : Programme des Nations Unies pour le
Développement
SDS : Sodium Dodecyl Sulphate
SNPV : Single Nuclear Polyhedrose Virus
UAC : Université d'Abomey-Calavi
V : Volume
°C : Degré Celsius
PIB : Polyhedral Inclusion Body
rpm : Rotation par minute
ul : Micro litre
RESUME
L'objectif principal de ce travail est de trouver un moyen
efficace permettant une réduction sensible de l'utilisation des
insecticides de synthèse au profit de la lutte biologique dans un
contexte de lutte intégrée contre Maruca vitrata
Fabricius (Lépidoptera : Pyralidae) ravageur de niébé.
Pour atteindre cet objectif, deux agents de lutte biologique ont
été identifiés. Il s'agit du parasitoïde
Apanteles taragamae et du virus MaviNPV. Ces deux agents ont
été utilisés suivant trois (3) méthodes de
contamination des parasitoïdes et deux (2) durées. Ainsi, une dose
de 2,16.103 PIB/ml a été prise pour effectuer les
contaminations. Cette dose représente la DL50 pour les
chenilles de 4 jours. Les chenilles utilisées sont de stade 2 et le
début du stade 3. Les parasitoïdes contaminés avec la
méthode de contamination par l'ovipositeur sont inoculés avec un
mélange de chenilles du stade 2 et 3. Les mêmes opérations
sont effectuées dans le cas des méthodes de contamination de la
surface totale du corps et du milieu nutritif. En effet, toutes ces
méthodes conduisent à la transmission et l'acquisition du virus
(Mavi NPV) aux parasitoïdes qu'importe la durée d'inoculation. La
procédure ANOVA du logiciel SAS a permis de montrer que toutes ces
méthodes ne sont pas différentes les unes des autres. Ainsi,
l'analyse statistique des données révèle une symbiose
parfaite entre le virus et le parasitoïde pour une réduction
sensible de la population de M.vitrata. Les parasitoïdes
acquièrent et transmettent le virus (MaviNPV) aux chenilles saines. A
l'aide de la procédure du produit logiciel SAS, l'acquisition du virus
par les parasitoïdes, hautement significative, a été
prouvée. Bien que le produit biologique n'agisse pas dans tous les cas
de la même manière sur le parasitoïde et l'hôte, on
assiste à une importante trilogie biologique constituée par un
produit biologique, un parasitoïde et un hôte phytophage.
Mots clés : Maruca vitrata, Vigna Unguiculata, MaviNP
V, Apanteles taragamae.
ABSTRACT
The main objective of this study is to find an efficient way
to reduce the use of synthetic insecticides to the benefit of biological
control in the context of integrated pest management against Maruca
vitrata Fabricius (Lepidoptera: Pyralidae), a serious pest of cowpea,
Vigna unguiculata Walp.. To this effect, we studied the interactions
of two natural enemies of M. vitrata, the parasitoid Apanteles
taragamae and the entomopathogenic virus MaviNPV. To study the ability of
A. taragamae in transmitting the virus, three (3) methods of
contamination and two (2) durations of contamination were chosen. For all
experiments, we used a dose of 2.16x103 PIB/ml representing the
DL50 for four days old M. vitrata larvae. The parasitoids
were first contaminated by the ovipositor method, and exposed to a mix of
second and third stage larvae. The same methodology was followed also for the
two other ways of contamination, i.e. contamination of total body surface and
contamination o the artificial diet offered as food to M. vitrata
larvae. The results showed that all the three contamination methods led to the
transmission of the MaviNPV virus to M. vitrata larvae through the
oviposition activity of the parasitoids, and the subsequent acquisition of
MaviNPV by the parasitoids, without regards to the length of inoculation. The
differences in the transmission rates for the three methods investigated were
statistically not significant. The combined action of both the virus and the
parasitoids induced a statistically significant mortality on M. vitrata larvae
as compared to the control. The implications of these findings for an efficient
biological control of this pest are discussed..
Key words: Maruca vitrata, Vigna
unguiculata; MaviNPV, Apanteles taragamae.
INTRODUCTION
L'une des préoccupations des pays subsahariens est le
développement du secteur agricole en vue d'une croissance de la
production agricole pour assurer la sécurité alimentaire et la
réduction de la pauvreté. Cette préoccupation est d'autant
plus importante qu'on observe de nombreux cas de malnutrition et de sous
alimentation conduisant à des pertes en vies humaines et en
productivité de travail. L'agriculture, dans le tiers monde et surtout
en Afrique subsaharienne, reste marginale et est caractérisée par
une faible productivité. Ceci constitue la principale cause de
pauvreté dans ces pays en voie de développement où les
problèmes de déficits alimentaires et surtout protéiniques
se posent avec acuité.
Pour son alimentation, l'homme dans ces régions fait
souvent recours aux principales cultures de bases d'origine animale,
végétale ou minérale. Parmi les aliments d'origine
végétale, les légumineuses vivrières, qui, occupent
une place prépondérante, sont sans doute le moyen le plus
efficace pour assurer l'équilibre alimentaire de la population des
régions tropicales (FAO, cité par Akpovi, 1993). Elles
constituent une source importante et peu coûteuse de protéine par
rapport aux protéines animales et répondent au niveau de vie de
la majorité de la population africaine (IITA, 1992). Elles ont la
capacité d'augmenter la fertilité du sol (Tiyagi & Paveen,
1990). En effet, parmi les légumineuses vivrières
rencontrées au Bénin, le niébé est le plus
cultivé (Atachi & Desmidts., 1984). La
consommation du niébé constitue alors un appoint non
négligeable pour l'amélioration de la qualité
nutritionnelle du régime alimentaire de la population de ces pays en
voie de développement.
Au Bénin, le niébé n'occupe que 7.8% des
superficies totales cultivées et présente des avantages aussi
bien sur le plan alimentaire et que sur le plan économique (OBOPAF,
2004). En plus de ses graines, le niébé offre à
l'alimentation humaine ses feuilles tendres et ses fanes à
l'alimentation animale (Akundabwensi et al., 1991 ; Okeyo-Owuor et
al., 1991). A cet effet, une production de bonne qualité et en
quantité suffisante s'avère nécessaire pour satisfaire la
demande en niébé de la population de ces régions. Mais en
Afrique de l'ouest, la production actuelle du niébé est loin de
couvrir les besoins de la population.
Comment expliquer ce paradoxe ?
Il est dû au faible rendement moyen en Afrique : 100
à 400 kg/ha (Assa, 1976 ; Ntare, 1989), faiblesse due à de
nombreux facteurs tels que les insectes nuisibles, les maladies cryptogamiques.
Très peu de cultures souffrent de pareilles attaques d'insectes (Assa,
1976 ; Taylor, 1978, Atachi & Ahohuendo, 1989). Tous ces facteurs
constituent pour le niébé des obstacles sérieux dont on
est obligé de se défaire pour une productivité de
quantité et de
qualité.
Les pertes occasionnées par les différents
ravageurs (insectes, nématodes, maladies et adventices) sont
évaluées à 300 millions de dollars américains par
an (NRI, 1991). Ainsi, la forte pression parasitaire et les maladies
constituent la seule contrainte majeure pour la production du
niébé (Atachi et al., 1985). Au nombre des ravageurs, la
foreuse de gousse, Maruca vitrata Fabricius
(Lépidoptèra) est un ravageur très sérieux
de niébé dans les régions tropicales et subtropicales de
l'Asie, de l'Amérique Latine et de l'Afrique (Liao & Lin, 2000). Au
cours de son développement, les chenilles de cet insecte se nourrissent
des pédoncules, des boutons floraux, des fleurs et gousses encore
fraîches (Okech & Saxena, 1990). Les dégâts
causés par M.vitrata sont estimés en une perte de
rendement de 30 à 86% (OkeyoOwuor et al., 1983 ; Atachi &
Ahohuendo, 1989 ; Singh et al., 1990 ; Tamò et
al.,2003). Il s'avère important et même capital, de chercher
tous les moyens nécessaires pouvant aider à lutter efficacement
contre ce ravageur. Ainsi, plusieurs moyens de luttes contre cet insecte
nuisible ont été mis au point. Parmi ceux-ci, la lutte chimique
est la plus ancienne et la plus utilisée pour le contrôle de la
population de cet insecte. Son application a connu au début de sa mise
au point des succès spectaculaires, mais une diminution graduelle de son
efficacité se note dans le temps. Ce phénomène est
dû au système d'adaptation, de développement de
résistance chez les ravageurs vis-à-vis des pesticides (Brooks,
1993).
Pour parvenir à une réduction
considérable de la population de ce ravageur suite au problème de
développement de résistance, il faudra utiliser des insecticides
beaucoup plus toxiques et augmenter le nombre d'application de pesticides tout
en les changeant régulièrement (Bourguerra ,1986). Mais, si
l'application répétée des pesticides hautement toxiques
peut réduire les populations des ravageurs des cultures, elle est loin
d'être écologiquement et socialement saine, et s'effectue à
grand frais. Aussi, ces produits sont-ils à l'origine de plusieurs cas
d'intoxication et font selon les estimations de l'ONU, chaque année,
40.000 victimes, puis provoquent des séquelles chez environ 2.000000 de
personnes (IITA, 1988).
Dans le cas particulier de la lutte contre M.
vitrata, la lutte chimique est bien établie et fait appel à
l'utilisation d'une large gamme d'insecticides (Atachi & Sourokou, 1989 ;
Singh et al., 1990). Malgré l'établissement de cette
méthode de lutte contre M. vitrata sur le niébé,
elle ne serait pas envisageable dans les régions où ses feuilles
sont consommées comme légume à cause de la toxicité
des insecticides (Okeyo-Owuor et al., 1991).
A cause des problèmes que pose l'utilisation des
pesticides, d'autres méthodes de lutte visant une réduction de
l'intensité d'application des pesticides ont été mises au
point. Il
s'agit de la lutte par la résistance variétale, par
la pratique culturale et la lutte biologique, méthode dont les
efficacités diffèrent vis-à-vis de M. vitrata.
En ce qui concerne la lutte variétale, elle est
difficilement applicable pour le contrôle de M. vitrata car il
est difficile de trouver des variétés de niébé dont
les fleurs et les gousses seraient résistantes à ce ravageur
(Jackai & Singh, 1981 ).Quant aux pratiques culturales, telles que les
cultures pièges et l'association culturale, elles n'ont jusqu'à
présent donné que des résultats d'un intérêt
limité (Amoaka-atta & Omolo, 1983). Outre tous les organismes
nuisibles, il existe beaucoup d'agents qui aident à combattre les
ennemis des cultures; ce sont les auxiliaires ou ennemis naturels. Ceux-ci
vivent aux dépens des ennemis des cultures, par exemple, en les
dévorant ou en les parasitant; c'est la lutte biologique. On peut la
définir comme l'utilisation d'auxiliaires, afin de réduire les
dégâts causés par des ennemis des cultures à un
niveau économiquement acceptable. Mais elle exige une étude
détaillée d'identification et d'évaluation des parasites,
prédateurs et pathogènes de ce lépidoptère
(Okeyo-Owuor et al., 1991).
La lutte biologique, qui préconise l'emploi d'agents
très spécifiques, ne peut être considérée
comme une panacée universelle susceptible de protéger toute
culture contre tout ennemi. C'est pourquoi aujourd'hui, la mise en oeuvre de ce
concept s'inscrit systématiquement dans le cadre de la lutte
intégrée.
C'est dans ce contexte que le présent travail
effectué dans le laboratoire de l'IITA trouve sa pertinence.
L'objectif principal de ce travail est de trouver un moyen
efficace permettant une réduction sensible de l'utilisation des
insecticides de synthèse au profit de la lutte biologique et la mise en
place d'une unité de production des parasitoïdes infectés
efficaces à moindre coût pour lutter contre M. vitrata,
ravageur de niébé. Pour atteindre cet objectif, un certain nombre
d'objectifs spécifiques sont visés. Il s'agit de :
- étudier les possibilités d'acquisition et de
transmission du virus (MaviNPV) par le parasitoïde Apanteles
taragamae aux chenilles de M.vitrata.
- examiner les effets conjugués du virus et du
parasitoïde sur les chenilles de M. vitrata afin d'en
déduire la synergie ou l'antagonisme.
Ce travail se déroule en différentes parties :
- la première partie fait le point sur les travaux
déjà effectués.
- la deuxième partie décrit le matériel et
la méthodologie utilisés.
- la troisième partie analyse les résultats
obtenus.
- la quatrième partie aborde la discussion des
résultats obtenus.
- la dernière partie tire les conclusions, qui
découlent de l'analyse des résultats avec un accent sur les
recommandations.

PREMIERE PARTIE : REVUE DE
LITTERATURE
1-1 Le Niébé : Vigna unguiculata (L)
walp
La connaissance de niébé s'avère
indispensable pour sa parfaite utilisation.
1-1-1 : Botanique - Origine- Dispersion
géographique
· Botanique
Le niébé est une légumineuse à
graines appartenant à l'ordre des légumineuses, à la
famille des Fabaceae, à la tribu des Phaseoleae et au genre
Vigna (Maréchal et al., 1978) ; d'où son nom
botanique Vigna unguiculata (L.) Walpers. Le nombre de chromosomes de
cette espèce est 2n =22 (Maréchal, 1 970).C'est une plante
à port érigé principalement autogame bien que l'on ait
fait état d'un certain degré d'allogamie qui serait fonction de
l'activité des insectes assurant la pollinisation (Rachie et
al., 1974). Il possède une racine pivotante, rampant ou grimpant
(Porter et al., 1975). Les tiges sont cylindriques,
légèrement cannelées et volubiles. Les feuilles sont
alternes et trifoliées. Les fleurs évoluent pour donner des
gousses, lesquelles seront récoltées à maturité.
· Origine
L'origine du niébé, bien que très
discutée, serait de l'Afrique. En effet, une vaste distribution du
niébé sauvage en Afrique constitue une des preuves, les plus
évidentes, sur l'énigme de l'espèce sur ce même
continent. L'hypothèse la plus soutenue admet que le point de
départ du niébé est l'Afrique occidentale et très
vraisemblablement le Nigeria où les espèces sauvages abondent
dans les savanes et les forêts (Rawal, 1975), bien que certaines formes
cultivées comme la variété ses quipedalis
semblent avoir leur origine dans le Sud -Est asiatique ou en Extrême
-Orient. Cependant, aucune forme sauvage n'a été trouvée
en Asie.
· Dispersion géographique
Le niébé est très répandu sous
les tropiques et dans de nombreuses régions subtropicales. Il est une
légumineuse à graine importante en Afrique tropicale et est
cultivé au sud d'une ligne allant de la côte ouest à la
limite subsaharienne jusqu' en Afrique de l'Est (IITA cité par Godonou,
1987).
1-1-2 Ecologie et production
· Ecologie
Le niébé est résistant à la
sécheresse (IITA, 1982). Etant une plante des régions tropicales
et subtropicales, le niébé supporte des températures
variant entre 25 et 28°C et une
pluviométrie variant entre 750 et 1000mm (Anochili,
1978), l'excès d'eau lui étant préjudiciable. Par contre,
il supporte facilement une large gamme de sol allant des sols à
prédominance sableuse aux sols à dominance argileuse
légèrement alcalins (Jonhson, 1970). Cependant, les contraintes
hydriques intervenant après la floraison peuvent ne pas affecter de
façon significative le rendement en graine de certains cultivars
(Summerfield & Huxey cité par IITA, 1982). C'est une plante de jour
court (Anon ,1995).
· Production
Le niébé peut être cultivé en
culture pure ou en association avec d'autres céréales comme le
maïs, le sorgho, le mil ou des racines amylacées comme le manioc
(Jackai & Daoust., 1986). A l'instar des autres
légumineuses, le niébé a de grandes exigences en phosphore
et en potassium (plus précisément sur les sols pauvres). Des
expériences ont montré que l'application d'engrais azoté
réduit la modulation et provoque un développement foliaire
excessif au détriment de la formation des graines. Une dose de 200 kg de
NPK (0-15- 15) est admise pour les régions de la savane soudanaise ou du
Sahel. Cependant, l'application de quelques kg d'azote à l'ha est
bénéfique au moment des semis où il joue un rôle de
« starter » en stimulant la croissance des plantules.
La production du niébé dans le monde a connu une
légère hausse au cours des dix dernières années.
Ainsi, la production est-elle passée de 1.388726 tonnes en 1986 à
3.930500 tonnes en 2004 dans le monde (Tableau 1). La même tendance
s'observe en Afrique (Tableau 2). La production semble être
proportionnelle à la superficie emblavée et les rendements sont
restés pratiquement constants. Ceci s'explique par le fait que la
superficie et la production augmentent dans la même proportion
d'année en année.
L'Afrique est le continent qui produit plus de
niébé avec une production totale de 3.721835 tonnes en 2004
(Tableau 2). En 2004, les meilleurs pays producteurs du niébé au
monde sont le Nigeria suivi du Niger sur le plan africain avec les productions
respectives de 2.137000 tonnes et de 549035 tonnes (FAO, 2005).
Au Bénin, la production du niébé
évolue très lentement que ce soit au niveau des superficies
emblavées que de celui de la production. Le tableau 3 donne
l'évolution des superficies, production et rendement au cours des vingt
sept dernières années. Malgré l'importance du patrimoine
foncier, le rendement en niébé est de 690 kg /ha (IFDC, 2005), ce
qui est inférieur à ceux observés dans d'autres pays en
voie de développement situés sur la même latitude.
Tableau 1: Evolution des superficies,
productions et rendements du niébé dans le monde de 1994 à
2004.
|
Années
|
Superficie (Ha)
|
Production (t)
|
Rendement (Kg/Ha)
|
|
1994
|
6957226
|
2655837
|
382
|
|
1995
|
8023887
|
2634770
|
328
|
|
1996
|
8242011
|
2959850
|
359
|
|
1997
|
8428850
|
2880966
|
342
|
|
1998
|
9977872
|
3806016
|
381
|
|
1999
|
10074917
|
3549889
|
352
|
|
2000
|
8756464
|
3198325
|
365
|
|
2001
|
9357480
|
3591831
|
384
|
|
2002
|
9968011
|
3577794
|
359
|
|
2003
|
10004409
|
3820434
|
382
|
|
2004
|
10131909
|
393050
|
388
|
Source : FAO (2005)
Tableau 2 : Evolution des superficies,
productions et rendements du niébé en Afrique de 1994 à
2004.
|
Années
|
Superficie (ha)
|
Production (t)
|
Rendement (Kg/ha)
|
|
1994
|
6828650
|
2552281
|
373.8
|
|
1995
|
7885593
|
2514512
|
319
|
|
1996
|
8074589
|
2810992
|
348
|
|
1997
|
8254323
|
2725929
|
330
|
|
1998
|
9805967
|
3654046
|
373
|
|
1999
|
9893554
|
3409346
|
345
|
|
2000
|
8562646
|
3040780
|
355
|
|
2001
|
91415100
|
3407234
|
373
|
|
2002
|
9756679
|
3392680
|
348
|
|
2003
|
9785966
|
3620007
|
370
|
|
2004
|
9913800
|
3721835
|
375
|
Source: FAO (2005)
Tableau 3: Evolution des superficies
emblavées, productions et rendements de la culture du
niébé au Bénin de 1994 à 2004.
|
Année
|
Superficie (ha)
|
Production (t)
|
Rendement
(kg/ha)
|
|
1994
|
99109
|
65041
|
656
|
|
1995*
|
98157
|
61782
|
629
|
|
1996*
|
97987
|
60358
|
616
|
|
1997*
|
103660
|
65857
|
635
|
|
1998*
|
108456
|
70978
|
654
|
|
1999*
|
122854
|
76926
|
626
|
|
2000*
|
117654
|
77743
|
661
|
|
2001*
|
107302
|
73793
|
688
|
|
2002*
|
134698
|
92576
|
687
|
|
2003
|
119642
|
82532
|
773
|
|
2004
|
122762
|
94108
|
767
|
* Estimation de l'ONASA Source : ONASA (2005)
1-1-3 Importance et utilisation
Les légumineuses sont les plantes les plus
cultivées dans le monde entier. Les espèces utilisées
étant adaptées à des climats très variés
qu'ils soient tempérés ou tropicaux humides ou arides (Aykroyd
& Doughty, 1982). Elles sont largement répandues en zone tropicale
et subtropicale (Hutchinson & Daizel cités par Okwakpam, 1978).
Dupriez & De Leener (1987) rapportent que toute la plante est comestible.
Les feuilles, les jeunes pousses et les gousses immatures sont
consommées comme légume, les graines cuites sont utilisées
comme aliments de base ou d'accompagnement. Elles sont
caractérisées par sa richesse en protéine et sa
capacité d'augmenter la fertilité du sol (Tiyagi & Parveen,
1990). Les graines mûres sont hautement nutritives et occupent une place
importante dans l'alimentation humaine. Dans les régions tropicales
où se posent des problèmes de déficit protéique
alarmant et de malnutrition chronique, les légumineuses doivent
être particulièrement utilisées comme source principale de
protéine végétale, d'énergie et de vitamine pour
les hommes et surtout pour les enfants (Okigbo, 1978). Ainsi, le
niébé constitue une importante source de protéine dans les
régions tropicales et occupe une place importante dans les
régimes alimentaires d'une grande partie de la population mondiale
(Anonyme ,1974). Le niébé doit cette importance à son taux
élevé de protéine (22 - 25 % ) (deux à cinq fois
plus élevé que celui des céréales), à la
valeur biologique de sa protéine proche de 57%, à son bon
coefficient de digestibilité de l'ordre de 85% et à sa bonne
concentration en lysine d'environ 93% (Santos, 1976). A cet effet, il est
appelé " la culture des plus démunis" (Anonyme ,1976). Aussi les
animaux nourris aux fanes de niébé, jouissent-ils d'une bonne
santé, produisent-ils plus de lait, de viande, d'effort de traction et
de fumier et, ce faisant, garantissent-ils une bonne production agricole (IITA,
2004). En outre, il est considéré tout comme les autres
légumineuses comme une usine d'azote. Le niébé joue
également un rôle important sur le plan culturel. Dans certaines
tribus comme les Yoruba et Haoussa, les graines de niébé
présentent un caractère sacré et sont utilisées
pour conjurer les mauvais sorts et pour apaiser les mauvais esprits (Duke,
1990).
Le niébé est confronté à de nombreux
problèmes dont le plus déterminant est l'attaque des
ravageurs.
1-1-4 Insectes ravageurs de niébé
En Afrique, ce sont les insectes qui sont plus responsables des
dégâts énormes dans les cultures de niébé
(Singh & Allen, 1980). Le problème des ravageurs est beaucoup
plus
sérieux en Afrique qu'en Asie et en Amérique
Latine (Singh et al., 1990). Selon Oghiakhes (1995), le
niébé est susceptible à une large gamme d'insectes
ravageurs qui l'attaquent depuis les semis jusqu'au stockage. Cet état
de choses s'explique par plusieurs facteurs, à savoir: le climat, les
sols, les mauvaises pratiques culturales, les mauvaises herbes, les maladies et
un large complexe parasitaire (Atachi & Ahohuendo, 1989; Lane et
al., 1994). Ainsi, un grand nombre d'insectes ravageurs appartenant
à différents ordres et genres expose le niébé
à une forte pression parasitaire (Tableau 4). L'ensemble de ces insectes
peut causer jusqu'à 100% de perte de rendement (IITA, 1989). Parmi
ceux-ci, M. vitrata (Fabricius) est considéré comme le
plus dangereux causant des pertes significatives allant de 50 à 80%
(Assa, 1976 ; Atachi & Ahohuendo 1989). En effet, M. vitrata
attaque le niébé à tous les stades de développement
: jeune tige tendre, bourgeons végétatifs, boutons floraux,
fleurs, gousses et feuilles (Jackai, 1981)
La figure 1 illustre la période d'activité des
principaux insectes ravageurs en relation avec la phénologie de la
plante. Le tableau 4 complète la figure 1.
Age de la plante en Jour après la levée
0 10 20 30 40 50 60 70
|
Pré et floraison
|
Post-floraison
|
Espèces d'insectes

1 Ootheca mutablilis (Sahlberg)

2 Medythia quaterna (Fairmaire)

3 Sericothrips occipitalis (Hood)
|
4 Empoasca facialis (Jac)
|
|
|
5 Taeniothrips sjostedti (Trybom)
|
|
|
|
6 Maruca vitrata (Fabricius)
|
|
|
7 Anoplocnemis curvipes (Fabricius)
|
|
|
8 Acanthomyia horrida (Germar)
|
|
|
9 Riptortus dentipes (Fabricius)
|
|
10 Cydia ptychora (Meyrick)
|
|
11 Callosobruchus maculatus (Fabricius)
|
|
Période d'activité Période d'activité
maximale
Figure 1: Périodes d'activité des
principaux insectes ravageurs du niébé Source : Singh
(1990)
Tableau 4: Insectes ravageurs du
niébé, date d'apparition dans la culture et organes
végétatifs attaqués.
|
Familles
|
Genres et espèces
|
Périodes
d'apparition
(JAS)
|
Organes
attaqués
|
|
Coléoptères
|
|
Chysomelidae
|
Ootheca mutabilis (Sahlberg)
|
8
|
Fe
|
|
Chysomelidae
|
Medythia quaterna (Faimaire) (=
Luperodes /Paraluperodes lineata
(Karsh))
|
11
|
Fe
|
|
Apionidae
|
Piezotrachelus varius (Wagner)
|
11
|
Fe + BV
|
|
Apionidae
|
Ischnotrachelus dorsalis (Chevrolat)
|
11
|
Fe + BV
|
|
Lagriidae
|
Chrysolagria nairobana (Borch).
|
14
|
Fe + BV
|
|
Lagriidae
|
Chrysolagria cuprina (Thomson)
|
14
|
Fe + BV
|
|
Apionidae
|
Apion varium (Wagner)
|
32
|
Fe
|
|
Lagriidae
|
Lagria villosa (Fabricius)
|
45
|
Fe + Fl
|
|
Chysomelidae
|
Asbecesta spp.
|
60
|
Fe + Fl
|
|
Meloidae
|
Mylabris spp.
|
60
|
Fe + Fl
|
|
Lycidae
|
Lycus proboscideus (Fabricius)
|
60
|
Fl
|
|
Cetoniidae
|
Diplognatha gagates (Förster)
|
60
|
G
|
|
Lépidoptères
|
|
Arctiidae
|
Spilosoma maculosa (Stoll)
|
42
|
Fe
|
|
Pyralidae
|
Maruca vitrata (Fabricius) (= testulalis Geyer)
|
43
|
Fl + G
|
|
Tortricidae
|
Cydia ptychora (Meyrick)
|
52
|
G
|
|
Thysanoptères
|
|
Thrypidae
|
Megalurothrips sjostedti (Trybom)
|
43
|
BV + BF +Fl
|
|
Homoptères
|
|
Aphididae
|
Aphis craccivora ( Koch)
|
11
|
Fe
|
|
Cicadellidae
|
Empoasca dolichi (Paoli)
|
23
|
Fe
|
|
Orthoptères
|
|
Pyrgomorphid
ae
|
Zonocerus variegatus (L.)
|
23
|
Fe
|
|
Hétéroptères
|
|
Lygaeidae
|
Oncopeltus famelicus (Fabricius)
|
35
|
Fe + G
|
|
Pyrrhocoridae
|
Physopelta melanoptera (Distant)
|
35
|
Fe + G
|
|
Plataspidae
|
Coptosoma nubilalis (Germar)
|
42
|
Fe + G
|
|
Pentatomidae
|
Caura pugilator (Fabricius)
|
42
|
Fe + G
|
|
Plataspidae
|
Brachyplatys testudonigra (De Geer)
|
45
|
G
|
|
Pyrrhocoridae
|
Dysdercus superstitiosus (Fabricius)
|
45
|
G
|
|
Coreidae
|
Clavigralla (=Acanthomia)
tomentosicollis (Stãl)
|
53
|
G
|
Source: Atachi & Adéoti (2004)
BF = Boutons floraux; BV = Bourgeons végétatifs; Fe
= Feuilles; Fl = Fleurs; G = Gousses
1-2 Insecte : M. vitrata
Maruca vitrata (Fabricius) est un ravageur
sérieux de niébé. Une étude approfondie est
indispensable pour établir les moyens de lutte nécessaires contre
ce dernier.
1-2-1 Systématique - Origine - Distribution
Maruca vitrata Fabricius est un petit papillon
nocturne de la famille des Pyralidae, l'une des plus grandes Familles
de l'ordre des lépidoptères avec près de 10.000
espèces recensées (Chu, 1949). C'est sur Phaseolus mungo
que le papillon a été rencontré pour la première
fois (Dietz cité par Gblagada, 1982). Il est couramment appelé
« foreuse des gousses » en français et « bean pod borer
» ou « cowpea pod borer » en anglais. L'origine de cet insecte
reste encore incertaine (Waterhouse & Noris, 1987). En effet, le genre
Maruca dans lequel est inclus M. vitrata semble trouver son
origine en Asie du Sud- Est (Tamò et al., 1997). Selon les
mêmes auteurs, le genre Maruca comporte également deux
autres espèces : Maruca amboinales (Feldand Rog) et Maruca
nigroapicalis (De joannis). Cet insecte fut signalé en Irland de
l'ouest comme l'insecte parasite le plus abondant et le plus redoutable dans
les champs de haricot et de niébé (Scott, 1940). De nos jours, il
est largement répandu dans les régions tropicales et
subtropicales d'Amérique, d'Afrique, d'Asie et dans la région
pacifique où il est considéré comme un important ravageur
de niébé, du pois d'angole (Cajanus cajan) (L) Millsp)
et d'un certain nombre de légumineuses (Singh & Jackai ,1988). Cet
insecte est distribué dans une grande partie de l'Afrique
sub-saharienne. Ce ravageur est bien établi dans la zone
écologique du sud et du centre du Bénin (Arodokoun et
al., 1997).
Parmi les diverses plantes hôtes (Tableau 5), le
niébé est la principale plante hôte cultivée que
M. vitrata peut exploiter toute l'année lorsqu' elle est
disponible (Atachi & Djihou, 1994 ; Arodokoun et al., 2003). La
figure 2 présente la répartition géographique de M.
vitrata en Afrique.
1-2-2 Description
La chenille, brun chair, de tête noire, a des faces
dorsale, latérales et ventrale ponctuées de taches brun- noir
(Singh & Allen, 1979). Selon Atachi & Gnanvossou (1989), la capsule
céphalique noirâtre a un diamètre médian qui varie
entre 0,1 et 1,4 mm. Le cycle de l'insecte comprend cinq (5) stades larvaires.
Les premiers stades larvaires sont de couleur blanchâtre translucide de
petite taille après éclosion des oeufs. La chenille change de
couleur au fur et à mesure qu'elle passe d'un stade à l'autre et
devient de plus en plus sombre. La photo 1 montre les stades des chenilles de
M. vitrata.

L1
L2
L3
L4
L5
2mm
Photo 1: Les cinq stades larvaires de M.
vitrata (Photo réalisée par Goergen, IITA)
> Adultes de M. vitrata (photo2)
C'est un petit papillon nocturne de corps brun foncé.
Les ailes antérieures sont marquées de taches blanchâtres
alors que les ailes postérieures sont blanc grisâtre avec des
marques sombres aux extrémités. Chez M. vitrata, il
existe un dimorphisme sexuel c'est -à- dire une différence
morphologique entre le mâle et la femelle. En effet, la femelle et le
mâle se distinguent par la face ventrale de leur abdomen. La femelle de
cet insecte a un abdomen brunâtre, un peu élargi et
évasé et se termine par un organe génital (orifice). Par
contre, le mâle a un abdomen noir gris, filiforme, spécialement au
quatrième et au cinquième segment et se termine par une partie
postérieure pointue.

2mm 2mm
(a) (b)
Photo 2 : Adultes de M. vitrata (Photo
réalisée par Goergen, IITA)
(a) Mâle adulte de M.vitrata
(b) Femelle adulte de M.vitrata
1-2-3 Biologie et Ecologie
Maruca vitrata a une biologie complexe due au
comportement de l'adulte en relation avec l'accouplement et le lieu
d'oviposition (Singh & Jackai ,1988). Après les études
effectuées sur le comportement au vol de M.vitrata à
l'Université d'Ibadan, Taylor (1978) conclut que les variations
saisonnières étaient fonction des facteurs climatiques telles que
la pluviométrie, l'humidité relative et la température.
Ainsi, une humidité relative élevée et des
températures nocturnes basses favorisent la reproduction chez cette
pyrale (IITA, 1983).
L'accouplement a lieu dans la nuit entre 21h00 et 5h00 avec une
température de 20 à
25 °C et une humidité relative d'au moins 80% (
Jackai et al., 1990). La femelle ne s'accouple qu'une seule fois,
entre la 2ème et la 5ème nuit suivant son
émergence (IITA, 1981).
Les oeufs sont déposés sur les bourgeons
floraux, les fleurs, les pédoncules (Jackai, 1981). En effet,
Crotalaria retusa Linn. est la plante hôte la plus favorable
à l'oviposition de cette pyrale (Atachi & Djihou, 1994). La femelle
pond environ 150 oeufs (Quintella et al., 1991) et selon Jackai et
al (1990), le nombre moyen d'oeufs par femelle est d'environ 400.
Après la ponte, les oeufs, d'abord translucides et difficilement
observables, virent à la couleur marron foncé à la fin du
développement embryonnaire qui intervient au bout de 2 ou 3 jours
(Okeyo- Owuor et al., 1981). L'éclosion des oeufs donne des
chenilles qui se développent en 5 stades (Atachi & Gnanvossou,
1989). Leur développement est optimal entre 27 et 32°C (IITA, 1982)
mais se trouve ralenti à 22°C et inhibé à 19°C
(Jackai & Daoust, 1986), et la durée du stade larvaire est de 8
à 14 jours (Singh & Jackai ,1985).
Les chenilles des jeunes stades (L1 ; L2 ; L3) sont moins
mobiles que celles des deux derniers stades (L4 ; L5) (Jackai & Daoust
,1986). Avant la chrysalidation, il y a une période de 1 à 2
jours au cours de laquelle la chenille devient verdâtree, perd tous ses
autres pigments et cesse de s'alimenter. La chenille au terme de son
développement se chrysalide dans le sol ou dans un cocon de soie
fixé à la plante (Taylor, 1967). La chrysalide, au début
verdâtre, change progressivement de couleur et devient brun foncé
au bout de 5 à 14 jours (Ochieng et al., 1981).
L'émergence de l'adulte est favorisée par une forte pluie ou
humidité du sol (Singh & Jackai, 1985). L'adulte est un papillon
nocturne mais on le voit parfois dans la journée (Allen et al.,
1996). L'insecte a une durée de vie variable. L'alimentation a un effet
sur les potentialités biologiques de l'insecte (Atachi & Ahounou,
1995). Selon ces mêmes auteurs, la longévité des femelles
est supérieure à celle des mâles dans tous les cas. Cet
insecte n'entre jamais en diapause même en conditions de vie difficiles
(Okeyo- Owuor & Ochieng, 1981), mais transite par de nombreuses plantes
hôtes alternatives qui sont en général des
légumineuses, ce qui maintient sa population dans les
écosystèmes (Atachi & Djihou ,1994).
Le tableau 5 présente les différentes plantes
hôtes possibles du ravageur.
Tableau 5 : Quelques plantes hôtes de
M.vitrata.
|
Familles
|
Espèces Végétales
|
Organes infestés
|
Sources
|
|
Fabaceae
" " " " " " " " " " " " " " " " " " " " " " " " " " " "
|
Vigna unguiculata (L.) Walp. Vigna mungo (L.)
Hepper Vigna triloba (Walp.) Savi Vigna radiata (L.) Wilczec
Cajanus cajan (L.) Millsp. Cajanus indicus (Spreng)
Crotalaria caricea
Crotalaria juncea (L.)
Crotalaria mucronata (Desv.) Crotalaria incana
(l.)
Crotalaria amazonas (L.) Crotalaria
misereninsis (L.) Crotalaria retusa (L.)
Crotalaria saltiana (L.)
Crotalaria goreensis (Guill. &Perr.) Arachis
hypogea (L.)
Dolichos Lablab (L.)
Dolichos sp.
Phaseolus vulgaris (L.)
Phaseolus Lunatus (L.)
Psophocarpus tetragonolobus (Neck.).
Sphenostylis stenocarpus (E.Mey.) Gliricidia
sepium (Jacq.) Walp. Vicia faba (L.)
Stizolobium sp.
Mucuna sp.
Tephrosia candida (Roxb.) Dc. Tephrosia
purpurea (L.) Pers. Eriosema psoraloides (Lam) G.Don.
Pericopsis laxiflora (Benth. Ex.
Bak.) van Meenwen
|
Fleurs, gousses, Bourgeons
"
Gousses
Fleurs, gousses Gousses
Fleurs,
Fleurs, gousses Gousses
Fleurs Fleurs Fleurs
Fleurs, gousses Fleurs
Fleurs gousses
Fleurs Fleurs Fleurs Fleurs -
Fleurs Fleurs Fleurs Fleurs Fleurs Fleurs Fleurs
Fleurs, gousses Fleurs
Fleurs Fleurs
|
Taylor (1978)
" " " " " " " " Jackai (1983)
"
"
Atachi &
Djihou (1994
" " " " " " " " " " " " Jackai (1983)
"
"
"
Atachi &
Djihou (1994)
"
"
|

Tableau : Quelques plantes- hôtes de
M.vitrata (suite et fin)
|
Familles
|
Espèces Végétales
|
Organes infestés
|
Sources
|
|
Fabaceae
|
Phaseolus adenanthus (G.)F.W.Mey.
|
Fleurs
|
Atachi &
|
|
"
|
Phaseolus lunatus (L.)
|
Tige tendre,
|
Djihou (1994)
|
|
"
|
Pseudovigna argentea (Willd.) Verde
|
fleurs, gousses
|
"
|
|
"
|
Pueraria phaseoloïdes (Roxb.) Benth
|
Fleurs
|
"
|
|
"
|
Rhynchosia minima (Harv.) Meiklo.
|
Bourgeon végétatif,
|
"
|
|
"
|
Tephrosia bracteolate (Guill. & Perr.)
|
fleurs
|
"
|
|
"
|
Vigna racemosa (G.Don) Hutch &
|
Fleurs
|
"
|
|
"
|
Dalz
|
Fleurs
|
Arodokoun
|
|
"
|
Tephrosia Humilis (G.et Perr.)
|
Fleurs
|
(1996)
|
|
"
|
Tephrosia platycarpa (Guill.& Perr.)
|
Fleurs
|
"
|
|
"
|
Milletia thonningii
|
-
|
"
|
|
"
|
Sesbania pachycarpa (D. C.).
|
-
|
"
|
|
"
|
Xerroderri sulthmanii (Taub.) Mend
|
-
|
"
|
|
"
|
& Sous.
|
-
|
"
|
|
"
|
Lonchocarpus sericeus (Poir) H.B.K
|
-
|
"
|
|
"
|
Lonchocarpus cyanescens (Schum
|
-
|
"
|
|
&Thonn)
|
-
|
"
|
|
"
|
Pterocarpus santalinoïdes (l'Her. ex
|
-
|
"
|
|
"
|
D.C.)
|
-
|
"
|
|
"
|
Pterocarpus erinaceus (Poir)
|
-
|
"
|
|
"
|
Pacchyrrhizus angulatus (Rich.)
|
-
|
"
|
|
"
|
Psophocarpus palustris (Deso.)
|
-
|
"
|
|
"
|
Afromosia laxiflora (Benth) Harms
|
-
|
"
|
|
"
|
Andira inernis (Wright) D.C.
|
-
|
"
|
|
"
|
Carnavalia ensiformis (L.) D.C.
|
-
|
"
|
|
"
|
Centrosema pubescens
|
-
|
"
|
|
"
|
Carnavalia virosa (Roxb.)
|
-
|
"
|
|
"
|
Esclerotona dolabriformis (coll.)
|
-
|
"
|
|
"
|
Parkia africana (Jack) Benth
|
-
|
Taylor (1978)
|
|
Mimosaceae
|
|
Feuilles
|
Atachi &
|
|
|
Gousses
|
Djihou (1994)
|
|
Cesalpinaceae
|
Poinciana sp
|
Gousses
|
Taylor (1978)
|
|
"
|
Cassia occidentalis (L.)
|
Fleurs
|
Atachi &
|
|
"
|
Cassia obtusifolia (L.)
|
Fleurs
|
Djihou (1994)
|
|
Pedaliaceae
|
Sesamun sp.
|
Fleurs, gousses
|
"
|
|
Malvaceae
|
Hibiscus sp
|
-
|
Taylor (1978)
|
|
"
|
Abutilon mauritianum (Jack) Medic.
|
Fleurs, fruits
|
"
|
|
Annonaceae
|
Annona senegalensis (Pers.)
|
Fruits
|
Atachi &
|
|
Moraceae
|
Ficus gnaphalocarpa (Miq) A. Rich.
|
Fruits
|
Djihou (1994)
|
|
Rubiaceae
|
Gardenia erubescens (Stapf & Hutch)
|
Fruits
|
"
|
|
Euphorbiaceae
|
Ricinus communis (L.).
|
Bourgeons végétatifs, fleurs
|
"
"
|
|
|
|
"
|
1-2-4 Ennemis naturels
Dans l'écosystème du niébé, il
existe une diversité d'ennemis naturels de M. vitrata.
Cependant, la chenille de M. vitrata est très peu
attaquée sur le terrain par les ennemis naturels, le taux d'infestation
variant entre 1 et 5%. Ainsi, Taylor (1967) a obtenu 5% ; Gblagada (1982)
trouva quant à lui 1,5 à 4,6 % et Adango (1994), 3,9% en
condition expérimentale et 3,2% en milieu paysan. Mais des interactions
diverses peuvent exister entre les ennemis naturels de M. vitrata et
ses plantes hôtes. Ainsi, l'action des ennemis naturels peut être
plus importante et plus efficace sur ces plantes hôtes que sur les
légumineuses herbacées. C'est le cas de Phanerotoma
leucobasis (Kriechbaumer), parasite ovo-larvaire de M. vitrata,
qui présente plus de succès sur les arbres et arbustes que sur
les légumineuses herbacées. Cependant, c'est le
phénomène contraire qui est observé chez
Trichogrammatoïdae sp. parasite oophage de M.vitrata
(Tamò et al., 2002). Les ennemis naturels peuvent être
répartis en trois catégories: les prédateurs, les
entomopathogènes et les parasitoides. Le tableau 6 présente les
principaux ennemis naturels de M.vitrata.
1-2-5 Les parasitoïdes
L'immense diversité des Arthropodes, en particulier
celle des insectes et des Acariens, en fait le groupe taxonomique
potentiellement le plus important comme source de biocides autonomes
potentiellement exploitables en lutte biologique. Ainsi, plus de 150.000
espèces d'insectes sont parasites ; la majorité d'entre elles
étant plus précisément des parasites d'autres insectes
(Waage & Greathead, 1986). Les espèces exploitées en lutte
biologique contre les ravageurs sont le plus souvent des
Hyménoptères Chalcidoîdes, ou Ichneumonoïdes, et des
Diptères tachinides ; mais d'autres groupes
d'Hyménoptères, de Diptères et Coléoptères
sont aussi exploités à un moindre degré (Poinar &
Thomas, 1985). Les parasitoïdes sont caractérisés par un
adulte ayant de forte capacité d'orientation et de
répérage d'hôtes potentiels. Généralement
l'adulte dépose un ou plusieurs oeufs de façon qu'ils soient
directement en contact de l'hôte soit en surface ou à
l'intérieur dans le cas d'Hyménoptère, mais seulement en
surface dans le cas des Tachines. Ainsi on distingue les endoparasites qui se
développent dans le corps de leur hôte et les ectoparasites qui se
développent à l'extérieur. Les parasitoïdes sont des
candidats de premier choix comme biocides autonomes applicables en la lutte
biologique contre les ravageurs. Leur utilisation présente certains
avantages sur d'autres possibilités, en particulier les microorganismes
:
- une forte autonomie et une grande mobilité se
manifestant par une capacité élevée de dispersion, de
repérage du ravageur et de suivi indépendant ;
- une bonne capacité d'auto propagation avec
possibilité d'effets durables sinon permanents et
modérément amplifiés pour que l'hôte convenable soit
accessible ;
- un niveau de sécurité exceptionnel pour la
santé humaine et la qualité du milieu et ;
- une spécificité très élevée
qui permet une capacité d'intervention précise contre un
ravageur particulier ou quelques espèces
apparentées. Mais leur emploi présente aussi des
inconvénients :
- le caractère onéreux de leur production en
masse qui nécessite l'élevage d'hôtes spécifiques
devant être aussi produits en masse à partir de plantes vivantes
ou de régimes alimentaires particuliers ;
- le fait que leur livraison vers le lieu d'intervention
nécessite des précautions spéciales pour assurer
l'intégrité des entomophages libérés ;
- le fait que leur libération soit surtout manuelle, donc
exigeante en main d'oeuvre ; - la longueur relative de leur délai
d'action ;
- l'incertitude quant au niveau de répression qui est
lié à l'influence des conditions extérieures sur
l'activité et la survie des parasitoides et ;
- le niveau élevé de leur spécificité
biologique qui limite la gamme des ravageurs visés et la position d'auto
propagation lorsque l'hôte a une faible densité.
· Apanteles taragamae (Viereck) > Origine
Apanteles taragamae a été
identifié dans les champs de Sesbania cannabina sur lequel
l'attaque de M. vitrata est aussi sérieuse. En effet, c'est
après une prospection pouvant aider à recenser tous les ennemis
naturels de M .vitrata que Apanteles taragamae fut
découvert à Taïwan.
> Biologie
Chez ce parasitoïde, il existe une différence
morphologique entre les deux sexes. Ainsi, la femelle a un corps noir mesurant
environ 2,89 mm de long. Elle possède des yeux noirs et deux antennes
qui mesurent environ 2,26 mm de long. Les ailes sont transparentes et les
pattes sont généralement noires. L'abdomen est noir et se termine
par un ovipositeur. Ce dernier mesure 1,35 mm de long environ. Par contre, le
mâle se distingue de la femelle par :
- un corps plus petit (2,28 mm de long environ)
- des antennes légèrement plus longues (2,59 mm de
long environ)
- un abdomen plus mince et sans ovipositeur.
Ils s'accouplent très tôt après leur
émergence. Les mâles émergent d'abord de la pupe et
fécondent les femelles au fur et à mesure qu'elles apparaissent.
Les femelles ne s'accouplent qu'une seule fois au cours de toute leur vie
(Ekpodilè, 2006). Le sexe ratio chez l'espèce est de 50% donc une
femelle pour un mâle. Mais quelquefois, 2 à 3 mâles essaient
de s'accoupler avec la même femelle et il s'en suit la mort de celle-ci.
Ceci pourrait, entre autres expliquer la mortalité des femelles au sein
d'une population. En effet, dans une population de A. taragamae, le
nombre de mâles dépasse largement celui de femelles. Les femelles
non fécondées des Hyménoptères en
général ne produisent que de mâles (Greathead et
al., 1992).
La recherche de l'hôte par la femelle se fait par une
prospection sans cesse sélective de l'organisme visé dans son
habitat. Ainsi avec ses antennes, elle identifie la chenille hôte, et une
fois la chenille retrouvée, elle peut monter sur elle et se pencher de
côté, baisse son abdomen, insère son ovipositeur dans la
chenille hôte et y dépose des oeufs. Cette phase dure
généralement quelques secondes. Les oeufs se développent
à l'intérieur de la chenille hôte jusqu'à
l'éclosion. La larve de A. taragamae qui sort de la chenille
hôte dure quelques heures (5 à 10 heures environ) et se transforme
en pupe. Pour sortir, la larve de A. taragamae, déchire le
corps de son hôte, entraînant ainsi la mort de celui-ci. La pupe
est cylindrique et arrondie aux deux extrémités. Elle mesure
environ 3,73 mm de long et 1,27 mm de large. Elle est d'une couleur blanc
claire au début et devient sombre à la fin de la pupaison.
L'émergence de l'adulte a lieu 4 à 8 jours après la
pupaison à 24,6°C et 80-85% d'humidité relative (Peter &
David, 1 990).Lors des périodes d'intense activité, le
parasitisme de A. taragamae atteint un seuil élevé de
63% des chenilles de M.vitrata trouvées sur S.
cannabina de juin à août avec une réduction de
septembre à novembre. (Huang et al., 2003)

2mm
Photo 3 : Adulte de Apanteles taragamae
(viereck) Réalisé par Dr Georgen, IITA-Bénin.
1-2-6 Dégâts et importance
économique
La foreuse de gousse occasionne de graves dégâts
sur les plants de niébé. Les dégâts de cette pyrale
ont été signalés surtout sur les Fabaceae cultivés
dans toutes les régions tropicales et subtropicales du monde (Atachi
& Djihou, 1994). Les dégâts sont causés par les
chenilles qui se nourrissent des tiges tendres, des pédoncules et des
fleurs. Ces chenilles, par l'intermédiaire des fils soyeux, migrent
d'une fleur à une autre. Dans ces conditions, 4 à 6 fleurs
peuvent être détruites avant le développement complet de la
chenille (Gblagada, 1982). La présence de l'insecte se signale par ses
excréments qui restent accrochés aux fils soyeux avec lesquels la
chenille lie les organes attaqués (Autrique & Perreaux, 1989).
L'incidence économique de ses dégâts est
remarquable. Dans ses travaux, Taylor (1978) a montré que les
activités de M. vitrata sont sérieuses, continuelles et
se situent généralement au dessus du seuil économique. Les
dégâts chez cet insecte entraînent des pertes de rendement
de 30 à 86 %, même chez les variétés à haut
rendement (Okeyo- Owuor et al., 1983) ou entre 20 à 80% (Singh
et al., 1990). Néanmoins, avec une lutte appropriée, les
rendements en graines de niébé peuvent passer de 100 - 300 kg
à plus de 1000 kg/ ha (Singh et al., 1990).
Pour accroître la production du niébé au
Bénin, des actions efficaces doivent être entreprises dans
plusieurs domaines pour favoriser son développement. Au nombre de
celles- ci, nous pouvons indiquer l'utilisation des bio pesticides, des
variétés résistantes aux insectes ou aux maladies, des
ennemis naturels et des méthodes efficientes résultant de la
combinaison d'au moins deux techniques de lutte pouvant contribuer à la
réduction sensible des ravageurs.
1-3 Méthodes de lutte contre M.
vitrata
La lutte contre ce ravageur s'avère nécessaire
afin de diminuer considérablement la pression d'attaque due à cet
insecte. Ainsi, pour la protection durable du niébé contre cette
foreuse des gousses, diverses méthodes ont été
développées. Ces dernières se substituent ou se
complètent dans le temps et dans l'espace. Ainsi, pour une lutte
efficace, les pheromones peuvent servir d'avertissement agricole puissant
pouvant nous aider à reduire le dégré d'infestation afin
de vite intervenir pour limiter les dégâts.
1-3-1 Pratique traditionnelle : Utilisation des pesticides
botaniques
Les diverses pratiques recouvrent l'utilisation des plantes
insecticides. Jackai & Oyediram (1991) disent à propos de
l'utilisation des plantes insecticides que les différentes
concentrations (5 ; 10 et 20%) d'huile de neem ont un effet inhibiteur
prononcé sur les chenilles de M. vitrata.
1-3-2 Lutte culturale
Elle requiert certaines pratiques culturales qui permettent
à la culture d'échapper aux dégâts causés par
les ravageurs. Certaines cultures associées avec le niébé
se sont avérées susceptibles de réduire les effets nocifs
de M. vitrata sur celui-ci. Ainsi, les lignées
résistantes du sorgho et du niébé en culture
associée protègent remarquablement leur homologue sensible contre
les principaux insectes parasites notamment M. vitrata (Omolo &
Ogango, 1999). Pour cette lutte culturale, il est aussi recommandé la
destruction des gousses attaquées ainsi que celles des
légumineuses qui poussent spontanément afin d'éviter le
maintien d'une population de ravageurs tout au long de l'année
(Autrique, 1981).
1-3-3 Lutte chimique
C'est la méthode de lutte la plus pratiquée.
Elle est fondée sur l'utilisation des pesticides qui anéantissent
le parasite par contact, par inhalation ou par ingestion. Plusieurs
insecticides ont été testés par différents
chercheurs pour le contrôle de M. vitrata. Les résultats
varient selon les saisons culturales, les localités et les
années. Il serait inexact de désigner l'insecticide le plus
efficace contre cet insecte. Ainsi, pour lutter contre cette pyrale, plusieurs
insecticides ont été étudiés par différents
chercheurs (Atachi & Adeoti ; 2004). Atachi & Souroukou (1989)
préconisent l'application du Decis (deltaméthrine) aux
45ème et 65ème jours après les
semis, alternée avec le Systoate (diméthoate) au
55ème jour aux doses respectives de 12,5 g/ha et 400g/ha. En
effet, selon les mêmes auteurs, le Decis contrôle mieux la
population larvaire de M . vitrata dans les fleurs et les gousses que
le systoate. Mais malgré le fait qu'ils contribuent à augmenter
les rendements en luttant contre les ravageurs, leur utilisation
présente beaucoup d'inconvénients parmi lesquels nous pouvons
citer : promotion de la résurgence, sélection des ravageurs
résistants, détérioration de la santé humaine et
animale, pollution du sol, de l'air et des eaux. La situation actuelle ne se
prête pas à la suppression totale des pesticides. Pour cela, des
efforts doivent être entrepris afin de minimiser les risques.
1-3-4 Résistance variétale
Il s'agit de la méthode la plus saine et la plus
importante pour lutter contre l'insecte. Elle repose sur l'utilisation de
variétés résistantes. Il s'agit de la capacité
génétique que présente le niébé à
donner un rendement de bonne qualité et plus élevé que les
variétés ordinaires pour une même densité de
population d'insecte. Selon Painter (1954) les mécanismes de base de
défense sont : l'antibiose, la tolérance ou la non
préférence.
La résistance des variétés VIT A5 et TVU
946 réside dans l'inhibition des premiers stades larvaires (Okech &
Saxena, 1990). Selon Oghiakhes et al. (1992), les
variétés de niébé qui produisent des gousses
à angles ouverts (> 89°) révélent une
résistance aux attaques de M .vitrata. Pour Machucka et
al. (1999), l'utilisation de l'antibiose est une voie prometteuse pour
l'obtention des variétés transgéniques résistantes
aux attaques de cette pyrale. Il est important de retenir que la
résistance variétale est le moyen de lutte le moins astreignant,
le plus économique et le moins polluant (Messiaen ,1981).
1-3-5 Lutte biologique
La lutte biologique est l'utilisation des organes vivants en
tant qu'agents de lutte contre les ravageurs. (Kumar, 1991). Selon le
même auteur, la signification traditionnelle de lutte biologique est la
manipulation des ennemis naturels des ravageurs visant à réduire
ces derniers à des niveaux rendant tolérables les pertes
économiques qu'ils entraînent.
Il est important de distinguer les différents types de
lutte biologique. Ainsi, il y a :
- la lutte biologique classique ou inoculative. On qualifie de
lutte biologique classique, ou par introduction, la technique qui consiste
à introduire une nouvelle espèce dans un environnement afin de
contrôler les populations d'un ravageur (Pedigo ,1996).
- la lutte biologique inondative est une technique
augmentative consistant à augmenter les populations d'ennemis naturels
existant déjà dans un milieu donné. Dans ce cas, les
quantités relâchées dans le milieu sont importantes et
l'objectif est de détruire immédiatement le ravageur sans que
l'établissement et la reproduction de l'ennemi naturel ne soient
visés. Des efforts considérables ont été
déployés pour le contrôle biologique de M. vitrata
ces dernières années (Tamò et al., 2003).
Les méthodes biologiques sont celles qui offrent le plus
de solutions véritables et durables (Cloutier & Cloutier 1992).
1-3-6 Lutte intégrée
La lutte intégrée est une pratique de lutte qui
associe au moins deux méthodes de contrôle complémentaires
des ravageurs (Kossou & Aho, 1993). Elle est un système de lutte
contre les ravageurs qui, dans le contexte de l'environnement et de la
dynamique des populations des espèces de ravageurs, emploie toutes les
techniques et les méthodes adaptées d'une manière aussi
compatible que possible, pour réduire et maintenir les populations des
ravageurs à des niveaux entraînant des dommages économiques
faibles (Glass ,1975).
Au Bénin, plusieurs projets, dont notamment le «
projet niébé », utilisent l'approche de lutte
intégrée contre les ravageurs du niébé. A cet
effet, Kossou et al. (2001) avancent une approche de lutte
intégrée selon laquelle une mesure de contrôle
intégrant la conservation des ennemis naturels à travers la
gestion des habitants des cultures et l'utilisation des plantes insecticides.
Cette méthode de lutte a pour objectif de mettre au point des
méthodes mixtes appropriées de luttes anti ravageurs qui seraient
en harmonie avec les réalités économiques et
écologiques, favorisant ainsi un équilibre environnemental fiable
et vivable.
1-3-7 La lutte microbiologique
Comme la plupart des animaux, les insectes sont sensibles aux
maladies causées par une variété d'organismes
pathogéniques dont certains présentent un potentiel
élevé en tant qu'agents de lutte biologique. Les
pathogènes pénètrent dans le corps de l'insecte de
manière passive lors de l'ingestion d'aliment ou active par les orifices
naturels ou par voie directe à travers la cuticule. Une fois à
l'intérieur de l'hôte, les pathogènes se multiplient
rapidement, puis entraînent la mort de l'hôte après une
période de latence plus ou moins longue en produisant des substances
toxiques ou en épuisant les ressources alimentaires de ce dernier. Cinq
principaux groupes ont montré dans la pratique, un potentiel
considérable en lutte microbiologique. Il s'agit des Bactéries,
des Virus, des Champignons, des Nématodes et des Protozoaires.
(Programme Natura/Nectar, 1996).
La plupart des pathogènes présentent une grande
spécificité et certains, notamment les virus, n'infectent qu'un
seul genre ou qu'une seule espèce d'hôtes (Cloutier &
Cloutier, 1992).
1-4- Les virus entomopathogènes
Les virus sont des organismes pathogéniques
obligatoires, ultramicroscopiques et intracellulaires. Ils sont
constitués d'un seul type d'acide nucléique (Acide
Desoxyribonucléique (ADN) ou Acide Ribonucléique (ARN)
entouré ou non d'une enveloppe protectrice de nature protéine ou
lipoprotéine appelée capsule. En effet, les virus sont capables
d'organiser leur propre réplication seulement à
l'intérieur de leur hôte (Mattews, 1991).
Hunter-Fujita et al. (1998), ont inventorié 13
familles de virus dont les Baculoviridae, les Iridoviridae, les
Réoviridae, les Entomopoxviridae, les Barvoviridae, les Ascoviridae, les
Birnaviridae, les Caliciviridae, les Nodaviridae, les Picornaviridae, les
Rhabdoviridae, les Tetraviridae, les Polydnaviridae, en plus d'un grand nombre
non encore classifié.
Environ 1600 espèces de virus ont été
isolées sur 1100 espèces d'insectes et d'acariens. Certaines
d'entre elles infectent seulement les Arthropodes et d'autres Crutacés.
Cependant, en pratique, seuls les Baculovirus sont actuellement utilisés
comme agents de lutte biologique (Dent, 1991).
1-4-1- Les Baculovirus
· Origine
Les Baculovirus ont été découverts pour
la première fois en Asie au 1 6ème siècle dans
une sériciculture de lépidoptère Bombyx mori. Ils ont une
grande importance dans la lutte biologique contre des ravageurs des
cultures.
En matière de lutte biologique, beaucoup de travaux
ont été faits sur plusieurs espèces de
lépidoptères. Mais c'est dans l'ordre des
Hyménoptères que deux espèces de guêpes ont
été identifiées (Catopsilia thauruma Mabille et
Catopsilia versicota Saalmuller) comme espèces ayant la
capacité de conservation du pouvoir infectieux des virus. Elles ont
été identifiées comme étant respectivement à
l'origine des Baculovirus et des Cypovirus (Morel & Fouillaud, 1994).
· Morphologie, Biologie et Taxonomie des
Baculovirus
Les Baculovirus constituent un groupe de virus très
vaste. Ils ont été isolés principalement des insectes et
un peu des autres arthropodes tels que les Crutacés et les Acariens,
Arachnides (Robert et al., 1984). Différentes espèces de
Baculovirus peuvent infecter des chenilles de lépidoptère dont
certaines sont des ravageurs de culture, mais aussi
des Hyménoptères, des Diptères, des
Coléoptères et des Trichoptères. Contrairement aux autres
virus des insectes, les Baculovirus ne semblent présenter aucun risque
écologique. En effet, aucun cas d'infection n'a été
observé jusqu' aujourd'hui chez les vertébrés ou les
végétaux, que ce soit en conditions naturelles ou
expérimentales. Devauchelle & Cérutti (2000) ont
montré que les Baculovirus sont très virulents pour certaines
espèces d'insectes mais sans effets néfastes sur les
vertébrés et les végétaux. Seules les chenilles
sont touchées après l'ingestion d'aliments contaminés. Ils
sont très spécifiques à l'espèce et parasitent
seulement une seule espèce d'insectes ou quelques espèces
à l'intérieur du même genre. Cependant, il y en a un petit
nombre qui peut infecter plusieurs espèces d'insectes à la fois.
Ces virus en forme de bâtiments enveloppés, d'une longueur
d'environ 250 - 300 nm et d'un diamètre de 30 - 50 nm avec une moyenne
de 45 nm , contiennent un génome constitué d'une molécule
d'ADN bicaténaire circulaire. Ils se répliquent uniquement dans
le noyau des cellules hôtes (Cloutier & Cloutier, 1992). Leur
structure est constituée d'une nucléocapside ou coque
formée de la chaîne d'ADN circulaire enroulée en spirale de
la capside. Il faut noter que ces nucléocapsides peuvent être
regroupées en faisceau délimité par une enveloppe
lipoprotéique appelée virion. Un corps d'inclusion
(polyèdre ou granule) peut contenir plusieurs virions. Il est
formé d'une protéine du nom de polyèdrine. La
polyèdrine est une protéine structurale viro-codée qui
constitue la matrice, protège les virions contre les influences de
l'environnement et permet à ces virus de persister pendant plusieurs
années sous conditions favorables. Chez les polyèdroses
nucléaires et les granuloses, les particules virales se
développent dans une structure cristalline de nature protéique
(corps d'inclusion), permettant de conserver le facteur d'infection hors de
l'hôte. On parle dès lors de virus d'occlusion (Hunter-Fujita
et al., 1998)
Les Baculovirus se dissolvent en présence d'une
solution alcaline : c'est un caractère physiologique propre à ces
virus entomopathogènes. La famille des Baculoviridae a été
connue depuis des décennies. Selon Greathead et al. (1992)
cette famille est subdivisée en deux sous-familles :
- les Eubaculovirinae constitués de deux Genres ;
+ Le genre polyèdre nucléaire (NPV on Nuclear
Polyhedrosis Virus) regroupe les virus qui sont inclus dans des corps
protéiques de 1 à 5 appelé polyèdres (Figure 3).
Dans ce groupe, on distingue deux sous-groupes de NPV selon que les particules
se présentent à raison d'une seule nucléocapside (SNPV =
Single Nuclear Polyhedrosis Virus) tel que Bombyx mori SNPV ou de
plusieurs nucléocapsides (MNPV=Multiple Nuclear Polyhedrose virus)
à l'exemple de l'Ac MNPV isolé des
chenilles d'Autographa californica.
+ Le genre Granulose (GV ou Granulosis Virus) au niveau
duquel il y a une seule nucléocapside dans un corps d'inclusion
appelé granule à l'exemple de Granulosis Virus (GV) isolé
à partir de Plutella xylostella.
La différence entre les deux genres est que les
polyèdroses nucléaires affectent principalement les
lépidoptères et les Hyménoptères phytophages tandis
que la Granulose affecte surtout les lépidoptères.
- les Nudibaculovirinae : cette sous-famille est
constituée des Baculovirus dépourvus de corps d'inclusion pendant
tout leur cycle de développement.
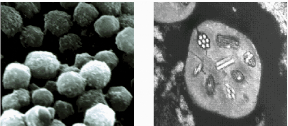
Figure 3: Polyèdres de NPV
(laissés) et une section transversale d'un MNPV
Source :
www.univ-montp1.fr/biotech/Baculovirus/BaculoStructure.htm-101K.
(2004)
GP 64
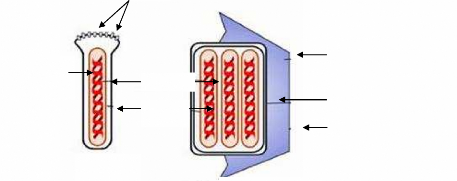
Corps d'inclusion (polyèdre ou granule)
nvelope du Enveloppe du virion
Enveloppe polyédrale
Enveloppe issue
de la cellule de ADN viral
l'hôte
Nucléo
Nucléo capside
Virus bourgeonné Vi
Virus dérivé par
occlusion
Figure 4: Schéma d'un virus
bourgeonné (BV) et d'un virus dérivé par
occlusion
Source :
www.
Univmonpt1.fr/biotech/Baculovirus/BaculoSommaire.htm (2001)
(ODV)
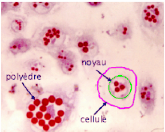
Figure 5: Culture de cellules Spodoptera litura
infectées par un Baculovirus
Source :
www.
Univmonpt1.fr/biotech/Baculovirus/BaculoSommaire.htm (2001)
· Ecologie des Baculovirus
Les Baculovirus vivent dans différents milieux mais ne
se multiplient que lorsqu'ils se retrouvent au sein de leur hôte. Ils
sont stables dans le sol et les autres milieux protégés. Cela
leur confère une longue persistance et une durabilité utile dans
l'optique de la production de bio pesticides (Jacques, 1973 ; Fuxa, 1987). Les
corps d'inclusion restent de préférence dans les premiers
centimètres du sol. Les particules virales sont très sensibles
à conditions environnementales telles que la température, le pH
et le rayon ultra violet.
Après infection virale, des chenilles meurent puis
libèrent de nombreuses particules virales dans le sol. Ces particules
sont suffisamment importantes pour infecter d'autres individus. En effet, les
polyèdres en provenance des chenilles mortes contaminent les environs et
les feuilles inférieures des plantes ; ils constituent donc une nouvelle
source d'infection pour d'autres chenilles vivant à proximité.
Il a été constaté que 98% de corps
d'inclusion de Mamestra brassicae NPV ont disparu du sol après
une période de 12 mois (Evans et al., 1980). De même, la
persistance de l'activité des Baculovirus s'atténue avec le temps
lorsqu'ils se retrouvent dans le sol, dans l'eau et dans tout milieu qui leur
est défavorable.
· Mode d'action et cycle de réplication
Les Baculovirus utilisent plusieurs modalités pour
infecter leurs hôtes : l'ingestion, les voies ovariennes, l'infection par
contact direct. Mais, l'infection baculovirale commence par l'ingestion des
corps d'inclusion (OB) sur le régime de l'insecte hôte.
Au cours du processus d'infection dans le noyau des cellules,
ces virus forment des corps d'inclusion constitués de plusieurs
particules virales dans une matrice protéinique
composée principalement de la polyédrine,
simple polypeptide. Les polyèdres, une fois ingérés par
les larves, sont dissouts dans le suc intestinal en général
très alcalin ; les virions sont libérés puis
pénètrent dans les cellules intestinales par fusion membranaire
ou endocytose (Figure5). Après leur passage dans
l'épithélium intestinal, ces virus infectent les hémocytes
et les tissus adipeux de leur hôte où ils se multiplient.
Chez les Lépidoptères, l'infection est
normalement limitée à l'intestin. Les virus secrètent dans
le corps des larves, une sorte de protéase qui permet aux cheniiles de
s'éclater et de libérer les corps d'inclusion. Les chenilles
atteintes de maladies virales apparaissent souvent pâles et flasques.
Elles prennent la couleur brune et noire par suite d'une infection
bactérienne. Dans certains cas, les virus liquéfient les corps
gras, entraînant une turgescence de la larve suivie de sa mort (Meynadier
et al., 1993) 5 à 14 jours après l' infection. Chez les
Lépidoptères, la majorité des cellules du corps de la
chenille infectée est finalement envahies par le virus. Les particules
virales forment 30% du poids sec des larves malades à la fin du
processus d'infection (Programme Natura/Nectar, 1996).
Après la mort de l'insecte, les corps d'inclusion
très résistants sont disséminés dans la nature pour
réinitier une autre infection après libération des
particules virales qu'ils contiennent. Les polyèdres représentent
principalement la forme d'infection de larve à larve à
l'intérieur de l'insecte alors que les virions sont transmis de cellule
à cellule par exocytose (Cloutier & cloutier, 1992).
Chez les Baculovirus, il existe la synthèse biphasique
de deux particules différentes de virus : les particules virales
extracellulaires issues du bourgeonnement de la cellule et les particules
virales incluses dans les polyèdres. Les Virus Bourgeonnés (BV)
contiennent généralement une seule nucléocapside simple,
tandis que les Virus Dérivés par Occlusion (ODV) en contiennent
plusieurs (Figure 6). Les nucléocapsides bourgeonnent dehors par le mur
de cellules qui est préalablement modifié par l'addition de la
protéine virale GP 64. Les ODV sont produits au cours de la
dernière étape de l'infection virale (Fuxa, 1987). Ils sont
enveloppés d'un corps protéique
· Transmission et importance des
Baculovirus
La transmission peut être divisée en deux
grandes catégories selon la manière dont le pathogène est
introduit dans la population hôte. La transmission est dite horizontale
lorsque le pathogène passe d'un individu à un autre sans que cela
ne soit de parent à descendant direct (Canning, 1982). Cette
transmission peut avoir lieu dans une même génération ou
d'une
génération à une autre et ne
dépend pas de la voie d'entrée. La transmission est dite
verticale lorsqu'il y a un transfert direct du pathogène de l'organisme
d'un parent vers sa descendance (Fine, 1975). Cette transmission permet le
transfert du pathogène d'une génération à une
autre. Elle est aussi appelée transmission congénitale,
parentale, héréditaire ou transovariale.
Chez les Baculovirus, la transmission horizontale est de loin
la plus fréquente (Kelly, 1981), et la voie d'entrée dominante
est la bouche. La transmission orale se fait par ingestion d'aliments ou de
matières fécales contaminées par les virus, mais cela peut
aussi avoir lieu lorsque des individus se nourrissent directement des cadavres
infectés suite à un cannibalisme des hôtes infectés
(Tanada, 1964). Il faut noter que le phénomène de cannibalisme
est très prononcé chez Maruca vitrata en cas
d'insuffisance alimentaire.
Les Baculovirus peuvent aussi être transmis directement
par les téguments, par l'ovipositeur d'Hyménoptère.
L'inoculation de l'hôte sain se fait directement dans l'hémocoele
par un ovipositeur contaminé. Les parasitoïdes peuvent aussi
transporter mécaniquement le virus sur le corps d'un hôte sain, et
l'entrée se fait par ingestion (Raimo et al., 1977 ). La
contamination initiale du parasitoïde adulte résulte
fréquemment de l'oviposition dans un hôte malade mais peut aussi
se produire lorsque le parasitoïde a réussi à se
développer dans une chenille d'hôte malade (Vail, 1981).
Membrane péri trophique
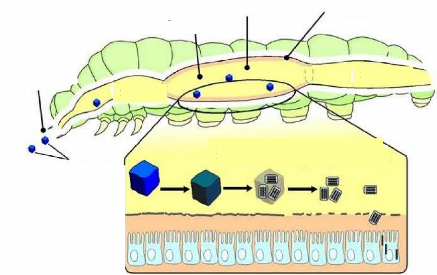
Intestin
pH alcalin
Ingestion des polyèdres
Post-intestin
Pré-Intestin
Dissolution des polyèdres pour libérer les
virions: Rupture de la membrane péri trophique
Polyèdres à virions enveloppés
Membrane péri-trophique
Cellules intestinales
Figure 6 : Diagramme montrant le cycle
d'infection d'un insecte hôte par le NPV Source
:www.univ-montp 1 .fr/biotech/Baculovirus/BaculoStructure.htm- 101K
(2004) .
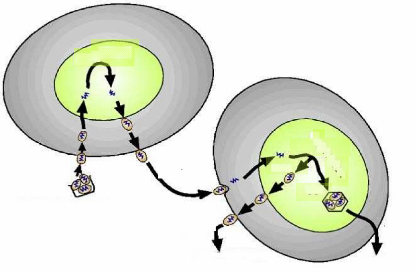
Réplication
Réplication
Virus bourgeonné
Précoce
Tardif
Dissémination
Polyèdres dissous: migration et fusion des virions
à la membrane des cellules intestinales
Virus bourgeonné
Dissémination
Virus inclus
Lyse cellulaire
Figure 7 : Cycle de réplication des
Baculovirus
Source :
www.univ-montp1.fr/biotech/Baculovirus/BaculoStructure.htm-101K.
(2004)
· Importance et limite des Baculovirus dans la
lutte biologique
Les Baculovirus ont présenté depuis longtemps
un grand intérêt dans la lutte contre les ravageurs des plantes.
Ils causent souvent des épizooties, exterminant presque des populations
entières de chenilles et des insectes, généralement
à la fin de la saison de croissance. Ces maladies sont relativement
spécifiques à un nombre limité d'espèces
d'hôtes potentiels (Dent, 1991).
Ces virus peuvent aussi rapidement causer la mortalité
dans les 4 à 6 jours qui suivent l'infection selon la dose, la
concentration et l'isolat du virus.
Les Baculovirus sont des virus exclusivement
pathogènes d'invertébrés, en particulier les insectes,
mais bénins pour les vertébrées. Les différents
tests exécutés par Possée et al. (1993) ont
attesté la non toxicité des Baculovirus pour les
mammifères et même les formes recombinées. Plus de 3000
espèces d'insectes ont été contrôlées par le
virus. Le mode d'action hautement spécifique et unique, la
spécificité de l'hôte, font des Baculovirus une forme de
lutte séduisante pour les agriculteurs, et cadre bien avec les
programmes de lutte intégrée. Ils constituent des agents
sécuritaires du point de vue de la santé des
vertébrés et
entraînent des impacts environnementaux très
négligeables.
Les caractéristiques principales des biopesticides
à base de Baculovirus sont : la spécificité, la haute
virulence, la rapidité d'action et le niveau raisonnable de persistance
dans l'environnement. (Dent, 1991).
Les problèmes liés au développement de
ces biopesticides sont les suivants : leur spectre d'action étroit, la
lenteur de leur action par rapport aux insecticides chimiques, l'importance de
programmation du traitement, la persistance limitée au champs, la
sensibilité au rayonnement solaire et au PH plus élevé du
feuillage. La durée de vie des Baculovirus est limitée par
rapport aux insecticides chimiques. Leur rémanence est affectée
par les radiations ultraviolettes. Les NPV et GV deviennent inactifs
après quelques heures d'exposition au rayonnement solaire (Franz, 1971).
Les rayons UV dénaturent les molécules d'ADN, ce qui bloque la
réplication de l'ADN.
Le coût de production de ces agents constitue un frein
à son développement, du fait qu'ils doivent être produits
in vivo dans des cultures de cellules d'insectes ; ce qui nécessite un
dispositif de culture cellulaire assez complexe. Le marché pourrait donc
être assez limité à cause de la spécificité
de la cible pour les Baculovirus et du nombre restreint d'espèces
d'insectes ravageurs pour lesquelles ils sont pathogènes.

DEUXIEME PARTIE : MATERIEL
ET METHODES
2.1. Cadre de l'étude
Les essais ont été conduits au laboratoire de
Pathologie de la Station de l'IITA-Bénin située dans la Commune
d'Abomey-Calavi à 12 km au Nord de Cotonou. Elle s'étend sur une
superficie de 50 ha de terre dans le voisinage de l'Université
d'abomey-Calavi. C'est le Centre de Lutte Biologique pour l'Afrique.
2.2. Matériel
2.2.1. Matériel entomologique
Pour le déroulement de nos essais, nous avons
utilisé des chenilles de M. vitrata à deux
différents âges à savoir : 4 jours et 5 jours. Ces deux
âges larvaires correspondent respectivement aux stades L2 et au
début du stade L3 (Atachi, 1998). Toutes ces chenilles nous ont
été fournies par le Laboratoire d'élevage de la Section
niébé de la Station de l'IITABénin.
Nous avons aussi utilisé des parasitoïdes
femelles déjà accouplées de A. taragamae et
possédant toutes leurs potentialités génétiques.
Tous ces insectes nous ont été fournis par le Laboratoire
d'élevage de la Section niébé de notre élevage.
2.2.2. Matériel entomopathogène
Le virus polyédrose nucléaire (MaviNPV) ,
spécifique à M. vitrata qui est un virus
pathologène spécifique d'insectes les mieux connus dans le
contexte de la lutte biologique, a été utilisé ( Miller
et al., 1983). Ce virus a été importé de Taiwan
et introduit au Bénin par l'IITA en 2006.
2.3. Condition de laboratoire
Tous nos essais se sont déroulés dans une gamme de
température et d'humidité. La température variait entre 24
et 26°C avec une humidité relative variant entre 75 et 85%
2.4. Matériel de laboratoire
Plusieurs équipements ont été
utilisés au laboratoire au cours de nos travaux de recherche surtout
pour la production de virus :
- une hotte de marque BIOHAZARD MICROFLOW : c'est une
enceinte qui protège le manipulateur contre toute contamination,
explosion et brisure de verres. Elle permet aussi d'éviter les
microorganismes non désirés présents dans les alentours
immédiats de même que les particules et odeurs provenant de la
manipulation des produits ;
- un petit pulvérisateur de capacité 250 ml
nécessaire pour l'application de la suspension virale sur le milieu
nutritif artificiel lors de l'infestation en masse des chenilles ;
- une centrifugeuse de marque ALC-PK 121, série 30007057
CE, pour centrifuger le broyat lors de la purification du virus ;
- un microscope optique de marque LEICA DMLB muni d'une
caméra vidéo couleurs
JVG de marque SANYO, série TK-1280E, pour
visualiser les corps d'occlusion ;
- une microbalance de marque Denver Instrument (Max = 220 mg ;
Min = 10 mg, d = 0,1
mg) qui permet de peser la poudre de SDS (Dodecyle Sulfate de
Sodium) afin de
préparer la solution SDS 0,1% ;
- un homogénéiseur de marque JANKE &
KUNKEL-IKA, qui sert à faire dissoudre la poudre de SDS dans l'eau
distillée stérilisée ;
- un agitateur magnétique de marque JANKE &
KUNKEL-IKA qui sert à faire dissoudre la poudre de SDS dans l'eau
distillée stérilisée.
- un réfrigérateur de marque VESTFROST, dont la
température interne est maintenue à 4° C servant à la
conservation des suspensions virales ;
- un congélateur de marque LIEBHERR dont la
température interne est maintenue à - 12°C et qui sert
à conserver les chenilles mortes ou malades ;
- des boîtes pour garder les chenilles et les
parasitoïdes ;
- des toiles pour couvrir les boîtes et permettre aux
chenilles de respirer ;
- des plateaux dans lesquels on met les boîtes ;
- des étiquettes pour numéroter les boîtes
et les plateaux ;
- une boîte contenant du miel pour nourrir les
parasitoïdes ;
- un incubateur de marque Percival ayant l'image d'un
réfrigérateur dans lequel les
plateaux contenant les chenilles
sont stockées et gardées durant toute la durée de l'essai
;
- un hématimètre de type NEUBAVER qui est
l'élément indispensable pour la numération
du virus. Il
présente 25 grands carreaux subdivisés chacun en 16 petits
carreaux de
surface de base 1/400 mm2 et de profondeur 0,1 mm
;
- des lames et lamelles servant aux montages microscopiques pour
observer les chenilles mortes afin de constater la présence de virus
;
- une trousse à dissection comportant ciseaux, pincette
et pinceau ;
- un mixeur de marque WARING BLENDOR qui sert à broyer
les chenilles mortes au cours de la production ;
- un compteur manuel de marque VEEDOR-ROOT (V/R) qui sert
à compter afin de calculer les différentes concentrations ;
- un distillateur GFL de type 2008, fréquence 50/60,
puissances 6kw qui sert à préparer de l'eau distillée ;
- une autoclave de marque SYSTEC modèle 3870 EL type
TUTTAUER Autoclave permettant la stérilisation de certains
matériels utilisés au cours de l'essai ;
- des béchers, des erlenmeyers ;
- des désinfectants tels que : (l'alcool, l'eau de javel
et le savon MIR) pour nettoyer les
boîtes utilisées évitant ainsi toute
autre contamination pouvant biaiser les données ; - un
thermomètre et un hygromètre pour relever la température
et l'humidité relative ; - des micropipettes de capacité 10 ul et
1000jtl pour pipeter la quantité de la suspension
virale voulue ;
- un aspirateur muni d'embouchure servant à
prélever les parasitoïdes pour l'inoculation et ;
- des papiers aluminium et torchons pour emballer le reste du
milieu nutritif et nettoyer les outils utilisés.
2.5. Méthodes
Pour atteindre les objectifs que nous nous sommes fixés,
les étapes suivantes ont été adoptées.
2.5.1. Formation à la Station de l'Institut
International d'Agriculture Tropicale (IITA)
Une formation de deux mois a été
organisée à notre intention. Cette formation a eu lieu d'une
part, au niveau du prototype où se fait l'élevage en masse de
M. vitrata sur milieu artificiel, à l'insectarium où se
fait l'élevage en masse de A. taragamae et d'autre part, dans
la
section pathologie où la production en masse du virus se
fait.
A l'issue de notre formation, nous avons été
capable de :
- identifier les adultes (papillons) de M. vitrata ;
- identifier les différents stades larvaires;
- identifier les pupes et les adultes de A. taragamae
et ;
- produire en masse le virus MaviNPV.
Il est important de mentionner que tous les objectifs
préfixés pour la formation ont été atteints
à la fin de celle-ci.
2.5.2. Production en masse de Maruca vitrata
La production en masse des adultes de M. vitrata se
fait déjà au Laboratoire suivant les techniques d'élevage
développées par Jackai & Raulston (1988). La production en
masse consiste à produire en nombre très important des chenilles
de M. vitrata devant être infectées avec le virus.
Ainsi, cette production consiste à recueillir les
oeufs de M. vitrata dans les boîtes de 60cc qui sont
déposées sur le milieu nutritif artificiel à la veille de
l'éclosion. Dès l'éclosion, les chenilles quittent les
boîtes pour le milieu nutritif où elles s'alimentent
jusqu'à leur chrysalidation. A l'étape chrysalide, les chenilles
cessent de s'alimenter jusqu'à l'émergence des papillons. Ces
adultes sont transférés dans les cages d'élevage au sein
desquelles, des boîtes de Petri contenant du coton imbibé de
solution de saccharose à 10% et du coton imbibé d'eau
distillée comme substrat alimentaire sont mises. Trois jours
après leur émergence, les adultes sont soumis à
l'accouplement pendant 24 heures. Les femelles sont ensuite isolées dans
les boîtes de 60 cc et incubées dans une chambre noire pour la
ponte des oeufs. Les oeufs évoluent en chenilles de même âge
et sont nourries au milieu artificiel jusqu'au stade larvaire
désiré, isolées du milieu à l'aide des pincettes
pour servir à la production en masse du virus. La même technique
est utilisée pour assurer la fourniture régulière des
chenilles aux stades désirés pour nos essais.
2.5.3. Préparation du milieu nutritif artificiel de
Maruca vitrata
Pour préparer le milieu nutritif artificiel, il faut
en un premier temps, verser 59,2 g d' agar dans deux litres d'eau
distillée. On porte le mélange à ébullition,
remué à l'aide d'une cuillère pour éviter la
formation des grumeaux. On laisse le mélange ainsi obtenu se refroidir
jusqu'à une température de 60°C environ. Cette
température nous permet d'obtenir un gel qui est un fluide.
En second temps, on verse deux litres d'eau distillée
avec les ingrédients du tableau 6. Le mélange ainsi fait est
ajouté au mélange d'agar obtenu au préalable. L'ensemble
du mélange est remué énergiquement afin
d'homogénéiser le mélange. Après un moment de
remuage, le mélange ainsi obtenu est coulé sous hotte dans les
boîtes cylindriques réservées à cette fin. Il faut
noter que la hauteur du milieu coulé dans les boîtes est environ 1
cm. C'est de ce milieu nutritif que se nourrissent les chenilles jusqu'à
l'émergence des adultes.
Tableau 6 : La composition du milieu artificiel
d'élevage de M. vitrata et les
Rôles de quelques composantes.
Constituant
|
Rôle /utilité
|
Quantité
|
Premier mélange Eau
|
|
2000 ml,
|
Agar agar
|
Liant nécessaire pour donner une certaine
consistance au milieu
|
59,2 g,
|
Deuxième mélange
Farine de graine de
niébé
|
Utilisé pour rapprocher le milieu artificiel de la
nourriture naturelle des chenilles
|
400 g,
|
Farine de germe de blé
|
Permet d'apporter l'énergie à partir du glucose
pour assurer la croissance des chenilles
|
127 g,
|
Sucre
|
Permet d'apporter de l'énergie
|
60 g,
|
Mélange de sels de
Wesson
|
|
44 g,
|
Auréomicine
|
Antibiotique qui empêche le développement des
bactéries sur le milieu
|
11 g,
|
Acide sorbiques
|
Rôle de stabiliseur du milieu
|
6.82 g
|
Méthyl. Parahydroybenzoate
|
|
3.64 g,
|
Acide L. ascorbique
|
A un rôle phagostimulant pour les chenilles ; c'est un
élément nutritif indispensable à leur croissance
|
25 ml,
|
Acide acétique
|
Rôle de stabiliseurs du milieu
|
50 ml,
|
Formaldéhyde
|
Antibiotiques qui empêchent le développement des
bactéries sur le milieu
|
60 ml,
|
Hydroxyde de
potassium
|
|
22 ml,
|
Choline chloride
|
|
29.2ml
|
Vitamine B-complexe
|
|
30 ml
|
Eau
|
|
2000ml
|
|

Source : Jackai & Raulston, (1988)
2.5.4. Obtention et multiplication des adultes de Apanteles
taragamae
Les adultes de A. taragamae utilisés ont
été obtenus au centre AVRDC (Asian Vegetable Research and
Development Center) à Taïwan et introduits à l'insectarium
de l'IITA-Bénin où ils sont produits et élevés en
masse. A l'aide d'un aspirateur, on introduit deux (2) femelles fécondes
de A. taragamae dans chacune de ces boîtes. Ces dernières
sont ensuite couvertes par un tissu en mousseline sur lequel on dépose
une goutte de miel pour l'alimentation des parasitoïdes. Elles sont
ensuite fermées avec des couvercles perforés. Les femelles du
parasitoïde A. taragamae pondent dans les chenilles. Après
24 heures, les femelles sont retirées des boîtes. On introduit
ensuite dans les boîtes où séjournent les chenilles de
M. vitrata parasitées, un autre morceau du milieu nutritif
artificiel et un bout de papier torchon pour réduire l'humidité
dans les boîtes. Les oeufs de A. taragamae se développent
et éclosent à l'intérieur des chenilles. Sept à
huit jours après l'inoculation, les larves de A. taragamae
sortent des chenilles de M. vitrata et se transforment en pupes au
bout de quelques heures (Ekpodilé, 2006). Ensuite on procède au
dépouillement qui consiste à la collecte des pupes des
boîtes de 30 cc dans les boîtes cylindriques de 60 cc. On les
couvre de toile en mousseline sur laquelle on met une goutte de miel pour
l'alimentation des adultes dès leur émergence.
2.5.5. Production, Purification et Comptage du virus
MaviNPV
Dans le but de disposer d'une quantité suffisante de
suspension virale pour effectuer nos essais, nous avons procédé
à une production en masse du virus MaviNPV.
Pour produire le virus en masse, la suspension virale de
MaviNPV de concentration 4,07.108 PIB/ml préparée
à partir de la poudre de ce virus produite à Taïwan à
partir d'une autre lignée de chenille de M. vitrata a
été utilisée. Elle a été conservée au
réfrigérateur à 4°C.
· Méthode de production du virus
Le travail se fait sous hotte à flux laminaire pour que
l'inoculation se réalise sans
contamination et s'inspire des travaux de Shapiro (1986). Les
étapes sont les suivantes :
- 4000 chenilles de 2ème stade ont
été dépouillées au Laboratoire d'élevage de
M. vitrata ;
- une suspension virale à inoculer aux chenilles en
fonction du nombre de chenilles à
infecter est préparée ; soit à inoculer 5
iil de cette suspension à la dose virale de
104PIB/ml à chaque chenille ;
- sous une hotte, le milieu nutritif artificiel a
été découpé en petits morceaux cubiques sur
du papier aluminium ;
- le milieu nutritif artificiel ainsi découpé, a
été pulvérisé avec la suspension virale
préparée en prenant soin de bien mouiller chaque morceau cubique
;
- le milieu infecté est versé dans un bac
d'alimentation en plastique où les chenilles sont déposées
;
- les chenilles sont suivies quotidiennement ;
- après être nourries de la
quasi-totalité du milieu infecté, les chenilles sont
isolées par lots de cinq (05) dans les boîtes de 30 cc où
elles sont nourries au milieu nutritif sain, c'est-à- dire exempt de
suspension virale ;
- les chenilles infectées sont
récoltées. Les premiers symptômes apparaissent après
4 jours. Les chenilles infectées portent dans leur corps un pus
blanchâtre visible à travers la cuticule. La récolte se
fait avant la mort de la chenille pour éviter la contamination par les
spores de champignons et ;
- les chenilles récoltées sont stockées
dans un congélateur à - 12°C.
Au total 3568 chenilles malades ont été
collectées excepté celles éclatées et qui suintent
déjà. La production en masse a duré huit (08) jours
environ. Les chenilles gardées au congélateur sont soumises
à l'extraction et à la purification du virus.
· Extraction et purification du virus
C'est la méthode de centrifugation différentielle
décrite par Harrap et al. (1977) et Hunter et al.
(1984) pour les baculovirus qui est utilisée. Elle se déroule
comme suit :
- à l'aide d'un mixeur, les chenilles infectées
sont broyées et homogénéisées dans un
volume égal de 0,1% de Dodécyl Sulfate de Sodium
(SDS = Sodium Dodecyl
Sulphate) ;
- l'homogéinat obtenu est filtré (filtre de maille
de 90 iim) pour enlever les cuticules et les débris grossiers ;
- le filtrat obtenu est rincé avec de la solution de SDS
à 0,1% puis distribué dans des tubes appelés godets ;
le filtrat est centrifugé à 100g avec une vitesse
de 1350 rpm pendant 25 secondes puis on recupère les surnageants ; le
culot solide du bas reste dans le tube ;
- Le culot est lavé au SDS à 0,1% ;
l'homogéinat a été distribué dans les tubes
à essai puis centrifugé avec une vitesse de 6750 rpm pendant 30
mn ;
- L'opération précédente a
été répétée 3 fois de suite ;
- Les culots obtenus ont été lavés avec de
l'eau distillée stérilisée puis centrifugés une
dernière fois avec une vitesse de 6750 rpm pendant 30 mn.
Cette étape a permis d'éliminer les graisses
contenues dans la suspension virale. La suspension virale obtenue a
été mise dans un flacon puis conservée à 4°C
au réfrigérateur pour comptage des corps d'occlusion au
microscope optique muni d'une caméra digitale.
La méthode qui est utilisée ici a un haut
degré de pureté (Cherry et al., 1997) mais
l'inconvénient est sa cherté (Jones, 1994). Elle convient aux
applications à petite échelle.
· Comptage du virus de la polyédrose
nucléaire.
Ici, trois opérations sont exécutées : les
dilutions, le comptage proprement dit et les calculs de concentrations virales
(Wigley, 1980)
La détermination précise de la concentration
virale est essentielle. Toute erreur dans l'estimation de la concentration
influence les résultats et fausse la discussion.
> Les différentes dilutions
Les premières opérations effectuées dans le
cadre du comptage concernent les différentes dilutions de la suspension
virale mère contenue dans le flacon.
La première dilution (10-1) se fait avec 900 u
l d'eau distillée stérilisée et 100 u l de la suspension
mère. A partir de celle-ci, cinq (05) autres dilutions ont
été faites.
10-1 = 100 u l de suspension virale mère dans
900 u l d'eau distillée stérilisée (1ère
dilution) 1 0-2 = 100 u l de la 1ère dilution dans
900 u l d'eau distillée stérilisée (2ème
dilution)
1 0-3 = 100 u l de la 2ème dilution
dans 900 u l d'eau distillée stérilisée
(3ème dilution) 1 0-4 = 100 u l de la
3ème dilution dans 900 u l d'eau distillée
stérilisée (4ème dilution) 1 0-5 =
100 u l de la 4ème dilution dans 900 u l d'eau
distillée stérilisée (5ème dilution)
10-6 = 100 ul de la 5ème dilution dans 900 ul
d'eau distillée stérilisée (6ème
dilution)
> Le comptage des corps d'inclusion au microscope.
Le comptage se fait avec l'hématimètre de
Noubar amélioré qui est convenable aux suspensions de Baculovirus
hautement purifiées. L'hématimètre est une lame en verre
ayant sur sa surface 25 grands carreaux (5 sur la ligne, 5 sur la colonne)
contenant chacun 16 petits carrés de 0,002 5 m2 chacun. La
profondeur du champ est 0,1 mm. Cette méthode a été
décrite par Wigley (1980) et améliorée par Hunter-Fujita
et al. (1998).
Elle suit les étapes suivantes :
- l'hématimètre et sa lamelle ont
été nettoyés avec de l'eau savonneuse et de l'eau de javel
puis séchés ;
- parmi les différentes dilutions faites, la solution la
moins concentrée est choisie ;
- la solution choisie est bien
homogénéisée et on prélève 10 ul de cette
solution qu'on introduit dans la chambre de l'hématimètre
après avoir pris soin de le fermer au préalable ; - la
préparation faite a été montée au microscope
optique puis on passe à la mise au
point ;
- avec un compteur manuel, on a compté tous les corps
d'inclusion retrouvés dans les 25 grands carreaux du champ de
l'hématimètre.
Le comptage manuel est répété 2 fois pour
calculer la concentration de la suspension
X1 = nombre de corps d'inclusion énuméré
dans le champ 1.
X2 = nombre de corps d'inclusion énuméré
dans le champ 2
Xm = moyenne des deux comptages
> Calcul des concentrations virales.
La concentration de la suspension virale a été
calculée par la formule de (Grzywacz, 1987). C = F Xm/KV ; avec
C = Concentration de la suspension virale
Xm = Moyenne des comptages
F = 1/D = Facteur de dilution, avec D = dilution faite ;
K = nombre de petits carreaux sur l'hématimètre
V = Volume de l'hématimètre ; V = 0,1 mm x 0,0025
mm2 = 2,5. 10-4 mm3
· Méthode de préparation d'une
suspension virale à partir d'une suspension virale mère
connue.
Le stock de suspension virale précédemment
préparée a une concentration élevée
(4,07.108PIB/ml). Ainsi pour obtenir la concentration voulue pour
les inocula, on est obligé de faire des dilutions. Pour y parvenir, on a
utilisé la méthode qui suit :
C1 V1 = C2 V2 où C1 est la concentration de la
suspension virale mère et C2 est la concentration de la nouvelle
suspension virale à préparer, mais connue et fixée
d'avance. Dans notre cas ici, elle est de 2,16.103 PIB/ml.
V1 est le volume de la suspension à prélever,
V2 est le volume de la nouvelle suspension.
2.6. Protocole des expériences
Trois expériences ont été menées
au Laboratoire de la section Entomopathologie de l'IITA. En effet, nos essais
ont été stockés dans un incubateur au sein duquel
règne une de température variant entre 24 et 26°C et une
humidité relative variant entre 75 et 85%. Tous ces paramètres
sont fonctions des conditions environnementales favorables pour les
différentes unités (espèces)
entomologiques utilisées. Au cours de ces expériences,
différents paramètres ont été
évalués. Ainsi, pour les différentes méthodes de
contamination du parasitoïde, les paramètres suivants ont
été mesurés : la transmission et l'acquisition du virus
par le parasitoïde (A. taragamae) ; évaluation des effets
conjugués du virus et du parasitoïde.
2.6.1. Expérience : conception des
différentes méthodes de Contamination de
Apanteles taragamae
Pour la réalisation de nos essais, nous avons
utilisé une suspension virale de concentration 2,16.103
PIB/ml.
Cette suspension a été préparée par
la méthode suivante :
- Nous avons prélevé un volume donné de
la suspension virale mère. Pour chercher ce
volume, nous avons
maintenu la concentration initiale qui est 2,16.103 PIB/ml. Le
nombre de
chenilles à infecter est connu ; à partir de ces
données, le volume de la suspension virale mère
C1 x nbre de chenille
est prélevé : Vmère =
Cmère
Vmère = Volume de la suspension virale mère
à prélever
C1 = Concentration de la suspension virale à
préparer
n = Nombre de chenilles
Cmère = Concentration de la suspension virale
mère.
Après, on a supposé qu'une chenille peut
être infectée par une quantité de suspension virale de
5iil. Ainsi, le volume total pour infecter les chenilles est obtenu en faisant
le volume par chenille multiplié par le nombre total de chenilles. Pour
cela, la quantité d'eau distillée et stérilisée est
obtenue en soustrayant du volume total, le volume de la suspension virale
mère.
En effet, trois méthodes de contamination ont
été définies pour effectuer nos essais afin d'atteindre
les objectifs prédéfinis.
· Première méthode de contamination
(T1)
Elle consiste à contaminer l'ovipositeur du
parasitoïde femelle adulte à l'aide d'un pinceau plongé
préalablement dans une suspension contenant des corps d'inclusion. Etant
donné que le parasitoïde est un Hyménoptère, on a
essayé de le faire endormir à une température basse
(4°C) pour pouvoir toucher effectivement l'ovipositeur par le pinceau.
Après la contamination, on a orienté la lumière de la
lampe de la binoculaire sur le parasitoïde pour le réveiller.
Ensuite on met les parasitoïde pendant 2 heures et 24 heures, dans une
boîte
contenant un mélange de 30 chenilles de
M.vitrata au stade L2 et au début de L3 (5ème jour)
à raison de 15 chenilles par stade, pour faire l'inoculation.
Après, le parasitoïde est retiré et mis dans une autre
boîte. On isole ensuite les chenilles à raison d'une chenille par
boîte pour s'assurer de l'effectivité de la piqûre de la
chenille par le parasitoïde .Dans chaque boîte est mis du milieu
nutritif artificiel sain c'est-à-dire exempt de tout virus pour nourrir
chaque chenille. Cette chenille est suivie jusqu'à la mort et est
écrasée pour être observée au microscope afin
d'identifier la présence des corps d'inclusion ou à la pupaison
après piqûre. Les pupes qui en sont sorties, sont
collectées de chaque boîte et sont mises dans une autre
boîte couverte par une toile sur laquelle du miel sera mis pour nourrir
les adultes de parasitoïde qui seront émergés 3 jours
après la pupaison. Après l'émergence, à deux
femelles considérées comme la première
génération, sont soumises trente (30) chenilles saines de
M.vitrata de sorte que toutes les femelles soient inoculées.
Ainsi, ces chenilles ont été examinées au microscope
après leur mort pour voir la présence de virus.
La même opération est faite pour un
parasitoïde contaminé et laissé après 24 heures.
· Deuxième méthode de
contamination (T2)
Les mêmes opérations, comme dans le cas
précédent, sont reprises seulement, ici, on évite de
toucher à l'ovipositeur tout en contaminant toute la surface du corps du
parasitoïde .La suite des opérations demeure la même que
précédemment.
· Troisième méthode de contamination
(T3)
Elle consiste à contaminer le milieu nutritif qui,
pulvérisé sous hotte, sert de nourriture aux chenilles
préalablement à jeun pendant 24 heures.Ainsi on découpe le
milieu nutritif en de petits carrés afin que le milieu soit bien
imprégné de la suspension virale de concentration
2.16103 PIB/ml. Après, le milieu nutritif est mis dans une
boîte de 60cc contenant un mélange de 30 chenilles aux stades L2
et L3. Après 24 heures, les chenilles sont retirées de cette
boîte pour être mises dans une boîte contenant du milieu sain
pendant 12 heures. Après cette phase, ces chenilles sont retirées
à nouveau de cette boîte pour être mises dans une autre
boîte sans milieu nutritif. Dans cette boîte, elles subissent
l'action de deux parasitoïdes femelles saines pendant 2 heures et 24
heures. Chacune des chenilles est mise ensuite dans une boîte contenant
du milieu nutritif artificiel sain c'est-à-dire exempt de tout virus
pouvant le contaminer. Chacune des chenilles est suivie jusqu'à la mort
et est écrasée pour être observée au microscope afin
de constater la présence des corps d'inclusion. Les chenilles peuvent
donner de pupes ou non avant de mourir. Les pupes sont collectées de
chaque boîte
et sont mises chacune dans une autre boîte couverte par
une toile sur laquelle du miel est mis pour nourrir les adultes de
parasitoïde qui ont émergé 3 jours après la pupaison.
Il est soumis à chacune des femelles émergées, une
chenille de M.vitrata. Ainsi ces chenilles sont examinées au
microscope après leur mort pour voir la présence de virus.
La même opération est faite pour le délai de
24 heures.
Chaque expérience est répétée 5
fois.
Pour chacune des méthodes, nous avons utilisé deux
parasitoides pour 30 chenilles et par durée représentant ainsi
une répétition.
· Témoin (T0)
Le témoin a été realisé avec des
parasitoïdes non contaminés.A ces parasitoides, sont soumises 30
chenilles saines en fonction des durées.Chaque témoin est
répété 5 fois.
2-6-2 Analyses statistiques
Les données sont enregistrées avec le logiciel
Excel version (2001). Nous avons fait l'analyse de variance (ANOVA ; Analysis
of Variance) en utilisant la procédure GLM (Generalized Linear Model) du
programme statistique SAS Version 8. Les moyennes sont séparées
par le test de Student-Newman et Keuls.
Les moyennes cumulées de mortalité,
d'émergence et de présence de virus ont subi la transformation
arc sinus dans le test de Student et de Newman et Keuls pour l'analyse de la
variance afin de stabiliser la variance et rendre homogène la
population.
Nous sommes partis d'une génération de
parasitoïdes notée Go. Les tests utilisés prennent seulement
en compte les parasitoïdes de la première génération
G1.

TROISIEME PARTIE : RESULTATS
3.1- Acquisition et Transmission du virus par les
parasitoïdes aux chenilles
de Maruca vitrata à partir des
différentes méthodes de Contamination.
3.1.1- Comparaison de la mortalité des
chenilles
Pour toutes les méthodes utilisées, on a
enregistré des chenilles mortes et ceci durant les deux temps
utilisés.
· Comparaison de la mortalité des chenilles entre
les différentes méthodes de contamination durant 2 heures
d'inoculation.
L'analyse de la variance a indiqué une
différence significative (au seuil de 5%) entre la mortalité des
chenilles due au virus (toutes méthodes de contamination confondues) et
le témoin.Cependant, deux (2) heures après l'inoculation,la
mortalité des chenilles ne diffère pas significativement entre
les diffèrentes méthodes de contamination (Tableau 7).
· Comparaison de la mortalité des chenilles entre
les différentes méthodes de contamination durant 24 heures.
L'analyse du tableau 7 révèle, vingt quatre
heures après l'inoculation, la mortalité des chenilles est
significativement élevée au niveau des diffèrentes
méthodes de contamination en comparaison avec le témoin.
Toutefois, l'analyse de variance ne révèle aucune difference
significative entre les differentes méthodes de contamination.
Les moyennes cumulées pour les deux durées,
révèlent une différence significative au seuil de 5 %.
Tableau 7. Mortalité des chenilles de
Maruca vitrata en fonction de differentes méthodes de
contamination : 2h et 24h après l'inoculation par le virus.
Traitements
|
Durée de l'essai
|
Moyenne
|
|
24 H
|
|
0,43 b
|
0,44 b
|
0,43 B
|
T1
|
0,91a
|
0,96 a
|
0,93 A
|
T2
|
0,94 a
|
0,97 a
|
0,95 A
|
T3
|
0,90 a
|
0,98 a
|
0,94 A
|
P>F
|
<0,0001***
|
<0,0001***
|
-
|
Cv%
|
11,18
|
9,15
|
-
|
Moyenne
|
0,79A
|
0,84 A
|
-
|
|
Les moyennes suivies de la même lettre ne sont pas
statistiquement différentes au seuil de 5% ; *** : différence
significative au seuil de 0,1%
Les résultats d'ANOVA montrent une différence
hautement significative entre méthodes de contamination de 2 h et 24 h
avec le témoin.
3.1.2 - Comparaison de l'existence de virus dans les
chenilles mortes
· Comparaison de l'existence de virus entre les
différentes méthodes de contamination durant 2 heures
d'inoculation.
L'analyse du nombre moyen cumulé de virus
présents dans les chenilles mortes révèle une
différence significative entre les méthodes et le témoin
non contaminé avec le virus (Tableau 7). Toutefois, aucune
différence n'est observée entre ces différentes
méthodes.
· Comparaison de l'existence de virus entre les
différentes méthodes de contamination durant 24 heures.
L'analyse du nombre moyen cumulé de virus
présents dans les chenilles mortes pour une durée de 24 h de
contamination révèle une différence significative entre
les méthodes utilisées et le témoin (Tableau 7). Par
contre, aucune différence n'est observée entre ces
différentes méthodes.
La comparaison des effets des deux durées n'a
montré aucune différence significative.
Tableau 8. Présence de Virus dans les
chenilles de Maruca vitrata en fonction de differentes méthodes
de contamination : 2h et 24h après l'inoculation par le virus.
Traitements
|
Durée de l'essai
|
Moyenne
|
|
24 H
|
|
0 b
|
0 b
|
0 B
|
T1
|
0,91 a
|
0,96 a
|
0,93 A
|
T2
|
0,94 a
|
0,97 a
|
0,95 A
|
T3
|
0,90 a
|
0,98 a
|
0,94 A
|
P>F
|
<0,0001***
|
<0,0001***
|
-
|
Cv%
|
12,8
|
10,26
|
-
|
Moyenne
|
0,68 A
|
0,73 A
|
-
|
|
Les moyennes suivies de la même lettre ne sont pas
statistiquement différentes au seuil de 5% ; *** : différence
significative au seuil de 0,1%
L'analyse globale d'ANOVA révèle une
différence hautement significative pour différentes
méthodes et aussi pour les durées d'acquisition du virus.
3.1.3- Comparaison de l'émergence des
parasitoïdes
· Comparaison de l'émergence après 2 heures
d'inoculation
L'analyse de variance n'a révélé aucune
difference significative entre les méthodes pour ce qui concerne le taux
d'émergence des parasitoides après 2h d'inoculation (Tableau 8).
La structuration des moyennes de l'émergence n'a présenté
aucune différence significative entre les différentes
méthodes de contamination. Mais, par contre il y a une différence
significative au seuil de 5 % entre les méthodes et le témoin.
· Comparaison de l'émergence en fonction de : 24
heures d'inoculation.
La structuration des moyennes révèle une
différence hautement significative entre les méthodes d'une part
et entre les méthodes et le témoin d'autre part avec un
coefficient de variation (CV = 9,19 %).
Les moyennes des durées ne sont pas statistiquement
différentes. (Tableau 8). L'analyse dans ANOVA révèle une
différence significative pour les différentes méthodes en
ce qui concerne l'émergence des parasitoïdes.
L'analyse de la variance n'a présenté aucune
différence entre les deux durées utilisées. Tous les
résultats sont consignés dans le tableau 9.
Tableau 9. La structuration des moyennes de
l'émergence des parasitoïdes (moyennes#177;erreur standard) issues
de l'analyse de la variance suivant le test de Student, Newman et Keuls.
|
Traitements
|
Durée de l'essai
|
|
Moyenne
|
|
2 H
|
24 H
|
|
|
T0
|
0,41 b
|
0,42 d
|
0,41 C
|
|
T1
|
0,63 a
|
0,57 c
|
0,60 B
|
|
T2
|
0,73 a
|
0,69 b
|
0,71 A
|
|
T3
|
0,67 a
|
0,85 a
|
0,76 A
|
|
P>F
|
0,0009***
|
<0,0001***
|
-
|
|
cv%
|
12
|
9,19
|
-
|
|
Moyenne
|
0,61 A
|
0,63 A
|
-
|
Les moyennes suivies de la même lettre ne sont pas
statistiquement différentes au seuil de 5% ; * * * : différence
significative au seuil de 0,1%
Tableau 10. Analyse de la variance à
deux critères de classification, modèle croisé mixte, des
paramètres de mortalité, d'émergence des parasitoïdes
et de leur infection au virus dans un essai de 4 traitements suivant deux temps
(2H et 24 H).
|
Sources
de variation
|
DL
|
Les carrés moyens
|
|
Mortalité
|
Emergence
|
Virus
|
|
Traitements
|
3
|
4,362 ***
|
1,096 ***
|
18,978 ***
|
|
Temps
|
1
|
0,488 ns
|
0,037 ns
|
0,45 8 ns
|
|
Traitement*Temps
|
3
|
0,068 ns
|
0,163 *
|
0,078 ns
|
|
Erreur
|
32
|
0,060
|
0,03 8
|
0,056
|
|
Total
|
39
|
-
|
-
|
-
|
|
Cv
|
-
|
10,14
|
10,4
|
11,5
|
Ces données ont subi une transformation arc sinus ; ns
: différence non significative au seuil de 5% ; * : différence
significative au seuil de 5% ; ** : différence significative au seuil de
1% ; *** : différence significative au seuil de 0,1%

QUARTRIEME PARTIE : DISCUSSION
4.1. Effet d'acquisition et de transmission du virus
4.1.1. Mortalité
De l'analyse globale des résultats, les
différentes méthodes ont un effet très hautement
significatif sur la mortalité des chenilles de M. vitrata
comparées au témoin (parasitoides non infectés mais
inoculés aux chenilles de M.vitrata saines). Cela signifie que
ces méthodes engendrent plus de mortalité que le témoin.Ce
qui nous conduit à dire que l'effet combiné du virus et du
parasitoïde a agi sur les chenilles de Maruca vitrata. Cette
observation confirme celle de Raimo et al. (1977), qui ont
démontré qu'il y a plus de mortalité des chenilles de
Lymantria dispar (Lepidoptera: Noctuidae) lorsque Apanteles
melanoscelus (Ratzeburg) est infecté avec le virus que lorsqu'il ne
l'est pas. En effet, Reardan & Podgwaite (1976) ont rapporté qu'il
existe une corrélation positive entre les actions de NPV et les adultes
de A. melanoscelus sur les populations de chenilles.
4.1.2. Présence de virus
L'analyse des chenilles mortes a révélé
la présence de virus en leur sein. Les parasitoïdes
contaminés ont donc pu transmettre le virus aux chenilles de M.
vitrata. Les progénitures des parasitoïdes contaminés
ont également transmis le virus à des chenilles saines de M.
vitrata. Ceci signifie qu'il y a acquisition du virus, c'est dire que
A. taragamae constitue un vecteur de Mavi NPV, ce qui confirme les
tests de Raimo et al. (1977) qui ont montré que A.
melanoscelus était un vecteur capable de transmettre des doses
létales de NPV pour les chenilles.
Ainsi, toutes les méthodes de contamination
utilisées dans la présente étude ont permis aux
parasitoïdes d'acquérir et de transmettre le virus aussi bien aux
chenilles qu'aux parasitoïdes provenant des chenilles contaminées.
Ces observations sont similaires à celles rapportées par Dung
et al. (2005) sur Meteows pulchricornis (Hymenoptera :
Braconidae) dans les chenilles de Spodoptera litura (Lepidoptera :
Noctuidae). Ces auteurs ont observé qu'une femelle de M.
pulchricornis émergée à partir de chenilles de
Spodoptera litura (Lepidoptera : Noctuidae) infectées, transmet le
virus à n'importe quel hôte sain et peut être
considérée comme un agent efficace de dispersion du virus. La
transmission du virus par les parasitoïdes peut être
catégorisée en 2 termes : un vecteur mécanique dans la
translocation du virus comme le résultat de la contamination d'une
partie du corps de l'hôte en contact avec une source d'aliment
infecté (Irabagon & Brooks, 1974 ; Sait et al., 1996) et un
vecteur
biologique dans la translocation du virus comme un
résultat d'une inoculation directe de l'hôte par un ovipositeur
contaminé par des virus (Levin et al., 1983 ; Hamm et
al., 1985).
Les études du comportement des hôtes
sélectionnés par les parasitoïdes en relation avec les
infections virales ont été conduites par plusieurs auteurs. Ainsi
Caballero et al. (1991), ont observé que les taux de
parasitisme des chenilles de Agrotis segetum (Lepidoptera :
Nocturidae) par Apanteles telengai (Hymenoptera : Braconidae) et
Aleiodes gasteratus (Hymenoptera : Ichneumonidae) sont plus
élevés que la mortalité des chenilles causée par
l'infection des Granulovirus.
4.1.3 Influence des Délais d'inoculation
Les analyses ont montré qu'il n'existe aucune
différence significative entre les deux délais d'inoculation
utilisés. Cela signifie, que le temps d'inoculation n'a aucun effet sur
la possibilité de transmission et d'acquisition du virus par le
parasitoïde. Ceci confirme les résultats obtenus par Raimo et
al.(1977) qui ont rapporté que le temps d'inoculation du
parasitoïde de A. melanoscelus contaminé avec le virus NPV
n'a aucun effet dans la transmission du virus aux chenilles de L.
dispar.
Nos tests démontrent qu'il existe une différence
significative pour l'émergence entre les différentes
méthodes de contamination utilisées et le témoin. En
effet, cela signifie que pour les différentes méthodes, nous
n'obtenons pas le même taux d'émergence, ce qui infirme les
résultats obtenus par Raimo et al. (1977) qui par contre n'ont
observé aucune différence significative. Ceci pourrait être
expliqué par les conditions hygrométriques. Les variations de
température au cours de notre étude ont été de
l'ordre de 24 à 26°C et l'humidité relative de l'ordre de 75
à 85%. Par contre, Raimo et al. (1977) ont travaillé
sous une température constante de 20°C et 50% d'humidité
relative.
L'analyse des résultats n'a présenté
aucune différence significative entre les deux délais. Ceci
signifie que les durées utilisées n'ont aucun effet sur la
mortalité et la transmission du virus. Mais l'interaction entre les
méthodes et le temps révèle une différence
signification de l'effet du facteur temps pour l'émergence des
parasitoïdes. Ceci signifie que les différentes méthodes de
contaminées appliqués ne se comportent pas de la même
façon pour l'émergence d'une durée d'inoculation à
une autre.
CONCLUSION ET SUGGESTIONS
La présente étude met en évidence
l'action combinée de Biopesticide MaviNPV et du parasitoïde A.
taragamae sur M. vitrata. Bien que la contamination du
parasitoïde ait été faite avec différentes
méthodes, l'efficacité de ces dernières s'est
révélée identique en ce qui concerne la transmission de
MaviNPV. On assiste alors à une importante trilogie biologique
constituée par un insecticide biologique, un parasitoïde larvaire
et un hôte phytophage. La transmission du virus MaviNPV assurée
par le parasitoïde est un moyen de lutte intégrée efficace
pouvant permettre au paysan une protection écologiquement durable de
niébé et ce faisant, une amélioration de la production.
Ceci favorisera davantage une réduction sensible des cas de
malnutrition.
Aussi, pour la protection de niébé, les stades de
jeunes âges de M.vitrata seront - ils donc ciblés
prioritairement.
Etant donné que le parasitoïde est une
espèce exotique, son établissement dans notre milieu
s'avère obligatoire. Or pour un établissement, il faut un temps
long allant de 10 ans à 30 ans, alors que la nécessité de
protéger cette culture est un besoin immédiat non seulement pour
le paysan mais aussi pour les consommateurs. De ce fait, nous
préconisons une production massive (élevage en masse) des
parasitoïdes véhiculant le virus afin de faire des lâchers
inondatifs pour une résolution immédiate de ce problème
lié à ce ravageur (M. vitrata) avant que le
parasitoïde ne s'établisse dans notre milieu paysan.
De façon globale, l'analyse des différents
résultats soulève des questions qu'il serait souhaitable
d'étudier dans l'avenir. Il s'agit de :
- reprendre les mêmes investigations en milieu réel
et d'en déduire les impacts réels dans une zone
écologiquement contrôlable..
- étendre cette étude au niveau de toutes les
zones agro-écologiques du Bénin où l'on produit le
niébé en vue de la mise au point d'une méthode de lutte
efficace pour tout le Bénin.
- étudier la rentabilité de cette méthode de
lutte.
- comparer l'efficacité des parasitoïdes sains au
champ et des parasitoïdes contaminés avec le virus dans le milieu
réel.
- étudier l'impact du biopesticide sur les
vertébrés.
- comparer l'efficacité des parasitoïdes
contaminés et du biopesticide.
- effectuer la même étude de contamination sur le
parasitoïde ovo-lavaire Phanerotoma leucobasis Kriechbaumer
(Hymenoptera : Braconidae).
- associer les deux ennemis naturels contaminés pour le
contrôle de M. vitrata au laboratoire et dans le milieu
réel.
REFERENCES BIBLIOGRAPHIQUES
Adango, E., 1994. Inventaire des parasitoïdes de Maruca
testulalis (Geyer)
(Lepidoptera : Pyralidae) en culture du niébé (
Vigna unguiculata (l.) Walp au Sud du Bénin. Thèse
d'Ingénieur Agronome (FSA/UAC), 96 p.
Akpovi, S., 1993. Etude au laboratoire de l'efficacité de
Dinarmus basalis
(RONDANI) (Hyménoptera : Pteromalidae) Ectoparasite de
Callosobruchus maculatus (Fabricius) (Coleoptera Bruchidae).
Mémoire de fin de formation pour l'obtention du diplôme
ingénieur agronome.27-40 p.
Akundabwensi, L., S., Paul C. P & Singh,B .B, 1991.
Evaluation des lignées
d'élites de niébé pour un usage double
(feuilles, fourrage et graine) Recherche à IITA
n° 3 pp. 6-9.
Allen D. J., Ampofa J. K. O. & Wortmann C. S., 1996. Pest,
diseases and nutritional discorders of the common bean in Africa. A fild
guilde, CIAJ & IITA, 132 p.
Amoaka-atta B. & Omolo E.O.,1983. Influence of maize, cowpea
and sorghum intercropping system on stem-pod borer infestation. Insect Science
Application,4 , 47-57
Anochili B., 1978 . Food crop production world crops, 39-42.
Anon , 1995 . Fiche technique des cultures vivrières :
céréales légumineuses à
graines et tubercules. Institut National des Recherches Agricoles
du Bénin (INRAB) 75 p.
Anonyme, 1974 . Cowpea has a great potential as plant protein
source. Trop. Grain Legume Bull 26, p. 281.
Anonyme, 1976 : Grain legume improvement programme report, 1976
Ibadan, IITA. 74 p.
Arodokoun, D. Y., Tamò M., Cloutier, C., 1997:
Parasitoids guild; Feasibility
of its application incontrolling legume pod
borer, Maruca vitrata
(Fabricius) (Lepidoptera : Pyralidae). In: Proceeding of the
joint congress of the Entomoligical Society of Southern Africa (11 th Congress)
and the African. Association of Insect Scientists (12 th congress)
(Stellenbosch 30 June - 4 July 1997). Robertson G. H. (ed). Entomological
Society of Southern Africa. 1997, p. 63.
Arodokoun D. Y., Tamò M., Cloutier C. & Adeoti R.,
2003. Importance of
alternative host plants for the annual cycle of the legume pod
borer Maruca vitrata (Fabricius) (Lepidoptera: Pyralidae) in southern
and central Benin. Insect Sci. Applic., 23, 103-1123 p.
Assa, A.D., 1984. Coordinated minimum insecticide trial: yield
performance of insect resistant cowpea cultivar from IITA Tropical Grain
Legume Bull. 5.p .9.
Atachi P., 1998. Lutte chimique contre les foreurs du maïs
dans un programme de lutte intégrée au Bénin-Agron. Trop.,
44, 93-103.
Atachi, P. & Adeoti R., 2004. Interaction plante- animal : un
cas d'étude d'utilisation de quelques formulations combinées
d'insecticides dans la gestion des insectes ravageurs de niébé,
Vigna unguiculata (L.) Walp. au Sud-Bénin - Sciences du
Végétal, 2, 7-21.
Atachi P. & Ahohuendo B. C.,1989. Comparaison de quelques
paramètres
caractéristiques de la dynamique des population entre
Megalurostrips sjostidae (Trybom) et Maruca testulalis
(Geyer) sur une même plante hôte, le niébé. Insect
Science. And its Application 10,1 83p.
Atachi P. & Ahounou M., 1995. Etude expérimentale des
potentialities
biologiques de Maruca testulalis (Geyer) (Lepidoptera.
Pyralidae) sur quelques subtrats alimentaires en condition de laboratoire.
Bull. Soc. Zool. Fr., 120,29-45.
Atachi P.& Desmidts,N., 1984. Investigation sur les insectes
parasites du
Niébé ( Vigna unguiculata (L) Walp). en
République du Bénin, Laboratoire de Défense des Cultures,
Recherches Agronomiques 37p.
Atachi P., Desmidts M. & Durnez C., 1985. Entomologie et
protection phytosanitaire du niébé : éléments d'un
premier inventaire des insectes ravageurs du niébé,
République Populaire du Bénin. Essais de mise au point de moyens
de lutte. Travaux et documents de la Recherche Agronomique au Bénin, 37
p.
Atachi P. & Djihou Z., C., 1994. Inventaire des plantes
hôtes de Maruca testulalis (Geyer) (Lepidoptera : Pyralidae) en
Republique du Benin. Ann. Soc. Entomol. Fr. (N.S), 30, 169-174.
Atachi P. & Gnanvossou D., 1989. Dynamique quantitative des
populations Animales : Recherches préliminaires à une
étude comparée des dynamiques des biomasses, d'effectifs et de
production chez Maruca testulalis
(Geyer).( Lepidoptera : Pyralidae) en culture de
niébé dans un agrosystème du sud Benin. Acta oecologica
oecol. Applic., 10 (3), 221- 239.
Atachi P. & Sourokou B., 1989. Use of Decis and Systoate for
the control of Maruca vitrata (Fabricius) in cowpea. Insect Sci
Applic, 10; 373-381.
Autriche A., 1981. Principaux ennemis des cultures de la
région des grands lacs d'Afrique Centrale - Institut des Sciences
Agronomiques du Burundi (ISABU) 144 p.
Autrique A. & Perreaux D., 1989. Maladies et ravageurs des
cultures de la
région des grands Lacs d'Afrique Centrale. Ed. Division de
la Défense des végétaux et Institut des Sciences
Agronomiques du Burundi, 232 p.
Aykroyd W. R. & Doughty J., 1982. Les graines de
légumineuses dans l'alimentation humaine. Revu et corrigé par
Doughty J. & Walker, A. Etude FAO. Alimentation et Nutrition Rome ,1982.
152 p.
Bourguerra L., M., 1986. Les pesticides et le tiers monde
.Recherche n°176 pp: 545-553 Brooks G., T., 1975. Chlorinated insecticide.
Vol II Biological and Environnemental aspect-CR-C. Press in England, 197p.
Brooks W. M., 1993. Host-parasitoïd pathogen interaction
In Parasites and Pathogens of Insects (N. E Beckage S. N., Thompsen and
Federici eds) vol. 2. Academic Press, New York, NY., pp. 23 1-272.
Caballero P., Vargas-Osuna E. & Santiago - Alvarez, 1991.
Parasitization of
granulosis-virus infected and nominfected Agrotis
segetum Larvae and the virus
transmission by three hymenoptera parasitoïds. Entomol.Exp.
Applic. 58, 55-60.
Canning E. U., 1982. An evaluation of protozoal Characteristics
in relation to biological control of pest. Parasitology 84, 22-119
Cherry A. J., Parnell M. A., Grzrywacz D. & Jones K. A.,
1997. The optimisation of in vivo nuclear polyhedrosis virus production in
Spodoptera exempta (walker) and Spodoptera exigua, (Hubner).
Journal of Invertebrate Pathology 70. 50-5 8.
Chu H. F., 1949. How to know the immature Insects. W. M. C. Brown
Company Publishers. Dubuque, Iowa, 234p.
Cloutier C. & Cloutier C., 1992. Les solutions biologiques de
lutte pour la répression des insectes et acariens ravageurs des
cultures. In : La lutte Biologique, Vincent, C. & Coderre, D., (eds) ;
Gaëtan Morin, 19-88.
Dent D. R., 1991. Insect pest management, éd. CAB
International UK.V
Debach, P. et B. Barlett, 1951. Effect of biological insecticide
control of insect pest of citrus. J. Econ. Entomol. 44, 372-3 83.
Devauchelle G. & Cerutti M., 2000. Les Baculovirus d'Insectes
Vecteurs d'expressions de gènes Etrangère. Station de pathologie
comparée. UMR 5087. INRA CNRS Université Montpellier II 30380.
Saint Christol, 117- 140.
Duke J. A., 1990. Introduction to food Legume. In : Insect pest
of tropical food Legumes, Singh S.R., John Wiley & Sons. (eds)., New York,
1-42.
Dung Hoang N., Nakai, M., Takatsuka J., Okuno S., Ishh T. &
Kunimi y., 2005.
Interaction between a nucleopolyhedrovirus and the braconid
parasitoid Meteows pulchricornis (Hymenoptera: Braconidae) in the
larvae of Spodotera litura (Lepidoptera: Noctuidae). Appl. Entomol
Zool 40 (2), 325-334.
Dupriez H. & De Leencer P., 1987. Jardins et Vergers
d'Afrique. Ed. Terre et Vie, 354 p.
Ekpodilé A. B., 2006. Etude expérimentale de
quelques caractéristiques biologiques de Apanteles taragamae
Viereck (Hymenoptera : Braconidae) parasitoïde larvaire de Maruca
vitrata(Fabricius) (Lepidoptera : Pyralidae) ravageur de
niébé. Mémoire de fin de formation pour l'obtention de
diplôme d'Ingénieur des Travaux (DIT) en Aménagement et
protection de l'Environnement (APE) à l'Ecole Polytechnique
d'Abomey-Calavi (EPAC), UAC, 77 pages.
Evans H F., Bishop J. M. & Page, E. A., 1980 : Method for the
quantitative assessment of nuclear Polyhedrosis virus in soil Journal of
investebrate pathology 35. 1-8 p
F.A.O., 2005. FAO stat database. Site internet : http//
www.fao.org/statistic.
Fine P. E. M., (1975). Vectors and vertical transmission : an
epidemiology perspective. Annual New York Académic Science 266,
173-178.
Franz J. M., 1971 . Influence of environment an modern trends in
crop management on microbial control. In : Birgess, H. D. and Hussey, M. W.
(eds), Microbial control of nsects and mites. Academic press, London, pp.
407-444.
Fuxa J. R., 1987. Ecological consideration for use of
entomopathogens in IPM. Annu. Rev. Entomol. 32, 225-609.
Gblagada C. C. S. 1982. Inventaire des parasites Lavaires de
Maruca testulalis (Geyer) sur le niébé ( Vigna
unguiculata (L.) Walp) et sur le pois d'angole (Cajanus cajan L.
Millsp.). Thèse d'ingenieur Agronome ; IITA-Ibadan,
Nigéria. 145 p.
Glass E., 1975. Integrated pest management rational, potential,
needs and
improvment. Special Publication, ESA, 140 p.
Godonou I., 1987. Effets et doses d'application de divers
produits naturels pour
le contrôle de Callosobruchus maculatus (F)
(Coleoptera : Bruchidae) de niébé (Vigna unguiculata (L)
(Walp)). Mémoire d'Ingénieur Agronome.1 15p.
Greathead D. J., Waage J. K., Evans H. C. P. Bergvan den H.,
1992. Etude des
ennemis naturels In: Manuel Lutte Biologique. 1er tome: principe
et
application de lutte biologique. 27-147.
Grzywacz D., 1987. A Training Manual on the Production and
Quality Control of Nuclear Polyhedrosis Viruses (NPV). UK: Natural Resources
Institute, p. 55.
Hamm. J., Nordlung, D. A. & Marti O. G., 1985. Effects of a
nonoccluded virus of Spodoptera frugiperda (Lepidoptera: Noctuidae) on
the development of a parasitoid Cotesia marginiventris (Hymenoptera:
Braconidae) Environ. Entomol. 14: 258-326.
Harrap K., Payne C. C. & Robertson J., 1977. The properties
of three
baculovirus from closely related hosts. Virology 79, 14-31.
Huang C., Peng. W-K. & Talekar N. S., 2003. Parasitoids and
other natural enemies of Marci vitrata feeding on Sesbania cannabina
in Taiwan. Biocontrol., 48, 407-416. Hunter F. R., Grook n. E & Entwistle
P. F., 1984. Viruses as pathogens for the
control of insect. In: Microbiological methods and environmental
biotechnology Grainger J. M. (eds) Society of Applied Bacteriology, London pp
325-3 47. Hunter-fujita F. R., Entwisthe P. F., Evans F. H. & Crook N. E.,
1998. Insect
Viruses and pest Management. England: John and Sons 620 p.
IFDC., 2005. L'état du marché des Intrants
Agricoles au Bénin. Technical
Bulletin 70, 85 p.
IITA., 1981 : Le point de la recherche. Ibadan, Nigeria 72 p.
IITA., 1982 : Annual report for 1981. Ibadan, Nigeria, 46 p.
IITA., 1983 : Annual report for 1982. Ibadan, Nigeria 217 p.
IITA., 1988. Annual Report and Research Highlights - IITA,
Ibadan, 50 p.
IITA., 1989 : Rapport Annuel. Ibadan, Nigeria 72 p.
IITA., 1992. Fiches météorologiques mensuelles,
station de Cotonou, pour la
Première saison.IITA, Cotonou 1-9.
IITA., 2004. Annual report IITA. Ibadan, Nigeria, 55 p.
Irabagon, T. A. & brooks, W. M., 1974. Interaction of
Campoletis sonorensis
and a nuclear polyhedrosis virus in larvae of Heliothis
virescens. J. Econ. Entomol. 67, 229-23 1.
Jackai L., E., N., 1981. Use of an oil soluble dye to determine
the oviposition
sites of the legume pod borer, Maruca testulalis (Geyer)
(Lepidoptera: Pyralidae) Insect Sci. Applic, 2, 205-207.
Jackai L. E. N., Railston J. R., 1988. Rearing the legume pod
borer Maruca
testulalis (Geyer) (lepidoptera: Pyralidae) on
artificial diet. Trop. Pest Management 34 (2), 168-172.
Jackai, L. E. N., Singh, S. R., 1981. Studies on some behavioural
aspect of
Maruca testulalis on selected species of Crotalaria
retusa and Vigna unguiculata. Tropical Grain Bulletin, 22:
1-3.
Jackai L.E.N & Daoust R. A., 1986. Insect pests of cowpea.
Annu. Rev Ent.,3 1, 95-119.
Jackai L.E.N, Pnizzi A. R., Kundu G. G., SWAS T. K. P., 1990.
Insect pests of
Soybean in the tropic, 91-156. In S. R. Singh (ed), Insect pest
of tropical food legumes. John wiley & sens, Chichester, Devon, U. K. 451
p.
Jackai L.E.N. & Oyederan I., O., 1991. The potential of neem
(Azadirachta
indica). A juss for controlling post-flowering pest of
cowpea (Vigna unguiculata Walp.) The pod borer Maruca
testulalis . Insect Sci. Applic. 12, 103-109.
Jacques R. P., 1973. Pest on microbial and chemical, insecticide
for control of
Trichoplusia ni (Lepidoptera: Noctuidae) and Pieris
rapae
(Lepidoptera:Peridae) on cabbage. Can. Entomol. 105, 2 1-27.
Jones K. A., 1994. Use of baculovirus for cotton pest control. In
: insect pest of
cotton (Matthews G.A. & Tunstall, J. P. eds) CAB
International Wallingford, UK. Pp .477-504.
Jonhson D. T., 1970. The cow pea in African eareas of Rhodesia -
Rhod. Agric J., 67, 61-64.
Kelly D. C., 1981. Non-occluded Virus. In "Pathogenesis of
inverte brates
microbial diseases". E. W. Davidson. ed. Osmon publishers,
Totowa, New
Jersey. Pp. 196-220.
Kossou D. K., Agbo B. P., Arodokoun D. Y., Aïhou K. &
Mathess A., 2001. lutte intégrée
contre les organismes nuisibles du niébé (
Vigna unguiculata (L.) Walp au Bénin (projet
niébé) In : Actes de l'Atelier Scientifique (Niaouli, 11-12
Janvier 2001), Recherche Agricole pour le Développement, 81-82.
Kossou D. K. & Aho N., 1993. Stockage et Conservation des
grains alimentaires tropicaux : principes et pratiques. Ed. Flamboyant,
125p.
Kumar R., 1991. La lutte contre les insectes ravageurs: situation
de l'agriculture africaine Ed .Karthala et CTA 31 0p.
Lane J. A., Moore T. H. M., Child D. V., Cardwell K. F., Singh
B. B. & Bailley
J. A., 1994. Virulence characteristics of a new race of
the parasitic
Angiospem, Striga gesneroides, from southerm Benin on cowpea
(Vigna unguiculata) Euphytica. 72 (3), 183-188.
Levin d. B., Laing J. E., Jacques R. P., & Corrigan J. E.
1983. transmisson of the
granulosis virus of Pieris rapae (Lepidoptera :
Pieridae) by the parasitoïd Apanteles glomeratus (Hymenoptera:
Braconidae) Environ. Entomol. 12, 166-170.
Liao, C. T. & Lin,C.S., 2000. Occurrence of legume podborer
Maruca testulalis
(Geyer) (Lepidoptera: Pyralidae) on cowpea Vigna
unguiculata(L.) Walp. an its insecticides applicationb trial. Plant
Pro.Bull., 42,213-222.
Machuka J., Van Damme E. J. M., Peumans W. J. & Jackai L. E.
N., 1999.
Effect of plant lectins on Larval development of the legume pod
borer, Maruca vitrata. Ent. Exp. Appl., 93, 179-187.
Maréchal R., 1970. Donnée cytologiques sur les
aspects de la sous tribu des
Papilionaceae Phaseoleae. Bulletin du Jardin Botanique National
de Belgique 40, 307- 348.
Marechal R., Maschepa J. W. M. & Stainnier R. Y., 1978 Etude
taxonomique
d'un groupe d'espèce de genre Phaseolus et
Vigna (Papilionaceae) sur la base des données morphologiques et
polliniques traitées par l'analyse informatique Boissiera 28,
271-273.
Mattews R. E. F., 1991. Plant virology. Third Ed., Academic
Press, San Diego, California Pp. 1-10.
Messiaen C. M., 1981. Les variétés
résistantes: Méthodes de lutte contre les
maladies et ennemis des plantes. Ed. INRA, 374 p.
Meynadier G., Margier A., GiradieJ. & Vago, C. 1992. Une
entomopoxvirose chez
l'orthoptère Anacridium aegyptium. Entomophag 37,
453-464.
Miller L. K., Lingg A. J. & Bulla L. A., 1983. Bacterial,
Viral and Fungal
Insecticides Sciences 219, 715-721.
Morel G. & Fouillaud M. 1994 : Persistance of occluded
Viruses in the nests of
the paper wasp polistes herbraeus (Hym : Vespidae) Unis.
Réunion face. Sei, Lab; pathologie invertébrés, 97715.
Saint-Dénis Messag, Reunion. Librairie le François. Paris, France
Revue V. 156-197pp.
NRI., 1991. Aperçu general de la lutte biologique
intégrée dans les pays en développement, Natural
Ressources Institut, Chattham, 20p.
Ntare B., R., 1989. Intercropping cowpea with millet. IITA
research brief 9, 4 p5. OBOPAF, 2004. Expansion du commerce intra et inter-
régional entre les pays
de la CEMAC et de l'UEMOA : Etude de l'offre et la demande sur
des produits alimentaires. République du Bénin; 189p.
Ochieng R. S., Okeyo-Owuor. J. B. & Dabrowski Z. T., 1981.
Studies on
legume pod borer Maruca testulalis (Geyer). 11: Mass
rearing on natural food. Insect Sci. Applic., 1, 269-272.
Oghiakhes S., Jackai L. E. N. & Makanjuola W. A., 1992.
Cowpea plant
architecture in relation to infestation and damage by the
legume pod borer, Maruca testulalis (Geyer) (Lepidoptera: Pyralidae)
effect of pod angle - Insect Sci. Applic., 13, 339-344.
Oghiakhes S., 1995. Progress and future prospects in utilisation
of host plant
resistance in the control of insects pest of cowpea, Vigna
unguiculata in Africa - Insect Sci. Applic., 16, 123-143.
Okech S. O. H. & Saxena K. N., 1990. Responses of Maruca
testulalis,
(Lepidoptera: Pyralidae) Larvae to variably resistant cowpea
cultivars. Environ. Entomol., 19, 1792-1797.
Okeyo-owuor J.B. & Ochieng R., 1981. Studies on the legume
pod borer
Maruca testulalis (Geyer) . Life cycle and behaviour.
Insect Sci Applic,
1(3), 263-268.
Okeyo-Owuor J. B., Agwaro P. O. & Simbi C. O. J., 1983.
Studies on the
legume pod borer, Maruca testulalis. (Geyer). V. Laval
population. Insect Sci. Applic., 4, 75-81.
Okeyo-Owuor J. B., Oloo G. W & Agwaro P. O., 1991. Natural
enemies of the
legume pod borer Maruca testulalis (Geyer)
(Lepidoptera: Pyralidae) in small scale
farming systemes of western Kenya. Insect Sci. Applic., 12,
35-42.
Okigbo B. N., 1978. Grain legume in the agriculture of the
Tropics. Madison,
American Society of Agronomy, 246 p.
Okwakpan B. A., 1978. The taxonomy, biology and control of two
species of
thrips Sjostetti trybom and Sericothrips
occipitalis Hood (Thysonoptera: Thripidae) on legume. Ph.D. Thesis
University of Ibadan, Nigeria 205 p.
Omolo E. O. & Ogango K. O., 1999. Use of varietal
intercropping to control
pests in sorghum and cowpea. In African Crop Science
Conference Proceeding (Casablanca 10-14 octobre 1999). Adipala E., Nampala P.,
Osiru M., Tenywa J. S. & Ismaïli M., (eds)., Africa Crops Science.,
1999, 569-573.
Painter R., 1954 . Resistance of plants to insects. J. Econ.
Entomol., 47. 1036-
1040.
Pedigo L. P., 1996. Entomology and pest management.
2nd ed. Prentice Hall,
Upper Saddle River, New Jersey. 5 6-89
Peter C. & David B. V., 1990. Biology of Apanteles
taragamae Viereck
(Hymenoptera : Braconidae), a parasitoïd of Diaphania
indica (Sauder) (Lepidoptera: Pyralidae): Frederick Institut of plant
Protection and Toxicology. Padappai 601301, Tamil Nadu, India. Insect Sci.
Applic, 13 (1) 7-17.
Poinar G. O. & Thomas G. M., 1985. Laboratory guide to insect
pathogens and parasites. Plenum Press, New York, 392 p.
Porter W. M., Rachie K. O., Rawal K. M., Wien H. C., Williams R.
J., Luse R.
A., 1975.Cowpea Coerm plasm catalogue n°1. IITA. Ibadan
Nigeria, 209 p.
Possée R. D., Hirts M., Jones J. D., Bishop D. H. L.,
& Cayley P. J. 1993. Fields
tests of genetically engineered Baculoviruses, Br. Crop
Protect Council 55, 23- 26.Programme Natura/Nectar, 1996. Adaptation du Module
Biologique. Pour une formation continue destinée aux professionnels des
Institutions de Development. 151 p.
Programme Natura / Nectar, 1996. Adaptation du Module Biologique
pour une formation
continue destinée aux professionnels des Institutions de
Développement. 151p. Quintella E. D., Quinderé M. A. W. &
Roberts D. W., 1991. Principal insect
pests of Cowpea in Brazil EMBRAPA & CNPAF, Brasil, 37 p.
Rachie K. D., Robert 1. M., 1974. Grain legume of the low land
tropics.
Advanced in Agronomy, 26, 1-32.
Raimo B., Reardon R. C. & Podgwaite D. J., 1977. Vectoring
gypsy moth
nuclear Polyhedrosis virus by Apanteles melanoscelus
(Hymenoptera: Braconidae). Entomophaga 22, 207-13.
Rawal K., 1975. Natural hybridization among wild, weedy and
cultivated Vigna unguiculata (L.) Walp. Euphytica, 24, 699-707.
Readon R. C. & Podgwaite J. D. 1976. Disease -
parasitoïd relationships in natural population of Lymantria
dispar in the northeastern United States. Entomophaga, 21, 333-341.
Reardon R. C. & Podgwaite D. J., 1976. Disease-parasitoid
relationships in nature al Population of Lymantria dispar in the northeastern
United States. Entomophaga, 21,33 1-341.
Robert L. M., Rachie K. D., 1974 . Grain Legume of the Low land
tropics. Adv. Agronomy. 26: 132.
Sait S. M., Begon M., Thompson d. J. & Harvey J. A., 1996.
Parasitism of
baculovirus infected Plodia interpunctella by
Venturia canescens and subsequent virus transmission. Func . Ecol. 10,
586-591.
Santos O. J., 1976. Grain legume of Mozambique. Tropical Grain
Legume
Bulletin 3 pp 13-15.
Scott L. B., 1940. The Bean Pod Borers In Puerto Rico. J. Agwe.
Univ. P. R., 24 (2), 35-47.
Shapino M., 1986. In vivo production of Baculovirus. In : the
Biology of
Baculovirus, vol. 2 pratical application for insect control
Granados, R. R. & Federici A. (eds) CRC Press, Boca Raton. 31-61.
Singh S.R.,1990. Insect pest of food legume.IITA. ,Ibadan,4
15p.
Singh S. R. & Allen D. J., 1979. Les insectes nuisibles et
maladies en niébé. Manuel N°2. IITA. 113p.
Singh S. R., & Allen D. J., 1980. Pests, diseases, Resistance
and Protection in
Cowpea. In : Summerfield, R. J. and Bulling, A. H. (eds). London,
Advances in Legumes Sciences, 419-443
Singh S. R. & Jackai L. E. N., 1985. Insect of cowpea in
Africa: their life cycle,
economic importance and potential for control. In: Cowpea
Research, Production and
Utilization, Singh S. R., Rachie K. D. & Wiley H. N., (eds).,
London, 217-23 1.
Singh R.S. & Jackai L.E.N., 1988. The legume pod borer
Maruca testulalis (Geyer) past present and future research. Insect
Sci. Applic., 9; 1-5
Singh B. R., Jackai L.E.N., dos Santos J. H. R. & Adalla C.
B., 1990. Insect pest
of cowpea. In : Pest of Tropical Food Legume, Singh, S. R. (ed.).
Chichester, 43-89. Tamò M., Bottenberg H. Arodokoun D. &
Adéoti R., 1997. The feasibility of
classical biological control of two major cowpea insect pests
In : Advance in Cowpea Research, Singh B. B., Mohan R. A. J., Dashiell D. L.
& Jackai L. E. N. (eds). Ibaraki, 259-270.
Tamò M., Arodokoun D. Y., Zenz N., Tindo M., Agboton C.
& Adéoti R., 2002. the importance of alternative host plants for the
biological control of two key cowpea insects pests, the pod borer Maruca
vitrata (Fabricius) and the flower thrips Megalurothrips
sjostedti (Trybom.). In : Challenges and opportunities for enchancing
sustainable cowpea production, Fatokin, C. A., Tarawali S. A., Singh B. B.,
Mahan
Ray D. R., Dsahiell K. E. & Jackai L. E. N. (eds)., IITA,
Ibadan, Nigeria, 81-93.
Tamò M., Ekesi S., Maniania N. K. & Cherry A., 2003.
Biological control non-
obvious component integrated pest management for cowpea. In:
Biological control in integrated pest management systems in Africa.
Neuenschwander P., Borgemeister C. & Langewald, (eds.)., Wallingford,
205-309.
Tanada Y., 1964. Epizootiology of infections diseases. In
Biological control of insects and weeds. Reinhold, New York. 548 p.
Taylor T. A., 1967.The bionomic of Maruca testulalis
(Geyer) (Lepidoptera:
Pyralidae), a major pest of cowpea in Nigeria. J.W.
Afric.Sci.Assoc., 12,111-129.
Taylor T. A., 1978.Maruca testulalis: an important pest
of tropical grain legume.
In: Pests of Tropical Grain Legumes: ecology and control, Singh
S.R.,Taylor T.A.& Van Emden H.F. (eds)., London, 193-200.
Tiyagi S. A. & Parveen M., 1990. Pathological effect of stunt
nematode
Tylenchorhynchus .brassicae on pollen. Fertility, water
absorption caya ability and plant growth of pigeonpea news pp.19-21.
Vail P. V., 1981. Cabbage looper nuclear polyhedrosis virus
parasitoïd
interactions. Environmental Entomology 517, 221-28.
Waage J. & Greathead D., 1986. Insect parasitoïds.
Academic Press, London,
389 p.
Waterhouse D. F. & Norris K. R., 1987. Chapter 31:
Polyphagotarsonemus latus
(Bank). In: Biological Control Pacific Prospects. Inkata Press.
Melbourne, 454 p. Wigley P. J., 1980. Pratical. Counting micro-organisms. In :
Microbial control
of insect pest (Kalmakoff, J. & Longworth. J. F. eds). DSIR
Bulletin 228. Department of Scientific and Industrial Research, Wellington, New
Teacland, pp. 29-3 5.

ANNEXES
www.
Univmonpt1.fr/biotech/Baculovirus/BaculoSommaire.htm (2001)
ANNEXE 1. La structuration des moyennes de la
Mortalité (moyenne s#177;erreur standard) issues de l'analyse de la
variance suivant le test de Student, Newman et Keuls (parents
infectés)
|
Traitements
|
Durée de l'essai
|
|
Moyennes
|
|
2 H
|
24 H
|
|
|
T0
|
1,66#177;0,04 (0,55)c
|
1,91#177;0,05 (0,57)c
|
1,78#177;0,05 (0,61)C
|
|
T1
|
2,27#177;0,05 (0,82)b
|
2,38#177;0,04 (0,86)b
|
2,32#177;0,03 (0,84)B
|
|
T2
|
2,38#177;0,07 (0,86)b
|
2,34#177;0,11 (0,84)b
|
2,36#177;0,06 (0,85)B
|
|
T3
|
3,14#177;0 (1,00)a
|
3,14#177;0 (1,00)a
|
3,14#177;0(1,00)A
|
|
P>F
|
<0,0001***
|
<0,0001***
|
-
|
|
cv%
|
4,6
|
5,7
|
-
|
|
Moyennes
|
2,36#177;0,12 (0,81) A
|
2,44#177;0,10 (0,84)A
|
-
|
Les moyennes suivies de la même lettre ne sont pas
statistiquement différentes au seuil de 5% ; ( ) : les valeurs entre
parenthèse sont des proportions moyennes sans la transformation arc
sinus ; * * * : différence significative au seuil de 0,1%
ANNEXE 2. La structuration des moyennes de la
présence de Virus (moyennes#177;erreur standard) issues de l'analyse de
la variance suivant le test de Student, Newman et Keuls
|
Traitements
|
Durée de l'essai
|
|
Moyenne
|
|
2 H
|
24 H
|
|
|
T0
|
0 c
|
0 c
|
0 C
|
|
T1
|
2,16#177;0,11 (0,77)b
|
2,20#177;0,04 (0,79)b
|
2,18#177;0,06 (0,78)B
|
|
T2
|
2,25#177;0,06 (0,81)b
|
2,30#177;0,10 (0,83)b
|
2,28#177;0,06 (0,82)B
|
|
T3
|
3,14#177;0 (1,00)a
|
3,14#177;0 (1,00)a
|
3,14#177;0(1,00)A
|
|
P>F
|
<0,0001***
|
<0,0001***
|
-
|
|
cv%
|
7,26
|
6,8
|
|
|
Moyenne
|
1,89#177;0,26 (0,65) A
|
1,9 1#177;0,27 (0,66)A
|
-
|
Les moyennes suivies de la même lettre ne sont pas
statistiquement différentes au seuil de 5% ; ( ) : les valeurs entre
parenthèse sont des proportions moyennes sans la transformation arc
sinus ; * * * : différence significative au seuil de 0,1%
ANNEXE 3. La structuration des moyennes de
l'Emergence des parasitoïdes (moyennes#177;erreur standard) issues de
l'analyse de la variance suivant le test de Student, Newman et Keuls. (Parents
infectés)
|
Traitements
|
Durée de l'essai
|
|
Moyenne
|
|
2 H
|
24 H
|
|
|
T0
|
1,46#177;0,06 (0,45)b
|
1,60#177;0,08 (0,56)a
|
1,58#177;0,06 (0,50)A
|
|
T1
|
1,14#177;0,06 (0,29)c
|
1,33#177;0,06 (0,38)b
|
1,23#177;0,05 (0,34)B
|
|
T2
|
1,79#177;0,09 (0,61)a
|
1,16#177;0,10 (0,31)bc
|
1,48#177;0,12 (0,46)A
|
|
T3
|
1,02#177;0,05 (0,24)c
|
1,02#177;0,07 (0,24)c
|
1 ,02#177;0,04(0,24)C
|
|
P>F
|
<0,0001***
|
0,0002***
|
-
|
|
cv%
|
11,5
|
14
|
|
|
Moyenne
|
1,35#177;0,07 (0,40) A
|
1,30#177;0,07 (0,84)A
|
-
|
Les moyennes suivies de la même lettre ne sont pas
statistiquement différentes au seuil de 5% ; ( ) : les valeurs entre
parenthèse sont des proportions moyennes sans la transformation arc
sinus ; * * * : différence significative au seuil de 0,1%
ANNEXE 4. Analyse de la variance à
deux critères de classification, modèle croisé mixte, des
paramètres de mortalité, d'émergence des adultes de
Apanteles taragamae et de leur infection au virus dans un essai de 4
traitements suivant deux temps (2H et 24 H).(parents infectés)
|
Sources
de variation
|
DL
|
Les carrés moyens
|
|
|
Mortalité
|
Emergence
|
Virus
|
|
Traitements
|
3
|
3,104 ***
|
0,629 ***
|
17,915 ***
|
|
Temps
|
1
|
0,060 ns
|
0,028 ns
|
0,0046 ns
|
|
Traitement*Temps
|
3
|
0,042 ns
|
0,390 ***
|
0,0016 ns
|
|
Erreur
|
32
|
0,015
|
0,029
|
0,018
|
|
Total
|
39
|
-
|
-
|
-
|
|
Cv
|
-
|
5,17
|
12,77
|
7
|
Ces données ont subi une transformation arc sinus ; ns :
différence non significative au seuil de 5% ; *** : différence
significative au seuil de 0,1%
ANNEXE 5. Mortalité des chenilles de
Maruca vitrata en fonction de differentes méthodes de
contamination : 2h et 24h après l'inoculation par le
virus.(première génération)
|
Traitements
|
Durée de l'essai
|
Moyenne
|
|
2 H
|
24 H
|
|
T0
|
1,42#177;0,06 (0,43)b
|
1,45#177;0,06 (0,44) b
|
1,44#177;0,04 (0,43) B
|
|
T1
|
2,54#177;0,08 (0,91)a
|
2,83#177;0,13 (0,96) a
|
2,68#177;0,08 (0,93) A
|
|
T2
|
2,81#177;0,12 (0,94)a
|
2,86#177;0,12 (0,97) a
|
2,78#177;0,08 (0,95) A
|
|
T3
|
2,58#177;0,57 (0,90)a
|
2,99#177;0,09 (0,98) a
|
2,79#177;0,11(0,94) A
|
|
P>F
|
<0,0001***
|
<0,0001***
|
-
|
|
cv%
|
11,18
|
9,15
|
-
|
|
Moyenne
|
2,41#177;0,13 (0,79)A
|
2,53#177;0,15 (0,84)A
|
-
|
ANNEXE 6. Présence de Virus dans les
chenilles de Maruca vitrata en fonction de differentes méthodes
de contamination : 2h et 24h après l'inoculation par le
virus.(première génération)
|
Traitements
|
Durée de l'essai
|
Moyenne
|
|
2 H
|
24 H
|
|
T0
|
0 b
|
0 b
|
0 B
|
|
T1
|
2,54#177;0,07 (0,91) a
|
2,83#177;0,03 (0,96) a
|
2,68#177;0,08 (0,93) A
|
|
T2
|
2,71#177;0,12 (0,94) a
|
2,86#177;0,12 (0,97) a
|
2,78#177;0,08 (0,95) A
|
|
T3
|
2,60#177;0,17 (0,90) a
|
3#177;0,08 (0,98) a
|
2,79#177;0,11 (0,94) A
|
|
P>F
|
<0,0001***
|
<0,0001***
|
-
|
|
cv%
|
12,8
|
10,26
|
-
|
|
Moyenne
|
1,96#177;0,26 (0,68) A
|
2,17#177;0,29 (0,73) A
|
-
|
ANNEXE 7. La structuration des moyennes de
l'émergence des parasitoïdes (moyennes#177;erreur standard) issues
de l'analyse de la variance suivant le test de Student, Newman et
Keuls.(première génération)
|
Traitements
|
Durée de l'essai
|
|
|
Moyenne
|
|
2 H
|
24 H
|
|
|
|
T0
|
1,38#177;0,06 (0,41) b
|
1,41#177;0,05
|
(0,42) d
|
1,39#177;0,04 (0,41) C
|
|
T1
|
1,85#177;0,13 (0,63) a
|
1,72#177;0,07
|
(0,57) c
|
1,78#177;0,07 (0,60) B
|
|
T2
|
2,06#177;0,08 (0,73) a
|
1,97#177;0,09
|
(0,69) b
|
2,02#177;0,06 (0,71) A
|
|
T3
|
1,93#177;0,10 (0,67) a
|
2,36#177;0,07
|
(0,85) a
|
2,15#177;0,09(0,76) A
|
|
P>F
|
0,0009***
|
<0,0001***
|
-
|
|
cv%
|
12
|
9,19
|
|
|
|
Moyenne
|
1,81#177;0,07 (0,61) A
|
1,87#177;0,08
|
(0,63) A
|
-
|
Les moyennes suivies de la même lettre ne sont pas
statistiquement différentes au seuil de 5% ; ( ) : les valeurs entre
parenthèses sont des proportions moyennes sans la transformation arc
sinus ; * * * : différence significative au seuil de 0,1%
ANNEXE 8. Analyse de la variance à
deux critères de classification, modèle croisé mixte, des
paramètres de mortalité, d'émergence des parasitoïdes
et de leur infection au virus dans un essai de 4 traitements suivant deux temps
(2H et 24 H).(première génération)
|
Sources
de variation
|
DL
|
Les carrés moyens
|
|
Mortalité
|
Emergence
|
Virus
|
|
Traitements
|
3
|
4,362 ***
|
1,096 ***
|
18,978 ***
|
|
Temps
|
1
|
0,488 ns
|
0,037 ns
|
0,45 8 ns
|
|
Traitement*Temps
|
3
|
0,068 ns
|
0,163 *
|
0,078 ns
|
|
Erreur
|
32
|
0,060
|
0,03 8
|
0,056
|
|
Total
|
39
|
-
|
-
|
-
|
|
Cv
|
-
|
10,14
|
10,4
|
11,5
|
Ces données ont subi une transformation arc sinus ; ns
: différence non significative au seuil de 5% ; * : différence
significative au seuil de 5% ; ** : différence significative au seuil de
1% ; *** : différence significative au seuil de 0,1%
ANNEXE 9: Les principaux ennemis naturels de
M. vitrata
|
Groupe
|
Espèces
|
Stades
attaqués
|
Lieu de
l'étude
|
Sources
|
|
Pathogènes
|
|
Virus
|
Virus de la Granulose
|
L
|
Kenya
|
Odiendo et
al.,1989
|
|
Virus de la
Polyhédrose
cytoplasmique
|
L
|
Kenya
|
Otieno et al., 1983.
|
|
Bactéries
|
Bacillus sp
|
LC
|
Kenya
|
Okeyo-Owuor et
al., 1991
|
|
Bacillus thuringiensis
|
L
|
Kenya
|
Otieno et al., 1983.
|
|
Bacillus cereus
|
L
|
Kenya
|
Otieno et al..,
1983
|
|
Clostridium
|
L
|
Kenya
|
Okeyo-Owuor et
al.,1991
|
|
Monococci
|
L
|
Kenya
|
Odiendo et
al.,1989
|
|
Champignons
|
Entomophthora spp
|
L
|
Kenya
|
Otieno et al., 1983
|
|
Protozoaires
|
Nosema sp
|
L
|
Kenya
|
Okeyo-Owuor et
a.,1991.
|
|
Parasitoides
|
|
Braconidae
|
Apanteles sp
|
L
|
Kenya
|
Okeyo-Owuor et
al.,1991
|
|
Bracon sp
|
LC
|
Kenya
|
Okeyo-Owuor et
al., 1991
|
|
Braunsia sp
|
L
|
Kenya
|
Okeyo-Owuor et
al., 1991.
|
|
Phanerotoma
leucobasis
|
L
|
Nigeria
|
Arodokoun, 1996
|
|
Trichogrammatoïdae
|
Trichogramma sp
|
O
|
Bénin
|
Tamò et al., 1997
|
|
Eulophidae
|
Tetratichus sp
|
C
|
Nigeria
|
Usua &
Singh, 1978
|
|
T. sesamiae
|
C
|
Kenya
|
Okeyo-Owuor et
al., 1991
|
|
Prédateurs
|
|
Araneae
|
Selenops radiatus
|
L
|
Nigeria
|
Usua & Singh,
1978
|
|
Formicidae
|
Campanotus sericeus
|
L
|
Nigeria
|
Usua &
Singh, 1978
|
|
C. rufoglaucus
|
L
|
Kenya
|
Odiendo et
al.,1991
|
Légende: L = larves; O = oeufs; C
= chrysalide



