CHAPITRE I: INTRODUCTION
Cette étude est donc une remise en question à la
difficulté liée à l'amélioration du bananier
plantain, c'est pourquoi pour chercher à satisfaire le besoin
alimentaire local, national et même international et réduire tant
soi peu, la famine et contribuer au développement de la région
à travers la science, nous devons mieux cerner les problèmes
liés à la culture des bananiers (plantains).
I. 1 PROBLEMATIQUE
A l'heure actuelle, les problèmes alimentaires
constitue une casse tête dans la perspective de développement et
du progrès, or l'activité agricole liée à la
biotechnologie offre présentement la possibilité aux agriculteurs
d'obtenir un rendement meilleur, à travers ces techniques de cultures en
temps record, à moindre coût et à production abondante
(culture in vitro, culture en serre).
La banane plantain constitue l'aliment idéal capable de
résoudre le problème alimentaire dans notre milieu. Parce qu'il a
un apport énergétique conséquent capable d'assurer une
bonne santé à la population. Elle est aussi un aliment qui nous
accompagne dans nos cérémonie comme amuse gueule et comme aliment
de choix dans notre alimentation. D'où nous avons songé à
une étude, sur les bananiers plantains, pour envisager l'abondance de sa
production dans une phytocènose non pathologique. Et pour y parvenir il
fallait penser à la maladie bananière la plus complexe, celle qui
pourra entraver sa production abondante, baisser sa fréquence de
consommation de manière remarquable et décourager ainsi les
cultivateurs à se lancer dans la culture du bananier.
Par ailleurs, nous devons aussi savoir que la maladie des
bananiers provenant d'un champignon, la plus dévastatrice, ayant un
impact négatif sur le rendement, dans une production agricole
bananière est la Cercosporiose. La cercosporiose est la maladie foliaire
la plus dévastatrice dans le monde, causée par
Mycosphaerella spp (Jones, 2000), elle mérite une attention
particulière dans le milieu local. Une bonne vigilance de son
expansion permet de mieux cerner le problème d'imperfection de
production chez les bananiers dans notre région de Kisangani. Elle peut
ravager toute une plantation en un temps record et décourager les
cultivateurs de se lancer dans la culture des bananiers (LAMBOU K et
al 2008).
I. 2 HYPOTHESE DU TRAVAIL
Dans ce travail nous, nous sommes assigné les
hypothèses suivantes :
- Comme le bananier plantain est
cultivé à Kisangani, il est vrai qu'il peut être
attaqué par des maladies entre autre la cercosporiose. Son degré
d'atteinte doit nécessairement avoir un niveau quelconque, ce qui
mérite une étude.
- Les bananiers plantains infectés doivent
réagir face à la maladie de différentes façons
selon les dispositions florales de ses espèces, par exemple, les
bananiers plantains seraient différemment attaqués par la
cercosporiose.
- l'intensité des symptômes
évolueraient aussi différemment dans une population des cultivars
des plantains dans les conditions de Kisangani peut être selon son
échelle de culture expérimentale locale.
I.3 OBJECTIF DU TRAVAIL
L'objectif de notre travail consiste à :
1)
Détecter la présence ou non de Mycosphaerella spp dans
la région de Kisangani et de chercher à adopter un comportement
responsable vis-à-vis aux cultures infectées.
2) Suivre
l'évolution des populations de Musa spp attaquées en vue
d'avoir une vision éclairée sur leur stade d'infection.
3)
Présenter officiellement Mycosphaerella spp à la
communauté scientifique et non scientifique de Kisangani pour une
meilleur lutte contre ce micro-organisme qui crée un fléau
gigantesque sur Musa spp.
4) Contribuer
à l'étude de Mycosphaerella, et apporter à la
génération présente et à venir notre apport dans
l'édifice scientifique en construction perpétuelle. Notamment
à ce sujet.
I.4 BUT ET INTERET
I.4.1 BUT
Le but de ce travail est d'effectuer une observation minutieuse
sur l'évolution des symptômes de Mycosphaerella spp sur
des bananiers plantains de la région de Kisangani et présenter
leur dégât d'infection au niveau local d'après une
caractérisation.
I.4.2 INTERET
L'intérêt de cette étude est qu'elle
permettra aux scientifiques et à la population en général
de :
a) Découvrir Mycosphaerella et son mode
d'invasion
b) Connaître son évolution dans la région de
Kisangani
c) Avoir une expertise globale provenant de l'évolution
des populations de Musa, trouvées dans la région et
infectées par Mycosphaerella.
d) Contribuer à l'étude des
Mycosphaerella pour aider les chercheurs qui pourrons
rechercher à avoir une information quelconque sur cette maladie de s'en
acquérir sans difficulté.
e) Etaler le danger que représente la maladie
causée par Mycosphaerella et chercher à la
combattre en vue de protéger et améliorer nos cultivars qui
pourront en souffrir.
I.5 GENERALITES SUR LES BANANIERS
(PLANTAINS)
I.5.1 DE L'ORIGINE DU BANANIER.
De par son origine, le bananier est une plante rependue
pratiquement sur toutes les zones du monde mais il est certainement important
de connaître son origine. Le bananier proviendrait des régions
forestières asiatiques. Précisément des jungles tropicales
chaudes et humides du Sud- Est asiatique. Cette localisation
géographique correspond exactement aujourd'hui au pays qu'on appelle
Inde, où la banane s'y retrouva vers 500 ans avant Jésus-Christ.
(SIMMONDS, 1987).
Le bananier présente son fruit de 2 façons et se
consomment aussi différemment. Soit il se présente de
manière directe après mûrissement ou brute et se consomme
aussi directement ; banane à dessert, soit il se présente de
manière indirecte sans mûrissement ou avec mûrissement (de
part son mode de consommation) et doit être cuit ou grillé.
(Après avoir été épluché), c'est la banane
plantain. Mais la banane plantain peut aussi être aussi consommée
dans une certaine mesure, directement, après mûrissement bien
sûr, comme la banane à dessert (DALMON A et al 2008).
La banane plantain comme la plus part des bananes est
considérée comme étant le résultat du croisement de
2 espèces diploïdes sauvages des bananiers. Musa acuminata
(Génome AA) et Musa balbisiana (Génome BB) (SIMONDS et
SHEPHRED, 1955). Ces 2 espèces précitées appartiennent
à la section Eumusa et sont donc originaires de l'Asie du Sud-
Est, précisément la partie correspondant à l'Ouest Indien,
l'Est Philippin, le Nord Malaisie ; ainsi qu'une partie de
l'Océanie correspondant au Sud Australien. Ce sont là les
régions où se situent une grande diversification du genre
(STOVER, 1986; CIRAD-GRET, 2002)
Dans la mythologie Indienne, la banane serait le fruit qu'Adam et
Eve mangèrent. Ce qui explique le fait que dans ce pays on
l'appelle « fruit du paradis » ce qui par
interprétation analogie donna le nom de Musa paradisiaca,
donné à la banane plantain (STOVER R.N., 1982).
Depuis l'an 200 de notre ère, les bananerais existait
déjà chez les Chinois. En 650, 450 ans plus tard les marchands
arabes dans leurs navettes l'apportèrent en Palestine. Puis ils se
dispersèrent dans presque tout les pays du monde (STOVER, 1982). En
Afrique c'est la traite des noires qui en aurait introduit puis s'y est
répandu, à nos jours, dans toutes les parties du monde, favorable
à sa culture (STOVER, 1986).
I.5.2 DESCRIPTION DU BANANIER
I.5.2.1 Les organes végétatifs et
reproducteurs du bananier.
I.5.2.1.1 Les organes végétatifs du
bananier
Le bananier est une plante Herbeuse. Une herbe qui se distingue
de toutes les autres qui en générale sont fines et minces par
leurs tailles. D'où le bananier est la plus haute et grande herbe parmi
les végétaux. Elle n'a pas de tige identifiable à
l'observation directe, comme les autres individus du règne
végétal (PADAMANABAN, B et al 2001).
En effet ce qui se présente comme une tige identifiable
à l'observation directe, n'est qu'une fausse tige ou pseudo tronc. Un
pseudo tronc constitué par des feuilles qui forment une gaine foliaire
qui peut avoir un diamètre de 20 cm et au-delà. Le bananier,
malgré qu'il ait une fausse tige qui porte confusion, il possède
quand même une tige. Sa vraie tige est souterraine et est de faible
taille. C'est le pseudo tronc qui possède une grande taille. Sa hauteur
varie entre 2 et 8 mètres, selon les espèces et les
éléments nutritifs, associé aux facteurs environnementaux
(climat, sol, espacement ...), mais la vraie tige du bananier ne dépasse
pas le niveau du sol, jusqu'à l'époque de sa floraison; c'est
pourquoi, elle est classifiée parmi les bulbes ou rhizomes (CHAMPION,
1963).
A partir de ces rhizomes, proviennent les feuilles qui pendant
leur développement apparaissent latéralement jusqu'à
former une gaine qui étouffe la tige ou du moins la camoufle. Le rhizome
est l'élément de reproduction végétatif du
bananier ; vers le bas il donne naissance à des racines qui
s'enfoncent dans le sol (SKIREDJ, et al, 2005)
FIGURE DU BANANIER A INSERER
I.5.2.21 Les organes reproducteurs du bananier.
Un bananier à l'age adulte est constitué d'un
cormus, des racines, d'un pseudo tronc et des feuilles qui le contournent. Les
cormus sont la tige souterraine du bananier ou rhizome. Le bananier adulte
porte généralement un régime qui à des fruits du
bananier, placés sous forme des mains à son sein. Le
régime généralement se développe à partir de
l'inflorescence. Au sommet du bananier se trouve un méristème
apical ou point végétatif d'où se développent vers
le haut les feuilles. Les nouvelles feuilles naissent au centre du sommet du
pseudo tronc, auquel le régime se développe à partir de
celui-ci (THOMAS et al 1996).
L'inflorescence qui apparaît après le
prolongement du méristème apicale est un cone de coloration
violette ou chocolat. Elle se dirige soit vers le haut comme le rachis se
développent souvent vers le bas, (géotropisme positif) et fait
ressortir les bractées qui ont à leurs aisselles des mains. Une
main comporte plusieurs bananes (ISKRA CARUANA et al 2008).
Et les bractées comportent des fleures femelles
à leurs aisselles en plus de mains. Chacune de ces fleures après
développement parthénogénique de son ovaire donne des
doigts. Ces doigts à la chute de la bractée se recourbent vers le
haut (Géotropisme négatif), chaque double rangée des
doigts constitue la main. Les fleures qui sont males restent groupées
sur le cone violacée située à l'extrémité
basale de l'inflorescence (SKIREDJ et al 2005)
I.5.3 SYSTEMATIQUE DU BANANIER
Le bananier plantain appartient systématiquement
au :
- Le bananier plantain est une plante du
règne végétal ;
- Il se retrouve dans l'embranchement de
Phanérogames ;
- Il est dans la classe de
Monocotylédones ;
- Il a pour ordre, Scitaminales ;
- Il est dans la famille de
Musaceae ;
- Il est du
genre, Musa ;
- Parmi ses espèce, on retrouve Musa
paradisiaca et autres espèces de Musa.
Le bananier plantain constitue un groupe tout à fait
homogène. Il est toujours génétiquement triploïde AAB
(SWENNEN, 1984 ; SHOOFS, 1997). Pour ce caractériser, les bananiers
plantains se distinguent des autres bananiers triploïdes ; par des
détails suivants :
- Les bananiers plantains ont toujours des tépales
composés des de couleurs typiques jaunes rouges.
- Leur axe male est généralement absent mais
quand il est présent, il est couvert des bractées persistantes et
des restes des fleures sont males.
- Il possède des longs fruits à chaire
rosâtre et cette chaire est épaisse quand le fruit est mur et est
désagréable au goût quand le fruit est non mur.
- La couleur de leur feuille est vert jaunâtre (DE
LANGHE, 1961a) cité par ADHEKA, 2005
Avec cette diversité morphologique ; les bananiers
plantains peuvent être regroupés en 3 types, selon la disposition
de leurs inflorescences.
- Le Type « French »
avec une inflorescence complète et le bourgeon male présent
à maturité
- Le type « Faux corne »
avec une inflorescence incomplète et le bourgeon male disparaît
à maturité.
- Le type « Vraie
corne » avec une inflorescence incomplète et l'axe
florale s'arrête au de la de la dernière main femelle (TEZENAS DU
MONTCEL et al 1983)
FIGURE DE TYPE D'INFLORESCENCE
I.5.4 Exigences écologiques
Comme tous les êtres vivants, le bananier plantain a
besoin d'eau pour sa survie. Et cela, de manière suffisante, du soleil,
à un rayonnement modéré, car le bananier est une plante
tropicale humide qui évolue bien à des températures
moyennes ou modérées (FACON B et al 2008).
Lorsque la température varie, brusquement en sa
défaveur, le bananier à tendance à faner et à
mourir. Les fluctuations qui se rencontrent entre le changement du jour et de
la nuit contrôlent régulièrement ou régulent sa
viabilité, car la température minimale pour la culture de la
banane est de 11°C, la maximale à 40°C et la moyenne environ
26°C (DE LANGHE et al 1961b)
La croissance du bananier plantain se réalise de
façon ralentie à plus de 40°C. Mais lorsqu'elle s'affaiblit
déjà et à moins de 12°C, les fruits subissent des
dommages en présentant des stries noires. A des températures plus
basses comme à 11°C, il se déforme et se nécrose ou
elle s'arrête complètement. (CHAMPION, 1963)
A part la température, il y a aussi le vent. Le vent est
un élément de l'air qui est très importante pour la
croissance du bananier plantain. Il lui faut entre 60% à 90%
d'humidité. En cas de diminution, on palie cela en irrigant ou
déclanchant la nébulisation sous serre. L'eau étant
important pourra la survie de la plante, il constitue un facteur qui joue dans
l'action d'utilisation de l'humidité par la plante, car la
lumière solaire compense son accumulation de manière
élevée dans la plante (SKIEREDJ et al, 2005).
Le sol où le plantain est cultivé exige un pH
variant entre 3,5 et 9,5 avec un optimum de 5,5 à 7,5.C'est dans les
endroits ou le sol parait entrer en profondeur qu'il pousse mieux. (Au moins
60cm de profondeur), car il draine bien l'eau et ne présente aucune
texture lourde, une faible perméabilité. En ce qui concerne les
éléments minéraux, le bananier exige trop la
présence d'azote, du potassium, le phosphore et le magnésium.
Les matières organiques sont aussi importantes voir
très importantes, pour réguler la croissance de la plante.
(SKIEREDJ et al, 2005)
I.5.5 Importance et valeurs nutritionnelles de la
banane plantain
I.5.5.1 Importance de la banane plantain et valeur
nutritionnelle
La banane plantain est un aliment très important pour
la a population ou le peuplement du monde .Surtout ceux qui habitent dans des
milieux favorables pour sa prolifération (ROSALES, 1998).
Actuellement dans le monde, la banane plantain à sa
place dans le classement des produits couramment consommées ; comme
le riz, le blé et le mais qui tous occupent les rangs importants des
cultures vivrières, en terme de valeur brute de la production. Avec une
production annuelle de 95 millions de tonnes .Près de 90% de bananes et
bananes plantains produit dans des pays qui en exploitent. La production
consacrée, à l'exportation n'atteint que 10%(INIBAB, 2001 ;
ABADI, 2001)
La banane plantain comme nous l'évoquions
précédemment sert à la fois d'aliment
énergétique et de dessert. Elle joue un rôle
socio-economico-culturel très important. La banane produit de la farine.
Celle-ci s'utilise dans la fabrication des beignets, biscuits et
gâteaux ; la purée de la banane peut être
congelée pour une utilisation ultérieure lors de la fabrication
des glaces, des bonbons, le milk-shake, les chewing-gums etc. (KASONGO,
2005).
La banane à une composition chimique voisine à
celle du mucus, tapissant l'estomac. Ainsi, elle joue un rôle dans le
traitement des ulcères gastriques et la diarrhée. Et sa forte
teneur en vitamine B6 aide à soulager le stress et
l'anxiété (DHED'A et al 1991)
Aux Etats-Unis D'Amérique, un extrait naturel du pseudo
tronc est commercialisable en tant que complément alimentaire et comme
pilule préventive contre le cancer. Le jus d de la banane mur est
consommé frais, fermenté pour obtenir une bière à
la faible teneur en alcool commercialisable ou médical. Les bananiers
fournissent des fibres très utilisées dans la fabrication de
certains papiers utilisés dans l'industrie de manufacturation des
sachets de thé et des billets de banque au Japon. Et ces fibres ont
d'autres usages dans la fabrication des cordes, ficelles et de nombreux objets
d'artisanat (CIRAD, 2001)
En outre, selon certaines cultures, nous devons savoir que les
feuilles de bananiers s'utilisent comme toiture lorsqu'elles sont
séchées, comme couverture de contour des latrines, comme lit ou
natte, comme porte objet sur la tête, comme assiette, comme couvre
aliment pendant la cuisson,comme emballage d'aliments, en fin comme papier
hygiénique dans certaines circonstances etc.
I.5.5.2 Valeurs nutritionnelles de la banane
plantain.
Les bananiers en générale sont très
énergétiques (90 calories /100grammes).Elle constitue un
aliment de base de bonne qualité .Elle est très facile à
digérer, d'où elle joue un rôle très importante dans
certains pays où elle est le premier aliment solide donné aux
nourrissons et aux femmes enceintes. Le tableau 1 ci-dessous donne la valeur
nutritionnelle de la banane.
Tableau 1 : La valeur nutritionnelle de la
banane plantain (CIRAD-GRET, 2002)
|
SUBSTENCE
|
Teneure dans la banane plantain
|
|
Eau (litre)
|
68,2
|
|
Glucide (gramme)
|
23,3
|
|
Protides (gramme)
|
0,9
|
|
Fibres (gramme)
|
0,4
|
|
Lipides (gramme)
|
0,2
|
|
Cendres (gramme)
|
1,0
|
|
Energie alimentaire (calorie)
|
476,0
|
|
Calcium (milligramme)
|
19,0
|
|
Phosphore (milligramme)
|
38,0
|
|
Fer (milligramme)
|
0,6
|
|
Potassium (milligramme)
|
352,0
|
|
Sodium (milligramme)
|
3,0
|
|
Equivalent carotène (microgramme)
|
475,0
|
|
Thiamine (microgramme)
|
0,15
|
|
Riboflavine (microgramme)
|
0,06
|
|
Acide ascorbique (microgramme)
|
0,7
|
Pour les sportifs, la banane est particulièrement
indiquée, en raison de sa richesse en glucide, vitamine B, Potassium et
en Magnésium, qui sont des éléments minéraux
très importations pour un bon travail musculaire. La banane étant
sain et digeste, participe au maintient des défenses immunitaires,
grâce a ces apports en vitamine C et B, en minéraux et en
oligoélément variées (Zinc, Cuivre, Manganèse,
Sélénium...) (INIBAP, 2001CIRAD-GRET, 2002)
I.5.5.2.1 Production de la banane dans le monde
En Amérique surtout dans sa partie dite latine et aux
caraïbes, la plus part des bananiers plantains produit servent à
l'exportation .Elles représente environ 35% de la production globale de
ce milieux. Plusieurs pays d'Amérique latine et des Caraïbes
cultivent des grandes quantités de bananes plantains. Et ce ci se
consomme exclusivement localement .Même si on retrouve certains pays
exportateurs, mondiaux comme la Colombie, l'Equateur qui souvent utilisent plus
de la moitié de leurs productions au terroir malgré
l'exportation. En Asie et au Pacifique, les bananes viennent en tête de
tous les fruits produits. Aux Philippines, en Thaïlande, en
Indonésie en Inde, leurs productions atteignent environ 25millions de
tonnes par an, soit 95% de la production de la région (KASONGO, 2005)
La banane est un aliment de base pour la plus part
d'individus dans le monde. En Europe et le reste d'endroits du monde où
le climat n'y est défavorable, il est souvent difficile d'apercevoir des
bananiers, plantés de façon permanente. La banane est une culture
importante des hautes terres d'Afrique de l'Est et dans les zones tropicales
humides d'Afrique occidentale et centrale. En Ouganda, au Burundi et au
Rwanda, la consommation annuelle est d'environ 250Kg/ Personnes, ce qui
apparaît comme un record mondial (INIBAP, 2001). En République
démocratique du Congo (R.D.C) ; la banane plantain constitue une
nourriture de base chez la population du Nord-Est et du Centre. Près de
70% de la production bananière s'y consomment directement par les
producteurs locaux, ruraux, 30% restant représente la partie
commercialisable et l'ensemble de pertes enregistrés dans des
conditionnements des produits, après sa récolte. (BAKELENA et
MUYUNGU, 1996).
La production annuelle de banane dans le monde est estimée
à 2.700.00 tonnes (FRISON et SHAROCK, 1998). Les tableaux 1 et 2
ci-dessous donnent les 10 premiers producteurs et consommateurs de la banane
plantains (FRISON et SHARROCK, 1998)
Tableau 2 : Les 10 premiers producteurs de
Bananes
|
N°
|
Pays
|
Production en Kg/an
|
|
1
|
INDE
|
9.934.600
|
|
2
|
OUGANDA
|
9.893.000
|
|
3
|
EQUATEUR
|
6.622.362
|
|
4
|
BRESIL
|
5.779.120
|
|
5
|
COLOMBIE
|
4.767.800
|
|
6
|
INDONESIE
|
4.767.720
|
|
7
|
PHILIPINE
|
3.500.000
|
|
8
|
CHINE
|
3.41.000
|
|
9
|
R.D.CONGO
|
2.700.000
|
|
10
|
COSTA-RICA
|
2.505.000
|
Tableau 3 : Les 10 premiers consommateurs de
bananes dans le monde.
|
N°
|
PAYS
|
Consommations en Kg/individus
|
|
1
|
OUGANDA
|
243
|
|
2
|
RWANDA
|
197
|
|
3
|
GABON
|
161
|
|
4
|
CAMEROUN
|
128
|
|
5
|
PAPOUASIE NOUVELLE GUINEE
|
121
|
|
6
|
SAO-TOME et PRINCIPE
|
113
|
|
7
|
GHANA
|
92
|
|
8
|
BURUNDI
|
89
|
|
9
|
EQUATEUR
|
88
|
|
10
|
MARTINIQUE
|
86
|
I.5.6 Les maladies et ravageurs des bananiers
(plantains
I.5.6.1 Les Maladies virales
1. LE BUNCHY TOP DU BANANIER.
Le Bunchy top est l'affection virale la plus
grave des bananiers plantains .Elle est causée par le Pentalonia
nigronervosa. (THOMAS et al 1994). Ces symptômes
s'observent mieux lorsque la plante est suffisamment atteinte, car ils
apparaissent sous forme des rosettes avec des feuilles parfaitement
dressées mais courtes. D'où cette appellation anglaise
de « Bunchy top » ou « sommet
touffu » en français (BLANC et al 2008).
Les bords des feuilles atteintes se recourbent vers le haut et
jaunissent, sur leurs nervures centrales et aux pétioles apparaissent
des striés verts très foncées, étendues jusqu'au
pseudo tronc (GAYRAL et al 2008). L e symptôme direct est la
présence des tirets vert foncées et des pointillées sur
les nervures secondaires des feuilles qui fournissent fortement des
aspérités, lorsqu'ils pénètrent dans l'arrêt
de la nervure centrale (PALUKU, 2005)
2. LA MOSAÏQUE DES BRACTEES DU BANANIER
Cette maladie est causée par le virus de la mosaïque
des bractées du bananier (B.Br.M.V), ses symptômes sont
généralement caractéristiques, comme l'indique son nom. On
observe une mosaïque brune rouge foncée sur les bractées de
l'inflorescence mâle. Ce qui la distingue de toutes les autres maladies
virales connues du bananier (BODJO et al 2008).
D'autres symptômes sont des lésions multiformes de
coloration vertes brunes, ou rouge, selon que le cultivar développe sa
maladie. Et cette coloration s'observe au niveau des pétioles, car les
feuilles s'engorgent souvent et les limbes présentent ou pas des
feuilles jeunes. Cette maladie à été observée pour
la première fois en 1979 à DAVAO dans l'île de MINDANAO aux
Philippines (ONAUTSHU, 2007)
I.5.6.2 Les maladies bactériennes.
1. LA MALADIE DE BUGTOK DU BANANIER
PLANTAIN
L'agent causal de cette maladie est le Pseudomonas Solana
Cearum. Les symptômes externes de la maladie de bugtok ne sont
souvent visibles que sur les plantes ayant encore leur inflorescence
mâle. Les bractées âgées des plantes infectées
ne manifestent aucune déhiscence, d'où cela donne une apparence
sèche et légère ou lâche, son régime est sain
avec une hampe longue et propre portant l'inflorescence mâle (BALINIE
ELSA et al 2008).
2. LA MALADIE DE MOKO
Cette maladie comme l'une des maladies, citées
précédemment est aussi causée par un
Pseudomonas. Elle est surtout fréquente en
Amérique, aux Philippines surtout. Cette maladie provoque des
flétrissements des feuilles de bananes en commençant par les plus
jeunes ; suivi de la nécrose de cigare. Les fruits immatures d'un
bananier infecté prennent une coloration jaunâtre. Et ces pulpes
présentent une pourriture sèche. Et cella entraîne un
développement anormal du régime dont les fruits pourrissent avant
de mourir. Cela s'observe surtout quant l'infection s'est produite avant la
floraison (MOLINA, 1999) (ONAUTSHU, 2007)
I.5.6.3. Les Maladies dues aux
charançons.
1. LES CHARANÇONS DU BANANIER EN
GENERAL.
Les charançons du bananier comme le Cosmopolites
Sordiodus, ont une origine Asiatique. L'origine précise serait
l'Indonésie et la Malaisie. En R.D.congo, cet insecte serait introduit
avec les plantes de bananiers venus de Sao tomé et principe. Vers 1925,
déjà il était retrouvé à Mbandaka et
à Libenge dans la province de l'Equateur, à Kindu au
Manièma et dans la ville de Beni au Nord Kivu, puis de là, les
charançons ce sont répandues partout en R.D. Congo et ce sont
retrouvés dans la ville de Kisangani. C'est surtout à l'Est
où la culture des bananiers est abondante pour la fabrication de la
bière qu'on les retrouve. (ONAUTSHU, 2007)
Les charançons figurent parmi les principaux ravageurs
des bananiers plantains, quant on fait allusion aux insectes ravageurs. Surtout
les bananiers plantains, du genre Ensete. Les charançons volent
rarement et leur diffusion se fait essentiellement par l'intermédiaire
de matériel végétal infecté comme nous l'avons
évoqué ci-haut. Les symptômes de la maladie s'observent
à la partie supérieure de la plante où les feuilles se
dessèchent. Surtout celles situées à la
périphérie car elles sont les premières à vieillir.
La banane parait souffrir de la sécheresse et les régimes sont de
très petites tailles. Une bonne partie du système radiculaire se
dessèche et les bananiers atteints sont souvent déracinés
par les tornades (SIMMONDS, 1976).
2. LES CHARANÇONS DU PSEUDO TRONC DU
BANANIER
L'espèce ravageuse du pseudo tronc du bananier est
Odoiporus longicollis, Oliver appelée également
« Floreur du pseudo tronc du bananier ». L'un des
principaux ravageurs des bananiers plantains est Coleoptrea :
Curculionidae ; il a des larves qui se nourrissent des tissus
succulents des gaines, dans lesquelles, elles creusent une multitude des
galeries qui peuvent atteindre la tige proprement dite. Si les larves
émergent juste avant le stade de floraison. Il arrive qu'elles
dévorent les pseudo tronc et à bloquer l'émergence du
bourgeon (ONAUTSHU, 2007) (PADMANA BAN et al, 2001).
I.5.6.4. Les Nématodes Parasites des
racines.
1. Radopholus simili
Le Radopholus simili, est l'un des nématodes
parasites des racines de bananiers plantains le plus fréquent. Surtout
dans la zone inter tropical. Ce parasite pénètre souvent l'apex
de la racine mais parfois aussi sur toute la longueur de la racine.
C'est-à-dire au fur et à mesure qu'il y a progression inter et
intracellulaire. Le Radopholus simili se nourrit aux dépends du
cytoplasme des cellules du parenchyme cortical, jusqu'à détruire
la paroi de la cellule et à former un tunnel qui évolue et
apparaît comme une pathologie de l'espèce nécrosée.
Cette destruction peut atteindre tout le cylindre central du cortex (ONAUTSHU,
2007)
2. Pratylenchus Coffeae et P. goodey
Ces 2 espèces de nématodes qui sont aussi parmi
les prédateurs majeurs des bananiers plantains. Leur ravage crée
des dégâts énormes aussi comme des Radopholus
simili, que nous avons cité précédemment. (BRIDGE et
al, 1997) (ONAUTSHU, 2007)
3. Meloidogyne incognita et M.
Javanica.
Ces 2 espèces sont aussi des grands destructeurs de
bananiers plantains. Le Meloidogyne Javanica, s'appelle aussi,
« Nématode à galle des bananiers ». Partout
où il y a culture des bananiers plantains on ne manque pas de retrouver
l'un ou l'autre dans ce site. Alors, malgré leurs large
répartition et parfois leurs abondance, les nématodes à
galle ne sont pas considérés comme ayant un pouvoir
pathogène beaucoup plus important sur les bananiers, plantains que
d'autre espèces cités ci-haut. Ils sont également
présent en association avec Pratylenchus spp et Radopholus simili (De
WAELE et al, 1998)
I.5.6.5. Les Maladies Cryptogamiques.
1. MALADIES DE PANAMA.
L'agent responsable de la fusariose du bananier appelée
également « Maladie de Panama », c'est le
Fusarium oxyporum. Le symptôme de cette maladie du bananier
crée un jaunissement prononcé du feuillage en commençant
par les feuilles les plus basses jusqu'au feuilles les plus haute, selon que
celle-ci vieillissent (MUSOLI et al 2008). Cela fait que la bordure
des feuillages crée un virement du vert pale au jaune. Ensuite les
bandes nécrotiques entourées d'une marge jaune apparaissent. Ce
qui finit par faire périr la feuille en la pourrissant. Les feuilles les
plus basses pendent en forme d'entonnoir, le long du pseudo tronc et meurent
complètement. (CARLIER et al 2003)
2. Les Cercosporioses et autres maladies d'origine
fongiques.
a) Généralités sur les
cercosporioses
Les cercosporioses du bananier ont pour origine deux
champignons ascomycètes apparentés ; Mycosphaerella
fijiensis Morelet, agent de la maladie des raies noires (MRN) ou
cercosporiose noire et Mycosphaerelle musicola Lech ex Mulder, agent
de la maladie de Sigatoka (M-S) ou cercosporiose jaune. Les 2 agents
pathogènes se distinguent essentiellement par les
caractéristiques morphologiques des conidies et des conidiospores
(ARZANLOU et al 2008). L'épaississement des parois cellulaires
observables à la base des conidies des Paracercospora fijiensis
(Morelet) Deighton (Anamorphe de M. fijienssis) est absent des conidies de
Pseudocercospora musae (Zimm) Deighton Anamorphe de M. Musicola
(CARLIER J et al 2000).
En outre les conidies de P. fijiensis qui sont
souvent courbées et exhibent des cicatrices conidiennes. Ces
différences entre les anamorphes peuvent être observées
directement sur les échantillons des feuilles et sur les cultures
sporulantes après isolement de l'agent pathogène (PEREGRINE et
al 1989).
En dehors de ces deux espèces de Mycosphaerella qui
attaquent les bananiers, il existe aussi, d'autres espèces virulentes et
qui causent d'autres maladies fongiques sur les bananiers plantains. Parmi
celles-ci Mycosphaerella Eumusae agent responsable de la maladie
qu'on appelle ELSD (Eumusae leaf spot disease), maladie très
fréquente en Inde, amis actuellement, elle est distribuée
à travers les continents et Mycosphaerella musae,
considérée virulente et dévastatrice (CRUZ, 2002). Mais
sa distribution n'est pas encore confirmée à l'échelle
planétaire. Elle n'est encore apparente qu'en Afrique du Sud et dans la
région sud- tropicale d'Australie. (JACOME et al, 2003).
b) Historique des cercosporioses du
bananier
La maladie de Sigatoka a été identifiée
pour la première fois à Java en 1902. Depuis 1962, elle est
signalée dans la plupart des zones de production bananière du
monde ; ce qui le met au rang des principales épiphyties
(MOURICHON et al 1997).
Quant à la maladie des raies noires, elle a
été identifiée pour la première fois en 1963 sur le
côté Sud Est de Viti Levu (Iles Fidji). (Detroit de Torres et
Péninsule du Cap York en Australie, Papouasie - Nouvelle- Guinée,
Iles Cook, Tahiti, Hawaï).
En Asie, elle a également été
observée dans des parties telles que Bhutan, Taiwan, Sud de la Chine,
(RHODES, 1964), y compris l'Ile Hainan, Vietnam, Philippines, Malaisie
Occidentale et Sumatra en Indonésie (LONG et al 1979).
Cependant, la distribution de cette maladie en Asie du Sud -Est demande
à être clarifiée en particulier au sein de l'Archipel de
l'Indonésie (JONES et al 2008).
En Amérique, c'est dans sa partie dite latine que la
maladie des raies noires a été identifiée pour la
première fois. En 1972, on observe au Honduras. Elle est ensuite
propagée vers le Nord (Guatemala, Belize, Sud du Mexique et au sud vers
Salvador, Nicaragua, Costa-Rica, Panama, Colombie, Equateur, Pérou,
Bolivie. Les derniers pays dont la maladie s'est révélée
sont : le Venezuela, le Cuba, la Jamaïque et la République
Dominicaine d'où elle menace de se propager vers le reste des
Caraïbes (CARLIER et al 1994).
En Afrique, cette affection, a été signalée
pour la première fois en Zambie en 1973 (RAEMAEKERS, 1975) et au Gabon
en 1978 (FROSSARD et al 1981), elle s'est répandue le long de
la côte occidentale vers le Cameroun, le Nigeria, Le Benin, le Togo, le
Ghana et la Côte d'Ivoire. Elle est également présente au
Congo-Brazza et en R D Congo. Elle loge la partie Est, notamment, dans des
pays tels que le Rwanda, le Burundi, l'Ouest de la Tanzanie, le Kenya,
l'Ouganda et s'étend vers la République Centrafricaine. (DABEKA
et WALLER, 1990). Vers 1987, elle a été introduite dans
l'île de Pemba, d'où, elle s'est propagée à zanzibar
et aux zones côtières de Kenya et de la Tanzanie, sans oublier le
Malawi et les Comores.
Etant donné qu'il n'y a pas une très grande
considération sur le Mycosphaerella musae à cause de
certaines incertitudes sur sa manifestation qui s'apparente avec celle de deux
espèces précitées, nous nous contentons de parler de
Mycosphaerella eumusae. Ce microorganisme a été
considéré et reconnu au milieu des années 1990 (CARLIER
et al, 2000) tout cela à cause de l'incertitude des
scientifiques sur leurs découvertes d'une maladie qu'ils avaient
attribuées au Mycosphaerella fijiensis, à Bhutan en 1985
(PEREGRINE, 1998).
Mais les scientifiques se demandaient pourquoi ne
retrouvaient-ils pas cette maladie aux alentours de l'Inde vers la même
période. En 1992 et 1995 une équipe de l'UNIBAP fut
envoyée sur terrain pour collecter certains échantillons des
spécimens au Sud Est asiatique et la région du Sud. Durant leur
visite de diagnostic, ils crurent reconnaitre les indices prouvant la
présence de M. fijiensis en Malaisie et en Thaïlande et
ceux qu'ils récoltèrent en Inde ils crurent à la
présence de Mycosphaerella musicola. Après analyse, de
ces deux échantillons, du CIRAD, on ne retrouva ni l'un, ni l'autre.
Mais, la majorité des champignons provenant de cette région
étaient atypique. (ANON, 1995) et (CARLIER et al, 2006). Alors,
on compara les échantillons de ce milieu avec ceux collectés
à Origine au Nigeria en 1989 et 1990 qu'on pensait être des M.
fijiensis. Après confrontation, on confirma la présence de
Mycosphaerella eumusae. Identifié pour la première fois
au Nigeria (ABADI et al 2001b).
2.1. Le Mycosphaerella
Le Mycosphaerella est un champignon microscopique agent
de plusieurs maladies des plantes car les champignons sont responsables du
près de la moitié des maladies connues. (LE POIVRE, 2003)
2.1.1. Présentation de Mycosphaerella
présent sur Musa
Le Mycosphaerella présent sur musa est un
champignon appartenant au :
ü Le Mycosphaerella présent sur
Musa est un champignon appartenant au Règne
végétal
ü Il se retrouve dans l'embranchement de
loculoascomycètes
ü Il est de la classe des ascomycètes
ü Il se retrouve dans l'ordre des dothidéales
ü Sa famille est celle de Mysosphaerellae
ü Il est du genre Mycosphaerella
ü Parmi ses espèces, on peut
citer Mycosphaerella musicole, M. fijiensis, M.
eumusae...
Le genre mycosphaerella est un des genres les plus
représentés des ascomycètes avec plus de 3000 Taxa.
Environ 23 genres anamorphes ont été liés à
Mycosphaerella, à l'aide d'étude sur les cultures
variées. Des études phylogénétiques à partir
des séquences d'ADN ITS1, 5.8S et ITS2 ont permis d'identifier les
synonymies parmi les genres anamorphes. De plus, plusieurs genres qui
n'étaient pas associés auparavant à mycosphaerella se
regroupent à ce jour dans ce genre qui s'est avéré
être principalement monophylétique. A partir de ces
résultats, ainsi que par la réévaluation des
critères, desquels on peut distinguer les genres a été
réduit (JACOME et al 2003)
Par exemple, le degré d'épaississement, de
noircissement et de réfraction des cicatrices ainsi que la
présence ou l'absence des pigmentations dans les conidiophores et la
conidies qui semble être des critères pour délimiter les
genres des anamorphes des Mycosphaerella (MEREDITH et al
1970).
2.1.3. Symptômes
Il est parfois difficile d'établir la différence
entre le symptôme de la maladie des raies noires et ceux de la maladie de
sigatoka. De manière générale, le premier symptôme
apparait sur la face supérieure du limbe, sous forme de tirets jaunes
pâles (MS) ou marron foncé sur la face inférieure du limbe
(MRN) de 1 à 2 mm de long, qui s'élargissent pour former des
lésions nécrotiques à halo jaune et centre gris clair. Les
lésions peuvent devenir coalescentes et détruire de vastes
portions de tissus foliaires, entrainant une réduction du rendement et
une maturation prématurée des fruits (PHILPOTTE et al,
1913).
La maladie des raies noires revêt un caractère de
gravité plus important que la maladie de sigatoka, car ses
symptômes se manifestent sur les feuilles à un plus jeune
âge (Inoculum étant généralement plus abondant)
(ZAPATER et al 2008), et causent donc davantage des
dégâts au système foliaire du bananier. En outre, elle
affecte beaucoup les cultivars résistants à la maladie de
sigatoka, tels ceux du sous-groupe des bananiers plantains (AAB). Les pertes de
production peuvent atteindre dans certains cas plus de 50% (CARLIER et
al, 1997)
Chapitre II : MATERIELS ET METHODES
II.1. Milieu d'étude
Le milieu d'étude de ce travail est un site au sein duquel
se retrouve des bananiers plantains collectés par des scientifiques pour
études. Il se retrouve dans l'enceinte de la Faculté des
Sciences de l'Université de Kisangani. Le climat régional de la
ville de Kisangani et du type AF selon la classification de KOPPEN avec une
moyenne de température oscillant entre 22,4 à 26°C (KUMBA,
2008).
La région de Kisangani est située dans la cuvette
centrale à 00°31' de latitude Nord et de 250°11' de longitude
Est. Sa superficie est de 1910 km2. Tandis que le champ expérimental est
situé à 00°30'45 Nord de latitude et 0,12 de longitude.
Altitude 393 mètre (GPS de marque Magellan)
II.2. Matériel végétal
En ce qui concerne le matériel, nous nous sommes servi des
bananiers plantains se retrouvant dans le champ de collection des bananiers et
bananiers plantains de la faculté des sciences de l'Université de
Kisangani.
Parmi ces bananiers plantains, les cultivars utilisés pour
la présente observation sont représentés dans le tableau 4
ci-dessous.
Tableau 4 : Cultivars de référence
étudiés, regroupés selon leurs natures, génotypes
et usages.
|
N°
|
Cultivar
|
Type de floraison
|
Nature
|
Génotype
|
Usage
|
|
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
|
APOKA MAGBUKE
MBURUKU-VERT
LIBANGA LYA BOEA BOKOY
LINGU
BOLOMAISE
LOKUSU II
ADILI
BOSAKARAKA II
NGUKU
ALEKE MOMBINGENE
AMUNGU
MAGOMA II
BOOFO NOIR
AMAGABA
FRENCH ROUGET ou Plantain-Rouse
BOGO
EGBE O MABESE (Reverse)
EGBE O MABESE(I)
IKPOLO
|
Faux corne
Faux corne
French
Faux corne
French
Vraie corne
French
French
French
French
French
Faux corne
French
French
French
French
Faux corne
Vraie corne
|
Triploide naturel
Triploide naturel
Triploide naturel
Triploide naturel
Triploide naturel
Triploide naturel
Triploide naturel
Triploide naturel
Triploide naturel
Triploide naturel
Triploide naturel
Triploide naturel
Triploide naturel
Triploide naturel
Triploide naturel
Triploide naturel
Triploide naturel
Triploide naturel
|
AAB
AAB
AAB
AAB
AAB
AAB
AAB
AAB
AAB
AAB
AAB
AAB
AAB
AAB
AAB
AAB
AAB
AAB
|
À cuire
À cuire
À cuire
À cuire
À cuire
À cuire
À cuire
À cuire
À cuire
À cuire
À cuire
À cuire
À cuire
À cuire
À cuire
À cuire
À cuire
À cuire
|
|
Total 18 Cultivars
|
|
|
|
|
II.3. METHODES
Il existe plusieurs méthodes des dispositifs pour
étudier les Mycosphaerella. Parmi ceux-ci nous pouvons citer
le dispositif expérimental, le dispositif en randomisation total et le
dispositif en bloc de Fischer.
Nous avons choisi 18 cultivars comportant 5 plants en ligne. Les
noms de cultivars étaient donnés par les plaques
d'identifications (collections FSK, code MG 19, 2006). Puis nous avons
vérifiés :
- Leur type de floraison ;
- Le niveau d'évolution du dégât ;
- L'indice de dispersion de la maladie ;
a)Au niveau du type de floraison nous avons
catégorisé les cultivars selon leur regroupement par leur type
d'inflorescence, puis nous avons calculé leur taux d'infection
moyenne.
b) Au niveau de dégâts, nous avons observé,
le dégât causée par les champignons sur les feuilles de
bananiers plantains identifiées pathogènes durant une
période de 6 semaines, puis nous avons observé l'évolution
du dégât pendant les dites semaine .Les six semaines de suivi
correspondent à la date allant du1er septembre au 12 octobre 2008. Nous
avons enregistré le niveau de dégâts sur chaque cultivar,
puis nous avons effectués une moyenne pour ces 6 semaines d'observation
de l'évolution de Mycosphaerella en comptant de haut en bas de
la plus jeune nécrosée (PJFN)(ABADI et al 2008 ;
PAULIN et al 2008 ) et la 1ere feuille qui présent
au moins 10 lésions nécrotiques matures distincts c.à.d.
une grande zone nécrotique contenant au moins 10 centres
desséchés de couleur claire ce qui correspond aussi au 6 niveau
de dégât selon les différentes phases associé au 7
feuilles du bananier déjà infecté et qui sont
représentés dans le tableau 5 ci-dessous. (Selon les
stades)(LECHER et al 1941)
|
Phase
|
Description
|
|
Phase 1
|
attaque de la cigare du bananier associé à la
1ere feuille qui présent au moins 10 lésions
nécrotiques.
|
|
Phase 2
|
déroulement de la cigare est la 1ere feuille
qui présente au moins 10 lésions nécrotique
|
|
Phase 3
|
progression de la maladie à la 2e feuille en
partant de la cigare vers la feuille la plus superficielle du pseudo tronc.
|
|
Phase 4
|
progression de la maladie à la 3e feuille en
partant de la cigare vers la feuille la plus superficielle du pseudo tronc.
|
|
Phase 5
|
progression de la maladie à la 4e feuille en
partant de la cigare vers la feuille la plus superficielle du pseudo tronc.
|
|
Phase 6
|
progression de la maladie à la 5e feuille en
partant de la cigare vers la feuille la plus superficielle du pseudo tronc
associé au deux feuilles du pseudo tronc situé à la
périphérie du pseudo tronc.
|
c) Pour l'indice de dispersion de la maladie, nous nous sommes
basé sur les symptômes de la maladie en se penchant sur le TDM
(temps de développement de la maladie) en comptant les nombres des jours
entre le moment ou les feuilles sont au stade d'apparition d'au moins 10
lésions nécrotiques (PARNEL M et al 1998).
  
Fig.1 Fig.2 Fig.3
Fig.1 : 1 cultivar de niveau de dégât 1.
(Cigare infecté)
Fig. 2 : 1 cultivar de niveau de dégât 2.
Fig. 3 : 1cultivar de niveau de dégât 3
Fig. 4 : 8 cultivar de niveau de dégât 5 et 6

Fig.4
CHAPITRE III : RESULTAT ET DISCUSSION.
III.1. RESULTAT
Après avoir suivi l'évolution de 18 types de
cultivars collectés, en série de 5 individus par groupe, nous
avons pu obtenir un résultat quelconque. Ce résultat est le fruit
de l'indentification de tous les individus que nous avons trouvé malades
dès la première semaine d'observation de l'évolution de la
cercosporiose, sur les cultivars que nous avions ciblés. Et ce sont ceux
la qui étaient choisi pour suivi de l'évolution.
Pour chaque type de cultivars nous avons observé ceci,
Tableau 6 : nombre de cultivars observé selon le type
de floraison en pourcentage par groupe ;
|
No.
|
Type
|
Cultivars
|
Nbre observé
|
Nbre des malades
|
Nbre de % /groupe
|
|
1
|
French
|
ADILI
|
5
|
4
|
80 %
|
|
2
|
French
|
ALEKE
|
5
|
1
|
20 %
|
|
3
|
French
|
AMAGABA
|
5
|
1
|
20 %
|
|
4
|
French
|
AMUNGU
|
5
|
1
|
20 %
|
|
5
|
Faux corne
|
APOKA MAGBUKE
|
5
|
3
|
60 %
|
|
6
|
French
|
BOGO
|
5
|
5
|
100 %
|
|
7
|
French
|
BOLOMAISE
|
5
|
2
|
40 %
|
|
8
|
French
|
BOOFO NOIR
|
5
|
2
|
40 %
|
|
9
|
French
|
BOSAKARAKA
|
5
|
2
|
40 %
|
|
10
|
Faux corne
|
EGBE O MABESE
|
5
|
1
|
20 %
|
|
11
|
French
|
FRENCH ROUGE
|
5
|
2
|
40 %
|
|
12
|
Vraie corne
|
IKPOLO ROUGE
|
5
|
1
|
20 %
|
|
13
|
French
|
LIBANGA LYA BOEA BOKOY
|
5
|
2
|
40 %
|
|
14
|
Faux corne
|
LINGU
|
5
|
1
|
20 %
|
|
15
|
Vraie corne
|
LOKUSU II
|
5
|
2
|
40 %
|
|
16
|
Faux corne
|
MAGOMA II
|
5
|
1
|
20 %
|
|
17
|
Faux corne
|
MBOUROUKU VERT
|
5
|
2
|
40 %
|
|
18
|
French
|
NGUKU
|
5
|
2
|
40 %
|
|
TOTAL
|
90
|
35
|
Le tableau 6 ci-dessus reparti pour chaque groupe, sa
proportionnalité en individus malades que nous synthétisons comme
suit :
1. ADILI a présenté 4 individus
malades ;
2. ALEKE (MOMBINGENE) a présenté un individu
malade ;
3. AMAGABA a présenté un individu
malade ;
4. AMUNGU a présenté un individu
malade ;
5. APOKA MAGBUKE a présenté trois individus
malades ;
6. BOGO a présenté cinq individus
malades ;
7. BOLOMAISE a présenté deux individus
malades ;
8. BOOFO NOIRE a présenté deux individus
malades ;
9. BOSAKARAKA II a présenté deux individus
malades ;
10. EGBE O MABESE (reverse) a présenté un
individu malade ;
11. FRENCH ROUGE II a présenté deux individus
malades ;
12. IKPOLO ROUGE a présenté un individu
malade ;
13. LIBANGA LYABOEA BOKOY a présenté deux
individus malades ;
14. LINGU a présenté un individu
malade ;
15. LOKUSU II a présenté deux individus
malades ;
16. MAGOMA II a présenté un individu
malade ;
17. MBOUROUKOU VERT a présenté deux individus
malades ;
18. NGUKU a présenté deux individus
malades ;
Après analyse de symptôme observé, ces
individus ont présentés des niveaux des dégâts
aléatoires, allant de la première semaine à la
6e semaine. Voici alors le tableau représentatif des
symptômes observé : cfr tableau 7
Ainsi, les cultivars ont présentés des niveaux de
dégâts aléatoires, allant de la 1ère
semaine à la 6e semaine et ceci se présente comme
suit : (pour ces 18 groupes de bananiers plantains
sélectionnés) :
- ADILI : pour la première semaine,
les cultivars observés pour ce groupe ont respectivement
été pour la première semaine au stade I ; puis la
2e semaine, les cultivars du 2e rang est monté au
niveau de dégât de deux et les autres sont resté au stade
I ; la 3e semaine mêmement, la 4e semaine
ceux du 2e et 3e rang sont monté au stade II,
tandis que le premier du rang et le dernier sont toujours resté au stade
I ; la 5e semaine celui du 2e rang est monté
au niveau III et le 3e du rang, au niveau II toujours ; ainsi
que le premier et dernier, donc le 4e est resté au stade I.
enfin, à la 6e semaine ils sont restés idem tout les
4.
- ALEKE MOMBINGENE : pour la
première semaine, le seul cultivar observé dans ce groupe
était au stade I, puis les 2e, 3e et 4e
semaines au stade II. Enfin, à la 5e et 6e semaine
au stade III.
- AMAGABA : pour la première
semaine, le seul cultivar observé ici à débuté au
stade IV puis à la 3e et 4e semaine il est
monté au stade V, à la 5e et 6e semaine au
stade VI.
- AMUNGU : pour la première semaine,
le cultivar unique observé dans ce groupe était au stade I puis
les 2e et 3e semaines au stade II, les 4e et
5e semaines au stade III. Enfin, la 6e semaine au stade
IV.
- APOKA : il y'a eu 3 cultivars
observés. Celui du premier rang a été au stade I durant la
première semaine, ceux du 2e et 3e rang au stade
II. A la 2e, 3e et 4e semaine, ceux du
2e rang et 3e sont devenus différents, stade II et
III ; tandis que celui du premier rang est resté au stade I,
à la 2e semaine, au stade II à la 3e
semaine. Puis au stade III à 4e et 5e semaine
pendant que ceux du 2e et 3e rang sont montés
respectivement au stade III et IV pour la 5e et 6e
semaine, celui du premier rang monte au stade VI à la 6e
semaine.
- BOGO : ce 5 cultivars n'ont pas du tout
évolués, de la première semaine à la 6e
semaine, ils sont restés au stade I donc c'est un cas typique de
résistance à la maladie.
- BOLOMAISE : pour ce groupe, les 2
cultivars observés ont été au stade IV et I pour la
première semaine. Puis celui du premier du rang est monté au
stade V durant la 2e et 3e semaine, et à la
4e, 5e et 6e semaine au stade VI. Quand au
second, il est resté au stade I la 2e et 3e
semaine pour monter au stade II à la 4e semaine et au stade
III à la 5e et 6e semaine.
- BOOFA NOIRE : ici aussi on a
observé 2cultuvares, à la première semaine ils sont
resté au stade I, à la 2e semaine le premier du rang
au stade I toujours, celui du 2e rang monte au stade II. A la
3e et 4e semaine, ils ont respectivement atteint les
stades II et III. A la 5e semaine, celui du premier rang est
resté au stade II celui du 2e rang mont au stade IV. Enfin,
à la 6e semaine celui du premier rang est monté au
stade III, le second est resté au stade IV.
- BOSAKARAKA II : Deux cultivars, celui du
1 er rang est resté au stade v pendant ; la 1e ;
2e ; 3e ; et 4e semaines et a la
5e et 6e semaine il est monté au stade VI. Le
second durant pour le 1er, 2 e, 3e semaine, il est resté au
stade III. A la 4e semaine au stade IV, à la 5 e semaine au
stade V et enfin 6e semaine stade VI.
- EGBE O MABESE : le seul cultivar
observé du groupe et qui est resté au stade III à la
1ere et 2e semaine, à la 3e et
4e semaine il est monté au stade IV et à la
5e et 6e semaine au stade V.
- FRENCH-ROUGE II (plantain rouge) : le
1er cultivar observé ici est resté au stade VI durant
toutes les 6 semaines et le second au stade II à la 1ere et
2e semaine au stade III à la 3e et 4e
semaine, à la 5e semaine au stade IV et enfin à la
6e semaine au stade V.
- IKPOLO ROUGE : ce cultivar est
resté au stade I durant les deux 1ere semaine, à la
3e semaine il est monté au stade II, à la
4e et 5e semaine, stade III et enfin à la
6e semaine au stade IV.
- LIBANGA LYA BOEA BOKOY : le
1er cultivar (du 1er rang) est resté au stade I
pendant la 1ere, 2e, 3e semaine et à la
4e et 5e semaine au stade II, enfin, à la
6e semaine au stade III. Le second lui est au stade I durant 6
semaines donc c'est un cas de résistance.
- LINGU : le cultivar observé ici
est resté au stade II durant les 3 premières semaines, à
la 4e et 5e semaine au stade III, enfin à la
6e semaine au stade IV.
- LOKUSU : Parmi les 2 cultivars
observés, le 1er a débuté au stade I la
1er semaine ; la 2e, 3e et 4e
semaine au stade II, la 5e et 6e semaine au stade III et
IV respectivement. Le second est resté au stade durant les 2
premières semaines. A la 3e, 4e, et 5e
semaine il est monté au stade II et à la 6e semaine au
stade III.
- MAGOMA : l'unique cultivar observé
dans ce groupe, il a été au stade III à la 1ere
semaine, au stade IV à la 2e semaine, stade V à la
3e et 4e semaine puis enfin au stade VI à la
5e et 6e semaine.
- MBOUROUKOU : avec ses deux individus
malades, le premier a été au stade III à la
1ere semaine. Au stade IV à la 2e semaine,
à la 3e et 4e semaine au stade V. pour terminer
à la 5e et 6e semaine au stade VI. Le
2e lui a débité les 2 premières semaines au
stade V et toutes les autres au stade VI (3e, 4e,
5e et 6e semaines).
- NGUKU : deux individus. Le 1er
au stade II à la 1ere semaine, puis la 2e,
3e semaine au stade III. A la 4e, 5e et
6e semaine il est monté au stade IV. Les 2e a
débuté au stade VI et est resté à ce stade toutes
les 6 semaines.
L'évolution de l'indice de la cercosporiose de bananier
a aussi été démontrée en termes de moyenne. Nous
avons procédé à la moyenne générale et
à la moyenne de variable observé selon le degré de
générescence, ainsi nous avons regroupé les cultivars en
deux catégories :
ü Les Faux et Vraies cornes
ü Les French (French corne)
Tableau 8 : Evolution de l'indice de la cercosporiose sur
les feuilles de bananiers plantains (musa AAB)
|
Evolution de l'indice (moyenne/semaine)
|
|
Semaine
|
|
No.
|
Cultivars
|
Nbre de % /groupe
|
1
|
2
|
3
|
4
|
5
|
6
|
  total/Sem total/Sem
|
|
1
|
ADILI
|
80 %
|
2,5
|
3
|
3,5
|
4
|
5
|
5,5
|
3,9
|
|
2
|
ALEKE
|
20 %
|
1
|
2
|
2
|
2
|
3
|
3
|
2,1
|
|
3
|
AMAGABA
|
20 %
|
4
|
4
|
5
|
5
|
6
|
6
|
5
|
|
4
|
AMUNGU
|
20 %
|
1
|
2
|
2
|
3
|
3
|
4
|
2,5
|
|
5
|
APOKA MAGBUKE
|
60 %
|
2,5
|
3
|
3,5
|
4
|
5
|
5,5
|
3,9
|
|
6
|
BOGO
|
100 %
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
|
7
|
BOLOMAISE
|
40 %
|
2,5
|
3
|
3
|
4
|
4,5
|
4,5
|
3,5
|
|
8
|
BOOFO NOIR
|
40 %
|
1
|
1,5
|
2,5
|
2,5
|
3
|
3,5
|
2,3
|
|
9
|
BOSAKARAKA
|
40 %
|
4
|
4
|
4
|
4,5
|
5,5
|
6
|
4,6
|
|
10
|
EGBE O MABESE
|
20 %
|
3
|
3
|
4
|
4
|
5
|
5
|
4
|
|
11
|
FRENCH ROUGE
|
40 %
|
4
|
4
|
4,5
|
4,5
|
5
|
5,5
|
4,5
|
|
12
|
IKPOLO ROUGE
|
20 %
|
1
|
1
|
2
|
3
|
3
|
4
|
2,3
|
|
13
|
LIBANGA LYA BOEA BOKOY
|
40 %
|
1
|
1
|
1
|
1,5
|
1,5
|
2
|
1,3
|
|
14
|
LINGU
|
20 %
|
2
|
2
|
2
|
3
|
3
|
4
|
2,6
|
|
15
|
LOKUSU II
|
40 %
|
1
|
1,5
|
2
|
2
|
2,5
|
3,5
|
2,5
|
|
16
|
MAGOMA II
|
20 %
|
3
|
4
|
5
|
5
|
6
|
6
|
4,8
|
|
17
|
MBOUROUKU VERT
|
40 %
|
4
|
4,5
|
5,5
|
5,5
|
6
|
6
|
5,2
|
|
18
|
NGUKU
|
40 %
|
4
|
4,5
|
4,5
|
5
|
5
|
5
|
4,7
|
|
TOTAL
|
|
42,5
|
49
|
57
|
63,5
|
73
|
80
|
60,7
|
Au niveau du tableau 8 ci-dessus, nous observons qu'il y'a une
répétition de pourcentage au niveau des cultivars, une moyenne
supérieure équivalente à 5,2 ; ainsi qu'une moyenne
inferieure, équivalente à 1 dans l'ensemble de cultivars
observés.
L'évolution de l'indice de la cercosporiose et sa
caractérisation selon le type d'inflorescence des cultivars sont
représentés dans les tableaux 9 et 10 ci-dessous.
Tableau 9 : Evolution de l'indice de la cercosporiose et
caractérisation selon le type d'inflorescence de la catégorie
vraie et faux corne
|
Evolution de l'indice (moyenne/semaine)
|
|
Semaine
|
|
No.
|
Cultivars
|
Type d'inflorescence
|
1
|
2
|
3
|
4
|
5
|
6
|
  total/Sem total/Sem
|
|
1
|
APOKA MAGBOUKE
|
faux corne
|
2,5
|
3
|
3,5
|
4
|
5
|
5,5
|
3,9
|
|
2
|
EGBE O MABESE
|
Faux corne
|
3
|
3
|
4
|
4
|
5
|
5
|
4
|
|
3
|
IKPOLO ROUGE
|
Vraie corne
|
1
|
1
|
2
|
3
|
3
|
4
|
2,3
|
|
4
|
LINGU
|
Faux corne
|
2
|
2
|
2
|
3
|
3
|
4
|
2,6
|
|
5
|
LOKUSU
|
Vraie corne
|
1
|
1,5
|
2
|
2
|
2,5
|
3,5
|
2,5
|
|
6
|
MAGOMA II
|
Faux corne
|
3
|
4
|
5
|
5
|
6
|
6
|
4,8
|
|
7
|
MBOUROUKU
|
Faux corne
|
4
|
4,5
|
5,5
|
5,5
|
6
|
6
|
5,2
|
|
Total
|
16,5
|
19
|
24
|
26,5
|
30
|
34
|
25,3
|
L'évolution de l'indice du niveau de dégât
moyen chez les Vraies et Faux corne représenté dans le tableau 9
ci-dessus montre que MBOUROUKU a un niveau plus élevé que tous
les autres soit 5,2 comme niveau de dégât. Suivi de MAGOMA II avec
4,8 ; EGBE O MABESE avec 4 ; APOKA MAGBUKE avec 3,9 ; LINGU avec
2,6 ; IKPOLO ROUGE avec 2,3 ; et enfin LOKUSU avec 2,8.
Tableau 10 : Evolution de l'indice de la cercosporiose et
caractérisation selon le type d'inflorescence de la catégorie
french (corne)
|
Evolution de l'indice (moyenne/semaine)
|
|
Semaine
|
|
No.
|
Cultivars
|
Type d'inflorescence
|
1
|
2
|
3
|
4
|
5
|
6
|
  total/Sem total/Sem
|
|
1
|
ADILI
|
French
|
2,5
|
3
|
3,5
|
4
|
5
|
5,5
|
3,9
|
|
2
|
ALEKE MOMBINGENE
|
French
|
1
|
2
|
2
|
2
|
3
|
3
|
2,1
|
|
3
|
AMAGABA
|
French
|
4
|
4
|
5
|
5
|
6
|
6
|
5
|
|
4
|
AMUNGU
|
French
|
1
|
2
|
2
|
3
|
3
|
4
|
2,5
|
|
5
|
BOGO
|
French
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
|
6
|
BOLOMAISE
|
French
|
2,5
|
3
|
3
|
4
|
4,5
|
4,5
|
3,5
|
|
7
|
BOOFO NOIR
|
French
|
1
|
1,5
|
2,5
|
2,5
|
3
|
3,5
|
2,3
|
|
8
|
BOSAKARAKA
|
French
|
4
|
4
|
4
|
4,5
|
5,5
|
6
|
4,6
|
|
9
|
FRENCH ROUGE
|
French
|
4
|
4
|
4,5
|
4,5
|
5
|
5,5
|
4,5
|
|
10
|
LIBANGA LYA BOEA BOKOY
|
French
|
1
|
1
|
1
|
1,5
|
1,5
|
2
|
1,3
|
|
11
|
NGUKU
|
French
|
4
|
4,5
|
4,5
|
5
|
5
|
5
|
4,7
|
|
Total
|
26
|
30
|
33
|
39
|
42,5
|
47
|
35,4
|
L'évolution de l'indice de dégât moyen
représenté dans le tableau 10 ci-dessus chez les french (corne)
montre que : AMAGABA a une moyenne plus élevé que tous les
autres. Soit 5 comme niveau de dégât moyen par semaine. BOSAKARAKA
a une moyenne de 4,6 par semaine suivi de NGUKU et FRENCH ROUGE qui ont une
moyenne de 4,5 ; ADILI avec une moyenne de 3,9 par semaine, BOLOMAISE avec
une moyenne de 3,5 ; AMUNGU a une moyenne de 2,5 ; BOOFO NOIR a une
moyenne de 2,3 ; ALEKE et MOMBINGENE avec une moyenne de 2,1 ;
LIBANGA LYA BOEA BOKOY avec une moyenne de 1,3.
L'évolution selon la dispersion de la maladie de musa
observés sur chaque cultivars nous donne une bonne image de la
dispersion des symptômes de la maladie causé par
Mycosphaerella, observé sur tout les bananiers. Celle-ci est
représentée dans le tableau 11 ci-dessous qui nous en donne les
détails.
Tableau 11 : Evolution selon l'indice de dispersion des
symptômes observés sur tous les bananiers plantains
étudiés par rapport a la propagation de Mycosphaerella spp
sur la population de Musa AAB étudiée.
|
Modalité
|
Effectif (nc)
|
|
|
|
1
|
3
|
0,085
|
0,0072
|
|
2
|
2
|
0,057
|
0,0032
|
|
3
|
2
|
0,057
|
0,0032
|
|
4
|
1
|
0,028
|
0,0007
|
|
5
|
2
|
0,057
|
0,0032
|
|
6
|
1
|
0,028
|
0,0007
|
|
7
|
2
|
0,057
|
0,0032
|
|
8
|
4
|
0,114
|
0,0129
|
|
9
|
2
|
0,057
|
0,0032
|
|
10
|
2
|
0,057
|
0,0032
|
|
11
|
1
|
0,028
|
0,0007
|
|
12
|
1
|
0,028
|
0,0007
|
|
13
|
1
|
0,028
|
0,0007
|
|
14
|
2
|
0,057
|
0,0032
|
|
15
|
1
|
0,028
|
0,0007
|
|
16
|
2
|
0,057
|
0,0032
|
|
17
|
5
|
0,142
|
0,0201
|
|
18
|
1
|
0,028
|
0,0007
|
|
n=
|
35
|
|
|
n= nombre d'individus
L'indice de dispersion (ID)= 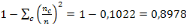 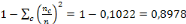
L'indice de dispersion total de la maladie montre qu'il y'a une
nette homogénéité de la distribution de la maladie par
rapport à son évolution moyenne. En outre, la valeur étant
très élevé, soit 0,8978,
l'hétérogénéité de la progression est
très forte. Ce constat là s'observe également au niveau de
catégorie Vraie et Faux corne ainsi que French (corne).
L'évolution selon le type de
dégénérescence florale sont représenté dans
les tableaux 12 et 13 qui suivent ;
Tableau 12 : Evolution de l'indice de dispersion de la
maladie selon la caractéristique de l'inflorescence du type vraie et
faux corne.
|
Modalité
|
Effectif (nc)
|
|
|
|
1
|
3
|
0,272
|
0,0739
|
|
2
|
1
|
0,090
|
0,0081
|
|
3
|
1
|
0,090
|
0,0081
|
|
4
|
1
|
0,090
|
0,0081
|
|
5
|
2
|
0,118
|
0,0139
|
|
6
|
1
|
0,090
|
0,0081
|
|
7
|
2
|
0,118
|
0,0139
|
|
n=
|
11
|
|
|
n= nombre d'individus
L'indice de dispersion (ID)= 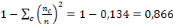 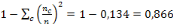
L'indice de dispersion partiel de la maladie montre aussi qu'il
y'a une nette homogénéité de la distribution de la maladie
par rapport à son évolution moyenne selon la
caractéristique de l'inflorescence du type vraie et faux corne. Sa
valeur réelle de l'indice de dispersion est de 0,866 ce qui confirme
presque l'observation faite dans la totalité d'indice de
symptômes.
Tableau : Evolution de l'indice de dispersion de la
maladie selon la caractéristique de l'inflorescence du type french
(corne)
|
Modalité
|
Effectif (nc)
|
|
|
|
1
|
4
|
0,166
|
0,0275
|
|
2
|
1
|
0,041
|
0,0016
|
|
3
|
1
|
0,041
|
0,0016
|
|
4
|
1
|
0,041
|
0,0016
|
|
5
|
5
|
0,208
|
0,0432
|
|
6
|
2
|
0,083
|
0,0068
|
|
7
|
2
|
0,083
|
0,0068
|
|
8
|
2
|
0,083
|
0,0068
|
|
9
|
2
|
0,083
|
0,0068
|
|
10
|
2
|
0,083
|
0,0068
|
|
11
|
2
|
0,083
|
0,0068
|
|
n=
|
24
|
|
|
n= nombre d'individus
L'indice de dispersion (ID)= 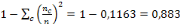 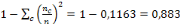
L'indice de dispersion de la maladie observé à se
niveau montre encore qu'il y'a une nette homogénéité de la
distribution de la maladie par rapport à son évolution moyenne
selon la caractéristique de l'inflorescence du type french (corne). Sa
valeur réelle de l'indice de dispersion est de 0,883 celle-ci envoisine
presque l'observation faite dans la totalité d'indice de
symptômes.
III.2. DISCUSSION
Au niveau de dégât par semaine, sur 90 cultivars
observés au total, 35 parmi eux ont été
diagnostiqués malades soit 38,8% des malades et 61,2% des cultivars non
malades. Ce qui représente 55 des cultivars sains ;
L'évolution de l'indice à démontré
que BOGO a représenté un taux d'effectif maximale de 100%
d'individus du groupe mais ceux-ci ont été très
résistant à la maladie ce qui correspond à un niveau
d'indice moyen évolutif de 1 par semaine, ADILI a
représenté 80% de son cultivars soit 3,9 comme niveau moyen par
semaine. Chez APOKA MABUKE on a retrouvé 60% d'individus malades. NGUKU,
BOOFO NOIR, BOSAKARAKA II, LOKUSU II, BOLOMAISE, LIBANGA LYA BOEA BOKOY,
MBOUROUKU VERT ont eu à leur sein 40% d'individus malades chacun
correspondant au niveau moyen par semaine de 4,5 pour NGUKU, 2,3 pour BOOFO
NOIR, 4,6 pour BOSAKARAKA II, 2,0 pour LOKUSU II, 3,5 pour BOLOMAISE, 1,3 pour
LIBANGA LYA BOEA BOKOY, 5,2 pour MBOUROUKU VERT contre 7 groupes qui ont eu
à leur sein 20% d'individus malades par rapport à leur effectif
des groupes. Il s'agit de : ALEKE avec une moyenne de 2,1 par semaine
comme indice du niveau du dégât, AMUNGU avec une moyenne de 2,5
par semaine, AMAGABA avec comme moyenne de 5 par semaine, FRENCH-ROUGE avec une
moyenne de 4,5 par semaine, EGBE O MABESE avec une moyenne de 4 par semaine,
LINGU avec une moyenne de 2,8 par semaine, IKPOLO ROUGE avec une moyenne de 2,3
par semaine, MAGOMA II avec une moyenne de 4,8 par semaine.
L'indice de dispersion total de la maladie montre qu'il y'a une
nette homogénéité de la distribution de la maladie par
rapport à son évolution moyenne. En outre, la valeur étant
très élevé, soit 0,8978,
l'hétérogénéité de la progression est
très forte. Ce constat là s'observe également au niveau de
catégorie Vraie et Faux corne ainsi que French (corne).
Les individus malades représentent 68,5% chez les french
ce qui correspond à 24 individus par rapport à l'effectif total
des malades équivalent à 35. Et chez les Vraies et Faux cornes,
ils représentent 31,4% correspondant à 11 individus malades.
Les individus malades représentent 26,6% de l'effectif
total chez les French corne en se basant sur l'effectif global des cultivars
correspondant à 90 individus et 12,2% de l'effectif des Vraies et Faux
cornes.
Chapitre IV : CONCLUSION ET SUGGESTION
Après cette étude, on vient de se rendre compte que
les Mycosphaerella spp existent bel et bien à Kisangani et il
attaque les bananiers plantains. Le Mycosphaerella est un danger
permanent pour les bananiers plantains. Le résultat obtenu dans ce
travail, correspondant à 38%, constitue le ¼ de la population
totale considérée. En tenant compte de
l'hétérogénéité des individus, la
distribution aléatoire et isolé de la maladie prouve son
évolution à longue échelle. Elle mérite ainsi une
attention particulière. Comme nous venons de l'illustré dans ce
travail. Son degré de virulence, minime soit-il, n'est pas à
négliger car il peut se propager à une très grande
échelle et infecter toute une grande population des bananiers plantains
de la région.
D'où, nous suggérons que l'on envisage d'avance des
méthodes de luttes contre cette épidémie, entre autre
l'utilisation des fongicides (DEBERDT P et al 2008). Une lutte
raisonnée sur avertissement, des souches pathogènes est la
solution la plus approprié à court et à long terme, elle
est certainement la meilleur, car elle permet aux personnes avisées et
expérimentées à la matière de lutter efficacement
contre cette pathologie, en identifiant, les espèces
génétiquement résistantes. C'est pourquoi nous devons
envisager des études régulières sur cette phytopathologie
pour son contrôle permanent.
BIBLIOGRAPHIE
ABADI C., EL HADRAMI A. et CARLIER J., 2001a. Banana partial
resistance against mycosphaerella fijiensis: studies of efficiency and
durability. In symposium on durable disease resistance, Wageningen, Netherland,
November 2001.43p
www.ecogest.ch
ABADI C., EL HADRAMI A., RIVACE G., ZAPATER M.F., et CARLIER J.,
2001b. Studies of mycosphaerella fijiensis population structure and
partial resistance of bananas. INFOMUSA 10/1: 14-15.
www.cgiar.org
ABADI C., ZAPATER M.F., PIGNOLET L., CARLIER J., MOURICHON X.,
2008. Inoculation artificiel sur plants et tissus des feuilles des bananiers
avec mycosphaerella spp responsable de la maladie de Sigatoka, fruit,
65/5 : 319-323.
ARZANLOU M., GOENEWALD J.Z., FULLERTON R.A., ABELNE E.C.A.,
CARLIER J., ZAPATER M.C., BUDDENHAGEN I.W., VILJOEN A., CROUS P.W. 2008.
Multiple gene genealogies and phenotypic characters differentiate several novel
species of mycosphaerella and related anamorphes on banana. Persoonia 20:
19-37
ADHEKA G, J., 2007. Etude de l'effet de la micro
décapitation sur la prolifération In vitro des bourgeons
chez 3 cultivars des bananiers et bananiers plantains (Musa
AAB) à Kisangani. Mémoire inédit, Faculté des
Sciences, UNIKIS. 69p
AMUNDALA, Y., 2006. Contribution à la recherche des
cultivars des bananiers et bananiers plantains (Musa spp)
résistant aux charançons du bananier. Mémoire
inédit, faculté des sciences, UNIKIS. 39p
BALINIE ELSA, MOREL J.B., DROC G., PRICE A.H., COURTOIS B.,
NOTTEGHEN G.L., THARRAU D., 2008. A genome-wide meta-analyses of rise blast
resistance genes and quantitative lociprovide new insights into partial
complete resistance. Molecular plant- microbe interaction, 21/7: 859-868
www.lavoisier.fr
BLANC M., UZEST M., CANDRESSE T., DRUCKER M., FERERES A., GARGANI
D., GARZO E., HEBRAD E., 2008. Une protéine clé pour la
transmission d'un virus des plantes à la pointe des stylets de l'insecte
vecteur. Virologie 12/1 : 70-72
BODJO S.C., LELENTA., COUACY-HYMANN E., KWIATEK O., ALBINA E.,
GARGANI D., LIBAU G., DIALLO A., 2008. Mapping the pest des petits ruminants
virus nucleoprotein: identification of two domains involve in protein self
association. Virus search, 131/1: 23-32
www.le-robillard.fr,
www.agravis.com
CARLIER J., MOURICHON X., GONZALES de LEON D., ZAPATER M.F., et
LEBRUN M.H., 1994. DNA restriction fragment length polymorphisms in
mycosphaerella species causing banana liefspot disease. Phytopathology
84: 751-756p
CARLIER J., MOURICHON X., et JONES DR., 2000. Black leaf streak.
The causal agent. CABI publishing Wallingford, UK, 46-56p
CARLIER J., WAELE D. et ESCALANT., 2003. Evolution globale de la
résistance des bananiers à la fusariose, aux maladies foliaire
causées par le mycosphaerella spp et aux nématodes, IPGRI
(interantional plant genetic resource institute). INIBAP fiche technique
N°6.
www.ulaval.ca
CHAMPION, J., 1960. Indications préliminaires à la
croissance du bananier (POYO). Fruit, 16 :191-194.
www.ac.be,
www.inibap.org
CHAMPION, J., 1963. Le bananier. Maison neuve et Laros, Paris
263p
CIRAD, 2001. Les usages multiples du bananier. Centre de
coopération international en recherche agronomique pour le
développement.
www.cirad.org,
www.musalit.inibap.org
CIRAD-GRET, 2002. Mémento d'agronomie, centre de
coopération international en recherche et échange technologique
(GRET), imprimé en France Jouve, 11Bd de Sébastopol,
dépôt légal Décembre 2002, 191p
CRUZ P et MOURICHON X., 2002. Mycosphaerella eumusae and its
anamorph pseudocercospora eumusae spp. Causal agent of eumusae
leaf spot disease of banana in mycosphaerella leaf spot disease of bananas:
present status and outlook INIBAP 2003.
DABEK A.J., et WALLER J.M., 1990. Black leaf streak new banana
diseases in East Africa. Tropical pest management 36/2: 157-158
DALMON A., HALKETT F., GRANIER M., DELATTE H., PETERSCHMITT M.,
2008. Genetic structure of the invasive pest Bemisia tabaci:
evidence of limited but persistent genetic differentiation in glass house
populations. Heredity, 100/1: 316-325
DEBERDT P., MFEGUE C.V., TONDJE P.R., BON M.C., DUCAMP M., HURARD
C., BEGOUDE D., NDOUMBE NKENG M., HEBBAR P.K., CILAS C., 2008. Impact of
environnement chemical fungicide and biological control on cacao pod production
dynamics and black pod disease (phytophthora megakarya) in Cameroun. Biological
control, 44/2: 149-159
DE LANGHE, E., 1961a. La taxonomie du bananier en Afrique
équatorial, journal d'agriculture tropical et de botanique
appliqué, N°1-11 :417-449
www.futur-science.com
DE LANGHE, E., 1961b. Multiplication végétative
accéléré en plantation des bananiers plantains
« BOSUA » bulletin d'information de l'INEAC : 70-87
DHED'A D.B., DUMORTIER F., PANIS B., VUYLSTEK et DE LANGHE E.,
1991. Plant regeneration in cell suspension cultures of cooking banana CV.
Bluggoe (Musa spp. ABB groupe) fruit. 46 : 125-135
www.biodiv.org,
www.vib.be,
www.biodeveloppements.org,
www.swiftt.cornell.edu
FACON B., RAVIGNE V., GOUDET J., 2008. Gender-role alternation in
the simultaneously hermaphroditque French water snail physa acuta not
with the same partner. Behavioural ecology and sociabiology 62/5: 713-720
FRISON E. E., et SHARROCK. J., 1998. The economic, social and
nutritional importance of banana in the world. In: INIBAP, 1998. Bananas and
food security: 21-35p
FROSSARD P., 1981. Apparition d'une grave maladie foliaire des
bananiers et plantains au Gabon : la maladie de raies noires,
mycosphaerella fijensis morelet. Fruit 35 : 443-453
www.bayerhealthcar.com
JACOME L., LEPOIVRE D., MARTIN D.,ORTIZ R.,ROMERO et
ESCALANT J.V,2003.Mycospaerella leaf spot disease of banana : present
status and outlook. Proceedings of the 2nd international workshop on
Mycosphaerella leaf spot diseases held in San Jose Costa Rica, 20-23-Mai 2002,
IPGRI 318p
GAYRAL P., NOA-CARRAZANA J.C., LESCOT M., LHEUREUX F., LOCKHARD
B.E.L., MATSUMOTO T., PIFFANELLI P., ISKRA CARUANA M.L., 2008. A single banana
streak virus integration event in the banana genome as the origin of infectious
indogenious pararetrovirus. Journal of virology, 82/13: 6697-6710
INIBAP, 2001. Annual rapport 2001. International network for
improvement of banana and banana plantain, Montpelier, France. 42p
ISKRA CARUANA M.L., GALZI S., LABOUREAU N.,2008. A reliable IC
one step RT-PCR method for the detection of BBrMV to ensure safe exchange of
Musa germplasm.
www.genopole.org
JONES D.R., et ALCORN J.L., 1982. Freckle and black sigatoka
diseases of banana in far North Queensland. Australasian plant pathology 11:
7-9
KASONGO K. A., 2005. Etude du taux des multiplications rapides Ex
situ chez 3 cultivars acuminata diploïde, triploïde
et tétraploïde de bananier après décapitation et
utilisation de 6-benzylaminopyrine (BAP) à Kisangani. Mémoire
inédit, Faculté des Sciences, UNIKIS, 39p
KUMBA S., 2008. Gestion de la biodiversité à
l'Université de Kisangani : projet d'introduction du système
agro forestier : cas du village YOKO (Kisangani)
www.blog-city.info
LAMBOU K., THARREAUT D., KOHLER A., SIRVEN C., MARGUERETTAZ M.,
BARBISAN C., SEXTON A.C., KELLNER E.M., MARTIN F. HOWLETT B.J., ORBACHE M.,
LEBRUN M.H.,2008. Fungi have three tetraspanin families with distinct
functions. BMC Genomics 9/63: 200-227
LECHER R., 1941. Banana leaf spot mycosphaerella musicola, the
perfect stage of cercospora musae zimm. Tropical agriculture (Trinidad) 18:
91-95p
LECHER R., 1964. A new form of banana leaf spot in Fiji, black
leaf streak. World crops 16: 64
LEPOIVRE P., 2003. Phytopathologie. Ed. De Boeck
Université, Gembloux. 1-400p
LONG P.G., 1979. Banana black leaf streak diseases
(mycosphaerella fijiensis) in Western Samoa. Transactions of
the British mycological society 72: 299-310
MEREDITH D.S., 1970. Banana leaf spot diseases (sigatoka) cause
par mycosphaerella leach. Phytopathological Paper, N°11, Commonwealth
mycological institute, Kew, surrey, UK. 147p
MOURICHON, X., CARLIER, J et FOURE, E., 1997. Les cercosporioses.
In INIBAP 2001 parasite et ravageur de Musa fiche technique
N°5
MUSOLI C.P., PINARD F., CHARRIER A., KANGIRE A., TEN HOOPEN G.M.,
KABOLE C., OGWANG J., BIEYSSE D., CILAS C., 2008. Special and temporal analyse
of coffee wilt disease caused by Fusarium xylarioides in
coffea canephora. European journal of plant pathology 122/4:
451-460
ONAUTSHU, O.D., 2007. Etude de l'incidence des maladies ravageurs
chez les bananiers (Musa spp) de la région de Kisangani
(R.D.Congo), DEA inédit, Faculté des Sciences, UNIKIS, 92p
PALUKU, M., Etude des taux de multiplication rapide Ex
situ de quelques hybrides tétraploïdes de bananiers sous
l'effet de la double décapitation et des 6-benzilaminopurine à
Kisangani. Mémoire inédit, Faculté des Sciences, UNIKIS.
51p
PADAMANABAN, B et SATHIAMOORTHY, S., 2001. Charançons du
pseudo tronc du bananier Odioporus longicolis in INIBAP 2001.
Parasites et ravageurs de Musa fiche technique N°5
PARNEL M., BURTE P.G.A., et WILSON K., 1998. The influence of
exposure to ultra violet radiation in simulated sunlight on ascospores causing
black sigatoka diseases of banana and plantain. International journal of
biometeorology. 42: 22-27
PAULIN D., DU CAMP., LACHENAUD P., 2008. New source of resistance
to phytophtora megacarya identified in wild cocoa tree
populations of French Guiana crop protection 27/7: 1143-1147
PEREGRINE W.T.H., 1989. Black leaf streak of banana
mycosphaerella fijiensis morelet. FAO plant protection bulletin 37/3: 130
PHILPOTTE ET KNOWLES C.H., 1913. Repport on a visit to sigatoka.
Pamphlet of the department of agriculture, Fiji, 3
RAEMAEKERS R., 1975. Black leaf streak disease in Zambia. Pans
21: 396-400
RHODES P.L., 1964. A new banana disease in Fiji. Commonwealth
phytopathological news. 10: 38-41p
ROSALES, F., 1998. Importance de production locale des bananiers
plantains en Amérique latine et dans le Caraïbe. In INIBAP 2001
Banana and Food Society: 265-284p
SHOOFS, H., 1997. The origin of embryogenic cell in Musa. These,
KU Leven.
SIMMONDS, N, W., 1966. Tropical agriculture series bananas.
Longman groupe limited, London, England, 512p
SIMMONDS, N, W., 1976. Evolution of crop plant: Scottish plant
breeding station pentlandfield Roshin Midlothian, Scotland. Longman:
211-215p
SIMMONDS, N, W., 1987. Classification and breeding of bananas.
Australia: 69-73p
SIMMONDS, N, W and SHEPHERD. K., 1955. Taxonomy and origin of
cultivated bananas. Journal of the lineal society of botanic. 55: 302-312p
SKIREDJ, A., WALALI, D.M et HASSAN EL ATIR., 2005. La culture
sous serre au Maroc (
www.legume-fruit-maroc.com)
STOVER R.N., 1982. Banana plantain and abaca disease,
Commonwealth mycological institute, Kew, England. 70p
STOVER R.N. and SIMMONDS N.W., 1987. Banana 3rd
edition. Longman Scientific and technical, 468p
STOVER R.H., 1980. Sigatoka leaf spots of banana and plantain.
Plant disease
SWENNEN R., 1984. A physiological study of suckering behaviour in
plantain. Faculty of Agriculture, catholic University of Leuven, Belgium.
SWENNEN R. and VUYLESTEKE D., 1991. Banana in Africa: diversity,
uses and prospects for improvement, 34: 151-159.
SWENNEN R. And VUYLESTEKE D., 2001. Agriculture en Afrique
tropical, Bruxelles : 611-636
TEZENAS DU MONTCEL H., SWENNEN R. et DE LANGHE E., 1983. Essai de
classification des bananiers plantains (Musa AAB). Fruit 38/6 : 318-325
THOMAS J.E, MAGNAYE L.U., 1996. La mosaïque des
bractées du bananier. In INIBAP, 2001 Maladie de Musa- fiche technique
N°7
THOMAS, J.E., ISKRA-CARUANA, M.L et JONES, DR., 1994. La maladie
du bunchy top. In INIBAP 2001 Maladie de Musa- fiche technique N°4
ZAPATER M.F., DUCHEMIN M., DUSSART J.F., BROTTIER P., CARLIER J.,
2008. Microsatellite marquers for the fungal banana pathogens, mycosphaerella
fijiensis, mycosphaerella musicola and mycosphaerella eumusae.
www.unesco.com
www.Google.com
www.fao.org
www.oms.org
AUTRES SITES VISITÉES
www.ijpb.versaille.inra.fr
www.chapitre.com
www.wipidepia.org
www.bananas.bioversityinternational.org
www.sciencedev.net
|
|



