INTRODUCTION
L`igname est une plante à racine et tubercule du genre
botanique Dioscorea, répandue dans le monde entier. Il est
considéré comme un aliment significatif dans plus de trente pays
du monde qui regroupent plus de trois cents milliers d'habitants. Ce
tubercule constitue un aliment séculaire tant en Afrique qu'en
Océanie où sa culture et son utilisation font l'objet du
savoir-faire ancestral et souvent rituel (RABIER, 2000). Son
utilisation comme aliment de base en Afrique remonte à plus de cinq
siècles. ceci avant l'introduction aux XVIe et XVIIe siècles du
manioc et du maïs, et les importations plus récentes du riz et du
blé (COURSEY, 1972). Plusieurs espèces d'igname
sont cultivées au Cameroun parmi lesquelles Dioscorea
schimperiana (MEDOUA, 2005).
Dioscorea schimperiana est une
espèce d'igname de longueur variable et caractérisée
par de longs poils sur la peau. Il existe en trois
variétés : jaune, rouge et jaune tachetée de rouge
en fonction de la couleur de la pulpe (FAVIER et BELL, 2005).
Cette pigmentation serait due aux caroténoïdes, provitamines A
contenus dans cette espèce (BIENG, 2005). Au
Cameroun, les troubles dus à la carence en vitamine A, demeure un
problème de santé publique (KOLLO 2000).
L'igname Dioscorea schimperiana de part sa couleur permettrait de
réduire ces carences en vitamines A. Toutefois, sa forte teneur en eau
limite son utilisation de façon permanente. Traditionnellement, le
séchage est la méthode de conservation la plus utilisée.
Toutefois, le séchage accélère l'oxydation des
caroténoïdes entraînant ainsi sa destruction. Le blanchiment
apparaît comme un prétraitement capable de limiter l'oxydation du
en -Carotène par inactivation des oxydases. Le blanchiment à eau
permet en plus une gélatinisation de l'amidon. Ceci peut être
bénéfique pour la réduction des pertes en minéraux
en particulier le -Carotène.Toutefois, l'influence du blanchiment dans
l'inactivation enzymatique où la perte en en -Carotène est en
fonction du temps et de la température. C'est dans cet optique que nous
avons étudié l'influence du blanchiment à 60°C et
à 95°C sur les pertes en -Carotène de deux
variétés d'igname. Ceci s'effectue en fonction du temps. Pour
atteindre notre objectif, nous nous sommes attelés à :
- Blanchir des tranches d'igname ;
- Déterminer la capacité d'absorption en eau et
des pertes en eau de l'igname ;
- Déterminer les pertes en -Carotène dans les
ignames blanchis.
I- GÉNÉRALITÉS SUR LES
IGNAMES
I-1- Définition de l'igname
L'igname est un nom générique s'appliquant
à plusieurs plantes appartenant à une vingtaine d'espèces
du genre Dioscorea, famille des Dioscoreacées. Il est
cultivé dans toutes les régions tropicales du globe dans un but
alimentaire et pour leurs tubercules riches en amidons (Dictionnaire de
l'académie française, 1935).
I-2- Aspect botanique
La situation du genre Dioscorea dans la
systématique botanique réalisée par TRECHE en 1979 est la
suivante :
Ø embranchement des spermaphytes,
Ø sous-embranchement des Angiospermes,
Ø classe des Monocotylédones,
Ø ordre des Dioscoréales,
Ø familles des Dioscoréacées,
Ø genre Dioscorea.
Ce genre est très diversifié avec 650
espèces dont plus d'une centaine comestible crue ou après
détoxification, cuisson rapide ou prolongée (DEGRAS, 1986).
I-3- Les différentes espèces
cultivées
Le genre Dioscorea est très
diversifié. Il compte 600 à 800 espèces dont plus d'une
centaine sont comestibles (DEGRAS, 1986). Le Cameroun compte
dans sa flore la plupart des espèces connues en Afrique tropicale. En se
basant sur la classification de LAWTON en 1967,
et de LYONGA et AYUK-TAKEM en 1978,
on a identifié 63 cultivars qui représentent les neufs
espèces suivantes : D. alata, D. bulbifera, D. cayenensis, D.
dumetorum, D. esculenta, D. liebretsiana, D. rotundata, D. schimpriana.
I-4- Production des Ignames
Les ignames sont une culture importante au plan mondial.
La récolte annuelle est d'environ 40 millions de tonnes sur 4 millions
d'hectares repartis dans 56 Pays. Les principaux pays producteurs sont
situés en Afrique de l'Ouest. Selon les statistiques de la
FAO (2004-2005), le Nigeria détient 67% de la
production mondiale de l'igname en tonnes. Le Cameroun quant à lui a
produit 286 494,00 tonnes d'ignames ce qui représente 1% de la
production mondiale en 2004-2005 (annexe 1).
I.5- Besoins nutritionnels
Selon les recommandations de la FAO sur les besoins
nutritionnels de l'homme, une consommation moyenne de 215g d'igname brute par
personne et par jour peut satisfaire en moyenne 6% des besoins
énergétiques de l'adulte Camerounais, 6% de ses besoins
protéiques, 10% de ses besoins en Calcium, 16% de ses besoins en
Phosphore, 7% de ses besoins en Fer et 12% de ses besoins en Thiamine.
L'annexe 3 présente les apports nutritionnels des
ignames après transformation.
I.6- Généralités sur
l'espèce Dioscorea schimperiana
De la famille des Dioscoréacées, l'espèce
D. schimperiana est aussi appelé "chimpanze yam" à cause
des nombreux poils qui hérissent le tubercule et de la forme en pied de
singe de certaines variétés. Cette espèce est peu
répandue mais très appréciée par certaines tribus
d'Afrique centrale et septentrionale. Elle est connue sous le nom de "nlen" par
les Bamiléké au Cameroun. La couleur de la chair est jaune ou
brunâtre et certaines variétés brunissent vite après
épluchage. Cette igname de texture grossière, présente des
caractéristiques culinaires médiocres et s'effrite souvent lors
de la cuisson (BELL, 1981).

Photographie A: Tubercules d'igname D.
schimperiana (KAMDE 2006)
Comme le décrit WURSTEN en
2007, ces espèces ignames sont les plantes à
tige grimpantes, qui s'enroulent autour d'un support et sont souvent
dioïques. Les feuilles pétiolées, cordiformes sont
alternes.

Photographie B : Plante du
Dioscorea schimperiana prise par HYDE, M.A et
WURSTUN,B ( 2007)
I-7- Composition chimique des Ignames
Dioscorea schimperiana
Chez Dioscorea schimperiana, on trouve aussi bien les
métabolites primaires que secondaires :
Comme métabolite primaire, cette igname contient
pour 100 g de partie comestible : 13,14 g à 17,14 g de
glucides ; 1,8 g de protéines et un taux de lipides
inférieur à 2 % de la matière sèche. Le
Dioscorea schimperiana contient aussi des fibres (0,71
à 1,3 %) des sels minéraux (Ca, P, Fe) et les vitamines
(thiamine, niacine, la riboflavine et le -Carotène qui est une
provitamine A (COURSEY et ALDO, 1996).
Comme métabolite secondaire, les tests
caractéristiques qui ont été mené par
BIENG en 2005 dans le but de contribuer
à l'étude phytochimique de Dioscorea
schimperiana ont révélé que cette igname contient
les composés phénoliques, des stérols, des alcaloïdes
mais de flavonoïdes qui sont des polyphénols doués de
propriétés biologiques très importantes (YAMGA,
2006). BIENG en 2005 a pu isoler
un stérol qui a été identifié comme le stigmata -
5,22-dien-3-sol de formule brute C29H48O.
II. LES CAROTENOÏDES
II.1. Définition, origine et sources
Les caroténoïdes sont, avec la chlorophylle et
les anthocyanes, les pigments naturels de couleur verte, orange, jaune ou
rouge. Ces caroténoïdes constituent le groupe le plus rependu parmi
tous les pigments naturels et sont responsables des couleurs
appétissantes de nombreux fruits et légumes (DONALD et
MARTIN, 2002). A ce jour, plus de 600 caroténoïdes ont
été identifiés, mais seulement une quarantaine est
retrouvée régulièrement dans l'alimentation humaine. Une
trentaine de ces caroténoïdes et leur métabolites a
été identifiée dans le plasma et les tissus humains, mais
6 pigments parmi eux sont majoritaires : le carotène, le
lycopène, la lutéine, la â-cryptoxanthine,
l'á-caroténe et la zéaxanthine (ROCK,
2003). Seuls les végétaux et les microorganismes sont
capables de synthétiser les caroténoïdes. Ils s'accumulent
dans les chloroplastes et les tissus photosynthétiques. Les
caroténoïdes provitamine A sont présent dans les
légumes, feuilles verts foncés ;les fruits de couleur
jaune,orange et rouge ; les racines de couleur jaune et orange ;
et l'huile de palme (ABOUNDA, 2005).
II.2. Structure et propriétés
physico-chimiques
Les caroténoïdes provitamines A
sont classés en deux groupes :
- Les caroténoïdes formés d'une
chaîne hydrocarbonée comportant plusieurs doubles liaisons qui
leur confère une coloration pouvant aller du jaune au rouge.
- Les xanthophylles qui sont des pigments dérivant des
carotènes par oxydation et ont des groupements hydroxyles sur le cycle
(WELLE et al; 1998).
Les caroténoïdes sont généralement
caractérisés par huit unités isopréniques se
répétant par endroit de façon systématique par
rapport au centre de la molécule et des radicaux méthyles
(IVACG, 1987). Ils possèdent un système de
doubles liaisons conjuguées. Ce système est responsable non
seulement de la couleur des caroténoïdes qui varie du jaune au
rouge foncé, mais aussi responsable de leur stabilité à
l'oxydation (BIENG, 2005). Les caroténoïdes sont
des provitamines A qui contiennent au moins un noyau de type â-ionone
(SIMPSON et al; 1987). Les plantes renferment trois
isomères à savoir á, â, et
ã-carotènes. La figure 1 donne les structures de
quelques caroténoïdes courantes.
Carotène
Carotène
Criptoxanthine
Canthaxanthine
Lutéine
Lycopène
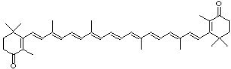
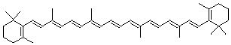
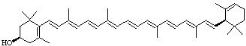
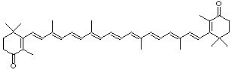
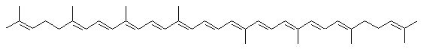
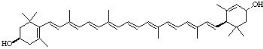
Figure I : Structure de quelques
caroténoïdes rencontrés dans les tissus humains et certains
végétaux.
L'absorption des caroténoïdes dans l'ultraviolet
et le visible est utilisée pour leur identification. Les pigments
naturels sont en général des isomères trans. Cependant on
peut trouver les formes naturelles mono-cis et poly-cis. Ils sont non polaires
et hydrophobes, pratiquement insolubles dans l'eau et solubles dans les
solvants organiques et les lipides.
II.3. Propriétés biologiques et effets
santé des caroténoïdes.
Outre leur fonction de provitamine A, les
caroténoïdes possèdent des propriétés
antioxydants et antiradicalaires qui réduisent les risques de cancer, de
maladies cardiovasculaires, cataracte, maladies du système nerveux
central ou déficiences immunitaire (SIMPSON et al;
1987 ; CHALCHAT, 1997 ; BIENG, 2005). Ces
caroténoïdes font de même partie des micronutriments qui
participent aux défenses de l'organisme contre les espèces
oxygénées réactives. Ce sont essentiellement des
piégeurs de l'oxygène singulet, mais peuvent également
neutraliser des radicaux libres. Le piégeur d'oxygène singulet le
plus efficace est le lycopène (plus du double de l'activité du
â-carotène) suivi successivement par le ã-carotène,
l'astaxanthine, la canthaxantine, l'á-carotène, le
â-carotène, la zéaxanthine,la lutéine et la
â-cryptoxanthine (cinq fois moins active que le lycopène). Au
niveau cellulaire, la lutéine est le caroténoïde qui
protège le mieux de la péroxydation lipidique suivie du
lycopène et de la canthaxanthine, l'á-carotène et le
â-carotène étant les moins actifs
(ROCK,2003). D'après BRUNETON,
1993, les caroténoïdes servent de colorants
naturels non toxiques dans les industries agroalimentaires. Ils peuvent aussi
intervenir sous la forme de provitamine A dans la formation du pourpre
rétinien, la reproduction, la résistance de l'organisme aux
infections et la croissance des tissus (LAREN, 2002).
III. LE BLANCHIMENT
III.1. Définition
Le blanchiment est un traitement thermique consistant
à exposer le produit à la chaleur, souvent par immersion dans
l'eau entre 60-100° C ou dans la vapeur d'eau à 100° C
(ENCARTA ENCYCLOPEDIA, 2001). D'après
CHEFTEL et al; en 1983, la durée du
traitement varie en fonction de la technique employée, la nature
du produit, la grosseur ou encore l'état de maturité. Le
blanchiment est une méthode de prétraitement avant le processus
de lyophilisation, d'appertissage, de séchage et de surgélation.
Il existe plusieurs modalités de blanchiments : le blanchiment
à la chaleur sèche par génération interne de la
chaleur grâce aux radiations électromagnétiques
(micro-ondes) et le blanchiment par la chaleur humide (utilisation de la vapeur
d'eau ou de l'eau liquide comme vecteur de chaleur (ESSIBEN,
2005).
L'igname Dioscorea schimperiana se conserve
de préférence sous forme sèche. Toutefois, le
séchage accélère l'oxydation des caroténoïdes
entraînant ainsi sa destruction. Le blanchiment apparaît comme un
prétraitement capable de limiter l'oxydation du
-Carotène.
III.2.Interêt du blanchiment
Un traitement thermique d'un aliment avec
une température haute et de brève durée permet
d'accélérer la réaction de destruction des
bactéries et des enzymes en respectant d'avantage les vitamines
thermolabiles et en évitant la surcuisson du produit. C'est donc ainsi
que le blanchiment élimine les enzymes et microorganismes
(ESSIBEN, 2005). Le blanchiment à l'eau chaude
gélatinise l'amidon ou l'hydrolyse partiellement. Cette hydrolyse de
l'amidon perméabilise la membrane cellulaire facilitant ainsi la sortie
d'eau de la cellule. Cependant la gélatinisation se fait par formation
de liaisons de faible énergie entre les molécules hydrophiles de
la suspension de l'amidon et celle de l'eau. Ainsi, les molécules libres
de l'eau deviennent faiblement liées, ce qui diminue leur
capacité d'évaporation. La rétention d'eau lors de la
gélatinisation conduit cependant à un produit plus volumineux et
plus hydratés avec une bonne conductivité de la chaleur
d'où le blanchiment dénommé prétraitement à
la déshydratation (CHEFTEL et al; 1983).
III.3. Effet du blanchiment sur les
caroténoïdes
Les caroténoïdes sont localisés à
l'intérieur des membranes internes des chloroplastes qui sont elles
entourées d'une double membrane (ENCARTA ENCYCLOPEDIA, 2001).
Ces caroténoïdes sont liposolubles, peu sensible à
la chaleur, mais sensibles à l'oxydation enzymatique, chimique et
photochimiques (CHEFTEL et al; 1983). Ils sont assez
stables et peu affectés par les traitements thermiques
modérés lorsqu'ils sont tenus éloignés des enzymes
oxydases. Par contre, si l'intégrité cellulaire est compromise et
la membrane perméabilisée par épluchage, triburation ou
découpage, ils deviennent accessibles et vulnérables. Ils sont
d'autant plus détruit que les traitements sont sévères et
que leur concentration est élevée (CHEFTEL et
al; 1983) cité par ESSIBEN en 2005. Du
fait de la présence de nombreuses insaturations, la chaleur peut induire
les changements de conformation et activer d'autres réactions. Les
isomères trans majoritairement dans les aliments, pourraient alors
devenir cis à des proportions égales à la
sévérité du traitement comme dans l'équation
ci-dessous (CASTERMILLER et WEST, 1998) : Figure
II
I. MATERIEL
I.1. Matériel biologique
Le matériel biologique est constitué de
tubercules de Dioscorea schimperiana, variété à
chair jaune et à chair jaune tachetée de rouge.

Variété Jaune
Variété Jaune Tachetée rrrrrrrrrouge rouge
Photographie C : Coupe de
différentes variétés de D. Schimperiana
I.2 Matériel et appareillage de laboratoire.
I.2.1 Appareillage.
- Balance BB-11550/capacity 1550 g; d=0, 05
- Etuve Binder 14-D78532
- Spectrophotomètre uv/VISHEëIOS
- Agitateur magnétique
- Réfrigérant
- Centrifugeuse
I.2.2 Matériel de laboratoire
- Mortier et pilon
- Papier filtre watman n°4
- Entonnoir
- Pince en bois
- Spatule
- Colonne en verre de diamètre 2.5 cm et 100cm de
hauteur
- Eprouvettes de 100ml
- Becher de 80ml et de 250ml
- Flacons opaques de 10ml
I.3 Réactifs.
- Acétone pure
- Ethanol 95°
- Hexane 65-70°
- Sulfate de sodium anhydre
- Silice pour chromatographie sur colonne (70-230Mesh).
- Eau distillée
I.4 Solutions préparées
- Solvant d'extraction du â-carotène :
Hexane-Ethanol (1 :1, v/v)
- Solvant d'élution des caroténoïdes :
Hexane-Acetone (9 :1 ,v/v)
II. METHODES
II.1 Choix de l'échantillon.
Les échantillons sont récoltés dans les
plantations de Fotouni dans le département du Haut-nkam, province de
l'Ouest Cameroun en février 2006. Ils sont transportés dans des
corbeilles au laboratoire de biochimie de l'université de Douala
où ils sont conservés à même le sol et à
température ambiante jusqu'à l'utilisation.
II.2 Conditionnement des échantillons
II.2.1 Le tranchage des échantillons
Les différentes variétés de D.
Schimperiana sont lavées à l'eau du robinet,
épluchées à l'aide d'un couteau en acier inoxydable et
découpées en cylindre de 3 centimètres de
diamètre. Le diamètre exact est vérifié à
l'aide d'un pied à coulisse. Les tubes ainsi formés sont tranches
en rondelles de 3 millimètres d'épaisseur à l'aide d'un
couteau.
II.2.2 Le blanchiment
Le blanchiment est fait dans de l'eau désionisée
aux températures de 60°C ET 95°C pendant 20, 30, 45, 55,60 S.
Le rapport eau/tranches est d'un litre pour deux tranches. Les tranches,
sélectionnées au hasard, par paire et en fonction de la
variété, sont trempées pendant quelques secondes,
lavées à l'eau déminéralisée puis
humectées à l'aide d'un papier absorbant. Elles sont ensuite
plongées dans de l'eau chauffée à 60° C ou à
95° C Après chaque temps de blanchiment, les tranches sont
rapidement refroidies dans l'eau froide et l'eau de surface absorbée
à l'aide d'un papier absorbant. Les tranches blanchies ainsi obtenues
sont utilisées pour les différentes analyses
physico-chimiques.
II.3 Analyses Physico-Chimiques
II.3.1 Capacité d'absorption d'eau
Principe
Il est basé sur la différence de masse entre les
échantillons blanchis et les échantillons non blanchis.
Mode opératoire (Philips, Chinman,
Miller et Watter, 1988)
Les ignames de variété connue sont pelées
et transformées en tubes de 3 cm de diamètre. Ils sont ensuite
tranchés en rondelles de 3mm d'épaisseur. Deux tranches sont
pesées avant d'être blanchir dans de l'eau chaude à
60° C ou à 95° C .Après blanchiment les tranches sont
à nouveau pesées. L'eau à la surface des tranches est
enlevée par imbibition à l'aide d'un papier absorbant. Le gain en
masse est pris comme étant la quantité d'eau absorbée et
exprimée en pourcentage d'eau absorbée selon la formule
suivante :
Masse échantillon non blanchi - masse échantillon
blanchi
Masse échantillon non blanchi
% d'eau absorbée = x 100
II.3.2 Capacité de rétention d'eau
Principe
Il est basé sur les différences de masses entre
les échantillons non centrifugés et les échantillons
centrifugés.
Mode opératoire (JAUREGUI et
al; 1981),
Une masse de 0,5 g d'échantillon
blanchi aux températures de 60° C ou de 95° C pendant 20,30,
45, 55 et 60 secondes a été pesée et enveloppée
dans du papier filtre Whatman n° 3. Elle est ensuite
centrifugée à 3000 tr/mn puis pesée à nouveau. La
quantité d'eau expressive est donnée par la formule
suivante :
(Masse échantillon non centrifugé) - (masse
échantillon centrifugé)
Masse échantillon non centrifugé
% d'eau expressible = x 100
II.3.3 Détermination de la teneur en
-Carotène
II. 3.3.1 Extraction du -Carotène
Principe
L'extraction se fait à froid, par différence de
solubilité dans un mélange de solvants des phases non miscibles
contrastées. Grâce aux interactions entre molécules
polaires et entre molécules non polaires. Les molécules peu
polaires seront dissoutes dans l'éthanol et les molécules
apolaires dans l'hexane.
Mode opératoire (SIMPSON et al,
1987)
Une masse d'igname, environ 1g est introduit dans un mortier
contenant du sable fin. Après ajout de 10 ml de solvant d'extraction
hexane/acétone (1 : 1 ; v/v), l'ensemble est
homogénéisé. L'homogénat est filtré et le
résidu obtenu est repris 3 fois dans 5 ml de solvant d'extraction. Les
filtrats sont mélangés, puis décantés à
l'aide d'une ampoule à décanter. La phase organique est
recueillie et lavée dans 50 ml d'eau déminéralisée.
L'opération est reprise 3 fois de suite. La phase organique obtenue est
déshydratée à l'aide du sulfate de sodium anhydre (1
pincée). Lors de la manipulation, la verrerie est enveloppée
à l'aide du papier aluminium pour minimiser la dégradation du
-Carotène sous l'effet de la lumière.
II.3.3.2 Elution (Chromatographie sur colonne)
Principe
L'élution du -Carotène est effectuée sur
colonne chromatographique contenant du gel de silice, en utilisant comme
colonne une burette au fond de laquelle on a introduit du coton. Les
molécules sont entraînées vers le bas à des vitesses
variables selon leur affinité pour l'absorbant et leur solubilité
dans l'éluant.
Mode opératoire
Pour préparer la colonne à gel de silice, une
masse de silice est prélevée et suspendue dans l'hexane pour
former un gel. La colonne est tassée avec le gel obtenu jusqu'à
une hauteur de 10 cm environ. Une couche d'environ un cm de sulfate de sodium
anhydre y est ajoutée. Pour l'élution proprement dite, la phase
organique est ajoutée à la colonne puis éluée avec
30 ml de solvant hexane / acétone (9 : 1 ; V/V). Des fractions
de 5 ml chacune sont recueillies dans des bouteilles en verre de couleur
marron. Les D O sont lues à 450 nm contre l'hexane.
II.3.3.3 Quantification par spectrométrie
visible
Principe (ESSIBEN, 2005)
Lorsqu'on excite un atome par un apport externe
d'énergie (application d'un rayonnement électromagnétique
par exemple), les électrons de la couche externe de cet atome peuvent
peuvent passer d'un état énergétique fondamental à
un état d'énergie supérieure dite excité. Le
â-corotène présente une réunion de onze doubles
liaisons conjuguées qui crée une importante délocalisation
spatiale des électrons et donc une diminution de l'écart entre le
niveau fondamental et excité. Grâce à cette stabilisation
par résonance de l'état excité, la molécule absorbe
dans le visible. Le spectrophotomètre mesure l'absorbance (reliée
à la quantité de lumière absorbée) qui selon la loi
de Beer-Lambert est proportionnelle à la concentration du constituant
analysé.
La relation de Beer-Lambert décrit que, à une
longueur d'onde donnée, l'absorbance d'une solution est
proportionnelle, à la concentration des espèces de la solution,
et à la longueur du trajet optique (distance sur laquelle la
lumière traverse la solution). Ainsi, pour une solution limpide
contenant une seule espèce absorbante, la loi de
Beer-Lambert donne :
A : absorbance de la solution (sans
unité)
A = x L x C avec
L : longueur de la solution
traversée par la lumière (en cm)
C : Concentration de la solution
(en mol.L-1)
: Coefficient d'extinction molaire (en
mol.L-1 cm-1)
Dépend de la nature de la solution et de la
longueur d'onde.
Mode opératoire
Deux ml des fractions obtenues lors de l'élution sont
prélevés à l'aide d'une micropipette et introduites dans
des tubes à essai pour la lecture des D.O. Ces dernières sont
lues à 450 nm contre l'hexane. Le tube contenant l'hexane constitue le
tube blanc.
Quantification
Les concentrations en - carotène sont obtenues en
utilisant la pente de la courbe d'étalonnage tracée à
partir du standard de - carotène.
Préparation de la gamme
d'étalonnage
La courbe d'étalonnage a été
tracée à partir des données du tableau suivant :
Tableau 1 : Données de la gamme
d'étalonnage pour le dosage du - carotène
|
Tube N°
|
1
|
2
|
3
|
4
|
5
|
6
|
|
Standard de - carotène (5g/ml)
|
0
|
1
|
2
|
3
|
4
|
5
|
|
Hexane (ml)
|
5
|
4
|
3
|
2
|
1
|
0
|
|
Concentration (g/ml)
|
0
|
1
|
2
|
3
|
4
|
5
|
|
Quantité ((g)
|
0
|
5
|
10
|
15
|
20
|
25
|
|
Densités Optiques moyennes
|
0
|
0.078
|
0.154
|
0.223
|
0.0312
|
0.392
|
La figure 3 ci-après illustre la courbe
de dosage pour le - carotène
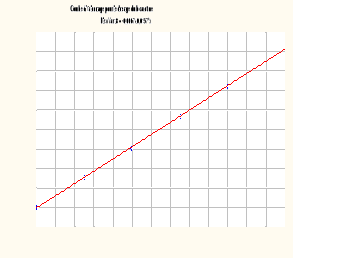
Figure III : Courbe d'étalonnage
pour le dosage de - carotène
Soient,
ni : Le nombre de fraction de
l'éluât chromatographique.
V1 : Volume de lecture de l'éluât
en millilitre
V2 : Volume de chaque
fraction de l'éluât en millilitre
M : Masse de prise d'essai.
Q : La quantité de -
carotène dans la matière fraîche
D.O = -0.00073+0.0157Q1
Q1 = 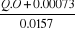
V1
Q2
Q2 = 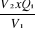 Qt = Q2ni Qt = Q2ni
V2
Q2
M Qt
Y =
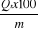 mg/100g de M.F mg/100g de M.F
100 Y
Y exprime la quantité de - carotène en mg/100g de
MF
Estimation du pourcentage de perte en - carotène
(P)
Il est déterminé par la relation suivante :
P = 100 - 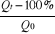 Qt = teneur en - carotène au temps t. Qt = teneur en - carotène au temps t.
Q0 = teneur initiale en - carotène.
I- RESULTATS
I-1 Composition en eau et en -carotène des
tubercules frais d'igname.
Le tableau 2 présente les teneurs en
eau, en eau libre, et en -carotène des variétés à
chair jaune tachetée (VJT) et à chair jaune (VJ) des tubercules
de Dioscorea Schimperiana.
Tableau 2 : Teneurs
en eau, en eau libre et quantité de
-carotène dans les deux variétés
d'igname
|
Teneur en eau
|
Teneur en eau libre
|
Qté -carotène g/100GMF
|
|
VJ
|
74,000
|
9,927 #177;2,158
|
7235,462#177;92,68
|
|
VJT
|
66,302
|
7,025#177;2,067
|
8215,664#177;48,002
|
VJ : variété jaune ; VJT :
variété jaune tachetée de rouge
Il ressort de ce tableau que les tubercules du Dioscorea
Schimperiana de variété à chair jaune tachetée
est plus riche en -carotène que celui à chair jaune. Cependant
les teneurs en eau et celui de l'eau libre sont plus importants dans la
variété jaune que dans la variété jaune
tachetée de rouge
I-2 Influence du blanchiment sur les teneurs en
nutriments
I-2-1 Absorption d'eau au cours du blanchiment
Le tableau 3 ci-dessous présente les
différentes valeurs enregistrées lors de l'absorption d'eau au
cours du blanchiment des tranches de deux variétés du
Dioscorea Schimperiana.
Tableau 3 :
Différentes valeurs enregistrées lors de l'absorption
d'eau au cours du blanchiment des tranches de deux variétés du
Dioscorea Schimperiana.
|
t(s)
|
VJT
|
VJ
|
|
60° C
|
95° C
|
60° C
|
95° C
|
|
Moy.
|
écartype
|
Moy.
|
écartype
|
Moy.
|
écartype
|
Moy.
|
écartype
|
|
0
20
30
45
55
60
|
0
0,042
0,019
0,934
0,511
0,489
|
0
0
0
0,231
0,295
0,320
|
0
4,684
5,421
5,938
5,843
4,966
|
0
0,924
1,317
1,862
2,272
2,177
|
0
2,009
1,135
0,884
0,768
0,649
|
0
0
0
0
0
0
|
0
2,94
3,620
4,336
4,413
3,415
|
0
1,323
1,409
1,327
1,538
0,726
|
Moy. : moyenne
Les figure IV et V
représentent les courbes d'absorption d'eau au cours du blanchiment des
tranches de l'igname Dioscorea Schimperiana de variété
jaune (VJT) et jaune tachetée de rouge (VJ°.
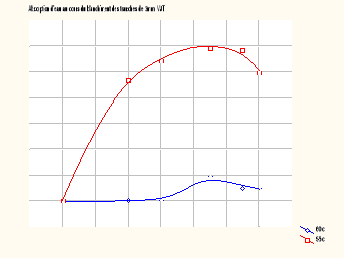
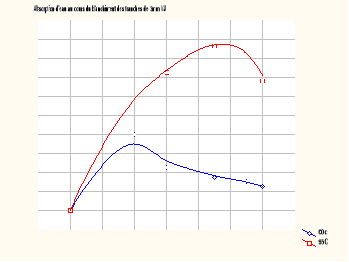 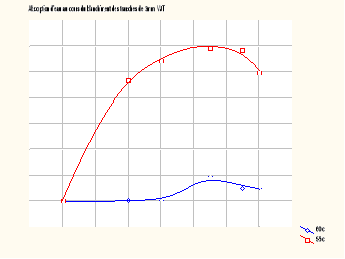 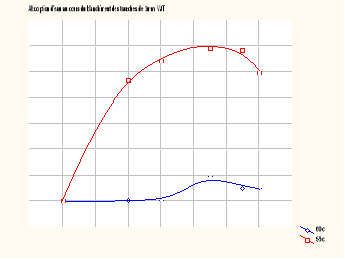
FIGURE IV : Courbe d'absorption
d'eau au cours FIGURE V : Courbe d'absorption
d'eau au
du blanchiment (VJT) cours du
blanchiment (VJ)
I-2-1-1- Allure de la courbe
D'une manière générale, les courbes ont
une allure polynomiale en forme de cloche et présentent deux
phases :
- Une phase où l'absorption d'eau est rapide
- Une seconde phase où la capacité d'absorption
d'eau diminue.
I-2-1-2- Influence de la température
Quelque soit la variété, l'absorption d'eau est
plus élevée à 95°C qu'à 60°C.
I-2-1-3- Influence de la variété
L'influence de la variété est fonction de la
température. A 60°C, la variété jaune absorberait un
peu plus d'eau que la variété jaune tachetée.
A 95°C, le phénomène contraire se produit.
La variété jaune tachetée absorbe plus d'eau que la
variété jaune.
I-2-2 Rétention d'eau au cours du blanchiment
des tranches
Les figures VI et VII
présentent les courbes de rétention d'eau au cours du blanchiment
des tranches de 3mm à 60° C et 95° C pour les deux
variétés d'ignames.
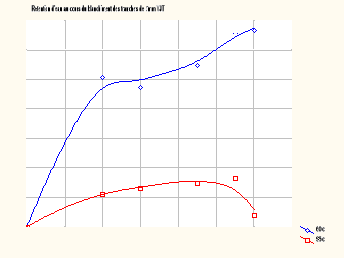
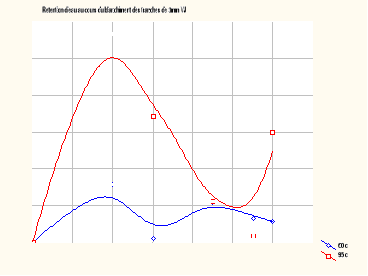
FIGURE VI : Rétention d'eau
au cours du blanchiment de
Tranches de 3 mm VJT
FIGURE VII : Rétention d'eau
au cours du blanchiment de
Tranches de 3 mm VJ
I-2-2-1- Allure de la courbe
Les courbes sont fonction de la
variété : elles ont une allure polynomiale avec deux ou
trois phases pour la variété jaune tachetée et
sinusoïdale pour la variété jaune.
Parlant de la variété jaune tachetée,
les courbes ont une allure polynomiale avec deux phases :
- Une phase où la quantité d'eau expulsée
augmente rapidement, ceci pendant les trente première secondes.
- une seconde phase où elle ralentie voire même
chute (90° VJT).
Pour la variété jaune, les courbes sont
sinusoïdales avec des périodes où la quantité d'eau
expulsée augmente et des périodes où elle chute.
I-2-2-2- Influence de la température
L'influence de la température sur la capacité
d'absorption d'eau est fonction de la variété.
Pour la variété jaune tachetée : le
pourcentage d'eau expulsé est très élevé à
60°C qu'à 95°C.
Pour la variété jaune, le pourcentage d'eau
expulsé est très bas à 60°C. A 95°C, il est
élevé en début de blanchiment entre 0 et 20 secondes, puis
on observe une chute drastique entre 20 et 45 secondes et remonte par la
suite.
I-2-2-3- Influence de la variété
L'influence de la variété est aussi fonction de
la température. A 95°C, le pourcentage d'eau expulsé est
plus élevé dans la variété jaune que dans la
variété jaune tachetée. A 60°C, on observe
plutôt le phénomène contraire.
I-2-3 Expulsion d'eau au cours du blanchiment
Les figures VIII et IX présentent les
courbes de vitesses d'expulsion d'eau au cours du blanchiment à 60°
C et 95° C dans du Dioscorea Schimperiana de
variété jaune tachetée (figure VIII) et
de variété jaune (figure IX).
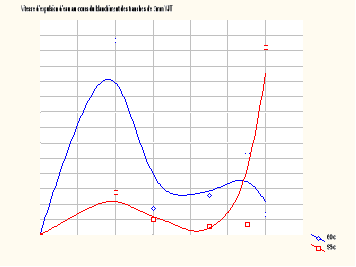
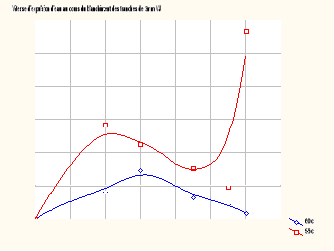
FIGURE VIII : Vitesse d'expulsion
d'eau au cours du
blanchiment des tranches de 3 mm VJT
FIGURE IX : Vitesse d'expulsion
d'eau au cours du
Blanchiment des tranches de 3 mm VJ
I-2-3-1- Allure de la courbe
D'une manière générale, les courbes ont
une allure sinusoïdale sauf la courbe de vitesse d'expulsion d'eau
à 60°C qui a une allure polynomiale.
I-2-3-2- Influence de la température
L'influence de la température sur la vitesse
d'expulsion d'eau est fonction de la variété.
Pour la variété jaune tacheté, la
vitesse d'expulsion d'eau est fonction du temps. Elle est plus
élevée en début de traitement à 60°C entre
0et 45 secondes alors qu'à 95°C elle s'élève
après 45 secondes de traitement.
I-2-3-3- Influence de la variété
La vitesse d'expulsion d'eau est plus élevée
dans la variété jaune que dans la variété jaune
tachetée.
I- 2-4 Influence ou blanchiment sur les teneurs en
-carotène
Le tableau IV représente les pertes en
-carotène ou leurs du blanchiment à des températures de
60° C et 95° C pendant 0, 20, 30, 45, 55, 60 secondes des deux
variétés d'ignames.
|
t(s)
|
VJT
|
VJ
|
|
60° C
|
95° C
|
60° C
|
95° C
|
|
0
|
0
|
0
|
0
|
0
|
|
20
30
45
55
60
|
9,212
18,424
87,137
75,637
80,827
|
79,557
87,102
74,979
55,999
57,975
|
20,316
38,290
21,724
31,345
20,936
|
14,622
70,004
66,750
61,150
17,935
|
VJ : variété jaune ; VJT :
variété jaune tachetée de rouge.
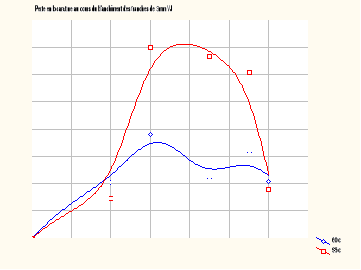
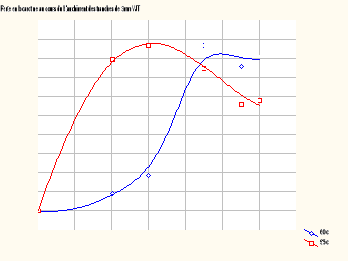
Les figures X et XI présentent
l'évolution des pertes en -carotène dans les tranches de 3mm
pour la variété jaune tachetée (figure X)
et la variété jaune (figure XI) au cours du
blanchiment à 60° C et 95° C en fonction du temps.
FIGURE XI : Perte en
carotène au cours du blanchiment
des tranches de 3 mm VJ
FIGURE X : Perte en carotène
au cours du
blanchiment des tranches de 3 mm VJT
I-2-4-1 Allure de la courbe
L'allure générale des courbes est polynomiale et
présentent deux phases :
v Une phase ascendante où la perte en
â-carotène est considérable
v Une phase descendante ou constante où la perte en
â-carotène diminue.
I-2-4-2 Influence de la température
Quelque soit la variété, l'influence de la
température est fonction du temps. La perte en â-carotène
est plus élevée à 95°C par rapport à 60°C
en début du traitement (0 à 45 secondes pour la
variété jaune tachetée et 0 à 30 secondes dans la
variété jaune). Par la suite, elle chute pendant qu'elle
s'élève à 60°C pour la variété jaune
tachetée et chute légèrement pour la variété
jaune.
I-2-4-3 Influence de la variété
La perte en â- carotène est fonction de la
variété. La variété jaune perd moins de â-
carotène que la variété jaune tachetée quelque soit
le temps.
II - DISCUSSION
Les résultats obtenus au cours de nos analyses, nous
conduisent à de nombreuses hypothèses : Dioscorea
Schimperiana est riche en eau et en - carotène. Nous avons obtenu
une teneur moyenne en eau de 74,000% et en eau libre de 9,927% dans la
variété jaune. Cependant ces teneurs dans la
variété tachetée de rouge sont estimées
respectivement à 66,302% (teneur en eau) et à 7,020% (teneur en
eau libre). Ce qui montrerai que la variété jaune est plus riche
en eau libre que la variété jaune tacheté de rouge. Par
contre, Nous avons observé que la teneur en - carotènes semble
plus élevée dans la variété Jaune tachetée
de rouge que dans la variété Jaune. Cette différence
observée est en accord avec les travaux de RODRIGUEZ AMAYA
(1997). En effet, la teneur en - carotène dépend de
plusieurs facteurs tels que la variété (plus la
coloration de la pulpe de celle-ci tend vers l'orange, meilleur est sa teneur
en -carotène), les techniques culturales et la maturité des
tubercules.
Nous constatons d'autre part que l'absorption d'eau est plus
importante à 95°C qu'à 60°C quelque soit la
variété. Ceci pourrait s'expliquer par l'effet de la
température sur le diamètre des pores des tubercules. En effet,
ce diamètre augmente avec la température facilitant ainsi
l'entrée massive d'eau dans la cellule (CHEFTEL et al;
1983). Cette absorption d'eau est plus prononcée à
60°C dans la variété jaune que dans la variété
jaune tachetée. Ceci s'expliquerait par la porosité normale de la
cellule des tubercules. Ce qui est en accord avec les résultats de
NGO NGUIDJOL (2006) qui a affirmé que cette
porosité serait plus grande dans la variété jaune et les
différents transferts d'eau et de chaleur plus importants. A 95°C,
le phénomène contraire se produit : la variété
jaune tachetée absorbe plus d'eau que la variété jaune.
Ceci serait dû au transfert massif de chaleur dans cette
variété puisqu'elle semble plus poreuse. Ce transfert de chaleur
dans la cellule provoquerait à cette température un gonflement
des granules d'amidon. Ces dernières entraîneraient une
restriction des diamètres des pores de la cellule réduisant ainsi
l'absorption d'eau. Ces résultats sont en accord avec celui de
MEDOUA (2005) qui a montré que l'épaississement
de la membrane cellulaire lors de la gélatinisation de l'amidon ralentit
la capacité des tubercules à observer de l'eau.
En ce qui conserne la capacité de rétention
d'eau, nous remarquons dans un premier temps que l'influence de la
température sur cette dernière est fonction de la
variété. Nous avons noté un pourcentage d'eau
élevé à 60°C qu'à 95°C dans la
variété jaune tachetée. Ceci pourrait s'expliquer par la
gélatinisation de l'amidon à 95°C (température
favorable pour le gonflement des granules d'amidon). Laquelle
gélatinisation réduirait les pores des cellules. Pourtant, ce
pourcentage d'eau expulsée est très bas à 60°C dans
la variété jaune alors qu'95°C, il est élevé
en début de blanchiment puis chute drastiquement pour remonter par la
suite. Ces phénomènes seraient dus au départ de la
porosité du tubercule, ensuite de la réduction des pores
par gélatinisation de l'amidon et enfin de l'éclatement des
granules d'amidon. Dans un second temps, nous constatons qu'à 95°C
la quantité d'eau expulsée est élevée dans la
variété jaune que dans la variété jaune. Pourtant
à 60°C le phénomène contraire se produit. Nous
pouvons justifiez ceci par la porosité de cellules des tubercules sur la
variété jaune qui serait plus grande, aussi par les
différents transferts d'eau et de chaleur qui seraient plus importants
à 95°C. En plus la teneur en eau libre est plus
élevée dans la variété jaune ; ce qui pourrait
aussi expliquer le fait que cette variété ait un pourcentage
d'eau expressive plus élevé que la variété jaune
tachetée. Cette forte teneur en eau libre dans la variété
jaune justifierait aussi la rapidité de la vitesse d'expulsion d'eau
chez celle-ci que dans l'autre variété.
Les analyses des résultats de dosage en
-carotène montrent que quelque soit la variété, la
perte en -carotène est plus élevé à 95°C
par rapport à 60°C en début de blanchiment. Ceci
pourrait s'expliquer par le transfert de chaleur qui est très
importante pendant cette phase. Ce qui entraînerait une
dégradation progressive du -carotène au cours du temps.
Ces résultats sont en accord avec CHEFTEL et al; (1983)
et ESSIBEN (2005) qui montrent que les
molécules du - carotène sont liposolubles et sensibles à
la chaleur. Elles sont dont détruites majoritairement par la chaleur
dans les conditions du blanchiment. Lors du blanchiment la température
de l'intérieur du produit tend très rapidement vers celle du
milieu chauffant ; c'est ce qui peut expliquer l'ampleur des pertes.
Ensuite on note une diminution de ces pertes en - carotène Cette
diminution serait due aux différentes modifications structurales
observées dans les tubercules notamment lors de la gélatinisation
de l'amidon. En effet, en présence de la chaleur les granules d'amidon
passent d'état cristallin à un état amorphe. Au cours de
la gélatinisation, il y a gonflement des granules d'amidon ce qui
occasionne une obstruction des pores des cellules et une diminution de la
porosité des tubercules d'où la chute. Enfin la perte en -
carotène est plus élevé dans la variété
jaune tachetée que dans la variété jaune. Ce qui pourrait
justifier la sensibilité de cette variété à ce
traitement.
I - CONCLUSION
Ce travail avait pour but de contribuer à
l'étude de l'influence du blanchiment sur la teneur en -
carotène du D. Schimperiana. Il s'agissait spécifiquement de
rechercher les températures et temps propices pour un bon blanchiment,
afin de minimiser les pertes en - carotènes de l'igname.
Au terme de cet analyse, nous avons noté que lors du
blanchiment il y avait une forte perte en - carotène. Cependant cette
perte est moins élevée à une température de
95° C qu'à 60° C quelque soit la variété.
D'où la température de 95°C est la température la
mieux indiquée pour le blanchiment ; ainsi qu'un temps de 60
secondes quelque soit la variété du Dioscorea
Schimperiana. Ceci parce que c'est à cette température et
cette durée que nous enregistrons moins de pertes en ce micronutriment
c'est-à-dire 17,935% de perte pour la variété jaune et
57,975% pour la variété jaune tachetée de rouge.
II - RECOMMANDATION
Nous recommandons vu l'importance de la - carotène dans
notre alimentation un blanchiment à 95° C pendant 60 secondes avant
tout séchage d'igname ce qui permettant d'améliorer sa richesse
en provitamine A ainsi que ses qualités organoleptiques de notre
Dioscorea Schimperiana.
III - PERSPECTIVES
Nous envisageons dans un proche avenir de continuer notre
études sur :
- L'influence du blanchiment sur d'autres micronutriments de
cette igname ;
- Etendre notre étude en faisant varier les
épaisseurs de l'igname de façon croissante ;
- Faire une comparaison entre les teneurs en - carotène
entre les tranches d'ignames sèches ayant subit un blanchiment et celles
n'ayant pas subit de blanchiment.
- Transformer les tranches séchées en farine et
analyser les teneurs en nutriments.
BIBLIOGRAPHIES
Ø ABOUNDA S.
(2005) : Effet de la cuisson à eau et de la friture sur la
teneur en - carotène de deux variété de Patates Douce
(Ipomea batatas) des provinces du Littoral et du centre du Cameroun.
Mémoire de Maîtrise Université de Douala Cameroun, 7 -
8.
Ø BRUNETON J (1993) :
Pharmacognosie, phytochimie, plantes médicales. 2e
édition, Lavoisier, Paris 211 - 213.
Ø BIENG F. (2005) :
Contribution a l'étude phytochimique des pulpes de Dioscorea
Schimperiana, Mémoire de Maîtrise, Université de
Douala Cameroun, 8, 11.
Ø CASTENMILLER JJ M et WEST C.E.,
(1998) Bioavailability and bioconversion of caroténoïds; Annu Rev.
Nutr., 18, 19 - 38.
Ø CHALCHAT, JC., (1997) : Les
plantes ; sources naturelles d'antioxydant, IN Rev. Ital. EPPOS
N°spécial de Janvier 97 PP213 - 230.
Ø CHEFTEL J.C CHEFTELH et BESANCONP
(1983) : Introduction à la Biochimie et à la technologie
des Aliments, Volume 1 Edition technique et documentation 11 Rue
Lavoisier, 75008 Paris, 420
Ø CHEFTEL J.C. CHEFTEL H. et BESANCON
P. (1983) : Introduction à la Biochimie et à la
technologie des Aliments, Volume 2 Edition technique et documentation 11
Rue Lavoisier, 75008 Paris, 400
Ø COURSEY D. (1972): The civilization
of the yam. International Ships of man and your in Africa and the Indo-Pacific
region Archaeol. Phy. Anthropol Oceania. 7, 215 - 233.
Ø DONALD Mc LAREN et MARTIN F,
(2002) : Manuel sightand life sur les troubles dus à la carence en
vitamine A (TCVA) 172 P.
Ø DANIELE Ribier, (2000) : La
transformation de l'igname Bulletin du réseau Technologie et Partenariat
en Agroalimentaire (TPA). Edition N°18 Décembre 200 page 4, 5,
6.
Ø DICTIONNAIRE DE L'ACADEMIE FRANÇAISE (1995)
8e Edition ; volume 1, P. 102 et 103.
Ø DICTIONNAIRE DE L'ACADEMIE FRANÇAISE (1995)
8e Edition ; volume 2, P. 102 et 103.
Ø ESSIBEN Yvette Claude, (2005) :
Influence d'une déshydratation par entraînement après
blanchiment sur les teneurs en - carotène et vitamine C : cas
Dioscorea Schimperiana, Mémoire de Maîtrise
Université de Douala Cameroun p : 15 - 17.
Ø EDMOND ROCK, (2003) : Stress
oxydant, Micronutriment et Santé ; Université
d'été de Nutrition 2003 Clément Ferrand P. : 40 - 41
INRA France.
Ø ENCARTA ENCYCLOPEDIA (2001) :
Logiciel Microsoft corporation
Ø JAUREGUI, C.A., REGENSTTEIN, J.M et BAKER, R.
(1981). A simple centrifugal method for measuring expressible
moisture, a water-binding property of muscle foods. Journal of food
science,46, 1271-1273p
Ø HYDE MA et WURSTEN (2007) :
Flora of Zimbabwe ; species informations, Dioscorea
Schimperiana prise sur le site http//www. Zimbabwe flora. Co. ZW/
Specieds data/ du 23 Octobre 2007.
Ø MEDOUA, 2005 : Potentiels
Nutritionnels et Technologique des Tubercules Durcis de L'IGNAME Dioscorea
Dumetorum (Kunth) pax : Etude du Durcissement post- récolte et des
conditions de transformations des tubercules durcis en farine. thèse
doctorat au département de sciences. université de
Ngaoundéré
Ø . p 23-26
Ø PENELOPE N., RITUN, (2003) Food:
Préparation protices can affect provitamin A carotenoïd content and
bioavailability ILSI, Humain nutrition Institute pays p. 99-123
Ø RODRIGEUZ AMAYA DELIAD, (1997):
Carotenoïd and food preparation the retention of provitamin a
carotenoïd in prepared processed and stored foods. Arlington VA, JOHN Snow
Inc/OMNI Project. p 38-46
Ø RODRIGEUZ A (1999): Guide to
caroténoïd analysis in food, bop Arlington VA! John Snow
Inc/ONNI Project. P 305-310
Ø RODRIGEUZ - AMAYA DELIAD., (1997):
Carotenoïds and food the retention of provitamin a carotenoïds in
prepared, processed and stored foods. Arlington VA: John Snow Inc/OMNI project.
P 222-225
Ø RAOULT-WACK .A, (1994): Recent
advance in the osmotic deshydratation of foods. Tred in nfood science and
technology. 5,8: 255 -260.
Ø SIMPSON K. L., TSOU T. C. (1987):
Biochemical methodology for the assessment of carotenoïd.
International Vitamine A consultative group, Washington, 45 P.
Ø Well J., Bonnet J., Boulanger Y., Dubertret
G., et MONTREUIL J., (1998) : Biochimie
Générale. 8e 2dition, Masson Paris, 1 - 283.
Ø YAMGA E. P., (2006) :
Synthèse bibliographique sur quelques
polyphénols et leur rôle biologique. Mémoire de
Maîtrise, Université de Douala Cameroun. P.15-17.
| 


