|
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET
POPULAIRE
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR ET DE LA
RECHERCHE SCIENTIFIQUE
UNIVERSITE DES SCIENCES ET DE LA TECHNOLOGIE «
HOUARI BOUMEDIENE »

FACULTE DES SCIENCES BIOLOGIQUES
Mémoire de projet de fin d'études en vue de
l'obtention du Diplôme de Master
Domaine: Sciences de
la Nature et de la Vie
Spécialité : Biologie Cellulaire
et Moléculaire
Option : Microbiologie et Contrôle de
Qualité
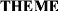

Helicobacter pylori : Etude
bactériologique
des premières souches isolées à
l'Hôpital
Bologhine Ibn Ziri
Présenté par: Melle DJOUADI
Lydia Neïla
Melle RAOUI Sarah Ibtissem
Soutenu le : 13 /06/2011 devant le jury composé de :
Président : Mme Natèche F. (Maitre de
conférence, USTHB) Promoteur: Mme Amhis W. (Professeur, EPH
Bologhine Ibn Ziri) Examinateur : Melle Antri K. (Maitre assitstante, USTHB)
Examinateur : Mr Selama O. (Maitre assitstante, USTHB)
Promotion 2010/2011
1
dedicaces :
A la memoire de mon Papy,
A mes parents, et a mon petit frere, Samy. A ma Mamie,
A mes grands-parents paternels,
A Madame Greffou M. qui m'a tant apporte. Et a tous ceux qui me
sont chers.
Lydia.
A ma grand-mere, qui est, pour moi, un modele de force et de
sagesse. A ma mere, dont le soutien indefectible a ete indispensable.
A ma sceur, Rym.
A mes amis, qui m'ont toujours epaulee.
Et a tous ceux qui me sont chers.
Sarah.
Remerciements :
Nous tenons tout d'abord a remercier le Professeur Amhis, d'avoir
accepte d'encadrer ce travail.
Nous remercions egalement, l'ensemble du personnel du laboratoire
central de biologie de l'hapital Bologhine Ibn Ziri pour leur disponibilite et
leur gentillesse.
Nous adressons nos remerciements aux membres du jury, qui ont
accepte de juger ce travail.
Tous nos remerciements vont a nos enseignants qui ont contribue a
la reussite de notre cursus.
3
Introduction
4
I-Introduction :
La découverte, en 1982, de Helicobacter
pylori a suscité un immense intérêt
scientifique dans le monde et a bouleversé notre compréhension de
la pathogénie des principales pathologies gastro-duodénales.
Cette découverte a révolutionné le domaine
de la Gastro-Entérologie. En effet, malgré les réticences
initiales, le traitement de l'ulcère passe à présent par
une antibiothérapie d'éradication de Helicobacter
pylori.
Cette éradication a permis un recul notable du lymphome
gastrique, puisqu'il est possible aujourd'hui, de faire régresser
durablement ce cancer par un traitement antibiotique spécifique.
(Ferrand, 2009)
En Algérie, bien que l'incidence de l'infection à
Helicobacter pylori soit estimée à plus
de 70% (6éme colloque sur Helicobacter pylori,
2011), peu d'études bactériologiques ont été
publiées sur ce thème.
La culture de cette bactérie, très exigeante, et
donc la réalisation de l'antibiogramme nécessaire à
l'orientation du traitement, sont difficiles à mettre en oeuvre compte
tenu des contraintes techniques qui s'y rattachent.
L'étude prospective qui nous a été
confiée consiste en la mise en place d'un protocole de diagnostic
bactériologique permettant , par plusieurs techniques , la culture ,
l'isolement et la réalisation d'antibiogrammes pour les souches obtenues
à partir de biopsies gastriques de patients suivis à
l'hôpital Bologhine Ibn Ziri.
I- Généralités

1-Historique :
En 1906 Walter Krienitz, un médecin allemand, observe pour
la première fois des bactéries spiralées dans l'estomac
d'un patient. (Ferrand, 2009)
Les scientifiques de l'époque étant convaincus
de la stérilité de l'estomac, vu la très forte
acidité qui y règne, n'accordent pas d'importance à cette
observation pensant qu'il ne peut s'agir que de contaminants. (Mégraud,
2005)
Ce n'est qu'au début des années 1980 que de
telles bactéries sont cultivées et étudiées : Robin
Warren, un pathologiste australien constate la présence de
bactéries spiralées, dans la moitié des biopsies
gastriques qu'il prélève. Il fait l'hypothèse qu'elles
sont à l'origine de gastrites chroniques et d'ulcères
gastroduodénaux, pathologies que l'on pensait, jusque là,
liées au stress ou à la nourriture épicée.
(Ferrand, 2009)
Intéressé par ces résultats, Barry Marshall,
un étudiant de Robin Warren, est le premier à cultiver cette
bactérie en 1982. (Mégraud, 2005)
Cette dernière est baptisée dans un premier
temps Campylobacter pylordis puis
Campylobacter pylori (après correction
grammaticale latine) en raison de ces similitudes avec
Campylobacter jejuni (notamment son caractère
microaérophile). Cependant, différentes études portant sur
les caractères génétiques (séquences des ARNr 16S,
pourcentage de G+C) et phénotypiques (morphologie, structure,
composition en acides gras, activités enzymatiques) ont permis
d'individualiser cette bactérie dans un nouveau genre, et de la renommer
Helicobacter pylori (Ferrand, 2009).
La communauté scientifique, sceptique quant au
rôle de H.pylori dans les ulcères
gastriques, commence à changer d'avis après des études
complémentaires, conduites par Marshall, dont la plus décisive
est celle durant laquelle il ingurgite un tube à essai de H.
pylori, contracte une gastrite et guérit avec des
antibiotiques.
En 1994, le National Institute of Health publie un texte
soutenant que la plupart des ulcères gastriques récurrents sont
causés par H. pylori, et recommande que des
antibiotiques soient inclus dans le traitement.
En 2005, Warren et Marshall obtiennent le prix Nobel de
médecine pour leur découverte. (Mégraud, 2005)

Figure n°1 : Photo de Warren et Marshall
*
*:
http://cours.francocite.ca/courslaf/SBI3Uweb/SBI3Cwebunite3-
anatomie/digestion/estomac/SBI3Cdigestionestomaculc%C3%A8re%20de%20l'estomac.htm
2- Epidémiologie :
L'infection à Helicobacter
pylori est l'une des infections les plus répandues dans le
monde, près de la moitié de la population mondiale est porteuse
de la bactérie. Toutefois, la prévalence varie de 20 à 90%
selon les pays, l'infection étant plus fréquente dans les pays en
voie de développement. (Leclerc, 2006) (Figure n°2)
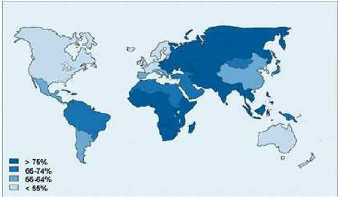
Figure n°2 : Prevalence de l'infe ction a
Helicobacter pylori dans le monde*
L'infection survient généralement pendant
l'enfance. La réaction immunitaire qui s'en suit détermine
probablement l'évolution de l'infection au cours du temps. (Raymond
et al.,2005). En effet, plusieurs études
tendent à montrer qu'un individu a très peu de risques
d'être infecté après l'âge de 10 ans. (Mitchell et
Megraud, 2002)
Le seul réservoir significatif de Helicobacter pylori est
l'estomac humain, bien que la bactérie soit retrouvée chez le
chat domestique et certains primates. (Ferrand, 2009)
Les facteurs de risque de l'acquisition de l'infection par
Helicobacter pylori sont fréquemment
liés à la pauvreté. Ils comprennent la promiscuité,
le manque d'hygiène, le partage de lits pendant l'enfance et le faible
niveau d'éducation des parents. En outre, des facteurs comportementaux
propres à certaines sociétés, tel que la
pré-mastication des aliments par la mère, semblent
également jouer un rôle significatif.
De nombreuses études épidémiologiques
suggèrent une transmission de personne à personne par voie
féco-orale ou plus vraisemblablement par voie oro-orale.
Le fait que la promiscuité soit un facteur de risque
d'acquisition de l'infection, plaide en faveur d'une transmission de personne
à personne et les études concernant l'influence de la
pré-mastication des aliments suggèrent une transmission
oro-orale.
Le risque pour un enfant d'être infecté augmente
de façon significative avec le nombre de personnes infectées dans
la famille. Il dépend en priorité de l'infection de la
mère suivie de celle du père et de la place des enfants dans la
fratrie. Ceci montre l'importance de la transmission intrafamiliale. Il a
été en effet prouvé, par des techniques de biologie
moléculaire de séquençage de gènes, que des souches
identiques circulaient chez les différents membres d'une même
famille, parents et fratrie. (Raymond et al.,
2005)
L'une des conséquences les plus inattendues de cette
transmission intrafamiliale est la possibilité de retracer les grandes
migrations humaines à partir de l'Afrique de l'Est en étudiant la
diversité génétique des souches de
H.pylori. Ainsi, ces résultats montrent la
co-évolution de la bactérie avec l'Homme depuis plus de 58 000
ans. (Ferrand, 2009)
* :
http://www.nature.com/onc/journal/v23/n38/figtab/1207726f7.html#figure-title
8
3- Rappel anatomique sur l'estoma c humain :
L'estomac est constitué de plusieurs régions:
(Figure n°3)
- le cardia: jonction entre l'oesophage et l'estomac
- le fundus ou grosse tubérosité: partie en forme
de dôme faisant saillie au dessus et à coté du cardia.
- le corps: portion médiane de l'estomac
- l'antre: portion terminale de l'estomac, terminée par
le pylore qui régit l'évacuation gastrique via le muscle
sphincter pylorique. *
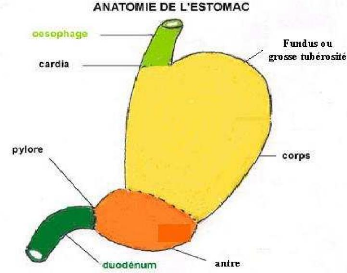
Figure n° 3 : Schema de l'anatomie de l'estoma c
humain *
La paroi de l'estomac est constituée des quatre couches
concentriques caractéristiques de la majeure partie de tube digestif:
(Figure n°4)
- Muqueuse : en contact avec la lumière (ou
cavité) gastrique, elle est formée d'une monocouche cellulaire ou
épithélium gastrique qui s'invagine dans un tissu conjonctif
appelé chorion. Les cellules de l'épithélium sont
responsables de la sécrétion de suc gastrique.
- Sous-muqueuse: tissu conjonctif
- Musculeuse: tissu musculaire qui mélange et propulse
les aliments dans l'estomac
- Séreuse: tissu conjonctif ayant un rôle
protecteur. *
* :
http://nte-serveur.univ-lyon1.fr/physiogerland/sysdigestif/page%20html/aa%2024.html
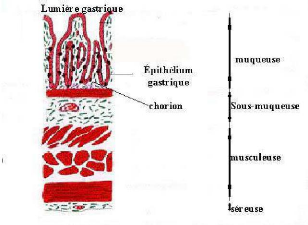
Figure n°4 : Histologie de l'estoma c humain
*
4- Classification de Helicobacter pylori
: (Manuel de Bergey, 2001) Domaine:
Bacteria
Phylum: Proteobacteria
Classe: Epsilonproteobacteria
Ordre : Campylobacterales
Famille : Helicobacteraceae
Genre et espece : Helicobacter
pylori
5- Caracteres bacteriologiques de Helicobacter
pylori : 5-1-Morphologie :
Helicobacter pylori est un petit
bacille (0,5 pm de diamètre sur 2 pm de longueur) de forme
hélicoïdale, Gram négatif, mobile grâce à de
multiples flagelles (5 à 7) entourés d'une gaine et
disposés selon une ciliature polaire. La bactérie ne forme pas de
spores mais peut adopter une forme coccoïde lorsqu'elle atteint la phase
du plateau de croissance. (O'Rourke et Günter, 2001) (Figure n°5)
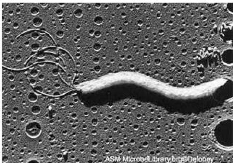
Figure n°5 : Helicobacter pylori observe au
Microscope électronique a balayage**
* :
http://nte-serveur.univ
lyon1.fr/physiogerland/sysdigestif/page%20html/aa%2024.html
** :
http://preveengeorge.blogspot.com/2011/02/h-pylori-and-peptic-ulcers.html
10
5-2-Caracteres bio chimiques :
Helicobacter pylori est
micro-aérophile (mais capable de croître en anaérobiose en
présence de CO2) et possède une catalase, une oxydase, une
nitrate réductase ainsi qu'une uréase très active. Elle
n'acidifie pas les sucres, et cultive à une température comprise
entre 33 et 40°C. Elle est RM et VP négatifs. (Ferrand, 2009)
5-3-Caracteres culturaux :
Elle croît lentement (3 à 4 jours minimum) et
exige des conditions de culture particulières (micro-aérophile)
et des milieux de culture additionnés de sang, de sérum ou de
suppléments d'enrichissement (Flandrois,1997) tels que la gélose
PYL (sélective pour H.pylori) ou Columbia
additionnée de sang. Les colonies sont petites (0.5 mm) ou en nappes
brillantes et non hémolytiques.* (Figure n°6)

Figure n°6 : Aspect des colonies de
H.pylori sur gelose Columbia au sang frais* 5-4-Genetique :
Le génome de H. pylori est
séquencé depuis 1997 : il possède 1 667 867 paires de
bases codant pour 1590 protéines essentielles.
Environ trente pour cent des gènes de
Helicobacter pylori sont spécifiques à
l'espèce et une grande variabilité génétique peut
être retrouvée entre les différentes souches.
Cette hétérogénéité se
manifeste par des taux de mutation et de recombinaison importants, par
l'acquisition d'ADN étranger (endogène ou exogène à
l'espèce) et par des différences au niveau de l'organisation des
gènes.
Helicobacter pylori possède
environ 1200 gènes communs à toute l'espèce et 200
à 400 gènes présents de manière variable selon les
souches. La majorité des différences génétiques est
retrouvée dans la zone de plasticité et dans l'îlot de
pathogénicité cag.
(cf. § 6-1)
L'importance des taux de mutation et de recombinaison serait due
au manque d'efficacité du système de réparation de
H.pylori.
De plus, Helicobacter pylori peut
possèder des plasmides ou des systèmes d'import d'ADN qui lui
permettent d'augmenter son adaptabilité. Ainsi, les analyses
in silico ont permis de montrer que les gènes
de ménage ou de virulence peuvent être transférés
entre bactéries. Ces gènes peuvent provenir d'autres
espèces du genre Helicobacter mais
également d'autres genres bactériens. (Ferrand, 2009)
* :
http://bacterioweb.univ-fcomte.fr/bibliotheque/remic/23-Helic.pdf
11
La diversité génétique de
Helicobacter pylori s'explique aussi par des
différences notables, entre les souches, dans l'organisation
générale du génome, l'ordre des gènes et les
séquences protéiques théoriques.
La grande variabilité génétique de
Helicobacter pylori pourrait être due à
sa voie de transmission intrafamiliale et à sa grande adaptation
à un hôte unique. (Fauconnier,1998)
6- Pouvoir pathogène de Helicobacter pylori
:
6-1-Fa cteurs de virulence :
Helicobacter pylori dispose de tout un
arsenal de propriétés lui permettant de résister à
l'acidité gastrique, de se mouvoir dans le mucus gastrique d'une grande
viscosité et d'échapper aux réponses du système
immunitaire de l'hôte (facteur de colonisation et de
persistance). Les facteurs de colonisation sont
généralement exprimés par l'ensemble des souches
cliniques.
D'autres facteurs sont plus spécifiquement associés
à la genèse des lésions et interviennent en
altérant l'intégrité de la muqueuse ou en
déclenchant, puis modulant la nature de la réaction inflammatoire
(facteurs de pathogénicité). La présence ou non des
gènes codant ces facteurs, ou leur expression, est une composante
variable. (Ferrand, 2009) (Tableau I)
Tableau I : Fa cteurs de virulence de Heli coba cter
pylori (Amir-Tidani, 2003)
|
Fa cteurs de virulence
|
Fon ction
|
Présence dans toutes les
sou ches :(+) oui,
(_)
non.
|
|
Fa cteurs de colonisation de la muqueuse
gastrique
|
|
Flagelles*
|
Mobilité
|
(+)
|
|
Uréase**
|
Résistante à
l'acidité
Métabolisme azoté
Echappement à la réponse
immunitaire
Effet cytotoxique (NH3)
|
(+)
|
|
Bab A
|
Adhérence aux antigènes
Lewis b
|
( - )
|
|
Sab A
|
Adhérence
(se lie à un lipide particulier
présent
à la surface des
cellules épithéliales)
|
( - )
|
|
Alp A, Alp B
|
Adhérence
(récepteurs non
identifiés)
|
(+)
|
|
Fa cteurs d'inflammation et lesions
cellulaire
|
|
Cytotoxine vacuolisante
Vac A***
|
Cytotoxicité
|
( - )
|
|
Cag A****
|
Perturbation des voies de
|
( - )
|
12
|
signalisation cellulaire
Modification de la
morphologie épithéliale
|
|
|
Motifs antigéniques Lewis
(x, y)
(Lipopolysaccharides)
|
Mimétisme moléculaire
(échappement à la
réponse
immunitaire)
Adhérence
|
( - )
|
|
Autres fa cteurs
|
|
Catalase
|
Détoxication
(échappement à la
réponse
immunitaire)
|
(+)
|
|
Superoxyde-dismutase
|
Détoxication
(échappement à la
réponse
immunitaire)
|
(+)
|
|
Oip A
|
Activation des voies de
signalisation pro
inflammatoires
(libération
d'IL-8)
réorganisation du
cytosquelette
|
( - )
|
|
NapA
|
Recrutement de neutrophile
et monocytes
|
( - )
|
|
Tip
|
Capacités de colonisation
Rôle
carcinogène
|
( - )
|
* Ces flagelles sont Constitués de 2 protéines
distinctes FlaA et FlaB et sont recouverts d'une gaine permettant une
protection contre l'acidité gastrique. (Fauconnier, 2002)
** L'uréase transforme l'urée en dioxyde de
carbone et ammoniac permettant de
neutraliser localement l'acidité gastrique et
créer ainsi un microenvironnement favorable
au développement
bactérien. L'uréase de H.pylori est
composée de deux sous unités :
UreA et UreB. Elle correspond
à 6 à 10% de la masse totale bactérienne, ce qui montre
le
rôle essentiel de cette molécule. (Gerhard et
al., 2002)
*** La cytotoxine vacuolisante VacA tient son nom de sa
capacité à induire l'apparition de vacuoles dans certaines
lignées de cellules épithéliales. (Lamarque, 2001)
**** l'îlot de pathogénicité « cag
» code pour un système de sécrétion de type IV : le
TSS4 qui permet d'injecter, dans le cytoplasme de la cellule cible, la
protéine CagA
(Ferrand, 2009).
6-2- Physiopathologie :
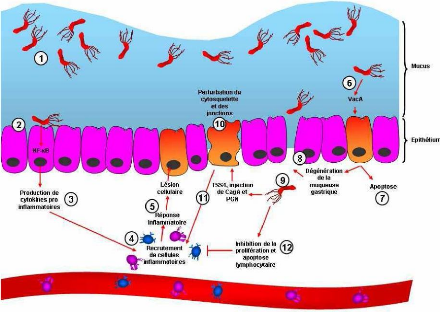
Figure n°7 : Résumé de la
pathogenicite de H. pylori (Ferrand, 2009)
1/ Les flagelles et la forme spiralée
de H. pylori permettent une mobilité dans le
mucus. L'uréase bactérienne permet de créer un
microenvironnement tamponné favorable à sa survie.
2/ La présence d'adhésines permet
une adhérence à la surface cellulaire.
3/Cette liaison induit la production de
cytokines pro inflammatoires.
4/ Ces cytokines pro-inflammatoires recrutent
les cellules de l'immunité circulante.
5/ Ces cellules sont responsables d'une
inflammation locale entraînant des lésions cellulaires. (Figure
n°7)
6/ D'autre part, H.
pylori secrète la cytotoxine vacuolisante, VacA. Ses
effets sont nombreux sur les cellules : (Figure n°8)
A) La protéine VacA peut être retrouvée au
niveau membranaire où elle joue le rôle d'adhésine.
B) VacA peut également être
sécrétée et activer des voies de signalisation
proinflammatoires après activation de récepteurs cellulaires.
C) L'internalisation de VacA et sa localisation mitochondriale
induit un relarguage du cytochrome C et l'apoptose cellulaire
(7). (Figure n°7)
D) Les protéines VacA endocytées forment des
pores à l'intérieur des vésicules d'endocytose
responsables de l'apparition de vacuoles, celles-ci proviendraient des
vésicules d'endocytose après la liaison de VacA au niveau de la
membrane cellulaire. Plusieurs molécules de VacA s'organisent en canaux
permettant le passage de certains ions chlorure. Ce passage anionique serait
compensé par l'entrée d'ions hydrogènes par les canaux
cellulaires. Les vacuoles seraient alors une conséquence du
rétablissement de la pression osmotique
E) La cytotoxine peut également interférer avec
les lymphocytes T présents au niveau de la lamina
propria. (Figure n°8)
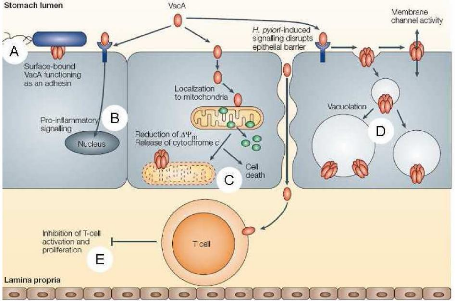
Figure n° 08 : Effets de la cytotoxine va cuolisante
Va cA. (Ferrand, 2009)
8/In vivo, l'administration de la
protéine Vac A purifiée à des souris est responsable d'une
dégénération de la muqueuse gastrique. (Figure
n°7)
9/ Les bactéries retrouvées sur
la face basale des cellules épithéliales se lient
spécifiquement aux intégrines alpha5beta1 et injectent la
protéine CagA et le peptidoglygane (PGN) via le TSS4.
10/CagA perturbe les voies de signalisation
cellulaire et modifie la morphologie épithéliale en
désorganisant les jonctions intracellulaires. La perturbation des
jonctions serrées peut jouer un rôle dans le développement
tumoral.
11/ La sécrétion de NapA et la
production de cytokines pro-inflammatoires induite par CagA et le PGN sont
responsables d'un recrutement de cellules immunitaires.
12/ H. pylori bloque également
la maturation des lymphocytes et induit leur apoptose. (Ferrand, 2009)
6-3- E chappement a la reponse immunitaire de l'hate
:
Toute infection entraîne une réponse immunitaire
à la fois humorale et cellulaire de la part de l'hôte. Toutefois
H.pylori persiste pendant longtemps dans l'estomac,
en échappant aux systèmes de défense de l'organisme.
Différents mécanismes expliquent l'échec de
la réponse immunitaire :
Le premier repose sur la saturation des anticorps opsonisants,
par une libération abondante, programmée ou non par
H.pylori, d'antigènes extrêmement
immunogènes tels que l'uréase, la catalase ou encore la
protéine de choc thermique Hsp B. (AmirTididani, 2003)
En outre le lipopolysaccharide de
H.pylori caractérisé par un faible
pouvoir endotoxique, est capable de mimétisme par la présence de
motifs antigéniques de type Lewis X ou Lewis Y également
présents à la surface des cellules épithéliales
gastriques. (Szczepanik,2006)
De plus, lors d'une infection, H.pylori
est phagocyté par les macrophages mais peut retarder cette
internalisation et rester viable après fusion des phagosomes.
La bactérie est également capable d'induire
l'apoptose des macrophages permettant une évasion de la réponse
immunitaire innée. Ces mécanismes de résistance seraient
portés par des facteurs de virulence, les souches dépourvues de
l'îlot de pathogénicité cag et du gène vacA
étant plus sensibles à la phagocytose. (Lamarque et Peek,
2003)
Enfin, H.pylori
sécrète une catalase, une superoxyde dismutase (SOD) et une
alkylhydroperoxyde-réductase qui lui permettent d'échapper aux
réactions humorales et
à la phagocytose. Ces enzymes convertissent les
radicaux libres bactéricides (en particulier H2O2) libérés
par les lysosomes des polynucléaires neutrophiles en réponse
à l'infection par H.pylori, en composés
inoffensifs tels que l'oxygène, alors que l'uréase neutraliserait
l'environnement phagolysosomial. (Ferrand, 2009)
6-4- Aspects cliniques :
La lésion de base de l'infection à H.
pylori est une gastrite, c'est-à-dire une inflammation de
la muqueuse gastrique. Elle peut persister des décennies, voire toute la
vie du sujet
mais n'est pas forcément symptomatique. Par contre, elle
peut évoluer vers les maladies suivantes :
Maladie ulcéreuse:
L'infection à H. pylori peut
évoluer dans environ 5% des cas, vers la maladie ulcéreuse. Elle
va fragiliser la muqueuse qui devient alors sensible à l'acide.
Cancer gastrique:
L'infection à H. pylori est la
première infection bactérienne associée au
développement de cancers chez l'homme. Dans moins de 1% des cas, la
gastrite va évoluer vers un carcinome gastrique.
Le lymphome du MALT (Mucosa Associated Lymphoid Tissue), autre
cancer gastrique, encore plus rare a vu son pronostic transformé depuis
la connaissance de H. pylori.
(Megraud ,2004)
Infection chronique à Helicobacter pylori
Gastrite chronique, Gastrite surtout au niveau du
acidité normale, pas corps. Acidité réduite.
Atrophie

d'atrophie. (85%) (10%)
Gastrite surtout au niveau de l'antre, pas
d'atrophie, acidité accrue.
(5%)
Pas de signe Lymphome du MALT
Clinique (0.1%)
Ulcère duodénal Gastrite atrophique

Métaplasie ulcère gastrique
Intestinale (1%)
(10%)
Dysplasie

Adénocarcinome
Figure n° 09: Pathologies gastro-intestinales
induites par l'infe ction a H. pylori. (Ferrand, 2009)
7- Diagnosti c histologique : Anatomo-pathologie
:
L'examen anatomopathologique est pratiqué sur des
coupes de biopsies gastriques colorées par coloration de Giemsa
modifiée ou par la coloration argentique. Il permet, en plus de la
détection de H.pylori, l'étude de l'état de la muqueuse et
est indispensable au diagnostic, au typage, au grading et à la
stadification des lésions associées à l'infection.
La sensibilité et la spécificité de
l'examen histologique sont toujours supérieures à 90% dans les
différentes publications scientifiques (96,8 % à100 % de
sensibilité ; et 97,7 % de spécificité).
(Amir-Tidadini,2003)
8- Diagnostic ba cteriologique :
Les méthodes de recherche de Helicobacter
pylori sont classées en « invasives » ou «
non invasives » selon qu'elles nécessitent ou non une fibroscopie
gastro-duodénale.
8-1-Méthodes invasives (dire ctes) :
Elles consistent à pratiquer plusieurs biopsies de la
muqueuse antrale ou fundique au cours d'un examen endoscopique et à
rechercher les bactéries dans ces prélèvements
biopsiques.
La mise en évidence des germes se fait par trois
méthodes différentes, souvent combinées. En règle
générale, trois biopsies sont examinées au laboratoire,
chacune d'entre elle servant à réaliser une des méthode
suivantes : ( Mégraud , 1997)
- Recherche de l'activité uréasique :
Cette technique consiste à rechercher l'activité
uréasique des germes contenus dans un fragment de biopsie en
plaçant celui-ci dans un milieu urée-indole (contenant un
indicateur coloré). En présence de l'uréase
bactérienne, l'urée est hydrolysée en
ammoniac et CO2 en quelques minutes à quelques heures. La
réaction s'accompagne de
l'alcalinisation du milieu et du virage de l'indicateur.* (Figure
n°10)
* :
http://bacterioweb.univ-fcomte.fr/bibliotheque/remic/23-Helic.pdf

Figure n°10: Test de l'urease en milieu Uree-Indol.*
- Examen direct :
Les biopsies sont soit broyées soit
dilacérées stérilement au scalpel. Le produit,
étalé sur une lame, est coloré par la méthode de
Gram. Cette méthode permet de mettre en évidence
H.pylori à la surface de
l'épithélium de la muqueuse.* (Figure n°11)
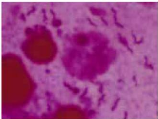
Figure n°11 : Fragment de biopsie gastrique colore
par la methode de Gram.** - Culture :
La culture est théoriquement l'examen de
référence pour le diagnostic d'une infection à H.pylori.
Elle permet essentiellement l'étude de la sensibilité aux
antibiotiques. (AmirTididani, 2003)
La biopsie est dilacérée ou broyée puis
ensemencée en milieu solide (enrichi en suppléments et agents
sélectifs). Après une incubation de 2 à 5 jours à
37° C et dans une atmosphère appauvrie en oxygène, la
croissance obtenue sur une gélose enrichie au sang se traduit par
l'apparition de colonies translucides, non pigmentées d'un
diamètre d'environ 1 mm.* (Figure n°9)

Figure n°12 : Aspects des colonies de
Helicobacter pylori sur gelose Columbia au sang. **
* :
http://bacterioweb.univ-fcomte.fr/bibliotheque/remic/23-Helic.pdf
** :
http://www.microbe-edu.org/professionel/diag/helicob.html
L'identification de H.pylori passe par
deux étapes :
- La première est une identification morphologique
après coloration de Gram.
- La seconde est basée sur l'analyse de la
présence de trois enzymes spécifiques : uréase, catalase
et cytochrome oxydase. (Mégraud,1997)
8-2- Methodes non invasives (indire ctes) :
Les méthodes indirectes ont l'avantage de ne pas
nécessiter d'endoscopie et d'être des méthodes dites «
globales », c'est-à-dire qui explorent la totalité de la
muqueuse gastrique. Elles sont sensibles et spécifiques et permettent un
suivi de l'infection. Cependant, elles ne permettent pas l'isolement des
bactéries.
- Test respiratoire à l'urée marquée :
Cette méthode consiste à mettre en évidence
l'activité uréasique de la bactérie en faisant
ingérer au patient de l'urée marquée au 13C
(isotope non radioactif), puis à détecter le
CO2 marqué dans l'air expiré. Le 13CO2
doit alors être dosé par spectrographie de masse.
Si la bactérie est présente dans l'estomac,
l'urée se scinde et libère le carbone 13 (ou 12) qui passe dans
le sang puis les poumons et se retrouve dans l'air expiré. Ce test,
fiable à plus de 98 %, présente l'avantage de rechercher la
présence de la bactérie dans la totalité de l'estomac.*
(Figure n°13)
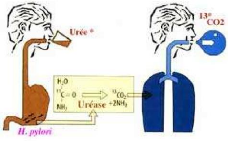
Figure n°13: Test respiratoire a l'urée
marquée.**
- Sérodiagnostic :
La sérologie consiste à détecter les
anticorps anti-H.pylori par des techniques de type
ELISA ou Western Blot. (Figure n°14)
Elle permet de définir des profils d'anticorps
sériques avec :
- la présence d'anticorps anti-Cag A (116 kD)
- la présence d'anticorps anti-Vac A (89 kD)

Figure n°14: Bandelette ELISA pour le
serodiagnostic. **
Le sérodiagnostic est utile en dépistage mais a
l'inconvénient de rester positif de nombreux mois après
éradication de la bactérie, les anticorps étant toujours
présents dans le sérum des patients.
*:
http://bacterioweb.univ-fcomte.fr/bibliotheque/remic/23-Helic.pdf
** :
http://www.microbe-edu.org/professionel/diag/helicob.html
- Recherche des antigènes fécaux :
Cette méthode récemment proposée, est un
test ELISA qui consiste à rechercher les antigènes de
Helicobacter pylori sur un échantillon de
selles.
Elle est indiquée dans le contrôle de
l'éradication à condition de respecter un intervalle de 8
semaines après arrêt du traitement. Il est surtout très
performant chez les enfants de tout âge : c'est la méthode non
invasive de choix pour ce groupe de patients. (AmirTidadini,2003)
Tableau II : Sensibilite et Specificite des methodes de
diagnostic bacteriologique (AmirTidadini,2003)
Méthodes Sensibilité
Spécificité
Test rapide à l'urée 85 à 95% 99%
Culture 80 à 90% 95 à 100%
Test respiratoire à l'urée marquée 90
à 98% 99%
Recherche des antigènes fécaux 89 à 98% >
90%
Sérologie 85 à 95% 80 à 95%
9- Traitement : sensibilite aux antibiotiques
:
Le traitement consiste en une trithérapie de 7 jours
associant un inhibiteur puissant de l'acidité gastrique : l'IPP
(inhibiteur de la pompe à protons) et deux antibiotiques, le plus
souvent l'Amoxicilline et la Clarithromycine (macrolide) ou encore le
Métronidazole, si possible guidé par l'antibiogramme. (Vilaichone
et al~,2006) (Figure n°15)
La bactérie est éradiquée dans plus de 70
% des cas après un premier traitement. Les facteurs d'échec sont
: résistance à la clarithromycine retrouvée dans 12
à 14 % des cas, mauvaise observance du traitement, âge
inférieur à 50 ans et tabagisme.
Après un traitement de deuxième ligne, 90 % des
patients sont guéris de leur infection.*

Figure n°15 : Exemple d'antibiogramme pour les ma
crolides dont l'erythromycine (E) *
* :
http://www.microbe-edu.org/professionel/diag/helicob.html
Tableau III : Resistance de Helicobacter pylori
aux antibiotiques, selon les pays. (Botuna Eleco, 2003)
|
Pays
(année)
|
No. de
tests
|
Amoxicilline
|
Métro-
nidazole
|
Cla rithro- mycine
|
Quino-
lones
|
Furazoli-
done
|
Tétra-
cycline
|
|
Afrique
|
|
Sénégal
(2009)
|
40
|
0%
|
90%
|
|
0%
|
|
|
|
Nigeria
(1999)
|
50
|
0%
|
55%
|
13%
|
13%
|
|
|
|
Asie
|
|
Inde (2003)
Inde (2005)
|
259
67
|
33%
0%
|
78%
85%
|
45%
0%
|
3%
|
0%
|
4%
7%
|
|
Asie du
Sud-est
(2006)
|
72
|
19%
|
100%
|
28%
|
7%
|
|
|
|
Taiwan
(2009)
|
227
|
0%
|
27%
|
11%
|
9%
|
|
|
|
Chine
(2007)
|
340
|
3%
|
76%
|
28%
|
|
|
|
|
Thaïlande
(2009)
|
221
|
7%
|
39%
|
3%
|
|
|
3%
|
|
Moyen Orient
|
|
Iran (2007)
Egypte
(2004)
|
101
48
|
21%
2%
|
73%
100%
|
9%
4%
|
5%
2%
|
9%
|
5%
|
|
Arabie
Saoudite
(2002)
|
223
|
1%
|
80%
|
4%
|
|
|
0 .5%
|
|
Koweït
(2006)
|
96
|
0%
|
70%
|
0%
|
|
|
0%
|
|
|
Amérique du Sud
|
|
Argentine
(2006)
|
242
|
|
|
24%
|
|
|
|
|
Colombie
(2009)
|
106
|
2%
|
82%
|
4%
|
|
|
0%
|
|
Brésil
(2002)
|
202
|
53%
|
|
9%
|
|
|
0%
|
II- Matériel et Méthodes
Notre travail est une étude prospective (février
à mai 2011) portant sur la recherche de Helicobacter
pylori , à partir de la culture de biopsies gastriques
provenant de 38 patients suivis dans les services de médecine interne et
de pédiatrie de l'hôpital Bologhine Ibn Ziri , adressés
pour une endoscopie digestive haute.
1- Materiel Biologique :
Les biopsies gastriques constituent le matériel
biologique objet de notre étude. Celles-ci sont prélevées
en salle d'endoscopie et sont acheminées au laboratoire de
bactériologie dans un délai n'excédant pas 10 minutes.
En règle générale, pour chaque patient,
deux prélèvements sont effectués : une biopsie antrale (au
niveau de l'antre) et une biopsie fundique (au niveau du fundus).
Cependant, si l'endoscopiste est contraint de mettre fin
à l'examen, en cas de reflexes nauséeux ou d'hémorragies
digestives constatées, une seule biopsie est prélevée.
Lorsqu'il s'agit de patients suivis en pédiatrie, le
protocole n'exige qu'un seul prélèvement : la biopsie antrale.
Nous avons établi, pour chaque patient, une fiche de
renseignements mentionnant outre le nom, le prénom et le sexe, la
pathologie ayant motivée la recherche de Helicobacter
pylori et les éventuels traitements actuels ou
antérieurs. (Annexe n°3)
2- Materiel non biologique : 2-1- Materiel pour le
broyage des biopsies :
- Pipette Pasteur (1mL)
- Bistouri
- Porte bistouri
- Boite de Pétri (90mm de diamètre)
- Poire en plastique
- Portoir
- Alcool (70°)
- Lames propres
2-2- Matériel pour la realisation du test rapide
a l'urée :
- Milieux Urée-Indole
- Pipette Pasteur (1mL)
- Tablette en plastique blanc
- Poire en plastique
2-3- Materiel pour l'isolement, l'identifi cation et
l'in cubation :
- Lame
- Lamelle
- Boite de Pétri (90mm de diamètre)
- Pipette Pasteur (1mL)
- Poire en plastique
- Portoir
Milieux de base :
- Flacon de gélose Columbia (180ml) (Annexe n°4)
- Sang frais humain (groupe O rhésus +)
- Supplément sélectif pour
Helicobacter pylori : Trimétoprime,
Cefsulodine
Vancomycine, Amphotéricine B (Oxoid)
Réa ctifs :
- Milieux de réaction Urée-Indole (Annexe
n°5)
- Générateurs d'atmosphère
microaérophile (Annexe n°6)
- Peroxyde d'hydrogène (H2O2)
- Disque d'oxydase (1% diméthyl para
phényléne diamine)
- Alcool (70°)
- Violet de Gentiane
- Lugol
- Fushine
2-4- Matériel pour l'étude de la
sensibilité :
- Boite de Pétri (90mm de diamètre)
- Pipette Pasteur (1mL)
- Ecouvillon stérile
- Disques d'Antibiotiques
- Pince stérile
- Poire en plastique
Milieux de base :
- Milieux Mueller-Hinton (Annexe n°7)
- Sang frais humain (groupe O rhésus +)
2-5- Matériel pour la conservation :
- Pipette Pasteur (1mL)
- Tube stérile
- Poire en plastique
- Portoir
Milieux de base :
- Gélose Columbia au sang cuit coulé en pente.
2-6- Appareillage né cessaire :
- Etuve
- Congélateur -50°C
- Réfrigérateur
- Bain-Marie
- Microscope photonique
- Vortex
- Densitomètre
- Bec Bunsen
3- Méthodes de recherche et d'identifi cation
de Helicobacter pylori :
Les biopsies gastriques étant récoltées en
salle d'endoscopie et immédiatement
transportées au laboratoire, les
prélèvements ne nécessitent pas de milieux de transport
particuliers. Ils sont déposés, lors de l'endoscopie, dans des
tubes à essai contenant uniquement de l'eau physiologique
stérile. Une fois au laboratoire de bactériologie, nous
soumettons les prélèvements à un examen direct comportant
un test rapide à l'urée, une observation microscopique à
l'état frais et une coloration de Gram. Nous procédons alors a
leur mise en culture dans des conditions favorables au développement de
Helicobacter pylori. Ces opérations se
déroulent selon le protocole suivant :
3-1- Broyage des biopsies :
- Essuyer une lame avec de l'alcool et flamber
au bec Bunsen. - Mettre la lame dans une boite de Pétri
stérile.
- Prélever et jeter l'eau physiologique
des tubes contenant les biopsies et la remplacer par du BHIB (Bouillon
coeur-cervelle)
- Pipeter les biopsies avec le BHIB et les
déposer sur une lame. - Dilacérer les biopsies
à l'aide d'un bistouri.
3-2-Realisation du test rapide a l'uree :
- Déposer une goutte de milieu Urée-Indole sur une
tablette en plastique blanc (permet d'apprécier le virage du milieu)
- Pipeter un fragment de biopsie et le déposer dans la
goutte de milieu Urée-Indole.
En présence de l'uréase bactérienne, au
bout de quelques minutes, le milieu passe du jaune-orangé au rose
fushia. (Figure n°16)
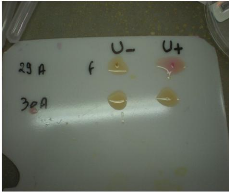
Figure n°16 : Test rapide a l'uree (photo prise au
laboratoire de bacteriologie, de l'EPH Bologhine Ibn Ziri).
3-3- Observation mi cros copique a l'état frais
:
- Essuyer une lame avec de l'alcool et flamber au bac Bunsen.
- Déposer une goutte d'eau stérile à l'aide
d'une seringue ou d'une pipette Pasteur sur la lame.
- Pipeter un fragment de biopsie et déposer sur la lame.
Observation au microscope photonique :
- Déposer une lamelle sur la lame.
- Déposer une goutte d'huile à immersion sur la
lamelle. - Observer à l'objectif x100.
L'observation d'un petit bacille incurvé avec une
mobilité caractéristique très
importante, indique la présence de
Helicobacter pylori.
3-4- Coloration de Gram : Frottis :
- Déposer une goutte d'eau distillée sur une lame
propre, à l'aide d'une seringue ou d'une pipette Pasteur.
- Pipeter un fragment de biopsie, le déposer dans la
goutte d'eau et l'étaler en
effectuant des mouvements circulaires, à l'aide d'une
pipette Pasteur.
- Laisser sécher la lame dans une boite de Pétri
stérile à température ambiante, la coloration et
l'observation se fontt le lendemain.
Coloration :
- Recouvrir le frottis de Violet de Gentiane. Laisser agir 1
minute. Rincer à l'eau.
- Verser le lugol. Laisser agir 1 minute 30. Rincer.
- Verser l'alcool (70°) goutte à goutte sur la lame
jusqu'à recouvrir tout le frottis. Laisser agir 30 secondes, puis
rincer.
- Recouvrir la lame de Fushine. Laisser agir 1 minute. Rincer.
Sécher. Observation au microscope photonique :
- Déposer une goutte d'huile à immersion sur la
lame.
- Observer à l'objectif x100.
L'observation d'un bacille de forme hélicoïdale,
coloré en rose (Gram -), indique la présence de
Helicobacter pylori.
3-5- Culture :
3-5-1- Ensemencement :
- Pipeter un fragment de biopsie et le déposer sur le
milieu Colombia au sang frais avec supplément (prélablement
coulé et incubé pendant 24 heures, à 37°C)
- Ensemencer à l'aide d'une pipette en râteau en
effectuant des mouvements circulaires sans toucher les bords de la boite de
Pétri.
3-5-2- Incubation :
L'incubation se fait dans des jarres contenant des
générateurs de microaérophilie (2 sachets par jarre). Ces
dernières sont placées dans une étuve à 37°C
pendant 2 à 15 jours.
3-6- Identification des cultures :
Les milieux ensemencés et mis à l'étuve
à 37°C en atmosphère microaérophile, sont
observés tous les deux jours pour détecter une éventuelle
croissance de colonies suspectes : petites (environ 1mm de diamètre) et
translucides. (Figure n°17)
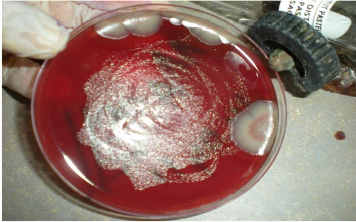
Figure n°17 : Helicobacter pylori en
primo- culture (photo prise au laboratoire de bacteriologie, de l'EPH Bologhine
Ibn Ziri).
L'identification repose sur les conditions de culture (notamment
la microaérophilie), et sur les caractères morphologiques et
biochimiques. Elle comprend les étapes suivantes :
3-6-1- Réalisation d'un frottis coloré par la
méthode de Gram : Frottis :
- Déposer une goutte d'eau distillée sur une lame
propre, à l'aide d'une seringue ou d'une pipette Pasteur.
- Prélever une colonie, la déposer dans la goutte
d'eau et l'étaler en effectuant des
mouvements circulaires, à l'aide d'une pipette
Pasteur.
- Sécher puis fixer au bec Bunsen.
Coloration :
- Recouvrir le frottis de Violet de Gentiane. Laisser agir 1
minute. Rincer à l'eau.
- Verser le lugol. Laisser agir 1 minute 30. Rincer.
- Verser l'alcool (70°) goutte à goutte sur la lame
jusqu'à recouvrir tout le frottis. Laisser agir 30 secondes, puis
rincer.
- Recouvrir la lame de Fushine. Laisser agir 1 minute. Rincer.
Sécher la lame.
Observation au microscope photonique :
- Déposer une goutte d'huile à immersion sur la
lame. - Observer à l'objectif x100.
L'observation d'un bacille de forme hélicoïdale,
coloré en rose (Gram -), isolé ou en « banc de poissons
», indique la présence de Helicobacter
pylori.
3-6-2- Recherche de la cytochrome oxydase :
- Humidifier un disque de diméthyl
paraphényléne diamine, avec une goutte d'eau distillée.
- Prélever une colonie et l'écraser sur le disque
avec une pipette Pasteur.
La présence d'une cytochrome oxydase se traduit par
l'apparition d`une coloration brunnoir sur le disque.
3-6-3- Recherche de la catalase :
- Déposer une goutte d'eau oxygénée (H2O2)
sur une lame propre.
- Prélever une colonie avec une pipette Pasteur et
déposer dans la goutte d'eau oxygénée.
La présence de l'enzyme se traduit par le
dégagement de bulles gazeuses. 3-6-4- Recherche de l'uréase :
- Déposer une goutte de milieu Urée-Indol sur une
tablette en plastique blanc . - Prélever une colonie et la
déposer dans la goutte de milieu Urée-Indol.
En présence de l'enzyme, au bout de quelques minutes, le
milieu passe du jaune-orangé au rose fushia. (Annexe)
3-6-5- Résistance à l'acide nalidixique :
Cette résistance est appréciée par la
méthode de diffusion sur gélose. (cf § 3-7)
4-Methodes d'etude de la sensibilite aux antibiotiques :
Après recherche et identification de
Helicobacter pylori, nous procédons à
l'étude de la sensibilité de la bactérie aux antibiotiques
habituellement prescrits dans les pathologies gastriques qui lui sont
liées.
Helicobacter pylori présentant
une résistance naturelle à l'acide nalidixique, nous testons cet
antibiotique pour confirmer l'identification.
4-1- Antibiogramme par la methode de diffusion sur
gelose :
4-1-1- Liste des antibiotiques testés :
- Amoxicilline
- Ciprofloxacine
- Tetracycline
- Erythromycine
- Acide nalidixique (caractère d'identification) 4-1-2-
Préparation de l'inoculum :
L'inoculum est préparé à partir de
colonies viables fraîchement identifiées dans un tube à
essai stérile contenant de l'au distillée. La turbidité
est ajustée à l'aide d'un vortex et d'un densitomètre
à 3 Mac Farland.
4-1-3- Inoculation : (méthode par écouvillonnage
ou méthode de KIRBY-BAUER)
- Plonger un écouvillon stérile dans l'inoculum et
bien l'essorer sur les rebords du tube.
- Frotter l'écouvillon sur la totalité de la
surface gélosée d'un milieu Mueller- Hinton au sang frais, de
haut en bas, en stries serrées.
- Répéter l'opération deux fois en tournant
la boîte de Pétri à 60°, à chaque fois. Finir
en en passant l'écouvillon sur toute la périphérie de la
boîte.
4-1-4-Application des disques d'antibiotiques :
Les disques d'antibiotiques sont d'abord retirés du
congélateur (-20°C), puis laissés à
température ambiante.
A l'aide d'une pince stérile, déposer les
disques, un à un, sur la gélose ensemencée, à
l'extrémité de la boite de Pétri. Pour une bonne lecture,
déposer trois disques maximum par boite.
4-1-5- Incubation :
Incuber à l'étuve à 37°C deux à
trois jours, en atmosphère microaérophile. 4-1-6-
Interprétation des résultats :
La lecture est faite après une période minimale
d'incubation de 72 heures. Si la croissance, à la surface de la
gélose, est significative et que les zones d'inhibitions sont clairement
visibles, on peut mesurer les rayons d'inhibitions à l'aide d'un pied
à coulisse métallique (les disques ayant été
déposés aux bords de la boite de Pétri) et les multiplier
par deux pour obtenir les diamètres d'inhibition. Les valeurs obtenues
sont alors interprétées en fonction d'un abaque de lecture. Si
ces conditions ne sont pas remplies, on prolonge le délai
d'incubation.
4-2- Determination de la CMI (concentration minimale
inhibitri ce) pour l'Amoxi cilline par E-test® :
4-2-1- Définition :
Le système E-test® consiste en une bande plastique
non poreuse calibrée par un gradient de concentration d'antibiotiques
contenant 15 dilutions.
Les concentrations prédéfinies sont
immobilisées à la face opposée à l'échelle
et représentent des valeurs de CMI (la CMI est définie comme
étant la plus faible concentration d'antibiotiques inhibant en 72 heures
la multiplication des bactéries).
4-2-2- Méthodologie :
La CMI est déterminée à partir du
même inoculum bactérien, après inoculation par les
mêmes méthodes et sur le même milieu que pour
l'antibiogramme par méthode de diffusion sur gélose.
Application des bandes (retirées du congélateur
puis laissées à température ambiante) :
- Déposer la bande de E-test® sur la gélose
sèche à l'aide d'une pince stérile en mettant
l'échelle de la CMI face à l'ouverture de la boîte.
- Assurer un bon contact entre la bande et la gélose en
appuyant sur la bande en partant de la base.
4-2-3- Incubation :
L'incubation se fait à l'étuve à
37°C pendant 72 heures en atmosphère microaérophile (
à condition que la croissance soit significative et que l'ellipse
d'inhibition soit clairement visible).
4-2-4- Interprétation des résultats :
La CMI est lue au point d'intersection de l'ellipse et de la
bande. 5- M6thode de conservation des sou ches :
La conservation des souches de Helicobacter pylori se fait
sur milieu Columbia au sang cuit, coulé en pente dans des tubes à
essai stériles. La gélose est ensemencée en stries
à partir des colonies obtenues en primo-culture ou à partir des
réisolements.
III-Résultats et
Discussion
1-Etude épidémiologique :
1-1-Repartition générale des resultats
: Tableau IV : Taux de positivité globale
(culture)
Nombre total de patients
|
Effectif patients positifs
|
Pourcentage
|
38
|
13
|
34,2%
|
|
D'après le tableau IV, sur un total de 38 patients
atteints de pathologies gastriques associées à
Helicobacter pylori, 13 se sont avérés
positifs après culture.
Un patient est considéré positif à
Helicobacter pylori lorsque la culture est positive.
L'examen direct (test rapide à l'urée, états frais,
coloration de Gram), quant à lui, permet d'orienter ou de confirmer le
diagnostic.
Le taux de positivité global de notre étude
(34,2%), très bas par rapport aux taux de prévalences obtenus par
des techniques de diagnostic histologique et sérologique
(supérieur à 70%) de plusieurs études algériennes,
montre que notre technique doit être améliorée. Celle-ci
n'ayant été mise en place qu'en février 2011 durant notre
stage au laboratoire de bactériologie de l'hôpital Bologhine, des
progrès au niveau du protocole et du matériel de travail peuvent
être obtenus.
1-2-Repartition des resultats en fon ction du sexe
:
Tableau V : Repartition des resultats en fon ction du
sexe (culture).
Sexe
|
Nombre
|
Pourcentage
|
Positifs
|
Pourcentage
|
Féminin
|
23
|
60,5%
|
07
|
30,4%
|
Masculin
|
15
|
39,5%
|
06
|
40%
|
Total
|
|
|
|
|
|
|
|
34,2%
|
|
38
|
|
100%
|
|
13
|
|
|
|
|
|
|
|
|
|
On note que le taux de positivité chez l'homme (40%)
est supérieur à celui retrouvé chez la femme (30,4%).
Cependant, de nombreuses études épidémiologiques
rapportent que l'infection à Helicobacter
pylori touche plus le sexe féminin (6éme
colloque sur Helicobacter pylori, 2011). Ceci
s'explique par notre faible effectif qui ne nous permet pas de conclure.
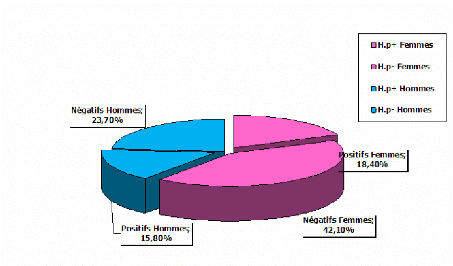
Figure no 18 : Répartition des resultats en fon
ction du sexe.
1-3- Repartition des resultats en fon ction de l!age
:
Tableau VI: Repartition des resultats en fon ction de
l!age (culture).
Age
|
Nombre
|
Pourcentage
|
Positifs
|
Pourcentage
|
[0-16]
|
04
|
10,5%
|
01
|
7,6%
|
[17-32]
|
14
|
36,8%
|
04
|
30,7%
|
[33-48]
|
07
|
18,4%
|
03
|
23%
|
[49-64]
|
07
|
18,4%
|
02
|
15,3%
|
[65-80]
|
05
|
13,2%
|
02
|
15,3%
|
[81-96]
|
01
|
2,6%
|
01
|
7,6%
|
Total
|
38
|
100%
|
13
|
100%
|
|
Le tableau ci-dessus nous montre que la tranche d'âge
la plus touchée par les infections à Helicobacter
pylori est celle de [17-32] ans avec un taux de positivité
de 30,7%, suivie par celle de [33-48] ans (23%). Ceci est probablement
lié à l'âge d'apparition des premières
manifestations gastriques motivant la consultation en
gastro-entérologie, sachant que le portage de la bactérie
augmente avec l'âge et que seuls 10% des porteurs développent des
pathologies gastriques.
En revanche les tranches d'âge les moins
touchées sont celles de [0-16] ans et [81-96] ans avec un taux de 7,6%.
Ceci s'explique par le faible effectif pour ces deux tranches d'âge, qui
ne nous permet pas de conclure.
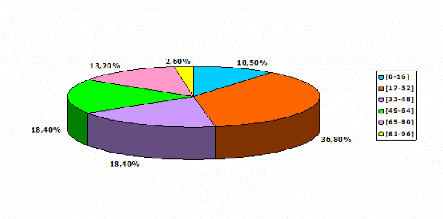
Figure n°19 : Repartition des patients adresses
pour une endos copie en fon ction des tran ches d'age.
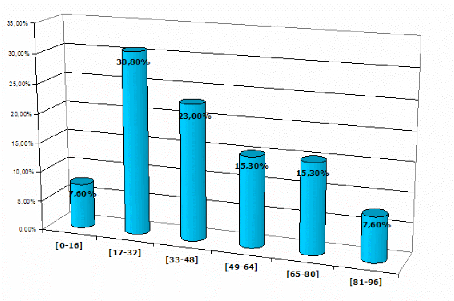
Figure n°20 : Repartition des résultats
positifs en fon ction de l'age.
1-4- Repartition des resultats en fon ction de la
pathologie ayant motivee la recherche d'Helicobacter pylori
:
Tableau VII: Association entre H.pylori et
differents types de pathologies gastriques.
Pathologies
|
Femmes (N=23)
|
Hommes (N=15)
|
Femmes
Positives
(N=7)
|
Hommes Positifs
(N=6)
|
Total F+H Positifs
|
|
%
|
N
|
%
|
N
|
%
|
N
|
%
|
|
05
|
21,7%
|
07
|
46,7%
|
03
|
42,8%
|
04
|
66,7%
|
53,8%
|
Néoplasie
|
00
|
00%
|
00
|
00%
|
00
|
00%
|
00
|
00%
|
00%
|
Lymphome
|
00
|
00%
|
01
|
6,7%
|
00
|
00%
|
00
|
00%
|
00%
|
Gastrite
|
16
|
69,6%
|
07
|
46,7%
|
04
|
57,1%
|
02
|
33,3%
|
46,2%
|
Maladie coeliaque
|
00
|
00%
|
00
|
00%
|
00
|
00%
|
00
|
00%
|
00%
|
Autres
|
02
|
8,7%
|
01
|
6,7%
|
01
|
14,3%
|
00
|
00%
|
7,7%
|
|
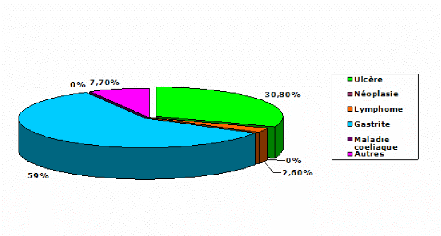
Figure n°21 : Repartition des patients en fon ction
des pathologies ayant motive la recherche de Helicobacter
pylori.
Dans notre étude, chez les patients positifs à
Helicobacter pylori aucun cas de néoplasie, de
lymphome, ou de maladie coeliaque n'a été retrouvé. En
outre, certains patients peuvent présenter une deuxième
pathologie gastrique en plus de celle liée à
Helicobacter pylori.
On remarque que les taux de positivité les plus
élevés concernent les patients atteints d'ulcères et de
gastrites avec des proportions de 53,8% et 46,2%, respectivement.
On note également que pour les patients dont l'infection
à Helicobacter pylori est
avérée, la gastrite touche plus les femmes, tandis que
l'ulcère prédomine chez les hommes.
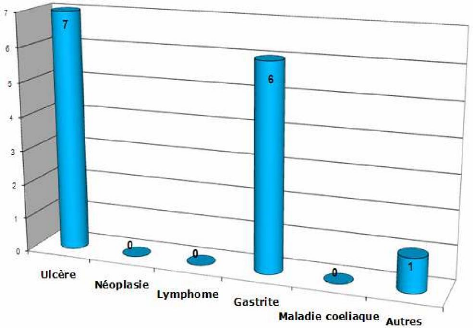
Figure no 22 : Répartition des résultats
positifs en fon ction de la pathologie.
1-5-Traitement antérieur :
Tableau VIII : Proportions de patients traités et
non traités
|
Nombre
|
Pourcentage
|
Positifs
|
Pourcentage
|
Patients traités
|
11
|
29%
|
03
|
27,3%
|
Patients non
traités
|
27
|
71%
|
10
|
37%
|
Total
|
38
|
100%
|
13
|
34,2%
|
|
D'après le tableau VIII, sur les 38 patients de notre
étude, seuls 11 ont reçu un traitement d'éradication
contre Helicobacter pylori.
Sur les 13 patients positifs à
Helicobacter pylori, 3 d'entre eux ont reçu un
traitement antérieur d'éradication. Cet échec
thérapeutique peut s'expliquer soit par une mauvaise observance du
traitement soit par une résistance des souches de
Helicobacter pylori à l'un des antibiotiques
prescrits (le traitement étant souvent donné à
l'aveugle)
Molecules utilisees :
Tableau D (: Proportion des differents traitements
administres.
TRAITEMENTS
|
Nombre de patients
(N=11)
|
Pourcentage
|
|
Amoxicilline
|
|
45,4%
|
|
|
05
|
|
|
Clarithromycine
|
|
18,2%
|
J ES
|
|
02
|
|
|
Metronidazole
|
06
|
54,5%
|
AUTRES
|
IPP
|
09
|
|
|
|
81,8%
|
|
On constate que l'antibiotique le plus administré est
le metronidazole (54,5% des patients), suivi de l'amoxicilline (45,4%). Ceci
correspond au schema thérapeuthique de première ligne
utilisé en Algérie, la clarythromicine etant prescrite en cas
d'allergie aux bêtalactamines
L'IPP (inhibiteur de la pompe à protons) est
systématiquement associé à l'antibiothérapie
d'éradication de Helicobacter pylori.
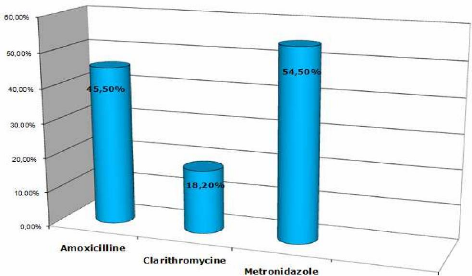
Figure n°23 : Répartition des antibiotiques
administrés.
2-Etude bacteriologique :
2-1-Repartition des resultats en fon ction du site
anatomique de prelevement :
Tableau X : Repartition des resultats en fon ction du
site anatomique de prelevement.
Sites
|
Nombre de
prélèvements reçus
|
Positifs
|
Pourcentage de patients positifs
|
Antre
|
37
|
13
|
35%
|
Fundus
|
33
|
11
|
33,3%
|
Total
|
|
|
|
|
|
34, 3%
|
|
70
|
|
24
|
|
|
|
|
|
|
|
Le tableau X nous montre qu'il n'y a pas de différence
significative entre les taux de positivité, à la culture, des
prélèvements antraux et fundiques. Néanmoins nous avons
noté, durant notre étude, des cultures plus abondantes pour les
prélèvements antraux. Ceci corrobore les données de la
littérature où il est rapporté que
Helicobacter pylori infecte
préférentiellement l'antre (6éme colloque sur
Helicobacter pylori, 2011).
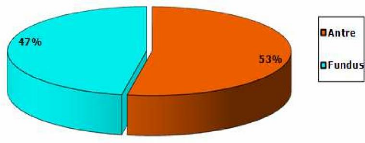
Figure n°24 : Repartition des prelevements en fon
ction du site anatomique. 2-2- Resultats de l'examen direct :
Tableau XI : Positivite aux examens directs
(N=70)
Examens directs
|
N
|
Fundus
%
|
N
|
Antre
%
|
N
|
TOTAL (N=70)
%
|
Coloration de Gram
|
21
|
63,6 %
|
24
|
64,9%
|
45
|
64, 3%
|
Test rapide à l'urée
|
19
|
57,6 %
|
25
|
67,6 %
|
44
|
62,8%
|
Mobilité
|
29
|
87,9 %
|
34
|
91,9 %
|
63
|
90%
|
|
On remarque que les taux de positivité aux
différents examens directs sont nettement plus importants que ceux de la
culture seule. Ceci s'explique par le fait que ces tests soient
réalisés immédiatement après le
prélèvement, sur des bactéries fraichement
prélevées, non encore confrontées à des conditions
défavorables à leur survie.
On remarque également que le taux de positivité
le plus élevé concerne l'étude de la mobilité
(90%). Ce taux peut s'expliquer par la présence de bactéries
contaminantes mobiles provenant de la flore oro-pharyngée des patients
ou des contaminations du matériel d'endoscopie qui peuvent souiller la
lame et induire de faux positifs.
La coloration de Gram et le test rapide à
l'urée représentent respectivement 64, 3% et 62,8% de
positivité. Ces taux se rapprochent de ceux retrouvés dans
différentes études algériennes sur la prévalence de
l'infection à Helicobacter pylori.
(6éme colloque sur Helicobacter
pylori, 2011)
On remarque également une positivité plus
importante aux différents tests rapides pour les
prélèvements antraux. Ce qui coïncide avec les
données de la littérature qui rapportent que
Helicobacter pylori est retrouvé de
manière plus abondante dans l'antre, cette bactérie ayant un
tropisme particulier pour les cellules antrales. (6éme
colloque sur Helicobacter pylori, 2011)
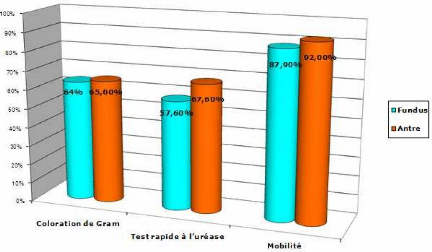
Figure n°25 : Pourcentages de positivite aux
examens directs. 2-3- Ftesultats de la Culture :
Tableau XII : Pourcentage de positivite de la
culture.
|
Fundus
|
Antre
|
Total
|
Culture
|
Positifs
|
Positifs
|
|
|
(N=33)
|
(N=37)
|
(N=70)
|
Nombre
|
11
|
13
|
24
|
Pourcentage
|
33%
|
35%
|
34, 3%
|
|
On note un taux de positivité à la culture de
34,3% ce qui concorde avec le taux de
positivité rapporté au
nombre de patients (34,2%). Sur les 38 cas adressés, 13 souches
ont
été identifiées et seules 10 ont pu être
isolées et purifiées (Figure n°26). En effet
pour trois des patients, une contamination importante
à rendu les cultures inexploitables (Figure n°27). Ceci s'explique
par des contaminants pouvant provenir du matériel d'endoscopie, de la
flore oro-pharyngée des patients, des poches de sang servant la
préparation des milieux de culture, ou de l'environnement
(matériel, manipulateur, ambiance). Il est à noter
également que ces bactéries contaminantes sont forcément
résistantes aux différents antibiotiques contenus dans le milieu
de culture spécifique à Helicobacter
pylori.
Lors de notre étude, nous avons remarqué que pour
un patient dont on traite les deux prélèvements (antral et
fundique), la positivité est retrouvé pour les deux sites.
Figure n°26 : Reisolement de Helicobacter
pylori (Photo prise au laboratoire de bacteriologie de l'EPH
Bologhine).

Figure n°27 : Contamination d'une primo culture
de Helicobacter pylori (Photo prise au laboratoire de bacteriologie de
l'EPH Bologhine).
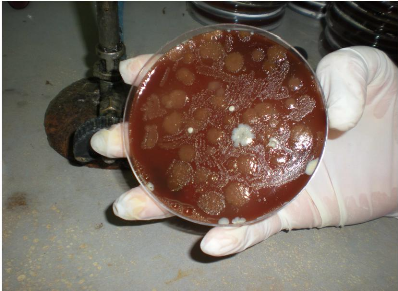
Figure n° 28: Contamination d'un reisolement de
Helicobacter pylori (Photo prise au laboratoire de bacteriologie de l'EPH
Bologhine).
2-4- Résultats des antibiogrammes :
Tableau XIII : Résultats des
Antibiogrammes
Antibiotique
|
Diamètre
|
Interprétation (S / R)
|
Patient 1
|
Amoxi cilline Ciprofloxa cine Tetracycline Erythromy
cine Acide nalidixique
Rifampi cine
|
Fundus
82 mm 58mm 72mm 60mm
< 0.6mm 56mm
|
Antre 82 mm 58mm 72mm 60mm
< 0.6mm 56mm
|
Fundus
S S S S
R
S
|
Antre
S S S S
R
S
|
Patient 2
|
Amoxi cilline Ciprofloxa cine Tetracycline
Erythromy cine
Acide nalidixique
Rifampi cine
|
92mm
40mm
96mm
< 0.6mm < 0.6mm 64mm
|
92mm
40mm
96mm
< 0.6mm < 0.6mm 64mm
|
S
S
S
R
R
S
|
S
S
S
R
R
S
|
|
Sur les 10 souches isolées, seulement deux
antibiogrammes ont pu être réalisés. En effet plusieurs
difficultés ont été rencontrées :
Les repiquages successifs des souches avant réalisation
de l'antibiogramme induisent l'apparition de formes coccoides non
cultivables.
Dans certains cas, une suspension de 3 Mac Farland n'a pas pu
être réalisée même après réisolement en
raison de contaminations envahissant toute la surface gélosée.
(Figure n°28)
Le lot de milieu Mueller- Hinton utilisé durant notre
stage semble déficient, et ne permet donc pas la croissance de
Helicobacter pylori, étant une bactérie
exigeante.
Des problèmes de contaminations sont survenus, le milieu
Mueller-Hinton étant riche et non séléctif.
On remarque une résistance à l'erythromycine pour
le patient 2, et une bonne sensibilité globale pour les 2 souches avec
de grandes zones d'inhibition.
On note également une résistance des 2 souches
à l'acide nalidixique, celle-ci étant un caractère
d'identification de Helicobacter pylori.
2-5- Ftesultats de l'etude de la CMI :
L'étude des CMI pour l'amoxicilline par E-test n'a pas
pu être réalisée pour les raisons suscitées.
Conclusion
Conclusion :
Notre étude a permis de contribuer à la mise en
place d'un poste de culture de Helicobacter pylori au
sein du laboratoire central de biologie de l'hôpital Bologhine Ibn Ziri.
Un protocole de recherche et d'étude de la sensibilité aux
antibiotiques de cette bactérie a été
élaboré.
Sur 38 patients prélevés, ce dernier a permis de
cultiver 13 souches différentes, d'en isoler et purifier 10 et d'obtenir
2 antibiogrammes exploitables pour le traitement.
Le faible taux de positivité à la culture
(34,2%) comparé aux résultats que nous avons obtenu à
l'examen direct (environ 63%) qui sont corroboré par les taux de
prévalence d'environ 70% retrouvés dans les études
algériennes (estimé par les méthodes
histologique et sérologique), indique que notre protocole
de culture induit un nombre non négligeable de faux négatifs.
Le caractère « capricieux » de
Helicobacter pylori nécessite certainement une
optimisation de notre protocole et exige une observation plus stricte de la
qualité du matériel utilisé.
Malgré le modeste taux de réussite de la culture
de Helicobacter pylori, cette étude
prospective nous montre qu'un investissement dans l'amélioration du
protocole est souhaitable pour permettre d'établir, in
situ, des profils de résistance aux antibiotiques
nécessaires à l'orientation du traitement et de ce fait,
réduire l'acquisition de nouvelles résistances induites par le
traitement à l'aveugle.
References
Bibliographiques
- Amir Tidadini Z.C., 2003- Pathologies gastriques et
infections à Helicobacter pylori :
Thése pour l'obtention du diplôme de doctorat d'état en
sciences médicales à la faculté de Médecine
d'Alger. pp 13-34.
- Bergey's Manual of systematic bacteriology,2001.
Deuxième édition.
- Botuna Eleco E., 2003- Prévalence de l'infection
à Helicobacter pylori en milieu rural
québécois : Mémoire présenté à la
Faculté des études supérieures de l'Université
Laval pour l'obtention d'un diplôme de maîtrise en
épidémiologie. pp 14-15.
- Fauconnier A., 1998- Génétique et biologie
moléculaire de Helicobacter pylori : des
approches efficaces pour aborder la pathogénicité de la
bactérie. In : Acta endoscopica. v 28 ; pp 165-173.
- Ferrand J. et Ménard A., 2009- Helicobacter
pylori dans un modèle de carcinogenèse gastrique
impliquant les cellules souches mésenchymateuses : Thèse pour
l'obtention du diplôme de doctorat à l'Université Bordeaux
2. pp 32-49.
- Flandrois J.P., 1997- Bactériologie médicale.
Presse universitaire de Lyon. pp 216-18.
- Gerhard M., Rad R., Prinz C. et Michael Naumann- Pathogenesis
of Helicobacter pylori infection. In: The year in Helicobacter
pylori 2002, v7. pp 17-23.
- Lamarque D. et Peek R.M., 2003- Pathogenesis of
Helicobacter pylori infection. In: The year in
Helicobacter pylori 2003. v8. pp 21-30.
- Lamarque D., 2001- Les facteurs de virulence de
Helicobacter pylori: quelle importance?. In :
Gastroentérologie Clinique et Biologique, v25. pp 1079-1081.
- Leclerc H., 2006- Epidemiological aspects of
Helicobacter pylori infection. In: Pubmed.
- Mégraud F., 1997- Diagnostic bactériologique
standard de l'infection à Helicobacter
pylori.In : Helicobacter pylori : v1,
Epidémiologie, Pathogénie, Diagnostic. pp 249-266.
- Mégraud F., 2004- Cours de Bactériologie
Médicale, centre national de référence des
Campylobacter et
Helicobacter.
- Mégraud F.,2005- The Helicobacter
pylori saga ending with the Nobel Prize. In: ESCMID mars
2005.p15.
- Mitchell H. et Mégraud F.,2002- Epidemiology and
diagnosis of Helicobacter infection. In: The year in
Helicobacter 2002. v7. pp8-13.
- O'Rourke J. et Bode G., 2001- Morphology and ultrastructure of
Helicobacter pylori. In: Pubmed.
- Raymond J., Nguyen V.B., Vidal-Trecan G. et Kalach N., 2005-
Infection à Helicobacter pylori chez l'enfant
dans les pays en développement. In : Med Trop. pp383-388.
- Szczepanik M., 2006- Interplay between
Helicobacter pylori and the immune system: clinical
complications. In: Pubmed.
- Vilaichone R.K., Mahachai V., Graham D.Y., 2006-
Helicobacter pylori diagnosis and management. In :
PubMed
- 6 éme colloque sur Helicobacter
pylori , Laboratoire Algérien de Recherche sur
Helicobacter- Alger, Palais de la Culture Moufdi
Zakaria, 20 Février 2011.
Annexes :
Annexe n°1 : Coloration de Giemsa.
Coloration qui repose sur l'action complémentaire de
deux colorants neutres et sur l'affinité des éléments
cellulaires pour les colorants acides ou basiques. Ces colorant neutres sont
:
- Le May-Grünwald, neutre, contenant un colorant acide,
l'éosine , et un colorant basique, le bleu de
méthylène.
- Le Giemsa, neutre, contenant lui aussi de l'éosine , et
un colorant basique, l'azur de méthylène .
Annexe n°2 : Coloration argentique
Technique basée sur la capacité des membranes et
parois cellulaires à s'imprégner d'argent. Elle permet
d'épaissir le corps bactérien et de mieux le visualiser.
Annexe no 3: Fiche de renseignements

Annexe n°4 : Composition du milieu Columbia
Polypeptones : 17,0 g/L
Peptone pancréatique de coeur : 3,0
g/L Amidon de maïs : 1,0 g/L
Chlorure de sodium : 5,0 g/L
Extrait de levure : 3,0 g/L
Agar : 13,5 g/L
pH = 7,3 +/- 0,2
Annexe n°5 : Composition du milieu urée
-idole
L-tryptophane : 3 g
Urée : 20 g
Monophydrogénophosphate de potassium : 1 g
Dihydrogénophosphate de potassium : 1 g
Chlorure de sodium : 5 g Éthanol à 95 °GL :
10 ml Rouge de phénol : 25 mg Eau distillée : 1 l
Annexe n°6 : composition du milieu
Mueller-Hinton
infusion de viande de boeuf:300,0 ml peptone de
caséine:17,5 g
amidon de maïs:1,5 g
agar: 17,0 g pH = 7,4
53
Glossaire :
Adenocarcinome : Tumeur maligne
développée aux dépens d'un épithélium
glandulaire.
Alkylhydroperoxyde-reductase : Enzyme dont La
fonction est de protéger H. pylori par
réduction d'hydroperoxydes organiques toxiques.
Antigene lewis a, b : antigènes libres
dans le plasma et autres liquides biologiques, adsorbés sur les
érythrocytes (antigènes des groupes sanguins).
Antigene lewis x, y : antigènes
présents sur les membranes des leucocytes et des cellules
endothéliales.
Carcinome : Cancer développé
à partir d'un tissu épithélial (peau, muqueuse).
Cytokine : Substances solubles de communication
synthétisées par les cellules du système immunitaire (les
lymphocytes T) ou par d'autres cellules et/ou tissus, agissant à
distance sur d'autres cellules pour en réguler l'activité et la
fonction.
Dysplasie : Malformation ou déformation
résultant d'une anomalie du développement d'un tissu ou d'un
organe, qui survient au cours de la période embryonnaire ou après
la naissance.
Grading : Détermination du grade.
Intégrine alpha5 beta 1 :
Protéine transmembranaire qui intervient dans les interactions entre les
molécules d'adhésion sur les cellules adjacentes et/ou la matrice
cellulaire.
Lamina propria : Membrane
située au dessous de l'épithélium de la muqueuse,
constituée essentiellement d'un épithélium et d'un
chorion, et accessoirement de fibres élastiques musculaires, de glandes,
de villosités, etc., selon la muqueuse considérée.
Lymphome : Cancer du système lymphatique
aux dépens des lymphocytes.
Metaplasie : Transformation d'un tissu
cellulaire différencié en un autre tissu cellulaire
différencié.
Super oxyde-dismutase : Enzyme dont la fonction
est de protéger H. pylori par réduction
d'hydroperoxydes organiques toxiques.
54
Liste des abréviations :
· ADN: Acide
désoxyribonucléique.
· Alp: Adhesion associated protein.
· Bab A: Blood group antigen binding
protein.
BHIB: Beef Heart Infusion Broth, bouillon Coeur
cervelle. Cag A: Cytotoxin associated gene.
CMI: Concentration minimale inhibitrice.
ELISA: Enzyme Linked Immunoadsorbent Assay.
H.pylori: Helicobacter
pylori
Hsp: Heat Shock Protein, protéine du choc
thermique. IL-8 : Interleukine 8
MALT: Mucosa Associated Lymphoid Tissue, tissu
lymphoïde associé aux muqueuses.
Nap A: Neutrophile associated protein.
RM : Rouge de
méthyle.
Sab A: Sialic acid-binding adhesion.
SOD: Super oxyde-dismutase.
Tip: TNS inducing protein.
TSS4: Système de sécrétion
type 4.
Vac A: Active vacuolating cytotoxin, cytotoxine
vaccuolisante.
VP: Voges proskauer.
55
| 


