|
SOMMAIRE
|
ABREVIATION
|
..4
|
|
INTRODUCTION
|
6
|
|
GENERALITE
|
8
|
A. MICROBIOLOGIE DES INFECTIONS EN STOMATOLOGIE ET
CHIRURGIE
|
MAXILLO-FACIALE
|
9
|
|
1) LE MILIEU BUCCAL
|
9
|
|
2) LA FLORE BUCCO-DENTAIRE
|
9
|
|
3) NOTION DE GERMES PATHOGENES
|
10
|
|
4) PATHOGENIE
|
.12
|
|
B. ANTIBIOTIQUES
|
14
|
1) DEFINITION
|
...14
|
2) CLASSIFICATION DES ANTIBIOTIQUES
|
.14
|
3) REGLE D'UTILISATION DES ANTIBIOTIQUES
|
|
21
|
|
|
C. ASPECTS CLINIQUE ET THERAPEUTIQUE DES INFECTIONS EN
STOMATOLOGIE ET CHIRURGIE MAXILLO-FACIALE 25
|
|
1) LA CARIE DENTAIRE
|
25
|
|
2) LES CELLULITES
|
26
|
|
3) LES OSTEITES
|
27
|
|
4) LES STOMATITES
|
29
|
|
5) LES SOUS-MAXILLITES
|
.29
|
|
6) LES PAROTIDITES
|
.30
|
|
7) LA THROMBOSE VEINEUSE FACIALE ET CEREBRALE
D'ORIGINE
|
|
|
MAXILLOFACIALE
|
31
|
|
8) LA SINUSITE MAXILLAIRE D'ORIGINE DENTAIRE
|
33
|
|
9) LE NOMA
|
35
|
|
10) L'ULCERE DE BURULI
|
...35
|
|
11) LA SURINFECTION POST OPERATOIRE
|
.36
|
|
NOTRE ETUDE
|
...38
|
|
MATERIEL ET METHODE
|
39
|
1) TYPE D'ETUDE
|
40
|
2) LIEU D'ETUDE
|
40
|
3) POPULATION ETUDIEE
|
..40
|
4) METHODE
|
|
40
|
|
RESULTATS 42
COMMENTAIRES 72
CONCLUSION 78
RECOMMANDATIONS. 80
BIBLIOGRAPHIE ...83
ANNEXE 87
ABREVIATION
CHU : Centre Hospitalier Universitaire
CES : Certificat d'Études
Spécialisées
IRM : Imagerie par Résonnance
Magnétique Max : maximal
Min : minimal
OMS : Organisation Mondiale de la
Santé
SIDA : Syndrome de l'Immunodéficience
Acquise TDM : Tomodensitométrie
VIH : Virus de l'Immunodéficience humaine
STAPH : Staphylococcies
Ac : Acide
AMOX : Amoxicilline
CLAV : Clavulanique
PENI : Pénicilline
INF : Inferieur
SUP : Supérieur
STOMATO : Stomatologie CMF :
Chirurgie maxillo-faciale
INTRODUCTION
De part sa situation anatomique et son rôle
physiologique, la cavité buccale est l'un des sites les plus septique du
corps humain ; elle contient une flore microbienne et fongique dense et
très variées (plus de 500 germes répertoriés
jusqu'à présent) [1].
En 1998, une étude réalisée dans le
service de stomatologie et chirurgie maxillo-faciale du CHU de Treichville
[2] montrait que les pathologies infectieuses de la face et de
la cavité buccale représentaient environ 18,15% de l'ensemble des
consultations et occupaient le troisième rang des motifs de
consultations.
Une autre étude [3]
réalisée dans le service de stomatologie et chirurgie
maxillo-faciale du C.H.U. de Cocody montrait une prévalence d'environ
28,5% des affections infectieuses. Elles venaient en deuxième position
des motifs de consultation et représentaient la première cause de
mortalité.
La plupart de ces infections ont un pronostic
sévère du fait soit d'une prise en charge tardive, soit du manque
de moyen financier, soit de l'association de certains facteurs de risques
(diabète, hypertension artérielle, cardiopathie,
dénutrition...)
Devant cette situation et :
> L'insuffisance de travaux concernant
l'écosystème microbien en Côte d'Ivoire,
> L'utilisation systématique des antibiotiques sans
examens microbiologique
> L'absence de recommandations (type ANDEN [4],
AFSSAPS [5] C.H. TOURCOING
[6]) que nous ne pouvons pas suivre à la lettre parce que ne
tenant pas compte de notre contexte épidémiologique, il nous est
apparu opportun d'effectuer une étude du profil bactériologique
des infections en stomatologie et chirurgie maxillo-faciale avec pour :
Objectif général
Déterminer les différents profils
bactériologiques en stomatologie et chirurgie maxillo-faciale.
Objectifs spécifiques
· Identifier les germes responsables d'infection en
stomatologie et chirurgie maxillo-faciale.
· Déterminer le niveau de résistance des
germes isolés vis-à-vis des antibiotiques.
· Etablir la corrélation entre les résultats
cliniques et microbiologiques.
· Proposer des schémas thérapeutiques.
GENERALITES
A. MICROBIOLOGIE DES INFECTIONS EN STOMATOLOGIE ET
CHIRURGIE MAXILLO-FACIALE
1) LE MILIEU BUCCAL
La bouche constitue une entité unique, carrefour de la
plupart des échanges entre le corps et le milieu extérieur. Ce
milieu est constitué par :

La salive
Le mucus
Les produits de desquamations épithéliales
La population microbienne.
A l'état sain 300 espèces différentes
peuvent résider dans la bouche et 100 autres y sont constamment
présentes. Ce qui confère un caractère écologique
unique à la plus grande partie de la flore bactérienne de la
cavité buccale, c'est son organisation sous forme de plaque dentaire, au
sein de laquelle les bactéries établissent des interactions, tant
entre elles qu'avec leur environnement, à savoir le milieu buccal. Cette
flore est dite commensale, c'est à dire vivant normalement dans la
bouche, mais pouvant devenir pathogène par opportunité à
la suite d'un déséquilibre [7].
Le déséquilibre aura diverses incidences :
· La moins connue est le passage d'une partie de la
flore dans le sang, créant une bactériémie. Selon les
principes de sélection, d'acquisition, certaines bactéries
peuvent se fixer sur des organes lésés et créer ainsi un
foyer infectieux secondaire.
· La plus connue est la carie dentaire
2) LA FLORE BUCCO-DENTAIRE [8]
La flore bucco-dentaire constitue un écosystème
complexe riche en bactéries. Cette flore varie selon :
a) LES CONDITIONS PHYSICO-CHIMIQUE
Le milieu buccal présente des conditions optimales
pour le développement de la flore microbienne, qui y est a l'abri de la
lumière et des agents chimiques concentrés. La température
de 37°C est des plus favorables. L'air s'y renouvelle
constamment, les aérobies y sont favorisés, les anaérobies
végètent cependant dans les replis de la muqueuse où le
taux d'oxygène est suffisamment abaissé.
b) L'AGE
Dès la naissance, la flore buccale, inexistante in utero,
va se constituer à partir de l'environnement et principalement au
contact de la mère lors du maternage. Des bactéries sont
présentes transitoirement ; certaines colonisent de façon durable
la bouche et la langue de l'enfant en adhérant à des surfaces
grâce à des récepteurs spécifiques. A ce stade,
l'immaturité immunologique autorise cette première colonisation.
Ensuite, la première denture augmentera significativement le nombre
potentiel de niches et sites de fixation des bactéries, de même
que le sillon gingival permettra d'autres colonisations en atmosphère
anaérobie. Durant les premières années de la vie, la flore
buccale est sans cesse remaniée jusqu'à l'apparition de la
denture définitive [9]
A la vieillesse, avec la perte des dents, la flore
complète persiste dans les endroits voisins des dents qui restent.
c) LES CONDITIONS D'HYGIENE BUCCO-DENTAIRE
Si la cavité buccale est tenue dans de bonnes conditions
hygiéniques, la flore dominante est représentée par
environ 70% de bactéries aérobies et micro-
aérophiles dont 40% de streptocoques non groupables pour 30%
d'anaérobies stricts. En cas de mauvais état de la denture, les
germes anaérobies tels que les spirochètes, les bacilles
fusiformes prédominent
d) NYCTEMERE
Le nombre de germes dans la cavité buccale n'est pas
constant. Il présente dans 24 heures des fluctuations d'un rythme
régulier. A chaque déglutition on avale des germes ce qui
entraîne une réduction des germes. Lors des différents
repas la mastication et la déglutition entraînent une chute du
nombre des germes.
3) NOTION DE GERMES PATHOGENES
On distingue
deux variétés de bactéries :
a) BACTERIES PATHOGENES On les retrouve au
Cours des pathologies générales. Leur présence est
liée à une affection spécifique. On
cite :

Streptocoque bêta- hémolytique du groupe A
Staphylococcus aureus
b) BACTERIES COMMENSALES DEVENUES PATHOGENES
Les bactéries commensales de la cavité buccale peuvent
devenir pathogènes et entraîner des infections buccodentaires dans
certaines conditions :

par une effraction de la muqueuse
par un phénomène d'anachorèse : tropisme des
bactéries pour les foyers inflammatoires initialement non microbiens.
par des passages successifs d'un sujet à un autre
par une exaltation en cavité close : infections
radiculaires.
par une association à d'autres germes (streptocoques non
groupables + flore de VEILLON) ou à la mucine salivaire.
par une mutation
Tableau I : FLORE DOMINANTE DE LA CAVITE BUCCALE
[10]

4) PATHOGENIE
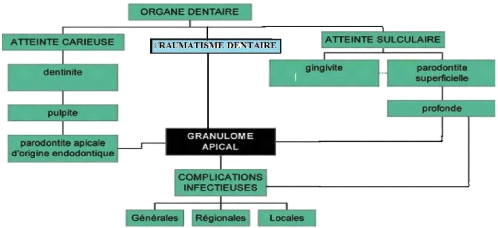
Figure 1 : Les voies de propagation de l'infection dentaire. II
est sous la dépendance de deux facteurs
a) LES FACTEURS INTRINSEQUES PROPRES AUX GERMES
Ils sont en rapport avec :

la virulence et le potentiel de multiplication de la
bactérie. la toxicité par
la production d'exotoxines ou d'endotoxines.
la sécrétion enzymatique bactérienne et la
libération de poisons à faible poids moléculaire qui
peuvent être :

antigéniques : hémolysines, hyaluronidases,
fibrinolysines.
non antigéniques : coagulases, amines de
décarboxylation, lactates, déshydrogénases,
pyrophosphatases. orthophosphatases
b)


LES FACTEURS EXTRINSEQUFS C'est :
I `ensemble des conditions extérieures aux germes et qui
favorisent l'infection o Diabète.
o déficits immunitaires (infections à VIH.)
o grossesse
o état de la cavité buccale
o drépanocytose
Les facteurs iatrogènes
o les anti-inflammatoires : leur rôle aujourd'hui est
indéniable dans la virulence des germes et l'aggravation des infections
banales.
En effet, les anti-inflammatoires inhibent la synthèse des
prostaglandines qui entraînent une inhibition des réactions
inflammatoires avec une baisse de l'afflux des cellules inflammatoires et une
baisse de la sécrétion des
facteurs solubles, ce qui occasionne une levée de la
barrière biologique (immunodépression) et une diffusion de
l'infection.

Les immunosuppresseurs la radiothérapie
B. ANTIBIOTIQUES
1- DEFINITION
substance chimique, produite par un organisme vivant, qui,
administrée à un organisme, peut bloquer la croissance d'autres
microorganismes ou même les détruire sans intoxiquer l'hôte.
Sont regroupés en famille selon leur structure, leur mode d'action, leur
spectre antibactérien, leur pharmacocinétique et leurs effets
secondaires
2- CLASSIFICATION DES ANTIBIOTIQUES [11] La
classification des antibiotiques est basée sur leur mode d'action.
a) 1e CIBLE : LA PAROI
i. BETALACTAMINES
1' LES PÉNAMS (pénicillines)
- Groupe G : de la pénicilline G
Spectre : cocci Gram + et cocci Gram -,
bacilles Gram +.
Chef de file :
|
Benzylpénicilline : Pénicilline G 1944
|
Formes dites "retard" :

Benzylpénicilline procaïne :
Bipénicilline (semi-retard : 12 heures) Benzathine
benzylpénicilline : Extencilline (long-retard : 15 jours)
Formes orales :

Phénoxypénicilline (Pénicilline V) :
Oracilline, Ospen 1958 - Groupe M : des
pénicillines anti staphylococciques
Spectre : celui de la pénicilline
G ; moins actifs, ces produits ne sont pas inactivés par la
pénicillinase staphylococcique.
D'où leur indication : les infections à
staphylocoques producteurs de pénicillinase.

Oxacilline : Bristopen 1963 Cloxaciline :
Orbénine 1976
- Groupe A : de l'amino-benzylpénicilline
(Ampicilline)
Spectre : élargi à certains
bacilles à Gram négatif ; inactivées par les
pénicillinases, y compris celle du staphylocoque.
Inactives sur le groupe KES et Pseudomonas
aeruginosa.

Ampicilline : Totapen 1965
Amoxicilline : Agram, Ospamox, Clamoxyl, Flémoxine,
Hiconcil Bacampicilline : Bacampicine, Penglobe
Métampicilline : Suvipen
Pivampicilline : ProAmpi
- groupe des
acyl-uréido-pénicillines
Spectre : élargi à certains
bacilles à Gram négatif ; inactivées par les
pénicillinases, y compris celle du staphylocoque.
Actives sur Pseudomonas aeruginosa et sur certaines souches
productrices de céphalosporinases (en particulier Proteus).
uréido-pénicillines :

Azlocilline : Sécuropen
Mezlocilline : Baypen 1980 Pipéracilline :
Pipérilline 1980
carboxy-pénicilline :

Ticarcilline : Ticarpen (H) 1981
- Groupe des amidino-pénicillines
Spectre : limité aux bacilles
à Gram négatif (Entérobactéries)
Pivmécillinam : Sélexid 1982
- Groupe des Pénams, inhibiteurs des
bétalactamases
Activité antibactérienne faible.
Inhibe la majorité des pénicillinases (et les
bétalactamases à spectre élargi).
N'inhibe par contre qu'un faible nombre de
céphalosporinases.
Oxapénam
Acide clavulanique

associé à l'amoxicilline : Augmentin, Ciblor
1984 associé à la ticarcilline : Claventin 1988
Pénicilline-sulfones
Sulbactam : Bétamase (H) 1991

associé à l'ampicilline : Unacim 1992
Tazobactam

associé à la pipéracilline :
Tazocilline (H) 1992
v' LES PÉNEMS : CARBAPÉNEMS
Spectre : spectre large.

Grande stabilité vis à vis de diverses
bétalactamases. Imipénème : Tiénam (H)
1993
v' LES CÉPHEMS
Ce sont tous des produits à large
spectre, mais dont l'intérêt réside surtout dans
leur activité sur les bacilles à Gram
négatif.
Les céphalosporines sont classées en trois
catégories, selon l'histoire (Trois "générations"), leur
spectre et surtout leur comportement vis à vis des
céphalosporinases.
- Céphalosporines de 1°
génération (C1G)
Spectre : relativement résistantes
aux pénicillinases ; détruites par les céphalosporinases
Inactives sur Pseudomonas aeruginosa.
Actives par voie orale :

Céfalexine : Céporexine,
Kéforal, Céfacet 1970 Céfadroxil :
Oracéfal 1976
Céfaclor : Alfatil 1981
Céfatrizine : Céfaperos 1983
Inactives par voie orale
|
Céfalotine : Kéflin (H) 1968
Céfapyrine : Céfaloject 1974 Céfazoline :
Céfacidal 1976
|
- Céphalosporines de 2°
génération (G)
Spectre : relative résistance
à certaines céphalosporinases ; léger gain
d'activité sur les souches sensibles. Inactives sur Pseudomonas
aeruginosa.

Céfoxitine : Méfoxin (H) 1978
Céfamandole : Kéfandol (H) 1979 Céfotétan
: Apacef (H) 1985

Céfuroxime : Cépazine (VO),
Zinnat (VO) 1988 - Céphalosporines de
3° génération (C3G)
Spectre : accentuent les avantages des
précédentes : résistance accrue à l'inactivation
par les céphalosporinases ; gain d'activité sur les souches
sensibles.
Certaines (*) sont actives sur Pseudomonas
aeruginosa.

Céfotaxime : Claforan (H) 1980
Cefsulodine (*) : Pyocéfal (uniquement
anti pyocyanique) (H) 1981
Céfopérazone (*) : Céfobis
(H) 1982
Céfotiam : Pansporine (H) ; Taketiam,
Texodil (VO) 1983
Ceftazidime (*) : Fortum (H) 1986 Ceftriaxone :
Rocéphine 1985 Céfixime : Oroken (VO) 1988
Cefpodoxime : Cefodox (VO), Orelox (VO) 1991
Céfépime (*) : Axépim (H)
1993
v MONOBACTAMS
Spectre : actif uniquement sur les
bacilles à Gram négatif
Y compris Pseudomonas aeruginosa.
- Aztréonam : Azactam (H) 1988
ii. FOSFOMYCINE
Spectre large : cocci Gram + et cocci
Gram -, bacilles Gram + et bacilles Gram -. La fosfomycine est toujours
utilisée en association pour éviter l'apparition de mutants
Fosfocine (H) 1980

On utilise, par voie orale, dans le traitement mono dose de la
cystite aigüe chez la femme jeune :
iii. GLYCOPEPTIDES
Spectre étroit : les
bactéries à Gram + et principalement : staphylocoques et
entérocoques (voie IV). Traitement de la colite pseudomembraneuse
(VO)

Vancomycine : Vancocine (H) 1985 Teicoplanine :
Targocid (H) 1988
b) 2e CIBLE : LA MEMBRANE Ce sont des
antibiotiques de nature polypeptidique.
i. POLYMYXINES
Spectre : actifs sur les bacilles
à Gram négatif

Colistine : Colimycine 1959
ii. GRAMICIDINES ET TYROCIDINE
Spectre étroit : bactéries
à Gram positif

Bacitracine : usage local Tyrothricine : usage local
c) 3e CIBLE : LE RIBOSOME
i. AMINOSIDES
Spectre large : cocci et bacilles
à Gram positif (sauf les streptocoques) ; cocci et
bacilles à Gram négatif, mycobactéries. Peu
ou pas actifs sur les anaérobies.

Streptomycine : Streptomycine Diamant 1949 Kanamycine
1959
Tobramycine : Nebcine, Tobrex 1974
Amikacine : Amiklin (H) 1976
Sisomicine : Sisolline 1980
Dibékacine : Débékacyl,
Icacine 1981
Nétilmicine : Nétromycine 1982
AMINOCYCLITOL

Structure apparentée aux aminosides. Son usage est
limité au traitement de la blennorragie gonococcique. Spectinomycine :
Trobicine 1974
ii. GROUPE DES "M L S"
Spectre assez comparable à celui
de la pénicilline G : cocci Gram + et cocci Gram -, bacilles Gram +.
Totalement inactifs sur les entérobactéries et sur
Pseudomonas.
v' MACROLIDES

Spiramycine : Rovamycine 1972
Erythromycine : Ery, Erythrocine, Erycocci
1979 Josamycine : Josacine 1980

Roxithromycine : Rulid 1987 Clarithromycine :
Zéclar 1994 Azithromycine : Zithromax 1994

v' LINCOSAMIDES
Lincomycine : Lincocine 1966 Clindamycine : Dalacine
1972
v' SYNERGISTINES
- utilisés comme anti
staphylococciques

Virginiamycine : Staphylomycine 1963 Pristinamycine :
Pyostacine 1973
- ou en cas d'infections à bactéries Gram +
résistantes aux autres antibiotiques dans les indications
suivantes :
o pneumonies nosocomiales
o infections de la peau et des tissus mous
o infections cliniquement significatives à Enterococcus
faecium résistant à la vancomycine

Dalfopristine-Quinupristine : Synercid 2000
iii. PHÉNICOLÉS
Spectre large y compris rickettsies et
chlamydiae

Chloramphénicol : Tifomycine 1950
Thiamphénicol : Thiophénicol, Fluimucyl
antibiotic 1962
iv. TÉTRACYCLINES
Spectre large mais résistances
fréquentes. Actives sur les germes à développement
intracellulaire y compris rickettsies, chlamydiae et mycoplasmes.

Tétracycline : Hexacycline 1966
Doxycycline : Vibramycine, Vibraveineuse, Monocline
1970 Minocycline : Minocine, Mestacine 1974
v. ACIDE FUSIDIQUE

Spectre limité : surtout
utilisé comme anti staphylococcique Acide fusidique : Fucidine
1965
vi. OXAZOLIDINONES
Spectre : antibiotiques
bactériostatiques réservés aux traitements des infections
à Gram + résistants aux traitements habituels.
|
Linézolide : Zyvoxid 2001
|
d) 4e CIBLE : BLOCAGE DE L'ARN-POLYMÉRASE i.
RIFAMYCINES
Spectre large : mycobactéries
(M. tuberculosis, M.leprae), coccidé Gram +
et -, Bactéries à Gram +, divers bacilles à Gram
négatif (dont Brucella). Les rifamycines sont actives sur les
germes à développement intracellulaire.

Rifamycine SV : Rifocine 1966 Rifampicine : Rifadine
1969
e) 5e CIBLE : L'ADN
i. QUINOLONES
Spectre limité aux
bactéries à Gram négatif à l'exception de
Pseudomonas aeruginosa

Acide nalidixique : Négram 1968 Acide
oxolinique : Urotrate 1974 Acide pipémidique : Pipram
1975
ii. FLUOROQUINOLONES Spectre
élargi au Pseudomonas et aux bactéries à Gram
positif, notamment les staphylocoques.

Fluméquine : Apurone 1978 Péfloxacine :
Péflacine 1985 Norfloxacine : Noroxine 1986 Ofloxacine
: Oflocet 1987 Ciprofloxacine : Ciflox 1988 Enoxacine :
Enoxor 1993 Sparfloxacine 1994
Levofloxacine : Tavanic 1998 Moxifloxacine :
Izilox 2000
iii. PRODUITS NITRÉS
Pro drogues dont certaines bactéries peuvent
réduire le radical (-NO2) ce qui fait apparaître un
dérivé toxique pour l'ADN par substitutions de bases ou
cassures.
v' OXYQUINOLÉINES
Spectre large, utilisés dans le
traitement des infections urinaires ou intestinales :
|
Nitroxoline : Nibiol 1969 Tilboquinol :
Intétrix 1969
|
v' NITROFURANES
Spectre large, utilisés dans le
traitement des infections urinaires ou intestinales :

Nitrofurantoïne : Microdoïne,
Furadantine 1971 Nifuroxazide : Ercéfuryl 1972
v' NITRO-IMIDAZOLÉS
Spectre limité aux
bactéries anaérobies, surtout les bacilles Gram - et les bacilles
Gram + sporulés

Métronidazole : Flagyl 1971
associé à la spiramycine : Rodogyl 1972
Ornidazole : Tibéral (H) 1984
f) 6e CIBLE : LA SYNTHESE DE L'ACIDE FOLIQUE
i. SULFAMIDES
Spectre théoriquement large, mais
résistances fréquentes

Sulfadiazine : Adiazine 1945 Sulfaméthisol :
Rufol 1949
ii. TRIMÉTHOPRIME
Spectre large, résistances
beaucoup moins fréquentes

Utilisé seul :
Triméthoprime : Wellcoprim 1982

Ou associé à un sulfamide :
Bactrim, Eusaprim, Bactékod 1971
3- REGLES D'UTILISATION DES ANTIBIOTIQUES
a) GENERALITES
Un antibiotique doit assurer une concentration « efficace
» au niveau du site infectieux pendant une période de temps
adéquate.
> L'antibiothérapie est soumise à de nombreuses
contraintes :


L'émergence de souches résistantes doit être
évitée par une politique de réserve (utilisation
réservée des nouvelles molécules). Les relations entre
consommation d'antibiotique et émergence de résistance
bactérienne sont établies à l'hôpital comme en
ville [12], [13], [14], [15], [16], [4].
Le contrôle des choix thérapeutiques par un
antibiogramme est souhaitable si le prélèvement
bactériologique et son exploitation sont possibles.
> Le choix d'une antibiothérapie dépend de cinq
critères : bactério-pharmacologie, pharmacocinétique,
terrain du patient, tolérance et écologie. Ces
critères doivent être connus de tous les prescripteurs.
b) CRITERES BACTERIO-PHARMACOLOGIQUES >
Situations de prescription d'un antibiotique :

Détermination d'un ou des germe(s) responsable(s) de
l'infection ;
Présomption avec une forte probabilité de
l'existence d'un ou des germe(s) responsable(s) de l'infection (situations
cliniques spécifiques d'un germe précis)
Evaluation d'un risque potentiel d'extension ou de
dissémination de l'infection lors d'un acte invasif
déterminé.
> Antibiotiques bactériostatiques et
bactéricides :
Paramètres de laboratoire permettant de mesurer la
sensibilité des germes aux antibiotiques

Concentration Minimale Inhibitrice (CMI) : concentration la plus
faible d'antibiotique capable d'inhiber toute la multiplication
bactérienne après 18 heures de culture à
37°C.
Concentration Minimale Bactéricide (CMB) : concentration
la plus faible d'antibiotique capable de laisser un pourcentage de
bactéries survivantes inférieur ou égal à 0,01%
après 18 heures à 24 heures de culture à
37°C in vitro.
> Durée de traitement :
En pratique générale, certaines études ont
validé des durées d'antibiothérapie en fonction de
l'évolution de l'infection et du terrain du patient. Ce n'est pas le cas
en odontologie et stomatologie.
Une durée excessive d'un traitement antibiotique
accroît le risque de pression de sélection sur la flore
bactérienne et émergence de souches multi résistantes aux
antibiotiques. Une durée trop courte est aussi critiquable.
L'arrêt d'une antibiothérapie est
plus souvent déterminé par des critères de
guérison clinique que par la négativation des
prélèvements bactériologiques.
> Doses thérapeutiques :
Nécessité de prescrire des posologies
suffisantes afin de garantir une efficacité antibiotique.
L'association de deux antibiotiques n'est justifiée que
dans certaines infections et certaines complications (endocardites,
septicémies à bactéries à Gram -, Gram +,
cellulites...).
De l'association de deux antibiotiques peut résulter :

- une synergie, par exemple lactamines et aminosides, lactamines
et métronidazole ; - une addition, par exemple lactamines et
fluoroquinolones ;
- un antagonisme.
c) CRITERES PHARMACO-CINETIQUES
L'antibiotique doit être efficace au site de
l'infection. Au niveau du foyer infectieux, la concentration tissulaire doit
être au moins égale à la CMI et si possible à la CMB
pour les germes identifiés ou suspectés. Les paramètres
pharmacocinétiques des antibiotiques doivent être connus
> Absorption :
Pour l'obtention d'un effet systémique, l'utilisation de
la voie orale nécessite une absorption du principe actif par les
muqueuses digestives. Certains antibiotiques non résorbés au
niveau du tube digestif doivent être utilisés par voie
parentérale si une action systémique est souhaitée.
> Diffusion et demi-vie d'élimination
:
La connaissance de la qualité de la diffusion
tissulaire et cellulaire des antibiotiques doit guider le choix du
prescripteur. Les critères de demi-vie d'élimination, de liaison
aux protéines plasmatiques, de taux sérique et de volume apparent
de distribution, sont pris en compte pour définir la posologie et le
rythme d'administration.
> Biotransformation et élimination
:
La majorité des antibiotiques est
métabolisée en métabolites actifs ou inactifs avant
d'être éliminée par voie biliaire, fécale ou
urinaire.
d) CRITERES LIES AU TERRAIN
> Insuffisance rénale :
La plupart des antibiotiques sont éliminés de
façon prédominante ou exclusive par voie rénale.
L'insuffisance rénale peut être responsable d'une accumulation du
produit avec risques toxiques extra-rénaux ou rénaux. Les
posologies doivent être adaptées à la fonction
rénale, notamment pour les glycopeptides, les aminosides, l'amoxicilline
et le métronidazole ; la tétracycline doit être
évitée.
> Insuffisance hépatique :
Il est important d'utiliser de préférence des
produits peu ou non métabolisés. On se doit d'éviter les
produits hépatotoxiques comme la clindamycine, et de diminuer ou
éviter l'utilisation des antibiotiques fortement
métabolisés et ayant une élimination biliaire importante
comme les macrolides et le métronidazole.
> Allergie :
L'allergie connue à un antibiotique contre-indique son
administration.
> Nouveau-nés et enfants :
Une administration impose une adaptation en fonction du poids et
une surveillance du traitement antibiotique liés à une
pharmacologie particulière associée au développement de
l'organisme, une immaturité enzymatique et des risques
spécifiques de complications.
> Femmes enceintes et allaitantes
:
Si une prescription antibiotique est justifiée au cours de
la grossesse, on prescrira d'abord l'amoxicilline, puis les macrolides, le
métronidazole et enfin l'association amoxicilline - acide clavulanique,
et ceci à tous les stades de la grossesse.
> Personnes âgées :
La pharmacocinétique des antibiotiques diffère de
celle du sujet jeune. Des recommandations spécifiques concernant la
prescription pluri médicamenteuse chez la personne âgée de
plus de 70 ans ont été proposées par un groupe de travail
de l'ANDEM en 1994[17] ou figurent également dans
certains Résumés Caractéristiques des Produits.
e) CRITERES DE TOLERENCE
A efficacité équivalente, il convient de choisir
l'antibiotique le mieux toléré, d'où l'importance de
connaître la tolérance des différentes familles
d'antibiotiques ainsi que les interactions médicamenteuses pour
prescrire une antibiothérapie à bon escient.
f) CRITERES ECOLOGIQUES OU PRESSION DE
SELECTION
> Le spectre d'activité des antibiotiques
:
Un antibiotique est défini par son spectre,
c'est-à-dire par les espèces bactériennes sur lesquelles
il exerce une action bactéricide ou bactériostatique. Le spectre
est d'autant plus large que le nombre d'espèces bactériennes
sensibles à cet antibiotique est grand. Chaque fois que cela est
possible, il faut donner la priorité à l'utilisation d'un
antibiotique à spectre étroit, et limiter l'utilisation des
antibiotiques à spectre large, fortement inducteurs de
résistances.
> Les résistances aux antibiotiques :
La résistance peut être :

Bactériologique :
Une résistance bactérienne est définie par
une élévation de la CMI d'un antibiotique vis-à-vis d'une
souche par rapport à la CMI du même antibiotique vis-à-vis
de la population sauvage de cette même espèce. Une souche devient
résistante lorsqu'elle peut survivre au contact d'une concentration
antibiotique habituellement efficace, ce qui ne signifie pas que l'antibiotique
soit devenu inefficace. La catégorisation clinique de cette souche
s'effectue par comparaison aux concentrations critiques définies par le
communiqué annuel du Comité de l'Antibiogramme de la
Société Française de Microbiologie. Il existe des paliers
de niveaux dans cette résistance bactériologique. Lorsque la
tolérance du patient à l'antibiotique l'autorise, des posologies
plus fortes permettent de dépasser certains paliers et de surmonter
certains niveaux de résistance (adaptation phénotypique).

Clinique :
Une résistance est liée dans certains cas à
une impossibilité d'atteindre au niveau du foyer infectieux une
concentration antibiotique suffisante alors que l'antibiotique est
adapté. Un échec clinique est défini par une persistance
des signes cliniques.
> Quel est le rôle des antibiotiques dans
les résistances acquises ? Les antibiotiques sont
susceptibles de :

Favoriser la prolifération des germes déjà
résistants, en détruisant les germes sensibles (ce
phénomène est communément appelé « pression de
sélection » des antibiotiques sur la flore bactérienne de
l'environnement) ;
Sélectionner les bactéries commensales porteuses de
plasmides, y compris des bactéries saprophytes (tube digestif) ;
Sélectionner également des mutants
résistants.
Les antibiotiques à spectre large peuvent rompre
l'équilibre en détruisant la flore de barrière, surtout
aux niveaux cutané et digestif. Ceux-ci sont dangereux pour la flore
intestinale, car ils favorisent la transmission des
plasmides de résistance sélectionnés par
pression de sélection, d'où le risque non négligeable de
prolifération de bactéries multi résistantes à
potentiel pathogène.
La multi résistance des bacilles à Gram
négatif et des coccidé à Gram positif est à
l'origine d'infections et de surinfections tres difficiles à
maîtriser. Il existe une forte corrélation entre la consommation
d'antibiotiques et la fréquence des résistances à ces
mêmes antibiotiques.

g) PRINCIPES DE PRESCRIPTION D'UN ANTIBIOTIQUE
Prescrire une antibiothérapie uniquement s'il existe une
indication
Ne pas substituer un antibiotique à une chirurgie
appropriée (drainage) Choisir l'antibiotique de rapport
bénéfice/risque le plus favorable
Choisir l'antibiotique efficace avec un spectre le plus
étroit possible
Effectuer un prélèvement avec antibiogramme lorsque
c'est possible et exploitable Prescrire une posologie adéquate (à
dose et durée suffisantes)
Choisir l'antibiotique avec le moins d'effets indésirables
possibles
Choisir le médicament le moins cher, à
efficacité égale.
C. ASPECTS CLINIQUE ET THERAPEUTIQUE DES INFECTIONS
EN
STOMATOLOGIE ET CHIRURGIE MAXILLO-FACIALE
1- CARIE DENTAIRE
a) DEFINITION
Infection bactérienne non spécifique qui
détruit progressivement la dent de la superficie en profondeur et abouti
à la formation d'une cavité.
b) ÉTIOLOGIE
C'est sans conteste l'alimentation qui joue le rôle
favorisant le plus important (glucides : sucres). Dans le développement
de la carie dentaire, on peut isoler une condition principale :
- la présence de débris alimentaires glucidiques,
Les espaces interdentaires, toutes régions qui échappent au
nettoyage mécanique de la langue et des joues. Dans ces endroits, les
bactéries prolifèrent et entraînent la formation d'acides
qui attaquent l'émail dentaire.
c) CLINIQUE Plusieurs formes cliniques sont
distinguées :

La carie de l'émail : elle est
asymptomatique et montre une simple rugosité à l'inspection et au
sondage
La carie de la dentine (dentinite) : l'atteinte
de la dentine est marquée par une douleur brève, plus ou moins
modérée, inconstante et localisée à la dent. Cette
douleur est provoquée par le froid et le chaud, les aliments
sucrés ou acides.
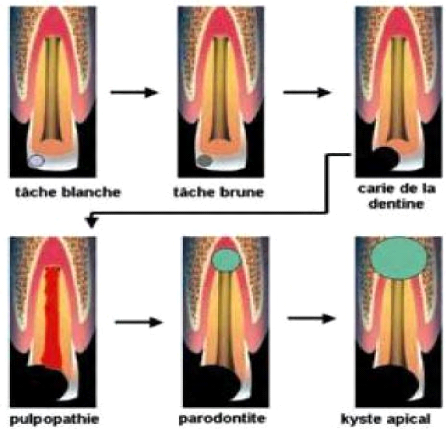
Figure 2 : Génie évolutif de la carie
dentaire.
d) PARACLINIQUE
Le cliché rétro-alvéolaire et le
panoramique ou orthopantomogramme dentaire montrent la lésion carieuse
sous forme d'une lacune radio transparente et permettent surtout l'exploration
parodontale et apicale (granulome ou kyste péri apical).
e) ÉVOLUTION En l'absence de traitement,
elle se fait vers une inflammation de la pulpe dentaire ou pulpopathie.
2- CELLULITES [18]
a) DEFINITION
Les cellulites péri maxillaires sont des infections du
tissu cellulaire de la face à point de départ dentaire ou
péri dentaire. Elles constituent en milieu tropical un chapitre
important de la pathologie infectieuse maxillofaciale.
b) ETIOLOGIE
Les cellulites compliquent le plus souvent une nécrose
pulpaire, l'infection diffusant à travers l'os alvéolaire pour
gagner les régions sous-périostées et au-delà les
loges musculaires ou graisseuses. D'autres causes dentaires sont possibles :
complications de parodontopathie, évolution de péricoronarite.
Des causes non dentaires peuvent donner des tableaux
équivalents : fracture, ostéite, infection de kyste...
c) CLINIQUE
|
le stade oedémateux associe douleurs, tuméfaction
inflammatoire sous muqueuse et sous-cutanée, trismus
modéré
le stade suppuré est très caractéristique :
douleurs continues avec trismus, signes généraux,
tuméfaction volumineuse fluctuante, gardant le godet adhérente au
plan profond
l'évolution se fait le plus souvent vers la fistulisation
spontanée qui pourra précéder le passage à la
chronicité
|
|
d) FORMES TOPOGRAPHIQUES [10]
Elles sont très nombreuses et dépendent de la
localisation de l'apex dentaire par rapport aux corticales osseuses et aux
insertions musculaires.
Schématiquement, on peut distinguer :

à la mandibule les formes vestibulaire,
temporo-massétérine, pelvi-buccale sus et
sousmylohyoïdienne, sous-mandibulaire
au maxillaire les formes palatine, jugale et orbitaire lorsque
la dent causale est la canine ou la prémolaire.
e) EVOLUTION
fistulisation ou chronicisation avec persistance d'un nodule
sous-cutané
aggravation des signes locaux et généraux en
particulier sur des terrains favorisants (diabète, baisse de
l'immunité)
diffusion réalisant une cellulite faciale associant des
signes locorégionaux (infiltration pelviglosse, infiltration cervicale),
et des signes généraux de type choc septique. L'évolution
peut être fatale en l'absence de traitement rapidement bien conduit.
f) TRAITEMENT
traitement médical : il repose sur une bi
antibiothérapie associée à un antalgique pur. Un
traitement anti-inflammatoire ne sera jamais prescrit [19].
le traitement consistera à une incision
drainage de l'abcès par voie cutanée et/ou vestibulaire ainsi que
l'extraction de la ou des dents causales.
3- OSTEITES [20]
a) DEFINITION
L'ostéite correspond à une affection inflammatoire
du tissu osseux, qu'il s'agisse d'une infection microbienne ou d'une atteinte
parasitaire ou chimique.
Les causes des ostéites des os de la face sont
essentiellement microbiennes et locales tout particulièrement
dento-alvéolaires. Les pathologies infectieuses générales
ne donnent que de façon exceptionnelle des localisations
maxillo-mandibulaires. La flore microbienne causale
retrouvée est très variée. (Staphylococcus aureus,
Staphylococcus epidermidis, genres Streptococcus,
Lactbacillus, Fusobacterium et Klebsiella)
[44]
b) OSTEITE CIRCONSCRITE
Alvéolite post-extraction : quelques jours après
l'extraction d'une molaire survient une douleur très violente de
l'alvéole qui est le plus souvent sèche, parfois comblée
par un bourgeon charnu inflammatoire.
La recherche d'un petit séquestre osseux ou d'une racine
oubliée par un examen radiologique sera systématique. Dans ce
cas, une révision alvéolaire sera nécessaire en
complément du traitement médical.
c) Ostéite diffuse de la mandibule
Le tableau clinique associe douleurs mandibulaires souvent
irradiées (otalgies, syndrome général
modéré, tuméfaction mandibulaire douloureuse). Il existe
très souvent une anesthésie labio-mentonnière (signe de
Vincent).
Sur le plan radiologique, l'origine dentaire est plus ou moins
évidente (la dent a pût être extraite). Il existe une
modification de la trame osseuse qui apparaît gommée. A un stade
plus avancé, un séquestre osseux pourra être
observé.
d) Evolution
La chronicisation est la règle en l'absence de traitement
parfaitement adapté. L'ostéite évolue alors au long cours
avec des poussées inflammatoires régulières
séparées d'un intervalle libre plus ou moins asymptomatique.
L'image radiologique est de plus en plus évidente avec
l'apparition d'un ou plusieurs séquestres qui peuvent parfois
s'extérioriser.
e) Traitement
> traitement étiologique : extraction
de la dent causale, révision du foyer alvéolaire, contention
ou
nouvelle ostéosynthèse en cas d'ostéite
traumatique...
> traitement médical :

Antibiothérapie [21]
Le choix de l'antibiotique est soumis aux contraintes habituelles
d'activité bactériologique présumée et d'obtention
de concentration efficace dans le foyer d'infection. (Fluoquinolone, aminoside,
beta lactamines, imidazole...)

Antalgiques
Ils doivent être utilisés dans toute la gamme
croissante nécessaire afin de soulager les patients des douleurs
quasiment constantes lors des ostéites, surtout à la phase de
début. On respecte les différents paliers d'indication classique
pour leur emploi, allant du paracétamol jusqu'aux morphines vraies.

Héparines et thrombolytiques [22]
Le rôle de l'hypo vascularisation et de l'ischémie
locale dans la genèse et surtout dans l'extension des ostéites
est bien connu. Ceci a conduit à proposer l'usage d'héparine et
de streptokinase pour le traitement des ostéomyélites
infectieuses. Ce protocole semble intéressant, spécialement pour
les récidives aiguës et les formes d'ostéomyélites
chroniques diffuses. Ce protocole permettrait de diminuer le nombre et
l'importance des gestes chirurgicaux.
> traitement chirurgical : ablation des
séquestres, décortication de la table externe de la mandibule.
4- STOMATITES [23]
Les stomatites sont dominées par les infections des tissus
de soutien des dents dont l'élément superficiel est
représenté par les gencives.
a) DIAGNOSTIC Le bilan diagnostique, clinique
et radiographique définit différents aspects
anatomo-cliniques.
> Gingivites érythémateuses
aiguës
> Gingivites érythémateuses
chroniques
> Gingivite gravidique associant
érythème, oedème et hémorragie >
Gingivites ulcéronécrotiques
> Parodontites
b) Traitement
> Préventif
Il repose sur un contrôle rigoureux de l'hygiène
bucco-dentaire avec élimination quotidienne de la plaque
dentaire


> Curatif
Elimination de la plaque avec conseils au patient pour un
meilleur contrôle ultérieur de cette dernière,
détartrage complet et minutieux des dépôts
calcifiés, polissage des surfaces dentaires, obturations, traitements
chirurgicaux des poches parodontales et abcès dentaires, avulsions
dentaires, remodelages osseux, élévations de lambeaux...
Les solutions antiseptiques pour bains de bouche sont des
adjuvants utiles. Les antibiotiques. (macrolide, bétalactamines,
aminoside,....)
5- SOUS-MAXILLITES
Évolue souvent dans un contexte de lithiase.
|
a) LA WHARTONITE (SIALODOCHITE OU INFECTION
CANALAIRE)
Douleur et tuméfaction importante du plancher
buccal Gène aux mouvements de la langue, trismus
Fièvre modérée
L'ostium salivaire est rouge et oedematié laissant sourdre
spontanément ou à la palpation une goutte de pus.
|
b) 
LA PERIWHARTONITE OU ABCES PERICANALAIRE DU PLANCHER DE
LA BOUCHE
Douleur intense, pulsatile et s'accompagne de trismus, de
dysphagie et de signe généraux importants Tuméfaction sus
mylo-hyoïdienne et refoulement de la langue du côté sain
La ponction ramène du pus
c) LA SOUS MAXILLITE (SIALADENITE OU INFECTION
GLANDULAIRE)
Infection de la glande sous mandibulaire

Tuméfaction sus hyoïdienne et unilatérale du
plancher buccal descendant jusqu'à la base du cou, ferme et
douloureuse
Emission de pus à l'orifice salivaire, turgescent.
SCHEMA THERAPEUTIQUE
> Antibiothérapie (beta lactamines, imidazole,
fluoquinolone....) > Agent sécrétant
> Au stade de collection : incision
> Dissection canalaire si calcul antérieure
> Sous-maxillectomie en cas de lithiase postérieure
6- PAROTIDITES
a) LA PAROTIDITE AIGUË MICROBIENNE
Elle survient lors d'une détérioration de
l'état général avec déshydratation. Elle est
favorisée par une cause locale : infection dentaire ou stomatite
(infection canalaire ascendante). Elle débute par une douleur à
la mastication, puis une douleur spontanée à l'angle de la
mandibule, avec température élevée. Il existe un
gonflement rétro mandibulaire en général
unilatéral, soulevant le lobule de l'oreille. La peau est rose et
oedematié. L'orifice du canal de Sténon est rouge avec issue de
pus.
L'évolution est favorable sous antibiotiques et
anti-inflammatoires avec éventuellement une réhydratation. Elle
peut néanmoins se faire vers la suppuration avec micro abcès, ou
passer à la chronicité avec sclérose glandulaire, sur des
terrains particulièrement fragiles.
b) LA PAROTIDITE LITHIASIQUE SURINFECTEE Elle
est rare car la lithiase parotidienne est beaucoup moins fréquente que
la lithiase sous-maxillaire. La radiographie panoramique et surtout
l'échographie en permettent le diagnostic.
c) LES PAROTIDITES CHRONIQUES NON
SPECIFIQUES.
Rares, elles sont dues à une infection canalaire
ascendante dont le trouble initial est mal connu. Elles se traduisent par des
poussées de tuméfaction avec douleurs à la mastication. La
parotide est hypertrophiée et douloureuse à la palpation.
7- THROMBOSE VEINEUSE FACIALE ET CEREBRALE D'ORIGINE
MAXILLOFACIALE
a) DEFINITION
Les thrombophlébites craniofaciales (TPCF) sont une
entité anatomoclinique dont la première description remonte
à plus de 150 ans. Leur connaissance a évolué de
manière radicale au cours de la deuxième moitié de ce
siècle, au point qu'il soit utile d'en changer la
dénomination.
Si l'on a pu jusqu'alors parler de TPCF en raison de leur
origine infectieuse dans 95 % des cas, il faut aujourd'hui parler de thrombose
veineuse faciale (TVF) et cérébrale (TVC), concept
reflétant mieux la diversité étiopathogénique de ce
tableau clinique.
Les premières sont devenues rares avec la maîtrise
des problèmes infectieux, les secondes, d'étiologies plus
variées, sont moins exceptionnelles pourvu que l'on veuille bien s'y
intéresser.
b) ETIOLOGIE Il s'agit de processus infectieux
locorégionaux que nous regroupons en foyers infectieux :

buccodentaire ; ORL ;
tégumentaire ;
> Foyers infectieux buccodentaires
La mandibule est aussi souvent concernée que le
maxillaire. En revanche, si toutes les dents peuvent être
incriminées à l'étage maxillaire, seules les molaires, et
plus particulièrement les dents de sagesse au niveau de l'étage
mandibulaire, peuvent être à l'origine de telles thromboses
veineuses.
La dent est alors le point de départ d'une cellulite, soit
circonscrite dans un premier temps diffusant aux espaces celluleux voisins
secondairement, soit diffuse d'emblée, redoutable, pouvant emporter le
malade en 48 à 72 heures. Dans les deux cas, des complications majeures
peuvent survenir : tableau de toxi-infection maligne avec choc septique ou
complication embolique locorégionale.
> Foyers infectieux
tégumentaires
Une lésion cutanée située au niveau de la
face, du cuir chevelu, d'origine traumatique (plaie souillée) ou
dermatologique (staphylococcie de la lèvre supérieure ou de
l'aile du nez) peut être le point de départ d'une cellulite
diffusée.
> Foyers infectieux ORL
Les otomastoïdites ont fourni un contingent important de
TVC, surtout chez l'enfant. Ici aussi, l'avènement des antibiotiques a
totalement modifié la fréquence et l'expression clinique des
complications qui nous intéressent.
c) MANIFESTATIONS CLINIQUES
> Thromboses veineuses faciales
Elles concernent le réseau veineux superficiel avec la
veine faciale ou la veine ophtalmique. Encore focalisée, la
thrombophlébite de la veine faciale se traduit par un oedème du
pli nasogénien diffusant ensuite à
l'angle interne de l'oeil. La palpation retrouve un cordon
induré et l'évolution se fait vers le développement d'une
tuméfaction très sensible du canthus interne. Une atteinte de la
canine est parfois retrouvée. L'atteinte de la veine ophtalmique associe
un oedème de la paupière supérieure, un chémosis
séreux, puis une exophtalmie
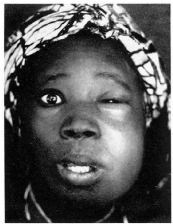
Figure 3 : Cellulite jugale compliquée d'une
thrombose de la veine faciale.
> Thromboses veineuses
cérébrales
Tous les sinus veineux peuvent être concernés par
l'extension d'un thrombus intéressant leur réseau d'amont.
L'atteinte du sinus caverneux est caractérisée par
l'apparition de façon aiguë d'une infection générale
sévère avec hyperthermie intense, céphalées
frontales et orbitaires, oedème palpébral.
Le patient développe par la suite un ptosis, un
chémosis et une ophtalmoplégie douloureuse unilatérale
(paralysie oculomotrice intrinsèque et extrinsèque). Il s'y
associe une baisse de l'acuité visuelle avec dilatation veineuse au fond
d'oeil. La branche ophtalmique du trijumeau est parfois atteinte. La
présence d'un syndrome confusionnel peut être retrouvée.
L'atteinte du sinus caverneux, autrefois liée à des infections
cutanées (staphylococcie maligne de la face), est actuellement le plus
souvent secondaire à une pathologie sinusienne (sphénoïdale,
ethmoïdale, maxillaire) ou focale de la face (infections buccodentaires et
de l'orbite).
d) TRAITEMENT
Le traitement des TVC d'origine maxillo-faciale comporte deux
volets : un volet préventif et un volet
curatif.
> Traitement préventif

Prévention de l'infection
Prévention des TVC d'origine traumatique
> Traitement curatif
Il reste controversé, mais depuis quelques années
un consensus semble se dégager. Il fait appel au traitement des
complications de la TVC.

Les TVC septiques relèvent d'un traitement antibiotique de
première intention : céphalosporines de 3e
génération associées au métronidazole.
Devant une comitialité secondaire à la TVC, le
traitement anti comitial est de rigueur.
|
L'HIC fait appel aux corticostéroïdes.
Le traitement de la TVC par lui-même sur
l'héparinothérapie
|
8- SINUSITE MAXILLAIRE D'ORIGINE DENTAIRE
La sinusite maxillaire d'origine dentaire est une réaction
inflammatoire de la muqueuse du sinus maxillaire consécutive à
une infection d'origine dentaire. Forme étiologique fréquente (40
%) de sinusite maxillaire, elle s'oppose aux sinusites d'origine nasale dont
elle partage une partie de la symptomatologie. Le traitement impose, sous peine
d'échec, de traiter conjointement sinus et dent.
a) RAPPEL ANATOMIQUE : LES DENTS SINUSIENNES
Les dents en rapport intime avec le plancher du sinus sont
les prémolaires et les molaires supérieures (par ordre de
fréquence : les 6, les 5, les 7, puis les 4. La mince couche d'os
spongieux séparant les apex dentaires de la muqueuse sinusienne diminue
avec l'âge et avec l'édentement (procidence du sinus, classique
après la perte des premières molaires).
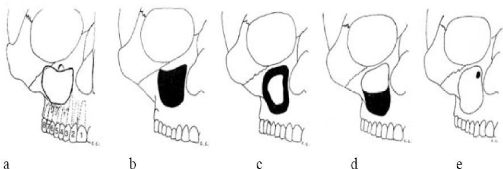
Figure 4 : Différents aspects radiologiques des
sinusites maxillaires d'origine dentaire :
a. Les dents « sinusiennes ». b à c.
Différents aspects radiologiques des sinusites maxillaires d'origine
dentaire.
b) Étiologies
> Foyers dentaires
Il s'agit le plus souvent d'une parodontite apicale d'origine
endodontique, aiguë ou plus souvent chronique. Cette parodontite
succède généralement à la mortification d'une dent
sinusienne cariée. Plus rarement, il s'agit d'une parodontite profonde
d'origine sulculaire. (Les microbes, en particulier les ANAEROBIES de la
bouche, gagnent la cavité du sinus par la lésion dentaire. C'est
le métabolisme de ces bactéries qui est responsable de la
fétidité du mouchage).
> Causes iatrogènes
Les causes iatrogènes sont possibles, notamment
après avulsion d'une dent maxillaire (communication bucco-sinusienne) ou
dépassement de pâte lors de l'obturation d'une dent sinusienne.
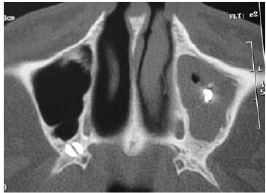
Figure 5 : Sinusite maxillaire par dépassement de
pâte dentaire.
c) DIAGNOSTIC DE SINUSITE
> Signes d'appel
Les signes d'appel, qui témoignent d'une poussée
de surinfection ou d'une rétention, sont :

une rhinorrhée purulente, unilatérale et
fétide (cacosmie subjective de la flore anaérobie d'origine
dentaire).
une algie maxillo-dentaire unilatérale et une obstruction
nasale inconstantes.
> Examen clinique
L'examen facial recherche une douleur élective à
la pression de la paroi antérieure du sinus maxillaire, sous
l'émergence du nerf infra-orbitaire.
L'examen rhinologique au spéculum nasal (après
mouchage) se décompose en deux rhinoscopies :

la rhinoscopie
antérieure. la rhinoscopie
postérieure.
d) DIAGNOSTIC DE L'ETIOLOGIE DENTAIRE
On recherche un foyer infectieux (caries, parodontopathie) au
niveau des dents sinusiennes, avec surtout des signes de mortification. En
pratique, seules les dents intactes réagissant aux tests de
vitalité sont considérées comme hors de cause Parfois ne
persiste qu'une communication bucco-sinusienne après avulsion
ancienne.
e) TRAITEMENT A la fois dentaire et sinusal
> Traitement dentaire
Extraction ou traitement radiculaire parfait. >
Traitement sinusal

Au stade aigu : antibiothérapie
suffisante dans l'ensemble des cas (surtout les bétalactamines)
Au stade chronique :
- ponction, lavage, antibiothérapie locale et
générale,
- curetage sinusal (CALDWELL-LUC), en cas d'échec.
9- NOMA
C'est une forme gravissime de stomatite gangreneuse ou de
gingivite ulcéro- nécrotique aigu (GUNA).
Affection liée au sous- développement, survenant
pendant la période de sécheresse (octobre- février- mars),
pendant les famines et au décours de maladies infectieuses graves telles
que la fièvre typhoïde, la grippe, et surtout la rougeole.
Pour expliquer la pathogénie du noma, plusieurs
théories ont été énoncées mais celle qui
retiendra notre attention est la théorie d'ENWONWU qui admet l'existence
d'une corrélation entre la malnutrition, les fièvres
éruptives, la prolifération microbienne dans la cavité
buccale.
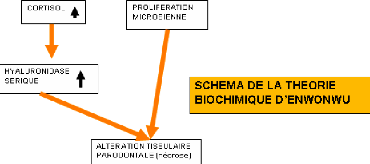
Figure 6 : Théorie d'ENWONWU [44]
10- ULCERE DE BURULI
L'ulcère de Buruli est une infection chronique
nécrosante et extensive du tissu graisseux sous-cutané
(l'extension peut se faire en profondeur avec atteinte osseuse) causée
par Mycobacterium ulcerans découvert par MAC CALLUM en
Australie en 1948 [24], [25], [26]
On sait que l'ulcère de Buruli se retrouve dans des
milieux chauds et humides, notamment lorsque la végétation est
abondante, le sol marécageux et que des masses d'eau stagnent ou
s'écoulent lentement. Toutefois, on n'a pas encore pu élucider
complètement le mode de transmission. Des faits observés donnent
à penser que des insectes d'eau pourraient jouer un rôle,
notamment des punaises d'eau. Des essais au laboratoire ont permis de
transmettre la bactérie d'une punaise d'eau à une souris,
après morsure de cette dernière. Des recherches sont en cours
pour confirmer ce mode de transmission dans des conditions naturelles.
Aucune transmission directe d'une personne à une autre n'a
pu être démontrée jusqu'à ce jour.
Le germe responsable, le Mycobacterium ulcerans se multiplie
à une température de 28° à
33° C d'où sa prédilection pour le tissu
sous-cutané. Sous le plan clinique, la maladie évolue en 3 phases
:

une phase pré ulcérative à début
oedémateux ou nodulaire, une phase d'ulcération
caractéristique,

une phase de cicatrisation au prix de cicatrices fibreuses et
rétractiles. Le diagnostic para clinique repose sur la
bactériologie.
Depuis 2005, l'Organisation Mondiale de la Santé
recommande un traitement médicamenteux constitué d'une
association rifampicine/streptomycine pendant 8 semaines. Ce traitement n'est
cependant pas applicable à toutes les personnes atteintes et les effets
secondaires de la streptomycine (ototoxicité) nécessitent un
suivi régulier des malades sous traitement.
Souvent, cependant, étant donné le diagnostic
tardif de la maladie, la chirurgie reste le traitement de choix. Le traitement
chirurgical dépend fortement de la forme clinique de la maladie lorsque
le patient se présente au centre de santé. On distingue deux
formes : évolutive et inactive. La forme évolutive peut
être classée en forme non ulcérative (papule, nodule,
plaque, oedème) et ulcérative. Le traitement consiste en premier
lieu en une excision de la lésion suivie d'une suture ou, dans le cas
d'un ulcère supérieur à 2 cm, d'une greffe cutanée.
Par conséquent, l'hospitalisation est souvent longue et coiteuse.
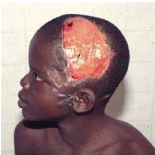
Figure 7 : Lésion ulcérative (Photo :
Programme national de lutte contre l'ulcère de Buruli, Côte
d'Ivoire)
11- SURINFECTION POST OPERATOIRE - 3ème
cause d'infection nosocomiale
- Germes variables selon site opératoire
- Facteurs de risque liés au terrain, au geste
opératoire
a) DEFINITION
Infection superficielle ou profonde survenant dans les 30 jours
post opératoire ou 1 an si matériel prothétique mis en
place.
b) FACTEURS DE RISQUES
- Risques liés au patient : état
immunitaire, statut nutritionnel, âge, diabète, cigarette, prise
concomitante de stéroïdes, longue hospitalisation
préopératoire.
- Risques liés à la
procédure : présence d'un corps étranger,
importance du traumatisme tissulaire, organes cibles.
- Risques liés au microorganisme :
virulence, charge bactérienne, sensibilité aux antibiotiques.
c) GERMES RESPONSABLES - Staphylocoque
aureus.
- Staphylocoque coagulase négative.
- Entérocoque.
d) CLINIQUE
Début des signes de 24h (streptocoque A) à
plusieurs mois selon le germe. Signes inflammatoires locaux, déhiscence
cicatrice, écoulement purulent, +/- fièvre (inconstante si
infection superficielle)
e) CONDUITE A TENIR
- Explorations complémentaires : TDM, IRM en absence de
cicatrice inflammatoire - Ponction guidée ou reprise chirurgicale.
- Diagnostic microbiologique.
- Antibiothérapie guidée par la
bactériologie. Pas systématique en cas d'infection
superficielle
NOTRE ETUDE
MATERIEL ET METHODE
1- TYPE D'ETUDE
Il s'agit d'une étude transversale exhaustive et
descriptive sur une période de 7 (sept) mois, de novembre 2008 à
juin 2009 inclus au CHU de Cocody.
Elle a porté sur les aspects
épidémiologiques, cliniques, bactériologiques et
thérapeutiques des infections en stomatologie et chirurgie
maxillo-facial
2- LIEU D'ETUDE
Les patients ont été recrutés dans le
service de stomatologie et chirurgie maxillo-faciale du C.H.U. de Cocody
à Abidjan. Tous les prélèvements ont été
analysés à l'unité de bactériologie clinique de
l'INSTITUT PASTEUR de Côte d'IVOIRE.
3- POPULATION ETUDIEE
a) Critères d'inclusions
· Patients de tous sexes.
· Patients de tous âges
· Patients présentant une infection patente ou
latente diagnostiquée par un médecin et ayant fait un examen
microbiologique
b) Critère d'exclusion
. Patients ne présentant des signes d'infection mais sans
analyse microbiologique.
4- METHODE
a) TAILLE DE L'CHANTILLON
Notre enquête a porté sur 43 patients atteints
d'infection odonto-stomatologique et maxillo-faciale. Nombre obtenu en
utilisant la formule pour un échantillon aléatoire simple :
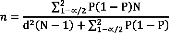
Nous avons estimé la prévalence a 28,5%
[3] .Or selon la littérature lorsque la pire des valeurs n'est
pas connue, comme c'est le cas pour notre étude, on utilise
d=p/2=0,141[30] au lieu de d=0,5-p
b) TECHNIQUE DE PRELEVEMENT
Les prélèvements ont été
effectués chez tous les patients suspects d'infection. Trois types de
prélèvements ont été réalisés selon
la nature des lésions.
i. Prélèvement à la
seringue
Cette méthode a été utilisée pour les
collections suppurées fermées. Cela consiste à nettoyer le
site de prélèvement à l'aide d'une compresse
imbibée d'antiseptique
La ponction de l'abcès a été
réalisée à l'aide d'une seringue stérile munie d'un
trocart avec aspiration douce (en évitant des bulles d'air) à
cause des bactéries anaérobies.
ii. Prélèvement à
l'écouvillon stérile
Cette technique intéressera les lésions
ouvertes telles que les ostéites, les alvéolites~le
prélèvement s'est fait après avoir nettoyer la plaie
à l'eau et au savon antiseptique dilué, rincer puis sécher
délicatement par tamponnement et on appui l'écouvillon sur la
surface à prélever.
iii. Prélèvement biopsique En per
opératoire pour les séquestres osseux
Les prélèvements ont été
acheminés rapidement au laboratoire d'analyse de l'INSTITUT PASTEUR
d'Abidjan dans un délai de 5 à 10 minutes. Chaque
prélèvement a été accompagné d'une fiche de
renseignement dûment remplie.
Les milieux de transport n'ont pas été
utilisés
c) ANALYSE BACTERIOLOGIQUE AU LABORATOIRE
L'analyse a été effectuée selon
différentes étapes :
> Examen macroscopique
Il permet d'apprécier l'aspect du
prélèvement, la couleur, si possible l'odeur.
> Examen microscopique ou direct

Etat frais
Il permet de rechercher les leucocytes, leur nombre, les
cellulites épithéliales, la présence des hématies,
les germes, leur vitalité et les levures parfois sous forme de
filaments

Coloration de Gram
Elle permet d'apprécier la présence de
polynucléaire, la nature de la flore et elle oriente le choix des
milieux de culture.

Culture
Divers milieux sont utilisés (pour la recherche des
bactéries aérobies et anaérobies) qui doivent satisfaire
les besoins nutritif et énergétiques des germes à
cultiver. En pratique, sont utilisé des milieux solides

Identification
Elle se fait sur un ensemble de caractères morphologiques,
culturaux, biochimique et antigéniques.

Antibiogramme
Utilisation de la méthode par diffusion des disques
imprégnés d'antibiotiques et la mesure des diamètres
(c'est la méthode de Kirby Bauer, elle est recommandée par
l'O.M.S.)
a) COLLECTE ET DEPOUILLEMENT
Nous avons rempli pour chaque patient une fiche d'enquête.
(Voir annexe)
L'étude est transversale et descriptive, les
résultats seront présentés sous forme de proportions et le
test du khi carré sera utilisé pour comparer ces valeurs. Les
méthodes de data mining non supervisées seront utilisées
pour étudier les corrélations entre les résultats
cliniques et la bactériologie et/ou la mycologie. Les différents
risques exprimés sous forme d'Odds ration seront estimés par
régression logistique ou multi nominale. Les logiciels EpiInfo2007 et
R2.5.1 seront utilisés pour la saisie des données et les analyses
statistiques
RESULTATS
I. DONNEES EPIDEMIOLOGIQUES
A. Répartition de la population selon le sexe
|
Tableau II : Répartition selon le
sexe
|
|
|
|
Sexe
|
Effectif Pourcentage(%)
|
|
Féminin
|
18
|
39,13
|
|
Masculin
|
28
|
60,86
|
|
Total
|
46
|
100
|
Sex-ratio :1,55
Les sujets de sexe masculin représentent 60,86% des cas
contre 39,13 pour le sexe féminin
B. Répartition de la population selon les tranches
d'âge Tableau III : Répartition selon les tranches
d'âge
Tranche d'âge Effectif Pourcentage(%)
|
0-15
|
5
|
10,86
|
|
16-31
|
22
|
47,82
|
|
32-47
|
13
|
28,26
|
|
>48
|
6
|
13,04
|
|
Total
|
46
|
100
|
La moyenne d'âge est de 31,97 ans avec des extrêmes
allant de 5 mois à 76 ans. Les enfants de mois de 15 ans
représentaient 10,86% des cas
La tranche la plus touchée se situe entre 16-31 ans avec
47,82%, puis suit la tranche d'age de 32 -- 47 ans avec 28,26% des cas
Les plus de 48 ans représentaient 13,04% des cas
C. Répartition de la population selon le niveau
d'instruction Tableau IV : Répartition selon l'instruction
Niveau instruction Effectif Pourcentage(%)
|
Non scolarisé
|
12
|
27,9
|
|
Primaire
|
6
|
14,0
|
|
Secondaire
|
16
|
37,2
|
|
Supérieure
|
9
|
21,0
|
|
Total
|
43
|
100
|
La population non scolarisée représentait 27,9% des
cas Ceux du primaire 14,0% des cas
Les élèves du secondaire étaient
majoritaires avec 37,2% des cas Les patients du supérieur
représentaient 21%
D. Répartition de la population selon la
profession
|
Tableau V : Répartition selon la
profession
|
|
|
|
Profession
|
Effectif Pourcentage(%)
|
|
Fonctionnaires
|
3
|
6,52
|
|
Retraites
|
3
|
6,52
|
|
Elèves/étudiants
|
10
|
21,73
|
|
Profession libérale
|
14
|
30,43
|
|
Aucune*
|
16
|
34,78
|
|
Total
|
46
|
100
|
* donc 2 enfants de moins de 5 ans
Les fonctionnaires et les retraités représentaient
6,52% des cas
Les élèves et les étudiants 21, 73% des
cas
Ceux ayant une profession libérale 30, 43%
Les personnes n'ayant aucune profession sont majoritaires avec
34,78% des cas
II. DONNEES CLINIQUES
A. Motif de consultation
Tableau VI : Répartition selon le motif de
consultation
|
Motif de consultation
|
Effectif
|
Pourcentage(%)
|
|
Douleur
|
Présence
|
46
|
100
|
|
Absence
|
0
|
0
|
|
Tuméfaction
|
Présence
|
45
|
97,82
|
|
Absence
|
1
|
2,17
|
|
Suppuration
|
Présence
|
39
|
84,78
|
|
Absence
|
7
|
15,21
|
|
Fièvre
|
Présence
|
27
|
58,69
|
|
Absence
|
19
|
41,30
|
La douleur représente le premier motif de consultation
(100%) suivie de la tuméfaction (98%), de la suppuration et de la
fièvre avec respectivement 85% et 59%
52,17% soit 24 patients présentaient une association :
douleur-tuméfaction-suppuration-fièvre
82,60% soit 38 patients présentaient une association :
douleur-tuméfaction-suppuration
Sujet a risque d'infection


le risque A correspondant à un risque
d'infection identifiée localement et/ou d'infection
générale (septicémie)
le risque B correspondant à un risque
d'infection liée à une localisation secondaire de la
bactérie.
|
Tableau VII : Répartition selon la notion de
sujet a risque d'infection
|
|
|
Risque A
|
Effectif Pourcentage(%)
|
|
Mauvaise hygiène bucco-dentaire
|
36
|
78,26
|
|
Infection à VIH
|
4
|
8,69
|
|
Dénutrition
|
4
|
8,69
|
|
Insuffisance rénale
|
1
|
2,17
|
|
Insuffisance hépatique
|
1
|
2,17
|
|
Diabète
|
0
|
0
|
|
Total
|
46
|
100
|
78,26% des patients présentaient une mauvaise
hygiène bucco-dentaire Parmi les 46 patients testés seulement 4
soit 8,69% étaient VIH+ 8,69% des patients avaient une
dénutrition
2,17% des patients présentaient une insuffisance
rénale et hépatique Aucun patient présentant un risque B
n'a été identifié
B. Répartition de la population selon la porte
d'entrée infectieuse Tableau VIII : REPARTITION SELON LA PORTE D'ENTREE
INFECTIEUSE
Origine probable des infections Effectif
Pourcentage(%)
Pulpite 38 82,60
Gingivite 5 10,8
Traumatisme alvéolo-dentaire 2 4,34
Traumatisme maxillo-facial 1 2,17
Total 46 100
83% des infections présentées par les patients sont
d'origine dentaire, contre 10% pour les gingivites, 4% pour les TAD et 2% pour
les TMF
C. Répartition selon le statut d'hospitalisation
98% des patients étaient hospitalisés
D. Répartition des malades selon les pathologies
Tableau IX : Répartition selon les pathologies
Pathologie Effectifs Pourcentage(%)
Cellulite 28 60,86
Ostéite 6 13,04
Cellulite+ostéite 5 10,86
Staph. Maligne face 2 4,34
Parotides 2 4,34
Suppuration linguale 1 2,17
Parulie 1 2,17
Adenophlegmon 1 2,17
Total 46 100
Les cellulites prédominaient avec 60,86% des cas, suivi
des ostéites avec 13,04% des cas L'association cellulite-ostéite
représentait 10,86% des cas
Les parotidites et les staphylococcies malignes de la face
représentaient que 4,34% des cas, suivi des suppurations linguales,
parulie et adenophlegmon avec 2,17% des cas.
III. DONNEES MICROBIOLOGIQUES
A. Répartition selon le type de
prélèvement
écouvillon
11%
Prélèvement
osseux
4%
seringue
85%
Figure 8 : Répartition selon le type de
prélèvement réalisé
Dans 85% des cas, les prélèvements ont
été réalisés à l'aide d'une seringue
11% des prélèvements avec un écouvillon et
4% ont été des prélèvements osseux
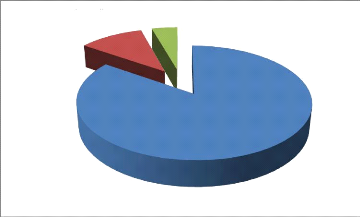
B. Répartition selon l'examen macroscopique
Hématique
8%
Purulent
92%
Figure 9 : Répartition selon l'examen
macroscopique
L'examen macroscopique des collections suppurées a
été apprécié seulement sur des
prélèvements effectués à la seringue
92% des prélèvements avaient un aspect purulent
contre 8% qui avaient un aspect hématique
C. Examen microscopique
1. Leucocytes
Tableau X : Répartition selon le nombre de
leucocytes
Nombre de leucocytes Effectif Pourcentage(%)
> 5 leucocytes 33 71,73
< 5 leucocytes 13 28,26
Total 46 100
La majorité des prélèvements
présentaient un taux élevé de leucocytes (72%) 28% des
patients avaient un taux de leucocytes inferieur 5 par champs
2. Répartition des bactéries selon la
culture Sur 46 cultures effectuées, 18 cultures soit 39,17% ce
sont révélées positives
3. Morphologie des bactéries Tableau XI :
Répartition de la flore aérobie et anaérobie selon la
coloration de Gram
Coloration de Gram Flore aérobie N (%) Flore
anaérobie N (%)
Coccidé Gram+ 11(23,91) 0 (0)
Bacille Gram- 8 (17,39) 1 (2,17)
Parmi les bactéries isolées, la répartition
se fait comme suit : les coccidé Gram+ prédominent avec 23,91%

les bacilles Gram- avec 19,56%
4. Culture
|
Tableau XII : Répartition selon les
bactéries isolées
|
|
|
|
Bactéries isolées
|
Groupe infectéEffectif
Pourcentage(%)
|
|
Entérobactéries
|
Escherichia coli
|
3
|
15
|
|
Klebsiella pneumoniae
|
1
|
5
|
|
Proteus mirabilis
|
1
|
5
|
|
Non
entérobactéries
|
Pseudomonas aeruginosa
|
3
|
15
|
|
Staphylocoques
|
Staphylococcus aureus
|
11
|
55
|
|
Anaérobies
|
Bactéroïdes spp
|
1
|
5
|
|
Total
|
|
20
|
100
|
Dans la flore
aérobie, les coccidé Gram positif
représenté par les staphylocoques viennent en tête avec 11
souches soit 55 % du groupe infecté suivi des bacilles Gram
négatif avec 40% ; avec une majorité des
entérobactéries avec 5 souches (25%),
Parmi les entérobactéries, l'espèce
prédominante est Escherichia coli 15%, suivi Klebsiella
pneumoniae et Proteus mirabilis avec 5%
Les bacilles Gram négatif non
entérobactéries sont représentés essentiellement
par Pseudomonas aeruginosa avec 3 souches soit 15% des cas
1 seul anaérobie : Bactéroïdes a
été identifié
5. Analyse comparative entre les bactéries
isolées et les pathologies retenues
Tableau XIII : Répartition des bactéries
selon la pathologie retenue
|
S. aureus
|
E. coli
|
P. aeruginosa
|
P. mirabilis
|
K. pneumoniae
|
Bactéroïdes
|
|
Cellulites (n=28)
|
3
|
2
|
2
|
|
1
|
1
|
|
Ostéites (n=6)
|
2
|
1
|
1
|
1
|
|
|
|
Cellulite+ostéite (n=5)
|
1
|
|
|
|
|
|
|
Staph. maligne face (n=2)
|
2
|
|
|
|
|
|
|
Adenophlegmon
(n=1)
|
1
|
|
|
|
|
|
Parotidites
(n=2)
|
|
1
|
|
|
|
|
|
|
|
Parulie
|
1
|
|
|
|
|
|
(n=1)
S. aureus a été isolé dans toutes
les pathologies identifiés (11 souches), suivie E. coli, P
aeruginosa (3 souches) et enfin P. mirabilis, K. pneumoniae,
Bactéroïdes (1 souche)
Dans les cellulites, 5(K. pneumoniae, S. aureus, E. coli, P
aeruginosa, Bactéroïdes) des 6 bactéries
isolées sont retrouvées Dans les ostéites, 4 types de
bactéries ont été isolées (E. coli, P
aeruginosa, S. aureus, Bactéroïdes)
D. Répartition en fonction du profil individuel
des germes 1. Staphylococcus aureus
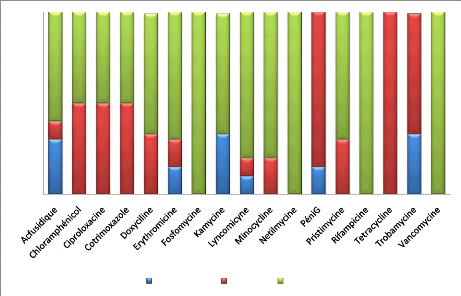
100%
90%
80%
40%
70%
60%
50%
30%
20%
10%
0%
Intermediaire Résistant Sensible
Figure 10 : Sensibilité aux
antibiotiques
S.aureus
|
Trobamyci
Kanamycine
Erythromicyne
|
Intermédiaire
ne
Acfusidique
Lyncomicyne Tetracycline
Pristinamycine
|
|
Vancomycine
Doxycycline
Sensible
Fosfomycine Rifampicine
Netilm
|
Résistant ..
CiproloxacingéniG minocycline
Chloramphénicol
Cotrimoxazole
ycine
|
-4 -3 -2 -1 0 1 2 3 4
-- axe F1 (67.48 %) -->
|
-- axe F2 (32.52 %) -->
|
4 3 2 1 0
-1
-2
-3
-4
|
Figure 11 : Analyses des correspondances
multiples
Staphylococcus aureus est :

sensible à : netilmycine, fosfomycine, rifampicine,
vancomycine
intermediaire à la plupart des antibiotiques.
résistant à Péni G et Tetracycline
2. Escherichia coli
100%
90%
80%
40%
70%
60%
50%
30%
20%
10%
0%
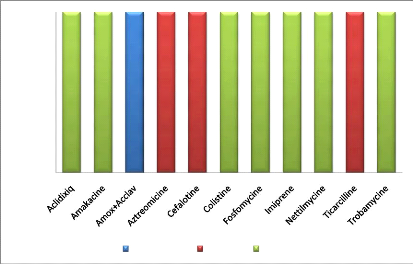
Intermédiaire Résistant Sensible
Figure 12 : Sensibilité aux
antibiotiques
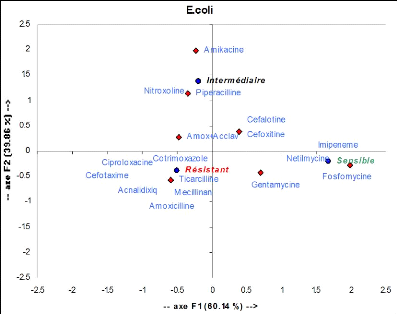
Figure 13 : Analyses des correspondances
multiples
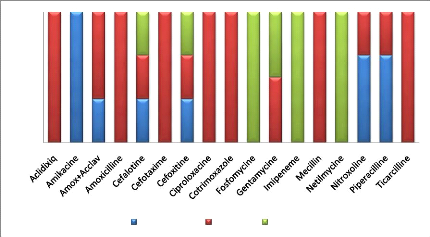
F. coli est :

Résistant à : Amoxicilline, Ticarcilline,
Cotrimoxazole, Céfotaxime, Ac nalidixique sensible à :
Imipenème, Fosfomycine, Nétilmicine
intermédiaire à : Amoxicilline+acide
clavulanique
3. Klebsiella pneumoniae
100,00%
40,00%
90,00%
80,00%
70,00%
60,00%
50,00%
30,00%
20,00%
10,00%
0,00%
Intermediaire Resistant Sensible
Figure 14 : Sensibilité aux
antibiotiques
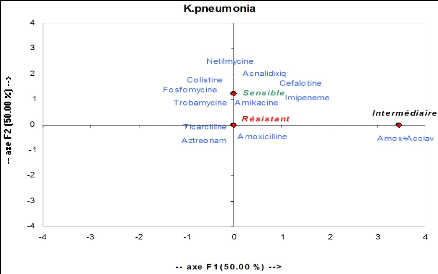
Figure 15 : Analyses des correspondances
multiples
Klebsiella pneumoniae est :

Sensible à : Nétilmicine, Amikacine, Fosfomycine,
Céfalotine, colistine, acide nalidixique, Tobramycine
Intermédiaire à : amoxicilline-acide clavulanique
Résistant à : amoxicilline, Ticarcilline,
Aztréonam
4. Pseudomonas Aeruginosa
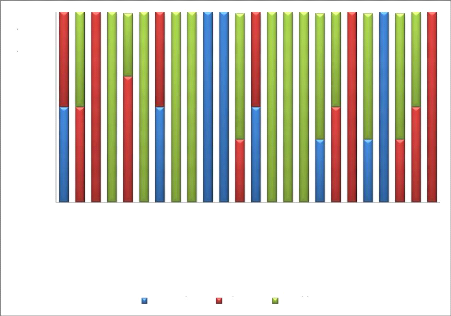
100,00%
40,00%
90,00%
80,00%
70,00%
60,00%
50,00%
30,00%
20,00%
10,00%
0,00%
Aclidixiq
Amox+Acclav
Amoxicilline
Aztreom
Cefalotine
Cefotaxine
Cefotixine
Ceftazidine
Ceftriaxone
Cefuroxine
Chloramphenicol
Ciprolaxacine
Colistine
Cotrimoxazole
Fosfomycine
Gentamycine
Imipeneme
Kanamycine
Mecilline
NetiImycine
Nitroxoline
Piperacilline
Ticarcilline
Vancomycine
Intermediaire Résistant Sensible
Figure 16 : Sensibilité aux
antibiotiques
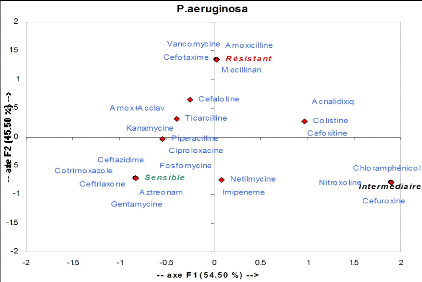
Figure 17 : Analyses des correspondances
multiples
Pseudomonas aeruginosa est :

résistant à : Mécillinam, Amoxicilline,
Vancomycine, Céfotaxime AC nalidixique, colistine, Céfoxitine
Sensible à Aztréonam, Gentamycine, Ceftriaxone,
Cotrimoxazole, Fosfomycine
intermédiaire a Pipéracilline, Amoxicilline+Acide
clavulanique, Céfalotine, Ticarcilline, Nétilmicine et
Imipenème
5. Proteus mirabilis
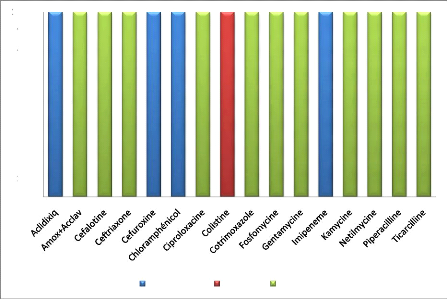
100%
40%
90%
80%
70%
60%
50%
30%
20%
10%
0%
Intermediaire Résistant Sensible
Figure 18 : Sensibilité aux
antibiotiques
Figure 19 : Analyses des correspondances
multiples
Proteus mirabilis est :

Sensible à : Nétilmicine, Amikacine, fosfomycine,
Céfalotine, Ceftriaxone, Tobramycine, amoxicillineacide clavulanique,
Ciprofloxacine, ticarcilline

Intermédiaire à : acide nalidixique,
Céfuroxime, chloramphénicol, imipenème Résistant
à : colistine
6. Bacille Gram-
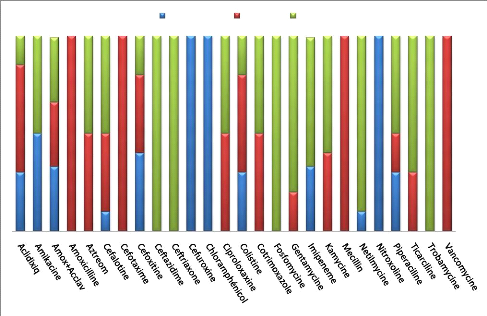
Intermediaire Résistant Sensible
Figure 20 : Sensibilité aux
antibiotiques
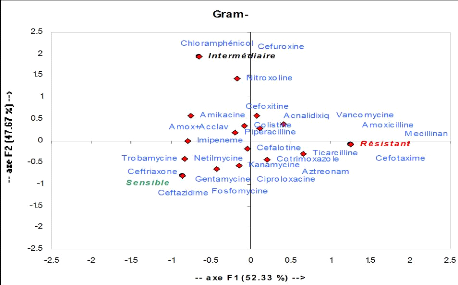
Figure 21 : Analyses des correspondances
multiples
En regroupant toutes les bactéries Gram négatif en
fonction de leur sensibilité aux antibiotiques, nous remarquons que :


Pour les â lactamines on a
- Une résistance a presque 100% pour les
aminopénicillines
- Une sensibilité a près de 80% pour l'association
amoxicilline-acide clavulanique
- Une sensibilité à 100% pour les
céphalosporines de troisième génération
Pour les aminosides, on a une sensibilité à environ
100%
Pour les fluoquinolones, la sensibilité avoisine les
80%
7. Coccidé Gram+
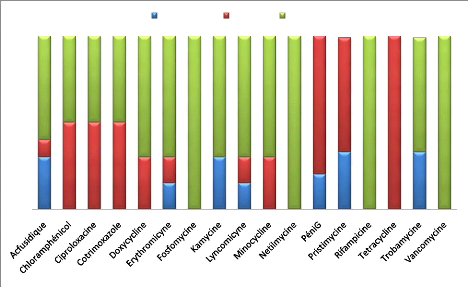
Intermediare Résistant Sensible
Figure 22 : Sensibilité aux
antibiotiques
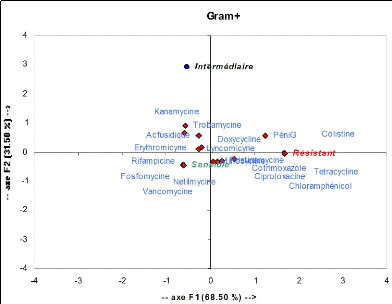
Figure 23 : Analyses des correspondances
multiples
En regroupant toutes les bactéries Gram positifs en
fonction de leur sensibilité aux antibiotiques, nous remarquons que :

Pour les â lactamines on a une résistance à
presque 80%
Pour les aminosides, on a une sensibilité à environ
100%
Pour les fluoquinolones, la sensibilité avoisine les
60%
Pour les macrolides on une sensibilité d'environ 70%
E. Tableau récapitulatif
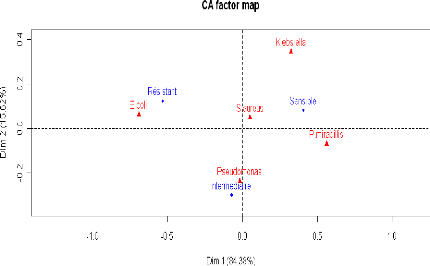
Figure 24 : Récapitulatif de la sensibilité
des germes aux antibiotiques testés
Ce graphique nous montre que sur l'ensemble, Escherichia coli
développe une résistance sur la grande majorité des
antibiotique, tandis que Pseudomonas est intermédiaire, Klebsiella
pneumoniae et Proteus mirabilis sont encore sensible et Staphylococcus aureus
est assez mitigé, même si il est encore assez sensible
COMMENTAIRES
I. DONEES EPIDEMIOLOGIQUES
A. Le sexe
La répartition des infections selon le sexe montre une
prédominance masculine avec un sex-ratio de 1,55 dans notre
étude.
Nos résultats sont sensiblement proches de KOUAME
[2] qui trouve un sex-ratio de 1,24 et DIOMANDE [31]
qui trouve un sex-ratio de 1,90. Par contre selon OUATTARA
[32] et FOFANA [33] il y a autant d'hommes que de
femmes qui présentent une infection stomatologique.
On peut retenir que les infections en stomatologie ne semblent
pas être influencées par le sexe toutefois, les femmes prenant
plus soin de leur cavité buccale, on comprend qu'il y ait une
légère différence.
B. L'âge
L'âge de nos patients varie de 5 mois à 76 ans avec
une moyenne de 31,97 ans. La tranche d'âge la plus touchée par les
infections se situe entre 16-31 ans. Nos résultats concernant les
tranches d'âge sont superposables à ceux de OUATTARA [32]
et KOUAME [2]
L'observation de ces tranches d'âge, permet de constater
que les sujets jeunes sont les plus touchés par les infections ; cela
s'expliquerait par le fait qu'a ces ages on assiste a une sur consommation
d'aliment cariogène et une négligence de l'hygiène
bucco-dentaire.
La fréquence des infections décroit progressivement
à partir de la quarantaine. A cet âge il est signalé une
régression du taux de germes dans la cavité buccale, ce qui
expliquerait que les caries dentaires sont rares selon ADOU OI
[34].
C. La profession
Dans notre étude 34,78% de la population est sans emploi.
Nos résultats se rapprochent de ceux de GADEGBEKU [18]
et d'ADOU OI [34]. La faiblesse du pouvoir d'achat ne
permet pas à ces patients de s'offrir le strict minimum pour assurer une
bonne hygiène bucco- dentaire et d'avoir accès aux soins. Cela
favoriserait les infections et les complications qui en résultent.
II. DONNEES CLINIQUES
A. le motif de consultation
La douleur (100%), la tuméfaction (98%) et la suppuration
(86%) dans notre série représentent les premiers motifs de
consultation soit 82,60% des consultations. Nos résultats sont proches
de ceux de OUATTARA [32] et SIGHA [35] qui
trouvent respectivement 88% et 86% pour les suppurations
B. La notion de sujet a risque d'infection Il
existe deux types de sujets à risque infectieux :


risque A : risque d'infection identifiée localement et/ou
de surinfection générale (septicémie). Ce risque concerne
:
- les sujets immunodéprimés,
- les sujets atteints d'une pathologie chronique non
contrôlée,
- sujets dénutris.
risque B : risque d'infection liée à une
localisation secondaire de la bactérie, c'est-à-dire à un
nouveau foyer infectieux situé à distance du foyer primaire
(endocardite infectieuse, infection sur prothèse). Une
antibiothérapie est recommande chez les sujet a risque A ou B
[9].
Dans notre étude nous avons noté près de
78,26% des patients avec une mauvaise hygiène bucco-dentaire, 13,03% de
patients sont porteurs de pathologie chronique et 8,69% sont
dénutris.
Nous n'avons pas noté de patient à risque B.
Contrairement a certaine recommandation de l'Agence
Française de Sécurité Sanitaire des Produits de
Santé de juillet 2001, dans notre contexte, la prescription
d'antibiotique serait indiquée pour toutes les pathologies
odonto-stomatologique. Cette pratique se justifie pleinement en Afrique par la
fréquence et l'urgence des cas à traiter, mais également
par la difficulté d'obtenir une identification bactériologique et
un antibiogramme, surtout pour les germes anaérobies, et par le prix de
revient de ces examens
C. L'origine probable des infections
83% des infections présentées par les patients
sont d'origine dentaire (carie dentaire) suivi des parodontites 11% et des
complications des traumatismes 7%.
La majorité de ces infections sont d'origine dentaire
comme l'a également montré KPEMISSI au Togo avec 88%
[36].
D. Le statut d'hospitalisation
97,7% de nos malades sont hospitalisés. Cette
fréquence élevée est due à la gravité des
infections, qui mettent en jeu le pronostic vital et ceci d'autant plus que les
patients arrivent très tard à la consultation, après avoir
épuisé les ressources des thérapeutiques traditionnelles
et que le terrain est à ce stade déjà très
altéré.
E. Les pathologies
Les cellulites prédominent avec 60,86% des cas suivi des
ostéites avec 13,04% et de l'association celluliteostéite avec
10,86% des cas.
Les autres pathologies (parotidites, adenophlegmon,
staphylococcie maligne de la face, parulie et suppuration linguale)
représentent environ 11% des cas. Ce faible taux peut s'expliquer par le
fait qu'une parti des patients a été vu en consultation et pour
ces patients les prélèvements n'ont pas été faits.
D'où le fait de mettre encore l'accent les prélèvements
systematique de toutes collections purulente que ce soit aux urgences, en
hospitalisation qu'en consultation.
III. DONNEES BACTERIOLOGIQUES
A. Le type de prélèvement
85% des prélèvements ont été
effectué à la seringue. Ce type de prélèvement,
comparativement à l'écouvillon, permet de réduire
considérablement les contaminations de la flore commensale.
L'écouvillon a été utilisé pour les
lésions ouvertes dans 11% des cas.ces prélèvement sont en
général contaminés par la flore commensale.
KOUAME [2] retrouve respectivement pour les
prélèvements à la seringue et à l'écouvillon
79,2% et 20,8% des cas.
Les prélèvements osseux (séquestre) ont
représenté 4% des cas
B. L'examen macroscopique
L'examen macroscopique des collections suppurées a
été apprécié seulement sur des
prélèvements effectués à la seringue.
92% des prélèvements avaient un aspect purulent et
8% hématiques.
C. L'examen microscopique
72% des patients avaient un taux élevé de
leucocytes, ce qui est en faveur d'une infection, contre 28% qui avaient un
faible taux de leucocytes. Cette prédominance est aussi rapportée
par KOUAME [2]
Notre étude montre pour la flore aérobie, une
prédominance des coccidé Gram positif avec 23,91% contre 17,39%
pour les bacilles Gram négatif,
Cette prédominance est également rapportée
par DIOMANDE [31] et KOUAME [2]
Pour la flore anaérobie, il a été
observé 1 cas de bacille gram négatif soit 2,17 des cas. Ce
résultat est largement en deçà de ceux observé par
FOFANA [33], LAROQUE [37] et KOUAME
[2]. Ceci peut s'expliqué :


par une maitrise insuffisante des techniques de
prélèvements par les médecins du service (Afin
d'isoler des anaérobies stricts, il convient en effet d'éviter de
prélever la flore résidente par la ponction à l'aiguille
apr~s désinfection locale, et de réduire au minimum la
toxicité de l'oxygène sur le prélèvement durant son
transport jusqu'au laboratoire. En aucun cas le prélèvement ne
doit être placé au réfrigérateur)
et une attitude compulsive de prescription des antibiotiques
avant les prélèvements.
D. Les bactéries du groupe
infectéLe groupe infecté est représenté
par les 18 patients chez qui les prélèvements étaient
positifs sur les 46
patients recruté
Notre étude montre une prédominance des
staphylocoques avec 55%, suivis des entérobactéries 25%, des
bacilles Gram négatif non entérobactéries 15% et des
anaérobies 5%.
Ces résultats semblent être en contradiction avec
les travaux de KOUAME en Côte d'Ivoire, LAROQUE au Sénégal
et FOFANA en Guinée qui trouvent une prédominance des
streptocoques.
Dans les infections où les aérobies sont
présents, Eick et coll. [38] isolent toujours un
streptocoque, 5 fois un staphylocoque et 8 fois un bacille à Gram
négatif.
De 1995 à 1999[39] ZAKIA sur quarante
(40) cas de cellulites cervico-faciales à Oran en Algérie a
obtenu un taux des Staphylocoques de 66,66 %.
Une deuxième étude a été
réalisée par GHERBI et KOUAKI [39] (Oran en
Algérie), ont remarqué que les cellulites étaient
causées surtout par le Staphylocoque (88,88 %) et rarement par
le Streptocoque (11,12 %).
En comparant ces résultats avec les nôtres, nous
trouvons que les Staphylocoques deviennent de plus en plus
majoritaires dans la flore microbienne des dents et leurs accidents
infectieux.
D'où proviennent les Staphylocoques
?
Les Staphylocoques sont des coccidé Gram positif,
typiquement groupés en amas (en forme de grappe de raisin) ; ils sont
facultatifs et possèdent une catalase qui permet de les
différencier des Streptocoques. Ils sont immobiles,
asporulés et en général sans capsule. Les
Staphylocoques dits à coagulase positif comme S.
aureus ont un pouvoir pathogène important di à la
présence de l'enzyme staphylocoagulase. S. aureus est le type
même des bactéries pyogènes, c'est à dire, des
bactéries provoquant essentiellement des lésions suppuratives et
nécrotiques.
La peau et les muqueuses en particulier des cavités
nasales, sont l'habitat préférentiel des Staphylocoques,
où S. aureus et S. epidermidis
constituent la flore commensale dominante. La salive du tiers des individus
sains contient S. aureus et S. epidermidis en faible
proportion, et leur présence dans la plaque dentaire n'est
qu'occasionnelle. On trouve constamment S. epidermidis sur les
lèvres et les commissures labiales. Sur ces sites ainsi que sur la
langue, la présence d'une forte proportion de S. aureus signe
une pathologie. Ces données indiquent que les Staphylocoques ne font pas
partie de la flore indigène de la cavité buccale. Toutefois, la
proximité d'habitat où ils sont la flore dominante explique
qu'ils sont une flore de passage exprimant à l'occasion un pouvoir
pathogène opportuniste.
Les lésions qui caractérisent les
Staphylococcies sont suppuratives et nécrotiques,
d'évolution aiguë ou suraiguë et parfois même
chronique.
Elles sont dues à S. aureus,
appelé vulgairement Staphylocoque doré en raison de la
couleur jaunâtre de ses colonies sur gélose. S.
aureus devient de plus en plus résistant aux antibiotiques ! !
!
E. Profil individuel des germes
1. Staphylococcus aureus
Ce sont des coccidé Gram positif aérobies et
anaérobies facultatifs. Les souches de Staphylococcus aureus
sont connues pour provoquer des infections cutanées : cellulites,
staphylococcie maligne de la face... S. aureus partage avec la
bactérie Escherichia coli le triste privilege d'être au
premier rang des germes responsables d'infections
nosocomiales. L'élévation de l'incidence des infections
staphylococciques est en rapport avec le nombre croissant
d'immunodéprimés mais aussi avec la multiplication des
procédures invasives qui lèsent la barrière
cutanéo-muqueuse.
Les staphylocoques ont développé depuis longtemps
une résistance à la méticilline et plus de 30 % des
souches de staphylocoque doré sont maintenant résistantes
à la méticilline [40].
Les bétalactamases sont des enzymes inactivant
l'antibiotique par ouverture du cycle béta lactame. La
bétalactamase du staphylocoque est une pénicillinase qui induit
une résistance aux pénicillines G et A (Ampicilline,
Amoxicilline), aux carboxypénicillines (Ticarcilline) et aux
acyluréidopénicillines (Mezlocilline, Azlocilline et
Pipéracilline) mais n'a pas d'effet sur les pénicillines M
(Méticilline, Oxacilline, Cloxaciline), les céphalosporines et
les pénèmes (Imipenème). Cette pénicillinase
staphylococcique est inactivée par des produits dénommés
"inhibiteurs de bétalactamases" (acide clavulanique, Tazobactam,
Sulbactam) qui, associés aux bétalactamines, restaurent leur
efficacité. En milieu hospitalier, 80% au moins des staphylocoques sont
producteurs de bétalactamase.
LAROQUE et coll. Leur reconnaissent une sensibilité aux
aminosides.
Dans notre série, ces bactéries sont sensibles
à 100% aux aminosides (Nétilmicine, vancomycine) et à la
fosfomycine.
Bon niveau de sensibilité aux macrolides 70-80% et aux
quinolones de 50-80%
Par contre avec la péni G on note une résistance
à 85%. Cette résistance est reconnue dans la
littérature
[41].
2. Escherichia coli
Ce sont des bacilles Gram négatif aérobies. Ces
germes sont fréquemment résistant à l'amoxicilline
[42]. Dans notre étude, les souches isolées sont
résistantes à 100% à l'amoxicilline et 33 % restent
résistantes à son association avec l'acide clavulanique.
Par contre, pour les aminosides, on note un bon niveau de
sensibilité : 100% pour la Nétilmicine et à peu
près supérieur 50%. Pour la gentamycine.
Pour les autres, on note un niveau de sensibilité
à 100%pour l'imipenème et la fosfomycine, un taux de
sensibilité modéré pour les céphalosporines a
environ 67% et un taux de résistance à 100% pour la
Ciprofloxacine
3. Klebsiella pneumoniae
K. pneumoniae est naturellement résistant aux
pénicillines (amoxicilline, ticarcilline) par production d'une
bétalactamase de La résistance à l'amoxicilline et
à la ticarcilline correspond à une résistance naturelle de
cette espèce par sécrétion d'une pénicillinase
naturelle.
On peut remarquer que contrairement à E. coli, il
persiste une bonne activité de l'association amoxicilline -acide
clavulanique.
Excellente activité des autres familles d'antibiotiques :
Aminosides et quinolones, la sensibilité tend vers
100%
4. Pseudomonas aeruginosa
Ou bacille pyocyanique est une espèce bactérienne
fréquemment isolée en milieu hospitalier. Le traitement des
infections à pyocyanique est souvent difficile à cause de la
multi résistance, l'adaptation et la résistance naturelle de
cette espèce à de nombreux antibiotiques
Dans notre série on note une bonne sensibilité
dans l'ensemble aux â-lactamines avec des niveaux de sensibilité
allant de 50% pour l'association amoxicilline- acide clavulanique
jusqu'à 100% pour les céphalosporines (Ceftriaxone,
Céfotaxime, Ceftazidime...)
Céphalosporinases hyper produite.
La sensibilité aux aminosides reste bonne.
Pour les quinolones (Ciprofloxacine), on un taux de
sensibilité à 66%.
5. Proteus mirabilis
P. mirabilis est naturellement résistant
à la colistine.
Il persistance d'une bonne activité de l'ensemble des
â-Lactamines et des autres classes d'antibiotiques (aminosides,
quinolones...) avec 100% de souches sensibles.
6. Bactéroïdes
D'après LE BERGEY'S MANUEL rapporté par M'BOUP
[43], ce sont des bacilles Gram négatif
anaérobies strictes, non sporulées, commensales de la
cavité buccale, susceptibles de provoquer chez les sujets dont
l'hygiène bucco-dentaire est défectueuse, une gingivite et par
progression une cellulite.
Selon la littérature, ces germes sont sensibles :

A l'amoxicilline-acide clavulanique
Aux nitro-imidazolé
Aux quinolones
Aux macrolides
Chloramphénicol
Dans notre étude le germe isolé au laboratoire n'a
pas poussé, ce qui n'a pas permis de tester sa sensibilité.
7. Profil général des germes
L'étude du profil bactériologique dans le service
de stomatologie et chirurgie maxillo-faciale du CHU de Cocody fait ressortir
que escherichia coli est le germe le plus résistant à
presque tous les antibiotiques testés ; surtout au bétalactamines
(pénicilline A) et le Cotrimoxazole.
Il y a de nombreuses preuves de la relation entre consommation
des antibiotiques et résistances aux antibiotiques [43]. Les
données générées par ESAC (European surveillance of
antimicrobial consumption) ont montré que la France était en 2001
le premier pays prescripteur de pénicillines en Europe [44]. On note
depuis 1990 une diminution significative des sensibilités aux
pénicillines A et au Cotrimoxazole d' escherichia coli
(respectivement 73,1% et 91,6% en 1990 à 62,8% et 80% en 1995).
Ceci s'explique aussi dans notre service car E. coli pourrai
avoir acquis une résistance du fait que, surtout les péni A sont
d'utilisations systématique dans presque toute les infections et ceci
depuis des années.
Dans l'ensemble, la sensibilité aux quinolones, aux
céphalosporines de 3e génération, à la fosfomycine
et aux aminosides reste élevée.
CONCLUSION
La fréquence des infections en stomatologie et chirurgie
maxillo-faciale, la rareté de recours à un antibiogramme due
à l'extrême urgence du traitement, mais surtout aux
difficultés économiques des patients, imposent la pratique d'une
antibiothérapie probabiliste de première intention basée
sur des connaissances épidémiologiques. Le constat du
développement de la résistance des germes couramment
rencontrés aux antibiotiques habituellement utilisés, justifie un
réajustement des protocoles thérapeutiques.
Nous avons une mené une étude de type
étude transversale exhaustive et descriptive sur une période de 7
(sept) mois au CHU de Cocody, incluent les patients de tous sexes, les patients
de tous âges et les patients présentant une infection patente ou
latente diagnostiquée par un médecin et ayant fait un examen
microbiologique.
Elle a porté sur les aspects
épidémiologiques, cliniques, bactériologiques et
thérapeutiques des infections en stomatologie et chirurgie
maxillo-facial.
Cette étude de la sensibilité aux antibiotiques des
germes isolés d'une série de 46 observations de manifestations
infectieuses nous a permis de montrer que :

Les cellulites maxillo-faciales constituent la pathologie
infectieuse la plus fréquente en stomatologie et chirurgie
maxillo-faciale avec 60,86% des cas
Les ostéites viennent en deuxième position avec
13,04% suivi de l'association cellulite-ostéite avec 10,86% des cas
Les autres pathologies représentent 15,24% de l'ensemble
des pathologies infectieuses.
L'étude bactériologique montre le type de
prélèvement semble influencer les bactéries isolées
; cependant, les autres bactéries sont fréquemment isolées
avec les écouvillons. Les bactéries isolées sont
dominées par :

les staphylocoques (55%), suivi des entérobactéries
(25%) avec pour chef de file escherichia coli (15%) les
bactéries Gram négatifs non entérobactéries sont
dominées par klebsiella pneumoniae (15%)
compte tenu des difficultés liées au
prélèvement et au transport, une bactérie anaérobie
(bactéroïdes) a été isolée dans notre
étude.
Sur le plan thérapeutique, la bi ou la tri
antibiothérapie est de règle compte tenu de la flore pluri
microbienne. Ce travail permet de prédire aux aminosides, aux
fluoquinolones, aux céphalosporines de troisième
génération, à l'association amoxicilline-acide
clavulanique et aux macrolides, une place prépondérante dans les
prescriptions antibiotiques en stomatologie et chirurgie maxillo-faciale au CHU
de Cocody.
RECOMMANDATIONS
Au terme de ce travail, nous pouvons formuler un certain nombre
de recommandation :
i. Concernant la nature des
prélèvements
> Les prélèvements â la seringue doivent
être préconisés car la qualité des résultats
dépend de la qualité des prélèvements.
> Si cela est possible, faire les prélèvements
avant toute prescription médicamenteuse
ii. Concernant l'antibiothérapie
probabiliste c'est-â-dire l'antibiothérapie de premiere
intention sans
l'antibiogramme.
> Dans les cellulites
v' L'antibiothérapie de premiere
intention

Les cellulites aigues circonscrites :
amoxicilline* + aminoside**ou
amoxicilline* + métronidazole.
Les cellulites aigues diffusés :
amoxicilline*-acide clavulanique + aminoside**
ou amoxicilline*-acide clavulanique + métronidazole.
Les cellulites diffuses : C3G +
aminoside** + fluoquinolone
v' L'antibiothérapie de deuxième
intention
C3G + aminoside** ou C3G + métronidazole
> Dans les ostéites
Fluoquinolone + aminoside** ou fluoquinolone +
métronidazole
> Dans les stomatites et les infections des glandes
salivaires
( Patients hospitalisés

En première intention : amoxicilline*-acide
clavulanique + aminoside** En deuxième intention : C3G +
aminoside**
V' Patients en ambulatoire Macrolide +
métronidazole
L'antibiothérapie curative sera poursuivie jusqu'à
la disparition des signes des signes de l'inflammation.
> Dans l'antibioprophylaxie de la chirurgie propre ou
propre-contaminée aura recours â l'Amoxicilline.
> Dans l'antibioprophylaxie de l'endocardite
streptococcique : l'Amoxicilline par voie orale ou parentérale
(on utilisera les aminosides par voie parentérale et en cas de
contre-indication aux Bétalactamines.
P.S : * :si allergie aux
â-lactamines, remplacer par macrolide
** :si bilan rénal bon. Ne pas dépasser 5 jours de
traitement.
iii. A l'intention des autorités
( La nécessite de la création d'une commission du
médicament qui doit choisir les antibiotiques qui ont un taux de
sensibilité supérieur à 75% comme antibiothérapie
probabiliste.
( La collaboration entre clinicien et microbiologiste pour le
choix de l'antibiothérapie probabiliste. ( Promouvoir la formation des
spécialistes e bactériologies de la cavité buccale et en
maxillofaciale.
iv. A l'intention de la population
( Eviter l'automédication aux antibiotiques sources de
résistance ( Réaliser les soins dentaires adaptés et
précoce
BIBLIOGRAPHIE
1. MOORE WEC, MOORE LV. The bacteria of
periodontal diseases. Periodontol 2000 1994; 5: 66-77.
2. KOUAME BCK. Profil bactériologique
des infections bucco-dentaires en stomatologie et chirurgie maxillo-faciale
(C.H.U. de Treichville) thèse de médecine - juillet 1999.
3. SEHI RYBI. Bilan d'activité de deux
années d'activité au service de stomatologie et chirurgie
maxillofaciale du C.H.U. de Cocody (1er mars 1999-30 mars 2001)
thèse de médecine 2002.
4. Agence Nationale pour le Développement de l'Evaluation
Médicale. Le bon usage des antibiotiques à l'hôpital.
ANDEM, Paris 1996
5. Recommandations de l'AFFSSAPS, Revue de Praticien
Médecine Générale 16, 573,29/4/2002.
6. Antibiothérapie curative chez l'adulte CH
TOURCOING.
www.infectiolille.com/Antibiotiques/atb2009-minitourcoing.pdf
7. ANNER A, MAIDEN MF, PASTER BJ, DEWHIRST FE.
The impact of 16S ribosomal RNA-based phylogeny on the taxonomy of
oral bacteria. In: Socransky SS, Haffajee AD, eds. Periodontology 2000, vol 5,
Microbiology and immunology of periodontal diseases. Copenhagen : Munksgaard,
1994 : 26-51
8. Prescription des antibiotiques en odontologie et
stomatologie. Recommandations et argumentaire. Agence Française de
Sécurité Sanitaire des Produits de Santé, juillet
2001.
www.afssaps.fr/content/download/5297/.../5/.../stomarg.pdf
9. Peron JM, Mangez JF. Cellulites et fistules
d'origine dentaire. Encycl Méd Chir (Editions Scientifiques et
Médicales Elsevier SAS, Paris, tous droits réservés),
Stomatologie/Odontologie, 22-033-A-10, 2002, 14 p.
10. CLASSIFICATION DES ANTIBIOTIQUES.
http://anne.decoster.free.fr/atb/atb.htm
11. GONZALES R, STEINER JF, MERLE A.Antibiotic
prescribing for adults with colds, upper respiratory tract infections, and
bronchitis by ambulatory care physicians. JAMA 1997; 278: 901-904.
12. KRISTINSSON KG, HJALMARSDOTTIR MA, GUDNASSON
T. Epidemiology of penicillin resistant pneumococci (PRP) in Iceland.
Hope for the future? ICAAC 1995; abstract C9.
13. SEPPÄLÄ H, KLAUKKA T, VUOPIO-VARKILA J,
MUOTIALA A, HELENIUS H, LAGER K, HUOVINEN P. and the Finnish Study Group for
Antimicrobial Resistance. The effects of changes in the consumption of
macrolides antibiotics on erythromycin resistance in group a streptococci in
Finland. N Engl J Med 1997; 337: 441-6.
14. STEPHENSON J. Icelandic researchers are
showing the way to bring down rates of antibiotic-resistant bacteria. JAMA 1996
; 275 : 175-6.
15. COHEN R, VARON E. Un exemple de
résistance liée à la pression de sélection en ville
: le pneumocoque. In WOLFF A, CREMIEUX AC, CARBON C, VACHON F, COULAUD JP,
VILDE JL. Du bon usage des antibiotiques à l'Hôpital.
Journée de pharmacologie clinique. Journée de l'hôpital
Claude-Bernard. Arnette Blackwell, Paris 1996 ; 161-70.
16. Agence Nationale pour le Développement de
l'Evaluation Médicale. Prescription pluri-médicamenteuse chez la
personne âgée de plus de 70 ans. In Recommandations et
références médicales. ANDEM, Paris 1995 ; tome 2 :
125-48.
17. GADEGBEKU SA, CREZOIT GE, AKA GKF, OUATTARA B.
Cellulites et phlegmons maxillofaciaux graves en milieu africain.
Revue du COSA-CMF, Vol. 2 N°2, 1995, PP : 8-11.
18. GADEGBEKU SA, OUATTARA B, KONSEM T, BANDAMA KJ, AKA
GF, ANGOH JJY, HARDING MB et AL. rôle des AINS dans les
cellulites maxillo-faciale ; Revue Africaine de Chirurgie 2000 ; 4(2) ;
8-12.
19. Pierre S, Pierre B. Ostéites des os
de la face : Traité de Stomatologie : 22-062-D-10 (1996) 1996
Éditions Scientifiques et Médicales Elsevier SAS - Tous droits
réservés.EMC est une marque des Éditions Scientifiques et
Médicales Elsevier SAS
20. Anonyme. 3e conférence de consensus en
thérapeutique anti-infectieuse. Les infections bactériennes
ostéoarticulaires. Med Mal Infect 1991 ; 21 (no
spécial)
21. BARTKOWSKI S, HECZKO P, LISIEWICZ J, ET AL.
Combined treatment with antibiotic, heparin and streptokinase - a new
approach to the therapy of bacterial osteomyelitis. J Craniomaxillofac Surg
1994 ; 22 : 167-176
22. Guide de conduite pratique et de formation en infectiologie
pour le médecin généraliste. Par le collège
universitaire des maladies infectieuses et tropicales. 4eme
édition. 2005.
23. GBERY IP, DJOKOUEHI D, YOBOUET P, AKA B, KANGAH JM.
Infections cutanées à mycobactéries atypiques.
Cahiers de Santé 1996 ; 6 : 317-22.
24. HEROIN P, COLIN M, KANGAH JM.
Mycobactérioses cutanées africaines : quelques aspects
à propos de 11 cas observés en 1982 et 1983 dans le service de
dermatologie du CHU d'Abidjan. Journal Dermatologique Paris 1984 ; 83-83 b.
25. OLUWASANMI JO, SOLANKE JF, OLURIN EO, ITAYEMI SO,
ALABI GO, LUCAS A. Mycobacterium ulcerans (Buruli) skin
ulcération in Nigérian. Am. J. Trop Med. Hgg. 1976; 25:
122-128.
26. Debelian GJ, Olsen I, Tronstad L. Systemic
diseases caused by oral microorganisms. Endod Dent Traumatol 1994 ; 10:
57-65.
27. Analysis of epimiological data using R and epicalc, p225
28. DIOMANDE A. Contribution a l'étude
étiopathogénique et thérapeutique des cellulites
perimaxillaire aigues. Thèse de médecine-juillet 1989-Abidjan.
29. OUATTARA B. Cellulite maxillo-faciales
graves et SIDA. Thèse de médecine, dec 1995, Abidjan
30. FOFANA L. Etude de la sensibilité
aux antibiotiques des bactéries isolées des cellulites
odontogeniques. Thèse de chirurgie dentaire. 2006. GUINEE
31. ADOU OI ADOU. Cellulites diffusées
et anti-inflammatoires. Thèse de médecine- Mai 1997-Abidjan
32. SIGHA O.B. Evaluation du traitement des
cellulites maxillo-faciales au CHU de COCODY, thèse de médecine.
Abidjan. 2009
33. KPEMISSI D. Cellulite cervico-faciale
d'origine bucco-dentaire : étude de 26 cas au CHU de Lomé. Revu
de laryngologie, d'otologie et de rhinologie, Vol. :116. N°3, 1995, PP :
195-197
34. LAROQUE G, DIA-TINE S, EVRARD L, GENTILE B,
FATY-NDIAYE Ch, DIALLO B, DIENGSARR F.L'antibiothérapie
probabiliste des cellulites perimaxillaire au Sénégal.
Médecine d'Afrique Noire : 1993, 40 (11)
35. EICKS, PFISTERW, KORN- STEMMES,
MAGDEFESSEL-SCHUMTZERU, STRAUBEE. Pathogen and resistance spectrum in
intraoral infections of the jaw-facial area with special reference to anaerobic
bacteria. Mund Kiefer Gesischtschir 2000; 4: 234-9.
36.
http://denteeth.ifrance.com/cv.htm
Sous la bienveillante direction de :Pr. F. Guedda : Professeur en
Stomatologie/chef de service du département de pathologie bucco-dentaire
du centre hospitalouniversitaire d'ORAN / Algérie
37. Gibert C, Trouillet JL.Traitement des
infections à staphylocoques résistants à la
méticilline : optimisation des traitements disponibles ou utilisation de
nouvelles molécules ? Service de réanimation médicale,
groupe hospitalier Bichat--Claude-Bernard, 46, rue Henri-Huchard, 75877, Paris
cedex 18, France
38. Burnichon N, Texier A. L'antibiogramme : la
détermination des sensibilités aux antibiotiques. D.E.S.
bactériologie semestre été 2003
39. Potel G, Caillon J, Bugnon D.
Antibiothérapie : de la pharmacologie à la
décision. Revue du praticien : (paris), 2003, vol : 53.N°14, pp :
1554-1560
40. M'boup N. Bactériologie des
cellulites péri-maxillaires d'origine dentaire. Thèse chir. Dent.
Dakar 1994, N°1
41. Enwonwu CO, Falkler WA, Idigbe EO.
Pathogenesis of cancrum oris (NOMA): confounding interactions of malnutrition
with infection. Ann. J. Trop: Med. Hyg 1999; 60: 223-32
42. Les pathologies d'origine dentaire.
http://denteeth.ifrance.com/ciii.htm
43. CONCLUSIONS OF THE EUROPEAN UNION CONFERENCE ON 'THE
MICROBIAL THREAT', 9- 10 September 1998. : The Copenhagen Recommendation.
Ministry of Health Ministry of Food, Agriculture and Fisheries. Vet. Res., 1999
; 30 : 119-122.
44. VANDER STICHELE R.H., ELSEVIERS M.M., FERECH M.,
BLOT S., GOOSSENS H. : European surveillance of antimicrobial
consumption (ESAC) : data collection performance and methodological approach.
Br. J. Clin. Pharmacol. 2004 ; 58 : 419-428.
ANNEXE
FICHE D'ENQUÊTE
I) ASPECT EPIDEMIOLOGIQUE
|
N°
|
Question et filtre
|
Réponse
|
Code
|
Passer à
|
|
001
|
Date de l'enquête
|
|__|__|20__|
|
|
|
|
002
|
Heure de début
|
|__|h|__|min
|
|
|
|
003
|
Non du patient
|
|
|
|
|
004
|
N° du patient
|
|
|
|
005
|
N° UBC
|
|
|
|
N°
|
Question et filtre
|
|
Réponse
|
|
Code
|
Passer à
|
|
|
|
Ambulatoire
|
|
1
|
|
|
101
|
Patient
|
|
|
|
|
|
|
|
|
Hospitalisé(e)
|
|
2
|
|
|
|
|
Homme
|
|
1
|
|
|
102
|
Sexe
|
|
|
|
|
|
|
|
|
Femme
|
|
2
|
|
|
103
|
Age
|
|
|
|
|__|__|ans
|
|
|
|
|
|
|
NSP
|
|
|
Poids
|
|
|__|Kg
|
|
|
|
|
|
|
Elève / Etudiant
|
|
1
|
|
|
|
|
Commerçant (e)
|
|
2
|
|
|
|
|
Profession libérale
|
|
3
|
|
|
104
|
Profession
|
|
Fonctionnaire
|
|
4
|
|
|
|
|
Retraité
|
|
5
|
|
|
|
|
Chômeur
|
|
6
|
|
|
|
|
Autre
|
|
7
|
|
|
105
|
Secteur d'activité
|
|
Privé
|
|
1
|
|
|
|
|
Publique
|
|
2
|
|
|
|
|
Primaire
|
|
1
|
|
|
|
|
Secondaire premier cycle
|
|
2
|
|
|
106
|
Niveau d'éducation
|
|
|
|
|
|
|
|
|
Secondaire second cycle
|
|
3
|
|
|
|
|
Supérieur
|
|
4
|
|
|
|
|
|
Catholique
|
1
|
|
|
|
|
|
Protestant
|
2
|
|
|
|
|
|
Musulman
|
3
|
|
|
107
|
Religion
|
|
|
|
|
|
|
|
|
|
Pentecôtiste
|
4
|
|
|
|
|
|
Musulman
|
5
|
|
|
|
|
Autre
|
|
6
|
|
|
|
|
|
Cours commune
|
1
|
|
|
|
|
|
Studio
|
2
|
|
|
108
|
|
Type de résidence
|
|
Appartement
|
3
|
|
|
|
|
|
Villa
|
4
|
|
|
|
|
Autre
|
|
5
|
|
II) Aspect clinique
|
N°
|
Question et filtre
|
Réponse
|
Code
|
Passer à
|
|
|
|
Oui Non
|
|
|
|
Fièvre
|
1 0
|
|
|
201
|
Motif de consultation
|
Douleur
|
1 0
|
|
|
(plusieurs choix possible)
|
Tuméfaction
|
1 0
|
|
|
|
Suppuration
|
1 0
|
|
|
|
Autres
|
1 0
|
|
|
|
|
Oui Non
|
|
|
|
Asthme
|
1 0
|
|
|
|
UGD
|
1 0
|
|
|
|
Allergie
|
1 0
|
|
|
|
Hépatopathies
|
1 0
|
|
|
|
Grossesse
|
1 0
|
|
|
202
|
Antécédents
|
Allaitante
|
1 0
|
|
|
(plusieurs choix possible)
|
Drépanocytose
|
1 0
|
|
|
|
Cardiopathies
|
1 0
|
|
|
|
RAA
|
1 0
|
|
|
|
Diabète
|
1 0
|
|
|
|
Tabagisme
|
1 0
|
|
|
|
Prurit
|
1 0
|
|
|
|
Autre
|
1 0
|
|
|
Risque d'infection
|
|
|
|
Oui Non
|
|
|
|
Immunodépression
|
1 0
|
|
|
|
Diabète
|
1 0
|
|
|
Risque A
|
|
|
|
|
203
|
|
Insuffisance rénale
|
1 0
|
|
|
(plusieurs choix possible)
|
Insuffisance hépatique
|
1 0
|
|
|
|
Dénutrition
|
1 0
|
|
|
|
Mauvaise hygiène bucco-dentaire
|
1 0
|
|
|
|
|
Oui Non
|
|
|
|
Infection sur prothèse dentaire
|
1 0
|
|
|
204
|
Sujet à risque d'infection à distance Risque B
(plusieurs
|
Endocardite infectieuse
|
1 0
|
|
|
choix possible)
|
Uvéite autre
|
1 0
1 0
|
|
III) Diagnostique clinique
|
N°
|
Question et filtre
|
Réponse
|
|
Code
|
Passer à
|
|
301
|
Caries
|
Email Dentine
|
|
1
2
|
|
|
302
|
Pulpopathies
|
Pulpites
Desmodontites Abcès péri-apical Granulome-kyste
radiculo-dentaire
Nécrose pulpaire
|
|
1
2
3
4
5
|
|
|
303
|
Traumatismes maxillo faciale
|
Plaies Fractures
|
|
1
2
|
|
|
304
|
Traumatismes alvéolo-dentaires
|
Simple
Compliqué (effraction de muqueuse et / ou associer)
|
|
1
2
|
|
|
305
|
Maladies parodontales
(plusieurs choix possible)
|
Gingivite chronique
Gingivite associée à des maladies
systémiques
Gingivite associée à la prise de
médicaments
Gingivite ulcéro-nécrotique aigue (GUNA)
Parodontites agressives Parodontite chronique Abcès
parodontal
|
Oui 1 1 1 1 1 1 1
|
Non
0 0 0 0 0 0 0
|
|
|
306
|
Accidents d'éruption dentaire
|
Dent temporaire
Dent permanente (péricoronarite)
|
|
1
2
|
|
|
307
|
Cellulites
(plusieurs choix possible)
|
Aiguë circonscrite
Aiguë diffusée
Chronique
Diffuse (de type gangréneux)
Actinomycose
cervico-faciale
|
Oui 1 1 1 1 1
|
Non 0 0 0 0 0
|
|
|
308
|
Ostéites
(plusieurs choix possible)
|
Alvéolite sèche
Alvéolite suppurée
Ostéite (maxillo-mandibulaire)
Ostéomyélite
|
Oui 1 1 1 1
|
Non 0 0 0 0
|
|
|
309
|
Stomatite
|
Oui
Non
|
|
1
2
|
|
|
310
|
Sous maxillites
|
Oui
Non
|
|
1
2
|
|
|
311
|
Parotides
|
Oui
Non
|
|
1
2
|
|
IV) ASPECT THERAPEUTIQUE
|
N°
|
Question et filtre
|
Réponse
|
Code
|
Passer à
|
|
401
|
Prise d'antibiotique avant consultation
|
Oui
Non
|
1
2
|
|
|
402
|
Nom commercial
|
|
|
|
403
|
Délai
|
Inf. à 5 jours
Sup à 5 jours
|
1
2
|
|
V) bactériologie
|
N° Question et filtre
Réponse
|
|
Microbiologie
|
|
504
|
Mode de prélèvement
|
Seringue Ecouvillon curetage
|
1
2
3
|
|
505
|
Heure de prélèvement
|
|__|__|h|__|__|mn
|
|
506
|
Heure d'arrivée au labo
|
|__|__|h|__|__|mn
|
|
507
|
Heure d'ensemencement
|
|__|__|h|__|__|mn
|
|
508
|
Microbiologie
|
|
509
|
Examen macroscopique
|
Aspect
|
|
|
510
|
Couleur
|
|
|
511
|
Odeur
|
|
|
512
|
Examen microscopique : état frais
|
Leucocytes
|
/champs
|
|
513
|
Leucocytes
|
/mm3
|
|
514
|
Cellules épithéliales
|
/champs
|
|
515
|
Levure
|
Présence 1
Absence 2
|
|
516
|
Cristaux
|
Présence 1
Absence 2
|
|
517
|
Parasites
|
Présence 1
Absence 2
|
|
518
|
Cylindres
|
Présence 1
Absence 2
|
|
519
|
bactéries
|
|
|
520
|
Examen microscopique : coloration
|
Flore
|
|
|
521
|
Bacille gram négatif
|
Aérobie 1
Anaérobie 2
|
|
522
|
Coccidé
|
Gram négatif 1
Gram positif 2
|
|
523
|
Bacille gram positif
|
Aérobie 1
Anaérobie 2
|
|
524
|
Extra cellulaire Intra cellulaire
|
1
2
|
|
525
|
Polynucléaires
|
/champs
|
|
526
|
Polynucléaires
|
%
|
|
527
|
Lymphocytes
|
%
|
|
528
|
Culture
|
Négative Positive
|
1
2
|
|
529
|
Germes
|
- - - -
|
Antibiogramme
|
Sensible
|
Intermédiaire
|
Résistant
|
CMI ( g/ml)
|
|
Amoxicilline
|
|
|
|
|
|
Amoxicilline + Ac clavulanique
|
|
|
|
|
|
Pénicilline G
|
|
|
|
|
|
Pénicilline V
|
|
|
|
|
|
Céfazoline
|
|
|
|
|
|
Céfoxitine
|
|
|
|
|
|
Céfuroxime
|
|
|
|
|
|
Ceftazidime
|
|
|
|
|
|
Ceftriaxone
|
|
|
|
|
|
Céfixime
|
|
|
|
|
|
Céfalotine
|
|
|
|
|
|
Céfépime
|
|
|
|
|
|
|
|
|
|
|
Amikacine
|
|
|
|
|
|
Gentamicine
|
|
|
|
|
|
Nétilmicine
|
|
|
|
|
|
Kanamycine
|
|
|
|
|
|
|
|
|
|
|
Ofloxacine
|
|
|
|
|
|
Ciprofloxacine
|
|
|
|
|
|
|
|
|
|
|
Erythromycine
|
|
|
|
|
|
Lincomycine
|
|
|
|
|
|
Clarithromycine
|
|
|
|
|
|
Josamycine
|
|
|
|
|
|
Azithromycine
|
|
|
|
|
|
|
|
|
|
|
Métronidazole
|
|
|
|
|
|
|
|
|
|
|
Doxycycline
|
|
|
|
|
|
Tétracycline
|
|
|
|
|
|
|
|
|
|
|
Thiamphénicol
|
|
|
|
|
|
Chloramphénicol
|
|
|
|
|
|
|
|
|
|
|
Pipéracilline
|
|
|
|
|
|
Rifampicine
|
|
|
|
|
|
Ticarcilline
|
|
|
|
|
|
Aztréonam
|
|
|
|
|
|
Imipénème
|
|
|
|
|
|
Fosfomycine
|
|
|
|
|
|
Acide nalidixique
|
|
|
|
|
|
Cotrimoxazole
|
|
|
|
|

ETUDE Dr CHECHOM


Institut Pasteur de Côte d'Ivoire CHU de
Cocody
Département de Bactériologie -
Virologie Unité Bactériologie Clinique poste
6802
Bulletin de demande d'analyse en Bactériologie -
Virologie
I- Identification du patient
Date de prélèvement /
/«~«~ N° dossier
médical :«~«~«~«~«~«~
Nom:«~«~«~«~«~«~«~«~«~«~«~«~«~«~«~.
Prénom
:«~«~«~«~«~«~«~«~«~«~
Age
(jours/mois/années):«~«~«~«~«~«~«~«~
Sexe : M ? F ?
Poids de naissance en grammes
:«~«~«~«~«~
Quartier
:«~«~«~«~«~«~«~«~«~«~«~«~«~«~.
Ville : «~«~«~«~«~«~«~«~
Profession«~«~«~«~«~«~«~«~«~«~«~«~«~«~
Hospitalisation: oui ? non ?
|
Date hospitalisation : «~«~
/«~«~ /
|
|
N° chambre :
|
|
N° lit :
|
|
|
|
|
II- Service d'origine :
Pediatrie ? Stomato-CMF ? Nephrologie ?
Neonatologie ? Reanimation ? Neurologie ?
Gynecologie ? Chirurgie digestive ? Neurochirurgie ?
Medecine ? Chirurgie orthopedique ? PPH ?
Urgences chirurgie ? Chirurgie pediatrique ? Urgences Medecine
?
Urgences pediatrique ? Autres (à preciser)
:«~«~«~«~«~«~«~«~«~«~«~«~«~«~«~«~«~
III- Tableau clinique
Septicemie ? bacteriemie ? pneumonie ? Pleuresie ? bronchite
?
Meningite ? arthrite ? peritonite ? cystite ? pyelonephrite ?
Infection cutanee ? Autres
«~«~«~«~«~«~«~«~«~«~«~«~«~«~«~«~«~«~«~«~«~«~«~
Traitement antibiotique en cours non ? oui ?
jours
Si oui preciser le nom du ou des antibiotique(s)
: «~ Durée de l'antibiothérapie
Antécédents de gestes invasifs = 30
jours : catheterisme ? sondage urinaire ?
Drain ? escarre ou plaie ?
Dispositif à demeure : catheter veineux
? prothèse ? sonde urinaire ?
Depuis quand ? Preciser la date : /
/«~«~«~«~«~«~«~.
IV- Type analyse demandée
Hemoculture ? crachat lave ? aspiration bronchique ? ECBU ?
liquide pleural ? LCR culture ? LCR antigènes solubles ?
HLM ?
liquide articulaire ? ascite ? Liquide peritoneal ? coproculture
?
Pus cutanee ? abcès ? pus cellulite ? pus oreille ?
Materiel : sonde ? valves ? drain ? autres
«~«~«~«~
Nom Médecin traitant
:«~«~«~«~«~«~«~«~«~«~«~.
Tel du service
:«~«~«~«~«~«~«~«~«~«~«~«~«~«~
Date
:«~«~«~«~«~«~«~«~«~«~«~«~«~
Cachet et signature
RESUME
Les infections en stomatologie et chirurgie maxillo-faciale
viennent en deuxième position dans les pathologies du service de
stomatologie et chirurgie maxillo-faciale au CHU de Cocody où elles ont
représenté prés de 30% en 2005.
Devant le pronostic sévère de ces infections, et la
résistance de plus e plus élevée des bactéries aux
antibiotiques, il nous a donc paru opportun et intéressant
d'étudier le profil bactériologique des infections en
stomatologie et chirurgie maxillo-faciale.

Les objectifs de notre travail sont :
D'évaluer les techniques de prélèvement,
De déterminer la prévalence des bactéries
isolées,
De déterminer le niveau de sensibilité des
bactéries vis-à-vis des antibiotiques, De proposer des protocoles
thérapeutiques.
Cette étude s'est déroulé au service de
stomatologie et chirurgie maxillo-faciale du CHU de Cocody et a porté
sur 46 patients présentant une infection stomatologique et
maxillo-faciale durant la période de novembre 2008 à juin
2009.
Il ressort de notre travail que :
> Les pathologies fréquemment rencontrées
s'observent chez les sujets jeunes (16 - 31 ans) et de classe sociale
défavorisée avec 34,70% de sans emploi.
> La carie dentaire occupe le premier rang de l'origine
probable des infections avec 82,60% des cas.
> Les facteurs de risque sont représentés par
une mauvaise hygiène bucco-dentaire dans 78,26% des cas > Les
cellulites viennent en première position des infections en stomatologie
et chirurgie maxillo-faciale.
> L'écosystème bactérien est
représenté (dans la population infectée) par les
staphylocoques (55%) suivi des
entérocoques (25%), des bacilles Gram négatif non
entérocoque (15%) et des anaérobies (5%). > Les staphylocoques
présentent une bonne sensibilité aux aminosides, aux
fluoquinolones, aux
céphalosporines de troisième
génération et aux macrolides.
> Les entérobactéries sont sensibles aux
aminosides, à l'amoxicilline-acide clavulanique et aux
céphalosporines
> Les non entérobactéries sont sensibles aux
aminosides, et aux â-lactamines
Le choix de l'antibiothérapie doit obligatoirement passer
par la connaissance de notre écosystème bactérien,
d'où l'intérêt d'étendre ce type d'étude a
d'autres services hospitaliers.
Mots dles : Stomatologie - Profil
bactériologique - Infections - Antibiothérapie
| 


