|

UNIVERSITE CHEIKH ANTA DIOP DE DAKAR
FACULTE DE MEDECINE, DE PHARMACIE ET
D'ODONTOSTOMATOLOGIE
LA POLYARTHRITE RHUMATOÏDE
EN MILIEU RURAL AU SENEGAL
MEMOIRE
POUR L'OBTENTION DU CERTIFICAT D'ETUDES SPECIALES
EN
MEDECINE INTERNE
PRESENTE ET SOUTENU PUBLIQUEMENT
Le 10 Mai
2010
PAR
Dr Fernando KEMTA LEKPA
MEMBRES DU JURY
PRESIDENTE : Mme Thérèse MOREIRA
DIOP : Professeur
MEMBRES : M. Mamadou Mourtalla KA :
Professeur
M. Abdoulaye POUYE : Professeur
DIRECTEUR DE MEMOIRE : M. Souhaïbou NDONGO :
Maître Assistant
ANNEE: 2010 N° 282
SOMMAIRE
ABBREVIATIONS 3
I INTRODUCTION 4
II RAPPEL 6
1. Epidémiologie 7
2. Etiopathogénie 7
3. Diagnostic 8
4. Evolution 10
5. Traitement 10
III METHODOLOGIE 12
1. Cadre d'étude 13
2. Type et période d'étude 13
3. Population d'étude 13
4. Recueil de données 14
5. Analyse des données 16
6. Aspects éthiques 16
III RESULTATS 17
IV DISCUSSION 25
1. Limites de l'étude 26
2. Nos résultats 27
2.1. Fréquence de la PR chez les patients vivant en milieu
rural 27
2.2. Données sociodémographiques 28
2.3. Caractéristiques cliniques, biologiques et
immunologiques 29
V CONCLUSION 31
VI REFERENCES 33
Annexes 39
Abstract 43
ABBREVIATIONS
PR : polyarthrite rhumatoïde
RIC : rhumatisme inflammatoire chronique ACR : American College
of Rheumatology
EULAR : European League Against Rheumatism CHU : Centre
Hospitalier Universitaire
IPP : inter-phalangiennes proximales MCP :
métacarpo-phalangiennes
MTP : métatarso-phalangiennes
EVA : échelle visuelle analogique
ACPA : Anti-citrullinated protein/peptide antibodies
Ac anti-CCP : anticorps anti-peptides cycliques
citrullinés
FR : facteur rhumatoïde
VS : Vitesse de sédimentation
CRP : C réactive protéine
DAS28 : disease activity score 28

INTRODUCTION
La polyarthrite rhumatoïde (PR), autrefois appelée
polyarthrite chronique évolutive, est une maladie inflammatoire du tissu
conjonctif, à prédominance synoviale [1].
La PR est le rhumatisme inflammatoire chronique (RIC) le plus
fréquent, avec une prévalence variable d'une région
à une autre, estimée entre 0.3 et 1.2% dans les séries
occidentales [1,2]. Comme beaucoup de maladies auto-immunes, c'est une
affection polyfactorielle relevant de facteurs psychologiques, endocriniens,
environnementaux, génétiques et immunologiques. Les facteurs
génétiques ne représentent que 30 % des facteurs
favorisant la PR. C'est dire l'importance des facteurs environnementaux qui
expliquent peutêtre les différences de prévalence de la PR
selon les pays [2].
En Afrique subsaharienne, les données disponibles
retrouvent également une répartition
inégale d'une région à l'autre du continent,
parfois mrme dans le mrme pays, avec des prévalences variant de 0 et
3.3% [3-6], suggérant des facteurs environnementaux.
Au Sénégal, l'incidence hospitalière au
Centre Hospitalier Universitaire (CHU) Aristide Le Dantec de Dakar est
estimée à 0.16 % [7].Selon des études sud africaine et
nigériane, la prévalence de la PR serait faible voire nulle en
milieu rural, avec des taux de 0 à 0.68% [4-6], peut ~tre en raison de
la rareté de l'épitope partagé HLA-DRB1 [6]. Cette
rareté de la PR en milieu rural n'est pas retrouvée dans toutes
les études [8-10].
Aussi avons nous initié ce travail avec pour objectifs
:
· mesurer l'incidence de la PR en milieu rural
sénégalais ;
· déterminer ses caractéristiques
· rechercher les différences potentielles entre la
PR en milieu rural et la PR en milieu urbain au Sénégal.

RAPPEL
1. Epidémiologie
La PR est présente dans le monde entier. Il existe de
grandes variations de prévalence en fonction du pays et des ethnies
[1,2,11]. Ainsi, en Europe et en Amérique du Nord, la prévalence
rapportée est de l'ordre de 0.8% de la population adulte, alors qu'elle
varie de 0.3 à 0.8% en Asie. La prévalence de la PR est
particulièrement élevée dans certaines populations
indiennes oil le taux de consanguinité est important. Par contre, la PR
est rare en chine, à la fois en milieu rural et urbain [1,2,11]. En
Afrique, dans certaines ethnies sud-africaines, la PR est
particulièrement fréquente, avec de forte prévalence,
atteignant 3.3% de la population [3]. Cette forte prévalence se
rencontre uniquement en milieu urbain, alors qu'elle est exceptionnelle en zone
rurale [4-6].
2. Etiopathogenie
Des progrès considérables ont été
réalisés dans la compréhension de la physiopathologie de
la PR. Toutefois, son origine reste toujours inconnue. Plusieurs facteurs
interviennent dans le déclenchement de la maladie : des facteurs
hormonaux, le terrain génétique prédisposé, et les
facteurs environnementaux. Lorsque tous ces facteurs sont réunis, ils
activent une réponse immunitaire innée et acquise
incontrôlées qui se traduit par une réaction inflammatoire
exagérée, en particulier au niveau de la membrane synoviale
[12].
La plus grande incidence de la PR chez la femme suggère
une implication des hormones dans le déclenchement de la PR. Par
ailleurs, pendant la grossesse, le risque de développer une PR est
faible tandis que dans l'année qui suit le post partum, ce risque est
nettement plus élevé. De plus, une rémission clinique est
fréquente durant la grossesse [2].
Sur le plan génétique, l'association la plus
forte est observée avec les gènes codant pour les
molécules HLA de classe II. En Europe et en Amérique du Nord, la
PR est associée aux allèles HLA-DRB1*0410, DRB1*0404 et DRB1*0101
[2]. Au Sénégal, dans une étude
réalisée chez 34 patients ayant une PR, une
association positive avait été retrouvée avec les
allèles HLA DR10 et HLA DR3 [13].
Les facteurs environnementaux tiennent une place importante
dans le déclenchement, voire l'entretien de la maladie. Les plus connus
sont les agents infectieux ; viraux (Epstein Barr virus) ou bactériens
(Escherichia coli, Mycobacterium tuberculosis...), le statut social,
la vie urbaine par rapport au mode de vie rural, le stress et le tabagisme
[1,2,12,14,15,16].
3. Diagnostic
La PR est classée parmi les maladies systémiques
(existence de manifestations extraarticulaires), les maladies auto-immunes
(présence d'auto-anticorps, le facteur rhumatoïde, ACPA...) et les
rhumatismes inflammatoires chroniques (caractère inflammatoire de la
polyarthrite et évolution chronique, c'est à dire
supérieure à 3 mois).
La PR réalise un tableau de polysynovite,
caractérisé par une évolution chronique, progressive et
une tendance érosive ou destructrice vis-à-vis des
éléments constituant l'articulation [1,2].
Le diagnostic se fait actuellement à partir des
Critères de classification de la PR de l'American College of
Rheumatology (ACR) définis en 1958 puis révisés en 1987.
Ces critères ont une sensibilité de 91% et une
spécificité de 89% [17]. Les critères ACR de 1987 sont
souvent pris à défaut à la phase de PR débutante.
En effet, il est rare qu'une PR débutante soit d'emblée
séropositive, nodulaire et érosive. De plus, ces critères
n'intègrent pas les anticorps anti-peptides cycliques citrullinés
(Ac anti-CCP ou ACPA), dont la valeur diagnostique est reconnue et
validée. Ainsi, le diagnostic repose sur un faisceau d'arguments
cliniques, biologiques, immunologiques et radiologiques.
La nécessité d'un diagnostic précoce est
actuellement primordiale du fait de l'évolution
des traitements utilisés dans la PR. Au début de la
maladie, le traitement à le plus de chance
d'rtre efficace. En effet, à ce stade, il n'existe pas
encore de lésions irréversibles et les traitements de fonds
actuels, conventionnels ou les biothérapies, sont capables de limiter la
progression de la maladie [2]. Le principal objectif thérapeutique
actuel (traiter vite et fort !) est de mettre le patient en
rémission clinique et de prévenir la destruction articulaire par
une intervention aussi précoce que possible, comme l'atteste les
données issues du suivi des cohortes de patients ayant une PR
débutante [18].
L'ACR et l'European League Against Rheumatism (EULAR) ont
proposé de nouveaux
critères lors du congrès annuel de l'ACR en
octobre 2009 (cf. Annexe 1) [19-23] avec pour objectif d'identifier des
patients avec une arthrite inflammatoire récente et de les traiter pour
prévenir le développement de la maladie qui pourrait remplir les
critères ACR de 1987.
L'activité de la maladie peut ~tre
évaluée par plusieurs indices composites : le disease activity
score (DAS ou DAS44) et sa version réduite, le DAS28, le simplified
disease activity index (SDAI) et sa version modifiée, le clinical
disease activity index (CDAI) [24].
Le DAS28 est actuellement l'indice le plus utilisé. Il
est plus permissif dans sa définition de la rémission. Le DAS28
tient compte de l'indice articulaire, de l'indice synovial, de la
première heure de la VS ou la CRP et de l'appréciation global du
patient (évalue le retentissement global de la PR sur les
activités quotidiennes sur une échelle EVA de 0 à 100
selon la sévérité) [25]. En dépit des limites du
plateau technique, toutes les composantes du DAS 28 sont accessibles dans nos
contrées.
Le DAS28 est obtenue à partir de la formule suivante [25]
:
DAS28 (VS) = 0,55 x v (Indice articulaire) + 0,284 x
v (synovites) + 0,33 x log VS + 0,0142 x EVA globale du
patient.
OU
DAS28 (CRP) = 0,56 x v (Indice articulaire) + 0,28 x
v (synovites) + 0,36 x ln CRP + 0,014 x EVA globale du patient +
0.96.
Les 28 sites articulaires (épaules, coudes, poignets, MCP,
IPP, genoux) sont évalués par mobilisation ou par pression (cf.
Annexe 2).
La PR est considérée comme [25] :
· très active si le DAS28 > 5.1,
· modérée si le DAS28 varie entre 3.2 et 5.1
inclus,
· faible si le DAS28 < 3.2,
Des calculatrices de poche (DAS28 calculator) existent
pour le calcul rapide du DAS28.
4. Evolution
La PR est une maladie très
hétérogène dont l'évolution est extr~mement
variable d'un patient à l'autre. Il existe des formes
sévères, avec soit des destructions articulaires rapides, source
d'un handicap fonctionnel important, soit des atteintes viscérales
pouvant mettre en jeu le pronostic vital. - l'opposé, la PR peut ~tre
bénigne, pouvant guérir complètement, soit entraîner
peu ou pas de gêne fonctionnelle, avec des lésions radiographiques
et des déformations minimes, voire inexistantes mrme après de
longues années d'évolution [2].
Des remissions spontanées sont fréquentes au cours
de la PR. Elles surviennent surtout au début de la maladie et peuvent
durer de quelques mois à plusieurs années.
Les facteurs prédictifs de l'évolution vers une
PR sévères sont : le syndrome inflammatoire biologique, la
présence d'auto-anticorps (FR et ACPA), les lésions
radiographiques initiales et à un moindre degré les gènes
HLA DRB1*04 [2].
5. Traitement
La prise en charge thérapeutique de la PR a connu de
profonds changements au cours de ces dernières années [26]. Ces
changements ont été motivés par :
· la mise à disposition de médicaments
plus performants :
- traitements de fonds ou DMARDs (méthotrexate,
hydroxychloroquine, leflunomide, sulfasalazine...)
- biothérapies : inhibiteurs du TNFá ou
anti-TNFá (infliximab, etanercept,
adalimumab, golimumab), rituximab, abatacept, tociluzumab,
anakinra...
· la démonstration scientifique de nouveaux
concepts, conduisant à de nouvelles
stratégies thérapeutiques et à des objectifs
plus ambitieux :
- nécessité de l'instauration d'un traitement
efficace le plus rapidement possible (traiter vite et fort !)
- supériorité des traitements « intensifs
» précoces
- surveillance étroite de l'activité de la maladie
afin de réadapter régulièrement la stratégie
thérapeutique.
Les objectifs du traitement de la PR sont le contrôle de la
douleur et de l'inflammation, le maintien de la qualité de vie, de la
fonction et de l'insertion socioprofessionnelle [2,26].
Le traitement médicamenteux initial repose actuellement
sur l'association de corticoïdes à « dose rhumatoïde
» (0,15mg/kg/24h, soit moins de 10mg/j de prednisone) et de traitements de
fond, d'autant plus efficace qu'ils sont instaurés tôt dans
l'évolution [26]. En cas d'efficacité insuffisante, l'utilisation
des biothérapies, en particulier les anti-TNFá est
envisagée [26]. En raison des conditions socioéconomiques
défavorables en Afrique subsaharienne, le choix thérapeutique
dépend des disponibilités locales [16]. Le méthotrexate
(« pierre angulaire » du traitement) et l'hydroxychloroquine sont les
principaux traitements de fond utilisés en Afrique noire [27-31].

METHODOLOGIE
1. Cadre d'étude
Notre étude a été conçue et
réalisée par la consultation de rhumatologie de la Clinique
Médicale I (service de Médecine Interne) du centre hospitalier
universitaire Aristide Le Dantec de Dakar, Sénégal ;
établissement public de santé de niveau III, situé au
sommet de la pyramide sanitaire du Sénégal. Ce service comprend 3
unités : une unité d'hospitalisation, une unité
d'échographie et une unité de consultation externe. Les patients
reçus en consultation de rhumatologie viennent d'eux-mêmes ou sont
référés des différentes consultations
médicales et chirurgicales de l'hôpital, des centres hospitaliers
de la région de Dakar, et des autres régions du
Sénégal.
2. Type et période d'étude
Nous avons réalisé une étude prospective
de cohorte, descriptive et analytique entre le 1er juin 2006 et le
31 mai 2009, soit une durée de 3ans. Elle portait sur tous les dossiers
des patients reçus durant cette période en consultation externe
de rhumatologie pour PR.
Cette étude était non interventionnelle : aucun
examen complémentaire spécifique (hormis ceux ayant un
intérêt diagnostique et thérapeutique validé), ni
intervention thérapeutique n'ont été
réalisé.
3. Population d'étude
3.1. Critéres d'inclusion
Ont été inclus tous les dossiers de patient de la
consultation de rhumatologie ayant un diagnostic de PR, définie selon
les critères de l'ACR révisés en 1987 [17].
Ces critères sont les suivants :
1. Raideur articulaire matinale de durée > 1 heure
avant l'amélioration maximale.
2. Gonflement des parties molles, touchant au moins 3 groupes
articulaires simultanément, observé par un médecin.
3. Gonflement d'au moins une articulation des mains (poignet,
MCP, IPP) durant un minimum de 6 semaines, observé par un
médecin.
4. Atteinte articulaire simultanée symétrique (une
atteinte bilatérale sans symétrie absolue des MCP, IPP ou MTP est
acceptée).
5. Nodules rhumatoïdes, sous-cutanés, en regard des
proéminences osseuses, des surfaces d'extension, ou des régions
para-articulaires, observés par un médecin.
6. Facteur rhumatoïde sérique positif.
7. Modifications radiologiques typiques de PR des mains (MCP,
IPP) et poignets avec présence obligatoire d'érosions ou de
déminéralisation osseuse touchant les articulations atteintes de
façon exclusive et prédominante.
Les critères 1 à 4 doivent Etre présents
depuis au moins 6 semaines.
Le diagnostic de PR est posé lorsque 4 critères ou
plus sur les 7 sont présents.
3.2. Critères de non inclusion
Ont été exclus :
- Tous les cas de PR reçus en consultation de
rhumatologie durant cette période, avec un diagnostic antérieur
à la période d'étude ;
- Tous les cas de RIC ou autres arthropathies qui ne
remplissaient pas les critères de classification de la PR ;
- Tous les dossiers de patients ne faisant pas apparaître
de façon claire le lieu d'habitat.
3.3.Définition du milieu géographique
(urbain et rural)
Le territoire sénégalais est compris entre
12°8 et 16°41 de latitude Nord et 11°21 et 17°32 de
longitude Ouest.
Le milieu rural englobe l'ensemble de la population et du
territoire situés en dehors des agglomérations urbaines. Le
milieu rural, essentiellement agro-pastoral, constitue le lieu de production
d'une grande partie des denrées et des matières
premières.
Ainsi, nous avons défini le milieu urbain comme
étant constitué essentiellement par la ville de Dakar, mais aussi
les différents chefs lieux de régions du Sénégal.
Le milieu rural quant-à lui regroupait toutes les autres
localités du Sénégal (Annexe 3 : carte du
Sénégal).
Source :
http://www.habitation.gouv.qc.ca/bibliotheque/habitat_en_bref/HB024.pdf;
http://environnement.wallonie.be/pedd/C0e
5-2b.htm.
4. Recueil des données
Pour chaque dossier de patient retenu, une fiche de recueil des
données comportant les éléments suivants a
été établie :
ü Données épidémiologiques :
âge, sexe, adresse et lieu d'habitat, profession, statut matrimonial ;
ü Données cliniques
- Antécédents, notion de tabagisme et/ ou
d'éthylisme;
-
;
Retard diagnostique, évalué en mois par rapport au
début de la symptomatologie clinique et au moment du diagnostic de PR
;
- Nombre d'articulations douloureuse
- Nombre d'articulations gonflées (indice synovial);
- Nombre d'articulations déformées et les
différents types de déformation ;
- Durée du dérouillage matinal en heure et nombre
de réveils nocturnes ;
- Manifestations extra-articulaires.
ü Données biologiques
- Numération formule sanguine ;
- Vitesse de sédimentation (VS) à la
première heure en mm ;
- C-réactive protéine (CRP) en mg/l.
ü Evaluation de l'activité de la PR au moment du
diagnostic gr~ce au score d'activité de la maladie basé sur 28
articulations, le DAS28 [25].
Les patients ont été classés en :
· PR très active si le DAS28 > 5.1,
· modérée si le DAS28 varie entre 3.2 et 5.1
inclus,
· faible si le DAS28 < 3.2,
· en rémission si le DAS28 < 2.6.
Données immunologiques :
- facteurs rhumatoïdes (FR) avec taux de Latex et de Waaler
Rose en UI ;
- anticorps anti-peptides cycliques citrullinés (Ac
anti-CCP ou ACPA) en UI.
5. Analyse des données
Les variables quantitatives sont décrites en termes de
médiane [1er quartile - 3e quartile] du fait du
caractère non gaussien de leur distribution. Les variables qualitatives
sont décrites en termes d'effectifs (pourcentage) pour chacune des
modalités de la variable.
Pour l'analyse en sous-groupe, les variables quantitatives
sont comparées à l'aide du test non paramétrique de
Wilcoxon-Mann-Whitney et les variables qualitatives avec un test du
Chi2 si les conditions d'application sont respectées ou un
test exact de Fisher dans le cas contraire, avec un seuil de
significativité pour p = 0.05.
6. Aspects éthiques
Les informations recueillies dans cette étude ont
été obtenues lors de l'interrogatoire des patients, avec leur
consentement. L'anonymat et la confidentialité des informations
recueillies ont été préservés.
Rappelons que cette étude était non
interventionnelle : aucun examen complémentaire spécifique
(hormis ceux ayant un intérêt diagnostique et thérapeutique
validé), ni intervention thérapeutique n'ont été
réalisé.

RESULTATS
Cent quatre vingt douze cas de PR ont été
recrutés dans la période d'étude. Douze patients ont
été exclus car le lieu d'habitat n'était pas clairement
défini.
Finalement, nous avons inclus 180 patients
dans cette étude. L'lge médian de ces patients était de
40.5 ans [31.0 - 52.5]. Les femmes représentaient 90.6% (n = 163) de
l'ensemble des effectifs, rural et urbain.
Parmi ces 180 patients, 143 (79.4%) habitaient en milieu urbain,
contre 37 patients (20.6%) en milieu rural (Figure 1).
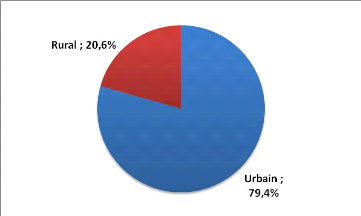
Figure 1 : Répartition des patients en fonction
de l'habitat
L'kge médian des patients vivant en milieu rural au
moment du diagnostic était de 44 ans [34 - 55]. Cet âge
était de 41 ans [30 - 53] pour le milieu urbain. La différence
n'était pas statistiquement significative (p = 0.24).
Par contre, il y avait significativement plus de sujets de moins
de 60 ans au moment du diagnostic en milieu urbain (p = 0.03) (Figure
2).
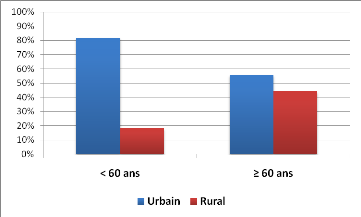
Figure 2 : Répartition des patients en fonction du
lieu d'habitation et de la tranche d'âge
En milieu urbain il y avait plus de femmes, alors qu'il
n'existait pas de différence pour les hommes. En effet, 30 femmes
(18,4%) vivaient en milieu rural contre 133 (81,6%) pour le milieu urbain.
Cette différence était statistiquement significative (p =
0.05). Ceci n'était pas le cas pour les hommes dont 7 (41,2%)
vivaient en milieu rural contre 10 (58,8%) en milieu urbain.
La répartition des patients selon le sexe et l'habitat est
présentée dans la Figure 3.
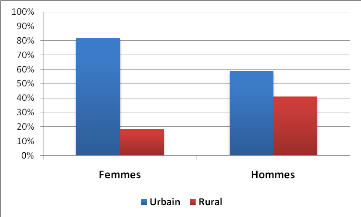
Figure 3 : Répartition des patients selon le
sexe et l'habitat
Un RIC familial (40.6%) et les avortements (26.1%) étaient
les principaux antécédents rapportés. Chez 39.9% des
patients, il n'existait pas d'antécédent
déclaré.
La notion de RIC familial n'a été renseignée
que chez 92 patients inclus dans notre
étude. Un RIC familial était
déclaré par 15 patients dont 11 (80.0%) vivaient en milieu rural
et 4 (20.0%) en milieu urbain. Chez 77 patients, aucun antécédent
de RIC dans la famille n'a été retrouvé, parmi lesquels 17
(22.1%) vivaient en milieu rural et 60 (77.9%) en milieu urbain.
La répartition des patients selon l'existence ou non d'un
RIC familial est résumée dans la Figure 4.
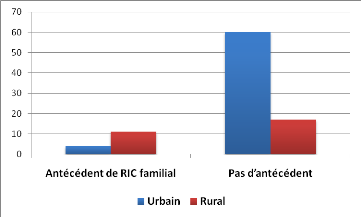
Figure 4 : Profil des patients ayant un
antécédent de RIC familial
La répartition des patientes selon l'existence ou non d'un
antécédent d'avortement est présentée dans la
Figure 5.
La notion d'avortement a été recherchée
chez 118 patientes lors de l'interrogatoire au moment du diagnostic.
L'existence d'un antécédent d'au moins 1 avortement a
été déclarée par 36 patientes, dont 13 (36.1%)
vivaient en milieu rural et 23 (63.9%) en milieu urbain. Aucun
antécédent d'avortement n'a été retrouvé
chez les 82 autres patientes sur les 118 initiales. Dans ce groupe, elles
étaient 10 patientes à vivre en milieu rural contre 72 en milieu
urbain.
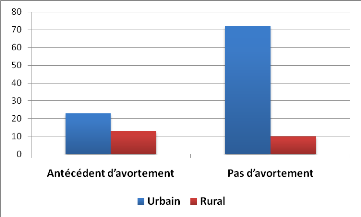
Figure 5 : Profil des patientes ayant un
antécédent d'avortement
Les caractéristiques cliniques, biologiques et
immunologiques de la répartition des patients en fonction du milieu
d'habitation sont résumées dans les Tableaux I et II.
Les manifestations extra-articulaires étaient
significativement plus fréquentes chez les patients vivants en milieu
rural (p = 0.02) (Figure 6 ; Tableau I).
Tableau I : Nombre de signes extra-articulaires en
fonction du lieu d'habitation
|
Milieu rural
n = 37 (20.6%)
|
Milieu urbain
n = 143 (79.4%)
|
p value
|
|
Nombre de signes
extra-articulaires
|
0
|
11 (29.7%)
|
73 (51.0%)
|
0.02
|
|
= 1
|
26 (70.3%)
|
70 (49.0%)
|
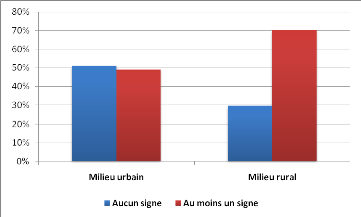
Figure 6 : Nombre de signes extra-articulaires en
fonction du milieu d'habitation
Il n'existait pas de différence statistiquement
significative selon le lieu d'habitation pour le retard diagnostique, les
déformations des mains, le nombre d'articulations gonflées,
l'activité de la maladie (DAS28) et le taux des auto-anticorps (FR et
ACPA).
Tableau II : Caractéristiques des patients en
fonction du lieu d'habitation(1)
|
Milieu rural
n = 37 (20.6%)
|
Milieu urbain
n = 143 (79.4%)
|
p value
|
|
Age (années)
|
44 [34 - 55]
|
41 [30 - 53]
|
0.24
|
|
Retard diagnostique (mois)
|
45 [26 - 82]
|
50 [35 - 92]
|
0.21
|
|
Déformations des mains
en...
|
Coup de vent cubital
|
13 (35.1%)
|
46 (32.2%)
|
0.73
|
|
Maillet
|
1 (2.7%)
|
8 (5.6%)
|
0.69(2)
|
|
Boutonnière
|
12 (32.4%)
|
43 (30.1%)
|
0.78
|
|
Col de cygne
|
1 (2.7%)
|
6 (4.2%)
|
>0.99(2)
|
|
Pouce en Z
|
7 (18.9%)
|
23 (16.1%)
|
0.68
|
|
Dos de chameau
|
2 (5.4%)
|
11 (7.7%)
|
>0.99(2)
|
|
Flessum
|
6 (16.2%)
|
23 (16.1%)
|
0.98
|
|
Touche de piano
|
0
|
3 (2.1%)
|
/
|
|
Pas de déformation
|
15 (40.5%)
|
62 (43.4%)
|
0.76
|
|
Nombre d'articulations gonflées
|
6 [2 - 12]
|
4 [2 - 12]
|
0.39
|
|
DAS 28
|
7.2 [6.4 - 7.7]
|
6.4 [4.7 - 7.3]
|
0.09
|
|
Auto-anticorps (UI)
|
FR - Latex
|
47 [30 - 64]
|
46 [16 - 64]
|
/
|
|
FR - Waaler Rose
|
48 [29 - 192]
|
32[12 - 140]
|
0.55
|
|
ACPA
|
63 [10 - 162]
|
95 [18 - 167]
|
0.38
|
1 Les variables qualitatives sont exprimées en nombres
(%), les variables quantitatives en médiane [intervalle interquartile].
2Test exact de ficher.

DISCUSSION
Depuis l'année 1965, la PR a fait l'objet de plusieurs
publications au Sénégal [7,13, 28- 43]. Toutes ces publications
ont concernée les différents aspects de la PR :
épidémiologiques [7,32-34], cliniques [7,32-37],
immuno-biologiques [7,32-34], génétiques [13], radiographiques
[7,32-34,38], évolutifs [7,32-37,39-43] et thérapeutiques
[28-31].
Malgré cet engouement pour cette pathologie
déclarée comme rare voire inexistante en Afrique subsaharienne,
en milieu rural en particulier [4-6], aucune étude ne s'est
spécifiquement intéressée à la PR en milieu rural
sénégalais.
C'est ainsi que cette étude a été
réalisée dans l'optique d'apprécier la
réalité de la PR et de déterminer ses
caractéristiques en milieu rural sénégalais. Les
résultats obtenus grâce à ce travail princeps nous
permettent de faire les commentaires suivants :
1. Limite de l'étude
Les principales limites de notre étude sont :
· La méthodologie utilisée. Une
étude de population aurait été souhaitable, non seulement
pour apprécier les caractéristiques de la PR en milieu rural mais
et surtout pour déterminer la prévalence réelle de la PR
au Sénégal.
· Le caractère rétrospectif, à
l'origine de données manquantes, pouvant entraîner des biais dans
l'interprétation de certains résultats. Par exemple, le DAS 28
n'était pas renseigné ou calculable chez 109 patients.
· Le caractère mono-centrique de notre
recrutement de patients. Ceci tient essentiellement au nombre limité de
rhumatologue exerçant au Sénégal. Le CHU Aristide Le
Dantec de Dakar est l'une des rares structures sanitaires publiques au
Sénégal à disposer d'une consultation de rhumatologie.
· L'absence de données radiologiques. Son
impact nous paraît limité car dans une étude
précédente, Ndongo et al. ont démontré que seuls
56% des patients avaient les lésions radiographiques au moment du
diagnostic de PR. Dans cette étude, le score de Sharp modifié par
Van Der Heijde était bas, à 21.8 #177; 47.7 [7].
2. Nos résultats
2.1. Fréquence de la PR chez les patients vivant
en milieu rural
La PR est une réalité en milieu rural
sénégalais. Elle concerne 20.6% des patients inclus dans notre
étude.
Ce résultat s'inscrit en faux avec certaines études
de population faite en milieu rural qui affirmaient la rareté voire
l'absence de PR en Afrique.
La PR semble toujours prédominer en milieu urbain
[3,8,9]. La différence entre 2 études sud-africaines urbaine [3]
et rurale [4] réalisées en 1975, utilisant la même
méthodologie, était statistiquement significative (p<0.01)
[12].
Cependant, il est à noter que des prévalences
élevées de PR avaient été retrouvées dans
d'autres populations rurales sud-africaines [10] et du Lesotho [8,9]. A noter
que 80% de la population du Lesotho est rurale [8].
Les raisons de cette disparité des prévalences
de la PR en Afrique restent inconnues. La rareté de l'épitope
partagé HLA-DRB1 jadis suggérée [6] n'a pas
été retrouvée dans une étude menée chez les
africains-américains [44]. Les facteurs génétiques et
environnementaux ont été évoqués par plusieurs
auteurs [3,14,15,45]. Toutefois, les divergences ethniques et
génétiques semblent ne pas avoir de grand impact [3]. Les
facteurs sociaux ou environnementaux (stress, activité physique,
infections, malnutrition, tabagisme...) pourraient
jouer un rôle majeur, renforcé par les
changements de style de vie des populations africaines, en particulier celles
vivant en milieux urbains [3,15,45]. D'autres auteurs ont suggéré
que l'accès limité aux structures sanitaires contribuerait
à expliquer cette disparité milieu rural - milieu urbain [14,45].
Les ressources financières limitées des populations africaines et
le recours aux tradipraticiens pourraient aussi contribuer à
réduire le nombre de patients consultant en milieu
spécialisé de rhumatologie.
D' autre part une forte mortalité a été
retrouvée en milieu rural et attribuée aux difficultés
d'accès aux structures sanitaires [14]. Ainsi, le taux de 20.6% de PR
retrouvé parmi les patients vivant en milieu rural dans notre
étude représenterait la partie visible de l'iceberg. Des
investigations approfondies sont nécessaires pour mieux expliquer cette
différence.
2.2. Données sociodémographiques
Age
Dans une précédente étude, nous avions
démontré que l'~ge au moment du diagnostic de la PR au
Sénégal était de 40.29 #177; 15.46 ans [7]. Cet âge
est concordant à celui observé chez les patients inclus dans la
présente étude, à savoir 44 ans [34 - 55] en milieu rural
contre 41 ans [30 - 53] en milieu urbain. La différence entre ces 2
groupes n'était pas significative (p = 0.24). Ces
données constituent un argument supplémentaire en faveur d'un ~ge
moyen de début de la PR plus bas dans la race noire [16,45].
De façon statistiquement significative, les sujets de
moins de 60 ans au moment du diagnostic vivaient plus souvent en milieu urbain
(p = 0.03). Ce résultat est concordant avec la
répartition de la population sénégalaise constituée
de 58.9% de ruraux.
Sexe
La prédominance féminine observée dans
notre étude est également conforme aux données de la
littérature. Toutefois, le rapport femme/homme varie d'une région
à l'autre du continent, allant de 0.9 au Nigeria [46] à 3.7 en
Afrique du Sud [27]. Ces chiffres sont inférieurs au taux de 7.3
retrouvé dans l'étude de Ndongo et al. en 2009 [7]. Le
phénomène d'exode rural, intéressant plus les hommes ne
pourrait pas, à lui seul expliquer la plus grande fréquence des
femmes en milieu urbain.
Dans notre étude, ce rapport était de 9.58 pour
toute la population d'étude, 4.28 en milieu rural et 13.3 en milieu
urbain.
Nous ne disposons par d'argument pouvant expliquer la plus
forte fréquence des femmes en milieu urbain. Les hommes ayant une PR
auraient-ils tendance à migrer moins vers la ville ?
Antécédents
La notion d'antécédent de Rhumatisme
Inflammatoire Chronique (RIC) familial ou d'avortement a été
rapportée dans certains dossiers de patients. Les groupes de patients
n'étant pas indépendants, ils ne sont donc pas comparables par
des tests statistiques. L'analyse ne peut alors ~tre que descriptive. Il semble
ne pas avoir d'influence de ces 2 types d'antécédents sur le lieu
d'habitat. Toutefois, les patients vivant en milieu rural ont une tendance
à rapporter plus souvent des antécédents de RIC dans leur
famille ou d'avortement. La notion d'éthylisme n'a pas été
retrouvée dans notre étude. Le tabagisme n'a été
déclaré que par 4 patients.
2.3. Caractéristiques cliniques, biologiques et
immunologiques
En dehors du nombre de manifestations extra-articulaires, nous
n'avons pas retrouvé de différence significative entre les
manifestations cliniques, biologiques et immunologiques de la PR en milieu
rural et urbain. L'absence de différence au cours de la PR chez des
patients vivant en milieu rural et urbain avait également
été retrouvée chez les sujets de race noire du Zimbabwe
[47].
Le retard diagnostique semblait plus court chez les patients
vivant en milieu rural mais cette différence n'était pas
significative (p = 0.21). Donc, paradoxalement, les patients vivant en
milieu rural seraient plus rapidement référés dans notre
hôpital que ceux vivant en milieu urbain. L'handicap chez un travailleur
manuel le pousserait-il à consulter plus vite ?

CONCLUSION
La PR existe en milieu rural sénégalais. Elle
concerne 20.6% des patients suivis en consultation de rhumatologie. L'Ige des
patients, la présentation clinique, biologique et immunologique de la PR
ne différaient pas selon le lieu d'habitat. Par contre, les sujets de
moins de 60 ans et les femmes vivaient plus souvent en milieu urbain. Les
patients vivant en milieu rural avaient plus souvent des manifestations
extra-articulaires.
Les facteurs environnementaux ont probablement un rôle
majeur dans l'expression de la PR, quelque soit le lieu d'habitat, rural
ou urbain. Des études plus larges sont nécessaires pour mieux
comprendre cette disparité des prévalences en Afrique
subsaharienne et les facteurs associés pour une prise en charge
meilleure des patients ayant une PR en milieu urbain comme rural. Ce qui passe
aussi par la formation de nouveaux rhumatologues.

REFERENCES
1. Rheumatoid arthritis. In: Silman AJ, Horchberg MC, eds.
Epidemiology of the rheumatic diseases. Oxford: Oxford Medical Publications,
1993:7-68.
2. Combe B. Polyarthrite rhumatoïde : clinique et
diagnostic, EMC (Elsevier Masson SAS, Paris), Appareil locomoteur, 14-220-A-10,
2007.
3. Solomon L, Robin G, Valkenburg HA. Rheumatoid arthritis in an
urban South African Negro population. Ann Rheum Dis 1975;34:128-35.
4. Beighton P, Solomon L, Valkenburg HA. Rheumatoid arthritis in
a rural South African Negro population. Ann Rheum Dis 1975;34:136-41.
5. Brighton SW, de la Harpe AL, van Staden DJ, Badenhorst JH,
Myers OL. The prevalence of rheumatoid arthritis in a rural African population.
J Rheumatol 1988;15:405-8.
6. Silman AJ, Ollier W, Holligan S, et al. Absence of rheumatoid
arthritis in a rural Nigerian population. J Rheumatol 1993;20:618-22.
7. Ndongo S, Lekpa FK, Ka MM, Ndiaye N, Diop TM. Presentation
and severity of rheumatoid arthritis at diagnosis in Senegal. Rheumatology
(oxford) 2009;48:1111-3.
8. Moolenburgh JD, Moore S, Valkenburg HA, Erasmus MG.
Rheumatoid arthritis in Lesotho. Ann Rheum Dis 1984;43:40-3.
9. Moolenburgh JD, Valkenburg HA, Fourie PB. A population study
on rheumatoid arthritis in Lesotho, southern Africa. Ann Rheum Dis
1986;45(8):691-5.
10. Meyers OL, Daynes G, Beighton P. Rheumatoid arthritis in a
tribal Xhosa population in the Transkei, Southern Africa. Ann Rheum Dis
1977;36:62-5.
11. Saraux A. Epidémiologie de la polyarthrite
rhumatoïde. La lettre du rhumatologue 1999;253 :18-21.
12. Firestein GS. Evolving concepts of rheumatoid arthritis.
Nature 2003;423:356-61.
13. Dieye A, Diallo S, Diatta M, Thiam A, Ndiaye R, Bao O,
Sarthou JL. Identification of HLA-DR alleles for susceptibility to rheumatoid
polyarthritis in Senegal. Dakar Med 1997;42: 111-3.
14. McGill P. Rheumatoid arthritis in sub-Saharan Africa. Ann
Rheum Dis 1991;50:965- 6.
15. Mijiyawa M. Rheumatoid arthritis in Black Africa. Rev Med
Interne 1996; 17 :625-6.
16. Roux H. Polyarthrite rhumatoïde en Afrique
subsaharienne. Rev Rhum 2002 ;69 :797- 800.
17. Arnett FC, Edworthy SM, Bloch DA et al. The American
Rheumatism Association 1987 revised criteria for the classification of
rheumatoid arthritis. Arthritis Rheum 1988; 31: 315-24.
18. Smolen JS, Aletaha D, Bijlsma JW et al. Treating rheumatoid
arthritis to target: recommendations of an international task force. Ann Rheum
Dis 2010;69:631-7.
19. Emery P. The changing approach to RA: a need for new
definitions. Program and abstracts of the American College of Rheumatology 2009
Annual Meeting; October 17-21, 2009; Philadelphia, Pennsylvania.
20. Silman AJ. RA classification criteria: past, present and
future. Program and abstracts of the American College of Rheumatology 2009
Annual Meeting; October 17-21, 2009; Philadelphia, Pennsylvania.
21. Aletaha D. Developing new RA classification criteria:
learning from early disease cohort. Program and abstracts of the American
College of Rheumatology 2009 Annual Meeting; October 17-21, 2009; Philadelphia,
Pennsylvania.
22. Hawker GA. Developing new RA classification criteria:
reaching a consensus. Program and abstracts of the American College of
Rheumatology 2009 Annual Meeting; October 17-21, 2009; Philadelphia,
Pennsylvania.
23. Weinblatt ME. What might new RA classification criteria
mean for clinical trials and clinical practice? Program and abstracts of the
American College of Rheumatology 2009 Annual Meeting; October 17-21, 2009;
Philadelphia, Pennsylvania.
24. Gaujoux-Viala C, Mouterde G, Baillet A et al. Evaluation de
l'activité de la polyarthrite rhumatoïde, quel indice faut-il
utiliser ? Rev Rhum 2009;76:S3-S10.
25. Prevoo ML, van 't Hof MA, Kuper HH, van Leeuwen MA, van
de Putte LB, van Riel PL. Modified disease activity scores that include
twenty-eight-joint counts. Development and validation in a prospective
longitudinal study of patients with rheumatoid arthritis. Arthritis Rheum
1995;38:44-8.
26. Breedveld FC, Kalden JR. Appropriate and effective
management of rheumatoid arthritis. Ann Rheum Dis 2004;63:627-33.
27. Mody M, Meyers OL. Rheumatoid arthritis in black in South
Africa. Ann Rheum Dis 1989;48:69-72.
28. Ka MM, Diallo S, Mbengue M, Fary Ka E, Moreira Diop T.
Use of methotrexate in the management of rheumatoid arthritis in Dakar.
Potential pitfalls. Rev Rhum Engl Ed 1998;65:799-800.
29. Ka MM, Diallo S, Ka EF et al. Treatment of rheumatoid
polyarthritis with methotrexate in Dakar: efficacy, tolerance and cost. Sante
2000;10:65-8.
30. Ndongo S, Ka MM, Pouye A, Ka EF, Diallo S, Diop TM.
Undesirable effects of methothrexate during treatment of rheumatoid arthritis.
Dakar Med 2007;52:37-40.
31. Diouf ML, Diallo S, Mbengue M, Moreira-Diop T. Methotrexate,
liver and rheumatoid arthritis in tropical areas. Sante 2001;11:195-200.
32. Sankalé M, Sow AM, Diop B, Toure YI, Ruscher H.
General characteristics of rheumatoid polyarthritis in Senegal. Afr J Med Med
Sci 1976;5:273-7.
33. Sankalé M, Sow AM, Diop B, Touré YI,
Ruscher H. Rheumatoid polyarthritis in the black African (apropos of 43 cases
observed at Dakar). Bull Soc Med Afr Noire Lang Fr 1976;21:443-54.
34. Sankalé M, Sow AM, Diop B, Touré YI, Ruscher
H. Caractères généraux de la polyarthrite rhumatoïde
chez le noir africain. Concours med 1977;99: 1103-12.
35. Ducloux M, Couturier Y, Siegl F, Bobin P, Derrien JP.
Rheumatoid lung in a Senegalese woman?. Bull Soc Med Afr Noire Lang Fr
1970;15:27-31.
36. Ndongo S, Ka MM, Pouye A, Diallo S, Leye A, Diop TM.
Dilatation des bronches et polyarthrite rhumatoïde seronégative.
Médecine d'Afrique Noire 2006;53:121-3.
37. Diallo S, Ndiaye P, Diouf ML, Mbengue M, Pouye A, Ka MM,
Diop TM. Uvéite au cours de la polyarthrite rhumatoïde : à
propos d'une observation sénégalaise. Médecine d'Afrique
Noire 2009;56:249-52.
38. Cave L, Sankalé M, Bobo J, Moulanier M.
Considérations sur les aspects radiologiques des rhumatismes chroniques
chez le noir africain. Rhumatologie 1965;17:153.
39. Ka MM, Leye A, Dangou JM, et al. Multicentric
reticulohistiocytosis with a 20-year follow-up. Rev Med Interne
2002;23:779-83.
40. Niang A, Diallo S, Ka MM, et al. Hemophagocytic syndrome
complicating adult's seropositive rheumatoid arthritis. Rev Med Interne
2004;25:826-8.
41. Diallo M, Kane A, Sy N, Ndiaye B. Pyoderma gangrenosum in
dakar: about 14 cases. Dakar Med 2005;50:52-5.
42. Diallo S, Dia D, Fall S, et al. Diffuse interstitial lung
disease and connective tissue diseases: study of seven cases in Dakar. Dakar
Med 2008;53:255-9.
43. Diallo S, Ndongo S, Leye A, Pouye A, Ka MM, Diop TM.
Tuberculosis and systemic diseases: study of 8 Senegalese cases. Med Trop
(Mars) 2009;69:307-8.
44. Hughes LB, Morrison D, Kelley JM, et al. The HLA-DRB1
shared epitope is associated with susceptibility to rheumatoid arthritis in
African Americans through European genetic admixture. Arthritis Rheum
2008;58:349-58.
45. Mody GM. Rheumatoid arthritis and connective tissue
disorders: sub-Saharan Africa. Baillieres Clin Rheumatol 1995; 9: 31-44.
46. Greenwood BM. Polyarthritis in western Nigeria. I.
Rheumatoid arthritis. Ann Rheum Dis 1969;28:488-96.
47. Chikanza IC, Stein M, Lutalo S, Gibson T. The clinical,
serologic and radiologic features of rheumatoid arthritis in ethnic black
Zimbabwean and British Caucasian patients. J Rheumatol 1994;21:2011-5.

ANNEXES
Annexe 1
|
Critères ACR/EULAR 2009 de diagnostic de la
Polyarthrite Rhumatoïde
(d'après les communications de Emery P, Silman AJ,
Aletaha D, Hawker GA, Weinblatt ME. ACR 2009 [19-23])
ATTEINTE ARTICULAIRE (0-5)
|
|
1 articulation moyenne ou grosse
|
0
|
|
2-10 articulations moyennes ou grosses
|
1
|
|
1-3 petites articulations
|
2
|
|
4-10 petites articulations
|
3
|
|
> 10 articulations (au moins une petite
articulation)
|
5
|
|
SEROLOGIE (0-3)
|
|
|
FR et ACPA négatifs
|
0
|
|
Au moins 1 test faiblement positif (< 3 fois la
normale)
|
2
|
|
Au moins 1 test fortement positif = 3 fois la
normale)
|
3
|
|
DUREE DE LA SYNOVITE (0-1)
|
|
|
< 6 semaines
|
0
|
|
= 6 semaines
|
1
|
|
MARQUEURS DE L'INFLAMMATION (0-1)
|
|
|
CRP normale ET VS normale
|
0
|
|
CRP élevée OU VS
élevée
|
1
|
|
ACR/EULAR : score = 6
|
|
Annexe 2

(Consulté le 27 avril 2010 sur le site
http://revue.medhyg.ch/article.php3?sid=30226)
Annexe 3

RESUME
Rationnel : Plusieurs études ont
suggéré que la prévalence de la polyarthrite
rhumatoïde (PR) serait faible voire nulle en milieu rural en Afrique
subsaharienne.
Patients et méthodes : Nous avons
réalisé une étude prospective de cohorte du 1er juin 2006
au 31 mai 2009, soit une durée de 3 ans chez des patients atteints de PR
colligés à la consultation de rhumatologie du CHU Le Dantec,
Dakar, Sénégal. La fréquence des patients habitant en
milieu rural et les caractéristiques de leur maladie ont
été déterminées.
Résultats : Nous avons inclus 180
patients dans cette étude, dont 143 patients (79.4%) habitant en milieu
urbain, contre 37 (20.6%) en milieu rural. L'kge médian des patients
étaient de 44 ans [34-55] en milieu rural contre 41 ans [30- 53] en
milieu urbain, sans différence significative (p = 0.24). Les
sujets de moins de 60 ans vivaient plus souvent en milieu urbain (p =
0.03). Les manifestations extra-articulaires étaient
significativement plus fréquentes chez les patients vivants en milieu
rural (p = 0.02). Il n'existait pas de différence
statistiquement significative selon le lieu d'habitation pour le retard
diagnostique, le nombre d'articulations gonflées, l'activité de
la maladie, les déformations des mains, et le taux des auto-anticorps
(facteurs rhumatoïdes et ACPA).
Conclusion : La PR existe en milieu rural
sénégalais oil elle concerne 20.6% des patients suivi dans notre
département pour PR. Le nombre de manifestations extra-articulaires est
la principale différence entre chez les patients vivant en milieu rural
et urbain au Sénégal.
ABSTRACT
Rheumatoid arthritis in a rural Senegal
Backgroung: Several studies have suggested that
rheumatoid arthritis (RA) is uncommon in rural sub-Saharan Africa.
Objectives: To determinate the frequency of
patients living in rural areas with RA and the characteristics of their
disease
Patients and methods: We performed a
prospective study from June 2006 to May 2009 in patients with RA seen at the
Rheumatology consultation (Internal Medicine Department) of the Le Dantec
Teaching Hospital, Dakar, Senegal.
Results: We included 180 patients in this
study, with 143 patients (79.4%) living in urban areas vs. 37 (20.6%) in rural
areas. The median age was 44 years [34-55] in rural areas vs. 41 years [30-53]
in urban areas, without significant difference (p=0.24). Patients
under 60 years living mostly in urban areas (p=0.03). The
extra-articular manifestations were significantly more frequent in patients
living in rural areas (p=0.02). There was no statistically significant
difference according to place of residence for the delay in diagnosis, number
of swollen joints, disease activity, hand's deformations, and levels of
antoantibodies (RF and ACPA).
Conclusion: RA exists in a rural Senegal
where it concerns 20.6% of patients followed in our department for RF. The
number of extra-articular manifestations is the main difference between
patients living in rural and urban Senegal.
| 


