|

Synthèse de nouveaux polyesters aliphatiques par
polymérisation de lactones
Fonctionnalisées par catalyse
organométallique
Jean-Claude TOMANI et Hamad ELKAROUS
Centre d'Etude et de Recherche sur les Macromolécules
Monsieur P. Lecomte
Laboratoire de Chimie Macromoléculaire et de Catalyse
Organique
Monsieur A. Demonceau
Sous la tutelle de Raphaël RIVA et
Yannick BORGUET
1er Master

Année académique 2009-2010
Sommaire
1. Introduction 2
2. Synthèse des monomères 4
2.1 Synthèse de 2-Bromocyclohexanone 4
2.2 Synthése de l'a-bromo-e-caprolactone 5
3. Synthèse du copolymère 6
3.1 Synthèse du copolymère statistique, le
poly a-Bromo-e-caprolactone-e-caprolactone 6
3.2 Synthése de l'oléfine, le benzoate de
3-butényle 8
4. Fonctionnalisation par ATRA 8
4.1 Fonctionnalisation de
l'a-bromocyclohexanone 9
4.2 Fonctionnalisation du copolymère par ATRA
9
4.3 Fonctionnalisation du copolymère par ATRA sous la
catalyse de cuivre 12
5. Conclusion 12
6. Remerciements 13
7. Références bibliographiques 13
1. Introduction
Un polyester est un polymère dont le squelette
macromoléculaire est constitué de motifs répétitifs
contenant la fonction chimique ester.
De nos jours, une attention toute particulière est
portée aux polymères aux propriétés
biodégradables et biocompatibles [1,2]. Ceux-ci sont soit issus du
milieu naturel, soit d'origine pétrochimique. Particulièrement,
les polyesters aliphatiques tels que la poly-åcaprolactone (PCL) et les
polylactides (PLA) occupent une place remarquable suite à leur possible
dégradation totale en molécules de faible masse molaire sous
l'action de stimuli biologique ou physico-chimique; en CH4, CO2, H2O et
biomasse [2]. En effet, du fait qu'ils sont biodégradables,
biorésorbables et perméables à beaucoup de
médicaments, ils sont très utilisés en industries
pharmaceutiques et en différentes formulations galéniques [3].
Cependant, le domaine d'application de ces thermoplastiques est limité
par de basses températures de fusion (60 pour la PCL et 50 pour PLA).
Plusieurs stratégies sont mises en oeuvre pour palier
à ces problèmes de température de fusion et pour
étendre leur gamme de propriétés afin d'élargir
leur champ d'application. On peut citer la modification chimique ainsi que
l'architecture macromoléculaire mais la copolymérisation reste la
plus générale. En effet, le changement de structure et de teneur
ainsi que la distribution des comonomères conduisent à une
variété de nouveaux matériaux [4].
Pour obtenir un polymère porteur d'une fonction
chimique désirée, on peut soit fonctionnaliser des
monomères et ensuite les (co)polymériser ou soit procéder
d'abord à la polymérisation et fonctionnaliser le polymère
lors d'une seconde étape. Pour aboutir au copolymère
désiré, plusieurs méthodes sont proposées. On peut
recourir soit à la cycloaddition 1,3-dipolaire de Huisgen sous la
catalyse de cuivre (I) (« Chimie Click »), soit à l'addition
radicalaire par transfert d'atome (ATRA). Cependant, deux problèmes
majeurs sont liés à la réaction dite « Click ».
Il s'agit de la formation des intermédiaires portant une fonction
azoture qui est potentiellement explosif d'une part et de la présence
des résidus catalytiques (Cu+) qui restreindraient leur
utilisation d'autre part.
Quant à la réaction d'ATRA, elle est avantageuse
car elle ne nécessite pas la préparation d'intermédiaires
azotures. En effet, la réaction d'ATRA est une réaction de
Kharasch catalysée par des complexes métalliques (schéma
1).
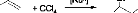
Schéma 1 : Réaction modèle d'ATRA
Récemment, quelques travaux en rapport avec l'ATRA ont
été reportés. S. Lenoir et al. [2] ont reporté en
2004 les résultats de l'ATRA sur une
poly(a-chloro-å-caprolactone-co-åcaprolactone)
(poly(aClåCL-co-åCL)) par catalyse au cuivre à 60°C
dans du DMF. Cependant, la quantité de catalyseur extrêmement
élevée ainsi que la présence de DMF reste un handicape
pour l'applicabilité de ces polymères. P. Jonlet, en 2009, dans
la perspective de palier à ces problèmes, a étudié
la fonctionnalisation de la poly(aClåCL-co-åCL) par ATRA sous la
catalyse de complexes de ruthénium mais le taux de fonctionnalisation
reste faible.
Ainsi, le but de notre travail était de préparer
des polyesters fonctionnels par ATRA, grace à l'intermédiaire
ct-bromo-å-caprolactone (ct-Br-å-CL), en présence de faible
quantité de catalyseur à basse température et en des temps
de réaction relativement courts. En effet, la liaison C-Br étant
plus labile que la liaison C-Cl, l'a-Br-å-CL est plus active que
a-Cl-å-CL, ce qui augmenterait le taux de fonctionnalisation par ATRA.
Au cours de notre stage, nous avons d'abord
synthétisé des monomères et réalisé leur
polymérisation avant de procéder à la fonctionnalisation
proprement dite. Typiquement, la cyclohexanone a été
bromée pour donner la 2-bromo-cyclohexanone qui ensuite a subi une
oxydation de Baeyer-Villiger pour donner l'a-Br-å-CL. Ensuite, nous avons
procédé à la copolymérisation de l'a-Br-å-CL
avec l'åCL. Le test de la réaction d'ATRA a été fait
sur la 2- bromocyclohexanone et sur le copolymère.
Pour le test sur la 2-bromocyclohexanone, 2 types de complexes
au ruthénium (Cata A et cata B), ont été utilisés
alors que sur le copolymère, seul le complexe bimétallique (cata
B) a été utilisé.

Cata A :
RuCl2(p-cymène)PPh3 Cata B :
Complexe de Severin [6]
2. Synthèse des monomères
2.1 Synthèse de 2-Bromocyclohexanone
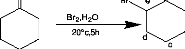

Schéma 2 : Synthèse de Bromocyclohexanone
La 2-bromocyclohexanone a été
synthétisée à partir de cyclohexanone comme décrit
par G. Wang et al [5]. Dans un ballon à deux tubulures de 250ml, muni
d'un thermomètre,
O
nous avons mélangé 15g de cyclohexanone avec
100ml d'eau distillée. Ensuite, 7,9 ml de
C
Br e
brome ont été ajoutés, goutte à
goutte pendant 4h. Puisque la réaction est exothermique, un
Br2,H2O C
bain de glace est utilisé pour rabaisser la
température de la réaction entre 20°C et 30°C.
Après
c,5 d
addition du brome, la solution est agitée
jusqu'à décoloration complète (pendant 1h). La phase
organique est ensuite séparée de la phase aqueuse et
séchée sur sulfate de magnésium anhydre. Le solvant est
évaporé sous pression réduite et le résidu est
distillé sous vide (5 10- 2mm de Hg/40°C). On
récupère 18,57g (68,77%) d'une huile incolore, qui se solidifie
lorsqu'on la place en chambre froide (-20°C), qui est alors
analysée par RMN.
RMN 1H (250MHz, CDCl3): ä (ppm) = 4,4 (m, 1H,
He); 2,8 (m, 2H, Ha); 1,7-2,3 (m, 6H, Hb, Hc,
Hd).
RMN 13C (63,5 MHz; CDCl3): ä(ppm) = 169,7 (CO);
53,6 (Ce); 37,9 (Cd); 36,8 (Ca); 226,7 (Cb); 22,1
(Cc).
2.2 6 QJKqseIdeI4'i-bromo-e-caprolactone
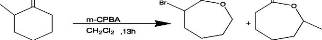
Schéma 3 : Synthèse de
l'a-bromo-e-caprolactone
L'ct-Br-E-GL a été synthétisée par
oxydation de Baeyer-Villiger de la 2- bromocyclohexanone par l'acide
m-chloroperoxybenzoique (m-GPBA) [2]. Dans un ballon de 100 ml, sont introduits
25ml de GH2Gl2 et 3g de 2-bromocyclohexanone. Ensuite, 4,3g de mGPBA ont
été ajoutés par petite portion sur bain de glace. La
solution est agitée à 0°c pendant une nuit, mise en chambre
froide (-20°G) pendant 1h30 et filtrée. 35ml de GH2Gl2 sont ensuite
ajoutés au filtrat (25ml) et la solution est lavée par 3 fois
20ml de Na2S2O3 diluée, 3 fois 20ml de NaHGO3 saturée,
suivi de 20ml de NaGl saturée, et enfin par 2 fois 20ml d'eau
distillée. Après lavage, la solution est séchée par
du MgSO4 anhydre, filtrée et séchée sous la rampe à
vide. Le produit brut est ensuite chromatographié par colonne de silice
(Ether de pétrole-
m-CPBA CHl2 3h
Ethylacétate 10 :3). Le solvant est évaporé
au rotavapor pour fournir 1,421g (43,3%) d'un solide blanc. La nature de
produit obtenu est confirmée par RMN.
RMN 1H (250MHz; GDGl3) (Figure 1) : ä(ppm) = 4,8
(m, 1H, Ha); 4,7 (m, 1H, He); 4,3 (m, 1H, He);
1,7-2,2 (m, 6H, Hb, Hc, Hd).
RMN 13G (63,5 MHz; GDGl3) : ä (ppm) = 169,6 (GO);
69,7 (Ge); 48,3 (Ge); 31,8 (Gb); 29,1 (Gd); 25,3
(Gc).
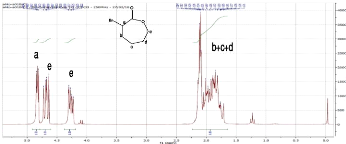
Figure 1: Spectre RMN 1H (GDGl3) de l'
a-Bromo-E-caprolactone.

Le produit n'est pas stable en dehors du frigo (-20°c), ce
qui se traduit par le rougissement de la solution dû à la
libération de brome.
3. Synthèse du copolymère
3.1 Synthèse du copolymère statistique, le
poly a-Bromo-e-caprolactone-e-caprolactone

Schéma 4 : Synthèse du copolymère
poly(a-Br-E-CL-co-E-CL)
La copolymérisation de a-Br-å-CL avec å-CL a
été amorcée par 2,2-dibutyl-2-Stanna1,3-Dioxépane
(DSDOP) dans du toluène à 40°C (schéma 3).
Dans un tube en verre, on conditionne sous atmosphere inerte
1,421g d'ct-Br-E-CL. Le
DSDO O
solide est alors séché par distillation
azéotropique (toluène). Ensuite, 5ml de toluène
anhydre,
40°c3h30min
Br
2.7ml d'ECL et 0,56ml de DSDOP 0,75M ont été
respectivement ajoutés à travers le septum sous flux d'azote. Le
tube est placé dans un bain d'huile de silicone à 40°C
pendant 3h30. A la fin de la réaction, 7ml de toluène sont
ajoutés. Le copolymère est alors précipité dans
l'heptane et cette suspension est placée en chambre froide (à
-20°C) pendant une nuit. Le copolymère est ensuite filtré,
séché et pesé (3,28g ; 78%). Ce dernier est alors
caractérisé par RMN (Figure 2) et GPC (UV à 260nm) (figure
3).
RMN 1H (250MHz; CDCl3): ä (ppm) = 4,2 (t, 1H,
Ha); 4,1 (m, 2H, He); 4(t, 2H, Hj); 3,6 (s, 2H, OH); 2,3 (t, 2H, Hb); 2,1 (t,
2H, Hf); 1,3-1,7 (m, 10H, Hc, Hd, Hg, Hh, Hj).
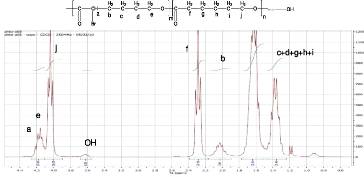

Figure 2 : Spectre RMN 1H (CDCl3) du
copolymère
La fraction molaire des comonomères dans le
copolymère est déterminée par RMN 1H. Par
comparaison avec le spectre RMN 1H de PCL [5], on observe une
apparition de deux nouveaux multiplets à ä=4,1 et 4,2ppm
(Ha + He) et ä = 1,95-2,05ppm (Hb de l'unité
monomérique a-Br-CL) dans le spectre RMN 1H du
copolymère. La fraction molaire de a-Brå-CL dans le
copolymère est donnée par le rapport des intégrales Hb sur
Hb+Hf et il est de 0,20. Les quantités utilisées pour
la copolymérisation étaient calculées pour obtenir un
copolymère de masse moléculaire égale à 10000 g/mol
et dont la fraction en a-Br-å-CL est de 25%. L'analyse du spectre RMN
1H a permis de déterminer que la masse moléculaire du
copolymère était de 9500 g/mol et que la fraction en a-Br-E-CL
était de 20%. La fraction obtenue reste inférieure à la
fraction théorique et cela serait dû du fait que
l'a-Br-å-CL
g
contenait des traces de solvant. Par CES (figure 5), on observe
une distribution monomodale
b
avec un indice de polydispersité de 1,4, ce qui est
couramment rencontré pour ce type de polymérisation.

Figure 3 : Chromatogramme GPC (THF) du copolymère
3.2 Synthèse de T'/TIfine1 1Te benzoate de
3-butényle
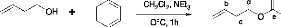

Schéma 5 : Synthèse de l'oléfine, le
benzoate de 3-butényle [6]
Cl
Dans un ballon à deux tubulures de 100ml, on introduit
40ml de CH2Cl2, 4,7ml de 3- butène-1-ol et 15,2ml de
triméthylamine respectivement. A cette solution, placée dans un
bain de glace, 9,54 ml de chlorure de benzoyle ont été
ajoutés goutte à goutte pendant 10min. Le milieu
réactionnel est maintenu sous agitation pendant 50min à
0oC et pendant 3h à la température ambiante. On ajoute
ensuite 50ml de HCl 1N et on extrait le produit par 30ml de diéthyl
éther. La phase organique est lavée par 50ml d'une solution
saturée en NaHCO3, puis séchée sur MgSO4. Le solvant est
évaporé sous pression réduite et le produit brut est
chromatographié sur colonne de silice (diéthylether-éther
de pétrole 2:98). Après évaporation du solvant, le
benzoate de 3-butényle est obtenu sous forme d'un liquide incolore
(7,66g ; 78,4%) de pureté 98% (GC), le produit est analysé par
RMN.
RMN 1H (250MHz; CDCl3) : ä(ppm)=7,5-8 (m, 5H,
Ph); 5,7 (m, 1H, Hb); 5,1 (m, 2H, Ha); 4,7 (m, 2H, Hd); 2 ,5 (m, 2H,
Hc).
RMN 13C (63,5MHz; CDCl3): ä (ppm)=165
(Ce); 130 (Ph); 115 (Ca, Cb); 65 (Cd); 32
(Cc).
4. Fonctionnalisation par ATRA
Les tests de fonctionnalisation ont été faits
à la fois sur la 2-bromocyclohexanone et sur le copolymère
statistique. Nous avons commencé la fonctionnalisation de la 2-
bromocyclohexanone, pour tenter de contourner les risques de
dégradations liées à l'ouverture de cycle lors de la
fonctionnalisation de l'a-Br-å-CL. Pour fonctionnaliser le
copolymère, nous avons utilisé le benzoate de 3-butényle
car sa détection UV (GPC), lors de la caractérisation, est
aisée.
4.1 Fonctionnalisation de l'i-bromocyclohexanone
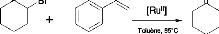
Schéma 6 : Fonctionnalisation l'a-bromocyclohexanone par
ATRA
[Ru]
Ph
Les tests d'ATRA sur cette molécule ont
été faits en utilisant le styrène, qui est une
oléfine activée. Pour ce faire, nous l'avons fait sous
différentes conditions en variant le type de pré-catalyseur. Deux
Types de catalyseurs ont été utilisés. Dans tous les cas,
une masse de catalyseur (5% en moles de 2-bromocyclohexanone)
considéré est introduit dans un tube en verre contenant un
barreau magnétique et dégazé par 3 cycles de vide/argon.
0,167g de 2- bromocyclohexanone, 3,5ml de toluène et 0,4ml de
styrène, dégazés, sont respectivement ajoutés par
seringue sous atmosphère inerte. Le mélange est placé dans
un bain d'huile de silicone à 85oC sous agitation
magnétique. Des prélèvements sont effectués
après différents temps de réaction, pour évaluer
l'avancement de la réaction, par chromatographie en phase gazeuse.
Cependant, après 4 jours de réaction, seul des traces de produit
sont formées.
4.2 Fonctionnalisation du copolymère par ATRA
La fonctionnalisation du copolymère a été
testée expérimentalement sous différentes conditions. Les
conditions qui ont été modifiées sont la quantité
de catalyseur utilisé et l'usage un amorceur radicalaire le
2,2-azobis-2,4-diméthyle-4-méthoxyvaléronitrile (V-70) en
vue de réduire le complexe in situ [8]. Dans tous les cas, le
pré-catalyseur (Cata b) (5 ou 10% en moles par rapport au
copolymère) est mesuré dans un tube en verre. Ensuite, 884,9mg du
copolymère sont ajoutés (et le V-70 selon le tableau 1) et le
mélange est dégazé par 3 cycles vide/argon. A 0,6455g (4
équivalents) de 3-butényl benzoate dégazé est
ajouté 3,5ml de CH2Cl2 dégazé et le mélange est
transféré au milieu réactionnel par canule sous
atmosphère inerte. Le tube est mis au bain d'huile de silicone à
40oC.

Schema7: Fonctionnalisation du copolymère par ATRA
Des prélèvements sont effectués après
différents temps de réaction pour évaluer l'avancement de
la réaction. Chaque prélèvement est traité de la
façon suivante :
Après évaporation du solvant sous vide et
redissolution dans quelques gouttes de toluène, l'échantillon est
précipité dans l'heptane et mis au frigo (-20°C) pendant au
moins 4h. Après une seconde précipitation dans l'heptane et
évaporation du solvant, l'échantillon est séché
dans un dessiccateur sous vide et puis analysé par RMN 1H
(CDCl3) et au GPC (dans le THF) avec UV (260nm).
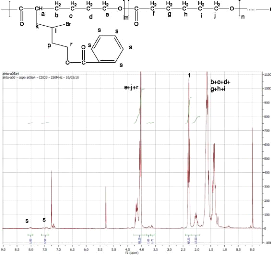
Figure 4: Spectre RMN 1H du copolymère
après fonctionnalisation
Le spectre RMN 1H du copolymère
fonctionnalisé (figure 4) montre l'apparition des pics, dans la zone des
aromatiques, correspondant aux protons du cycle aromatique greffé
[3,4].
Par cette technique de caractérisation, nous pouvons
calculer le taux de fonctionnalisation par la formule :
% ATRA
|
Conversion =
|
|
|
% ATRA + %aBrCL
|
Avix %ATRA =
1H ATRA (pic phényl) %PCL = ' 1H PCL (pic
CH2--CO)
1H(ATRA+PCL+aBrCL 1H (ATRA+PCL+aBrCL) et
|
%aBrCL =
|
1H aBrCL (pic CHBr)
|
|
1H(ATRA + PCL + aBrCL)
|
La caractérisation GPC, permet d'évaluer
qualitativement si le greffage a eu lieu ou s'il s'agit d'une oléfine
résiduelle grâce du détecteur UV couplé au
détecteur à indice de réfraction. Ainsi, comme il y a
superposition des chromatogrammes (figure 5), on conclut que l'oléfine
détectée est celle greffée sur le copolymére.

Figure 5 : Spectre GPC (THF) couplé au détecteur UV
(260nm) du copolymère après ATRA
|
Durée (h)
|
Fonctionnalisation
(%)
|
Polydispersité
|
|
AhTo-a
|
AhTo-b
|
AhTo-a
|
AhTo-b
|
|
3
|
6
|
2
|
1,31
|
1,33
|
|
5,5
|
7
|
3
|
1,34
|
1,77
|
|
21,3
|
9
|
2
|
1,26
|
1,57
|
|
24
|
8
|
2
|
1,32
|
1,75
|
Tableau 1 : Résultats de l'ATRA sur le copolymére
AhTo-a : 5% cata AhTo-b : 5% de Cata + 5% de V-70
L'usage du V-70 était de régénérer
le catalyseur lors de la catalyse. Cependant, le tableau 3 montre qu'en sa
présence, le taux de fonctionnalisation diminue. Ceci serait dû au
fait que sa durée de demi-vie est de 1h30 à 40oC,
température à laquelle nous menons notre réaction. Ainsi,
il est désactivé avant que la conversion ne commence.
4.3 Fonctionnalisation du copolymère par ATRA
sous la catalyse de cuivre
La fonctionnalisation du copolymère poly(aBrECl-co-ECL)
a été également testée en présence d'un
complexe de cuivre CuBr [10]. Cette fois-ci, nous avons utilisé 600mg de
copolymère puis on a ajouté successivement 0,15g de CuBr, 0,77g
de benzoate de 3- butényle, 0,153 g de HMETA et 4ml de DMF. Ensuite le
milieu est barboté par l'azote pendant 15min et chauffé à
60°c et la réaction est arrêtée après 8 heures.
Des prélèvements, en fonction du temps de la réaction,
sont effectués et traités par la technique décrite
précédemment. Au début de la réaction le milieu est
de couleur vert foncé, après quelques heures de réaction
le milieu prend une couleur bleue ce qui peut expliquer qu'il y a
réaction. Cependant, le taux de fonctionnalisation du copolymère
est négligeable car il n'y a pas apparition de pics dans la zone
d'aromatiques sur le spectre RMN 1H et il n'y a pas de superposition
de chromatogrammes en GPC (UV).
5. Conclusion
La première approche consistait à la
fonctionnalisation de 2-bromocyclohexanone par ATRA. Cependant, la
fonctionnalisation n'a pas vraiment abouti à grands choses car il n'y
avait détection qu'en traces de produits de réaction.
Par contre, la seconde approche se faisant sur le
copolymère conduit à la fonctionnalisation bien qu'elle reste
faible (9%). Ce résultat est comparable, en de temps plus courts, au
résultat de fonctionnalisation par ATRA sur le copolymère
a-chloré [7].
6. Remerciements
Nous tenons à remercier les promoteurs de notre stage,
M. Philippe Lecomte et M. Albert Demonceau qui nous ont donné
accès à leur laboratoire et pour leurs multiples conseils tout au
long de notre stage. Nos remerciements vont également à nos
encadrants M. Raphael Riva et M. Yannik Borguet qui nous ont entourés
d'un encadrement fort appréciable. Leurs conseils et leur analyse
scientifique nous ont permis de bien mener notre recherche.
7. Références bibliographiques
1. R. Riva, S. Schmeits, Ch. Jérôme, R.
Jérôme, and Ph. Lecomte, Macromolecules,
2007, 40, 796-803.
2. S. Lenoir, R. Riva, X. Lou, Ch. Detrembleur, R.
Jérôme and Ph. Lecomte, Macromolecules,
2004, 37, 4055-4061.
3. C. Detrembleur, M. Mazza, X. Lou, O. Halleux, Ph. Lecomte, D.
Mecerreyes, J. L. Hedrick, and R. Jérôme, Macromolecules,
2000, 33, 7751-7760.
4. J.P. Latere Dwan'Isa, Ph. Lecomte, P. Dubois, and R.
Jérôme, Macromolecules, 2003, 36,
2609-2615.
5. G. Wang, Y. Shi, Z. Fu, W. Yang, Q.Huang, and Y. Zhang,
Polymer, 2005, 46, 10601-10606.
6. T. Tokuyasu, K. Shigeki, J. Kevin, M. Araki, N. Masatomo
Nojima, Synthesis of Cyclic Peroxides by Chemo- and Regioselective
Peroxidation of Dienes with Co(II)/O2/Et3SiH , Osaka University, Suita, Osaka,
565-0871.
7. P. Jonlet, Rapport de stage de Ier Master,
Université de Liège, 2009.
8. L. Quebatte, K. Thommes, and K. Severin, J. Am. Chem.
Soc., 2006, 128, 7440-7441.
9. T. Pintauer et al, Chem. Eur. J.,
2009, 15, 38 - 41.
10. R. Riva, Mémoire de licence, Université de
liège, 2002.
11. J.P. Latere Dwan'Isa, Ph. Lecomte, P. Dubois, and R.
Jérôme, Macromolecules, 2000, Vol. 33,
No. 1.
|
|



