|
DYNAMIQUE NON LINEAIRE ET EFFET DE
L'INSTABILITE DE TURING SUR LES
SYSTEMES CELLULAIRES DESORDONNES
Mémoire rédigé et présenté
en vue de l'obtention du
Master II of Physique
par
TAMKO
MBOPDA Boris
Matricule: 12U0592
Licencié en
Physique
Sous la supervision du
Pr EKOBENA FOUDA HENRI
PAUL
Maitre de conférences, Université de
Yaoundé I
Spécialité: PHYSIQUE DES RAYONNEMENTS ET
BIOPHYSIQUE
Option : Physique Atomique, Moléculaire et Biophysique
Mai 2019
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
Table des matières
Dédicace vi
Remerciements viii
Liste des abréviations ix
Lettre grecs et liste nomenclature x
Résumé xi
Abstract xii
|
INTRODUCTION
1 GENERALITES SUR LE CANCER
|
1
3
|
|
1.1
|
La Cancérogénèse
|
3
|
|
|
1.1.1 Le cycle cellulaire et sa régulation
|
3
|
|
|
1.1.2 Les principales caractéristiques du cancer
|
6
|
|
|
1.1.3 Les étapes de la maladie
|
9
|
|
1.2
|
Facteurs de risque (autres que le tabac)
|
10
|
|
|
1.2.1 Les facteurs de risque internes du cancer
|
11
|
|
|
1.2.2 Les facteurs externes du cancer
|
12
|
|
1.3
|
Différents modes de traitement de la maladie
|
14
|
|
|
1.3.1 Traitements localisés
|
14
|
|
|
1.3.2 Traitements systémiques
|
15
|
|
2
|
ANALYSE MATHEMATIQUE ET METHODOLOGIE
|
17
|
|
2.1 Les modèles mathématiques du cancer
|
17
|
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
ii
2.1.1 Les modèles discrets 17
2.1.2 Les modèles continus 19
2.2 Modélisation mathématique 19
2.2.1 Description de la croissance cellulaire et tissulaire
20
2.2.2 contrôle de la croissance cellulaire et tissulaire :
21
2.2.3 Intérêt de la modélisation 22
2.3 Rôle des acides dans le cancer 22
2.3.1 Cause directe du cancer 22
2.3.2 L'action du PH sur le développement du cancer
23
2.4 Modèle utilisé pour le mémoire 24
2.5 Description de l'instabilité de Turing 27
2.5.1 Problématique 27
3 RESULTATS ET DISCUSSION 31
3.1 Modèle mathematique modifié de Gatenby et
Gawlinski 31
3.2 Dynamique non linéaire du modèle modifié
de Gatenby et Gawlinski 33
3.3 Etude de la stabilité linéaire et bifurcation
35
3.4 Instabilité de Turing 37
3.5 résultats de simulation numérique 42
3.5.1 Modèle non diffusif de Gatenby et Gawlinski 43
3.5.2 Modèle diffusif de Gatenby et Gawlinski 44
Bibliographie 50
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
Table des figures
1.1 Schéma du cycle cellulaire. [7] 5
1.2 Les principales caractéristiques du cancer. [5] 6
1.3 Processus d'angiogenèse. [12] 8
1.4 Dissémination des métastases.[13] 9
2.1 differents motifs que nous pouvons retrouver dans la nature
[24] 27
2.2 Interactions entre un activateur et un inhibiteur [24]
29
3.1 diagramme schématique du système 3.1 32
3.2 Relation des coefficients de dispersion valeurs des
paramètres : r2 = 1; d1 = 10; d2 =
9;c = 1.5;d = 4 * 10-5;a1 = 12;a2 = 6;D1 =
10-5;D2 = 5 x 10-6;D3 = 1.5 x 10-3 . . 43 3.3
Relation des coefficients de dispersion pour différentes valeurs de r2
valeurs des para-
mètres :d1 = 10;d2 = 9;c = 1.5;d = 4 x 10-5;a1
= 12;a2 = 6;D1 = 10-5;D2 =
5 x 10-6;D3 = 1.5 x 10-3 44
3.4 Relation des coefficients de dispersion pour
différentes valeurs de c 45
3.5 Relation des coefficients de
dispersion pour différentes valeurs de c (taux de croissance de l'acide)
valeurs des paramètres :r2 = 1; d1 = 10; d2 = 9; d = 4 x 10-5; a1 = 12;
a2 =
6;D1 = 10-5;D2 = 5 x 10-6;D3 = 1.5 x
10-3 45
3.6 Evaluation de la série chronologique pour le
modèle 3.3 46
3.7 Evaluation de la série chronologique pour le
modèle 3.3 46
3.8 Evaluation de la série chronologique pour le
modèle 3.3 47
3.9 Evaluation de la série chronologique pour le
modèle 3.3 47
3.10 Evaluation de la série chronologique pour le
modèle 3.3 48
3.11 Evaluation de la série chronologique pour le
modèle 3.3 48
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
iv
3.12 Coefficient de dispersion et relation de dispersion du
système 3.3 valeurs des paramètres :r2 = 1;d1 = 10;d2 = 9;d = 4
× 10-5;a1 = 12;a2 = 6;D1 = 10-5;D2 =
5 × 10-6;D3 = 1.5 × 10-3 49
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
Liste des tableaux
1.1 Exposition aux facteurs de risques au cours du temps et
conséquences en termes d'ap-
parition des cancers 10
1.2 virus et autres micro-organismes responsables de cancers
humains 13
3.1 Dimensions des paramètres de l'équation 3.1
32
3.2 Coefficients générales des fonctions
v0(k) et v1(k)v2(k) - v0(k) 39
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
Dédicaces
Je dédie ce mémoire à :
mes très chers parents : grâce à leurs
tendres encouragements et leurs grands sacrifices, ils ont pu créer le
climat affectueux et propice à la poursuite de mes études.
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
Remerciements
Avant de commencer la présentation de ce travail,
tout d'abord, je remercie Dieu, notre
créateur de nous avoir donné la force, la volonté et le
courage pour accomplir ce modeste travail .
Je profite de l'occasion pour remercier toutes les personnes
qui ont contribué de près ou de loin à la
réalisation de ce travail.
Je tiens à exprimer mes vifs remerciements à mon
encadreur, Professeur EKOBENA FOUDA Henri Paul , d'avoir
accepté de m'encadrer pour mon mémoire, ainsi que pour son
soutien, ses remarques pertinentes et son encouragement, je le remercie aussi
pour le temps et les connaissances qu'il ma dispensé.
J'adresse mes sincères remerciements, au
Professeur NDJAKA Jean-Marie Bienvenu qui me fait l'honneur de
présider le jury de cette soutenance.
Je souhaite exprimer mes remerciements au Professeur
Germain Hubert BEN-BOLIE pour avoir accepté, d'examiner et
d'évaluer ce travail
Mes remerciements vont aussi à tous mes professeurs,
enseignants et toutes les personnes qui m'ont soutenu jusqu'au bout, et qui
n'ont pas cessé de me donner des conseils très importants.
Je voudrais exprimer toute ma gratitude et ma
considération à Mr.C. D. Bansi Kamdem pour avoir
suivi mon travail avec une attention soutenue, pour sa
générosité et pour ses qualités scientifiques et
humaines qui m'ont beaucoup aidé et guidé tout au long de mes
années d'initiation à la recherche, qu'il trouve ici toute ma
gratitude et ma reconnaissance. Je remercie de façon
générale les membres du laboratoire de Biophysique de
UY1.
A tous mes professeurs : Leur
générosité et leur soutien m'oblige de leurs
témoigner mon profond respect et ma loyale considération.
Je remercie tous ceux là qui ont oeuvré pour ma
vie et ma scolarisation, mais qui malheureusement ne sont plus là pour
déguster le fruit de leur travail. Je pense à ma
grand-mère TOUMBOU PAULINE; ce travail est le reflet de
votre protection d'au-delà
Remerciements viii
A tout mes frères et soeurs
réunis qu'ils reçoivent ici l'expression de mes
sentiments profonds. A tous mes amis Tuam Fotso, Kengne joseph, Kengne
Foko, Kuate Ernest
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
Liste des abréviations
A.D.N Acide DésoxyriboNucléique
E.D.O : Equations aux Dérivées Ordinaires
E.D.P : Equations aux Dérivées Partielles
CIRC : Centre International de Recherche sur le Cancer
VEGF Facteur de croissance endothélial vasculaire
SIDA : Syndrome Immuno-Déficitaire Acquis
mSv : Mili-Sievert
ORL : Oto-Rhino-Laryngologie
IRM : Imagérie par Résonnance
Magnétique
CDK : kinases cycline-dépendantes
ATP : Adénosine TriPhosphate
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
Lettre grecs et liste nomenclature
á : Alpha fi : Beta O : theta u : mu
À : lambda ä : sigma Ä : Delta p : rho
? : nabla Ù : Omega
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
Résumé
Le but de ce mémoire est de localiser les zones de
forte concentration des cellules tumorales et de la concentration d'acide
lactique pour un système de réaction de diffusion à trois
espèces impliquant les cellules saines, les cellules tumorales et la
concentration d'acide lactique. Les solutions du système avec des
conditions initiales non négatives sont déterminés.
L'utilisation des critères de Routh -Hurwitz nous permet de faire
l'analyse par bifurcation du modèle et les conditions d'existence des
modèles de Turing et non-Turing. Une série de résultats de
simulations numériques sont présentés pour montrer les
modèles de Turing. L'existence d'oscillations apériodiques et
d'oscillations chaotiques spatialement homogènes, inhomogènes,
périodiques et inhomogènes est montrée dans le
modèle à trois espèces pour le cancer.
Mots clés Modèle à trois
espèces, Diffusion, Bifurcation, Formation de modèles
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
Abstract
The purpose of this thesis is to locate areas of high
concentration of tumor cells and lactic acid concentration for a three-species
diffusion reaction system involving healthy cells, tumor cells and lactic acid
concentration. The System solutions with non-negative initial conditions are
determined. Use Routh -Hurwitz criteria allows us to make the analysis by
bifurcation of the model and the existence conditions of Turing and non-Turing
models. A series of numerical simulation results are presented to show the
Turing models. The existence of oscillations aperiodic and spatially
homogeneous, inhomogeneous, periodic and inhomogeneous is shown in the three
species model for cancer.
Keywords Three species model Diffusion Bifurcation Pattern
formation cancer
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
INTRODUCTION
Avec l'augmentation de l'espérance de vie et
l'évolution de nos modes de vie et de notre environnement, le cancer est
devenu une des problématiques majeures de santé publique. Le
cancer est à l'origine d'environ un décès sur sept dans le
monde, c'est aussi la deuxième cause de mortalité dans les pays
développés (après les maladies cardio-vasculaires) et la
troisième dans les pays en voie de développement (après
les maladies cardio-vasculaires et les maladies infectieuses et parasitaires)
[1]. Le cancer a été longtemps, à tord,
considéré comme une pathologie occidentale, à cause de
l'ignorance des données statistiques. Ces dernières ont
montré que ce fléau serait non seulement la
3e cause de mortalité dans nos pays, mais
que 72% des décès mondiaux dus au cancer sont enregistrés
dans les pays en voie de développement [2],[3].
En Afrique sub-saharienne, le cancer touche
particulièrement la population jeune. Les femmes sont les plus
exposées; elles représentent jusqu'à 68% des cas [4]. Les
principaux sites touchés par le cancer sont le sein, le
côlon-rectum et le poumon chez la femme. La prostate, le poumon et le
côlon-rectum chez l'homme, selon les dernières données de
la ville de Yaoundé sur les cancers gynécologiques, le cancer du
col utérin occupait la deuxième place après celui du
sein
[4].
En biologie, la cellule joue un rôle particulier et
central. Il s'agit de l'élément de base de tout être vivant
: on dit qu'elle est l'unité structurale, fonctionnelle et reproductrice
du vivant. En particulier, elle contient dans son noyau les chromosomes
constitués de l'acide désoxyribonucléique (ADN)
associé à des protéines. Ce rôle fondamental nous
amène à placer la cellule au coeur de notre discussion sur la
croissance tumorale. Une cellule, au cours de son existence, dispose de divers
mécanismes qui lui permettent d'assurer son bon fonctionnement. Une
cellule cancéreuse est, en quelque sorte, une cellule au comportement
anormal échappant à ces mécanismes de contrôle,
suite à des dérégulations qui sont souvent
associées à des modifications de l'information
génétique (appelées mutations). Une tumeur se forme
lorsque des cellules ont
Introduction 2
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
acquis des mutations leur permettant d'échapper aux
systèmes de régulation naturels et se mettent à
proliférer anormalement [5]. Une tumeur est une structure
tridimensionnelle composée d'une population
hétérogène de cellules : on peut y trouver des cellules en
prolifération, des cellules ayant stoppé leur croissance et des
cellules mortes. Parmi les tumeurs, on distingue les tumeurs bénignes et
les tumeurs malignes, appelées tumeurs cancéreuses. La
terminologie «un cancer» peut aussi bien désigner «une
tumeur cancéreuse» qu'une maladie caractérisée par
l'apparition de tumeurs cancéreuses. En général, la
plupart des tumeurs sont bénignes et sont rapidement
évacuées par le système immunitaire, mais malheureusement
dans certains cas, les tumeurs peuvent devenir malignes et peuvent
également acquérir un caractère invasif : elles sont donc
capables d'envahir les tissus voisins voire d'envahir d'autre organes en
traversant le système vasculaire, formant alors ce que l'on appelle des
métastases. Les métastases sont la cause d'environ 90% des
décès dus au cancer [6].
Ces dernières années plusieurs modèles
mathématiques ont été développées pour
décrire et comprendre l'évolution des cellules cancéreuses
dans l'organisme notamment le modèle de Gompertz (ou loi de
mortalité de Gompertz-Makeham) établit que le taux de
mortalité est la somme de termes dépendants de l'âge
(termes de Makeham) et de termes dépendants de l'âge (fonction de
Gompertz). Ce modèle suggère également la diminution
exponentielle du nombre d'organismes vivants proportionnellement à
l'augmentation linéaire de l'âge. Le modèle de
Lotka-Volterra que l'on désigne aussi sous le terme de «
modèle proie-prédateur », sont un couple d'équations
différentielles non-linéaires du premier ordre, et sont
couramment utilisées pour décrire la dynamique de systèmes
biologiques dans lesquels un prédateur et sa proie interagissent. Ce
pendant ces modèles ne permettant pas la localisation des zones de forte
concentration des cellules cancéreuses. Ainsi pour apporter notre
modeste contribution à la détermination de ces zones de forte
concentration nous nous proposons de mené cette étude
intitulé «dynamique non linéaire et effet de
l'instabilité de Turing sur les systèmes cellulaires
désordonnés».
La suite est présentée ainsi : Au chapitre un
nous étudierons les généralités sur le cancer. Au
chapitre deux nous présenterons les modèles mathématique
développé dans la bibliographie et en suis sur la
méthodologie adopté. Au dernier nous présenterons et
analyserons les résultats de nos différentes simulation
numérique.
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
CHAPITRE PREMIER
GENERALITES SUR LE CANCER
Dans ce chapitre, nous rappellerons quelques notions sur la
cancérogénèse et les différents modes de traitement
de la maladie.
1.1 La Cancérogénèse
Le cancer est dû à des mutations
génétiques des cellules qui leur confèrent la
capacité de proliférer de manière
incontrôlée. Dans cette section nous commencerons par
présenter le fonctionnement normal du cycle cellulaire et les
mécanismes permettant de le réguler. Au paragraphe suivant, nous
détaillerons les principales caractéristiques du cancer. Dans la
suite nous présenterons le cycle cellulaire et sa régulation,
ainsi que les principales caractéristiques du cancer et enfin nous
expliquerons les différentes étapes de la maladie.
1.1.1 Le cycle cellulaire et sa
régulation
Une tumeur étant un amas de cellules qui
prolifèrent de manière incontrôlée, nous
commencerons par rappeler le fonctionnement du cycle de la division cellulaire
(voir Figure 1.1). En effet, c'est notamment un dérèglement du
cycle cellulaire et des systèmes le régulant qui permettent aux
cellules tumorales une prolifération illimitée. Chez l'Homme, la
durée moyenne du cycle cellulaire est d'environ 24h (cela peut varier
d'un individu à l'autre mais aussi pour les cellules d'un même
individu). Le cycle cellulaire est constitué de 4 phases : les 3 phases
G1, S et G2, formant l'interphase, phase au cours de laquelle la cellule va
doubler de taille (tout en assurant les fonctions pour lesquelles elle a
été programmée), afin de préparer la
quatrième phase qui est la mitose, la division de la cellule en deux
cellules identiques.
· La phase G1 (gap 1, phase
intermédiaire) :
Cette phase dure en moyenne 11h, elle est la première
étape du cycle cellulaire. Lors de
Chapitre I : Généralités sur le cancer
4
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
cette phase la cellule augmente en volume et synthétise
des protéines nécessaires à la réplication de
l'ADN.
· La synthèse (phase S) :
C'est la phase au cours de laquelle a lieu la
réplication de l'ADN grâce à l'ADN polymé-rase. La
synthèse dure environ 8h.
· La phase G2 (gap2)
:
C'est la phase qui démarre lorsque la
réplication de l'ADN est complète. Au cours de cette phase, qui
dure environ 4h, la cellule continue de grandir et synthétise des
protéines qui sont nécessaires à la mitose.
· La Mitose :
D'une durée d'environ 1h, est la dernière phase
du cycle cellulaire, elle se divise elle-même en plusieurs
étapes.
· La prophase :
Au cours de laquelle les chromosomes (formés de deux
chromatides) se condensent et se séparent et l'enveloppe du noyau se
dissout.
· La Métaphase:
Les chromosomes s'alignent sur le plan équatorial de la
cellule.
· L'anaphase :
Les chromatides soeurs se séparent et migrent vers deux
extrémités opposées de la cellule.
· La Télophase:
Une enveloppe nucléaire se forme à chacune des
deux extrémités de la cellule, puis la cellule se divise en
deux.
En général, en âge adulte, les cellules
ne se divisent que de manière occasionnelle, lorsque cela est
nécessaire, par exemple pour remplacer des cellules mortes ou bien en
cas de blessure. La plupart des cellules sont ainsi principalement en phase G0,
une phase de quiescence au cours de laquelle les cellules sont
métaboliquement actives mais ne prolifèrent pas sauf si un signal
extracellulaire appelle à la prolifération. Pour qu'une cellule
effectue un cycle complet et s'engage dans le cycle cellulaire, elle doit
passer un certain nombre de points de contrôle.
· Le point de restriction est un point
de contrôle qui a lieu à la fin de la phase G1, au cours duquel la
cellule vérifie la présence de facteurs de croissance
extérieurs. La cellule vérifie également que son
matériel génétique n'a pas été
altéré (par irradiation
Chapitre I : Généralités sur le
cancer 5
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
par exemple).
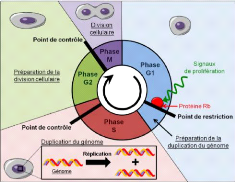
FIGURE 1.1 - Schéma du cycle
cellulaire. [7]
Si la cellule est dans les bonnes conditions pour la
synthèse de l'ADN, elle va alors passer en phase S, sinon elle passe en
phase de quiescence G0
· Au cours de la synthèse de l'ADN, il y a un
point de contrôle pour vérifier qu'il n'y a pas de dommage
à l'ADN
· Le point de contrôle G2/M, est
un point de contrôle qui est à la fin de la phase G2,
juste avant la mitose. La cellule contrôle l'intégrité des
chromosomes qui ont été en phase S. Elle vérifie que le
génome a été complètement et correctement
répliqué, qu'il n'y a pas eu d'altération de l'ADN et
tente de réparer d'éventuels dommages.
· Lors de la métaphase, l'étape d'alignement
des chromosomes durant la mitose, il y a également un point de
contrôle pour vérifier que les chromosomes sont bien
alignés. Ces points de contrôle permettent de réguler la
prolifération en empêchant l'avancement dans le cycle lorsque les
conditions ne sont pas réunies et lancent le processus d'apoptose, la
mort cellulaire programmée, si nécessaire. Ces mécanismes
permettent notamment de s'assurer que les altérations du code
génétique ne se propagent pas. Un dérèglement de ce
système de contrôle peut conduire à la formation d'une
tumeur : les cellules affectées par ce dérèglement
prolifèrent alors de manière incontrôlée, propageant
ainsi les mutations qu'elles ont acquises.
Chapitre I : Généralités sur le
cancer 6
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
1.1.2 Les principales caractéristiques du
cancer
Comme nous l'avons vu, les cellules normales sont capables de
réguler leur prolifération. L'apparition de mutations lors de la
division cellulaire permet aux cellules d'acquérir des
caractéristiques qui sont propres au cancer. Dans leur article [8],
Hanahan et Weinberg ont établi les principales caractéristiques
du cancer (voir la Figure 1.2) à savoir :
· Emission soutenue de signaux de
prolifération
Les tissus normaux contrôlent la production et
l'émission de signaux de prolifération qui vont inciter les
cellules à entrer dans le cycle cellulaire. Les cellules
cancéreuses sont quant à elles capables d'émettre des
signaux de prolifération afin d'appeler à la production de
facteurs de croissance pour maintenir une prolifération continue.
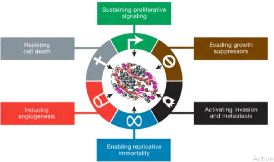
FIGURE 1.2 - Les principales caractéristiques du
cancer. [5]
· L'échappement aux inhibiteur de
croissance
Afin de pouvoir proliférer, les cellules
cancéreuses doivent également être capables
d'échap-per aux mécanismes qui limitent la prolifération
notamment les suppresseurs de tumeurs. Les deux principaux suppresseurs de
tumeurs sont les gènes codant les protéines Rb et P53. Ces deux
protéines sont capables de bloquer le cycle cellulaire. La
protéine Rb, qui agit lors du point de restriction, traduit
principalement des inhibitions résultant de signaux extérieurs
à la cellule, tandis que la protéine P53, dont l'action a lieu
lors de plusieurs points de contrôle comme par exemple lors du point de
contrôle de la synthèse de l'ADN, permet d'arrêter le cycle
cellulaire en cas d'altération génétique. Une mutation des
gènes codant ces protéines peut désactiver leur rôle
inhibiteur. Par exemple, la mutation du gène codant la protéine
P53 est l'altération génétique la plus commune dans
Chapitre I : Généralités sur le
cancer 7
les cancers humains [10]
· La résistance à la mort
cellulaire
L'apoptose est le phénomène de mort cellulaire
programmée, au cours duquel la cellule se contracte pour être
éliminée naturellement. Les cellules tumorales sont capables
d'échap-per à l'apoptose à travers différents
mécanismes. Un de ces mécanismes est la perte de la
fonctionnalité P53, conduisant à l'apoptose en cas
d'altération génétique. Les cellules tumorales sont
également capables d'émettre des régulateurs ou des
signaux de survie qui vont annuler les facteurs conduisant à l'apoptose.
Au lieu de mourir par apoptose, la plupart des cellules tumorales ont tendance
à mourir par nécrose. La nécrose est la mort d'une cellule
par explosion. Elle peut être engendrée aussi bien par l'hypoxie
que par l'effet d'un traitement. La mort d'une cellule par nécrose peut
induire l'émission de signaux pour recruter les cellules inflammatoires
du système immunitaire. Ces cellules inflammatoires vont s'occuper de la
destruction des débris de la cellule mais aussi de la répartition
du tissu environnant. De fait, les cellules inflammatoires vont favoriser la
prolifération, ainsi que les phénomènes
d'angiogenèse et d'invasion (décris dans la suite). Il est
également possible que les cellules mortes par nécrose rejettent
des facteurs de régulation qui vont promouvoir la prolifération
localement. Ainsi, la présence de nécrose n'est pas toujours
bénéfique.
· La réplication à
l'infini
Lors de la division cellulaire, une partie non codante de
l'ADN, située à son extrémité et formée par
les télomères, se raccourcit. Ainsi, le nombre de divisions
successives que peut effectuer une cellule normale est limité par la
quantité de télomères dont elle dispose. Une enzyme, la
télomérase, permet d'ajouter des télomères aux
extrémités de l'ADN. Grâce à une production
élevée de télomérase, les cellules
cancéreuses sont capables de se répliquer de manière
infinie.
· L'angiogenèse
Pour se diviser, les cellules ont besoin d'un apport en
oxygène et nutriments. Lorsque la tumeur a atteint une taille
élevée et que la vascularisation n'est plus suffisante pour
assurer l'apport nécessaire à la croissance de la tumeur, les
cellules tumorales sont capables d'émettre des signaux, par exemple un
signal VEGF (Vascular Endothélial Growth Factor), afin d'induire le
phénomène d'angiogenèse (voir Figure 1.3). Le processus
d'an-
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
Chapitre I : Généralités sur le cancer
8
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
giogenèse, la création de vaisseau sanguins
à partir des cellules endothéliales, les cellules recouvrant la
paroi intérieure des vaisseaux sanguins, sont un phénomène
parfaitement naturel, par exemple lors du développement embryonnaire,
mais c'est un processus pathologique primordial dans le développement
embryonnaire, aussi c'est un processus pathologique primordial dans le
développement des tumeurs et donc une cible thérapeutique
importante [10][11]
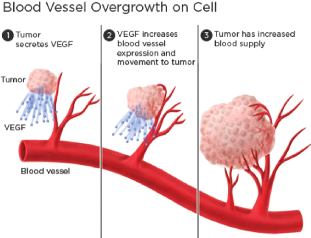
FIGURE 1.3 - Processus d'angiogenèse. [12]
· L'invasion et le processus
métastatique
Suite au processus d'angiogenèse, lorsque la tumeur
bénéficie de sa propre vascularisation, certaines cellules de la
tumeur sont capables de s'en détacher et de pénétrer dans
le système sanguin. En général, de telles cellules sont
éliminées par le système immunitaire mais il peut arriver
que des cellules arrivent à s'installer dans un nouvel organe, formant
ainsi une métastase (voir figure 1.4). Les organes les plus
vascularisés, tels que le poumon et le foie par exemple, sont les
organes les plus touchés par les métastases.
En 2011, Hanahan et Weinberg ont ajouté deux nouvelles
caractéristiques, dites »caractéristiques
émergentes» aux six caractéristiques déjà
évoquées dans leur article de 2000 à savoir :
· La reprogrammation du métabolisme
énergétique
Les cellules tumorales sont capables de modifier leur besoin
en nutriments et oxygène afin de s'adapter à leur
environnement.
· Chapitre I : Généralités sur
le cancer 9
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
La résistance au système
immunitaire
Les cellules cancéreuses sont capables de ne pas
être détectées par le système immunitaire ou bien de
résister à leur destruction par le système immunitaire.
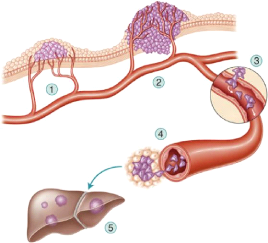
FIGURE 1.4 - Dissémination des
métastases.[13]
1.1.3 Les étapes de la maladie
Au cours de son développement, la maladie passe par
plusieurs phases intermédiaires.
· La phase avasculaire
C'est la première étape de la croissance
tumorale, au cours de cette étape qui démarre dès
l'apparition de la première cellule tumorale, la tumeur croît en
consommant les nutriments et l'oxygène qui arrivent par diffusion depuis
les capillaires voisins. A partir d'une certaine taille, la zone centrale de la
tumeur n'a plus accès aux nutriments, qui sont consommés par les
cellules en périphérie de la tumeur. Il se forme alors une zone
de quiescence, composée de cellules au repos, voire un coeur de
nécrose, composé de cellules morte par nécrose.
· La phase vasculaire
Lorsque la tumeur a atteint une taille élevée,
celle-ci ne peut plus continuer sa croissance sans un apport
supplémentaire en nutriments [14]. Pour pouvoir continuer sa
croissance,
Chapitre I : Généralités sur le cancer
10
la tumeur enclenche alors le processus
d'angiogenèse afin d'acquérir sa propre
vascularisation. C'est la phase vasculaire.
· La phase métastatique
Cette phase débute lorsque la tumeur commence à
disséminer des métastases dans l'or-ganisme.
1.2 Facteurs de risque (autres que le tabac)
Le cancer est un ensemble de maladie graves, d'origine
multifactorielle, dont les étapes d'installation peuvent,
schématiquement, se décrire en trois périodes .
L'efficacité et le succès de la lutte contre les cancers exige
une connaissance, la plus large possible, des facteurs qui en augmentent le
risque. Les facteurs de risque de certains cancers reconnus comme
responsables
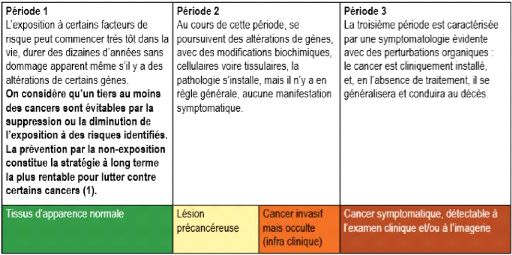
TABLE 1.1 - Exposition aux facteurs de risques au cours du temps
et conséquences en termes d'appa-
rition des cancers
ou facilitateurs de la survenue d'un cancer peuvent être
classées en deux grands groupes : facteurs externes et facteurs
internes.
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
Chapitre I : Généralités sur le
cancer 11
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
1.2.1 Les facteurs de risque internes du
cancer
A- Facteurs génétiques
Deux types d'altérations génétiques sont
à distinguer
· Altérations héréditaires
: on parle d'une prédisposition génétique quand
le risque de cancer est augmenté par la présence d'une mutation
sur un gène transmissible d'une génération à
l'autre et héritée d'un parent. Les formes familiales de
prédisposition concernent environ 5% des cancers (par exemple mutations
des gènes BRA1 ou BRCA2 qui confèrent un haut risque de cancer du
sein d'environ 70% au cours de la vie).
L'hérédité est suspectée face
à l'âge jeune de survenue de cancer, la fréquence de
cancers de même type dans la famille, la répétition d'un
type histologique identique de cancer et bien sûr des données
génétiques objectives : identification de mutations
spécifiques chez les malades et chez leurs apparentés, ce qui
ouvre des possibilités de dépistage adapté. La mise en
évidence de ces altérations génétiques n'est pas
encore entrée dans la pratique quotidienne en Afrique francophone
subsaharienne, mais grâce à des actions de coopération,
cette situation devrait évoluer.
· Altérations acquises : elles
sont à la suite de l'exposition répétée aux
facteurs de risques de cancer. Ce type de mécanisme est en jeu dans
beaucoup de cancers, sachant qu'il faut en général la succession
de plusieurs mutations ( qui vont s'ajouter à d'éven-tuelles
mutations héritées des parents )pour qu'un cancer apparaisse, ce
qui explique l'augmentation de fréquence de la plupart des cancers avec
l'âge.
B- Des dysfonctionnement immunitaires ou endocriniens
facilitent l'apparition de certains cancers
De nombreuses publications, dont [15] et [16] ont
démontré que la diminution ou la suppression des défenses
immunitaires naturelles, qu'elle soit congénitale ou acquise, favorise
l'installation des cancers ou augmente la fréquence de certains.
L'exemple bien connu est celui de l'effondre-ment des défenses
immunitaires par l'infection due au virus de l'immunodéficience acquise
dans le cadre du SIDA. Cette infection facilite l'action d'autres virus
oncogènes. plusieurs cancers sont en relation souvent complexe avec
l'état hormonal chez la femme ( cancers du sein, de l'endomètre )
et chez l'homme (cancers de la prostate).
Chapitre I : Généralités sur le
cancer 12
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
1.2.2 Les facteurs externes du cancer
Ils sont représentés par les expositions
à des substances chimiques, des agents physiques, et à des agents
infectieux (dont des virus oncogènes, des bactéries et des
parasites). Les comportements individuels peuvent faciliter l'exposition
à certains facteurs de risque.
A- Facteurs chimiques
Ils sont souvent inhalés ou ingérés avec
les aliments pour, par la suite, subir des réaction biochimiques qui
aboutissent à la formation d'un catabolite ayant un pouvoir plus ou
moins cancérogène. Les denrées alimentaires peuvent
contenir des contaminants qui ont un pouvoir mutagène et
cancérogène, comme par exemple des :
· Mycotoxines (retrouvées dans les tourteaux
d'arachides) dont l'exemple bien connu est l'aflatoxine (mycotoxine produite
par un champignon microscopique, aspergillus flavus), citée dans la
genèse du cancer primitif du foie.
· Ochratoxines retrouvées dans le sorgho et le
blé
· Fumonisines qui contaminent le maïs (cancers de
l'oeophage)
· Nitrosamines qui peuvent se retrouver dans les
salaisons et dans de nombreux aliments (cancer digestifs).
Les aliments sont contaminés à
différentes étapes : lors de la population, durant le stockage,
pendant la transformation, au cours de la cuisson.
S'agissant des polluants, le CIRC (Centre
International de Recherche sur le Cancer) a classé 119 agents polluants
comme cancérogènes pour l'homme (dont les particules fines et les
vapeurs de diesel) et 81 autres substances comme probablement
cancérogène pour l'homme. S'agissant des cancers
professionnels : l'amiante (mésothéliome de la
plèvre), les poussières de bois (fosses nasales, sinus), le
benzène (leucémies) sont les facteurs de risques les plus
fréquemment en cause.
B- Agents physiques
· Les rayons ultraviolets du soleil sont connus pour
avoir un effet cancérogène sur la peau (leur pouvoir de
pénétration étant très limité). Les
Africains sont naturellement protégés contre ces cancers à
l'exception des Albinos dont la peau est dépourvue de mélanine
protectrice au regard du fort ensoleillement tropical.
· Les rayonnements ionisants sont en cause, en pratique
lorsque la dose reçue dépasse 100 mSv ( peut-être un peu
moins chez le jeune enfant). A la suite de l'accident de
Chapitre I : Généralités sur le cancer
13
Tchernobyl, seuls les enfants exposés à de
fortes doses d'Iode radioatif dans les régions contaminées ont
présenté un excès de cancers de la thyroïde dans les
années qui ont suivi l'exposition.
· Ces rayonnements agissent par action directe sur le
noyau de cellules en provoquant des mutations.
C- Micro-organismes
Environ 25 à 30% de tous les cancers survenant en
Afrique sont liés à des agents infectieux : virus,
bactéries et parasites (voir tabeau 1.2)
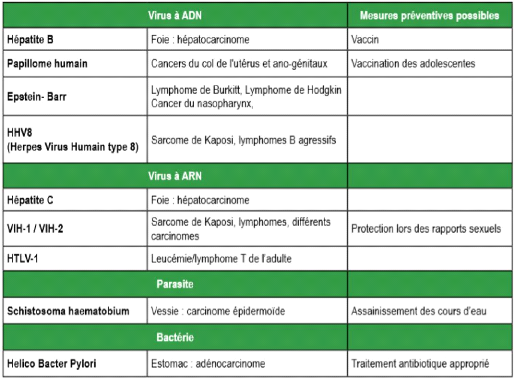
TABLE 1.2 - virus et autres micro-organismes responsables de
cancers humains
D- Facteurs comportementaux
· L'absorption excessive d'acool et le tabagisme
sont des facteurs de risque majeurs pour de nombreux cancers (tabac :
poumon, ORL, vessie, col ultérin et alcool : ORL :,
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
Chapitre I : Généralités sur le
cancer 14
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
oesophage, foie, pancréas, rectum, sein)
· L'alimentation fait partie des
comportements sur lesquels on peut agir pour accroître la
prévention des cancers. Elle agit à la fois comme un facteur de
protection à travers les fibres alimentaires présentent dans les
céréales complètes, les fruits, les légumes, les
légumes secs et aussi comme un facteur de risque à travers des
aliments qui, consommés en excès, favorisent le
développement d'un cancer, comme les viandes rouges, les charcuteries et
le sel (outre l'alcool déjà cité).
· L'obésité et l'absence
d'activité physique sont des facteurs reconnus dans le monde
entier favorisants les cancers colorectaux, du sein, de l'endomètre.
1.3 Différents modes de traitement de la maladie
Les cancers sont traités par différentes voies,
dépendant de leur nature et de leur stade d'avancement. Trois grands
types de traitements se différencient : la chirurgie, la
radiothérapie et les traitements systémiques (utilisation de
médicaments). Dans la plupart des cas, les patients passent par
plusieurs phases de traitement, et reçoivent éventuellement des
séances de chacun de ces types. La chirurgie, la radiothérapie,
et les traitements systémiques sont ici brièvement
présentées.
1.3.1 Traitements localisés
· La radiothérapie
Ce traitement consiste à utiliser des radiations
ionisantes qui cassent les brins d'ADN de la cellule, entraînant la mort
cellulaire.
· L'électro perméabilisation ou
électro-poration
Cela consiste à appliquer un champ électrique
à l'aide d'électrodes placées dans une zone ciblée.
L'application d'un champ de forte intensité sur une longue
période permet de détruire les cellules, on parle alors
d'électro perméabilisation irréversible. En appliquant un
champ de plus faible intensité et/ou sur une période plus courte,
il est également possible de perméabiliser la membrane des
cellules pour faciliter l'entrée de molécules dans les cellules,
telles que des médicaments mais aussi des molécules d'ADN, on
parle alors d'électro perméabilisation réversible.
Chapitre I : Généralités sur le
cancer 15
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
1.3.2 Traitements systémiques
· La chimiothérapie
C'est l'administration (soit par intraveineuse ou sous la
forme de comprimés) de molécules qui s'attaquent aux cellules se
divisant rapidement. Ainsi, elles s'attaquent aux cellules tumorales mais
malheureusement également aux cellules à renouvellement rapide de
l'organisme, comme les cellules des cheveux, les globules rouges, les globules
blancs, les plaquettes et les cellules de l'estomac, induisant alors des effets
secondaires non négligeables.
· Les thérapies ciblées
Elles consistent à utiliser des molécules qui
ciblent des voies moléculaires propres aux cellules tumorales. Ces
thérapies peuvent être réparties en plusieurs familles :
les anticorps, qui bloquent une molécule précise à la
surface de la cellule et les inhibiteurs, qui bloquent une voie
moléculaire particulière à l'intérieur de la
cellule. Nous citons par exemple les inhibiteurs de tyrosine kinase (TKI) qui
inhibent la tyrosine kinase (TK), une enzyme responsable de réactions
intervenant dans la prolifération cellulaire. Certaines thérapies
ciblées peuvent également avoir un effet
anti-angiogénique, c'est-à-dire qu'elles peuvent bloquer la
formation de nouveaux vaisseaux sanguins, intervenant dans la
prolifération cellulaire. Certaines thérapies ciblées
peuvent également avoir un effet anti-angiogénique,
c'est-à-dire qu'elles peuvent bloquer la formation de nouveaux vaisseaux
sanguins.
· L'immunothérapie
Elle consiste à utiliser le système immunitaire
pour combattre les cellules tumorales. Parmi les méthodes
d'immunothérapie, nous pouvons distinguer l'immunothérapie non
spécifique qui consiste à stimuler le système immunitaire
global par des molécules de la famille des cytokines, comme
l'interféron ou l'interleukine 2. L'inconvénient de cette
méthode est qu'elle ne cible pas uniquement les cellules tumorales, ce
qui induit des effets secondaires comme des nausées ou de la
fièvre. un second type d'immunothérapie est la
vaccinothérapie dont le principe est d'éduquer le système
immunitaire à reconnaître des antigènes propres aux
cellules tumorales afin de reconnaître et d'attaquer ces cellules
tumorales (remarque : il est également possible d'utiliser des vaccin
à titre préventif, notamment en utilisant des vaccins contre des
infections virales qui sont à l'origine de certains, comme
l'hépatite B qui peut être à l'origine du cancer du foie ou
un certain
Chapitre I : Généralités sur le
cancer 16
papillomavirus qui peut être à l'origine du cancer
du col de l'utérus).
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
CHAPITRE DEUX
ANALYSE MATHEMATIQUE ET METHODOLOGIE
Face à la complexité des
phénomènes en jeu dans le développement du cancer, la
modélisation mathématique peut permettre d'améliorer la
compréhension de ces phénomènes, notamment grâce
à l'explosion de la quantité de données disponibles, aussi
bien au niveau expérimental qu'au niveau clinique, avec le
développement et l'amélioration des données d'imagerie
disponibles (IRM, CT-scan, PET-scan). L'intérêt de la
modélisation au niveau biologique est de pouvoir développer de
nouvelles théories biologiques et de les confronter aux données,
comme par exemple les cultures de Sphero des tumoraux [17]. En clinique, la
modélisation peut permettre de proposer de nouvelles cibles de
traitement, prédire l'évolution de la maladie ou bien aider
à la personnalisation du traitement.
Nous présenterons dans cette section un aperçu
de la modélisation mathématique de la croissance tumorale.
2.1 Les modèles mathématiques du cancer
Les premiers modèles mathématiques sur la
croissance tumorale dont nous avons connaissance remontent aux années
1930 [18]; c'est cependant essentiellement vers la fin du xxe siècle
qu'ils ont été nombreux à être
développés [19]. Parmi les différents modèles, on
distingue usuellement les modèles discrets et les modèles
continus.
2.1.1 Les modèles discrets
Dans un modèle discret, chaque élément
est modélisé comme une entité à part,
équipée de caractéristiques et suivie individuellement; un
certain nombre de règles de modélisation définissent ses
actions. Le comportement de chaque entité est alors
précisément défini, ce qui rend accessible l'ajout de
nouvelles règles. Par ailleurs, le devenir de toutes les entités
peut être
Chapitre II : Analyse mathématique et
méthodologie 18
Mémoire de MASTER II TAMKO MBOPDA Boris c2019
connu, ce qui facilite les comparaisons entre le modèle
mathématique et des données expérimentales. Ces avantages
atteignent cependant leurs limites sur de grandes populations cellulaires : en
effet, il devient alors nécessaire de suivre de nombreuses
entités, ce qui se révèle couteux en terme de
résolution numérique. Les modèles discrets sont
exposés en deux temps à savoir les modèles sur grille et
les modèles agent-centré.
· Modèles discrets sur grille (on lattice
models)
Il s'agit des modèles dans lesquels l'espace est
découpé en plusieurs petites cases : ces différentes cases
portent le nom de sites et forment une discrétisation appelée
grille (ou réseau). Cette grille détermine l'emplacement des
entités, puisqu'elles sont nécessairement placées sur des
sites. Elle fournit par ailleurs des relations intrinsèques de
voisinage, qui permettent de définir les interactions entre les
entités. Chaque site est caractérisé par son état
qui, à chaque pas de temps, évolue en fonction d'un jeu de
règles préalablement définies. Les avantages de ces
modèles sont une implémentation numérique aisée et
une facilité de modification des règles de modélisation.
Concernant leurs inconvénients, nous pouvons dire que les
déplacements (et en particulier leur direction), les positions ainsi que
la forme des entités sont contraints par le réseau : ces
modèles ne peuvent donc pas correctement capter des comportements
d'entités qui ne se dérouleraient pas sur la grille.
· Modèles agent-centré (agent-based
models)
Il s'agit des modèles discrets pour lesquels, à
la différence des modèles sur grille précédents, il
n'existe pas de réseau préalablement fixé qui contraigne
les entités : leur placement, leur forme ainsi que leur mouvements ont
alors totalement libres. Les entités sont représentées
dans l'espace par des objets individuels, appelés «agents»,
équipés de certaines caractéristiques (forme, position,
taille, état interne, etc.) à choisir. Un avantage de cette
liberté de mouvement est de fournir une modélisation plus
réaliste; l'inconvénient est que l'implémentation
numérique est plus ardue que dans les modèles sur grille.
L'avantage des modèles discrets est de permettre de
modéliser les cellules, leurs interactions et leurs changement
d'états individuellement, ce qui les rend très adaptés
à la comparaison des simulations de ces modèles avec des
données de cultures de cellules, notamment pour les cultures de cellules
en 3D comme les cultures de sphéroïdes. Cependant, à cause
de leur coût de calcul important, l'utilisation des modèles
discrets est moins adaptée à la modélisation d'un
très grand nombre de cellules continus.
Chapitre II : Analyse mathématique et
méthodologie 19
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
2.1.2 Les modèles continus
Dans les modèles continus, les entités ne sont
pas directement modélisées : ce sont des populations
d'entités qui sont décrites, par des fonctions de densité.
De tels modèles permettent d'étudier une population,non plus en
regardant les comportements individuels de chacune de ses entités mais
en la regardant de manière globale. Le modèle continu le plus
connu est le modèle de Gompertz qui permet de modéliser
l'évolution du volume et le ralentissement de la croissance d'une
tumeur.
Ce modèle peut s'écrire sous la forme suivante
:
dV = aV ln(K V ) (2.1)
dt
Où V est le volume de la tumeur. Le
paramètre K est la taille maximale que peut atteindre la tumeur dans un
environnement donné. Il permet de prendre en compte la quantité
limitée de ressources disponibles dans l'environnement pour expliquer un
ralentissement de la croissance. Si les modèles EDO permettent de
capturer l'évolution de l'aire tumorale ou du volume tumoral, ils ne
permettent pas d'inclure les effets spatiaux, comme par exemple
l'hétérogénéité tumorale, qui sont
observés aussi bien sur des données expérimentales qu'en
clinique.
2.2 Modélisation mathématique
Dans ces exposés on tentera de donner une idée
des méthodes utilisées en modélisation de la croissance
cellulaire et tissulaire, méthodes qui font naturellement intervenir des
systèmes dynamiques de dimension finie. Les systèmes
présentés seront toujours continus, commandés ou non, et
presque toujours non linéaires, car il n'y a pour ainsi dire pas de
phénomènes linéaires purs en biologie. Certains des
modèles présentés ici ont des propriétés
mathématiques bien connues, mais c'est en fait assez peu souvent le cas,
et les études menées sur ces systèmes d'équations
passent généralement par des simulations numériques.
Il ne s'agit pas ici, sauf exception, de présenter des
démonstrations mathématiques, mais d'in-diquer des thèmes
d'étude, avec des méthodes, et des directions de recherche dans
un domaine en expansion, dans lequel les progrès se font avant tout de
manière pluridisciplinaire, par une collaboration effective entre
biologistes et chercheurs dans le domaine des mathématiques
appliquées.
Chapitre II : Analyse mathématique et
méthodologie 20
Mémoire de MASTER II TAMKO MBOPDA Boris c2019
2.2.1 Description de la croissance cellulaire et
tissulaire
-- Vision microscopique : A la base de toute
croissance tissulaire : le cycle de division cellulaire, divisé
classiquement en 4 phases : G1(gap1), S (pour synthèse de l'ADN),
G2(gap2) et M (pour mitose). Ceci pour les cellules en prolifération, on
dit aussi »dans le cycle ». Celles qui ne le sont pas (la
majorité, même dans les tissus qui se renouvellent) sont dites
quiescentes, Ou » en phase G0». Des protéines, les cyclines,
activées par d'autres protéines, les CDK (kinases
cycline-dépendantes), rythment par les variations de leurs
concentrations la progression de chaque cellule dans le cycle jusqu'à la
division cellulaire effective (cytokinèse).
Les mécanismes biochimiques à l'oeuvre sont
actifs dans chaque cellule en prolifération individuellement, et les
cellules d'un même tissu peuvent être synchronisées ou non
dans leur progression dans le cycle, autant qu'on le sache non pas par
communication intercellulaire mais par des messages neuro-hormonaux externes.
Les modèles utilisés pour cette description microscopique sont
des systèmes d'équations différentielles ordinaires (EDO
non linéaires), qui peuvent être de très gros
systèmes, mais dans lesquels on cherchera à individualiser des
mécanismes décrits par des sous-modules de plus petite taille,
accessible à une étude mathématique.
-- Vision »mésocopique» :
plutôt que de considérer chaque cellule individuellement, on peut
considérer l'ensemble des cellules (de même nature) d'un tissu
comme une population divisée en compartiment : les phases G0, G1, S, G2
et M, structurées par une variable d'âge dans la phase pour les
cellules en prolifération, et des fonctions de transition d'une phase
à la suivante.
Ces échanges d'une phase à l'autre sont
irréversibles (unidirectionnels), sauf pour les échange entre G0
et G1, mais même dans ce cas seulement jusqu'au »point de
restriction » en fin de phase G1 : une fois le point de restriction
franchi, une cellule est inéluctablement conduite (sauf accident)
à passer par toutes les phases suivantes jusqu'à se diviser en
deux.
On utilisera alors pour décrire ce point de vue des
équations aux dérivées partielles (EDP) dans lesquelles la
variable structurante (= de position) ne sera pas l'espace, mais l'âge
dans la phase. Le terme source sera donné par une moyenne
pondérée sur toutes les cellules de la phase
précédente, et dépendant du temps
(ni+1(t, a = 0) =
Chapitre II : Analyse mathématique et
méthodologie 21
Z0
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
+8
Ki(t, á)ni(t, á)dá) pour inclure un
contrôle synchronisant extérieur.
D'autres représentations sont possibles; en
particulier dans le cas de la moelle osseuse hématopoïétique
on utilise souvent non pas des EDP, mais des équations
différentielles à retard.
-- Vision macroscopique : description
phénoménologique de la croissance tissulaire, i.e., sans
s'occuper des mécanismes biochimiques sous-jacents, mais en
privilégiant (en physicien Plutôt qu'en chimiste) une
représentation ajustée d'aussi près que possible à
des mesures expérimentales de croissance tissulaire.
On utilisera pour ce type de représentation des
modèles de dynamique des population, EDO ou EDP structurées en
espace, avec par exemple avec échanges entre cellules quies-centes et
cellules proliférantes, mais en général sans
représentation détaillée du cycle de division
cellulaire.
Par exemple pour la croissance tumorale, parmi les premiers
modèles proposés, à une
dx
variable, on peut citer les modèles exponentiels simple :
= Kx, ou, lorsqu'on veut
dt
représenter une croissance bornée, plus
réaliste : exponentiel borné vers +8
dx dx
alias de bertalanffy : = K(xmax - x) ; logistique : = K(xmax
- x) ; ou encore de
dt dt
).
dx = Kxln( x
Gompertz : dt x - xmax
2.2.2 contrôle de la croissance cellulaire et
tissulaire :
-- Stimulation ou inhibition d'une variable
biochimique par des facteurs endogènes : par exemple facteurs
de croissance et synthèse de la cycline D, induisant la progression
d'une cellule dans la phase G1.
-- Modification d'un taux de transition de phase ou
d'un de taux de mort dans la phase : par des facteurs physiologiques
tels que les variations de l'horloge circadienne venant directement
(gènes Bmal1, Wee1, Cdk1 et transitionG2/M) ou indirectement ( axe
hypothalamo-hypophyso-surrénalien, cortisol et transition G1/S) inhiber
des transitions de phases, ou encore par des médicament (cytotoxiques)
bloquant les transitions de phases, soit directement (inhibiteurs de Cdk,
poisons du fuseau mitotique), soit indirectement ( lésions de l'ADN
induisant l'activité de la protéine p53 avec blocage des
transitions G1/S et G2/M et déclenchement secondaire de l'apoptose (
mort cellulaire programmée). Le taux de croissance de la population en
est indirectement affecté.
Chapitre II : Analyse mathématique et
méthodologie 22
Mémoire de MASTER II TAMKO MBOPDA Boris c2019
-- Modification directe d'un taux de croissance d'une
population : vision macroscopique, plus
phénoménologique, du contrôle par l'adjonction dans une
équation décrivant globalement la dynamique de la population d'un
terme ne dépendant que d'une variable externe (concentration en
médicament), par exemple. Dans le modèle de Gom-
x
pertz on remplace Klm
xmax
|
x
par Klm xmax
|
f(M) en facteur de x, si f(M)
représente
|
|
l'effet du médicament sur le taux instantané de
mort dans la population. 2.2.3 Intérêt de la
modélisation
Ces modèles permettent :
· D'expliquer et prédire la dynamique cellulaire
et tissulaire normale dans les tissus à renouvellement rapide, en
particulier dans ses rapports avec l'horloge circadienne moléculaire.
· De comprendre qualitativement et quantitativement ses
dérégulations pathologiques
· D'intervenir pour rétablir une dynamique
physiologique par une commande pharmacologique de la croissance tissulaire :
donner un cadre théorique à la thérapeutique des maladies
prolifératives (cancer, maladies inflammatoires) et à leur
optimisation.
2.3 Rôle des acides dans le cancer
2.3.1 Cause directe du cancer
Le lauréat du prix Nobel, le Dr Otto Warburg H, a
consacré sa vie à l'étude et à la cause du cancer.
Dr Warburg était directeur de l'institut Kaiser Wilhelm (aujourd'hui
Institut Max Planck) pour la physiologie cellulaire à Berlin.
Otto Heinrich Warburg, né le 8 Octobre 1883 à
Fribourg-en-Brisgau (Bade-Wurtemberg), mort à Berlin, était un
médecin, physiologiste et biochimiste allemand. Docteur en chimie et
docteur en médecine, il fut lauréat du prix Nobel physiologie et
médecine pour sa découverte de processus-clés de la
respiration cellulaire et de différents systèmes enzymatiques.
Ayant démontré que les cellules cancéreuses changent leur
métabolisme pour passer à un métabolisme anaérobie
il a formulé l'hypothèse, non confirmée, que le cancer ne
peut pas se développer dans un milieu riche en oxygène. Parmi ses
étudiants, le plus illustre est Hans Adolf Krebs, prix Nobel lui aussi
en 1953.
Chapitre II : Analyse mathématique et
méthodologie 23
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
Le Dr Warburg a été l'un des éminents
physiologistes du 20ème siècle, et il a découvert que la
cause du cancer est une acidité trop importante dans le corps,
signifiant que le pH dans le corps est en dessous du niveau normal de 7,365,
qui constitue un état «acide». Warburg a étudié
le métabolisme des tumeurs et la respiration des cellules et a
découvert que les cellules cancéreuses persistent et
prospèrent dans un pH plus faible, à 6.0, à cause de la
production d'acide lactique et d'une concentration élevée en
CO2. Il croyait fermement qu'il y avait une relation directe entre le
pH et l'oxygène. Un pH plus élevé, qui est alcalin,
signifie qu'il y a une concentration plus élevée en
molécules d'oxygène, tandis qu'un pH plus faible, qui est acide,
signifie qu'il y a une concentration plus faible d'oxygène et c'est
cette même oxygène qui est nécessaire pour garder des
cellules saines.
En 1931, il a été lauréat du prix Nobel
de physiologie ou médecine pour cette importante découverte sur
la cause du cancer. Il a déclaré : «les tissus
cancéreux sont acides, alors que les tissus sains sont alcalins. L'eau
se divise en ions H+ et OH-,s'il y a un
excès d'H+, c'est acide; s'il y a un excès
d'OH-, alors c'est alcalin.»
Dans son ouvrage le métabolisme des tumeurs, il a
prouvé que « toutes les formes de cancer sont
caractérisées par deux conditions de base : l'acidose et
l'hypoxie. Le manque d'oxygène et l'acidose sont les deux faces d'une
même pièce : si vous en avez une, vous avez l'autre.»
«Toutes les cellules normales ont un besoin absolu d'oxygène, mais
les cellules cancéreuses peuvent vivre sans oxygène, c'est une
règle sans exception. Privez une cellule de 35% de son oxygène
pendant 48 heures, elle pourra devenir cancéreuse.»
Le Dr Warburg a clairement démontré que la
première cause du cancer est un manque d'oxygène, ce qui
crée un état acide dans le corps humain. Le Dr Warburg a
découvert que les cellules cancéreuses sont anaérobies et
ne peuvent pas survivre en présence de niveaux élevés
d'oxygène, que l'on trouve dans un état alcalin.
2.3.2 L'action du PH sur le développement du
cancer
D'après les recherches du Dr. Enderlein, une
guérison totale de maladies chroniques, ne peut arriver que lorsque le
sang est ramené à un pH normal, légèrement
alcalin.
Etant donné que nous sommes faits à 60-70%
d'eau, le niveau du pH a des effets très profonds sur la chimie du
corps, la santé et les maladies. Tous les mécanismes
régulateurs (respiration, circulation, digestion, production hormonale)
ont pour but d'équilibrer le pH, en débarrassant le
Chapitre II : Analyse mathématique et
méthodologie 24
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
corps et les tissus des résidus acides sans endommager
les cellules vivantes. Si le pH dévie, trop acide ou trop alcalin, les
cellules s'empoisonnent avec leurs propres déchets toxiques et meurent.
Comme les pluies acides sur une forêt et des déchets alcalins dans
un lac, un pH déséquilibré peut interrompre les
activités et fonctionnements cellulaires, comme les battements de coeur
et les étincelles entre les neurones du cerveau.
La cause du cancer est liée à deux facteurs qui
sont toujours présents lors d'un cancer, le pH acide et le manque
d'oxygène.
En apprenant à manipuler ces deux facteurs qui seraient
la cause du cancer, on peut réduire ou inverser le processus du cancer.
Rappelons-nous que le pH est un nombre exponentiel de 10; donc une petite
différence dans le pH se traduit en grosse différence dans le
nombre d'ions OH-. En d'autres mots, un sang avec un pH de
7.45 contient 64.5% plus d'oxygène qu'un sang donc le pH est
7.3. Le cancer a besoin d'un environnement acide/pauvre en oxygène pour
survivre et se développer. Les patients en phase terminale d'un cancer
sont environ 1000 fois plus acides qu'ils ne devraient l'être. Cela veut
dire un niveau d'oxygène dangereusement critique au niveau cellulaire.
En l'absence d'oxygène, le glucose fermente et devient acide lactique.
Cela baisse le pH des cellules. Le pH des urines et de la salive des patients
en phase terminale de cancer se situe très souvent entre 4.0 et 5.5.
Quand le cancer se transforme en métastases, le pH chute davantage. Nos
corps ne peuvent pas lutter contre la maladie si le pH n'est pas proprement
équilibré. En d'autres termes, c'est «alcalinise ou
meurt».
2.4 Modèle utilisé pour le
mémoire
Le métabolisme énergétique
altéré est une caractéristique quasi universelle des
tumeurs cancéreuses
solides. il est apparu ces
dernières années comme une caractéristique
phénotypique possible et une avenue pour de nouvelles stratégies
de traitement . Le principe du métabolisme altéré dans les
tumeurs remonte à l'oeuvre séminale d'Otto Warburg . Il a
observé que les carcinomes chez le rat et chez l'homme subissaient un
métabolisme du glucose, non pas par phosphorylation oxydative comme dans
les cellules normales, mais principalement par glycolyse, voie extra
mitochondriale tronquée produisant de l'acide lactique comme
sous-produit et généralement réservée aux
conditions d'hypoxie. Bien que de nombreuses cellules tumorales soient sujettes
à une hypoxie chronique ou transitoire due à un encombrement et
à un système vasculaire défectueux, Warburg a noté
que les tumeurs maintenaient la voie glycolytique même
Chapitre II : Analyse mathématique et
méthodologie 25
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
avec suffisamment d'oxygène. Pour la phosphorylation
oxydative, indiquant que le passage métabolique de la phosphorylation
oxydative à la glycolyse maintenant appelé effet Warburg, ou
phénotype glycolytique était un changement fondamental du
métabolisme de la tumeur (Warburg 1956). Les décennies qui ont
suivi ont confirmé les observations de Warburg. Le phénotype
glycolytique est suffisamment répandu, par exemple, pour le
succès de l'imagerie par tomographie à émission de
positrons au 18 fluoro-2-désoxyglucose (FDG-PET), qui exploite le taux
considérablement accru d'absorption du glucose présenté
par les tumeurs exprimant le phénotype glycolytique. Les facteurs
sous-jacents de l'effet Warburg restent toutefois en grande partie
mystérieux, car ils entrainent une baisse significative du rendement
absolu en ATP par molécule de glucose par rapport à la voie
d'oxydation normale et génèrent une charge toxique en acide
lactique. La glycolyse découplée de la respiration peut
éventuellement permettre aux cellules tumorales d'optimiser leurs voies
cataboliques et anaboliques pour la biosynthèse rapide requise par un
programme de croissance intensive. Alternativement, ou peut-être en
complément, en acquérant une résistance à
l'acidification du microenvironnement, les cellules tumorales exprimant le
phénotype glycolytique peuvent acquérir un avantage
sélectif par rapport aux cellules saines voisines sensibles à
l'acide, qui leur permet d'envahir le microenvironnement.
L'hypothèse d'une invasion à médiation
acide, est motivée par le fait de considérer une tumeur comme une
espèce invasive, soumise à des pressions sélectives de
plus en plus sévères et à une évolution somatique
au sein du microenvironnement d'une population en bonne santé; par
conséquent , il est sujet à une représentation
mathématique en tant que système de réaction-diffusion
à l'échelle du tissu. Alors que de nombreux modèles
mathématiques ont été développé pour
explorer les relations entre invasion tumorale, tissu-acide, métabolisme
cellulaire et exigences énergétiques, Gatenby et Gawlinski ont
été les premiers émettre hypothèse d'invasion
à médiation acide dans un cadre réaction-diffusion .
En partant du principe que les tumeurs
considérées exprimaient déjà l'effet Warburg, les
auteurs ont isolé les conséquences du phénotype
glycolytique sur l'invasion à l'interface entre la tumeur en croissance
et le tissu sain environnant. Le système d'équations aux
dérivées partielles non linéaires qui en résulte
est décrit en détail dans Gatenby et Gawlinski (1996). Toutefois,
par souci de commodité, nous reproduisons les équations ici,
U(x,T) indiquant la densité de cellules saines (fonction de la variable
spatiale x en unités de centimètres et le temps T, mesuré
en secondes) V(x,T) la densité des cellules tumorales et W(x,T) la
concentration d'acide
Chapitre II : Analyse mathématique et
méthodologie 26
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
lactique extracellulaire dépassant les concentrations
normales d'acide tissulaire. Les équations de Gatenby-Gawlinski
(Gatenby-Gawlinski, 1996 ) sont les suivantes :
|
?
???????
???????
|
?U
?T
?V
?T
|
|
U
= ñ1U(1 - ) -
ä1UW(1)
K1
V ? U ) ?V
= ñ2V (1 - ) + ?X
[Ä2(1 - ?X ](2)
K2 K1
|
(2.2)
|
|
?W
|
?2W
= ñ3V - ä3W + Ä3 ?X2
(3)
|
|
|
?T
|
|
|
L'indice «1» représente ici l'association des
paramètres avec les cellules saines, «2» avec les cellules
tumorales et «3» avec un excès d'acide lactique
extracellulaire. Les constantes K1,2 représentent les capacités
porteuses des tissus, ä1 le taux de mort cellulaire saine induite par
l'acide, ä3 le taux de clairance de l'acide en excès par
tamponnement et évacuation vasculaire, ñ1,2 les taux de
prolifération cellulaire, ñ3 le taux de production d'acide en
excès par les cellules tumorales, Ä2 le coefficient de
diffusion en espace libre des cellules tumorales et Ä3 le
coefficient de diffusion chimique de l'excès d'acide. Une
caractéristique clé de ce modèle est le terme de diffusion
tumorale à densité limitée dans l'équation. (2),
l'idée étant qu'un tissu sain fonctionnant à sa pleine
capacité portante agira patiemment contre nous- mêmes, sans qu'il
soit réduit, dans Gatenby et Gawlinski (1996), solution numérique
des équations (1) à (3) du système 2.2 ont capturé
deux types de comportement : l'invasion par une tumeur
hétérogène composée de cellules saines et malignes,
et l'invasion par une tumeur homogène tuant toutes les cellules saines
derrière son bord d'attaque. En outre les tumeurs suffisamment
agressives, les auteurs ont prédit l'ouverture d'un écart
interstitiel entre les cellules malignes en progression et les cellules saines
en régression, comportement qui n'avait pas été
signalé auparavant, avant de détecter des lacunes dans les
échantillons de tête et de cou fixés et congelés
instantanément de carcinomes à cellules squameuses humaines.
cette prédiction et la détection subséquente de
l'écart interstitiel ont été reconnues comme une
illustration élégante des avantages d'une approche hybride
mathématique et expérimentale de l'étude du cancer [20].
cet écart pourrait peut-être avoir un potentiel diagnostique
potentiel tumeurs agréssives.
Le modèle de Gatenby-Gawlinski est l'un des nombreus
études suggérant que l'acidité pourrait jouer un
rôle important dans la progression tumorale [21]. si cela est vrai, cela
pourrait conduire à de nouvelles stratégies
thérapeutiques. L'un de ces traitement en cours de développement,
la thérapie tampon, était motivé par les conclusions de la
modélisation de Gatenby et Gawlinski [22] et visait à priver une
tumeur en développement de son avantage sélectif en neutralisant
le
Chapitre II : Analyse mathématique et
méthodologie 27
pH du microenvironnement F23].
2.5 Description de l'instabilité de Turing
Est-il possible de trouver une règle
générale pouvant expliquer la diversité des motifs
observés dans la nature? pourquoi les Zèbres ont-ils des rayures
et les lépards des taches? pour un mathématicien, il est
très intéressant de pouvoir regrouper, sous un seul cocept,
plusieurs problèmes qui nous semblent, à première vue,
totalement sans lien. En 1952, Alan Turing publia son célèbre
article «The chemical Basis of Morphogenesis» dans lequel il avance
une idée orignale : la morphogenèse serait causée par la
perte de stabilité, due à la diffusion, d'une position
d'équilibre de réactants chimiques. En d'autres termes, des
équations de réaction-diffusion pouraient modéliser un
pelage tacheté, rayé ou bien plus complexe encore. Bien que les
biologistes n'aient actuellement pas la tecnologie nécessaire pour
confirmer l'hypothèse de Alan Turing, certains motifs obtenus
grâce aux modélisations sont si proches de la
réalité que cette hypothèse semble être une
explications les plus prometteuses.

FIGURE 2.1 - differents motifs que nous pouvons
retrouver dans la nature [24]
2.5.1 Problématique
Bien que nous puissions étendre la notion de formation
de motifs sur un espace en 2D, comme les taches sur la peau d'un
léopard, ou en 3D, comme la forme de la tête d'une echinacea,
seule l'équation de réation-diffusion en 1D sera
présentée afin de rendre les explications plus intuitives. Mais
dans quel contexte biologique une simple «ligne» espace en 1D.
Peut-elle engendrer des motifs intéressants? la réponse
réside dans le développement de la coquille d'un mollusque!
Mémoire de MASTER II TAMKO MBOPDA Boris c2019
Chapitre II : Analyse mathématique et
méthodologie 28
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
Aussi surprenant que cela puisse paraître, Hans
Meinhardt, chercheur à l'Institut Max Planck pour le
développement en biologie, a entièrement consacré à
ces petits invertébrés son livre The Algorithmic Beauty of Sea
Shells [25] dans lequel il s'intéresse à la diversité
fulgurante des motifs engendrés par ceux-ci. Lorsque le mollusque
agrandit sa coquille, une rangée de cellules ajoute une fine ligne de
matière au rebord du coquillage et, au même moment, dépose
des pigments à certains endroits sur cette nouvelle ligne de
matière. L'hypothèse est que le taux de concentration d'une
substance chimique quelconque, présente dans cette rangée de
cellules, déterminerait la quantité ou l'intensité des
pigments déposés sur la bordure de la coquille. En d'autres
termes, si la concentration de la subtance chimique n'est pas uniforme tout le
long de la ligne de la diffusion de celle-ci à travers les parois
cellulaires. Donc, en étudiant les variations des concentrations des
subtanceces responsables de la pigmentation des coquillages dans l'espace et
dans le temps, il nous serait possible de reproduire les motifs observés
sur les coquillages. c'est ce que Hans Meinhardt a entrepris de décrire
grâce aux équations de réaction-diffusion. Intuitivement,
nous savons maintenant que la concentration d'une subtance chimique
u(x,t) dépend de deux choses : de la positon
x, et du temps t. (Si nous avion été dans une
espace en 2D ou 3D, x aurait été un vecteur, mais en 1D
x est un scalaire). Il est donc naturel que l'équation de
réaction-diffusion associée contienne des dérivées
partielles représentant la variation des concentrations dans l'espace
(x) et dans le temps (t). Les équations de
réaction-diffusion sont de la forme:
|
8u(x, t) 8t
|
82u(x, t)
= f(u(x, t)) +
Du (2.3)
8x2
|
où Du est la constante de
diffusion. Certains d'entre vous auront peut-être reconnu la forme de
l'équation de la diffusion de la chaleur. Or, avant de nous attarder sur
les aspects mathématiques des termes de réaction et de diffusion,
nous resterons dans les explications intuitives de la théorie d'Alan
Turing. Cela nous permettra ainsi de renforcer notre compréhension de
base sur l'importance du rôle de la diffusion dans la formation des
motifs.
Mais quel est le lien entre les équation de
réaction-diffusion et la formation de motifs? Dans son article «The
Chemical Basis of Morphogenesis » publié en 1952, Alan Turing
proposa une idée brillante. Selon lui, la formation d'un motif
hétérogène et stable dans le temps peut se produire si, en
l'absence de diffusion, la concentration des substances chimiques est stable,
mais qu'à l'ajout du phénomène de la diffusion, il y a
perte d'équilibre de cette position de stabilité. C'est ce que
nous appelons l'instabilité de Turing. Imaginons un désert
initialement complètement
Chapitre II : Analyse mathématique et
méthodologie 29
Mémoire de MASTER II TAMKO MBOPDA Boris c2019
plat, à un état stable, lorsque le vent se met
à souffler, les petits grains de sable «diffuseront» et
s'aggloméreront là où il y a de petites
irrégularités jusqu'à la formation de dunes. Un motif est
alors créé. Cette idée est bien intrigante puisque le
concept de diffusion est normalement pour nous un synonyme
d'homogénéité. En effet, lorsque vous submergez votre
sachet de thé dans l'eau bouillante, vous n'obtiendrez pas des taches de
thé partout dans votre tasse, mais bien un mélange
homogène après un certain temps. Alors comment est-il possible
d'obtenir la formation d'un motif? Regardons ensemble le comportement d'un
système typique d'équations de réaction diffusion
comprenant un activateur et un inhibiteur. Il sera donc question de deux
substances qui interagissent et influencent mutuellement leur production.
Mise en situation : L'idée derrière les
systèmes d'activation-inhibition est que l'activateur est
auto-catalytique, c'est-à-dire qu'il encourage sa propre production, et
permet aussi la production d'un inhibiteur. Or, le rôle principal de
l'inhibiteur est de ralentir la production de l'activa-teur (voir figure).
Parmi toutes mes lectures, c'est probablement l'image donnée par J.D.
Murray dans son livre Mathematical Biology [26] qui m'a le plus aidée
à comprendre le phénomène. Imaginons un champ où la
végétation est très sèche et qui abrite
d'innombrables sauterelles. Supposons que ces insectes produisent
énormément d'humidité en transpirant lorsqu'elles ont
très chaud. Si une personne allume un feu dans le champ, les flammes
vont évidemment se propager. Ici, les sauterelles joueront le rôle
de l'inhibiteur et les flammes représenteront l'ac-tivateur. S'il n'y
avait pas d'humidité, les flammes se propageraient sur toute la surface
et il n'en résulterait rien d'autre qu'un champ totalement
brûlé. Par contre, supposons que les
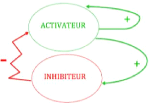
FIGURE 2.2 - Interactions entre un activateur
et un inhibiteur [24]
flammes réchauffent les sauterelles qui, à leur
tour, produisent suffisamment d'humidité pour protéger la
végétation des brûlure. Un motif peut alors être
créé de la façon suivante. Le feu commence à se
répandre avec un coefficient de diffusion Df. Lorsque les
sauterelles sentent le
Chapitre II : Analyse mathématique et
méthodologie 30
Mémoire de MASTER II TAMKO MBOPDA Boris c2019
front de flammes approcher, elles s'enfuient avec un
coefficient de diffusion Ds. Evidemment, les sauterelles
doivent s'enfuir plus rapidement que les flammes ne se propagent
(Ds»Df). Les insectes se mettent alors à
transpirer et l'humidité qui en résulte empêche le feu de
brûler la végétation imbibée d'eau. Les flammes sont
alors confinées dans un domaine fermé qui dépend des
coefficients de diffusion de l'activateur (le feu) et de l'inhibiteur (les
insectes). Supposons maintenant qu'il n'y ait pas seulement un point de
départ pour notre feu, mais bien plusieurs points choisis de
façon aléatoire. En répétant l'idée
précédente, nous pouvons facilement imaginer que les parties
brûlées du champ formeront un motif tacheté (non
homogène) puisque les sauterelles produiront de l'humidité entre
les différents feux.
CHAPITRE TROIS
RESULTATS ET DISCUSSION
Lorsque le taux de croissance d'une ou de plusieurs
espèces décroit tandis que le taux de croissance des autres
espèces croit, on dit qu'on est en présence de prédation,
c'est simplement la consommation par un prédateur d'une proie qui
était vivante quand le prédateur la attaquée. Dans ce
travail, nous étudions ce dernier type d'interaction. Entre cellules
saines, cellules cancéreuses et la concentration en acide lactique de
l'organisme
3.1 Modèle mathematique modifié de Gatenby
et Gawlinski
Nous considérons un système biologique de trois
espèces composé de deux espèces concurrentes, la
troisième espèce servant de prédateur à l'une des
espèces et d'hôte à l'autre. Récemment, Gupta et
Gakkhar [27] ont proposé un modèle de chaîne alimentaire
à trois espèces intégrant la prédation, la
compétition et le commensalisme. Les espèces W et U sont en
concurrence et on suppose que, du fait de la concurrence, le taux de croissance
de l'espèce est uniquement affecté. En particulier, nous
considérons le modèle de Gatenby et Gawlinski [28] :
U
= ñ1U(1 - ) - ä1UV
K1
V ? U= ñ2V (1 -K2) + ?X [02(1 -K1)?X
]
= ñ3V - ä3W + 03 ?X2
?2W
(3.1)
{
?U
?T
?V
?T
?W
?T
Dans ces équations les constantes sont défini
précédemment. Il s'agit d'une situation typique souvent
observée dans la nature dans divers chaîne alimentaires. Un
diagramme schématique de ce type de modèle de chaîne
alimentaire est présenté à la Fig 3.1 .
Le tableau 3.1 montre les dimensions des paramètres de
l'équation 3.1.
posons u =
|
ñ2
r2 =
ñ1
|
ä1,2ñ3k2
, d1,2 = c =
ñ1ä3
|
ä3 ñ1
|
02
et D = 03
|
U ,
v =
k1
ä3W t =ñ1T et x = ( ñ1
)1/2T
a1,2 = á1,2,
ñ3k2 03
V ,
w =
k2
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
Chapitre III: Résultats et discussion
32
Mémoire de MASTER II TAMKO MBOPDA Boris c2019
FIGURE 3.1 - diagramme schématique du système
3.1
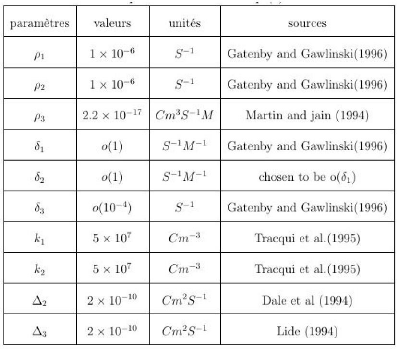
TABLE 3.1 - Dimensions des paramètres de
l'équation 3.1
Chapitre III : Résultats et discussion 33
le système 3.1 devient :
{
ut = u(1 - u - a2v)
- d1uw
(3.2)
vt = r2v(1 - v -
a1u) - d2vw + D[(1 -
u)vx]x wt =
c(v - w) + wxx
En changeant la forme de la diffusion on obtient :
= u(1 - u - a2v) -
d1uw + D1 52 u =
r2v(1 - v - a1u) -
d2vw + D2 52 v =
c(v - w) + D3 52 w
(3.3)
{
Ou
Ot
Ov
Ot
Ow
Ot
où D1 > 0 ; D2 >
0 ; D3 > 0 sont les coefficients de diffusion des
espèces u, v et w, respecti-
O2 O2
vement, et 52 = OX2 + OY 2 est
l'opérateur laplacien et u et v les variables d'espace. Nous
étudions l'effet de la diffusion spatiale en supposant
que les conditions initiales sont positives
W(-?x , 0) > 0, V
(-?x , 0) > 0,
U(-? x , 0) >
0avec-? x (x, y) ? S2 (3.4)
avec conditions aux limites de flux nul
A conditions limites homogènes de Neumann
|
Ou
= Ox
|
Ov
= Ox
|
Ow Ox
|
= 0 sur OS2, t > 0. (3.5)
|
= F(u, v, w)
= G(u, v, w)
= H(u, v, w)
(3.6)
{
du
dt
dv
dt
dw
dt
Ici, S2 est le domaine à deux dimensions et x est le
vecteur normal des unités extérieures de la frontière S2.
Les conditions aux limites correspondent à un flux nul à travers
la frontière qui implique que les espèces dans S2 ne peuvent pas
sortir du domaine S2 et qu'une espèce extérieure ne peut pas
entrer dans le domaine S2.
3.2 Dynamique non linéaire du modèle
modifié de Gatenby et Gaw-linski
Le modèle non diffusif peut être écrit sous
la forme suivante :
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
Chapitre III : Résultats et discussion
34
avec
{
|
A0 =
|
?
? ? ? ?
|
Fu Fv
Fw
Gu
Gv
Gw
Hu
Hv Hw
|
?
?? ? ? E*
|
F(u, v, w) = u(1 - u - a2v) - d1uw
G(u, v, w) = r2v(1 - v - a1u) - d2vw (3.7)
H(u, v, w) = c(v
- w)
dans cette section, les résultats concernant
l'existence, l'unicité et la délimitation de la solution du
système( 3.6 )sont présentés. les fonctions d'interaction
U,V et W sont continues et ont des dérivées partielles continues
dans l'espace d'états . En conséquence du théorème
de Nagumo, la solution du système avec des conditions initiales non
négatives existe et est unique Gupta et Gakkhar ([27]) ont
prouvés que la solution du système( 3.6 )est uniformément
bornée. en prenant
(3.8)
{ F(u, v, w) = 0
G(u, v, w) = 0
H(u, v, w) = 0
On obtient les points d' équilibres E0 = (0, 0, 0) et
E1 = (1, 0, 0) qui sont linéairement instable si a1 > 0 et stable si
a1 < 0 et E3 = (0, 1/(1 + d2/r2), 1/(1 + d2/r2)) est linéairement
instable si 0 < d1 < (1+d2/r2)-a2 et stable si d1 > (1+d2/r2)-a2 ainsi
qu'un point d'équilibre intérieur E* =
(u*, v*, w*) = (1 -
(a2 + d1)v, v, v) avec v = (1 -
a1)(1 - a1a2 + d2/r2 - a1d1) qui est linéairement instable si :
d1 > (1 + d2/r2) - a2et stable si 0 < d1 < (1 +
d2/r2) - a2
Du point de vue biologique, nous examinons uniquement la
formation de motifs pour le modèle 3.3 autour du point intérieur
E* en supposant que u* > 0,
v* > 0 et w* > 0. La matrice
jacobienne A0 du système 3.7 correspond à E*
comme
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
Chapitre III : Résultats et discussion 35
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
????????????? ?
?
?????????????? (
(?F
(?G
(?H)* = 0 a31 =
0;(?H)*E =
cw* a32 = cw* > 0
(?H)E* = -cw* a33 =
-cw* < 0
?F)* = --u* a11 =
--u* < 0; (OF)* =
--a2u* a12 = -a2u* < 0
?V )*E =
-r2v* = a22 = -r2v* < 0;
(?G
?w)*E = -d1u* = a13 =
-d1u* < 0; (?G ?u
)*E = -r2a1v* = a21
= -r2a1v* < 0
?w
?u E âv
?u E ?v ?w)*E =
-d2v* = a13 = -d2v* < 0 (3.9)
l'équation caractéristique de la matrice jacobienne
est :
?
??????
??????
avec
ë3 + í2(0)ë2 + í1(0)ë +
í0(0) = 0 (3.10)
í2(0) = -(a11 + a22) = -(-u* -
r2v*)
í1(0) = a11a22 - a12a21 - a23a32 =
v*(r2u* - a1a2r2u*
+ d2cv*) í0(0) = a32(a11a23 - a13a21) =
cw*u*v*(d2 -
d1r2a1)
Selon les critères de Routh-Hurwitz, le point
d'équilibre intérieur du système 3.3 est stable
si :
íi(0) > 0 pour i = 0, 1, 2 et
í1(0)í2(0) - í0(0) > 0 (3.11)
L'existence de la bifurcation de Hopf, de la bifurcation de
Hopf généralisée, de la bifurcation de Bogdanov-Takens,
etc est possible à condition que í1(0)í2(0) - í0(0)
= 0. Veuillez noter que í0(0) > 0 est toujours valable.
3.3 Etude de la stabilité linéaire et
bifurcation
Dans cette section, nous analysons la stabilité
linéaire du système complet (3.3 )et trouvons la condition de
l'instabilité de Turing (dans laquelle l'état d'équilibre
constant perd sa stabilité en raison de l'effet de diffusion et
l'apparition de la structure de Turing ). Nous linéarisons le
système( 3.3) autour de l'état stationnaire pour les petites
fluctuations dépendant de l'espace et du temps et développons les
variables U, V et W dans l'espace de Fourier de la manière suivante :
|
?
??????
??????
|
W(~x, t) w* + Äw(~x, t) V (~x, t)
v* + Äv(~x, t) U(~x, t) u* +
Äu(~x, t)
|
(3.12)
|
Chapitre III : Résultats et discussion
36
|
avec
|
{
|
|Äw(~x, t)| << w* |Äv(x, t)| << v*
|Äu(x, t)| << u*
|
(3.13)
|
Les perturbations Äw(x, t) ; Äv(x, t) et Äu(x,
t) dépendent de l'espace et du temps et ont la forme suivante :
|
{ Äw(x, t) = Cweëei~kx
Äv(x, t) = Cveëei~k~x Äu(x, t)
= Cueëei~k~
|
(3.14)
|
où Cw, CvetCu sont des
constantes. x~ est le vecteur spatial, k est le vecteur de nombre d'onde avec k
= |~k|, ë est la fréquence des ondes et i est la
notation complexe standard. En substituant les relations3.12 en (3.3 )et en
négligeant les termes d'ordre supérieur, nous avons les
équations suivantes :
|
{
|
?Äu
|
|
= a11Äu + a12Äv + a13Äw + D1V2Äu =
a21Äu + a22Äv + a23ÄW + D2V2Äv
|
|
|
?t
?Äv
|
|
|
(3.15)
|
|
?t
|
|
|
|
?Äw
|
= a31Äu + a32Äv + a33ÄW +
D3V2Äw
|
|
|
?t
|
|
|
|
En utilisant la forme spécifique de l'équation 3.14
on obtient l'équation caractéristique du
|
système 3.1 : |Ak - ëI| = 0 avec Ak = A0 -
K2D
Où
D1 0
?
D= ? ? ? ?
0 D2
0 0
|
0
0
D3 1
|
qui est la matrice de diffusion. Le polynôme
caractéristique de la matrice Aks'écrit
ë3 + í2(k)ë2 + í1(k)ë +
í0(k) = 0 (3.16)
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
Chapitre III: Résultats et discussion 37
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
|
avec
?
???????????? ?
?????????????
|
u2(k) = (D1 + D2 +
D3)k2 + u2
u1(k) = (D1D2 +
D1D3 + D2D3)k4 -
(D1(a22a33) + D2(a11a33)
+ D3(a11a22))k2
+u1(0)
u0(k) =
D1D2D3k6 -
(D1D2a33 + D1D3a22 +
D2D3a11)k4 +
[D1(a22a33 - a23a32)
+D2(a11a33 - a13a31) +
D3(a11a22 -
a12a21)]k2 + u0(0)
|
(3.17)
|
Avec aij et ui(0) définit
comme précédemment
Selon les critères les critères de Routh-Hurwitz
pour la stabilité du système 3.3 on a :
ui(k) > 0 pour i =
0,1,3 = u1(k) >
0;u2(k) > 0;u3(k) >
0 (3.18)
Avec u1(k)u2(k) -
u0(k) > 0 pour tout k
La violation de l'une des conditions ci-dessus données
en 3.18 (au moins pour un k) induit une instabilité induite par la
diffusion (Re(ëk) > 0).
3.4 Instabilité de Turing
L'instabilité induite par la diffusion est
appelée instabilité de Turing si le point d'équilibre
intérieur du système local (sans diffusion) est stable, mais il
devient instable en présence de diffusion. En d'autres termes,
l'instabilité de Turing se produit pour le système 3.3 si toutes
les conditions données par l'inégalité 3.11 sont valides,
mais qu'au moins une des conditions de l'inégalité 3.18 est
violée, c'est-à-dire. Re(ëk)
< 0 pour k = 0 et Re(ëk)
> 0 pour k =6 0.
Donc, pour étudier l'instabilité de Turing, il
est nécessaire de localiser la région pour laquelle le
système local devient asymptotiquement stable. Veuillez noter que les
valeurs de u2(0) et de u1(0) peuvent prendre les valeurs
positives avec un choix approprié des paramètres d, r2,
d2, d1, a2et a1 , c'est-à-dire
u2(0) et u1(0). sont conditionnellement positifs. Maintenant,
la fonction u1(0)u2(0) - u0(0) peut être
écrite de la manière suivante :
u1(0)u2(0) - u0(0) = -(a11 +
a22)(a11a22 - a12a21 -
a23a32) - a32(a11a23 -
a13a21) = a22[-a11(a11 +
a22) + a13a32] +
a21[a12(a11 + a22) +
a13a32] (3.19)
Sans perdre de généralité pour
étudier l'instabilité de Turing, nous supposons toujours que
a22 < 0. Notez également que pour le modèle
de diffusion 3.3 , u2(k) > 0 si u2(0)
> 0, k étant
Chapitre III : Résultats et discussion
38
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
un nombre non négatif. Par conséquent,
l'instabilité de Turing ne peut pas apparaître via
í2(k). De même, puisque par notre
hypothèse a22 < 0, nous avons
í1(k) > 0 et a11 < 0, et k est
un nombre non négatif. Maintenant, vérifions le signe de
í0(k) > 0 et
í1(k)í2(k) - í0(k)
. Ce sont deux fonctions polynomiales cubiques dans k2
et peuvent être écrites sous une forme
générale :
P(k2) =
P3(k2)3 +
P2(k2)2 +
P1(k2) + P0 (3.20)
Les coefficients P0, P1, P2 et
P3 sont donnés dans le tableau 3.2.
Maintenant, pour l'instabilité de Turing dans le
système 3.3, nous devons avoir P(k2) < 0
pour au moins l'un de í0(k) ou de
í1(k)í2(k) - í0(k)
. Ce point de Turing minimum et les critères correspondants sont
donnés par les relations suivantes :
?P ?k2
2
= 0 et 82k2 > 0
(3.21)
Un calcul simple donne
?P ?k2
= 0 k2 = -P2
+ ~P22 - 3P1P3 (3.22)
3P3
Où k2 est un nombre non
négatif, P3 > 0 pour les fonctions
í0(k) et
í1(k)í2(k) - í0(k)
, puis, à partir de l'expression ci-dessus 3.22, on doit avoir
soit
P2 < 0 ou P1 < 0 (3.23)
Le tableau 3.2 montre clairement que, pour étudier
l'instabilité de Turing, il existe certaines relations internes
nécessaires entre les coefficients de diffusion et la matrice jacobienne
des composants du système local, telles que P1 < 0
ouP2 < 0. Pour les fonctions
í0(k) et
í1(k)í2(k)- í0(k)
, le coefficient P2 > 0 est égal à
a11 < 0, a22 < 0,a33 = 0
etDi > 0(j = 1,2 et 3). Ainsi, le
seul moyen possible pour l'instabilité de Turing est P1
< 0 pour au moins une fonction í0(k) ou
í1(k)í2(k) -
í0(k). Encore une fois, notez que la condition
P1 < 0 n'est que la condition nécessaire à
l'instabilité de Turing mais non suffisante. Considérons
maintenant le coefficient P1 pour les deux fonctions
í0(k) et
í1(k)í2(k) -
í0(k).
Comportement deP0 dans la
fonction í0(k)
Pour le modèle 3.3,
P1|í0(k) =
-D1a23a32 +
D3(a11a22 - a12a21) (3.24)
Vu la relation 3.20, une condition nécessaire pour
laquelle P1|í0(k) devient conditionnellement
négative si
P1 < 0 = a11a22 -
a12a21 < 0 (3.25)

Chapitre III : Résultats et discussion
39
TABLE 3.2 - Coefficients générales des fonctions
v0(k) et v1(k)v2(k) - v0(k) La condition correspondante pour laquelle P1|v0(k)
< 0 est
|
D3 > D1
|
a23a32
(3.26)
a11a22 - a12a21
|
Comportement de P1dans la fonction
v1(k)v2(k) - v0(k)
Considérons le coefficientP1 pour la fonction v1(k)v2(k)-
v0(k) correspondant au modèle considéré 3.3
P1|í1(k)í2(k)-í0(k) = D1(a222 -
a12a21) + D2(a211 - a12a21 - a23a32) + D3(a211
+ a222 - a23a32) + 2(D1 + D2 + D3)a11a22 =
(D2 + D3)a211
+ (D1 + D3)a222 - D3a23a32 + (2D1 + D2 +
2D3)a11a22 + D2v1(0) - D1a12a21 (3.27)
?P
Maintenant nous cherchons le second critère de 3.21, ?k2 =
6P3(k2)3 + 2P2(k2)2, qui est
positif
pour les fonctions v0(k) et v1(k)v2(k) - v0(k) , qui indique que
à k2 = k2T cubes 3.20 a une
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
Chapitre III : Résultats et discussion
40
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
valeur minimale. Enfin, la condition pour laquelle
P(k2T) < 0 est possible si
2P23 - 9P1P2P3 -
2(P22 - 3P1P3)3/2 +
27P0P32 < 0 car P(K2T) < 0
(3.28)
Les relations 3.21 et 3.28 sont les conditions
nécessaires et suffisantes pour l'instabilité. Les
mécanismes mentionnés ci-dessus ne sont toujours pas suffisants
pour construire l'instabilité de Turing il est bien connu que
l'instabilié de Turing est possible lorsque la caractéristique Eq
3.17 a trois racines réelles (Im(ë) = 0 avec k =6 0) et l'une
d'elles devient positive. La caractéristique Eq 3.17 a trois racines
réelles si
[2(í2(k))3 - 9í2(k)í1(k) +
27í0(k)]2 - 4[(í2(k))2 -
3í1(k)]3 < 0 (3.29)
L'inégalité ci-dessus 3.29 est possible si
(í2(k))2 - 3í1(k) > 0 (3.30)
La relation 3.29 peut être considérée
comme une condition nécessaire à l'apparition de
l'insta-bilité de Turing pour un modèle à trois
espèces.
Lemme 1 : L'instabilité de Turing
n'est pas possible pour le système 3.3 si
(í2(k))2-3í1(k) < 0 . Considérant les
valeurs propres réelles de l'équation caractéristique,
l'instabilité de Turing se produit lorsque la valeur propre
réelle passe par zéro et prend sa première valeur
positive, et le mode critique correspondant pour l'instabilité de Turing
est donné par
Im(ë(k)) = 0, Re(ë(k)) = 0 k = kT =6 0.
(3.31)
L'instabilité durable ne suffit pas à comprendre
les structures des motifs dans un modèle prédateur - proie. Il
existe plusieurs autres types d'instabilités, telles que
l'instabilité de Hopf et l'instabilité des vagues. Le
mélange de toutes ces instabilités peut également
être présent ensemble. Nous supposons maintenant que
l'équation cubique.3.17 a trois racines et elles se présentent
sous la forme de è1, è2 #177; iè3. Par conséquent,
à partir de l'équation cubique 3.17 nous avons
í2(k) = í0(k) = -(è1 +
2è2),í1(k) = è22 +
è23 + 2è1è2, í0(k) =
è1(è22 + è23)
(3.32)
Dans les expressions de 3.32, on peut facilement constater que
si seul í0 change son signe de positif à négatif pour k
> 0, alors un ë(k) doit changer de signe de négatif à
positif et correspond au seuil correspondant de l'instabilité de Turing.
est è1 = 0, et donc í0(k) = 0 .
Chapitre III : Résultats et discussion
41
|
?
??
??
|
?v
?t
?w
?t
|
= r2v(1 - v) - d2vw = c(v - w)
|
(3.37)
|
Lemme 2 : Avec la condition v0(k) < 0, le
polynôme cubique 3.17 a au moins une racine réelle positive.
Preuve : supposer
h(ë) = ë3 + v2(0)ë2 +
v1(0)ë + v0(0).. (3.33)
Considérons maintenant la fonctionv1(k)v1(k) - v0(k) et
prend la forme suivante :
v1(k)v1(k) - v0(k) = -262[(61 + 62)2 +
623] (3.34)
D'après l'expression ci-dessus dans 3.34, il est clair
que si seulement v1(k)v1(k)-v0(k) fait passer son signe de positif à
négatif pour k > 0, alors le complexe ë(k) et son
conjugué paire croise l'axe imaginaire de gauche à droite. Le
seuil correspondant de l'instabilité de l'onde est 62 = 0, et par
conséquent, v1(k)v1(k) - v0(k) = 0 . Lorsque ë est purement
complexe (Re(ë) = 0, Im(ë) =6 0), le mode critique est
oscillatoire dans le temps et uniforme dans l'espace, de sorte que le mode
critique représente une onde progressive et que l'instabilité de
l'onde se produise. Le mode critique correspondant à
l'instabilité de la vague est donné par
Im(ë(k)) = 0, Re(ë(k)) = 0k = kW =6 0.
(3.35)
L'instabilité du système de diffusion de
réaction est appelée instabilité de Hopf si au moins une
condition donnée par l'inéquation 3.9 est violée. C'est le
cas d'une instabilité d'onde correspondant à k = 0,
c'est-à-dire que l'espace est indépendant. Le mode critique pour
l'instabilité de Hopf est donné par
Im(ë(k)) = 0, Re(ë(k)) = 0k = 0. (3.36)
Un motif fixe apparaît en raison de l'absence de partie
imaginaire de valeurs propres dans le cas de l'instabilité de Turing
(pure). D'autre part, pour les instabilités de Hopf et d'ondes, il donne
un schéma temporel dû à la présence d'une partie
imaginaire non nulle de valeurs propres. Dans la présente enquête,
nous supposons que les instabilités qui ne satisfont pas les conditions
de Turing sont appelées instabilité non-Turing.
L'instabilité non-Turing apparaît en cas de violation d'au moins
une des conditions énumérées en 3.11. Pour identifier la
nouvelle caractéristique du modèle à trois espèces,
nous abordons maintenant les conditions d'instabilité dans le
modèle 3.3 en l'absence d'une espèce. Supposons d'abord que
l'espèce u soit absente ; alors, le système 3.6 devient
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
Chapitre III: Résultats et discussion
42
Le modèle 3.37 est un modèle à deux
espèces en présence d'une complexité de l'habitat avec une
réponse fonctionnelle de Holling de type II. Déterminons les
points d'équilibre
r2v(1 - v) - d2vw = 0
c(v - w) = 0
On a un point d'équilibre intérieur E*
= (v*, w*)
r2
r2 + d2
avec w* = v* =
|
?
A = ?
|
-r2v* -d2v* cw*
-cw*
|
?
?
|
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
|
?
A = ?
|
b11 b12 b21 b22
|
?
?
|
Rappelons maintenant pour le modèle à deux
espèces en présence d'autodiffusion, les conditions de Turing
sont
|
?
????????? ?
??????????
|
b11 + b22 < 0
b11b22 - b12b21 > 0
D3b11 + D2b22 > 0
D3b11 + D2b22 > 2[D2D3(b11b22 -
b12b21)]1/2
|
(3.38)
|
Il ressort clairement de la relation 3.38 que, pour
l'instabilité de Turing dans le modèle prédateur-proie
à deux espèces, les diagonales de la matrice jacobienne doivent
être de signe opposé,Dj > 0,j = 2,3. En raison de
l'absence de terme b22(= 0), la relation 3.38 et la relation 3.38 ne
peuvent pas tenir simultanément. Par conséquent, le motif de
Turing n'apparaît pas pour le système 3.37 en présence
d'autodiffusion. De ce fait, seuls les motifs non-Turing existent dans le
système réduit 3.37 en présence d'autodiffusion.
3.5 Résultats de simulation
numérique
point d'équilibre E. Avec la condition limite de flux nul
?u ?v ?w
? ? ?
= = = 0 sur ,t > 0 où
x x x
est la limite du domaine et x la normale extérieure pour .
Sans perte de généralité, on suppose
Nous simulons le modèle 3.3 dans certains domaines
spatiaux bornés Ç R2 en supposant des
conditions aux limites à flux nul, c'est-à-dire l'absence
d'entrée externe. Nous simulons le modèle 3.6 pour tous (u,
v)c [0, L] x [0, L] avec des conditions initiales positives
autour du
Chapitre III: Résultats et discussion
43
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
?Ù ? C2 . Pour résoudre le
système 3.6, nous transformons le modèle continu en un
modèle de dimension finie, c'est-à-dire que nous
discrétisons le modèle à la fois dans le temps et dans
l'espace. Nous avons utilisé la méthode de Runge-Kutta d'ordre
quatre et utilisé des conditions initiales aléatoires autour de
l'état d'équilibre. Nous étudions ledit modèle 3.6
en prenant r2 et c comme paramètre de contrôle. Veuillez noter que
le paramètre non dimensionnel r2 est le rapport du taux de croissance de
l'espèce u à v et que c est le rapport du taux de croissance de
l'espèce w au taux de croissance de l'espèce u. Depuis le taux de
croissance et le taux de mortalité d'une espèce sont des
composants cruciaux pour un système prédateur - proie, donc r2 et
c sont des paramètres biologiques très importants. Nous avons
fixé les autres paramètres locaux comme d1 = 10; d2 = 9; a1 = 12;
a2 = 6 et les paramètres de diffusion sont définis comme D1 =
10-5;D2 = 5 × 10-6; D3 = 1.5 ×
10-3;
3.5.1 Modèle non diffusif de Gatenby et
Gawlinski
En fixant c = 1.5 et en prenant r2 = 1 nous obtenons le point
d'équilibre intérieur (u,v,w) sous la forme ( 0,0330, 0,0604,
0,0604) et nous trouvons u0(0) = -0.0201, u1(0) = -0.0922; u2(0) = 0.0934 et
u1(0)u2(0) - u0(0) = 0.0114 indiquant que, pour le choix de paramètre
ci-dessus, le système 3.6 est instable.
La figure (3.2) présente la variation de la relation de
dispersion et du Coefficient de dispersion en fonction de la fréquence
du système (3.3) on constate que pour toutes les valeurs de k
le critère de Routh-Hurwitz n'est pas respecté. Donc le
système 3.3 est instable.
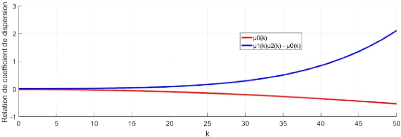
FIGURE 3.2 - Relation des coefficients de dispersion
valeurs des paramètres : r2 = 1; d1 =
10; d2 = 9; c = 1.5; d = 4*10-5;
a1 = 12; a2 = 6; D1 = 10-5; D2 =
5 × 10-6;D3 = 1.5 × 10-3
Chapitre III: Résultats et discussion
44
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
Examinons maintenant le modèle de diffusion du
système (3.3) et traçons les coefficients de dispersion
appropriés en fonction du nombre d'onde k sur la figure 3.2. Nous avons
constaté que le coefficient de dispersion í0(k) <
0 pour certaines valeurs de k =6 0, ce qui indique que
l'instabilité de Turing est possible. Si le jeu des paramètres
satisfait les conditions de l'équation (3.28) pour la fonction
í0(k)
3.5.2 Modèle diffusif de Gatenby et
Gawlinski
Dans cette section, nous présentons les preuves de la
formation de modèles de Turing du système 3.3. Pour simplifier
notre étude, nous supposons que l'instabilité qui ne satisfait
pas les conditions d'instabilité de Turing est appelée
instabilité non-Turing et que les modèles correspondants sont
nommés comme modèles non-Turing. Le modèle non-Turing se
produit via l'instabilité de Hopf.
La figure 3.3 représente variation du coefficient de
dispersion [y0(k)] pour différentes valeurs de r2(taux de croissance des
cellules tumorales) en fonction du nombre d'onde plane. Nous constatons qu'on a
trois zones : Une première zone ou le système est instable.
Une deuxième zone correspondante à une zone de
transition entre système stable et instable pour une valeur proche de k
= 30.
Une troisième zone qui une zone de stabilité du
système.
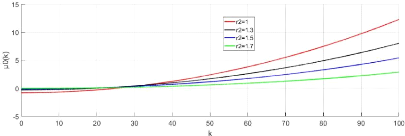
FIGURE 3.3 - Relation des coefficients de dispersion pour
différentes valeurs de r2
valeurs des paramètres :d1 = 10;d2 = 9;c = 1.5;d = 4 x
10-5;a1 = 12;a2 = 6;D1 = 10-5;D2 = 5 x 10-6;D3
= 1.5 x 10-3
Chapitre III: Résultats et discussion
45
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
L'étude de l'influence de c (taux de
croissance de l'acide) sur la stabilité du système sont
représenté par les figures (3.4) et (3.5). Ces figures
représentent la variation des coefficients de dispersion
[v0(k) et v1(k)v1(k) -
v0(k)] en fonction de l'onde plane. Pour la figure (3.4) nous
constatons que, lorsque c est faible le système est instable,
et par conséquent nous distinguons deux zones de
stabilité-instabilité pour des valeurs très grandes de
c. Par contre la figure 3.5 montre que pour les mêmes valeurs de
c le système est stable. Par contre selon les critères
de stabilité de Routh-Hurwitz [v0(k) > 0
et v0(k) v1(k)v1(k) -
v0(k) > 0] pour ces même valeurs de c
(taux de croissance de l'acide) le système est instable car ces
deux conditions ne sont pas toujours vérifiées.
FIGURE 3.4 - Relation des coefficients de dispersion pour
différentes valeurs de c
valeurs des paramètres r2 = 1;d1 =
10;d2 = 9;d = 4 x 10-5;a1 =
12;a2 = 6;D1 = 10-5;D2 = 5 x
10-6;D3 = 1.5 x 10-3
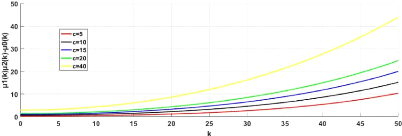
FIGURE 3.5 - Relation des coefficients de dispersion pour
différentes valeurs de c (taux de croissance de l'acide)
valeurs des paramètres :r2 = 1; d1 = 10; d2 =
9; d = 4x10-5; a1 = 12; a2 = 6; D1 =
10-5; D2 = 5 x 10-6;D3 = 1.5 x
10-3
Chapitre III: Résultats et discussion 46
Mémoire de MASTER II TAMKO MBOPDA Boris c2019
Dans le but de mieux apprécier le comportement du
système dynamique de l'equation (3.3) nous utilisons la
méthode de Runge-Kutta d'ordre quatre (RK4) pour la simulation
numérique de notre système de départ. Les figures
(3.6) à (3.11) montrent l'évolution de la densité
de cellules saines (u), densité de cellules tumorales
(v) et la concentration de l'acide lactique extracellulaire
(w) en fonction du temps Pour différentes valeurs du nombre
d'onde plane k et du nombre d'onde perturbée K Pour
les figures (3.6), (3.7) et (3.8), nous étudions le
cas où le nombre d'onde perturbée est supérieur au nombre
d'onde plane(K > k). Pour les figures (3.6) et (3.7)
nous observons un taux d'oscillations apériodiques et
inhomogènes mais par contre pour la figure (3.8) on observe des
oscillations périodiques et homogènes.
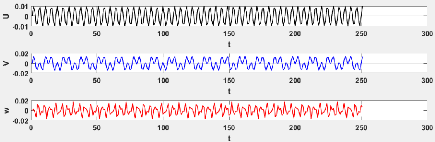
FIGURE 3.6 - Evaluation de la série
chronologique pour le modèle 3.3
valeurs des paramètres :r2 = 1;d1
= 10;d2 = 9;d = 4 x 10_5;a1 = 12;a2 =
6;D1 = 10_5;D2 = 5 x
10_6; D3 = 1.5 x 10_3; K
= 0.37r; k = 0.45
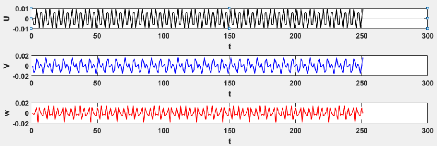
FIGURE 3.7 - Evaluation de la série
chronologique pour le modèle 3.3
valeurs des paramètres :r2 = 1;d1
= 10;d2 = 9;d = 4 x 10_5;a1 = 12;a2 =
6;D1 = 10_5;D2 = 5 x
10_6; D3 = 1.5 x 10_3; K
= 0.37r; k = 0.6
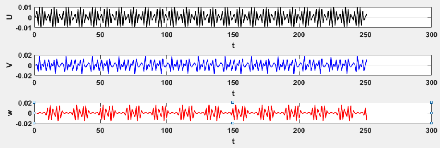
Chapitre III: Résultats et discussion 47
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
FIGURE 3.8 - Evaluation de la série chronologique pour
le modèle 3.3
valeurs des paramètres :r2 = 1;d1 =
10;d2 = 9;d = 4 x 10-5;a1 = 12;a2 =
6;D1 = 10-5;D2 = 5 x 10-6; D3
= 1.5 x 10-3; K = 0.37r; k
= 0.9
Pour les figures (3.9), (3.10) et (3.11) nous étudions
le cas où le nombre d'onde perturbée est inférieur au
nombre d'onde plane (K < k). Pour ces figures, nous constatons que
les oscillations sont apériodiques et inhomogènes mais aussi avec
certaine oscillations périodiques et homogènes mais qui ne nous
permet pas de localiser parfaitement le désordre
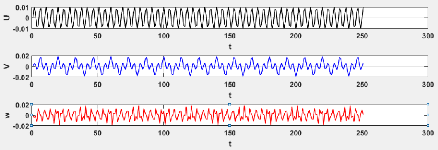
FIGURE 3.9 - Evaluation de la série chronologique pour
le modèle 3.3
valeurs des paramètres :r2 = 1;d1 =
10;d2 = 9;d = 4 x 10-5;a1 = 12;a2 =
6;D1 = 10-5;D2 = 5 x 10-6; D3
= 1.5 x 10-3; K = 0.457r; k
= 0.6
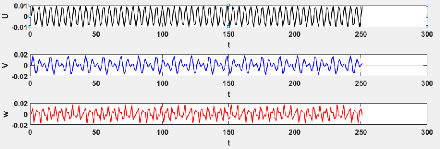
Chapitre III: Résultats et discussion 48
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
FIGURE 3.10 - Evaluation de la série chronologique pour
le modèle 3.3
valeurs des paramètres :r2 = 1;d1 = 10;d2 = 9;d = 4 x
10-5;a1 = 12;a2 = 6;D1 = 10-5;D2 = 5 x 10-6; D3 = 1.5 x
10-3; K = 0.457r; k = 0.75
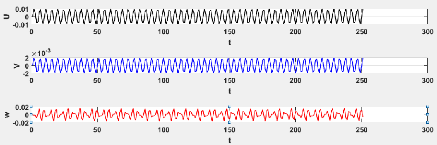
FIGURE 3.11 - Evaluation de la série chronologique pour
le modèle 3.3
valeurs des paramètres :r2 = 1;d1 = 10;d2 = 9;d = 4 x
10-5;a1 = 12;a2 = 6;D1 = 10-5;D2 = 5 x 10-6; D3 = 1.5 x
10-3; K = 0.457r; k = 0.9
Chapitre III: Résultats et discussion
49
La figure (3.12) présente la variation de relation de
dispersion et du Coefficient de dispersion en fonction du nombre d'onde plane
du système 3.3. On remarque que pour toutes les valeurs de k le
critère de Routh-Hurwitz n'est pas respecté. Donc le
système 3.3 est instable.
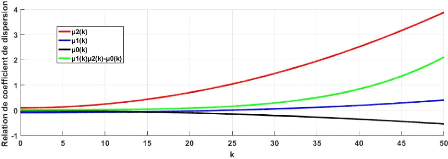
FIGURE 3.12 - Coefficient de dispersion et relation de
dispersion du système 3.3
valeurs des paramètres :r2 = 1;d1 = 10;d2 = 9;d = 4
× 10-5;a1 = 12;a2 = 6;D1 = 10-5;D2 = 5 ×
10-6;D3 = 1.5 × 10-3
Parvenu au terme de ces simulations numériques nous
constatons que les systèmes 3.3 et 3.6 sont instables mais par contre la
figure (3.8) nous permet d'avoir une localisation parfaite du désordre
cellulaire. Elle nous permettra par ce fait de localiser explicitement pour une
cellule donné les zones où nous avons une forte densité de
désordre cellulaire et, où la concentration d'acide lactique la
plus élevé. Ainsi nous pourrons attaquer ces zones par une
thérapie ciblée.
Mémoire de MASTER II TAMKO MBOPDA Boris
c2019
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
Conclusion Générale et perspectives
Dans le présent travail, nous étudions les
modèles générant des instabilités induites par la
diffusion spatiale dans un modèle à trois espèces
impliquant les cellules saines, les cellules cancéreuses et l'acide
lactique. La diffusion spatiale amplifie l'instabilité des points fixes
du modèle et produire divers motifs. La diffusion a induit
différents types de modèles lorsque le système local est
également instable. Les simulations numériques sont
effectuées en utilisant des conditions initiales aléatoires
autour de l'état d'équilibre, ce qui est plus
général qu'une condition spécifique du point de vue
biologique. Nous obtenons une grande variété de modèles
pour le modèle à trois espèces à l'aide de
simulations numériques.
Il est montré que l'instabilité de Turing
n'apparaît pas dans le modèle en raison de l'autodiffu-sion
lorsqu'une espèce est absente. Il est montré que le
système admet la possibilité de modèles variant dans le
temps. Les modèles sont calculés numériquement, en
supposant que les espèces prédatrices ont un taux de diffusion
plus rapide par rapport aux autres espèces.
L'hétérogénéité spatiale est une
caractéristique de nombreux systèmes biologiques et a des effets
profonds sur la persistance des populations. Différents types de
coexistence sont possibles dans le cas de trois espèces en fonction des
paramètres biologiques du système local et des coefficients de
diffusion de l'espèce. Les résultats de ce travail contribuent
à la détermination des zones de forte concentration des cellules
cancéreuses et peuvent être utiles dans la thérapie
ciblée du cancer. Il serait intéressant d'étudier les
effets de la diffusion croisée et de la diffusion aléatoire sur
la formation de motifs de ce modèle à trois espèces
à l'avenir.
Mémoire de MASTER II
TAMKO MBOPDA Boris c2019
Bibliographie
11] American cancer society, Global cancer facts and figures
3rd edition
12] Organisation Mondiale de la Santé. Rapport sur la
santé dans le monde 2007 -Un avenir plus sur :la sécurité
sanitaire mondiale au xxIe siècle. 2007 Genève. OMS. Google
Scholar
13] Sankaranarayanan R, Ferlay J.Worldwide burden of
gynaecological cancer : the size of the problem. Best Pract Res Clin Obstet
Gynaecol 2006; 20(2) : 207-25. PubMed /Google Scholar
14] Enow Orock GE, Ndom P, Doh AS. Current cancer incidence
and trends in Yaoundé, Cameroun. Oncol Gastroenterol Hepotol. 2012; 1(1)
: 58-63. pubMed / Google Scholar
15] Hallmarks of cancer : the next generation, Cell, 144
(2011), pp.646 à 674.
16] G. P Gupta and J Massagué, Cancer metastasis :
building a framework, cell, 127 (2006), pp. 679-695
17] http ://
www.futura-sciences.com
18] D. Hanahan and R.A. Weinberg, The hallmarks of cancer,
cell, 100 (2000), pp. 57-70
19] B. Vogelstein, S. Sur, and C. prives, p53 : The most
frequently altered gene in human cancers,Nature Education, 3(2010), p.6.
110] J. Folkman, Tumor angiogenesis : Therapeutic
implications, New England journal of Medecine,285(1971), pp. 1182-1186.
111] What is the evidence that tumors are angiogenesis
dependent, journal of the National Cancer Institute, 82(1990), pp.4-7
112] https : //
www.lungevity.org
113] Institut Curie, De la tumeur initiale aux
métastases : une multitude d'événements,
114] Olkman and M. Hochberg, Self-regulation of growth in
three dimensions, The journal of experimental medicine, 138(1973), pp.
745-753.
115] Sambo LG, Dangou JM, Adebamoyo C, Gombé Mbalawa C
et al. Cancer in Africa: a preventable
116] public health crisis J Afr Cancer 2012 ;4 :127-36.
117] J. Casciari, S. Sotirchos, and R. Sutherland,
Mathematical modelling of microenvironment and growth in EMT6/Ro multicellular
tumour spheroids, cell proliferation, 25(1992), pp. 1-22.
118]
Bibliographies 52
Mémoire de MASTER II TAMKO MBOPDA Boris c2019
Archibald VHill.«The diffusion of oxygen and lactic acid
through tissues». In : Proceedings of the Royal Society of London. Series
B, Containing Papers of a Biological Character (1928), p. 39 ?96 (cf. p. 8).
119] Robyn P Araujo et DL Sean Mc Elwain. «A history of
the study of solid tumour growth: the contribution of mathematical
modelling». In : Bulletin of Mathematical Biology 66.5 (2004), p. 1039
?1091 (cf. p. 8).
120] Byrne HM (2010) Dissecting cancer through mathematics :
from the cell to the animal model. Nat Rev Cancer 10 :221-230
121] Gillies RJ, Verduzco D, Gatenby RA (2012) Evolutionary
dynamics of cancer and why targeted therapy does not work. Nat Rev Cancer 12
:487-493
122] Gatenby RA, Gawlinski ET (1996) A reaction-diffusion
model of cancer invasion. Cancer Res 56(24) :57455753
123] Alfarouk KO, Muddathir AK, Shayoub MEA (2011) Tumor
acidity as evolutionary spite. Cancers 3(1) :408414
124] La formation des motifs et l'instabilité de
Turing. Cathérine Poissant
125] Meinhardt, H. (2009). The Algorithmic Beauty of Sea
Shells, quatrième édition, Springer.
126] Murray, J.D. (1993). Mathematical Biology,
deuxième édition, Springer.
127] Gakkar, S. Gupta, K : Athree species dynamical system
involving prey-predation, competitio and commensalism
128] Jessica B, McGillen, Eamonn A, Gaffney, Natasha K.Martin
Philip K.Maini A general reaction-diffusion model of acidity in cancer
invasion. J.Math.Biol. (2014) 68 :1199-1224
| 


