|
|
UNIVERSITE DE LIEGE
UNIVERSITE DE NAMUR
|
|
Septembre 2015
Centre de formation et de recherche en Aquaculture
(CEFRA)
Unité de Biologie du Comportement (UBC)
« Conditionnement de carpes communes (Cyprinus
carpio) à la détection
olfactive des composés
aromatiques de décomposition de viande de porc
par
imprégnation des oeufs et des larves »

Travail de Fin d'études présenté
par
Soniel MERCIUS
Pour l'obtention du diplôme de Master
Complémentaire en Aquaculture
Sous la direction de :
Dr. Carole ROUGEOT et Prof. Pascal PONCIN

Remerciements
Tout d'abord, je tiens à remercier Dr
Carole Rougeot de m'avoir guidé au cours de ce travail
de recherche, pour sa patience et son professionnalisme. Ensuite le Professeur
Pacal Poncin d'avoir été l'un de mes promoteurs.
Au professeur Charles Mélard pour ses conseils et ses
supervisions à la longueur des journées.
Je remercie également les équipes du Centre
de formation et de recherche en Aquaculture (CEFRA) et de
l'Unité de Biologie du Comportement (UBC) de
l'Université de liège, pour avoir facilité les
expérimentations pour la réalisation de ce travail.
Merci à Dr Brian Wade Jamandre,
Post doctorant au laboratoire de l'UBC/Ulg pour ses conseils et surtout son
infatigable support dans la réalisation des multiples tests, traitement
et analyses des données.
Merci à Christian Prignon d'avoir
été un encadreur patient et toujours disponible pour moindre
problème et souci.
Je remercie mes camarades de promotion en Master
Complémentaire en Aquaculture 20142015 pour leur
fraternité et leur amitié.
Merci à ma famille en Haïti
spécialement ma maman, à ma copine, à mes amis et
collègues haïtiens de la Belgique et d'Haïti pour leur
support.
Merci à mon fils Ralph Cédric
Mercius d'avoir supporté mon absence pendant ce temps
d'absence.
Enfin merci à tous ceux qui d'une façon ou
d'une autre ont contribué à la réalisation de ce
travail.
Merci !!

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
i

Résumé
Ce présent travail est la continuité d'un
ensemble de travaux déjà réalisés sur la carpe
commune (Cyprinus carpio) en vue de la conditionner comme
biodétecteurs de cadavres humains en milieu aquatique lors des
catastrophes naturelles. Il entre dans la cadre du projet «
Developpement of a methodology for cadaver search using new
biodetectors adapted to aquatic and terrestrial environnements» de l'Ulg
(Université de Liège). Beaucoup d'études
mettent en évidence la capacité d'apprentissage des poissons,
notamment la carpe commune. Des recherches sur le conditionnement auditif et
visuel abondent le répertoire scientifique, et les résultats sont
de plus en plus concluants. Cependant, peu d'études s'intéressent
au conditionnement précoce et encore moins par imprégnation,
c'est-à-dire par pénétration des oeufs ou par bain
précoce des larves fraichement écloses avec des substances
(composés) odorantes. Ainsi, ce travail vise pour sa part à
tester plusieurs techniques de conditionnement précoces afin de
déterminer laquelle est mieux adaptée dans le cadre de ce grand
projet.
Pour des raisons sanitaires, culturelles et éthiques,
la solution de cadavre d'humain a été substituée par une
solution de viande de porc (SVP), Sus scrofa
domesticus, se rapprochant plus ou moins de celle d'un humain mort et
contenant probablement des composés aromatiques de cadavres notamment la
cadaverine, la putrescine et l'histamine. L'espèce carpe commune,
Cyprinus carpio a été utilisée en raison de sa
grande taille, sa longévité moyenne de 20 ans, son poids maximal
de 40 kg, son adaptabilité à des écosystèmes
diverses, d'être omnivore, mais aussi et surtout le fait d'avoir un
système chimiosensoriel (olfactif et gustatif) très
développé. Ainsi, 3 techniques (traitements) de
conditionnement ont été utilisées en plusieurs doses sur
une même ponte de carpe. Les lots 1 et 2 (Incubation à dose 1
et 2) ont été imprégnés de la
fécondation jusqu'à la résorption de la vésicule
vitelline à la (SVP) à respectivement
(0,4ml/l et 0,8 m l/l). Les lots 3 et 4 (Bain 1 et 2) ont
subi aux mêmes doses que les précédents, un conditionnement
classique de type appétitif pendant 35 jours post-éclosion
(JPE) où la (SVP) a été
utilisée comme stimulant conditionnel (SC) et l'aliment comme stimulant
inconditionnel (SI). Le lot 5 (nourrissage) a été nourri
normalement du gemma micro jusqu'à 16ème JPE. A partir
du 17ème JPE, il a été soumis à un
aliment fabriqué à la solution de viande de porc
(SVP) dans une sorte de conditionnement classique
simultané. Le témoin a été nourri au Gemma micro
150 et 300 microns jusqu'à 35 JPE.
Les variables de déplacement
(pénétration) des alevins vers des compartiments
où la SVP et l'eau sont versées et le
temps passé à proximité des compartiments servent à
déterminer l'effet de la technique d'imprégnation sur le
comportement des alevins et en conséquence de conclure sur le possible
conditionnement ou non des différents lots. Aucune différence
significative n'a pu être mise en évidence pour les
différents traitements sauf le lot 1 (incubation 0,4ml/l)
qui passe préférentiellement plus de temps à
proximité du compartiment où la SVP est
versée. La comparaison des différents tests entre eux ne
révèle non plus aucune différence significative. Ainsi,
les résultats obtenus renforcent des hypothèses émises par
Joseph (2014) à savoir
l'imperméabilité de l'oeuf de carpe, le retard du
développement du système olfactif des carpes, l'effet
répulsif de la solution de viande de porc, mais aussi, la possible
toxicité de certains composés dans la solution. Cependant,
numériquement, certaines données laissent entrevoir un
début de conditionnement notamment chez les lots en
bain. Ainsi, il serait envisageable dans une
prochaine étude de prolonger le temps d'expérimentation afin que
la période de réponse acquise aux stimuli d'odeurs alimentaires
coïncide au plus près avec celle de l'expérience,
d'éviter si possible, au moment de la reproduction, tout produit servant
à renforcer la rigidité et l'imperméabilité de
l'oeuf (tanin), de réaliser des analyses des différents
constituants de la SVP afin d'identifier ceux qui
sont répulsifs, toxiques... pour la carpe.
Mots clés : Cyprinus carpio,
conditionnement, Cadaverine, putrescine

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
ii

Table des matières
Remerciements i
Résumé ii
Table des matières iii
Liste des figures v
Liste des tableaux vi
Liste des annexes vii
I.- INTRODUCTION 1
1.1.- Généralités 1
1.1.- Généralités 1
1.2.- Objectifs 2
1.2.1.- Objectif global 2
1.3.- La carpe commune et ses organes de sens 2
1.4.- Système olfactif des poissons 3
1.5.- La décomposition d'un corps en milieu aquatique
5
1.5.1- Les amines Biogènes 5
1.5.1.1- La putrescine 6
1.5.1.2 - L'histamine 6
1.5.1. 3- La cadaverine 6
1.6.- Le conditionnement 6
1.6.1.- Conditionnement olfactif des poissons par
imprégnation 7
II.- MATERIELS ET METHODE 9
2.1.- Matériels 9
2.1.1.- Matériels biologiques 9
2.2.- Méthode 9
2.2.1.- Reproduction et fécondation 9
2.2.1.6. - Incubation 9
2.2.2.- Le conditionnement et élevage larvaire
10
2.2.2.1.- Solution de viande de porc 10
2.2.2.2.- Procédure expérimentale 11
2.2.3.- Méthode d'observation 11
2.2.3.1.- Structure expérimentale 11
2.2.4.- Réalisation des tests 12
2.2.5.- Analyse statistique 12
III.- RESULTATS 13

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
iii
3.1.- Les paramètres physiques au cours de
l'expérience 13
3.2.- Taux de fécondation 13
3.3.- Suivi de croissance 13
3.4.- Déplacement des larves et temps moyens passé
à proximité 13
3.4.1.- Témoins (zéro solution de viande de
porc) 13
3.4.2.- Incubation doses 1 et 2 (0,4ml/l et 0,8ml/l)
14
3.4.4.- Nourrissage à l'aliment SVP 17
IV.- DISCUSSIONS 18
V.- CONCLUSION 23
REFERENCES BIBLIOGRAPHIQUES 24
ANNEXES I


« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
iv
Liste des figures
Figure 1: Système olfactif des poisons (Kermen et
al., 2013) 5
Figure 2: Schéma du conditionnement de type I
(Pavlov) 7
Figure 3 : Les oeufs en incubation 9
Figure 4 : Schéma du dispositif expérimental
10
Figure 5: Schéma du déroulement de
l'expérience par phase et par dose 11
Figure 6 : a) Croquis reprenant la dimension de la
structure expérimentale d'étude de comportement b)
Photo de la structure expérimentale 12
Figure 7: Comparaison de croissance au cours de
l'expérience 13
Figure 8: Comparaison du déplacement moyen vers les
compartiments ou les solutions sont versées (SVP et
eau) pour le lot à zéro solution de viande
de porc (témoin) 14
Figure 9 : Comparaison du temps moyen (secondes,
+ET) vers les compartiments ou les solutions sont
versées (SVP et eau) pour le lot à
zéro solution de viande de porc (témoin). 14
Figure 10:
Comparaison du déplacement (% d'individu) vers les compartiments
où les solutions sont
versées (SVP et eau) pour les lots incubés
à la solution de viande de porc dose 1 et 2 (0.4ml/l et 0,8ml/l)
15
Figure 11: Comparaison du temps moyen (secondes) passé à
proximité des compartiments ou les solutions sont versées (SVP et
eau) pour les lots incubés à la solution de viande de porc dose 1
et 2 (0.4ml/l et 0,8ml/l)
15
Figure 12: Comparaison du déplacement (%
d'individu) vers les compartiments où les solutions sont
versées (SVP et eau) pour les lots en bain
quotidien à la SVP dose 1 et 2 (0.4ml/l et 0,8ml/l) 16
Figure 13:
Comparaison du temps moyen (secondes) passé à proximité
des compartiments ou les solutions
sont versées (SVP et eau) pour les lots en bain
quotidien à la SVP dose 1 et 2 (0.4ml/l et 0,8ml/l) 16
Figure 14:
Comparaison du déplacement moyen vers les compartiments ou les solutions
sont versées (SVP
et eau) pour le lot nourrit à l'aliment SVP
17
Figure 15: Comparaison du temps moyen (secondes, +ET) vers les
compartiments ou les solutions sont
versées (SVP et eau) pour le lot nourrit à
l'aliment SVP 17


« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 V

Liste des tableaux
Tableau 1 : Comparaison des résultats obtenus avec
ceux obtenus par Joseph (2013) 19
Tableau 2: Analyses statistique (Student) du taux de
fécondation pour le lot éclos à la solution de viande
de
porc et sans la solution de viande de porc V
Tableau 3: Les taux de fécondation enregistrés
V
Tableau 4: Test de student pour le taux de fécondation
V
Tableau 5: Sommaire des données sur les croissances
enregistrées au cours de l'étude V
Tableau 6: ANOVA de Fischer pour les croissances
enregistrées V
Tableau 7: Les déplacements enregistrés pour
incubation dose 0,4ml/l V
Tableau 8: Test de Wilcoxon pour échantillons
appariés pour les déplacements pour incubation dose
0,4ml/l
(dose 1) VI
Tableau 9: Les déplacements enregistrés pour
incubation dose 0,8ml/l VI
Tableau 10: Test de Wilcoxon pour échantillons
appariés pour les déplacements pour incubation dose
0,8ml/l
VI
Tableau 11: Les déplacements enregistrés pour
les dose 0,4ml/l VI
Tableau 12: Test de Wilcoxon pour échantillons
appariés pour les déplacements pour Bain dose 0,4ml/l VI
Tableau 13: Les déplacements enregistrés pour
les dose 0,8ml/l VI
Tableau 14: Test de Wilcoxon pour échantillons
appariés pour les déplacements pour Bain dose 0,8ml/l VII
Tableau 15: Les déplacements enregistrés pour
le lot nourrissage à l'aliment SVP VII
Tableau 16: Test de Wilcoxon pour échantillons
appariés pour les déplacements pour les ASVP VII
Tableau 17: Les déplacements enregistrés pour
les Témoins (control) VII
Tableau 18: Test de Wilcoxon pour échantillons
appariés pour les déplacements des témoins VII
Tableau 19: Les temps moyens passés à
proximité des 2 compartiments enregistrés pour incubation
dose
0,4ml/l VII
Tableau 20: Test-t pour échantillons
appariés pour les temps moyens passés à proximité
des 2 compartiments
enregistrés pour incubation à la SVP dose 1
(0,4ml/l) VIII
Tableau 21: Les temps moyens passés à
proximité des compartiments enregistrés pour incubation
dose
0,8ml/l VIII
Tableau 22: Test-t pour échantillons
appariés pour les temps moyens passés à proximité
des 2 compartiments
enregistrés pour incubation à la solution de
SVP dose 2 (0,8ml/l) VIII
Tableau 23: Les temps moyens passés
à proximité des compartiments enregistrés pour bain dose 1
(0,4ml/l)
VIII
Tableau 24: Test-t pour échantillons appariés
pour les temps moyens passés à proximité des 2
compartiments
enregistrés pour bain à la solution de viande
de porc dose 1 (0,4ml/l) VIII
Tableau 25: Les temps moyens passés
à proximité des compartiments enregistrés pour bain dose 2
(0,8ml/l) IX Tableau 26: Test-t pour échantillons appariés pour
les temps moyens passés à proximité des 2
compartiments
enregistrés pour bain à la solution de viande
de porc dose 2 (0,8ml/l) IX
Tableau 27: Les temps moyens passés
à proximité des compartiments enregistrés pour nourrissage
à
l'aliment à la SVP IX
Tableau 28: Test-t pour
échantillons appariés pour les temps moyens passés
à proximité des 2 compartiments
enregistrés pour nourrissage à l'aliment
à la SVP IX
Tableau 29: Les temps moyens passés à
proximité des compartiments enregistrés pour les témoins
IX
Tableau 30: Test-t pour échantillons appariés
pour les temps moyens passés à proximité des 2
compartiments
enregistrés pour les témoins (Control)
X
Tableau 31: Comparaison de tous les traitements pris
ensemble, test de Friedman X

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 VI
Liste des annexes
Annexe 1: Formulation d'aliment a la cadaverine I
Annexe 2: Taux d'oeuf oeillés (Taux de
fécondation) II
Annexe 3: Prise des poids (gramme) hebdomadaire après
la mise en charge II
Annexe 4: Paramètres physique (Oxygène et
température) enregistrés au cours de l'étude III
Annexe 6: Analyses statistiques (ANOVA) pour la croissance
des différents lots V
Annexe 7: Analyses statistiques (Student) pour les
différents déplacements vers les deux compartiments où
les
solutions sont versées V
Annexe 8: Analyses
statistiques (Student) pour les différents temps moyens passés
près des deux
compartiments où les solutions sont versées
VII


« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
VII

I.- INTRODUCTION
1.1.- Généralités 1.1.-
Généralités
Tout organisme vivant est en interaction constante avec son
milieu de vie. Ainsi, il peut se mouvoir, déplacer et réagir en
fonction des stimulations du milieu extérieur et de sa perception
interne. Les systèmes nerveux et endocrinien constituent les deux grands
moyens de communication intercellulaire. Ainsi, des cellules du système
nerveux se différencient en récepteurs sensoriels, capables
d'interpréter les messages renseignant l'organisme sur les variations
des paramètres physico-chimiques de l'environnement. La somme des
impressions provenant des organes sensoriels entraîne une sensation, qui,
interprétée en fonction de l'expérience de l'organisme,
constitue la perception (Stecey et al., 2002). Ainsi, plus que tout
autre groupe de vertébrés, les poissons possèdent un champ
énormément varié et fascinant d'adaptations de leur
système sensoriel afin de survivre à des variations
extrêmes de leur complexe milieu de vie. Ils peuvent être des
proies ou des prédateurs ; l'eau dans laquelle ils vivent peut
être claire ou turbide, chaude ou froide, douce ou salée,
stagnante ou coulante... Bref, le milieu peut être très
diversifié. Ce qui occasionne souvent d'énormes efforts
d'adaptations et de développement des systèmes sensoriels
(Marshall, J. 2006).
Le poisson possède de bonnes capacités
d'apprentissage. Plusieurs études mettent en évidence cette
hypothèse et des résultats intéressants sont perçus
notamment chez le poisson rouge (Carassius auratus) où des
études sur l'apprentissage acoustique ont été
menées (Yan and Popper, 2000). Les systèmes sensoriels
sont notamment les meilleurs moyens de communication du poisson avec son
milieu. Ce sont les systèmes ; auditif, visuel, électro et
mécano-sensoriel, mais aussi et surtout le système
chimiosensoriel (olfactif et gustatif). Ainsi, ces systèmes varient
d'une espèce à autre (Tine Valentinic, 2004). Certains
avancent même que les poissons représentent la superclasse chez
laquelle les problèmes liés à la
chémoréception ont été les plus
étudiés (Saglio, 1979). Ainsi, plusieurs études
ont été réalisées afin de conditionner les animaux
en exploitant leurs systèmes sensoriels. Des études notamment sur
le conditionnement du saumon afin qu'il puisse regagner son cours d'eau de
naissance pour la reproduction ont été concluantes (Yamamoto
et al., 2010). Cependant, jusqu'à aujourd'hui, peu de chercheurs
s'intéressent au conditionnement olfactif et encore moins le
conditionnement par imprégnation. La majeure partie des recherches sur
le conditionnement a été réalisée sur les
systèmes auditif et visuel (Laberge et Hara, 2001). De
là, après s'être longtemps consacrées à
l'étude presque exclusive de la vision, les recherches en psychologie
sensorielle se sont attachées plus particulièrement depuis
quelques années à déterminer le rôle chimiosensoriel
(olfaction et gustation essentiellement) dans les comportements fondamentaux
des animaux (Saglio, 1979).Citons comme exemple, les récentes
recherches de Xhardez, 2013, Sepcha, 2013 et de Joseph,
2014 sur le conditionnement olfactif de la carpe commune pour lesquelles
des résultats prometteurs ont été obtenus et des
perspectives importantes ont été formulées.
C'est dans ce souci de continuité que notre
étude vise à déterminer parmi des techniques
proposées, lesquelles sont les mieux appropriées et
adaptées pour conditionner la carpe commune à la détection
olfactive des composés aromatiques de décomposition de viande de
porc par imprégnation des oeufs et des larves.

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
1

1.2.- Objectifs
1.2.1.- Objectif global
Ce mémoire entre dans le cadre d'un projet de
L'Unité de Biologie de Comportement de l'Université de
Liège (UBC/Ulg) « Developpement of a methodology for cadaver
search using new biodetectors adapted to aquatic and terrestrial environnements
». Il vise à conditionner la carpe commune (Cyprinus
carpio) comme bio-détecteurs de cadavres dans le milieu naturel. Ce
travail est entre autre la continuité d'un ensemble de travaux de
recherches déjà effectué à ce sujet à
l'UBC/Ulg, notamment le travail de Joseph, 2014 qui visait
particulièrement à conditionner des oeufs et des larves par
imprégnation s'appuyant surtout sur l'apprentissage précoce des
carpes. Cependant, les résultats ont montrés peu d'attirance par
rapport à l'odeur de viande de porc décomposée
utilisée à cet effet, ce qui signifiait probablement que les
oeufs n'ont pas été imprégnés et les laves non
conditionnées. C'est pourquoi le protocole et les conditions
expérimentales ont été revus, modifiés et
implémentés par rapport à celui de Joseph, 2014
notamment le nourrissage à partir d'aliment fabriqué
à base de solution de viande porc, afin de poursuivre les recherches
autour d'une technique de conditionnement mixte, autre que celles
utilisées préalablement. Ainsi, l'objectif de cette
présente étude est d'identifier les techniques les mieux
appropriées et adaptées à la méthode de
conditionnement de la carpe commune par imprégnation des oeufs et des
larves. Le protocole a été validé par le comité
d'éthique de l'Ulg et le numéro de dossier 1684 lui a
été attribué.
1.3.- La carpe commune et ses organes de sens
Systématiquement, l'ordre des cypriniformes à
l'intérieur duquel on trouve famille des cyprinidés fait partie
du grand groupe des ostariophyses. Le groupe des ostariophyses est
caractérisé par la présence de l'appareil de Weber
de fonction jusqu'à aujourd'hui mal connue. Cependant, plusieurs
hypothèses abondent dans le sens qu'il serait intervenu dans la
transmission des variations de la vessie natatoire et d'un rôle
acoustique notamment les perceptions de sons, ce qui explique probablement la
grande capacité auditive des cyprinidés Ostariophyses
(Billard, 1995). Dans cette grande classe on retrouve le genre
Cyprinus et l'espèce Cyprinus carpio, celle qui nous
intéresse dans le cadre de cette présente étude.
La carpe commune colonise les eaux tièdes ou chaudes,
stagnantes ou lentes. Cependant, elle affectionne particulièrement les
eaux chaudes (27 à 32 °C). Son préferendum est de
30.8 °C (Escoudero Garcia et al., 1997). Sa très grande
tolérance et plasticité vis-à-vis aux variations
environnementales expliquent son grand succès de colonisation des
milieux les plus divers et de grandes extensions géographiques. Elle est
grégaire et benthique, sédentaire et plutôt nocturne. Elle
est photophobe et préfère les habitats avec de faibles
intensités lumineuses (Everard, 2007). La carpe commune est
omnivore ou polyphage à forte tendance carnivore (Michael et
Oberdorff, 1995).
Elle atteint la maturité sexuelle à 2 ans pour
les mâles et 3 ans pour les femelles (Brusle, J., & Quinard,
J.P., 2004; Schultz, 2004). Elle a une maturité sexuelle
asynchrone ce qui lui confère la capacité d'être
féconde plusieurs fois dans sa vie à des périodes
différées (Balon, 1995). Elle pond
généralement des oeufs de 1,2 à 1,8 mm diamètre
(Brusle & Quinard, 2004 ; Nikolsky, 1963).
Les poissons, de par leur physiologie et leur relation avec
les facteurs environnementaux présentent de grandes capacités
sensorielles. Ils ont un système auditif (acoustique) bien
développé ce qui facilite souvent la communication avec ses
congénères. Beaucoup d'études scientifiques ont d'ailleurs
prouvé leur bonne capacité d'émettre des sons et dans une
moindre mesure, de les percevoir (Parmentier et al., 2013 ;
Parmentier, et al., 2011). Ainsi, la carpe commune développe de
bonnes capacités d'apprentissage via ses systèmes sensorielles,
particulièrement son système chimiosensoriels incluant notamment
le système olfactif (Braubach, 2009).

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 2

Le choix de la carpe commune (Cyprinus carpio) dans
le cadre de notre étude est justifié par le fait d'être de
grande taille, d'une longévité moyenne de 20 ans, d'un poids
maximal de 40 kg, d'être adapté à des
écosystèmes diverses (températures vairées, eau
turbide, pH, oxygène ...) (Brusle, J., & Quinard, J.P.,
2004), d'être omnivores (polyphage) à forte tendance
carnivore (Michael et Oberdorff, 1995). Mais aussi et surtout, la
carpe commune (Cyprinus carpio) possède un système
olfactif très développé coordonnant divers comportements
notamment, la reproduction, l'alimentation, la chasse des proies mais aussi
l'évitement des prédateurs. Via ses systèmes sensoriels,
elle présente de fortes capacités d'apprentissage par
conditionnent (Hamdani et Doving, 2006). Il a été
démontré que le poisson rouge, de la même famille que la
carpe, peut être conditionné pour éviter des particules
alimentaires aromatisées associées à des injections de
chlorure de lithium (Manteifel et Karelina, 1996). D'autres
études ont démontré que le poisson Zèbre de la
famille des Cyprinidés était conditionnable olfactivement
(Braubach, et al., 2012). Kojima et al,. 2005 ont conditionné
la carpe commune à la détection des sons de différentes
amplitudes. L'étude de Sokolov et al., (2001), montre que la
carpe peut associer un stimulus visuel avec une récompense alimentaire,
ainsi, elle a la capacité de se souvenir des événements
passés. Xhardez, 2013 a conditionné des carpes communes
à différencier des mixtures d'acides aminées avec des
acides aminées isolées.
1.4.- Système olfactif des poissons
Les organismes aquatiques évoluent dans un milieu
où les informations visuelles sont souvent limitées, alors que
les informations chimiques abondent. Cela est d'autant vrai pour la carpe
commune qui vit préférentiellement dans le fond. Les poissons
vivent alors dans un brouillon chimique complexe (Stecey et al.,
2002). Ainsi, ils développent plein d'aptitude pour survivre
grâce aux sens et au système chimiosensoriel (Stecey et al.,
2002 ; Charles & Sorensen 2008). L'olfaction est le sens reliant les
neurones aux axones dans le nerf olfactif (nerfs crâniens primaires)
(Charles & Sorensen, 2008). Elle est entre autre une fonction par
laquelle l'odorat reçoit l'impression des odeurs (Muller,
1845). Le système olfactif joue un rôle important pour la
plupart des animaux parce qu'il leur permet de communiquer efficacement et
d'interpréter les informations fournies par l'environnement
(Séverine, 2001). Comme chez les organismes terrestres,
l'olfaction et la gustation chez les animaux aquatiques sont habituellement
identifiées comme les systèmes chimiosensoriels. Leurs
rôles sont souvent confondus vu que leurs fonctions sont semblables.
Cependant, il existe bien des différences de structure et de fonction
entre elles (Stecey et al., 2002 ; Charles & Sorensen, 2008).

L'existence d'un sens olfactif chez les animaux aquatiques n'a
été reconnue que tardivement (Rider et Bauchaut, 1984).
Duméril, 1807 pensait que l'olfaction était liée
à des substances gazeuses. Weber cité par Rider et
Bauchaut, 1984 quant à lui considérait que seul le
goût a un sens chimique général chez les animaux
aquatiques. Ce n'est qu'au début du 20ème
siècle que l'existence d'un vrai sens olfactif a été
reconnu et accepté chez le poisson (Herrick, 1908 ; Parker, 1910).
Cependant, la controverse ne cessa qu'en 1929 quand Schering, 1929
cité par Rider et Bauchaut, (1984) mettait en
évidence le rôle de l'olfaction dans le retour des saumons aux
frayères. Ainsi, d'autres études ont mis en
évidence l'existence de la sensibilité chimique (olfaction et
goût) chez la plupart des poissons (Rider et Bauchaut, 1984).
Situé au-dessus de la bouche, les sacs nasaux de l'odorat jouent
plusieurs rôles important dans divers types de comportement, notamment
dans la recherche des aliments, les phénomènes de homing
chez les migrateurs, la reproduction, la défense contre les
prédateurs etc. (François et Saint-André,
2015).

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 3

Comme chez les vertébrés, le système
olfactif des poissons contient 3 composantes neuroanatomiques principales
(Stecey et al., 2002).

L'Epithélium olfactif
appelé aussi système olfactif
périphérique est entre autre constitué des ouvertures
(cavités nasales) de la face dorsale de la tête du poisson en
avant des yeux (Laberge et Hara, 2001). Il comprend 3 principales
classes de cellules neuronales réceptrices (Fig.1) (Hamdani and
Døving, 2006, Stecey et al., 2002): les neurones ciliés qui
possèdent de longues dendrites ; les neurones microvillositaires avec de
courtes dendrites et les neurones de la crypte qui sont sphériques et ne
possédant ni cils ni microvillosités (Hansen et al., 2003,,
Hansen and Finger, 2000, Zeiske et al, 2003 , Ichikawa et Ueda, 1977,
Thommesen, 1983 , Kermen et al., 2013). Autres que les neurones
sensoriels, il existe aussi dans l'épithélium olfactif d'autres
types de neurones non-sensoriels (Bazaes et al., 201 , Kermen et al.,
2013).
Le Bulbe olfactif est la structure du cerveau
des vertébrés qui reçoit la grande majorité des
neurones sensoriels olfactifs à travers les nerfs olfactifs. Ainsi,
comprendre les mécanismes neurophysiologiques qui régissent le
traitement des odeurs perçues dans le bulbe olfactif nécessite
une compréhension profonde de ses propriétés
physiologiques (Kermen et al., 2013).
Il est structurellement organisé en 4 couches
concentriques de cellules et comprend plus de 20.000 neurones (Friedrich et
al., 2009). De superficielle à profonde nous trouvons:
? une couche de fibres olfactives primaires formée par
les axones des neurones sensoriels olfactifs; (Sato et al., 2007)
? une couche glomérulaire contenant environ 140 modules
sphériques de glomérules (Braubach et al, 2012);
? la couche externe de cellules, constituée de cellules
mitrales riches en soma cellulaire (Fuller and Byrd, 2005, Fuller et al,
2006);
? la couche interne de cellules, contenant les corps
cellulaires de différents inter neurones, (Edwards et Michel, 2002,
Bundschuh et al, 2012). Les principales cellules du bulbe olfactif des
poissons sont mitrales glutamatergiques (Edwards et Michel, 2002).
Des expériences montrent que chez les poissons, les
acides aminés activent la partie ventrale du bulbe olfactif et les sels
biliaires la partie médiane (Hamdani & Doving, 2007).
D'autres expériences l'ont confirmé par des enregistrements
d'électrodes de surface chez les salmonidés (Thommesen, 1978
, Doving et al, 1980). Donc, il y a une structuration spatiale des
récepteurs olfactifs neuronaux en fonction de l'odeur perçue. Ce
qui traduira sans doute les différents types de comportement liés
à chaque type d'odeur dans le bulbe olfactif. Donc, contrairement
à ce qui se trouve dans l'épithélium olfactif, dans le
bulbe olfactif chaque classe de substances odorantes est
représentée par une zone glomérulaire distincte
(Kermen et al., 2013 , Hamdani & Doving, 2007).
Le pédoncule olfactif est
formé par la projection des neurones du second degré du bulbe
olfactif. Il se divise en 2 types en fonction de leur position anatomique : le
pédoncule olfactif médian (POM) et le pédoncule
olfactif latéral (POL) (Laberge et Hara, 2001 , Hamdani &
Doving, 2007). Le pédoncule olfactif médian (POM)
est divisé en 2 faisceaux distincts ; un faisceau latéral ou
dorso-latéral (DL) et un faisceau médial ou medio
ventral (MV) qui induisent respectivement, les réactions
comportementales de reproduction et des réactions d'alarmes. Le
pédoncule olfactif latéral (POL) quant à lui
induit des réactions comportementales liées à la nutrition
(Laberge et Hara, 2001 , Daghfous et al., 2012).

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
4


OE: épithélium olfactif ;
OB: bulbe olfactif ; TE:
télencéphale ; Dp: partie
postérieure dorsal du télencéphale ; Vv:
Noyau ventral du télencéphale ; HT:
hypothalamus
Figure 1: Système olfactif des poisons
(Kermen et al., 2013) 1.5.- La
décomposition d'un corps en milieu aquatique
En milieu aquatique, un corps se décompose
différemment qu'en milieu terrestre. Ainsi, la décomposition se
différent en temps et en étapes de décomposition en
fonction du milieu. Plusieurs facteurs conditionnent le temps et les type de
décomposition qu'un corps subit en milieu aquatique. Citons entre autre
: la température du milieu, la présence des microorganismes et
leur diversité spécifique, le teneur en sel de l'eau
(salée ou douce), la position du corps dans le milieu (en surface ou au
fond), l'état initial du corps (malade, blessé...). Ainsi,
distingue-t-on 5 grandes phases dans la décomposition d'un corps en
milieu aquatique qui sont : la phase de cadavre frais ; la phase de
putréfaction, la phase de fermentation ; la phase de desséchement
et la phase de squelette (Anderson & Hobischak, 2004 ; Ayers,
2010). Ainsi, dans un corps en décomposition notamment en phase de
putréfaction et fermentation, les différentes réactions
chimiques de décomposition (protéines du corps), sous l'effet des
microorganismes du milieu quand les conditions sont favorables
(température, salinité,...), libèrent des composés
chimiques servant souvent de moyens pour découvrir et vérifier
l'état de décomposition (phase) d'un corps. Parmi les produits,
nous trouvons des composés volatiles notamment des composés
phénoliques, aromatiques et surtout des polyamines biogènes.
1.5.1- Les amines Biogènes
Les amines biogènes constituent une classe de
composés organiques azotés de faible poids moléculaire
(Lewis, 2007 ; Zhang et al., 2014). Elles sont aussi issues de la
dégradation de tissus morts et sont responsables des odeurs
répulsives que dégagent les cadavres en phase
décomposition (Wechsle et al., 2009 ; AFSSA, 2006). En fonction
de leur structure chimique, elles sont divisées en : amines aromatiques
[(tyramine (TYM), 2-phényléthylamine (2-PHE)], amines
aliphatiques [putrescine (PUT)], cadaverine (CAD), spermine (SPM),
spermidine (SPD)] et amines hétérocycliques [histamine
(HIM), tryptamine (TRM)]. Elles sont formées principalement par
décarboxylation enzymatique d'acides aminés sous l'action des
bactéries d'altération décarboxylases (Zhang et al.,
2014). Ainsi, un corps en décomposition en présence des
bactéries d'altération libère des amines biogènes.
Cependant, la plus importante proportion de polyamines libérée
est constituée de putrescine et de cadaverine ayant des odeurs
particulières servant de moyens notamment pour les animaux pisteurs de
découvrir les cadavres avant la phase de squelette ce qui facilite les
suivis judiciaires légaux (Stadler, 2013).

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
5

1.5.1.1- La putrescine
La putrescine est une diamine toxique formée par la
putréfaction de la décarboxylation de l'arginine et de
l'ornithine. Elle est synthétisée biologiquement par deux voies
différentes, à la fois à partir de l'arginine et ornithine
sous l'effet de l'ornithine décarboxylase (Wechsle D. et al.,
2009).
1.5.1.2 - L'histamine
L'histamine a été découverte en 1910 par
Akerman. Elle résulte de la décarboxylation de la L-histidine
essentiellement par décarboxylases microbiennes. Sa présence en
forte proportion est toxique pour les organismes qui s'y exposent et provoque
notamment des phénomènes d'hémoconcentration. Sa
toxicité est d'autant plus élevée en présence de la
cadaverine et de la putrescine (Lewis, 2007 ; AFSSA, 2006).
1.5.1. 3- La cadaverine
La cadaverine appelé aussi pentane-1,5-diamine est une
ptomaïne formée par la désintégration de
protéines animales après la mort. Elle est également
produite en petites quantités par les êtres vivants et est
partiellement responsable de l'odeur caractéristique de l'urine et du
sperme. Elle est formée par la décarboxylation bactérienne
de la lysine (Lewis, 2007 ; Zhang et al., 2014). Elle est soluble dans
l'eau, l'éthanol et légèrement soluble dans l'éther
éthylique. Elle est toxique et irritant pour la peau (Lewis, 2007 ;
ChemEurope, 2011).
1.6.- Le conditionnement
L'apprentissage, est le processus par lequel un organisme
acquiert des connaissances nouvelles en modifiant son comportement sous l'effet
des interactions avec les facteurs de son milieu pour mieux résister
à ses multiples variations (biotique et abiotique) (Kieffer et
Colgan, 1992 ; Dill, 1993). Elle permet à tout animal de s'adapter
aux changements multiples et imprévisibles de leur environnement en
constante évolution (Kieffer et Colgan, 1992). Plusieurs
méthodes d'apprentissage existent. Chez les animaux notamment, il est
réalisé de différentes façons : essaies/erreurs,
imitations, conditionnement.... La plus utilisée reste le
conditionnement (Kirsch et al., 2004). Ainsi, existe-il deux grands
types de conditionnement. D'abord celui étudié par Pavlov
appelé conditionnement de type I ou répondant, permettant
à un animal de prédire l'arrivée d'un danger ou la
présence d'une récompense grâce à l'association d'un
stimulus conditionnel avec un stimulus inconditionnel. Ensuite, le
conditionnement de Skinner du nom d'opérant ou de type II, expliquant
l'aptitude de certains animaux à prédire le résultat de
leurs actions (Salotti et al, 2009, Kirsch et al., 2004, John D. Cone et
Steven c. Hayes, 1980). Ainsi, les animaux adoptent des comportements
particulièrement adaptés à leur environnement grâce
aux conditionnements classiques et opérants (Pavlov, I.P. (1927) ;
Skinner, B.F. (1953) cités par Salotti et al, 2009).
Conditionnement de Type I
(Répondant): C'est Ivan Petrovitch
Pavlov, un célèbre physiologiste Russe qui parla
pour la première fois du conditionnement répondant. En effet,
dans les années 1920, Pavlov s'intéressa à la digestion et
est confronté à un difficile problème pratique qui est de
faire saliver les chiens de laboratoire en dehors de la prise de nourriture. Il
remarque qu'au cours des préparatifs d'avant expériences, rien
qu'en voyant le matériel de l'expérimentateur, les chiens
commence déjà à saliver. Ainsi, il précéda
systématiquement la présentation de la nourriture par un son, ce
qui lui permet de procéder au recueil de la salive avant la consommation
de nourriture par le chien. Ainsi, est né le premier protocole
expérimental sur le conditionnement (Marc, 1977). La
méthode de conditionnement de Pavlov ou conditionnement répondant
consiste entre autre à associer d'abord un stimulus neutre (SN) et un
stimulus inconditionnel (SI) et d'avoir une réponse

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
6
inconditionnelle. Ainsi, plusieurs stimulus inconditionnels
sont utilisés (Aliment, décharge électrique, signes,
images, son ...) ce qui donne lieu à plusieurs types de conditionnement
dit répondant. On en distingue donc, le conditionnement appétitif
quand le stimulus conditionnel est associé à un stimulus
inconditionnel de type appétitif (la nourriture) et le conditionnement
aversif lorsque le stimulus conditionnel est associé à stimulus
inconditionnel de type aversif (Blazer et Vira, 2014). Pavlov constate
que la réponse conditionnée (RC) s'amenuise puis
disparaît si, de temps en temps on n'apporte pas le stimulus
inconditionnel. D'où la nécessité de maintenir la liaison
Stimulus conditionnel (SC) et stimulus inconditionnel (SI) pour obtenir un
conditionnement durable. (Cone et Hayes, 1980; Marc, 1977 ; Hergenhahn,
1976) (Fig. 2).

SN
SC
SI
SI
RC et
RI
RI
SI : Stimulus inconditionnel SC :
Stimulus conditionnel SN : Stimulus
neutre
RI: Réponse inconditionnelle RC
: Réponse conditionnel

Figure 2: Schéma du conditionnement de type I
(Pavlov)
Le conditionnement opérant ou de type II :
Le deuxième type de conditionnement a été
développé par BF Skinner (1904-1988). Skinner utilise le terme
opérant pour s'opposer au qualificatif répondant du
conditionnement de type I de Pavlov. Il est donc répondant en ce sens
qu'un stimulus donne une réponse. L'animal subit la réponse. Le
conditionnement opérant est un système où la
réponse faire venir le stimulus qui porte le nom dans ce cas de
renforçateur (Marc, 1977). C'est en d'autre terme, la situation
environnementale de l'animal (poisson dans un aquarium avec une porte) qui fait
que l'animal cherche une solution (il appui sur la porte pour l'ouvrir et en
conséquence, il est renforcé (Aliment :
Appétitif). Cependant, tout comme dans le cas du
conditionnement classique, le renforcement pourrait être aversif
(Blazer et Vira, 2014).
Ces deux sortes de conditionnements accroissent les chances de
survie d'un animal et notamment le poisson. Car, le conditionnement classique,
en crée un système de signes et de symboles permettant
l'anticipation d'événements significatifs, et le conditionnement
opérant développe de patrons de comportements appropriés
en réponse à ces événements significatifs. Les deux
types de conditionnement dépendent également du renforcement
(Hergenhahn, 1976).
1.6.1.- Conditionnement olfactif des poissons par
imprégnation
Contrairement au système acoustique des poissons, les
études sur le conditionnement olfactif de la carpe commune n'abondent
pas. Encore moins quand il s'agit de conditionnement par imprégnation.
Atéma et al., 1981 ont publié les résultats d'une
étude menée sur le conditionnement des poissons à travers
le pairage répété d'odeur d'acides aminés avec des
récompenses alimentaires et le résultat était prometteur.
Car, selon son étude, Ameiurus spp est conditionnable
olfactivement car il arrive à faire la discrimination entre les acide
aminé simple et complexes d'acides aminés. Plus récemment,
Karplus, et al., 2007 arrivaient à conditionner des carpes
visuellement et acoustiquement. Par cette expérience, les poissons
arrivaient à reconnaitre un son de 400 Hz et se diriger vers l'aliment
(récompense). Plus près de nous, les études de
Xhardez, 2013 et de Joseph, 2014 ont mis en évidence
la possibilité de conditionnement olfactif de la carpe commune
(Cyprinus carpio) et ont essayé plusieurs techniques de
conditionnement. Chez Xhardez, 2013, les poissons ont effectué
des

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
7
déplacements préférentiels vers des
mixtures d'Acides aminés après conditionnement. Par contre, les
premiers essais d'imprégnation précoces à la solution de
viandes de porc des oeufs et des larves de Joseph, 2014 n'ont pas
encore montrés des résultats concluants. On supposerait le fait
que les poissons de Xhardez, (2013) aient été
conditionnés en phase juvénile pourrait influencer qu'ils soient
mieux conditionnés car normalement le système nerveux devrait
être mieux développé.


« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 8

II.- MATERIELS ET METHODE
2.1.- Matériels
2.1.1.- Matériels biologiques
Comme matériels biologiques, nous avons utilisé
pour la reproduction, 2 femelles de Carpe commune (Cyprinus carpio)
souche CEFRA de respectivement 5 et 4 kg et 1 mâle de poids corporel
de 2,4 kg. Après la reproduction, des laves sont utilisées pour
conditionnement à la solution de viande de porc (SVP)
et étude comportementale de déplacement vers la
solution.
2.2.- Méthode
2.2.1.- Reproduction et
fécondation
Trois géniteurs (2 femelles et 1 male) sont
sélectionnés parmi le stock de la souche CEFRA puis placés
dans des bacs en plastiques et anesthésiés dans une solution de
Benzocaïne (0,4 ml/l). Ils sont sélectionnés en fonction des
signes de maturités: ventre mou et bien arrondi, papille génitale
rouge et protubérante, légère palpation et pression
abdominale laissant passer quelques ovocytes (femelle) et laitance (male). Ils
ont ensuite été stockés dans des bassins (Bacs plastiques
de 1000 l) séparés par sexe. La ponte et la spermiation ont
été induites par une hormone de synthèse, l'OVAPRIM. Elle
a été utilisée dans le but de synchroniser la ponte des
femelles et la maturité gondale du mal. L'injection est intra
péritonéale. L'induction s'est réalisée en deux
injections chez les femelles (préliminaire et définitive)
à respectivement 0,05 ml/kg et 0,5 ml/kg réalisée a
intervalle de 12 heures à 26 °C. La spermiation a été
provoquée par une seule injection d'hormone soit 0,25 ml/kg au
même moment que la dose définitive de la femelle. Ils ont ensuite
été stockés dans leur bassin respectif. La reproduction
est réalisée par fécondation à sec.
2.2.1.6. - Incubation
Les oeufs sont incubés à 22,5 oC dans
des bouteilles de Zoug de capacité 1,5 litres reliées par des
pompes pour assurer leur flottaison et des paniers dans des aquariums pour
récupérer les larves une fois éclos. Ainsi,
l'éclosion a eu lieu suivant plusieurs méthodes. La bouteille de
Zoug 1 (de gauche à droite dans fig. 3) comprend le lot 1
(incubatin1) où l'éclosion est
réalisée à la solution de viande de porc dose 1 (0,4
ml/l), soit 20 ml/50 litres 2 fois par jour. La deuxième comprend le lot
2 ((incubation2) l'éclosion est
réalisée à la SVP dose 2 (0,8
ml/l), soit 40 ml/50 litres 2 fois par jour. Les deux (2) autres ont
été écloses normalement sans la solution de viande de
porc (Fig. 1).

Figure 3 : Les oeufs en incubation

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 9

Pendant la période d'incubation, des mesures de
température et du taux d'oxygène de l'eau ont été
prélevées. Les oeufs non oeillés ont été
enlevés afin d'éviter toute attaque de champignons. A deux jours
post fécondation (PF), le taux de fécondation a été
déterminé dans chaque bouteille. A six jours
post-fécondation, toutes les larves ont été
récoltées dans les paniers, puis transférées dans 6
aquariums de capacité 50 litres en circuit ouvert à raison de 500
par aquarium (fig. 4).

Lot 1
(Incubation
)
Lot 2
(Incubation 2)
Lot 3
(Bain1)
Lot 4 (Bain2)
Lot 5
(Nourrissage
)
Lot 6
(Témoin)
Figure 4 : Schéma du dispositif
expérimental
Légende :
· Incubation dose 1 : incubation à
la solution de viande de porc à 0.4ml/l (Zéro SVP
en élevage larvaire)
· Incubation dose 1 : incubation à
la solution de viande de porc à 0.8ml/l (Zéro SVP
en élevage larvaire)
· Bain dose 1 : Bain à la solution
de viande de porc à 0.4ml/l (Zéro SVP en
incubation)
· Bain dose 1 : Bain à la solution
de viande de porc à 0.8ml/l (Zéro SVP en
incubation)
· Nourrissage : nourrissage à
aliment à la solution de viande de porc (Zéro
SVP en incubation)
· T : Témoin (Zéro
SVP)
2.2.2.- Le conditionnement et élevage larvaire
Le conditionnement des carpes a été
réalisé à une solution de viande de porc (Sus scrofa
domesticus) contenant probablement des polyamines biogènes
notamment la putrescine, l'histamine et la cadaverine. Il a été
réalisé suivant plusieurs méthodes. Les lots 1 et 2
(Incubation 1 et 2) ont été
imprégnés de la fécondation jusqu'à la
résorption de la vésicule vitelline à la solution de
viande de porc (SVP) à doses respectives de
0.4ml/l et 0.8 m l/l. Les lots 3 et 4 (Bain 1 et 2)
ont subi un conditionnement classique aux mêmes doses que
les précédents de type appétitif pendant 35 jours
post-éclosion (JPE) où la solution de viande de porc a
été utilisée comme stimulant conditionnel (SC) et
l'aliment comme stimulant inconditionnel (SI). Jusqu'au 16ème
JPE (Jour Post Eclosion), le lot 5 (nourrissage)
a été nourrit normalement du gemma micro 150
à 300 microns. A partir du 17ème JPE, il a
été soumis à un aliment fabriqué à la
solution de viande de porc (SVP) dans une sorte de
conditionnement classique simultané. Le témoin a
été nourrit au Gemma micro 150, 300 et 500 micron jusqu'au
35ème JPE.
2.2.2.1.- Solution de viande de porc
Pour la réalisation de notre expérience de
conditionnement, bien que l'objectif soit de conditionner les poissons à
la détection de cadavres d'humains en cas de catastrophes en milieu
naturel, nous avons de préférence utilisé une solution de
viande de porc (SVP) afin d'obtenir une solution rapprochant celle des
cadavres humains. Cette solution a été préparée
à l'unité de Biologie du Comportement de l'Université de
Liège (UBC/Ulg) en mélangeant 2 kg de viande porc (Jambes de
porc) dans 30 litres d'eau laissés en milieu ambiant pour
décomposer pendant 7 jours à 22-25 degrés Celsius. Une
solution similaire a été préparée dans le cadre du
Travail de Ferrari, 2014 et a été soumise à des
analyses au laboratoire de CHU. La présence de plusieurs composés
volatiles et toxiques ont été identifiés notamment le
phénol, le méthyl phénol, diméthyl di et
tri-sulfide (Composé volatils produisant des odeurs de viande
pourrie).

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 10

2.2.2.2.- Procédure expérimentale
Le conditionnement par imprégnation des oeufs a
été réalisé pendant 5 jours (Période de
développement embryonnaire) et par bain et aliment
imprégné de type classique pour les alevins. Ce dernier
coïncidait avec l'élevage larvaire et l'alevinage en partie car il
a été mené pendant les 35 JPE. D'abord les lots 1 et 2
(incubation 1 et 2) imprégnés à
la solution de viande de porc (SVP) à
respectivement 0,4 ml/l, soit 20 ml/ 50 litres et 0,8 ml/l, soit 40 ml/50
litres en deux bains quotidiens des oeufs à partir de la
fécondation jusqu'à la mise en charge. Apres la mise en charge,
les lots 3 et 4 (Bain 1 et 2) contenant 500 individus
chacun ont été soumis à des bains quotidiens à la
solution de viande de porc (SVP) chaque heure pendant
8 heures à respectivement 0.2 ml/l et 0,4 ml/l. Les 1/2 doses ont
été décidées en considérant le
renouvellement total de chaque aquarium qui a été de 0,5/heure
pour un débit de 0.41 l/s. Le lot 5 (Nourrissage)
a été soumis avec un aliment préparé
à la solution de viande de porc (SVP) (45
% de protéines : voir annexe 1) à
partir du 17èmeJPE jusqu'à la fin de l'élevage
(35ème JPE). Un dernier lot éclos sans la solution de
viande de porc (SVP) et nourri au gemma micro
(150 à 300 microns) est utilisé comme témoin
(T). Tous les lots ont été nourri
pendant la durée de l'expérience au gemma micro (150 à 300
microns, 59 % de protéines), sauf le lot 5 à partir du
17ème JPE (Fig. 5). Les aquariums sont
nettoyés et les morts sont enlevés 2 fois par jour. La
température moyenne de 21,5 °C et le taux d'oxygène dissous
moyen de 7,5 ppm (Voir annexe 3) ont été
enregistrés au cours de l'expérience. Une mesure
hebdomadaire de poids à partir du 15ème jour de mise
en charge jusqu'au 35ème jour a été
prélevée. Elle a été réalisée en
prélevant d'abord 50 individus par lot puis les séchés et
les pesés pour avoir le poids du lot et enfin, le poids individuel en a
été déduit.
|
Prise de poids
|
Jour 1
|
Jour 5 J 15
|
J 17 J 22
|
J 29
|
J 35
|
|
Pesée 1
|
Pesée 2
|
Pesée 3
|
Pesée 4
|
|
Lots/phases
|
Fécondation
|
Eclosion
|
Conduite de l'élevage
|
|
Fin
|
|
ESVP1 ESVP2 BSVP1 BSVP2 ASVP
Témoin
|
Début ESVP 1(0.4 ml/l)
Début ESVP
2(0.8ml/l)
|
|
|
|
|
|
|
Début BSVP (0.4 ml/l) Début BSVP
(0.8ml/l)
|
|
|
|
|
Début d'ASVP
|
|
|
|
Début d'alimentation
|
|
|
|
Figure 5: Schéma du déroulement de
l'expérience par phase et par dose 2.2.3.- Méthode
d'observation
Apres 35 JPE, 60 individus dans chaque traitement sont
transférés à UBC /Ulg (l'Unité de Biologie du
Comportement de l'Université de Liège) pour l'étude de
leur comportement (l'évaluation de leur préférence
olfactive par déplacement ou non vers la solution de viande de porc et
le temps passé à proximité).
2.2.3.1.- Structure expérimentale
La structure expérimentale (Fig. 6) est
composée de 2 aquariums de 200 L (80x50x50cm), rempli uniquement
à 80 litres d'eau d'écloserie. Chacun de ces 2 aquariums
présentent un compartiment central (50x50 cm) et 2
compartiments latéraux (50x15 cm) fermés par des portes.
Ces compartiments latéraux sont formés par des cloisons qui
peuvent être enlevées (Fig. 6 a). Un tube par lequel des
substances arriveront est attaché dans les compartiments
latéraux (Fig. 6 b). Des dispositions sont prises pour
éviter que les poissons ne voient l'expérimentateur (Fig. 6
b). Au-dessus de chaque aquarium est placée une caméra qui
filme et enregistre la séance expérimentale et envoie les
données sur un ordinateur. Ces données sont traitées et
exploitées manuellement.

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 11


Figure 6 : a) Croquis reprenant la dimension de la
structure expérimentale d'étude de
comportement b) Photo de la structure
expérimentale 6 b
2.2.4.- Réalisation des tests
40 alevins sont sélectionnés
aléatoirement pour chaque lot parmi les 60 et sont soumis à des
tests de groupe de 10, soit 4 tests par lot. 30 ml de SVP sont versés
dans un compartiment et 30 ml d'eau de l'écloserie (neutre) dans
l'autre. Les compartiments sont choisis de façon aléatoire.
Ensuite les portes sont ouvertes et les comportements sont enregistrés
pendant 10 minutes à l'aide d'une caméra connectée
à un ordinateur.
2.2.5.- Analyse statistique
A partir des enregistrements vidéo, les variables de
sortie : nombre de déplacement (pénétration) de alevins
dans chaque compartiment et le temps qu'au moins 50 % passent à
proximité de chaque compartiment ont été relevés,
traitées et analysées à l'aide des logiciels
Excel et Statistica 10. Le terme proximité dans notre cas
signifie à l'intérieur des espaces délimités devant
chaque compartiment (Fig. 6b). Les résultats sont donc
exprimés en moyenne #177; écart-type. La variable nombre de
pénétration étant quantitatif discrète et de petit
échantillonnage, le test non paramétrique de Wilkoxon
pour échantillons appariées a été
utilisé pour mettre évidence l'effet de l'imprégnation des
oeufs ou des larves. Le test appariées a été choisi en
raison que les alevins une fois dans l'aquarium étaient soumis aux deux
critères possibles (Eau et SVP). La
vérification de l'homoscédasticité pour le temps
passés à proximité des compartiments des variances pour
chaque lot montre que les données suivent une distribution normale,
ainsi, le test paramétrique de student pour
échantillons appariés est utilisé pour comparer l'effet de
l'imprégnation en fonction de la variable de sortie temps moyen à
proximité. Ces tests nous permettent de mettre en évidence
l'influence de la SVP sur les déplacements et les temps passés
à proximité pour chaque lot. Le test de Friedman pour
comparaisons multiples de rang moyen a été utilisé pour
comparer tous les lots entre eux. Les autres paramètres sont
comparés tantôt par ANOVA de Fisher, tantôt par Student pour
échantillons indépendants en fonction de la distribution. Un
effet a été considéré comme significatif pour un
p-value inférieur à 0,05.

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
12

III.- RESULTATS
3.1.- Les paramètres physiques au cours de
l'expérience
La température moyenne au cours de l'expérience
est de 21.5 °C et le taux d'oxygène moyen est de 7.5 ppm. Aucune
différence significative n'a pu être relevée par
comparaison d'ANOVA de Fisher dans les deux cas (p-value
température=0.864575 et p-value oxygène=0.110074).
3.2.- Taux de fécondation
Les oeufs qui sont incubés à la solution de
viande de porc présentent un taux de fécondation moyen de 87 %
alors que 91 % en moyenne des oeufs incubés sans la solution de viande
de porc ont été fécondés. Cependant, aucune
différence significative entre les 2 traitements n'a pu être
démontrée via l'ANOVA de Fisher (p-value : 0.12993).
Ainsi, on peut dire que la solution de viande de porc n'a pas eu d'effet
sur la fécondation.
3.3.- Suivi de croissance
Quatre prises (pesées) de poids ont
été effectuées au cours de l'expérience et les
alevins sont passés en moyenne de 0.02 à 0.45 g en 35 jours
(fig. 7). La présence de la solution de viande de porc
(SVP) n'a pas eu d'effet négatif sur la
croissance car, le résultat de l'ANOVA de Fisher n'a montré
aucune différence significative entre les différent traitements
(p-value=0.9762).

poids moyen gra m d'un me juvenile
e n
0,5
0,4
0,3
0,2
0,1
0
Prise 1 Prise 2 Prise 3 Prise 4
La croissance des differents lots
Incubation 1 Incubation 2 Bain 1
Bain 2
Nourrissage Temoin
Figure 7: Comparaison de croissance au cours de
l'expérience
3.4.- Déplacement des larves et temps moyens
passé à proximité
3.4.1.- Témoins (zéro solution de
viande de porc)
Les résultats du lot témoin montrent que les
alevins se déplacent préférentiellement vers le
compartiment où l'eau est versée (55 % contre 20 %). Le test de
Wilcoxon pour échantillons appariés ne montre cependant, aucune
différence significative entre les comportements de déplacement
vers la SVP et l'eau (p-value=0,067 et Z=1,825742). Ainsi, on peut
conclure que la présence de la solution n'a pas eu d'effet
négatif sur le déplacement des larves fig.8).

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 13
Eau SVP Pas d'entrée

Entrée des individus (%)
100
40
80
60
20
0

Figure 8: Comparaison du déplacement moyen
vers les compartiments ou les solutions sont versées (SVP et eau) pour
le lot à zéro solution de viande de porc
(témoin)
Pour le temps moyens passé à proximité,
les valeurs obtenues laissent voir à première vue une
préférence pour le compartiment où la solution de viande
de porc est versée car, les juvéniles ont passé en moyenne
178 secondes près du compartiment de la SVP contre 77 secondes pour
celui de l'eau. Par contre, aucune différence significative n'a pu
être mise en évidence par le test de Student pour
échantillons appariés (p-value=0.533) (fig. 9).
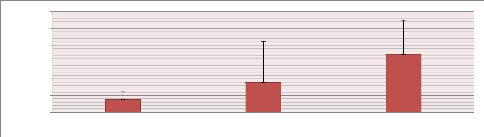
Temps (secondes)
400
600
500
300
200
100
0
Eau SVP Pas d'entrée
Figure 9 : Comparaison du temps moyen (secondes,
+ET) vers les compartiments ou les solutions sont versées (SVP et eau)
pour le lot à zéro solution de viande de porc
(témoin).
3.4.2.- Incubation doses 1 et 2 (0,4ml/l et
0,8ml/l)
Les différents déplacements enregistrés
dans le lot incubé à dose 1 (0,4ml/l) montrent qu'il y a une
préférence de déplacement des alevins vers le compartiment
où l'eau est versée contre celle où la solution de viande
de porc est versée car, 8 % seulement entrent vers la SVP contre 22 %
qui pénètrent dans le compartiment de l'eau. Cependant, le test
de Wilcoxon pour échantillons appariés ne nous permet pas de
conclure sur la présence d'une différence statistique
significative car, la p-value (0. 0.108) est supérieure à la
valeur seuil limite (Fig. 10).

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 14

Comme pour le lot 1, les alevins du lot incubé à
la dose 2 (0,8ml/l) ont pénétrés
préférentiellement dans le compartiment où l'eau est
versée par rapport à celle ou la solution de viande de porc est
versée, 38 % contre 30 %. Le test de Wilcoxon pour échantillons
appariés ne met pas en évidence non plus une différence
significative (p-value=0.42), ce qui nous laisse conclure que
la présence de la solution de viande de porc n'a pas eu effet sur les
différents déplacements vers les compartiments (Fig.
10).
|
100 80 60 40 20
0
|
|
|
|
|
Entrée des individs (%)
|
|
Dose 1 (0,4ml/l)
Dose 2 (0,8ml/l)
|
|
|
|
|
Eau SVP Pas d'entrée
Figure 10: Comparaison du déplacement (%
d'individu) vers les compartiments où les solutions sont versées
(SVP et eau) pour les lots incubés à la solution de viande de
porc dose 1 et 2 (0.4ml/l et 0,8ml/l)
En ce qui a trait au temps moyen passé à
proximité des compartiments, les alevins du lot incubation 1 sont
restés préférentiellement près du compartiment
où l'eau est versée par rapport à celle où la
solution de viande de porc est versée avec des temps moyens respectifs
de 58 secondes et 27 secondes. Le test de Student pour échantillons
appariés met en évidence la présence d'une
différence significative entre les temps passés à
proximité des 2 compartiments (p-value=0.0111). Ainsi, la
solution de viande de porc aurait probablement un effet sur le temps
passé à proximité pour le lot incubé à la
dose de 0,04ml/l de SVP. Par contre, aucune
différence significative n'a pu être démontrée pour
le lot incubé à la dose de 0,8ml/l de SVP (eau= 83
secondes et SVP= 62 secondes) (fig. 11) car, la valeur
t=0,676 issue du test de
student pour échantillons appariés est inférieure à
la valeur critique de Student (3.182) pour la distribution
(p-value=0.744).
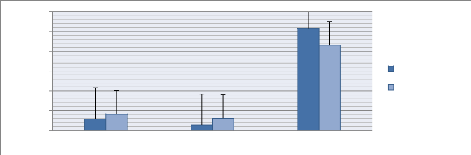
Temps (secondes)
400
600
500
300
200
100
0
*
Eau SVP Pas d'entrée
Dose 1 (0,4ml/l) Dose 2 (0,8ml/l)
Figure 11: Comparaison du temps moyen (secondes)
passé à proximité des compartiments ou les solutions sont
versées (SVP et eau) pour les lots incubés à la solution
de viande de porc dose 1 et 2 (0.4ml/l et 0,8ml/l)

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 15

3.4.3.- Bain dose 1et 2 (0,4ml/l et
0,8ml/l)
La comparaison de déplacement pour les alevins
traités en bain quotidien à la solution de viande de porc
à la dose de 0,4ml/l montre un déplacement positif vers le
compartiment ou la SVP est versée (48 % contre
27%). Cependant, le test de Wilcoxon pour échantillons appariés
ne révèle aucune différence significative entre les
pénétrations dans les 2 compartiments (fig.12)
(p-value=0.108). Alors que 10 % des alevins du lot de la dose de 0,8ml/l
ont déplacé vers le compartiment où l'eau est
versée contre 15 % vers la SVP. Comme pour le
précédent lot, le test de Wilcoxon pour échantillons
appariés ne relève aucune différence entre les 2 ce qui
laisse présager que la présence de la solution n'a pas eu d'effet
sur les déplacements vers l'un ou l'autre compartiment
(p-value=0.422) (fig.12).
Figure 12: Comparaison du déplacement (%
d'individu) vers les compartiments où les solutions
sont
|
100
|
|
|
|
|
|
|
|
|
|
|
Entrée des individus (%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
80
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60
|
|
|
|
|
|
|
|
|
|
Dose 1 (0,4ml/l)
Dose 2 (0,8ml/l)
|
|
|
|
|
|
|
|
40
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0
|
|
|
|
|
|
|
|
|
Eau SVP Pas d'entrée
versées (SVP et eau) pour les lots en bain
quotidien à la SVP dose 1 et 2 (0.4ml/l et 0,8ml/l)
La comparaison du temps moyens passé à
proximité des compartiments par les alevins du lot élevé
en bain quotidien à la solution de viande de porc (SVP)
dose 0,4ml/l, montre qu'ils passent en moyenne 154 secondes
près du compartiment de la SVP contre 70 secondes près du
compartiment de l'eau (Fig13). Par contre, le test de Student pour
échantillons appariés ne permet pas de mettre en évidence
aucune différence significative entre les traitements
(p-value=0.349). Pour la dose 0,8ml/l, les données montrent peu
de différences de valeurs entre les traitements (51 secondes pour l'eau
contre 44 secondes pour la SVP). Le test de Student
pour échantillons appariés renforce cette affirmation en ne
mettant en évidence aucune différence significative
(p-value=0.574).

Temps (secondes)
400
600
500
300
200
100
0
Eau SVP Pas d'entrée
Dose 1 (0,4ml/l) Dose 2 (0,8ml/l)
Figure 13: Comparaison du temps moyen (secondes)
passé à proximité des compartiments ou les solutions sont
versées (SVP et eau) pour les lots en bain quotidien à la SVP
dose 1 et 2 (0.4ml/l et 0,8ml/l)

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 16

3.4.4.- Nourrissage à l'aliment SVP
Pour le lot soumis à l'aliment imprégné
la solution de viande de porc, les résultats enregistrés montrent
que 13 % des alevins se sont dirigés préférentiellement
vers le compartiment de l'eau et 15 % vers celui où la SVP est
versée (fig. 14). Comme pour tous les précédents
traitements, le test de Wilcoxon pour échantillons appariés ne
nous montre aucune différence significative entre eux (p-value=
0,654).
Eau SVP Pas d'entrée

Entrée des individus (%)
100
40
80
60
20
0
Figure 14: Comparaison du déplacement moyen
vers les compartiments ou les solutions sont versées (SVP et eau) pour
le lot nourrit à l'aliment SVP
Pour le temps passé à proximité des
compartiments par le lot nourri à l'aliment imprégné
à la solution de viande de porc, on enregistre un temps moyen de 46
secondes près du compartiment de l'eau contre 50 secondes près du
compartiment de la SVP (fig. 15). De ce
fait, il n'existe aucune différence significative par comparaison au
test de Student pour échantillons appariés
(p-value=0.931).

Temps (secondes)
400
600
500
300
200
100
0
Eau SVP Pas d'entrée
Figure 15: Comparaison du temps moyen (secondes, +ET)
vers les compartiments ou les solutions sont versées (SVP et eau) pour
le lot nourrit à l'aliment SVP
En résume, aucune différence significative n'a
pu être mise en évidence, ainsi, la présence de la solution
de viande de porc n'aurait aucune influence sur le déplacement et le
temps passé à proximité vers l'une ou l'autre compartiment
par les alevins. La comparaison de tous les lots entre eux ne montre aucune
différence, p-value=0,161.

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 17

IV.- DISCUSSIONS
Chez les téléostéens, beaucoup de
substances chimiques odorantes induisent des comportements divers en fonction
de l'espèce grâce au système chimiosensoriel
(système olfactif) (Valdés and Olivares, 2015). Certains
mettent en évidence l'efficacité du système olfactif en
affirmant que les poissons notamment les salmonidés détectent
facilement l'odeur humaine et la classent parmi les substances qui lui sont
répulsives. Beaucoup d'études mettent en évidence le
développement de la mémoire chez les poissons à partir de
la perception visuelle, cependant, des études très concluantes
affirment que le sens olfactif est le mieux relié avec le cerveau et en
conséquence influencerait au mieux le développement de la
mémoire (Kerller et al, 2004). La carpe commune (Cyprinus
carpio), comme la majorité des ostariophyses, fait partie des
téléostéens à système chimiosensoriel
très développé. De ce fait, elle possède une bonne
capacité de détection par identification de molécules
odorantes grâce aux papilles de son système olfactif servant de
récepteurs pour divers types de molécules odorantes (Rolen et
al, 2003). Ainsi, ce système lui sert à rechercher ses
congénères (comportement grégaire, reproduction,
...), sa nourriture dans le milieu et à assurer sa défense
contre les prédateurs (Brusle, J., & Quinard, J.P., 2004 ;
Sorensen and Caprio, 1998 ; Heinen, 1980). Vivant
préférentiellement dans les fonds des eaux en milieu naturel, le
développement de ce système est entre autre le moyen efficace
utilisé par ce dernier pour survivre. Car, non seulement la
lumière manque mais aussi, beaucoup de substances nécessaires
à sa survie à odeurs, goûts, et couleurs divers y sont en
circulation continue. Ainsi, Atema et al, 1980 mettent en
évidence chez la carpe en situation expérimentale, un changement
de comportement et notamment un changement de mouvement sous l'effet de signaux
chimiques des aliments perçus par son système olfactif, ce qui
augmente ou diminue l'appétit. D'autres auteurs mettent affirment que
son système olfactif a la capacité de discriminer des substances,
particulièrement des mixtures d'acides aminés et des acides
aminés libres, par l'apprentissage (conditionnement) (Saglio et al,
1990 ; Xhardez, 2013 ; Sepchat, 2013). Ainsi, la carpe est capable
d'apprendre à partir de son système olfactif et à modifier
son comportement en conséquence. Cependant peu d'études, mettent
en évidence la capacité d'apprentissage précoce de la
carpe commune, encore moins par imprégnation. C'est-à-dire, par
pénétration des oeufs ou par bain précoce des larves
fraichement écloses de substances qui peuvent influencer leur
comportement futur notamment des substances odorantes. Dans la majorité
des cas consultés, elles tiennent surtout compte des mécanismes
olfactifs chez la carpe adulte. C'est dans cette optique que notre
étude, continuité de l'expérience de Joseph,
2014, bien que méthodologiquement modifiée, met en
évidence l'apprentissage précoce tantôt par
imprégnation des oeufs, tantôt par conditionnement des larves.
Globalement, aucune différence significative n'a pu
être démontrée. Ainsi, la solution de viande de porc n'a
pas d'effet sur les comportements. Donc, les alevins n'étaient pas
conditionnés. Une similarité avec les résultats de
l'étude de Joseph, (2014) peut être mise en
évidence (tab. 1), tout au moins pour les
traitements reconduits. Exception faite (dans mon cas) dans le temps
moyens passés à proximité des compartiments où la
présence d'un effet de la solution de viande de porc (p-value=0,011)
a été mise en évidence chez le lot incubé
à la dose 1 [(0.4ml/l) à la
SVP]. Même le lot nourrissage à
SVP (aliment imprégné de la
solution de viande de porc) présente la même tendance
(Absence de différences significatives, c'est-à-dire, pas
d'effet de la solution de viande de porc). Ce qui nous permet d'avancer
dans notre cas, que les alevins de carpe ne soient pas réellement
conditionnés par imprégnation des oeufs et des larves.
Tout laisse à croire que l'absence de conditionnement
précoce par imprégnation obtenue dans l'étude pour l'une
ou l'autre traitement est liée soit aux caractéristiques
biologiques et comportementales de l'espèce (Cyprinus carpio),
soit aux conditions expérimentales ou à la substance

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 18

odoriférante (solution de viande de porc)
utilisée pour le conditionnement comme stimulant conditionnel... Voyons
donc au cas par cas en fonction des différents traitements
utilisés.
Tableau 1 : Comparaison des résultats obtenus
avec ceux obtenus par Joseph (2014)
|
Traitement
|
Doses
|
Résultats Mercius, (2015)
|
Résultats Joseph (2014)
|
|
|
Entrées
|
Temps
|
Entrées
|
Temps
|
|
Incubation à la solution de viande de
porc
|
1(0,4ml/l)
|
DNS
|
DS
|
DNS
|
DNS
|
|
Eclosion à la solution de viande de
porc
|
2(0,8ml/l)
|
DNS
|
DNS
|
|
|
|
OEufs cadaverine juvéniles
cadaverine*
|
|
|
|
DNS
|
DNS
|
|
OEufs normaux juvéniles
|
|
_______
|
______
|
DNS
|
DNS
|
|
Bain quotidien à la solution de viande de
porc
|
1(0,4ml/l)
|
DNS
|
DNS
|
|
|
|
Bain quotidien à la solution de viande de
porc
|
2 (0,8ml/l)
|
DNS
|
DNS
|
|
|
|
Aliment imprégné à la solution
de viande de porc
|
|
DNS
|
DNS
|
|
|
|
Témoin
|
|
DNS
|
DNS
|
DNS
|
DNS
|
*Thème utilisé par Joseph, (2014)
pour décrire la solution de viande de porc.
DS : Différence
significative ; DNS : Différence non
significative
Les résultats de déplacements obtenus pour les
témoins montrent que les alevins se sont
préférentiellement déplacés vers le compartiment
où il n'y a que de l'eau versée. Ainsi, ils évitent donc
celui où la solution de viande de porc est versée. Cependant,
aucune différence statistique via le test de Wilcoxon n'a pu être
mise en évidence. Ainsi, pour le temps passé à
proximité des compartiments, aucune influence de la solution n'est mise
en évidence par Student. Bien que statistiquement aucune
différence n'est mise en évidence, les données laissent
voir un évitement du compartiment ou la SVP est versée. L'absence
de différence statistique est probablement due au petit nombre
d'observation utilisé. D'autre en plus, le risque d'erreur Beta est
inconnu. Comme démontré précédemment, la
présence de certains composés odorants dans l'eau
déclenche des comportements innées diverses chez les poissons.
Selon l'espèce et les substances, différents comportements sont
détectables. Certains odeurs répulsives pour certains peuvent
être attractives pour d'autres (Kasumyan, 2010). Ainsi, des
cyprinidés soumis à des diamines (Cadaverine et putrescine)
issues de la chair en décomposition, montrent des réactions
d'évitement innées (Hussain et al., 2013). Le poisson
zèbre mort, de la même famille que la carpe, émet des
signaux chimiques qui induisent des comportements de défense
innés (augmentation du niveaux de cortisol défensif)
chez les congénères (Oliveira, et al., 2014, Hussain et
al., 2013).
La décomposition de la viande de porc, selon les
analyses de laboratoire de Ferrari, (2014), montre qu'elle contient
des composés aromatiques volatiles notamment phénoliques, lui
conférant une odeur de viande pourrie. Probablement, elle
contient aussi la cadaverine et la putrescine. Cependant, aucune analyse des
substances dissoutes n'est encore effectuée. Les deux composés
(Cadaverine et putrescine) chez bon nombre de vertébrés jouent le
rôle de repères sociaux pour le marquage de territoire, pour
induire une réponse au stress... Bien que chez les carnivores et
carnassiers leur présence dans un milieu induisent un comportement
alimentaire, chez certains cyprinidés, ces substances (la
cadavérine et la putrescine) accompagnées d'autres
substances issues de la décomposition de cadavres (di et
tri-methylsulfides, phénol...) produisent des réactions
plutôt répulsives innées (Hussain et al., 2013).
Le phénol et ses dérivés sont particulièrement
connus pour

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 19

avoir des effets toxiques (Lewis, 2007 ; Zhang et al.,
2014). Ainsi, dans notre cas, ne serait-ce pas l'effet répulsif et
toxique des composés de la solution de viande de porc qui pousse les
alevins à entrer préférentiellement dans le compartiment
(neutre) où l'eau est versée et rester à proximité
dans un souci d'évitement. Bien que d'autres études montrent
l'attractivité des amines biogènes pour la carpe (Sepchat,
2013 ; Xhardez, 2013), dans notre cas, l'effet répulsif est mis en
évidence chez les individus témoins. Nos résultats sont
encore renforcés par ceux de Joseph, (2014) et Ferrari,
(2013) pour le même traitement (non conditionné).
Les ovocytes des poissons téléostéens
sont couverts par une enveloppe non cellulaire d'une épaisseur de 10
à 10,2 ìm nommée le zona radiata (Shabanipour and
Hossayni, 2010). La surface interne est protéique et a pour
rôle de protéger l'ovocyte et la surface externe neutre, est
formée d'acides mucopolysaccharides (glycoprotéines,
phospholipide, etc.) qui servent à fixer l'oeuf aux substrats
(Shabanipour and Hossayni, 2010 ; Riehl et Patzner, 1998). En plus de
la structure de surface, l'enveloppe possède des microvillosités
et des pores (Park et Kim, 2001). Le zona radiata joue donc un
rôle important dans les processus de reproduction en servant d'interface
entre l'oeuf et le sperme, mais aussi et surtout comme une interface entre
l'embryon et son environnement immédiat (Murata, et al., 1997).
La carpe commune pond généralement des oeufs de 1.2 à
1.8 mm diamètre (Brusle& Quinard, 2004 ; Nikolsky, 1963).
Les pores de l'enveloppe permettent le transport de matières
vitellogéniques au cours de l'ovogenèse avant l'exposition des
ovocytes à l'environnement externe (Stehr et Hawkes, 1979). Mansour
et al. 2008 ont rapporté que l'enveloppe externe est
composée de 9 types de protéines, dont 4 sont des
glycoprotéines et sont probablement la cause du caractère collant
des oeufs de cape. En fin de vitellogénèse, les pores de la
couche externe perdent leur fonction. Il est par conséquent mis en
évidence chez la carpe qu'une fois la vittelogénèse
achevée, les pores jouent plutôt un rôle de protection et
servent à l'imperméabilité de l'oeuf en renforçant
sa rigidité (Shabanipour and Hossayni, 2010).
Les lots qui étaient soumis à la solution de
viande de porc pendant l'incubation (fig. 5), ne présentent pas
des résultats significatifs, sauf le temps à proximité
pour le lot 1 (incubation à dose 0,4ml/l). Donc, il est fort
probable qu'ils ne soient pas imprégnés. Ainsi, même la
dose doublée, 0,8ml/l ne présente pas d'effet.
Cependant, beaucoup d'études mettent en évidence
l'imprégnation des oeufs de poisson par des substances diverses en vue
de contrôler ou d'orienter certains mécanismes biologiques,
comportementaux, etc. Ce qui prouve la perméabilité de
l'enveloppe des oeufs de certaines espèces à certaines
substances. Par contre, chez la carpe commune, des recherches montrent qu'il
est fort probable que l'oeuf soit imperméable sinon très
sélectif en ce qui a trait aux échanges avec l'extérieur
une fois fécondé. Une forte mortalité a été
observée chez des larves de carpes soumises au dichromate de potassium
après éclosion par rapport à des larves dont les oeufs
étaient soumis à ce même composé (Krejci et al,
2006).
La présence de substances liées aux cadavres
dans la solution notamment la cadaverine et la putrescine a été
mise en évidence car les témoins ont eu un comportement
d'évitement mettant en cause le caractère répulsif de ces
dernières. Il faut signaler qu'après éclosion, le plus bas
taux de mortalité a été observé chez les lots
incubés à la solution de viande de porc. L'existence de certains
composés toxiques issus de la décomposition de cadavre a
clairement été prouvée (Lewis, 2007). Donc,
l'imperméabilité ou la perméabilité très
sélective des oeufs peut être à l'origine de l'absence
d'imprégnation chez ces lots. C'est d'autant vraisemblable,
puisqu'après fécondation, les oeufs ont été
traités au tanin afin de rendre rigide leur enveloppe. Bien qu'une
différence significative ait pu statistiquement montrer en ce qui a
trait au temps moyen passé à proximité des compartiments
chez le

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
20

lot1 (Incubation à la dose 0,4ml/l), un
réel effet ne peut pas être mis en cause. Non seulement ce
résultat est contraire à la majorité des traitements dans
les mêmes conditions expérimentales, mais aussi, il faut
considérer le peu de répétitions par traitement qui
pourrait à l'origine d'imprécisions de données. Le
caractère grégaire de la carpe commune peut aussi être
évoqué pour ce lot (Couzin et al., 2005). Ainsi, il est
probable que la différence significative observée soit due au
hasard (Effet résiduel).
Chez les poissons, la chémoréception, c'est
à dire, la capacité de détecter des signaux chimiques
externes, est fourni par les systèmes olfactif et gustatif, et le sens
chimique commun. Ces systèmes jouent un rôle primordial dans la
vie des poissons, car l'environnement aquatique en comparaison avec l'air
crée les conditions particulières de la communication chimique,
à savoir, pas de restrictions sur le poids moléculaire pour des
molécules de signalisation, la maintenance continue des composés
odorants etc. (Kasumyan, 2010). Beaucoup d'études se sont
intéressées à la structure des systèmes
chimiosensoriels (olfactif et gustatif) chez les poissons. Cependant, la
majorité des données sont liées aux organismes adultes.
Ainsi, la limite des études sur les petits spécimens
(larves/juvéniles) est liée à la difficulté
d'analyser la structure des petits organes ainsi que la
vulnérabilité des embryons et juvéniles immatures de la
plupart des poissons. L'organe olfactif, une partie périphérique
du système olfactif commence à se former à des stades
embryonnaires précoces du développement des poissons. Chez
certaines espèces, les cellules de récepteurs olfactifs (neurones
sensoriels) se trouvent déjà dans les embryons qui sont encore
sous le revêtement (Kasumyan, 2010). Le développement et
la période de la sensibilité olfactive à différents
types d'odeurs induisant des réactions diverses varient d'une
espèce à autre et sont en conformité étroite avec
le comportement des juvéniles et avec le niveau de développement
des autres systèmes sensoriels. Par exemple, les juvéniles de
nombreuses espèces de carpes au tout début de la période
larvaire, même au stade de l'alimentation mixte, répondent
à des signaux chimiques naturels de danger (défense)
(Døving et al., 1994 ;Kasumyan, 2010).
Comme cité ci-dessus, l'apprentissage permet à
un animal de se conformer au changement de son environnement afin de survivre.
Ainsi, des facteurs peuvent influencer le processus d'apprentissage. Citons
notamment le renforcement qui peut être de plusieurs natures. Car, il a
un effet de stimulant de mémoire et donc une motivation d'apprentissage
(Liberman, 1990). Dans le cadre du notre travail, les lots
conditionnés en bain continu à la solution de viande de porc
(voir matériels et méthodes) ne sont pas
influencés par la SVP. Les résultats
obtenus pour les 2 variables de sortie (déplacement et temps moyen
à proximité des compartiments) ne mettent pas en évidence
une influence de la solution sur le comportement des alevins des deux lots. Des
recherches affirment qu'une fois éclos, les juvéniles de carpe
sont déjà capables de répondre à certains stimulus
olfactifs notamment des solutions d'acides aminés et extraits
alimentaire (Doving et al., 1994). C'est pourquoi, dans le cadre de
notre étude, des lots ont été conditionnés en bain
à la solution de viande de porc (SVP) (stimulant conditionnel)
avec l'alimentaire jouant le rôle de stimulant inconditionnel dans
un type de conditionnement opérant classique. Donc, les alevins de carpe
étaient exposés à l'aliment et en conséquence,
pouvaient associer l'odeur de la solution de viande de porc à celle de
l'aliment. Il faut dire que, les données dans ce cas, laissent
comprendre que le faible nombre de sujet par test pouvait influencer le
résultat, car, non seulement la variabilité est
élevée entre les différents tests, mais aussi, du point de
vue numérique, les alevins se sont toujours
préférentiellement orientés vers la SVP que ce soit pour
les déplacements et pour le temps passé à proximité
(fig. 12 et 13). Une comparaison montre que, dans l'ontogenèse
de nombreux poissons, la sensibilité aux signaux chimiques alimentaire
se pose et mûrit plus tard que la sensibilité aux odeurs suscitant
les réactions défensives. Donc, les premières
réponses à des stimuli d'odeurs de nourriture chez la carpe
(Ñyprinus carpio) seraient dans le milieu de la période
larvaire (Kasumyan et Ponomarev, 1990). Ainsi, nous pouvons attribuer
l'absence

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
21

d'influence de la SVP sur le
comportement des larves des deux lots en bain à la SVP
(0,4 et 0,8ml/l) par un système olfactif peu
développé et de fonction peu complète. Car, notre
période de conditionnement s'étendait sur 30 JPE, alors que la
période larvaire (alevinage) chez la carpe commune dure entre 45 et 60
jours (FAO, 1992). Donc, la période du début de la
capacité de la carpe commune à donner des réponses
conditionnées coïncide avec la fin de notre expérience. En
conséquence, le peu de temps imparti pour l'expérience pourrait
être aussi à l'origine de l'absence d'effet et le
non-conditionnement des alevins des lots en bain. Ce qui voudrait dire qu'il
n'est pas possible de conditionner les carpes trop tôt.
L'alimentation exogène chez la carpe commune commence
entre 60 à 80 degrés-jours. C'est-à-dire en environ 3
jours à 27 °C après l'éclosion (FAO, 1992).
La prise alimentaire pendant cette période larvaire est surtout
liée à des réflexes innés. Ce sont donc des
réactions non spécialisées qui visent surtout à
détecter des proies pendant les premières alimentations
(Doving et al., 1994).
Comme la plupart des traitements, la solution de viande de
porc n'a pas d'effet sur le déplacement et le temps passé
à proximité par le lot nourri à l'aliment
imprégné de la SVP, et en
conséquence, il n'y a pas eu de conditionnement. L'aliment a
été préparé en l'imprégnant de la
SVP. Cependant, le début de l'alimentation
pour ce test a eu lieu 17ème JPE, ce qui ne se
coïncidait pas encore avec la période des premières
réponses innées à des stimuli olfactifs alimentaire
(Kasumyan et Ponomarev, 1990). Ce choix est fait par le fait que la
première partie (16 premiers jours) de la phase larvaire, la carpe est
très fragile car ses systèmes de défense ne sont pas
encore bien développés. De ce fait, un aliment bien
équilibré était nécessaire. En plus, la très
probable présence de composés aux caractères toxiques et
répulsifs pouvait compromettre la survie des larves fraichement
écloses. Ainsi, de J1 à J16 PE, le lot était nourri
normalement avec du gemma micro (150 à 300) protéiné
à 59 %. Néanmoins, l'appétence des alevins a
diminué et un léger ralentissement de la croissance a
été observé à partir du 17ème
JPF. L'aliment à la SVP était moins
protéique (45 %) que le gemma micro et en conséquence de
moindre appétibilité, mais de qualité
énergétique acceptable (Annexe 1). Cependant, la
diminution de la prise alimentaire et en conséquence de la croissance
s'assimilerait probablement aux caractères toxiques et répulsifs
de certains composés de la SVP. La
présence des amines biogènes (cadaverine, putrescine et
histamine) aux caractères répulsif et toxique à forte
dose a probablement occasionné la baisse de prise alimentaire. Il faut
noter une forte mortalité enregistrée dans le lot nourrissage
à partir du début de l'alimentation avec l'aliment
imprégné à la solution de viande porc. Ainsi, les cas de
mortalité sont surtout observés les matins après le
début de l'alimentation. Avant qu'ils meurent, les sujets affaiblis
présentent des battements operculaires lents et une nage erratique avant
de tomber dans le fond de l'aquarium. Toutefois, chaque matin, avant le
début de l'alimentation, les alevins présentent toujours une
allure normale. Cependant, la présence des amines biogènes
notamment la cadaverine, la putrescine et l'histamine dans le régime
alimentaire des vertébrés a un effet indésirable à
dose élevée et varie spécifiquement. Elle provoque entre
autre une diminution de la pression artérielle, de légères
augmentations de l'hématocrite, de la concentration en
hémoglobine, et des thrombocytes (Lewis, 2007 ; ChemEurope, 2011).
Ainsi, probablement, la faible prise alimentaire, les cas de nages
erratiques et faiblesse physique, la diminution de la croissance et les cas de
mortalité élevée, sont dû aux caractères
répulsif et la toxicité de certains composés (cadaverine,
putrescine et histamine) de la SVP.

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
22
V.- CONCLUSION
Nos résultats fournissent de bonnes pistes pour des
recherches futures sur le conditionnement alimentaire de la carpe commune par
rapport à la solution de viande de porc et particulièrement la
cadaverine, la putrescine et l'histamine. Car, la base moléculaire et
cellulaire des amines biogènes et autres composés de la solution
de viande de porc (SVP) ainsi que les
récepteurs sensoriels (olfactif) qui les détectent ne sont pas
bien connus. Ainsi, le prolongement de la période de conditionnement
notamment pour le lot nourrissage serait un bon moyen pour conclure sur le
conditionnement précoce, car numériquement, les alevins se sont
toutefois déplacés vers la SVP ce qui
laisse entrevoir un début d'effet. D'autres techniques
devront être testées afin d'augmenter les possibilités
d'avoir des résultats prometteurs et concluants.
En effet, Il serait intéressant de reprendre
l'étude sur les mêmes angles avec des innovations et modifications
surtout sur le temps de l'expérience sur toute la période
d'alevinage, de ne plus utiliser si possible de substances (tanin) de
renforcement de la rigidité de l'enveloppe de l'oeuf, de réaliser
des analyses afin d'identifier les composés de la solution de viande de
porc (SVP). Enfin, d'augmenter le nombre de test par
traitement afin de diminuer la variabilité et en conséquence de
diminuer d'éventuelles erreurs. Car, les résultats obtenus bien
que statistiquement non significatifs, sont prometteurs sur la
possibilité de conditionnement olfactif précoce (oeufs et
larves) de la carpe commune par imprégnation.


« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 23

REFERENCES BIBLIOGRAPHIQUES
AFSSA, (2006). Histamine, Fiche de
description de danger transmissible par les aliments, Coordination
scientifique de l'Agence française des Sécurités
Alimentaires
Anderson, G. S. & Hobischak, N. R., (2004).
Decomposition of carrion in the marine environment in British
Columbia, Canada, International Journal of Legal
Medicine, 118(4), 206-9. Doi : 10.1007/s00414-004-0447-2
Atema J. and Derby C., (1981). The Function of
chemo- and mechanoreceptors in lobster (Homarus americanus) Feeding
behavior, J. exp. Biol. (1982). 98, 317-327
Atema, J., (1980). Chemical senses, chemical
signals, and feeding behavior in fishes, international center for ling
aquatic resources management.
Ayers Laura E., (2010). Differential
decomposition in terrestrial, freshwater, and saltwater environments: a
pilot study. Texas State University-San Marcos.
Bajer P. G., Lim H., Travaline M. J., Miller B. D.,
Sorensen P. W., (2010). Cognitive aspects of food searching behavior
in free-ranging wild common carp, Env. Biol. Fishes,
doi:10.1007/s10641-010-9643-8, 88, 295-300.
Balon E. K. and Crawford S. S., (1994).
Alternative life histories of the genus 24reshwa. Early antogeny of L.
parva. The rainwater Lillifish, Env. Biol. Fish.
40. 349-389
Bazaes, A., Olivares J., and Schmachtenberg, O., (2013).
Properties, projections, and tuning of teleost olfactory receptor
neurons. Journal of Chemical Ecology. 39,
451-464. Doi:10.1007
Billard R. 1995 : Hydrobiologie et Aquaculture,
les carpes, Biologie et elevage, INRA.
Braubach, O.R., Fine A., and Croll, R.P., (2012).
Distribution and functional organization of glomeruli in the olfactory
bulbs of zebrafish (Danio rerio). J. Comp.Neurol. 520,
2317-2339.
Brusle, J., and Quinard, J.P., (2004). Biologie
des poissons d'eau douce européens. Paris, France :TEC et
DOC.
Cone J.D. et Hayes S. C., (1984).
Environnemental problem of behavioral solution, Cambridge University,
Printed In USA, 94001, ISBN 0521-319730.
Couzin, I., Krause, J., Franks, N.R. and Levin, S.A.,
(2005). Effective leadership and decision-making in animal groups on
the move. Nature, 433,513-516.
Daghfous G., Green, W. W., Zielinski B. S., Dubu, R.,
(2012). Chemosensory-induced motor behaviors in fish, Science
Direct, Neuroethology, 10.009, DOI10.10162011.
Derby C. D. and Sorensen P. W., (2008). Neural
Processing, Perception, and Behavioral Responses to Natural Chemical Stimuli by
Fish and Crustaceans, Journal Of Chemical Ecology, 34:898-914.

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
24

Doving, K. B., Selset, R. and Thommesen, G., (1980).
Olfactory sensitivity to bile acids in salmonid fishes. Acta
Physiol. Scand. 108, 123-131.
Doving, K.B., Mårstøl, M., Andersen, J.R.,
et al. (1994). Experimental Evidence of Chemokinesis in Newly Hatched
Cod Larvae (Gadus morhua L.), Mar. Biol., vol. 120, pp. 351-
358.
Dumeril M. C., (1807). Mémoire
sur l'odorat des poisons. Nouveau Bulletin des Sciences,
Tome 1, Paris, 1807-1809 (pp. 14-15).
Edwards, J. G., and Michel, W. C., (2002).
Odor-stimulated glutamatergic neurotransmission in the zebrafish
olfactory bulb. Journal of Comparative Neurology, 3,294-309. DOI:
10.1002/cne.10445.
El Hassan Hamdani and Kjell B. Døving, (2002).
The alarm Reaction in Crucian Carp is Mediated by olfactory Neurons
with long Dendrites, Division of Physiology, Department of Biology,
University of Oslo, 27 (4), 395-8.
El Hassan Hamdani and Kjell B. Døving, (2006).
Specific Projection of the Sensory Crypt Cells in the Olfactory System
in Crucian Carp, Carassius carassius, Department of Molecular Biosciences,
University of Oslo, PO Box 1041, Blindern, 0316 Oslo, Norway,
31(1): 63-67.doi: 10.1093.
Escoudero Garcia et al., (1997). Modelo de
calidad del habitat para el carzo (Capreolus capreolus L.) con resolucion
estadistica en estudios mediambiantales. EMAGG. Universidad nacional de la
plata, Argentina.
FAO, (1992). Manuel pour le développement
de la pisciculture à Madagascar, Document Technique N°4, FI :
DP/MAG/88/005...
FAO, (2007). The State of World Fisheries and
Aquaculture 2006. FAO Fisheries department : Roma.
Ferrari F., (2014). Processus de conditionnement
aux stimulus olfactifs chez la Carpe commune (Cyprinus carpio),
mémoire pour un Master en Biologie des organismes et Ecologie,
Faculté de des Sciences, Département des Sciences et Gestion de
l'environnement, Unité de Biologie de Comportement, Université de
Liège, UBC/Ulg.
Friedrich, R. W., Yaksi, E., Judkewitz , B. and Wiechert
M. T., (2009). Processing of odor representations by neuronal circuits
in the olfactory bulb. Annals of the New York Academy of Science,
1170, 293-297. DOI: 10.1111.
Fuller, C.L., and Byrd, C. A., (2005). Ruffed
cells identified in the adult zebrafish olfactory bulb. Neurosci. Lett.
379, 190-194.
Fuller, C.L., Yettaw, H. K., and Byrd, C.A.,
(2006). Mitral cells in the olfactory bulb of adult zebrafish
(Danio rerio): morphologyanddis- tribution. Journal of Comparative
Neurology. 499, 218-230.
Hansen, A. and Finger, T.E., (2000). Phyletic
distribution of crypt-type olfactory receptor neurons in fishes. Brain Behav.
Evol., 55, 100-110.
Hansen, A., Rolen, S. H., Anderson, K., Morita Y.,
Caprio, J., and Finger, T. E., (2003). Correlation between olfactory
receptor cell type and function in the channel catfish. J. Neurosci,
23, 9328-9339.

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 25

Heinen, J. M., (1980). Chemoreception in
decapods Crustacea and chemical feeding stimulants as potential feed additives.
Proceedings of the World Mariculture Society, 11:319-334, DOI:
10.1111.
Hergenhahn, B.R., (1976). An introduction to
theories of learning, Englewood Cliffs, N.J.: Prentice-Hall.
Herrick C. J., (1908). On the phylogenic
differenciation of the organs of smell and taste, Journal of comparative
neurology and psychology, 157-166, DOI: 10.1002/cne.920180205.
Hosseini, S. V., Hamzeh, A., Moslemi, M., Lashkan, A. B.,
Iglesias, A. And Feás, X., (2013). Effect of Delayed Icing on
Biogenic Amines Formation and Bacterial Contribution of Iced Common Carp
(Cyprinus carpio), Molecules, 18 (12), 15464-15473;
doi:10.3390.
Ichikawa, M. and Ueda, K., (1977). Fine
structure of the olfactory epithelium in the goldfish, Carassius
auratus. A study of retrograde degeneration. Cell Tissue Res.,
183, 445-455.
J. Muller, (1845). Manuel de
Physiologie Vol. 1, Paris, Ed. chez J.B. Bailliere, 1845.
James D. Kieffer 1. And Patrick W. Colgan, (1992).
The role of learning in fish behavior, Fish Biology and
Fisheries, 2, 125-143.
Joseph J. R., (2014). Conditionnement des carpes
communes (Cyprinus carpio) à la détection olfactive des
composés aromatiques de décomposition de cadavres par
imprégnation des oeufs et des larves, mémoire pour un Master
Complémentaire en Aquaculture, Faculté des sciences,
Ulg/CEFRA.
Kapoor, B.G., Von der Emde,
G., Mogdans, J., (2004). Adaptations for the
receptions of natural stimuli, The sences of FISH.
Karplus, I., Zion, B., Rosenfeld, L., Grinshpun, Y.,
Slosman, T., Goshen Z., and Barki A., (2007). Social facilitation of
learning in mixed-species schools of common carp (Cyprinus carpio L.)
and nile tipalia Oreochromis niloticus (L.). Journal of Fish Biology,
71 (4), 1023-1034. Doi :10.1111/j.10958649.2007.01568.
Kasumyan, A. O., (2010). Functional Development
of chemosensory Systems in the Fich Ontogeny. Rusian Jurnal of Development
Biology, 2011, Vol, 42, 3,173-179, doi: 10.1134.
Kasumyan, A.O., and Ponomarev, V.Yu. (1990).
Formation of the Food Search Response to Natural Chemical Signals in the
Ontogeny of Carp Fish, Vopr. Ikhtiol. vol. 30, no. 3, pp. 447-456.
Keller, M., Perrin, G., Ferreira G., Levy F., (2004).
Cortical and medial amygdala are both involved in the formation of
olfactory offspring memory in sheep. European Journal of neuroscience,
20:3433-41.
Kermen F., Franco, L. M. Wyatt C., and Yaksi E., (2013).
Neural circuits mediating olfactory-driven behavior in fish.
Frontiers in neutral circuits, 62 (7), 1-9. Doi:
10.3389.
Kirsch, I., Lynn, S. J., Vigorito, M., and Mille R.R.,
(2004). The Role of Cognition in Classical and Operant Conditioning,
Journal of Clinical Psychology, DOI: 10.1002/jclp.10251.
Kojima, T., Ito, H., Komada, T., Taniuchi, T., and
Akamatsu, T., (2005). Measurements of auditory sensitivity in common
carp Cyprinus carpio by the auditory brainstem response technique and cardiac
conditioning method, Fisheries Science, Volume 71, Issue 1,
pages 95-100, DOI: 10.1111.

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
26

Krejaèí, R., Palikova, M. (2006).
Potassium Dichromate as a Reference Substance for Embryonic Tests of Toxicity
in the Common Carp (Cyprinus carpio L.). ACTA VET. BRNO, 75:
259-263.
Laberge, F., and Hara, T.J., (2001).
Neurobiology of fish olfaction: A review. Brain Research
Reviews, 36, 46-5.
Lewis, R.J., (2007). Hawley's Condensed Chemical
Dictionary 15th Edition. John Wiley & Sons,
Inc. New York, NY 2007, pp. 20.
Lim, H., & Sorensen, P.W., (2012). Common
carp implanted with prostaglandin F2á release sex pheromone complex that
attract conspecific males in both laboratory and field. Journal of Chemical
Ecology, 38 (2), 127-134. Doi
:10.1007/s10886-012-0062-5.
Mansour, N.,Lahnsteiner, F., McNiven, M. A., Richardson,
G. F., (2008). Morphological characterization of Arctic char,
Salvelinus alpinus, eggs subjected to rapid post-ovulatory aging at 7
°C, aquaculture, doi:10.1016, 204-208
Manteifell, Y.B., and Karelina, M.A., (1996).
Conditioned food aversion in the gold fish, Carrassius auratus.
Comparative Biochemistry and Physiology, 115A (1),
31-35.
Marshall, J., (2006). Adaptations for the
Reception of Natural Stimuli. Fish and Fisheries, The Senses of Fish,
7: 76-77. Doi: 10.1111.
Michael P. Oberdorff T, (1995). Feeding habits
of fourteen europeen Fresh water fish species. Cybium
19(1), 5-46.
Murata, K., Sugiyama, H., Yasumasu, S., Iuchi, I.,*
Yasumasu, I. and Yamagami, K., (1997). Cloning of cDNA and
estrogen-induced hepatic gene expression for choriogenin H, a precursor protein
of the fish egg envelope (chorion), Proc Natl Acad Sci U S A, 94(5):
2050-2055.
Nelson J. (1984). Fishes of the World (2nd
edn). John Wiley and Sons: New York.
Nikolsky, G.V., (1963). The Ecology of Fishes,
(Translated by L. Birkett). Rev Fish Biol Fish. Academic Press. London, 352
pp. In Kamler, E. (2002). 12 : 79-103.
Njouokou, S., Tchoumboue, J., Nguenga, D., Pouomogne, V.,
Gaillard, J., Sulem, S. and Bidzanga. N., (2013). Détermination
des caractéristiques de maturité sexuelle du Cyprinus carpio
en zone d'altitude Camerounaise, Int. J. Biol. Chem. Sci.
7(2) : 649-656.
Oliveira, T. A., Koakoski, G., Costa da Motta, A., Luis
Piato, A., Barreto, R.E., Luiz Volpato, G., Barcellos, L. J. G. (2014).
Death-associated odors induce stress in zebrafish. Hormones and
behavior, 65 340-344.
Park, J., Kim, I., (2001). Fine structures of
oocyte envelopes of three related Cobitid species in the genus Iksookimia
(Cobitidae). Ichthyol. Res. 48, 71-75.

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
27

Parker G. H., (1910). Olfactory reaction in
Fishes, Journal of Expérimental Zoology. Vol 8, no 4 ;
535542.
Parmentier, E., Vandewalle, P., Brié, C.,
Dinraths, L. and Lecchini, D., (2011). Comparative study on sound
production in different Holocentridae species. Front. Zool. 8, 12.
Parmentier1, E., Kéver, L., Boyle, K., Corbisier,
Y., Sawelew, L. and Malavasi, S., (2013). Sound
production mechanism in Gobius paganellus (Gobiidae), The Journal of
Experimental Biology 216, 31893199.
Pavlov, I.P., (1927). Conditioned Reflexes: An
Investigation of the Physiological Activity of the Cerebral Cortex (translated
by G. V. Anrep). Oxford University Press.
Richelle M., (1977). BF SKINNER ou le
péril behavioriste, psychologie et sciences humaines. PIERRE
MARDAGA, EDITEUR.
Rider J. M. et Bauchaut R., (1984). L'olfaction
Chez les téléostéens, « Equipe de
neuroanatomie comparée », laboratoire d'Anatomie
comparée, Société française d'ichtyologie, vol. 8,
no1, pp. 9-14. Riehl, R., Patzner, R.A.,
(1998). Minireview: the modes of egg attachment in teleost fishes.
Italian J. Zool. 65, 415-420.
Rolin, S. H., Sorensen P. W., Mattson, D., and Carpio, J.
(2003). Polyamines as olfactory stimuli in the goldfish Carassius
auratus. The Journal of Experimental Biology 206, 1683-1696-1683, Doi
:10.1242.
Saglio, P., (1979). Interactions sociales chez
les poissons, I.N.R.A., Laboratoire de Physiologie des Poissons 78350
JOUY EN JOSAS, France, 173-184.
Saglio, P., Fauconneau, B., and Blanc, J. M., (1990).
Orientation of carp, 28reshwat carpio to free amino acids from tubifex
extract in an olfactometer. Journal of fish Biology, 37, 887-898.
Salotti J. M., Lepretre F., Berthet P., Ceccaldi B.,
Gomond N., (2009). Essai de conditionnement classique et
opérant appliqué à un robot, Ecole Nationale
Supérieure de Cognitique.
Sato, Y., Miyasaka, N. and Yoshihara, Y., (2007).
Hierarchical regulation of odorant receptor gene choice and subsequent
axonal projection ofolfactory sensory neurons in zebrafish. J. Neurosci.
27, 1606- 1615.
Schultz, K, (2004). Ken Schultz's field guide to
28reshwater fish. Hoboken, NJ : John Wiley & Sons.
Sepchat E., (2013). Attractivité olfactive et
processus de conditionnement chez la carpe commune (Cyprinus carpio),
mémoire pour un Master en Biologie des organismes et
Ecologie, Faculté de des Sciences, Département des Sciences et
Gestion de l'environnement, Unité de Biologie de Comportement,
Université de Liège, UBC/Ulg.
Séverine LECLERC, (2001).
Glucuronoconjugaison dans les organes olfactifs : roles dans la
protection du cerveau et dans le métabolisme de molécules
odorantes et de médicaments, thèse de doctorat en science du
médicament, nancy university de, france, 225 pages.

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 28

Shabanipour, N., Hossayni, S.N., (2010).
Histological and ultrastructural study of Zona Radiata in oocyte of
common carp Cyprinus carpio (Linnaeus 1758), Department of Biology, Faculty
of Science, University of Guilan, Rasht, Iran.
Sokolov, E. N. et al., (2001). Vector
representation of associative learning. Neuroscience and Behavioral
physiology, 31(2), 133-8.
Sorensen, P. W. and Caprio J., (1998).
Chemoreception. In: Evens DH, The physiology of fishes. CRC
LLC, New York, 375-5405.
Stacey, N.E., Wisenden, B., and P.W. Sorensen., (2002).
Chemical Communication in Fish. E.O.L.S.S. website.
Stadler S., (2013). Analysis of the Volatile
Organic Compounds Produced by the Decomposition of Pig Carcasses and Human
Remains, Thesis Submitted in Partial Fulfillment of the Requirements for
the Degree of Doctor of Philosophy in Applied Bioscience, University of Ontario
Institute of Technology.
Stehr, C.M., Hawkes, J.W., (1979). The
comparative ultrastructure of the egg membrane and associated pore structures
in the starry flounder Platichthys stellatus (Pallas) and pink salmon,
Oncorhynchus gorbuscha (Walbaum), Cell Tissue Res, 202, 347-356.
Thommesen, G., (1978). The spatial distribution
of odour induced potentials in the olfactory bulb of char and trout
(Salmonidae). Acta Physiol. Scand., 102, 205-217.
Thommesen, G., (1983). Morphology, distribution,
and specificity of olfactory receptor cells in salmonid fishes. Acta
Physiol. Scand., 117,241-249.
Valdés, J. and Olivares J., (2015).
Analysis of olfactory sensitivity in rainbow trout (Oncorhynchus
mykiss) reveals their ability to detect lactic acid pyruvic acid and four b
vitamins, Fich Physiol Biochem, 41:879-885, Doi:10.1007.
Wechsler, D., Walther, B., Jakob, E., Winkler H.,
(2009). Importance des amines biogènes dans
l'alimentation et présence dans les différents fromages,
Station de recherche Agroscope Liebefeld-Posieux ALP, CH-3003 Berne, ISSN
1661-0814.
Xhardez S., (2013). Evaluation du pouvoir
d'attractivité des acides Aminés sur le sens de l'odorat de la
carpe Commune (cyprinus carpio, cyprinidae) en vue de Leur utilisation
dans un paradigme de Conditionnement olfactif, mémoire pour un
Master en Psychologie et des Sciences de l'Education, Faculté de
Psychologie et des Sciences de l'Education, Ulg.
Yamamoto, Y., Hino, H.and Ueda, H., (2010).
Olfactory Imprinting of Amino Acids in Lacustrine Sockeye Salmon.
journal.pone, 5(1): 8633. DOI:10.1371.
Yan, H. Y., and Popper, A. N., (2000). An
automated positive reward method for measuring acoustic sensitivity in fish.
Behaviour Research Methods, instruments & computers,
23(3), 351-356.
Zeiske, E., Kasumyan, A., Bartsch, P. and Hansen, A.,
(2003). Early developmentnof the olfactory organ in sturgeons of the
genus Acipenser: A comparative and electron microscopic study. Anat.
Embriol., 206, 357-372.

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
29
Zhang, Y., Qin, N., Luo, Y., Shen, H., (2014).
Effects of different concentrations of salt and sugar on biogenic
amines and quality changes of carp (Cyprinus carpio) during chilled
storage, DOI 10.1002.
Sites et pages internet consultés
Biogenic Amines, Technical Bulletin, 899 Adams Street/St. Helena
Ca 94574, http://www.etslabs.com/
Encyclopædia Universalis [en ligne],
consulté le 6 juillet 2015.URL
http://www.universalis.fr/encyclopedie/poissons/)
Encyclopedia of Chemistry. Cadaverine,
http://www.chemeurope.com/en.
Fishbase: Species summary for Cyprinus carpio diversity
ummz.umich.edu/local/redirect.hp/http://www.fishbase.org).
http://neurobranches.chez-alice.fr/systnerv/systsens/physiogene1.html


« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 30
ANNEXES
Annexe 1: Formulation d'aliment a la cadaverine
|
Composition des ingrédients
|
|
|
Composition de la ration
|
|
|
Ingrédients
|
PB
|
LB
|
Glucides
|
% R
|
Masse (g)
|
PB
|
LB
|
Glucides
|
ED (kcal/100g)
|
|
Farine de muscle de morue
|
89
|
4
|
0
|
38
|
1520
|
33.82
|
1.52
|
0
|
769.6292
|
|
Farine de gluten de blé
|
80
|
6
|
10
|
14
|
560
|
11.2
|
0.84
|
1.4
|
278.2738
|
|
Huile de foie de morue
|
0
|
100
|
0
|
7.6
|
304
|
0
|
7.6
|
0
|
256.462
|
|
Amidon
|
0
|
0
|
100
|
27.4
|
1096
|
0
|
0
|
27.4
|
235.64
|
|
alpha-cellulose
|
0
|
0
|
0
|
6
|
240
|
0
|
0
|
0
|
0
|
|
Prémix minéral
|
0
|
0
|
0
|
1
|
40
|
0
|
0
|
0
|
0
|
|
Prémix vitaminé
|
0
|
0
|
0
|
1
|
40
|
0
|
0
|
0
|
0
|
|
CMC
|
0
|
0
|
0
|
2
|
80
|
0
|
0
|
0
|
0
|
|
BHA
|
|
|
|
1
|
40
|
|
|
|
|
|
BHT
|
0
|
0
|
0
|
1
|
40
|
0
|
0
|
0
|
0
|
|
Attractant, bétaïne
|
0
|
0
|
0
|
1
|
40
|
0
|
0
|
0
|
0
|
|
Total
|
|
|
|
100.0
|
4000.0
|
45.02
|
9.96
|
28.80
|
1540.01
|


« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
I
Annexe 2: Taux d'oeuf oeillés (Taux de
fécondation)
Traitement (Incubation SVP 1) (Incubation SVP 2)
(incubation sans SVP 1) (incubation sans SVP 1)
Taux 85% 88% 90% 92%
Annexe 3: Prise des poids (gramme) hebdomadaire
après la mise en charge
|
Date
|
Incubation SVP 1 (0.4ml/l)
|
Incubation SVP 2 (0.8ml/l)
|
Bain SVP 1 (0.4ml/l)
|
Bain SVP 2 (0.8ml/l)
|
Aliment SVP
|
Témoin
|
|
50 ind.
|
500 ind.
|
1 ind.
|
50 ind.
|
500 ind.
|
1 ind.
|
50 ind.
|
500 ind.
|
1 ind.
|
50 ind.
|
500 ind.
|
1 ind.
|
50 ind.
|
500 ind.
|
1 ind.
|
50 ind.
|
500 ind.
|
1 ind.
|
|
6/23/2015
|
1.1233
|
11.233
|
0.022
|
0.3455
|
3.455
|
0.007
|
1.52
|
15.2
|
0.03
|
1.17
|
11.7
|
0.023
|
1.25
|
12.5
|
0.025
|
1.1817
|
11.817
|
0.024
|
|
6/30/2015
|
12.549
|
125.49
|
0.251
|
9.944
|
99.44
|
0.199
|
13.24
|
132.4
|
0.265
|
12.39
|
123.9
|
0.248
|
12.67
|
126.7
|
0.253
|
12.092
|
120.92
|
0.242
|
|
7/7/2015
|
14.127
|
141.27
|
0.283
|
12.795
|
127.95
|
0.256
|
18.61
|
186.1
|
0.372
|
15.08
|
150.8
|
0.302
|
15.48
|
154.8
|
0.31
|
14.269
|
142.69
|
0.285
|
|
13/7/2015
|
19.623
|
196.23
|
0.392
|
15.423
|
154.23
|
0.308
|
23.52
|
235.2
|
0.47
|
18.42
|
184.2
|
0.368
|
16.22
|
162.2
|
0.324
|
17.003
|
170.03
|
0.340
|
« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de décomposition de viande de porc par
II
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015
« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015
III
Annexe 4: Paramètres physique (Oxygène et
température) enregistrés au cours de l'étude
|
Date
|
Incubation SVP 1 (0.4ml/l)
|
Incubation SVP 2 (0.8ml/l)
|
Bain SVP 1 (0.4ml/l)
|
Bain SVP 2 (0.8ml/l)
|
Aliment SVP
|
Témoin
|
|
Paramètres
|
température
|
Oxygène
|
température
|
Oxygène
|
température
|
Oxygène
|
température
|
Oxygène
|
température
|
Oxygène
|
température
|
Oxygène
|
|
6/3/2015
|
22.5
|
|
22.5
|
|
22.4
|
|
22.6
|
|
|
|
|
|
|
6/4/2015
|
21.9
|
7.6
|
22
|
7.4
|
22.2
|
7.4
|
21.9
|
7.8
|
|
|
|
|
|
6/5/2015
|
23.3
|
7
|
24
|
7.5
|
23.5
|
7.3
|
23.4
|
7.7
|
|
|
|
|
|
6/6/2015
|
23.9
|
7
|
23
|
7.1
|
23.9
|
7.4
|
23.7
|
7.4
|
|
|
|
|
|
6/7/2015
|
23.3
|
7.3
|
22.9
|
7.4
|
22.9
|
6.5
|
23.2
|
7.1
|
|
|
|
|
|
6/8/2015
|
23.2
|
7.5
|
22.7
|
7.5
|
23.3
|
7.7
|
23.1
|
8
|
|
|
|
|
|
6/9/2015
|
22.4
|
7.7
|
22.7
|
7.5
|
22.4
|
7.1
|
22.3
|
8.2
|
22.8
|
7.6
|
23.5
|
7.4
|
|
6/10/2015
|
22.7
|
8.2
|
22.7
|
8
|
22.7
|
8.4
|
22.7
|
8.5
|
22.5
|
8
|
22.7
|
8.5
|
|
6/11/2015
|
22.8
|
7.5
|
23
|
7.2
|
22.6
|
7.5
|
22.6
|
7.9
|
22.5
|
8.3
|
22.6
|
7.7
|
|
6/12/2015
|
23.2
|
7.5
|
23.3
|
7.3
|
23.1
|
7.8
|
23.1
|
7.7
|
22.6
|
7.8
|
23.1
|
7.4
|
|
6/13/2015
|
23.6
|
7.2
|
23.6
|
7.4
|
23.5
|
7.6
|
23.5
|
7.3
|
23
|
7.4
|
23.5
|
7.6
|
|
6/14/2015
|
22.7
|
7.5
|
23
|
7.5
|
22.7
|
7.7
|
22.8
|
7.2
|
23.4
|
7.2
|
22.8
|
7.4
|
|
6/15/2015
|
23.1
|
7.2
|
23.2
|
7.2
|
23
|
7.7
|
23
|
7.2
|
22.8
|
7.3
|
23.1
|
7.5
|
|
6/16/2015
|
22.1
|
8.2
|
22.5
|
7.8
|
22.2
|
7.9
|
22.4
|
7.4
|
22.9
|
7.6
|
22.3
|
7.7
|
|
6/17/2015
|
21.8
|
8.1
|
22.3
|
7.7
|
22.1
|
8
|
22.1
|
7.5
|
22.3
|
7.6
|
21.7
|
7.7
|
|
6/18/2015
|
22
|
7.9
|
22.5
|
7.4
|
22.2
|
8
|
22.1
|
7.3
|
22.1
|
7.7
|
22.1
|
7.5
|
|
6/19/2015
|
21
|
7.2
|
22.5
|
7.3
|
21.1
|
7.9
|
21
|
7.4
|
22.3
|
7.5
|
22.4
|
7.4
|
|
6/20/2015
|
22
|
7.1
|
21.1
|
7
|
21.8
|
7.3
|
20.9
|
7.7
|
20.9
|
7.8
|
21.4
|
7.5
|
|
6/21/2015
|
21.9
|
7.5
|
21.8
|
7.4
|
21.5
|
7.8
|
21.8
|
7.7
|
21.8
|
7.7
|
22
|
7.4
|
|
6/22/2015
|
21.5
|
7.2
|
21.6
|
7.4
|
21.1
|
7.8
|
21.3
|
7.4
|
21.3
|
7.6
|
21.6
|
7.6
|
|
6/23/2015
|
21
|
7.3
|
21.1
|
7.5
|
22.1
|
7.9
|
21
|
7.6
|
20.9
|
7.5
|
20.9
|
7.3
|
|
6/24/2015
|
21.9
|
7.4
|
22
|
7.3
|
22
|
7.9
|
21.9
|
7.5
|
20.9
|
7.7
|
21.9
|
7.6
|
|
6/25/2015
|
22
|
7.4
|
22
|
7.2
|
22
|
7.8
|
22
|
7.5
|
22
|
7.7
|
22
|
7.5
|
|
6/26/2015
|
20.2
|
6.7
|
20.2
|
7.1
|
20.2
|
7.4
|
20.2
|
7.8
|
20.2
|
7.5
|
20.3
|
7.3
|
|
6/27/2015
|
20.9
|
7.2
|
21.7
|
7
|
20.8
|
7.5
|
21
|
7.7
|
21
|
7.5
|
20.9
|
7.3
|
|
6/28/2015
|
20.6
|
7.4
|
20.7
|
7.2
|
20.5
|
7.4
|
20.7
|
7.6
|
20.7
|
7.8
|
20.7
|
7.2
|
« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de décomposition de viande de porc par
imprégnation des oeufs et des larves
», Ulg/Septembre 2015
IV
6/29/2015
|
20.8
|
7.6
|
20.8
|
8
|
20.8
|
7.6
|
20.8
|
7.7
|
20.9
|
7.9
|
20.8
|
7.6
|
|
6/30/2015
|
20.4
|
7.7
|
20.4
|
7.7
|
20.3
|
7.4
|
20.4
|
7.7
|
20.6
|
7.6
|
20.5
|
7.2
|
|
7/1/2015
|
20.7
|
7.7
|
20.7
|
7.9
|
20.5
|
7.2
|
20.6
|
7.6
|
20.7
|
6.9
|
20.6
|
6.8
|
|
7/2/2015
|
22.1
|
6.6
|
22.1
|
7.7
|
21.7
|
7.1
|
21.9
|
6.9
|
22
|
6.8
|
21.8
|
6.7
|
|
7/3/2015
|
21.5
|
7.7
|
21.7
|
7.8
|
21.2
|
7.5
|
21.3
|
7.6
|
21.4
|
7.4
|
21.3
|
6.9
|
|
7/4/2015
|
21.6
|
7.2
|
21.8
|
7.3
|
21.4
|
7.1
|
21.7
|
7
|
21.8
|
7
|
21.9
|
6.6
|
|
7/5/2015
|
21.2
|
7.1
|
21.4
|
7.4
|
21.1
|
7.2
|
21.3
|
7.3
|
21.4
|
7.2
|
21.3
|
7.2
|
|
7/6/2015
|
20.4
|
7.3
|
20.5
|
7.6
|
20.4
|
7.1
|
20.5
|
7.4
|
20.6
|
7
|
20.5
|
7.6
|
|
7/7/2015
|
20.5
|
7
|
20.6
|
7.5
|
20.5
|
7.4
|
20.6
|
7
|
20.6
|
7.1
|
20.7
|
7
|
|
7/8/2015
|
20.3
|
8
|
20.3
|
8
|
20.3
|
7.6
|
20.3
|
8.2
|
20.4
|
8
|
20.4
|
7.7
|
|
7/9/2015
|
20.3
|
8.2
|
20.2
|
8.3
|
20.1
|
7.4
|
20.2
|
7.9
|
20.3
|
8.2
|
20.2
|
7.3
|
|
7/10/2015
|
20.3
|
8.3
|
20.2
|
8.3
|
20.2
|
7.5
|
20.3
|
8
|
20.4
|
8.3
|
20.4
|
7.2
|
|
7/11/2015
|
20.4
|
8.1
|
20.3
|
8.3
|
20.2
|
7.6
|
20.3
|
8.1
|
20.4
|
8.1
|
20.3
|
7.1
|
|
7/12/2015
|
20.7
|
8
|
20.7
|
7.8
|
20.7
|
7.3
|
20.7
|
8
|
20.7
|
7.5
|
21
|
7
|
|
7/13/2015
|
21.3
|
8
|
21.3
|
7.8
|
21.3
|
7.3
|
21.3
|
7.7
|
21.3
|
7.6
|
21.9
|
7.6
|
|
7/14/2015
|
|
|
|
|
|
|
|
|
|
|
|
|

Tableau 2: Analyses statistique (Student) du taux de
fécondation pour le lot éclos à la solution de viande de
porc et sans la solution de viande de porc
Tableau 3: Les taux de fécondation
enregistrés
(Incubation SVP) (Incubation sans SVP)
Bouteille 1 85% 90%
Bouteille 2 88% 92%
Tableau 4: Test de student pour le taux de
fécondation
|
Test-t: Deux échantillons
indépendants
|
|
Bouteille 1
|
Bouteille 2
|
|
Moyennes
|
0.865
|
0.91
|
|
Variances
|
0.00045
|
0.0002
|
|
Observations
|
2
|
2
|
|
Degré de liberté
|
2
|
|
|
t (calculée)
|
-2.49615
|
|
|
P (p-value)
|
0.129937
|
|
|
t (critique)
|
4.302653
|
|
Annexe 5: Analyses statistiques (ANOVA) pour la
croissance des différents lots Tableau 5: Sommaire des données
sur les croissances enregistrées au cours de
l'étude
|
Sommaire des données sur les croissances
enregistrées au cours de l'étude
|
|
variables
|
Nbre d'observation
|
Somme
|
moyenne
|
Variance
|
|
Incubation 1
|
4
|
0.9484
|
0.237
|
0.0242
|
|
Incubation 2
|
4
|
0.7702
|
0.193
|
0.0173
|
|
Bain 1
|
4
|
1.1379
|
0.284
|
0.0357
|
|
Bain 2
|
4
|
0.9412
|
0.235
|
0.0224
|
|
Nourrissage
|
4
|
0.9172
|
0.229
|
0.0195
|
|
Témoin
|
4
|
0.8909
|
0.223
|
0.0192
|
Tableau 6: ANOVA de Fischer pour les croissances
enregistrées
|
ANOVA
|
|
Source de variation
|
SC
|
dl
|
CM
|
F (calculée)
|
P-value
|
F (théorique)
|
|
Entre groupe (Factorielle)
|
0.0177
|
5
|
0.004
|
0.1536
|
0.9762
|
2.773
|
|
Erreur (Résiduelle)
|
0.4152
|
18
|
0.023
|
|
|
|
|
Totale
|
0.4329
|
23
|
|
|
|
|
Annexe 6: Analyses statistiques (Student) pour les
différents déplacements vers les deux compartiments où les
solutions sont versées
Tableau 7: Les déplacements enregistrés
pour incubation dose 0,4ml/l
|
Incubation à la solution de viande de porc dose 1
(0,4ml/l)
|
|
Test
|
Eau
|
SVP
|
Pas d'entrée
|
|
1
|
1
|
1
|
8
|
|
2
|
2
|
1
|
7
|
|
3
|
2
|
0
|
8
|

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
V

Tableau 8: Test de Wilcoxon pour échantillons
appariés pour les déplacements pour incubation dose 0,4ml/l (dose
1)
|
Test de Wilcoxon pour Ech. Appariés
(Données déplacements pour incubation dose
|
|
Couples de
|
0,4ml/l (dose 1)) Tests significatifs
marqués à p <.05000
|
|
variables
|
N Actifs
|
T
|
Z
|
valeur p
|
|
Eau & SVP
|
3
|
0.00
|
1.603567
|
0.108810
|
Tableau 9: Les déplacements enregistrés
pour incubation dose 0,8ml/l
|
incubation à la solution de viande de porc dose 2
(0,8ml/l)
|
|
Test
|
Eau
|
SVP
|
Pas d'entrée
|
|
1
|
3
|
3
|
4
|
|
2
|
4
|
1
|
5
|
|
3
|
5
|
3
|
2
|
|
4
|
3
|
5
|
2
|
|
Total
|
15
|
12
|
13
|
Tableau 10: Test de Wilcoxon pour échantillons
appariés pour les déplacements pour incubation dose
0,8ml/l
|
Test de Wilcoxon pour Ech. Appariés
(Données déplacements pour incubation dose
|
|
Couples de
|
0,8ml/l (dose 2)) Tests significatifs
marqués à p <.05000
|
|
variables
|
N Actifs
|
T
|
Z
|
valeur p
|
|
Eau & SVP
|
3
|
1.500000
|
0.801784
|
0.422679
|
Tableau 11: Les déplacements
enregistrés pour les dose 0,4ml/l
|
Bain à la solution de viande de porc dose 1
(0,4ml/l)
|
|
Test
|
Eau
|
SVP
|
Pas d'entrée
|
|
1
|
2
|
6
|
2
|
|
2
|
1
|
4
|
5
|
|
3
|
5
|
5
|
2
|
|
4
|
3
|
4
|
3
|
|
Total
|
11
|
19
|
12
|
Tableau 12: Test de Wilcoxon pour échantillons
appariés pour les déplacements pour Bain dose
0,4ml/l
|
Test de Wilcoxon pour Ech. Appariés
(Données déplacements pour bain dose 0,4ml/l
|
|
Couples de
|
(dose 1)) Tests significatifs marqués
à p <.05000
|
|
variables
|
N Actifs
|
T
|
Z
|
valeur p
|
|
Eau & SVP
|
3
|
0.00
|
1.603567
|
0.108810
|
Tableau 13: Les déplacements
enregistrés pour les dose 0,8ml/l
|
Bain à la solution de viande de porc dose 2
(0,8ml/l)
|
|
Test
|
Eau
|
SVP
|
Pas d'entrée
|
|
1
|
2
|
1
|
7
|
|
2
|
0
|
1
|
9
|
|
3
|
1
|
1
|
8
|
|
4
|
1
|
3
|
6
|
|
Total
|
4
|
6
|
30
|

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 VI

Tableau 14: Test de Wilcoxon pour échantillons
appariés pour les déplacements pour Bain dose
0,8ml/l
|
Test de Wilcoxon pour Ech. Appariés
(Données déplacements pour bain dose 0,8ml/l
|
|
Couples de variables
|
(dose 1)) Tests significatifs marqués
à p <.05000
|
|
N Actifs
|
T
|
Z
|
valeur p
|
|
Eau & SVP
|
3
|
1.500000
|
0.801784
|
0.422679
|
Tableau 15: Les déplacements
enregistrés pour le lot nourrissage à l'aliment
SVP
|
Nourrissage à l'aliment
imprégné à la solution de viande de porc
|
|
Test
|
Eau
|
SVP
|
Pas d'entrée
|
|
1
|
0
|
0
|
10
|
|
2
|
2
|
1
|
7
|
|
3
|
0
|
0
|
10
|
|
4
|
3
|
5
|
2
|
|
Total
|
5
|
6
|
29
|
Tableau 16: Test de Wilcoxon pour échantillons
appariés pour les déplacements pour les ASVP
|
Test de Wilcoxon pour Ech. Appariés
(Données déplacement pour nourrissage à
|
|
Couples de variables
|
l'aliment à la SVP)) Tests significatifs
marqués à p <.05000
|
|
N Actifs
|
T
|
Z
|
valeur p
|
|
Eau & SVP
|
2
|
1.000000
|
0.447214
|
0.654721
|
Tableau 17: Les déplacements
enregistrés pour les Témoins (control)
|
Témoin (Control)
|
|
Test
|
Eau
|
SVP
|
Pas d'entrée
|
|
1
|
5
|
1
|
4
|
|
2
|
7
|
1
|
2
|
|
3
|
4
|
3
|
3
|
|
4
|
6
|
3
|
1
|
|
Total
|
22
|
8
|
10
|
Tableau 18: Test de Wilcoxon pour échantillons
appariés pour les déplacements des
témoins
|
Test de Wilcoxon pour Ech. Appariés
(Données déplacement (témoin))
|
|
Couples de variables
|
Tests significatifs marqués à p
<.05000
|
|
N Actifs
|
T
|
Z
|
valeur p
|
|
Eau & SVP
|
4
|
0.00
|
1.825742
|
0.067890
|
Annexe 7: Analyses statistiques (Student) pour les
différents temps moyens passés près des deux compartiments
où les solutions sont versées
Tableau 19: Les temps moyens passés à
proximité des 2 compartiments enregistrés pour incubation dose
0,4ml/l
|
incubation à la solution de viande de porc dose 1
(0,4ml/l)
|
|
Test
|
Eau
|
SVP
|
Pas d'entrée
|
|
1
|
70
|
35
|
495
|
|
2
|
65
|
25
|
510
|
|
3
|
50
|
35
|
515
|
|
4
|
45
|
13
|
542
|
|
Total
|
230
|
108
|
2062
|

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves »,
Ulg/Septembre 2015 VII

Tableau 20: Test-t pour échantillons
appariés pour les temps moyens passés à proximité
des 2 compartiments enregistrés pour incubation à la SVP dose 1
(0,4ml/l)
|
|
|
|
Différences significatives marquées à
p < .05000
|
Test t pour des Echantillons Appariés
(Données temps.xlsx (E5:H8))
|
|
|
|
|
|
|
|
Moyenne
|
Ec-Type
|
N
|
Différ.
|
Ec-Type
|
t
|
dl
|
p
|
Confiance
|
|
|
Variable
|
|
|
|
|
Différ.
|
|
|
|
-95.000%
|
|
Confiance
+95.000%
Eau
57.50000
11.90238
SVP
27.00000
10.45626
4
30.50000
10.84743
5.623454
3
0.011120
13.23932
47.76068
Tableau 21: Les temps moyens passés à
proximité des compartiments enregistrés pour incubation dose
0,8ml/l
|
incubation à la solution de viande de porc dose 2
(0,8ml/l)
|
|
Test
|
Eau
|
SVP
|
Pas d'entrée
|
|
1
|
45
|
132
|
423
|
|
2
|
132
|
15
|
452
|
|
3
|
153
|
25
|
422
|
|
4
|
0
|
74
|
426
|
|
Total
|
330
|
246
|
1723
|
Tableau 22: Test-t pour échantillons
appariés pour les temps moyens passés à proximité
des 2 compartiments enregistrés pour incubation à la solution de
SVP dose 2 (0,8ml/l)
|
Test t pour des Echantillons Appariés (Données
temps.xlsx (D4:G7))
|
|
Moyenne
|
Ec-Type
|
Différences significatives marquées à
p < .05000
N
|
Différ.
|
Ec-Type
|
t
|
dl
|
p
|
Confiance
|
Confiance
|
|
Variable
|
|
|
|
|
Différ.
|
|
|
|
-95.000%
|
+95.000%
|
|
Eau
|
82.50000
|
|
|
|
|
|
|
|
|
|
72.18726
SVP
61.50000
53.60659
4
21.00000
117.4081
0.357727
3
0.744236
-165.823
207.8225
Tableau 23: Les temps moyens passés à
proximité des compartiments enregistrés pour bain dose 1
(0,4ml/l)
|
Bain à la solution de viande de porc dose 1
(0,4ml/l)
|
|
Test
|
Eau
|
SVP
|
Pas d'entrée
|
|
1
|
67
|
373
|
150
|
|
2
|
130
|
93
|
373
|
|
3
|
44
|
98
|
458
|
|
4
|
39
|
53
|
508
|
|
Total
|
280
|
617
|
1489
|
Tableau 24: Test-t pour échantillons
appariés pour les temps moyens passés à proximité
des 2 compartiments enregistrés pour bain à la solution de viande
de porc dose 1 (0,4ml/l)
|
Variable
|
Test t pour des Echantillons Appariés (Données
temps.xlsx (D4:G7))
Différences significatives marquées à
p < .05000
|
|
Moyenne
|
Ec-Type
|
N
|
Différ.
|
Ec-Type
Différ.
|
t
|
dl
|
p
|
Confiance
-95.000%
|
Confiance
+95.000%
|
|
Eau
|
70.0000
|
41.8171
|
|
|
|
|
|
|
|
|
|
SVP
|
154.2500
|
147.2172
|
4
|
-84.2500
|
152.4519
|
-1.10527
|
3
|
0.349723
|
-326.835
|
158.3350
|

« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
VIII

Tableau 25: Les temps moyens passés à
proximité des compartiments enregistrés pour bain dose 2
(0,8ml/l)
|
Bain à la solution de viande de porc dose 2
(0,8ml/l)
|
|
Test
|
Eau
|
SVP
|
Pas d'entrée
|
|
1
|
55
|
30
|
515
|
|
2
|
35
|
35
|
530
|
|
3
|
76
|
48
|
466
|
|
4
|
38
|
61
|
501
|
|
Total
|
204
|
174
|
2012
|
Tableau 26: Test-t pour échantillons
appariés pour les temps moyens passés à proximité
des 2 compartiments enregistrés pour bain à la solution de viande
de porc dose 2 (0,8ml/l)
|
|
|
|
Différences significatives marquées à
p < .05000
|
Test t pour des Echantillons Appariés
(Données temps.xlsx (D4:G7))
|
|
|
|
|
|
|
|
Moyenne
|
Ec-Type
|
N
|
Différ.
|
Ec-Type
|
t
|
dl
|
p
|
Confiance
|
Confiance
|
|
Variable
|
|
|
|
|
Différ.
|
|
|
|
-95.000%
|
|
+95.000%
Eau
51.00000
18.85029
SVP
43.50000
13.91642
4
7.500000
23.89561
0.627730
3
0.574712
-30.5232
45.52324
Tableau 27: Les temps moyens passés à
proximité des compartiments enregistrés pour nourrissage à
l'aliment à la
SVP
|
Aliment à la solution de viande de
porc
|
|
Test
|
Eau
|
SVP
|
Pas d'entrée
|
|
1
|
7
|
20
|
573
|
|
2
|
88
|
0
|
512
|
|
3
|
15
|
23
|
562
|
|
4
|
75
|
155
|
370
|
|
Total
|
185
|
198
|
2017
|
Tableau 28: Test-t pour échantillons
appariés pour les temps moyens passés à proximité
des 2 compartiments enregistrés pour nourrissage à l'aliment
à la SVP
|
Test t pour des Echantillons Appariés (Données
temps.xlsx (D4:G7))
|
|
Moyenne
|
Ec-Type
|
Différences significatives marquées à
p < .05000
N
|
Différ.
|
Ec-Type
|
t
|
dl
|
p
|
Confiance
|
Confiance
|
|
Variable
|
|
|
|
|
Différ.
|
|
|
|
-95.000%
|
+95.000%
|
|
Eau
|
51.00000
|
18.85029
|
|
|
|
|
|
|
|
|
Tableau 29: Les temps moyens passés à
proximité des compartiments enregistrés pour les
témoins
|
Témoin (Control)
|
|
Test
|
Eau
|
SVP
|
Pas d'entrée
|
|
1
|
115
|
25
|
460
|
|
2
|
110
|
35
|
455
|
|
3
|
63
|
110
|
427
|
|
4
|
20
|
540
|
40
|
|
Total
|
308
|
710
|
1382
|

45.52324
« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
IX
Tableau 30: Test-t pour échantillons
appariés pour les temps moyens passés à proximité
des 2 compartiments enregistrés pour les témoins
(Control)
|
|
|
|
Différences significatives marquées à
p < .05000
|
Test t pour des Echantillons Appariés
(Données temps.xlsx (D4:G7))
|
|
|
|
|
|
|
|
Moyenne
|
Ec-Type
|
N
|
Différ.
|
Ec-Type
|
t
|
dl
|
p
|
Confiance
|
|
|
Variable
|
|
|
|
|
Différ.
|
|
|
|
-95.000%
|
|
Eau
77.0000
44.6393
SVP
177.5000
244.6256
4
-100.500
286.3174
-0.702018
3
0.533232
-556.095
Tableau 31: Comparaison de tous les traitements pris
ensemble, test de Friedman
|
Milieu
|
Traitement
|
Variable
|
Moyenne
|
Tps
|
|
1
|
ASVP
|
Eau
|
2.00
|
46.25
|
|
2
|
ASVP
|
SVP
|
5.50
|
49.50
|
|
3
|
BSVP 1
|
Eau
|
3.00
|
70.00
|
|
4
|
BSVP 1
|
SVP
|
3.75
|
154.25
|
|
5
|
BSVP 2
|
Eau
|
0.75
|
51.00
|
|
6
|
BSVP 2
|
SVP
|
2.25
|
43.50
|
|
7
|
ESVP 1
|
Eau
|
1.50
|
57.50
|
|
8
|
ESVP 1
|
SVP
|
1.00
|
27.00
|
|
9
|
ESVP 2
|
Eau
|
4.75
|
82.50
|
|
10
|
ESVP 2
|
SVP
|
2.75
|
61.50
|
|
11
|
Témoin
|
Eau
|
1.50
|
46.25
|
|
12
|
Témoin
|
SVP
|
1.25
|
49.50
|
|
friedman. Test
|
|
Friedman rank sum test
|
|
Friedman chi-squared = 7.8986, df = 5,
p-value = 0.1619 => NS
|


Confiance
+95.000%
355.0949
« Conditionnement de carpes communes (Cyprinus
carpio) à la détection olfactive des composés
aromatiques de
décomposition de viande de porc par
imprégnation des oeufs et des larves », Ulg/Septembre 2015
X
| 


