Remerciement.
Nous exprimons nos respectueux remerciement à Melle
F. Baghdadi de nous avoir fais confiance et accepté de
travailler avec nous sur ce thème, pour son soutient et ses conseils.
On remercie Mme Meddah d'avoir accepté de
présider le jury de soutenance.
Nos remerciements s'adressent également à
Mme D. Lakhdar, Mme N.
Benouaz, Mme W. Moumen respectivement pour accepter
d'examiner ce travail en l'enrichissant par leurs critiques.
On exprime toute notre gratitude à Dr
Benhaouia médecin spécialiste en
diabétologie et on tien à la remercier pour nous avoir
accepté dans son service, pour sa disponibilité et pour son
soutien. Ainsi que tous les infirmiers des services, médecine interne,
ophtalmologie et pneumologie qui nous ont facilité la tâche.
Un merci tous spécial à Dr B.
Benaricha (département d'agronomie) pour ses conseils.
On exprime nos respectueux remerciements à Mr
Khadar M. pour son aide et sa disponibilité pour
l'étude statistique.
On remercie vivement les ingénieurs de laboratoire tronc
commun, Mr Jaafri, Mr Benfata, Melle
Hafida, Melle Hanane.
Nous exprimons également notre profonde gratitude pour les
personnes ayant contribuées de prés ou de loin à la
réalisation de ce travail.
RésuméL'age
biologique est le reflet du fonctionnement physiologique de nos organes, il
reflète l'état fonctionnel exact de l'individu. La mesure de
l'âge biologique est un processus multifactoriel, elle constitue en une
évaluation quantitative de plusieurs paramètres qui vont servir
à déterminer la compétence fonctionnelle des organes
testés. Ainsi on utilise une équation à régression
multiple permettant de prédire l'age à partir de scores
établis sur de nombreux tests (hémoglobine, albumine, rapport
(albumine /globine), cholestérol, urée, TGP, glycémie
à 60 min après ingestion de glucose, acuité visuelle,
fréquence cardiaque de repos, capacité vitale forcée,
pression artérielle systolique, âge chronologique).
Les résultats obtenus d'après la mesure de l'age
biologique des diabétiques et des insuffisants rénaux ont
démontré que ces pathologies favorisent et
accélèrent le vieillissement. On a trouvé que l'age
biologique des insuffisants rénaux a augmenté de 25.48% par
rapport a leur âge chronologique, celui des diabétiques a
augmenté de 14.65%. Ainsi l'insuffisance rénale chronique et le
diabéte ont provoqués des effets délétères
du a la survenue d'un stress oxydant pernicieux pour la performance
physiologique des malades.
Les maladies, les facteurs socioculturels, économiques,
anthropométriques (obésité),
hygiéno-diététiques ont une très grande influence
sur l'age biologique. Ainsi l'age biologique des sujets sains, sportifs, non
fumeurs a diminué de 2.21% par rapport à leur âge
chronologique.
Mots dles : âge biologique ;
âge chronologique ; vieillissement ; diabète ; insuffisance
rénale chronique ; obésité.
Summery
The biological age is the reflection of the physiological
operation of our bodies; it reflects the exact functional state of the
individual. The measurement of the biological age is a process multifactoriel,
it constitutes in a quantitative evaluation several parameters which will use
to determine the functional competence of the bodies tested. Thus one uses an
equation
with multiple regression allowing to predict the age starting
from scores established on many tests (haemoglobin, albumin, ratio
(albumin/globins), cholesterol, urea, TGP, glycemia with 60 min after ingestion
of glucose, vision, heart rate of rest, forced vital capacity, systolic blood
pressure, chronological age).
The results obtained according to the measurement of the
biological age of diabetic and insufficient renal showed that these pathologies
support and accelerate ageing. One found that the biological age of
insufficient renal increased by 25.48% compared to their chronological age,
that of diabetic increased by 14.65%.Thus the chronic renal insufficiency and
diabetes caused noxious effects it has occurred of a pernicious oxidative
stress for the performance physiological of the patients.
The diseases, the factors socio-cultural, economic,
anthropometric (obesity), hygiénodietetic have a very great influence on
the biological age. Thus the biological age of the subjects healthy, sporting,
not smokers decreased by 2.21% compared to their chronological age.
Key words: biological age; chronological
age; ageing; diabetes; chronic renal insufficiency; obesity.
I
Table des Matières
Liste des figures IV
Liste des tableaux VI
Liste d'abréviation VII
Introduction générale 01
LA pARTie 0 d 0 Evue BiBLioGRApHiQue
CHApiTRe 0
d GENERALiTEs GERoNToLoGiQuEs
I.1.Vieillissement des organes et
fonctions~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~.~ 02
I.1.1. Vieillissement des tissus
conjonctif~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~.~ 03
I.1.1.1. La matrice
extracellulaire~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ ~ 03
I.1.1.2. vieillissement et programme de synthèse de la
matrice extra cellulaire~~~~~~~~~ 03
I.1.1.3.Vieillissement du
collagène~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~.~ 04
I.1.1.4. Vieillissement des fibres
élastique~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 04
- Tissu conjonctif et vieillissement de la
peau~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 04
I.1.2.Vieillissement des
organes~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~. 06
I.1.2.1. Fibrose sclérose et
vieillissement~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 06
I.1.2.2. Vieillissement des cellules parenchymateuses des
organes~~~~~~~~~~~~~~~~~.~ 06
I.1.2.3. Tous les organes ne
vieillissent pas à la même vitesse~~~~~~~~~~~~~~~~~~~~.~~
07
I.1.3. Vieillissement cardiovasculaire 08
I.1.4. Vieillissement de l'appareil respiratoire 12
I.1.5. Vieillissement du système nerveux 14
I.1.6. - Vieillissement de l'appareil locomoteur 12
I.1.7. Vieillissement du métabolisme 14
I.1.8. Vieillissement des organes des sens 14
A- Vision 15
B- Audition 17
I.1.9. Vieillissement de l'appareil urinaire 17
I.2. Le vieillissement cellulaire 17
I.2.1. Rappel de la cellule 17
I.2.2. Les Deux hypothèses du vieillissement 18
I.2. 2.1. Hypothèse génétique 18
I.2.2.1.1. Programmation génétique 19
I.2.2.1.2 - altération de l'ADN 20
- Les lésions de l'ADN 21


Lésions spontanées de l'ADN 21
Lésions induites de l'ADN 22
- Mécanisme de réparation de l'ADN

Réparation de l'ADN et sénescence 26
ADN mitochondrial et vieillissement 26
I.2.2.1.2 - Différents types de cellules 26
I.2.2.1.3 - Les télomères et les
télométrases 29
I.2.2.1.4 - Les conséquences de l'altération de
l'ADN 29
1.2.2.2- Hypothèse somatique 29
1.2.2.2.1- Radicaux libres et stress oxydatif 30
- Radicaux super oxydes (O2°-) 32
- Radicaux hydroxyles le OH° 32
- Monoxyde d'azote NO 33
-Composé oxygéné non radicalaire 33
- Acide hypochloreux HOCL 33
- Peroxyde d'hydrogène H2O2 36
- Peroxynitrite ONOO- 36
1.2.2.2.1.1. Les systèmes de défense anti-oxydants
38
1.2.2.1.2. Système enzymatique 39
1.2.2.2.1.3. Système non enzymatique 40
1.2.2.2.1.4. Oxydation des molécules biologiques 40
> oxydation des lipides 40
> Oxydation du cholestérol 41
> Oxydation des phospholipides 41
> Oxydation des protéines et acides aminés 41
> Oxydation des acides nucléiques 43
I.2.2.2.2- Glycation non enzymatique des protéines 44
I.2.3. Eco gérontologie « facteur environnementaux
» 44
Chapitre II : - Relation entre diabète, insuffisance
rénal et vieillissement. r
- âge biologique.
II.1. Effet du diabète sur le vieillissement corporel
48
II.1.1. Diabète et vieillissement de la matrice
extracellulaire 50
II.1.2. Complication du diabète 51
II.1.2.1. Complications macro vasculaires « macro
angiopathies » 52
II.1.2.2. Complication micro vasculaire (micro angiopathie) 52
II.1.2.3. Diabète et production de radicaux libres 52
II.1.2.4. Activation de la voie des polyols 54
II.1.2.5. Activation de la formation des AGE 54
> Glycation et glycoxydation
> Mécanisme réactionnel de la glycoxydation
> Récepteurs des protéines glyquées et
des produits avancés de glycation 56
> Produit de glycoxydation et fonctions cellulaires 56
II.2. Insuffisance rénale chronique (IRC) et
vieillissement 56
II.3. Stratégie pour ralentir le vieillissement 57
III. Age biologique 58
III.1. Les critères de choix de paramètres de
mesure de l'âge biologique 58
III.2. Intérêt de mesure de l'âge biologique
58
PARTIE EXPERIMENTALE.
Matériels et méthodes
III.1.Objectif 60
III.2. Le protocole d'étude 60
III.3. matériels 61
III.4. Méthode de travail 61
A. La mesure de l'âge biologique 63
1) Tests cliniques 64
2) Test biologique -- les dosages biochimiques-
2.1. Le prélèvement du sang 65
1. Dosage du glucose 65
2- Dosage de cholestérol total 65
3- Dosage de l'albumine 65
4- dosage des protides totaux 66
5- dosage de l'urée 67
6- dosage de TGP 67
7- dosage de l'hémoglobine 68
Résultat et discutions 69
1. Résultat de l'étude clinique 70
1.1. La pression artérielle systolique 73
1.2. La fréquence cardiaque de repos (FCR) 73
1.3. La capacité vitale forcée (CVF) 73
1.4. L'acuité visuelle 75
2. Les résultats des dosages biochimiques 76
2.1. Le taux de cholestérol, d'hémoglobine, de
l'urée et de glycémie 78
2.1. Le taux de cholestérol, d'hémoglobine, de
l'urée et de glycémie 86
2.3. Le TGP
2.4. Rapport albumine/ globine
3. Résultat de l'âge biologique
· Conclusion
· Référence bibliographique
· Annexe
Rappel
bibliographique
INTRODUCTION:
L'âge biologique ou physiologique est une notion
relative au vieillissement du corps humain, qui contrôle l'aspect
médical ou biologique de l'individu. C'est un processus multifactoriel,
qui permet l'évaluation quantitative de plusieurs paramètres qui
vont servir à déterminer la compétence physiologique de
l'organisme.
L'age biologique ainsi déterminé évolue de
façon différente de l'âge chronologique, il peut être
diminué ou augmenter selon différents facteurs qui influencent le
vieillissement.
L'age biologique est le reflet de l'état physiologique
ou fonctionnel exact d'un individu, alors que l'âge chronologique ne
reflète qu'une partie du vieillissement personnel. Un certain nombre de
tests biochimiques et biologiques permettent d'évaluer l'âge des
individus à la fois fonctionnellement et biologiquement.
Depuis longtemps, on considère l'âge comme un
facteur de risque dans différentes maladies; telles que l'augmentation
de la cholestérolémie, le diabète, la surcharge
pondérale, l'insuffisance rénale etc., qui sont des maladies
corrélatives avec l'âge. Le déclin dans les
fonctions des organes, dus aux détériorations
rapportées au niveau de leurs cellules ainsi qu'àleurs
échelles moléculaires commence en troisième âge. Le
système de défenses est faiblesse ce qui favorise l'apparition de
ces maladies surtout les maladies métaboliques.
En revanche, le diabète et l'insuffisance rénale
ne touchent pas exclusivement les personnes âgées mais, on trouve
des malades de 20-30 ans et voir moins. Ces maladies ont des effets
délétères sur le corps, car elles provoquent des
modifications apparentées à celles rapportées avec
l'avancé en âge. En effet ces maladies sont des exemples d'un
vieillissement prématuré et accéléré de
l'organisme.
Dans ce travail, on considère les maladies
(diabète et l'insuffisance rénale) comme facteurs de risque dans
le vieillissement. Les essais réalisés au cour de notre
étude nous on permit de :



Calculer l'âge biologique des malades.
Détecté l'influence du diabète et de
l'insuffisance rénale sur la physiologie du vieillissement du corps.
Montrer que ces maladies sont l'exemple d'un vieillissement
prématuré et accéléré des malades.

D'avoir une idée sur l'état physiologique de ces
individus.
La comparaison entre l'âge biologique des individus sains
et malales.
I. Vieillissement des organes et fonctions,
Vieillissement cellulaire.
Le vieillissement est un processus multifactoriel, qui a lieu
durant l'ultime étape de cycle vital caractérisé par une
diminution progressive de la capacité fonctionnelle de tous les tissus
et organes corporels, ainsi que l'habilité conséquente de
s'ajuster aux stimuli mésologiques, utilisant des indicateurs de
changements moléculaires, morphologiques, physiologiques, fonctionnels
et psychologiques, on obtient une vision globale du processus.
> Beaucoup de changements involutifs qui sont visibles en
différents moments de cette
étape.
> Le début de la vitesse avec laquelle se produisent
les changements involutifs des différents tissus sont variables.
> Au sein de méme tissu ou d'un système
différentes parties ou composants vieillissent à un rythme
différent.
> Il existe une grande variabilité individuelle,
sexuelle et populationnelle de début et de vitesse des processus
involutifs.
> La variabilité phénotypique augmente
à la vieillesse due à la maximalisation de différence
d'age physiologique entre individus d'age chronologique égal.
(Charles & al., 2003).
I.1.Vieillissement des organes et fonctions :
Nos organes sont constitués de tissus, eux méme
composés de cellules et d'une matrice inter cellulaire. Rappelons qu'il
y a deux types de cellules :
Des cellules renouvelables ou inter mitotiques qui
elles-mêmes peuvent être divisées en :


Gellules mitotiques qui se renouvellent tout au long de
l'existence : kératinocytes, les cellules de la muqueuse buccale,
cellules hématopoïétiques, fibroblastes.
Gellules intermédiaires qui gardent la capacité
de se diviser mais ne le font que rarement : les hépatocytes
après hépatectomie partielle, l'épithélium du
cristallin après lésion de la capsule, des cellules tubulaires
rénales, myocytes en cas de blessure musculaire.
Des cellules poste mitotiques qui ne se renouvellent plus
après la maturation de l'organisme telles que les neurones
(CUNY, 1995).
I.1.1. Vieillissement des tissus conjonctif :
I.1.1.1. La matrice extracellulaire :
particulièrement riche au niveau des tissus dits
conjonctifs (peau, paroi des vasculaires, os, cartilage, tendons). Est
composée de quatre catégories de constituant : les
collagènes, l'élastine, (protéoglycanes et les
glycoprotéines de structure), dont la répartition est
adaptée au type et à la fonction des différents tissus.
Ces constituants vieillissent également (glycation) contribuant pour une
part au vieillissement du revêtement cutané (derme), des vaisseaux
(artériosclérose), du système ostéo articulaire.
(CUNY, 1995).
Les tissus conjonctifs, jouent des rôles structurels et
fonctionnels importants dans l'organisme, ce qui les différencie des
autres tissus est leur richesse en matrice extracellulaire, cette
dernière permet de relier les cellules en tissus, les tissus en organes
et même les organes en organisme ainsi d'adapter les taches
précises au quel est soumis l'organe, exemple : les tendons sont riches
en collagène type I, convient à la grande résistance
requise pour relier les muscles et les os. (Robert, 1989).
I.1.1.2. vieillissement et programme de synthèse de
la matrice extra cellulaire :
C'est la relation entre la prolifération cellulaire
(fibroblastes de la peau, cellules musculaires des parois vasculaires) et leur
capacité à fabriquer les constituants de la matrice extra
cellulaire .On note que la synthèse du collagène diminue
parallèlement pour ces cellules, ainsi la capacité de sa
synthèse baisse, tandis que la biosynthèse de la fibronectine
(glycoprotéine de structure) s'accélère. (Robert,
1989).
Cette modification de synthèse entraîne une
modification progressive de la composition et de la structure de la matrice
extra cellulaire et des tissus conjonctifs qui caractérisent leur
vieillissement. Pour les fibroblastes, ils ont une durée de vie
relativement courte en raison de leur renouvellement par division, mais pour
les cellules qui ne se divisent plus et restent présentes dans les
tissus au cours de la maturation et du vieillissement telles les cellules
musculaires lisses de l'aorte, là est le problème. Plus l'animal
est âgé plus les cellules de l'aorte fabriquent moins de
constituant de la matrice : fibre de collagène et d'élastine.
Ainsi le vieillissement des cellules des tissus conjonctifs présente
deux aspects : baisse de la capacité de prolifération, baisse de
la capacité de production et de renouvellement de la matrice extra
cellulaire à l'exception de la fibronectine. Moins de cellule et moins
de matrice produites, voila les deux raisons des modifications progressives de
nos tissus. (Robert, 1989).
I.1.1.3.Vieillissement du collagène :
Les fibres de collagène se raccourcissent, et se
rigidifient, donc le vieillissement peut en général s'expliquer
par un pontage croissant au collagène, ce sont des ponts provenant de
l'interaction entre le glucose et les résidus lysine du
collagène. Ce phénomène s'accélère au fur et
à mesure que la concentration du glucose augmente dans le sang, cette
réaction est dite réaction de Maillard. (Robert,
1989).
I.1.1.4. Vieillissement des fibres élastique :
C'est la première protéine fibreuse à
souffrir au cours de la vie et du vieillissement, car elle possède une
forte affinité pour les corps gras et le calcaire. La structure des
fibres d'élastine par sa configuration spatiale est parfaitement capable
de capter les corps gras (esters de cholestérol et acide gras en
particulier). Les tours de spire de ces chaînes peptidiques forment des
sites de captation privilégiée du calcium.
Les fibres d'élastines captent le Ca++, plus
il y a du Ca++ plus elles peuvent retenir des lipides. Or la
durée de vie de l'élastine dans l'organisme est très
longue ainsi le dépôt de corps gras et de calcium se fera t'il
d'une façon continue au cours de la vie, les fibres élastiques
ainsi saturées de graisses et calcifiée ne sont plus
élastiques pire encore elles deviennent la cible
privilégiée des enzymes pouvant la dégrader ; les
élastases. Donc, il en résulte une dégradation progressive
des fibres et perte d'élasticité du tissu. . (Robert,
1989).
Exemple : Tissu conjonctif et vieillissement de
la peau :
L'apparition des rides est un des signes les plus
précoces du vieillissement. L'apparition des rides est due, en grande
partie, à l'altération du tissu conjonctif. L'exposition
exagérée aux rayonnements solaires (surtout UV) est un des
facteurs environnementaux majeurs impliqués dans
l'accélération du processus du vieillissement de la peau.
Le tissu conjonctif est composé d'une part par des
cellules (fibroblastes, lymphocytes) et d'autre part par la matrice
extracellulaire (très complexe et comprenant de nombreux constituants).
(Robert, 1989). Le collagène est fortement
altéré chez les personnes âgées. En plus des
pontages intramoléculaires, la synthèse du collagène par
les fibroblastes est diminuée en fonction de l'age, et l'activité
des enzymes responsables de la transformation posttranscriptionnelle de ces
fibres est altérée. D'autres fibres de l'espace extracellulaire,
comme l'élastine, sont également modifiées en fonction de
l'age. Les fibres de l'élastine sont composées d'élastine
et de micro fibrilles glycoprotéiniques. La diminution du nombre de
micro fibrilles, la fragmentation de l'élastine par l'élastase et
l'augmentation de l'avidité des

N. Benaoum & A. Abbou (2008).Age biologique : un concept
actualisé au service de la lutte contre le vieillissement. DES
biochimie. Univ. Mascara
fibres d'élastine pour les lipides et le calcium
augmentent en fonction de l'âge. La fragmentation de l'élastine
est particulièrement nocive pour l'organisme car les peptides
formés ont une grande affinité pour les récepteurs
à élastine-laminine, exprimés à la surface d'un
grand nombre de cellules (fibroblastes, cellules musculaires lisses, monocytes,
lymphocytes). La liaison entre les peptides nouvellement formés
d'élastine et le récepteur ci mentionné provoque
l'activation cellulaire, le chimiotactisme (attraction d'autres cellules), la
libération des enzymes lytiques ainsi que la production des RLO
(radicaux libres oxygénés). (Anne Marie& ferry
2002)
A
B
Fig .1. Schématisation simplifiée du
vieillissement de la peau. (Anne Marie& ferry 2002).
A (sujet jeune), B (sujet âgé).
Les fibroblastes subissent également les effets
délétères de l'âge. Les fibroblastes isolés
à partir de l'organisme des donneurs âgés expriment
à leur surface moins de récepteurs spécifiques pour les
facteurs de croissance et prolifèrent moins efficacement à la
stimulation aux mitogènes que les fibroblastes contrôlent. Un
retard dans la phosphorylation de certains récepteurs suite à la
liaison avec des facteurs de croissance correspondants et une perturbation des
voies de signalisation intracellulaire sont certainement à l'origine de
cette limite proliférative observée in vitro. Le
vieillissement de la peau est en grande partie dû aux multiples
altérations de la matrice extracellulaire. La perte
d'élasticité, l'apparition des rides, la diminution de
l'épaisseur du derme et du nombre de cellules (fibroblastes,
macrophages, éosinophiles) et de vaisseaux sanguins sont les
caractéristiques les plus importantes de la peau qui vieillit (voir
fig.1). (Anne Marie& ferry 2002).
I.1.2.Vieillissement des organes :
13
Tous les organes contiennent du tissu interstitiel ou tissu
parenchymateux .dans le foie, les hépatocytes représentent le
parenchyme et les capsules et les travées conjonctives qui les relient
la partie interstitielle. (Robert, 1989).
I.1.2.1. Fibrose sclérose et vieillissement
Il y a une rigidification du collagène progressive avec
l'âge, ce qui va augmenter sa résistance aux attaques d'enzyme
devant la dégrader les collagénases. Ainsi sa durée de vie
va augmenter et son renouvellement va se ralentir.
D'autres constituants sont dégradés et peu ou
pas remplacés, ainsi les polysaccharides capables de retenir l'eau, les
protéoglycanes, l'acide hyaluronique baissera avec l'âge, les
organes âgés paraiteront donc plus riches en collagène (de
type I en particulier).
Ce phénomène s'observe dans la plupart des
tissus conjonctifs mais ses conséquences seront les plus graves au
niveau des vaisseaux sanguins, leur enrichissement en collagène, et leur
appauvrissement en élastine duent à sa dégradation
caractérise l'artériosclérose. . (Robert,
1989).
I.1.2.2. Vieillissement des cellules parenchymateuses des
organes :
Le vieillissement des organes est due d'une part à la
perte progressive de la fonction des cellules parenchymateuses vieillissant
selon un mécanisme post-mitotique (donc sans division cellulaire)
caractérisé par une perte progressive de leurs fonctions
spécialisées, et d'autre part par une perte cellulaire
(appoptose).On assiste ainsi à un appauvrissement en cellules
différenciées fonctionnelles, par exemple, le taux de
néphron diminue dans le rein, les neurones dans le cerveau, les
alvéoles dans les poumons et à un enrichissement relatif en
collagène mais avec une trame fibreuse altérée n'assurant
plus d'une façon efficace son rôle d'intégration.(
Michael, 2000).
Le vieillissement des cellules du parenchyme s'explique aussi
par l'accumulation de déchets prenant souvent la forme de grain de
lipofuscine, qui sont le résultat d'une baisse de l'efficacité du
système d'épuration de la cellule.
Les défaillances dans l'activité et dans
l'élimination des déchets, des cellules parenchymateuses
s'accompagnent par la modification de la matrice conjonctive. Les organes
perdent ainsi progressivement la capacité d'assurer leurs rôles
dans l'organisme. (Robert, 1989).
I.1.2.3. Tous les organes ne vieillissent pas à la
même vitesse :
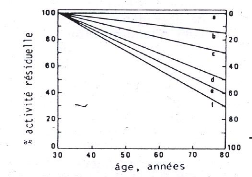
Un certain nombre de fonctions de nos organes sont mesurables
et ont été mesurées. Les études les plus
complètes sont dues à un gérontologue américain
« Nathan Schoke ». Il a comparé le déclin avec
l'âge, de certaines fonctions, la fig 2 montre d'une
façon schématique les résultats de ses études, on
note qu'il existe de grande différences entre les vitesses avec les
quelles les différentes fonctions mesurées déclinant. Les
pertes les plus rapides concernent les organes respiratoires, circulatoires,
vaisseaux sanguins, le coeur qui sont les plus riches en matrice extra
cellulaire et en particulier en tissu élastique. Ainsi la baisse de la
vitesse de la conduction nerveuse est très lente, suivie de prés
par celle du métabolisme de base (mesuré par la concentration
d'oxygène d'une personne au repos). A l'autre extreme, ils trouvaient
les fonctions respiratoires, capacité vitale (la quantité d'air
maximale emmagasiner par les poumons lors d'une inspiration profonde) et la
vitesse de circulation du sang dans les artères. Donc le vieillissement
des organes mesuré par leurs fonctions s'effectue à des vitesses
très différentes. (Robert, 1989).
FIG.2. le résultat des études
effectuées par Nathan Schock sur le vieillissement in (Robert,
1989)
Une étude portant sur des individus d'age
différent dont on évalué un certain nombre de fonctions
physiologiques, on peut voir que selon la nature de ces fonctions, leur vitesse
de déclin varie fortement avec l'age. Ainsi, la glycémie à
jeun (a), la conduction nerveuse (b), baissent t'elle lentement avec l'age,
l'indice cardiaque de repos (c) décline plus vite. La capacité
vitale (d), la vitesse de circulation sanguine (e) capacité respiratoire
maximale (f) déclinent rapidement avec l'age. Les paramètres qui
déclinent rapidement avec le vieillissement concernent des tissus riches
en élastine.
Il semble donc qu'au niveau de ces organes, la vitesse de
vieillissement soit étroitement liée au vieillissement de leur
matrice extracellulaire : la perte d'élasticité des poumons et
des vaisseaux, la perte de capacité de filtration sélective des
capillaires. L'enrichissement en collagène du myocarde aggravent et
précipitent la défaillance de ces systèmes d'importance
vitale. Cela doit avoir des répercussions au niveau de tous les
organes
dont l'irrigation, la nutrition, l'oxygénation,
l'élimination des déchets vont souffrir progressivement. Plus un
organe dépend de ces fonctions. Plus il souffrira de leur déclin
rapide (vieillissement pathologique). Il doit être ainsi tout
particulièrement du cerveau, richement vascularisé et sensible
à une baisse en oxygène et en sucre (Robert,
1989).
En dernière analyse, le vieillissement des organes
dépendra de la conjonction de la perte de cellules
spécialisées, et de la perte de ces fonctions car la
synthèse de protéines qui contribuent au fonctionnement
spécialisé dans des cellules spécialisées ainsi les
cellules du pancréas synthétisent l'insuline, de la thyroïde
les tyrosines, cellules nerveuses les neurotransmetteurs, les cellules du
muscle la myosine, myoglobine, actine et les fibroblastes (collagène).
Donc tout défaut ou déficience de la synthèse de ces
protéines provoque une détérioration du fonctionnement de
ces cellules qui à son tour provoquent le déclin de
l'activité de l'organe qui les constitue. (Michael,
2000).
I.1.3. Vieillissement cardiovasculaire :
> Vieillissement des artères : qui se
caractérise par :
1- Modification d'élastine : d'après ce qui a
été mentionné précédemment les fibres
d'élastines captent le Ca++, plus il y a du Ca++
plus elles peuvent retenir des lipides, et puisque sa durée de vie est
prolongée elles ne sont plus élastiques, et plus
privilégier des élastase.
2- Rigidification du collagène par glycation en pontage
croissant qui lui donne l'esprit rigide.
Ces deux phénomènes caractérisent
l'artériosclérose et l'altération de la
vasomotricité artérielle. (Robert, 1989).
Ce processus diminue progressivement l'efficacité des
gros vaisseaux à aider le coeur à faire circuler le sang :
à chaque contraction, à chaque systole, l'aorte jeune se dilate
pour accommoder le volume du sang éjecté par le ventricule
gauche. La rigidification progressive l'oblige à se dilater pour
accepter passivement ce volume arrivant au coeur 60 à 80 fois par minute
grace au filtre élastique intacte. Le rebond élastique de l'aorte
jeune, dilaté à chaque contraction sera capable d'aider le coeur
à pomper le sang vers la périphérie. Sa rigidification
progressive lui enlève cette capacité et nuit ainsi
considérablement au travail du coeur, ce qui explique l'augmentation de
la pression artérielle systolique avec l'age. (Robert
1989).
> Athérosclérose et vieillissement des
artères :
Elle est considérée comme une inflammation
chronique de l'intima des artères de gros et moyen calibre, dont
l'origine repose sur une interaction entre des composant plasmatiques
thermogènes (LDL) oxydé et les cellules de la paroi
artérielle, et la formation d'une plaque d'athérome qui diminue
la lumière vasculaire. (Delattre& al., 2003).

Sa localisation ;
Certain zones sont préférentiellement
touchés il s'agit de : l'aorte et de ces principales branches, des
carotides internes et des artères cérébrales, des
coronaires et des artères des membres inférieurs.
Trois localisations sont concernées par la
fréquence des manifestations ischémiques le myocarde, le cerveau
et les membres inférieurs. On s'intéresse surtout pour le
myocarde, les lésions coronaires s'expriment de manière aigue
(syndrome de menace, infarctus du myocarde, mort subite) ou chronique (angor
d'effort ou de stress). (Delattre& al., 2003). (voir
fig.3).
Athérosclérose : obstruction d'une
artère (Encarta, 2008)
On site que quelques uns : Tabagisme, hypertension
artérielle, hypercholestérol total, augmentation des LDL = 1.6
g/l, diminution de HDLC < 0.35 g/l, diabète sucré ;
glycémie =1.26 g/l, hypertrophie ventriculaire gauche.
(Delattre& al., 2003).
L'évolution de la plaque provoque la
sécrétion de l'interféron ó par les lymphocyte T
activé (LT), majore la dysrégulation du métabolisme de la
matrice extra cellulaire en bloquant la synthèse du collagène par
les cellules musculaire lisses. Et bien évidement on n'oublie pas la
prédiction des chercheurs gérontologues français qui
disent que :

« L'~ge de l'être humain appartient
à l'ge de ces vaisseaux sanguins ». (Micheal,
2000)
Dans le vieillissement pathologique due à des
manifestations au niveau des vaisseaux telles que
l'athérosclérose, on peut évaluer la vitesse du
vieillissement du corps car ces modifications interférât avec le
vieillissement normal sont la cause majeur du vieillissement
accélère et la mort des organes. (Michael,
2000)
> Vieillissement de coeur :
Le coeur prend une coloration plus brune, la graisse sous
épi cardiaque devient plus abondante, le poids du coeur augmente
modérément.
Il y a diminution du nombre des cellules musculaires
cardiaques et leur taille moyenne augmente. Le cytoplasme se charge de
dépôts de lipofuscine. L'endocarde (tunique interne du coeur,
tapissant l'intérieur du myocarde et limitant les cavités
cardiaques) tend à s'épaissir notamment au niveau de l'oreillette
gauche et de la face septale du ventricule gauche. Les valves sont le
siége d'un épaississement scléreux due à des
modifications qualificatives du collagène « glycation », et
des dépôt calciques se développent au niveau de l'anneau
valvulaire « qui altèrent les fibres d'élastines ».Ces
modifications touchent préférentiellement les valves du coeur
gauche. (CUNY, 1995).
Les conséquences anatomiques sont :
augmentation de la masse cardiaque globale.
augmentation de l'épaisseur de la paroi ventriculaire.

Elargissement de la
paroi du VG
A B
Fig.4. A : coe
(Caillet, 2006
auche (HVG
18

|
hypertrophie ventriculaire gauche (HVG). (CUNY, 1995).
(voir fig.4)
|


Les conséquences fonctionnelles sont : 1' A
l'état basal :
diminution du débit cardiaque.
le volume systolique diminue de 0.7% par an.
la résistance systolique diminua de 0.5 % par an.
la résistance artérterielle systémique
augmente régulièrement avec l'âge en raison de la
diminution de l'élasticité des parois de gros et de moyen
calibre. Il en est de même des résistances vasculaires
périphériques, ceci explique l'augmentation de la pression
artérielle systolique. (CUNY, 1995).
1' à l'effort on note :
réduction de la fréquence cardiaque. le
débit cardiaque diminue à l'effort. défaut de relaxation
du ventricule gauche.
Le système autonome peut être incriminé dans
cette moindre adaptation à l'effort, en effet, s'il existe une
élévation plus franche des catécholamines circulantes, les
récepteurs
â adrénergiques situés au niveau des
myocytes et du muscle lisse vasculaire ont une moindre réactivité
donc diminution de la sensibilité du coeur aux catécholamines
(CUNY,1995).
Il y a une augmentation du taux de cholestine,
sphyngoméline et cardiolipine dans les membranes des cellules
sénescentes au niveau mitochondrial, car ces modifications provoquent
une diminution dans la viscosité de la membrane, ce qui altère la
fonction de la mitochondrie cardiaque et diminue l'alimentation du coeur en
énergie « ATP », ce qui altère également la
fonction du muscle cardiaque pendant la sénescence. Ainsi
l'altération des particularités physico-chimique de la membrane
cellulaire empêche les récepteurs de nature protidique
nouvellement synthétisée de s'intercaler dans la double couche
lipidique ce qui explique la diminution de leur nombre y compris les
récepteurs catecholaminergiques du coeur (Michael
,2000).
Il y a donc tous les éléments d'une
défaillance de la circulation ou plus exactement une oxygénation
moins accrue des tissus (Robert, 1989). Se sont des maladies
qui accélèrent le vieillissement « vieillissement par
surcroît » (CUNY, 1995). (Voir tableau.1.)
Tableau.1. Effets cardiovasculaires du vieillissement.
(Bounhoure, 1999).
|
Effets cardiaques
|
Effets vasculaires
|
|
Epaississement des parois du VG Fibrose collagène
Dégénérescence valvulaire
Diminution du nombre de cellules sinusales
|
Modification des cellules
endothéliales
Epaississement de l'intima Epaississement de la média
Fragmentation des fibres élastiques Dépôt
collagène.
|
I.1.4. Vieillissement de l'appareil respiratoire :
La trame fibreuse des poumons subit le même sort que celle
des vaisseaux, leur plasticité diminue avec l'age.
Le poumon est un organe ou les fibres élastiques jouent un
rôle d'importance vitale.
A chaque inspiration son volume augmente de 30% environ.
L'expiration aidée par la contraction de la paroi thoracique repose
néo moins surtout sur son réseau élastique, donc son
vieillissement et sa dégradation « élastase » sont
fortement augmentés par l'age, aggravant encore le problème que
pose le moindre effort (Robert, 1989).
-diminution de l'accommodation pulmonaire.
-diminution de l'accommodation de la paroi thoracique.
-diminution des muscles respiratoires. (Caillet,
2006).
Ce qui entraîne une réduction de la
capacité ventilatoire expliquant la diminution de la capacité
vitale (la quantité d'air maximale emmagasiné par les poumons
lors d'une respiration profonde). (Robert, 1989).
Il y a aussi une diminution de la capacité de diffusion
de l'oxygène due à une diminution des alvéoles pulmonaires
et donc une diminution de la pression partielle en O2 du sang artériel
(PaO2).
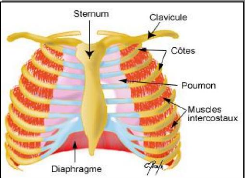

Fig.5. Les muscles de la respiration. (Anonyme III,
2004).
La diminution du nombre des cellules musculaires, le poumon et
la première barrière vulnérable à la
matière cancérigène et toxique trouvant dans l'air,
certain de ces substances peuvent persister dans la cellule et causer des
dommages a l'ADN, ainsi qu'à la membrane plasmique, réduisant
avec le temps le pouvoir réparatoir des cellules ce qui entraîne
leur entrer en appoptose. (Callet, 2006)
I.1.5. Vieillissement du système nerveux :
Il y a ralentissement de l'activité des cellules
post-mitotiques et l'accumulation continue de déchets à leur
niveau, ce sont les grains de lipofuscine, on les appelle ainsi à cause
de leur fluorescence jaune --verdâtre, ce sont des déchets que la
cellule n'arrive plus à les éliminer. Après la
quarantaine, nous perdons 40.000 cellules nerveuses par jour.
La diminution et le changement des fonctions des organes
peuvent être corrélés avec la défaillance du
contrôle nerveux. Ce dernier s'applique par la mort des cellules des
fibres nerveuses, qui est suivie par la diminution du taux et la vitesse de
sécrétion des neurotransmetteurs, donc la diminution de la
capacité des cellules réceptrices de ces neurotransmetteurs.
(Michael, 2000).
> Vieillissement du système nerveux central
:
Nombreuses modifications neuropathologies et neurobiologiques du
système nerveux central sont:
diminution de la substance blanche « défaut de
myélinisation ». (CUNY, 1995)
diminution de nombre de neurone corticaux.

diminution de certains neurotransmetteurs intra
cérébraux surtout l'acétylcholine.
Fig.6. Schématisation des changements neuronaux
observés chez les sujets âgés. A : chez le sujet jeune ; B
: chez le sujet âgé. (Anne Mari& Ferry 2002)
Les conséquences sont :




augmentation des temps de réaction par diminution des
neurotransmetteurs et de leurs récepteurs dans les cellules
réceptrices.
diminution modérée des performances
mnéstique (acquisition d'information nouvelle, par exemple ; la personne
ne se souvient pas du nom d'une personne récemment connue mais souvient
des noms d'amie d'enfance. (CUNY, 1995)
diminution et destruction du sommeil (diminution de
sécrétion de la mélatonine Désorganisation des
rythmes circadiens.
Diminution de la sensibilité des récepteurs de la
soif, les osmorécepteurs qui en résultent une diminution de la
sensation de soif des sujets âgés. . (Caillet,
2006).
> Vieillissement du système nerveux
périphérique :
Diminution du nombre de fibres fonctionnelles, qui en
résultent une augmentation de conduction des nerfs
périphériques.
- Diminution de la sensibilité proprioceptive.
- Instabilité posturale et risque de chute.
(Caillet, 2006)
> Vieillissement de système nerveux autonome
:
Hyperactivité sympathique (augmentation du taux
plasmatique des catécholamine), mais réduction des
réponses sympathiques en raison d'une diminution de la
sensibilité des récepteurs aux catécholamines.
Exemple :La tachycardé normalement
induite par l'effort est moins marquée chez les sujets âgés
( Caillet,2006).
I.1.6. - Vieillissement de l'appareil locomoteur :
> muscles squelettiques :
Sur le plan microscopique, on note une diminution de la
densité des fibres musculaires, alors sur le plan anatomique,
il y a une diminution de la masse musculaire = sarcopénie.
La conséquence est une diminution de la force
musculaire.
> squelettes, os :
On note une diminution de la densité minérale
osseuse = ostéopénie, surtout chez la femme, ostéoporose
(carence ostrogénique). (Voire Fig.7) et une diminution
de la résistance mécanique osseuse, augmentation du risque de
fracture (Caillet, 2006).

Vieillissement
Insuffisance vitaminique D diminution de la masse diminution de
production Et/ou calcique. Néphronique de facteur de croissance
(IGF-1, IGFB)
Diminution du taux de 25 (OH) D diminution de la
Différenciation
Ostéoblastique.

Diminution de l'absorption Diminution de
Intestinale du calcium
L'activité des ostéoblastes
Chute de calcémie
Diminution de formation osseuse
Augmentation du taux de PTH (parathormone)

Stimulation de la différenciation osteoclastique perte
osseuse +++
Augmentation de la résorption osseuse ostéoporose
sénile
Fig.7.Mécanisme physiopathologique de
l'ostéoporose sénile (Kamel et Durand. in Delattre&
al., 2003.
Les conséquences sont : an niveau du cartilage
articulaire, on note une diminution du
contenu en eau, diminution du nombre des chondrocytes, par
conséquence il y a :
- amincissement du cartilage et altération de ses
propriétés mécaniques et fragilité. - La
fragilité augmente avec l'arthrose. (Caillet, 2006).
I.1.7. Vieillissement du métabolisme :
Modification de la composition corporelle.
-A poids constant :
- réduction de la masse maigre ou masse protoplasmique
active « muscle et os », au contraire, la masse adipeuse
s'accroît.
- réduction de la tolérance à la charge en
glucose, témoignant d'un certain degré de résistance
à l'insuline.
- réduction de la capacité de l'organisme à
s'adapter aux situations de stress. (CUNY, 1995).
I.1.8. Vieillissement des organes des sens :
A- Vision :
-Réduction de l'accommodation presbytie (EN OPHTALMOLOGIE
modification de la vision, généralement liée à
l'âge, caractérisée par une baisse de l'acuité
visuelle).
- Opacification progressive du cristallin = cataracte.
(CUNY, 1995).
B- Audition : - perte progressive de l'audition
(presbyacousie). (CUNY, 1995).
I.1.9. Vieillissement de l'appareil urinaire :
Concerne surtout le rein :
> modifications anatomiques :
- macroscopiquement : diminution modérée de la
taille des reins, ce dernier passant en moyenne de 250 g à 40- 49 ans,
à 200 g après 70 ans. .
- microscopiquement : diminution du nombre de néphrons
fonctionnels, le nombre de glomérules diminue d'un tiers à la
moitié entre l'âge adulte et 70 ans. Ce qui altère la
filtration glomérulaire qui diminue.
- Epaississement des membranes basales, augmentation de la
surface mésangliale définissant une glomerulosclérose,
fibrose interstitielle et vasculaire.
> Modifications fonctionnelles :
Diminution des capacités d'élimination du rein :
la filtration glomérulaire -- quelle que soit appréciée
par la clairance de l'inuline, de l'urée ou de la créatinine -
diminue quasi linéairement avec l'âge.
-Un sujet âgé est un insuffisant rénal
jusqu'à preuve de contraire. Il faut toujours adapter la dose des
médicaments à la fonction rénale (estimé par la
clairance de créatinine - formule de Cockcroft)
C L . creat = (140 --age) . Poids .K
Créatinine
K: constant femme =1.04
Chez l'homme =1.25
Poids en Kg, créatinine en u mol/l
Exemple : créatinine = 80 umol/l et poids =60kg
Femme de 40 ans, CL = 78 ml / min.
Femme de 85 ans, CL = 43 ml / min
Insuffisance rénal sévère si CL < 30 ml /
mm.
> Toutes ces notions bien classiques sont rapportées
au seul effet de l'âge, indépendamment de tout processus
pathologique susceptible d'affecter ou de retenir sur les reins (processus
infectieux, uropathie acquise, maladie générale telle que le
diabète ou HTA). (CUNY.1995).
I.2. Le vieillissement cellulaire :
I.2.1. Rappel de la cellule :
Elément constitutif fondamental de tout être
vivant. La plupart des cellules humaines ont une structure semblable,
composée de trois éléments principaux. Le noyau, le
cytoplasme et la membrane cytoplasmique. (Larousse
médical)
Fig.8. Rappelle de la cellule (Caillet,
2006)
I.2.2. Les Deux hypothèses du vieillissement :
I.2. 2.1. Hypothèse génétique :
I.2.2.1.1. Programmation génétique :
La durée de vie diffère selon chaque
espèce animale. Il existe de véritables gènes du
vieillissement propre à l'espèce qui aurait l'effet de limiter la
durée de vie de l'organisme ou de la cellule et son potentiel de
division en ralentissant, troublant ou en bloquant certaines fonctions.
Il pourrait agir soit d'une désactivation de certains
gènes au cours de l'avance en age, soit de la manifestation des
gènes demeurés jusqu'à la silencieuse. Cette programmation
pourrait varier d'espèce à espèce et de cellule à
cellule à l'intérieur d'une méme espèce, expliquant
que les divers tissus puissent vieillir de façon différente
(CUNY ,1995). En effet, il existe des syndromes de
vieillissement accélérés liés à certains
gènes (Caillet, 2006)
I.2.2.1.2 - altération de l'ADN :
Le matériel génétique est
endommagé plus ou moins en permanence, spontanément ou par
l'exposition à des gènes nocifs provenant de l'intérieur
ou de l'extérieur (Florian&al., 2005)
Durant le vieillissement il y a une augmentation importante de
la fréquence des altérations de l'ADN (délétion,
mutation) et des anomalies de réparation (ADN mitochondrial)
(Caillet, 2006).

Les lésions de l'ADN :
Les lésions de l'ADN sont classées en 3
catégories ;
> Les lésions spontanées de l'ADN qui se
produisent couramment dans nos cellules. > les lésions induites de
l'ADN .provoquées par des agents extérieurs.
> les lésions de l'ADN provoqués par des
erreurs de réplication (Florian&al., 2005)
? Lésions spontanées de l'ADN :
Ces lésions n'aillent pas jusqu'à la
création d'une nouvelle paire de base remplaçant la paire de base
originale. Les deux types de lésions spontanées de l'ADN sont la
désamination, et la dépurination thermique.
(Florian&al., 2005)
> La température et les gènes
:
Méme la température de 37° C du corps de
l'animal et qui est indispensable à leur vie, peut avoir des effets sur
l'ADN.
On connait tous, que certains enzymes perdent leur
activité à 37°C mais puisque les protéines des
cellules sont renouvelables, celle dénaturé est remplacée
par une autre nouvelle mais ce n'est pas le cas pour l'ADN (Michael,
2000).
Le site faible dans l'ADN est la liaison N.glycosidique entre
le sucre désoxyribose et les bases purines. A 37°C, il peut se
produire spontanément une hydrolyse de cette lésion dans les
nucléotides purinique. On appel cela dépurination et plus
précisément enlèvement de la Guanine.
(Michael.2000). (voir fig.9)
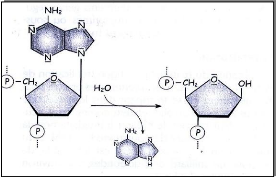

Fig .9. Représentation schématique de la
dépurination thermique. (Florian&al., 2005)
Dés la sortie de la purine dans l'ADN, la liaison du
phosphate avec le sucre devient plus faible au site de l'absence de la purine
et moins stable et se détruit grâce à la liaison d'une
molécule d'eau, ce qui provoque des ruptures dans la chaîne
polynucléotidique de l'ADN. Donc sous les conditions physiologiques
(température 37°C, pH, force ionique) de la cellule, l'ADN perd
chaque 1010 bases, une base chaque seconde.
Le taux d'apparition des dommages dans l'ADN des cellules de
mammifère sous les conditions physiologiques vitals est comme suit :
Il y a10 000 désaminations et dépurinations
(Florian&al., 2005).
Environ 2000 ruptures dans les chaînes de l'ADN pendant
une heure, et se sature en méthyle environ 100 guanine. Sur ces bases,
la vitesse d'apparition d'altération de l'ADN égale environ
5.103 /heure. Ce nombre est trop grand par rapport au rôle
biologique et vital de l'ADN. Seulement que sous la température de
37°C il y a un autre processus opposé à l'altération
thermique de l'ADN qui est la réparation. Ce qui rend l'animal
résistant à la sénescence de son ADN
(Michael.2000).
> La désamination :
Consiste à la disparition d'un groupement aminé sur
une base.
Si elle emporte le groupement aminé de la cytosine, elle
aboutit à un uracile.
Si elle emporte celui d'une adénine, elle aboutit
à l'hypoxantine. Ces deux bases ne sont pas normalement
présentées dans l'ADN et elles sont donc reconnues par le
système de réparation d'ADN (Florian&al., 2005).
(Voir fig.10)
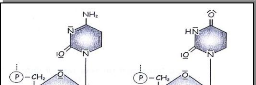


Fig.10. La désamination. (Florian&al., 2005)
Lésions induites Q l'A' 1 :
Tous les agents susceptibles d'induire des liaisons dans l'ADN
sont appelés mutagènes : substance chimique, rayonnement, agent
chimique exemple de beaucoup de colorants et de conservateurs qui se fixent sur
l'ADN et empechent sa réplication (Florian&al.,
2005)
- - Le rayonnement, lésion
directe Q l'A' 1 :
Quand le rayonnement radioactif rencontre un brin d'ADN
directement provoque une cassure d'un seul brin. S'il rencontre les deux brins,
il provoque cassure de la double hélice, ou provoque des modifications
dans la structure des nucléotides.
Exemple ;
Les UV formation de dimère de thymine.
(Florian&al., 2005)
- Lésion indirecte :
Le rayonnement ne rencontre pas directement l'ADN mais les
molécules d'eau, il se produit alors l'apparition de radicaux libres qui
à leur tour provoque des lésions du matériel
génétique. (Florian&al., 2005)
- Erreurs de 1.080FIRSQ d11l'A' 1 :
Lors de la réplication de l'ADN les ADN polymérases
commettent des erreurs relativement, fréquemment en se trompant dans le
nucléotide incorporé (Florian&al., 2005)
.

Mécanisme de réparation de
l'ADN
Il y a une relation étroite entre l'efficacité du
système de réparation des cellules et la durée de vie
spécifique à l'espèce. (Michael.2000).
- Activation du système de réparation
:
De même que des lésions se produisent à
tout moment, notre système de réparation est constamment à
l'oeuvre, il est plus actif lors de la phase S, G2 pour vérifier
l'intégrité du génome. (Florian&al.,
2005)

Réparation de lésion d'un seul brin
:
Elle est basée essentiellement su l'excision --
resynthèse. Il y a deux systèmes d'excision -- resynthèse
principaux :
- Par excisons de base ; il utilise les enzymes suivant : ADN.
N.glycosylase, Endonucléase, Polymérase et Ligase.
(Florian&al., 2005)
Il est fort possible que l'activité de l'enzyme
N.glycosylase soit très élevée chez l'etre humain en
raison de sa longue vie par rapport à d'autre mammifère
(Micheal.2000).
- Par excision de nucléotides. (Florian&al.,
2005)

Réparation de lésion de double brin
:

Ce sont des réparations de dommage causer par les
radiations ionisantes (Florian&al., 2005) Protéine P53
:
S'il se produit des dommages importants de l'ADN, la
concentration de la protéine P53 augmente rapidement dans la cellule. La
P53 est appelée « la gardienne du génome ». La
conséquence de l'activité de la P53 est d'abord un blocage du
cycle cellulaire pour que la cellule puisse remédier au dommage avant
d'envisager la suite. Si les dommages sont trop importants, P53 conduit
à l'appoptose. (Florian&al., 2005)
Au cours du vieillissement une diminution de nombre de cellule
est observée dans la majorité des organes. Cette
réfraction cellulaire progressive est due à la disparition des
cellules par appoptose. Cette dernière peut etre la conséquence
d'une accumulation trop importante de dommage d'ADN. (Clos & al,
2003).

Réparation de l'ADN et sénescence
:
Le vieillissement est la conséquence de l'accumulation
des erreurs de la machinerie de biosynthèse des protéines,
s'accroissant de manière exponentielle dés lors qu'auraient
été altérées des processus de contra e et de
réparation du matériel génétique. (Michael,
2000)
Il existe une relation étroite entre la
longévité des espèces et l'efficacité de leur
système de réparation de l'ADN. Par exemple chez les souris la
déficience de ces systèmes comparée à leur haute
performance chez l'homme pourrait expliquer la sénescence
accélérée de ces petits mammifères et leur
longévité diminue par rapport a l'homme. 3 ans pour la sourie et
90 ans pour l'homme, donc l'altération et la lésion de l'ADN sont
parmi les causes principales du vieillissement. . (Michael, 2000) (Voir
fig.11)

Longevite de different
rf,FarnFNifert
ADN
d


Capacité de la cellule irradiée à rarer son
A DN pg.11. RelatioKIEentre lidwévité et la
caErtwitméparation de l'ADN dans différentes
spècesr (lewiux relatif Ase réparation
représente la sy Q4hèseRWprograIm mée de l'AD1
-h
e la cellule irradiée par le mrme taux d'UV).
(D'après Michael.2000).
Donc les facteurs environnementaux et les conditions de vie
qui diminuent le taux de lésion de l'ADN ou qui augmentent la
capacité vitale de la cellule doivent etre rapportés aux facteurs
de la longévité.
La capacité de réparation de l'ADN dans les
cellules sénescentes est moins que celle des cellules jeunes et en plus
le dérèglement dans la coordination dans le travail des enzymes
de réparation va aboutir non pas à la réparation de l'ADN
mais au contraire causé des dommages fatales à ce niveau.
(Michael.2000)
Exemple :
Pendant la perte d'une base, comme on à
déjà vue dans la dépurination, doit commencer la
réparation et la fermeture de la lacune due à la sortie de la
base. S'il y a un retardement de la réparation par exemple manque de la
concentration de la DNA polymérase dans ce cas l'enzyme
exonucléase ne peut pas etre stoppé ce qui cause des
lésions de l'ADN et dans ce cas la réparation va se dévier
dans le sens contraire,ou elle contribue à l'augmentation des
lésions de l'ADN (Michael,2000).
|
ADN mitochondrial et vieillissement :
|
De nombreuses théories de vieillissement suggèrent
que les altérations de l'ADN mitochondrial sont également
responsables du vieillissement de l'organisme.
L'ADN mitochondrial est particulièrement vulnérable
aux altérations car il n'est pas protégé par les histones
protectrices, et son système de réparation est très
limité.
Toute altération de l'ADN mitochondrial ou des
protéines mitochondriales est délétère pour la
cellule par diminution de la production d'ATP, et les cellules ne peuvent pas
fonctionner d'une manière normale. (Michael, 2000).
I.2.2.1.2 - Différents types de cellules :
> Cellule à faible capacité de
renouvellement :
Les neurones, cellules musculaires, leucocytes qui ont
l'âge de la personne. Le dérèglement dans les fonctions de
ces cellules et leur destruction est parmi les déterminants fondamentaux
du vieillissement du corps. Puisque ces cellules sont non renouvelables car
elles ont perdu le pouvoir mitogène. Alors l'accumulation à leur
niveau de lésion de l'ADN qui mène à l'appoptose ce qui
explique la réduction progressive de leurs nombres.
Des modifications structurales et fonctionnelles dont la plus
apparente est la surcharge cytoplasmique en grains pigmentaire d'origine
lipidique : la lipofuscine appelée aussi pigment de la vieillesse.
(CUNY. 1995)
> Cellules renouvelables dont les possibilités
de renouvellement ne sont pas illimitées :
Elles sont proportionnelles à la longévité
de l'espèce avec des écarts entre les individus d'une méme
espèce. (CUNY. 1995)
I.2.2.1.3 - Les télomères et les
télométrases :
Ce sont des séquences de nucléotides (TTAGGG)
pouvant se répéter plusieurs milliers de foies, marquent la fin
de l'ADN et permettent sa stabilité et évitent la fusion entre
les chromosomes (Caillet,2006).
Le vieillissement cellulaire pourrait être
conditionné par une perte progressive de l'ADN des
télomères (extrémité du chromosome). En effet, au
cours de leur division successive, les cellules perdent progressivement de
l'ADN télomérique (car l'ADN polymérase ne peut
répliquer complètement les extrémités des
molécules d'ADN linéaires. Ce qui en résulte une perte de
nucléotides terminaux). Quand la perte totale dépasse un certain
seuil, les cellules cessent de se diviser et entrent en
sénescence. (Clos & al,2003).
La télomérase est une enzyme qui peut compenser
cette perte d'ADN télomérique. Notons que les cellules
cancéreuses qui peuvent se diviser indifféremment, expriment
fortement cette enzyme. De plus des cellules humaines, qui entrent normalement
en sénescence au bout d'un nombre défini de cycle cellulaire
continuent à se diviser si elles sur expriment la
télomérase. La protéine anti-apoptotique Bcl-2 favorise
l'activité de la télomérase et pourrait donc participer au
control du vieillissement cellulaire (Clos & al .2003). (voir fig.
12)
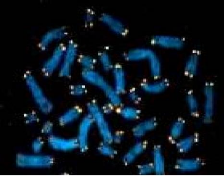
Fig.12. les télomères. (Caillet,
2006)
I.2.2.1.4 - Les conséquences de l'altération
de l'ADN :
Des modifications de l'expression de certains gènes et
modifications de synthèse des protéines commandées par ces
gènes.
Des perturbations du cycle cellulaire ce qui favorise
l'entré en appoptose et diminution du nombre des cellules.
(CUNY, 1995)
1.2.2.2- Hypothèse somatique :
1.2.2.2.1- Radicaux libres et stress oxydatif
:
Les radicaux libres existent dans tous les systèmes
vivants. Ils apparaissent comme intermédiaires dans les réactions
métaboliques d'oxydation de la cellule de nature enzymatique ou non. Les
réactions enzymatiques productrices de radicaux libres concernent la
chaîne respiratoire cellulaire, la synthèse de la prostaglandine,
le système du cytochrome
P450. Les réactions de l'oxygène avec les
composés organiques ou celles secondaires aux radiations ionisantes sont
des exemples (CUNY.1995).
Le vieillissement et de nombreuses pathologies
(athérosclérose, diabète sucré, maladies
inflammatoires, Alzheimer) s'accompagnent d'un stress oxydant
(Delattre& al., 2003)
· Définition des radicaux libres
:
Ce sont des espèces capables d'existence
indépendante contenant un ou plusieurs électrons non
appariés « dite électron célibataire »
(Hallicuel & gutterige 1999) in (Delattre& al.,
2003).
Ces radicaux peuvent se former par transferts mono
électroniques, ou par scission homolytique d'une liaison covalente.
(voir fig 13)
rupture homolytique radicaux libres.


A° + B°
A + + B - rupture hétérolytique ions
Fig.13 .Mécanisme de formation d'un radicale
libre. (Delattre& al., 2003)
Après une rupture homolytique, chacun des deux
électrons intervenant dans la liaison entre les atomes A et B gagne
l'orbital externe de ces atomes qui deviennent alors des radicaux libres. Mais
au cours d'une rupture hétérolytique le doublet
électronique est accepté par l'un des deux atomes, qui deviennent
un anion B-.
La présence d'électron libre confère aux
radicaux libres une grande réactivité. (Delattre&
al., 2003)
· Sources et réactivité des
principaux radicaux libres et espèces activées de
l'oxygène :
La formation des principales espèces activées de
l'O2 est rapportée par la chaîne de réduction monovalente
de l'O2. L'addition successible de 4é sur la molécule d'O2
conduite à la formation de molécule d'eau. (Voir
fig14)
+é + é + 2H + + é+ H++ H2O +
é+ H+

O2 O2°- H2O2
OH° H2O
Dioxygène anion super oxyde peroxyde d'hydrogène
radical hydroxyle
(Non radicalaire)
FIG.14. Source des principaux radicaux libres.
(Delattre& al., 2003)
> Radicaux super oxydes (O2°-)
:
Ce sont des radicaux relativement peu réactifs par eux-
même, mais dont la toxicitéprovient de leur pouvoir de
donner naissance à des composés plus réactifs.
Sous l'action de la superoxyde dismutase
l'O2°- se dis mute en peroxyde d'hydrogène H2O2 qui, en
présence d'ions métalliques, donne des radicaux hydroxyles OH
° très réactifs, sa forme peptonée hydroperoxyle
H2O° est beaucoup plus réactive et sa pénétration est
facilitée au niveau des membranes biologiques.
Plusieurs sources de radicaux superoxydes peuvent êtres
répertoriées in vitro, il s'agit des réactions
enzymatiques, des réactions d'auto oxydation, de protéines
héminiques, des mitochondries, du réticulum endoplasmique et du
noyau de la cellule :
- Réaction d'auto ~oxydation :
Plusieurs composés, tel que l'adrénaline, la
noradrénaline, le FMNH2, le FADH2 peuvent être oxydés en
présence d'O2°, en transférant un électron sur la
molécule O2 conduisant au radical super oxyde. (Delattre&
al., 2003).
- Protéines hémi-niques :
L'hémoglobine et la myoglobine capables de fixer l'O2 au
niveau de leur noyau héminiques (Fe+2), peuvent subir une
oxydation en présence d'O2 selon la réaction suivante :
Hème --Fe+2 -- O2 O2°- +
hème --Fe+3
La forme oxydée dénommée,
mét-hémoglobine ou met-myoglobine est incapable de transporter
l'O2 et donc inefficace. (Delattre& al.,2003)
- Mitochondrie :
La membrane mitochondriale interne contient la chaîne de
transport d'électron, lors du passage de la forme semi quinone à
la forme quinone (un coenzyme --Q) se produit une fuite d'électrons
conduisant à la formation de
O2°- .Cette production
radicalaire contribue aux attaques de l'ADN mitochondriale.
(Delattre& al., 2003)
- Réticulum endoplasmique :
La membrane de réticulum endoplasmique (REP)
possède une chaîne de transfert d'électrons microsomiques
fait intervenir des cytochromes P450. Le (REP) hépatique est très
riche en cyt p450 pour rendre les médicaments, xénobiotiques plus
hydrophiles et facilite leur élimination urinaire. Il y a aussi le
transfert d'électron qui fait intervenir la NADPH, cytochrome P450
réductase, flavoprotéine capable de réduire O2 en O2
-° .
(Delattre& al.,2003)
- Noyau :
La membrane du noyau est comme celle de la mitochondrie
contient une chaîne de transport d'électrons qui peut laisser
échapper des électrons susceptible de réduire l' O2 en O2
-°, conséquence néfaste en raison de la
proximité de l'ADN. (Delattre& al.,2003)
> Radicaux hydroxyles le OH°
:
Ce sont les plus réactifs, ils peuvent oxyder des
acides aminés, produire des coupure de brin d'ADN et des modifications
des bases puriques et pyrimidiques, et attaquer des lipides au niveau des
membranes et des lipoprotéines, initiant ainsi la peroxydation lipidique
:
> Source des OH°
1. Selon la réaction de Fenton qui est un exemple
radicalaire catalysé par des métaux de transitions et conduisant
à la formation de OH°.
Fe+2 +H2O2 Fe+3 +
OH° + OH-
Ainsi le fer pourra t'il agir comme initiateur primaire de la
peroxydation lipidique.
2. les radiations ionisantes sont aussi des
générateurs des OH°.
(Delattre& al.,2003).
Le rôle du OH° dans la
peroxydation des lipides, qui donne les peroxydes lipides qui sont
néfastes pour l'ADN (voir fig 18) et qui peuvent
être placés parmi les facteurs internes intoxiquant le
génome, et selon leur taux dans les tissus et le sang on peut constater
les risques internes sur l'ADN durant le vieillissement. (Michael,
2000)
> Monoxyde d'azote NO :
Synthétisé à partir de l'organisme grace
à l'enzyme NO synthéase.
Il est susceptible de réagir avec d'autre radicaux
libres pour former des espèces oxydantes telles que O2 - ° pour
donner le peroxynitrite ONOO-, oxydant puissant vis-à-vis de
nombreuse molécules biologiques (Delattre& al.,
2003).
- Composé oxygéné non radicalaire :
> Acide hypochloreux HOCL :
Un puissant oxydant capable de réagir avec de
nombreuses molécules biologiques notamment celles contenant des
groupements thiol (-SH) telles que les enzymes et les hormones.
(Delattre& al., 2003)
> Peroxyde d'hydrogène H2O2 :
Peu réactif en absence de métaux de transition,
capables de diffuser rapidement à travers les membranes
cellulaires. (Delattre& al., 2003)
> Peroxynitrite ONOO- :
Il induit la nitration d'acides aminés aromatiques et
l'initiation de la peroxydation lipidique. (Delattre& al.,
2003)
1.2.2.2.1.1. Les systèmes de défense
anti-oxydants :
Le vieillissement se traduit par une augmentation de radicaux
libres surtout au niveau mitochondrial et diminution dans les systèmes
antioxydants (Caillet, 2006).
1.2.2.1.2. Système enzymatique :
> Peroxyde dismutase (SOD) : les SOD
catalysent la dis- mutation mono électrique de l'anion super oxyde en
peroxyde d'hydrogène et en O2
La diminution de l'efficacité des systèmes anti
oxydant est un résultat du dérèglement des systèmes
de réparation de synthèse protéique de la cellule et la
mitochondrie.
Cu, Zn-SOD : essentiellement présentes dans le cytoplasme
des cellules.
Enzyme --Cu+2 +O2°- enzyme
--Cu++ O2

Enzyme-Cu+ + O2°- +H2+
enzyme- Cu+ +H2O2
Les ions Cu+2 nécessaires à
l'activité SOD, tandis que le Zn+ stabilisent la structure de
l'enzyme.
Mn-SOD : présente dans la mitochondrie
Mn+3+ O2°- Mn+2 +O2
> catalase :
C'est une enzyme héminique capable de transformer le
peroxyde d'hydrogène par dis- mutation en eau et en oxygène
moléculaire présent dans les peroxysome et les hématies.
Catalase --Fe+3 + H2O2 catalase --Fe+3 + H2O + O2
> peroxydase: glutathion peroxydase :
Les peroxydases sont des enzymes capables de détoxifier
le peroxyde d'hydrogène et d'autres hydroperoxydes (en particulier
d'origine lipidique) en couplant la réduction de l'hydroperoxyde avec
l'oxydation d'un substrat réducteur.
Ont se limitent aux caractéristiques de la glutathion
peroxydase (GSH-PX). Il est constitué de quatre sous unités
protéiques, comportant un atome de
sélénium dans chaque sous unité.
On mesure ainsi l'importance de sélénium pour le
bon fonctionnement de cette enzyme. Un déficit se conduit à une
baisse de l'activité de cette dernière, donc à une moindre
épuration des hydroperoxydes. (Delattre& al., 2003).
Un taux abondant en sélénium dans le corps diminue le
risque d'attrapé des maladies cardio-vasculaires, et joue un rôle
dans la prévention du vieillissement prématuré.
(Michael.2000).

SOD
O2 H2O2 H2O
catalase ~glutathion peroxydase.
+ NO° +Fe+2 (reaction de
Fenton)
ONOO- OH°+ OH-+ Fe
+3
Nitration et oxydation oxydation des lipides, ADN et des
protéines.
Des protéines.
Fig.15. Coopération entre enzyme anti-1 \
CD(MBS'DSLIs BI7 BDttLe] BDO,B2EE3).B 1.2.2.2.1.3. Système non
enzymatique :
Comporte des composés synthétisés in
vitro tel que la bilirubine, les hormones sexuelles
(oestrogène),la mélatonine ,l'acide lipoique, le coenzyme Q,
l'acide urique et des composés apportés par l'alimentation
comme l'acide ascorbique ,vitamine E , les caroténoïdes ou les
poly- phénols.
On peut les classer selon qu'ils sont hydrosolubles, assurant
une protection des milieux intra cellulaires, ou liposolubles agissant au
niveau des membranes lipoprotéines circulantes :
> antioxydants hydrosolubles :
L'acide ascorbique, glutathion réduit, l'acide urique
et poly phénols. Notons en outre le rôle protecteur
vis-à-vis du stress oxydant des protéines telles que la
ceruléoplasmine qui empêchent la formation du OH°
.
Les éléments traces (Zinc, Cuivre,
manganèse, sélénium) ont une grande importance dans la
défense anti-radicalaire, en raison de leur participation au
fonctionnement des enzymes anti-oxydantes. (Delattre& al.,
2003).
- L'aFideIahF1IEITXe :
Est un composé réducteur qui agit en synergie avec
l' á tocophérol en permettant sa
régénération.
- le glutathion réduit :
Joue un rôle majeur dans la détoxification des
hydroperoxydes par les glutathion peroxydases. (Delattre&
al.,2003).
- Les poly phénols :
Parmi les quels les flavonoïdes, sont des piégeurs
de radicaux libres et des chélateurs d'ions métalliques Fer. Ils
fonctionnent notamment en cédant un atome d'hydrogène à
des radicaux formés lors de la peroxydation lipidique.
> antioxydants liposolubles :
La vitamine E, la B carotène, l'ubiquinol 10 et le
lycopéne sont des antioxydants liposolubles transportés par les
lipo- protéines en particulier LDL, qu'ils protègent contre la
peroxydation lipidique.
Le composant majeur de la vitamine E est l'á
tocophérol, il consiste à piéger des radicaux pyroxyles le
RO2° issus de la peroxydation lipidique.
Les caroténoïdes dont font partie le
â.caroténe (carotte, chlorophylle) et le lycopéne
(présent dans les tomates) piègent l'oxygène singlets. Le
B carotène est aussi capable de piéger des radicaux peroxyles et
protège ainsi les LDL dans les quels il est transporté.
(Delattre& al.,2003).
1.2.2.2.1.4. Oxydation des molécules biologiques
:
> oxydation des lipides ;
Les acides gras poly- insaturés, qu'ils soient sous
forme non estérifiée (AGNE) ou estérifiée
(phospholipides, esters de cholestérol, triglycéride) sont la
cible lipidique majeur des radicaux libres ainsi que le cholestérol
libre. Donc chez les mammifères, les membranes plasmiques et les
complexes albumine-AGNE soient particulièrement
vulnérables. (Delattre& al.,2003).
L'initiation : est due à l'attaque
d'un radical libre entraînant l'abstraction d'un atome d'hydrogène
situé sur -CH2 pour la formation de radical centré sur le carbone
RO°. Ce RO° combine avec O2 pour donner un
radical pyroxyle ROO°. Rappelons que l'O2 est une
molécule hydrophobe capable de ce concentrer au sein de la
double couche phospholipidique des membranes.
Le ROO ° est capable d'arracher un atome
d'hydrogène d'un autre acide gras polyinsaturé en donnant un
hydroperoxyde de ROOH et un nouveau radical R° qui agit avec l'O2 pour
former un autre ROO°et la chaîne de peroxydation continue, c'est la
prolongation.
L'abstraction d'un H ° peut avoir lieu sur plusieurs
carbones de la chaîne d'acide gras. Par exemple l'acide linoléique
sa peroxydation donne deux hydroperoxydes.
Acide arachidonique= 6 ROOH.
La terminaison peut survenir par recombinaison de deux radicaux
libres par exemple : RO20 + RO20 ROOR + O2
Les peroxydes formés se décomposent sous l'effet
de la chaleur ou en présence d'ions de transition (Cu+2), et
libèrent de nombreux produit tels que des hydrocarbures (éthane),
des aldéhydes (dialdéhyde malonique) MAD ce dernier agit
aisément avec les groupement aminés libres des
Apo-lipoprotéines (Apo A1, Apo B...) plus particulièrement avec
les groupement lysines.
Les modifications du MAD sur certaines lysines de l'Apo B des
LDL, inhibe leur liaison avec les récepteurs Apo B/E, entravant leur
internalisation cellulaire.
Le 4 --hydroxynonénol formé au cours de la
peroxydation de l'arachidonique et linéique, est responsable de la
génotoxicité, inhibe la croissance cellulaire.
(Delattre& al., 2003).
> Oxydation du cholestérol :
Elle conduit à la formation d'hydro- peroxyde d'ester de
cholestérol et des oxystérols.
Ils on été mis en évidence dans le
plasma, lipoprotéine et plaque d'athérome lors de la biopsie. Ils
peuvent être apportais par l'alimentation ou générés
in vitro, ils ont un rôle d'initiation et le
développement de la plaque d'athérome.
Le 27 hydro cholestérol et le 7 céto
cholestérol sont de puissants agents cytotoxiques pour les cellules de
la paroi vasculaire (cellules endothéliales, cellules musculaires
lisses). (Delattre& al., 2003).
> Oxydation des phospholipides :
Les membranes cellulaires constituent les premières
cibles pour les radicaux libres circulants. Elles y sont sensibles
particulièrement à cause de leur richesse en acides gras
insaturée. Le système nerveux central est particulièrement
sensible aux radicaux libres à cause
de sa grande consommation d'oxygène, et de la grande
concentration de lipide poly insaturés « myéline », et
de sa faiblesse en enzymes antioxydants. (Borg &
Reeber.2005).
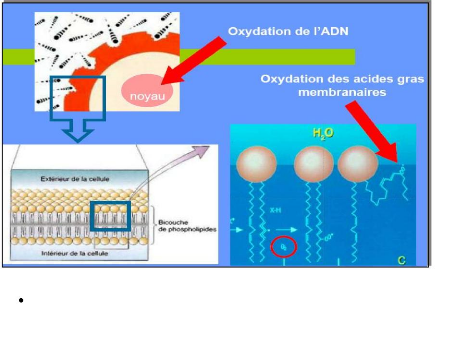
déformer (fluidité membranaire) (voir
fig 16). A ce niveau, le mécanisme oxydatif intervient sur les
structures phospholipidiques, très insaturées, et les
protéines présentant un groupement thiol (cystéine) par
formation de ponts disulfures. Cette dénaturation et à l'origine
:
De remaniements structuraux des récepteurs de surface
(difficulté ou incapacité à reconnaître les
substrats), se phénomène peut être la cause de
l'insulinorésistance au cour du diabète.
L'attaque des membranes modifie leurs propriétés
biologiques et leur capac
Fig.16. Attaques radicalaires des membranes biologiques
(Caillet, 2006).
ité à se


D'une régidification des structures membranaires
particulièrement handicapantes pour les érythrocytes
(chaîne respiratoire).
De modification des capacités d'échange (Na+, H+,
Ca++).
Du fait des sa très brève demie de vie (10-9
seconde), le radical OH° ne peut exercer son effet toxique que localement
c'est-à-dire sur sont lieu de production (foie, muscle,
érythrocyte...). A l'opposé O2° et H2O2 du fait de leur
relative stabilité, peuvent diffuser dans les liquides extracellulaires
et produire leurs effets toxiques à distance. (Pilardeau,
1995).
> Oxydation des protéines et acides
aminés :
Les protéines intra et extra- cellulaire sont des cibles
de radicaux libres. Elles prouvaient piéger 50 à 70 % des
radicaux libres générés par la cellule.
(Delattre& al., 2003).
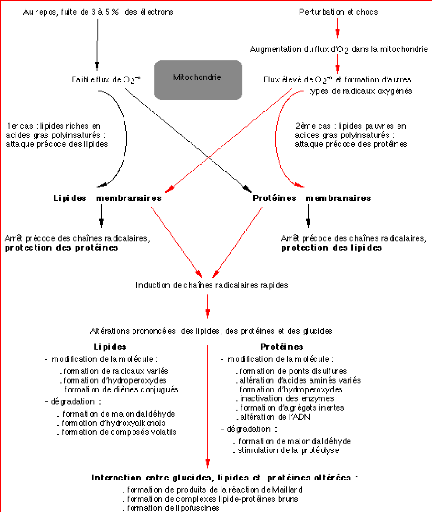
L'attaque des RLO porte également sur la
dépolymérisation de l'acide hyaluronique ce qui explique la perte
de l'eau. (P. Pilardeau, 1995).
L'ADN et L'ARN sont aussi des cibles privilégiées
de radicaux libres.
L'ADN d'une cellule peut être le siège de 10000
attaques radicalaires /jour.
Dans l'ADN nucléaire présente une base
modifiée par les radicaux libres sur 130000 bases, et une baes sur 8000
pour l'ADN mitochondrial. Cela est due au fait que la mitochondrie est le
siége d'un métabolisme important d'O2, plus de 90% de l'O2
cellulaire. Il peut y avoir un échappement continu de radicaux libres de
la chaffne respiratoire.
Le OH° est le radical le plus réactif avec l'ADN
et l'ARN, car il réagit facilement avec les bases (puriques,
pyrimidines) et avec les sucres (ribose, désoxyribose). Les
protéines nucléaires « histones » sont également
attaquées par les radicaux libres oxygénés, entraffnant la
formation de liaisons croisées ADN-histone par la formation de ponts
thymidine --tyrosine (voir fig 18). Ces liaisons
croisées interfèrents sur la réplication, transcription,
et la réparation de l'ADN. (Delattre& al.,
2003).
Cette opération est l'événement principal
dans le vieillissement des cellules de faible capacité de renouvellement
ou qui ne se divisent pas, d'où le dérèglement dans les
fonctions de ces cellules et leur destruction, est parmi les
déterminants principaux du vieillissement de tout le corps.
(Michael, 2000).
Des concentrations accrues de bases oxydées ont
été observées dans l'ADN au cours du vieillissement ainsi
que chez les patients diabétiques. (Delattre& al.,
2003).
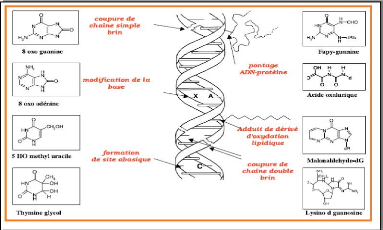
Fig18. Les principaux dommages oxydatifs
médiés à l'ADN par les RLO. (Favier,2003)
Les bases qui composent l'ADN, et particulièrement la
guanine, sont sensibles à l'oxydation. Engendrant un grand nombre de
bases modifiées : 8 oxo guanine, 8 nitroguanine, 8 oxo
adénine,
5 hydroxy cytosine, 5 hydroxy méthyle uracile, thymine
diol, oxazolone.
I.2.2.2.2- Glycation non enzymatique des protéines
:
Les protéines de demi-vie longue subissent des
modifications au contact de glucose exemple « hémoglobine HA1c
».
Les protéines de la matrice extra cellulaire, de
durée de vie très longue, sont très touchées par la
glycation (CUNY, 1995). (Pour la biochimie de la glycation
voir chapitre II.) I.2.3. Eco gérontologie « facteur
environnementaux » :
Notre vie est exposée non seulement au matière
bénéfique pour notre corps mais aussi au matière polluante
de l'environnement, et de produits nutritionnels naturels qui contiennent des
matières capables d'altérer le matériel
génétique, exemple : les insecticides, engrais dans les fruits et
les légumes, ces matières sont appelées les facteurs
exogènes génotoxiques ainsi que l'alcool et les cigarettes, ces
deux produits provoquent des lésions de l'ADN et altèrent les
mécanismes de réparation.
La fumée d'une cigarette provoque des
altérations dans l'ADN au nombre de 104 dans chaque cellule,
équitable aux lésions provoquées par les radiations
ionisantes de grande dose, et qui sont responsables d'une sénescence
physiologique accéléré.
Chez les fumeurs commence le processus de vieillissement et
s'accélère surtout dans les poumons « plus de contacte avec
les matières génotoxique », et apparaissent les maladies
liées au vieillissement, ainsi que celui de la peau, il y a apparition
de ride, et changement dans sa couleur chez le fumeur.
Pendant la production de l'énergie, il y a
dégagement de matières polluantes qui ont la possibilité
de diminuer la durée de vie, donc les problèmes de pollutions ont
des effets sur la santé et la longévité et provoquent le
vieillissement prématuré et ses morbidités.
Un taux de lipide surtout les graisses saturées dans la
nutrition peuvent altérer l'ADN par leur oxydation. (Michael,
2000).
On peut conclure que :


le vieillissement cellulaire résulte des effets
intriqués de facteurs génétiques et environnementaux aux
quel est soumis l'organisme .
les facteurs environnementaux et le mode nutritionnel peuvent
arrêter le mécanisme d'altération de l'ADN, comme ils
peuvent l'accélère. (Michael, 2000)


l'influence de déterminants socioculturels : les plus
défavorisés présentent toujours les taux les plus
élevés de morbi- mortalité et d'espérance de la vie
la moins élevée. (Fox. 1989, Regidor et Coll.1995) in
(Charles &al., 2003).
les facteurs qui diminuent les risques cardio-vasculaires, les
cancers, le vieillissement prématuré et parmi ces facteurs
efficaces pour la longévité sont très simple : les efforts
physiques tempérés, la nutrition qui contient des antioxydants et
des suppléments tels que vitamine E, le B carotène, augmentation
d'ingestion de fibres alimentaires qui réduit le transit intestinal,
hypolipémiant. Les fibres absorbent les matières polluantes
cancéreuses qui sont ingérées avec les aliments. .
(Micheal.2000).
Quelles que soient les théories du vieillissement
celui-ci est conditionné par 3 types de facteurs: - des facteurs
génétiques ; des facteurs exogène (l'environnement,
l'alimentation, et activité physique) et psychosociaux ; des facteurs
pathologiques : les maladies accélèrent le vieillissement,
ajoutant au vieillissement primaire, un « vieillissement par
surcroît », ou secondaire. (CUNY, 1995).
II.1. Effet du diabète sur le vieillissement
corporel:
Le diabète sucré est défini par un
désordre métabolique, d'étiologies diverses,
caractérisé par la présence d'une hyperglycémie
chronique accompagnée d'une perturbation des métabolismes
glucidiques, lipidiques et protéiques, résultant d'un
défaut de sécrétion d'insuline (voir figure
19), de son activité ou des deux associés. Outre les
complications aiguës liées à une absence ou une mauvaise
adaptation du traitement (comas acidocétosique,hyperosmolaire,
hypoglycémique). L'hyperglycémie chronique s'accompagne de
complications apparaissant au long cours et touchant de nombreux organes,
particulièrement l'oeil, le rein, les systèmes nerveux et
cardio-vasculaire.
Le diabète est une maladie mondialement répandue et
dont la prévalence est importante et en augmentation.
(Gillery& al, 1995)
Fig 19. Régulation de la glycémie (Wahren
& Ekberg 2007)
Parmi les maladies du 3ème age, le
diabète tient un rôle tout particulier, non qu'il soit le plus
fréquent car l'artériosclérose, l'arthrose touchent
à des degrés divers pratiquement tout le monde, mais c'est
à cause de sa gravité et de l'apparition relativement
précoce de certains de ses symptômes que cette maladie retient
l'attention des gérontologues.
Plusieurs symptômes du diabète imitent en effet
un vieillissement accéléré, ainsi la durée de vie
en culture de fibroblastes des diabétiques est plus courte que celle des
donneurs du même âge non diabétiques. (Robert,
1989).
II.1.1. Diabète et vieillissement de la matrice
extracellulaire :
Les manifestations vasculaires du diabète rappellent une
accélération de l'horloge biologique, en particulier en ce qui
concerne l'évolution de la matrice extracellulaire.
Dans le diabète les petits vaisseaux, les capillaires
sont altérés, il y a aussi le développement d'une
athérosclérose précoce et grave. Tout diabète est
une maladie des tissus conjonctifs, tout se passe comme si le programme de
synthèse des constituants de la matrice extracellulaire avait
été modifié. La lame basale qui entoure les capillaires
des diabétiques est souvent épaissie. (Robert 1989).
(Voir figure.19)
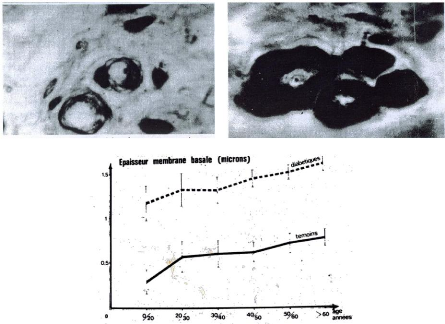
Fig 20. Vieillissement des petits vaisseaux
(capillaires). (KERN et ROBERT, 1983.)
Ces figures montrent :
- Augmentation de l'épaisseur des lames basales au
cours du vieillissement chez les diabétiques et les non
diabétiques. Les microphotographies représentent des capillaires
diabétiques aux parois considérablement épaissies. Cet
épaississement s'accompagne d'irrégularités de parcours et
d'une augmentation de la perméabilité de la paroi (micro
angiopathie diabétique)
Les déviations du programme normal de
biosynthèse de la matrice extracellulaire sont à la fois
quantitatives et qualitatives. Il y a épaississement mais aussi
l'apparition de fibrilles de Collagène interstitiel (de type III),
normalement absent des lames basales. La figure 20 montre la
progression avec l'age de l'épaississement des lames basales capillaires
selon les mesures de Patrick Kern, chez les diabétiques et les non
diabétiques . (Robert, 1989) (Voir Fig.20)
Mais la courbe des diabétiques est
décalée vers le haut : des le début, il y a un
excès de fabrication de matériaux composant la lame basale. Ses
composants principaux qui augmentent sont le collagène de type VI, la
laminine et la fibronectine. Chez la moitié environ des
diabétiques de fines fibrilles, apparemment de type III ont pu
être détectés, absentes chez les non diabétiques,
cela pourrait bien expliquer l'une des complications fréquentes du
diabète, les thromboses. Le collagène de type VI n'arrête
pas les plaquettes, le collagène de type III les retient fortement et
peut bien provoquer l'arrêt de la circulation dans les capillaires. Cela
se produit d'autant plus facilement que la dérégulation de la
synthèse des constituants des lames basales des capillaires aboutit a un
parcours irrégulier avec des élargissements micro
anévrismes : (dilatation pathologique de la membrane d'une artère
ou d'un vaisseau formant une hernie remplie de sang) et
rétrécissement (voir photo) provoquant. L'agglutination en
chapelets des globules rouges dont le passage à travers ces capillaires
irrégulier est fortement ralentie. (Robert 1989).
La réaction de Maillard dans l'organisme à une
grande importance dans l'altération des lames basales des capillaires
des diabétiques, le collagène de type VI de ces lames fixe aussi
le glucose ce qui altère ces propriétés.
La fibronectine dans les tissus et dans le sang subit aussi cette
réaction de Maillard et voit sa capacité de colle biologique se
détériorer chez le diabétique. (Robert
1989).
II.1.2. Complication du diabète :
II.1.2.1. Complications macro vasculaires « macro
angiopathies » :
Le diabète est associé à une
athérosclérose, apparaissant généralement de
manière précoce, source notamment d'insuffisance coronarienne et
d'artérite des membres inférieurs. L'athérosclérose
est devenue la première cause de décès des
diabétiques. L'insuffisance coronarienne et les accidents vasculaires
cérébraux sont 2 à5 fois plus fréquents chez le
diabétique que chez les non diabétiques.
L'arthrite des membres inférieurs est 4 fois plus
fréquente chez le diabétique, elle est caractérisée
par la fréquence des gangrènes conduisant à des
amputations. (Delattre&all., 2003)

Athérosclérose.
La pathogenèse de l'athérosclérose chez
les diabétiques débute par un dysfonctionnement
endothélial résultant d'une diminution de la production
endothéliales de NO (le monoxyle d'azote permet la vasodilatation).
(Delattre& all., 2003)

Rigidité des gros troncs artériels GTA au
cour du diabète
II.1.2.2. Complication micro vasculaire (micro angiopathie)
:
La micro angiopathie diabétique s'exprime par une
rétinopathie, une néphropathie et une neuropathie. Leurs
principaux caractéristiques sont : une augmentation du débit, de
la pression, et de la perméabilité capillaire avec une
transmission direct, sans autorégulation hémodynamique de la
pression artérielle systémique ; une augmentation du
diamètre des capillaires, une modification de leurs membranes basales
(Glycation du collagène) et de la matrice extra cellulaire. Ces
anomalies s'aggravent et deviennent irréversibles, la
perméabilité augmente, les capillaires s'obstruent,
entraînant une perte des cellules micro vasculaires .Ces anomalies
entraînent des oedèmes et des ischémies notamment
rétiniennes. (Delatter&all., 2003)
> Rétinopathie :
La perte des péricytes capillaires est l'une des
premières et des plus spécifiques manifestations s'associer
à la rétinopathie diabétique. 20% des diabétiques
de type 2 présentent une rétinopathie au moment du diagnostic de
leurs maladie, 1.4 % de cécité et 7.2 % d'insuffisance visuelle
sévère. Le diabète est ainsi la première cause de
cécité non traumatique. (Délatter &t all.,
2003)
> La néphropathie :
Elle est définie par une protéinurie
persistance, une diminution de la filtration glomérulaire, une
hypertension artérielle et des changements morphologique du rein avec
plumérulosclérose. La prévalence de la néphropathie
dans le diabète de type 2 augmente de manière assez rapide et est
devenue la 1ère cause d'insuffisance rénale terminale
dans de nombreux pays. (Delattre& all., 2003)
> Neuropathie diabétique ;
La neuropathie diabétique est le plus souvent
classée dans les micro- angiopathies bien que son étiologie ne
paraisse pas uniquement d'origine micro vasculaire
le cycle de Krebs est ralentit dans le système nerveux
central en perturbant les synthèse lipidiques (myélinisation) ce
qui s'explique par une diminution de la vitesse des conductions nerveuses et la
formation des neurotransmetteurs. (Delattre&all., 2003)
II.1.2.3. Diabète et production de radicaux libres
:
Dans le diabète une auto oxydation du glucose,
présente à forte concentration dans les milieux intra et extra-
cellulaire, conduit à la production de radicaux libres superoxydes et
participe donc à la genèse du stress oxydant et ces complications
(qui ont été discuté au 1er chapitre).
(Delattre&al., 2003)
Les mécanismes de la toxicité tissulaire dues
à l'hyperglycémie sont multiples et encore imparfaitement connus
; certain peuvent ne concerner qu'un seul tissu tandis que d'autre s'appliquent
à un grand nombre d'organes.
A la différence des cellules musculaires lisses
vasculaires, les cellules endothéliales ne peuvent réguler
l'entré de glucose ainsi l'hyperglycémie induit une augmentation
de la captation cellulaire de glucose qui va à son tour stimuler la
production par les mitochondries d'anion superoxyde O2 -°.
II.1.2.4. Activation de la voie des polyols :
L'hyperglycémie intra- cellulaire entraîne une
déviation d'une partie du glucose vers la voie des polyols par
l'intermédiaire de l'aldose réductase, générant
aussi du sorbitol. Le sorbitol ainsi accumulé, du fait de son pouvoir
osmotique jouerait un rôle dans la genèse de la cataracte, et
exercerait une action toxique sur la cellule nerveuse.
Par ailleurs, l'aldose réductase utilisant comme
co-facteur le NADPH, une déplétion intra cellulaire de cette
enzyme réduite est ainsi crée, déplétion à
l'origine de multiple conséquences touchant notamment certaines enzymes
antioxydantes ce qui pourrait concourir à aggraver l'excès de
radicaux libres. (Guillausseau, 1992).
II.1.2.5. Activation de la formation des AGE :
Mort apoptotique des neurones causée par les radicaux
libres.
> Glycation et glycoxydation :
La glycation et la glycoxydation figurent parmi les plus
caractéristiques des modifications post-traductionnelles tardives des
protéines qui fournissent les bases métaboliques à de
nombreux phénomènes physiologiques chez l'homme, tels que le
vieillissement, l'insuffisance rénale, l'athérosclérose ou
le diabète sucré (Gillery, 2006)
La glycation est provoquée par la fixation d'oses
simples ou de leurs dérivés groupement aminés des
protéines. C'est une réaction irréversible et cumulative,
consistant à la création d'une liaison covalente entre la
fonction aldéhyde du glucose et un groupement amine libre d'une
protéine. Dans un premier temps, il se forme une base de Schiff
subissant un réarrangement dit d'amadori qui stabilise la condensation
du résidu osidique sur la chaîne protéique.
(Gillery, 2006)
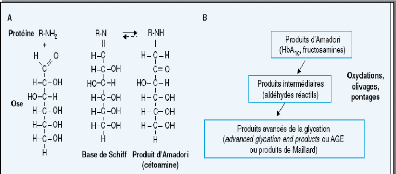
Fig.21. Etape A précoce et tardive B de la
glycation non enzymatique.(Gillery, 2006)
L'HBA1c et les fructosamines sont des exemples
caractéristiques de produit d'amadori évaluées en biologie
clinique au cours du suivi des patients diabétiques. En effet les
produits d'amadori ne constituent pas un état définitif
ultérieurement, lorsque leur demi de vie est supérieure à
8 ou 10 semaines ils subissent de nombreuses réactions oxydatives
(figure 21.B) formant des
intermédiaires réactifs (notamment des aldéhydes comme le
méthylglyoxal) et aboutissant à la formation de composés
de structure complexe dénommés produit de glycation avancé
(AGE), ou produit de Maillard(Gillery,2006)
Les AGE sont caractérisés par leur accumulation
tissulaire, notamment sur les protéines à longue durée de
vie comme le collagène de type I.
La glycation modifie la structure des protéines
(formation de liaisons croisées, modification de
l'antigénicité), mais également leur fonction
(activité enzymatique ou biologique) et leurs rapports avec les cellules
(les cellules inflammatoires). Les protéines glyquées
interviennent dans des phénomènes aussi divers que
l'inflammation, le remodelage tissulaire, l'appoptose ou encore
l'angiogénése. Donc, l'apparition des complications à long
terme du diabète est corrélée à la quantité
de l'équilibre glycémique à l'intensité de la
glycation. (Gillery, 2006)

Mécanisme réactionnel de la glycoxydation
:
La plupart des étapes de la glycation s'accompagnent d'un
stress oxydant, à tel point que l'ensemble du processus est souvent
désigné sous le nom de glycoxydation.
La glycation des LDL aussi bien que celle du collagène
cutané sont liés à leur Oxydation. Ces constations
expérimentales ont été renforcés par l'observation
que l'inhibition des processus oxydatifs prévenait la formation de
certains AGE. (Gillery, 2006)
Toutes les étapes de la glycation
génèrent des radicaux libres oxygénés (ROL) aussi
bien au stade du produit initial que des produits intermédiaires et
avancés, conduisant à la formation d'aldéhydes
réactifs dont l'un des plus abondants est le Methylglyoxal (MGO). Ainsi
les produits d'amadori comme les protéines glyquées plasmiques
réagissent avec l'oxygène moléculaire pour former de l'ion
superoxyde à pH physiologique ou encore H2O2.
Les voies de la glycation aboutissent ainsi à des
composés communs avec ceux issus de la peroxydation lipidique. Certain
AGE comme la carboxyméthyle lysine (CML) sont également des ALE
(produit de lipoxydation avancée) et se forme uniquement par oxydation
au cours de la peroxydation lipidique sans glycation préalable.
(Gillery, 2006)

Récepteurs des protéines glyquées et
des produits avancés de glycation :
Une autre possibilité d'intervention des AGE dans les
métabolismes oxydatifs est liées à leur capacité de
se fixer à des protéines membranaires spécifiques, RAGE
(Récepteurs des AGE). Par exemple récepteurs scavengers de classe
A et B (CD36). Ce dernier capable d'internaliser les AGE notamment dans les
monocytes / macrophage, pourrait intervenir dans la fixation des LDL
oxydées. Le récepteur le mieux connu est RAGE,
glycoprotéine de 45 KDa exprimé à la surface de nombreuse
cellules telles que: cellules endothéliales, les cellules musculaires
lisses, les lymphocytes, les monocytes, les polynucléaires et les
neurones. La fixation des AGE sur RAGE déclenche une signalisation
entraînant un stress oxydant intra- cellulaire et l'expression de
gène impliqué dans la réponse inflammatoire.
(Gillery, 2006)
Les produits de glycation plus précoces de type amadori
peuvent également générer des processus cellulaires
inflammatoires ainsi l'albumine glyquée induit la production
d'interleukine IL8 (chimio-attractante et activatrice des
neutrophiles et des éosinophiles), et de MOP-1 (monocyte chimiotactic
protéine 1) (chimio-attractante pour les monocytes et les lymphocytes)
dans les cellules épithéliales rétiniennes pigmentaires.
Dans ce modèle l'albumine glyquée agit en synergie avec le
TNFá. Dans les cellules musculaires lisses, elle active la production de
monoxyde d'azote.
Les interactions entre les produits de glycation et leurs
récepteurs participent donc dans la plupart des cas au
développement d'un stress oxydant et d'un état pro-inflammatoire
des cellules. (Gillery, 2006)

Produit de glycoxydation et fonctions cellulaires
:
De récentes investigations réalisées lors
de biopsie rénales chez des patients diabétiques ont-elles mis en
évidence une accumulation importante de carboxy méthyle lysine et
la pentosidine au niveau de mésengium rénal et des lésions
modulaire qui sont incriminés dans les complications rénales du
diabète.
L'augmentation de production de certain cytokines, ou facteurs
de croissance conduit à altérer le fonctionnement de certains
processus importants de l'homéostasie vasculaire. (Gillery,
2006)
De nombreuses recherches thérapeutiques visant à
retarder les complications du diabète sucré, qui font appel
à des molécules anti-oxydantes et anti-AGE sont en
développement. Aussi les antidiabétiques oraux par eux même
répondaient à ce critère. Ainsi le glyclazide, une
sulfonylurée, possède des propriétés anti-oxydantes
et la Metformine est douée à la fois de propriété
anti oxydante et anti-AGE (Délatter&al.,2003)
II.2. Insuffisance rénale chronique (IRC) et
vieillissement :
L'insuffisance rénale chronique se définit par une
diminution prolongée, souvent
définitive, des fonctions
rénales exocrines et endocrines. Elle s'exprime essentiellement
par
une diminution de la filtration glomérulaire (FG)avec
augmentation de la créatininémie et de
l'urée sanguin
(urémie) par la diminution de la clairance de la créatine. Elle
peut aboutir à
l'insuffisance rénale terminale (IRT) qui
nécessite suppléance (épuration extra --rénale
(EER)
par hémodialyse ou dialyse péritonéale et /ou par
transplantation rénale. (Anonyme IV,
2005)
L'insuffisance rénale chronique entraîne des
altérations métaboliques et des
dysfonctionnements
nutritionnels et hormonaux nombreux. À terme, ces altérations
sont à
l'origine de complications telles que l'anémie,
l'ostéodystrophie rénale, l'insulinorésistance,
la
dyslipidémie et la dénutrition. De plus, l'accumulation de
cytokines pro-inflammatoires, le
stress oxydant accru et les infections
répétées participent à la persistance d'un
état
inflammatoire chronique. Il existe une corrélation
étroite entre la dénutrition et l'inflammation
et ces deux anomalies contribuent largement à une
survie réduite de ces patients lorsqu'ils sont traités par
dialyse chronique. Il est donc essentiel de détecter de façon
précoce les anomalies métaboliques et de les traiter avant
même le stade de dialyse pour diminuer la morbi-mortalité
essentiellement cardiovasculaire. (Fidsum &Dénis,
2004)
Au cours de l'IRC, on observe une importante accumulation
d'AGE dans l'organisme, liée à un défaut
d'élimination par le rein. Ce qui a favorisé l'hypothèse
d'un stress oxydant délétère. (Gillery,
2006)
La rétention hydro sodée, notamment contribue
à l'hypertension artérielle, l'hypertrophie ventriculaire gauche
(HVG), et l'augmentation de l'épaisseur de la paroi artérielle.
Tous ces éléments concourent à l'augmentation du risque
cardiovasculaire. L'anémie est un facteur de risque d'insuffisance
cardiaque et de mortalité cardiovasculaire chez le patient
dialysée. (Foley& al, 2004). L'inflammation joue un
rôle central dans la physiologie et l'évolution de
l'athérosclérose. Plusieurs facteurs peuvent stimuler la
réponse inflammatoire durant la dialyse (contamination du dialysat,
biocompatibilité des membranes, accès vasculaire.). Des taux
anormalement élevés de CRP ont été rapportés
chez 30% à 60% des patients avec IRC. Ainsi, l'étude CREED
(Cardiovascular Extended Evaluation in Dialysis) a montré que les
niveaux de CRP étaient non seulement corrélés au nombres
de plaques d'athérosclérose chez les dialysées mais aussi
à une augmentation du risque de décès de toute cause dans
la population des dialysées. (Madore, 2004).
Au cour des séance de dialyse, il y a une production
accrue d'hyper oxydes par les plaquettes et d'anion super oxyde O2° par
les monocytes et les polynucléaires. Par ailleurs, les système de
défense anti-radicalaire sont profondément altérés
: baisse de l'activité SOD globulaire et la vitamine E
érythrocytaire. Les perturbations du métabolisme oxydatif en
hémodialyse sont multifactorielles ; leur prévention doit
êtres à plusieurs niveaux : amélioration de la
biocompatibilité du matériel de dialyse, suplémentation en
antioxydant. (Cristol, 1997).
II.3. Stratégie pour ralentir le vieillissement
:
Plusieurs travaux de recherche ont monté qu'il est
possible d'influencer le vieillissement ou la longévité par des
facteurs expérimentaux.
Certains effets du vieillissement étant sous le
contrôle de facteurs biologiques sont modulables par des interventions
sur ces facteurs, si bien que des stratégies capables de ralentir le
vieillissement sont envisageables (OZ, 2008)
1. La restriction calorique :
Elle pourrait agir en ralentissant la glycation des
protéines ou en améliorant la protection de l'organisme contre
les radicaux libres. (OZ, 2008).
2. L'activité physique :
L'activité physique a certains effets qui s'opposent
à ceux du vieillissement :
> Ralenti la diminution de la masse musculaire liée
à l'avance en age.
> Limite l'augmentation de la masse grasse et les
problèmes métaboliques
associés.
> Les fonctions cardiovasculaires sont mieux
préservées chez les sujets âgés qui ont une
activité physique régulière. (OZ,
2008)
3. Nutrition et vieilissement :
Les antioxydants sont un ensemble de molécules
susceptibles d'inhiber directement la production, de limiter la propagation ou
de détruire les espèces actives de l'oxygène. Ils peuvent
agir en réduisant ou en dismutant ces espèces, en les
piégeant pour former un composé stable, en séquestrant le
fer libre ou en générant du glutathion. (Favier,
2003).
a. La lutte contre le stress oxydative :
l'alimentation contient un très grand nombre
d'antioxydant non seulement les vitamines (A, E, C) et les
oligoélément (sélénium, cuivre, zinc,
manganèse), mais aussi 600 sortes de caroténoïdes (le
â carotène, l'á carotène, le lycopéne
trouvé dans la tomate, la lutéine, la â cryptoxanthine)
,4000 polyphénoles et flavonoides trouvés dans le chou, le
thé (les tanin du thé), le vin, céréales et fruits,
des alcaloïdes, des phytates, des dérivés soufrés de
l'ail et de l'oignon, des dérivés indoliques du chou.
(Favier, 2003).
Les produis végétaux sont une source majeur des
micronutriments antioxydants exogènes, pour cela il recommander de
prendre 5 fruits et légumes par jour. (Favier,
2003).
b. Supplément alimentaire :
1) Les suppléments recommandés par Dr OZ:
> 2500UI de vitamine A pour les personnes âgés
de 40 ans et plus.
> 2 capsules de d'aspirine par jour pour assurer une bonne
fluidité sanguine.
> 1000 UI de vitamine D pour diminuer les risque
d'ostéoporose, cette quantité
peut méme êtres
rapportée par l'exposition au soleil pendant 1/4 h chaque jour.
2) Les épices qui participent au bon fonctionnement du
système cardiovasculaire : Cannelle, paprika, gengembre, curry, rose
mary. (OZ.2008)
3) Les fibres alimentaires : du fait de leur rôle
hypoglycémiant, hypolipémiant, favorisent un bon transite
intestinal et jouent un rôle dans la détoxification car ils
absorbent les matières toxiques ingérés et trouvant dans
les intestins (Michael, 2000). les doses recommandées
sont de 25g de fibres par jour rapportées par les légumes et
fruits.
4) Les omégas : acide gras poly insaturés, les
omégas 3 et 6 sont des constituants à part
entières de nos cellules et sont essentiels car notre
organisme ne sais pas les
synthétiser. Les rapports conseillés sont 2g pour
l'homme et 1.6g pour une femme.
> Les poissons sont très riches en oméga3
surtout poissons gras tels que les
sardines.
> Ils représentent 15 à 25% des graisses du
cerveau.
> Ils améliorent la résistance du coeur et des
artères, favorisent la longévité, le fameux régime
crétois assure la longévité
> Améliore l'élasticité des
artères, Rôle essentiel dans la vision.
> La présence d'oméga 3 permettra un meilleur
maintient des performances
> Des apports élevés d'acides gras
saturés et trans-insaturés sont associés à une
augmentation du risque de la maladie d'Alzheimer alors que les apports en
acides gras mono- et poly-insaturés ont un effet protecteur contre le
déclin cognitif. (OZ.2008)
III. Age biologique :
Nous avons tous observé les différences qui
peuvent exister entre l'âge apparent d'un individu et son âge
chronologique (déterminé à partir de sa date de
naissance). L'âge chronologique, en effet, ne reflète qu'en partie
notre vieillissement personnel. Il devenait donc indispensable d'être
plus discriminatif et de mieux appréhender notre statut organique
réel, en trouvant une autre référence. Cette
évidence a depuis longtemps intéressé de nombreux
chercheurs principalement aux Etats-Unis et au Japon. Les principales
études sur l'âge biologique ont été faites par Heron
et Chown (1967), Dirken (1972), Siegler (1978), Shock (1980), Costa et McCrae
(1980) et Dean (1988).
L'âge biologique ou âge fonctionnel ou âge
physiologique reflète l'état physiologique ou fonctionnel exact
de l'individu. Cet âge biologique peut d'ailleurs correspondre à
l'âge chronologique de la personne. Mais il est habituel de rencontrer
des gens qui ne font pas du tout leur âge. Ils font soit plus jeune, soit
plus vieux, et parfois même beaucoup plus vieux
que leur âge. Il apparaît que ces gens sont
effectivement biologiquement plus âgés que ne le voudrait leur
âge chronologique.
III.1. Les critères de choix de paramètres de
mesure de l'âge biologique :
Ils sont multiples. Ils doivent se modifier avec l'âge ;
être représentatifs d'une ou plusieurs fonctions physiologiques ;
être capables de détecter de légères modifications
de l'état fonctionnel ; être non traumatiques et sans danger pour
l'individu ; avoir des résultats reproductibles ; mesurer une fonction
importante ; ne pas être redondants ; être susceptibles
d'influencer le rythme du vieillissement. L'ensemble de ces tests doit fournir
une image globale de l'état de santé de l'individu et servir de
base pour prédire sa santé future de même que sa
durée de vie. Ce choix est souvent rendu difficile par la
nécessité de tenir compte des coûts et des moyens
disponibles. (Christophe, 2006)
L'age biologique doit donc permettra de décrire
l'état physiologique d'un individu à chaque stade de son
vieillissement chronologique, permettre d'étudier des populations
particulières, vérifier l'efficacité de certains
traitements, médicaments, exercices ou régimes et prédire
le maintient ou la perte de la compétence physiologique, afin de
déterminer l'incidence des maladies et d'évaluer
l'espérance de vie.
De nombreux tests peuvent être utilisés. Il
convient dans un premier temps de noter les indices anthropométriques
(taille et poids). Puis viennent des paramètres courants (pression
artérielle, acuité visuelle et accommodation, audiométrie,
capacité vitale respiratoire forcée, force de préhension,
pli cutané tricipital, test de la dextérité,
sensibilité vibratile, etc.). Dans un second temps, on doit affiner les
résultats en utilisant du matériel médical adéquat
afin de mesurer la vitesse de conduction nerveuse, l'index cardiaque au repos,
le volume maximum d'oxygène consommé à l'effort, etc. La
biologie est précieuse et permettra d'apprécier la
numération formule sanguine, la vitesse de sédimentation, les
transaminases hépatiques, les phosphatases alcalines, la glycémie
à jeun, le cholestérol total et HDL-cholestérol, la
créatininémie, l'urée, les protides totaux, etc., auxquels
on peut associer des tests biologiques dynamiques et hormonaux.
(Christophe, 2006)
A titre d'exemple, le cholestérol total, le HDL (high
density lipoprotein) et LDL (light density lipoprotein) sont d'excellents bio-
marqueurs de l'atteinte vasculaire. L'obésité est
corrélée en tant que telle avec cancer, maladies
cardio-vasculaires, et réduction de l'espérance de vie.
L'obésité abdominale est la plus nocive (c'est un facteur de
risque considérable pour
l'artériosclérose et le diabète). La
pression artérielle et en particulier la pression artérielle
systolique doit rester inférieure à 140. La fréquence
cardiaque est influencée par l'entraînement physique. La moyenne
est de 72 battements par minute. Une personne physique en bonne santé
devrait avoir une fréquence d'environ 60. La mesure de la consommation
maximum d'oxygène ou VO2 max est un excellent reflet de l'état
cardiovasculaire et respiratoire de notre corps. La capacité vitale
forcée est la quantité d'air que nous pouvons inspirer et expirer
rapidement en une inspiration très profonde. Elle s'apprécie
grâce à un spiromètre. Elle reflète
l'intégrité de l'ensemble du système respiratoire (les
muscles de la poitrine, du diaphragme, le contrôle du système
nerveux central et l'élasticité de nos poumons). Cet examen s'est
révélé comme étant le meilleur test
prédictif de l'espérance de vie dans l'étude de
FRAMINGHAM. L'audition commence à diminuer vers l'âge de 30 ans. A
20 ans, on perçoit un son (8000 Hertz) à 18 décibels,
à 60 ou 70 ans, il faut monter à 50 ou 80 décibels.
L'apparition d'auto anticorps (facteur rhumatoïde et anti ADN) est un
élément péjoratif sur l'espérance de vie. La
glycémie est un bon indicateur de la restriction calorique. Un
régime bien suivi doit aboutir à une diminution de la
glycémie plasmatique. Un excès de sucre dans le sang peut
favoriser la mise en place de liaisons entre sucres et protéines, sucres
et ADN : la glycosylation. Celle-ci fait l'objet d'une théorie du
vieillissement. Enfin, l'appui monopodal est un test simple qui consiste
à pouvoir rester debout, sur une jambe (l'autre étant
relevée), les yeux fermés : c'est un excellent test de
l'intégrité de l'oreille interne, des systèmes
neurologiques centraux et périphériques, et de l'état
musculaire et ostéo-tendineux. Un adulte de 20 ans peut rester en
équilibre presque indéfiniment, un adulte de 50 ans environ 10
secondes, un adulte de 30 ans environ 25 secondes et une personne de 80 ans ne
peut tenir l'équilibre. Les résultats obtenus à ces
différents tests doivent ensuite être rapportés à
des tables de références permettant de déterminer avec
précision l'âge biologique de la personne. (Christophe,
2006)
III.2. Intér~t de mesure de l'ge biologique :
Les aptitudes fonctionnelles vieillissent à des
vitesses variables. Tous les individus du même âge chronologique
n'ont pas les mêmes niveaux de capacité fonctionnelle, et enfin,
pour connaître ce qu'un individu, en particulier, est capable de faire.
Il n'y a pas d'autre alternative que de mesurer directement les
capacités de cet individu. Le grand intérêt de la
détermination de l'âge biologique d'un individu est de parvenir
à une meilleure connaissance de son corps, à mettre en
évidence ses faiblesses, à déterminer des objectifs
personnels, et enfin, de pouvoir réaliser des comparaisons pour un
même individu à différents stades de son évolution.
Mais la mesure de l'âge biologique nécessite des moyens importants
et modernes
afin d'approcher au mieux ce paramètre indispensable pour
la prise en charge des patients vieillissants et qui souhaitent rester actifs.
(Christophe, 2006)
Partie
Expérimentale
III.1.Objectif :
Notre étude est basée sur la mesure de
l'âge biologique qui est un bio marqueur indispensable pour connaitre les
effets à court ou moyen terme d'agents potentiellement efficaces sur le
processus du vieillissement.
Tous les individus d'une même collectivité ne
vieillissent pas au même rythme, certains se trouvent dans un mauvais
état physiologique par rapport à la moyenne des individus de leur
age, de leur sexe et de leur collectivité, alors que d'autres au
contraire présentent dans l'ensemble de meilleures performances
physiologiques. Il y a une différence toute fois entre l'âge
biologique d'un individu - évalué en termes de performance - et
son âge chronologique -- estimé par le temps écoulé
depuis sa naissance.
Aussi les personnes souffrantes de maladies chroniques par
exemple le diabète ou l'insuffisance rénale perdent leurs
performances rapidement, que les personnes saines.
Le diabète est considéré par certains
aspects comme un modèle de vieillissement accéléré
de même que l'insuffisance rénale. Le but de notre étude
est de détecter l'influence d'une maladie sur l'âge et les
performances physiologiques et physiques en calculant l'âge biologique ou
physiologique des malades diabétique et insuffisant rénaux.

Témoin
40 patients
Diabétique
s
10 patients
N. Benaoum & A. Abbou (2008).Age biologique : un
concept actualisé au service de la lutte contre le vieillissement.
DES biochimie. Univ. Mascara
Partie pratique
Du 13/04/2008 au 24/07 /2008
Prélèvements
Srvic decine interne
Hôpital
S htalmologie (AV) Laboratoire
Service pneumologie (CVF)
Sang Centrifugation
Sérum
Dosages
Hématologiques
12 patients
Dosage du taux de l'hémoglobine.
iochimique Cholestérol
Urée
Albumine Protéines totales
Lecture
Traitement statistique.
Dosages biochimiques
Spectrophotomètre
Résultats
Échantillonnage
Insuffisant s rénaux
Figure 22. Organigramme de
·

III.2. Le Srotoc44e d'étude :
Nous avons réalisé une étude qui
s'échéancier sur une période de 03 mois allant de
13/04/2008 jusqu'au 24/07/2008, au niveau du laboratoire de biologie du centre
universitaire de Mascara, le laboratoire de l'hôpital Meslem Tayeb de
Mascara. Dont les prélèvements sanguins sont obtenus du service
de médecine interne de l'hôpital Yessad Khaled. Où ont
avait travaillé sur 52 malades hospitaliser pour des complications de
leur maladie :

40 diabétiques.
12 insuffisants rénaux.
Des tests biologiques et cliniques sont réalisés au
cour de notre étude. Les tests cliniques ont été fais dans
les services :
-test de l'acuité visuelle est réalisé
dans le service d'ophtalmologie, et dans le service de pneumologie pour
déterminer la capacité vitale
forcée. la mesure de la tension
artérielle été faite dans le service de médecine
interne.
Chaque malade subit un questionnaire sur :

l'histoire de sa maladie.
Ainsi qu'un questionnaire avec la diététicienne sur
le mode nutritionnel des malades.
Et avec le médecin pour les morbidités
développés, par exemple cataracte, HVG, hypertension
artérielle.


Fig .23. Représentation graphique des populations
étudiées et leur nombre.
Notre étude se focalise sur deux pathologies
diabète et insuffisance rénale chronique, et les personnes saines
étudiées comme témoin dont le nombre est
présenté dans la figure.24.


Fig .24. Répartition de l'échantillon
étudiée selon le sexe.
Dans notre échantillon on note que la population
féminine est plus touchée par le diabète et l'IRC que la
population masculine.

Fig.25. Pourcentage des patients ayant
développés une HTA, un HVG, et cataracte.
La valeur de tension artérielle à partir de
laquelle est définie une hypertension est de 130/85 mmHg, d'après
les principales recommandations internationales.
Les IRC hémodialysés ont fréquemment une
atteinte myocardique mineure évolutive liée à la maladie
coronaire, à l'hypertrophie ventriculaire gauche (HVG) et à la
dysfonction endothéliale.(BERTINCHANT ). L'HVG et
considéré comme un marqueur du vieillissement du coeur survenu au
cour de ces deux pathologies.
L' HTA est un phénomène secondaire à
l'IRC. L'élévation tensionnelle est la
conséquence de deux phénomènes:
III.3. matériels :
Les équipements et les produits suivant ont
été utilisés :
Spectrophotomètre à UV,
hémoglobinométre, kit de dosage SPINREACT, Espagne
pour les dosages biochimiques :

l'albumine.
des protéines totales.
du cholestérol.
De l'urée.
de TGP.
de glucose.
Tubes sans et avec anticoagulant, emboues bleu et jaune,
micropipettes, cuves, portoirs, seringues, coton, alcool chirurgical:
III.4. Méthode de travail :
A. I lIP esXLeIdeIl'âge biologique :
La mesure de l'âge biologique est un processus
multifactoriel. Elle consiste en une évaluation quantitative de
plusieurs paramètres qui vont servir à déterminer la
compétence physiologique de l'organisme. La méthode la plus
habituelle pour évaluer l'âge biologique est l'utilisation
d'équations à régression multiple permettant de
prédire l'âge à partir des scores établis sur de
nombreux tests, tels que la capacité vitale, le volume expiratoire
forcé, la
tension artérielle, l'acuité visuelle, le
degré d'accommodation pupillaire, la pression artérielle
systolique, la perte auditive, la force de préhension et la vitesse de
réaction. Dans le chapitre suivant, nous décrivons une
échelle à titre d'exemple :
BATTERIE JAPONAISE DE TESTS
Docteur Eitaro NAKAMURA de l'Université de KYOTO :
in Christophe ,2006
|
Tests
|
Unités
|
Résultats
|
Facteur correction
|
de Résultats
finaux
|
|
Hémoglobine
|
mg/100 ml
|
r1
|
0.102
|
R1
|
|
Albumine
|
gm/100 ml
|
r2
|
0.646
|
R2
|
|
Rapport albumine
globine
|
sur
|
r3
|
1.343
|
R3
|
|
Cholestérol
|
mg/100 ml
|
r4
|
0.002
|
R4
|
|
Urée
|
mg/100 ml
|
r5
|
0.031
|
R5
|
|
SGPT
|
U/ml
|
r6
|
0.024
|
R6
|
|
Glycémie à 60 mn après mg/100 ml
ingestion de glucose
|
r7
|
0.005
|
R7
|
|
Acuité visuelle
|
en dixième
|
r8
|
0.3
|
R8
|
|
Fréquence cardiaque
repos
|
de
|
r9
|
0.026
|
R9
|
|
Capacité vitale forcée
|
ml
|
r10
|
0.0005
|
R10
|
|
Pression artérielle mm de Hg
systolique
|
r11
|
0.018
|
R11
|
|
Age chronologique
|
années
|
r12
|
1.1
|
R12
|
|
Age chronologique au carré
|
r13
|
0.008
|
R13
|
Le résultat brut du test (r1, r2, etc.) est
multiplié par un facteur de correction permettant de calculer un
résultat corrigé (R1, R2, etc.). Ces résultats seront
alors inclus dans la formule de l'âge biologique (AB) :
AB = 12.09 X (2.616 - R1) - R2 - R3 + R4 + R5 + R6 + R7 -
R8 + R9 - R10 + R11 + 50.86 - (34.25 - R12 + R13).
Donc afin de mesurer l'âge biologique des patients, il a
fallu faire des tests cliniques et biologiques :
|
1) Tests ciniques :
nous avons procédé à la mesure de la
capacité vitale forcée avec un spiromètre (voir
fig 26).
|

Fig 26: le spiromètre.
La FVC (Forced Vital Capacity ou capacité vitale
forcée) est le volume total d'air (en litres) expiré lors d'une
expiration rapide et puissante ("forcée") qui suit une inspiration
maximale. Elle est mesurée lors d'une manoeuvre expiratoire
forcée : le sujet doit inspirer aussi fort et profondément que
possible puis expirer aussi fort et vite que possible jusqu'à la vidange
complète. Les valeurs normale de la CVF sont de 4.8 L.

A l'aide de tableau (ototype) portant des lettres de
différentes tailles, on a mesuré l'acuité visuelle des
patients (voir fig. 27)
|
Fig. 27. Tableau ototipe pour la mesure de
l'acuité visuelle.
Avec un tensiomètre (voir fig.28) on a
pris les valeurs tensionnelles, les malades doivent êtres assis et bien
reposés.
|
Fig.28. le tensiomètre.
La mesure de la FCR comptant le nombre de battements de
l'artère du bras : nombre de battement/ minute à l'aide d'un
chronomètre.
2) Test biologique #177; les dosages biochimiques-
:
2.1. Le prélèvement du sang :



chaque malade on lui fait deux prélèvements : un
à jeun et l'autre à une heure après l'ingestion de 25g de
glucose.
Recueillir le sang par ponction veineuse dans trois tubes les
deux premier sans anticoagulant et un avec anticoagulant.
La centrifugation des tubes à 8000 tours pendant 10 min
(fig.29) sauf celui de l'hémoglobine (avec
anticoagulant) ne doit pas être centrifugée.
A l'aide d'une micropipette, on prélève le
sérum obtenu (fig.29) selon le code du même
malade pour les dosages suivants :
- le tube avec anticoagulant(EDTA) pour la mesure du taux de
l'hémoglobine.
- le tube prélevé à jeun pour le dosage de :
albumine, protéine totale, cholestérol, urée, TGP.
- le tube prélevé après 60 min d'ingestion
de glucose pour dosage de la glycémie. C'est un test oral de
tolérance au glucose.
La personne testée commence à jeun (aucune
nourriture ou boisson en dehors de l'eau pendant au moins 10 heures mais pas
plus de 16 heures). Puis la personne boit une solution sucrée (glucose).
On effectue une prise de sang une heure après avoir bu la solution de
glucose.
- Il faut acheminer le plus vite possible les
échantillons à l'aide d'une glacière, vers le laboratoire
pour l'enchaînement rapide des analyses car il s'agit d'un milieu vivant
(avec enzymes...). S'il y a attente, pour dosage différé, il doit
y avoir stockage "au frais" (l jour = +4°C, au-delà = -20°C
voir -80°C).
Sang total
Tube sans anti coagulant
Centrifugation 8000 tours /mn, pendant

Sérum
Caillot
Fig. 29 : La technique d'obtention du sérum
à partir du sang total

Sang total avec anticoagulant
Laisser sans centrifugation
Plasma
Culot
Plasma
Figure 29 : la technique de l'obtention du plasma
sanguin.
1. Dosage du glucose : Ref : 1001191
Le Principe : Le glucose oxydase (GOD)
catalyse l'oxydation de glucose à l'acide gluconique le peroxyde
d'hydrogène (H2O2) produit est détecté au moyen
récepteur cromogénique d'oxygène, en présence de
POD.
Glucose oxydase
Glucose + O2 acide gluconique+H2O2
2 H2O2 + phénol +4AAP Quinonéimine +
4H2O
4AAP : amino-4antipique.
Les réactifs utilisés sont :
-réactif.1 :



TRIS pH 7.4.......... 92mmol/L.
Phenol..................0.3mmol/L.
-réactif.2 :
glucose oxydase (GOD)........... 15000 U/L
Peroxydase (POD) ..........1000U/L.
4- Aminophenazone (4- AP) .............2.6 mmol/L
-réactif.3 (standard) :
Glucose ..........100mg/Dl.
Echantillons : Sérum.
- Le mode opératoire :
Dans une série de tubes à
prélèvement (X n+2 d'où n= le nombre des
échantillons et 2 et 1 sont : un pour le blanc et le
2ème pour l'étalon) voir (fig.30).
Mettre dans chaque tube 1ml de solution de travail (qui est le résultat
du mélange de R1 et R2). On ajoute 10 ul de la solution d'étalon
dans le tube d'étalon et 10ul du sérum dans les tubes des
échantillons déjà codé. On mélange bien et
on laisse incuber 5min dans l'étuve à 37°C. Puis on lit la
longueur d'onde de chaque tube avec le spectrophotomètre en respectant
:
-longueur d'onde : 505 nm.
-cuve : 1 cm de diamètre.
La calibration du spectrophotomètre se fait par la
solution du blanc
Pour les calculs:
DO dosage x n
DO etalon
Ou n : est la concentration de l'étalon =1g/L
Les valeurs sont dites normales si les résultats
font partie de l'intervale suivant : 0.7-1.05g/l ou 3.89-5.84mmol/l
10ul de R3
Blanc Standard
L'incubation à 37°C pendant 5mn
1ml de R3
Echantillon
1 ml de RT
1 ml de RT
1 ml de RT
10ul de sérum

Blanc Standard Echantillon
Fig. 30 : La technique du dosage de Glucose
2- Dosage de cholestérol total :Ref :1001092
Le principe ; la détermination
enzymatique du cholestérol suivant ces réactions :
Cholestérol estérifié + H2O cholestérol + acide
gras.
cholestérol estérase
Cholesterol + O2 Cholesterol -4-one-3-H2O2.

Cholesterol oxydase
Peroxidase
2H2O2+ phénol + 4AAP quinonéimine+4 H2O.
L'intensité de la couleur formée est
proportionnelle à la concentration du cholestérol dans
l'échantillon.
Les réactifs utiliser :
Réactif.1 (solution tampon) :

PIPES pH 6.9..... 90 mmol/L
Phenol .....26mmol/L
Réactif.2 RIenz\ Pe) :

Cholestérol estérase (CHE) ~~~.. 300U/L
Cholestérol oxydase (CHOD) ...300U/L
Peroxydase (POD) ~~~~~~~1250U/L
4- Aminophenazone (4-AP) ~~~~0.4mmol/L
Réactif.3 : (standard)
Cholestérol 200mg/dL
Echantillon : sérum.
Mode opératoire :
Dans une série de tubes à
prélèvement (X n+2 d'où n= le nombre des
échantillons et 2 et 1 sont : un pour le blanc et le
2ème pour l'étalon) voir (fig.31).
Mettre dans chaque tube 1ml de solution de travail (qui est le résultat
du mélange de R1 et R2). On ajoute 10 ul de la solution d'étalon
dans le tube d'étalon et 10ul du sérum dans les tubes des
échantillons déjà codés. On mélange bien et
on laisse incuber 5min dans l'étuve à 37°C. Puis on lit la
longueur d'onde de chaque tube avec le spectrophotomètre en respectant
:
- longueur d'onde : 505 nm.
- cuve : 1 cm de diamètre.
La calibration du spectrophotomètre se fait par de l'eau
distillée.
1 ml de RT
Le calcul :
DO dosage x n
DO étalon
n : la concentration de l'étalon = 200 mg/dL
Les valeurs sont dites normales si les résultats
sont dans l'intervalle suivant :
150 - 260 mg/dL
10ul de R3
1 ml de RT
1 ml de RT
10ul de sérum
Blanc Standard Echantillon

L'incubation à 37°C pendant 5mn 1ml de R3
Blanc Standard Echantillon
Fig. 31 : La technique du dosage de
Cholestérol
3. Dosage d'albumine :Ref :1001020
Le principe :
L'albumine en présence de bromocrésol vert
à un pH légèrement acide, produit un changement de couleur
de l'indicateur du jaune vert au vert-blue. L'intensité de la couleur
formée est proportionnelle à la concentration de l'albumine dans
l'échantillon.
Les réactifs utilisés :
-Réactif.1 : vert de bromdresol pH4.2
...........0.12mmol/L
- réactif.2 : (étalon) : albumine
..............5g/dL
Echantillon : sérum.
3.2 Mode opératoire :
Dans une série de tubes à
prélèvement (X n+2 d'où n= le nombre des
échantillons et 2 et 1 sont : un pour le blanc et le
2ème pour l'étalon) voir (fig.32).
Mettre dans chaque tube 1ml de solution de travail (qui est le
réactif R1). On ajoute 5 ul de la solution d'étalon dans le tube
d'étalon et 5ul du sérum dans les tubes des échantillons
déjà codés chaque tube avec un malade. On mélange
bien et on laisse incuber 5min dans l'étuve à 37°C. Puis on
lit la longueur d'onde de chaque tube avec le spectrophotomètre en
respectant :
-longueur d'onde : 630 nm.
-cuve : 1 cm de diamètre.
La calibration du spectrophotomètre se fait par la
solution du blanc.
Calcul : DO dosage x
n
DO étalon
n ;a concentration de l'étalon= 5 g/dL
Les valeurs sont dites normales si elle en fait partie de
l'intervalle suivant : 3.5-5 g/dl

Blanc Standard
Echantillon
5ul de R2
L'incubation à 37°C pendant 5mn
1 ml de R1
1 ml de R1
1 ml de R1
5ul de sérum
Blanc Standard Echantillon
Fig. 32 : La technique du dosage d'albumine
Dosage de l'urée :Ref :1001331.
Le principe :
L'urée dans l'échantillon est hydrolysée
enzymatique ment en l'ammoniac NH4 et le dioxyde de carbone CO2. Les ions
d'ammoniaque formés réagissent avec le salicylate et
l'hypochlorite de sodium (NaCIO) en présence du catalyseur
nitroprusside, forme un vert indophénol :
Urea + H2O NH4 + CO2

Urease
NH4 + salycilate + NaCIO indophenol.
Nitroprusside
L'intensité de la couleur formée est
proportionnelle à la concentration d'urée dans
l'échantillon.
Réactifs utilisés :
-Réactif.1 :




Phosphate pH6.7 : ~~~~~~..50mmol/L.
EDTA ~~~~~..~~~~~~.2mmol /L.
Salicylate de sodium : ~~~~~.. 400mmol/L. Nitroprusiate de sodium
: ~~~~..10mmo/L.
- réactif.2 :

Hypochlorite de sodium (NaCIO) 140mmol/L.
Hydroxyde de sodium ~~~~~~.150mmol/L
-Réactif.3 'enzyme) : 1

enzyme)
Uréase : ~~~~~~~~~~. 30000 U/L.
- - Réactif.4
:(étalon)

EI
Urée~~~~~~~~~. 50 mg/dL
Echantillon : sérum.
Mode opératoire : Dans une
série de tubes à prélèvement (X n+2
d'où n = le nombre des échantillons et 2 et 1sont : un pour le
blanc et le 2ème pour l'étalon) voir
(fig.33). Mettre dans chaque tube 1ml de solution de travail
(qui est le résultat du mélange de R1 et R3). On ajoute 10 ul de
la solution d'étalon dans le tube d'étalon et 10ul du
sérum dans les tubes des échantillons déjà
codés chaque tube avec un malade. On mélange bien et on laisse
incuber 5min dans l'étuve à 37°C. Puis on ajoute 1ml du
réactif R2, on mélange bien et on réincube 5min dans la
température ambiante. On lit l'absorbance « A » de chaque tube
en respectant : -longueur d'onde : 580 nm.
-cuve : 1 cm de diamètre.
La calibration du spectrophotomètre se fait par la
solution du blanc.
Calcul : DO dosage x n
DO étalon
n : la concentration de l'étalon = 50 mg/dL Les
Valeurs normales de l'urémie doivent êtres dans l'intervalle
suivant :
15-45 mg/dL, 2.49-7.49 mmol
/L
10ul de R4
1 ml de RT
1 ml de RT
1 ml de RT
10ul de sérum
Blanc Standard Echantillon
La 1ère incubation à 37°C
pendant
5
1ml de R2 1ml de R2
1ml de R2
Blanc Standard Echantillon
La 2ème incubation à 37°C
pendant
5



Blanc Standard Echantillon
Fig. 33 : La technique du dosage de l'urée
79
5. dosage de protéines totales: Ref
:1001291
Le principe :
Les protéines donnent un complexe bleu violet intensif
avec des sels de cuivre dans un milieu alcalin. L'iodide est inclus comme un
antioxydant.
L'intensité de la couleur formée est
proportionnelle à la concentration de protéine totale dans
l'échantillon.
Réactif utilisé :
-Réactif.1 :

Sodium potassium tartrate ...........15mmol/L
Sodium iodide ....................100mmol/L
Potassium iodide ................5mmol/L
Copper (II) sulphate .................19mmol/L
-Réactif.2 (standard) : albumine bovine
.........7 g/dL.
Echantillon : sérum, le sang doit
être prélevé sur tube sans anticoagulant.
Mode opératoire :
Dans une série de tubes à
prélèvement (X n+2 d'où n= le nombre des
échantillons et 2 et 1 sont : un pour le blanc et le
2ème pour l'étalon) voir (fig.34).
Mettre dans chaque tube 1ml de solution de travail (qui est le
réactif R1). On ajoute 25ul de la solution d'étalon dans le tube
d'étalon et 25ul du sérum dans les tubes des échantillons
déjà codés chaque tube avec un malade. On mélange
bien et on laisse incuber 5min dans l'étuve à 37°C. Puis on
lit l'absorbance de chaque tube avec le spectrophotomètre en respectant
:
-longueur d'onde : 540 nm.
-cuve : 1 cm de diamètre.
La calibration du spectrophotomètre se fait par l'eau
distillée.
5.4. Calcul: DO dosage x n
DO étalon
n : la concentration de l'étalon = 7g/dL
Le taux normal de protides totaux doit êtres entre
:
6.6-8.3 g/dl

Blanc Standard
Echantillon
25ul de R2
L'incubation à 37°C pendant 5mn
1 ml de R1
1 ml de R1
1 ml de R1
25ul de sérum
Blanc Standard Echantillon
Fig. 34 : La technique de dosage de protéines
totales.
Il y a deux modalités de prélèvement
différent selon le tube :
a) Sans anticoagulant ("tube sec"): il y a
coagulation sanguine rapide, physiologique par une cascade enzymatique qui
aboutit à la transformation du fibrinogène en fibrine
(insoluble).
Fibrinogène monomère de fibrine
réseau de fibrine.
thrombine (IIa) XIIIa
Dans la fibrine se trouvent emprisonnés les
éléments cellulaires, le caillot sanguin est entouré du
sérum sanguin. On centrifuge pour récupérer le
sérum, sur lequel on effectue le dosage biochimique.
b) Avec anticoagulant (additif opposé
à la coagulation): après centrifugation, la phase liquidienne
ressemble au sérum mais est différente : il s'agit du plasma. Il
comporte encore le fibrinogène soluble alors que l'on a obtenu le
sérum après transformation en fibrine. Rq: L'anticoagulant peut
être:
-l'héparine de lithium.
-l'héparine de sodium.
-l'oxalate, le citrate, l'EDTA (éthylène diamine
tétra acétate) qui complexent le calcium et empêchent la
coagulation.
Le sang se compose essentiellement de trois sortes de
protéines déterminées globalement sous le nom de protides
totaux :

Protide totaux les albumines 60%

Les globines30%

La fibrinogène 10 _15%.
En éliminant la fibrinogène dans le sérum
obtenu, il a fallu prélever le sang dans un tube sec. Le
fibrinogène se transforme en fibrine et donne avec les restes des
éléments sanguins le caillot de la coagulation, donc dans le
sérum ne reste que l'albumine et les globines.
La valeur trouvée lors du dosage des protides totaux dans
ce sérum correspond à celle de l'albumine + globine.
Protide totaux = albumine + globine =» le taux de globine =
taux de protides totaux - taux d'albumine (mesuré
précédemment).
L'obtention de la valeur d'albumine et des globines nous permet
de calculer le rapport albumine / globine.
6. Dosage de TGP :Ref :1001171.
Principe :
L'alanine aminotransferase (ALT) ou Glutamate pyruvate
transaminase (TGP) catalyse le transfert réversible d'un groupement
aminé de l'alanine au alpha- cetoglutarate formant le glutamate et le
pyruvate.
Le pyruvate produit est réduit en lactate par la lactate
déhydrogénase (LDH) et NADH. Alanine + alpha- cetoglutarate
Glutamate + Pyruvate

ALT
Piruvate + NADH + H+ Lactate + NAD +
LDH
Réactif utilisé :
-Réactif.1 (tampon) :

TRIS pH7.8 ...........100mmol/L Alanine
................500mmol/L
-Réactif.2 :
|
NADH .................. 0.18mmol/L
Lactate déhydrogénase (LDH)........1200U/L
Alpha-Cétoglutarate ..................15 mmol/L.
|
Echantillon : sérum.
Mode opératoire :
Dans un tube à prélèvement on met 1ml de
solution de travail (qui est le résultat de la dissolution total de R2
dans 15ml de R1). On ajoute 100 ul de sérum (fig.35) et
on mélange bien puis on incube pendant 1 min. On lit l'absorbance
initial, puis les autre absorbance à 1min d'intervalle pendant 3
minutes, en respectant :
-longueur d'onde : 340 nm.
-cuve : 1 cm de diamètre.
La calibration du spectrophotomètre se fait par l'eau
distillée.
On calcule la différence entre les absorbances
trouvées, puis la moyenne par min (A/min). Calcule : A/min x
1750 = U/L de TGP.
Les valeurs normales de transaminase ALAT doivent
êtres inférieures à 40 U/L.
100ul sérum
1 ml de RT
Echantillon
Fig. 35 : La technique du dosage de TGP
6. Dosage de l'hémoglobine :
Le principe : Le sang est dilué dans
une solution d'acide chlorhydrique (HCL) à 0,1 N. Cette solution d'acide
transforme l'hémoglobine en hémoglobine acide qui a une couleur
brunâtre. On dilue le sang jusqu'à ce que sa couleur soit
comparable à celle du tube témoin de
l'hémoglobinométre (méthode de SAHLI).
Réactif utilisé :
Solution d'acide chlorhydrique à 0.1 N.
L'eau distillée.
Echantillon : sang total
Mode opératoire :
Dans un tube sec on met 500ul d'acide chlorhydrique puis on
ajoute 20ul de sang total on mélange très bien. A l'aide d'une
micropipette on remplie le tube de l'hémoglobinométre de la
solution. On dilue cette dernière avec l'eau distillé
jusqu'à ce que sa couleur soit comparable à celle du tube
témoin de l'hémoglobinométre voir
(fig.36).
Les valeurs normales :
Homme : 13-18g/dl, Femme : 12-16g/dl.
20ul Sang total
500 ul de HCL
Echantillon
Fig. 36 : La technique du dosage de
l'Hémoglobine
III.5. Résultat et discutions :
1. Résultat de l'étude clinique
:
1.1. La pression artérielle systolique
:
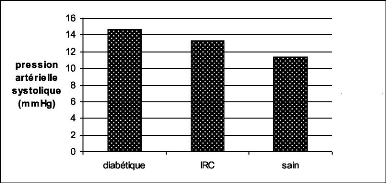
Fig.37. Les variations de la pression artérielle
systolique (PAS) chez les diabétiques et les insuffisant rénaux
comparées avec les témoins.
Nos résultats montrent que la PAS est augmenté chez
les diabétiques par rapport à la valeur recommandée qui ne
doit pas dépasser 13 mmHg.
La PAS est aussi élevée chez les insuffisants
rénaux. La rétention hydro sodée, contribue à
l'hypertension artérielle, l'hypertrophie ventriculaire gauche, et
l'augmentation de
16
4
l'épaisseur de la paroi artérielle.
(Madore, 2004).
La pression artérielle systolique augmente avec
l'âge. (Robert 1989). Le même cas est
on 10
observé dans les deux pathologies ce qui explique le
vieillissement du coeur lié à l'altération
lle
8 Série1
des fibres d'élastines, et des fibres de
collagéne.
g) 6
1.2. La fréquence cardiaque de repos (FCR)
:
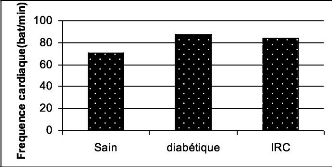
Fig.38: Les variations de la fréquence cardiaque
de repos (FCR) chez les diabétiques et
les insuffisant rénaux
comparées avec les témoins.
La fréquence cardiaque de repos est
élevée chez les diabétiques et les insuffisants
rénaux par rapport aux témoins. La (FCR) est comprise entre 60 et
80 battement/min. Cette dernière s'avère être le meilleur
facteur pronostique de mortalité après infarctus du myocarde. Il
y a une corrélation entre FCR rapide et mortalité chez les
patients diabétiques et les personnes âgées. De plus chez
les mammifères, il existe une relation semi-logarithmique 8
négative entre la fréquence cardiaque de repos et
l'espérance de vie, en effet les effets favorables des â-bloquants
sur la mortalité des patients co-ronariens sont au moins en partie 60
médiés par leur effet sur la FCR.
40
Donc il semblerait que l'augmentation de la FCR est fortement
liée à une hyperactivité sympathique cette modification et
un caractère bien déterminer de la survenue d'un 0
vieillissement du système nerveux autonome chez ces
patients. (Cook& al,. 2007). Sain diabétique IRC
1.3. La capacité vitale forcée (CVF)
:
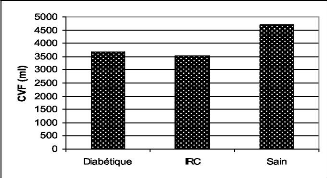
FIG.39. Les variations de la capacité vitale
forcée chez les diabétiques, les insuffisants
rénaux
comparées avec les témoins.
La capacité vitale forcée a diminué chez
les deux types de patients comparés par rapport aux témoins. Une
baisse de la CVF est associée à la présence de certaines
maladies métaboliques diabète et hypertension artérielle.
Cette observation pourrait en partie expliquer le lien entre la baisse de la
CVF et la maladie cardiovasculaire. (YASUDA, 2006)
Dans une analyse de régression linéaire uni
variée, la CVF est en lien inversement proportionnel avec une
consommation faible de légumes, le tabagisme et l'indice de masse
corporelle (IMC). La baisse de la CVF chez les insuffisants rénaux est
due à la survenue
5000
0
d'une hypertension artérielle. (YASUDA,
2006)
4000
La mesure de la capacité vitale forcée
reflète l'intégrité de l'ensemble du système
respiratoire (les muscles de la poitrine, du diaphragme, le contrôle du
système nerveux central
2500
et l'élasticité de nos poumons).Cet examen s'est
révélé comme étant le meilleur test
prédictif
1500
de l'espérance de vie dans l'étude de
FRAMINGHAM. (Christophe, 2006).
1000
La glycation et les radicaux libres qui attaquent les fibres
d'élastine des poumons au cour du diabète sont des facteurs
altérant l'élasticité des poumons.
Diabéqe C Sai
La diminution des la capacité vitale forcée (CVF)
reflète :
Une diminution de la compliance pulmonaire,
Une diminution de la compliance de la paroi thoracique, ces
modifications caractérisent un vieillissement de l'appareil
respiratoire. (Caillet, 2006).
1.4. L'acuité visuelle :
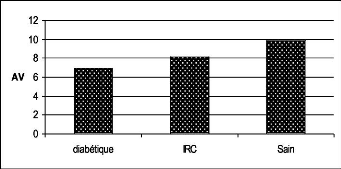
FIG.40. les variations de l'acuité visuelle chez
les diabétiques et les insuffisants rénaux et
les personnes
saines.
L'acuité visuelle diminue chez les diabétiques
et les insuffisants rénaux, elle reste inchangeable chez les personnes
saines. La perte de l'acuité visuelle s'explique par une
réduction de l'accommodation de l'oeil. Ce test reflet la survenue d'un
vieillissement de l'oeil au cour de ces pathologies. Car normalement avec
l'âge, le cristallin s'épaissit et perd de son
élasticité « détérioration des fibres
élastiques par glycation ou par l'effet des radicaux libres
oxygénés (RLO) », ce qui diminue son pouvoir d'accommodation
et provoque souvent des anomalies de réfraction. Ce
phénomène, qui se produit inévitablement avec le
vieillissement normal se traduit très prématurément chez
les diabétiques et les insuffisants rénaux. (Anonyme II,
1995).
La rétinopathie diabétique est une affection
chronique de l'appareil micro circulatoire de la rétine. La maculopathie
est la cause la plus fréquente de déficience visuelle chez les
patients atteints de rétinopathie diabétique et est plus courante
chez ceux qui sont atteints de diabète de type II. (Anonyme II,
1995).
2. Les résultats des dosages biochimiques
:
2.1. Le taux de cholestérol, d'hémoglobine,
de l'urée et de glycémie :
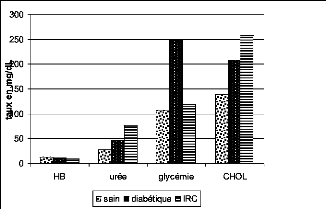
Fig.41. Les variations du taux du cholestérol,
l'urée, glycémie, et l'hémoglobine chez les
insuffisant
rénaux et les diabétiques.
Cet histogramme représente les variations du taux du
cholestérol, l'urée, glycémie, et l'hémoglobine
chez les insuffisant rénaux et les diabétiques comparé aux
variations obtenues chez les témoins (sains).

Pour le cholestérol :
Selon ces résultats, on a trouvé que le taux de
cholestérol est augmenté chez les diabétiques et les
insuffisants rénaux ce qui explique la survenu d'une dis-
lipidémie qui est un des facteurs de risque cardiovasculaire essentiel.
Les maladies métaboliques progressent à une vitesse effrayante
entraînant une recrudescence de la mortalité et de la
morbidité cardiovasculaire. (Golay, 2004). Ttraduisant
la survenue d'un vieillissement cardio-vasculaire au cour de ces
pathologies.

Pour l'urée :
Le taux de l'urée est augmenté chez les insuffisant
rénaux. On distingue une légère augmentation chez les
diabétiques comparant avec les témoins. Ces résultats
reflètent une
y
diminution des capacités d'élimination du rein,
ainsi la filtration glomérulaire diminue
sn éq RC
quasi linéairement avec l'âge ce qui traduit la
survenue d'un vieillissement de l'appareil urinaire dans ces
pathologies. (Gillery, 2006).
Le taux de glycémie est très élevé
chez les diabétiques et les IRC par rapport aux témoins.
L'insuffisance rénale chronique entraîne des altérations
métaboliques et des dysfonctions nutritionnelles et hormonales
nombreuses. A terme, ces altérations sont à l'origine de
complications telles que l'insulinorésistance, la prévalence du
diabète est très élevée chez les insuffisant
rénaux. (Mabore, 2004).
Selon (Gillery, 2006)
L'élévation de la glycémie dans le diabète et l'IRC
est à l'origine d'une glycation des protéines et la genèse
d'un stress oxydant chez les deux populations.
La glycémie été mesuré à
une heure après l'ingestion de glucose, ce test indique qu'il y a une
réduction de la tolérance à la charge en glucose, qui
témoigne d'un certain degré de résistance à
l'insuline, comparé avec les témoins chez qui le taux de
glycémie reste égale à 1g/L quelle que soit la masse de
glucose ingérée. (Caillet, 2007).

Pour l'Hb :
On observe une diminution du taux de l'Hb chez les
diabétiques et une diminution plus importante chez les IRC comparant
avec les témoins.
Les maladies rénales peuvent êtres cause d'une
anémie qui sera la cause de complication cardiovasculaire.
L'anémie est un facteur de risque d'insuffisance cardiaque et de
mortalité vasculaire chez les patients dialysés, chaque
diminution de 1g/dl augmente de 28% le risque d'insuffisance cardiaque
(Madore, 2004).
On observe une diminution importante du taux de l'Hb chez les
diabétiques comparé aux personnes saines. Une des causes de
l'anémie chez les diabétiques est la néphropathie.
L'érythropoïétine est une hormone qui stimule la production
de globule rouge, toute fois sous certaines conditions : la néphropathie
diabétique, l'insuffisance rénale ; la production de cette
hormone est entravée ou son action est altéré ce qui
entraîne l'anémie chronique. (O'Connell,
2003).
Le diabète provoque des modifications des petits
vaisseaux sanguins qui alimentent les reins microangiopathies, la progression
des dégâts à ce niveau a une conséquence importante
(souvent négligée) de l'insuffisance rénal est
l'anémie rénale. Celle-ci commence à ce manifester des les
premiers stades de l'altération de la fonction rénale, même
chez les personnes qui ne sont pas encore sous dialyse. L'anémie est une
complication silencieuse du diabète. (O'Connell,
2003).
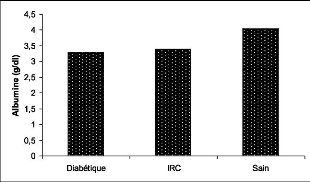
Il semblerait que la diminution da taux de l'Hb provoque un
état asthénique. Une diminution de l'oxygénation des
organes et tissus provoquant un mauvais fonctionnement cellulaire et organique.
Ainsi qu'un défaut dans les changements cellulaires, substance
énergétique, déchet défaillance des systèmes
d'épuration ce qui favorise l'accumulation des déchets au nivaux
de la cellule entraînant son vieillissement.
2.2. L'albuminémie :
Fig.42. Les variations de l'albuminémie chez les
diabétiques, insuffisants rénaux
comparées avec les
témoins.
Cet histogramme représente les variations du taux
d'albumine chez les diabétiques et les insuffisants rénaux
comparé au témoin.
On remarque qu'il y a une diminution du taux d'albumine chez
les patients insuffisant rénaux et les diabétiques. Cette
diminution est expliquée par une perte d'albumine par filtration
rénale en raison de l'atteinte rénale chez les insuffisants
rénaux (protéinurie). (Jan, 2000).
Chez les diabétiques il y a non seulement la
néphropathie mais aussi la réabsorption de l'albumine qui est
altérée. Au cour du vieillissement et du diabète il y a
une modification de l'albumine par glycation, ce phénomène
susceptible de modifier sa structure et de ce fait la reconnaissance de
l'albumine avec son récepteur au nivaux de la membrane apicale du tube
proximale. (Schaeverbeke, 1995).
On note aussi que l'albuminémie chez les insuffisant
rénaux est augmentée par rapport aux valeurs des
diabétiques cela est expliquée par la suplémentation par
voie veineuse
Diabétiqu RC Sain
d'albumine humaine chez ces patients hospitalisés pour le
syndrome néphrétique.
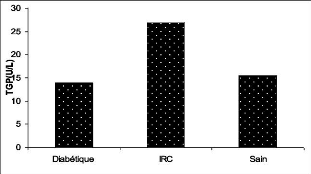
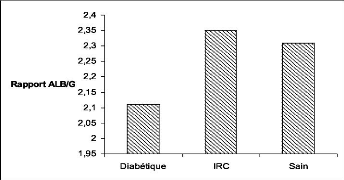
2.3. Le TGP :
Fig.43. Les variations du taux de TGP chez lez
insuffisant rénaux et diabétiques
comparant aux
témoins.
On distingue que les variations du taux de ALAT ou TGP < 40
U/L sont dans les valeurs normales, dans notre cas les malades n'ont pas
développé une atteinte hépatique.
2.4. Rapport albumine/ globine :
Fig. 44. Variation du rapport ALB/Globine chez les
insuffisants rénaux et les
24
diabétiques et les personnes saines. Ce test est
un test confirmatif, du taux de protide.
2,35
Dibétiqu IRC S
3. Résultat de l'k~ge biologique :
22
2,15
L'ensemble des résultats obtenus à partir des
tests cliniques et biochimiques nous ont
2,1
permis d'évaluer la compétence fonctionnelle des
organes testés. Ainsi on a démontré qu'il
existe
réellement un vieillissement accéléré au cour du
diabète et l'insuffisance rénale, en
2
calculant l'âge biologique de ces patients à
l'aide d'équation a régression multiple permettant
1,95
de prédire l'âge physiologique à partir des
résultats obtenus précédemment.
Chaque test reflète l'état physiologique d'un
organe à titre d'exemple : le taux sanguin d'albumine est un bio
marqueur sur l'intégrité du système de rétention
urinaire. Une mauvaise rétention d'albumine est un marqueur de la
survenue du vieillissement du rein qui se traduit par une perte d'albumine et
par conséquence une diminution d'albuminémie. L'épreuve de
la glycémie est un bon marqueur de la tolérance au
glucose...etc.
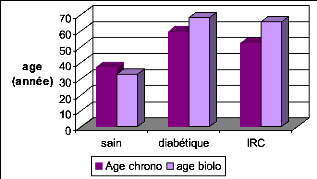
Fig.45. Représentation des résultats de
l'ge biologique évalué en termes de
performances
comparées avec l'ge chronologique.
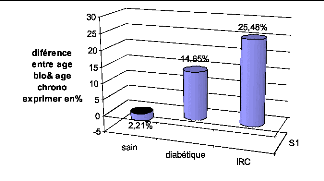
Fig.46. Repréosentation graphique de la
différence entreMde biologique et l'ld
en%
chronologique chez les diabétiques, les
insuffisants rénaux et les personnes saines
(résultat obtenu
par statistica version 6.1).
- Les résultats obtenus chez les
diabétiques :
La mesure de l'âge biologique est faite par un logiciel
statistica version 6.1. Selon ces histogrammes (voir fig.46)
on remarque que l'âge biologique des diabétiques a augmenté
d'une valeur de 14.65 % par rapport à leur age chronologique. Ces
résultats reflètent que ces patients sont physiologiquement
délabrés par le seul fais du diabète.
Les résultats de l'âge biologique reflètent
que tous les organes testés ont vieillit :
l'augmentation de la glycémie favorise le
phénomène de la glycation, cette
dernière modifie non seulement la structure des
protéines mais également leurs
fonctions (activité enzymatique ou biologique)
réaction de Maillard. (Gillery, 2006). La
réaction de Maillard a une très grande importance dans
l'altération des lames basales des diabétiques : glycation du
collagène et sa régidification et la perte
d'élasticité des fibres élastique.
Ces modifications au cour du diabète ont des
conséquences délétères sur la fonction des organes,
ainsi ces deux phénomènes caractérisent
l'artériosclérose et l'altération de la
vasomotricité artérielle, ce qui diminue l'efficacité des
gros vaisseaux à aider le coeur à faire circuler le sang. Ce fait
provoque l'augmentation de la pression artérielle systolique chez les
diabétiques. (Robert, 1989)
Certain diabétiques ont développé une HVG
conséquence du vieillissement du coeur.
(Caillet.2006)
Du fait de la modification de la trame fibreuse des poumons
due à la glycation, la plasticité des poumons diminue, cette
dernière est mesurée par la CVF qui est diminuée chez les
diabétiques.
l'hyperglycémie intracellulaire entraîne la
déviation d'une partie du glucose vers la voies des polyols
générant du sorbitol, ce dernier accumulé du fait de son
pouvoir osmotique joue un rôle dans la genèse de la cataracte.
(Delattre& al, 2003).
La plupart des étapes de la glycation sont
accompagnées d'un stress oxydant et la surproduction des radicaux libres
oxygénés (RLO). Les RLO ainsi accumulés durant le
diabète provoquent l'oxydation du cholestérol circulant (LDLc) ce
qui favorise la formation des plaques d'athéromes.
Un taux élevé de RLO est normalement
observé au cour du vieillissement, mais chez les
diabétiques
et du fait de l'ampleur du phénomène de la glycoxydation il y a
une
production accrue de RLO. Ce qui favorise la survenue d'un stress
oxydant pernicieux
pour les tissus, les cellules et plus
précisément pour le matériel génétique. Les
modifications apportées au niveau de ce dernier ont des
conséquences délétères pour les fonctions des
organes. (Gillery, 2006)
Un taux élevé de cholestérol total est un
excellent bio marqueur de l'atteinte vasculaire chez ces patients.
(Christophe, 2006)
La diminution du taux de l'Hb (l'hémoglobine) qui a un
rôle vital car elle assure l'oxygénation au tissu, c'est une
protéine impliqué dans les échanges cellulaires :
épuration, oxygénation, nutrition. L'Hb diminue chez les
diabétiques du fait de la néphropathie. (O'connelle,
2003)
Le rein est un organe d'importance vital, il est
altéré chez les diabétiques du fait de la
néphropathie. Cette dernière provoque la diminution de filtration
glomérulaire qui est mesurée par un taux élevé de
l'urémie au cours de cette pathologie.
La diminution de l'acuité visuelle chez ces patients est
due à la rétinopathie diabétique. (Anonyme II,
1995).
En comparant les modifications physiologiques apparues chez
les diabétiques avec celle apparues au cour du vieillissement normal
(biologique), on constate que les mêmes modifications surviennent pour
les deux phénomènes. Donc le diabète est réellement
un modèle de vieillissement accéléré et
prématuré.
L'augmentation de l'age biologique des diabétiques
diffère d'une personne à une autre, en fonction des modifications
rapportées aux diabétiques à l'échelle de leurs
organes. Cela s'explique par le pouvoir du corps à s'adapter à de
telle situation. Ainsi que la durée de la maladie, car une personne qui
a attrapé récemment le diabète n'a pas la méme
modification qu'une autre qui a la maladie depuis 10 ou 20 ans.
- Les résultats obtenus chez les insuffisants
rénaux :
D'après l'histogramme (fig.45) on note
que l'age biologique des insuffisants rénaux à augmenté
par rapport à leur âge chronologique. Ces résultats sont
dues d'une première cause de l'ampleur des réactions d'oxydation
qui surviennent chez ces patients.
La fonction rénale est altérée, donc il y
a une mauvaise élimination de déchets qui s'accumulent dans le
corps, ces derniers sont toxiques pour les organes exemple : l'urée et
l'acide urique qui provoque la goutte, les AGE (Advenced Glycation Product)
normalement éliminés avec les urines s'accumulent dans le sang et
modifient la structure et les fonctions des protéines. (Gillery,
2006)
L'insuffisance rénale chronique entraîne des
altérations métaboliques et des dysfonctions nutritionnelles et
hormonales nombreuses. À terme, ces altérations sont à
l'origine de complications telles que l'anémie, l'ostéodystrophie
rénale, l'insulinorésistance, la dyslipidémie et la
dénutrition. De plus, l'accumulation de cytokines pro inflammatoires, le
stress oxydant accru et les infections répétées
participent à la persistance d'un état inflammatoire chronique.
(Fitsum & Dénis, 2004)
Ces modifications sont les mêmes que celles
rapportées par le diabète. Chez les insuffisants rénaux,
il y a un dérèglement physiologique très important ainsi
qu'un vieillissement de tous les organes testés, ce qui explique une
augmentation importante de l'age biologique de ces patients par rapport
à leurs âge chronologique de 25.48%.
D'après cet histogramme (fig.45) on
note surtout que l'age biologique des insuffisants rénaux a
augmenté d'une valeur plus importante que celui des diabétiques.
Il semblera que les modifications rapportées par l'IRC sont
délétères, précoces et non changeables, alors que
celles rapportées par le diabète se forment en fonction du temps
: plus la maladie dure plus il y a apparition des complications pour le
diabète non équilibré. Plus on arrive a stabilisé
la glycémie et la dyslipidémie les capacités
fonctionnelles du malade au lieu de se détériorer peuvent rester
stables, ce qui conduit à une diminution de l'age biologique des
patients ou peut êtres devient égale à l'âge
chronologique, cela se passe au début de la maladie.
L'IRC ajoute ses troubles (anémie, troubles osseux,
nutritionnels, vasculaires) à ceux de l'age et des autres
pathologies(HTA). Méme lorsqu'elle ne tue pas directement, elle
fragilise et raccourcit l'espérance de vie. (Fourcade,
2006).
C'est pour cela, que pendant le séjour dans le service
de néphrologie, on entant les médecins en rapportent que les
insuffisant rénaux on une espérance de vie courte, ce qui est
vérifie par la comparaissant de leur âge chronologique par rapport
à leurs âge biologique.
- les résultats obtenus chez les personnes saines
:
D'après cet histogramme (fig.45.et.46)
on note que pour les personnes saines : l'age biologique a diminué de 2%
par rapport à leur âge chronologique. Dans notre étude, on
a travaillé avec des gens qui vivent bien et dans de bonnes conditions,
non fumeur, sportifs, ils ont une bonne vie socioculturelle. Ce qui explique la
diminution de leur âge biologique. Sauf pour une femme chez qui on
remarque une augmentation de son âge biologique : 22 ans son âge
chronologique comparé par 29 ans son âge biologique. Cette
augmentation est expliquée par l'infestation parasitaire de cette femme
par des
plathelminthes (Taenia) parasites intestinaux qui
provoquent : amaigrissement, anorexie, vomissement et nausée. Ces
parasites dépouillent l'hôte de sa nourriture et secrètent
des toxines, ce qui a rendu la femme physiologiquement moins performante.
Aussi en raison de manque de moyen, on a travaillé sur
une population réduite, donc on ne peut pas prédire que la
population Mascarienne est physiologiquement jeune en dehors de toute atteinte
pathologique, car on n'a pas pris en compte les facteurs socioculturels,
économiques, anthropométriques (obésité), qui ont
une très grande influence sur l'âge biologique des personnes.
Conclusion
CONCLUSION
Pour la première fois dans l'histoire de la
médecine, nous avons à notre portée un instrument
susceptible de mesurer le vieillissement : c'est le contrôle de
"l'âge biologique". G'est une notion fondamentale sans laquelle aucune
prise en charge sérieuse du vieillissement ne peut se concevoir.
L'âge biologique se définit par l'âge
fonctionnel de nos organes, c'est-à-dire l'âge de nos
artères, de notre coeur, de nos poumons, de notre cerveau, en opposition
avec l'âge chronologique -- (l'age qui est définit par une date de
naissance).
Get âge biologique déterminé sera
l'âge de référence de la personne concernée.
En mesurant l'âge biologique des diabétiques et
les insuffisants rénaux, on a trouvé que le diabète est un
facteur favorisant le vieillissement. Le diabète est une maladie qui
produit des modifications et des perturbations au niveau de tous les organes
provoquant ainsi une détérioration de l'état physiologique
général des malades.
Il existe aussi de nombreuses analogies entre les effets de
l'insuffisance rénale chronique et celui du vieillissement.
Au cours de ces deux pathologies, il y a une perte très
importante de la compétence physiologique ce qui rend l'espérance
de vie des malades très réduite.
L'américain Médical Association Goncil on
Scientifique Affair recommande pour les gens âgés de plus de 40
ans un examen tous les un à trois ans, en fonction de l'histoire
médicale du patient et de ces facteurs de risque.
Ainsi nous recommandons aux médecins
diabétologues et néphrologues de prescrire des tests de
l'âge biologique afin d'étudier l'évolution de
l'état physiologique de leurs patients, vérifier
l'efficacité du traitement et prédire le maintien ou la perte de
la compétence physiologique afin d'évaluer l'espérance de
vie.
Nos résultat obtenus chez les diabétiques et les
insuffisants rénaux peuvent s'améliorer en prenant une bonne
hygiène de vie. Par exemple : on a examiné un patient, en lui
faisant passer des tests, on obtient un certain nombre de valeurs, on peut lui
expliquer où elle est sa capacité fonctionnelles. Il est alors
possible en lui donnant des conseils d'hygiène de vie en le revoyant un
an plus tard et s'il a bien suivi ces conseils, ses capacités au lieu de
se détériorer peuvent êtres stabilisées ou voir
progressées.
Au cour de notre contacte avec les patient et les
médecins, on a remarqué qu'il n'y a aucune culture sur la lutte
contre le stress oxydant plutôt délétère durant ces
maladies. Il n'y a aucune suplémentation antioxydante (vitamine), ni
culture hygiéno-diététique.
Recommandation vers un vieillissement réussit
:
> L'hygiène diététique reste le
meilleur moyen pour pouvoir prévenir les complications du
diabète, pour lutter contre le diabète et les maladies du
troisième âge. L'alimentation naturel (fruits et
légume)contient une gamme très varié de matière
antioxydante, vitamine C, E, A, coenz Q, bêta carotène (carotte),
licopéne(tomate) le licopéne est 10 fois plus puissant que la vit
E, les polyphénole de l'oignon,et les tanin du thé,
oligoélément(Zn,Se,Cu) et en enzyme anti oxydante tel que la SOD
(melon).
> Il faux éviter de prendre beaucoup de lipides
saturés tels que celles trouvés dans les viandes rouges,
charcuterie, ou il faut toujours ajuster un autre plat contenant des
légumes.
> Manger au moins 5 fruits et légumes par jour.
> Faite une activité physique régulière,
et évité la sédentarité.
> Augmenter la consommation de fibres reconnues pour leurs
propriétés hypolipémiantes et hypoglycémiantes.
> Ajouter les suplémentations antioxydantes au
traitement des diabétiques (vitamine, oligoélément),
oméga3, même si sa coûte chère, mais l'argent ne
remplace jamais un organe perdu tel que le rein.
> Favoriser la consommation de poisson, des huiles poly
insaturés (huile d'olive, de soja) riches en oméga, pour la
préservation des performances
neurologiques. et la
prévention du déclin cognitif.
> Faire beaucoup de lecture pour éviter la perte de
neurone.
> Bien suivre le régime et les habitudes alimentaires
prescrites pour les diabétiques (voir annexe)
La détermination de l'age biologique avec son
corollaire la prise en charge, ne peut que contribuer à lutter contre la
survenue des pertes d'autonomie, si redoutables pour l'individu et
coûteuses pour la société.
Références
Bibliographiques
1' Anne Marie R., Ferry M ; (2003): le
vieillissement de la population causes et impact socioéconomiques. J
Nutrition clinique et métabolique, n°4 ; 16 :291.
1' Bertinchant J-P ;(2004) : Troponines et
insuffisance rénale chronique chez l'hémodialysé.
Fréquence et mécanismes d'élévation.
Intérêt pronostique. Implications cliniques. J Archives des
maladies du coeur et des vaisseaux, no2 ; 97 : 157-164.
1' Borg J., Reeber A ., (2004) .Biochimie
métabolique .édition ellipses, France.pp ; 226-227.
1' Charles S., Ester R., Brunetto C., (2003).
Anthropologie biologique. 1 ére Edition Deboeck , Bruxelle ,
pP ;527-538
1' Clos J., Marc Coumans., Muller
Y.,(2003).biologie cellulaire et moléculaire 1cycle,
différenciation et mort cellulaire chez les animaux et les
végétaux. Édition ellipses, France. Pp ; 157-162.
1' Connell N ;(2003) : L'anémie : une
complication silencieuse du diabète. J Diabète Voice ; 48
:25-26.
1' Cook S & al. (2007); fréquence
cardiaque élevée comme facteur de risque cardiovasculaire : que
dit l'évidence ? J Kardiovaskulare Medizen ,n° 6 ;10 :202- 207.
1' Cristol J-P., Maggi M ;(1998): stress
oxydant et insuffisance rénale chronique ; quelles peuvent être
les approches. J comptes rendus es séances de la société
de biologie Et de ses filières, n 4 ; 191 :603-616.
1' CUNY G ., (1995).précis de
gériatrie. édition ellipses, pp ; 40-52, 223,227.
1' Delattre J., Durant G ., Jardillier C.,
(2003). Biochimie pathologique, aspects moléculaires et
cellulaires. Édition Flammarion, pp ; 176.
v' Ederrer F., Krueger DE., Morwery RL., Connett J.,
Went Worth D., (1986) : Lessons from the visuel acuity impairment
sarvey pilot stady.Am J public Health ; 76 :160-165.
1' Favier A ; (2003 ): le stress oxydant
,intérêt conceptuel et expérimental dans la
compréhension des mécanismes des maladies et potentiel
thérapeutique. J l'actualité chimique ;14 :111-114
v' Fitsum GE, Denis F ; (2004) :
Altérations métaboliques au cours de l'insuffisance rénale
chronique .J science directe, n°1 ; 18 : 3-7.
1' Florian H., Gerdlinden M ., Christian G., Isabelle M.,
Silke B ., Nadine S.,Birgit M .,(2005). Biochimie humaine
.édition Flammarion.
1' Gillery P., (2006) ; stress oxydant et
glycation des protéines au cours du diabète sucré. J Ann
bio clin, n 4 ; 64 : 302-313.
1' Gillery P, Labbé D, Dumont G, Vassult A ;(
1995) : Glycohemoglobine essays évaluâtes in a large
scalequalitus control Survey ; 41 :1644-1648.
1' Jacque B., André R, (2004). biochimie
métabolique. Ellipse Edition marketing S.A. pp ; 220-230.
1' Madore F., (2004): facteurs de risques de
maladies cardiovasculaires et insuffisances rénales .J médecine
science, n 12 ; 20 :1101-1102-1103.
n° 6;10 : 202-207.
1' Guillausseau P& al ., 1992. Sucre&
nutrition, édition Doin éditeur, Paris. PP : 48
1' Pilardeau P., (1995).biochimie et nutrition
des activités physiques et sport. PP : 364-365.
1' Robert L., (1989). les horloges biologiques.
Flammarion, paris, PP ; 105-158.
1' Schevebeke J.,(1995) .étude de la
réabsorption de l'albumine dans le tube proximal
du rein
,modification au cours du vieillissement in thèse doctorat, Paris
France.
1' Wahren et Ekberg., (2007). Ann Rev Nutr.
1' Yassuda H., Ito T.,Sakuta H.,Suzukit ;2006
:vital capacity and selected metabolic
diseases in middle - aged japonese men. J canadien respiratory,
n°2 ; 13 :82.
'7
1' Anonyme :
- Anonyme I : (
www.OPRAH.com.Dr OZ.
Réal âge test). - Anonyme II : (www.a
FSSAPS .santé.fr).
- Anonyme III : (
www.Colvir.net).
- Anonyme IV :(
www-santé.ujf-grenoble.fr).
1' La rousse médicale, 2004.
ANNEXE :
ANNEXE :


Questionnaire des malades : Sexe : M F
Age :

SYNDROME METABOLIQUE :
Etes- vous hypertendu ?
Si oui, Depuis combien de temps avez- vous l' HTA?

Avez- vous du cholestérol ?
Etes- vous diabétiques ?
Si oui : etes-vous traité ?
Quel type de traitement ?
- antidiabétiques oraux ?
- Insuline ?
Depuis combien de temps avez- vous le diabète ?
RISQUE CARDIOVASCULAIRE :

Etes- vous fumeur ?
Quelle est sa tension artérielle ?
Quel est sont taux de cholestérol ?

POUR LES INSUFFISANTS RENAUX : Quant
été votre première séance de dialyse ?



