I.2.2.1.2 - Différents types de cellules :
> Cellule à faible capacité de
renouvellement :
Les neurones, cellules musculaires, leucocytes qui ont
l'âge de la personne. Le dérèglement dans les fonctions de
ces cellules et leur destruction est parmi les déterminants fondamentaux
du vieillissement du corps. Puisque ces cellules sont non renouvelables car
elles ont perdu le pouvoir mitogène. Alors l'accumulation à leur
niveau de lésion de l'ADN qui mène à l'appoptose ce qui
explique la réduction progressive de leurs nombres.
Des modifications structurales et fonctionnelles dont la plus
apparente est la surcharge cytoplasmique en grains pigmentaire d'origine
lipidique : la lipofuscine appelée aussi pigment de la vieillesse.
(CUNY. 1995)
> Cellules renouvelables dont les possibilités
de renouvellement ne sont pas illimitées :
Elles sont proportionnelles à la longévité
de l'espèce avec des écarts entre les individus d'une méme
espèce. (CUNY. 1995)
I.2.2.1.3 - Les télomères et les
télométrases :
Ce sont des séquences de nucléotides (TTAGGG)
pouvant se répéter plusieurs milliers de foies, marquent la fin
de l'ADN et permettent sa stabilité et évitent la fusion entre
les chromosomes (Caillet,2006).
Le vieillissement cellulaire pourrait être
conditionné par une perte progressive de l'ADN des
télomères (extrémité du chromosome). En effet, au
cours de leur division successive, les cellules perdent progressivement de
l'ADN télomérique (car l'ADN polymérase ne peut
répliquer complètement les extrémités des
molécules d'ADN linéaires. Ce qui en résulte une perte de
nucléotides terminaux). Quand la perte totale dépasse un certain
seuil, les cellules cessent de se diviser et entrent en
sénescence. (Clos & al,2003).
La télomérase est une enzyme qui peut compenser
cette perte d'ADN télomérique. Notons que les cellules
cancéreuses qui peuvent se diviser indifféremment, expriment
fortement cette enzyme. De plus des cellules humaines, qui entrent normalement
en sénescence au bout d'un nombre défini de cycle cellulaire
continuent à se diviser si elles sur expriment la
télomérase. La protéine anti-apoptotique Bcl-2 favorise
l'activité de la télomérase et pourrait donc participer au
control du vieillissement cellulaire (Clos & al .2003). (voir fig.
12)
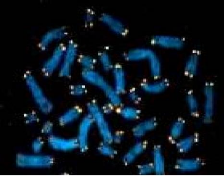
Fig.12. les télomères. (Caillet,
2006)
I.2.2.1.4 - Les conséquences de l'altération
de l'ADN :
Des modifications de l'expression de certains gènes et
modifications de synthèse des protéines commandées par ces
gènes.
Des perturbations du cycle cellulaire ce qui favorise
l'entré en appoptose et diminution du nombre des cellules.
(CUNY, 1995)
1.2.2.2- Hypothèse somatique :
1.2.2.2.1- Radicaux libres et stress oxydatif
:
Les radicaux libres existent dans tous les systèmes
vivants. Ils apparaissent comme intermédiaires dans les réactions
métaboliques d'oxydation de la cellule de nature enzymatique ou non. Les
réactions enzymatiques productrices de radicaux libres concernent la
chaîne respiratoire cellulaire, la synthèse de la prostaglandine,
le système du cytochrome
P450. Les réactions de l'oxygène avec les
composés organiques ou celles secondaires aux radiations ionisantes sont
des exemples (CUNY.1995).
Le vieillissement et de nombreuses pathologies
(athérosclérose, diabète sucré, maladies
inflammatoires, Alzheimer) s'accompagnent d'un stress oxydant
(Delattre& al., 2003)
· Définition des radicaux libres
:
Ce sont des espèces capables d'existence
indépendante contenant un ou plusieurs électrons non
appariés « dite électron célibataire »
(Hallicuel & gutterige 1999) in (Delattre& al.,
2003).
Ces radicaux peuvent se former par transferts mono
électroniques, ou par scission homolytique d'une liaison covalente.
(voir fig 13)
rupture homolytique radicaux libres.


A° + B°
A + + B - rupture hétérolytique ions
Fig.13 .Mécanisme de formation d'un radicale
libre. (Delattre& al., 2003)
Après une rupture homolytique, chacun des deux
électrons intervenant dans la liaison entre les atomes A et B gagne
l'orbital externe de ces atomes qui deviennent alors des radicaux libres. Mais
au cours d'une rupture hétérolytique le doublet
électronique est accepté par l'un des deux atomes, qui deviennent
un anion B-.
La présence d'électron libre confère aux
radicaux libres une grande réactivité. (Delattre&
al., 2003)
· Sources et réactivité des
principaux radicaux libres et espèces activées de
l'oxygène :
La formation des principales espèces activées de
l'O2 est rapportée par la chaîne de réduction monovalente
de l'O2. L'addition successible de 4é sur la molécule d'O2
conduite à la formation de molécule d'eau. (Voir
fig14)
+é + é + 2H + + é+ H++ H2O +
é+ H+

O2 O2°- H2O2
OH° H2O
Dioxygène anion super oxyde peroxyde d'hydrogène
radical hydroxyle
(Non radicalaire)
FIG.14. Source des principaux radicaux libres.
(Delattre& al., 2003)
> Radicaux super oxydes (O2°-)
:
Ce sont des radicaux relativement peu réactifs par eux-
même, mais dont la toxicitéprovient de leur pouvoir de
donner naissance à des composés plus réactifs.
Sous l'action de la superoxyde dismutase
l'O2°- se dis mute en peroxyde d'hydrogène H2O2 qui, en
présence d'ions métalliques, donne des radicaux hydroxyles OH
° très réactifs, sa forme peptonée hydroperoxyle
H2O° est beaucoup plus réactive et sa pénétration est
facilitée au niveau des membranes biologiques.
Plusieurs sources de radicaux superoxydes peuvent êtres
répertoriées in vitro, il s'agit des réactions
enzymatiques, des réactions d'auto oxydation, de protéines
héminiques, des mitochondries, du réticulum endoplasmique et du
noyau de la cellule :
- Réaction d'auto ~oxydation :
Plusieurs composés, tel que l'adrénaline, la
noradrénaline, le FMNH2, le FADH2 peuvent être oxydés en
présence d'O2°, en transférant un électron sur la
molécule O2 conduisant au radical super oxyde. (Delattre&
al., 2003).
- Protéines hémi-niques :
L'hémoglobine et la myoglobine capables de fixer l'O2 au
niveau de leur noyau héminiques (Fe+2), peuvent subir une
oxydation en présence d'O2 selon la réaction suivante :
Hème --Fe+2 -- O2 O2°- +
hème --Fe+3
La forme oxydée dénommée,
mét-hémoglobine ou met-myoglobine est incapable de transporter
l'O2 et donc inefficace. (Delattre& al.,2003)
- Mitochondrie :
La membrane mitochondriale interne contient la chaîne de
transport d'électron, lors du passage de la forme semi quinone à
la forme quinone (un coenzyme --Q) se produit une fuite d'électrons
conduisant à la formation de
O2°- .Cette production
radicalaire contribue aux attaques de l'ADN mitochondriale.
(Delattre& al., 2003)
- Réticulum endoplasmique :
La membrane de réticulum endoplasmique (REP)
possède une chaîne de transfert d'électrons microsomiques
fait intervenir des cytochromes P450. Le (REP) hépatique est très
riche en cyt p450 pour rendre les médicaments, xénobiotiques plus
hydrophiles et facilite leur élimination urinaire. Il y a aussi le
transfert d'électron qui fait intervenir la NADPH, cytochrome P450
réductase, flavoprotéine capable de réduire O2 en O2
-° .
(Delattre& al.,2003)
- Noyau :
La membrane du noyau est comme celle de la mitochondrie
contient une chaîne de transport d'électrons qui peut laisser
échapper des électrons susceptible de réduire l' O2 en O2
-°, conséquence néfaste en raison de la
proximité de l'ADN. (Delattre& al.,2003)
> Radicaux hydroxyles le OH°
:
Ce sont les plus réactifs, ils peuvent oxyder des
acides aminés, produire des coupure de brin d'ADN et des modifications
des bases puriques et pyrimidiques, et attaquer des lipides au niveau des
membranes et des lipoprotéines, initiant ainsi la peroxydation lipidique
:
> Source des OH°
1. Selon la réaction de Fenton qui est un exemple
radicalaire catalysé par des métaux de transitions et conduisant
à la formation de OH°.
Fe+2 +H2O2 Fe+3 +
OH° + OH-
Ainsi le fer pourra t'il agir comme initiateur primaire de la
peroxydation lipidique.
2. les radiations ionisantes sont aussi des
générateurs des OH°.
(Delattre& al.,2003).
Le rôle du OH° dans la
peroxydation des lipides, qui donne les peroxydes lipides qui sont
néfastes pour l'ADN (voir fig 18) et qui peuvent
être placés parmi les facteurs internes intoxiquant le
génome, et selon leur taux dans les tissus et le sang on peut constater
les risques internes sur l'ADN durant le vieillissement. (Michael,
2000)
> Monoxyde d'azote NO :
Synthétisé à partir de l'organisme grace
à l'enzyme NO synthéase.
Il est susceptible de réagir avec d'autre radicaux
libres pour former des espèces oxydantes telles que O2 - ° pour
donner le peroxynitrite ONOO-, oxydant puissant vis-à-vis de
nombreuse molécules biologiques (Delattre& al.,
2003).
- Composé oxygéné non radicalaire :
> Acide hypochloreux HOCL :
Un puissant oxydant capable de réagir avec de
nombreuses molécules biologiques notamment celles contenant des
groupements thiol (-SH) telles que les enzymes et les hormones.
(Delattre& al., 2003)
> Peroxyde d'hydrogène H2O2 :
Peu réactif en absence de métaux de transition,
capables de diffuser rapidement à travers les membranes
cellulaires. (Delattre& al., 2003)
> Peroxynitrite ONOO- :
Il induit la nitration d'acides aminés aromatiques et
l'initiation de la peroxydation lipidique. (Delattre& al.,
2003)
1.2.2.2.1.1. Les systèmes de défense
anti-oxydants :
Le vieillissement se traduit par une augmentation de radicaux
libres surtout au niveau mitochondrial et diminution dans les systèmes
antioxydants (Caillet, 2006).
1.2.2.1.2. Système enzymatique :
> Peroxyde dismutase (SOD) : les SOD
catalysent la dis- mutation mono électrique de l'anion super oxyde en
peroxyde d'hydrogène et en O2
La diminution de l'efficacité des systèmes anti
oxydant est un résultat du dérèglement des systèmes
de réparation de synthèse protéique de la cellule et la
mitochondrie.
Cu, Zn-SOD : essentiellement présentes dans le cytoplasme
des cellules.
Enzyme --Cu+2 +O2°- enzyme
--Cu++ O2

Enzyme-Cu+ + O2°- +H2+
enzyme- Cu+ +H2O2
Les ions Cu+2 nécessaires à
l'activité SOD, tandis que le Zn+ stabilisent la structure de
l'enzyme.
Mn-SOD : présente dans la mitochondrie
Mn+3+ O2°- Mn+2 +O2
> catalase :
C'est une enzyme héminique capable de transformer le
peroxyde d'hydrogène par dis- mutation en eau et en oxygène
moléculaire présent dans les peroxysome et les hématies.
Catalase --Fe+3 + H2O2 catalase --Fe+3 + H2O + O2
> peroxydase: glutathion peroxydase :
Les peroxydases sont des enzymes capables de détoxifier
le peroxyde d'hydrogène et d'autres hydroperoxydes (en particulier
d'origine lipidique) en couplant la réduction de l'hydroperoxyde avec
l'oxydation d'un substrat réducteur.
Ont se limitent aux caractéristiques de la glutathion
peroxydase (GSH-PX). Il est constitué de quatre sous unités
protéiques, comportant un atome de
sélénium dans chaque sous unité.
On mesure ainsi l'importance de sélénium pour le
bon fonctionnement de cette enzyme. Un déficit se conduit à une
baisse de l'activité de cette dernière, donc à une moindre
épuration des hydroperoxydes. (Delattre& al., 2003).
Un taux abondant en sélénium dans le corps diminue le
risque d'attrapé des maladies cardio-vasculaires, et joue un rôle
dans la prévention du vieillissement prématuré.
(Michael.2000).

SOD
O2 H2O2 H2O
catalase ~glutathion peroxydase.
+ NO° +Fe+2 (reaction de
Fenton)
ONOO- OH°+ OH-+ Fe
+3
Nitration et oxydation oxydation des lipides, ADN et des
protéines.
Des protéines.
Fig.15. Coopération entre enzyme anti-1 \
CD(MBS'DSLIs BI7 BDttLe] BDO,B2EE3).B 1.2.2.2.1.3. Système non
enzymatique :
Comporte des composés synthétisés in
vitro tel que la bilirubine, les hormones sexuelles
(oestrogène),la mélatonine ,l'acide lipoique, le coenzyme Q,
l'acide urique et des composés apportés par l'alimentation
comme l'acide ascorbique ,vitamine E , les caroténoïdes ou les
poly- phénols.
On peut les classer selon qu'ils sont hydrosolubles, assurant
une protection des milieux intra cellulaires, ou liposolubles agissant au
niveau des membranes lipoprotéines circulantes :
> antioxydants hydrosolubles :
L'acide ascorbique, glutathion réduit, l'acide urique
et poly phénols. Notons en outre le rôle protecteur
vis-à-vis du stress oxydant des protéines telles que la
ceruléoplasmine qui empêchent la formation du OH°
.
Les éléments traces (Zinc, Cuivre,
manganèse, sélénium) ont une grande importance dans la
défense anti-radicalaire, en raison de leur participation au
fonctionnement des enzymes anti-oxydantes. (Delattre& al.,
2003).
- L'aFideIahF1IEITXe :
Est un composé réducteur qui agit en synergie avec
l' á tocophérol en permettant sa
régénération.
- le glutathion réduit :
Joue un rôle majeur dans la détoxification des
hydroperoxydes par les glutathion peroxydases. (Delattre&
al.,2003).
- Les poly phénols :
Parmi les quels les flavonoïdes, sont des piégeurs
de radicaux libres et des chélateurs d'ions métalliques Fer. Ils
fonctionnent notamment en cédant un atome d'hydrogène à
des radicaux formés lors de la peroxydation lipidique.
> antioxydants liposolubles :
La vitamine E, la B carotène, l'ubiquinol 10 et le
lycopéne sont des antioxydants liposolubles transportés par les
lipo- protéines en particulier LDL, qu'ils protègent contre la
peroxydation lipidique.
Le composant majeur de la vitamine E est l'á
tocophérol, il consiste à piéger des radicaux pyroxyles le
RO2° issus de la peroxydation lipidique.
Les caroténoïdes dont font partie le
â.caroténe (carotte, chlorophylle) et le lycopéne
(présent dans les tomates) piègent l'oxygène singlets. Le
B carotène est aussi capable de piéger des radicaux peroxyles et
protège ainsi les LDL dans les quels il est transporté.
(Delattre& al.,2003).
1.2.2.2.1.4. Oxydation des molécules biologiques
:
> oxydation des lipides ;
Les acides gras poly- insaturés, qu'ils soient sous
forme non estérifiée (AGNE) ou estérifiée
(phospholipides, esters de cholestérol, triglycéride) sont la
cible lipidique majeur des radicaux libres ainsi que le cholestérol
libre. Donc chez les mammifères, les membranes plasmiques et les
complexes albumine-AGNE soient particulièrement
vulnérables. (Delattre& al.,2003).
L'initiation : est due à l'attaque
d'un radical libre entraînant l'abstraction d'un atome d'hydrogène
situé sur -CH2 pour la formation de radical centré sur le carbone
RO°. Ce RO° combine avec O2 pour donner un
radical pyroxyle ROO°. Rappelons que l'O2 est une
molécule hydrophobe capable de ce concentrer au sein de la
double couche phospholipidique des membranes.
Le ROO ° est capable d'arracher un atome
d'hydrogène d'un autre acide gras polyinsaturé en donnant un
hydroperoxyde de ROOH et un nouveau radical R° qui agit avec l'O2 pour
former un autre ROO°et la chaîne de peroxydation continue, c'est la
prolongation.
L'abstraction d'un H ° peut avoir lieu sur plusieurs
carbones de la chaîne d'acide gras. Par exemple l'acide linoléique
sa peroxydation donne deux hydroperoxydes.
Acide arachidonique= 6 ROOH.
La terminaison peut survenir par recombinaison de deux radicaux
libres par exemple : RO20 + RO20 ROOR + O2
Les peroxydes formés se décomposent sous l'effet
de la chaleur ou en présence d'ions de transition (Cu+2), et
libèrent de nombreux produit tels que des hydrocarbures (éthane),
des aldéhydes (dialdéhyde malonique) MAD ce dernier agit
aisément avec les groupement aminés libres des
Apo-lipoprotéines (Apo A1, Apo B...) plus particulièrement avec
les groupement lysines.
Les modifications du MAD sur certaines lysines de l'Apo B des
LDL, inhibe leur liaison avec les récepteurs Apo B/E, entravant leur
internalisation cellulaire.
Le 4 --hydroxynonénol formé au cours de la
peroxydation de l'arachidonique et linéique, est responsable de la
génotoxicité, inhibe la croissance cellulaire.
(Delattre& al., 2003).
> Oxydation du cholestérol :
Elle conduit à la formation d'hydro- peroxyde d'ester de
cholestérol et des oxystérols.
Ils on été mis en évidence dans le
plasma, lipoprotéine et plaque d'athérome lors de la biopsie. Ils
peuvent être apportais par l'alimentation ou générés
in vitro, ils ont un rôle d'initiation et le
développement de la plaque d'athérome.
Le 27 hydro cholestérol et le 7 céto
cholestérol sont de puissants agents cytotoxiques pour les cellules de
la paroi vasculaire (cellules endothéliales, cellules musculaires
lisses). (Delattre& al., 2003).
> Oxydation des phospholipides :
Les membranes cellulaires constituent les premières
cibles pour les radicaux libres circulants. Elles y sont sensibles
particulièrement à cause de leur richesse en acides gras
insaturée. Le système nerveux central est particulièrement
sensible aux radicaux libres à cause
de sa grande consommation d'oxygène, et de la grande
concentration de lipide poly insaturés « myéline », et
de sa faiblesse en enzymes antioxydants. (Borg &
Reeber.2005).
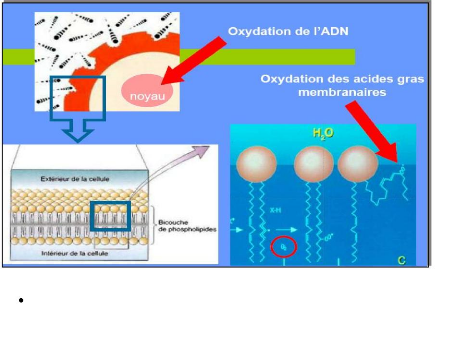
déformer (fluidité membranaire) (voir
fig 16). A ce niveau, le mécanisme oxydatif intervient sur les
structures phospholipidiques, très insaturées, et les
protéines présentant un groupement thiol (cystéine) par
formation de ponts disulfures. Cette dénaturation et à l'origine
:
De remaniements structuraux des récepteurs de surface
(difficulté ou incapacité à reconnaître les
substrats), se phénomène peut être la cause de
l'insulinorésistance au cour du diabète.
L'attaque des membranes modifie leurs propriétés
biologiques et leur capac
Fig.16. Attaques radicalaires des membranes biologiques
(Caillet, 2006).
ité à se


D'une régidification des structures membranaires
particulièrement handicapantes pour les érythrocytes
(chaîne respiratoire).
De modification des capacités d'échange (Na+, H+,
Ca++).
Du fait des sa très brève demie de vie (10-9
seconde), le radical OH° ne peut exercer son effet toxique que localement
c'est-à-dire sur sont lieu de production (foie, muscle,
érythrocyte...). A l'opposé O2° et H2O2 du fait de leur
relative stabilité, peuvent diffuser dans les liquides extracellulaires
et produire leurs effets toxiques à distance. (Pilardeau,
1995).
> Oxydation des protéines et acides
aminés :
Les protéines intra et extra- cellulaire sont des cibles
de radicaux libres. Elles prouvaient piéger 50 à 70 % des
radicaux libres générés par la cellule.
(Delattre& al., 2003).
L'attaque des RLO porte également sur la
dépolymérisation de l'acide hyaluronique ce qui explique la perte
de l'eau. (P. Pilardeau, 1995).
L'ADN et L'ARN sont aussi des cibles privilégiées
de radicaux libres.
L'ADN d'une cellule peut être le siège de 10000
attaques radicalaires /jour.
Dans l'ADN nucléaire présente une base
modifiée par les radicaux libres sur 130000 bases, et une baes sur 8000
pour l'ADN mitochondrial. Cela est due au fait que la mitochondrie est le
siége d'un métabolisme important d'O2, plus de 90% de l'O2
cellulaire. Il peut y avoir un échappement continu de radicaux libres de
la chaffne respiratoire.
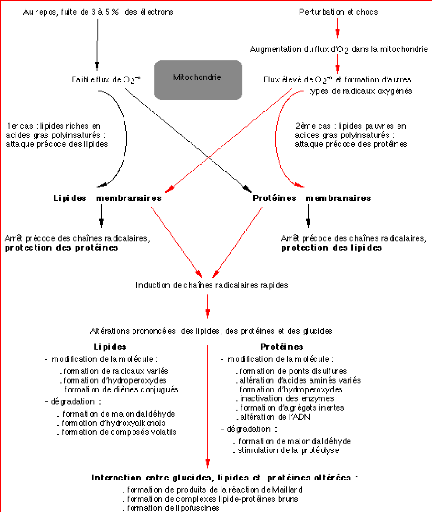
Le OH° est le radical le plus réactif avec l'ADN
et l'ARN, car il réagit facilement avec les bases (puriques,
pyrimidines) et avec les sucres (ribose, désoxyribose). Les
protéines nucléaires « histones » sont également
attaquées par les radicaux libres oxygénés, entraffnant la
formation de liaisons croisées ADN-histone par la formation de ponts
thymidine --tyrosine (voir fig 18). Ces liaisons
croisées interfèrents sur la réplication, transcription,
et la réparation de l'ADN. (Delattre& al.,
2003).
Cette opération est l'événement principal
dans le vieillissement des cellules de faible capacité de renouvellement
ou qui ne se divisent pas, d'où le dérèglement dans les
fonctions de ces cellules et leur destruction, est parmi les
déterminants principaux du vieillissement de tout le corps.
(Michael, 2000).
Des concentrations accrues de bases oxydées ont
été observées dans l'ADN au cours du vieillissement ainsi
que chez les patients diabétiques. (Delattre& al.,
2003).
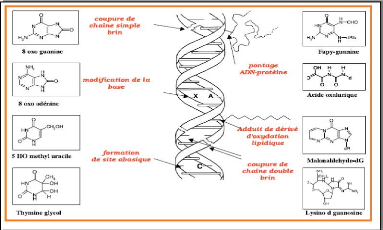
Fig18. Les principaux dommages oxydatifs
médiés à l'ADN par les RLO. (Favier,2003)
Les bases qui composent l'ADN, et particulièrement la
guanine, sont sensibles à l'oxydation. Engendrant un grand nombre de
bases modifiées : 8 oxo guanine, 8 nitroguanine, 8 oxo
adénine,
5 hydroxy cytosine, 5 hydroxy méthyle uracile, thymine
diol, oxazolone.
| 


