INTRODUCTION GENERALE
0.1.
Etat de la question
La République Démocratique du Congo
présente une grande biodiversité végétale, mais sa
composition floristique demeure très méconnue pour certaines
entités administratives. Il est indispensable que chaque nation dispose
des informations relatives à ses ressources ; à l'heure des
inventaires des ressources naturelles, comme le fait remarquer Mullenders
(1954).
La connaissance claire et précise de ses
potentialités est un des éléments qui permet
d'élaborer un programme de mise en valeur et de développement
local, régional et national qui doivent s'intégrer dans le plan
d'aménagement et de gestion durable des ressources naturelles. En ce qui
concerne les ressources naturelles biologiques en général et
végétales en particulier, les données actuellement
disponibles sont sectorielles et parfois incomplètes. Cela
nécessite le développement des recherches dans des régions
et des zones relativement peu ou pas du tout explorées.
La flore et la végétation de nombreuses
régions congolaises ont fait l'objet de plusieurs travaux floristiques
et phytosociologiques, notamment la région montagneuse de l'est (Lebrun,
1947; Robyns, 1958; Germain, 1952; Léonard, 1962). Ces travaux se
rapportent à la flore du parc national Albert, à la
végétation des plaines alluviales au sud de lac Edouard et
à la végétation de la plaine de la Ruzizi ainsi que
l'étude de la flore du Ruwenzori flanc ouest. Dans le sud-est, on peut
citer Focan et Mullenders (1949), Duvigneaud (1953), Schmitz (1950, 1952,
1963), Mullenders (1954), Malaisse (1997).
Ces travaux traitent la flore et la végétation
des forêts claires zambéziennes et de la zone de transition
régionale guinéo-congolaise et zambézienne ainsi que des
formations herbeuses. Plus récemment le travail de Malaisse sur les
ressources des forêts claires du Haut-Katanga complète les aspects
floristiques et phytosociologiques.
Dans la région de Yangambi, de Kisangani et Mbandaka
dans la cuvette centrale, les travaux sur la flore et la phytosociologie ont
été effectués, notamment par Louis (1947), Léonard
(1947, 1952), Germain et Evrard (1956), Dhetchuvi et Lejoly (1990). Dans cette
dernière contrée, les travaux floristiques, écologiques et
phytosociologiques se sont poursuivis après l'indépendance avec
les chercheurs des Universités de Kinshasa et de Kisangani (Evrard 1968;
Lubini, 1982; Mandango, 1982 et 1988; Nyakabwa, 1982; Mandango & Nyakabwa,
1988; Ntahobavuka & Nyakabwa, 1988; Nyakabwa, 1988; Musango, 1990; Bebwa et
al., 1990; Apema et al., 1994, Nshimba, 2008). Cette zone est parmi les mieux
floristiquement et phytosociologiquement connue.
Dans le sud-ouest, nous retiendrons les travaux de Devred
(1954, 1956, 1957, 1958), Lubini & Mandango (inédit), Lubini (1990,
1997), Masens (1997), etc). Les travaux de ces divers auteurs se rapportent
à l'analyse de la flore, à la phytosociologie et à
l'utilisation des ressources phytogénétiques.
La Réserve de Biosphère de Luki est l'une des
entités phytogéographiques de la R.D.C, floristiquement la moins
connue. Le travail de Donis (1948) a été la première
étude sur la sylviculture du Mayombe avec référence
à la Réserve de Biosphère de Luki. Une seconde
étude de Donis & Maudoux (1951) faisait allusion à une
méthode de conversion des futaies remaniées d'âges
multiples pour l'aménagement des forêts de la Réserve. Une
publication de Maudoux (1954) donnait des observations sur la
régénération naturelle dans les forêts
remaniées du mayombe. Lubini (1984) publiait une étude
préliminaire sur la Réserve de Biosphère de Luki et en
1990, une synthèse sur la flore de cette Réserve.
Le survol de la littérature consacrée à
ce territoire nous permet de signaler les différents travaux de
recherche réalisés par plusieurs chercheurs qui ont
porté sur la flore (A. Lubini ;1984,1997); l'écologie de la
rivière Luki (Mutambue,1984); le plan d'aménagement de la
réserve (Kapa et al, 1987); la conservation des
écosystèmes forestiers du Zaïre( Charles Doumenge,1990); le
patrimoine floristique et faunique (Pendje et Baya,1992); la
biodiversité (Mbemba et Malekani,1995); l' impact des activités
humaines (Gata,1997).
Ce survol rapide de la littérature confirme le
caractère sectoriel des connaissances botaniques de l'espace congolais.
Il apparaît nécessaire de poursuivre et de diversifier les
recherches floristiques et phytosociologiques sur l'ensemble du pays,
particulièrement dans les zones forestières où la
phytodiversité est naturellement élevée. Des connaissances
sur ces aspects des études conduisent à donner au Congo les bases
d'une gestion rationnelle garantissant son développement durable. C'est
ainsi que nous avons choisi pour notre étude la Réserve de
Biosphère de Luki, dans le territoire de Lukula, District du Bas-fleuve,
Province de Bas-Congo.
0.2.
Délimitation
Bien que située à la limite orientale de la
chaîne du Mayombe et malgré sa superficie réduite, la
Réserve de Biosphère de Luki constitue un échantillon
assez représentatif de la flore et de la végétation du
Mayombe. Avec quelque 1150 mm de pluie par an, son climat est de type
subéquatorial avec une saison sèche marquée de 3 mois,
dont les effets sont cependant très fortement atténués par
de très abondants brouillards. Le déficit de saturation reste en
effet inférieur, durant presque toute l'année, à ce qu'il
est dans la cuvette centrale zaïroise.
0.3.
Problématique
Botanistes et phytogéographes reconnaissent depuis
longtemps la nature hétérogène et morcelée des
forêts tropicales humides (Richard, 1952 ; Whitmore, 1984), mais le
rôle des variations locales de la topographie (Kahn, 1983 ; Basnet,
1992) ou des paramètres édaphiques (Trichon,
1997 ; Lescure et Boulet, 1985, etc.) sur
l'hétérogénéité structurale de ces
forêts et leur richesse spécifique élevée sont
souvent interprétés en termes de dynamique forestière
(Aubreville, 1938).
Les forêts de Mayombe sont en contradiction avec les
principes écologiques (1400 à 1500 mm) pour leur
développement. Elles existent grâce aux précipitations
occultes (pluies non mesurables ou brouillards) < 1400 mm.
Son relief est caractérisé par une altitude
variant entre 150 et quelque 500 m, avec des vallées très
encaissées et fréquemment sèches; les
dénivellations sont de l'ordre de 40 à 70 m entre les sommets de
colline et les fonds de vallée.
La chaîne du Mayombe en général et celle
de Luki en particulier sont constituées d'une série de collines
qui s'élèvent progressivement en direction Nord-est, depuis les
plateaux littoraux jusqu'aux limites Ouest de la chaîne des monts
Cristal. Dans les limites de la Réserve, ces collines forment des
crêtes dont l'altitude absolue varie entre 150 et plus de 500 m et ces
crêtes créent deux zones dont une orientée à l'Ouest
et l'autre à l'Est ; le versant Ouest est exposé aux vents
humides provenant de l'océan Atlantique et secs sur le versant Est
tandis que les dénivellations relatives (entre les fonds des
vallées et les collines environnantes) sont de l'ordre de 40 à 70
m. Les pentes atteignent des valeurs de 10 à 50%.
La saison sèche dure quatre mois et se
caractérise par une légère température et de
fréquents brouillards matinaux ou brumes, qui compensent le
déficit en eau du sol. Ces brouillards ou brumes sont
considérés comme des précipitations occultes. Les
précipitations moyennes annuelles sont très
irrégulières avoisinant 1.281,6 mm.
A partir de ces principes, les forêts s'adaptent dans
leur fonctionnement physionomique c'est-à-dire une adaptation
morphologique (la hauteur et le diamètre des arbres ainsi que le rythme
saisonnier). L'arbre ne peut atteindre l'optimum de son diamètre et les
forêts de Mayombe sont considérées comme forêts
basses par rapport aux autres forêts. Les forêts de Mayombe
présentent une structure verticale stratifiée comprenant
plusieurs synusies. Cette réalité a été mise en
évidence par les travaux antérieurs notamment, Donis (1948) et
Lubini (1997) ; tels que la discordance écologique, le
problème d'adaptation et la stratification.
L'agriculture et l'exploitation forestière ont
fortement remanié l'aspect de la végétation; la
Réserve de Luki n'échappe que très partiellement à
cette règle générale. L'humidité relative de l'air
reste élevée durant toute l'année (oscillant autour de
73%). Les vents sont très importants et violents surtout dans les
après-midi (Lubini, 1997).
La Réserve de biosphère de Luki se
caractérise par une grande variété de biotope
déterminé par la nature du sol, du relief, les microclimats,
l'action de l'homme ou encore l'hydrographie. On distingue ainsi des
forêts denses humides, des forêts secondaires, des forêts de
lisière, des savanes, des clairières, des champs, des
rivières, des fonds des vallées temporairement inondés,
des pentes ou encore des sommets rocheux et des crêtes (Pendje et Baya,
1992). Cet état de chose, donne une idée sur l'adaptation
morphologique des espèces floristiques (espèces à
contrefort, à empattement et à racines échasses) au niveau
du sol.
Très peu d'études ont abordé les aspects
relatifs aux relevés phytosociologiques et pas d'études relatives
à la toposéquence. Dans le but de combler cette lacune et
valoriser le potentiel écotouristique de la réserve, nous
proposons d'analyser la diversité des ligneux arborescents des
principaux types forestiers de la Réserve.
0.4.
Hypothèses de l'étude
Tous les arguments physionomiques, floristiques et
géologiques nous permettent de formuler l'hypothèse selon
laquelle : la variation de relief qui caractérise la Réserve
de Biosphère de Luki en général et en particulier le
nord-est de cette aire protégée exerce une certaine influence sur
les types de forêts, et la composition floristique des synusies
arborescentes dominantes et dominées. La catena de sols formés
induit des paramètres édaphiques susceptibles d'élucider
la variation physionomique saisonnière de certains groupements
forestiers développés sur les séquences topographiques
Ces aspects écologique, floristique et topographique
constituent des éléments pour lesquels nous tenterons d'apporter
notre contribution pour la compréhension de l'écosystème
de la Réserve de Biosphère de Luki en général et du
nord-est de cette aire protégée en particulier.
0.5.
Objectifs de l'étude
Ce travail a pour objet d'analyser la diversité
floristique des ligneux arborescents des principaux types forestiers du
nord-est de la Réserve de Biosphère de Luki. Il s'agit
d'identifier les ligneux arborescents, de les caractériser par les
principales espèces et de rechercher les explications de nature
écologique qui président à cette
différenciation.
En clair, notre étude vise les objectifs
spécifiques suivants:
Ø Déterminer la composition spécifique
sur chaque toposéquence ;
Ø Identifier le (s) facteur (s) écologique (s)
qui influence (nt) la composition floristique ;
Ø Déterminer les complexes les plus
diversifiés ;
Ø Analyser la texture du sol et la teneur en eau de
différents complexes
Ø Déterminer les différents groupements
forestiers ;
Ø Suggérer quelques propositions pour
l'utilisation locale durable de ces ressources naturelles.
0.5.
Intérêt de l'étude
Du point de vue scientifique, les
résultats de notre étude nous permettrons de connaître les
ressources forestières de la Réserve de Biosphère de Luki,
la richesse spécifique de chaque toposéquence et l'influence des
facteurs écologiques sur la richesse floristique afin de proposer un
plan d'aménagement qui nous amènera à une gestion durable
des ressources forestières de la Réserve. Ces résultats
combleront les lacunes sur la connaissance botanique de la Réserve de
Biosphère de Luki. La localisation des relevés phytosociologiques
et leur composition floristique peuvent servir à établir des
cartes de distributions locales des espèces, très utiles aux
scientifiques et aux utilisateurs.
Un autre intérêt de cette étude est de
nature didactique. Les méthodes d'études
utilisées pourront servir aux enseignants et aux chercheurs juniors. Ils
y trouveront le mode de traitement des données des relevés
phytosociologiques, des tableaux récapitulatifs des groupements
végétaux.
Notre herbier de référence déposée
à l'herbarium de la Faculté des Sciences de l'Université
de Kinshasa est un apport utile pour l'identification ultérieure des
matériels botaniques récoltés dans la réserve de
Biosphère de Luki. Les groupements végétaux
étudiés dans ce travail permettront l'identification des
espèces ou des associations indicatrices des différentes
toposéquences.
Sur le plan socio-économique, les
inventaires floristiques, l'étude des groupements végétaux
et les informations sur la raréfaction ou la disparition de certaines
espèces locales sont des informations très utiles pour les
gestionnaires, les exploitants forestiers et autres utilisateurs. Les
inventaires de la flore et les listes de la composition floristique
confectionnées lors des relevés phytosociologiques peuvent
être utilement exploitées par les exploitants forestiers et les
scientifiques pour construire le système d'informations
géographiques et l'établissement des inventaires d'exploitation.
De même les informations relatives à l'état d'exploitation
des ressources demeurent des sources précieuses pour le gestionnaire qui
en connaissance de causes peut décider de l'interdiction de la
protection ou de l'utilisation libre d'une espèce.
L'étude de la flore de la Réserve de
Biosphère de Luki apporte des informations utiles aux décideurs,
aux gestionnaires et aux communautés locales pour une gestion
concertée et durable des ressources forestières.
0.6.
Plan succinct du travail
Hormis l'introduction et la conclusion, le présent travail
s'articule autours de quatre chapitres :
- Le chapitre premier décrit le milieu où
l'étude a été effectuée ;
- Le second chapitre expose le matériel et les
méthodologies utilisés tant pour la collecte des données
sur le terrain que pour les analyses qui s'en étaient suivies ;
- Le troisième chapitre est consacré à
l'exposé des résultats obtenus ;
- Enfin le quatrième chapitre discute les résultats
obtenus entre eux et avec la littérature.
PREMIER
CHAPITRE : GENERALITES ET PRESENTATION DE LA RESERVE DE BIOSPHERE DE
LUKI
1.1.
Rappels des concepts clés
1.1.1. La diversité
La diversité floristique n'est qu'un des
aspects de la diversité biologique : sur plus de trois millions
d'espèces vivantes recensées, les végétaux n'en
représentent que moins de 20%. Il faut cependant rappeler que les
tropiques humides sont extrêmement riches en espèces
végétales, plus des deux tiers des espèces connues en sont
originaires. La flore africaine représente environ 20% des
espèces végétales tropicales actuellement recensées
(Whitmore, cité par Dupuy, 1998).
La richesse des communautés biologiques ou
biocénoses se fait à travers la quantification de plusieurs
paramètres caractéristiques qui sont : abondance,
fréquence, dominance, diversité, etc. La diversité est la
richesse d'une biocénose en espèces (
www.cons-dev.org) au moment de
l'observation.
D'après Spichiger et al. cité par
Lejoly (2008), la diversité biologique ou biodiversité est une
notion qui définit la diversité du vivant, en termes de
qualité et de quantité. La diversité
végétale est estimée à environ 250.000
espèces, c'est-à-dire le 1/6 de toutes celles
répertoriées dans les cinq règnes (Monères,
Protistes, Animaux, Végétaux et champignons). Cette
diversité a une histoire de quatre milliards d'années,
marquée aussi bien par des extinctions que par des apparitions ;
les groupes taxonomiques se sont succédé les uns aux autres, les
plantes à fleurs aux conifères et les Mammifères aux
grands Reptiles. Durant cette histoire, malgré les extinctions
naturelles, le taux de diversité n'a cessé d'augmenter. On estime
à 2 millions le nombre d'espèces probables contre seulement 1,5
millions décrites scientifiquement (Lejoly, 2007).
La diversité est considérée
à plusieurs niveaux :
- la diversité spécifique (taxonomique),
ou alpha-diversité, indique le nombre d'espèces, plus rarement de
genres ou de familles, recensées sur un territoire
donné ;
- la diversité écosystémique, ou
béta-diversité, exprime la variation entre les milieux ;
- la gamma-diversité mesure la diversité
totale dans un paysage constitué de plusieurs milieux différents.
C'est pourquoi les mosaïques de milieux différents ont des taux de
diversité très élevés ;
- la diversité endémique, exprime le
pourcentage d'espèces exclusives d'une région donnée.
- la diversité génétique exprime
la diversité des gènes à l'intérieur d'une
population et entre les populations.
D'après Gounot, cité par Mangambu
(2008), la diversité biologique est un critère clé dans
l'évaluation écologique des territoires. Du point de vue purement
phytogéographique, la diversité générique ou
spécifique contribue à rendre compte non seulement de la richesse
floristique d'une contrée, mais aussi du degré d'isolement ou de
connections avec d'autres territoires.
1.1.2. Types forestiers
Selon Lejoly, 2007, les plantes vivent ensemble en
formant des « groupements végétaux ». Ceux-ci
sont caractérisés par leur aspect qui est sous la
dépendance de l'action du climat, de la topographie, du sol, des
animaux, de l'homme (cultures, feux, récolte de produits divers, etc.),
et par leur composition qui dépend des mêmes facteurs et pour une
large part aussi de l'origine des plantes dans les temps anciens.
En zone intertropicale, deux principaux types de
forêts denses humides de plaine sont habituellement distingués en
fonction du régime et de l'intensité des
précipitations : les forêts denses humides sempervirentes et
les forêts denses semi décidues (Aubréville, Trochain,
Schnell, White, cités par Bernard, 1998). Ces deux types de forêts
se distinguent aussi par leur composition floristique et leur structure. Chaque
type des forêts présente une organisation caractéristique
commandée ou influencée par des paramètres
écologiques, floristiques et dynamiques.
1.1.3. Réserve de
Biosphère
Les Réserves de
Biosphère sont des aires protégées portant sur les
écosystèmes terrestres ou une combinaison
d'écosystèmes terrestres et côtiers / marins
représentatifs, dont la communauté internationale a reconnu
l'importance dans le cadre du programme de l'UNESCO sur l'homme et la
biosphère (UNESCO-MAB, 1996). L'ensemble de ces réserves
constitue un réseau mondial coordonné.
Le concept de
Réserve de Biosphère adopte une approche de zonage : des
aires centrales strictement protégées sont entourées par
des zones tampon où les populations vivent et travaillent ;
l'ensemble est encerclé par une aire de transition destinée
à promouvoir le développement durable, Koïchiro, Matsuura
(2007).
C'est la combinaison de
ces trois zones qui permet l'expérimentation, tout en promouvant la
conservation de la faune sauvage et l'utilisation durable de la
biodiversité grâce à l'écotourisme, des
éco-industries ou l'agriculture organique. De même, on peut
expérimenter l'intégration des connaissances scientifiques et
traditionnelles dans des régimes de gestion, afin de promouvoir le
développement durable adapté au contexte local.
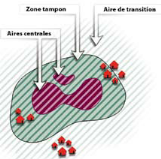
Figure1 :
Schéma classique d'une Réserve de biosphère (Source :
Science en Afrique, 2007, UNESCO).
Dans cette perspective,
les réserves de la biosphère, en tant que notion et en tant
qu'instrument, ont un rôle précieux à jouer (Di Castri et
Loope, 1997 ; UNESCO, 1984). Leur philosophie et leurs
caractéristiques sont proches, en effet, de ce que l'on appelle
aujourd'hui les « projets de conservation et de
développement intégrés » (Brown et
Wyckoff-Baird, 1992).
Les Réserves de la
Biosphère constituent un nouveau type de la zone protégée
qui doit son existence au Programme de l'UNESCO sur l'homme et la
biosphère (MAB). Elles datent du début des années 70.
Comme le nom du programme l'indique, l'objectif était de trouver un
moyen de concilier la protection de la nature et la satisfaction des besoins
humains, et d'appuyer le tout sur la coopération scientifique
internationale.
Les Réserves de la
Biosphère sont donc, avant tout, une entreprise pragmatique et
scientifique. Lorsqu'elles fonctionnent correctement, elles remplissent trois
rôles principaux :
i) conservation in
situ de la diversité des écosystèmes et des paysages
naturels et semi-naturels ;
ii) création de zones de
démonstration d'utilisation écologiquement durable des terres et
des ressources ;
iii) fourniture d'un appui
logistique à la recherche, au suivi, à l'enseignement et à
la formation en matière de conservation et de durabilité.
Ces fonctions sont
associées grâce à un système de zonage consistant en
une ou plusieurs zones centrales, où l'ingérence humaine est
minimale, puis une zone concentrique qui sert de tampon et accueille davantage
d'activités humaines, comme la recherche, l'éducation à
l'environnement et la formation, ainsi que des activités de tourisme et
de loisirs.
La zone de transition vers
l'extérieur sert de lien avec le reste de la région dans laquelle
se trouve la réserve de la biosphère et permet de promouvoir
notamment des activités de développement, par exemple la
recherche expérimentale, l'utilisation traditionnelle ou la
modernisation, les établissements humains, l'agriculture. La gestion de
cette zone exige par conséquent des mécanismes de coordination
novateurs.
En conclusion
« les réserves de la biosphère » sont
à la fois un concept et un instrument qui visent à associer la
protection de la biodiversité avec un développement durable et
une meilleure connaissance du fonctionnement des systèmes
écologiques et de leurs utilisations potentielles. Les deux principaux
défis qu'il a fallu relever pour mettre en pratique ce concept ont
consisté, d'une part, à mettre à profit les
résultats des recherches scientifiques pour élaborer des projets
d'amélioration et de diversification économiques.
1.2.
Milieu d'étude
1.2.1. Historique et localisation
de la Réserve de Biosphère de luki
La Réserve de Biosphère de Luki a
été créée par ordonnance coloniale du Gouverneur
Général n° 05/Agri du 12 janvier 1937 comme réserve
forestière de la RDC, Congo belge.
Sa mission consistait à l'exploitation
forestière avec la sylviculture, c'est-à-dire, concilier la coupe
des bois d'oeuvre avec la gestion durable des écosystèmes.
Au début, cette réserve constituait un domaine
boisé de l'Etat dont la gestion était confiée à
l'Institut National pour l'Etude Agronomique du Congo (INEAC). Ainsi, l'INEAC
institua une exploitation méthodique qui visait essentiellement la
connaissance de la dynamique forestière et l'identification des normes
permettant une sylviculture tropicale rentable dans les conditions
écologiques locales (Donis, 1948a).
En 1960, après l'accession du pays à
l'indépendance ; la gestion était transférée
à l'Institut National pour l'Etude et la Recherche Agronomiques (INERA)
ayant comme missions fondamentales :
- la création des parcelles expérimentales
appelées «blocs » pour besoin d'inventaires, de
relevés pédo-botanique et d'études
forestières ;
- l'élaboration des méthodes de conversions des
futaies afin d'accroitre la valeur marchande de la forêt (Kapa et
al. 1987). Conformément à l'ordonnance n°77-022 du 23
février 1977 la gestion de ce domaine boisé fut retirée de
l'INERA et concédée au Ministère de l'Environnement,
Conservation de la Nature et Tourisme par le canal du comité national
MAB Congo, sous le projet MAB Luki.
En Mai 1979, l'UNESCO intégra ce domaine dans le
réseau mondial des Réserves de Biosphère. De 1980 à
2006, la gestion de la Réserve de Luki, assurée par le MAB, a
été caractérisée par l'instabilité
d'animateurs et l'exploitation forestière dans les blocs de recherche,
l'installation des postes de contrôle, l'installation des cultivateurs
par un système de fiche qui a eu comme conséquence
l'intensification du sciage, de l'agriculture sur brûlis, de la
carbonisation et du braconnage. Actuellement la gestion est assurée par
un comité local de pilotage installé le 12 janvier 2007. Ce
comité est composé de six membres :
- L'INERA à la présidence ;
- Le MAB à la vice-présidence ;
- Un membre représentant les bailleurs de fonds
(WWF) ;
- Un membre représentant les ONGD intervenant dans la
réserve (GRAED) ;
- Un membre représentant les chefs traditionnels.
Le comité de pilotage a pour objectif la gestion de la
réserve qui se présente comme suit :
1. La conservation
2. La recherche
3. Le développement des populations riveraines,
cependant à l'heure actuelle, les activités se limitent à
la conservation.
4. La surveillance assurée par une Brigade de 13
Eco gardes équipée et payée par le WWF. Ce nombre est
très insuffisant pour une réserve d'une superficie de 32.714
ha.
Actuellement, la station de l'INERA a
bénéficié d'un financement du Projet de Relance de la
Recherche Agricole et Forestière en République
Démocratique du Congo en sigle « REAFOR ». Ce projet
financé par l'Union Européenne et géré par la Fao,
a pour objectif de relancer la recherche agricole et forestière pour
répondre, par transfert de technologie, aux besoins urgents des
utilisateurs en phase de démarrage économique à Luki,
comme un des sites.
Il y réalise les activités principales
suivantes : bilan des expérimentations, dynamique des forêts
naturelles, interactions populations-Forêts, plantations et
Agroforesterie, réhabilitation des infrastructures. INERA travail en
synergie avec d'autres partenaires tels que le MAB, le WWF, l'ERAIFT et le
Musée Royale pour l'Afrique centrale en sigle
« MRAC » pour échange des résultats de
recherches menées sur le terrain (communication personnelle, 2009)
1.2.2.
Situation géographique de la Réserve de Biosphère de
Luki
D'après Nsenga
(2001), la réserve de biosphère de Luki se situe à l'ouest
de la R.D.C, plus exactement au sud-est du Mayombe Congolais (R.D.C), dans la
Province du Bas-Congo, à 120 km environ à l'est de la côte
de l'Atlantique et à 30 km au nord de la ville portuaire de Boma. Elle
s'étend entre 5°35' et 5°43' de latitude Sud, et entre
13°07' et 13°15' de longitude Est ; l'altitude varie entre 151
et plus de 500m. Elle est l'une de trois Réserves de biosphère
de la République Démocratique du Congo. Elle s'étend aux
confins de trois territoires administratifs suivants:
- Le secteur Patu dans le
territoire de Lukula, où se trouve la grande partie de la
réserve, notamment le nord-ouest, l'ouest, le sud-ouest et l'aire
centrale;
- Le secteur Bundi dans le
territoire de Seke-Banza, où se localisent la partie septentrionale et
le nord de la réserve;
- Le secteur Boma-Bundi
dans le territoire de Muanda, où s'étendent l'est et le sud-est
de la réserve.
Cette aire couvre une superficie de 32.714 ha et
occupe tout le bassin hydrographique de la Luki, sous-affluent du fleuve Congo,
au sud-est de la forêt guinéenne du Mayombe congolais.
Sa position d'intersection dans ces trois territoires
en fait la convoitise des populations des territoires précités et
constitue un handicap sérieux à sa bonne gestion. Au sud-est,
elle est traversée par la route nationale Matadi-Boma. La route
Boma-Tshela longe la limite ouest à une distance d'environs 1 km. Une
grande partie de l'axe routier Lovo (Materne)-Kinzao-Mvuete, traverse la
Réserve et est le passage obligé des véhicules. Cela
explique en partie la croissance rapide des villages situés sur cette
route. Il est à signaler aussi que beaucoup d'exploitants clandestins de
la Réserve habitent dans ces villages.
Enfin, depuis une dizaine d'années, la
Réserve fait l'objet d'incursions villageoises
répétées qui compromettent son avenir.
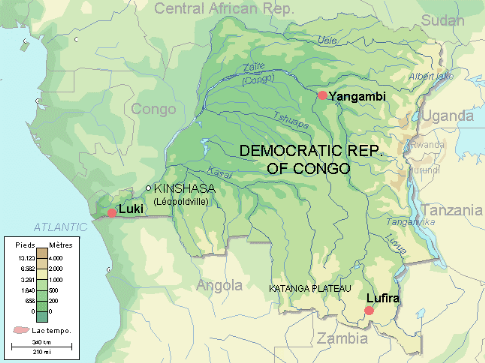
Figure
2 : Localisation de la Réserve de Biosphère de Luki sur la
carte de la R.D.C (WWF, 2009)
Figure 3 : Carte de la
Réserve de Biosphère de Luki (WWF, 2009)
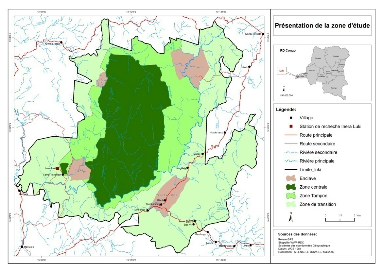
Cette Réserve
considérée comme étant aire protégée, fut
organisée en 3 zones classiques ; à savoir : une aire
centrale (11.931 ha), à protection intégrale, une zone tampon
(20.783 ha), dans laquelle se situent les enclaves villageoises, la station
INERA/MAB et les sites d'interventions forestières (blocs UB et UH), et
une zone de transition où sont exercées les activités des
paysans riverains et de certaines sociétés d'exploitation
forestière ou agricole (AGRIYUMBE, AGRIFOR, SOFORMA, etc.).
La zone tampon,
destinée à la recherche expérimentale et à la mise
au point des méthodes de gestion pouvant garantir la durabilité
des ressources naturelles et la protection de l'aire centrale, est aujourd'hui
victime d'une pression anthropique qui la voue à la dégradation.
Elle est l'objet des activités incompatibles aux normes premières
des aires protégée, Toirambe (2005).
1.2.3.
Caractéristiques biophysiques
1.2.3.1. Ecoclimat de Luki
Dans la Réserve de Biosphère de Luki, il
règne un écoclimat particulier du type tropical humide Aw4 de la
classification de Köppen, caractérisé par une forte
influence de la mer qui se traduit par de fréquents changements de temps
au cours de la journée.
Les données météorologiques de la station
de Luki pour la période de 2000 à 2008 (tableau1) montrent que
l'année est divisée en deux grandes saisons, l'une pluvieuse
s'étalant entre la deuxième moitié d'octobre et la
première moitié de mai, l'autre sèche, couvrant la
période comprise entre la seconde moitié de mai et la
première moitié d'octobre. La saison des pluies est
entrecoupée entre décembre et janvier par une courte
période de sécheresse relative, du reste peu marquée. La
saison sèche dure quatre mois et se caractérise par une baisse
légère de température et de fréquents brouillards
matinaux ou brumes, qui compensent le déficit en eau du sol. Ces
brouillards ou brumes sont considérés comme les
précipitations occultes. Nous présentons cette situation sur le
tableau 1 suivant :
Tableau 1 : Moyennes
mensuelles de précipitations (PPm en mm), de températures (Tm en
°C) et de l'humidité relative de la région de Luki
(source : Station climatologique de Luki, 2009).
|
Mois
|
J
|
F
|
M
|
A
|
M
|
J
|
J
|
A
|
S
|
O
|
N
|
D
|
|
P (mm)
|
155,5
|
159,3
|
132,7
|
142,5
|
52,4
|
5,1
|
1,8
|
4,1
|
16,3
|
87,1
|
211,3
|
235,5
|
|
T° (°C)
|
25,5
|
21,7
|
25,6
|
26,4
|
24,8
|
22,7
|
21,6
|
21,8
|
23,1
|
24,9
|
25,8
|
24,5
|
|
HR (%)
|
74,5
|
74,5
|
70,7
|
73,3
|
75,5
|
73,2
|
72,8
|
70,6
|
71
|
70,3
|
68,7
|
75,2
|
Légende :
P (mm) : Précipitation moyenne annuelle
exprimée en mm
T° (°C) : Température moyenne annuelle
exprimée en degré Celsius
HR : Humidité relative exprimée en
pourcentage
Il se dégage de l'observation de ce tableau les faits
suivants :
- L'abaissement des températures pendant les mois de
saison sèche (juin, juillet, août et septembre). La haute
humidité relative (75,5%), créée par le voisinage de
l'océan atlantique, atténue la rigueur du climat en maintenant un
déficit de saturation relativement bas pendant ladite saison
sèche. Les fréquents brouillards, occasionnés par le
courant océanique (courant marin froid de Benguela), tombent dans la
région, souvent sous forme de brume.
- Les précipitations se répartissent presque
anormalement d'octobre à mai avec un total annuel de 1341,7 mm, leur
irrégularité se justifie par l'influence du courant marin de
Benguela qui confère un caractère maritime accru à la
région ; les précipitations sont faibles pendant la saison
sèche et atteignent leur maximum en avril et en novembre. Les mois les
plus pluvieux sont ceux de novembre, décembre, janvier, février,
mars et avril.
- L'humidité relative de l'air reste
élevée durant toute l'année. Les vents sont très
importants et violents surtout dans les après midi. Dans la
Réserve de Biosphère de Luki les précipitations moyennes
annuelles sont irrégulières et avoisinent 1237mm.
En bref, en regardant le diagramme ombrothermique, les mois de
janvier, novembre et décembre sont les plus pluvieux et les mois de
février, avril et octobre sont les moins pluvieux. Tandis que les mois
de mai, juin, juillet, août et septembre ont reçu très peu
ou presque pas des pluies.
Comme on peut le constater, les précipitations sont
inférieures à la limite du seuil (1400mm) de développement
d'une forêt ombrophile semi-sempervirente ou semi-caducifoliée.
Mais les conditions écoclimatiques de la réserve de
biosphère de Luki permettent le développement de ce type de
forêt qui, par rapport à son aire géographique et sur le
plan synecologique ne s'explique pas. Quoiqu'il en soit, le
phénomène de compensation par les brouillards épais (ou
brumes) y est pour beaucoup dans la correction du déficit des
précipitations (Lubini, 1997.).
1.2.4.
La physiographie
1.2.4.1. Le relief
La Réserve de Biosphère de Luki fait partie de
la chaîne du Mayombe qui s'étend parallèlement à la
côte atlantique sur une distance de 1000 km (Vicat & al. cité
par Lubini, 1997) et borde du nord au sud les côtes gabonaise,
congolaise, angolaise (cabinda) et république Démocratique du
Congo (R.D.C).
Dans sa partie Congo Démocratique, la chaîne du
Mayombe est constituée d'une série de collines qui
s'élèvent progressivement en direction Nord-est, depuis les
plateaux littoraux jusqu'aux limites ouest de la chaîne des monts de
cristal. Dans les limites de la Réserve, ces collines constituent des
crêtes particulièrement inaccessibles dans l'entre Luki-Ntosi et
dont l'altitude absolue varie entre 150 et plus de 500 m (Donis 1948, Lubini,
1997), tandis que les dénivellations relatives (entre les fond des
vallées et les sommets des collines environnantes) sont de l'ordre de 40
à 70 m. Les pentes atteignent les valeurs de 10 à 50% ; les
vallées, très encaissées, sont fréquemment
sèches.
1.2.4.2. Géologie et
géomorphologie
La géologie de la chaîne de Mayombe a
été étudiée par des nombreux chercheurs belges et
portugais. Une abondante littérature existe sur la stratigraphie, la
tectonique et la géochronologie. A ce qui nous concerne, on se limitera
seulement à la composition des principales séries
géologiques, à la géochronologie et à la
géotectonique de cette chaîne montagneuse.
Selon Cahen, cité par Lubini, 1997, la structure
géologique de la partie congolaise (R.D.C) du Mayombe comprend quatre
étages, dont le plus récent est l'étage ouest-congolien.
La composition géologique de cet étage comprend plusieurs
séries reconnues pour l'ensemble de la chaîne du Mayombe (Diniz,
Vellutini & al., Cahen cités par Lubini, 1997). Les
systèmes sont schisto-gréseux et schisto-calcaire. Donc, la
structure géologique du Mayombe se caractérise par quatre
étages du plus récent au plus ancien. Il s'agit de :
- étage de Duizi (principalement schistes
satinés) ;
- étage de Tshela (principalement roches graphiteuses
et grès feldspathiques) ;
- étage de Matadi (principalement quartzites) ;
- étage de Palabala (principalement micaschistes et
gneiss), Lubini (1997).
Dans la Réserve de Biosphère de Luki, on observe
des schistes, quartzites, roches graphiteuses, grès feldspathiques, des
micaschistes, muscovites, amphiboloschistes et des roches intrusives. Ces
diverses roches ont permis la formation des divers types de sols qu'on
rencontre dans la Réserve.
D'après Lubini (1997), des nombreuses
tentatives de datation de l'âge de la chaîne du Mayombe ont
été faites ; les estimations varient largement : Vicat
& Gioan (1989) citent des chiffres de 234,514 et 609 millions
d'années suivant les auteurs et les méthodes de datation.
Les travaux de géotectoniques réalisés en
R.D.C et au Congo admettent l'existence de deux événements
orogéniques principaux, qu'on situe entre 2000 millions d'années
et 600 millions d'années. En R.D.C, De Paepe & al. et
Lepersonne, cités par Lubini, 1997 estiment que la chaîne du
Mayombe s'est édifiée dans un contexte tectonique
d'intérieur de plaque. Au Congo, Vellutini & al. (1983)
considèrent qu'elle résulte de la fermeture d'un bassin
océanique étroit qui séparait le craton de chaillu (Congo)
et les cratons de l'Angola et du Kasaï. Par la suite, ce bassin de
sédimentation aurait été plissé et une nouvelle
orogenèse aurait achevé la structure actuelle de la
chaîne.
1.5.3. Hydrographie
L'ensemble de l'écosystème Luki appartient
entièrement au bassin hydrographique de la rivière Luki, affluent
de la Lukula, elle-même affluent du fleuve Congo. Elle traverse toute la
Réserve du Nord-Est au Sud-Ouest en décrivant une grande courbe.
Les principaux tributaires de droite de la Luki sont la
Ntosi, principal affluent, avec des nombreux ruisseaux tributaires dont la
Yombolo et la Nkula, la Nkakala, la Kikolokolo, la Bondu, la Mambamba et la
Loba. Les affluents de gauche de la Luki sont la Kikulo, la Mabakosa, la Tadi,
la Monzi, la Likamba et la Nioka. Tous ces cours d'eau forment un réseau
complexe. Certains ont un caractère torrentiel et saisonnier, Lubini
(1997).
La rivière Luki et l'ensemble de son bassin se situent
entre 12 53'et 13 17'E et 5 46'S, ayant une superficie d'environ 756 km².
Cette rivière d'importance moyenne est alimentée par un
réseau secondaire très dense situé en contrebas des
plateaux, ses zones des sources se situent à une altitude de 500 m. Elle
coule en direction Est-Sud-Ouest et se jette dans la Lukunga après un
parcours de 68 km. Sa pente moyenne est de l'ordre de 0,65%. Elle traverse
successivement des schistes satinés, des quartzites micacés, des
gneiss et des grès sublittoraux.
Son lit est garni, selon le niveau considéré, de
roches, de cailloux, de graviers, de sables et de limons. Elle bordée de
plantes herbacées, d'arbustes et de grands arbres. Par l'ombre qu'elle
crée, cette végétation limite la croissance des
végétaux aquatiques. Inversement, les grains de pollen, les
feuilles mortes immergées ainsi que les fruits jouent un rôle
important en tant que source de nourriture pour bon nombre d'espèces de
poissons et d'invertébrés.
Ces apports constituent également leurs biotopes
électifs. Ses eaux et celles de ses principaux affluents se situent dans
les classes 2 et 4, caractéristiques des eaux peu productives ou
à productivité moyenne. Cette situation résulte de la
nature des roches et de celle du sol qu'elles traversent ainsi que de la
qualité des produits issus de la décomposition de la
litière et de l'humus.
Les caractéristiques générales du
régime hydrologique, de ces écosystèmes aquatiques
dépendent des facteurs climatiques et l'importance du régime du
fleuve Congo qui, lors de la période des crues, empêche
l'écoulement de ses affluents et sous-affluents et crée ainsi un
courant à contre-sens (Mutambue, 1984).
1.2.4.4. Sols
D'après les considérations
pédogéniques, on peut reconnaître dans la Réserve
les quatre groupes de sols suivants :
- les sols jaunes, les plus répandus et
développés sur les gneiss et les quartzites. Ils occupent la
majeure partie de la crête centrale Luki-Ntosi et presque tout l'Est et
le Nord-Est de la Réserve ;
- les sols rouges, peu étendus et
développés sur les gneiss. Ils se rencontrent dans l'Est et dans
la zone centrale ;
- les sols rouges violacés, développés
sur les amphibolites. Ils occupent également de faibles superficies et
se localisent dans les vallées de la Ntosi ainsi que sur les collines de
l'axe de la route Boma-Matadi ;
- les alluvions récentes se rencontrent dans les bas de
pente. Elles sont peu profondes et superficiels. On observe des cailloux
roulés et du quartz.
Selon la physiographie du terrain, tous ces sols occupent
divers sites lithologiques, à savoir : sols de sommets de colline
avec un profil autochtone (complexe éluvial) ; les sols de pentes
montrant un profil remanié (complexe colluvionnaire) avec apport
d'éléments du sommet par l'érosion et les sols de
vallée constitués sur des alluvions (sols alluvionnaires) peu
étendus.
D'une façon générale et sur base de la
texture, Lubini (1997) distingue :
- les sols avec un taux d'argile (0-20um) de 1 à 5% et
une fraction sableuse de 95% ;
- les sols ayant un taux d'argile compris entre 5 et 10% et
une fraction sableuse variant entre 88 et 90% ;
- les sols contenant 10 à 26% d'argile et 74 à
89% de sable.
Les principales caractéristiques chimiques de ces sols
sont l'acidité élevée, le taux de matière organique
de 3,3 à 12,61% dans l'horizon humifère et le rapport C/N
supérieur à 10 (variant entre 10,59 et 17,36).
Au Mayombe Congolais, Misset cité par Lubini (1997),
distingue cinq unités pédologiques principales : sols sur
alluvions récentes et anciennes, sols ferralitiques sur divers types
géomorphologiques : collines, pentes, bas de pente. Au Mayombe
Angolais (Cabinda), Lubini (op.cit) reconnait, sur base de climat tropical
humide et tropical subhumide, deux unités principales de sols :
sols ferralitiques et sols paraferralitiques. Sur base de la notion de catena
des sols et de différents types de forêts, des échantillons
de sols ont été prélevés et analysés au
point de vue physique et chimique. Les résultats obtenus constituent
l'essentiel des caractéristiques édaphiques de chaque type de
forêt étudié.
1.2.4.5.
Végétation et flore
La végétation de la Réserve de
Biosphère de Luki est très hétérogène et
diversifiée. Elle va des formations herbeuses aux forêts denses
humides de type semi-sempervirent en passant par des formations
édaphiques sur les sols hydromorphes. Elle regorge une diversité
spécifique qui varie entre 205 et 373 espèces par hectare, avec
une moyenne de 287 espèces (Lubini, 1997).
Les travaux de Lubini, op.cit montrent que la flore de la
réserve compte environ 1096 espèces dominées
essentiellement des plantes à fleurs (1055 angiospermes), parmi
lesquelles on note approximativement 153 monocotylédones, 902
dicotylédones
1.2.4.6. Faune
Les études de Pendje et Baya (1992) révelent que
la Réserve de Biosphère de Luki a une faune diversifiée
dont les classes des poissons, des mammifères, des oiseaux et des
reptiles sont plus exploitées. L'étude de Gata (1997) prouve
à suffisance que la faune ichtyologique qui, autrefois était
riche, est aujourd'hui en péril.
Selon les auteurs précités, la faune mammalienne
compte au total 38 espèces dont huit espèces de rongeurs,
excepté les Muridae (rats) parmi lesquels Cricetomy emini
(Cricetomes de forêt), Thryonomys swinderianus (grand aulacode),
Atherurus africacanus (Athérure), six chiroptères, un
hyracoïde (Dendrohyrax arboreus), deux Pholidotes, des Pangolins
(Manis spp et Uromanis tetradactyla), sept artiodactyles dont
Cephaloohus spp (Cephalophes), Tragelophus spekei et
T.scriptus, Potamochoerus porcus (Potamochère), sept carnivores
(Genatta spp, Civetticus civetta, Nandinia binotata, Mangouste, etc.)
et six primates (Perodictus potto, Galago demidovi et Cercopithecus spp,
etc.).
Les résultats de ces mêmes travaux ont mis en
évidence l'existence de certaines espèces d'oiseaux appartenant
aux familles de Psittacidae (Psitacus erithacus et Poicephalus
gulielmi), de Bucerotidae (Ceratogymna atrata, grand Galao), de
Mosophagidae (Corythoeola cristata) et de Phasianidae (Gallus
gallus et Numida meleagis). Parmi les espèces de poissons
décrits par Mutambwe (1992), certaines familles importantes ont
été dénombrées dans la Luki et Ntosi notamment
Cyprinidae (Barbus holotaenia, B. chrystyi, Garra ornata, Opsaridium
chrystyi, etc), Claridae (Clarias sp) et Cichlidae
(Oreochromis niloticus), etc.
La faune herpétologique compte plusieurs espèces
dont python reguis, Bitis gabonica et B.nasicornis, Varanus exanthematicus
et Kinixys spp. Gata (1997) souligne que l'inventaire de cette faune est
encore incomplet. Certains groupes d'animaux comme les
invertébrés, les reptiles, les amphibiens et les oiseaux
nécessitent des études approfondies.
1.2.5.
Techniques sylvicoles réalisées
A sa création, l'INEAC organisa une gestion
méthodique qui était basée sur le zonage et sur les
considérations à la fois sylvicoles et agricoles de la
réserve forestière. Les considérations sylvo-ager
aboutirent à l'élaboration des méthodes de conversion de
futaie dites « Uniformisation par le bas » et
« Uniformisation par le haut ». Le travail de Donis (1951)
a été la première étude réalisée sur
la sylviculture du Mayombe référence à la Réserve
forestière de Luki.
1.2.5.1. Uniformisation par le
haut (UH)
La méthode d'uniformisation par le haut, en sigle UH
vise d'abord à la conversion de futaies d'arbres d'âges multiples,
répartis par groupes ou pieds d'arbres, en une futaie tendant vers la
régularité en vue d'en améliorer les conditions de
productivité et d'exploitation (Donis & al. 1951). Elle
repose sur l'identification du potentiel d'avenir le mieux
représenté (brins, baliveaux, moyens). Ensuite, une
éclaircie est réalisée au profit de ce peuplement d'avenir
par régulation de la structure et réduction des écarts
d'âges. Les espèces secondaires, une fois identifiées,
sont éliminées lorsqu'elles sont un obstacle à la
croissance des espèces commerciales. L'éclaircie est
accompagnée d'un délianage systématique. Cette
intervention entraîne une modification de la composition floristique et
de la structure dans le sens de simplification au sein d'une parcelle. La
sélectivité des interventions peut, en outre, corriger la
composition floristique et favoriser certaines essences. En principe
l'uniformisation par le haut a pour objectif de créer la situation
suivante :
- une absence de gros bois, sauf en ce qui concerne les
espèces commerciales ;
- la présence de bois moyens d'âges
divers ;
- l'uniformisation de la lumière destinée
à favoriser les régénérations existantes et
nouvelles. Cette méthode avait concerné sept blocs dans la zone
tampon couvrant une superficie moyenne estimée à 225 hectares
chacun.
1.2.5.2. Uniformisation par le bas
(UB)
L'uniformisation par le bas était
développée dans les concessions octroyées aux paysans ou
fermiers considérés comme locataires dans un système de
métayage. Cette méthode fut pratiquée dans la zone tampon
qui couvre 14 blocs d'une superficie moyenne de 1631 hectares. La
méthode utilisée a consistée à faire une coupe
à blanc étoc de la forêt en vue d'effectuer des plantations
de limba (terminalia superba) par des techniques sylvo-agricoles. Elle
fut exécutée en 1950 (Toirambe, 2001).
En ce qui le concerne l'INEAC signa de 1949 à 1955 des
conventions avec des privés pour des blocs sylvo-bananier à Monzi
(bloc 1 à 8). Ainsi furent appliquées les techniques
agroforestières de types sylvo-bananier, sylvo-cacaoyer et
sylvo-caféier qui visaient à planter des essences
forestières dans les bananeraies et plantations de cacao et de
café.
Les essences forestières utilisées
étaient selon l'importance, terminalia superba (limba),
Milicia excelsa (Kambala), Entandrophragma angolense (Tiama),
Entandrophragma utile (Sipo), Nauclea diderrichii (Bilinga),
etc. (N'landu, 1999).
1.2.5.3. Enrichissements
Les enrichissements sont des méthodes extensives qui
s'adressent à des peuplements appauvris en essences commerciales, mais
dont le couvert est continu. Elles sont assimilables à une conversion.
Les peuplements concernés ne sont pas justifiables par des techniques
d'amélioration des forêts naturelles, eu égard à
leur pauvreté en essences commerciales préexistantes (Foury,
1956 ; Catinot, 1965). L'enrichissement consiste donc à
compléter le capital d'essences commerciales préexistantes par
complantation avec des espèces commerciales. Pour donner des
résultats escomptés, il doit porter sur un nombre
d'espèces commerciales préalablement identifiées (Alba,
1953).
Dans la Réserve de Biosphère de Luki,
l'enrichissement consistait à l'ouverture des layons et des placeaux.
Par des layons, on procédait au nettoyage complet du sol sur 2m de
largeur, à l'abattage de la strate arbustive sur une largeur de 10m dans
l'étage de 15 à 25m et à l'annélation des arbres
à couvert épais dont la cime vient surplomber le layon. La
méthode des placeaux servait à ouvrir totalement une superficie
donnée de la forêt et à planter les essences de valeur.
C'est le cas avec Pericopsis elata (Afromosia).
1.2.5.4.
Régénération naturelle
Elle permettait à choisir un semencier en dessous
duquel se fait un nettoyage. La dissémination par ptérochorie a
été installée au pied et à quelques mètres
de l'arbre- mère des individus qui vont se développer pour former
un peuplement équien, c'est-à-dire un peuplement de même
âge (Maudoux, 1954). Cette expérience a été
pratiquée au bloc 10 avec le Prioria balsamifera (Tola) et les
résultats ont été très satisfaisants.
1.2.5.5. Installation des
arboreta
L'installation des arboreta dans la réserve de
biosphère de Luki est réalisée dans le cadre de
l'aménagement forestier. En se référant au code forestier
de la RDC (2002), il ressort que l'aménagement forestier
détermine l'ensemble des opérations visant à
définir les mesures d'ordre technique, économique, juridique et
administratif de gestion des forêts en vue de les pérenniser et
d'en tirer le maximum de profit.
En guise de constat, il y a une interaction entre les arboreta
et les Réserves de Biosphère dans la mesure où ils
concourent tous à offrir des régions propices aux chercheurs sur
l'écologie, la botanique, l'environnement, le climat et à
permettre les activités éducatives. Nous tenons à
préciser les arboreta sont assimilables aux petites aires centrales de
la Réserve de Biosphère du fait de leur statut de protection, de
la conservation de la diversité biologique et dans la mesure où
ils servent d'outils de recherche.
1.2.6.
Activités humaines et leur impact sur la Réserve
La Réserve de Biosphère de Luki subit une forte
pression qui menace son intégrité. De par sa situation
géographique située au carrefour de deux routes très
importantes (Matadi-Boma et Boma-Tshela), la réserve connaît une
intense circulation de biens et de personnes. Malheureusement, cette position
exerce sur elle, une influence négative en favorisant son exploitation
abusive (Pendje & Mbaya, 1992, cité par Nsenga, 2001).
L'exploitation traditionnelle (ramassage de produits
forestiers, cultures, chasse, pêche) aussi bien qu'industrielle
(exploitation forestière) du milieu ont fortement entamé
l'intégrité de la Réserve. En conséquence des
impacts sur plusieurs types de facteurs mésologiques, floristiques et
fauniques sont observés (Projet MAB Luki, 1991, cité par Nsenga,
2001).
La croissance démographique a comme effets notamment
l'augmentation de la pression exercée sur la forêt et les
ressources naturelles en vue de la satisfaction des besoins en produits
vivriers de première nécessité et en énergie
domestique. Pour s'en convaincre 21 villages illicites, dans et autour de la
Réserve ont été érigés (Nsenga, 2001). La
diversité biologique de la Réserve est réellement en
péril. La menace qui pèse sur la phyto et la zoodiversité
de l'écosystème forestier du Mayombe se manifeste par ces
différents impacts humains.
En effet, la population locale revendique son droit foncier.
Les chefs coutumiers, les chefs des secteurs-administratifs locaux et les
autorités juridiques refusent de collaborer avec les gestionnaires. Ces
derniers accusent ceux-là d'être complices de la population au
sujet de la pression que subit la réserve depuis des années. Le
statut juridique ambigu de la Réserve et le bicéphalisme de sa
gestion, dû à la présence de deux gestionnaires ; MAB
et INERA se révèlent nuisibles à un aménagement
efficace.
1.2.6.1. La population
La création de la Réserve en 1937 avait
occasionné le regroupement des populations locales en quatre enclaves
villageoises (Tsumba-Kituti au Sud de la Réserve ; Kisavua au
Nord-Est ; Kimbuya au Nord-Ouest et Kiobo à l'est) auxquelles
s'ajoutent la station et le camp de travailleurs l'INERA et de MAB
situés à l'Ouest de la Réserve. La Réserve
étant devenue domaine de l'Etat, celui-ci a donné une
étendue de terre aux populations de chacune de ces enclaves afin de
couvrir leurs besoins en habitation, en agriculture vivrière et en
autres activités de subsistance.
Actuellement, avec l'explosion démographique, ces
populations sont devenues très denses et inégalement
réparties. Elles sont estimées à 5.224 habitants avec une
densité de 16 habitants au km². Elles sont en général
plus élevées dans l'enclave de Tsumba-Kituti suivie de celle de
Kisavua (Toirambe, 2001).
Hormis ces enclaves, la réserve est prise en
étau par trois axes routiers d'intérêt secondaire. Ceux-ci
traversent la zone tampon et ont favorisé l'implantation de nombreux
villages et centres ruraux. Les habitants de ces villages jouent un rôle
important dans la pression dont la réserve est victime. Ces axes
routiers sont :
- l'axe routier Kinzau-Mvuete - Lemba (Kinsundi) qui traverse
la Réserve au Nord et comprend 14 villages abritant une population de
2.131 habitants ;
- l'axe routier Manterne (Lovo)-Kinzau-Mvuete qui traverse la
Réserve au Sud, et compte 26 villages avec une population de 35.745
habitants ;
- l'axe routier Manterne (Lovo)-Patu qui longe la
réserve à l'Ouest et regroupent 13 villages avec une population
de 26.109 habitants.
Les autres routes secondaires situées à
l'intérieur de la Réserve desservent trois camps de planteurs et
sept villages avec une population totale de 2.311 habitants. Selon Isungu
(2003), la population totale vivant dans et autour de la Réserve
était de 71.520 habitants en 2000 alors qu'elle était
estimée à 50.873 habitants en 1996. Ce taux d'accroissement de
l'ordre de 6,8% se justifie par l'exode des populations venant de
l'intérieur du Mayombe (Tshela, Tshanga-nord, Maduda,...etc), et qui,
dépourvues des terres fertiles, sont à la recherche d'emplois
dans les centre urbains.
Par ailleurs, signalons que les essences animales et
végétales de la Réserve sont sauvagement exploitées
par les communautés environnantes. Les coupeurs de bois envahissent
très souvent ses concessions pour y chercher des espèces les plus
précieuses pour la fabrication de braise ou encore les grumes. Outre
les populations résidents, il faut compter aussi la présence de
la population dite flottante, car elle ne vient que pour exploiter
momentanément la Réserve et repartir. Si cette tendance se
maintiendrait, on peut être sûr que dans les dix prochaines
années, la Réserve n'existerait que de nom. D'où la
nécessité de surveiller, dans le cadre de l'aménagement
intégré du territoire, les mouvements migratoires des
populations et de trouver des solutions durables à ce problème.
Car la même tendance démographique s'observe également dans
les villages et centres ruraux, environnants la Réserve de
Biosphère de Luki.
1.2.6.2. Impact des
activités humaines sur la réserve
Selon Nsenga (2001), les activités humaines
méritent une attention particulière du fait de leurs impacts sur
la Réserve. Ces activités sont du type traditionnel ou
moderne. Les activités de type traditionnel englobent
l'agriculture itinérante, la cueillette, la chasse et la pêche qui
sont pratiquées par les populations locales. De même, le petit
élevage des caprins, porcins et ovins ainsi que de la volaille est
très répandu dans les villages et les enclaves.
Les cultures vivrières concernent : le manioc, les
bananes, le taro, le haricot, le maïs, l'arachide, les ignames, les
agrumes, les safoutiers, les mangues, etc. Elles sont cultivées dans
tous les villages de la réserve et constituent la base de l'alimentation
des populations. Les travaux de mise en culture commencent par le
défrichement, suivi de l'abattage des arbres pendant la saison
sèche. Par contre, dans les villages réguliers
(de métayers), la culture commence par le défrichement du
sous-bois et à l'abattage des petits arbres. Sans brûler, le
cultivateur installe les cultures (bananier, taro, etc.) et fait
l'agrosylviculture. Ces activités englobent aussi bien le ramassage des
produits de la forêt, la coupe du bois de chauffage que la production de
charbon de bois (carbonisation). Ce sont, donc là les activités
auxquelles les paysans s'adonnent surtout ceux des villages situés le
long des axes routiers Boma - Matadi et Boma - Tshela. Les
intéressés ravitaillent particulièrement les villes de
Boma et de Matadi en combustibles ligneux. Quant aux femmes, elles font la
cueillette des "Mfumbwa", des champignons. La chasse et la pêche
sont pratiquées dans toute la réserve malgré la
présence de quelques gardes forestiers.
La chasse est faite à l'arme de fabrication locale et
à l'aide de pièges surtout par les populations des villages
anarchiques. Les espèces les plus chassées sont les antilopes, le
pangolin, le sanglier, le porc-épic, l'aulacode, etc. Les produits de la
chasse sont vendus le long de la route Matadi - Boma aux voyageurs et aux
commerçants à des prix variables.
Actuellement, quatorze points de ventes de gibier se situent
aux abords immédiats de la réserve, principalement le long du
tronçon routier Kinzao - Mvuete - Materne. Une véritable
économie cynégétique s'est développée aux
alentours de la réserve. Toute la réserve sert d'aire de chasse,
y compris l'aire centrale, considérée comme le dernier refuge des
animaux.
La pêche est pratiquée dans les rivières
Luki et Ntosi qui, par le passé, avaient fait l'objet des
empoisonnements. Toutefois, il convient de noter l'activité de la
pêche a été réduite en raison du faible
développement du réseau hydrographique de la réserve.
S'agissant du bois de la forêt, il est utilisé
pour les besoins de la construction, quand bien même son usage amoindri
à la suite de l'adoption des nouvelles techniques : maisons en
briques adobes, en mortiers, etc. Cependant, on note une forte utilisation de
bois dans la construction des enclos, des poulaillers, etc. ainsi que dans la
fabrication du mobilier, etc. Trois activités du type moderne sont
à distinguer, à savoir : les activités des planteurs
agricoles ; celles des exploitants forestiers et des scieurs de long. Dans
ce contexte, signalons que l'INERA possède plusieurs ha de plantations
de café et de cacao dans les blocs 5, 4 et 10. De leur
côté, les planteurs font des plantations industrielles de
café, de cacao et de bananes suivant des techniques sylvo-agricoles. Le
limba est la seule essence qui a fait l'objet d'un effort de sylviculture.
Les exploitants forestiers ont leurs installations en dehors
de la Réserve. Cependant, quand ils viennent, c'est pour y
prélever la matière première à l'aide de leur
machinerie lourde. L'exploitation est sélective et se limite
essentiellement à la récolte des essences précieuses. Les
scieurs de long, clandestins, sont de plus en plus nombreux et cette
activité est très développée. Les
intéressés coupent même dans la zone centrale malgré
l'interdiction des autorités de l'INERA et du MAB. On peut noter, en
passant, que c'est davantage cette catégorie d'exploitants qui est en
conflits, devant la justice, avec les autorités du MAB.
En résumé, dans la Réserve de
Biosphère de Luki, les populations s'adonnent à l'agriculture
itinérante et l'exploitation forestière a un impact
négatif sur la Réserve. Ces effets pervers s'observe notamment,
par la réduction lente mais progressive de la forêt, le gaspillage
des terres défrichées et brûlées mais non
cultivées et l'usage fréquent des feux qui provoque souvent des
incendies ayant comme conséquences majeures :
- la suppression de la litière et par
conséquence la perte de la fertilité des sols ;
- l'appauvrissement de la flore ;
- l'accélération de l'érosion sur les
sols de pente ;
- l'apparition des espèces savanicoles en certains
endroits de forêt.
La faune sauvage riche et diversifiée dans la
région est soumise à un braconnage excessif avec des
méthodes de prélèvement non sélectives (armes
à feu, pièges etc.). Ce braconnage provoque la raréfaction
et/ou la disparition des certaines espèces animales dont la demande en
viandes de la part des habitants des villes de Boma, Matadi, Moanda,
Kinzau-Mvuete et Kinshasa est sans cesse croissante.
La faune aquatique est fortement menacée d'extinction
suite à l'usage des produits ichtyotoxiques. Quant à la
production des combustibles ligneux (bois de feu et charbon), elle est aussi
responsable de la destruction de forêts par les populations. De
même, l'usage fréquent de la tronçonneuse lors des coupes
de bois pour répondre aux besoins de l'industrie constitue une menace
grave pour cet écosystème forestier à vocation mondiale.
Selon Gata, cité par Isungu (2003), l'exploitation
forestière illicite et légale en bois d'oeuvre a permis le
prélèvement de 22.654,9 m de bois de 1994 à 1997. Cette
exploitation est à la base de la destruction du sous-bois, de la
raréfaction de certaines essences forestières comme
Chrysophylllum lacourtiana, Milicia excelsa (Ex : Chlorophora
excelsa) etc. et de la disparition de quelques espèces animales.
Comme pour le reste des rivières tropicales, la Luki et l'ensemble de
ses affluents sont bordés selon le niveau considéré,
d'arbres, d'arbustes et de plantes herbeuses.
Les observations faites lors de différentes campagnes
ont révèle que cette végétation joue un rôle
sans précédant dans le fonctionnement global de ces divers
écosystèmes et intervient directement et/ou indirectement par le
truchement des invertébrés, des algues ou de la physico-chimie
des eaux, sur la vie des poissons. Cependant, fait remarquer Mutambue, (1991),
la déforestation a des effets négatifs sur la qualité des
eaux et la vie des poissons.
Au plan de la déforestation et des milieux physiques,
il sied de noter que l'absence de la végétation perturbe le bon
fonctionnement de la rivière à plusieurs égards :
l'augmentation de la turbidité pendant la saison des pluies et de la
température pendant la saison sèche, la destruction d'habitants
des différentes biocénoses, l'augmentation du débit, la
réduction des apports ioniques, etc.
S'agissant de la déforestation et la
végétation allochtone, il est important de signaler que l'absence
de la végétation n'est pas favorable au développement de
la végétation allochtone qui 1'utilise comme support et comme
abri.
La déforestation et les invertébrés : A
ce sujet, l'absence des apports organiques (litière, débris
végétaux) qui constituent la source importante de nourriture pour
les différents taxons d'invertébrés ainsi que l'absence
des souches et des troncs d'arbres tombés qui répresentent leurs
supports ne sont pas favorables à leur développement.
La déforestation et les poissons : l'absence de la
végétation ripicole malgré sa triple fonction :
1) assure l'apport important d'invertébrés qui
sert d'alimentation à bon nombre d'espèces piscicoles ;
2) sert d'abris dans le cadre de l'équilibre
prédateur-proie ;
3) sert de supports pour les espèces qui pondent
essentiellement sur les herbes et est défavorable au
développement de l'ichtyofaune.
RESUME
DU PREMIER CHAPITRE
Selon Lubini (1997), la flore de la Réserve de
Biosphère de Luki est fondamentalement guinéo-congolaise et est
caractérisée par la présence d'un certain nombre
d'espèces propres du Mayombe dont elle fait partie. La
dégradation des forêts matures, conséquence des
activités humaines, a favorisé l'altération de cette flore
guinéo-congolaise ; cela se manifeste par la présence de
nombreuses espèces à très large distribution et
d'espèces africaines plurirégionales. Cette flore se
révèle riche et variée.
La chaîne du Mayombe est du type appalachien. Elle est
constituée de roches métamorphiques précambriennes. Le
relief actuel serait dû à un rajeunissement lié à la
série de mouvements de surrection qui aurait débuté au
crétacé. La présence des intrusions des roches
éruptives, granite.
L'hydrographie de la Réserve de Biosphère de
Luki est dominée par la rivière Luki, sous affluent du fleuve
Congo et son principal affluent, la Ntosi. Sur ces deux rivières
s'articule tout un réseau hydrographique complexe et à
caractère torrentiel et souvent saisonnier.
Les sols de la réserve résultent d'une longue
pédogenèse. Ils sont développés sur des schistes,
amphiboloschistes, quartzites et gneiss. Quatre principaux types basés
sur la nature de la roche-mère peuvent être
distingués : les sols rouges violacés
développés sur les amphibolites, les sols rouges formés
sur les gneiss, les sols jaunes développés sur les gneiss et
enfin les sols alluvionnaires récents. La fraction argileuse de ces sols
varie entre 1 et 26%. L'acidité est élevée.
Les précipitations de la Réserve de
Biosphère de Luki ne dépassent pas 1300 mm, ce sont des
précipitations occultes qui récompensent ces déficits.
Pour parler d'une forêt ombrophile semi-sempervirente, il faut que la
précipitation dépasse 1400 mm par année. Le sol de Luki a
un pourcentage élevé de l'argile, et permet la rétention
de l'eau pendant la saison sèche à un long moment.
DEUXIEME CHAPITRE : METHODOLOGIE
Le deuxième chapitre est consacré au
matériel (matériel biologique et équipement des terrains)
et aux méthodologies utilisés tant pour la collecte et les
analyses des données sur le terrain et au laboratoire, dont les
échantillons de sol ont été prélevé, ceux-ci
ont été acheminés au laboratoire de pédologie de la
faculté des sciences à l'Université de Kinshasa pour les
analyses y appropriés.
2.1.
Matériel
2.1.1. Matériel
biologique
Le matériel biologique est constitué des plantes
(ligneuses) dont des échantillons ont été
récoltés pour constituer des spécimens d'herbier et
faciliter l'identification des espèces. Ce matériel a subi le
traitement normal d'un herbier, c'est-à-dire séchage à la
chaleur libre, étiquetage et identification au laboratoire. Pour la
cartographie du site, des prélèvements numériques ont
été faits à l'aide du GPS. Nous avons aussi
prélevé les échantillons de sol à l'aide d'une
tarière, qui ont été l'objet des analyses physiques et
chimiques.
2.1.2. Equipement sur le
terrain
Divers instruments ont été
utilisés :
- une boussole de marque SYLVA SYSTEM TYPE 7NL pour la
direction et l'orientation des layons ;
- un GPS GPSMAP 60CSx de marque GARMIN pour l'orientation et
la prise des coordonnées géographiques ;
- une ficelle de 20,60 m pour délimiter les
placettes ;
- deux sécateurs pour prélever les
spécimens d'espèces ;
- une machette pour le déblayage de layons. Il est fait
de façon à ne pas perturber la structure de la
végétation ou à détruire certaines
espèces ;
- des fiches de collectes des données sur le terrain.
Elles permettaient de noter les différentes variables mesurées ou
observées ;
- des papiers journaux et des presses pour la
préparation des échantillons botaniques des herbiers ;
- cinq jalons pour la délimitation des
placettes ;
- des mètres rubans pour les différentes mesures
nécessaires ;
- un appareil photo numérique ;
- un clinomètre SUUNTO pour mesurer les pentes en
degré ;
- un pentadécamètre pour les mesures des layons
et la délimitation des aires d'inventaires ;
- un fil nylon de 50 m pour la délimitation des
placeaux ;
- un séchoir pour le séchage de matériel
botanique (herbier).
2.2.
Méthodes
En vue d'atteindre les objectifs fixés, notre
étude a été réalisée en deux
étapes : sur le terrain, et au laboratoire.
2.2.1. Phases analytiques sur le
terrain
Les études sur le terrain ont consisté en la
récolte de matériel botanique, en des relevés
phytosociologiques, en des mensurations des diamètres à la
hauteur de la poitrine (dhp) ainsi qu'en des prélèvements des
coordonnées géographiques et des échantillons de sol.
2.2.1.1. Inventaire proprement
dit
Tous les arbres dont le dhp (diamètre à la
hauteur de la poitrine) à 1,30 m de hauteur = 10 cm ont
été inventoriés. Le dhp a été mesuré
pour chaque arbre à l'aide d'un mètre ruban. Cette hauteur
était respectée en utilisant un bâton de 1,30 m de
hauteur.
Etant donné que des problèmes de mesure de dhp
se posent assez régulièrement en forêt dense humide lorsque
les arbres présentent des accotements ailés, des racines
contreforts et échasses, les mesures étaient faites au-dessus de
ces différents malformations comme prévue par la
méthodologie pour les inventaires forestiers.
Les études sur le terrain ont consisté : au
choix du site localisé au Nord-est de la Réserve, à
environ 2 km du village Mbondo qui se justifie du faite que les forêts
sont plus perturbées et menacées, nécessitant une
étude prioritaire pour connaître la biodiversité ou les
espèces que renferme ce site afin de prendre une décision de
conservation et de faire le monitoring ;
La moyenne des coordonnées géographiques de
chaque toposéquence (Crêtes, Pentes et dépressions) est
présentée au tableau 2 pour la localisation des sites
étudiés.
Tableau 2 : Moyenne
des coordonnées géographiques.
|
Complexes
|
Latitude
|
Longitude
|
Altitude (m)
|
|
Crête 1
|
S5 34.624
|
E13 11.591
|
319
|
|
Crête 2
|
S5 34.794
|
E13 11.585
|
335,5
|
|
Crête 3
|
S5 34.569
|
E13 11.959
|
324,25
|
|
Pente 1
|
S5 34.554
|
E13 11.836
|
277,75
|
|
Pente 2
|
S5 34.776
|
E13 11.628
|
339,5
|
|
Pente 3
|
S5 34.901
|
E13 11.805
|
283,25
|
|
Dépression 1
|
S5 34.603
|
E13 11.809
|
260,5
|
|
Dépression 2
|
S5 34.644
|
E13 11.960
|
285
|
|
Dépression 3
|
S5 34.799
|
E13 11.534
|
356
|
Ce tableau nous donne la moyenne des coordonnées
géographiques de chaque complexe, le détail est donné
à l'annexe 2, tableau 6.
Les coordonnées géographiques (altitude,
latitude et longitude) enregistrées par le GPS ont été
remises à un chercheur REAFOR pour des fins de cartographie.
Nous présentons à travers le dispositif
expérimental les sites étudiés.
Légende :
C : Crête (1, 2, 3)
P : Pente (1, 2, 3)
D : Dépression (1, 2, 3)
3
P
Site 4
D
3
3
C
Site 3
Rivière Kweta
2
D
2
P
Site 2
1
D
1
2
DISPOSITIF EXPERIMENTAL
1
N
C
P
Campement
Site 1
2.1.1.2. Identification des
arbres
Pour la reconnaissance des arbres, nous avons
été confrontés à des difficultés
d'identification d'arbres sur terrain. C'est pourquoi la combinaison des
caractères végétatifs suivants, était notée
sur le terrain :
- la forme générale du tronc à la base
(cylindre, avec contreforts ou échasses) ;
- texture de l'écorce (fibreuse, granuleuse) ;
- couleur de l'entaille (ocre, rouge, brune,
jaune,....) ;
- le goût de l'écorce ;
- odeur ;
- exsudation (latex jaune, orange, blanc,
résine,...) ;
- type de feuilles et forme ;
- ramification de l'arbre, le fût et le port.
Plusieurs ouvrages nous ont aussi aidés à
l'identification des espèces ligneuses, notamment : Aubin (1963),
Robyns (1958), Tailfer (1989), Wilks et al. (2000), Pauwels (1993),
Poorter et al. (2004). Le catalogue informatisé de Lejoly &
al. nous a aidés pour la correction des noms scientifiques. Les
espèces ligneuses non identifiées ont été
ramenée aux Herbaria de l'INERA/Luki et de
l'INERA/Kinshasa/Faculté des sciences/UNIKIN pour leur comparaison avec
les spécimens qui y sont gardés. Mise en place d'un dispositif
permanent de 9 ha, dont une parcelle d'un hectare divisée en 4 sous
parcelles (placettes) de 50 m x 50 m de dimension chacune ; tous les coins
des placettes sont marqués par des jalons surmontés de rubans
indiquant les distances depuis la ligne de base.
 
Figure 4 et 5: Jalons
placés au coin des placettes un pointeur, un mesureur, un marqueur et
un identificateur
Le processus comprend la localisation (positionnement) de tous
les arbres avec un diamètre = 10 cm à hauteur de poitrine (dhp),
par rapport à x, y, puis mesurage, marquage et identification des
espèces. L'équipe composé de 5 personnes parcourent la
placette, en commençant par l'angle gauche de la ligne de base et
marchant suivant un mouvement circulaire dans les sens des aiguilles d'une
montre en vue de rencontrer systématiquement et d'enregistrer tous les
arbres de dimensions appropriées. Tous les arbres = 10 cm de
diamètre à la hauteur de poitrine (dhp) sont mesurés. Le
dhp est mesuré avec un ruban diamétrique à une hauteur
approximative de 1,30 m, évitant toutes saillies ou lianes poussant sur
le tronc. Les arbres avec racines échasses et contreforts sont
mesurés au plus bas point où le diamètre du bol peut
être mesuré avec précision sans l'influence des
protubérances additionnelles. Mesurer au dessus des contreforts et
racines échasses nécessite souvent un grimpeur
spécialisé.
 
Figure 6 et 7 : Un
grimpeur spécialisé un marquer et un pointeur
La mesure des arbres au dessus du point dhp est connue comme
diamètre à hauteur de référence (dhr). Les
conventions suivies pour ces mesures sont celles préconisées par
Dallmeier & al., cité par Henrottay (2000) et Terry (2005).
Le point de mesure est marqué d'un « x » avec
le bout pointu du ruban dhp. A ce point précis, à l'aide d'un
pinceau, on fait un marquage avec une peinture autour de l'arbre. Cette marque
assure que les futures mesures des mêmes arbres soient prises exactement
au même point.
Dans chaque parcelle d'un hectare, tous les arbres sont
numérotés, ces numéros commencent par un et continuent
jusqu'à ce que le dernier arbre soit marqué, positionné et
identifié. Chaque arbre ainsi inventorié est marqué d'un
numéro, selon la numérotation continue pour chaque
toposéquence (bas de pente, pente et crête). La hauteur de mesure
de la circonférence est matérialisée par un double trait
de peinture.
Pour chaque arbre inventorié, les paramètres
relevés sont donc :
- le nom de l'essence ;
- le numéro de la tige ;
- la circonférence au dbh, mesurée selon les
conventions habituelles appliquées en inventaire d'aménagement,
au millimètre près ;
- la positon de l'arbre dans la placette.

Figure
8 : Pied d'un Autranella congolensis
2.1.1.3. Positionnement et marquage des arbres
Le positionnement des arbres dans l'espace a un objectif
essentiel, dans un dispositif où l'on veut effectuer un suivi dans le
temps : donner les moyens de retrouver et d'identifier correctement ces
arbres d'un inventaire au suivant.
En effet, si pour diverses raisons le temps
écoulé entre deux inventaires successifs dépasse deux/
trois ans, une partie des numéros posés sur les arbres aura
disparu. La connaissance de l'espèce et de la taille de l'arbre lors du
précédent inventaire ne suffit généralement
pas : seules les coordonnées prélevées à
l'origine permettent de lever l'incertitude.
A mon avis, non seulement le positionnement initial est
indispensable mais il doit être effectué avec la plus grande
rigueur possible.
Les coordonnées des arbres permettent également
de caractériser leur mode de répartition spatiale :
agrégée à divers degrés, systématique,
aléatoire. Ces modes peuvent être mis en relation avec diverses
caractéristiques biologiques des espèces étudiées
et donner accès à une meilleure connaissance de leur
fonctionnement écologique, donc de leur degré de
résilience face aux perturbations.
2.1.1.4. Positionnement des arbres dans les parcelles
C'est l'opération la plus longue et la plus
délicate. Il faut s'appuyer sur un quadrillage intermédiaire qui
délimite des placeaux au sein desquels la position des arbres sera
déterminée : ce système permet de limiter la
propagation des erreurs. Le quadrillage intermédiaire doit s'appuyer sur
le quadrillage initial de maille 1 ha : il lui superpose une maille plus
petite, de 10 m × 10 m au minimum et de 20 m × 20 m au maximum :
la taille de la maille (donc des placeaux) dépend de la structure
forestière. En effet, tous les arbres doivent être visibles
à un observateur situé au centre du placeau ou, selon la
méthode de localisation retenue, à l'un de ses coins, Picard
& al. (2008).
Dans les forêts non perturbées à
canopée relativement fermée (comme c'est le cas en forêt
ombrophile sempervirente) et sous-bois peu dense, le regard porte plus loin que
dans les forêts mixtes semi-décidues, exploitées ou non.
Ces différences de structure conditionnent également la
matérialisation sur le terrain du quadrillage
intermédiaire : lorsque le sous-bois est peu dense, un simple
piquetage au coin des placeaux et un marquage provisoire au topofil suffisent,
Picard & al. (Op.cit.). Lorsque le sous -bois est très dense,
il est préférable d'ouvrir de véritable layons permanents,
même si cela perturbe un peu la régénération :
on gagne alors beaucoup de temps lors des inventaires ultérieurs du
peuplement.
Deux méthodes peuvent être utilisées pour
localiser les arbres au sein des placeaux :
1. La méthode classique, utilisant boussole et
décamètres ou chaînes d'arpenteur. Deux
décamètres sont positionnés au sol, en x et en y, le long
des layons intermédiaires. Une personne A se déplace au sein du
placeau et passe d'arbre en arbre. Deux personnes B et C se déplacent le
long de chaque décamètre, avec une boussole.
B (resp. C) vise l'arbre Ao désigné par A en se
déplaçant jusqu'à ce que la droite AoB (resp. AoC) soit
perpendiculaire à la direction du layon portant le
décamètre. La lecture du décamètre donne la valeur
x ou y relativement à l'origine du placeau. Cette méthode est
simple à mettre en oeuvre, fournit directement les coordonnées
cartésiennes des arbres, et assure que l'erreur de positionnement est
aléatoire.
2. La méthode par triangulation, utilisant un
télémètre laser. Cette méthode présente deux
variantes. Dans la première variante, une personne A circule au sein du
placeau et désigne successivement chaque arbre Ao. Une personne B se
place à l'un des coins du placeau et vise l'arbre Ao à l'aide
d'un télémètre : l'appareil lui fournit les
coordonnées polaires de l'arbre, c'est-à-dire son azimut et sa
distance au coin du placeau. Cette méthode est plus rapide que la
précédente, et demande moins de main d'oeuvre. Elle entraine
cependant une propagation des erreurs (les erreurs sont de plus en plus
importantes lorsque la distance à l'arbre visé augmente) et
nécessite que les placeaux restent de faible taille.
Elle demande en outre la mise en oeuvre d'un programme de
calcul des coordonnées cartésiennes. La deuxième variante
est décrite par Dallmeier (1992) et reprise par Sunderland et al.
(2004). Deux personnes B et C, situées à deux coins voisins du
placeau, visent l'arbre Ao à l'aide du télémètre et
relèvent les distances qui les séparent de l'arbre. Comme dans le
cas précédent, un programme de calcul doit être mis en
oeuvre pour récupérer les coordonnées cartésiennes
de l'arbre. Dans le cadre de ce travail, nous avons utilisé la
première méthode qui était facile et importante.
Marquage des arbres

Figure
9 : Marquage d'un Zanthoxylum gilletii
Les arbres suivis dans les parcelles ou le long des sentiers
doivent être identifiés de manière unique, à l'aide
d'un numéro. Pour faciliter les inventaires dans les parcelles et
limiter les risques de mauvaise compréhension entre les mesureurs et le
chef d'équipe (en charge de la notation ou de la saisie des
informations), il est conseillé de limiter autant que possible à
trois chiffres les numéros désignant chaque arbre sur le
terrain : il faut pour cela attribuer un numéro à chaque
parcelle, subdiviser la parcelle en carrés de 1 ha (ou proches de 1 ha),
numéroter les carrés du sud au nord et d'ouest en est.
Il faut ensuite attribuer à chaque arbre un
numéro relatif au carré dans lequel il se trouve, en
commençant par 1 dans chaque carré. Si les carrés ont une
superficie proche de l'hectare, l'effectif des arbres de plus de 10 cm dbh ne
devrait pas dépasser 999 lors du premier inventaire. L'attribution des
numéros se fait lors de virées alternativement nord/ sud et sud/
nord, prenant les placeaux en enfilade : cette logique est utile par la
suite, pour se repérer dans les carrés. Toujours selon cette
logique, les coordonnées cartésiennes des arbres initialement
attribuées relativement aux placeaux, doivent être
recalculées au bureau dans un repère dont l'origine est
située au coin sud-ouest du carré 1, confondu avec l'origine de
la parcelle, Picard & al (2008).
Il existe essentiellement deux techniques de
matérialisation, sur le tronc, du numéro attribué à
chaque arbre :
1. Étiquettes métalliques ou en plastique
pré-imprimées et fixées au tronc par des clous,
2. Peinture au pochoir.
Du point de vu usage, la première technique
présente deux inconvénients majeurs :
- Si les clous sont trop gros, ils provoquent des
déformations parfois importantes du tronc, tandis que s'ils sont trop
petits, ils tombent ou sont rapidement « avalés »
par le tronc des espèces à croissance rapide.
- Lorsque la forêt est fréquentée par les
villageois, étiquettes et clous ont tendance à
disparaître.
Dans le cadre de notre travail, la pose de numéros
à la peinture et au pochoir nous paraît être la technique la
moins traumatisante et la plus durable. Selon Picard & al. (2008),
il convient cependant de prendre quelques précautions :
· Ne pas trop diluer la peinture afin qu'elle
résiste davantage et usage de peintures acycliques, peu sensibles au
lessivage. A défaut, les peintures à l'huile sont
préférables aux peintures à l'eau (Sheil, cité par
Picard & al. 2008) et il est également possible (application
plus rapide mais solution plus coûteuse) d'utiliser des bombes
aérosol. Les couleurs jaune, rouge et bleue sont à
privilégier ;
· Brosser le tronc avant de poser le numéro, afin
de le débarrasser de toutes les particules qui pourraient
entraîner la peinture ;
· Repasser sur les arbres tous les deux ans, afin de
contrôler et rafraîchir les numéros si nécessaire. En
effet certaines espèces ont des troncs qui desquament beaucoup et sur
lesquels les marques à la peinture disparaissent vite ;
· Effacer la vieille marque de peinture avant d'en poser
une nouvelle, afin de ne pas provoquer de confusion dans la lecture des
numéros
2.1.1.5. Marques du niveau de mesure
La méthode la plus répandue et qui nous
paraît la plus efficace, consiste à indiquer, à l'aide d'un
trait de peinture, l'emplacement exact où le mètre-ruban doit
être positionné sur le tronc : perpendiculairement à
l'axe du tronc et généralement à 1,30 m de hauteur
(hauteur de référence) à partir du pied de l'arbre.
Certaines personnes utilisent un double trait de peinture, ou, lorsqu'elles ont
recours aux étiquettes, ne matérialisent pas le trait : lors
de l'inventaire le ruban de mesure est, par convention, positionné juste
au-dessus ou juste au-dessous de l'étiquette. Cette dernière
pratique est dangereuse, car aucun repère ne subsiste lorsque
l'étiquette disparait.
Outre la présence de figuiers étrangleurs, cinq
types de problèmes peuvent être rencontrés à la
hauteur de référence :
1. L'arbre est fourchu, et la fourche démarre en
dessous de 1,30 m : dans ce cas, les traits de peinture sont posés
à 1,30 m sur chaque brin issu de la fourche et deux numéro
consécutifs leur sont attribués (les coordonnées des deux
brins seront les mêmes).
2. L'arbre est fourchu et la fourche se trouve proche de la
hauteur de référence : dans ce cas, le trait de peinture
doit être décalé vers le bas, si possible dans la limite de
50 cm, sur le tronc principal.
3. L'arbre présente une déformation locale du
tronc (genou, loupe, blessure ou bourrelet cicatriciel consécutif
à une blessure : dans ce cas, le trait de peinture doit être
remonté jusqu'à trouver une zone cylindrique
dégagée de l'influence de la déformation. Il est
préférable de descendre le trait de mesure, dans une limite de 50
cm, plutôt que de le remonter de plus de 50 cm.
4. L'arbre présente des racines-échasses ou
contreforts. Ces deux structures peuvent se développer sur le tronc
jusqu'à 4 ou 5 m de hauteur et même davantage en ce qui concerne
les contreforts. Selon Alder & Synnott, cités par Picard &
al. (2008), les consignes habituelles sont de poser le trait de peinture
au-dessus des racines ou des contreforts, à une hauteur variant entre 50
cm et 1,50 m. cela conduit inévitablement à remonter le trait, au
fur et à mesure du développement des structures. Par ailleurs,
les racines et contreforts étant à des stades de
développement différents sur les arbres mesurés, la
hauteur de référence perd son sens et cela pose problème
en particulier pour les calculs de surface terrière.
5. L'arbre n'est pas cylindrique, et la déformation
touche tout le tronc (ou s'étend au-delà de 4,50 m) : dans
ce cas, il faut poser le trait de mesure à hauteur de
référence et il est inutile de le déplacer par la suite.
À noter que si des lianes et des plantes grimpantes sont
présentes à l'endroit où l'on doit poser le trait de
mesure, il vaut mieux essayer de les écarter du tronc que de les couper
systématiquement. La même remarque s'applique pour les mesures
ultérieures de circonférence.
2.2.2. Relevés
phytosociologiques
Après avoir identifié et
caractérisé des diverses toposéquences, les travaux sur le
terrain qui constituent la phase analytique, se sont focalisés sur les
relevés phytosociologiques selon la méthode sigmatiste de
Braun-Blanquet (1932). Celle-ci a été choisie dans le souci de
caractériser cette végétation sur base des critères
floristiques purs et physionomiques, mais aussi sur la base des
considérations écologiques. Le choix porté sur cette
méthode est justifié par sa rigueur dans la description et la
compréhension de la végétation dans une prospective
à la fois phytoécologique, phytogéographique et
d'aménagement (Gilbert et al. cité par Habyaremye, 1997).
En plus, elle garantit également la connaissance fine de la
végétation (Devred et Dero, cités par Belesi, 2009).
D'où son usage accru dans l'évaluation botanique des territoires.
En effet, les travaux phytosociologiques ont donné une impulsion
à l'aménagement des territoires (Lebrun, Ozenda, cité par
Belesi, 2009).
Par ailleurs, nous disons qu'un relevé
phytosociologique est une mesure qualitative et semi-quantitative d'une
communauté végétale localisée dans le temps et dans
l'espace (Decocq, De Foucault et al. cité par Belesi, 2009). Les
relevés ont été effectués dans les sites de
végétation homogènes à toposéquences
différentes (facilement discernables) au sein de ces phytocénoses
et ce, afin d'obtenir un échantillonnage représentatif de
l'ensemble des formations végétales de ce territoire. Le maximum
de relevés est effectué dans chaque type forestier ou groupement
végétal selon les prescriptions du Code International de
nomenclature en phytosociologie (Greuter & al cité par
Belesi, 2009) dans le respect du principe de la structuration verticale et des
variations spatiales (étendue du territoire sous l'étude) et en
mettant en évidence les tendances diachroniques et synchroniques de la
végétation fondamentale pour la compréhension de la
dynamique de la végétation.
2.2.2.1. Surfaces des
relevés phytosociologiques et aires minimales
De nombreux travaux phytosociologiques réalisés
sur l'ensemble de l'Afrique tropicale, particulièrement dans l'ex-Congo
belge ont mis en évidence des superficies minimales pour
différents types de végétation. Fort de ces informations,
nous avons adopté la superficie standard admise pour les
différents types de végétation. Selon Frontier et
al. cité par Belesi (2009), il est très difficile
d'apprécier avec certitude l'aire minimale pour les formations
végétales forestières de l'Afrique tropicale. Leur flore
étant riche et diversifiée présente des structures
mosaïques et hétérogènes avec parfois des reliefs
accidentés :
- 10 - 25 m² pour les relevés des champs,
plantations et milieu rudéral;
- 25 à 100 m² pour les formations herbeuses
(Decocq, 2001) et jachères herbeuses et
- 225-625 m² pour les relevés des jachères
et recrus forestiers, forêts secondaires jeunes et forêts
édaphiques liées aux sols hydromorphes.
- 625 m² et plus pour les forêts denses
sempervirentes et semi-caducifoliées de terre ferme.
Mais à ce qui concerne notre étude, pour chaque
placeau ou parcelle d'un hectare, nous l'avons subdivisé en 4 placettes
de 50 m x 50 m chacune. Des perturbations d'origine naturelle ou humaine et
l'exposition des placeaux de pente qui n'étaient pas orientés
à l'est par rapport au vent venant de l'océan nous ont contrait
de ne pas mettre notre dispositif permanent sur un même endroit comme
prévu, c'est-à-dire installer tous les 9 ha sur un même
site. Ce dispositif a été installé d'une façon
inégale, dont le site1 (S1) avec 4 ha répartis comme suit :
Placeau de crête1 (C1) d'1 ha subdivisé en 4 placettes ou
quadrants de 50 m x 50 m chacune, placeau de crête2 () d'1 ha
subdivisé aussi en 4 placettes de 50 m x 50 m chacune, placeau de pente1
(P1) d'1 ha réparti en 4 quadrants de 50 m x 50 m chacune et placeau de
dépression1 (D1) d'1 ha réparti également en 4 placettes
de 50 m x 50 m chacune ; le site2 (S2) avec 2 ha tout près de
campement répartis comme suit : placeau de dépression2 (D2)
d'1 ha subdivisé en 4 placettes de 50 m x 50 m chacune, placeau de
pente2 (P2) d'1 ha subdivisé aussi en 4 placettes de 50 m x 50 m
chacune ; le site3 (S3) avec 2 ha répartis aussi comme suit :
placeau de crête3 (C3) d'1 ha subdivisé en 4 placettes de 50 m x
50 m chacune, placeau de dépression3 (D3) d'1 ha réparti en 4
placettes de 50 m x 50 m chacune et le site4 (S4) avec seulement un placeau de
pente3 (P3) d'1 ha réparti en 4 placettes de 50 m x 50 m chacune. Pour
chaque relevé, une liste exhaustive des taxons des Spermatophytes a
été établie sur terrain.
2.2.3. Etude du spectre
écologique
Pour caractériser la végétation
forestière du site de travail, nous avons faitndes observations sur les
caractéristiques liés aux types morphologiques (T M), aux types
biologiques (T B), aux types de diaspores (T D), au comportement des feuilles
(C F), aux groupes ou distributions phytogéographiques (D Ph) et aux
statuts phytosociologiques de l'ensemble de la forêt de Nord-Est de la
Réserve de Biosphère de Luki.
2.2.3.1. Types
morphologiques (T M)
Le type morphologique (ou forme biologique) est
généralement employé par plusieurs phytogéographes
pour expliquer l'organisation physionomique et écologique de la
végétation d'un territoire ou d'une région biologiques
constituent des dispositions adaptatives par lesquelles les
végétaux manifestent leur appropriation au milieu où ils
se développent a souligné Lebrun (1947), tandis que Evrard
(1968) a défini les formes biologiques comme étant une aptitude
à occuper les différentes synusies de la phytocénose
plutôt qu'un mode de protection durant une saison défavorable
où le cycle végétatif est réduit de façon
minime.
Les spectres morphologiques des espèces
recensées sur terrain ont été déterminés sur
le terrain et leur vérification a été
réalisée à l'aide de catalogue informatisé de
Lejoly & al. (1988).
Les types morphologiques recensés sont les
suivants :
a) Les plantes ligneuses :
- Arbre (A) ; espèce à tige ligneuse
identifiable par leur grande taille et par la présence de bourgeons
axillaires qui s'élèvent de plusieurs mètres.
- Arbuste (Arb) ; espèce à tige ligneuse
identifiable généralement par leur petite taille
généralement et surtout par l'absence de bourgeons axillaires
s'élevant de quelques mètres et se ramifient à leur
base.
- Sous arbuste (S-arb.) ; espèce
végétale qui se fait reconnaître par une tige ligneuse
à sa base elle est dure et persistante avec des ramifications qui
meurent et se renouvellent chaque année.
- Liane (L) ; plante terrestre pourvue de très
longues tiges qui s'appuyent sur d'autres plantes en vue d'élever son
feuillage et ses fleurs à un niveau favorable à son
développement.
b) Les plantes herbacées :
- Herbe annuelle (H an) ; espèce non ligneuse
vivant seulement pendant la période végétative.
- Herbe vivace (H vi) ; espèce non ligneuse vivant
pendant plusieurs périodes végétatives.
Notre travail s'est intéressé aux plantes
ligneuses suivantes : arbre et arbuste.
2.2.3.2. Types
biologiques
Le type biologique d'une espèce désigne
l'ensemble des dispositifs anatomiques et morphologiques qui
caractérisent son appareil végétatif et singularisent son
port et sa physionomie (Lebrun, 1960).
Selon Mandango (1982), le vocable type biologique s'applique
exclusivement aux catégories biologiques du système de Raunkiaer
(1905) basé sur la nature et le degré de protection des bourgeons
et de jeunes pousses durant la période rigoureuse.
Pour les types ou formes biologiques, nous nous sommes
référé à la classification de Raunkiaer, 1934, tel
que repris par plusieurs auteurs (Lebrun, 1960 ; Schnell, 1971 ;
Lubini, 1982 ; Mandango, 1982 ; Lejoly & al. 1988 ;
Lubini, 2001). Ainsi, nous avons reconnu les types biologiques suivants :
a. Les phanérophytes : Ce sont
des plantes ligneuses dont les bourgeons persistants sont situés
à une distance notable sur des axes aériens ayant une persistance
plus ou moins longue. Les phanérophytes sont constitués
de :
- Mégaphanérophytes (Mgph) :
Arbres dont les organes tendres sont situés au dessus du 30 cm
du sol
- Mésophanérophytes (Msph) :
Arbres à organes situés entre 10 - 30 cm au dessus du
sol.
- Microphanérophytes (Mcph) :
Arbustes dont les bourgeons sont situés entre 4 - 10 cm du
sol.
- Nanophanérophytes (Nph) : Sous
arbustes dont les jeunes pousses sont à une hauteur comprise entre 0,4 -
4 cm.
- Phanérophytes grimpants (Phgr) :
Lianes pouvant atteindre une hauteur considérable et se hissant
au sommet des arbres au moyen de divers modes de fixation.
b. Géophytes : Ce sont des
plantes possédant un appareil caulinaire caduc dont les bourgeons se
trouvent dans le sol. Nous y trouvons :
- Géophytes rhizomateux (Grh) :
Plantes ayant des organes pérennants des rhizomes.
- Géophytes tubéreux (Gtu) :
Plantes qui ont des organes pérennants des tubercules.
c. Chaméphytes : Ce sont des plantes
qui possèdent un appareil végétatif nain, inférieur
à 40 cm avec des bourgeons persistants protégés par des
débris de plantes. On y reconnaît :
- Chaméphytes érigés
(Cher) : Plantes à tige non ramifiée et toujours
dressée.
- Chaméphytes prostrés ou rampants
(Chpr) : Plantes à tige généralement
ramifiée et presque couchée au sol.
d. Thérophytes : Ce sont des
plantes annuelles qui passent la mauvaise saison sous forme des graines. On y
rencontre :
- Thérophytes grimpants ou dressés
(Tgr) : Plantes avec organe végétatif aérien
formé par une tige dressé.
- Thérophytes prostrés (Tpr) :
Plantes formant des touffes radicales ou axiales très
denses.
- Thérophytes scapeux (Tsc) :
Plantes avec organe végétatif aérien
appelé chaume.
Dans notre étude, nous avons pris compte seulement des
phanérophytes dont les mégaphanérophytes, les
mésophanérophytes, etc, car l'inventaire était fait sur
les strates arborescente et arbustive.
2.2.3.3. Types de
diaspores
La dissémination des diaspores joue un rôle
essentiel dans la dynamique forestière (Forget, 1988). A propos de types
de diaspores, nous avons recouru à la classification morphologique tel
que proposé par Lebrun (1960), Mandango (1982) et Schnell (1971).
Les catégories suivantes ont été
reconnues :
a. Plantes autochores : Ces plantes
assurent elles mêmes la dispersion de leurs graines ; une dispersion
à très faible distance, généralement sous le pied
de l'arbre.
- Les sclérochores (Scl) :
Diaspores non charnues relativement légères et
transportables sur des grandes distances.
- Les ballochores (Bal) : Diaspores
expulsées par la plante elle-même suite aux mouvements dus
à l'alternance de pression de sécheresse et d'humidité.
- les barochores (Bar): Diaspores non
charnues mais lourdes tombant au pied de la plante mère sous l'effet de
la pesanteur. La régénération se fait sur place. Les
explications de ces types de diaspores sont définis dans les travaux de
ces auteurs (Mpia 2002, Lebrun 1960, Mandango 1982 et Schnell 1971) que l'on
peut consulter.
b. Plantes hétérochores :
La dispersion de leurs graines est assurée soit par le vent
(anémochorie), soit par les animaux (zoochorie) ou soit par l'eau
(hydrochorie).
- Desmochores (Desmo) : Diaspores avec
appendices barbelées (zoochores) ou diaspores accrochantes ou
adhésives ;
- Pogonochores (Pogo) : Diaspores
à appendices plumeux ou à aigrettes (anémochores) avec une
légère touffe des poils ;
- Les ptérochores (Pter) :
Diaspores munies d'appendices aliformes ou ailés
(anémochores) disséminés sur de distances
réduites.
- les sarcochores (Sar): Diaspores à
pulpe tendre et charnue, totalement ou partiellement cheminées
(anémochores, hydrochores et zoochores).
2.2.3.4. Comportement des
feuilles
Le comportement du feuillage est une caractéristique
écologique qui permet de caractériser un type de forêt en
fonction de l'adaptation à l'écoclimat local. C'est pourquoi nous
l'avons pris en compte dans notre étude. Les résultats sur cet
aspect proviennent des observations directes sur terrain compléter par
les données de la littérature disponible.
2.2.3.5. Les groupes ou
distributions phytogéographiques
Selon Nshimba (2008), à la surface de la terre, tous
les taxons et toutes les formes de vie ne sont pas uniformément
répartis : certains ont une très grande extension
géographique, d'autres sont beaucoup plus localisés. En
étudiant leur répartition, il est possible de faire
apparaître des types de distributions parfois très spectaculaires.
Les plus anciennes cartes de répartition d'espèces
végétales connues datent de 1823. Elles sont dues au
Phytogéographe danois J.F. Schouw. Quelques-unes concernent l'Afrique et
il distingue pour ce continent trois royaumes floristiques : celui de
l'Afrique occidentale qui correspond à la côte atlantique
africaine ; celui de l'Afrique orientale, situé le long de la
côte de l'Afrique de l'Est au Sud de l'équateur ; celui du
Mesembryanthemum et des stapeliées, qui couvre l'Afrique du Sud
non tropicale.
Selon Lebrun, cité par Nshimba (2008), des nombreux
schémas phytogéographiques concernant l'Afrique où des
parties de celle-ci ont été publiés depuis Dixon(1822)
à Schouw (1823), mais on remarquera qu'il n'y a rien à
l'intérieur de l'Afrique, car ces régions étaient peu
connues d'un point de vue botanique. Petit à petit, les auteurs se sont
orientés vers des cartes phytogéographiques incluant une
véritable hiérarchisation de différentes entités
connues. C'est en 1869 que les premiers échantillons venant du Tchad
furent collectés. Finalement, c'est White qui donnera en 1976 une carte
au 1/60 000 000 de divisions phytogéographiques. Les cartes
publiées jusqu'alors étaient surtout les cartes de
végétation et la définition des entités reconnues
reposait sur des caractéristiques climatiques et physionomiques. En
conséquence, quatre types de zones de rang égal (ayant le rang de
régions) seront créés : la souche régionale
d'endémisme, la souche d'endémisme continentale insulaire, la
zone de transition et la mosaïque régionale. Les grandes divisions
chorologiques actuelles s'inspirent essentiellement du travail fondamental de
(White, cité par Nshimba, 2008).
Selon Robyns, cité par Belesi (2009), La
Réserve de Biosphère de Luki appartient bel et bien au Secteur du
Mayumbe. Elle se situe dans le sud-ouest du Centre régional
d'endémisme guinéo-congolais (White, cité par Lubini
(1997). Ne considérant que le territoire Congolais, Robyns, cité
par Lubini (1997) a érigé le Mayombe au rang de District
floristique ; il est certain que cette entité floristique du
Mayombe déborde les frontières, s'étendant à
l'enclave de Cabinda et au Mayombe congolais, ainsi que sans doute une partie
du Gabon.
Ainsi, pour les groupes phytogéographiques tels que mis
en évidence par nos observations sur le terrain et l'analyse des types
de distribution, nous avons adopté les groupes dont les
définitions suivent. Ces groupes phytogéographiques sont
basés sur la distribution des espèces contenues dans les
différentes Flores et ouvrages généraux (Livres, revues,
articles et thèses) et aux données Brahms de Wagningen et www
tropical du Missouri Botanical garden, cité par Belesi (2009). Il s'agit
de:
Espèces à très large distribution
Il s'agit des espèces rencontrées au niveau
mondiales ou au niveau continental africain.
A.1. Les espèces à très large
distribution mondiale, dont:
a) Cosmopolites (Cos), rencontrées aussi bien dans les
régions chaudes que tempérées,
b) Pantropicales (Pan), sensu stricto répandues en
Afrique, en Amérique, Asie tropicale et Australie,
c) Afronéotropicales (AnT), espèces
présentes en Afrique et en Amérique tropicale,
d) Paléotropicales (Pal), présentes en Afrique
et en Asie tropicale.
A.2. Les espèces africaines à large distribution
ou pluri-régionales africaines parmi lesquelles on a:
a) Afro-tropicales continentales (AT), en Afrique
continentale,
b) Afro-malgaches (AFM), distribuées en Afrique, au
Madagascar et les îles voisines,
c) espèces de l'Afrique Orientale et Australe (AOA),
occupant toutes l'est et le sud de l'Afrique.
B. Espèces régionales
Nous regroupons sous ce titre les espèces
cantonnées à une seule entité phytogéographique de
rang régional. Nous y distinguons les catégories suivantes:
B.1. Espèces guinéo-congolaises (GC),
répandues dans toute la région (Omni-guinéocongolaises
aussi appelées pluridomaniales). White, cité par Belesi (2009) a
proposé les subdivisions ci-après, correspondant au domaine de
Lebrun (1947), Aubréville (1962):
a. espèces bas-guinéo-congolaises (BGC),
espèces uniquement connues en Afrique équatoriale atlantique
(Cameroun, Gabon, Guinée équatoriale et les îles du Golfe
de Guinée) et existant aussi dans le Mayombe (angolais et
congolais) ;
b.espèces congolaises (C), espèces
répandues dans le bassin hydrographique du fleuve Congo incorporant
ainsi les espèces du Forestier Central (FC).
B.2. Espèces de transition régionale (White,
cité par Belesi, 2009): sont des espèces de liaison.
Elles sont plurirégionales. Elles sont répandues
en région guinéo-congolaise et en région
zambézienne du fait de leur voisinage. Dans la présente
étude, il s'agira des espèces Guinéo-congolaises et
zambéziennes (GC-Z), rencontrées dans le centre régional
d'endémisme guinéo-congolais et dans la partie
zambézienne.
2.2.4. Phase analytique au
labo
L'étude sur terrain a été
complétée par des recherches menées au laboratoire.
Les identifications provisoires réalisées sur le
terrain ont été vérifiées à l'herbarium de
l'INERA/Luki puis à Kinshasa (herbarium de l'INERA/UNIKIN),
c'est-à-dire la détermination était faite par comparaison
avec les spécimens des herbaria de l'INERA/Luki et de l'INERA/UNIKIN et
à l'aide des volumes de la flore d'Afrique centrale, du Gabon et du
Cameroun et flore of Ouest Tropical Africa.
Le matériel récolté a été
soumis au traitement habituel. Chaque échantillon possède un
numéro d'herbier en double. Hormis les espèces ayant subi des
modifications taxonomiques récentes, la nomenclature et la
classification des spermatophyta se base sur Hutchinson & Dalziel, Kramer
& Green, Tailfer, Lebrun & Stork, Pauwels, Hawthorne, Judd &
al. APG, Bremer et al. Ghazanfar, Hawthorne & Jongkind,
Martinsson & Ryman, cités par Belesi (2009). Les orthographes des
termes techniques botaniques ont été confirmées en nous
basant sur Tsteran, Sugden, Raynal-Roques, Allaby, Hickey & King, Puig,
Guignard & Dupont, Abderrazak & Reynaud, cités par Belesi
(2009). Les noms des parrains des espèces ont été
également confirmés sur base de Brummitt & Powell,
Adélia Diniz & Gonçalves, cités par Belesi (2009).
Etant donné que la plupart du matériel botanique
récolté était à l'état stérile (sans
fleurs ni fruits). Ces identifications ont été
vérifiées et confirmées par Lubini, surtout pour les
espèces des familles non encore traitées dans la flore du Congo
belge et du Rwanda-Urundi (Rubiaceae, Sapotaceae, Apocynaceae et quelques
Euphorbiaceae).
Les analyses granulométriques et chimiques de sol
prélevés ont été faite au laboratoire de
pédologie, faculté des sciences agronomiques, Université
de Kinshasa. Les paramètres étudiés sont : la
granulométrie, le ph et la teneur en eau. Les résultats de ces
analyses seront présentés au fur et à mesure de
l'étude de chaque type de forêt.
2.2.5. Analyse des données
végétales.
2.2.5.1. Analyse de la composition
floristique
Pour
la composition, une liste des espèces inventoriées dans les
formations végétales a été dressée. Le
nombre de familles, de genres, et d'espèces a été
évalué ct analysé dans chaque type des forêts. La
richesse aréale, la courbe aire-espèce, la fréquence
relative, l'abondance relative, la dominance relative, la surface
terrière des taxons, l'importance relative des taxons, les coefficients
de similarité des communautés, la diversités des taxons et
les différents indices ont été intégrés dans
l'analyse des données issues de l'inventaire des ligneux.
Les groupements végétaux ont été
obtenus à travers une analyse en composantes principales et une
classification hiérarchique ascendante. La Classification
Hiérarchique ascendante (CHA) (ou par agrégation) procède
par fusions successives de clusters existants. A chaque étape, les deux
clusters qui vont fusionner sont ceux dont la « distance» est la plus
proche.
La CHA considère initialement les observations comme
des clusters ne contenant qu'une seule observation. La première
étape consiste à réunir dans un cluster à deux
observations, les deux observations les plus proches. Puis le processus
continue et s'arrêtera quand deux clusters restant fusionnent dans
l'unique cluster contenant toutes les observations.
Le choix de cette analyse se justifie par le fait que c'est
une méthode qui permet de classer les variables (relevés) et de
les regrouper en nombres restreints basés sur le principe de la
similarité floristique, en créant des suites de partition de
classes de plus en plus vastes à l'image des classifications biologistes
en espèces, en genre, en famille, en ordre ...
Elle nous permet de regrouper les variables
étudiées ct d'assembler ces groupements jusqu'à ce qu'il
n'y ait plus qu'une seule classe.
L'arbre de classification ou dendrogramme représente
ces classes emboîtées les unes dans les autres. Les typologies les
plus significatives sont obtenues en traçant une ligne horizontale au
travers du dendrogramme obtenu et en retenant dans la typologie les clusters
terminaux situés juste au dessus de la ligne horizontale. En changeant
la hauteur de la ligne, on change le nombre de clusters retenus et on dispose
ainsi d'un moyen pour faire varier la granularité de la typologie.
Cette analyse a été réalisée
globalement sur la superficie de 9 ha selon la toposéquence et les types
forestiers définis dans le cadre phytosociologique de la Réserve
de Biosphère de Luki.
2.2.5.2. Analyse quantitative des
données végétales.
La nature structurale des espèces ligneuses
étudiées est définie par un ensemble de paramètres
(l'ail basale, la densité et la répartition des ligneux) et les
relations qui les interfèrent (Reitsma, cité par Lomba, 2007)
Afin d'analyser la composition du peuplement, les indices
ci-après ont été pris en compte (Lejoly, 1993 et Doucet,
2003).
a. Richesse aréale
C'est l'une des mesures les plus communes de la
biodiversité (Nshimba, 2008). Elle exprime le nombre d'espèces
recensées par unité de surface (Walker 1995). Cette mesure permet
de bien évaluer la variation de la surface terrière et de
diamètre au sein de la surface d'étude.
b. courbe aire-espèces
Elle est définie par l'augmentation de nombre
d'espèces (en ordonnée) en fonction de la surface croissante (en
abscisse). Elle permet de déterminer la surface minimale à
inventorier.
c. fréquence relative
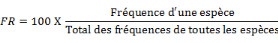
La fréquence d'une espèce correspond au nombre
d'unités d'échantillonnage contenant cette espèce. Elle
s'exprime en considérant le nombre de portions de 50 m où
l'espèce (ou famille) est présente. Elle se calcule par le
rapport de fréquence relative d'une espèce ou d'une famille
à la somme des fréquences de toutes les espèces ou de
toutes les familles dans l'échantillonnage. Elle s'exprime en
pourcentage.
d. Abondance relative
La densité relative des taxons est obtenue par la
connaissance du nombre d'individus d'une espèce ou d'une famille. Elle
se calcule par le rapport du nombre d'individus d'une espèce ou famille
au nombre total d'individus de ces espèces dans
l'échantillonnage. Elle s'exprime en pourcentage.
Densité relative d'une espèce = 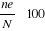 ; ;
Densité relative d'une famille = 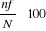 ; ;
Où ne = nombre d'individus d'une
espèce ;
nf = nombre d'individu d'une famille ;
N = nombre total d'individus dans
l'échantillon.
e. Dominance des taxons
Elle est obtenue à partir de la connaissance de la
surface terrière. Elle tient compte de la taille des individus pour
mettre en évidence les taxons qui occupent une grande surface dans la
forêt. Elle se calcule par la proportion de la surface terrière
d'une espèce ou d'une famille par rapport à la surface
terrière globale et s'exprime en pourcentage.
Dominance relative d'une espèce = 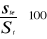 ; ;
Dominance relative d'une famille = 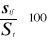 ; ;
Où ste = surface terrière d'une
espèce ;
Stf = surface terrière d'une
famille ;
St = surface terrière totale dans
l'échantillon
f. Surface terrière des
taxons
- La surface terrière d'un arbre est la superficie
occupée par le tronc, mesuré sur l'écorce à 1,30 m
du sol. Elle se `exprime en m²/ha.
- La surface terrière d'une espèce correspond
à la somme des surfaces terrières de tous les individus de cette
espèce et ramener les résultats à l'hectare.
- La surface terrière totale correspond à la
somme des surfaces terrières de tous les individus présents sur
la surface inventoriée. Elle se calcule à partir de la formule
suivante : 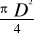 (Gounot, cité par Lomba, 2007). (Gounot, cité par Lomba, 2007).
La surface terrière pour chaque espèce ou
famille a été obtenue par la somme de différents individus
de l'espèce ou de la famille. Elle s'exprime en m² par ha et se
calcule comme suit : 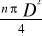 où n= nombre d'individu, D= diamètre où n= nombre d'individu, D= diamètre
g. Importance relative des
taxons
Elle se calcule par la sommation de la densité
relative, de la dominance relative et de la fréquence relative pour une
espèce. Pour exprimer l'importance relative d'une famille, on somme sa
densité, sa dominance et sa diversité relatives (GILLET &
al., 2003). Notons que la densité, la dominance, la fréquence et
la diversité relatives sont comprises entre 0 et 100 alors que
l'importance relative est comprise entre 0 et 300.
h. Indice d'importance des
espèces (ImportanceValue Index)
Cet indice effectue une pondération des valeurs de la
diversité par des termes relatifs à la densité relative,
à la dominance relative et à la fréquence relative des
relevés dans lesquels l'espèce est présente (Curtis &
Mclntosh, 1950). Elle se calcule par la formule suivante :
IVI= DR+DoR+FR
Avec : IVI : Importance Value Index (Indice
d'Importance des espèces)
i. Les coefficients de
similarité des communautés.
Le calcul des coefficients de similitude permet de quantifier
le degré d'association entre les espèces, ou encore le niveau de
similitude entre deux sites. Il exprime le degré de ressemblance
spécifique entre deux communautés végétales, par la
connaissance du nombre d'espèces qui les constituent.
Pour notre travail, nous avons choisi l'indice de coefficient
de similarité de Morisita-Horn qui correspond au rapport de la
probabilité que 2 individus tirés au hasard dans 2
échantillons appartiennent à la même espèce sur la
probabilité que 2 individus tirés au hasard dans le même
échantillon appartiennent à la même espèce. L'indice
de NNESS(k) est la forme généralisée de l'indice de
Morisita-Horn. Ces indices présentent l'avantage de comparer des
échantillons de même taille et prennent en compte les
espèces rares. Le programme BiodivR (Hardy 2007) calcule automatiquement
les valeurs de cet indice en fonction de k.
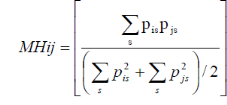 , , 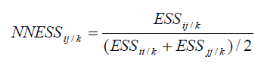
Pis et Pjs représentent les probabilités que
l'espèce s soit tirée des relevés i et j; ESSij/k
est le nombre d'espèces communes attendu pour des tirages
aléatoires (sans remise) parmi k individus des relevés i et j.
Pour chaque paire de relevés, k peut prendre différentes valeurs
tant que k = Ni et k = Nj. Il est à
noter que MHij = NNNESSij / k=1.
Lorsque ce coefficient tend vers 0, la similarité est
faible et les deux communautés sont différentes l'une de
l'autre ; et lorsqu'il tend vers 1, il existe une similarité dans
la composition floristique des communautés.
j. Diversité des taxons
La diversité des taxons dans la communauté se
traduit par le nombre d'espèces au sein d'une famille sur le nombre
total d'espèces, multiplié par 100. Elle s'exprime en
pourcentage.
Indice de diversité relative d'une famille = 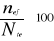 ; ;
Où nef = nombre d'espèces au
sein d'une famille ;
Nte = nombre total d'espèces dans
l'échantillon.
L'indice de diversité relative d'une famille permet de
mettre en évidence l'importance relative des grandes familles qui
dominent les forêts tropicales d'Afrique.
2.2.5.3. Calcul des indices
Un indice de diversité est fonction de la richesse
spécifique de la communauté et de la structure de la
communauté. Il permet d'évaluer rapidement, en un seul chiffre,
la biodiversité d'un peuplement. Il renseigne sur la qualité et
le fonctionnement des peuplements.
La diversité spécifique est calculée
suivant les formules de FRONTIER & PICHOD ou de BROWER & al.,
cités par Lomba (2007).
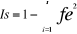 Ou Ou 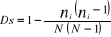
L'indice de diversité de Simpson varie de 0 à
1.
Si Is ou Ds tend vers 0, la diversité est
faible ;
Si Is ou Ds tend vers 1, la diversité est forte.
Is ou Ds = indice de diversité de Simpson
Où ni = nombre d'individus d'une
espèce ou d'une famille ;
N = nombre total d'individus dans
l'échantillonnage ;
fe = rapport entre le nombre d'individus d'une
espèce ou d'une famille et le nombre d'individus pour toutes les
espèces de la communauté.
Le calcul de ces indices a été facilité
par un passage à l'utilisation du logiciel MVSP (Multi-Variate
Statistical Package version 3,12d). Ils tiennent compte de la richesse
spécifique et de la régularité de la répartition
des individus entre les espèces en faisant la somme, sur toutes les S
espèces i, de termes basés sur l'abondance relative de
chaque espèce (fi) au sein de la communauté dont on
calcul l'indice de diversité (Senterre, cité par Boyemba,
2006).
Selon Doucet, Frontier & Pichod-Viale, 1993 in Senterre,
cité par Boyemba, op.cit., la diversité fournie par l'indice de
Shannon-Wiener peut être rapportée à la diversité
théorique maximale à une échelle variant de 0 (lorsque la
quasi- totalité des effectifs est concentrée sur une
espèce) à 1 (lorsque toutes les espèces ont la même
abondance), ce qui correspond à l'indice d'équitabilité de
Piélou (E= H / log2S).
Enfin, un autre indice de diversité que nous avons
utilisé, peu sensible à l'effort d'échantillonnage, est
l'indice de diversité alpha de Fisher (=8). Cet indice, facile à
calculer, ne nécessite que la connaissance du nombre total d'individus
d'une communauté végétale et le nombre d'espèces y
correspondant.
Condit & al, cité par Boyemba (2006), donne une
formule suivante : S = 8 ln (1+N / 8), où
8 = diversité alpha de Fisher,
N = nombre total d'individus et
S = nombre total d'espèces.
a. Indice de Simpson (S)
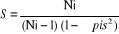
Où pis est la fréquence de l'espèce i
dans l'échantillon s.
Cet indice se base sur la fréquence des individus
élevée au carré. C'est la probabilité que deux
individus appartiennent à la même espèce dans une
communauté de taille Ni. Par conséquent la contribution relative
des espèces rares est presque insignifiante.
b. Indice de Shannon-Weaver
L'indice de diversité de Shannon-Weaver mesure la
quantité moyenne d'informations données par l'indication de
l'espèce d'un individu de la collection. Cette moyenne est
calculée à partir des proportions d'espèces qu'on a
recensées (Nshimba, 2008).
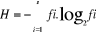
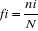 , avec ni compris entre 0 et N , avec ni compris entre 0 et N
fi est compris entre 0 et 1
N : effectif total,
ni: effectif de l'espèce dans l'échantillon,
S : nombre total d'espèces dans
l'échantillon
Les indices de diversité de Simpson, de Fisher et de
Shannon ont été calculés directement sur le logiciel
PAST.
c. Indice de Fisher á
Cet indice est assez facile à calculer car il ne
nécessite que le nombre d'individus dans la communauté dont on
cherche à évaluer la diversité. Il prend compte les
espèces rares et est stable en fonction de nombre d'individus.
 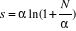
Où S : richesse spécifique,
N : nombre d'individus
d. Les indices de diversité-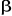
Elle reflète la modification de la diversité
alpha lorsque l'on passe d'un écosystème à un autre dans
un site ; ou tout simplement, c'est le taux de remplacement des
espèces dans un gradient topographique, climatique, ou d'habitat dans
une zone donnée. Elle est généralement mesurée par
le nombre des nouvelles espèces trouvées le long d'un
gradient.
Les indices les plus utilisés sont les coefficients de
similarité tels que : le coefficient de Jaccard et Sorensen. Un
indice plus petit indique moins de similarité dans la composition des
espèces entre les différents habitats (Smith, Scientia Silvica et
Condit & al., cité par Nshimba, 2008).
2.2.5.4. Description des
communautés
Afin d'apprécier les appétences entre les
relevés (ou sites) et en dégager les ressemblances et les
dissemblances on a procédé à des ordinations.
L'ordination est le terme collectif pour les techniques
multivariées qui arrangent les sites le long d'axes sur base de
données de la composition spécifique. Le résultat en deux
dimensions (2 axes) est un diagramme où les sites sont
représentés par des points. Le but de l'ordination est d'arranger
ces points de façon à ce que des points qui sont proches l'un de
l'autre correspondent à des sites qui ont une composition similaire et
que les points éloignés correspondent à des sites à
composition floristique différente (Jongman & al. 1995). Ce
réarrangement permet de synthétiser les résultats qui sont
ensuite interprétés à l'aide de ce qui est connu de
l'environnement des sites. Si on n'a pas de données environnementales
explicites, on le fait de manière informelle et s'il y en a, de
manière formelle.
Ainsi, nous avons d'abord procédé à
l'analyse indirecte particulièrement un DCA (Dentrended Correspondance
Analysis). Ici, l'ordination est construite sur base des
relevés/espèces uniquement. Les facteurs environnementaux sont
projetés à posteriori dans l'espace d'ordination pour examiner
leur corrélation avec la position des relevés/espèces.
Ensuite, les données environnementales sont directement
utilisées (CCA= Canonical Correspondance Analysis) pour organiser
l'information sur la variabilité floristique. Ces analyses ont
été réalisées avec le logiciel CANOCO (Leps &
Smilaur 1999). Ce logiciel nous à permis grâce à ses
nombreuses options notamment Canodraw de présenter les résultats
sous forme de diagrammes d'ordination.
On a pu également calculer l'effet significatif des
facteurs environnementaux sur la variabilité floristique à l'aide
de tests de permutations de Monte Carlo. L'analyse de classification
(dendrogramme) a été réalisée grâce au
logiciel PAST.
2.2.5.5. Les tests
statistiques
Dans une étude comparative, il est important avant de
prendre une position de recourir aux tests statistiques. Les tests statistiques
sont donc des outils d'aide à la décision. Cependant, ces tests
ne proposent aucune interprétation des résultats. Ils laissent au
chercheur les soins d'argumenter sa décision tout en rappelant les 2
risques d'erreur possibles :
· si un risque d'erreur est > 0,05, on conclut que la
différence entre 2 séries de mesure n'est pas significative.
· si le test indique un risque d'erreur < 0,05, on
conclut à une différence significative entre les 2 séries
de mesure.
Le principal test statistique réalisé dans ce
travail est l'ANOVA.
2.2.4.6. Outils d'analyse
Les données de l'inventaire ont été
enregistrées dans Excel 2003 et 2007. Elles ont été
ensuite vérifiées afin de corriger les éventuelles erreurs
de saisie, puis traitées. On avait aussi utilisé aussi le tableau
croisé dynamique pour le traitement des données.
Les aspects phytosociologiques ont été
abordés utilisant les logiciels Multi Variable Statistical:
EXSTAT.2008.4.01 pour l'ACP: PC-ORD version 4.10. pour la CHA: SIMSTAT/MVSP
qui a permis la détermination de la diversité
spécifique. Les noms scientifiques des espèces ont
été transcrits selon les documents des auteurs suivants: Aubin
(1963), Robyns (1958), Tailfer (1989), Wilks et al. (2000), Pauwels
(1993), Poorter et al. (2004). Le catalogue informatisé de Lejoly
& al (1988) nous a aidé pour la correction des noms
scientifiques.
TROISIEME CHAPITRE : PRESENTATION DES RESULTATS
Ce chapitre traite les résultats des travaux
menés sur le terrain et dans les laboratoires. Ces résultats
s'articulent autour des éléments suivants :
v analyse floristique globale,
v analyse floristique par toposéquence,
v analyse des caractéristiques quantitatives des
peuplements forestiers par site et par toposéquence,
v analyse de la diversité floristique
(spécifique) des sites et toposéquences,
v analyse des coefficients de similitude floristique au niveau
des sites et toposéquences.
3.1.
Analyse floristique globale et identification des groupements
Les inventaires réalisés dans les sites
étudiés d'une superficie de 9 ha, nous ont permis d'obtenir un
total de 4804 individus appartenant à 142 espèces, 110 genres et
35 familles. Ces sites (4) présentent une surface terrière totale
de 285,50 m²/ 9 ha avec une surface terrière moyenne de 31,72
m²/ ha. Parmi ceux-ci, 1437 individus appartenant à 117
espèces et 30 familles étaient recensés dans le bas de
pente (dépression), ensuite1736 individus appartenant à 91
espèces et 27 familles recensés dans les placeaux de pente et
enfin, 1631 individus, 104 espèces et 30 familles recensés dans
les placeaux de crête.
Nous présentons d'une façon
détaillée dans le tableau 3 ci-dessous les nombres d'individus,
d'espèces et des familles recensés dans les différentes
toposéquences.
Tableau 3 : Les
nombres d'individus, d'espèces et des familles recensés dans les
différentes toposéqueces.
|
Toposéquences
|
Nombre d'individus
|
Nombre d'espèces
|
Nombre des familles
|
|
Crête 1
Crête 2
Crête 3
Pente 1
Pente 2
Pente 3
Dépression 1
Dépression 2
Dépression 3
|
568
561
502
582
598
556
543
487
407
|
67
62
83
65
67
63
87
66
78
|
24
20
28
21
23
26
29
23
24
|
Il ressort de ce tableau que dans :
- D1, 543 individus ont été inventoriés
appartenant à 87 espèces et 29 familles,
- D2, le recensement a revelé 487 individus
regroupés à 66 espèces et 23 familles,
- D3, 407 individus répartis à 78
espèces et 24 familles,
- P1, 582 individus, 65 espèces et 21 familles ont
été inventoriés,
- P2, 598 individus appartenant à 67 espèces et
23 familles,
- P3, 556 individus répartis à 63
espèces et 26 familles,
- C1, 568 individus regroupés à 67
espèces et 24 familles,
- , 561 individus appartenant à 62 espèces et
20 familles,
- C3, 502 individus, 83 espèces et 28 familles
étaient recensés par la méthode de mesure de dbh = 10 cm.
Le dépouillement du matériel rassemblé
lors de la récolte permet d'étudier la richesse floristique de
différents types forestiers du Nord-est de la Réserve de
Biosphère de Luki.
Les résultats obtenus sont présentés dans
le tableau 4 qui donne la composition floristique des 9 ha.
Tableau 4 : Analyse
globale des espèces recensées avec leurs caractères
biologiques et écologiques
Legende : TM : Type
morphologique ; TB : Type biologique ; TD : Type de
diaspore ; DPH : Distribution phytogéographique ;
SPH : Statut phytosociologique
|
N°
|
Espèces
|
TM
|
TB
|
TD
|
CF
|
D PH
|
S PH
|
|
1
|
Afzelia bipindensis
|
A
|
Msph
|
Sarc
|
S
|
GC
|
SP
|
|
2
|
Aidia ochroleuca
|
Arb
|
Mcph
|
Sarc
|
S
|
GC
|
SP
|
|
3
|
Aidia stanerana
|
Arb
|
Mcph
|
Sarc
|
S
|
GC
|
SP
|
|
4
|
Albizia gummifera
|
A
|
Mgph
|
Bar
|
Sc
|
Guin
|
MT
|
|
5
|
Allanblackia floribunda
|
A
|
Msph
|
Sarc
|
S
|
GC
|
SP
|
|
6
|
Aningeria robusta
|
A
|
Mgph
|
Sarc
|
S
|
GC
|
SP
|
|
7
|
Annick chlorantha
|
A
|
Mcph
|
Sarc
|
S
|
GC
|
MT
|
|
8
|
Anonidium mannii
|
A
|
Msph
|
Sarc
|
S
|
GC
|
SP
|
|
9
|
Anthonotha pynaertii
|
A
|
Mcph
|
Bal
|
S
|
GC
|
MT
|
|
10
|
Antiaris toxicaria
|
A
|
Msph
|
Sarc
|
C
|
GC
|
MT
|
|
11
|
Antrocaryon nannanii
|
A
|
Msph
|
Sarc
|
Sc
|
GC
|
SP
|
|
12
|
Autranella congolensis
|
A
|
Mgph
|
Sarc
|
S
|
GC
|
SP
|
|
13
|
Barteria nigritiana
|
A
|
Mgph
|
Sarc
|
S
|
GC
|
MT
|
|
14
|
Blighia unijugata
|
A
|
Mcph
|
Sarc
|
S
|
Afr-Tr
|
SP
|
|
15
|
Blighia welwitschii
|
A
|
Mgph
|
Sarc
|
S
|
Guin
|
SP
|
|
16
|
Bombax buonopozense
|
A
|
Msph
|
Sarc
|
Sc
|
GC
|
SP
|
|
17
|
Bosqueia angolense
|
A
|
Msph
|
Sarc
|
S
|
GC
|
MT
|
|
18
|
Brenania brieyi
|
A
|
Msph
|
Sarc
|
S
|
GC
|
SP
|
|
19
|
Caesalpinia sp
|
A
|
Mcph
|
Bal
|
S
|
GC
|
MT
|
|
20
|
Canarium schweinfurthii
|
A
|
Mgph
|
Sarc
|
S
|
Guin
|
SP
|
|
21
|
Carapa procera
|
A
|
Msph
|
Sarc
|
S
|
Afro-Am
|
MT
|
|
22
|
Ceiba pentandra
|
A
|
Mgph
|
Pogo
|
Sc
|
Pantr
|
SP
|
|
23
|
Celtis mildbraedii
|
A
|
Mgph
|
Sarc
|
S
|
Afr-Tr
|
SP
|
|
24
|
Chrysophyllum africanum
|
A
|
Mgph
|
Sarc
|
S
|
Afr-Tr
|
SP
|
|
25
|
Chrysophyllum sp
|
A
|
Mgph
|
Sarc
|
S
|
GC
|
SP
|
|
26
|
Chytranthus macrobotrys
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
SP
|
|
27
|
Cleistopholis patens
|
A
|
Msph
|
Sarc
|
S
|
GC
|
MT
|
|
28
|
Coelocaryon botryoides
|
A
|
Msph
|
Sarc
|
S
|
C
|
MT
|
|
29
|
Cola bruneelii
|
Arb
|
Mcph
|
Sarc
|
S
|
C
|
SP
|
|
30
|
Cola griseiflora
|
A
|
Mcph
|
Sarc
|
S
|
GC
|
SP
|
|
31
|
Cola sp
|
A
|
Mcph
|
Sarc
|
S
|
GC
|
SP
|
|
32
|
Corynanthe paniculata
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
MT
|
|
33
|
Croton sylvaticus
|
A
|
Msph
|
Sarc
|
Sc
|
Afr-Tr
|
MT
|
|
34
|
Cynometra lujae
|
A
|
Mgph
|
Bar
|
S
|
GC
|
SP
|
|
35
|
Dacryodes buettneri
|
A
|
Msph
|
Sarc
|
Sc
|
GC
|
SP
|
|
36
|
Deinbollia acuminata
|
A
|
Msph
|
Sarc
|
S
|
C
|
SP
|
|
37
|
Desbordesia glaucescens
|
A
|
Mgph
|
Sarc
|
S
|
Guin
|
SP
|
|
38
|
Dialium angolense
|
A
|
Msph
|
Bar
|
S
|
GC
|
SP
|
|
39
|
Dialium corbisieri
|
A
|
Mgph
|
Sarc
|
S
|
C
|
HL
|
|
40
|
Dialium sp
|
A
|
Msph
|
Bar
|
S
|
GC
|
SP
|
|
41
|
Dialium tessmannii
|
A
|
Msph
|
Bar
|
S
|
GC
|
SP
|
|
42
|
Diospyros bipindensis
|
A
|
Msph
|
Sarc
|
S
|
GC
|
SP
|
|
43
|
Diospyros iturensis
|
A
|
Msph
|
Sarc
|
S
|
GC
|
HL
|
|
44
|
Diospyros pseudomesospilus
|
A
|
Mcph
|
Sarc
|
S
|
GC
|
SP
|
|
45
|
Diospyros sp
|
A
|
Mcph
|
Sarc
|
S
|
Guin
|
SP
|
|
46
|
Discoglipremna caloneura
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
MT
|
|
47
|
Dracaena arborea
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
Cultivé
|
|
48
|
Enanthia affinis
|
A
|
Mcph
|
Sarc
|
S
|
GC
|
SP
|
|
49
|
Entandrophragma angolense
|
A
|
Msph
|
Pter
|
S
|
Guin
|
SP
|
|
50
|
Entandrophragma candollei
|
A
|
Mgph
|
Sarc
|
S
|
Guin
|
SP
|
|
51
|
Entandrophragma cylindricum
|
A
|
Mgph
|
Sarc
|
S
|
Guin
|
SP
|
|
52
|
Eriocoelum microspermum
|
A
|
Mcph
|
Sarc
|
S
|
GC
|
SP
|
|
53
|
Erythrophleum suaveolens
|
A
|
Mgph
|
Bar
|
S
|
Afr-Tr
|
SP
|
|
54
|
Erythroxylum mannii
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
SP
|
|
55
|
Espèces inconnues
|
A
|
Mcph
|
Sarc
|
S
|
GC
|
SP
|
|
56
|
Ficus variifolia
|
A
|
Msph
|
Sarc
|
S
|
Afr-Tr
|
MT
|
|
57
|
Fillaeopsis discophora
|
A
|
Mgph
|
Sarc
|
Sc
|
GC
|
MT
|
|
58
|
Funtumia africana
|
A
|
Mgph
|
Pogo
|
S
|
Guin
|
MT
|
|
59
|
Funtumia elastica
|
A
|
Msph
|
Pogo
|
S
|
Guin
|
MT
|
|
60
|
Ganophyllum giganteum
|
A
|
Mgph
|
Sarc
|
S
|
GC
|
MT
|
|
61
|
Garcinia epunctata
|
A
|
Mgph
|
Sarc
|
S
|
Guin
|
SP
|
|
62
|
Garcinia punctata
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
SP
|
|
63
|
Garcinia sp
|
A
|
Mgph
|
Sarc
|
S
|
Guin
|
SP
|
|
64
|
Gilbertiodendron dewevrei
|
A
|
Mgph
|
Bar
|
S
|
GC
|
SP
|
|
65
|
Gilbertiodendron grandistipulata
|
A
|
Msph
|
Bar
|
S
|
GC
|
SP
|
|
66
|
Gilbertiodendron mayumbensis
|
A
|
Msph
|
Bar
|
S
|
C
|
SP
|
|
67
|
Greenwayodendron suaveolens
|
A
|
Mgph
|
Sarc
|
S
|
GC
|
SP
|
|
68
|
Grummilea cabrae
|
A
|
Mgph
|
Sarc
|
S
|
GC
|
MT
|
|
69
|
Guarea cedrata
|
A
|
Mgph
|
Sarc
|
S
|
Guin
|
SP
|
|
70
|
Guarea thompsonii
|
A
|
Mgph
|
Sarc
|
S
|
Guin
|
SP
|
|
71
|
Hannoa klaineana (Quassia undulata)
|
A
|
Mgph
|
Sarc
|
S
|
Guin
|
SP
|
|
72
|
Hexalobus crispiflorus
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
M
|
|
73
|
Huaga bonii
|
A
|
Mcph
|
Sarc
|
S
|
GC
|
SP
|
|
74
|
Hylodendron gabunense
|
A
|
Msph
|
Sarc
|
S
|
GC
|
SP
|
|
75
|
Hymenostegia laxiflora
|
A
|
Msph
|
Sarc
|
S
|
GC
|
SP
|
|
76
|
Irvingia sp
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
MT
|
|
77
|
Isolona dewevrei
|
Arb
|
Mcph
|
Sarc
|
S
|
GC
|
SP
|
|
78
|
Julbernardia arnoldiana
|
A
|
Msph
|
Bal
|
S
|
GC
|
SP
|
|
79
|
Klainedoxa gabonensis
|
A
|
Mgph
|
Sarc
|
Sc
|
Guin
|
SP
|
|
80
|
Lannea welwitschii
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
HL
|
|
81
|
Lovoa trichilioides
|
A
|
Mgph
|
Sarc
|
S
|
Guin
|
SP
|
|
82
|
Macaranga spinosa
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
MT
|
|
83
|
Maesopsis eminii
|
A
|
Msph
|
Sarc
|
Sc
|
Guin
|
MT
|
|
84
|
Mammea africana
|
A
|
Mgph
|
Sarc
|
S
|
Guin
|
SP
|
|
85
|
Manilkara sp
|
A
|
Msph
|
Sarc
|
S
|
R
|
SP
|
|
86
|
Maranthes glabra
|
A
|
Mgph
|
Sarc
|
S
|
Guin
|
HL
|
|
87
|
Margaritaria discoidea
|
A
|
Msph
|
Sarc
|
Sc
|
Af-Tr
|
MT
|
|
88
|
Milicia excelsa
|
A
|
Mgph
|
Sarc
|
Sc
|
Guin
|
MT
|
|
89
|
Millettia drastica
|
A
|
Msph
|
Bal
|
C
|
GC
|
CT
|
|
90
|
Mimusops heckeli
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
HL
|
|
91
|
Monodora angolensis
|
A
|
Msph
|
Sarc
|
S
|
GC
|
MT
|
|
92
|
Monodora myristica
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
MT
|
|
93
|
Musanga cecropioides
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
MT
|
|
94
|
Nesogordonia kabingaensis subsp.leplaei
|
A
|
Msph
|
Sarc
|
S
|
GC
|
MT
|
|
95
|
Newtonia glandulifera
|
A
|
Mgph
|
Sarc
|
S
|
GC
|
SP
|
|
96
|
Newtonia leucocarpa
|
A
|
Mgph
|
Sarc
|
S
|
GC
|
SP
|
|
97
|
Oncoba welwitschii
|
A
|
Mcph
|
Sarc
|
Sc
|
GC
|
CT
|
|
98
|
Pausinystalia pynaertii
|
A
|
Mcph
|
Sarc
|
S
|
May
|
SP
|
|
99
|
Pentaclethra eetveldeana
|
A
|
Msph
|
Bal
|
S
|
Guin
|
MT
|
|
100
|
Pentaclethra macrophylla
|
A
|
Msph
|
Bal
|
S
|
Guin
|
MT
|
|
101
|
Petersianthus macrocarpus
|
A
|
Mgph
|
Pter
|
Sc
|
Cguin
|
MT
|
|
102
|
Picralima nitida
|
A
|
Msph
|
Sarc
|
S
|
C
|
MT
|
|
103
|
Piptadeniastrum africanum
|
A
|
Mgph
|
Bal
|
Sc
|
Guin
|
SP
|
|
104
|
Plagiostyles africana
|
A
|
Mcph
|
Sarc
|
S
|
GC
|
SP
|
|
105
|
Pouteria aningeria
|
A
|
Msph
|
Sarc
|
S
|
GC
|
SP
|
|
106
|
Prioria balsamifera
|
A
|
Mgph
|
Bal
|
S
|
GC
|
SP
|
|
107
|
Prioria oxyphylla
|
A
|
Mgph
|
Bal
|
S
|
GC
|
SP
|
|
108
|
Pseudospondias longifolia
|
A
|
Msph
|
Sarc
|
S
|
GC
|
M
|
|
109
|
Psychotria dermatophylla
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
SP
|
|
110
|
Pteleopsis hylodendron
|
A
|
Msph
|
Sarc
|
Sc
|
Guin
|
MT
|
|
111
|
Pterygota bequaertii
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
SP
|
|
112
|
Pycnanthus angolensis
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
MT
|
|
113
|
Ricinodendron heudelotii
|
A
|
Msph
|
Sarc
|
C
|
Guin
|
MT
|
|
114
|
Santiria trimera
|
A
|
Msph
|
Sarc
|
Sc
|
C
|
SP
|
|
115
|
Sorindeia gilletii
|
A
|
Msph
|
Sarc
|
S
|
GC
|
SP
|
|
116
|
Sorindeia mayombensis
|
A
|
Mcph
|
Sarc
|
S
|
Guin
|
SP
|
|
117
|
Staudtia kamerunensis var gabonensis
|
A
|
Mgph
|
Sarc
|
S
|
GC
|
SP
|
|
118
|
Sterculia bequaertii
|
A
|
Msph
|
Sarc
|
S
|
GC
|
MT
|
|
119
|
Sterculia tragacantha
|
A
|
Msph
|
Sarc
|
Sc
|
GC
|
MT
|
|
120
|
Strombosia pustulata var pustulata
|
A
|
Mgph
|
Sarc
|
S
|
GC
|
SP
|
|
121
|
Strombosiopsis glaucescens
|
A
|
Msph
|
Sarc
|
S
|
GC
|
SP
|
|
122
|
Strombosiopsis tetandra
|
A
|
Msph
|
Sarc
|
S
|
GC
|
SP
|
|
123
|
Symphonia globulifera
|
A
|
Mgph
|
Sarc
|
S
|
Afro-Am
|
HL
|
|
124
|
Tabernaemontana crassa
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
MT
|
|
125
|
Tapura fischeri
|
Arb
|
Mcph
|
Sarc
|
S
|
Guin
|
MT
|
|
126
|
Terminalia superba
|
A
|
Mgph
|
Sarc
|
C
|
Guin
|
MT
|
|
127
|
Tessmanni africana
|
A
|
Mgph
|
Sarc
|
S
|
GC
|
MT
|
|
128
|
Tetrapleura tetraptera
|
A
|
Msph
|
Bal
|
S
|
Guin
|
MT
|
|
129
|
Tetrorchidium didymostemon
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
MT
|
|
130
|
Treculia africana
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
HL
|
|
131
|
Trema orientalis
|
A
|
Msph
|
Sarc
|
S
|
AM
|
CT
|
|
132
|
Trichilia degeana
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
SP
|
|
133
|
Trichilia gilgiana
|
A
|
Msph
|
Sarc
|
S
|
GC
|
SP
|
|
134
|
Trichilia prieureana
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
SP
|
|
135
|
Trichilia sp
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
SP
|
|
136
|
Trichoschypha acuminata
|
A
|
Msph
|
Sarc
|
S
|
C
|
SP
|
|
137
|
Trichoscypha odonii
|
A
|
Msph
|
Sarc
|
S
|
C
|
SP
|
|
138
|
Uapaca guinensis
|
A
|
Msph
|
Sarc
|
S
|
Guin
|
MT
|
|
139
|
Vitex welwitschii
|
A
|
Msph
|
Sarc
|
S
|
GC
|
MT
|
|
140
|
Xylopia chrysophylla
|
A
|
Mgph
|
Sarc
|
S
|
GC
|
SP
|
|
141
|
Xylopia hypolampra
|
A
|
Mgph
|
Sarc
|
S
|
Afr-Tr
|
SP
|
|
142
|
Zanthoxylum gilletii
|
A
|
Msph
|
Sarc
|
Sc
|
GC
|
SP
|
3.1.1 Analyse des spectres
écologiques
Comme il a été dit dans le chapitre sur la
méthodologie, nous avons estimé nécessaire de
caractériser les types des forêts étudiés dans les
différents sites à l'aide de l'analyse des spectres
écologiques. Les résultats de ces analyses sont
présentés dans les tableaux ci-dessous.
3.1.1.1 Types biologiques (T.B)
Les résultats de l'analyse des formes
biologiques de l'ensemble de notre florule sont rassemblés au tableau
5.
Tableau 5 : Spectre
biologique global de toutes les espèces resencées dans
différents sites du Nord-est de la Réserve de Biosphère de
Luki.
|
Types biologiques
|
Nombre d'espèces
|
Valeurs (%)
|
|
Mésophanérophytes
|
77
|
54,22
|
|
Mégaphanérophytes
|
45
|
31,69
|
|
Microphanérophytes
|
20
|
14,09
|
De l'analyse des
données de tableau 5, il ressort que les phanérophytes forment le
noyau le plus important de la forêt étudiée. Cette
conclusion n'a rien de surprenant pour autant qu'il s'agit bien d'une
végétation forestière où les arbres, arbustes et
lianes prédominent.
Dans ce groupe des phanérophytes, on constate la
prédominance des mésophanérophytes (54,22%), suivis de
mégaphanérophytes (31,69%) et de microphanérophytes
(14,09%).
3.1.1.2 Types de diaspores et adaptation à la
dissémination
Les types de diaspores et le mode de dissémination
constituent un critère écologique qui peut suggérer le
mécanisme de dissémination de l'espèce et d'en
déduire la présence et l'abondance de l'espèce
considérée dans le groupement étudié.
Les résultats de l'analyse de type des diaspores de
l'ensemble floristique de notre forêt figurent dans le tableau 6.
Tableau 6 : Spectre des
types de diaspores de toutes les espèces recensées dans les
différents sites du Nord-est de la Réserve de Biosphère de
Luki.
|
Types de diaspores
|
Nombres d'espèces
|
Valeurs (%)
|
|
Sarcochores
|
118
|
83,09
|
|
Ballochores
|
10
|
7,05
|
|
Barochores
|
9
|
6,34
|
|
Pogonochores
|
3
|
2,11
|
|
Ptérochores
|
2
|
1,41
|
De ce qui précède, les conclusions suivantes
peuvent être formulées :
A propos de type de diaspores, presque tous les types sont
représentés en proportion inégaux.
On relève cependant la prévalence des
espèces totalement ou partiellement charnues c'est- à- dire
sarcochores présumés être disséminés par les
animaux. Cette conclusion rejoint celle dégagée par Evrard
(1968), Lubini et Mandango (1981). Avec ces auteurs, nous concluons que les
diaspores partiellement ou totalement charnues dominent en milieu forestier
intertropical ; et que le rôle des animaux dans la
dissémination des espèces forestières est ainsi mis en
évidence.
La seconde catégorie se compose des espèces
à diaspores de type ballochores et barochores respectivement
présumés disséminés par le mécanisme propre
à l'espèce et par le vent. Les autres catégories sont
relativement peu représentées dans ce type de forêt.
3.1.1.3 Comportement du feuillage (CF)
Les résultats du comportement des
feuillages des espèces du Parc de la Nkula sont résumés
dans le tableau 7 ci-dessous.
Tableau 7 : Spectre de
comportement du feuillage pour toutes les espèces étudiées
dans les différents sites du Nord-est de la Réserve de
Biosphère de Luki
|
Comportement du feuillage
|
Nombre d'espèces
|
Valeurs (%)
|
|
Sempervirentes
|
120
|
84,51
|
|
Semi-caducifoliés
|
18
|
12,68
|
|
Caducifoliés
|
4
|
2,81
|
L'analyse du comportement du feuillage des forêts des
espèces étudiées permet de révéler la
prédominance des espèces sempervirentes soit un total de 84,51%,
proportion comparable à celle mentionnée par Lebrun et Gilbert
(1954). Notons que les espèces totalement ou partiellement
semi-caducifoliées et caducifoliées se retrouvent à des
proportions variables de la forêt (12,68% et 2,81%)
3.1.1.4. Distribution phytogéographique (D PH)
L'analyse du spectre phytogéographique de la
forêt des différents sites étudiés est
présentée dans le tableau 8.
Tableau 8 : Spectre de distribution phytogéographique
des types des forêts étudiées dans le Nord-est de la
Réserve de Biosphère de Luki
|
Distribution phytogéographique
|
Nombre d'espèces
|
Valeurs (%)
|
|
Espèces guinéo-congolaises
|
64
|
45,07
|
|
Espèces guinéennes
|
55
|
38,73
|
|
Espèces Afro-tropicales
|
8
|
5,64
|
|
Espèces Congolaises
|
9
|
6,34
|
|
Espèces Afro-Américaines
|
2
|
1,42
|
|
Espèces de Mayombe
|
1
|
0,7
|
|
Espèces Pantropicales
|
1
|
0,7
|
|
Espèces Régionales
|
1
|
0,7
|
De ce tableau, relevons la prédominance très
nette des espèces régionales. Dans cette catégorie
prédominent les espèces du sous centre régional
d'endémisme Guinèo- Congolais, espèces
guinéo-congolaises (45,07%) et guinéennes (38,73%). D'une
manière générale, la prédominance de ces
espèces est l'expression de l'appartenance de la Réserve de
Biosphère de Luki à la région
Guinéo-Congolaise. Les autres espèces (Afr-Tr, Cong, May, Pantr,
R et Am) se retrouvent à de proportions faibles.
3.1.1.5. Type morphologique
(TM)
Nous présentons le type morphologique des
différentes espèces récensées dans
les sites étudiés
Tableau 9 : Type
morphologique des espèces étudiées dans le Nord-est de la
Réserve de Biosphère de Luki
|
Types morphologiques
|
Nombre d'espèces
|
Valeurs (%)
|
|
Arbres
|
138
|
96,5
|
|
Arbustes
|
5
|
3,5
|
Le tableau 9 montre la prédominance très nette
des arbres.
3.1.1.6. Statuts
phytosociologiques (S PH)
Les statuts phytosociologiques des espèces
inventoriées dans les différents relevés ont
été obtenus suivant les travaux de Lebrun et Gilbert (1954),
Mandango (1982), et Nshimba (2008).
Tableau 10 : Spectre
Statuts phytosociologiques des espèces étudiées dans le
Nord-est de la Réserve de Biosphère de Luki.
|
Statuts phytosociologiques
|
Nombre d'espèces
|
Valeurs (%)
|
|
Strombosio-Parinarietea
|
85
|
59,86
|
|
Musango-Terminalietea
|
47
|
33,1
|
|
Halleetea
|
9
|
6,34
|
|
Cultivé
|
1
|
0,7
|
Il ressort du tableau 10, la prédominance de
Strombosio-Parinarietea (59,86%), suivis de
Musango-Terminalietea et de Halleetea (33,1% et 6,34%).
L'inventaire de toutes les espèces de l'ensemble des 4 sites est
donné en annexe 1 (tableau 2).
Le tableau 11 donne les informations sur le nombre des
familles, des genres et des espèces récensés sur les
différents sites étudiés.
Tableau 11 : Effectif
familles, genres et espèces dans les différents sites
étudiés dans le Nord-est de la Réserve de Biosphère
de Luki.
|
Site 1
|
Site 2
|
Site 3
|
Site 4
|
|
Familles
|
32
|
26
|
30
|
26
|
|
Genres
|
87
|
70
|
88
|
53
|
|
Espèces
|
112
|
87
|
107
|
63
|
Ce tableau révèle que le site 1 a 32 familles,
suivis des sites 3, 2, 4 avec respectivement 30 et 26 familles chacun, tandis
que le site 3 a 88 genres, suivis des sites 1, 2, 4 avec respectivement
87 ; 70 et 53 genres. Du point de vue espèces, le site 1 a 112
espèces, suivis des sites 3, 2, 4 ayant chacun 107 ; 87 et 63
espèces.
Le tableau 12 suivant présente les cinq familles
prépondérantes pour chaque site.
Tableau 12 : Les 5 familles les mieux représentées des
différents sites étudiés du Nord-est de la Réserve
de Biosphère de Luki.
Légende : Le rang
dans la classification des familles les mieux représentées dans
chaque site est indiqué entre parenthèse.
|
Familles
|
Site 1
|
Site 2
|
Site 3
|
Site 4
|
|
Malvaceae/Sterculiaceae
Fabaceae/Caesalpinioideae
Ebenaceae
Sapotaceae
Olacaceae
|
30,97% (1)
19,79% (2)
9,58% (3)
6,52% (4)
3,46% (5)
|
27,65% (1)
10,69% (4)
12,44% (3)
0
14,38% (2)
|
17,05% (2)
19,25% (1)
8,25% (3)
0
0
|
30,76% (1)
16,91% (2)
12,59% (3)
0
0
|
|
Irvingiaceae
|
0
|
4,88% (5)
|
0
|
0
|
|
Annonaceae
Rubiaceae
|
0
0
|
0
0
|
6,49% (4)
6,38% (5)
|
0
5,94% (5)
|
|
Anacardiaceae
|
0
|
0
|
0
|
6,12% (4)
|
Le tableau 12 nous renseigne ce qui suit :
· Dans le site1, la famille de
Malvaceae/Sterculioideae (30,97%) est la mieux
représentée suivies des familles de
Fabaceae/Caesalpinioideae (19,79%), Ebenaceae (9,58%),
Sapotaceae (6,52 %) et olacaceae (3,46 %).
· Dans le site2, la famille de
Malvaceae/Sterculiaceae (27,65%) est la mieux
représentée suivies des familles d'Olacaceae (14,38%),
Ebenaceae (12,44%), Fabaceae/Caesalpinioideae (10,69%) et
Irvingiaceae (4,88%).
· Dans le site3, la famille de
Fabaceae/Caesalpinioideae (19,25%) est la mieux
représentée suivies des familles de
Malvaceae/Sterculiaceae (17,05%), Ebenaceae (8,25%),
Annonaceae (6,49%) et de Rubiaceae (6,38%).
· Dans le site4, la famille de
Malvaceae/Sterculiaceae (30,76%) est la mieux
représentée suivies des familles de
Fabaceae/Caesalpinioideae (16,91%), Ebenaceae (12,95%),
Anacardiaceae (6,12%) et de Rubiaceae (5,94%).
3.1.2. Analyse de la surface
terrière
Rappelons que cette surface terrière n'a
été calculée que pour les espèces arborescentes et
arbustives. Elle est la surface occupée par les troncs à hauteur
de poitrine et s'exprime en m²/ha. La surface terrière des
espèces et des familles a été calculée pour chaque
site et les valeurs obtenues sont données au tableau 13 suivant.
Ø La surface terrière des
espèces
Le tableau 13 suivant présente les dix espèces
tops et autres présentant une surface terrière
considérable pour chaque site.
Tableau 13 : Surface
terrière relative de dix espèces tops et autres des
différents sites étudiés.
Légende : Le rang dans la
classification des espèces les mieux représentées dans
chaque site en surface terrière est indiqué entre
parenthèse.
|
Espèces
|
Site 1 (m²/4ha)
|
Site 2 (m²/2ha)
|
Site 3 (m²/2ha)
|
Site 4 (m²/ha)
|
|
Autres espèces
Cola griseiflora
Cynometra lujae
Desbordesia glaucescens
Hymenostegia laxiflora
Prioria balsamifera
Tessmannia africana
Newtonia glandulifera
Dialium corbisieri
Dacryodes buettneri
Diospyros iturensis
|
54,59 (1)
13,28 (2)
8,09 (3)
6,99 (4)
6,43 (5)
4,92 (6)
3,57 (7)
3,36 (8)
3,19 (9)
3,19 (10)
3,09 (11)
|
32,50 (1)
5,07 (4)
0
8,47 (3)
0
0
0
0
12,47 (2)
0
0
|
31,81% (1)
2,06 (8)
0
3,00 (3)
0
2,99 (4)
0
0
2,17 (7)
0
0
|
10,79 (1)
3,10 (4)
0
0
4,22 (2)
0
0
0
0
3,55 (3)
1,49 (5)
|
|
Ganophyllum giganteum
Pentaclethra macrophylla
Strombosia pustulata
Chrysophyllum africanum
Klainedoxa gabonensis
Ceiba pentandra
Nesogordonia kabingaensis
|
0
0
0
0
0
0
0
|
4,44 (5)
3,99 (6)
3,88 (7)
3,79 (8)
3,44 (9)
2,77 (10)
2,40 (11)
|
0
2,55 (5)
0
1,38 (11)
2,21 (6)
0
1,49 (9)
|
0
0
0
1,02 (6)
0
0
1,02 (7)
|
|
Gilbertiodendron mayumbensis
Terminalia superba
|
0
0
|
0
0
|
9,22 (2)
1,49 (10)
|
0
0
|
|
Sorindeia mayombensis
Pterygota bequaertii
Zanthoxylum gilletii
Guarea thompsonii
|
0
0
0
0
|
0
0
0
0
|
0
0
0
0
|
1,02 (8)
0,99 (9)
0,92 (10)
0,87 (11)
|
Le site1 présente une surface terrière totale de
110,7 m²/4ha dont la surface terrière moyenne est de 27,67
m²/ha avec 10 premières espèces les plus
représentatives : Cola griseiflora (13,28), Cynometra
lujae (8,09), Desbordesia glaucescens (6,99), Hymenostegia
laxiflora (6,43), Prioria balsamifera (4,92), Tessmannia
africana (3,57), Newtonia glandulifera (3,36), Dialium
corbisieri et Dacryodes buettneri (3,19) chacun, Diospyros
iturensis (3,09), et enfin les autres espèces (54,59).
Le site2 présente une surface terrière totale de
83,16 m²/2ha dont la surface terrière moyenne est de 41,58
m²/ha avec 10 premières espèces les plus
représentatives : Dialium corbisieri (12,47),
Desbordesia glaucescens (8,47), Cola griseiflora (5,07),
Ganophyllum giganteum (4,44), Pentaclethra macrophylla
(3,99), Strombosia pustulata (3,88), Chrysophyllum
africanum (3,79), Klainedoxa gabonensis (3,44), Ceiba
pentandra (2,77), Nesogordonia kabingaensis (2,40) et enfin les
autres espèces (32,50).
Le site3 présente une surface terrière totale de
62,67 m²/2ha dont la surface terrière moyenne est de 31,34
m²/ha avec 10 premières espèces les plus
représentatives : Gilbertiodendron mayumbensis (9,22),
Desbordesia glaucescens (3,00), Prioria balsamifera (2,99),
Pentaclethra macrophylla (2,55), Klainedoxa gabonensis
(2,21), Dialium corbisieri (2,17), Cola griseiflora (2,06),
Nesogordonia kabingaensis et Terminalia superba (1,49),
Chrysophyllum africanum (1,38) et enfin les autres espèces
(31,81).
Le site4 présente une surface terrière totale de
28,97 m²/ha dont la surface terrière moyenne est de 28,97
m²/ha avec 10 premières espèces les plus
représentatives : Hymenostegia laxiflora (4,22),
Dacryodes buettneri (3,55), Cola griseiflora (3,10),
Diospyros iturensis (1,49), Chrysophyllum africanum,
Nesogordonia kabingaensis et Sorindeia mayombensis (1,02)
chacun, Pterygota bequaertii (0,99) et Zanthoxylum gilletii
(0,92) , Guarea thompsonii (0,87) et enfin les autres espèces
(10,79).
Ø La surface terrière des
familles
Le tableau 14 suivant présente les dix familles tops et
autres présentant une surface terrière
prépondérante pour chaque site.
Tableau 14 : Surface
terrière relative de dix familles tops et autres des différents
sites étudiés dans le Nord-est de la Réserve de
Biosphère de Luki.
Légende : Le rang dans la
classification des familles les mieux représentées dans chaque
site en surface terrière est indiqué entre parenthèse.
|
Familles
|
Site 1 (m²/4ha)
|
Site 2 (m²/2ha)
|
Site 3 (m²/2ha)
|
Site 4 (m²/ha)
|
|
Autres familles
Fabaceae/Caesalpinioideae
Malvaceae/Sterculiaceae
Fabaceae/Mimosoideae
Irvingiaceae
Sapotaceae
Burseraceae
Ebenaceae
Euphorbiaceae
Meliaceae
Myristicaceae
|
23,02 (1)
30,88 (2)
18,96 (3)
8,03 (4)
7,03 (5)
4,47 (6)
4,41 (7)
3,84 (8)
3,57 (9)
3,55 (10)
2,93 (11)
|
11,02 (1)
17,80 (2)
10,95 (4)
6,83 (5)
11,90 (3)
6,48 (6)
0
0
2,79 (10)
3,36 (9)
0
|
13,45 (1)
20,12 (2)
6,86 (3)
5,14 (5)
5,22 (4)
1,69 (11)
0
0
0
2,12 (7)
1,75 (9)
|
3,97 (1)
7,86 (2)
5,54 (3)
0
0
1,38 (7)
3,55 (4)
1,59 (5)
0
1,21 (8)
0,64 (11)
|
|
Olacaceae
Sapindaceae
Bombacaceae
|
0
0
0
|
4,77 (7)
4,48 (8)
2,77 (11)
|
1,75 (10)
0
0
|
0
0
0
|
|
Rubiaceae
Combretaceae
|
0
0
|
0
0
|
2,57 (6)
2,00 (8)
|
0,87 (10)
0
|
|
Anacardiaceae
Rutaceae
|
0
0
|
0
0
|
0
0
|
1,45 (6)
0,92 (9)
|
Le site1 présente une surface terrière totale de
110,7 m²/4ha dont la surface terrière moyenne est de 27,67
m²/ha avec 10 premières familles les plus
représentatives : Fabaceae/Caesalpinioideae (30,88),
Malvaceae/Sterculioideae (18,96), Fabaceae/Mimosoideae
(8,03), Irvingiaceae (7,03), Sapotaceae (4,47),
Burseraceae (4,41), Ebenaceae (3,84), Euphorbiaceae
(3,57), Meliaceae (3,55), Myristicaceae (2,93) et enfin les
autres familles (23,02).
Le site2 présente une surface terrière totale de
83,16 m²/2ha dont la surface terrière moyenne est de 41,58
m²/ha avec 10 premières familles les plus
représentatives : Fabaceae/Caesalpinioideae (17,80),
Irvingiaceae (11,90), Malvaceae/Sterculioideae (10,95),
Fabaceae/Mimosoideae (6,83), Sapotaceae (6,48),
Olacaceae (4,77), Sapindaceae (4,48), Meliaceae
(3,36), Euphorbiaceae (2,79), Bombacaceae (2,77) et enfin les
autres espèces (11,02).
Le site3 présente une surface terrière totale de
62,67 m²/2ha dont la surface terrière moyenne est de 31,34
m²/ha avec 10 premières familles les plus
représentatives : Fabaceae/Caesalpinioideae (20,12),
Malvaceae/Sterculioideae (6,86), Irvingiaceae (5,22),
Fabaceae/Mimosoideae (5,14), Rubiaceae (2,57),
Meliaceae (2,12), Combretaceae (2,00), Myristicaceae
et Olacaceae (1,75) chacune, Sapotaceae (1,69) et enfin les
autres familles (13,45).
Le site4 présente une surface terrière totale de
28,97 m²/ha dont la surface terrière moyenne est de 28,97
m²/ha avec 10 premières familles les plus
représentatives : Fabaceae/Caesalpinioideae (7,86),
Malvaceae/Sterculioideae (5,54), Burseraceae (3,55),
Ebenaceae (1,59), Anacardiaceae (1,45), Sapotaceae
(1,38) , Meliaceae (1,21), Rutaceae (0,92), Rubiaceae
(0,87), Myristicaceae (0,64) et enfin les autres familles
(3,97).
La surface terrière est calculée aussi pour
chaque relevé (placette), les valeurs obtenues auxquelles nous avons
ajouté les valeurs de D130. Le nombre de pieds et des
espèces sont données dans les tableaux 15 (Dépression),
tableau 16 (Pente) et tableau 17 (Crête) ci-dessous.
· La dépression (Bas de pente)
Tableau 15 : Valeurs
de D130 moyen, de la surface terrière, de nombre de pieds et de nombre
d'espèces pour la dépression dans les 12 relevés
réalisés.
|
Relevés
|
Surface cumulée (en ha)
|
D130 moyen (m)
|
ST (m2/ha)
|
Pieds (N)
|
Espèces
|
espèces cumulées
|
|
1
|
0,25
|
0,19
|
6,09
|
132
|
47
|
47
|
|
2
|
0,5
|
0,23
|
9,28
|
136
|
40
|
64
|
|
3
|
0,75
|
0,21
|
7,46
|
137
|
49
|
82
|
|
4
|
1
|
0,23
|
7,9
|
138
|
42
|
86
|
|
5
|
1,25
|
0,21
|
10,03
|
150
|
39
|
93
|
|
6
|
1,5
|
0,24
|
10,53
|
121
|
34
|
99
|
|
7
|
1,75
|
0,24
|
7,27
|
98
|
27
|
102
|
|
8
|
2
|
0,22
|
8,09
|
118
|
32
|
104
|
|
9
|
2,25
|
0,21
|
6,76
|
106
|
42
|
111
|
|
10
|
2,5
|
0,22
|
8,28
|
108
|
49
|
115
|
|
11
12
|
2,75
3
|
0,24
0,24
|
7,11
7,81
|
89
104
|
37
40
|
116
118
|
|
Moyenne
|
|
0,22
|
8,05
|
119,75
|
39,83
|
|
|
Ecart-type
|
|
0,016
|
1,31
|
18,97
|
6,72
|
|
|
CV (%)
|
|
7,23
|
16,35
|
15,84
|
0,16
|
|
En moyenne la surface terrière ramenée à
l'hectare est de 8,05 m2 pour 119,75 pieds moyens totalisant un
D130 moyen de 0,22 m. Le nombre d'espèces moyen
s'élève à 39,83 espèces. A partir de ce qui
précède, nous présentons dans la dépression, la
courbe aire-espèces qui exprime l'augmentation de nombre
d'espèces en fonction de la surface croissante (figure10)
La figure 10 représente la courbe aire-espèces,
les espèces s'accumulent par rapport à l'augmentation de la
surface d'inventaire.
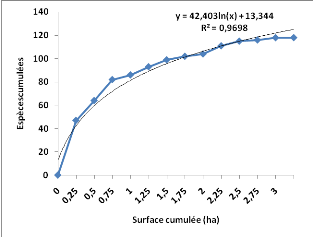
Figure 10 : La courbe aire-espèces de bas de
pente (complexe illuviale)
Cette courbe aire-espèces est régulière
car le coefficient de variation R2 est élevé (0,969),
ce qui montre que l'accumulation de nombre d'espèces augmente avec
l'augmentation de la surface d'inventaire. La courbe aire-espèces
illustrée par la figure 10 traduit l'augmentation du nombre
d'espèces en fonction de la superficie d'ensemble de
l'échantillonnage et elle est obtenue par le regroupement des ligneux
à dhp = 10 cm sur 0,25 ha et par l'ajout successif de cette superficie
pour atteindre 3 ha.
· La pente
Tableau 16 : Valeurs
de D130 moyen, de la surface terrière, de nombre de pieds et de nombre
d'espèces pour le complexe colluvial (pente) dans les 12 relevés
réalisés
|
Relevés
|
Surface cumulée (en ha)
|
D130 moyen (m)
|
ST (m2/ha)
|
Pieds (N)
|
Espèces
|
espèces cumulées
|
|
1
|
0,25
|
0,21
|
6,57
|
138
|
27
|
27
|
|
2
|
0,5
|
0,19
|
6,37
|
151
|
36
|
41
|
|
3
|
0,75
|
0,18
|
5,22
|
143
|
28
|
48
|
|
4
|
1
|
0,20
|
6,72
|
150
|
47
|
65
|
|
5
|
1,25
|
0,21
|
8,83
|
180
|
33
|
69
|
|
6
|
1,5
|
0,20
|
9,03
|
194
|
31
|
69
|
|
7
|
1,75
|
0,27
|
20,73
|
115
|
36
|
76
|
|
8
|
2
|
0,23
|
8,62
|
109
|
42
|
81
|
|
9
|
2,25
|
0,19
|
6,27
|
147
|
25
|
81
|
|
10
|
2,5
|
0,21
|
7,3
|
139
|
30
|
82
|
|
11
12
|
2,75
3
|
0,19
0,22
|
5,38
10,01
|
135
135
|
47
39
|
89
90
|
|
Moyenne
|
|
0,21
|
8,42
|
144,66
|
35,08
|
|
|
Ecart-type
|
|
0,02
|
4,16
|
23,69
|
7,46
|
|
|
CV (%)
|
|
11,55
|
49,42
|
16,37
|
0,21
|
|
En moyenne la surface terrière à l'hectare est
de 8,42 m2/ha au niveau de complexe colluvial (pente).
Les valeurs moyennes de diamètre, de nombre de pieds et
des espèces sont respectivement : 0,21 m, 144,66 et 35,08. La
courbe aire- espèce obtenue (figure 11) à partir des
données ci-haut est également régulière
(R2= 0,987) et confirme l'augmentation des espèces en
fonction de l'augmentation de la superficie d'inventaire.
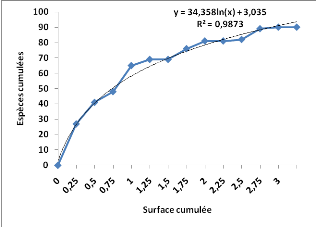
Figure 11 : La courbe aire espèce strate de
complexe colluvial (pente)
Cette courbe traduit l'augmentation du nombre d'espèces
en fonction de la superficie d'ensemble de l'échantillonnage et elle est
obtenue par le regroupement des ligneux à dhp = 10 cm sur 0,25 ha et par
l'ajout successif de cette superficie pour atteindre 3 ha.
· La crête
Tableau 17 : Valeurs
de D130 moyen, de la surface terrière, de nombre de pieds et de nombre
d'espèces pour le complexe éluvial (crête) dans les 12
relevés réalisés.
|
Relevés
|
Surface cumulée (en ha)
|
D130 moyen (m)
|
ST (m2/ha)
|
Pieds (N)
|
Espèces
|
espèces cumulées
|
|
1
|
0,25
|
0,20
|
6,81
|
143
|
42
|
42
|
|
2
|
0,5
|
0,19
|
6,3
|
145
|
32
|
54
|
|
3
|
0,75
|
0,21
|
7,8
|
145
|
30
|
60
|
|
4
|
1
|
0,22
|
7,8
|
135
|
40
|
68
|
|
5
|
1,25
|
0,21
|
5,8
|
130
|
44
|
78
|
|
6
|
1,5
|
0,21
|
6,9
|
147
|
37
|
80
|
|
7
|
1,75
|
0,22
|
6,5
|
124
|
30
|
80
|
|
8
|
2
|
0,19
|
6,9
|
160
|
29
|
81
|
|
9
|
2,25
|
0,22
|
7,5
|
141
|
42
|
86
|
|
10
|
2,5
|
0,25
|
10,4
|
134
|
41
|
94
|
|
11
12
|
2,75
3
|
0,22
0,24
|
6,4
8,4
|
123
104
|
38
41
|
99
103
|
|
Moyenne
|
|
0,21
|
7,29
|
135,91
|
37,16
|
|
|
Ecart-type
|
|
0,02
|
1,23
|
14,49
|
5,22
|
|
|
CV (%)
|
|
8,29
|
16,85
|
10,66
|
0,14
|
|
En moyenne la surface terrière à l'hectare est
de 7,29 m2/ha au niveau de complexe éluvial (crête).
Les valeurs moyennes de diamètre, de nombre de pieds et des
espèces sont respectivement : 0,21 m, 135,91 et 37,16. A partir de
ce qui précède, nous présentons dans la crête la
courbe aire-espèces qui exprime l'augmentation de nombre
d'espèces en fonction de la surface croissante (figure12).
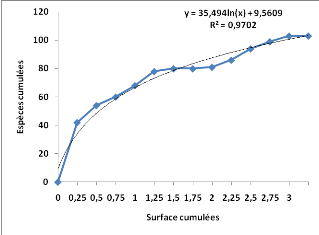
Figure 12 : La courbe aire espèce de complexe
éluvial (crête)
La courbe aire- espèce obtenue (figure 12) à
partir des données ci-haut est également régulière
(R2= 0,970) et confirme l'augmentation des espèces en
fonction de l'augmentation de la superficie d'inventaire. Cette courbe traduit
l'augmentation du nombre d'espèces en fonction de la superficie
d'ensemble de l'échantillonnage et elle est obtenue par le regroupement
des ligneux à dhp = 10 cm sur 0,25 ha et par l'ajout successif de cette
superficie pour atteindre 3 ha.
3.1.3. Distribution
diamétrique
La courbe aire- espèces est déterminée
lorsque la distribution des arbres par classes de diamètres, le nombre
d'espèces et le nombre d'individus sont bien définis. La
distribution de 4804 de ligneux à dhp = 10 cm est illustrée par
le tableau 18.
Tableau 18 :
Distribution des ligneux à dhp = 10 cm par classes diamétriques
sur 9 ha.
|
Distribution des ligneux à dhp = 10 cm par
classe diamétrique sur 9 ha
|
|
N°
|
Classes de diamètre
|
Nombre d'individus
|
Pourcentage
|
|
1
2
3
4
5
6
7
8
9
10
11
12
|
10-19
20-29
30-39
40-49
50-59
60-69
70-79
80-89
90-99
100-109
110-119
= 120
|
3092
929
327
193
93
63
27
30
21
12
2
15
|
64,36
19,34
6,81
4,02
1,94
1,31
0,56
0,62
0,44
0,25
0,04
0,31
|
|
Total
|
12
|
4804
|
100
|
La répartition des ligneux à dhp = 10 cm par
classes de diamètre présente une abondance des individus à
dhp compris entre 10 - 19 cm et une faible représentation des individus
à dhp supérieur ou égal à 120 cm.
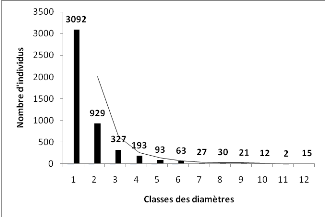
Figure 13 : Répartition des individus par classe
diamétrique pour le 9 ha.
Légende : 1 : (10-19)
cm ; 2 : (20-29cm) ; 3 : (30-39) cm ; 4 : (40-49)
cm ; 5 : (50-59) cm ; 6 : (60-69) cm ; 7 :
(70-79) cm ; 8 : (80-89) cm ; 9 : (90-99) ; 10 :
(100-109) cm ; 11 : (110-119) ; 12 : = 120 cm
On observe dans la figure 13 que les diamètres de tiges
présentent des différences considérables. Le graphique de
nombre de tiges en fonction de diamètres a une courbe ayant la forme de
i ou de J renversé. Les fréquences tiges pour le 9 ha sont plus
élevées dans les petits diamètres que dans les grands
diamètres ; c'est une caractéristique des forêts
naturelles. La courbe aire- espèces est déterminée lorsque
la distribution des arbres par classes de diamètres, le nombre
d'espèces et le nombre d'individus sont bien définis. La
distribution de 1632 ; 1437 et 1735 respectivement pour la crête, la
dépression et la pente de ligneux à dhp = 10 cm est
illustrée par le tableau 18.
Tableau 19 :
Distribution des ligneux à dhp = 10 cm par classes diamétriques
sur les différentes toposéquences.
|
CRETE
|
DEPRESSION
|
PENTE
|
|
N°
|
Classes (Cm)
|
Nbre d'indiv
|
Pourcentage
|
Nbre d'indiv
|
Pourcentage
|
Nbre d'indiv
|
Pourcentage
|
|
1
2
3
4
5
6
7
8
9
10
11
12
|
10-19
20-29
30-39
40-49
50-59
60-69
70-79
80-89
90-99
100-109
110-119
= 120
|
1012
337
114
81
38
24
8
8
4
3
1
2
|
62,01
20,65
7,00
4,96
2,33
1,47
0,49
0,49
0,24
0,18
0,06
0,12
|
937
242
107
55
23
21
10
16
12
6
1
7
|
65,21
16,84
7,45
3,83
1,60
1,46
0,70
1,11
0,83
0,41
0,07
0,49
|
1143
350
106
57
32
18
9
6
5
3
0
6
|
65,88
20,17
6,10
3,28
1,84
1,04
0,52
0,35
0,30
0,17
0
0,35
|
|
Total
|
12
|
1632
|
100
|
1437
|
100
|
1735
|
100
|
La répartition des ligneux à dhp = 10 cm par
classes de diamètre présente une abondance des individus à
dhp compris entre 10 - 19 cm et une faible représentation des individus
à dhp supérieur ou égal à 120 cm pour les
différentes toposéquences.
Figure 14 :
Répartition des individus par classe diamétrique pour les 3
toposéquences
Légende : C :
crête ; D : dépression ; P : pente
Légende : 1 : (10-19)
cm ; 2 : (20-29cm) ; 3 : (30-39) cm ; 4 : (40-49)
cm ; 5 : (50-59) cm ; 6 : (60-69) cm ; 7 :
(70-79) cm ; 8 : (80-89) cm ; 9 : (90-99) ; 10 :
(100-109) cm ; 11 : (110-119) ; 12 : = 120 cm
En analysant la figure 14, On observe que les diamètres
de tiges présentent des différences considérables. Le
graphique de nombre de tiges en fonction de diamètres a une courbe ayant
la forme de i ou de J renversé. Les fréquences tiges pour le 9 ha
sont plus élevées dans les petits diamètres que dans les
grands diamètres ; c'est une caractéristique des
forêts naturelles.
La forêt de pente a un nombre élevé de
tiges de classe de diamètre (10-19) cm par rapport aux forêts de
crête et de dépression. Au niveau de classe de diamètre
(20-29) cm, les forêts de pente et de crête ont presque le
même nombre de tiges. Tandis qu'au niveau de classe de diamètre =
120 cm, la forêt de pente a un nombre élevé de tiges de
cette catégorie. Ce résultat s'explique par la présence
des individus de gros diamètre des espèces au niveau des
dépressions.
Distribution des classes de
diamètre
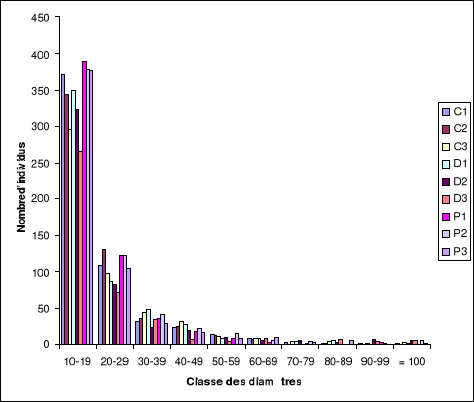
Figure 15 :
Répartition des ligneux à dhp = 10 cm par classe
diamétrique pour les différentes toposéquences
Légende : C (1, 2, 3) :
crête ; D (1, 2, 3) : dépression ; P (1, 2,
3) : pente
Partant de cette figure 15, la distribution des ligneux
à dhp = 10 cm par classes de diamètres nous montre que les
individus à dhp compris entre 10-19 cm sont les plus
représentés dans P1, suivi de ceux de P2, P3, C1 et de D1 et ceux
à dhp = 100 cm sont les moins nombreux, mais on observe un nombre
élevé d'individus de cette classe dans D2, D3 et P2 par rapport
à P3, C3, C1, D1, et P1 qui sont moins représentés. Ceci
indique une forte présence des espèces d'avenir, favorables
à la régénération de cette forêt.
Cette structure des individus de la forêt,
caractérisée par un grand nombre de petits individus, un petit
nombre d'individus de gros diamètre et une réduction
régulière du nombre d'individus d'une classe de diamètre
à une celle immédiatement supérieure s'observe
également dans les différentes toposéquences. Il ressort
de cette analyse que la population de la forêt étudiée est
une population stable. La tendance est presque la même pour toutes les
toposéquences : les nombres d'individus diminuent avec la taille de
diamètre. Il est à remarquer que les nombres d'individus de
petits diamètres restent élevés sur les pentes par rapport
aux autres toposéquences.
Les raisons qui militent pour la pente (effectif de petit
diamètre élevé) :
- projection des cimes des gros arbres sur les
pentes ;
- l'ouverture de la canopée occasionnée par la
chute des gros pieds sur la pente stimule la croissance et le
développement de jeunes individus.
3.1.4. L'abondance relative
3.1.4.1. L'abondance
relative des espèces
Nous présentons l'abondance relative des espèces
des différents sites des forêts étudiées.
Les cinq espèces abondantes du site 1 sont
illustrées à la figure 16.
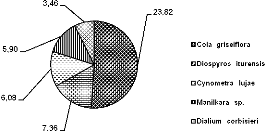
Figure 16 : Abondance relative des espèces des
forêts du site 1
L'abondance relative la plus élevée du site 1 de
la figure ci-dessus est observée au niveau de l'espèce Cola
griseiflora (23,82%), suivi de Diospyros iturensis (7,36%),
Cynometra lujae (6,08%), Manilkara sp. (5,90%) et enfin
Dialium corbisieri (3,46%).
Nous exposons dans la figure 17 l'abondance de quelques
espèces du site 2.
Les cinq espèces abondantes du site 2 sont
illustrées à la figure 17.
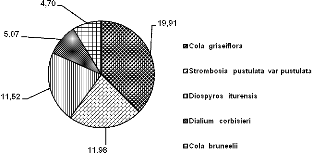
Figure 17 : Abondance relative des espèces des
forêts du site 2
L'abondance relative la plus élevée du site 2 de
la figure ci-dessus est observée au niveau de l'espèce Cola
griseiflora (19,91%), suivi de Strombosia pustulata var pustulata
(11,98%), Diospyros iturensis (11,52%), Dialium corbisieri
(5,07%),et enfin Cola bruneelii (4,70%).
Nous reprenons dans la figure 18 l'abondance de cinq
espèces tops du site 3
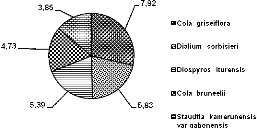
Figure 18 : Abondance relative des espèces des
forêts du site 3
L'abondance relative la plus élevée du site 3 de la
figure ci-dessus est observée au niveau de l'espèce Cola
griseiflora (7,92%), suivi de Dialium corbisieri (5,83%),
Diospyros iturensis (5,39%), Cola bruneelii (4,73) et enfin
Staudtia kamerunensis var gabonensis (3,85%).
Nous brossons dans la figure 19 l'abondance des familles les
plus représentatives du site 4
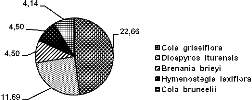
Figure 19 : Abondance relative des espèces des
forêts du site 4
L'abondance relative la plus élevée du site 4 de
la figure ci-dessus est observée au niveau de l'espèce Cola
griseiflora (22,66%), suivi de Diospyros iturensis (11,69%),
Brenania brieyi et Hymenostegia laxiflora (4,50%) chacune et
enfin Cola bruneelii (4,14%).
Nous présentons aussi l'abondance relative des
espèces des forêts des différents complexes.
Tableau 20 : Abondance relative des 10 espèces
tops recensées dans les forêts des différentes
toposéquences.
Légende 1 : Ab.Rel. :
Abondance relative ; C : crêtes ; P : pentes ;
D : dépression
Légende 2 : Le rang dans la
classification des espèces les mieux représentées en
abondance relative est indiqué entre parenthèse.
|
Espèces
|
Ab.Rel. C (%)
|
Ab.Rel. P (%)
|
Ab.Rel. D (%)
|
|
Cola griseiflora
Manilkara sp.
Cynometra lujae
Diospyros iturensis
Dialium corbisieri
Cola bruneelii
Hymenostegia laxiflora
Nesogordonia kabingaensis
Diospyros bipindensis
Isolona dewevrei
|
19,56 (1)
6,87 (2)
6,74 (3)
6,62 (4)
5,21 (5)
4,90 (6)
2,94 (7)
2,51 (8)
2,45 (9)
2,27
(10)
|
11,46
(2)
0
0
4,61
(4)
1,90
(9)
1,79
(10)
0
1,96
(8)
0
0
|
12,32
(1)
4,04
(5)
3,69
(6)
8,63
(2)
6,82
(4)
6,96
(3)
3,33
(7)
2,85
(8)
0
0
|
|
Strombosia pustulata var pustulata
Desbordesia glaucescens
Strombosiopsis tetandra
Mammea africana
Staudtia kamerunensis
|
0
0
0
0
0
|
29,26
(1)
4,61
(3)
3,46
(5)
2,88
(6)
2,71
(7)
|
0
0
0
0
0
|
|
Brenania brieyi
Dialium tessmannii
|
0
0
|
0
0
|
2,51
(9)
2,30
(10)
|
Il ressort de ce tableau que l'abondance relative la plus
élevée du complexe éluvial est observée au niveau
de l'espèce Cola griseiflora (19,56%), suivi de Manilkara
sp. (6,87%), Cynometra lujae (6,74%), Diospyros
iturensis (6,62%), Dialium corbisieri (5,21%), Cola
bruneelii (4,90%), Hymenostegia laxiflora (2,94%),
Nesogordonia kabingaensis (2,51%), Diospyros bipindensis
(2,45%) et enfin, Isolona dewevrei (2,27%). Au niveau de complexe
illuvial, Strombosa pustulata var pustulata est l'espèce la
plus représentée avec 12,32%, suivies de Cola
griseiflora (8,63%), Desbordesia glaucescens (6,96%),
Diospyros iturensis (6,82%), Strombosiopsis tetandra (4,04%),
Mammea africana (3,69%), Staudtia kamerunensis (3,55%),
Nesogordonia kabingaensis (2,85%), Dialium corbisieri
(2,51%), et enfin, Cola bruneelii (2,30%).
Tandis qu'au niveau de complexe colluvial, Cola
griseiflora (29,26%) est plus représenté suivis de
Diospyros iturensis (11,46%), Cola bruneelii et Dialium
corbisieri (4,61%) chacune, Manilkara sp. (3,46%), Cynometra
lujae (2,88%), Hymenostegia laxiflora (2,71%), Nesogordonia
kabingaensis (1,96%), Brenania brieyi (1,90%) et enfin,
Dialium tessmannii (1,79%).
Ø L'abondance
relative des familles
Nous vous présentons ici l'abondance des quelques
familles tops du site 1.
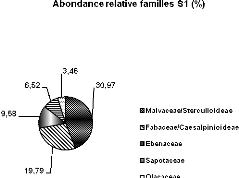
Figure 20 : Abondance relative des familles des
forêts du site 1
L'abondance relative la plus élevée du site 1 de
la figure ci-dessus est observée au niveau de la famille
Malvaceae/Sterculioideae (30,97%) suivi de
Fabaceae/Caesalpinioideae (19,79%), Ebenaceae (9,58%),
Sapotaceae (6,52%) et enfin d'Olacaceae (3,46%).
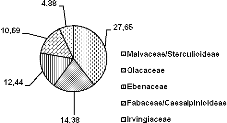
Figure 21 : Abondance
relative des familles des forêts du site 2 du Nord-est de la
Réserve de Biosphère de Luki.
L'abondance relative la plus élevée du site 2 de
la figure ci-dessus est observée au niveau de la famille de
Malvaceae/Sterculiaceae (27,65%) suivies de Olacaceae
(14,38%), Ebenaceae (12,44%), Fabaceae/Caesalpinioideae
(10,69%) et enfin de Irvingiaceae (4,88%).
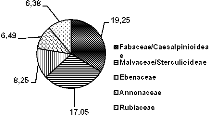
Figure 22 : Abondance relative des familles des
forêts du site 3
L'abondance relative la plus élevée du site 3 de
la figure ci-dessus est observée au niveau de la famille de
Fabaceae/Caesalpinioideae (19,25%), suivies de
Malvaceae/Sterculioideae (17,05%), Ebenaceae (8,25%),
Annonaceae (6,49%) et enfin de Rubiaceae (6,38%).
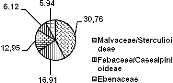
Figure 23 : Abondance relative des familles des
forêts du site 4
L'abondance relative la plus élevée du site 4 de
la figure ci-dessus est observée au niveau de la famille de
Malvaceae/Sterculioideae (30,76), suivies de
Fabaceae/Caesalpinioideae (16,91%), Ebenaceae (12,95%),
Anacardiaceae (6,12%) et enfin de Rubiaceae (5,94%).
Nous présentons également l'abondance relative
des familles des forêts des différents complexes.
Tableau 21 : Abondance relative des 10 familles tops
recensées dans les forêts des différentes
toposéquences.
Légende : Le rang dans la
classification des familles les mieux représentées en abondance
relative est indiqué entre parenthèse.
|
Familles
|
Ab.Rel. C (%)
|
Ab.Rel. P (%)
|
Ab.Rel. D (%)
|
|
Malvaceae/Sterculioideae
Fabaceae/Caesalpinioideae
Ebenaceae
Sapotaceae
Rubiaceae
Annonaceae
Clusiaceae/Guttiferaceae
Apocynaceae
Fabaceae/Mimosoideae
Anacardiaceae
|
28,20 (1)
22,75 (2)
9,14 (3)
7,66 (4)
4,84 (5)
3,99 (6)
2,39 (7)
2,33 (8)
2,33 (9)
2,21
(10)
|
36,98
(1)
16,94
(2)
12,67
(3)
4,09
(4)
3,97
(5)
2,88
(7)
2,53
(8)
0
0
3,74
(6)
|
16,94
(2)
12,67
(3)
4,09
(4)
0
1,96
(10)
2,19
(9)
2,88
(7)
0
0
0
|
|
Meliaceae
Olacaceae
|
0
0
|
2,19
(9)
1,96
(10)
|
2,53
(8)
36,98
(1)
|
|
Irvingiaceae
Myristicaceae
|
0
0
|
0
0
|
3,97
(5)
3,74
(6)
|
Il ressort de ce tableau que l'abondance relative la plus
élevée du complexe éluvial est observée au niveau
de la famille Malvaceae/Sterculioideae (28,20%), suivie de
Fabaceae / Caesalpinioideae (22,75%), Ebenaceae (9,14%),
Sapotaceae (7,66%), Rubiaceae (4,84%),
Annonaceae (3,99%),
Clusiaceae/Guttiferaceae (2,39%), Apocynaceae et
Fabaceae/Mimosoideae avec (2,33%) chacune et enfin, Anacardiaceae
(2,21%). Au niveau de complexe illuvial, Olacaceae (16,42%), la
famille la plus représentée, suivies de
Malvaceae/Sterculioideae (15,45%), Fabaceae/Caesalpinioideae
(11,55%) , Ebenaceae (8,98%) , Irvingiaceae
(7,31%), Myristicaceae (5,29%),
Clusiaceae/Guttiferaceae (5,22%),
Meliaceae (5,22%) , Annonaceae
(3,90%), et enfin, Rubiaceae (3,41%). Tandis qu'au niveau de complexe
colluvial, Malvaceae/Sterculioideae (36,98%) est plus
représenté suivis de, Fabaceae/Caesalpinioideae
(16,94%), Ebenaceae (12,67%), Sapotaceae
(4,09%), Rubiaceae (3,97%),
Anacardiaceae (3,74%), Annonaceae
(2,88%), Clusiaceae/Guttiferaceae (2,53%), Meliaceae (2,19%)
et enfin, Olacaceae (1,96%).
3.1.5. La dominance relative
Ø La dominance relative des
espèces
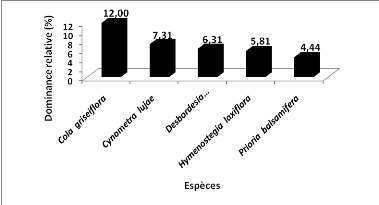
Figure 24 : Dominance relative des espèces de
forêt du site 1
La figure ci-dessus nous montre que la dominance relative la
plus élevée est observée au niveau de l'espèce
Cola griseiflora (12,00%), suivies des espèces de Cynometra
lujae (7,31%), Desbordesia glaucescens (6,31%),
Hymenostegia laxiflora (5,81%) et enfin de Prioria
balsamifera (4,44%).
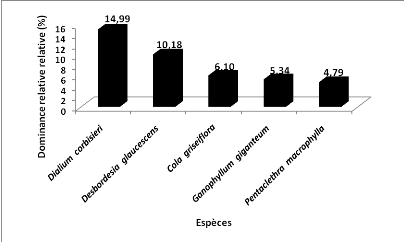
Figure 25 : Dominance relative des espèces de
forêt du site 2
La figure ci-dessus nous montre que la dominance relative la
plus élevée est observée au niveau de l'espèce
Dialium corbisieri (14,99%), suivies des espèces de
Desbordesia glaucescens (10,18%), Cola griseiflora
(6,10%), Ganophyllum giganteum (5,34%) et enfin Pentaclethra
macrophylla (4,79%).
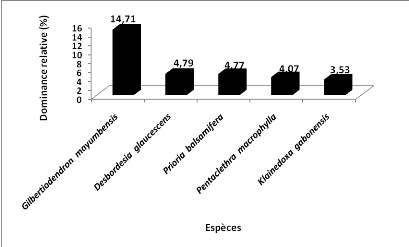
Figure 26 : Dominance relative des espèces de
forêt du site 3
La figure ci-dessus nous montre que la dominance relative la
plus élevée est observée au niveau de l'espèce
Gilbertiodendron mayumbensis (14,71%), suivies des espèces de
Desbordesia glaucescens (4,79%), Prioria balsamifera
(4,77%), Pentaclethra macrophylla (4,07%) et enfin de Klainedoxa
gabonensis (3,58%).
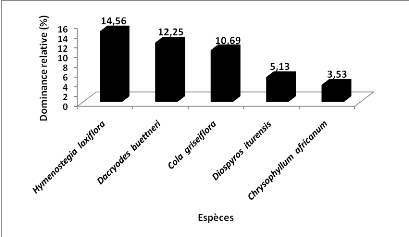
Figure 27 : Dominance relative des espèces de
forêt du site 4
La figure ci-dessus nous montre que la dominance relative la
plus élevée est observée au niveau de l'espèce
Hymenostegia laxiflora (14,56%) suivies des espèces de
Dacryodes buettneri (12,25%), Cola griseiflora (10,69%),
Diospyros iturensis (5,13%) et enfin de Chrysophyllum africanum
(3,53%).
Tableau 22 :
Dominance spécifique dans les différents complexes dans le
Nord-est de la Réserve de Biosphère de Luki.
Légende 1 : Dom.Rel. :
Dominance relative ; C : crêtes ; P : Pentes ;
D : dépressions
Légende 2 : Le rang dans la
classification des espèces les mieux représentées en
dominance relative est indiqué entre parenthèse.
|
Espèces
|
Dom.Rel. C (%)
|
Dom.Rel. P (%)
|
Dom.Rel. D (%)
|
|
Cola griseiflora
Cynometra lujae
Prioria balsamifera
Hymenostegia laxiflora
Dialium corbisieri
Dacryodes buettneri
Tessmannia africana
Newtonia glandulifera
Nesogordonia kabingaensis
Pentaclethra macrophylla
|
9,09 (1)
7,06 (2)
5,52 (3)
4,78 (4)
4,71 (5)
3,93 (6)
3,66 (7)
3,58 (8)
3,09 (9)
2,93
(10)
|
13,95
(1)
2,72
(10)
3,33
(9)
7,00
(2)
3,76
(7)
4,76
(3)
0
0
4,13
(5)
3,66
(8)
|
2,86
(8)
0
0
0
0
0
0
0
0
2,97
(6)
|
|
Diospyros iturensis
Ganophyllum giganteum
|
0
0
|
4,34
(4)
3,92
(6)
|
0
0
|
|
Desbordesia glaucescens
Gylbertiodendron mayumbensis
Strombosia pustulata var pustulata
Chrysophyllum africanum
Klainedoxa gabonensis
Ceiba pentandra
Staudtia kamerunensis
Trichilia gilgiana
|
0
0
0
0
0
0
0
0
|
0
0
0
0
0
0
0
0
|
17,12
(1)
9,53
(2)
5,45
(3)
4,90
(4)
3,55
(5)
2,87
(7)
2,63
(9)
2,41
(10)
|
Il ressort de ce tableau que la dominance relative la plus
élevée du complexe éluvial est observée au niveau
de l'espèce Cola griseiflora (9,09%), suivi de Cynometra
lujae (7,06%), Prioria balsamifera (5,52%), Hymenostegia
laxiflora (4,78%), Dialium corbisieri (4,71%), Dacryodes
buettneri (3,93%), Tessmannia africana (3,66%), Newtonia
glandulifera (3,58%), Nesogordonia kabingaensis (3,09%), et
enfin, Pentaclethra macrophylla (2,93%)
.
Au niveau de complexe illuvial, Desbordesia
glaucescens est l'espèce la plus représentée avec
17,13%, suivies de Gilbertiodendron mayumbensis
(9,53%), Strombosia pustulata var pustulata (5,45%),
Chrysophyllum africanum (4,90%), Klainedoxa gabonensis
(3,55%), Pentaclethra macrophylla (2,97%), Ceiba pentandra
(2,87%), Cola griseiflora (2,86%), Staudtia kamerunensis
(2,63%), et enfin, Trichilia gilgiana (2,41%). Tandis qu'au niveau de
complexe colluvial, Cola griseiflora (13,95%) est plus
représenté suivis de Hymenostegia laxiflora (7,00%),
Dacryodes buettneri (4,76%), Diospyros iturensis (4,34%),
Nesogordonia kabingaensis (4,13%), Ganophyllum giganteum
(3,92%), Dialium corbisieri (3,76%), Pentaclethra
macrophylla (3,66%), Prioria balsamifera (3,33%), et enfin,
Cynometra lujae (2,72%).
Ø Dominance relative des familles
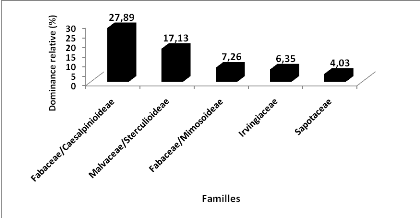
Figure 28 : Dominance relative des familles de
forêt du site 1
La figure 28, nous montre que la dominance relative la plus
élevée est observée au niveau de la famille de
Fabaceae/Caesalpinioideae (27,89%), suivies des familles
Malvaceae/Sterculioideae (17,13%), Fabaceae/Mimosoideae
(7,26%), Irvingiaceae (6,35%) et enfin de Sapotaceae
(4,03%).
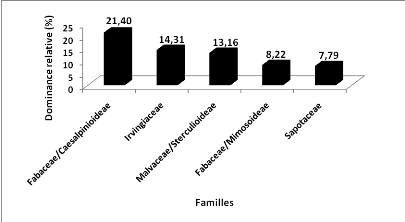
Figure 29 : Dominance relative des familles de
forêt du site 2
La figure ci-dessus nous montre que la dominance relative la
plus élevée est observée au niveau de la famille de
Fabaceae/Caesalpinioideae (21,40%), suivies des familles Irvingiaceae (14,31%),
Malvaceae/Sterculioideae (13,16%), Fabaceae/Mimosoideae (8,22%), et enfin de
Sapotaceae (7,79%).
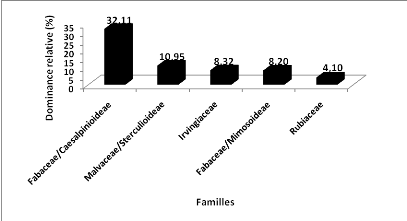
Figure 30 : Dominance relative des familles de
forêt du site 3
La figure 30, nous montre que la dominance relative la plus
élevée est observée au niveau de la famille de
Fabaceae/Caesalpinioideae (32,11%), suivies des familles
Malvaceae/Sterculioideae (10,95%), Irvingiaceae (8,32%),
Fabaceae/Mimosoideae (8,20%), et enfin de Rubiaceae
(4,10%).
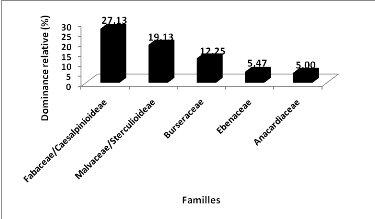
Figure 31 : Dominance
relative des familles de forêt du site 4
La figure 31, nous montre que la dominance relative la plus
élevée est observée au niveau de la famille de
Fabaceae/Caesalpinioideae (27,13%), suivies des familles
Malvaceae/Sterculioideae (19,13%), Burseraceae (12,25%),
Ebenaceae (5,47%), et enfin d'Anacardiaceae (5,00%).
Tableau 23 :
Dominance relative des familles dans les différents complexes du
Nord-est de la Réserve de Biosphère de Luki
Légende 1 : Dom.Rel :
Dominance relative ; C : crêtes ; P : pentes ;
D : dépressions
Légende 2 : Le rang dans la
classification des familles les mieux représentées en dominance
relative est indiqué entre parenthèse.
|
Familles
|
Dom.Rel. C (%)
|
Dom.Rel. P (%)
|
Dom.Rel. D (%)
|
|
Fabaceae/Caesalpinioideae
Malvaceae/Sterculioideae
Fabaceae/Mimosoideae
Burseraceae
Rubiaceae
Sapotaceae
Ebenaceae
Anacardiaceae
Meliaceae
Annonaceae
|
30,19 (1)
15,81 (2)
9,25 (3)
4,35 (4)
3,93 (5)
3,25 (6)
3,09 (7)
2,84 (8)
2,78 (9)
2,62
(10)
|
24,24
(1)
22,87
(2)
8,80
(3)
4,99
(4)
2,79
(10)
4,98
(5)
4,66
(6)
3,05
(9)
3,93
(8)
0
|
19,08
(2)
7,78
(4)
4,58
(6)
0
0
6,83
(5)
0
0
4,35
(8)
0
|
|
Sapindaceae
|
0
|
4,01
(7)
|
0
|
|
Irvingiaceae
Olacaceae
Euphorbiaceae
Myristicaceae
Bombacaceae
|
0
0
0
0
0
0
|
0
0
0
0
0
0
|
20,72
(1)
7,90
(3)
4,38
(7)
4,23
(9)
2,87
(10)
|
Il ressort de ce tableau que la dominance relative la plus
élevée du complexe éluvial est observée au niveau
de la famille Fabaceae/Caesalpinioideae (30,19%), suivie de
Malvaceae / Sterculioideae (15,81%), Fabaceae/Mimosoideae
(9,25%), Burseraceae (4,35%),
Rubiaceae (3,93%), Sapotaceae (3,25,%),
Ebenaceae (3,09%), Anacardiaceae (2,84%),
Meliaceae (2,78%) et enfin, Annonaceae (2,62%). Au niveau de
complexe illuvial, Irvingiaceae (20,72%), la famille
la plus représentée, suivies de
Fabaceae/Caesalpinioideae (19,08%), Olacaceae (7,90%),
Malvaceae/Sterculioideae (7,78%), Sapotaceae (6,83%),
Fabaceae/Mimosoideae (4,58%), Euphorbiaceae (4,38%),
Meliaceae (4,35%), Myristicaceae (4,23%), et enfin,
Bombacaceae(2,87%). Tandis qu'au niveau de complexe colluvial,
Fabaceae/Caesalpinioideae (24,24%), est plus représenté
suivis de Malvaceae/Sterculioideae (22,87%),
Fabaceae/Mimosoideae (8,80%), Burseraceae
(4,99%), Sapotaceae (4,98%),
Ebenaceae (4,66%), Sapindaceae
(4,01%), Meliaceae (3,93%),
Anacardiaceae (3,05%), et enfin, Rubiaceae
(2,79%).
Diversité relative des familles
La manière la plus simple d'aborder la diversité
floristique est la richesse des taxons. Cependant, ce paramètre reste
indicatif du fait qu'il est influencé par la taille de
l'échantillon. A l'échelle locale, bien que les tailles de
parcelles soient différentes, la richesse spécifique n'est pas
significativement différente entre les types d'inventaires. Ce
résultat est confirmé par la richesse spécifique
standardisée. Les fluctuations significatives de richesse
spécifique sont observées d'une part, dans l'ensemble des arbres
dominés, où les individus atteignent exceptionnellement des dbh
de 30 cm, et d'autre part dans l'ensemble des arbres émergents
faiblement représenté dans les petites classes de
diamètres. La richesse spécifique de l'ensemble des arbres
dominants est la plus élevée et elle ne diffère pas
significativement d'un inventaire à l'autre. La faible richesse
d'espèces émergentes dans les petites classes de diamètre
est compensée par la faible richesse d'espèces dominées
dans les grandes classes de diamètre, c'est donc l'ensemble des arbres
dominants qui influence significativement la richesse spécifique (Kouob
B., 2009).
Tableau 24 : Diversité relative de 10 familles
les plus représentées de 9 ha dans le Nord-est de la
Réserve de Biosphère de Luki.
|
Familles
|
Nombre d'espèces
|
Diversité rel (%)
|
|
Fabaceae/Caesalpinioideae
|
17
|
11,97
|
|
Annonaceae
|
11
|
7,75
|
|
Meliaceae
|
11
|
7,75
|
|
Anacardiaceae
|
8
|
5,63
|
|
Euphorbiaceae
|
8
|
5,63
|
|
Fabaceae/Mimosoideae
|
8
|
5,63
|
|
Malvaceae/Sterculioideae
|
7
|
4,93
|
|
Moraceae
|
7
|
4,93
|
|
Sapotaceae
|
7
|
4,93
|
|
Clusiaceae/Guttiferaceae
|
6
|
4,23
|
La famille de Fabaceae/Caesalpinioideae est la plus
diversifiée avec 17 espèces, soit 11,97%. Elle suivie par les
familles des Annonaceae et des Meliaceae, 11
espèces chacune, soit 7,75% ; Anacardiaceae,
Euphorbiaceae et Fabaceae/Mimosaceae, 8 espèces
chacune, soit 5,63% ; Malvaceae/Sterculioideae, Moraceae
et Sapotaceae, 7 espèces chacune, soit 4,93%et enfin de
Clusiaceae/Guttiferaceae, 6 espèces, soit 4,23%.
Fréquence relative des espèces
Tableau 25 : Fréquence relative des 10
espèces les plus représentées dans le 9 ha du Nord-est de
la Réserve de Biosphère de Luki.
|
Espèces
|
Fréquence relative (%)
|
|
Aidia ochroleuca
|
1,41
|
|
Aidia stanerana Aff micrantha
|
1,41
|
|
Carapa procera
|
1,41
|
|
Cola bruneelii
|
1,41
|
|
Cola griseiflora
|
1,41
|
|
Cynometra lujae
|
1,41
|
|
Dialium corbisieri
|
1,41
|
|
Dialium tessmannii
|
1,41
|
|
Diospyros bipindensis
|
1,41
|
|
Diospyros iturensis
|
1,41
|
Il ressort de ce tableau que les 10 espèces :
Aidia ochroleuca, Aidia stanerana Aff micrantha, Carapa procera, Cola
bruneelii, Cola griseiflora, Cynometra lujae, Dialium corbisieri, Dialium
tessmannii, Diospyros bipindensis et Diospyros iturensis sont
représentées avec 1,41% chacune.
Importance relative des espèces
Tableau 26 : Importance relatives des espèces
dans 9 ha
|
Espèces
|
Importance relative (%)
|
|
Cola griseiflora
|
36,35
|
|
Diospyros iturensis
|
15,74
|
|
Dialium corbisieri
|
9,72
|
|
Cynometra lujae
|
9,27
|
|
Strombosia pustulata var pustulata
|
9,20
|
|
Cola bruneelii
|
8,09
|
|
Desbordesia glaucescens
|
7,26
|
|
Manilkara sp.
|
7,24
|
|
Hymenostegia laxiflora
|
7,08
|
|
Nesogordonia kabingaensis
|
6,75
|
Pour ce qui est de l'importance générale des
taxons, l'indice le plus élevé est observé auprès
de Cola griseiflora (36,35%). Viennent ensuite Diospyros
iturensis (15,74%), Dialium corbisieri (9,72%), Cynometra
lujae (9,27%), Strombosa pustulata var pustulata (9,20%),
Cola bruneelii (8,09%), Desbordesia glaucescens (7,26%),
Manilkara sp (7,24%), Hymenostegia laxiflora (7,08%) et
Nesogordonia kabingaensis (6,75%)
Importance relative des familles
Tableau 27 : Importances relatives des familles dans 9
ha du Nord-est de la Réserve de Biosphère de Luki.
|
Familles
|
Importance relatives (%)
|
|
Fabaceae/Caesalpinioideae
|
53,59
|
|
Malvaceae/Sterculioideae
|
47,82
|
|
Ebenaceae
|
16,58
|
|
Fabaceae/Mimosoideae
|
14,95
|
|
Sapotaceae
|
14,61
|
|
Meliaceae
|
14,45
|
|
Annonaceae
|
13,53
|
|
Irvingiaceae
|
13,43
|
|
Olacaceae
|
11,63
|
|
Anacardiaceae
|
10,71
|
Pour ce qui est de l'importance générale des
familles, l'indice le plus élevé est observé auprès
de la famille de Fabaceae/Caesalpinioideae (53,59%), suivies des
familles de Malvaceae/Sterculioideae (47,82%), Ebenaceae
(16,58%), Fabaceae/Mimosoideae (14,95%), Sapotaceae
(14,61%), Meliaceae (14,45%), Annonaceae (13,53%),
Irvingiaceae (13,43%), Olacaceae (11,63%) et Anacardiaceae
(10,71%).
3.2.
Analyse floristique par toposéquence
Pour ce point, nous présentons la richesse floristique
par toposéquence pour caractériser chaque maillon de la
toposéquence (complexes : éluvial, colluvial, illuvial) sous
forme de tableau de type suivant :
Tableau 28 : Nombre
d'espèces dans les différents sites étudiés selon
la toposéquence.
|
Site 1
|
Site 2
|
Site 3
|
Site 4
|
|
Complexe éluvial (crête)
|
81
|
_
|
83
|
_
|
|
Complexe colluvial (pente)
|
65
|
67
|
_
|
63
|
|
Complexe illuvial (dépression)
|
88
|
67
|
78
|
_
|
Il ressort de ce tableau que les complexes illuvial et
éluvial sont plus représentatifs en termes d'espèces (88
et 81) par rapport au complexe colluvial (65) dans le site1, tandis que les
complexes colluvial et illuvial ont le même nombre d'espèces (67)
dans le site2 mais le complexe éluvial ne répondait pas aux
normes du protocole. Dans le site3, les complexes éluvial et illuvial
sont plus représentatifs en termes d'espèces (83 et 78) mais le
complexe colluvial n'était pas installé. Enfin, dans le site4, le
complexe colluvial a 63 espèces tandis que les 2 autres complexes
étaient déjà complétés dans d'autres
sites.
3.3.
Analyse des caractéristiques quantitatives des peuplements forestiers
par site et par toposéquence
Pour ce point, nous présentons de façon
succincte l'abondance, la densité, la surface terrière sous forme
de tableau comparatif.
Tableau 29 : Tableau
comparatif des résultats relatifs à l'abondance, densité
et surface terrière des différents sites étudiés du
Nord-est de la Réserve de Biosphère de Luki.
Légende: S1: Site 1, S2: Site 2, S3:
Site 3, S4: Site 4
|
Caractéristiques
|
S1 (ha)
|
S2 (ha)
|
S3 (ha)
|
S4 (1ha)
|
|
1. Nombre de pieds/Site
|
563,5
|
542,5
|
454,5
|
556
|
|
Nombre de pieds/ha
|
564
|
543
|
455
|
556
|
|
2. Densité spécifique (espèces/ha)
|
70
|
67
|
81
|
63
|
|
3.0. Surface terrière moyenne par site (m²/ha)
|
27,68
|
36,80
|
31,34
|
28,97
|
|
3.1. Surface terrière par maillon/ha (crête)
|
27,53
|
_
|
32,68
|
_
|
|
3.2. Surface terrière par maillon/ha (pente)
|
24,89
|
37,67
|
_
|
28,97
|
|
3.3. Surface terrière par maillon/ha
(dépression)
|
30,75
|
35,95
|
29,99
|
_
|
Il ressort de ce tableau que le site 1 représente un
nombre élevé d'individus (563,5 pieds/ ha), suivi de site 4 (556
pieds/ ha), ensuite de site 2 (542,5 pieds/ ha) et enfin de site 3 (454,5
pieds/ ha). Du point de vue densité (nombre d'espèces/ha), le
site 3 présente une densité élevée (81
espèces), suivi de site 1 (70 espèces), ensuite de site 2 (67
espèces), enfin de site 4 (63 espèces). Par ailleurs, le site 2
présente une surface terrière élevée (36,80
m²/ha), suivi de site 3 (31,34 m²/ha), ensuite de site 4 (28,97
m²/ha) et enfin de site 1 (27,68 m²/ha).
Dans le site 1, la crête a présenté une
surface terrière de 27,53 m²/ha, la pente 24,89 m²/ha et la
dépression (bas de pente) 30,75 m²/ha. Pour le site 2, la
crête n'a pas été prise en compte, la pente par contre a
présenté une surface terrière élevé (37,67
m²/ha), alors que le bas de pente a donné une surface
terrière de 35,95 m²/ha. Au niveau de site 3, la crête a
fourni une surface terrière de 32,68 m²/ha, la pente n'a pas
été prise en compte, alors que la dépression a
présenté une surface terrière de 29,99 m²/ha. Enfin,
au site 4, la pente a fourni une surface terrière de 28,97 m²/ha.
La crête et la dépression n'ont été prises en
compte.
3.4.
Analyse de la diversité floristique (spécifique) des sites et
toposéquences
Il est important de comparer la diversité ou richesse
spécifique au niveau des sites et des toposéquences pour
déduire des convergences et divergences. Les résultats
chiffrés sont présentés dans le tableau ci-dessous en
recourant les indices de Shannon et de Simpson couramment utilisés dans
ce genre des travaux à cause de leur pertinence.
Tableau 30 : Calcul
des valeurs moyennes des indices de diversité pour chacun de Sites au
sein de différents groupements du Nord-est de la Réserve de
Biosphère de Luki.
|
Indices
|
Site 1
|
Site 2
|
Site 3
|
Site 4
|
|
Richesse
|
113
|
87
|
107
|
63
|
|
Individus
|
2254
|
1086
|
909
|
556
|
|
Shannon
|
3,465
|
3,279
|
4,002
|
3,245
|
|
Pielou
|
0,733
|
0,734
|
0,856
|
0,783
|
|
Simpson
|
0,922
|
0,921
|
0,972
|
0,920
|
|
Fisher _ alpha
|
25,05
|
22,61
|
31,51
|
18,27
|
Ce tableau donne les valeurs de l'indice de Shannon les plus
élevées dans les sites 1et 3. Ce qui montre que les groupements
décrits au sein de ces sites sont plus diversifiés en
espèces que ceux d'autres sites. La valeur la plus faible a
été enregistrée dans le site 4 compte tenu de ses
groupements à faible richesse spécifique.
Quant à l'indice de régularité de
Piélou, il montre une bonne équitabilité entre les
groupements étudiés, car les valeurs obtenues sont toutes
élevées et voisines de 1. Etant indépendant de la taille
de l'échantillon, la valeur supérieure est obtenue dans le site
3, alors que les plus faibles sont obtenues dans les sites1 et 2.
L'indice de Simpson quant à lui, démontre que la
diversité de ces différents sites n'est pas tellement variable,
car les valeurs obtenues présentent des petites différences
seulement.
L'indice de diversité alpha de Fisher tient compte
principalement d'espèces et de nombre total de pied. Cet indice
comparé entre les sites varie entre 18,27 et 31,51 avec une moyenne de
24,36 ; le site 3 apparait le plus diversifié tandis que le site 4
est le moins diversifié.
Tableau 31 : Calcul
des valeurs moyennes des indices de diversité pour chacune des
toposéquences au sein de différents groupements du Nord-est de la
Réserve de Biosphère de Luki.
Légende : C (1,2 et 3) :
Crêtes; P (1, 2 et 3) : Pentes, D (1, 2 et 3) :
Dépressions
|
Indices
|
C1
|
|
C3
|
P1
|
P2
|
P3
|
D1
|
D2
|
D3
|
|
Richesse
|
67
|
62
|
83
|
65
|
67
|
63
|
87
|
66
|
78
|
|
Individus
|
568
|
561
|
502
|
581
|
599
|
556
|
543
|
487
|
407
|
|
Shannon
|
3,047
|
3,154
|
3,708
|
2,719
|
3,125
|
3,245
|
3,700
|
3,046
|
3,864
|
|
Pielou
|
0,725
|
0,764
|
0,839
|
0,651
|
0,743
|
0,783
|
0,829
|
0,727
|
0,887
|
|
Simpson
|
0,894
|
0,923
|
0,960
|
0,815
|
0,905
|
0,920
|
0,960
|
0,900
|
0,971
|
|
Menhinick
|
2,811
|
2,618
|
3,704
|
2,655
|
2,778
|
2,672
|
3,734
|
2,991
|
3,866
|
|
Margalef
|
10,41
|
9,637
|
13,19
|
9,898
|
10,48
|
9,809
|
13,66
|
10,5
|
12,81
|
|
Fisher_alpha
|
19,74
|
17,81
|
28,33
|
18,36
|
19,74
|
18,27
|
29,26
|
20,6
|
28,66
|
Ce tableau donne les valeurs de l'indice de Shannon les plus
élevées dans les D3, D1et C3. Ce qui montre que les groupements
décrits au sein de ces toposéquences sont plus diversifiés
en espèces que celles d'autres toposéquences. La valeur la plus
faible a été enregistrée dans P1 compte tenu de ses
groupements à faible richesse spécifique. Quant à l'indice
de régularité de Piélou, il montre une bonne
équitabilité entre les groupements étudiés, car les
valeurs obtenues sont toutes élevées et voisines de 1. Etant
indépendant de la taille de l'échantillon, la valeur
supérieure est obtenue dans D 3, alors que la plus faible est obtenue
dans P1. L'indice de Margalef est un indice qui indique si la richesse
spécifique d'une toposéquence est élevée ou non. Il
en ressort que les valeurs élevées sont obtenues dans D1 et C3,
alors que la faible se rencontre dans . Ce qui démontre bien la
dominance de D1 sur les autres en termes de richesse spécifique.
L'indice de Simpson quant à lui, démontre que la
diversité de ces différentes toposéquences n'est pas
tellement variable, car les valeurs obtenues présentent des petites
différences seulement.
Par contre, l'indice de Menhinick, étant basé
sur la richesse en espèces, a présenté une valeur
nettement élevée dans D3 où le nombre d'individus est
relativement faible (407/ha), mais dans les 8 toposéquences, il est
dominant dans D1 et faible dans . En le comparant (Menhinick) à celui de
Margalef, on constate que les deux indices évoluent de la même
manière. On observe les valeurs les plus élevées des
indices de Menhinick et de Margalef dans D3 et D1, par contre les valeurs
faibles des indices de Menhinick et de Margalef sont observées dans .
L'indice de diversité alpha de Ficher tient compte
principalement d'espèces et de nombre total de pied. Cet indice des
valeurs comparées entre les toposéquences varie de 17,81 à
29,26 avec une moyenne de 22,31 ; la dépression 1 apparait la plus
diversifiée tandis que la crête 2 est la moins diversifiée.
3.5.
Analyse des coefficients de similitude floristique au niveau des sites et
toposéquence
Afin d'établir des ressemblances ou des
différences entre les compositions floristiques des sites et des
toposéquences susceptibles d'établir ou de rejeter la
communauté ou l'exclusion des relevés comparés, nous avons
utilisé le coefficient de Morisita -Horn [=NNESS(K=1)], ce coefficient a
l'avantage de donner l'affinité entre les sites et les
toposéquences entre eux.
Ces coefficients de similitude de communauté
floristique permettent d'approcher les relevés ayant un nombre
d'espèces communes et de considérer de tels relevés comme
représentant un seul type de forêt ou, dans le cas contraire de
les séparer, chacun constituant un type de forêt différente
de l'autre. Ces coefficients sont calculés deux par deux dans un
tableau.
Les résultats obtenus sont repris dans le tableau
ci-dessous.
Tableau 32 :
Coefficient de similitude de Morisita des sites du Nord-est de la
Réserve de Biosphère de Luki.
|
Site 1
|
Site 2
|
Site 3
|
Site 4
|
|
Site1
|
1,000000
|
0,86431
|
0,65493
|
0,95252
|
|
Site2
|
0,86431
|
1,000000
|
0,67561
|
0,87329
|
|
Site3
|
0,65493
|
0,67561
|
1,000000
|
0,65278
|
|
Site4
|
0,95255
|
0,87329
|
0,65278
|
1,000000
|
Il s'agit de coefficient de similarité de Morisita dont
il a été question dans ce travail. Ce coefficient est
fréquemment utilisé dans les travaux de phytosociologie et permet
d'exprimer l'existence d'une communauté entre deux formations
végétales comparées entre-elles. Il existe une seule
communauté végétale entre les différents sites.
Tableau 33 :
Coefficient de similitude de Morisita pour les toposéquences du Nord-est
de la Réserve de Biosphère de Luki.
|
D1
|
D2
|
D3
|
P1
|
P2
|
P3
|
C1
|
|
C3
|
|
D1
|
1,000000
|
0,72643
|
0,68484
|
0,33245
|
0,55127
|
0,54338
|
0,38899
|
0,42768
|
0,61133
|
|
D2
|
0,72643
|
1,000000
|
0,42244
|
0,50123
|
0,61703
|
0,61091
|
0,49243
|
0,4694
|
0,47579
|
|
D3
|
0,68484
|
0,42244
|
1,000000
|
0,30231
|
0,43535
|
0,4949
|
0,38171
|
0,45335
|
0,57509
|
|
P1
|
0,33245
|
0,50123
|
0,30231
|
1,000000
|
0,82244
|
0,84898
|
0,89559
|
0,79793
|
0,50942
|
|
P2
|
0,55127
|
0,61703
|
0,43535
|
0,85244
|
1,000000
|
0,92637
|
0,84402
|
0,84739
|
0,75956
|
|
P3
|
0,54338
|
0,61091
|
0,4949
|
0,84898
|
0,92637
|
1,000000
|
0,90049
|
0,89203
|
0,69776
|
|
C1
|
0,38899
|
0,49243
|
0,38171
|
0,89559
|
0,84402
|
0,90049
|
1,000000
|
0,9262
|
0,59536
|
|
0,42768
|
0,4694
|
0,45335
|
0,79793
|
0,84739
|
0,89203
|
0,9262
|
1,000000
|
0,6685
|
|
C3
|
0,61133
|
0,47579
|
0,57509
|
0,50942
|
0,75956
|
0,69776
|
0,59536
|
0,6685
|
1,000000
|
Les tableaux 33 nous ont permis d'établir le
dendrogramme et de définir les types de forêts. En comparant les
différentes toposéquences du point de vue coéfficient de
similarité, D1 forme une même communauté
végétale avec D2, D3, P2, P3 et C3, leurc valeurs sont
supérieurs à 0,5 ; D1 et les trois autres
toposéquences (P1, C1 et ) forment des communautés
végétales différentes. D2 forme une même
communauté végétale avec D1, P1, P2 et P3 mais il ne forme
pas une même communauté végétale avec D3, C1, et
C3. D3 forme une même communauté avec D1 et P3, il n'est pas une
même communauté avec D2, P1, P2, P3, C1 et . P1 est une même
communauté avec D2, P2, P3, C1, et C3, et ne forme pas une même
communauté avec D1 et D3. P2 forme une même communauté avec
D1, D2, P1, P3, C1, et C3, il n'est pas une même communauté
végétale avec D3. P3 forme une même communauté
végétale avec D1, D2, P1, P2, C1, et C3, il ne forme pas une
même communauté végétale avec D3. C1 forme une
même communauté végétale avec P1, P2, P3, et C3, il
est différent de D1, D2 et D3. forme une même communauté
végétale avec P1, P2, P3, C1 et C3, il n'est pas similaire
à D1, D2 et D3. C3 forme une similarité avec D1, D3, P1, P2, P3,
C1 et , il n'est pas similaire à D2.
3.6.
Analyse de classification et d'ordination
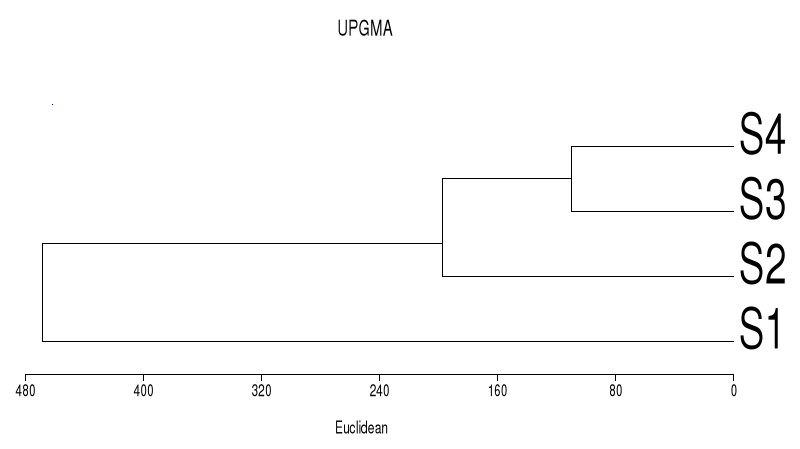
Figure 32 :
Dendrogramme regroupant les sites selon leur similarité floristique en
termes de leur abondance (Logiciel MVSP, données d'incidence).
En observant ce dendrogramme, la première subdivision
comporte deux grands groupements végétaux, dont le premier
composé de S4, S3, S2 et le second de S1. Le premier groupement se
subdivise en deux sous-groupements, dont le premier est constitué de S4
et S3 présentant des similitudes quant à leurs compositions
floristiques (abondance espèce, basée sur le nombre d'individus
par espèce) et le second avec S2. Ces différents sites forment
trois communautés végétales.
I 1
II
6
5
4
3
2
1
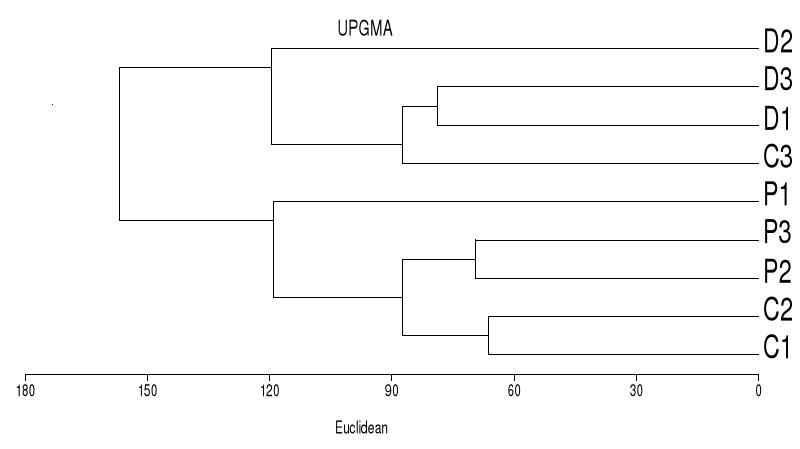
Figure 33 :
Dendrogramme regroupant les toposéquences selon leur similarité
floristique en termes de leur abondance (Logiciel MVSP, données
d'incidence).
En tenant compte du nombre d'espèces en commun
(données d'incidence), on remarque que les toposéquences les plus
proches dans l'espace, présentent de grandes ressemblances. Ces
toposéquences présentent également des similitudes quant
à leurs compositions floristiques (données d'abondance,
basées sur le nombre d'individus par espèce).
Pour les différentes toposéquences, le
dendrogramme permet de déceler dès la base 2 grands
groupes : un constitué uniquement des D2, D3, D1 et C3 et un autre
constitué des P1, P3, P2, et C1. Ce dendrogramme présente six
communautés végétales : D2 ; D3 et D1 ;
C3 ; P1 ; P3 et P2 ; et C1.
Donc, ce dendrogramme forme six groupements
végétaux :
- le groupement de bas de pente à Strombosia
pustulata var pustulata et Desbordesia glaucescens (Bas de pente
2) ;
- le groupement de bas de pente à Desbordesia
glaucescens et Strombosia pustulata var pustulata et à
Gilletiodendron mayumbensis (Bas de pente 1 et 3) ;
- le groupement de crête à Cola
griseiflora et Dialium corbisieri (Crête 3).
- le groupement de pente à Cola griseiflora
et Diospyros iturensis (Pente 1) ;
- le groupement de pente à Dialium corbisieri et
Cola griseiflora et à Hymenostegia laxiflora (Pente 2 et
3) ;
- le groupement de crête à Cola
griseiflora et Cynometra lujae et à Manilkara sp. (Crête 1
et 2).
1.5
-1.5
-1.5
2.0
D1
D2
D3
P1
P2
P3
C1
C3
D1
D2
D3
P1
P2
P3
C1
I
II
2
1
3
4
5
6
![]()
Figure 34 : DCA pour
les différentes toposéquences (Logiciel CANOCO), données
d'abondance.
La DCA réalisée pour les différentes
toposéquences montre deux grands groupements végétaux,
composés des 6 sous groupements végétaux qui sont
similaires entre eux. En effet on remarque que les toposéquences les
plus proches spécifiquement et géographiquement présentent
des ressemblances et forment des entités floristiques communes.
La DCA (Detrended Correspondance Analysis) appliquée
sur les différentes toposéquences a permis de rassembler la
forêt du Nord-est de la Réserve de Biosphère de Luki
à six groupements végétaux :
- le groupement de bas de pente à Strombosia
pustulata var pustulata et Desbordesia glaucescens (Bas de pente
2) ;
- le groupement de bas de pente à Desbordesia
glaucescens et Strombosia pustulata var pustulata et à
Gilletiodendron mayumbensis (Bas de pente 1 et 3) ;
- le groupement de crête à Cola
griseiflora et Dialium corbisieri (Crête 3).
- le groupement de pente à Cola griseiflora
et Diospyros iturensis (Pente 1) ;
- le groupement de pente à Dialium corbisieri et
Cola griseiflora et à Hymenostegia laxiflora (Pente 2 et
3) ;
- le groupement de crête à Cola
griseiflora et Cynometra lujae et à Manilkara sp. (Crête 1
et 2).
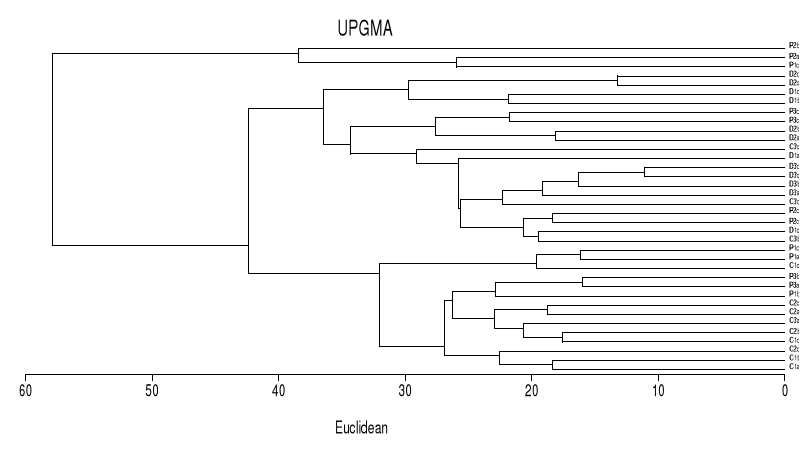
Figure 35 :
Dendrogramme regroupant les relevés selon leur similarité
floristique en termes de leur abondance pour les différentes stations
(Logiciel MVSP, données d'incidence).
En tenant compte du nombre d'espèces en commun
(données d'incidence), on remarque que les relevés les plus
proches dans l'espace, présentent de grandes ressemblances. Ces
relevés présentent également des similitudes quant
à leurs compositions floristiques (données d'abondance,
basées sur le nombre d'individus par espèce).
Pour les différents relevés, le dendrogramme
permet de déceler dès la base 2 grands groupes : un
constitué uniquement des P2b, P2a et P1c et un autre constitué
des autres relevés. Ce dendrogramme présente deux
communautés végétales.
3.7.
Déterminisme de l'hétérogénéité
environnemental sur la composition floristique
-0.6
0.8
-1.5
1.0
Teneur en eau
Sable
Limon
Argile
Altitude
D1
D2
D3
P1
P2
P3
C1
C3
![]()
Figure 36 : Diagramme
d'ordination de la CCA pour la zone étudiée avec les
données d'analyse de sol
Figure... : Diagramme d'ordination de la CCA pour
l'ensemble des relevés avec les données d'analyse de
sol
Légende : C (1, 2, 3) :
crêtes (1, 2, 3) ; P (1, 2, 3) : pentes (1, 2, 3) ; D (1,
2, 3) : dépressions (1, 2, 3)
Dans les paragraphes précédents nous avions
caractérisé les variations de la composition floristique avec les
facteurs du milieu de manière indirecte. Pour une analyse directe, nous
avons réalisé une Analyse Canonique des Correspondances (CCA en
anglais), les axes d'ordination étant contraints par les variables
environnementales mesurées sur le terrain. L'ordination indirecte
confirme la démarcation entre les différents types forestiers.
La figure 36 montre les différentes corrélations
des relevés en fonction des variables environnementales prises en
considération. L'argile, le sable et l'altitude sont
corrélés à D3, P3, C1, et C3, tandis que le limon et la
teneur en eau sont corrélés à leurs tours à D1,
D2, P1 mais P2 n'est pas corrélé à aucun
paramètre.
Après test statistique en utilisant l'ANOVA à
plusieurs variables, on constate qu'il ya une différence significative
entre les complexes par rapport à l'argile, sable, ph et teneur en eau,
le plus value est inférieur à 0,05, donc ces paramètres
influencent sur la composition floristique des différents complexes et
jouant un rôle important. Tandis que par rapport à l'altitude et
au limon, nous observons qu'il n'y a pas de différence significative, le
plus value est supérieur à 0,05, le limon et l'altitude ne jouent
pas un rôle important dans la composition floristique de chaque complexe.
Donc il ya les paramètres qui influent sur la composition floristique et
ceux qui n'influent pas.
Ø Données structurales sur la
station
Afin de pouvoir analyser de manière objective les liens
entre paramètres environnementaux, flores (diversité) et
végétations (groupements végétaux), il est
nécessaire de procéder à un minimum d'observations visant
à caractériser autant que possible les conditions stationnelles
des relevés botaniques réalisés.
Il existe un grand nombre de paramètres
environnementaux mesurables et observables sur le terrain. Etant donné
les moyens dont nous disposions, il n'était de toute façon pas
possible de réaliser le maximum des paramètres et de les analyser
de manière plus poussée.
De manière générale, nous avons
opté pour des paramètres macroécologiques, facilement et
rapidement identifiables directement sur le terrain sans appareillage
sophistiqué. Un effort a été réalisé afin
d'obtenir dans chaque complexe les paramètres environnementaux (argile,
sable, limon, ph, teneur en eau et altitude), ces échantillons du sol
ont été prélevés à l'aide d'une
tarière et soumis à l'analyse granulométrique
réalisée au laboratoire de pédologie de la faculté
des sciences agronomiques de l'Université de Kinshasa et dont les
résultats sont présentés au tableau 7 à l'annexe
2.
QUATRIEME CHAPITRE : DISCUSSION
4.1.
Composition floristique globale
Le but du présent chapitre est de rechercher les
différences ou les ressemblances en termes de diversité entre nos
inventaires et ceux effectués dans d'autres régions. A cet effet,
seuls les individus à D130 = 10 cm sont pris en compte.
La composition floristique globale obtenue pour nos recherches
(4804 individus à D130 =10 cm, appartenant à 142
espèces, 110 genres et 35 familles avec une densité moyenne de
534 pieds/ha) est similaire à celle obtenue par plusieurs travaux de
recherches réalisés en forêt dense humide en RDC et en
Afrique en général, à savoir :
- Lubini, (1997), trouve à Luki, 236 espèces/ha,
réparties en 52 familles dans la forêt à Prioria
balsamifera ; 328 espèces/ha regroupées en 55 familles
dans la forêt à Ganophyllum giganteum et Staudtia
stipitata ; 234 espèces/ha réparties en 48 familles
dans la forêt à Gilletiodendron kisantuense, etc.
- Lomba, (2007) trouve, dans la Réserve
forestière de Yoko, 2770 pieds/5ha à D130 = 10 cm
appartenant à 183 espèces, regroupées en 37 familles avec
une densité moyenne de 506 pieds/ha ;
- Nshimba, (2008), obtient dans sa thèse, 2534
individus/5ha à D130 = 10 cm, appartenant à 183
espèces, 131 genres et 44 familles avec une densité moyenne de
506 pieds/ha ;
- Boyemba (2006) a inventorié 410 pieds,
regroupés dans 87 espèces, reparties en 65 genres et 26 familles
sur une superficie totale de 1,2 ha, ces résultats paraissent assez
faibles dans la perspective d'une analyse intercontinentale de la richesse
spécifique.
- Terry & al. (2004), obtiennent dans le Parc
National de Mbe (au Gabon), une densité de 539 pieds/ha, 97,6
espèces et surface terrière de 37,23 m²/ha.
Whitmore (1990), Morley (2000) et Doucet (2003) mentionnent
des richesses spécifiques pouvant atteindre près de 300
espèces (D130 = 10 cm) sur 1 ha en Amérique du Sud et
711 espèces (dhp = 10 cm) sur 6,6 ha en Asie tropicale.
Cette richesse spécifique relativement
élevée en Amérique ou en Asie est d'autant plus
attestée du fait d'une très forte
hétérogénéité (Sabatier & Prevost, 1989)
et de densité de pieds à l'hectare parfois plus
élevées sur les autres continents (Rollet, 1974).
Il est convenable de relativiser une telle richesse
observée en Asie et en Amérique, ainsi la pauvreté des
forêts tropicales africaines. Ce seraient aussi des arguments
paléoclimatiques, lesquels se sont traduits par des phases
d'aridité, qui expliqueraient cette pauvreté toute relative
(Schnell, 1976, Doucet, 2003).
Ces chiffres ci-haut montrent une analogie assez frappante
avec nos données. L'analyse comparative de la diversité entre la
flore étudiée dans le présent travail et celle d'autres
sites se heurte à quelques difficultés dont certaines aient
été déjà soulevées par LEJOLY (2003),
SENTERRE (2005) et NGOK (2000).
Parmi ces difficultés, on
énumère :
Ø Les méthodes d'inventaires, l'aire
d'échantillonnage et les délimitations des formations
végétales qui sont loin d'êtres similaires et parfois
totalement différentes d'un auteur à l'autre. Ceci pourrait,
s'expliquer par le fait que les objectifs visés par chacune de ces
études sont très différentes ;
Ø La rigueur dans le processus d'identification des
plantes. En effet, dans le présent travail, cette étape a
été importante pour atteindre les objectifs assignés.
4.2.
Richesse floristique des sites étudiés
Nous allons comparer la richesse floristique, la
densité et la surface terrière des différents sites
étudiés : le plus riche en nombre d'espèces et le
moins riche.
Le site 1 a une densité moyenne de 563,5 pieds/ha, 112
espèces appartenant à 32 familles et occupant une surface
terrière moyenne de 27,68 m²/ha ; le site 2 a
présenté une densité moyenne de 542,5 pieds/ha, 87
espèces groupées à 26 familles et ayant une surface
terrière de 36,80 m²/ha ; le site 3 par contre a une
densité moyenne de 454,5 pieds/ha, 107 espèces réunies
à 30 familles et recouvrant 31,34 m²/ha de surface
terrière; le site 4 donne une densité moyenne de 556 pieds/ha,
63 espèces appartenant à 26 familles et une surface
terrière moyenne de 28,97 m²/ha.
Du point de vue densité moyenne par site, le site1 a
une densité élevée de 563,5 pieds/ha par rapport aux
autres sites et la faible densité est remarquée dans le site3
avec 454,5 pieds/ha.
En ce qui concerne la richesse spécifique, le site1 a
un nombre d'espèces élevé par rapport aux autres et le
faible nombre d'espèces s'observe au niveau de site4 avec 63
espèces. Le site1 a un nombre élevé de familles (32) par
rapport aux autres, les sites2 et 4 ont moins des familles (26). Enfin, le site
2 présente une surface terrière moyenne élevée
(36,80 m²/ha) par rapport aux autres mais la faible surface
terrière moyenne est observée au site1 (27,68 m²/ha).
Nous avons remarqué que le site1 est plus
diversifié, a une densité moyenne élevée à
l'hectare et un nombre élevé des familles, suite à son
éloignement du village Mbondo et a un relief très
accidenté empêchant les gens à y pénétrer et
la plupart des individus se retrouvent dans la classe de diamètre 1 et 2
, voilà ce qui justifie sa faible surface terrière par rapport
aux trois autres sites.
Il est important de signifier que dans l'ensemble de 142
espèces recensées dans le dispositif, 52 espèces sont
communes à tous les quatre sites étudiés. Cependant 90
autres espèces n'existent chacune dans trois ou deux sites selon la
répartition suivante :
- 19 espèces communes dans trois sites (S1, S2 et
S3) ;
- 5 espèces communes dans les deux sites (S1 et
S2) ;
- -15 espèces communes au niveau de sites 1 et
3 ;
- 4 espèces communes au niveau de sites 1 et
4 ;
- 2 espèces communes et 1 espèce non
identifié dans les sites 1, 3 et 4 ;
- 2 espèces communes au niveau de sites 2 et 3 et enfin
2 espèces communes dans les sites 3 et 4.
Il est nécessaire de signaler que vue les
caractéristiques propres de chaque entité, la répartition
des espèces présentées ci-dessous, ne concerne que la
forêt (site) que cette étude a ciblée et ne peut forcement
être enregistrer dans d'autres forêts (site) et sur les mêmes
supports colonisables.
Le tableau 34 présente les espèces propres
(différentielles) à chaque site.
Tableau 34 : Espèces propres
(différentielles) à chaque site du Nord-est de la Réserve
de Biosphère de Luki.
|
Site 1 (4 ha)
|
Site 2 (2ha)
|
Site 3 (2 ha)
|
Site 4 (1 ha)
|
|
Albizia gummiferaBarteria nigritiana Blighia unijugata
Bombax buonopozense Caesalpinia sp. Canarium schweinfurthii Croton
sylvaticus Diospyros sp.Enanthia affinis Erythroxylum mannii Garcinia
epunctataIrvingia sp.Lovoa trichilioides Pouteria aningeria Sterculia
bequaertii
|
Aningeria robustaCeiba pentandra Dialium angolense
Discoglipremna caloneuraEntandrophragma candollei Erythrophleum suaveolens
Fillaeopsis discophora Pteleopsis hylodendron Trema orientalis Trichilia
degeana
|
Anthonotha pynaertii Bosqueia buonopozense
Entandrophragma cylindricum Gilbertiodendron mayumbensisMilicia excelsa
Mimusops heckeli Strombosiopsis glaucescens Tabernaemontana crassa Tapura
fischeri Tetrapleura tetraptera Trichoscypha odonii Trilepisium
madagascarienseChytranthus macrobotrys
|
Oncoba welwitschii Uapaca guinensis
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
La lecture du tableau 34 montre qu'en termes des
espèces propres, le site 3 est plus diversifié par rapport au
site 2 constituant chacun 2 ha. Les types de forêts étudiés
dans les différents sites appartiennent aux groupes systématiques
des Magnoliophyta, cette assertion corrobore avec celle de Lubini
(1997).
Les résultats des dendrogrammes réalisés
confirment les DCA (Detrended correspondence analysis); la
similarité des sites 3 et 4 semble être liée au type de
support colonisable (argile), les sites 1 et 2 sont deux communautés
différentes, ils ne sont pas similaires aux autres sites, par contre
site 2 est proche des sites 3 et 1. En tenant compte du nombre de
données d'abondance, basées sur le nombre d'individus, la DCA
appliqué sur les sites de forêts étudiées en trois
ensembles :
- les groupements à Cola griseiflora et
Diospyros iturensis (S1 et S2),
- les groupements à Cola griseiflora et
Strombosia pustulata var pustulata,
- les groupements à Cola griseiflora et
Dialium corbisieri.
Lisingo (2009), les ordinations et classifications
réalisées dans son travail, l'ont permis dans l'ensemble de
distinguer deux grands groupes de forêts : un groupe sur sol sableux
et un autre sur sol argileux.
Nshimba (2008), par les mêmes ordinations à
identifié trois grands groupes dans la végétation de
l'île Mbiye près de Kisangani : la forêt sur terre
ferme au sein de laquelle il définit 3 groupements, la forêt
périodiquement inondée où deux groupements sont
individualisés et la forêt marécageuse dans laquelle on
retrouve trois groupements. Les gradients discriminatoires principaux à
la base de ce regroupement sont l'hygrométrie, l'anthropisation, la
sécheresse et la variation de niveau d'eau du fleuve,
l'écosystème étudié étant insulaire.
Kouob (2009) dans son étude sur les groupements
végétaux des strates arborescentes des forêts matures de
terre ferme de la Réserve de Biosphère de Dja au Cameroun a
défini 5 groupements dont le déterminisme de
l'hétérogénéité est dicté par les
principales variables ci-après : l'altitude, les pentes, le sable
et l'indice de continentalité.
Senterre (2001) dans son étude typologique dans les
forêts littorales de Guinée équatoriale et continentales
dans le mont Cameroun en a défini 10 communautés
végétales dont le déterminisme de
l'hétérogénéité végétale
était dicté par la pluviosité, l'Hygrométrie
(mesurée par le taux de recouvrement des Bryophytes sur les arbres),
l'altitude et la distance à l'océan.
Kouka (2005), par les mêmes ordinations dans son
étude floristique des forêts du Parc d'Odzala (Congo-Brazzaville),
l'ont permis de rassembler les forêts en trois ensembles :
- les forêts de l'ouest, possédant la
diversité la plus élevée et caractérisées
par un groupement à Plagiostyles africana et Coelocaryon
preussii ;
- les forêts du centre-sud, dominées par un
groupement à Pausinystalia macroceras et Dialium
pachyphyllum ;
- les forêts du nord-est, les moins diversifiées,
caractérisées par un groupement à Keayodendron
bridelioides et Markhamia tomentosa.
4.3.
Diversité spécifique des différents complexes
étudiés
Selon Frontier & Pichod-Viale, cité par Nshimba
(2008) la diversité des éléments d'une communauté
est une grande qualité qui s'impose à l'analyse.
La notion de diversité comprend deux aspects :
· le nombre de catégories
d'éléments, nombre de taxons distincts et on parle de
diversité spécifique pour les espèces et de
diversité générique pour les genres ;
· la régularité, qui est la manière
selon laquelle les individus se répartissent entre les
différentes catégories des taxons.
Ainsi, la méthode de mesure de diamètres
utilisée dans ce travail a permis d'inventorier 4804 individus dont le
D130 = 10 cm parmi lesquels 142 espèces appartenant à
110 genres et 35 familles ont été obtenues.
Cependant, la comparaison qui est faite dans les lignes qui
suivent est établie en considérant, en ce qui concerne les
complexes (éluvial, colluvial et illuvial), c'est seulement les arbres
à diamètre supérieur ou égal à 10 cm qui ont
été recensés.
Concernant la diversité en général, il
ressort du tableau 35 que les dépressions ont produit 117 espèces
appartenant à 30 familles et 94 genres, alors que les pentes montrent 90
espèces regroupées à 27 familles et 74 genres, enfin les
crêtes ont données 103 espèces appartenant à 30
familles et 80 genres.
Tableau 35 : Comparaison de la richesse
spécifique et générique pour les différents
complexes du Nord-est de la Réserve de biosphère de Luki.
|
Complexes
|
Espèces
|
Genres
|
Familles
|
|
Crêtes
|
103
|
80
|
30
|
|
Pentes
|
90
|
74
|
27
|
|
Dépressions
|
117
|
94
|
30
|
Les aspects relatifs à la diversité
spécifique ont été en grande partie traités dans le
chapitre de résultats. Nous avons montré les différences
entre complexes (crêtes, pentes et bas de pentes) et sommes
arrivés à la conclusion suivante : le complexe illuvial
(dépression) est plus diversifié en espèces par rapport
aux autres complexes en se référant au tableau 36 qui donne les
indices de chaque complexe.
Tableau 36 :
Comparaison des richesses spécifiques et des valeurs des indices de
diversité entre les différents complexes du Nord-est de la
Réserve de Biosphère de Luki.
Légende : RBL :
Réserve de Biosphère de Luki
|
Pays(Site) Relevé (ou layon)
surface IS H E
Rs p
|
|
RDC (RBL) Crête 1 ha
0,93 3,30 0,78 71
Pente 1 ha
0,88 3,03 0,73 65
Dépression 1
ha 0,94 3,54 0,81 77
RDC(Ubundu) Diversité totale 1,2 ha
0,969 5,637 0,875 87
|
|
Gabon Biliba1 2,5 ha
75, 144 4,681 0,905 175
Biliba 3 2,5 ha
52,821 4,451 0,885 153
Biliba 2 2,5 ha
53, 605 4, 481 0,878 166
|
|
Guinée Equatoriale Mont Alen 2, 5 ha
- - - 239
|
|
Cameroun Dja Djolimpoum 4 2, 5 ha -
- - 196
Dja Mékas 1 2,
5 ha - - -
171
|
|
RCA Ngotto L C 1 2,5 ha
- - - 147
|
|
Congo Odzala Mbandza 1 2,5 ha -
- - 146
Odzala Mbandza 2 2,5 ha
- - - 96
|
Ce tableau nous renseigne que la dépression est plus
diversifiée avec moins d'individus en petit diamètre, et tous
les indices (Shannon, Piélou, Simpson, Menhinick, Margalef et Fisher
alpha) donnent la valeur supérieure au complexe illuvial par rapport aux
autres complexes.
Quoiqu'il en soit, si la richesse spécifique des
forêts d'Afrique centrale est généralement moindre que
celle des autres continents, elle demeure cependant remarquable dans le
contexte africain car elle est beaucoup plus élevée que celle
d'Afrique de l'Ouest (Jones, 1956 ; Reitsma, 1988).
D'une manière générale, nos inventaires
figurent parmi les plus diversifiés si on doit considérer le
rapport en fonction de superficie. C'est en République Centrafricaine et
surtout en République du Congo que la diversité semble la moins
élevée. Elle est cependant plus élevée en
guinée Equatoriale. En confrontant les coefficients de diversité
entre les différents complexes on constate que parfois les complexes les
plus riches ne sont pas les plus diversifiés.
Il est important de signifier que dans l'ensemble de 142
espèces recensées dans le dispositif, 70 espèces sont
communes à tous les trois complexes étudiés. Cependant 72
autres espèces n'existent chacune dans trois ou deux sites selon la
répartition suivante :
- 14 espèces communes dans les deux complexes
(crête et dépression) ;
- 8 espèces communes dans les deux complexes
(crête et pente) ;
- 6 espèces communes au niveau de deux complexes (pente
et dépression);
Il est nécessaire de signaler que vue les
caractéristiques propres de chaque complexe, il existe des
espèces communes et différentielles (propres) à chaque
type des complexes. Le tableau 37 présente les espèces
propres (différentielles) à chaque complexe.
Tableau 37 :
Espèces propres (différentielles) à chaque complexe du
Nord-est de la Réserve de Biosphère de Luki.
|
CRETE
|
PENTE
|
DEPRESSION
|
|
Blighia unijugata Bombax buonopozense Dialium
sp.Entandrophragma cylindricum Garcinia epunctata Maesopsis eminii Milicia
excelsa Pteleopsis hylodendron Sterculia bequaertii Tapura fischeri
Trichoscypha odonii
|
Aningeria robustaCaesalpinia sp. Erythrophleum
suaveolens Fillaeopsis discophoraOncoba welwitschii Uapaca guinensis
|
Anonidium manniiAnthonotha pynaertiiBarteria
nigritianaBosqueia buonopozense Ceiba pentandra Chytranthus
macrobotrysCleistopholis patensCroton sylvaticus Dialium angolenseDiospyros
sp.Discoglipremna caloneuraEnanthia affinis Entandrophragma
candolleiErythroxylum manniiGilbertiodendron dewevrei Quassia undulata
(syn.Hannoa klaineana) Irvingia sp.Lovoa trichilioides Mimusops
heckeli Pouteria aningeria Tabernaemontana crassa Tetrapleura tetraptera
Treculia africana Trema orientalis Trichilia degeana (= T. splendida)
Trilepisium madagascariense
|
|
|
|
|
|
|
|
|
|
|
|
La lecture de ce tableau montre qu'en termes d'espèces
propres, le bas de pente est plus diversifié par rapport aux
crêtes et pentes.
D'après les observations, les dépressions semble
plus riche en individus en gros diamètres et moins riche en individus en
petits diamètres par rapport aux crêtes et pentes. Cette
hypothèse est similaire et différente à celle des autres
chercheurs d'autres pays :
- Heinsdijk (1957) en Amazonie brésilienne, a
trouvé que les pentes semblent plus riches en individus en petits
diamètres et moins riches en gros diamètres que les plateaux et
distingue les forêts d'après leur position topographique (hauts de
pente, bas de pente, plateaux élevés) ;
- De Milde et Groot (1970), ont distingués en Guyane,
divers types de forêts : les forêts sur terrains
vallonnés et sur collines élevées ne semblent pas
présenter des structures totales très différentes, par
contre, les forêts riveraines et sur terrasses latéritiques ont de
plus faibles densités de tiges, en particulier entre 20 et 29 cm de
diamètre ;
- Les différences d'altitude (environ 400 m) du massif
de l'Imataca en Guyane Vénézuélienne, semblent trop
faibles pour provoquer des différences notables de structure totale. Les
fortes (= 30%) ont un peu moins de tiges à l'hectare que les pentes
moyennes ou faibles (Rollet, 1969) ;
- White (1963) démontre que le nombre total des tiges
augmente quand on passe de 600 à 900 m d'altitude à Porto-
Rico ;
- Pierlot (1966) a publié des inventaires
effectués au Zaïre (R.D.C) entre 450 et 2200 m d'altitude, ne
semble qu'il ait des gradients bien nets des structures totales avec
l'altitude. Par contre, dans le sud-ouest du Nigeria, c'est seulement sur les
crêtes élevées et étroites que les peuplements sont
bas et sans gros diamètres : ridge forests de Ray (1971). A
l'inverse, Wyatt-Smith (1960), indique qu'il ya un plus grand nombre des tiges
à l'unité de surface sur les crêtes que sur les pentes ou
bas de pentes en Malaisie. La tendance à l'augmentation du nombre
réside en fonction d'altitude, si elle existe reste assez faible
d'après les données d'Arnot (1934) en Malaisie.
- Veillon (1965) semble être un des rares auteurs qui
ait eu les soucis d'étudier la variation des principales
caractéristiques des certains types des forêts non
perturbées situées à des altitudes progressivement
croissantes (50 parcelles de 0,5 ha échelonnées entre 70 et 3250
m d'altitude) dans les Andes au Venezuela. Le nombre des arbres de
diamètre = 20 cm par parcelle augmente assez progressivement ; il
passe de 52 à 138 tiges entre 70 et 1590 m d'altitude puis il subit
quelque fluctuation en passant par un maximum relatif de 123 tiges à
1940 m ; il atteint un maximum de 168 tiges à 2160 m d'altitude et
tombe brusquement à 71 tiges à 3250 m ;
- Plusieurs auteurs dont Ashton (1958), Robbins et Wyatt-Smith
(1964) pour la péninsule de Malaisie, Schmid (1958) pour l'Asie du
sud-est ; Mangenot (1955) pour la Côte d'Ivoire mettent l'accent sur
l'importance des facteurs édaphiques pour les forêts de terre
ferme, sans méconnaitre la prépondérance des climats
régionaux. Dans le cas de ces forêts de terre ferme, on note en
effet les différences physionomiques et floristiques entre forêts
sur sol à dominance argileuse et sol à dominance
sablonneuse ; ces dernières paraissent relativement mal venantes et
moins riches en espèces.
Les résultats obtenus par le dendrogramme (figure 33)
réalisé confirment les DCA (Detrended correspondence
analysis) ; la similarité des complexes des dépressions 3
et 1 ; pentes 3 et 2 ; crêtes 2 et 1 semble être
liée aux différents paramètres (argile, sable, teneur en
eau et altitude), les complexes (dépression 2, crête 3 et pente 1)
sont des communautés différentes. En tenant compte du nombre de
données d'abondance, basées sur le nombre d'individus, la DCA
appliquée sur les complexes des forêts étudiées du
Nord-est de la Réserve de Biosphère de Luki permet de distinguer
six groupements végétaux avec leurs espèces
caractéristiques et Lubini (1997) dans son travail trouve aussi six
groupements végétaux qui sont représentés au
tableau 38 et 39.
Tableau 38 :
Comparaison de la composition floristique de chaque groupement
végétal du Nord-est de la Réserve de Biosphère de
Luki (travail actuel).
|
Groupements végétaux inventoriés
(travail actuel)
|
Espèces caractéristiques (travail
actuel)
|
|
Le groupement à Strombosia pustulata var pustulata
et Desbordesia glaucescens
|
Strombosia pustulata var pustulata, Desbordesia
glaucescens, Cola griseiflora, Chrysophyllum africanum et Diospyros
iturensis
|
|
Le groupement à Desbordesia glaucescens et
Strombosia pustulata var pustulata et à Gilletiodendron
mayumbensis
|
Desbordesia glaucescens, Strombosia pustulata var
pustulata, Diospyros iturensis, Nesogordonia kabingaensis var.leplaei,
Gilletiodendron mayumbensis, Hymenostegia laxiflora, Prioria balsamifera,
Mammea africana
|
|
Le groupement à Cola griseiflora et
Dialium corbisieri
|
Cola griseiflora, Dialium corbisieri, Pentaclethra
macrophylla, Diospyros iturensis, Isolona dewevrei
|
|
Le groupement à Cola griseiflora et
Diospyros iturensis
|
Cola griseiflora, Diospyros iturensis, Hymenostegia
laxiflora, Cynometra lujae, Dialium tessmannii
|
|
Le groupement à Dialium corbisieri et Cola
griseiflora et à Hymenostegia laxiflora
|
Dialium corbisieri, Cola griseiflora, Diospyros
iturensis, Cola bruneelii, Nesogordonia kabingaensis var.leplaei,
Hymenostegia laxiflora, Dacryodes buettneri, Brenania brieyi
|
|
Le groupement à Cola griseiflora et Cynometra
lujae et à Manilkara sp.
|
Cola griseiflora, Cynometra lujae, Manilkara sp.,
Prioria balsamifera, Hymenostegia laxiflora, Dialium corbisieri
|
Tableau 39 :
Comparaison de la composition floristique de chaque groupement
végétal de la Réserve de Biosphère de Luki (Lubini,
1997).
|
Groupements végétaux inventoriés
(Lubini, 1997)
|
Espèces caractéristiques (Lubini,
1997)
|
|
La forêt à Gilletiodendron
kisantuense
|
Gilletiodendron kisantuense, Nesogordonia kabingaensis
var. leplaei, Cola griseiflora,
Diospyros vermoesenii, Microdesmis puberula et
Campylospermum lecomtei.
|
|
La forêt à Prioria balsamifera et
Hylodendron gabunense
|
Oxystigma oxyphyllum, Erythrophleum suaveolens, Dialium
excelsum, Ongokea gore, Diospyros
cinnabarina et Psychotria oddonii.
|
|
La forêt à Ganophyllum giganteum et
Staudtia stipitata
|
Ganophyllum giganteum, Staudtia stipitata, Carapa procera
var. procera, Blighia
welwitschii, Leptaspis cochleata, Entandrophragma utile,
Polyalthia suaveolens, Enantia chlorantha et Gambeya
lacourtiana,
|
|
La forêt à Corynanthe paniculata et
Xylopia wilwerthii
|
Aidia ochroleuca, Corynanthe paniculata, Xylopia
wilwerthii, X. toussaintii, X. hypolampra, Dacryodes
buettneri,
Memecylon myrianthus et Pentaclethra
eetveldeana.
|
|
La forêt à Terminalia superba.
|
Terminalia superba, Chlorophora excelsa, Zanthoxylum
gilletii, Ricinodendron heudelotii subsp. africanum et Ceiba
pentandra.
|
|
La forêt à Xylopia aethiopica
|
Xylopia aethiopica, Funtumia elastica,
Zanthoxylum gilletii, Canthium oddonii, Barteria nigritana
var.fistulosa et Bertiera racemosa
var. welwitschii,
|
4.4.
Abondance relative des taxons
L'abondance relative indique dans le complexe éluvial
que l'espèce Cola griseiflora est prépondérante
avec 19,56%, suivies de Manilkara sp. (6,87%), Cynometra
lujae (6,74%), Diospyros iturensis (6,62%), Dialium
corbisieri (5,21%), Cola bruneelii (4,90%), Hymenostegia
laxiflora (2,94%), Nesogordonia kabingaensis (2,51%),
Diospyros bipindensis (2,45%) et Isolona dewevrei (2,27%).
Au niveau de complexe colluvial, Cola griseiflora
vient en tête avec 29,26%, suivis de Diospyros iturensis
(11,46%), Cola bruneelii et Dialium corbisieri (4,61%),
Manilkara sp. (3,46%), Cynometra lujae (2,88%),
Hymenostegia laxiflora (2,71%), Nesogordonia kabingaensis
(1,96%), Brenania brieyi (1,90%) et enfin, Dialium
tessmannii (1,79%). Tandis qu'au niveau de complexe illuvial,
Strombosa pustulata var pustulata est l'espèce la plus
représentée avec 12,32%, suivies de Cola griseiflora
(8,63%), Desbordesia glaucescens (6,96%), Diospyros iturensis
(6,82%), Strombosiopsis tetandra (4,04%), Mammea africana
(3,69%), Staudtia kamerunensis (3,55%), Nesogordonia
kabingaensis (2,85%), Dialium corbisieri (2,51%), et enfin,
Cola bruneelii (2,30%), indique le tableau 18.
Dans la Réserve de Yoko (R.D.Congo), Lomba (2007) note
une proportion élevée de Scorodophloeus zenkeri
(5,669 %) ; viennent ensuite les densités relatives de
Cynometra alexandri (4,658 %), Brachystegia
laurentii (3,972 %), Gilbertiodendron dewevrei
(3,900 %), Pycnanthus angolensis (3,647 %),
Annonidium mannii (3,141 %), Trilepisium
madagascariensis (2,925 %), Funtumia africana (2,853 %),
Petersianthus macrocarpus (2,708 %), Morinda
geminata (2,252 %), Cynometra hankei (2,022 %),
Musanga cecropioides (1,263 %), Uapaca
guineensis (1,191 %), Pterigota bequaertii et
Trichilia welwitschii (1,083 % ), Crudia
laurentii (1,047 %).
Pour ce qui est de l'importance générale des
taxons, l'indice le plus élevé est observé auprès
de Cola griseiflora (36,35%). Viennent ensuite Diospyros
iturensis (15,74%), Dialium corbisieri (9,72%), Cynometra
lujae (9,27%), Strombosa pustulata var pustulata (9,20%),
Cola bruneelii (8,09%), Desbordesia glaucescens (7,26%),
Manilkara sp (7,24%), Hymenostegia laxiflora (7,08%) et
Nesogordonia kabingaensis (6,75%).
Ces espèces citées qui abondent dans ces milieux
sont pour la plupart des essences de strate arborescente dominante et
dominée, qui atteignent couramment une hauteur de 30 m et 20 m
environ ; trouvent cette condition favorable dans la strate
supérieure. Lubini (2003) considère un grand nombre de ces
espèces comme ressources ligneuses de forêts primaires.
Pour les familles, dans le complexe éluvial les
Malvaceae/Sterculioideae sont abondantes et représentent
28,20%, suivie de Fabaceae/Caesalpinioideae (22,75%),
Ebenaceae (9,14%), Sapotaceae (7,66%),
Rubiaceae (4,84%), Annonaceae
(3,99%), Clusiaceae/Guttiferaceae (2,39%),
Apocynaceae (2,33%), Fabaceae/Mimosoideae (2,33%) et
Anacardiaceae (2,21%).
Au niveau de complexe colluvial, les
Malvaceae/Sterculioideae sont plus représentées avec
36,98%, suivies de Fabaceae/Caesalpinioideae (16,94%),
Ebenaceae (12,67%), Sapotaceae
(4,09%), Rubiaceae (3,97%),
Anacardiaceae (3,74%), Annonaceae
(2,88%), Clusiaceae/Guttiferaceae (2,53%), Meliaceae (2,19%)
et enfin, Olacaceae (1,96%). Tandis qu'au niveau de
complexe illuvial, les Olacaceae viennent en tête avec 16,42%, suivies de
Malvaceae/Sterculioideae (15,45%), Fabaceae/Caesalpinioideae
(11,55%), Ebenaceae (8,98%), Irvingiaceae
(7,31%), Myristicaceae (5,29%),
Clusiaceae/Guttiferaceae (5,22%),
Meliaceae (5,22%), Annonaceae
(3,90%), et Rubiaceae (3,41%), indique le tableau 20.
Lomba (2007) dans son étude, les
Caesalpiniaceae représente une proportion élevée
avec 28,96%, suivies par des Annonaceae (7,43%),
Euphorbiaceae (6,57%), Moraceae (6,39%), Apocynaceae
(6,17%), Rubiaceae (5,63%), Mimosaceae (4,94%), etc.
Lubini (1997) a trouvé quelques familles bien
représentées et qui caractérisent bien les groupements
forestiers ; c'est le cas notamment des Caesalpiniaceae,
Combretaceae et Rubiaceae, mais les arbres émergeants
appartiennent aux Annonaceae, Apocynaceae,
Burseraceae, Caesalpiniaceae, Irvingiaceae,
Meliaceae, Mimosaceae, Rubiaceae,
Sapindaceae, Sapotaceae et Sterculiaceae, il ya
également les espèces forestières de sous-bois, les
Sterculiaceae, Ebenaceae, Rubiaceae, etc.
Nous constatons que les familles de
Malvaceae /Sterculioideae, Fabaceae/Caesalpinioideae,
Ebenaceae et Annonaceae sont plus abondantes dans les
différents sites étudiés et caractérisent les
forêts denses de la région guinéo-congolaise.
Pour ce qui est de l'importance générale des
familles, l'indice le plus élevé est observé auprès
de la famille de Fabaceae/Caesalpinioideae (53,59%), suivies des
familles de Malvaceae/Sterculioideae (47,82%), Ebenaceae
(16,58%), Fabaceae/Mimosoideae (14,95%), Sapotaceae (14,61%),
Meliaceae (14,45%), Annonaceae (13,53%),
Irvingiaceae (13,43%), Olacaceae (11,63%) et
Anacardiaceae (10,71%), indique tableau 27. Cette importance parait
comme une caractéristique régionale des forêts d'Afrique
centrale et ces familles figurent dans la liste des familles
caractéristiques des forêts d'Afrique centrale selon l'UICN
(1989), en termes de densité mais aussi de diversité (Kouka,
2006).
4.5.
Dominance relative des taxons
Dans le complexe éluvial (crêtes),
l'espèce la plus dominante est Cola griseiflora (9,09%), suivie
de Cynometra lujae (7,06%), Prioria balsamifera (5,52%),
Hymenostegia laxiflora (4,71%), Dialium corbisieri (4,71%),
Dacryodes buettneri (3,93%), Tessmannia africana (3,66%),
Newtonia glandulifera (3,58%), Nesogordonia kabingaensis
(3,09%), et Pentaclethra macrophylla vient
en cinquième position avec (2,93%).
Au niveau de complexe colluvial (pentes), Cola
griseiflora est plus représenté avec (13,95%), suivie de
Hymenostegia laxiflora (7,00%), Dacryodes buettneri (4,76%),
Diospyros iturensis (4,34%), Nesogordonia kabingaensis
(4,13%), Ganophyllum giganteum (3,92%), Dialium corbisieri
(3,76%), Pentaclethra macrophylla (3,66%), Prioria balsamifera
(3,33%), et enfin, Cynometra lujae (2,72%). Tandis qu'au niveau
de complexe illuvial (dépressions), Desbordesia glaucescens
est l'espèce la plus dominante avec 17,13%, suivies de
Gilbertiodendron mayumbensis (9,53%), Strombosia pustulata
var pustulata (5,45%), Chrysophyllum africanum (4,90%),
Klainedoxa gabonensis (3,55%), Pentaclethra macrophylla
(2,97%), Ceiba pentandra (2,87%), Cola griseiflora (2,86%),
Staudtia kamerunensis (2,63%), et enfin, Trichilia gilgiana
(2,41%), comme le montre le tableau 20.
Les Fabaceae/Caesalpinioideae constituent une famille
la plus dominante de complexe éluvial (crêtes) avec 30,19% de
recouvrement, elle est suivie de Malvaceae/Sterculioideae (15,81%),
Fabaceae/Mimosoideae (9,25%), Burseraceae
(4,35%), Rubiaceae (3,93%), Sapotaceae
(3,25%), Ebenaceae (3,09%),
Anacardiaceae (2,84%), Meliaceae (2,78%) et enfin,
Annonaceae (2,62%).
Au niveau de complexe colluvial (pentes), ce sont toujours les
Fabaceae/Caesalpinioideae qui dominent avec 24,24% suivies de
Malvaceae/Sterculioideae (22,87%), Fabaceae/Mimosoideae
(8,80%), Burseraceae (4,99%),
Sapotaceae (4,98%), Ebenaceae
(4,66%), Sapindaceae (4,01%),
Meliaceae (3,93%), Anacardiaceae (3,05%), et
enfin, Rubiaceae (2,79%).
Tandis que dans le complexe illuvial (dépressions), ce
sont les Irvingiaceae qui dominent avec 20,72%. Elles sont suivies de
Fabaceae/Caesalpinioideae (19,08%), Olacaceae (7,90%),
Malvaceae/Sterculioideae (7,78%), Sapotaceae (6,83%),
Fabaceae/Mimosoideae (4,58%), Euphorbiaceae (4,38%),
Meliaceae (4,35%), Myristicaceae (4,23%), et
Bombacaceae (2,87%), comme l'indique le tableau 21. Ces espèces
et familles qui dominent sont comme pour l'abondance, caractéristiques
des forêts d'Afrique centrale, a souligné Kouka (2006). Letouzey
(1982) indique que les familles Fabaceae, Meliaceae,
Myristicaceae, Moraceae, Apocynaceae,
Sapotaceae, Myristicaceae, Rutaceae, Annonaceae, Rubiaceae, Olacaceae,
Burseraceae, etc. se développent bien dans les forêts
denses humides. Ces familles sont donc dans leur milieu écologique.
Dans toutes les forêts tropicales africaines, les
familles des Caesalpiniaceae, des Rubiaceae et des Euphorbiaceae, sont les plus
abondantes, tant en genres qu'en espèces. Par contre, les familles des
Sapindaceae et des Apocynaceae, ont présenté de faibles valeurs
presque dans tous les autres types forestiers. Plusieurs auteurs l'ont
déjà signalé, entre autre ; Lebrun & Gilbert
(1954), Evrard (1968), Kouka (2006) dans le Parc National d'Odzala au Congo
Brazzaville etc. Signalons toutefois qu'à part ces familles
citées au dessus, plusieurs autres ne sont représentées
que par peu d'espèces, voire une espèce. Ces familles
caractérisent la végétation forestière. Nos
résultats confirment ceux obtenus par Germain (1957), Evrard (1968),
Mandango (1982) et Lubini (1982).
4.6.
Analyse du spectre écologique
Pour caractériser la flore de la Réserve de
Biosphère de Luki (au Nord-est), nous avons attribué à
chaque espèce son statut phytosociologique, le comportement de son
feuillage, types de diaspore, distribution phytosociologique et types
morphologiques, dont les détails ont été affectés
au chapitre des résultats (tableau (5, 6, 7, 8, 9 et 10).
Les Magnoliophyta sont mieux
représentées avec les familles des Rubiaceae, Fabaceae
Caesalpiniaceae, Annonaceae, Burseraceae, Sapindaceae, Meliaceae. Ces
familles caractérisent la végétation forestière.
Nos résultats confirment ceux obtenus par Germain (1957), Evrard (1968),
Mandango (1982) et Lubini (1982).
Dans notre étude, nous avons observé la
prédominance des phanérophytes (mésophanérophytes
avec 53,15%, mégaphanérophytes avec 32,17% et
microphanérophytes avec 14,68%).
Evrard dans ses recherches écologiques sur le
peuplement forestier dans la cuvette centrale a mis en évidence la
prédominance des phanérophytes. Il en est de même des
travaux de Mandango (1982), Nshimba (2008) et Lubini (1990 et1997). Pour ce
dernier auteur, les travaux se rapportent sur la flore et la
végétation de la Réserve de Luki dans laquelle
s'insère les sites étudiés (Nord-est de la
Réserve). Nos résultats concordent avec ceux de ces auteurs
précités. Même en dehors de forêts dense humides,
Ganglo & al. (2006), présentent dans les forêts du
Bénin, une dominance de Phanérophytes par rapport à
d'autres types.
Dans toutes les forêts analysées, il ressort que
les espèces sarcochores sont les plus abondantes, mais les ballochores
et les barochores sont représentées en faible pourcentage. La
proportion importante des espèces zoochores souligne le rôle des
animaux dans la dissémination des diaspores. Cette conclusion rejoint
celle dégagée par Evrard (1968), Lubini et Mandango (1981) qui
démontre l'importance des animaux dans la dissémination des
espèces. Par ailleurs, Mahamane (2006) dans son étude sur la
végétation du Parc régional du W du Niger, signale une
prédominance des anémochores (sclérochores,
ptérochores et pogonochores) et zoochores.
Les résultats de l'analyse de la caducité du
feuillage rejoignent les limites mentionnées par Lebrun & Gilbert
(1954). La défoliation des espèces concernées est
généralement brève, partielle ou totale et intervient
durant la saison sèche. Le spectre phytogéographique
établi pour les 142 espèces recensées met en
évidence une nette prédominance des espèces du centre
régional d'endémisme Guinéo-congolais. Nos
résultats corroborent avec la conclusion dégagée par
Lubini (1990 ,1997).
Pour ce qui est de statuts phytosociologiques, des 7 classes
phytosociologiques trouvées par Mandango (1982) et Mandango & Ndjele
(1984), 3 classes ont été rencontrées dans les sites
étudiés. Ce sont les classes de :
Strombosio-Parinarietea (59,86%), des Musango-Terminalietea
(33,1%) et des Halleetea (6,34%), (tableau 10).
4.7.
Tests statistiques
Tableau 40 : Valeurs
des différents plus values trouvés dans les différents
complexes du Nord-est de la Réserve de Biosphère de Luki par
rapport aux paramètres.
|
Complexes
|
|
Paramètre
|
Crêtes
|
Dépressions
|
Pentes
|
|
Argile
|
1.372e-05 ***
|
1.372e-05 ***
|
1.372e-05 ***
|
|
Sable
|
5.111e-06 ***
|
5.111e-06 ***
|
5.111e-06 ***
|
|
Limon
|
0.06385
|
0.06385
|
0.06385
|
|
ph
|
8.48e-07 ***
|
8.48e-07 ***
|
8.48e-07 ***
|
|
Teneur en eau
|
0.0003567 ***
|
0.0003567 ***
|
0.0003567 ***
|
|
Altitude
|
0.1413
|
0.1413
|
0.1413
|
Après test statistique en utilisant l'ANOVA à
plusieurs variables, on constate qu'il ya une différence significative
entre les complexes par rapport à l'argile, sable, ph et teneur en eau,
le plus value est inférieur à 0,05, donc ces paramètres
influencent la composition floristique des différents complexes et
jouent un rôle important. Tandis que par rapport à l'altitude et
au limon, nous observons qu'il n'y a pas de différence significative, le
plus value est supérieur à 0,05, le limon et l'altitude ne jouent
pas un rôle important dans la composition floristique de chaque complexe.
Donc il ya les paramètres qui influent sur la composition floristique et
ceux qui n'influent pas.
Plus value=
0.189
Plus value= 0.2639
Figure 37 :
Comparaison de la diversité exprimée par les indices de Simpson
et de Fisher par rapport aux différentes toposéquences (Logiciel
R, boîte de moustache).
Les différents complexes (toposéquences) soumis
à un test statistique de comparaison (ANOVA à un seul variable),
nous ont conduis au constat suivant : les indices de diversité de
Simpson et de Ficher ne présentent pas une différence
significative entre les différentes toposéquences
(p-value : 0,2639 pour le Simpson et
0,189 pour le Alpha Fisher). En effet la dépression
semble plus diversifiée.
Densité : p-value=
0,09497
Richesse spécifique :
p-value = 0,3217
Figure 38 :
Comparaison de la richesse spécifique entre les différentes
toposéquences (Logiciel R, boîte de moustache).
Le même constant s'observe lorsqu'on tient compte des
courbes d'accumulation des espèces le long de la surface d'inventaire et
la densité des individus dans les différentes
toposéquences. Un écart significatif se remarque lorsqu'on
compare l'accumulation des espèces et le nombre des individus au niveau
des différentes toposéquences (p-value :
0,3217 pour la richesse spécifique et 0,09497 pour la
densité des individus).
CONCLUSION ET RECOMMANDATIONS
Les objectifs ambitieux et complexes de la conservation des
forêts d'Afrique centrale font face à de nombreuses
difficultés qui entravent parfois gravement la prise de
décisions. Le manque de moyens techniques et financiers, la faiblesse
des capacités humaines et l'insuffisance des connaissances scientifiques
constituent les principaux goulots d'étranglement. Sur le plan
biologique, beaucoup d'espèces restent à décrire et
à nommer, la distribution des espèces reste incertaine, de vastes
régions sont peu ou pas explorées, les comportements de
nombreuses espèces demeurent inconnues tout comme une bonne partie des
relations et interactions entre espèces.
Ce travail portant sur l'analyse de la
diversité des ligneux arborescents des principaux types forestiers du
Nord-est de la Réserve de Biosphère de Luki a permis de
déterminer les groupements forestiers et la composition floristique de
ces forêts en fonction de la topographie et des facteurs
édaphiques et écologiques. Le souci majeur était de
développer d'urgence les moyens scientifiques propres à assurer
le savoir fondamental nécessaire à la conception des mesures
appropriées et à leur mise en oeuvre pour prévenir et
anticiper au plus haut point la perte sensible de cette biodiversité de
la Réserve de Biosphère de Luki. La gestion durable des
ressources naturelles nécessite une bonne connaissance des
biocénoses.
L'objectif principal de cette étude est d'identifier
les types de forêts sur base de différents complexes
(éluvial, colluvial et illuvial), de caractériser chaque type par
la composition floristique essentielle, de déterminer les
caractéristiques quantitatives des principales espèces et de
rechercher les explications de nature écologique qui président
à cette différenciation.
Après les inventaires réalisés, sur une
superficie de 9 ha de 100 m x 100 m à chacun, subdivisés en
quatre placettes de 50 m x 50 m pour les arbres à dhp = 10 cm, nous
avons inventoriés 4804 individus appartenant à 142
espèces, 110 genres et 35 familles. Deux principales
méthodes ont été utilisées afin d'arriver à
bien identifier cette phytodiversité :
1. La méthode des mesures de diamètre
(D130 =10 cm) dont les analyses floristiques ont permis de
définir les espèces et les familles caractéristiques de
chaque groupe, leur densité et dominance ainsi que la diversité
spécifique. Ces analyses floristiques ont permis de déceler les
espèces différentielles et communes pour tous les trois complexes
et de mettre en évidence la prédominance des familles des
Fabaceae/Caesalpinioideae et Malvaceae/Sterculioideae dans
la crête, des Fabaceae/Caesalpinioideae et
Malvaceae/Sterculioideae au niveau de la pente et des
Irvingiaceae et Fabaceae/Caesalpinioideae dans la
dépression et la prédominance des espèces Cola
griseiflora et Cynometra lujae dans la
crête, Cola griseiflora et Hymenostegia laxiflora dans
la pente, Desbordesia glaucescens et Gilbertiodendron
mayumbensis dans la dépression.
Du point de vue abondance, on constate que les familles des
Malvaceae/Sterculioideae et Fabaceae/Caesalpinioideae
dominent dans les deux complexes (crête et pente) et Olacaceae
et Malvaceae/Sterculioideae dominent dans la dépression ;
alors que les espèces Cola griseiflora
et Manilkara sp. dominent au niveau de la
crête, Cola griseiflora et Diospyros
iturensis dans la pente, Strombosa pustulata var pustulata et
cola griseiflora dans la dépression.
La densité par rapport aux complexes n'a pas
montré une différence significative (complexe éluvial,
complexe colluvial et le complexe illuvial). Statistiquement, cela revient
à dire que les différents complexes n'influencent pas la
densité des individus, mais la densité moyenne parait
supérieure sur le complexe colluvial (pente) avec 579 individus, suivie
du complexe éluvial (crête) avec 544 individus et enfin de
complexe illuvial (dépression) avec 479 individus.
Ce même constat est observé au niveau de la
richesse spécifique. Statistiquement, dans les trois complexes
étudiés, on n'a pas trouvé de différence
significative en termes de nombre des espèces par complexes. Nous
pourrons dire que les complexes n'influencent pas sur la richesse
spécifique, mais la richesse spécifique parait supérieure
sur le complexe illuvial avec 77 espèces que sur les complexes
éluvial avec 71 espèces et sur le complexe colluvial avec 65
espèces.
2. Les analyses d'ordinations et de classifications ont permis
de mettre en évidence les principaux groupements floristiques et de
montrer la similarité entre les divers relevés, les
espèces étudiées et les variables de l'environnement.
Ces analyses ont révélé que les
regroupements observés ont été dictés par le
pourcentage en argile, le taux de limon, le taux de sable, le ph, la teneur en
eau et l'altitude.
Ces résultats démontrent que les conditions
édaphiques et topographiques contribuent à déterminer la
composition floristique des types forestiers donnés. Statistiquement,
les variables environnementaux étudiés (l'argile, le sable, le ph
et la teneur en eau) ont influencé la composition floristique.
La proportion élevée des phanérophytes
met en évidence la présence des arbres et la nature
forestière de site de notre étude. L'analyse de l'ensemble de la
florule a révélé la prédominance des espèces
du centre régional d'endémisme guinéo-congolais confirmant
ainsi l'insertion de la Réserve de Luki à l'entité
floristique bas-guinéen tel que proposé par White (1979).
La distribution des ligneux par classes de diamètres
présente un grand nombre d'espèces ligneuses de petits
diamètres qui constituent les espèces d'avenirs pour assurer la
reconstitution des forêts et les espèces ligneuses.
La Sarcochorie est le type de dissémination des graines
qui caractérise nombreuses espèces recensées.
L'élément phytosociologique Strombosio-Parinarietea
renferme un nombre assez élevé des espèces
végétales.
La DCA (Detrended Correspondance Analysis) appliquée
sur les différentes toposéquences a permis de rassembler la
forêt du Nord-est de la Réserve de Biosphère de Luki
à six groupements végétaux.
Nous recommandons vivement de conserver
l'intégrité de cette Réserve et d'entreprendre sa gestion
durable et son aménagement.
Que les travaux botaniques du sous-bois ou encore
pédologiques soient aussi réalisés.
Etant donné que l'écotourisme est une des
activités alternatives pour l'autofinancement de cette Réserve
qui contient des espèces animales phares. Une autre piste pouvant
garantir la conservation de cette Réserve est la valorisation et
l'intégration du savoir endogène des communautés
locales.
La promotion des travaux d'aménagement durable des
forêts dans les forêts secondaires jeunes à Musanga
cecropioides en vue de permettre la régénération
des essences qui vont favoriser la reconstitution de ces forêts.
REFERENCES BIBLIOGRAPHIQUES
Alba P., 1953. A propos de l'enrichissement
des forêts denses de l'Ouest africain. Bois et Forêts des
Tropiques, 11-14p.
Apema A.K., Kambale K. et Lejoly J., 1994.
La forêt marécageuse à Wildemaniodoxa laurentii et
Cercestis congensis des environs de Kisangani (Haut-Zaïre). Proc.
XIIIth Plenary Meeting Aetfat, Malawi, 2: 1471-1482.
Aubin, G. 1963. La forêt du Gabon.
Centre technique forestière ; France. 208 p.
Ashton, P.S., 2000a. Predicting species
diversity in tropical forests. PNAS 97(20): 10850-10854.
Ashton, P.S., 2003. Floristic zonation of
tree communities on wet tropical mountains
revisited. Perspectives in Plant Ecology, Evolution and
Systematics 6 (1,2): 87-104.
Aubréville A. 1938. La forêt
coloniale : les forêts de l'afrique occidentale française.
Ann Acad Sci coloniales 9, 1-245.
Aubreville, A., 1957. Accord à
Yangambi sur la nomenclature des types africains de végétation.
Bois et Forêts des Tropiques. 57 : 23-27.
Aubréville A. 1962. Position
chorologique du Gabon, in Flore du Gabon, 2: 3-11.
Basnet, K., 1992. Effect of topography on the
pattern of trees in tabonuco (Dacryodes excels) dominated rain
forest of Puerto-Rico. Biotropica 24, 31-42
Baya, M. et Penje, G., 1992. La
réserve de biosphère de Luki (Mayombe, zaïre).Patrimoine
floristique et faunique en péril. Unesco, Paris, 62p
Bebwa B. et Lejoly J., 1990. Dynamique et
minéralomasse des jachères de premières années
à
Kinsangani (Haut-Zaïre), Mitt. Inst. Bot. Hambourg Band
23b. Comptes rendus de la XIIè réunion plénière de
l'AETFAT Symposium VIII, 879-893.
Belesi K.K.H. et Lubini
C.A., 1998. Note préliminaire sur la végétation
de l'entre Kasai-
Kamtsha in Pistes et Recherches, ISP Kikwit, Vol. 13 n°2,
pp.227-236.
http://www.congoline.com
Belesi K.K.H., 2004. Végétation
secondaire de l'Entre Kasai-Kamtsha (Bandundu-RDC), Mémoire de DEA.
Inédit UNIKIN. 82 p.
Belesi K.K.H., Lubini C.
& Lejoly J., 2006. Forêt à Canarium
schweinfurthii et Milicia excelsa dans le Kwilu Septentrional
(RDC) (Poster). In Compte Rendu de la Journée mondiale des Jeunes
Botanistes des pays du BENELUX (KU Leuven) Belgique.
Belesi K.K.H., 2007. Etude floristique,
phytogéographique et phytosocio-logique des formations herbeuses du
Kwilu Septentrional (RDC). Mémoire de DEA. Inédit. ULB. 87 p.
Belesi K.K.H., 2009. Etude floristique,
phytogéographique et phytosociologique de la végétation du
Bas-Kasai en République Démocratique du Congo. Thèse de
doctorat inédite, ULB, Bruxelles, 565p
Boyemba F., 2006. Diversité et
régénération des essences forestières
exploitées dans les forêts des environs de Kisangani.
Mémoire de DEA. Inédit. ULB. 101 p.
Braun-Blanquet J. &
Pavillard J., 1928. Vocabulaire de Sociologie végétale.
Reprod. Imp. Lemaire, Ardres, 23 p.
Braun-Blanquet, J., 1932. Plant sociology:
the study of plant communities. McGraw-Hill Book Company, Inc., New York, 407
p.
Brown V.K. 1992. Plant succession and plant
history. Tree 7: 143-144.
Brown, J.H. & Lomolino, M.V., 1998.
Biogeography. 2nd edn., Sinauer Associates, Sunderland.
Catinot R., 1965. Sylviculture tropicale en
forêt dense africaine. Bois et Forêts des Tropiques. N°100,
101, 102, 103 et 104. Tiré à part.
CIFOR, CIRAD, CTB & MRAC., 2007. Quel
avenir pour les forêts de la République Démocratique du
Congo ? Instruments et mécanismes innovants pour une gestion
durable des forêts. 83p.
Condit, R., Pitman, N., Leigh, E., Chave, J., Terborgh, J.,
Foster, R., Nunez, V., Aguilar, S., Vaencia, R., Villa, G., H.C., M.-L., Losos,
E., Hubbell, S. 2002. - Beta-diversity in tropical forest trees. Science, 295:
666-669.
Curtis, J.T. & McIntosh, R.P. 1950. The
interrelation of certain analytic and synthetic phytosociological characters.
Ecology, Vol. 31, n°3, pp. 434-455.
Dallmeier, F., 1992. Long-Term Monitoring of
Biological Diversity in Tropical Forest Areas. Methods for Establishment and
Inventory of Permanent Plots. UNESCO, Paris (MAB Digest Series n_ 11). 72 p.
Decocq G., 2001. La Phytosociologie comme
Méthode d'étude de la Végétation. Cours
destiné aux étudiants en Sciences Biologiques,
Spécialisation en Biolgie végétale, Université
Libre de Bruxelles, 56 p.+Annexes.
Decocq G., 2001. Connaître
échelle des processus écologiques, échelles de mesure de
la biodiversité et échelles de gestion en milieu forestier. Rev.
For.Fr.LIII.n° special. Amiens : Université de Picardie
Jules-Verne, p4 (49p).
Devred R., 1954. (In Denissoff I. et Devred
R.), Carte des sols et de la végétation du Congo belge et du
Ruanda-urundi, 2. Mvwazi, A et B. Notice exlpicative de la carte des sols et de
la végétation. INEAC. Bruxelles. 33 p. Cartes hors texte.
Devred R., 1957. Limite
phytogéographie occidento-méridionale de la région
guinéenne au Kwango. Bull. Jard. Bot. Nat. Beg., 27
(3): 417-431.
Devred R., 1958a. La végétation
forestière du Congo belge et du Ruanda-Urundi. Bull. Soc. Roy. Bot.
Belg. 65 (6): 409-468, 1 carte hors-texte. INEAC, Bruxelles.
Devred R. et DERO J., 1962. Etude
phytosociologique des forêts équatoriales et tropicales
-méthode mécanographique. 63 Duvigneaud P., 1946, La
variabilité des associations végétales, Bruxelles, Soc.
Roy. Bot. Belg. In Bull. Soc. Roy. Bot. Belg. 81, pp. 107
Dhetchuvi, M. 1996. Taxonomie et
Phytogéographie des Marantaceae et des Zingiberaceae de l'Afrique
Centrale (Gabon, Congo, Zaïre, Rwanda et Burundi), Thèse de doct.
ULB. Labo. Bot. Syst. & Phyt. 438p.
Direction de Gestion forestière, 2003.
Rapport annuel d'activités et statistique forestière.
Kinshasa : MINAF-ET. 30p.
Donis C., 1948a. Essai d'économie
forestière au Mayombe. Publications de l'INEAC, série
scientifique, n°37, Bruxelles, 92p., 3 cartes, 6 fig. Bruxelles.
Donis C., 1948b. Note sur la podzologie au
Mayombe. C.R Conf. Africaine des Sols, Goma (Kivu), Congo belge : 641-650.
Donis C., Mardoux R., 1951. Sur
l'uniformisation par le haut. Belgique, INEAC, 51-75p.
Doucet, J.L 2003. L'alliance délicate
de la gestion forestière et de la biodiversité dans les
forêts du centre du Gabon. Thèse de Doctorat, Fac. Universitaire
des sciences Agronomiques de Gembloux 323 p
Dupuy, B., 1998. Bases pour une sylviculture
en forêt dense tropicale humide africaine. FORAFRI, 387p. (p.20)
Evrard, C., 1968. Recherches
écologiques sur le peuplement forestier des sols hydromorphes de la
cuvette centrale Congolaise. Publ. INEAC.Sér. Sc. N°110 Bruxelles,
295p.
FAO, 1993. Valorisons la diversité de
la nature, Rome : FAO. 4p.
FAO, 2001. Stratégie de
développement rural - Programme de relance du secteur forestier en RDC.
Note de cadrage. Rome: FAO. 26 p.
FAO, 2003. Situation des forêts du
monde 2003. Rome : FAO. 126p.
Flore du Congo belge et du Rwanda-Urundi, 1948 -
1960. Spermatophytes. Vol. 1 à 7. Publications INEAC.
Bruxelles.
Flore du Gabon, vol. I
à XXIV, 1961 - 1978.
Flore du Cameroun, vol.
XXI-XXII, 1981. Muséum Nat. D'histoire Nat. Paris.
Flores, O., 2005. Déterminisme de la
régénération chez quinze espèces d'arbres tropicaux
en forêt guyanaise: les effets de l'environnement et de la limitation par
la dispersion. Thèse. Université de Montpellier II, 231 p
Forget, P.M. 1988. Dissémination et
régénération naturelle de huit espèces d'arbres en
Forêt Guyanaise. Université Pierre et Marie Curie, 245 p.
Foury, F., 1956. Comparaison des
méthodes d'enrichissement en forêt dense équatoriale. Bois
et Forêts des Tropiques, 15-25p.
Ganglo, J. C., 2005. Les groupements
végétaux à Chromolaena odorata dans les
plantations forestières du Sud Bénin: Caractéristiques
structurelles et valeurs indicatrices écologique et sylvicole. In Bull.
Jard. Bot. Nat. Belg. 75: 179-194.
Ganglo, J.C., De Foucault, B. & Lejoly, J.
2006. The Psychotria vogeliana-community in the spontaneous undergrwth
of teak (Tectona grandis L.f.) plantations in south-Benin: ecological
and sylvicultural indicatory values, Acta Bot. Gallica. 2006, 153
(2), (125-134).
Gata, D., 1997. Réserve de
biosphère de Luki - Études des impacts humains, évaluation
du degré de péril de la biodiversité et principes
directeurs pour une gestion durable des ressources naturelles
disponibles ; MAB/Congo, MECNT, 37 p. Cartes et photos.
Germain, R., 1952. Un essai d'inventaire de
la flore et des formes biologiques en foret équatoriale congolaise.
Bull.Jard. Bruxelles, 27 : 563-576p.
Germain, R. et Evrard, C., 1956. Etude
écologique et phytosociologique de la forêt à Brachystegia
laurentii. Publ. INEAC, Série Scient. 65: 105 A.
Germain, R., 1957. Un essai d'inventaire de
la flore et des formes biologiques en forêt équatoriale
congolaise, Bull. Jard. Bot. Etat Bruxelles, 27, pp. 563-576.
Gillet, J.F., Augiron, K., Doucet, J.L., Dethier, M.,
Ntchandi-Otimbo, P.A., Boubady, A-G. 2003. Evolution des zones
d'intérêt biologique et délimitation du secteur de
conservation. Nature plus, IRET, 45 p.
Habiyaremye M.K.,1997. Etude
phytocoenologique de la dorsale orientale du lac Kivu
(Rwanda). Musée Royal de l'Afrique Centrale, Tervuren,
Belgique, Annales Sciences Economiques, Vol. 24., 275 p.
Hardy, O.J., 2007. BiodivR 1.0. A program to
compute statistically unbiased indices of species diversity within sample and
species similarity between samples using rarefaction principles.
http://www.ulb.ac.be/sciences/ecoevol/biodivr.html
Heinsdijk, D. 1961. Forest survey in the
Amazon valley. Unasylva. 15: 167-174.
Heinsdijk, D. & Miranda Bastos, A. 1965.
Forest inventories in the Amazon: FAO report,
n° 28, 78 p.
Isungu, W., 2003. Parc de la Nkula et son
aménagement. Fac. Des Sciences, UNIKIN. P. 40.
IUCN, 1989. La conservation des
écosystèmes forestiers d'Afrique Centrale. Gland, Suisse et
Cambridge, Royaume-Uni, IUCN.
Journal Officiel, 2002. Loi n° 011/2002
portant Code forestier de la République Démocratique du
Congo. Kinshasa : CEDI. 38p.
Kahn, F., 1983. Architecture comparée
de forêts tropicales humides et dynamique de la rhizosphère.
Thèse doct Etat, USTL Montpellier, 426p.
Kapa B. & al., 1987. Aménagement
de la Réserve biosphérique de la Luki. Projet SPIAF/FRCF/MAB/
86/006. 74p.
Kouka, L.A. 2004.
Régénération des espèces ligneuses en forêt
du Parc national d'Odzala (Congo Brazzaville), Acta bot. Gallica, Bruxelles,
293-309 p
Kouka, L.A. 2006. Etude floristique des
forêts du parc national d'Odzala (Congo Brazzaville), Acta bot. Gallica
Vol.153(1), 49-81 p
Kouob, B., 2009. Organisation de la
diversité végétale dans les forêts matures de terre
ferme du sud-est Cameroun. Thèse de doctorat. Université Libre de
Bruxelles : ULB 212 p.
Koïchiro Matsuura, 2007. Science en
Afrique. Contribution de l'UNESCO au plan de l'Afrique pour la science et la
technologie d'ici 2010, UNESCO.
Jongman R.H.G., Ter Braak C.J.F. and Van Tongeren
O.F.R., 1995. Data analysis in
community and Landscape ecology Ed. Cambridge University press
(299 p.).
Lebrun J., 1947. La végétation
de la plaine alluviale au sud du lac Edouard. Expl. Parc Nat.
Lebrun, J. et Gilbert, G. 1954. Une
classification écologique des forêts du Congo-Belge. INEAC,
Séries Scientifiques (63), Bruxelles.
Lebrun J., 1960. Etude de la
flore et de la végétation des champs de la lave au nord du lac
Kivu. 392 p. Expl. Parc Nat. Albert, Mission J.Lebrun, Fasc.
2, Bruxelles, Inst. des parcs nationaux du Congo belge.
Lejoly, J., Lisowski, S. & Ndjele, M.
1988. Les plantes vasculaires de Sous Région de Kisangani et de
la Tshopo. Catalogue informatisé. Doc. Polycopié Fac. Sc. ULB.
136p.
Lejoly, J., 1993. Méthodologie pour
les inventaires forestiers (partie flore et végétation). Projet
Ecofac, Agreco-CTFT, 1 - 57, + annexes.
Lejoly J., 2003. Gestion durable des
forêts tropicales, ULB, Bruxelles.
Lejoly, J. 2007. Valorisation et conservation
de la biodiversité végétale, première partie,
Unikis, Fac. des sciences 34 p
Léonard, J. 1952. Flore du Congo Belge
et du Rwanda-Urundi. Spermatophytes. Caesalpiniaceae, vol.III, Publ. I.N.E.A.C,
Bxl, pp 234-554.
Lescure, JP. et Boulet, R., 1985.
Relationships between soil and vegetation in a tropical rain forest in French
Guiana, Biotropica 17, 155-160.
Letouzey, R., 1969. Manuel de Botanique
forestière. Afrique Tropicale, CTFT, T. 2B, 461p.
Letouzey, R., 1982. Manuel de botanique
forestière Afrique tropicale Tome1.
Letouzey R., 1982. Manuel de botanique
forestière - Afrique Tropicale. Tome 2A, 2ème
édition. CTFT. Marne. 461 P.
Lisingo, J., 2009. Typologie des forêts
denses des environs de Kisangani par une méthode d'analyse
phytosociologique multistrate. Mémoire DEA, UNIKIS, 111p.
Lomba, C., 2007. Contribution à
l'étude de la phytodiversité de la réserve
forestière de Yoko, D.E.S, faculté des sciences, 60 p
Louis, J. 1947. Contribution à
l'étude des forêts équatoriales congolaises. C.R. Sem.
Agr.INEAC Yangambi. 9O2-924 p.
Lubini, A. 1982. Végétation
messicole et post culturale de Kisangani et la Tshopo (Haut Zaïre).
Thèse de doctorat inédite, Fac. Sci., UNIKIS, 489 p.
Lubini, A., 1984. Réserve de la
biosphère de Luki (Bas-Zaïre), MAB- Zaïre, DECNT, 52p.
Lubini, A., 1990. La flore de la
Réserve forestière de Luki (Bas-Zaïre), Mitt. Inst. Allg.
Bot. Hambourg 23b, pp. 135-154.
Lubini, 1997. Catalogue de la flore de la
réserve de biosphère de Luki.
Lubini, C., 1997. La végétation
de la Réserve de Biosphère de Luki au Mayombe (Zaïre). Opera
Botanica Belgica 10 : 1-155
Lubini, A. 2001. Analyse
phytogéographique de la flore forestière du secteur du Kasaï
au Congo-Kinshasa. Syst. Géogr. pl.71, 859-872 p.
Mahamane, A., 2006. Etudes floristique,
phytosociologique et phytogéographique de la végétation du
Parc regional du W du Niger, Acta Bot. Gallica. 2006, 153
(2), 265-269.
Malaisse, F., 1984. Contribution à
l'étude de l'écosystème forêt dense sèche
(Muhulu).
Structure d'une forêt dense sèche
zambézienne des environs de Lubumbashi (Zaïre).
Bull. Soc. Roy. Bot. Belg.: 428-458.
Malaisse, F., 1997. Se nourrir en forêt
claire africaine. Approche écologique et nutritionnelle.
CTA, Wageningen, 384 p.
Maley J., 1994. Le cadre
paléoenvironnemental des refuges forestiers africains: quelques
données et hypothèses. In the Biodiversity of african plants,
Proceeding XIVth AETFAT Congress Wageningen-Netherlands. pp. 519-535.
Maldague, M., Mankoto, S. et Rakotomavo, T.,
1997. Notions d'aménagement et de développement
intégrés des forêts tropicales. ERAIFT, UNESCO, MAB, PNUD,
375p.
Mandango, M. 1981. Flore et
végétation de l'île Tundulu à Kisangani (H-Z) ;
DES, Fac.Sc. Unikis, 133 p.
Mandango, M. 1982. Flore et
végétation des îles du fleuve de Zaïre dans la Sous
Région de la Tshopo (H-Z). Thèse, Univ. Kisangani 425 p.
Mandango, A. & Ndjele, M. 1984. Etude
Phytosociologique de l'Association à Pteris similis et
Elaeis guineensis dans la Sous-Région de la Tshopo
(Haut-Zaïre), Bull. Soc. Roy. Bot. Belg. 117,
153-167.
Mandango M.A. et Nyakabwa M., 1988.
Associations nouvelles de la région de Kisangani
(Haut-Zaïre). Ann. Sci. Econ. Mus. Roy. Afr. Centr.
Tervuren, Belgique, 17: 311-315.
Mangambu, J.D., 2008. Etude des
Ptéridophytes et de leurs peuplements dans le Parc National de Kahuzi
Biega : Couloir et haute altitude (Sud-Kivu, R.D.C), D.E.S,
Université de Bukavu.
Mangenot, G., 1955. Etudes sur les
forêts des plaines et plateaux de la Côte d'Ivoire. Etudes
Eburnéennes, IFAN, 4: 5-61.
Masens, DA-Musa Yung, B., 1997. Etude
phytosociologique de la région de Kikwit (Bandundu, Rép.
Dém. Du Congo). Thèse de Doctorat, Université Libre de
Bruxelles, Laboratoire de Botanique systématique et de
Phytosociologie.
Maudoux, 1954. La
régénération naturelle dans les forêts
remaniées du Mayombe. Bull. soc. Bot. France XCVII .pp 156-157.
Mbemba et Malekani, M., 1995. La
Réserve de Biosphère de Luki, état actuel et perspectives
scientifiques à avenir pour la conservation de la
biodiversité.UNIKIN, 14p.
Mémento du forestier, 1976. Ed.
Ministère de la coopération, Paris, 834 p
MINAF-ET, 2001. Stratégie nationale et
plan d'action de la diversité biologique. Kinshasa : PNUD. 158p.
MINAF-ET, 2003. Les ressources
forestières de la République Démocratique du Congo dans le
contexte global du bassin du Congo : potentialités et perspectives
de mise en valeur. Rapport national. Kinshasa, 50p.
Mpia, I., 2002. Etude de la
végétation et de la flore riveraine de la concession du lac de Ma
vallée de Kinshasa ; Mémoire inédit, UNIKIN, Fac.Sc,
65p
Morley, R.T. 2000. Origin and Evolution of
Tropical Rain Forests. John Wiley & Sons, Ltd, New York, 362 p.
Mosango, M. 1990. Contribution à
l'étude botanique et biogéochimique de l'écosystème
forêt en région équatoriale (île Kongolo,
Zaïre). Thèse de doct. ULB. Labo. Bot. Syst. & Phyt. 442 p.
Mullenders, W. 1954. La
végétation de Kaniama entre (Lubishi-Lubilashi, Congo Belge). Th.
Doct. Publ. INEAC, Sér. Sc. 61 :
1-499.
Mutambue S., 1984. Contribution à
l'étude de l'écologie de la rivière Luki (sous-affluent du
fleuve Zaïre). Bassin versant. Poissons. Thèse doct. 3ème
cycle, Toulouse (UPS), 214 p.
Mutambwe, 1992. Le bassin de Luki
(Zaïre) et son aménagement. Systématique, biologie et
écologie de sa faune piscicole. Thèse de doctorat. Univ. P.
Sabatier. Toulouse, 335 p.
Mutambwe, S., 1993. Présentation de la
Luki et de son bassin versant, MAB-Zaïre, 53p.
Ndjele, M.B., 1988. - Les
éléments phytogéographiques endémiques dans la
flore vasculaire du Zaïre. Thèse de doct. ULB. Labo.Bot. Syst.
& Phyt. 528 p.
Ngok B.L., 2000. Diversité
végétale des inselbergs et des dalles rocheuses du nord de Gabon.
Thèse de Doctorat, Université Libre de Bruxelles, Laboratoire de
Botanique Systématique et de Phytosociologie, 420p.
Nlandu, J., 1999. Rapport du chargé
des travaux forestiers sur l'état actuel de la réserve de
biosphère de Luki. Projet MAB-Luki, 3p
Nsenga L., 2001. Etude de la gestion des
aires protégées en R.D.C, cas de la Réserve de
biosphère de Luki, Mayombe, 139p. Mémoire de DEA inédit,
ERAIFT.
Nshimba, S-M., 2005. Etude floristique,
écologique et phytosociologique des forêts inondées de
l'île Mbiye à Kisangani, (R.D.Congo), DEA, ULB, 101 p.
Nshimba, H., 2008. Etude floristique,
écologique et phytosociologique des forêts inondées de
l'île Mbiye à Kisangani. Thèse de doctorat inédite,
ULB, Bruxelles, 389p.
Ntahobavuka H. et Nyakabwa M. 1988. Etude de
l'association à Synedrella nodiflora et Amaranthus
div. sp. dans les sous-régionsde Kisangani et de la Tshopo
(Zaïre). Ann.
Fac. Sc. 5: 45-57.
Nyakabwa, M., 1982. Phytocénoses de
l'écosystème urbain de Kisangani, thèse de doctorat
inédit, Vol I, Fac des Sciences, UNIKIS, 428 p
Nyakabwa M., 1988. Associations nouvelles de
l'écosystème urbain de Kisangani (Haut- Zaïre), in Schmitz
A., 1988: 293-310, Mus. Roy. Afr. Centr., Tervuren, Publ. CIDAT.
Pauwels L., 1993. Nzayilu N'ti-Guide des
arbres et arbustes de la région de Kinshasa -Brazzaville. 486 p. Ed.
Jard. Bot. Nat. Belg., Meise.
Pendje G. et Baya M., 1992. La réserve
de biosphère de Luki (Mayombe, Zaïre) : Patrimoine floristique
et faunique en péril. UNESCO, Paris. 62p.
Picard, N. & Gourlet-Fleury, S., 2008.
Manuel de référence pour l'installation de dispositifs permanents
en forêt de production dans le bassin du Congo. CIRAD, 270p.
PIERLOT, R. 1966. Structure et composition de
forêts denses d'Afrique centrale, Spécialement celles du Kivu.
Ac.Roy.Se. XVI-4, Bruxelles, 367 p.
PNUD, 2000. Rapport national sur le
développement humain 2000 : gouvernance pour le
développement en RDC. Kinshasa: PNUD/RDC.
Poorter, L., Bongers, F., Kouamé, F.N'. &
Hawthorne, W.D., 2004. Biodiversity of West African Forests. An
ecological Atlas of Woody Plant Species. CAB International, Cambridge,
Wageningen University, 521 p.
Richard, PW., 1952. The tropical Rain Forest.
Cambridge University Press, Cambridge.
Rollet, B. 1969. La
régénération naturelle en forêt dense sempervirente
de plaine de la Guyane Vénézuélienne. Bois et forêts
de Tropiques, 124 : 19-38.
Rollet, B., 1974. L'architecture des
forêts denses humides sempervirentes de plaines : Paris, CTFT, 298
p.
Robyns, W. 1958. Flore du Congo belge et du
Ruanda-Urundi. Spermaphytes ; tableau analytique des familles, Bruxelles 67
p
Schmitz, A., 1950. Les principaux types des
végétations forestières dans le Haut-Katanga.
C.R. Congrès Scient. Elisabethville. C.S.K., Bruxelles,
pp276-304.
Schmitz A., 1963. Aperçu les
groupements végétaux du Katanga. Bull. Jard. Bot. Nat. Belg.,
96(2): 233-347, 5 fig., 33 Tabl.
Schmitz A., 1988. Révision des
groupements végétaux décrits du Zaïre, du Rwanda et
du Burundi. Annales Sciences économiques, Vol. 17, Musée Royal de
l'Afrique centrale, Tervuren, Belgique, 315 p.
Schnell, R., 1970. Introduction à la
Phytogéographie des pays tropicaux. Les problèmes
généraux. Vol.I Les flores et structures. Gauthier-Villars eds.,
Paris, 499 p.
Schnell, R., 1976. Flore et
végétation de l'Afrique centrale. Ed. Bordas, Paris vol.1 468
p
Schnell R., 1970, 1971, 1976, 1977.
Introduction à la phytogéographie des pays tropicaux,
Ed. Gauthier-Villars, Paris. 4 Volumes.
Senterre, B. et Lejoly, J., 2001. Trees
diversity in the Nsork rain forest (Rio muni, Equatorial Guinea). Acta Bot.
Gallica 148(3), 227-235.
Senterre B., 2001. La phytogéographie
des forêts denses de Guinée Equatoriale, avec une attention
particulière aux forêts de Nsork. In XVIème Congrès
de l'ATEFAT. Jard. Bot. Nat. Belg. 71: 1087-1096.
Senterre B., 2005. Recherches
méthodologiques pour la typologie de la végétation et la
phytogéographie des forêts denses d'Afrique tropicale. Th. Doct.,
Fac. Sc. Lab. Bot. Syst. & Phyt., ULB. 456p.
Spiaf, 1988. Liste des essences
forestières du Zaïre. 1ère édition.
Saint-Paul, Limete/Kinshasa. 70P
Sunderland T., Gretchen W. et Issembe Y.
2004. Etude préliminaire de la végétation du Parc
national de Mbe, Monts de Cristal, Gabon, Rapport Forafri sunderland04b, 50
p
Tailfer, Y., 1972. Les Acajous de la
forêt dense Zaïroise, leurs identifications forestières,
Mus.Roy.Afr. Centr. Belgique, Annales, sér. IN-8-sc.Econ-n°8,
51p
Tailfer, Y. 1989. La forêt dense
d'Afrique Centrale. Identification pratique des principaux arbres. ACCT et CTA.
Wageningen. Tome 1, 456p.
Tailfer Y., 1990. La forêt dense
d'Afrique Centrale. Identification pratique des principaux arbres. Tome 1 et 2.
Wageningen, Centre Technique de Coopération Agricole et Rurale (CTA).
Toirambe, B., 2001. Valorisation des produits
forestiers non ligneux (pfnl) dans la réserve de Biosphère de
Luki-Bas-Congo. Mémoire inédit de DESS, ERAIFT, 163p.
Trichon, V., 1997.
Hétérogénéité spatiale d'une
forêt tropicale humide de Sumatra : effet de la topographie sur la
structure floristique. Ann Sci For 54, 431-446. Elsevier/INRA.
Trochain J.-L., 1957. Accord interafricain
sur la définition des types de végétation de l'Afrique
Tropicale. Bulletin de l'Institut d'Etudes centrafricaines, nouvelle
série, 13-14, Inst. d'Etudes centrafricaines, Brazzaville: 55-93.
UNESCO-MAB, 1996. Réserve de
biosphère, Bulletin du réseau n° 4, 24p.
Vellutini P., Rocci G., Vicat J.P. & Gioan P.
(1983). Mise en évidence de complexes ophiolithiques dans la
chaîne du Mayombe (Gabon-Angola) et nouvelle interprétation
géotectonique. Précambr. Res. 23: 1-21.
Walker, B.H. 1995. Conservising Biological
diversity throught ecosystem resilience Conservation Biology, 9: 747-752.
White, 1979. The Guineo-Congolian Region and
this relation ship to other phytochoria. Bull. Jard. Bot. Belg, 49: p.p.11-15.
Press. 2è ed., 282 p.
Whitmore, T.C. 1984. Tropical Rain Forests of
the Far East. 2nd. edition. Oxford University Press, Oxford.
Whitmore, T.C., 1990. An introduction to
Tropical Rain Forest. Oxford University Press, New York, 220p.
Whitmore T.C., 1998. An introduction to
tropical rain forests. Oxford: Oxford University
WILKS, C.M. et ISSEMBE, Y.A. 2000. Guide
pratique d'identification : les arbres de la Guinée Equatoriale,
Région continentale. Projet UREF, Bata, Guinée Equatoriale, 546
p.
WWF et ERAIFT, 2005. Carte de la
réserve de Luki, Province du Bas-Congo, R.D.C
|
|



