Chapitre III
Courbe a : le potentiel devient de plus en plus noble, il y a
passivation du métal par formation à la surface d'un produit de
corrosion insoluble protecteur. C'est le cas du fer plongé dans l'acide
nitrique concentré.
Courbe b : le potentiel devient de moins en moins noble, ou
plus négatif, il y a attaque du métal c'est le cas de l'aluminium
plongé dans la soude.
Courbe c : le potentiel devient d'abord plus négatif,
puis tend vers des valeurs plus positives, il y a attaque suivie de
passivation. C'est le cas de l'aluminium plongé dans une solution
d'acide nitrique à 15 ou 20 %.
Courbe d : le potentiel devient plus noble puis se
déplace vers des valeurs plus négatives, c'est le cas lorsqu'au
moment de son immersion, le métal est recouvert d'une couche
protectrice.
Le mécanisme de la corrosion peut être
décomposé en plusieurs étapes et notamment lors de
l'adsorption des ions Cl- à la surface du film passif, suivie
de la migration des ions Cl- à travers le film passif et en
fin terminé par la propagation de la piqûre dans le
métal.
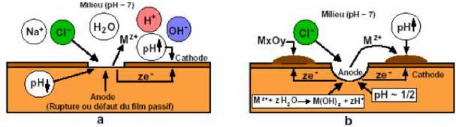
Figure III.4 : Amorçage (a) et propagation (b) d'une
piqûre [8].
En effet leur concentration locale induit une acidification du
milieu et d'autre part le film ainsi formé en surface du métal
devient moins efficace car plus instable et donc plus susceptible de se rompre
localement. Un autre effet de la salinité sur la corrosion
résulte de son influence sur la conductivité du milieu aqueux. La
résistivité du milieu aqueux corrosif limite la distance sur
laquelle le couplage est effectif. Cependant, la forte conductivité des
milieux salins tels que l'eau de mer (NaCl 0,5 M) implique que la
résistivité de l'électrolyte va jouer un rôle mineur
dans la cinétique des réactions de corrosion [4].
L'évolution du potentiel libre (potentiel d'abandon) au
cours d'un test de corrosion, est un premier indice pour estimer
l'évolution de sévérité de la dégradation
pendant l'immersion. L'échantillon est immergé dans une solution
NaCl à 0,5M. Son évolution donne des
Chapitre III
informations sur les phénomènes qui se
déroulent à l'interface métal/solution, ce qui permet
d'évaluer la stationnarité du système.
La figure III-5 Présente le chronopentiogramme de
l'acier nu immergé pendant 05 heures dans une solution NaCl à
0,5M.
|
-0,35
-0,40
|
|
|
|
|
|
1ier
Changement
|
|
|
|
E ( V/Ag/AgCl)
|
-0,45
|
|
|
|
-0,50
-0,55
|
|
|
2éme
Changement
|
|
|
|
|
|
|
-0,60
-0,65
|
|
|
|
|
|
|
|
|
|
46
0 50 100 150 200 250 300
Temps ( min)
Figure III.5 : Suivi du potentiel à circuit ouvert de
l'acier nu
dans une solution NaCl 0,5M
L'allure de la courbe de la figure III-5 nous a permis de
constater que le potentiel de corrosion n'atteint pas immédiatement une
valeur stationnaire, la stabilisation du potentiel à une valeur de -0,65
V/Ag/AgCl est atteinte après 05 heures d'immersion.
Avant la stabilisation du potentiel de corrosion, nous avons
constaté, en premier lieu, une augmentation relativement
remarquée du potentiel pendant les premières minutes d'immersion,
ensuite le potentiel diminue en deux temps différents , le premier
changement qui est après 01 heures d'immersion , la courbe est
caractérisée par une décroissance rapide du potentiel de
corrosion vers des valeurs très cathodiques, le potentiel devient de
moins en moins noble, ou plus négatifs, il ya une attaque provoquant une
dissolution du métal. En revanche, le deuxième changement c'est
un pseudo stabilité caractérisé par une faible variation
de potentiel de corrosion.
Le changement de l'allure de la courbe avec le temps
d'immersion est lié aux réactions de réductions se
déroulant à l'interface, généralement
l'évolution du potentiel vers des valeurs plus
électronégatives caractérise un phénomène de
dissolution spontané avant de se stabiliser
47
| 


