III. 4. 2. Evolution du potentiel à circuit ouvert
du substrat nu
0 50 100 150 200
E ( V/Ag/AgCl)
-0,18
-0,20
-0,22
-0,24
-0,26
-0,28
-0,30
Temps ( min)
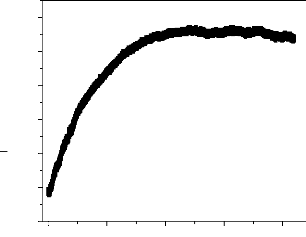
Figure III.17 : Suivi du potentiel à circuit ouvert de
l'acier nu dans l'eau
industrielle.
L'évolution du potentiel de corrosion libre en fonction
du temps de l'acier nu dans l'eau industrielle est représentée
sur la figure III-17. On constate que l'évolution du potentiel à
circuit ouvert se fait vers des valeurs positives et par conséquent
l'acier est de moins en moins actif.
Les études réalisées sur la corrosion de
l'acier en milieu neutre montrent des comportements différents selon le
temps d'immersion du métal dans la solution agressive [20,21]. Au
début de l'immersion, toute la surface du métal est active, ce
qui signifie que toute la surface du métal est disponible aux
réactions cathodiques et anodiques intervenant lors de la corrosion des
aciers. En revanche, après quelques heures d'immersion une partie de la
surface est bloquée par les produits de corrosion insolubles. En effet
l'analyse expérimentale démontre que les ions (SO4 -2,
Cl- ,CO3 -2, Ca+2, Mg+2,
K+, Fe+2) présents dans le milieu eau
industrielle, et en particulier la présence des sels carbonatés
constituent la source de la présence du dioxyde de carbone (CO2), ce
dernier intervient selon le mécanisme de réaction suivant :
2 HCO3 - CO2 + CO32- + H2O III-12
CO32- + H2O CO2 + OH - III-13
64
Chapitre III
Ainsi plusieurs auteurs proposentle mécanisme de
réaction du fer en présence de carbonates, dont celui de Castro
et al. [23] proposent la formation du complexe FeHCO3 + selon:
Fe+2 + HCO3 - FeHCO3 + III-14
Alors que Davies
et Burstein [24] proposent la formation du complexe Fe(CO3)2 -2
selon:
Fe+2 + 2 HCO3 - Fe(CO3)2 -2 +
2H+ III-15
Ces derniers justifient leur choix en étudiant
la solubilité de la sidérite avec la concentration en carbonate
à pH fixé. Dans ces conditions, ils montrent que la concentration
en ions ferreux est proportionnelle à la concentration de bicarbonate et
en accord avec l'équilibre suivant :
FeCO3 + HCO3 - Fe(CO3)2 -2 + H+
III-16
III. 4. 3. Evolution du potentiel à circuit ouvert
du substrat revêtu
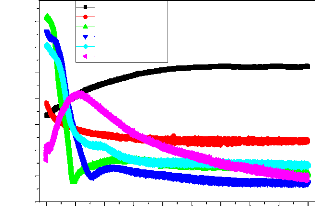
La figure III-18 présente l'évolution du
potentiel en fonction du temps pour les échantillons revêtus
à différentes densités de courant. Le potentiel à
circuit ouvert à été suivi pendant 03 heures d'immersion.
L'allure des courbes nous a permis de constater l'existence de trois formes
différentes. En effet, pour le revêtement élaboré
à 0,25mA/cm2, on observe une chute continue du potentiel vers
des valeurs cathodiques puis une stabilité du potentiel.
0 20 40 60 80 100 120 140 160 180
E ( V/Ag/AgCl)
-0,10
-0,15
-0,20
-0,25
-0,30
-0,35
-0,40
-0,45
substrat nu
revêtu à 0,25mA/cm2 revêtu à
0,5mA/cm2 revêtu à 1mA/cm2 revêtu
à 1,5mA/cm2 revêtu à 3mA/cm2
Temps(mn)
Figure III.18 : Suivi du potentiel à circuit ouvert de
l'acier revêtu à partir de
Ce(NO3)3.6H2O 0,1M dans une eau
industrielle
65
Chapitre III
Alors que pour les revêtements élaborés
à 0,5-1-1,5 mA/cm2 les allures des courbes suivent la
même tendance dans le temps, une chute importante du potentiel vers des
valeurs cathodiques puis une léger augmentation du potentiel vers des
valeurs anodiques suivi d'une stabilité du potentiel. L'évolution
du potentiel dans ce cas traduit que les revêtements formés
à ces densités de courant présentent les meilleurs
comportements à la corrosion.
Tandis que la courbe relative au dépôt obtenu
à 3mA/cm2 est caractérisée par une augmentation
du potentiel vers des valeurs anodiques puis d'une diminution jusqu'à
une stabilisation. Ceci confirme que les revêtements obtenus à
3mA/cm2 sont fissurés et qu'après immersion
(dissolution) la formation des produits de corrosion remplit le vide.
L'étude en milieu eau industrielle sera faite suivant
les mêmes conditions expérimentales que celles qui ont
été utilisées dans le milieu NaCl 0,5M, ceci nous
permettra d'étudier l'influence du milieu sur le comportement
électrochimique des revêtements.
| 


