INTRODUCTION
La diversité des eaux douces semble avoir
été sous-estimée dans plusieurs régions du monde.
Les eaux douces en tant qu'habitats naturels sont les écosystèmes
nécessaires non seulement pour l'alimentation et la reproduction des
nombreuses espèces des reptiles, d'amphibiens ; des sauvagines, des
mammifères, des invertébrés et des poissons. Elles
fournissent aussi une grande part de l'eau potable dans le
monde.(Verne ,2012).
Depuis la sortie de l'ouvrage d'Aristote «histoire
des animaux », les poissons ont occupé une place
importante dans des nombreuses investigations scientifiques. Malgré leur
grande importance alimentaire, touristique, culturelle et économique,
leur répartition est toutefois inégale : 50% des poissons
vivraient dans 17% de la surface des océans (qui sont souvent aussi les
plus surexploités mais certaines parties sont moins accessibles aux
humains).
L'effort de recherche sur la biodiversité des anciens
lacs africains a considérablement augmenté depuis les
dernières décennies, principalement en raison de
l'intérêt scientifique croissant porté à la biologie
de Cichlidae endémiques et à l'accroissement des industries de
pêche sur ces lacs africains.
Bien qu'il soit un des grands lacs de cette région, et
bien connu pour sa biodiversité exceptionnelle, le Lac Tanganyika est
aussi l'un des plus anciens lacs d'Afrique et deuxième plus profond du
monde (Poll, 1953; Brichard, 1989; Coulter, 1991 ; Patterson et
Makin ,1998 ; Nshombo et al, 2004). Ce lac possède une faune
halieutique particulièrement riche et diversifiée dans les zones
benthiques et côtières (Nshombo, 2008) dont le nombre avoisine 400
espèces de poissons comprenant un endémisme très
élevé spécialement dans la famille des Cichlidae (98%) et
des non-Cichlidae (46%) (Patterson et Makin, 1998 ; Nshombo, 2007;
Nanzige, 2006 ; Poll, 1956, 1986 ; Brichard, 1978 ; Kawanabe et
Mihigo, 1982). Un degré élevé de différenciation ou
de spéciation caractérise le taux d'évolution des
Cichlidae du lac Tanganyika et de tous les Grands lacs d'Afrique de l'Est
(Patterson et Makin, 1998 ; Plumptre et al., 2003). Beaucoup d'auteurs
soulignent que l'habitat littoral est plus complexe et les côtes
rocheuses, sableuses et rocheuses/sableuses offrent une variété
d'habitats. Aussi les communautés littorales du lac Tanganyika sont
dominées par les Cichlidae qui dépendent de ces habitats
(Kawanabe et Mihigo, 1982 ; Poll, 1956 ; Brichard, 1978 ; Hori,
1983).
Etant donnée cette diversité
élevée et surtout de l'importance commerciale, économique
et alimentaire, cette famille a fait l'objet de plusieurs recherches
scientifiques et quelques espèces en ont été
décrites alors qu'un nombre indéterminé attend
d'être décrit. Certaines de ces espèces qui n'ont pas
encore été décrites risqueraient de disparaître ou
se trouveraient seulement dans des collections des musées
(Lévêque et al. 1988).
Le lac Tanganyika avec sa richesse spécifique
présente un intérêt écologique et un capital
socio-économique certain au bénéfice de la population
riveraine. Le lac Tanganyika ainsi que sa richesse spécifique est bien
connu grâce à des nombreuses études écologiques y
réalisées spécialement principalement en ce qui concerne
la taxonomie et la systématique des poissons et plus
particulièrement les poissons Cichlidar mais très peu d'
études récentes traitent de certains aspects écologiques
tels que la diversité et la distribution des espèces piscicoles
dans les rivières, (Kisangani, 2007 ; Kisangani et all.,
2008 ; Mbalassa,2008).D'autres études ichtyologiques ont
été conduites par divers auteurs dans ce milieu sur les familles
des Cichlidae et des Non Cichlidae. Leurs travaux ont inventorié les
espèces de poissons des genres
Oreochromis,Bathybates,Astatotilapia,Limnothrissa ,
Stolothrissa,Clarias, Protopterus, , Barbus,
AplocheilichthysetCtenopoma.Poll,(1947),Akonkwa,(2006) ,Nshombo et
Muzumani,(2008),Mushagalusa,(2010), et Nabitu,(2012).
L'étude de l'écologie alimentaire et de la
reproduction de certains poissons du genre du Bathybates (B.minor et
B. graueri) sont fragmentaires malgré leur fréquences
dans les captures quotidiennes. Ces deux espèces endémiques
auraient les mêmes exigences écologiques et se reproduiraient au
même stade de maturité. Il importe donc de connaitre la relation
existante entre ces dernières espèces en vue d'une conservation
durable et une exploitation rationnelle de cette ressource.
C'est pour cette raison que nous avons voulu à travers
cette étude contribuer à la connaissance de l'écologie
alimentaire et de la reproduction des deux espèces du genre
Bathybates (Bathybates minor et B. graueri ) dans la partie nord du
lac Tanganyika.
Dans ce travail, en rapport avec ces deux espèces, nous
nous sommes fixés les objectifs spécifiques
ci-après :
ü identifier les aliments consommés
ü déterminer les stades de maturité
sexuelle,
ü évaluer la fréquence de leur proie.
L'intérêt porté sur ce travail est celui
d'apporter des données actualisées sur l'écologie
alimentaire et de la reproduction de B. minor et graueri, ainsi que la
contribution à l'étude de sa quantité dans les captures
des Cichlidae de la partie nord du lac Tanganyika, Territoire d'Uvira.
L'étude de la reproduction peut essentiellement
contribuer à la réglementation de la pêche car elle permet
d'évaluer la productivité de l'espèce, de
déterminer ses périodes de reproduction, ses lieux de fraies et
où se développent les alevins.
A côté de l'introduction, de la conclusion et
recommandations, le présent travail s'articule autour de quatre
chapitres. Le premier chapitre est consacré aux
généralités sur le lac Tanganyika et sur le genre
Bathybates. Le second chapitre décrit le matériel et les
méthodes de collecte, d'analyse et de traitement des données, le
troisième chapitre est consacré à la présentation
des résultats et le dernier chapitre à la discussion des
résultats.
CHAPITRE I : REVUE DE
LITTERATURE
A)
Généralité sur le lac Tanganyika
I.1. Situation
géographique du Lac Tanganyika
Le lac Tanganyika est situé dans la région des
lacs de l'Afrique de l'Est sur la branche occidentale de la
vallée
du Grand Rift. Logé dans la partie centrale du Graben occidental au
sud de l'Equateur à 29°5' et 31°15' de longitude Est soit une
longueur variant de 40 à 80 km et 3°20' et 8°45' de latitude
Sud soit une longueur de 650 km (MOORE, 1903). Sa température de surface
est de 25 °C en moyenne pour un pH variant de 7,6 dans les baies
marécageuses, à 9,5 en pleine eau. La profondeur ainsi que la
localisation tropicale du lac empêchent le renouvellement total des
masses d'eau et la plus grande partie des eaux profondes sont des
eaux fossiles et
anoxiques .
Le lac Tanganyika a une superficie de 32.900 km2 et ses eaux
occupent un volume de 18880 km3 (CAPART, 1952). Le même auteur indique
que, avec une profondeur de 1310 m dans le sous bassin Nord et de 1470 m dans
le sous bassin Sud, le lac Tanganyika est le deuxième en profondeur au
monde avec une profondeur maximal de 1433m et 770m en moyenne après le
lac Baïkal d'une profondeur de 1522 m. Solon la même source, le fond
du lac Tanganyika présente :
? Un bassin du Nord (Bujumbura) compris l'embouchure de la
RUSIZI et la baie du
Burton avec une profondeur maximale de 450 m.
? Le bassin de KIGOMA compris entre la presqu'île de
KUNGWE et la hauteur de KALEMIE.
? Le bassin de Zongwe qui possède la face la plus
profonde va du seuil de Kungwe jusqu'au seuil de Mpulungu.
Le lac Tanganyika est entouré de quatre pays qui se
partagent les 1850 km de son périmètre d'une manière
inégale (HANEK et al, 1993) :
? Le Burundi au Nord-Est contrôlant 159 km des
côtes (soit 9%),
? La R.D.C à l'Ouest avec 795 km (soit 43%),
? La Tanzanie à l'Est et au Sud-Est avec 669 km (soit
36%),
? La Zambie au Sud avec 215 km (soit 13%)
Ainsi les eaux du lac s'étendent principalement sur la
R.D.C avec 45% de la surface du lac, suivie de la Tanzanie avec 41%, le Burundi
avec 8% et la Zambie avec 6%.
I.2 la physico- chimie du lac
Tanganyika.
La température moyenne de l'eau dans les cents premiers
mètres serait proche de 25°C. Des températures allant
jusqu'à 28°C à la surface ont été
signalées par Stappers(1952) et Deelstra(1971), Cité par AKONKWA
BALAGIZI, 2006.
Selon Cappart(1952), la couche d'eau thermiquement stable se
situe entre 250m et 280m de fond.La conductivité électrique
à 20°C varie de 600 à 690MS /Cm (Kufferath, 1952 ;
Deelstra, 1972), cité par AKONKWA BALAGIZI, 2006.
La salinité totale varie de 357mg /l à
460mg/l. Les eaux du lac sont moyennement pures.
Le PH est élevé de 8 ,9 à
9,0 ;(Symoens1968 et Deelstra 1972) cité par AKONKWA BALAGIZI,
2006.
L'oxygène dissout est un élément
essentiel à la vie ders organismes aérobies du lac. Le taux de
saturation en oxygène dissous oscille autour de 100% en eaux de surface
(CRUL, 1994). Selon le même auteur, la limite en profondeur est fonction
du degré d'agitation des eaux de surface. La couche profonde
dépourvue d'oxygène représente au moins les 3/4 des eaux
du lac Tanganyika. Des analyses ont montré que la limite la plus
profonde de l'oxygène se situe entre 150 et 200m selon l'endroit et les
saisons (HORI et al., 1993).
Toute la surface du lac est fortement oxygénée
jusqu'à une profondeur variant selon les saisons et les bassins entre 40
et 115m au Nord, 110 et 225m au Sud Kufferath, 1952, Dubois, 1958 ; Degens
et al 1971), cité par AKONKWA BALAGIZI, 2006.
L'eau de profondeur est caractérisée par un
faible pH comparé à l'eau de surface. La consommation de dioxyde
de carbone au cours de la photosynthèse entraine des valeurs
élevées de pH. Ceci peut expliquer les fluctuations du pH
mesuré dans les différentes stations du lac. Durant la saison
humide, les changements de pH sont réduits pour atteindre des valeurs
plus stables. En février le pH est généralement similaire
à chaque station. Il est souvent compris entre 9,0 à la surface
et 8,7 à 300m avec une variation du pH importante de septembre à
décembre (PLISNIER et al., 1999).
La couleur et la transparence des eaux du lac Tanganyika sont
variables en fonction de l'endroit où l'on se trouve. Elles sont bleu
avec une très grande transparence au large du lac (jusqu' à 22
m), vertes avec une transparence encore assez bonne (de 10 à 15 m), dans
les baies à fonds rocheux et d'une couleur plutôt variable (brune
à verte) avec une transparence réduite dans les baies à
fond sablonneux à proximité du delta des rivières
(NTAKIMAZI, 1995).
I.3. Histoire
géologique du lac Tanganyika
L'histoire du lac Tanganyika n'est pas définitivement
établie. La version actuelle est que lors des plissements alpins, le
massif Africain s'est fracturé et a donné naissance au
Rift-Valley qui va de la Mer Rouge à l'embouchure du Zambèze
(NYAKAGENI, 1985). Il est le plus long, le plus vaste et le plus vieux des lacs
du Rift africains. Le lac Tanganyika se serait formé depuis le
miocène il y a 20 millions d'années (COULTER et al, 1991).
NTAKIMAZI (1992) parle d'un âge situé entre 5 et 20 millions
d'années et pendant plus de la moitié de cette période, le
lac était isolé des autres systèmes hydrographiques.
Selon BRICHARD (1989), trois phases semblent s'être
succédé dans l'évolution du lac Tanganyika :
? Phase I : Au cours de cette phase, il y aurait eu deux lacs
séparés par un mur de 500 à 600 m de hauteur ;
? Phase II : Les deux lacs auraient fusionné et la
profondeur aurait augmentée jusqu'à 700m ;
? Phase III : La profondeur du lac aurait augmenté
jusqu'à 900 m.
I.4. Conditions
hydrologiques.
Le lac Tanganyika est un réservoir estimé
à 18.800 km3 d'eau fraîche (COULTER, 1991). Selon NYAKAGENI
(1985), le lac Tanganyika est alimenté par des rivières de types
très variés. Ces rivières présentent le plus
souvent des débits très réguliers pendant au moins neuf
mois de l'année.
I.4.1. Affluents du lac
Tanganyika
De par l'importance des eaux déversées au lac
Tanganyika, deux affluents retiennent principalement l'attention : la Ruzizi et
la Malagarazi.
I.4.1.1. Rivière
Ruzizi
Suivant un cours Nord Sud, la Ruzizi sépare le Rwanda
au Nord et le Burundi au Sud, ainsi que la République
Démocratique du Congo qui les borde à l'Ouest. Située
à l'Ouest du Burundi, la Ruzizi est une rivière par laquelle le
lac Kivu se déverse dans le lac Tanganyika. Pendant son trajet de 117
km, elle récolte les eaux de nombreux affluents nommés Luvungi,
Nyakagunda, Nyamagana, Muhira, Kaburantwa, Kanuzi, Nyarundari, Mpanda et Ruhwa
(COULTER, 1991).
I.4.1.2. Rivière
Malagarazi
Elle draine plus de la moitié de la surface du bassin
du lac. Avec de nombreux affluents, elle capture les eaux sur une superficie
d'environ 130.000 km2 à l'Est du lac (PATTERSON et al., 1996). La
Malagarazi forme la frontière entre le Burundi et la Tanzanie sur 156
km. Les principaux affluents au Burundi sont Rukoziri, Nyakabonda, Mutsindozi,
Ndanga, Nyamabuye, Muyovozi, Musasa et Rumpungwe (NGENDAKURIYO, 2008).
I.4.2. Variation du niveau du
lac
De 1878 à 1884, le niveau du lac est tombé de
784 m jusqu'à 775m d'altitude pour atteindre son niveau le plus bas de
773m en 1894 (CAMUS, 1965). Les variations de niveau du lac résultent
d'une part de la différence entre les apports d'eau et d'autre part les
eaux acheminées par la Lukuga vers le fleuve Congo et
l'évaporation. Selon le même auteur, l'évaporation influe
beaucoup sur les variations du niveau car chaque année, elle
enlève au lac une couche de 1,6 m à 2 m tandis que
l'écoulement, lui, n'emporte que 2 m par an. Actuellement, les
variations annuelles des niveaux sont de l'ordre de 1m (NTAKIMAZI, 1995).
I.5. Conditions physiques et
climatiques.
Concernant les conditions thermiques, COULTER et al. (1991)
indiquent que le lac Tanganyika s'inscrit dans les lacs du type tropical
où la température est supérieure à 25°C avec
un écart moyen dépassant très rarement 3°C. On
observe une stratification thermique où une couche superficielle
«épilimnion » chaude, se superpose à une couche
profonde «l'hypolimnion» plus froide. Entre les deux se trouve «
le métalimnion » caractérisé par une
«thermocline» accusée.
? L'épilimnion dont la température varie de 25
à 27°C et dont l'épaisseur varie en fonction des saisons
entre 50 à 80 m dans le bassin nord du lac.
? Le métalimnion qui est une couche
intermédiaire où la température passe rapidement de 26
à 23,5°C
? L'hypolimnion, la couche la plus profonde et aussi la plus
épaisse, avec des températures stables de 23 à 23,7°C
Le même auteur indique aussi que le lac Tanganyika connaît un
climat intertropical avec des précipitations annuelles qui couvrent
presque huit mois de l'année avec une pluviométrie de 900mm.
I.6. Biotopes du lac
Tanganyika
Du point de vue des critères physiques et biologiques
associés à la profondeur et même au profil du lac, on peut
distinguer (COULTER 1991) :
? Une zone littorale constituée d'habitats très
variés et parfois difficiles à fixer les contours.
? Une zone sub-littorale, de la limite littorale
jusqu'à la profondeur limite de l'oxygène dissous (environ 100 m
dans le bassin Nord et à 200 m dans le bassin Sud). Le fond est souvent
mou.
? Une zone pélagique située entre la surface des
eaux au large jusqu' à la limite de l'oxygène en profondeur.
C'est une zone favorable au plancton et à la grande biomasse de
poissons.
? Une zone profonde située au-delà de la limite
inférieure de l'oxygène dissous, elle est donc impropre à
la vie aérobie. Elle occupe à elle seule environ 70% de la
cuvette lacustre.
Selon POLL (1958), les biotopes des estuaires et des marais
sont des expansions des rivières, des marais et des marécages
autour du lac. Ce sont des habitats fluviatiles, c'est à-dire propre aux
rivières et aux affluents caractérisés par des conditions
écologiques différentes de celles du lac.
I.7. Faune et flore
Au total, il y a plus de 2.156 espèces des plantes et
d'animaux dans le lac.
I.7.1. La flore.
La flore est constituée d'espèces d'algues (759
espèces) et des plantes aquatiques (81 espèces) (Nshombo,
2004 ; Coulter 1994).
a. Le
Phytoplancton
Des collections de phytoplancton ont été faites
depuis les expéditions de 1904 - 1905 au Lac Tanganyika (West, 1907
inNshombo, 2004). A partir des travaux antérieurs, l'on a
enregistré dans les collections pédagogiques : 474 taxa
infra génériques de Diatomées, 224 taxa de Chlorophytes,
111 taxa de Cyanophytes, 59 taxa d'Euglenophytes, 21 taxa de
Chorophytes, 19 taxa de Dinophytes, 14 taxa de Cryptophytes, taxa de
Chrysophytes et un taxa de Prymnesiophytes. Huit pour cent des
Diatomées du Lac Tanganyika sont endémiques (Nshombo, 2004).
b. Les plantes
supérieures
Les communautés de végétations couvertes
des feuilles sont comparativement rares dans le Lac Tanganyika, et
contrairement à la situation du Lac Victoria, les études sur les
plantes ont largement manqué. La plupart des zones avec beaucoup de
végétation sont limitées aux embouchures des
rivières qui, dans le cas de la Malagarasi, donnent naissance à
un grand marécage. Ces marécages sont souvent dominés par
Cyperus papyrus, Typha carex et d'autres plantes
émergentes.
I.7.2. Faune : la faune est
diversifiée et les principaux groupes seront représentés
dans le tableau ci-dessous
Tableau n°1. Principaux groupes fauniques du Lac
Tanganyika (Nshombo, 2004).
|
Taxon
|
Espèces
|
% des endémiques
|
|
Protozoaires
Cnidaires
Spongiaires
Bryozoaires
Vers plats
Ascarides
Vers en crin de cheval
Vers à têtes épineuses
Pentastomides (petit groupe de parasites)
Rotifères
Escargots
Palourdes
Arachides (araignées, scorpions, miles, tiques)
Crustacées
Insectes
Poissons (Cichlidae)
Poissons (non Cichlidae)
Amphibiens
Reptiles
Oiseaux
Mammifères
|
71
02
09
06
11
20
28
09
01
70
91
15
46
219
155
250
75
34
29
171
03
|
78
33
64
35
61
07
75
60
37
58
12
98
59
|
|
Total
|
2.156
|
|
Parmi les groupes majeurs contribuant aux niveaux
élevés de diversité ce sont les poissons qui ont
reçu probablement le plus d'attention. On connaît à l'heure
actuelle plus de 325 espèces des poissons dans le Lac Tanganyika dont
250 espèces de Cichlidae et le reste repartie en 18 familles non -
Cichlidae (Nshombo,2004). Sur toutes les espèces de Cichlidae connues
à présent au Lac Tanganyika, seulement 5 ne sont pas
endémiques. Cela veut dire que plus de 97% de toutes les espèces
Cichlidae sont endémiques au Lac Tanganyika. La spéciation des
Cichlidae semble être une caractéristique de Grands Lacs du Rift
Albertin. Max Poll1986 a classé les Cichlidae du Lac Tanganyika en 12
tribus.
Milieu d'étude
L'extrême nord-ouest du Lac Tanganyika à Uvira
est un sous bassin du bassin de Bujumbura du côté de la R.D.Congo
qui est limité au nord par la plaine de la Ruzizi et au sud par la baie
Burton (Amundala et al., 2002 ; Safari, 2009). Ce sous bassin est
situé dans la partie médiane du système de la
vallée du Riff Est Africain. Il est caractérisé par deux
ensembles morphologiques dont une plaine littorale à 773m d'altitude qui
représente une formation sableuse et sinueuse de largeur variable, le
versant oriental des monts Mitumba avec un relief qui s'élève
progressivement au niveau d'Uvira de l'Est vers l'Ouest où il atteint
plus de 2500 m à certains endroits et où plusieurs affluents
prennent naissance (Kakogozo et al.,2000 in SAFARI, 2009). Kavimvira, Mulongwe
et Kalimabenge sont les rivières permanentes parcourant la cité
d'Uvira d'Ouest vers l'Est et font partie de ce réseau hydrographique.
Cependant, nos sites sont situés aux intervalles de ces principales
rivières (figure n°3).
Le climat dans cette région est du type tropical humide
caractérisé par une alternance des saisons humides et
sèches. La pluviométrie moyenne annuelle est de plus ou moins 800
mm et la température moyenne annuelle est à peu près de
24°C.
La zone littorale du lac Tanganyika à Uvira le plus
souvent alterne avec des plages de galets ou de sable et est souvent rocheuse
dans l'ensemble du lac (Coulter, 1991) et type de substrat du milieu est un
élément déterminant majeur des assembles des
espèces trouvées dans les régions littorales (Kawabata
&Mihigo, 1982 ; Hori et al., 1983 ; Nakai et al., 1994).
Poissons
Cichlidae
1°)
Description
La plupart des Cichlidae ont une forme corporelle typique,
similaire à la perche, mais de nombreuses variantes existent, d'un corps
faiblement élevé à très comprimé.
Extérieurement, les Cichlidae se caractérisent par une seule
narine de chaque côté de la tête à quelques
exceptions près, tous ont une ligne latérale divisée en
une section supérieure longue et une section inférieure courte
qui s'étend sur le pédoncule caudal. Sur le plan interne, ils
partagent une série de spécialisations anatomiques dont beaucoup
de modifications impliquent les os pharyngiens, inférieur et
supérieur .Ces os pharyngiens, extrêmement bien
développés, jouent un rôle primordial dans l'alimentation,
libérant ainsi efficacement les mâchoires buccales qui se
spécialisent dans la capture des proies alimentaires. Les
particularités de la forme et de la denture des os pharyngiens ont de la
forme et de la denture des proies alimentaires. Les particularités se
spécialisent dans la capture des proies pharyngiens ont une importance
considérable dans la taxonomie des Cichlidae. De même, la forme
des mâchoires buccales et leur dentition constituent des
caractères importants chez les Cichlidae, en particulier africains. Tous
les Cichlidae pratiquent des soins parentaux intensifs aux jeunes, souvent
longtemps après la ponte, la famille montrant un tableau complexe de
stratégies reproductives. La plupart des Cichlidae peut être
classés comme étant des pondeurs sur substrat ou comme
incubateurs buccaux, plusieurs catégories intermédiaires et
divers répertoires comportementaux existent dans chaque catégorie
et la biologie reproductive est importante dans la taxonomie et la
classification des Cichlidae. Les évaluations actuelles du nombre
d'espèces de cette grande famille sont très variables (1300-3000
espèces) et de nombreuses espèces nouvelles sont
découvertes chaque année (L.J. Stiassy et al., 2007).
2°)
Coloration
Les Cichlidae sont des poissons voyants avec un système
de communication complexe. Leur patron de coloration est formé par
l'interaction de milliers de chromatophores sous contrôle des
systèmes nerveux, il peut changer rapidement sous l'influence de
l'état de motivation ou au moment de la reproduction. Le patron de la
coloration est particulièrement important dans la communication des
Cichlidae et ces modules sont souvent très utiles dans la discrimination
taxonomique entre les espèces. De nombreuses informations sont
malheureusement perdues lors de la conservation, mais beaucoup de
caractères restent visibles, souvent pendant des années
après leur mort.
3°) Habitat
Le type de substrat est un élément
déterminant majeur des assemblages des espèces trouvées
dans les régions littorales et benthiques du lac (Brichard,
1978,1989 ; Fryer et Iles, 1972 ; Kawabata et Mihigo, 1982 ;
Nakai et al. ; 1994 ; Hori et al., 1983 ; Patterson et Makin,
1998 ; Axelrod et al.,1977; Lévêque et al., 1988). C'est
ainsi que l'on peut également séparer les Cichlidae en fonction
du type de substrat :
· rocheux
· sableux
· marécageux
· les zones de sédimentation des rivières
affluentes,
· les zones de dépôt de coquillages
La distribution des espèces de Cichlidae est
associée aux habitats où l'on trouve les espèces : il
s'agit de
ü la zone supérieure, zone très peu
profonde où les vagues se brisent sur des plages sableuses ;
ü le littoral, la zone supérieure jusqu'à
une profondeur de 20 m environ ;
ü la zone sous-littorale, la zone au-dessous d'une
profondeur de 20 m ;
ü le benthique, la plate-forme plus ou moins plate du
fond ;
ü la partie bathypélagique, les eaux profondes
mais encore oxygénées jusqu'à une profondeur de 80 m au
nord et de 240 m au sud du lac.
B.
Généralités sur la tribu Bathybatini
Tableau n°2 classification des
Bathybates
La tribu Bathybatinicomprend deux genres essentiels
à savoir :Les
poissons du
genreBathybastes
comportant 7
espèces de
Cichlides
endémiques du
lac
Tanganyika :B.
Bathybates
fasciatus Boulenger, 1901
Bathybates
feroxBoulenger, 1898,
Bathybates
graueriSteindachner, 1911,
Bathybates
horniiSteindachner, 1911,
Bathybates
leoPoll, 1956,
Bathybates
minorBoulenger, 1906,
Bathybates
vittatus Boulenger, 1914 et les poissons du genre
Hemibatescomportant une seule espèce
Hemibatesstenosoma Boulenger,1901 aussi endémique du lac (M.Poll,1989,W.COULTER,19)
B.2. Tribu des Bathybatini
de l' Cette tribu renferme les cichlides de taille moyenne de
plus de 20Cm, le corps allongé mais comprimé3-3.5 fois plus long
que le haut (Hemibates) 3-3-5.5 fois plus long que le haut(
Bathybates).Tête a museau droit, long et comprimé. Bouche
terminale, fendue en longueur, plus ou moins oblique, mâchoire
inférieure à menton proéminent. Dents fortes, coniques et
inclinées vers l'interieur,en2 à 4 séries ,les internes
plus ou moins répressibles, au nombre de 90 à 110 (
Hemibates) ou 28 à 52 ( Bathybates) dans la rangées
externe supérieur, écartées l'une autre et plus grandes
que les dents internes (Bathybates).Os pharyngien inferieur
triangulaire ,étiré en longueur et encoché au bord
postérieur ;dents coniques, espacée, plus fortes en
arrière .Apophyse d'articulation crânienne de l'os pharyngien
inferieur du type Haplochromis( GREENWOOD 1978 ).
Dorsale XIII-XV(XIII), 14,17(18) ; Anale III,
13-19 .Rayons Mous de dorsale plus longs que les épines, ce qui se
traduit par une dénivellation entre les deux régions ou par des
épines plus courtes. Les pelviennes à rayon on externe de
longueur variable, parfois à peine plus long que le rayons les plus
internes. Caudale échancrée .Ecailles cycloïdes, petites,
au nombre de60 et 96 en ligne longitudinale. Livrée, chez le
màle, ornée de bandes noires sur les flancs transversales en
avant et longitudinales en arrière, parfois moracées en
taches ; ces marques mélaniques plus ou moins effacées chez
la femelle. Taille : 200-420mm. Incubation buccale maternelle.
B.2.1. Genre Bathybates (Poll
1956)

Figure n°1 Bathybates minor Boulenger, 1906
Hauteur du corps comprise 3,55
à 3,85 fois ; longueur de la tête 2,75 à 3 fois dans
la longueur standard ; tête 2,40 à 2,65 fois aussi longue que
large ; museau long et comprimé ,sa longueur varie entre 2,7
à 3 fois dans celle de la tête, sa largeur comprise 1,15 à
1,25 fois dans sa largeur, 1 à 1,40 fois aussi long que l'oeil, à
profil supérieur droit ;le pédicelle maxillaire n'atteignant
pas le niveau du bord antérieur de l'oeil ;oeil grand de forme sub
arrondie ,compris 3,25 à 3,80 fois dans la longueur de la
tête,1,25 à 1,50 fois aussi grand que la largeur de l'espace
interorbitaire1,50 à 2,55 fois aussi grand que la hauteur pré
orbitaire ; maxillaire entièrement caché, s'étendant
jusqu'au niveau du bord antérieur de l'oeil ;mâchoire
inferieur comprise 1,95 à 2,10 fois dans la longueur de la tête,
à menton proéminent ;joue nue sans
écailles ;dents coniques ,incurvées et ravisseuses ;os
pharyngien inferieur en forme de triangle étiré en longueur,
à lame antérieur bien formée mesurant les deux tiers de la
longueur de l' aire dentaire ;dents pharyngiennes forte, conique et
espacées, beaucoup plus longues en arrière ; Dorsale
profondément encochée en 2 parties presque séparées
; espace inter orbitaire égal à 20,0 à 21,3 % de la
longueur de la tête ; Dorsale XIII-XIV, 15-17 ; Anale III, 17-19 ; 10
à 12 branchiospines inférieures ; 71 à 86 écailles
en ligne longitudinale ; Cette espèce trapue possède une
morphologie très caractéristique et unique dans le genre, avec
une dorsale fortement encochée, une bouche dirigée vers le
haut.
Origine :
poisson originaire d'Afrique, endémique du lac Tanganyika. Espèce
de poisson trouvée dans l'ensemble du lac généralement
à une profondeur comprise entre 120 et 200 mètres.
Coloration :
Les mâles ont également une coloration typique formée de
lignes longitudinales noires sur le dos et les flancs, livrée
marquée uniquement par 4 bandes longitudinales sur les flancs; une tache
operculaire dans le haut de l'opercule, une ligne longitudinale noire dans la
nageoire dorsale ; femelle très argentée comme le mâle
mais sans bandes latérales.
Habitat :
poisson d'espèce pélagique de profondeur moyenne, s'approchant du
rivage surtout la nuit, mais aussi bien le jour à des profondeurs
variables ,vivant à une température variant entre 24°C
et 26°C , pH :7,5 à 8,5 ;dureté de 10°d
GH à 18° d GH
Régime : piscivores des petits
poissons indéterminés et Stolothrissatanganicae
Reproduction : aucun cas d'incubation
buccale n'as été observé en revanche, des ovaires murs
offrant des très gros oeufs au nombre de 60 avec une taille de 4mm ont
été vu chez une femelle de 175mm de longueur totale. Longueur
maximum : 205 mm (Poll, 1956)
Il s'agit d'incubateurs buccaux,
l'une des particularités de cette espèce et la taille importante
des oeufs, environ 6mm.la femelle prépare toute seule le site de ponte.
L'incubation buccale peut durer plus d'un mois. Les alevins ont
déjà une belle taille lorsqu'ils sortent de la bouche maternelle.
Ils acceptent des nauplius d'artémias et des paillettes. Leur
élevage ne cause aucun problème
particulier.(http//www.aquabase.org)
Bathybates graueri :

Figure n°2 Bathybates
graueri
Hauteur du corps comprise entre 3,55 à 4,0 fois,
longueur de la tête 2,60 à 2,70 fois dans la longueur
standard ; tête 2,60 à 2,85 fois aussi longue que
large ; museau log et comprimé, sa longueur comprise 2,5 à
2,6 fois dans celle de la tête, sa largeur comprise 1,5 à 1,60
fois dans sa largeur; l'oeil grand de forme ovale, compris 3,40 à 3,65
fois dans la longueur de la tête 1,90 à 2,30
fois(juvéniles) aussi grand que la largeur de l' espace inter orbitaire
1,20 à 1,35 fois aussi grand que la hauteur pré orbitaire ;
maxillaire caché par le pré orbitaire, ne s'étendant pas
jusqu'au niveau du bord antérieur de l'oeil ;mâchoire
inferieur comprise 2,2 à 2,32 fois dans la longueur de la tête,
à menton très proéminent ;joue écailleuse
portant (3-4) rangées d'écailles ; dents toutes fortes,
incurvées, ravisseuses en 3-4 un peu plus grandes extérieurement
et au nombre de 36-46 dans la rangée externe supérieur, os
pharyngien inferieur en forme de triangle étiré en longueur,
à lame antérieure très courte ne mesurant que le tiers de
la longueur de l'aire dentaire ;dents pharyngiennes fortes, coniques et
espacées ;Dorsale XIII-XIV, 14-16; Anale III, 14-16 ; 11 à
13 branchiospines sur la partie inférieure du premier arc branchial ;
60 à 72 écailles en ligne longitudinale ; Cette espèce est
moyennement élancée.
Distribution
géographique: poisson originaire d'Afrique, endémique du
lac Tanganyika. Elle trouvée dans l'ensemble du lac en
général et repartie sur 4 pays dont la République
démocratique du Congo, le Burundi, la Tanzanie et la Zambie
Coloration :
livrée du male très tranchée caractérisée
par une série de 3- 4 barres verticales sur l'avant du tronc,
perpendiculaire aux 4bandes horizontales qui ornent l'arrière flanc.
Opercule offrant deux grosses taches noires ; femelle très peu
marquée sauf sur le dos ; longueur maximum 250 mm. (Poll, 1956).
Habitat :
poisson d'eau douce ou pélagique, espèce fréquentant des
fonds assez variables mais en moyenne assez importants. C'est une espèce
bathypélagique, vivant dans l'eau à pH entre 6,5 et 7,7 ;
dureté entre 5°d GH et 15° d GH et une température
de 5°C et 28° ( Coulter 1994)
Régime : vorace ;
prédateur, ichtyophage
Reproduction : rien n'a
signalé
CHAPITRE II. MATERIEL
ET METHODES
II.1. Sites
d'échantillonnage
La cité d'Uvira subit aujourd'hui une pression
démographique avec une population concentrée sur diverses
activités telles que : agriculture, élevage, commerce,
d'autres activités tertiaires et surtout la pêche qui constitue
une activité importante le long des côtes d'Uvira sur plusieurs
plages ou sites d'échantillonnage dont les principaux sont
(Deo Mushagalusa ,2010) :
a. Kalundu : situé entre la
rivière Kalimabenge et le port de Kalundu, il connaît aussi une
présence humaine intense le long du littoral et les activités de
pêche sont les plus dominantes surtout pour les Clupeidae avec des
catamarans et senneurs à la recherche des poissons Cichlidae. L'eau du
lac sert pour diverses activités : vaisselle, lessivages, boissons,
etc. et le substrat est dominé par du sable qui est creusé pour
la construction. Le marché Maman Martha Bashomerwa est a quelque
mètre du lac. ces sites ont étés choisis compte nue de
leur accessibilité mais aussi pour réaliser un
échantillonnage plus représentatif.
b. Mulongwe : Ce site se trouve entre
les rivières ayant le même nom et Kalimabenge, connaît une
si forte démographie et la plage est plus surtout menacée par
diverses activités humaines : marchés, ports, constructions
anarchiques à 0m de l'eau. Les communautés de
végétation couvertes de feuilles sont rares mais on trouve
à certains endroits des plantes envahissantes comme la jacinthe d'eau
(Eichhorniacrassipes). La plage est sale et elle est encombrée par des
vieux habitations, des sachets en plastique, papiers et autres matériaux
non dégradables abandonnés. Un substrat rocheux domine ce site.
c. Kasenga : situé entre
Kavimvira et la rivière Mulongwe, ce site connaît une grande
présence humaine à la recherche du sable et roches pierres pour
la construction des maisons avec d'autres activités comme la lessive et
autres travaux ménagers. Ce site renferme rarement une
végétation avec des maisons d'habitation à 1m de l'eau
sauf aux embouchures des rivières. Le substrat côtier et les plus
souvent est sableux et les senneurs, y pêchent toute la journée.
d. Kilomoni : la plage ou le site de
Kilomoni est sur sa grande partie sableuse avec certains endroits alternant le
sable et les roches. Parfois on trouve de petites espèces à
macrophytes (Phragmites mauritianus.), menacée par des
constructions et surtout des fermes des paysannes autour. Il y a un afflux des
pêcheurs chaque jour qui s'adonne aux activités de pêche
à tout moment de la journée. lesquels embarquent souvent le soir
pour débarquer le matin ou pouvant pêcher à tout moment.
Leurs engins (pirogues filets et autres) restent étalés sur la
plage où certains pêcheurs peuvent camper le jour. Certaines
activités humaines sont observables sur le site : lavage, lessive
et le bain. Ce site se trouve entre la frontière burundaise et
Kavimvira
Kalundu
Mulongwe
Kasenga
Kilomoni
Figure n°3. Localisation des sites d'étude le long
du littoral d'Uvira
Période et technique
d'échantillonnage
L'échantillonnage, dans la partie nord-ouest du lac
Tanganyika sur les 4 sites ( Kilomoni, Kalundu, Kasenga, et Kalundu) a couvert
une période de 4 mois, de Mars à Juin 2014 en raison de deux
sorties par mois et ce reparti en 4 jours, soit un jour par site.
Matériel utilisé dans la récolte
des données
Nos déplacements dans les 4 sites ont
étés facilités par une moto, une pirogue monoxyle de 3m de
longueur et parfois par une marche à pied. Un stylo et un carnet
étaient à notre disposition pour la prise de certaines
données.
Le filet maillant dormant de longueur de 500m, 1,5m de largeur
et 1,5cm de maille et de couleur blanche a été utilisé
pour la capture des poissons (Bathybates graueri et Bathybates
minor).
Le formol de 4% a été utilisé pour la
conservation des espèces introduites dans les bocaux. Une seringue a
servi pour injecter le formol dans l'orifice anal pour arrêter la
digestion dans l'estomac en fin de conserver les contenus stomacaux.
Des bocaux en plastique ont étés utilisés
pour la conservation des poissons
Le filet maillant dormant :
Constitué par une nappe rectangulaire dont la longueur
est de 500m et la hauteur d'un mètre et demi. La dimension des mailles
est de 1,5cm, La nappe de filet est montée sur deux ralingues, une
ralingue supérieure munie de flotteurs, souvent constituée de
polystyrène, et une ralingue inférieure munie de pierre.
La pêche au filet maillant se pratique à la
tombée de la nuit et au lever du jour.
Toutefois, les sorties pendant la soirée sont plus
irrégulières à cause du vent appelé « Kusu
» en Kivira, langue locale, soufflant du Sud au Nord. La pêche de la
soirée et celle matinale se pratiquent à l'aide d'une pirogue
monoxyle non motorisée, 2 cordes attachées au filet, 2 à 3
rames, et emploie 2 personnes. Le départ pour pêcher se faits vers
3h souvent en milieu pélagique. Le filet est posé vers 4h pour
être relevé aux environs de 7h30, le démaillage se fait au
même moment qu'on retire le filet pour éviter de ne pas prendre
beaucoup de temps et se poursuit jusqu'à ce qu'on débarque si
l'opération n'était pas finit dans le lac, Le retour sur la plage
de débarquement se fait souvent vers 8h. L'arrangement du filet de
poursuit par les petits enfants de 10 à 13 ans entre 8 heures et 9
heures 30min.
Des papiers autocollant ont étés utilisés
pour l'étiquetage des bocaux contenant les échantillons,
Une latte en plastique graduée de 30cm nous a servi
pour la prise des dimensions des mailles du filet.
Matériel utilisé au laboratoire
- Le laboratoire de biologie du CRH et celui de l'U.O.B ont
servi des lieux d'analyses des échantillons. Nous avons utilisé
une trousse de dissection, deux plateaux, un masque à gaz, les gans, un
pied à coulisse de marque canon permettant une mesure de zéro
jusqu'à 300mm de longueur. Des bocaux pour conserver les
échantillons, une loupe pour observer des éléments et les
oeufs en détail non discernables à l'oeil nu, des papiers
filtres, du formol dilué à 4% pour conserver les
spécimens , , boite de pétrie et des pinces pour
compter les oeufs. Une balance de précision électronique de
marque Kern permettant une mesure précise de 0,01g à 200g. Le
microscope optique monoculaire de marque KYOWA / TOKWO/ Numéro 8900684
de grossissement 4x10 ; 4x 40 et 4x 100 Pour
l'identification des proies consommées par les poissons et le stade de
maturité des gonades de poissons, les ouvrages suivantes
utilisées : MICHA 1973, PLISNIER et al 1988 ont étés
utilises.
METHODOLOGIE DE RECOLTE
DES DONNEES
Sur le terrain
Le filet maillant dormant:
constitué par une nappe rectangulaire dont la longueur est de 500m et la
hauteur d'un mètre et demi. La dimension des mailles est de 1,5cm, La
nappe de filet est montée sur deux ralingues, une ralingue
supérieure munie de flotteurs, souvent constituée de
polystyrène, et une ralingue inférieure munie de pierre.
La pêche au filet maillant se pratique à la
tombée de la nuit et au lever du jour. Toutefois, les sorties pendant la
soirée sont plus irrégulières à cause du vent
appelé « Kusu » en Kivira, langue locale, soufflant du Sud au
Nord. La pêche de la soirée et celle matinale se composent d'une
pirogue monoxyle non motorisée, 2 cordes attachées au filet, 2
à 3 rames, et emploie 2 personnes. Le départ pour pécher
se faits vers 3h souvent en milieu pélagique. Le filet est posé
vers 4h pour être relevé aux environs de 7h30, le
démaillage se fait au même moment qu'on retire le filet pur
éviter de ne pas prendre beaucoup de temps et se poursuit
jusqu'à ce qu'on débarque si l'opération n'était
pas finit dans le lac, Le retour sur la plage de débarquement se fait
souvent vers 8h. L'arrangement du filet de poursuit par ls petits enfants de 10
à 13 ans entre 8 heures et 9 heures 30min.
Des papiers autocollant ont étés utilisés
pour l'étiquetage des bocaux contenant les échantillons,
Les poissons capturés ont étés
immédiatement conserver dans une solution concentrer du formol 4% et
particulièrement Bathybates graueri et les individus de
Bathybates minor étaient injectés au formol à
travers l'orifice anal pour la conservation des contenus stomacaux. Ces
échantillons étaient conservés dans les bocaux portant
une étiquette sur lequel le site, la date, l'heure de
prélèvement des échantillons, le nom des spécimens
et le nom du préleveur étaient mentionné à la
même heure.
Au laboratoire
Une fois au laboratoire les échantillons étaient
d'abord triés sur des plateaux en plastique pour grouper les individus
semblables. Juste après le triage les ouvrages et/ou les clés de
détermination ont été utilisés pour avoir la
confirmation sur l'identification des poissons (Poll, 1956 ;Eccles,
1992 ; Brichard, 1989),.
- La longueur totale (LT) qui est la distance
horizontale de l'extrémité de la nageoire caudale
c'est-à-dire la longueur maximale du poisson dans le sens horizontal
(Thys, 1964 in Plisnier, 1988 ; Stiassny et al, 2007) ;
- La longueur standard (LS) est la distance
horizontale de l'extrémité antérieur du poisson à
la base de la nageoire caudale, à l'endroit où le
pédoncule caudal peut être plié aisément. Les deux
longueurs sont exprimées en mm ;
- Longueur à la fourche ;
- Poids total de l'individu ;
- Poids des gonades ;
Le sexe était déterminé ainsi que les
stades de maturité des gonades et le nombre d'ovules était
compté pour les individus qui en avaient. Les stades de maturité
des gonades ont été déterminés en se
référant à l'échelle conventionnelle de
degré de maturité MICHA, 1976 in PLISNIER, MICHA et FRANK,
1988)
- Puis les estomacs étaient enlevés et
conservés dans des sachets en plastique, après avoir mis une
petite quantité du formol dans chaque sachet pour permettre de bien
conserver l'échantillon.
Tableau 3 : Caractéristiques de divers
stades de maturité sexuelle (MICHA, 1976 in PLISNIER, MICHA et FRANK,
1988)
|
STADES
|
MALES
|
FEMELLES
|
|
I
|
- Gonades de petites dimensions accolées à la
colonne vertébrale
- Sexe non reconnaissable même au binoculaire
|
- Gonades de petites dimensions accolées à la
colonne vertébrale
- Sexe non reconnaissable même à la
binoculaire
|
|
¼
|
- Gonades transparentes à l'observation
|
- Gonades transparentes à l'observation et ovocytes
discernables à la binoculaire
|
|
2/4
|
- Testicules rose- rougeâtres ou rose-
blanchâtres
|
- Ovaires rosâtres ou rose- claires ou rougeâtres
d'aspect granuleux
- Ovocytes bien visibles mais non dissociables
|
|
¾
|
- Testicules blanchâtres ou rose- blanchâtres bien
développés avec les points de laitance
|
- Ovaires jaunâtres ou rose- jaunes ou jaune-
blanchâtres
- Ovules bien visibles et dissociables
-
|
|
4/4
|
- Testicules blanchâtres, laitance excusable par
pression du doigt
- Spermiducte gorgé de laitance
|
- Ovaires jaunes, jaunes- orange ou jaune- citron
- Présence d'ovules dans l'oviducte
|
|
5/4
|
- Testicules rose- pâle flasques et vidés de
spermes
|
- Ovaires roses ou rouges- brique, vides, flasques, quelques
granulations blanchâtres petites
|
II.4. Analyse des contenus digestifs
Il existe plusieurs méthodes qualitatives et
quantitatives pour l'analyse des contenus stomacaux. Les indices suivants ont
étés calculés selon Hynes(1950).
a) Indice d'occurrence :
Il consiste à calculer le nombre d'estomac contenant
une catégorie de proies(Np).ce nombre est exprimé en pourcent par
le nombre total d'estomac examiné (Hynes, 1950 in LAUZANE ;
1976)
Io= (Np/Nt) ×100
Io : indice d'occurrence en pourcentage
Np : nombre d'estomac contenant une catégorie de
proie
Nt : nombre total d'estomac examiné
b) Indice d'abondance :
Il consiste à calculer le nombre d'individu d'une
catégorie donnée de proie(Na), est exprimé en pourcentage
par le nombre total de proie trouvé pour l'échantillon.
Iab= (Na/Np) ×100
Analyse des
résultats
L'analyse des résultats a été
réalisée à l'aide du logiciel STATISTICA. Les statistiques
descriptives et l'ANOVA ont été effectuées grâce
à ce logiciel
CHAP III. RESULTATS ET
INTERPRETATIONS
III.1 Espèces
récoltés et leur abondance dans les sites
Le nombre de tous les individus capturés pour les deux
espèces est représenté dans le tableau ci-dessous.
Tableau n°4 : Nombre d'individus par
espèce et par site.
|
Especes
|
Kalundu
|
Mulongwe
|
Kasenga
|
Kilomoni
|
|
B.graueri
|
16
|
16
|
17
|
30
|
|
B.mior
|
21
|
16
|
17
|
19
|
|
Total
|
37
|
32
|
34
|
49
|
Le tableau ci-dessus indique que 152 spécimens des
poissons ont étés capturés au cours de notre
échantillonnage sur ces 4 sites étudies. Kilomoni est le plus
riche en individus suivi de kalundu, puis Kasenga et en dernier lieu le site
de Mulongwe. Les individus de l'espèce Bathybates graueri
sont numériquement les plus élevés avec (79 individus) que
ceux du Bathybates minor (73 individus).
III.2 Abondance des
mâles, femelles et juvéniles pour les deux espèces dans les
4 sites
L'abondance des mâles, femelles et juvéniles pour
les deux espèces dans les quatre sites d'échantillonnages est
présentée dans le tableau n°5
Tableau n°5 Abondance des mâles, femelles et
juvéniles pour les deux espèces dans les quatre sites
|
Site
|
Sexe
|
Bathybates minor
|
Bathybates graueri
|
|
Kalundu
|
|
Nombre
|
Pourcentage
|
Nombre
|
Pourcentage
|
|
M
|
6
|
8,2
|
8
|
10,1
|
|
F
|
10
|
13,6
|
9
|
11,3
|
|
ND
|
3
|
4,1
|
1
|
1,2
|
|
Mulongwe
|
M
|
8
|
10,9
|
5
|
6,3
|
|
F
|
10
|
13,6
|
7
|
8,8
|
|
Kesenga
|
M
|
6
|
8,2
|
9
|
11,3
|
|
F
|
6
|
8,2
|
9
|
11,3
|
|
ND
|
5
|
6,8
|
1
|
1,2
|
|
Kilomoni
|
M
|
7
|
9,5
|
22
|
27,8
|
|
F
|
6
|
8,2
|
8
|
10,1
|
|
ND
|
6
|
8,2
|
0
|
0
|
|
TOTAL
|
|
73
|
100
|
79
|
100
|
Le tableau montre qu'en généra les mâles
(46,7 %) ont dominé par rapport aux femelles dans l'ensemble de
l'échantillonnage les femelles avec 42,7% et 10,5% pour les individus
dont le sexe n'a pas été identifié pour l'espèce
Bathybates minor les femelles sont plus dominantes que les mâles
dans le site de kalundu et dans le site de Mulongwe. D'autre part les
mâles sont plus dominants dans le site de Kilomoni et dans le site de
Kasenga. De même les individus dont le sexe n'a pas été
déterminé sont trouvés en grand nombre dans le site de
Kilomoni suivi du site de Kasenga et en fin dans le site de Kalundu.
Par contre pour l'espèce e Bathybates graueri
ce sont les mâles qui sont les plus dominants par rapport aux femelles
dans le site de Kilomoni suivi du site de Kasenga. A Kalundu on trouve que ce
les femelles qui dominent les mâles et même à Mulongwe.
III.3 Sex-ratio
Tableau n°6. Pourcentages des mâles par rapport aux
femelles et aux juvéniles
Les pourcentages des mâles, femelles et juvéniles
sont représentés dans le tableau ci- dessous :
|
SITES
|
SEXE
|
Nombre
|
%
|
|
Kalundu
|
J
|
4
|
2,63
|
|
M
|
14
|
9,21
|
|
F
|
18
|
11,84
|
|
Mulongwe
|
J
|
0
|
0
|
|
M
|
14
|
9,21
|
|
F
|
18
|
11,84
|
|
Kasenga
|
J
|
6
|
3,94
|
|
M
|
16
|
10,52
|
|
F
|
13
|
8,55
|
|
Kilomoni
|
J
|
6
|
3,94
|
|
M
|
27
|
17,7
|
|
F
|
16
|
10,52
|
|
TOTAL
|
|
152
|
100
|
Le tableau n°6 indique que les mâles ont
été nombreux (46,7%) par rapport aux femelles (42,7%) et aux
juvéniles (10,5%) dans les 4 sites. à kalundu et a Mulongwe . La
sex-ratio (rapport entre mâles et femelles de ces deux
espèces) appliquées à cette capture donne une valeur de
0,77 tandis qu'à Kasenga elle est de 1,230 et enfin une valeur de 1,68
à Kilomoni.
III.3.1Bathybates
graueri
Tableau n°7. Sex-ratio entre mâles et femelles de
Bathybathes graueri et proportion des juvéniles dans les 4
sites
Les pourcentages des mâles, femelles et
juvéniles ainsi que leurs fréquences sont
représentés dans le tableau ci- dessous
|
sexe
|
Kalundu
|
Mulongwe
|
Kasenga
|
Kilomoni
|
|
J
|
Effectif
|
1
|
0
|
1
|
0
|
|
%
|
6,2
|
0
|
5,8
|
0
|
|
M
|
Effectif
|
7
|
6
|
9
|
21
|
|
%
|
43,7
|
37,5
|
52,9
|
70
|
|
F
|
Effectif
|
8
|
10
|
7
|
9
|
|
%
|
50
|
62,5
|
41,1
|
30
|
|
Rapport
|
0,875
|
0,6
|
1,285
|
2,333
|
Le tableau n°7 montre que les mâles ont
étés beaucoup captures dans nos échantillons pour les
Bathybates graueri par rapport aux femelles dans les 4 sites. A
kalundu le sex- ratio donne une valeur de 0,875 tandisqu' à Mulongwe
elle set de 0,6 puis àKasenga de 1,285 et en fin une valeur de 2,333
à Kilomoni
III.3.1.2. Stades de
maturité des gonades pour l'espèce Bathybates graueri
Tableau n° 8. Fréquence des différents
stades de maturité des gonades
|
SITES
|
STADE DE MATURITE
|
Nombre
|
%
|
|
Kalundu
|
I
|
1
|
6,2
|
|
¼
|
1
|
6,2
|
|
2/4
|
4
|
25
|
|
¾
|
8
|
50
|
|
4/4
|
2
|
12,5
|
|
5/4
|
0
|
0
|
|
Total
|
16
|
100
|
|
Mulongwe
|
I
|
0
|
0
|
|
¼
|
1
|
6,2
|
|
2/4
|
3
|
18,7
|
|
¾
|
3
|
18,7
|
|
4/4
|
5
|
31,2
|
|
5/4
|
4
|
25
|
|
Total
|
16
|
100
|
|
Kasenga
|
I
|
1
|
5,8
|
|
¼
|
4
|
23,5
|
|
2/4
|
4
|
23,5
|
|
¾
|
6
|
35,2
|
|
4/4
|
2
|
11,7
|
|
5/4
|
0
|
0
|
|
Total
|
17
|
100
|
|
Kalundu
|
I
|
0
|
0
|
|
¼
|
3
|
10
|
|
2/4
|
8
|
26,6
|
|
¾
|
9
|
30
|
|
4/4
|
2
|
6,6
|
|
5/4
|
8
|
26,6
|
|
Total
|
30
|
100
|
D'après ce tableau la plupart des individus
observés étaient déjà matures. Ceci montre que les
poissons Bathybates graueri observés pendant la période
d'étude dans tous les sites étaient au stade sexuellement
mûr pouvant se reproduire. Les poissons immatures sont
représentés mais en faible quantité.
III.3.1.3. Moyenne de
longueur totale, standard et poids des individus de l'espèce
Bathybates graueri
Tableau n°9.statistique descriptive des variables
|
Moyennes
|
N
|
Ec-Type
|
Minimum
|
Maximum
|
|
LT (mm)
|
211,7215
|
79
|
27,95827
|
130,0000
|
250,0000
|
|
LS (mm)
|
174,5316
|
79
|
25,65792
|
105,0000
|
213,0000
|
|
POIDS INDIVIDU
|
83,47873
|
79
|
28,21293
|
21,33000
|
150,0200
|
Le tableau ci- dessus montre la moyenne, la fréquence,
l'écart type, le minimum et le maximum de la longueur totale, la
longueur standard et le poids des individus.
III.3.2 Bathybates minor
Tableau n°10. Sex ratio mâles/ femelles du
Bathybathes minor et proportion des juvéniles
Les pourcentages des mâles, femelles et
juvéniles ainsi que leurs fréquences sont
représentés dans le tableau ci- dessous 8 :
|
sexe
|
Kalundu
|
Mulongwe
|
Kasenga
|
Kilomoni
|
|
J
|
Effectif
|
3
|
6
|
0
|
5
|
|
%
|
14 ,2
|
37,5
|
0
|
26,3
|
|
M
|
Effectif
|
6
|
5
|
9
|
7
|
|
%
|
28,4
|
31,2
|
52,9
|
36,8
|
|
F
|
Effectif
|
12
|
5
|
8
|
7
|
|
%
|
57,1
|
31,2
|
47
|
36,8
|
Ce tableau n°10 montre que les femelles ont
étés beaucoup captures dans nos échantillons pour les
Bathybates minor par rapport aux males et juvéniles dans
les 4 sites. A kalundu le sex- ratio appliqué à cette capture
donne une valeur de 0,5 tandisqu' à Mulongwe et à Kilomoni elle
est de 1 et en fin une valeur de 1,125 à Kasenga.
III.3.2.1.stades de
maturité des gonades pour Bathybates minor
Tableau n°11. stades de maturité des gonades de
l'espèce Bathybates minor ,
|
SITES
|
STADE DE MATURITE
|
EFFECTIF
|
%
|
|
Kalundu
|
I
|
3
|
14,2
|
|
¼
|
6
|
28,5
|
|
2/4
|
5
|
23,8
|
|
¾
|
4
|
19,0
|
|
4/4
|
3
|
14,2
|
|
5/4
|
0
|
0
|
|
Total
|
21
|
100
|
|
Mulongwe
|
I
|
0
|
0
|
|
¼
|
3
|
18,7
|
|
2/4
|
3
|
18,7
|
|
¾
|
3
|
18,7
|
|
4/4
|
5
|
31,2
|
|
5/4
|
2
|
12,5
|
|
Total
|
16
|
100
|
|
Kasenga
|
I
|
5
|
29,4
|
|
¼
|
4
|
23,5
|
|
2/4
|
0
|
0
|
|
¾
|
5
|
29,4
|
|
4/4
|
2
|
11,7
|
|
5/4
|
1
|
5,8
|
|
Total
|
17
|
100
|
|
Kalundu
|
I
|
6
|
31,5
|
|
¼
|
1
|
5,2
|
|
2/4
|
5
|
26,3
|
|
¾
|
1
|
5,2
|
|
4/4
|
6
|
31,5
|
|
5/4
|
0
|
0
|
|
Total
|
19
|
100
|
Ce tableau indique que les individus au stade 4/4 sont les
plus représentés dans le site de Kilomoni suivie des individus du
stade I dans le même site puis du stade ¼ dans le site de Kalundu.
Les stades 2/4 et 3/4 sont aussi représentés dans les autres
sites.
III.3.2.2.Moyenne de longueur
totale, standard et poids des individus de l'espèce
Bathybates minor
Tableau n°12. Statistique descriptive des variables
|
Moyennes
|
N
|
Ec-Type
|
Minimum
|
Maximum
|
|
LT (mm)
|
182,9315
|
73
|
32,45481
|
66,0000
|
225,0000
|
|
LS (mm)
|
151,5068
|
73
|
27,38720
|
54,0000
|
201,0000
|
|
POIDS INDIVIDU
|
58,34778
|
73
|
23,64660
|
2,02000
|
134,0200
|
Ce tableau montre la moyenne, la fréquence,
l'écart type, le minimum et le maximum de la longueur totale, la
longueur standard et le poids des individus.
III.3. Taille de la
première maturité
La taille de la première maturation est entre les
mâles et femelles estimée par la plus petite taille de longueur
standard des individus au stade de maturité ¾. Pour ce faire nous
avons considérés 36 individus au stade ¾ dans l'ensemble de
notre échantillon pour les deux sexes et les deux espèces.
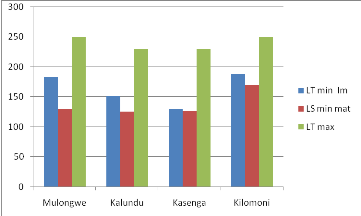
Fig.n°3 Présentation de la première
maturité sexuelle par les sites pour Bathybates
graueri
Cette figure montre que la taille de la première
maturité observée pour Bathybates graueri varie selon
les sites, la plus grande taille observée est à Kilomoni(169mm),
suivi de Mulongwe(130mm), puis vient Kasenga(126mm) et enfin la plus petite
taille est observable est à Kalundu( 125mm).
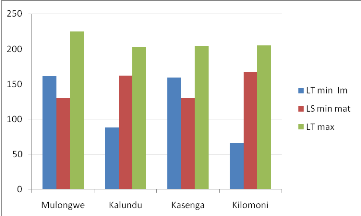
Figure n°4 Présentation de la
première maturité sexuelle par les sites pour Bathybates
minor
Cette figure montre que la taille de la première
maturité observée pour Bathybates minor varie selon les
sites, la plus grande taille observée est à Kilomoni, suivi de
Kalundu, à Kasenga et Mulongwe la taille de la première
maturité est égale dans ces deux sites.
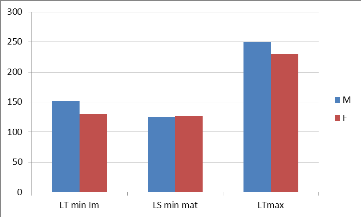
Figure n° 5présentations de la taille de
première maturité sexuelle pour B.graueri en fonction du
sexe.
D'après cette figure les femelles atteignent la taille
de la première maturité sexuelle à 126mm avec une longueur
totale de 230mm tandis que les mâles arrivent à cette taille
à 125mm avec une longueur totale de 250mm
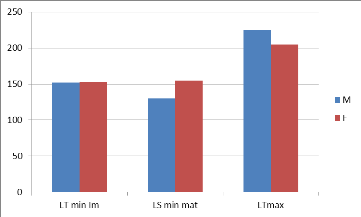
Figure n° 6présentations de la taille de
première maturité sexuelle pour B.minor en fonction du
sexe.
Les résultats de cette figure montrent que les
mâles atteignent la taille de la première maturité sexuelle
à 130mm avec une longueur totale de 225mm tandis que les femelles
arrivent à cette taille à 155mm avec une longueur totale de
205mm.
III.3.2.Dstribution mensuelle
de la maturité sexuelle du Bathybates graueri
La fréquence et le pourcentage de chaque stade de
maturité des gonades par mois sont répartis mensuellement dans le
tableau n°13
Tableau n°13: Evolution mensuelle de la
maturité sexuelle chez Bathybates graueri
|
Site
|
stade
|
Mars %
|
Avril %
|
Mai %
|
Juin %
|
|
Kalundu
|
I
|
0
|
0
|
2,3
|
0
|
|
1/4
|
0
|
0
|
2,3
|
0
|
|
2/4
|
0
|
0
|
4,6
|
9
|
|
3/4
|
0
|
33
|
9,3
|
9
|
|
4/4
|
0
|
0
|
2,3
|
0
|
|
5/4
|
0
|
0
|
0
|
0
|
|
Mulongwe
|
I
|
0
|
0
|
0
|
0
|
|
¼
|
10
|
0
|
0
|
0
|
|
2/4
|
0
|
0
|
6,9
|
0
|
|
¾
|
20
|
0
|
2,3
|
0
|
|
4/4
|
10
|
0
|
2,3
|
13,6
|
|
5/4
|
0
|
33,5
|
0
|
9
|
|
Kasenga
|
I
|
10
|
0
|
0
|
0
|
|
¼
|
10
|
0
|
6,9
|
0
|
|
2/4
|
10
|
0
|
6,9
|
0
|
|
¾
|
10
|
0
|
6,9
|
9
|
|
4/4
|
0
|
0
|
0
|
9
|
|
5/4
|
0
|
0
|
0
|
0
|
|
Kilomoni
|
I
|
0
|
0
|
0
|
0
|
|
14
|
10
|
16,6
|
0
|
4,5
|
|
2/4
|
0
|
0
|
18,6
|
4,5
|
|
¾
|
10
|
16,6
|
11,6
|
4,5
|
|
4/4
|
0
|
0
|
0
|
9
|
|
5/4
|
0
|
0
|
13,9
|
9
|
Il ressort du tableau ci-dessus que les individus matures
stade sont plus élevés aux mois de Mai et Juin, suivie du stade
5/4, contrairement aux mois de Mars et d'Avril qui possèdent très
peu d'individus à différents stades. Surtout au stade I, 4/4,5/4
et 2/4.
III.3.3.Evolution
mensuelle de la maturité sexuelle chez
Bathybates minor
La fréquence et le pourcentage de chaque stade de
maturité des gonades par mois sont répartis mensuellement dans le
tableau n°14
Tableau n°14: Evolution mensuelle de la
maturité sexuelle chez Bathybates minor
|
Site
|
stade
|
Mars %
|
Avril %
|
Mai %
|
Juin %
|
|
Kalundu
|
I
|
0
|
7,1
|
2,3
|
0
|
|
¼
|
5,2
|
0
|
2,3
|
4
|
|
2/4
|
10,5
|
14,2
|
4,6
|
0
|
|
¾
|
5,2
|
0
|
9,3
|
0
|
|
4/4
|
5,2
|
7,1
|
2,3
|
4
|
|
5/4
|
0
|
0
|
0
|
0
|
|
Mulongwe
|
I
|
0
|
0
|
0
|
0
|
|
¼
|
15,7
|
0
|
0
|
0
|
|
2/4
|
0
|
7,1
|
6,9
|
0
|
|
¾
|
5,2
|
14,2
|
2,3
|
0
|
|
4/4
|
0
|
35,7
|
2,3
|
0
|
|
5/4
|
0
|
0
|
0
|
4
|
|
Kasenga
|
I
|
0
|
0
|
0
|
0
|
|
¼
|
5,2
|
0
|
6,9
|
20
|
|
2/4
|
0
|
0
|
6,9
|
16
|
|
¾
|
15,7
|
0
|
6,9
|
0
|
|
4/4
|
5,2
|
0
|
0
|
0
|
|
5/4
|
0
|
0
|
0
|
4
|
|
Kilomoni
|
I
|
15,7
|
0
|
0
|
12
|
|
14
|
0
|
0
|
0
|
4
|
|
2/4
|
10,5
|
0
|
18,6
|
8
|
|
¾
|
0
|
7,1
|
11,6
|
8
|
|
4/4
|
0
|
0
|
0
|
16
|
|
5/4
|
0
|
7,1
|
13,9
|
0
|
ce tableau montre que les individus de stade 3/4 sont plus
élevés aux mois de Mars et de Mai, suivi des individus au
stade I au mois de Juin, puis ceux du stade 4/4 au mois d'Avril. Par contre les
individus au stade 2/4 et ¼ sont repartis dans presque tous les mois sauf
au mois d'Avril où il n y a pas des individus au stade ¼. Les
individus au stade au stade 5/4 sont très moins élevés dans différents sites.
Iii.4. Fécondité absolue
La fécondité absolue désigne le nombre
total d'oeufs ou d'ovules présents chez la femelle avant
fécondation.
III.4.1.
Fécondité absolue pour Bathybates graueri
Tableau n°15.Fécondité absolue de
Bathybates graueri dans différents sites
d'échantillonnage ainsi que leur pourcentage
|
Site
|
Nombres d'oeufs
|
Pourcentage
|
|
Kalundu
|
46
|
37,1
|
|
78
|
62,9
|
|
Total
|
124
|
16,2
|
|
Mulongwe
|
71
|
21,5
|
|
84
|
25,5
|
|
84
|
25,8
|
|
90
|
27,3
|
|
Total
|
329
|
43,2
|
|
Kasenga
|
77
|
52,7
|
|
69
|
42,3
|
|
Total
|
146
|
19,1
|
|
Kilomoni
|
81
|
50
|
|
81
|
50
|
|
Total
|
162
|
21,2
|
|
TOTAL GENERAL
|
761
|
100
|
Le tableau indique que le nombre total d'oeufs pour
l'espèce Bathybates graueri est de 761 oeufs présents
chez les femelles avant fécondation. Le nombre maximal trouvé est
de 90 oeufs dans le site de Mulongwe et le nombre minimal est de 46 oeufs dans
le site de kalundu. Dans l'ensemble des oeufs trouvés le pourcentage
élevé est observé dans le site de Mulongwe soit 43,2,
suivi du site de kilomoni 21,2 puis Kasenga 16,2 et en dernier lieu vient le
site de kalundu.
III.4.2.
Fécondité absolue pour Bathybates minor
Tableau n°16.Fécondité absolue de
Bathybates minor dans les 4 sites ainsi que leur pourcentage
|
Site
|
Nombres d'oeufs
|
Pourcentage
|
|
Kalundu
|
88
|
33,9
|
|
87
|
33,5
|
|
84
|
33,4
|
|
Total
|
259
|
21,6
|
|
Mulongwe
|
91
|
21,9
|
|
81
|
19,5
|
|
82
|
19,8
|
|
81
|
19,5
|
|
79
|
19
|
|
Total
|
414
|
34,6
|
|
Kasenga
|
32
|
28,3
|
|
81
|
71,6
|
|
Total
|
113
|
9,4
|
|
Kilomoni
|
80
|
19,5
|
|
83
|
20,2
|
|
82
|
20
|
|
83
|
20,2
|
|
81
|
19,8
|
|
Total
|
409
|
34,2
|
|
TOTAL GENERAL
|
1195
|
100
|
Ce tableau montre que le nombre total d'oeufs présent
avant fécondation pour les femelles de l'espèce Bathybates
minor est de 1195. Le nombre maximal trouvé est de 91 oeufs dans le
site de Mulongwe soit 21,9% du site et le nombre minimal est de 32 oeufs dans
le site de kasenga soit 28,3% du site. Dans l'ensemble des oeufs trouvés
le pourcentage élevé a été observé dans le
site de Mulongwe(43,2%), suivi du site de kilomoni (34,2%) puis Kalundu(21,6%)
et en dernier lieu vient le site de kasenga(9,4%) pour 15 femelles
concernées dans l'ensemble par les valeurs de fécondité
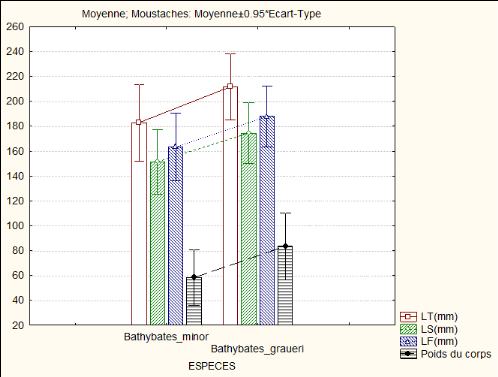
Figure n°7: la longueur totale, longueur
standard, longueur a la fourche et poids du corps en fonction du sexe pour les
deux espèces
La figure n°7 indique que Plus l'espèce n'est
grande, plus il a un poids élevé et plus son sexe n'est
facilement déterminable. Au contraire plus elle est petite plus elle a
un petit poids, mais aussi plus son sexe n'est pas déterminé.
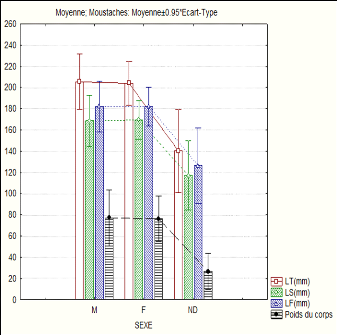
Figure n°8: longueur totale, longueur standard,
longueur a la fourche et poids du corps en fonction deux espèces
Le figure n°8 indique que la longueur totale, la
longueur standard, la longueur a la fourche et le poids du corps de ces deux
espèces sont presque égales pour les mâles et femelles
exclus pour les poissons dont le sexe n'a pas été
déterminé
III.5.Effect du stade de
maturité
Concernant les résultats de l'ANOVA pourla longueur
totale, longueur standard, longueur a la fourche, le poids du corps pour les
deux espèces en fonction des stades de maturité, consultons le
tableau n°17
III.5.1.Anova pour les
Stades de Maturité
Tableau n°17 : statistique descriptive
|
|
SC
|
dl
|
MC
|
SC
|
dl
|
MC
|
F
|
p
|
|
|
Effet
|
Effet
|
Effet
|
Erreur
|
Erreur
|
Erreur
|
|
|
|
LT (mm)
|
79686,49
|
5
|
15937,30
|
88569,83
|
146
|
606,6427
|
26,27131
|
0,000000
|
|
LS (mm)
|
57353,10
|
5
|
11470,62
|
68114,80
|
146
|
466,5397
|
24,58659
|
0,000000
|
|
LF (mm)
|
61922,84
|
5
|
12384,57
|
72142,00
|
146
|
494,1233
|
25,06372
|
0,000000
|
|
Poids du corps
|
59378,28
|
5
|
11875,66
|
66929,06
|
146
|
458,4182
|
25,90572
|
0,000000
|
Le tableau n°17 a pour statistique descriptive de
stade de maturité pour les deux espèces, nous montre que sa
probabilité est vraiment significative en fonction de LT, LS, LF et
poids du corps.
Concernant les résultats de l'ANOVA pourle poids de
gonades, nombres d'oeufs, longueur de l'intestin et poids de l'estomac pour les
deux espèces en fonction des stades de maturité, consultons le
tableau n°18
Tableau n°18 : statistique descriptive pour les
stades de maturité
|
|
SC
|
dl
|
MC
|
SC
|
dl
|
MC
|
F
|
p
|
|
|
Effet
|
Effet
|
Effet
|
Erreur
|
Erreur
|
Erreur
|
|
|
|
Pds de Gonad
|
5,0
|
5
|
1,01
|
16,32
|
146
|
0,1118
|
9,0091
|
0,000000
|
|
NbrOeufs
|
116769,1
|
5
|
23353,83
|
15386,74
|
146
|
105,3886
|
221,5972
|
0,000000
|
|
LI(mm)
|
47296,2
|
5
|
9459,24
|
61050,53
|
146
|
418,1543
|
22,6214
|
0,000000
|
|
PDS ESTOMAC
|
40,1
|
5
|
8,01
|
243,97
|
146
|
1,6710
|
4,7943
|
0,000436
|
Le tableau n°18 a pour statistique descriptive de
stade de maturité pour les deux espèces, nous montre que sa
probabilité est vraiment significative surtout sur le poids des
gonades, nombres d'oeufs, longueur de l'intestin mais aussi sur le poids de
l'estomac.
III.5. 2.Effect des sites
Les résultats de l'ANOVA pourle poids de gonades,
nombres d'oeufs, longueur de l'intestin et poids de l'estomac pour les deux
espèces en fonction des sites, consultons le tableau n°19
III.5.2.1.Anova pour les
sites
Tableau n°19 : statistique descriptive pour les
sites
|
|
SC
|
dl
|
MC
|
SC
|
dl
|
MC
|
F
|
p
|
|
|
Effet
|
Effet
|
Effet
|
Erreur
|
Erreur
|
Erreur
|
|
|
|
Pds de Gonades
|
0,35
|
4
|
0,116
|
21,0
|
148
|
0,1420
|
0,819524
|
0,485023
|
|
Nbr OEufs
|
11017,25
|
4
|
3672,418
|
121138,6
|
148
|
818,5041
|
4,486744
|
0,004799
|
|
LI (mm)
|
9325,89
|
4
|
3108,629
|
99020,8
|
148
|
669,0596
|
4,646266
|
0,003909
|
|
PDS ESTOMAC
|
11,40
|
4
|
3,799
|
272,6
|
148
|
1,8421
|
2,062065
|
0,107747
|
Le tableau n°19 a pour statistique descriptive de sites
pour les deux espèces, nous montre que sa probabilité est
significative sur la longueur de l'intestin et de nombres d'oeufs mais pour le
poids de gonades et le poids de l'estomac la fréquence de
probabilité est non significative.
III.5. 3.Effect des sexes
Les résultats de l'ANOVA pourle poids de gonades,
nombres d'oeufs, longueur de l'intestin et poids de l'estomac pour les deux
espèces en fonction des sexes, consultons le tableau n°20
III.5.3.1.Anova pour les
sexes
Tableaun° 20 statistique descriptive pour les sexes
|
|
SC
|
dl
|
MC
|
SC
|
dl
|
MC
|
F
|
p
|
|
Pds de Gonades
|
1,48
|
2
|
0,74
|
19,9
|
149
|
0,1334
|
5,53935
|
0,004781
|
|
NbrOeufs
|
25333,61
|
2
|
12666,80
|
106822,3
|
149
|
716,9279
|
17,66817
|
0,000000
|
|
LI (mm)
|
42796,95
|
2
|
21398,47
|
65549,8
|
149
|
439,9313
|
48,64049
|
0,000000
|
|
PDS ESTOMAC
|
17,64
|
2
|
8,82
|
266,4
|
149
|
1,7878
|
4,93409
|
0,008416
|
Le tableau n°20 qui a pour statistique descriptive de
sexe pour les deux espèces, nous montre que sa probabilité est
vraiment significative surtout sur les nombres d'oeufs, longueur de
l'intestin mais aussi sur le poids des gonades et le poids de l'estomac.
III.6. Ecologie alimentaire de
B.graueri et B.minor
III.6.1. Régime
alimentaire de Bathybats minor
Le nombre d'estomacs dans le quels se rencontre un ou
plusieurs individus d'une catégorie d'aliment mais aussi le nombre
d'individus d'une catégorie données des proies pour
l'espèce Bathybates minor sera représenter dans le
tableau ci -dessous.
Tableau n°21 indice d'occurrence et d'abondance pour
B.minor
|
Proies
|
Indice d'occurrence
|
Indice d'abondance
|
|
Na
|
Io(%)
|
Nx
|
Iab(%)
|
|
Stolothrissatanganicae
|
35
|
41,1
|
82
|
28,9
|
|
Poissons identerminés
|
29
|
34,1
|
54
|
19
|
|
Aulonocranusdewindti
|
2
|
2,3
|
2
|
0,7
|
|
Larves des poissons
|
10
|
11,7
|
132
|
46,6
|
|
Morceaux des poissons
|
9
|
10,5
|
13
|
4,5
|
L'observation du tableau n° 21 fait remarquer que le
Bathybates minor à un régime carnivores piscivores au
sens large (mangeur des poissons adultes et juvéniles) et se nourrit
préférentiellement de stolothrissatanganicae (Io=41,1)
et larves des poissons (Iab=46,6). Il se nourrit également des poissons
indéterminés et cichlide Aulonocranusdewindti.
III.6.2. Régime
alimentaire de B. graueri
Le nombre d'estomacs dans le quels se rencontre un ou
plusieurs individus d'une catégorie d'aliment mais aussi le nombre
d'individus d'une catégorie données des proies pour
l'espèce Bathybates graueri.
Tableau n°22. Indice d'occurrence et d'abondance pour
B.graueri
|
Proies
|
Indice d'occurrence
|
Indice d'abondance
|
|
Na
|
Io(%)
|
Nx
|
Iab(%)
|
|
Stolothrissatanganicae
|
49
|
48
|
123
|
56,1
|
|
Limnothrissamiodon
|
32
|
31,3
|
55
|
25,1
|
|
Poisson identeterminés
|
2
|
2,9
|
4
|
1,8
|
|
Larves des poissons
|
1
|
0,9
|
10
|
4,5
|
|
Morceaux des poissons
|
17
|
16
|
27
|
12,3
|
L'observation du tableau n° 22 fait remarquer que le
Bathybates graueri à un régime carnivores piscivores au
sens large (mangeur des poissons adultes et juvéniles) et se nourrit
préférentiellement de stolothrissatanganicae (Io=48) et
(Iab=56,1), et de Limnothrissamiodon (Io=31,3) et (Iab=25,1). On
remarque également la présence d'autres poissons
indéterminés et des larves des poissons.
Abondance des proies pour les deux
espèces
Tableau n°23 Abondance de différentes
catégories des proies pour les deux espèces
|
Bathybates Graueri
|
Bathybates minor
|
|
PROIES
|
EFFECTIFS
|
POURCENTAGE
|
EFFECTIFS
|
POURCENTAGE
|
|
Stolothrissatanganicae
|
123
|
56,1
|
84
|
29,5
|
|
Limnothrissamiodon
|
55
|
25,1
|
0
|
0
|
|
Aulonocranusdewindti
|
0
|
0
|
2
|
0,7
|
|
Poisson indéterminés
|
4
|
1,8
|
54
|
19
|
|
Larves des Poissons
|
10
|
4,5
|
131
|
46,1
|
|
Morceaux des poissons
|
27
|
12 ,3
|
13
|
4,5
|
|
TOTAL
|
219
|
100
|
284
|
100
|
Ce tableau montre que dans l'ensemble des proies
trouvées pour le Bathybates graueri .Le
Stolothrissatanganyicae viennent en tête avec 56% suivi de
Limnothrissamiodon avec 25,1% et en dernier lieu vient les poissons
indéterminés. Tandis que pour le Bathybates
minorldansl'ensemble des proies observées. Les larves des poissons
viennent en tête avec 46,1%, suivie des Stolothrissatanganicae
avec 29,5% et en dernier lieu vient l'Aulonocranusdewindti.
Evolution des proies en fonction des mois pour les
deux espèces
Tableau n°24 Evolution de différentes
catégories des proies pour B. minor en fonction des mois
|
Bathybates minor
|
|
MOIS
|
PROIES
|
|
%
|
|
MARS
|
Stolothrisssatanganicae
|
13
|
9,8
|
|
Limnotrissamiodon
|
0
|
0
|
|
Aulonocranusdewindti
|
0
|
0
|
|
Poissons indeterminés
|
17
|
12,8
|
|
Larves des poissons
|
96
|
72,7
|
|
Morceaux des poissons
|
6
|
4,5
|
|
TOTAL
|
|
132
|
100
|
|
AVRIL
|
Stolothrisssatanganicae
|
27
|
39,7
|
|
Limnotrissamiodon
|
0
|
0
|
|
Aulonocranusdewindti
|
1
|
1,4
|
|
Poissons indeterminés
|
11
|
16,1
|
|
Larves des poissons
|
25
|
36,7
|
|
Morceaux des poissons
|
4
|
5,8
|
|
TOTAL
|
|
68
|
100
|
|
MAI
|
Stolothrisssatanganicae
|
9
|
33,3
|
|
Limnotrissamiodon
|
0
|
0
|
|
Aulonocranusdewindti
|
0
|
0
|
|
Poissons indeterminés
|
16
|
59,2
|
|
Larves des poissons
|
0
|
0
|
|
Morceaux des poissons
|
2
|
7,4
|
|
TOTAL
|
|
27
|
100
|
|
JUIN
|
Stolothrisssatanganicae
|
35
|
61,4
|
|
Limnotrissamiodon
|
0
|
0
|
|
Aulonocranusdewindti
|
1
|
1,7
|
|
Poissons indeterminés
|
10
|
17,5
|
|
Larves des poissons
|
10
|
17,5
|
|
Morceaux des poissons
|
1
|
1,7
|
|
TOTAL
|
|
57
|
100
|
|
TOTAL GENERAL
|
|
284
|
|
Ce tableau montre que le nombre des proies varie vraiment en
fonction des mois pour Bathybates minor, le nombre total des proies
est de 284 dans tous les mois. Leur abondance numériques montre que les
larves des poissons viennent en tête avec 72,2% du mois de mars, en
second lieu vient les S.tanganicae avec 61,4% du mois de juin et en
dernier lieu vient leAulonocranusdewindti avec 1,7% du Mois de
Juin.
Evolution Des Proies ingérés en
Fonction Des mois Pour Bathybates Graueri
Tableau n°25 catégories des proies pour B.
Graueri en fonction des mois.
|
Bathybates Graueri
|
|
MOIS
|
PROIES
|
NOMBRE
|
%
|
|
MARS
|
Stolothrisssatanganicae
|
10
|
33,3
|
|
Limnotrissamiodon
|
7
|
23,3
|
|
Aulonocranusdewindti
|
0
|
0
|
|
Poissons indeterminés
|
0
|
0
|
|
Larves des poissons
|
10
|
33,3
|
|
Morceaux des poissons
|
3
|
4,2
|
|
TOTAL
|
|
30
|
100
|
|
AVRIL
|
Stolothrisssatanganicae
|
11
|
57,8
|
|
Limnotrissamiodon
|
3
|
15,7
|
|
Aulonocranusdewindti
|
0
|
0
|
|
Poissons indeterminés
|
2
|
10,5
|
|
Larves des poissons
|
0
|
0
|
|
Morceaux des poissons
|
3
|
15,7
|
|
TOTAL
|
|
19
|
100
|
|
MAI
|
Stolothrisssatanganicae
|
64
|
59,8
|
|
Limnotrissamiodon
|
29
|
27,1
|
|
Aulonocranusdewindti
|
0
|
0
|
|
Poissons indeterminés
|
2
|
1,8
|
|
Larves des poissons
|
0
|
0
|
|
Morceaux des poissons
|
12
|
11,2
|
|
TOTAL
|
|
107
|
100
|
|
JUIN
|
Stolothrisssatanganicae
|
38
|
60,3
|
|
Limnotrissamiodon
|
16
|
25,3
|
|
Aulonocranusdewindti
|
0
|
0
|
|
Poissons indéterminés
|
0
|
0
|
|
Larves des poissons
|
0
|
0
|
|
Morceaux des poissons
|
9
|
14,2
|
|
TOTAL
|
|
63
|
100
|
|
TOTAL GENERAL
|
|
219
|
|
Le tableau ci-dessous montre que le nombre des proies varie
vraiment en fonction des mois pour Bathybates graueri. Le nombre total
des proies observées dans tous les mois est de 219. Selon l'abondance
numérique le Stolothrissatanganicae vient en tête avec
60,3% du Mois de Juin suivi de Limnothrissamiodon avec 27,1% du mois.
Evolution Des Proies En Fonction Des Sites Pour
Bathybates Minor
Tableau n°26 catégories des proies pour B.
minor en fonction des sites
|
Bathybates minor
|
|
SITES
|
PROIES
|
|
%
|
|
KALUNDU
|
Stolothrisssatanganicae
|
22
|
35,4
|
|
Limnotrissamiodon
|
0
|
0
|
|
Aulonocranusdewindti
|
0
|
0
|
|
Poissons indeterminés
|
14
|
22,5
|
|
Larves des poissons
|
21
|
33,8
|
|
Morceaux des poissons
|
5
|
8
|
|
TOTAL
|
|
62
|
100
|
|
MULONGWE
|
Stolothrisssatanganicae
|
18
|
24,3
|
|
Limnotrissamiodon
|
0
|
0
|
|
Aulonocranusdewindti
|
1
|
1,3
|
|
Poissons indeterminés
|
23
|
31
|
|
Larves des poissons
|
23
|
31
|
|
Morceaux des poissons
|
9
|
12,1
|
|
TOTAL
|
|
74
|
100
|
|
KASENGA
|
Stolothrisssatanganicae
|
20
|
60,6
|
|
Limnotrissamiodon
|
0
|
0
|
|
Aulonocranusdewindti
|
0
|
0
|
|
Poissons indeterminés
|
13
|
39,4
|
|
Larves des poissons
|
0
|
0
|
|
Morceaux des poissons
|
0
|
0
|
|
TOTAL
|
|
33
|
100
|
|
KILOMONI
|
Stolothrisssatanganicae
|
23
|
20
|
|
Limnotrissamiodon
|
0
|
0
|
|
Aulonocranusdewindti
|
1
|
0,8
|
|
Poissons indéterminés
|
4
|
3,4
|
|
Larves des poissons
|
87
|
75,6
|
|
Morceaux des poissons
|
0
|
0
|
|
TOTAL
|
|
115
|
100
|
|
TOTAL GENERAL
|
|
284
|
|
Ce tableau montre que le nombre des proies varie
significativement en fonction des sites pour Bathybates minor. Le
nombre total des proies est de 284 dans tous les sites. Leur abondance
numérique montre que les larves des poissons viennent en tête avec
75,6% du site de kilomoni, suivi du site Mulongwe avec 31% du site. En second
lieu vient les S.tanganicae avec 35% dans le site de Kalundu.
l'Aulonocranusdewindti occupe une petite quantité dans
les sites (1,3%) dans le site de mulongwe et de 0,8% dans le site de
kilomoni..
Evolution Des Proies En Fonction Des Sites Pour
Bathybates graueri
Tableau n°27 catégories des proies chez
B.graueri dans les différents sites
|
Bathybates Graueri
|
|
SITES
|
PROIES
|
NOMBRES
|
%
|
|
KALUNDU
|
Stolothrisssatanganicae
|
21
|
56,7
|
|
Limnotrissamiodon
|
13
|
35,1
|
|
Aulonocranusdewindti
|
0
|
0
|
|
Poissons indeterminés
|
0
|
0
|
|
Larves des poissons
|
0
|
0
|
|
Morceaux des poissons
|
3
|
8,1
|
|
TOTAL
|
|
37
|
100
|
|
MULONGWE
|
Stolothrisssatanganicae
|
22
|
55
|
|
Limnotrissamiodon
|
8
|
20
|
|
Aulonocranusdewindti
|
0
|
0
|
|
Poissons indéterminés
|
2
|
5
|
|
Larves des poissons
|
0
|
0
|
|
Morceaux des poissons
|
8
|
20
|
|
TOTAL
|
|
40
|
100
|
|
KASENGA
|
Stolothrisssatanganicae
|
21
|
50
|
|
Limnotrissamiodon
|
16
|
38,1
|
|
Aulonocranusdewindti
|
0
|
0
|
|
Poissons indéterminés
|
0
|
0
|
|
Larves des poissons
|
0
|
0
|
|
Morceaux des poissons
|
5
|
11,9
|
|
TOTAL
|
|
42
|
100
|
|
KILOMONI
|
Stolothrisssatanganicae
|
59
|
59
|
|
Limnotrissamiodon
|
18
|
18
|
|
Aulonocranusdewindti
|
0
|
0
|
|
Poissons indeterminés
|
2
|
2
|
|
Larves des poissons
|
10
|
10
|
|
Morceaux des poissons
|
11
|
11
|
|
TOTAL
|
|
100
|
100
|
|
TOTAL GENERAL
|
|
219
|
|
Ce tableau montre que le nombre des proies varie
significativement en fonction des sites pour Bathybates graueri. Le
nombre total des proies observées dans tous les sites est de 219. Selon
l'abondance numérique le stolothrissatanganicae vient en
tête avec 59% du site de kilomoni, suivi Limnothrissamiodon avec
18% dans le site de kilomoni.
CHAPITRE IV. DISCUSSION DES
RESULTATS
D'après nos résultats, le Bathybates
graueri du lac Tanganyika présente une taille totale qui varie
entre 130mm et 250 mm avec une longueur moyenne de 221,7. La longueur standard
est de l'ordre de 105 et 213mm dans nos sites d'échantillonnages choisis
dans la partie Nord- est du lac Tanganyika, avec une longueur standard(LS)
moyenne de 174,5mm, tandis que dans l'ensemble des parties du lac Tanganyika
cette espèce a comme longueur standard de l'ordre de 168mm-233mm (Max
poll, 1956), par contre Brichard trouve 145- 250mm.
Tandis que pour l'espèce Bathybates minor du
même Lac présente une taille totale qui varie entre 66mm et 225 mm
avec une longueur moyenne de 182,9. La longueur standard est de l'ordre de 54
et 201mm dans nos sites d'échantillonnages choisis dans la partie Nord-
est du lac Tanganyika, avec une longueur standard(LS) moyenne de 151,5mm,
tandis que dans l'ensemble des parties du lac Tanganyika cette espèce a
comme longueur standard de l'ordre de 90mm-204mm ( Max poll,1956), par contre
Brichard trouve 95- 210mm. Le poids total du corps pour Bathybates
graueri a comme minimum21, 33g et maximum 150g avec comme moyenne 84,4g.
Le rapport de sexes (sex-ratio) des poissons capturés est en faveur des
males(1,264).
Le poids total du corps de Bathybates minor du corps
a un minimum 2, 02g et maximum 133,02g avec comme moyenne 58,3g. Le rapport de
sexes (sex-ratio) des poissons capturés est en faveur des
femelles(0,843). Cependant, les résultats peuvent dépendre
fortement de la technique de pêche utilisée et des
matériels utilisés (Plisnier, 1990 in NAKANGU, 200) et de la
période et du site de capture (NAKANGU, 2009).
Les échantillons du Bathybates graueri
étaient composés des femelles avec six stades de maturité,
le stade I, ¼,2/4,3/4,4/4 et 5/4 dont 34 femelles avec 43 males qui n'ont
pas de caractéristiques morphologiques très significatives. Les
individus étaient en période de reproduction. Cela nous pousse
à dire que la période de reproduction est continuelle pour cette
espèce .Partant de la reproduction, nous avons trouvé les
individus matures de stade ¾ et 4/4 de l'espèce Bathybates graueri
qui se produit a une longueur standard de 130mm pour les mâles et
femelles dans tous les sites à Kalundu vers le mois de mars.
les échantillons trouvés pour Bathybates
minor étaient aussi composés des femelles avec le stade
,1/4,2/4,3/4,4/4 et 5/4 dont 32 femelles avec 27 mâles qui ont des
caractéristiques morphologiques très significatives(les femelles
sont argentées comme les mâles mais sans bandes
latérales),Maxpoll(1956). Il ressort de dire que les mêmes stades
de maturités sont observables pour les deux espèces .Mais aussi
la période de reproduction est aussi continuelle pour les deux
espèces.
La différence entre les différents stades de
maturités pour les deux espèces étudiées dans les
sites d'échantillonnage peut être justifiée soit par la
période d'échantillonnage ou soit de la taille de
l'échantillon.
Partant de la reproduction, nous avions trouvés les
individus matures au stade ¾ et 4/4 pour Bathybates minor qui se produit
à une longueur standard de 125 mm pour les mâles et de 126 mm pour
les femelles dans différents sites et presque pendant toute la
période d'échantillonnage.
Ces tailles de la première maturité sexuelle
pour les espèces Bathybates graueri et Bathybates
minor, espèces si précoces serait peut être due
à la grande pression de pêche et aux multiples méthodes et
engins de pêche destructeurs ne favorisant pas la meilleure croissance de
poissons dans les différents sites. Mais aussi la maturation des gonades
peut être saisonnière habituellement associée à la
saison des pluies ou sèche. Par contredans article littoral fisheries
on Cichlidae ( pisces) from the nortwester part of lake Tanganyika, East
Africa, by C.D. Mushagalusa ,M. Nshombo and M.Lushombo,2014. La taille de la
première maturité observable pour Bathybates minor est
de 70,7mm avec une longueur standard 89,2mm, pour le Bathybates
graueri cette taille n'a pas été trouvée mais la
longueur standard est de 122,3mm. Cette contrainte se justifierais peut
être que parce que leur échantillon étaient prise dans la
zone littorale partie du lac dans laquelle il y a une forte pression de
pêche obligeant ces deux espèces à se reproduire de
manière précoce..
Pour cela, le processus de maturation est influencé par
le changement de température et de photopériode au cours de
l'année mais le facteur final de déclenchement de fraie (ponte)
est l'augmentation du niveau de l'eau causée par les
précipitations ( Viveen et al,1985,1986,de graaf et al, 1995 in Graaf et
Janssen,(1996).
L'analyse du régime alimentaire des populations
naturelles, se fait le plus souvent de façon indirecte, par l'examen du
contenu de l'estomac ou du tube digestif, tout entier ( N'Guessan, 2010). Pour
le cas de notre étude nous avons fait l'analyse du régime
alimentaire par l'examen de contenu de l'estomac.
En ce qui concerne le régime alimentaire de
Bathybates graueri, précisons que le S.tanganicae et
L. miodon constituent les aliments essentiels du Bathybates
graueri ; les autres nourritures s'avèrent
supplémentaires comme l'Aulonocranusdewindti, les larves des
poissons et les poissons indéterminés pour l'ensemble des
échantillons dans les sites et au courant des mois. La
quantité é des proies varie significativement en fonction
des mois. Le mois de Juin se présente comme le mois le plus riche en
nourriture. Max pool(1956) montre à partir des résultats du
régime alimentaire du Bathybates graueri qu'il est vorace,
ichthyophage et les restes non identifiable des poissons ont été
trouvé dans l'estomac .Mais nous nous venons de préciser les
proies préférées.
Les indices d'occurrences de ces deux catégories
d'aliments préférentiels pour B.graueri dans les quatre
sites montrent que le S.tanganicae est beaucoup
préféré. Les autres catégories d'aliments ont
été considérées comme étant occasionnels.
Par contre le régime alimentaire de bathybates
minor est constitué principalement des larves des poissons et de
S.tanganicae qui constituent ces aliments essentiels. Les autres
nourritures s'avèrent supplémentaires comme pour l'ensemble
des,Aulonocranusdewindti les poissons indéterminés et
autres pour l'ensemble des échantillons dans nos site et au courant des
mois. Ce qui a été aussi observé par Max pool et autres
auteurs comme P.Brichard et Coulter.
La quantité des proies varie significativement en
fonction des mois et même des sites. Le mois de Mars se présente
comme le mois le plus riche en nourriture, suivi du mois de Juin. Tandis qu'en
ce qui concerne les sites Kilomoni se présente comme le plus riche en
proies
Les indices d'occurrences de ces deux catégories
d'aliments préférentiels pour B.minor dans les quatre
sites montrent que les larves des poissons sont les plus
préférés, suivis de Stolothrissatanganicae. Les
autres catégories d'aliments ont été
considérées comme étant occasionnels.
Il est important de se demander pourquoi ces deux
espèces préfèrent se nourrir uniquement des
clupéidés et non pas des cichlides ou de Latidés alors
que toutes ces espèces habitent les milieux pélagiques du lac
Tanganyika? La réponse à cette question peut être
justifiée par les modes d'adaptations développées par les
cichlides et Latidés pour se protéger contre la prédation
(développement des épines sur différentes nageoires). Mais
aussi la distribution des Latidés n'est pas égale à celle
des clupéidés qui constituent la grande quantité des
poissons vivant sur les milieux pélagiques du Lac Tanganyika
Nous avons pu observer d'une part que L.miodon ne
fait pas partie des aliments dans le régime alimentaire du Bathybates
minor mais seulement pour Bathybates graueri,d'autre part
l'Aulonocranusdewindti est dans le régime alimentaire du
Bathybates graueri mais seulement pour celui du premier.
CONCLUSION ET
RECOMMENDATION
Ce travail avait pour but d'contribuer à
l'étude des quelques paramètres de la reproduction et de
l'écologie alimentaire de deux espèces de poissons du genre
Bathybates, B. minor et B. graueri dans la partie Nord-Ouest
du lac Tanganyika ayant comme objectifs de déterminer les stades de
maturité pour les deux espèces, d'identifier les aliments que
consomment les deux espèces.
En effet, pendant toute la période
d'échantillonnage, nous avons récolté les
échantillons des poissons 152 spécimens au total pour les deux
espèces citées ci-haut dans les quatre sites de Kalundu,
Mulongwe, Kasenga et Kilomoni au moyen d'une technique de pêche
traditionnelle, utilisant un filet maillant dormant de 500m de longueur, 1,5m
de largeur et 1,5cm de maille. De ces données il ressort les
résultats suivants :
Les différentes catégories de stade de
maturité et d'aliments consommés ainsi que la fréquence
des proies pour les deux espèces ont été
observées.
Pour Bathybates graueri, le sex-ratio montre que les
mâles étaient plus capturés que les femelles.les stades
2/4,3/4 et 4/4 sont plus élevés au mois de Mai et de Juin qui
sont considérés comme une période de reproduction
avancée pour cette espèce car le stade ¾ et 4/4 sont
beaucoup plus observables pendant les mois d'études. cette espèce
atteint la taille de la première maturité sexuelle à
130mm pour le male à Mulongwe et de 201mm pour les femelles au
même site et ce stade est tardif par rapport aux travaux
antérieurs (Mushagalusa et al 2014) qui avaient montré que cette
espèce atteignaient la maturité sexuelle précocement dans
la zone littorale.
Tandis que pour Bathybates minor les femelles ont
étaient plus capturées que les mâles. Cette espèce
se reproduit presque pendant toute la période d'échantillonnage,
mais surtout aux mois de Mars, Avril et Mai. Elle atteint la taille de la
première maturité sexuelle à 125 mm pour les mâles
et femelle dans le site kalundu mais aussi de 126mm pour les femelles pour les
femelles à kasenga.
Concernant le régime alimentaire, d'après nos
résultats, ces deux espèces ont presque le même
régime alimentaire dans les quatre sites avec les larves des poissons,
le Stolothrissatanganicae et Limnothrissamiodon comme
aliments essentiels et par d'autres types d'aliments estimés rares. Ce
constant nous pousse à conclure que ces deux espèces sont
carnivores piscivores qui mangent des poissons adultes et juvéniles sur
leur parcourt.
Comme recommandation, nous suggérons à
l'autorité locale chargée de l'environnement, de bien faire des
campagnes de sensibilisation auprès des population riveraine et les
pécheurs pour leur mettre au courant d'une mesure de
réglementation de la pêche pour ne pas nuire et risquer
d'extinction de certaines espèces qui doivent se multiplier pour garder
leurs espèces ,
A d'autres chercheurs des domaines différents qui
seront intéressés à aborder ce sujet de le faire pour une
période relativement longue ( une année ou plusieurs) pour
permettre de connaitre plus et compléter peut-être les
informations contenues dans la présente étude
réalisée sur une période de quatre mois seulement ,
Il serait aussi utile de combiner d'autres facteurs écologique et
physico- chimiques pour les cinq autres espèces du genre
Bathybates pour permettre de bien comprendre et d'élucider la
variation et la dynamique des Bathybates dans toutes les parties du Lac
Tanganyika.
BIBLIOGRAPHIE
1. AKONKWA B., 2011. Cours de bio stat, deuxième
année de graduat, Inédit, UOB
2. AKONKWA B., 2006.Ecologie des réservoirs
connectés au delta de la Ruzizi, bassin nord du lac Tanganyika,
Mémoire inédit, UOB.53p
3. Axelrod H.R. & Burgess W.E., 1977. Africans Cichlids of
Lake Malawi and Tanganyika. Sixth edution.. .
4. BRICHARD P., 1978. Fishes of Lac Tanganyika.T.F.H.
Publication, Inc. 448pp.
5.BRICHARD P., 1952. Cichlids and all the others fishes Lake
Tanganyika. T.F.H. Publications, Inc. Neptune City. 448pp.
6. CAPART A., 1952. Le milieu géographique et
géophysique. Résultants scientifiques de l'exploration
hydrobiologie du Lake Tanganyika. Inst. Roy. Sciences Nat. Belgique.
7. C.D.MUSHAGALUSA, M. NSHOMBO& M.LUSHOMBO., 2014.
Littoral fisheries on cichlidae(pisces) from the nortwestern part of lake
Tanganyika, East Africa.
8. CIKWANINE K., 2011. Cours d'écologie
générale deuxième année de graduat, inédit,
UOB/Bukavu
9. COULTER G.W., 1991. Lake Tanganyika and its life.London;
British Museum (Natural History) Oxford Uni. Press. 354pp.
10. FRYER G. & ILES T.D., 1972. The Cichlids fishes of the
Great Lakes of Africa. Their Biology and Evolution. Oliver & Boyd,
Edinburg. T.F.H. Publications.641pp.
11. BIRIMWIRAGI J., 2013. Contribution à l'étude
du régime alimentaire et quelques parametres de reproduction des
espèces du genre clarias : C.gariepinus, C.theodorae et
C.wenei dans les marais de Kinyamburu et de Kawizi dans la plaine de
la Ruzizi, territoire d'Uvira. Memoirinedit , UOB.5p.
12. CASSANDRE B., 2011.Ecologie de l'espèce clarias
gariepinus au lac Kivu ( Teleostei,claridae) cas du bassin
d'Ishungu et du bassin de Bukavu. Mémoire inédit, UOB.5p.
13. ISUMBISHO M., 2006. Ecologie du zooplancton du lac
Kivu (Afrique de l'est).Thèse de doctorat en sciences
P.UN.UNECED,Namur .174p.
14. KANINGINI., 1995.Etude de la croissance de la reproduction
et de l'exploitation de Limnothrissamiodon au lac Kivu, bassin de
Bukavu zaïre, thèse de doctorat en sciences P.UN.UNECED,
Namur .211p.
16. KATEMBERA S., 2011. Etude comparative du régime
alimentaire et de la reproduction des poissons du genre Oreochromis du
delta de la Ruzizi. Mémoire inédit ; UOB.42p.
17. LUSHOMBO M., 2004. Contribution à l'étude du
régime alimentaire d'Oreochromisniloticus et
d'Astatotilapiaburtoni(Teleostei, cichlidés en relation avec la
croissance dans l'étang naturel de Nyangara, territoire d'Uvira.
Mémoire inédit, faculté des sciences et sciences
appliquées ; UOB.42p.
18. LUSHOMBO M.,2012. Cours de
pisciculture générale, Troisième année de graduat
en hydrobiologie, Inédit, UOB.
19. MAX POLL, 1956. Exploitation hydro biologique du Lac
Tanganyika (1946-1947), Poissons Cichlidae. Vol III, Inst Royal des Sciences
Naturelles de Belgique (Tervuren) .365p
20. MAX POLL, 1986. Classification des Cichlidae du Lac
Tanganyika, Tribus, Genres et espèces. Mem. Cl. Sci., Acad. r. de
Belgique, 8? (2) 45(2), 1-163.
21. MUHIGWAN B., 2014. Vertébrés aquatique. Note
de cours L2 hydrobiologie, UOB.123p.
22. MUSHAGALUSA D., 2010. Contribution à l'étude
de l'impact du matériel de pêche sur les Cichlidae littoraux du
lac Tanganyika dans sa partie nord- ouest cas d'Uvira. Mémoire
inédit, UOB.52p
23. NSHOMBO M., 2013. Notes de cours d'Ichtyologie
première année de licence en hydrobiologie, inédit, UOB.
p
24. NSHOMBO M et MUZUMANI R., 2008. Inventaire des poissons de
la partie ouest de la Ruzizi et des zones inondées adjacentes.
CRH(Uvira).
25. NTANSANGIRA E., 2013. Contribution à l'étude
de l'écologie alimentaire et de la reproduction des espèces de
poissons Aplocheilichthysprumilus(poecilidae) et
ctenopomamurei(anabantidae) dans l'étang de Nyangara, petite
Ruzizi( kahoro) et la lagune du lac Tanganyika. Mémoire inédit,
UOB.p.
26. PATTERSON G. et MAKIN J., 1998. L'état de la
biodiversité du Lac Tanganyika. Un examen de la littérature.
Chattanuk : Naturel Ressources Institute.
27. PLISNIER.P.MICHA JC et FRANC., 1988. Biologie et
exploitation des poissons du lac Ihema, presses universitaires de
namur.202p.
28. VERNE-B.J., 2012. Rapport de stage sur l'identification,
distribution et taxonomie des cichlidés Ectodini du lac Tanganyika (
200-2001).
29. ZIGASHANE O., 2011. Contribution à l'étude
du régime alimentaire de l'espèce Bagrusdocmac(
teleostei, bagridae) dans la rivière ishasha et le lac Edouard.
Mémoire inédit, faculté des sciences et sciences
appliquées, UOB. 51p.
ANNEXES


De gauche à droite lors de la capture des
échantillons sur terrain 

Analyse des échantillons au
laboatoire


Certains ds contenus
stomacaux observés



Du gauche, les oeufs du Bathybates minor,au milieu son
image et à doite Bathybates graueri
Table des matières
DEDICACE..........................................................................................................................................................I
REMERCIEMENTS............................................................................................................................................II
ABREVIATIONS.............................................................................................................................................III
RESUME..........................................................................................................................................................IV
SUMMURY.....................................................................................................................................................V
INTRODUCTION
Erreur ! Signet non
défini.
CHAPITRE I : REVUE DE LITTERATURE
4
A) GENERALITE SUR LE LAC TANGANYIKA
4
I.1. Situation géographique du Lac
Tanganyika
4
I.2 LA PHYSICO- CHIMIE DU LAC TANGANYIKA.
4
I.3. Histoire géologique du lac
Tanganyika
6
I.4. Conditions hydrologiques.
6
I.4.1. Affluents du lac Tanganyika
6
I.4.1.1. Rivière Ruzizi
6
I.4.1.2. Rivière Malagarazi
7
I.4.2. Variation du niveau du lac
7
I.5. Conditions physiques et climatiques.
7
I.6. Biotopes du lac Tanganyika
8
I.7. Faune et flore
8
a. Le
Phytoplancton
8
b. Les plantes
supérieures
8
Poissons Cichlidae
10
1°) Description
10
2°) Coloration
11
3°) Habitat
11
B. GENERALITES SUR LE TRIBU BATHYBATINI
12
B.1. Classification
12
B.2. TRIBU DES BATHYBATINI
12
B.2.1. GENRE BATHYBATES (Poll 1956)
13
CHAPITRE II. MATERIEL ET METHODES
17
II.1. Milieu d'étude et sites
d'échantillonnage
17
METHODOLOGIE DE RECOLTE DES DONNEES
21
ANALYSE DES RESULTATS
24
CHAP III. RESULTATS ET INTERPRETATIONS
25
III.1 Espèces récoltés et leur
abondance dans les sites
25
III.2 Abondance des mâles, femelles et
juvéniles pour les deux espèces dans les 4 sites
25
III.3 Sex-ratio
26
III.3.1Bathybates graueri
27
III.3.1.2. Stades de maturité des gonades
pour l'espèce Bathybates graueri
27
III.3.1.3.MOYENNE DE LONGUEUR TOTALE, STANDARD ET
POIDS DES INDIVIDUS DE L'ESPECE BATHYBATES GRAUERI
28
III.3.2 Bathybates minor
28
III.3.2.1.stades de maturité des gonades
pour Bathybates minor
28
III.3.2.2.MOYENNE DE LONGUEUR TOTALE, STANDARD ET
POIDS DES INDIVIDUS DE L'ESPECE BATHYBATES MINOR
29
III.3. Taille de la première
maturité
30
III3.2.DISTRIBUTION MENSUELLE DELA MATURITE
SEXUELLE DU BATHYBATES GRAUERI
32
III.3.3.EVOLUTION MENSUELLE DE LA MATURITE SEXUELLE
CHEZ BATHYBATES MINOR
32
III.4. FECONDITE ABSOLUE
33
III.4.1. Fécondité absolue pour
Bathybates graueri
33
III.4.2. Fécondité absolue pour
Bathybates minor
34
III.5.EFFECT DU STADE DE MATURITÉ
36
III.5.1.Anova pour les Stades de
Maturité
36
III.5. 2.EFFECT DES SITES
37
III.5.2.1.Anova pour les sites
37
III.5. 3.EFFECT DES SEXES
38
III.5.3.1.Anova pour les sexes
38
III.6. Ecologie alimentaire de B.graueri et
B.minor
38
III.6.1. Régime alimentaire de Bathybats
minor
38
III.6.2. Régime alimentaire de B.
graueri
39
CHAPITRE IV. DISCUSSION DES RESULTATS
46
CONCLUSION ET RECOMMENDATION
49
BIBLIOGRAPHIE
51
ANNEXES
54



