|
UNIVERSITE DE LUBUMBASHI
FACULTE DES SCIENCES AGRONOMIQUES
Département de Phytotechnie
B.P : 1825

Impact des activités minières sur la
macrofaune du sol : Cas des bassins de rejets miniers de Kipushi et de
Musoshi
Par MUGANGUZI NTALE Trésor
Mémoire présenté et défendu en vue
de l'obtention du grade d'ingénieur agronome
Septembre 2016


UNIVERSITE DE LUBUMBASHI
FACULTE DES SCIENCES AGRONOMIQUES
Département de Phytotechnie
B.P : 1825
Impact des activités minières sur la
macrofaune du sol : Cas des bassins de rejets miniers de Kipushi et de
Musoshi
Par MUGANGUZI NTALE Trésor
Mémoire présenté et défendu en vue
de l'obtention du grade d'ingénieur agronome
Défendu le 04 Octobre 2016
Directeur :Prof. MUJINYA BAZIRAKE
Basile
Encadreur :Doctorant MPINDA TUSHIMININE
Martin
Année Académique 2015-2016
Epigraphe
" Faune du sol : intestins contestables du sol,
qu'il faut préserver à tout prix !"
MUGANGUZI NTALE Trésor
Dédicace
A mon père MUGANGUZI B. Fernand et ma mère
KIZA K. Dorcas, pour votre amour, votre soutient sur tous les plans. Aucune
phrase ne pourra exprimer l'amour que je porte pour vous. Prenez cette oeuvre
d'esprit qui témoigne ma profonde gratitude !
A mes frères et soeurs, Aimé N., Solange B.,
Thérèse DINA., Ruth M., Gloire M., John K., Joseph I., Francine
M., pour votre amour et soutient dont je suis bénéficiaire et
très fière.
A mes neveux et ma nièce, Daniel C., Glociel et
Merciel,
A ma famille,
A Sylvie MUGANGUZI, tu aurais amé partagé ce
moment !
A ceux qui m'ont transmis leur passion pour la science,
pour les sciences de la vie, et pour la vie !
Remerciements
L'achèvement de ce mémoire est une
apothéose d'un courage à braver les difficultés et d'une
chance à bénéficier d'un appui sans dimension. Qu'il me
soit alors permis d'adresser mes remerciements à tous ceux qui ont
apporté leur assistance, d'une manière ou d'une autre, à
sa réalisation.
Je tiens tout d'abord à exprimer ma profonde gratitude
et mes sincères remerciements au professeur MUJINYA BAZIRAKE Basile,
directeur de l'unité de recherche « Bio-géochimie et
Écologie des Sols et des Écosystèmes Tropicaux
(BESET) », directeur de ce mémoire. Avec sa
disponibilité, son savoir-faire, ses conseils, son soutien financier, il
m'a permis de réaliser ce mémoire dans les meilleures conditions.
Merci d'avoir couvert la totalité des frais de laboratoire pour les
analyses et d'avoir déboursé une grande somme dans l'achat du
matériel de terrain. Merci encore pour tout !
Je tiens à remercier le Doctorant Meng. MPINDA
TUSHIMININE Martin, pour sa générosité et son savoir-faire
qu'on lui connait, lui qui, en dépit de ses différentes
occupations, a accepté l'encadrement de ce travail.
J'adresse également mes remerciements :
ü Au Prof. NGOY SHUTCHA Mylor, doyen de la Faculté
des Sciences Agronomiques, à toutes les autorités
académiques et administratives, pour avoir assuré notre formation
;
ü Au Chef des Travaux USENI S. Yannick, pour son encadre,
ses conseil et soutien moral ;
ü Aux Msc. TSHIBUNGU Alain, TSHIBANGU Audry et KASANGIJ
Patrick, pour leurs conseils ;
ü A KISIMBA Trésor, pour l'encadrement pendant les
analyses, son sacrifice et soutien ; tu restes un ami
incontestable ;
ü A mon ami NGOY BANZA Hardy, pour m'avoir
accompagné sur terrain, avec toutes les peines possibles ; je
n'oublierai jamais qu'il a travaillé jusqu'à très tard
pendant la réalisation de ce travail.
ü A mes oncles, tantes, cousins, cousines, neveux et
nièce,... pour leur amour et appui. Je cite : BIRINDWA A.
Moïse, RUHEZA M. Benjamin,...
ü Aux compagnons de lutte, les étudiantes de Grade
2 Phytotechnie (2015-2016), je site : Joseph K., Ruffin S., Didier K., De
Gaulle M., Cyprien K., Laurant L,...
ü Au amis et connaissances, je site : Jules M., Remy
K., Alphons M., Bienvenu K., Cédric K., Mike K., Houston K.,
Médard I., Gentil K., Junior K.,...
Résumé
Depuis des longues années l'actuelle province du
Haut-Katanga a procédé à l'extraction et transformation
des métaux lourds. Cette extraction s'accompagnait des rejets dans
l'environnement d'une grande quantité des déchets et effluents
chargés en métaux lourds (Cu, Zn, etc.) qui posent des
dégâts sur la flore, mais surtout sur la faune en avale. C'est
ainsi que ce travail a été initié en vue d'évaluer
l'impact des activités minières (métaux lourds) sur la
macrofaune du sol. Les échantillonnages systématiques ont
été réalisés sur les sols environnant les bassins
de rejets miniers de Kipushi et Musoshi. L'échantillonnage a
été réalisé en deux temps selon la méthode
standard TSBF adaptée pour les sols tropicaux, aux intervalles de 50 m
depuis les bords du bassin jusqu'à 200 m dans la forêt. Les
résultats obtenus ont révélé que les sols
environnant les bassins de décantation sont acides (pH > 6),
excepté les sols près du bassin de Kipushi dont le pH est alcalin
(pH > 7.5). L'ensemble des paramètres physico-chimiques
observés à Kipushi (à l'exception du Phosphore disponible
et de l'Azote total) décroissaient avec l'éloignement au bassin
pendant que ceux observés à Musoshi croissaient avec
l'éloignement ; les teneurs en métaux lourds (excepté
le Zn) étaient fortement supérieurs à celles
rapportées pour les sols non contaminés. Pour les deux sites,
l'abondance et la diversité des macroinvertébrés
croissaient avec l'éloignement au bassin. Concernant la relation
macrofaune-paramètres édaphiques, le Cu, le Fe, l'acidité
échangeable et le carbone organique influencent significativement la
répartition des macroinvertébrés (p < 0.05). Les
résultats de cette étude ont monté que les
activités minières ont un impact négatif sur la macrofaune
du sol.
Mots clés : Activités
minières, macrofaune, abondance et diversité, Haut-Katanga.
Abstract
For many years the current Upper-Katanga Province performed
the extraction and processing of heavy metals. This extraction was accompanied
by the release into the environment of large amounts of waste and effluents
containing heavy metals (Cu, Zn, etc.) that cause damage to the flora, but
especially wildlife swallows. Thus this work has been initiated to assess the
impact of mining (heavy metals) on the soil macrofauna. Systematic sampling was
carried out on the soil surrounding ponds ofKipushi and Musoshi tailings.
Sampling was conducted in two stages using the standard method TSBF suitable
for tropical soils, 50 m intervals from the edges of the basin up to 200 m in
the forest. The results showed that the soil surrounding the tailings ponds are
acidic (pH> 6), except the soil near the Kipushi basin whose pH is alkaline
(pH> 7.5). All physicochemical parameters observed in Kipushi (with the
exception of available phosphorus and total nitrogen) decreased with the
distance to the pool while those observed in Musoshi grew with distance; the
heavy metal content (except Zn) were significantly higher than those reported
for uncontaminated soils. For both sites, the abundance and diversity of
macroinvertebrates grew with the distance to the pool. Regarding the edaphic
macrofauna-parameter relationship, Cu, Fe, exchangeable acidity and organic
carbon, significantly influence the distribution of macroinvertebrates (p
<0.05). This study revealed that mining activities influence negatively soil
macrofauna.
Keywords: Mining activities, macrofauna,
abundance and diversity, Upper-Katanga.
Table des
matières
Epigraphe
i
Dédicace
ii
Remerciements
iii
Résumé
v
Abstract
vi
Table des matières
vii
Liste des figures
x
Liste des tableaux
xi
Introduction
1
Chapitre 1. Revue bibliographique
3
1.1. Activités minières dans la
Haut-Katanga et leurs impacts environnementaux
3
1.1.1. Déforestation et perte de la
biodiversité
3
1.1.2. Contamination du sol
4
1.1.3. Contamination des eaux de surface
4
1.2. Généralité sur la
macrofaune du sol
5
1.2.1. Définition
5
1.2.2. Groupes des indicateurs clés et leurs
écologies
5
1.2.2.1. Vers de terre
6
1.2.2.2. Termites
7
1.2.2.3. Fourmis
8
1.3. Structures biogéniques
générées par les activités de la macrofaune du
sol
8
1.3.1. Galeries des vers de terre
8
1.3.2. Turricules de vers de terre
9
1.3.3. Termitières
9
1.3.4. Fourmilières
9
1.4. Relations entre la macrofaune du sol et les
facteurs abiotiques du milieu
10
1.4.1. Régime air-eau
10
1.4.2. Température du sol
11
1.4.3. Réaction du sol (pH) et type de
sol
11
1.3.4. Salinité du sol
12
1.3.5. Matière organique
12
1.4.6. Métaux lourds (activités
minières)
12
1.5. Relations entre les indicateurs clés et
autres organismes du sol
13
1.6. Réponses de la macrofaune du sol face
aux facteurs abiotiques du milieu
14
1.7. Importance de la macrofaune du sol
14
1.7.1. Ingénieurs de
l'écosystème
14
1.7.2. Rôle dans la fertilité du
sol
15
Chapitre 2. Milieu, Matériels et
Méthodes
16
2.1. Milieu d'étude
16
2.1.1. Localisation
16
2.1.2. Climat
16
2.1.3. Sol
17
2.1.4. Végétation
18
2.1.5. Sites étudiés
18
2.1.5.1. Kipushi
18
2.1.5.2. Musoshi-Gare
19
2.2. Matériels
20
2.2.1. Matériel biologique
20
2.2.2. Outils, appareils et réactifs
20
2.3. Méthodologie
21
2.3.1. Stratégie d'échantillonnage et
prélèvement de la macrofaune du sol
21
2.3.2. Travail du laboratoire et
caractérisation des sols
23
2.3.3. Analyses statistiques
25
Chapitre 3. Résultats
27
3.1. Caractéristiques physico-chimiques des
sols des sites étudiés
27
3.2. Abondance et diversité des
macroinvertébrés des sols des sites étudiés
31
3.2.1. Abondance des macroinvertébrés
du sol
31
3.2.2. Diversité des
macroinvertébrés du sol
32
3.3. Corrélations et influence entres les
paramètres physico-chimiques des sols et la macrofaune du sol.
34
Chapitre 4. Discussion
38
4.1. Caractéristiques physico-chimiques des
sols des sites étudiés
38
4.2. Abondance et diversité des
macroinvertébrés des sites étudiés
40
4.3. Relations entre les paramètres
physico-chimiques du sol et la macrofaune du sol.
41
Conclusion
44
Bibliographie
45
Liste des figures
Figure 1-1 : Impact des
activités minières sur l'environnement : (a) Déforestation
et perte de la biodiversité dans le bassin de décantation de
Kipushi ; (b) Contamination du sol et des eaux de surface dans le bassin
de Shimambo à Musoshi-Gare
1
Figure 1-2 : Morphologie
d'un ver de terre adulte
6
Figure 1-3 : Castes
d'une colonie de termites
7
Figure 1-4 : Anatomie de la
fourmi
8
Figure 1-5 : Structures
biogéniques produites par la macrofaune du sol : (a) Galerie de vers de
terre tapissé de déjections, (b) Turricules de vers de terre, (c)
termitière, (d) fourmilière
10
Figure 2-1 : Arc
cuprifère du Katanga
16
Figure 2-2 : Localisation
des sites étudiés dans la province du Haut-Katanga, RD. Congo
20
Figure
2-3. Schéma descriptif d'un monolithe de sol.
22
Figure 2-4 :
Opérations réalisées au cours des travaux de terrain :
(a), (b) et (c) prélèvement de monolithe de sol ; (d) tamisage du
sol et triage des macroorganismes
23
Figure 2-5 :
Opération réalisées au laboratoire : (a)
préparation des échantillons ; (b) analyse du pH et de la
conductivité ; (c) analyse de l'azote et du carbone organique ; (d) et
(e) analyse des Métaux lourds par XRF ; (f) analyse du Phosphore
25
Liste des tableaux
Tableau 2-1 :
Représentation des points de prélèvement
1
Tableau 2-2. Les variables
pédologiques (physiques et chimiques) déterminés
24
Tableau 3-1 :
Résumé des caractéristiques physico-chimiques des sols des
sites étudiés.
30
Tableau 3-2 :
Abondance des macroinvertébrés à Kipushi.
31
Tableau 3-3 :
Abondance des macroinvertébrés à Musoshi.
32
Tableau 3-4 :
Catégories des espèces de la macrofaune recensé dans les
sites étudiés
33
Tableau 3-5 : Indices
de diversité de la macrofaune à Kipushi
34
Tableau 3-6 : Indices
de diversité de la macrofaune à Musoshi
34
Tableau 3-7 : Matrice
des corrélations de Pearson des facteurs physico-chimiques et de la
macrofaune du sol de Kipushi.
36
Tableau 3-8 : Matrices
des corrélations de Pearson des facteurs physico-chimiques et de la
macrofaune du sol de Musoshi
37
Introduction
Le problème des sols contaminés est aujourd'hui
très préoccupant pour les pays émergents. Ces pays (cas de
la République Démocratique du Congo) ont développé
depuis des longues années, des activités d'extraction et de
transformation des métaux lourds (
Tembo et al., 2005 ; Ngoy Mwana et
al., 2006 in
Mpundu, 2010). Dans diverses usines
hydro-métallurgiques et fonderies, l'extraction des métaux
s'accompagnait des rejets des sous-produits tels que le cuivre, le cobalt, le
plomb, le zinc, etc. qui ne peuvent pas être biodégradés (
Kashimbo et al., 2015) et donc
persistent dans l'environnement pendant de longues périodes (
Tembo et al., 2005) . Leur accumulation
dans l'environnement peut se répercuter sur les êtres humains et
les animaux en menaçant leur habitat (
Tembo et al., 2005) mais aussi sur leur
santé (
Malaisse, 1997 ;
Wang et al., 2003 ;
Mpundu, 2010). Il a été
démontré, dans la région de Lubumbashi, que les
émissions de SO2 par la cheminée du four de l'usine
d'extraction et de transformation du cuivre de la Gécamines
étaient responsables de pluies acides (
Mbenza et al., 1989), néfastes
pour les êtres vivants dont la faune du sol et les
végétaux. Les résultats des études menées
par
Banza et al. (2009) ont
révélé des teneurs élevées en ETM dans les
urines et les sangs des personnes habitant dans les quartiers environnant de
sites miniers, à cause d'un contact plus long avec les poussières
chargées en métaux lourds.
A l'échelle microscopique, les métaux lourds ont
aussi des effets néfastes sur la population bactérienne (
Belyaeva et al., 2005), ce qui n'est
pas sans conséquence sur la vie des autres organismes du sol et sur le
fonctionnement de l'écosystème tout entier. Il a
été démontré que l'augmentation de la teneur en
métaux lourds au-delà d'un certain seuil réduit la
densité des vers (
Pizl & Josen, 1995) et influe
négativement sur leur croissance pondérale, leur
développement sexuel et la production de cocons (
Spurgeon & Hopkin, 1999).
Pourtant, la macrofaune du sol est une source de
biodiversité animale importante qu'il convient de préserver. Elle
comprend de nombreux taxons, comprenant eux-mêmes de centaines voire des
milliers d'espèces (
Bachelier, 1978 ;
Gobat et al., 2003), qui ont des
rôles essentiels dans la stabilité de l'écosystème,
dans le maintien de la qualité du sol et peuvent fournir un certain
nombre de biens et de services écosystémiques utiles pour les
sociétés humaines (
Millenium Ecosystem Assessment,
2005 ;
Mujinya et al., 2014). Ainsi, elle
participe à la décomposition de la matière organique et
à la biodisponibilité des nutriments pour les plantes et les
microorganismes du sol(Dangerfield et al., 1998 in
Mujinya et al., 2014). Elle joue
également dans la création et la conservation de la structure du
sol (
Mayeux & Savanne, 1996).
Au regard de toutes ces conséquences
énumérées ci-haut sur la santé et l'environnement
(faune et flore) due à l'impact des métaux lourds, des
études ont été initiées pour développer,
d'une part, des techniques efficaces pour décontaminer les sites
pollués (
Rufus et al., 1997 ;
Salt et al., 1998 ;
Prabha et al., 2007 ;
Ngoy, 2010) et d'autres parts, des stratégies de
conservation in situ et ex situ des espèces de la
flore endémique des sites métallifères menacées par
l'extinction (
Li, 2006 ;
Ngoy, 2010 ;
Ilunga, 2010 ;
2014).
Cependant, il existe peu d'études jusqu'à
présent qui ont mis en évidence l'impact de ces métaux
lourds sur la faune du sol, plus particulièrement sur la macrofaune du
sol, en menant un inventaire in situ. D'où l'originalité
de la présente étude.
Cette étude poursuit l'objectif principal
d'évaluer l'impact indirecte des activités minières sur
l'abondance et la diversité de la macrofaune du sol.
Spécifiquement, il s'agira de : (1) donnerles
propriétés physico-chimiques des sols environnant les sites de
traitement minier (bassins de décantation), (2) évaluer
l'abondance et la diversité de la macrofaune de ces sols et
(3) Mettre en évidence les relationsexistantes entre les
propriétés édaphiques des sites miniers et
macroinvertébrés.
Outre l'introduction et la conclusion, ce travail s'articule
en 4 chapitres : la revue bibliographique (chapitre 1) ; milieu,
matériels et méthodes (chapitre 2) ; résultats (chapitre
3) et enfin la discussion (chapitre 4).
Chapitre 1. Revue
bibliographique
1.1. Activités
minières dans la Haut-Katanga et leurs impacts environnementaux
La présence des nombreuses collines riches en minerais
de cuivre et cobalt a conduit dans le district du Haut-Katanga au
développement des industries d'extraction et de transformation des
minerais (
Kaniki, 2008). Celle-ci a débuté depuis
l'époque précoloniale, où les croisettes de cuivre
étaient utilisées comme monnaie dans la transaction commerciale,
et s'est ensuite intensifiée dès 1906 avec la création de
l'Union Minière du Haut-Katanga (UMHK) pour atteindre le pic de
production des minerais avec la Gécamines vers les années 1970 ;
qui connut par la suite, une chute de production spectaculaire due à une
mauvaise gestion vers les années 1990 (
Ngoy, 2007). Une reprise très nette des
activités d'extraction a eu lieu depuis quelques années et
actuellement, ces activités ont connu une expansion florissante due
à l'arrivée des nombreux investisseurs dans le secteur minier (
PROMINE, 2014).
Cependant, les étapes du traitement des minerais depuis
l'extraction jusqu'à la production du métal purifié sont
génératrices des nuisances pour l'environnement par
l'altération de celui-ci (
Impes et al., 1991). En effet, depuis
l'extraction du minerai des gisements par l'établissement des
carrières jusqu'à celle du minerai spécifique
recherché à l'industrie, l'activité minière,
rejette dans l'environnement les déchets solides et les effluents
(liquides) car le minerai recherché n'est qu'une infime fraction du
volume de la roche déplacée (
Impes et al., 1991). Le passage des
engins lourds sur le site minier entraine aussi une destruction de la structure
du sol, chose qui impacte négativement sur la biodiversité (
Leteinturier et al., 1999).
1.1.1. Déforestation et
perte de la biodiversité
Les opérations réalisées durant la phase
d'exploration et d'exploitation minière entrainent la destruction de la
flore et faune sur la zone affectée, la migration des espèces
animales vers des zones plus calmes et la recolonisation du milieu par la flore
métallophyte (
Ngoy et al., 2010). L'ouverture des voies
d'accès à la mine est aussi une menace pour la
biodiversité (
Leteinturier et al., 1999).
L'effet le plus direct sur la faune est la destruction ou le
déplacement des espèces dans les zones d'excavation et
d'accumulation des déchets miniers. Les espèces mobiles de la
faune, comme le gibier, les oiseaux et les prédateurs, quittent ces
zones (
Depta et al., 1999). Les animaux plus
sédentaires, comme les invertébrés, de nombreux reptiles,
les rongeurs fouisseurs et les petits mammifères, peuvent être
plus sévèrement affectés (
MINEO Consortium, 2000).
1.1.2. Contamination du sol
Les risques sur la santé humaine sur l'environnement
provenant de sols appartiennent généralement à deux
catégories: (1) sol contaminé provenant des poussières
fouettés par le vent et (2) les sols contaminés à partir
de déversements de produits chimiques et de résidus (
Tembo et al., 2005). La poussière
fugitive peut poser des problèmes environnementaux significatifs dans
certaines mines ; la toxicité inhérente de la
poussière dépend de la proximité des récepteurs
environnementaux et du type de minerai exploité. Les sols
contaminés à partir de déversements de produits chimiques
et des résidus sur les sites de la mine peuvent poser un risque de
contact direct lorsque ces matériaux sont utilisés abusivement
comme matériaux de remblayage, pour la création de zones vertes
ornementales ou encore comme suppléments de sol (
MINEO Consortium, 2000).
1.1.3. Contamination des eaux
de surface
Les rejets des déchets dans les rivières (pour
les usines qui procèdent par hydrométallurgie) ont comme
conséquences la pollution des rivières par les substances
chimiques (
Cobert, 1977;
Katemo et al., 2010 ;
Mees et al., 2013). Ceci entraîne un
débordement des boues à caractère souvent sableux, se
propageant ainsi sur un grand espace blanc semblable à un désert
communément appelés « Katapula », cas de Kipushi,
usine de zinc de Kasombo(UZK), Mashamba, Musoshi,... (
Montgomery, 2003 ;
Anonyme, 2004 ;
Prince, 2007).

Figure 1-1
:Impact des activités minières sur l'environnement : (a)
Déforestation et perte de la biodiversité dans le bassin de
décantation de Kipushi ; (b) Contamination du sol et des eaux de
surface dans le bassin de Shimambo à Musoshi-Gare (photos Muganguzi,
2016).
1.2.
Généralité sur la macrofaune du sol
1.2.1. Définition
Aujourd'hui, de très nombreuses études
s'intéressent au rôle des communautés
d'invertébrés dans les processus physico-chimiques et biologiques
du sol (
Sarr et al., 2001 ;
Folgarait et al., 2003 ;
Mujinya et al., 2010 ;
2014). En dehors de la classification
zoologique, ces communautés peuvent être classées en 4
groupes fonctionnels basés sur la taille : (i) microfaune (moins de
0.2 mm), (ii) mésofaune (de 0.2 à 4 mm), (iii) macrofaune (4
à 100 mm) et (iv) mégafaune (plus de 100 mm) (
Bachelier, 1978).
Le groupe des macrofaunes, qui fait l'objet de cette
étude, comprend essentiellement les mollusques, les lombricidés,
les myriapodes, les insectes, les isoptères et les arachnides (
Lavelle et al., 1994). Ce groupe est
très diversifié et très sensible à toute
modification du milieu, ces divers composants répondent
différemment suivant leur adaptabilité.
1.2.2. Groupes des indicateurs
clés et leurs écologies
Les principaux groupes de la macrofaune du sol en fonction de
leur abondance et l'importance de leurs activités dans le sol sont: les
vers de terre, les termites, les fourmis, les myriapodes, diptères et
coléoptères (
Lavelle & Spain, 2001). Dans le cas de
cette étude, il sera question d'étudier les trois principaux
groupes (verres de terre, termites et fourmis).
1.2.2.1. Vers de terre
Comme leur nom l'indique, les vers de terres (lombrics) sont
des vers terrestres qui creusent dans le sol. Ils font souvent surface lorsque
le sol est froid ou humide (
Ruiz et al., 2008). Ils appartiennent
à l'embranchement des Annélides, qui comprend la classe des
Oligochètes et des Hirudinées (
Bachelier, 1978). Ils ont un corps
segmenté, divisé en deux parties (Figure 1-2) : une partie
antérieure avec des segments contenant des ganglions céphaliques,
les organes reproducteurs, gésiers, les glandes et les coeurs
calcifiants ; et une partie postérieure vers l'arrière de
l'intestin postérieur, comprenant une série de segments assez
similaires (
Bachelier, 1978). A l'âge adulte, ils
mesurent entre 3 et 30 cm, mais dans des cas rares, ils peuvent mesurer
75 cm à 3 m de long (
Ljungstrom & Reinecice, 1969).
Le lombricien avale la terre où il trouve ses aliments
(les débris des végétaux plus ou moins
décomposés) ; Ils sont donc omnivores (
Sims & Gerard, 1999). Il peut être
ainsi considéré comme un animal utile (
Villeneuve & Désiré,
1965). Il respire, en effet, par la peau (on parle de la respiration
cutanée).
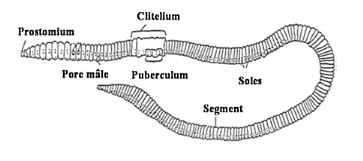
Figure 1-2
:Morphologie d'un ver de terre adulte (
Da Silva, 2013).
Selon des critères morphologiques et comportementaux
les vers de terre se répartissent en trois grandes catégories
écologiques : les épigés, les anéciques et les
endogés (
Lee, 1985 ;
Da Silva, 2013).Ils sont hermaphrodites ;
néanmoins, ils doivent s'accoupler pour se reproduire (
Pelosi, 2008). D'autres peuvent se reproduire sans
accouplement, par auto-fertilisation ou parthénogénèse (
Sims & Gerard, 1999). Ils ont une
durée de vie dépendante de l'espèce, de leur biotope et
des conditions dans lesquelles ils vivent (
Lakhani & Satchell, 1970). Sous les
tropiques, ils sont principalement actifs pendant les saisons des pluies (
Lavelle, 1971).
1.2.2.2. Termites
Les termites sont les insectes sociaux (
Thomas, 2006). Cela signifie qu'ils sont
organisés, formant des colonies où diverses castes
(différentes personnes ayant des rôles différents dans la
colonie) avec un ensemble de spécialisations morphologiques et
physiologiques coexistent (
Ruiz et al., 2008). Ils sont les seuls
représentants de l'ordre des isoptères et les seuls insectes
sociaux non hyménoptères (abeilles, guêpes, fourmis) (
Inward et al. 2007 ;
Legendre et al., 2008). Ils utilisent
efficacement le bois et les résidus végétaux pauvre en
nutriments (cellulose) (
Decaëns et al., 1994). En se
basant sur leurs différents régimes alimentaires, quatre groupes
sont distingués (
Bourguignon et al., 2011
D:\Trésor\Trésor\Mon
Mémoire\Trésor Docs Chap 1\2008_Lefebvre_T_these (most important
for termites).pdf) : (1) Les xylophages, qui
vivent plus ou moins dans le bois ; (2) Les
champignonnistes, qui consomment du bois, des feuilles et des
herbes et vivent en symbioses avec des champignons dans des chambres
appelée meules à champignon ; (3) Les
fourrageurs, qui consomment des herbes et de la litière
; (4) Les humivores, qui se nourrissent d'humus et sont
parfois géophages.
Les termites connaissent une métamorphose progressive
et différentes voies de développement conduisent à trois
ou plusieurs castes terminales différentes qui sont polymorphes (
Lavelle & Spain 2001). Leur cycle de vie
commence par l'oeuf ; le développement de l'oeuf aboutit à
la larve. À partir de cette étape, certains individus deviennent
des soldats et d'autres des ouvriers (
Lavelle & Spain 2001).Une colonie de
termites typique comprend des nymphes (jeunes, individus semi-matures), les
travailleurs, les soldats et les individus reproducteurs des deux sexes,
parfois avec plusieurs reines de ponte (Figure 1-3).
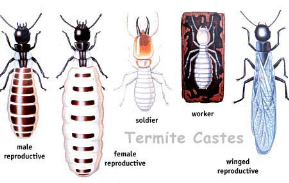
Figure 1-3 :
Castes d'une colonie de termites
1.2.2.3. Fourmis
Les fourmis sont des insectes sociaux formant des colonies,
appelées fourmilières (Figure 1-5d), parfois extrêmement
complexes, contenant de quelques dizaines à plusieurs millions
d'individus (
Deneubourg, 1991). Elles peuvent se produire
en grand nombre dans les sols et sur leurs surfaces.
Les fourmis sont classées dans la famille des
Formicidae, dans l'ordre des hyménoptères, c'est
à dire des insectes dont les deux paires d'ailes sont membraneuses et
fines (
Ouadfel, 2006). Cette famille est subdivisée
en 11 sous-familles et compte approximativement 10 000 espèces (
Benyamina, 2013).
Les fourmis mesurent généralement 0.01 à
3 cm, et pesant de 1 à 150 mg. Elles ont un corps constitué
principalement de muscles enveloppés dans une carapace chitineuse
très résistante. On peut observer que le corps de la fourmi est
divisé en trois parties majeures (la tête, le thorax et l'abdomen)
bien reconnaissables (
Ouadfel, 2006). Même si la plupart des fourmis
sont asexuées, certaines présentent un système reproductif
mâle ou femelle (
Ouadfel, 2006).
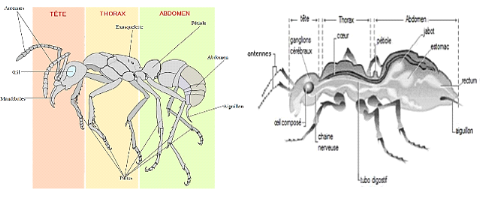
Figure1-4 :
Anatomie de la fourmi (
Ouadfel, 2006)
1.3. Structures
biogéniques générées par les activités de la
macrofaune du sol
1.3.1. Galeries des vers de
terre
Le nombre de galeries dans un sol dépend de l'abondance
des vers de terre, mais peut atteindre plusieurs centaines par m2 (
Lee, 1985). Dans les sites avec des communautés
de vers de terre importantes, le volume des galeries contribue pour une grande
part aux pores du sol et fournit ainsi une voie de passage pour l'air et l'eau
dans le sol (
Tomlin et al., 1995). Les
expérimentations en microcosmes ont montré que les galeries de
L. terrestris augmentaient de 8 à 9 fois la conductivité
hydraulique (
Joschko et al., 1989). Des
études au champ (in situ) confirmé ces résultats
en montrant un transfert d'eau par les galeries de L. terrestris (
Edwards et al., 1992) et une forte
corrélation du taux d'infiltration avec la longueur, la surface et le
volume des galeries d'un ver anécique Scherotheca gigas mifuga (
Bouché & Al-Addan, 1997).
Cependant, le seul inconvénient enregistré
jusque-là est que les galeries de vers de terre peuvent
accélérer le transfert en profondeur des produits phytosanitaires
vers les nappes phréatiques(
Pelosi, 2008).
1.3.2. Turricules de vers de
terre
Les vers de terre ingèrent les sols, puis les
excrètent à la surface du sol (turricules) ou dans les galeries
(fèces) (
Huynh, 2009). Selon leur diamètre, ils peuvent
être granulaires, produits par les épigés
(très petits et formés par des boulettes fécales
isolées) ou globulaires, produits par les
endogés et les anéciques (plus grandes et formées de
grands agrégats) (Lee, 1985). La quantité de turricules produite
peut aller de 40 à 50 tonnes ha-1 par an, ce qui
représente une épaisseur de sol de 3 à 4 mm (Lee,
1985).
1.3.3. Termitières
Les termitières (Figure 1-5c) sont parmi les
caractéristiques les plus remarquables en Afrique subsaharienne, en
particulier dans les paysages de savane (
Mujinya et al., 2014). Les
termitières sont de divers types (
Grassé, 1984a). Elles sont la partie
épigée d'un nid de termites d'origine hypogée (
Bachelier, 1978 ;
Thomas, 2006). Par conséquent, les
termitières ont au moins une partie de leur structure en dessous de la
surface du sol. En Afrique, les termites construisent la moitié de la
biomasse des plaines. Leurs nids peuvent se produire dans des endroits
différents, par exemple dans le bois en vie ou des arbres morts, dans
des endroits souterrains, dans d'autres nids formés par d'autres
espèces de termites. Différentes études (
Mujinya et al., 2011 ;
Stewart et al., 2011 ;
Abe et al., 2016) ont
démontré que les sols de termitières présentaient
des caractères bien particuliers.
1.3.4. Fourmilières
La fourmilière classique (Figure 1-5d) est
constituée par un ensemble de cellules réunies entre elles par un
réseau complexe de galeries qui peut être très important.
Dans ces cellules, les fourmis déposent les oeufs, les larves et les
nymphes (
Harun, 2003 ;
Benyamina, 2013).

Figure 1-5
:Structures biogéniques produites par la macrofaune du sol :
(a) Galerie de vers de terre tapissé de déjections, (b)
Turricules de vers de terre, (c) termitière, (d) fourmilière
(photos Muganguzi, 2016).
1.4. Relations entre la
macrofaune du sol et les facteurs abiotiques du milieu
La macrofaune du sol est très sensible à toutes
modification des conditions abiotiques du milieu ; ses divers composants
répondent différemment suivant leur adaptabilité (
Lavelle et al., 1994).
1.4.1. Régime
air-eau
Les lombriciens sont composés à 80-90% d'eau
lorsqu'ils sont pleinement hydratés (
Lee, 1985 ; Avel, 1959). D'une manière
générale, les vers de terre recherchent l'humidité et
craignent plus la sécheresse qu'une immersion temporaire. C'est ainsi
qu'ils restent très sensibles aux faibles humidités. Ils ont une
respiration cutanée, qui n'est possible que si leur peau est maintenue
humide (
Bachelier, 1978). Leur respiration croît
avec la température ; mais, ils fuient les atmosphères à
plus de 25 % de CO2.
Comme les vers de terre, les termites et les fourmis sont
très susceptibles à la dessiccation. Ils doivent vivre dans une
atmosphère constamment humide et l'eau leur est nécessaire pour
élaborer leur salive qui chez eux joue un grand rôle, tant dans
l'alimentation que dans la construction des leurs habitats (termitières
et fourmilières) et le maintien de l'humidité dans ces derniers.
Cependant, ce qui les rend particuliers, est qu'ils utilisent non seulement
l'eau de leurs aliments et l'eau susceptible de s'accumuler en saison des
pluies dans la partie d'affouillement de certaines termitières (
Boyer, 1973), mais aussi l'eau qu'ils descendent
chercher si nécessaire à plusieurs mètres de profondeur (
Lepage et al., 1974), et
éventuellement l'eau métabolique résultant de la
décomposition des glucides (Struthers, 1970 In
Watson, 1974).
1.4.2. Température du
sol
La température des sols est aussi un facteur important
dans la répartition de la macrofaune dans le sol. Etant
poïkilothermes, les vers de terre ne peuvent pas réguler leur
température corporelle et sont par conséquent très
sensibles aux variations de température. Les conditions optimales de
température se situent en général entre 10 et 20°C
pour les espèces de régions tempérées et entre 20
et 30°C pour les zones tropicales. Peu d'espèces survivent à
des températures inférieures à 0°C ou
supérieures à 28°C (
Lee, 1985 ;
Curry, 2004 ;
Sims & Gerard, 1999).
De même, les termites sont sensibles au baisse de
température, d'où l'édification des termitières. La
limite de température minima est de 9°C, mais chaque espèce
a ses préférences (
Pomeroy, 1977).Comme le vers de terre, les fourmis
sont des animaux poïkilothermes. Cela signifie que l'activité des
ouvrières va dépendre de la chaleur ambiante; plus il fait chaud,
plus elles travaillent vite (
Donzé, 2011).
1.4.3. Réaction du sol
(pH) et type de sol
Les vers sont absents dans des sols très acides (pH
< 3.5) et sont peu nombreux dans les sols à pH < 4.5 (
Curry, 2004). Il existe un pH optimal pour chaque
espèce (
Edwards & Bohlen, 1996). Les travaux de
Bachelier (1978) définissent des valeurs
limites de pH.
L'action directe du pH sur les termites et les fourmis est
à ces jours encore mal connue. Cependant certaines études
menées sur les termitières (
Mujinya et al., 2011) et les
fourmilières (
Herzog et al., 1976 ;
Czerwinski et al., 1971) ont
relevé des valeurs de pH plus élevés sur ces structures
par rapport aux sols des environs.
1.3.4. Salinité du
sol
La salinisation, l'accumulation dans les sols de sels solubles
dans l'eau, est une forme de pollution. La faune des sols salins est une faune
spécialisée, présentant souvent un peuplement abondant
mais peu diversifié. Les études menées sur les vers de
terre (
Barley, 1961), ont démontré que
certaines espèces sont euryhalines, mais les vers fouisseurs se
rencontrent rarement où la salinité de la solution du sol
excède 0,4 % (= 0,07 M par litre).
Cependant,
Bernard (1951), en mettant en évidence la
remontée de boulettes de sel dans les fourmilières
d'Acanlholepisfrauenfeldi, a constaté que l'eau retenue par le
sel de ces boulettes contribue à entretenir un degré
hygrométrique optimum à l'intérieur des nids.
1.3.5. Matière
organique
A part quelques bactéries autotrophes et certains
protozoaires à chromatophores chlorophylliens (chloroflagellés du
type euglène), l'ensemble des bactéries et des organismes de la
faune du sol est hétérotrophe et trouve son énergie dans
la dégradation des matières organiques (
Guild, 1955). L'énergie nécessaire
à ces organismes hétérotrophes ne peut donc
dépasser celle apportée par les matières organiques
disponibles.
L'effet négatif d'une diminution de la ressource en
matière organique à la vie de vers de terre est souvent
rapportée dans la bibliographie (
Lee, 1985 ;
Oyedele et al., 2006 ;
Don et al., 2008). Les termites sont aussi
sensibles à la baisse de la matière organique dans le sol, car la
cellulose est leur aliment de base (
Bourguignon et al., 2011
D:\Trésor\Trésor\Termites,
VT, Fourmis le 25.06.2016\THS-6505 (termites).pdf). Les travaux de
Roy-Noël (1974) rapportent que la
végétation (la matière organique) est l'un des facteurs
qui guident la répartition des termites. Quant aux fourmis, la teneur de
la matière organique influence activement la construction de leurs
fourmilières (
De Bruyn & Conacher, 1990).
L'activité ouvrière augmente avec la baisse de la matière
organique dans le sol (
Lenoir et al., 2001).
1.4.6. Métaux lourds
(activités minières)
Les métaux lourds ont des effets variables en fonction
des espèces, du stade de développement, du mode de vie (lieu de
vie et régime alimentaire) et de leur capacité d'adaptation face
à la pollution. Ces effets varient également suivant la nature du
métal, sa forme chimique et les propriétés du sol (
Depta et al., 1999).
Les études montrent que les vers de terre sont plus
sensibles aux teneurs en métaux lourds que les autres
invertébrés dans le sol (
Pizl & Josen, 1995 ;
Spurgeon & Hopkin,1999 ;
Spurgeon et al., 2000) et leur
capacité à accumuler des métaux lourds souvent plus
élevée que pour d'autres espèces animales (
Beyer
et al., 1982). Les vers, placés en sols pollués,
seraient ainsi en mesure de différencier la matière organique
selon son niveau de contamination (
Gasse et al., 2006).
L'impact de différents éléments traces
métalliques (Cuivre, Zinc, Plomb et Cadmium) sur les vers de terre a
été étudié au laboratoire, en conditions
contrôlées (
Nahmani et al., 2007 ;
OCDE, 2004). Cependant, ces derniers sur la macrofaune
du sol in situ, reste encore peu étudié à ces
jours aussi bien en milieu tempéré que tropical. D'où
l'objet de cette étude.
1.5. Relations entre les
indicateurs clés et autres organismes du sol
La plupart des organismes du sol vivent dans une
variété de relations symbiotiques. Les relations symbiotiques
comprennent : mutualisme (les deux organismes bénéficient) ;
commensalisme (un organisme bénéficie, l'autre non, mais pas de
nuisance) ; compétition ; parasitisme (un organisme
bénéficie, l'autre est lésés) ; et la
prédation (un organisme bénéficie de l'autre en le tuant).
Ces relations permettent à de nombreux organismes divers de vivre dans
des conditions qu'ils ne pouvaient pas vivre dans leur propre chef. Ensemble,
ils créent des substances et des matériaux de recyclage qui
créent les conditions nécessaires à la vie dans le sol (
Ruiz et al., 2008).
Ainsi, certains groupes d'indicateurs clés
présentent ces types de relations avec d'autres organismes du sol. Par
exemple, les termites sont associés étroitement avec les
communautés microbiennes spécifiques liées à leur
digestion (
König et al., 2006 ;
Warnecke et al., 2007). Il existe
également une relation symbiotique entre les termites et les
fourmis ; certaines espèces de termites bénéficient
de la présence dans leurs nids de fourmis en se nourrissant sur leurs
résidus individuelles morts (
Jaffe et al., 1995). En plus, les vers de
terre servent de ressource alimentaire à bon nombre d'organismes
carnivores et insectivores, de la taupe à la chouette en passant par les
hérissons, les mouettes, les renards et certains
coléoptères prédateurs (
Sims & Gerard, 1999).
Cependant, il y a d'autres types de relation entre les
organismes du sol qui ne reposent pas sur les interactions trophiques, mais sur
les structures biogéniques produites par les ingénieurs de
l'écosystème. Par leurs activités, les vers de terre, les
termites et les fourmis produisent une grande variété de
macropores (par exemple, des galeries et des chambres) et des structures
organo-minérales (par exemple les turricules des lombrics, les
termitières et les nids de fourmis) qui influencent les
propriétés hydrauliques, la macroagrégation et la
dynamique de la matière organique dans le sol (
Lavelle, 1997) et améliorent les conditions
de vie pour d'autres organismes (
Decaëns et al., 1999).
1.6. Réponses de la
macrofaune du sol face aux facteurs abiotiques du milieu
Face à des agressions extérieures (conditions de
température, d'humidité ou réaction à une substance
ou à une agression), les organismes du sol affichent plusieurs
réponses. L'un des mécanismes potentiels d'adaptation de la
macrofaune à la pollution est l'évitement (
Depta et al., 1999). Les organismes du
sol, face aux conditions défavorables, cessent leurs activités et
entrent en léthargie pendant un certain temps (
Saussey, 1966).
Cette léthargie, chez les vers de terre, peut avoir
deux formes (
Saussey, 1966) : (i) la
diapause, qui est déclenchée par la dessiccation
du milieu ou un agent traumatisant, comme l'ablation d'une partie du
corps ; (ii) la quiescence, qui est une léthargie
temporaire directement provoquée par un facteur du milieu dont la
manifestation cesse dès que ce facteur disparaît.Les termites et
les fourmis font souvent recours à l'hibernation
(profond sommeil)pour échapper aux conditions
défavorables, surtout face à une forte baisse de la
température (
Donzé, 2011).
1.7. Importance de la
macrofaune du sol
1.7.1. Ingénieurs de
l'écosystème
Le terme d' « ingénieur de
l'écosystème » a été utilisé par
Jones et al. (1994) et
Lawton (1994) pour désigner des organismes
qui, directement ou indirectement, modifient les ressources disponibles pour
d'autres organismes en provoquant des changements physiques de l'état
des matériaux biotiques et abiotiques tels que le ver de terre, le
termite ou la fourmi. Ils sont considérés comme les principaux
ingénieurs de l'écosystème en zone tropicale (
Jones et al., 1994 ;
Lavelle, 1996). D'une autre manière, ce sont
des organismes qui peuvent avoir un effet déterminant sur l'abondance et
le diversité d'autres organismes (
Decaëns et al., 1999 ;
Jiménez & Decaëns,
2004).
Ces organismes ont souvent développé des
relations de mutualisme interne avec les microorganismes du sol (
Lavelle et al., 1997). Ils se
caractérisent par leur capacité à fabriquer des grosses
structures organo-minérales appelées domaines fonctionnels (la
drilosphère des vers de terre, le termitosphère
de termites, la myrmécosphère de fourmis auxquelles
s'ajoute la rhizosphère des racines) qui peuvent être
épigés ou endogés. Ces structures peuvent persister durant
des propriétés physiques et de dynamique de la matière
organique particulières (
Lavelle, 2002).
1.7.2. Rôle dans la
fertilité du sol
La fertilité d'un sol dépend à la fois de
ses caractères pédogénétiques
(propriétés morphologiques intrinsèques issues de la
pédogénèse) et de ses caractères fonctionnels
(propriétés physico-chimiques) (
Duchauffour, 1997). En agissant sur les
propriétés physico-chimiques du sol, en particulier sur la
structure du sol (
Lee, 1985 ;
Barois, 1992), les macroinvertébrés du
sol jouent un grand rôle dans la fertilité du sol.
Les galeries (Figure 1-5a), creusées par les vers de
terre, favorisent le transfert de composés dans les différents
horizons du sol, à la fois passivement (percolation, infiltration) mais
également par le rôle fouisseur actif des espèces
anéciques.
Binet et al. (1993) ont montré
que les parois de galeries de L. terrestris sont plus riches en
Carbone organique et en Azote que le sol environnant.
Les termites déploient une activité
particulièrement impressionnante pour construire leurs logis. Ces
invertébrés participent indirectement à l'incorporation de
la matière organique dans le sol et réalisent un travail de
décompactage en remuant, dispersant et mélangeant les
éléments mis en oeuvre. Les structures créées
favorisent, dans le sol, une nette amélioration de la porosité,
de l'aération, du régime hydrique et de la stabilité
structurale (
Lavelle et al., 1991).
Chapitre 2. Milieu,
Matériels et Méthodes
2.1. Milieu d'étude
2.1.1. Localisation
La présente étude a été conduite
dans la province du Haut-Katanga en République Démocratique du
Congo.
Le Haut-Katanga est actuellement une des 26 provinces de la
République démocratique du Congo (RDC). Il faisait, jusque
début mars 2015, partie dequatre districts de la province du Katanga
lorsque la RDC était encore constituée de 11 provinces. Le
Haut-Katanga occupe la partie la plus méridionale du pays,
possède une superficie de 131 443 km² (
Kabulo, 2010) et à Lubumbashi pour chef-lieu.
Cette province est délimité au Nord par la province du Haut
Lomami et celle du Tanganyika ; à l'Ouest par la ville de Likasi et
de Kolwezi ; à l'Est et au Sud par la Zambie. Elle est
géographiquement comprise entre les parallèles 10° à
13°Sud et les méridiens 25° à 28°Est, à une
altitude moyenne de 1200 mètres. Cette province est en partie
située sur l'arc cuprifère (Figure 2-1). L'arc cuprifère
consiste en une large bande de 600 km de long et 50 km de large,
s'étendant entre la RDC et la Zambie (
François, 1974 ;
Kaniki, 2008). Elle est dès lors le centre
d'une activité minière intense.
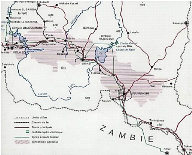
Figure 2-1 :
Arc cuprifère du Katanga (
François, 1974).
2.1.2. Climat
Les travaux de Bultot (cité par
Robert, 1956) sur la classification climatique du
Katanga démembré, ont été fondés sur les
critères de la classification de Köppen. Ainsi, deux zones
climatiques de premier ordre sont distinguées dans le Haut-Katanga: Aw
et Cw. La zone Aw est caractérisée par la température
diurne du mois le plus froid qui est supérieure à
18°C ; la côte pluviométrique du mois le plus sec
descend en dessous de 60 mm. Cependant, la zone Cw est
caractérisée par la température moyenne diurne du mois le
plus froids descendant en dessous de 18°C, mais reste supérieure
à -3°C (
Ruwet et al., 1985;
Malaisse, 1997).
Le climat du Haut-Katanga est donc tropical humide,
caractérisé par une alternation des deux saisons : (i) la
saison sèche dure 6 mois et 7 mois ; elle débute, en
moyenne, le 20 avril et prend fin vers le 20 octobre. (ii) la saison des pluies
dure 6 mois soit 230 à 240 jours de pluie du mois d'Octobre à
Avril (
Kasongo, 2009). Durant la saison des pluies, il
tombe une moyenne de 1200 mm, ce qui signifie qu'il ne pleut presque pas durant
la saison sèche.
Le maximum moyen de température mensuelle se produit au
début de la saison des pluies, soit en septembre et octobre, au moment
où le soleil s'élève au zénith. Les
températures maxima moyennes diurnes se dessinent en septembre et
octobre et avoisinent 33°C alors que les températures minima
diurnes sont généralement observées en juillet, soit
5.9°C à Lubumbashi (
Kasongo, 2009).
2.1.3. Sol
Les sols du Haut-Katanga sont très diversifiés
par leur nature. La carte des sols élaborée par l'ISRIC (Van
Engelen et al., 2006 in
Kasongo 2009) dans le cadre de la base des
données SOTER montre, la dominance de groupes des sols de
référence suivants : Ferralsols, Vertisols, Cambisol et
Fluvisols.
Les ferralsols, couvrant la grande partie du Haut-Katanga,
sont des sols minéraux, avec plus de 20 % d'argile, à profil A-C,
A-B-C, à A1 faible, sans B textural. Ces sont
caractérisés par : une réserve en minéraux
altérable nulle ou faible, un rapport limon/argile inférieur
à 0,2 sur roches sédimentaires et alluvions, à 0,15 sur
roches éruptives et cristallophylliennes, la présence d'oxydes
libres dans la fraction argileuse, une faible capacité d'échange
cationique (
Sys, 1960).Les groupes de référence des
Vertisols, Cambisol et Fluvisols, s'intègrent, à quelques
difficultés près, dans les différentes classes des Sols
Minéraux Bruts, Sols Tropicaux Récents, et Terres Noires
Tropicales de la classification de l'INEAC (
Kasongo, 2009).
Le relief est caractérisé par les chaînes
des montagnes de Mitwaba et de Kundelungu et le plateau d'Upemba.
2.1.4.
Végétation
Les principales unités de végétation dans
le Haut-Katanga sont : les forêts denses sèches, les forêts
denses édaphiques, les forêts claires, les savanes et les milieux
aquatiques (
Duvignaud, 1958). En effet, Lubumbashi et ses
environs (Kipushi et Musoshi), sont entourés par les forêts
claires de trois types : (i) la forêt claire du type «Miombo»,
(ii) la forêt claire à dominance de Marquesia macroura et
(iii) les hautes termitières de forêt claire érigées
par Macrotermes falciger (
Schmitz, 1952 ;
Malaisse, 1997).
2.1.5. Sites
étudiés
Deux sites ont été sélectionnés
dans le cadre de cette étude. Il s'agit du bassin de
sédimentation de l'entreprise minière SODIMICO situé
à MUSOSHI-GARE et celui de l'ACK qui appartient à l'entreprise
GCM, situé à KIPUSHI.
Le choix des sites d'étude a été
motivé par les critères suivants : (i) le site doit
être localisé dans la province du Haut-Katanga, (ii) le site doit
être un bassin de décantation (sédimentation) d'une
entreprise minière de longue date. D'autres contraintes ont
également limité les choix : manque d'autorisation,
accessibilité des sites, végétation...
2.1.5.1. Kipushi
Située à 30 Km à l'Ouest de la ville de
Lubumbashi, la ville de KIPUSHI (11°45'40''S, 27°14'50''E et 1351 m
d'altitude) abrite deux concentrateurs : l'Ancien Concentrateur de Kipushi
(ACK) se trouvant dans l'enceinte des installations de la Gécamines et
celui de la Compagnie Minière de Sud-Katanga (CMSK), anciennement
appelé NCK (Nouveau concentrateur de Kipushi), né du partenariat
entre la Gécamines et le groupe Malta Forrest (
Kaniki, 2008).
L'ACK a été mis en opération en 1935 pour
traiter les minerais sulfurés cupro-zincifères de la mine de
Kipushi. Il a atteint la production des 120 000 tonnes de minerais par an en
1980.
Le traitement par flottation, procédé par l'ACK,
a donné d'énormes quantités de rejets qui ont atteint
à partir des années 1980, 3 000 à 3 400 t/j pour 4 000 t/j
de minerais alimentés. L'entreposage en surface de ces rejets de
flottation remonte aux années 1960, longtemps après la mise en
service du concentrateur (
Kaniki, 2008 ;
Kitobo, 2009).
Ces rejets ont donc conduit à la création des
bassins artificiels par la construction des digues en terre dans la
vallée de la rivière Kipushi pour la rétention des
particules solides après décantation (Figure 2-2). Ainsi, deux
bassins ont été totalement remplis de rejets (tailings). Le
troisième est actuellement utilisé par les nouvelles
sociétés en place. Les études (
Kitobo et al., 2007 ;
Kaniki, 2008 ;
Kitobo, 2009 ;
Mees et al., 2013) ont relevé les
fortes concentration en métaux lourds dans les trois tailings.
2.1.5.2. Musoshi-Gare
Musoshi-Gare (12°15'10''S, 27°38'46.4''E et 1311m
d'altitude) se situe à 25 Km de la cité de Kasumbalesa qui est,
à son tour, située à 60 km à vol d'oiseau au Sud de
Lubumbashi (Figure 2-2). Cette cité minière compte un
concentrateur (SODIMICO créé en 1972) qui était
alimenté par les mines souterraines de Musoshi, de Kinsenda, de Kimpe et
Lubembe, faisant toutes parties de la copperbelt congolais. Les minerais
alimentant le concentrateur provenaient principalement de Musoshi (minerai
monométallique de cuivre 2-2.4%) et de Kinsenda (minerai
monométallique de cuivre 5%) (
Kaniki, 2008).
Avec une capacité installée de 5.000 tonnes de
minerais par jour, la SODIMICO effectuait une concentration par flottation au
xanthate et à l'hydrosulfure de sodium (NaSH). Les minerais
cuprifères sulfurés et oxydés étaient
essentiellement constitués de la chalcopyrite, bromite, cuprite,
malachite, chalcosine et azurite (
Kaniki, 2008). Les rejets en pulpe étaient
pompés sur une colline voisine de la mine de Musoshi et de là,
par gravité, ils coulaient vers le bassin de stockage (site
à rejets de Shimambo). Dans le bassin, les eaux plus ou moins
clarifiées par décantation, débordaient et coulaient vers
la rivière Kanuampungu qui se jette dans la rivière Musoshi. La
rivière Musoshi se jette dans la rivière Kafubu, qui à son
tour se jette dans la Luapula. Il faut aussi noter qu'un système dit de
sauvegarde avait été mis en place. En cas de panne de la pompe,
au lieu que la pulpe s'entasse à l'intérieur de la concession de
l'usine, elle était dirigée vers les drains des eaux d'exhaure
passant par le camp des travailleurs pour se déverser dans la
rivière Kanuampungu. Les stocks de rejets accumulés (tailings)
sont entreposés en surface dans une optique de valorisation future (
Kaniki, 2008 ;
Kitobo, 2009).
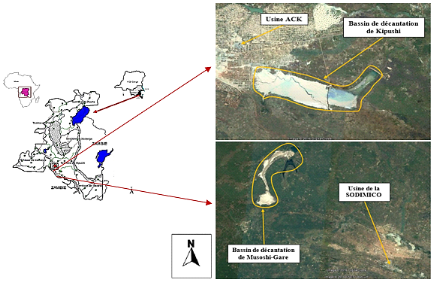
Figure 2-2:
Localisation des sites étudiés dans la province du Haut-Katanga,
RD. Congo (Source :
Munyemba 2010, adapté par
l'auteur).
2.2. Matériels
2.2.1. Matériel
biologique
L'ensemble de la macrofaune du sol a constitué le
matériel biologique dans la cadre de cette étude. Celle-ci est
constituée essentiellement des vers de terre (lombrics), des termites,
des fourmis et d'autres macroorganismes du sol.
2.2.2. Outils, appareils et
réactifs
Pour une bonne conduite de cette étude, les outils,
appareils et réactifs suivants ont été
nécessaires : des bocaux de 500 ml (en verre) ; le formol à
4% ; une bèche ; une houe ; des sachets de conditionnement des
échantillons des sols ; des sacs en plastique ; des gants en
plastique ; des bottes en caoutchouc ; un mètre ruban de 50 m ; une
latte de 30 cm ; un GPS (Garmin GPSMAP 64st) ; un Quadra en métal (de 50
x 50 cm) ; un tamis de 5 mm de maille à; un couteau de camping.
2.3. Méthodologie
2.3.1. Stratégie
d'échantillonnage et prélèvement de la macrofaune du
sol
L'échantillonnage et le prélèvement ont
été réalisés en deux temps : (i) une campagne
de prospection en février 2016, (ii) puis un échantillonnage
complet au cours des mois de mars et avril 2016, à la fin de la saison
des pluies. Cette période est la plus favorable pour
l'échantillonnage de la macrofaune des sols dans les pays tropicaux (
Tondho & Lavelle, 2005 ;
Lavelle & Fragoso, 2000).
Les échantillons des sols et de la macrofaune du sol
ont été prélevés par la méthode standard
Tropical Soil Biology and Fertility (TSBF) proposée par
Anderson et Ingram (1993) consolidé et
amélioré par
Swift et Bignell (2001), étant
donné que cette étude a été effectuée dans
la région tropicale.
Cette méthode est basée sur la technique
standard de référence, «bêchage-triage», mais les
échantillons (monolithes) sur les parcelles sont d'abord
délimités par un quadra en métal ou en bois, dont les
dimensions dans le cas de cette étude ont été 50 x 50 cm
et 30 cm de profondeur, avant d'être bêchés (figure 2.3).
Cette profondeur est justifiée par le fait qu'en forêt tropicale,
les vers de terre et beaucoup d'autres macroorganismes du sol se
répartissent verticalement dans les premiers 40 cm du sol, mais sont
concentrés dans les 10-30 premiers centimètres (
Fragoso & Lavelle, 1992 ;
Da Silva, 2013).
Sur chaque site étudié, 5 échantillons
ont été récoltés aux intervalles réguliers
de 50 m, suivant un transect tracé à partir des bords du bassin
de décantation jusqu'à 200 m dans la forêt. Donc, un total
de 10 échantillons a été réalisé dans tous
les deux sites étudié (tableau 2-1). Après son
prélèvement, le monolithe de sol a été
tamisé à l'aide d'un tamis de 5 mm de maille et trié
à la main.
Les macroorganismes (vers de terre, termites, fourmis, etc.)
extraits ont été ensuite conservés dans des bocaux
hermétiques (récipients) de 500 ml (en verre), contenant une
solution de formol à 4 %.
Chaque bocal été étiqueté, les
informations suivantes étaient mentionnée sur chacune d'elles :
la date et nombre d'identification du site ; le numéro du point sur le
transect où les échantillonnages ont été
effectués (1, 2, 3, 4 ou 5) ; le Microhabitat concerné (nouveau
bois mort, bois pourri, butte, le sol, la litière, le sol contenant des
racines, sol pollué, etc.).
50 cm
50 cm
30 cm
Figure 2-2.
Schéma descriptif d'un monolithe de sol (adapté du model
d'
Anderson et Ingram, 1993).
Après le triage et la conservation des macroorganismes
dans les bocaux, un échantillon de sol a été
prélevé entre 20 et 30 cm de profondeur par rapport à la
surface, à l'aide d'une houe.
Tableau 2-1 :
Représentation des points de prélèvement
|
Point
|
Distance au bassin (m)
|
Coordonné GPS
|
|
KPS 1
|
Kipushi 1
|
0
|
11°46'42.4''S ; 027°16'58.9''E ; 1279 m
|
|
KPS 2
|
Kipushi 2
|
50
|
11°46'42.9''S ; 027°17'00.6''E ; 1290 m
|
|
KPS 3
|
Kipushi 3
|
100
|
11°46'43.4''S ; 027°17'02.4''E ; 1304 m
|
|
KPS 4
|
Kipushi 4
|
150
|
11°46'42.5''S ; 027°17'09.2''E ; 1303 m
|
|
KPS 5
|
Kipushi 5
|
200
|
11°46'42.7''S ; 027°17'05.8''E ; 1306 m
|
|
MUS 1
|
Musoshi 1
|
0
|
12°12'21.9''S ; 027°39'07.2''E ; 1284 m
|
|
MUS 2
|
Musoshi 2
|
50
|
12°12'21.1''S ; 027°39'05.8''E ; 1286 m
|
|
MUS 3
|
Musoshi 3
|
100
|
12°12'21.0''S ; 027°39'04.1''E ; 1292 m
|
|
MUS 4
|
Musoshi 4
|
150
|
12°12'19.1''S ; 027°39'02.9''E ; 1292 m
|
|
MUS 5
|
Musoshi 5
|
200
|
12°12'18.5''S ; 027°39'01.3''E ; 1300 m
|

Figure 2-3
:Opérations réalisées au cours des travaux de
terrain : (a), (b) et (c) prélèvement de monolithe de sol ; (d)
tamisage du sol et triage des macroorganismes (photo Muganguzi, 2016)
2.3.2. Travail du laboratoire
et caractérisation des sols
Les travaux au laboratoire ont consisté à
l'analyse physico-chimique des échantillons des sols
prélevés.
La préparation des échantillons consistait au
séchage à l'étuve (à 36° C), au broyage au
mortier, puis au tamisage à l'aide d'un tamis de 2 mm de maille. Cette
préparation a pour but de séparer la fraction sol du non-sol.
Après préparation (séchage +
émottage à 2 mm), les échantillons des sols ont
été analysés au Laboratoire Agro-Pédologique de la
Faculté de Sciences Agronomiques de l'Université de Lubumbashi
(LAP-FSA-UNILU).
Les variables pédologiques mesurés et les
méthodes utilisées pour caractériser les différents
sols sont regroupés dans le Tableau 2-1 ci-dessous :
Tableau 2-2. Les
variables pédologiques (physiques et chimiques)
déterminés
|
Variable pédologique
|
Méthode
|
Référence
|
|
pHeau
|
Potentiométrie
|
A
|
|
pHKCl
|
Potentiométrie
|
A
|
|
Conductivité électrique (CE)
|
Potentiométrie
|
A
|
|
Carbone organique (OC)
|
Walkley &Black
|
A
|
|
Azote total (N)
|
Kjeldahl
|
A
|
|
Phosphore total (Ptot) et disponible
(Pdisp)
|
Bray-2
|
A
|
|
Hydrogène et Aluminium extractibles (H + Al)
|
-
|
A
|
|
Teneurs en métaux lourds (Cu, Co, Fe, Zn, Mn, Ba...) et
autres éléments majeurs (Ca, K...)
|
XRF
|
B
|
A :
Ranst et al., 1999 ;
B :
Siamia et al., 2013
Ces mesures ont par ailleurs donné lieu aux variables
calculées suivantes : la différence entre pHeau et
pHKCl, la teneur en matière organique (MO), le rapport C/N,
la Disponibilité du Phosphore.
L'identification des macroorganismes a été
réalisée au moyen d'une loupe binoculaire avec caméra
(marque LAS EZ). Les macroorganismes ont été identifiés au
niveau des groupes clés, à la Faculté des Sciences
Agronomiques de l'UNILU. Pour chaque échantillon, le nombre d'individus
de chaque groupe a été déterminé.

Figure 2-4 :
Opération réalisées au laboratoire : (a)
préparation des échantillons ; (b) analyse du pH et de la
conductivité ; (c) analyse de l'azote et du carbone organique ; (d) et
(e) analyse des Métaux lourds par XRF ; (f) analyse du Phosphore (photos
Muganguzi & Ngoy B., 2016)
2.3.3. Analyses
statistiques
L'abondance de la macrofaune a été
estimée par le nombre d'individus par m². La diversité des
espèces a été déterminée, pour chaque point
d'échantillonnage, par les indices de diversité (
Harper, 1999) :
ü La richesse spécifique (S) qui correspond au
nombre total d'espèces, échantillonnées par site. Elle
permet de voir le nombre d'espèces que chaque site étudié
regorge.
ü L'indice de Shannon-Wiener, qui prend en compte le
nombre de taxons rencontrés sur le milieu. Il est calculé par la
formule suivante :
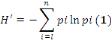
Où pi est la proportion d'une espèce
i par rapport au nombre total d'espèces dans le milieu
d'étude (Pi = ni/N ; avec
ni est le nombre d'individu pour l'espèce i et N
est l'effectif total). Cet indice est nul quand il n'y a qu'un taxon et sa
valeur est maximale quand tous les taxons ont la même abondance.
ü L'équitabilité (J), encore appelée
régularité, mesure la répartition équitable des
taxons. Elle permet de comparer des peuplements comportant des nombres de
taxons différents. Elle a pour objectif d'observer l'équilibre
des populations présentes. Elle est égale au rapport entre la
diversité réelle calculée et la diversité
théorique maximum :
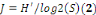
J tend vers 0 lorsqu'un taxon domine largement un peuplement
et est égale à 1 lorsque tous les taxons ont la même
abondance.
ü La dominance (D) prend en compte la fréquence
mesurée des espèces. Elle accorde plus d'importance aux
espèces les plus fréquentes qu'à la richesse
spécifique totale. Est donc plus sensible aux espèces les plus
fréquentes qu'à la richesse spécifique totale. Elle est
donnée par la formule suivante :
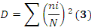
D est égal à 0 lorsque tous les taxons ont la
même abondance et tend vers 1 lorsqu'un taxon domine largement un
peuplement.
ü L'indice de Simpson (1-D) évalue la
probabilité que 2 individus, tirés aléatoirement d'une
population infinie de N individus appartiennent à la même
espèce. Elle est donné par : 1-D. L'indice de Simpson varie entre
0 et 1. La diversité est minimale pour 1-D = 0 et la diversité
est maximale pour D = 1.
Ces indices ont été calculés avec le
logiciel PAST (PAleontological STatistics, version 3.12).
L'étude des relations et influence existant entres les
paramètres édaphiques et les macroinvertébrés de
sols de sites étudiés a passé par le test de
corrélations de Pearson. La matrice des corrélations a
été déterminée à l'aide du logiciel Minitab
16.2.0.
Chapitre 3.
Résultats
3.1. Caractéristiques
physico-chimiques des sols des sites étudiés
Cette partie du chapitre présente les sites
séparément en résumant, les caractéristiques
phyco-chimiques globales des sols échantillonnés dans chaque site
: pHeau, pHKCl, conductivité électrique
(CE), carbone organique (CO) et matière organique (MO), azote total (N
total), rapport carbone/azote (C/N), acidité échangeable (H+Al),
phosphore total (Ptotal) et disponible (Pdisp),
disponibilité en phosphore (Dispon P), potassium total
(Ktotal), Calcium (Ca), teneurs en métaux lourds (Fer,
Manganèse, Zinc, Cuivre, Baryum).
L'observation du tableau, montre qu'à Kipushi, tous les
échantillons prélevés ont montré des pH très
acides (< 5.5) à l'exception de l'échantillon
prélevé près du bassin de décantation (KPS 1) qui
présentait un pH alcalin (> 7.5), avec un pHKCl
légèrement supérieur au pHeau. Quant au site de
Musoshi, les 3 premiers échantillons (MUS 1, MUS 2, MUS 3) ont
présenté des pH très acides (< 5.5) pendant que les
échantillons (MUS 4 et MUS 5) restant présentent tous des pH
acides (5.5 < pH = 6.0). En observant les valeurs, on remarque qu'à
Kipushi, le pH devient de plus en plus acide au fur et à mesure que l'on
s'éloigne du bassin de décantation pendant qu'à Musoshi,
le pH devient de plus en plus alcalin (élevé) en
s'éloignant du bassin de décantation.
L'analyse de la conductivité a
démontréqu'à Kipushi, une forte conductivité
(215.43 us/cm), étais observable près du bassin de
décantation (KPS 1),alors qu'une faible conductivité (12.42
us/cm) a été observée à KPS 2. A Musoshi, l'analyse
a montré une forte conductivité (26.20 us/cm) à MUS 4
tandis qu'une faible conductivité (6.19 us/cm) a été
observée à MUS 1. A Kipushi, cette conductivité
électrique diminue sensiblement en quittant KPS 1 à KPS 2 et de
là, elle augmente peu à peu quand on s'éloigne d'avantage
du bassin. Cependant, à Musoshi, elle augmente au fur et à mesure
que l'on s'éloigne du bassin.
L'étude du tableau 3-1 révèle que le site
de Kipushi présente des fortes teneurs en CO (1.9 %) et enMO (3.2 %) au
niveau de KPS 1 alors qu'elle présente des faibles teneurs au niveau de
KPS 3 (CO = 1.1 %, MO = 1.8 %). Quant au site de Musoshi, les fortes teneurs
sont observées à MUS 4 (CO = 3.3 %, MO = 5.6 %), alors que des
faibles teneurs sont enregistrées à MUS 2 (CO = 0.8 %, MO = 1.4
%). Les teneurs en ces paramètres décroissent de KPS 1 à
KPS 3, mais croissent de KPS 3 à KPS 5, alors qu'à Musoshi, elles
ont tendance à croitre le long du transect en s'éloignant du
bassin.
En ce qui concerne l'analyse deN total, les résultats
ont montré qu'à Kipushi, la plus grande teneur (0.12 %)a
été observée à KPS 4 tandis qu'une faible teneur
(0.10 %) a été observée à PKS 1 et à PKS 3.
Par ailleurs, à Musoshi, la plus grande teneur (0.23 %) a
étéobservée à MUS 4 alors que la plus faible valeur
(0.09 %) a étéobservée à MUS 1. Pour tous les deux
sites, l'on enregistre une augmentation de la teneur en azote suivant le
transect en s'éloignant du bassin de décantation.
L'analyse du Ptotal a relevé, qu'à
Kipushi, des fortes teneurs ont été observée à KPS
1 (638.75 ug/g sol) et à KPS 2 (633.75 ug/g sol),tandis que la plus
faible teneur (488.75 ug/g sol) a été observée à
KPS 4. En ce qui concerne le Pdisp, la forte teneur (7.00 ug/g sol)
a été observée à KPS 5 alors que la faible teneur
est repérée à KPS 1. La disponibilité en P (Dispon
P) a été élevée à KPS 5 (1.39 %) alors
qu'elle a été faible à KPS 4 (1.31 %) et à KPS 1.
Par contre, à Musoshi, la forte teneur en Ptotal (421.25 ug/g
sol) a été observée à MUS 5 alors que la faible
teneur (258.75 ug/g sol) aétéobservée à MUS 2.
Concernant le Pdisp, la forte teneur était
repérée à MUS 3 (15.53 ug/g sol) pendant que la faible
teneur était repérée à MUS 4. La
disponibilité en P a été plus élevée
à MUS 2 (4.70 %), alors qu'elle demeure faible à MUS 4 (1.42
%).
En étudiant l'acidité échangeable, on
remarque que sur l'ensemble des échantillons prélevés
à Kipushi et à Musoshi, trois (KPS 1, MUS 4 et MUS 5) n'ont pas
été analysés compte tenu de leurs valeurs pH. La plus
grande valeur (3.32 méq/100g) a été observée
à KPS 3 et à MUS 1 (2.6 méq/100g). Elle décroit en
s'éloignant du bassin à Musoshi.
La teneur en K total a été fortement
élevée (15600 ppm) à KPS 1 et à MUS 3 (16600 ppm),
alors que la plus faible teneur (6600 ppm) a été
enregistrée à KPS 2 tandis qu'à MUS 5, une teneur plus
élevée a été observée (14500 ppm).
La teneur en Ca, fortement élevée (27600ppm), a
été observée à KPS 1, mais pour le reste des
échantillons, (y compris l'ensemble des échantillons de Musoshi),
elle reste particulièrement très faible et non détectables
par l'XRF.
Concernant les métaux lourds (Fe, Mn, Cu, Ba), les
analyses réalisées sur l'ensemble des échantillons des
sols ont révélé que les sols environnant les deux bassins
de décantation affichent des teneurs excessivement élevées
par comparaison avec les teneurs moyennes normales dans la croûte
terrestre, à l'exception du Zn total dont en grande partie les teneurs
ont été inférieurs aux moyennes normales dans la croute
terrestre. Le Cu total, présente une teneur de 53 ppm à KPS 5 et
des très faibles teneurs à Musoshi, de manière
spécifique à MUS 1 et à MUS 3. En général,
les teneurs ont été particulièrement élevées
dans les sols localisés près du bassin de décantation.
Tableau 3-1
:Résumé des caractéristiques physico-chimiques
des sols des sites étudiés.
|
|
Kipushi
|
Musoshi
|
Norme
MATF
|
|
Unité
|
KPS 1
|
KPS 2
|
KPS 3
|
KPS 4
|
KPS 5
|
MUS 1
|
MUS 2
|
MUS 3
|
MUS 4
|
MUS 5
|
|
pHeau
|
-
|
7.69
|
4.85
|
4.65
|
5.2
|
4.58
|
5.14
|
4.8
|
5.33
|
5.85
|
5.92
|
-
|
|
pH KCl
|
-
|
8.29
|
4.75
|
4.55
|
4.8
|
3.95
|
4.73
|
4.65
|
4.86
|
5.62
|
5.46
|
-
|
|
ÄpH
|
-
|
-0.6
|
0.1
|
0.1
|
0.4
|
0.6
|
0.4
|
0.1
|
0.5
|
0.2
|
0.5
|
-
|
|
CE
|
us/cm
|
215.43
|
12.42
|
39.76
|
14.56
|
16.32
|
6.19
|
8.97
|
11.43
|
26.2
|
14.21
|
-
|
|
OC
|
%
|
1.9
|
1.3
|
1.1
|
1.5
|
1.6
|
1.3
|
0.8
|
1.9
|
3.3
|
2.2
|
-
|
|
OM
|
%
|
3.2
|
2.2
|
1.8
|
2.6
|
2.8
|
2.2
|
1.4
|
3.2
|
5.6
|
3.8
|
-
|
|
N total
|
%
|
0.1
|
0.11
|
0.1
|
0.12
|
0.11
|
0.09
|
0.07
|
0.13
|
0.23
|
0.14
|
-
|
|
C/N
|
-
|
19.0
|
11.8
|
11.0
|
13.6
|
14.5
|
18.6
|
11.4
|
14.6
|
14.3
|
15.7
|
-
|
|
H+Al
|
méq/100g
|
NA
|
2.44
|
3.32
|
0.92
|
2.04
|
2.6
|
1.8
|
0.76
|
NA
|
NA
|
-
|
|
Ptotal
|
ug/g sol
|
638.75
|
633.75
|
488.75
|
366.25
|
502.7
|
339.67
|
258.75
|
339.67
|
326.08
|
421.25
|
-
|
|
PDisp
|
ug/g sol
|
2.23
|
5.73
|
6.04
|
4.83
|
7.00
|
13.63
|
12.17
|
15.53
|
4.64
|
6.51
|
-
|
|
Dispon P
|
%
|
0.34
|
0.90
|
1.23
|
1.31
|
1.39
|
4.01
|
4.70
|
4.57
|
1.42
|
1.55
|
-
|
|
K total
|
Ppm
|
15600
|
6600
|
8900
|
12400
|
12500
|
14800
|
14800
|
16600
|
16100
|
14500
|
-
|
|
Ca total
|
Ppm
|
27600
|
ND
|
ND
|
ND
|
ND
|
ND
|
ND
|
ND
|
ND
|
ND
|
-
|
|
Fe total
|
Ppm
|
33400
|
45100
|
44500
|
38500
|
28900
|
30500
|
35900
|
28600
|
21100
|
20600
|
-
|
|
Mn total
|
Ppm
|
635
|
131
|
69
|
156
|
56
|
76
|
254
|
358
|
287
|
292
|
-
|
|
Zn total
|
Ppm
|
5396
|
29
|
30
|
55
|
31
|
ND
|
ND
|
27
|
30
|
24
|
101
|
|
Cu total
|
Ppm
|
5728
|
83
|
67
|
64
|
53
|
38
|
ND
|
85
|
129
|
101
|
62.5
|
|
Ba total
|
Ppm
|
547
|
489
|
589
|
663
|
425
|
450
|
486
|
583
|
403
|
329
|
250
|
NA : Non analysé ; ND : Non
déterminé par XRF
3.2. Abondance et
diversité des macroinvertébrés des sols des sites
étudiés
3.2.1. Abondance des
macroinvertébrés du sol
Cette partie du chapitre va présenter,
séparément, chaque site en mettant en évidence l'abondance
de chaque groupe clé de la macrofaune prélevée pendant la
période de l'étude.
Les abondances (densités) des
macroinvertébrés des sites étudiés, en fonction de
l'éloignement au bassin de décantation, sont
présentées respectivement dans les tableaux 3-4 (pour Kipushi) et
3-5 (pour Musoshi).
Pour les deux sites étudiés, l'abondance absolue
(densité globale) des macroinvertébrés du sol varie selon
les points de prélèvement. A Kipushi, l'emplacement KPS 5
héberge la plus forte abondance (1020 ind.m-2), alors
qu'à KPS 3, il a été observé une diminution
sensible de l'abondance d'ordre de 440 ind.m-2, situation similaire
au KPS 2 (420 ind.m-2). La plus faible abondance (4
ind.m-2) a été observée au niveau de KPS 1.
Le groupe clés le plus abondant est celui des fourmis avec une abondance
variant entre 0 - 960 ind.m-2, alors que les termites ont
présente une abondance variant entre 0 - 324 ind.m-2 sur
l'ensemble des points échantillonnés. Ces groupes
représentent l'essentiel du peuplement. L'abondance des fourmis a
été plus importante à KPS 5 tandis que celle des termites
a présenté la plus forte valeur dans deux emplacements, de
façon particulière à KPS 2 et à KPS 3.
Tableau
3-2 : Abondance des macroinvertébrés à
Kipushi.
|
Macroorganisme
|
KPS 1
|
KPS 2
|
KPS 3
|
KPS 4
|
KPS 5
|
|
Vers de terre
|
0
|
36
|
40
|
48
|
0
|
|
Termites
|
0
|
324
|
220
|
120
|
40
|
|
Fourmis
|
0
|
4
|
48
|
0
|
960
|
|
Autres
|
4
|
56
|
132
|
68
|
20
|
|
TOTAL
|
4
|
420
|
440
|
236
|
1020
|
Abondance = Individus.m-2
Quant à Musoshi, la plus forte abondance des
macroinvertébrés (1788 ind.m-2) a été
observéeà l'emplacement MUS 2, alors qu'à MUS 5, une
abondance faible a été observée, (464 ind.m-2),
situation similaire en ce qui concerne MUS 4 avec 420 ind.m-2.Il a
été observé de manière exceptionnelle une faible
abondance (4 ind.m-2) au niveau de MUS 1. Le plus abondant parmi
tous les groupes clés était celui des fourmis (4 - 1548
ind.m-2) avec une valeur plus importante à MUS 2, suivi de
celui des vers de terre (0 - 244 ind.m-2) avec une valeur maximale
à MUS 5.
Tableau
3-3 : Abondance des macroinvertébrés à
Musoshi.
|
Macroorganisme
|
MUS 1
|
MUS 2
|
MUS 3
|
MUS 4
|
MUS 5
|
|
Vers de terre
|
0
|
112
|
160
|
184
|
244
|
|
Termites
|
0
|
120
|
140
|
200
|
184
|
|
Fourmis
|
4
|
1548
|
20
|
8
|
8
|
|
Autres
|
0
|
8
|
28
|
28
|
28
|
|
TOTAL
|
4
|
1788
|
348
|
420
|
464
|
Abondance =Individus.m-2
3.2.2. Diversité des
macroinvertébrésdu sol
Lors des prélèvements dans les deux sites
étudiés, 3 groupes clés (vers de terre, termites et
fourmis) ont été mis en évidence. Les autres
espèces non identifiées (catégorisées) ont
été représentées sous l'indice
« Autres » qui veut dire, autres groupes de la macrofaune.
La catégorisation de ces espèces est reprise dans le tableau 3-4
ainsi que leur abondance absolue et leur richesse spécifique.
L'observation de ce tableau montre que dans tous les deux
sites les fourmis ont une grande proportion (48 % à Kipushi et 53 %
à Musoshi). Elles sont suivies par les termites (33 %), les autres
espèces de la macrofaune (13 %) et les vers de terre, qui ont une faible
richesse spécifique (0.6 %). A Musoshi, les vers de terre viennent en
deuxième position (23 %), suivis de de termites (21 %) et des autres
(0.03 %).
Tableau
3-4 : Catégories des espèces de la macrofaune
recensé dans les sites étudiés
|
Kipushi
|
Musoshi
|
|
Macroorganisme
|
Abondance absolue
|
Proportion
|
Abondance absolue
|
Proportion
|
|
Vers de terre
|
124
|
0.06
|
700
|
0.23
|
|
Termites
|
704
|
0.33
|
644
|
0.21
|
|
Fourmis
|
1012
|
0.48
|
1588
|
0.53
|
|
Autres
|
280
|
0.13
|
92
|
0.03
|
Les indices de diversité de dominance (D), de
Shannon-Wiener (H'), de Simpson (1-D) et d'équitabilité (J) ont
été calculés pour chaque groupe clé, dans chaque
site étudié. Le milieu est défini en fonction du point de
prélèvement. Les tableaux 3-7 et 3-8 présentent la
richesse spécifique de chaque groupe clé pour chaque milieu
(point de prélèvement) et les indices de diversité.
La richesse spécifique (pour les deux sites) varie en
fonction du point d'échantillonnage (Tableaux 3-7 et 3-8). La plus
faible richesse spécifique est a été observée
à 0 m du bassin de décantation. Les indices de diversité
de Shannon (H') et de Simpson (1-D) suivent presque les mêmes
évolutions que la richesse spécifique. Les valeurs les plus
élevées étaient observées dans les deux sites
à 100 m du bassin de décantation, avec respectivement H' = 1.17,
1-D = 0.64 (à Kipushi) et H' = 1.09, 1-D = 0.79 (à Musoshi). Par
contre les valeurs nulles ont étaient observées à KPS 1 et
MUS 1. L'équitabilité se comporte différemment des autres
indices de diversité pour les deux sites ;à Kipushi, la plus
grande valeur (J = 0.93) était observée à l'emplacement
KPS 4 suivi de KPS 3 (J = 0.84), alors qu'à Musoshi, la plus grande
valeur (J = 0.79) était observéeà MUS 3 suivi par MUS 4 (J
= 0.70). Cependant, il sied de noter que ces variations n'étaient
importantes.
La plus faible dominance a été observée
à 100 m depuis le bassin, avec D = 0.36 pour (KPS 3) et D = 38 pour
(MUS 3), alors qu'une dominance maximale (D = 1.0) a été
observée à KPS 1 et MUS 1, car un seul groupe clé a
été collecté sur ces points (fourmis à KPS 1 et
Autres à MUS 1).
Tableau
3-5 :Indices de diversité de la macrofaune à
Kipushi
|
KPS 1
|
KPS 2
|
KPS 3
|
KPS 4
|
KPS 5
|
|
Richesse spécifique (S)
|
1
|
4
|
4
|
3
|
3
|
|
Dominance (D)
|
1.0
|
0.62
|
0.36
|
0.38
|
0.89
|
|
Shannon-Wiener (H')
|
0.0
|
0.72
|
1.17
|
1.03
|
0.26
|
|
Simpson (1-D)
|
0.0
|
0.38
|
0.64
|
0.62
|
0.11
|
|
Equitabilité (J)
|
0.0
|
0.52
|
0.84
|
0.93
|
0.24
|
Tableau
3-6 :Indices de diversité de la macrofaune à
Musoshi
|
MUS 1
|
MUS 2
|
MUS 3
|
MUS 4
|
MUS 5
|
|
Richesse spécifique (S)
|
1
|
4
|
4
|
4
|
4
|
|
Dominance (D)
|
1.0
|
0.76
|
0.38
|
0.42
|
0.44
|
|
Shannon-Wiener (H')
|
0.0
|
0.50
|
1.09
|
0.97
|
0.94
|
|
Simpson (1-D)
|
0.0
|
0.24
|
0.62
|
0.58
|
0.56
|
|
Equitabilité (J)
|
0.0
|
0.36
|
0.79
|
0.70
|
0.68
|
3.3. Corrélations et
influence entres les paramètres physico-chimiques des sols et la
macrofaune du sol.
Les matrices des corrélations entre les
paramètres mesurés pour les échantillons et les
macroinvertébrés des sols de sites étudiés sont
présentées dans les tableaux 3-7 et 3-8 (pages 35-36). L'analyse
de ces matrices permet de mettre en évidence l'influence mutuelle de ces
différents paramètres et leur influence sur la macrofaune de sols
étudiés.
En examinant le tableau 3-7, relatif au site de Kipushi, on
découvre que plusieurs paramètres physico-chimiques
corrèlent entre eux et quelques un corrèlent significativement
aux différents groupes des macroinvertébrés. En
s'intéressant plus particulièrement à la macrofaune du
sol, on remarque que les termites sont significativement corrélé
au K totalet au Fe total. Cependant, les fourmis sont en corrélation
significative au CO (p < 0.05).
En faisant une analyse sur les données de Musoshi
(Tableau3-8), il se dégage une corrélation significative en ce
qui concerne, la macrofaune du sol et certains paramètres
édaphiques. Ainsi,on remarque que les vers de terreet les termites sont
significativement corrélésaux fourmis et ensemble sont
corrélés significativement et négativement à
l'acidité échangeable, l'exception faite en ce qui concerne les
fourmis qui sont en plus corrélées significativement au Cu (p
< 0.05).
Tableau 3-7 :
Matrice des corrélations de Pearson des facteurs physico-chimiques et de
la macrofaune du sol de Kipushi.
|
pHeau
|
PHKCl
|
CE
|
CO
|
N total
|
H+Al
|
P total
|
P Disp
|
K total
|
Fe total
|
Mn total
|
Zn total
|
Cu total
|
Ba total
|
Vers
|
Termites
|
Fourmis
|
|
pHKCl
|
0.991
0.001
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CE
|
0.965
0.008
|
0.972
0.006
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CO
|
0.785
0.116
|
0.702
0.186
|
0.708
0.181
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N total
|
-0.400
0.505
|
-0.481
0.412
|
-0.616
0.269
|
-0.020
0.975
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H+Al
|
-0.829
0.083
|
-0.754
0.141
|
-0.682
0.205
|
-0.910
0.032
|
-0.151
0.809
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P total
|
0.468
0.427
|
0.532
0.356
|
0.537
0.351
|
0.262
0.671
|
-0.618
0.267
|
-0.094
0.881
|
|
|
|
|
|
|
|
|
|
|
|
|
P Disp
|
-0.963
0.009
|
-0.964
0.008
|
-0.888
0.044
|
-0.660
0.225
|
0.284
0.643
|
0.816
0.092
|
-0.353
0.560
|
|
|
|
|
|
|
|
|
|
|
|
K total
|
0.713
0.177
|
0.625
0.260
|
0.683
0.204
|
0.879
0.050
|
-0.077
0.902
|
-0.829
0.082
|
-0.085
0.891
|
-0.612
0.272
|
|
|
|
|
|
|
|
|
|
|
Fe total
|
-0.326
0.592
|
-0.217
0.726
|
-0.329
0.589
|
-0.794
0.108
|
-0.056
0.928
|
0.550
0.336
|
0.043
0.946
|
0.125
0.842
|
-0.806
0.100
|
|
|
|
|
|
|
|
|
|
Mn total
|
0.998
0.000
|
0.994
0.001
|
0.965
0.008
|
0.774
0.125
|
-0.419
0.483
|
-0.811
0.096
|
0.517
0.372
|
-0.958
0.010
|
0.678
0.208
|
-0.304
0.619
|
|
|
|
|
|
|
|
|
Zn total
|
0.984
0.003
|
0.981
0.003
|
0.992
0.001
|
0.775
0.124
|
-0.531
0.357
|
-0.752
0.143
|
0.551
0.336
|
-0.906
0.034
|
0.705
0.184
|
-0.373
0.536
|
0.986
0.002
|
|
|
|
|
|
|
|
Cu total
|
0.983
0.003
|
0.981
0.003
|
0.992
0.001
|
0.773
0.126
|
-0.535
0.353
|
-0.748
0.146
|
0.556
0.330
|
-0.905
0.035
|
0.700
0.188
|
-0.370
0.540
|
0.985
0.002
|
1.000
0.000
|
|
|
|
|
|
|
Ba total
|
0.162
0.795
|
0.169
0.786
|
0.061
0.922
|
-0.161
0.796
|
0.228
0.713
|
-0.223
0.719
|
-0.565
0.321
|
-0.390
0.516
|
0.118
0.850
|
0.402
0.502
|
0.127
0.839
|
0.030
0.961
|
0.027
0.965
|
|
|
|
|
|
Vers
|
-0.487
0.405
|
-0.440
0.459
|
-0/577
0.309
|
-0.741
0.152
|
0.425
0.475
|
0.405
0.499
|
-0.504
0.387
|
0.234
0.705
|
-0.620
0.264
|
0.819
0.090
|
-0.494
0.398
|
-0.600
0.285
|
-0.600
0.285
|
0.678
0.209
|
|
|
|
|
Termites
|
-0.572
0.314
|
-0.476
0.418
|
-0.577
0.308
|
-0.838
0.076
|
0.092
0.883
|
0.703
0.185
|
0.109
0.861
|
0.425
0.476
|
-0.971
0.006
|
0.906
0.034
|
-0.538
0.350
|
-0.595
0.290
|
-0.591
0.294
|
0.053
0.932
|
0.717
0.173
|
|
|
|
Fourmis
|
-0.370
0.540
|
-0.446
0.452
|
-0.287
0.639
|
0.187
0.763
|
0.109
0.862
|
0.164
0.792
|
-0.123
0.844
|
0.586
0.299
|
0.189
0.761
|
-0.712
0.177
|
-0.377
0.532
|
-0.268
0.663
|
-0.270
0.661
|
-0.716
0.174
|
-0.589
0.296
|
-0.410
0.493
|
|
|
Autres
|
-0.573
0.313
|
-0.495
0.397
|
-0.492
0.400
|
-0.907
0.034
|
-0.072
0.908
|
0.733
0.159
|
-0.431
0.468
|
0.412
0.490
|
-0.626
0.259
|
0.763
0.133
|
-0.580
0.305
|
-0.584
0.301
|
-0.583
0.302
|
0.493
0.398
|
0.788
0.114
|
0.633
0.251
|
-0.366
0.545
|
Tableau
3-8 :Matrices des corrélations de Pearson des facteurs
physico-chimiques et du la macrofaune de sol de Musoshi
|
pHeau
|
pHKCl
|
CE
|
CO
|
N total
|
H+Al
|
P total
|
P Disp
|
K total
|
Fe total
|
Mn total
|
Zn total
|
Cu total
|
Ba total
|
Vers
|
Termites
|
Fourmis
|
|
pHKCl
|
0.952
0.012
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CE
|
0.736
0.156
|
0.877
0.051
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CO
|
0.885
0.046
|
0.918
0.028
|
0.928
0.023
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N total
|
0.821
0.089
|
0.889
0.043
|
0.962
0.009
|
0.991
0.001
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H+Al
|
-0.849
0.069
|
-0.868
0.056
|
-0.795
0.108
|
-0.812
0.095
|
-0.785
0.116
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P total
|
0.773
0.125
|
0.567
0.319
|
0.140
0.822
|
0.430
0.470
|
0.304
0.619
|
-0.500
0.391
|
|
|
|
|
|
|
|
|
|
|
|
|
P Disp
|
-0.770
0.128
|
-0.911
0.032
|
-0.812
0.095
|
-0.734
0.158
|
-0.733
0.158
|
0.697
0.191
|
-0.351
0.562
|
|
|
|
|
|
|
|
|
|
|
|
K total
|
0.159
0.799
|
0.143
0.818
|
0.446
0.451
|
0.489
0.403
|
0.529
0.360
|
-0.357
0.555
|
-0.163
0.794
|
0.152
0.808
|
|
|
|
|
|
|
|
|
|
|
Fe total
|
-0.999
0.000
|
-0.951
0.013
|
-0.737
0.155
|
-0.892
0.042
|
-0.828
0.083
|
0.825
0.086
|
-0.770
0.128
|
0.770
0.128
|
-0.158
0.799
|
|
|
|
|
|
|
|
|
|
Mn total
|
0.365
0.546
|
0.380
0.528
|
0.466
0.429
|
0.407
0.496
|
0.412
0.491
|
-0.783
0.118
|
0.108
0.863
|
-0.190
0.759
|
0.559
0.327
|
-0.324
0.595
|
|
|
|
|
|
|
|
|
Zn total
|
0.490
0.402
|
0.597
0.288
|
0.875
0.052
|
0.821
0.088
|
0.876
0.051
|
-0.649
0.236
|
-0.091
0.884
|
-0.428
0.472
|
0.815
0.093
|
-0.491
0.401
|
0.567
0.319
|
|
|
|
|
|
|
|
Cu total
|
0.919
0.027
|
0.927
0.023
|
0.892
0.042
|
0.969
0.007
|
0.945
0.015
|
-0.925
0.024
|
0.515
0.375
|
-0.713
0.177
|
0.485
0.407
|
-0.914
0.030
|
0.587
0.298
|
0.782
0.118
|
|
|
|
|
|
|
Ba total
|
-0.638
0.246
|
-0.690
0.198
|
-0.382
0.525
|
-0.393
0.512
|
-0.345
0.570
|
0.380
0.528
|
-0.555
0.331
|
0.837
0.077
|
0.609
0.276
|
0.643
0.241
|
0.191
0.758
|
0.106
0.866
|
-0.376
0.533
|
|
|
|
|
|
Vers
|
0.721
0.169
|
0.737
0.156
|
0.614
0.271
|
0.596
0.289
|
0.562
0.324
|
-0.951
0.013
|
0.480
0.414
|
-0.615
0.270
|
0.182
0.769
|
-0.685
0.202
|
0.834
0.079
|
0.440
0.459
|
0.764
0.133
|
-0.375
0.534
|
|
|
|
|
Termites
|
0.658
0.228
|
0.754
0.141
|
0.778
0.121
|
0.677
0.210
|
0.684
0.202
|
-0.946
0.015
|
0.233
0.706
|
-0.674
0.212
|
0.328
0.590
|
-0.626
0.259
|
0.852
0.067
|
0.648
0.237
|
0.800
0.104
|
-0.296
0.628
|
0.947
0.014
|
|
|
|
Fourmis
|
-0.715
0.174
|
-0.522
0.367
|
-0.320
0.600
|
-0.646
0.239
|
-0.561
0.326
|
0.372
0.537
|
-0.759
0.137
|
0.203
0.743
|
-0.331
0.587
|
0.737
0.156
|
0.010
0.987
|
-0.307
0.615
|
-0.611
0.273
|
0.218
0.725
|
-0.168
0.787
|
-0.059
0.924
|
|
|
Autres
|
0.769
0.129
|
0.737
0.155
|
0.697
0.191
|
0.758
0.137
|
0.727
0.164
|
-0.962
0.009
|
0.481
0.412
|
-0.480
0.413
|
0.538
0.350
|
-0.742
0.151
|
0.868
0.056
|
0.676
0.210
|
0.891
0.042
|
-0.140
0.823
|
0.910
0.032
|
0.891
0.042
|
-0.428
0.472
|
Chapitre 4. Discussion
4.1. Caractéristiques
physico-chimiques des sols des sites étudiés
Les analyses au laboratoire ont révélé
que les sols environnant (de 50 à 200 m) le bassin de décantation
à Kipushi sont principalement acides, mais à 0 m près du
bassin, les sols sont alcalins avec un pHKCl supérieur au
pHeau. Cette basicité près du bassin pourrait trouver
une justification à partir de la chaux formée suite à la
calcination de la castine qui est ajoutée dans la charge comme fondant.
En effet, le traitement des minerais par flottation a adopté par l'ACK,
faisait intervenir la chaux pour fixer le pH entre 9 et 11 (
Kaniki, 2008 ;
Kitobo, 2009). Après extraction des minerais,
les sous-produits (à pH très alcalin) rejetés rehaussent
le niveau de pH dans le bassin de décantation. Ceci se confirme,
d'ailleurs par une teneur élevée (27600 ppm) en Ca à ce
point. Ces résultats corroborent ceux de
Mees et al., 2013, qui ont trouvé
des pH alcalins sur l'ensemble des échantillons prélevés
dans ce bassin de décantation. Le fait que le pHKCl soit
supérieur au pHeauimplique que l'AEC est supérieur
à la CEC, donc les sols à KPS 1 ont une importante
quantité des charges positives. Les pHKCl supérieurs
aux pHeau ont été révélés par
Kaniki (2008) et étudiant les
propriétés physico-chimiques de rejets miniers.
A Musoshi, les sols environnant le bassin de
décantation sont tous acides, mais une forte acidité a
été observée près du bassin, tout en diminuant au
fur et en mesure que l'on s'éloigne du bassin. Cette situation peut
être justifiée par la présence du Soufre dans les rejets de
la SODIMICO. L'hydrosulfure de sodium (NaSH) employé dans le traitement
des minerais, augmentait la teneur en S dans les rejets. L'hypothèse est
qu'une fois rejetés dans le bassin, ce S réagissait avec l'eau
pour formait de l'acide sulfurique (H2SO4) et ainsi,
baisser le pH du bassin de décantation. Les recherches de
Kaniki (2008)ont révélé
jusqu'à une teneur de 2.25 % en S total dans les rejets de cet
concentrateur à l'usine. Toutefois, au cours de cette étude,
l'analyse a décelé des faibles valeurs en non
déterminées par XRF en s'éloignant du bassin.
La mesure de la conductivité constitue une bonne
appréciation du degré de minéralisation d'un sol où
chaque ion agit par sa concentration et sa conductivité
spécifique. Les valeurs enregistrées, ont montré une
baisse de la conductivité à Kipushi (de 215.43 us/cm à KPS
1, à 16.32 us/cm à KPS 5), mais une augmentation de celle-ci
à Musoshi (de 6.19 us/cm à MUS 1, à 14.21 us/cm à
MUS 5), en s'éloignant du bassin de décantation. La
conductivité électrique est influencée par le pH.
Quant au CO et à la MO, les résultats montrent
une tendance décroissante des teneurs en s'éloignant du bassin de
Kipushi. A Musoshi, l'on enregistre une augmentation des teneurs au fur et
à mesure que l'on s'éloigne du bassin. Pour ce qui concerne
Phosphore total et disponible, à Kipushi, on enregistre une diminution
de teneur en phosphore total, mais une augmentation de la teneur en phosphore
disponible, en s'éloignant du bassin. A Musoshi, les courbes montrent
une augmentation des teneurs en phosphore total et disponible en
s'éloignant du bassin. Ce phénomène peut trouver
explication dans la topographie associée au couvert
végétal de deux sites.
Dabin (1985 ;
1974)a rapportéqu'une forte pente
combinée à une perte du couvert végétal conduit
à la perte des éléments par lixiviation ou par
ruissellement latéral surtout pour le Potassium, la Carbone organique et
le Phosphore. L'érosion a pour effet de décaper la partie
supérieure du sol la plus riche et d'amener en surface des couches
sous-jacentes plus pauvres ; il y a aussi un effet de tassement et de
destruction de la structure du sol, les pertes de matières organiques
sont considérables(
Roose, 1975).Le site de Kipushi regorge une forte
pente et une perte excessive de la flore. Ce qui justifie les teneurs
élevées en éléments chimiques près du bassin
qu'à 200 m plus loin du bassin à ce site.
Les faibles valeurs de teneurs en Phosphore disponible dans
les deux sites peuvent être liées à l'influence du pH. En
effet, la biodisponibilité des éléments majeurs (azote,
phosphore, potasse,...) comme des oligo-éléments (bore, cuivre,
zinc...) dépend de leurs teneurs dans le sol, mais également du
pH (
Michel, 2005). Ainsi donc, un pH trop alcalin ou
acide réduit la disponibilité du phosphore dans le sol (
Hopkins, 2003 ;
Demers, 2008 ;
Drouet, 2010). Ceci est aussi valable pour le
potassium.
Pour tous les deux sites, on enregistre une augmentation de la
teneur en Azote total en s'éloignant de la source de contamination
(bassin de décantions). La baisse de teneurs en Azote dans les sols
près du bassin de décantation peut êtredue d'une part
à la perte de l'azote nitrate (NO3-) en solution
par lessivage (
Gouyer, 2001 ;
Cattan et al., 2005) et d'autres parts,
à l'activité biologique (Motisi, 2005 in
Thieuleux, 2006 ;
Bâ et al., 2004), d'où la
capacité des microorganismes du sol à fixer l'azote
atmosphérique (
Roggy et al., 2004). En se rapportant au
deuxième aspect, il est donc à comprendre que la faible
activité biologique (faible abondance) dans les sols près du
bassin combiné au fait du lessivage entraine une perte en azote dans ces
sols.
En s'intéressant plus particulièrement aux
métaux lourds, les analyses ont révélé des teneurs
en ETM total (principalement en Fe, Mn, Cu, Ba) dans les sols environnant les
deux bassins de décantation en comparaison aux teneurs moyennes normales
dans la croûte terrestre (
Foucault 1995 ;
Bowen, 1979) et à celles de ces métaux
dans les sols en France (
MATF, 1998) (Tableau 3-1). Mais ces valeurs restent
inférieures à celles rapportée sur les sols naturels
dès les collines métallicoles du Katanga dans plusieurs
études de la végétation métallophyte (
Duvigneaud & Denaeyer de Smet,
1963 ;
Malaisse et al., 1994 ;
Ilunga, 2010,
2014). Néanmoins, ces sols nécessitant
certainement des travaux de restauration. Par comparaison entre les points de
chaque site étudié (à Kipushi et Musoshi), on observe la
variabilité des teneurs en métaux lourds entre les sols en
s'éloignant du bassin. En effet, les teneurs en métaux des sols
sont en général très élevées près du
bassin tout en diminuant en fonction de l'éloignement par rapport au
bassin et de la position par rapport à la pente. Sauf pour le cuivre et
le manganèse à Musoshi, on enregistre une diminution des teneurs
pour l'ensemble des métaux (qui restent cependant supérieures
à la normale) en allant du bassin jusqu'au point situé à
plus de 200 m dans la forêt. La variabilité des teneurs en
métaux entre les sols d'un même site minier semble être une
caractéristique de la pollution minière dans la région. En
effet, selon
Ernst et Nelissen (2000), les teneurs en
métaux totaux dans les sols proches des régions minières
et des fonderies, sont élevées et très différentes
d'un point à l'autres. Ces résultats révèlent que
ces sites, abandonnés sans réhabilitation constituent des foyers
importants d'éléments traces métalliques susceptibles
d'avoir des effets contaminants durables au voisinage immédiat et
même plus longue distance dans les directions des ruissellements et des
vents dominants.
4.2. Abondance et
diversité des macroinvertébrés des sites
étudiés
L'abondance des macroinvertébrés du sol
près du bassin, pour les deux sites étudiés, est de loin
inférieure à celle observée jusqu'à 200 m dans la
forêt. La plus grande valeur a été observée à
200 m du bassin à Kipushi et à 50 m du bassin à Musoshi.
L'augmentation de l'abondance sur ces points est due l'expansion des
populations des fourmis. En effet, les fourmis sont les insectes sociaux vivant
en colonie (
Deneubourg, 1991). Il est donc évident
que ces points sont localisés sur des fourmilières, d'où
l'expansion de leur abondance lors de la collecte des données. Ces
résultats sont similaires à ceux de
Tondoh (2007) rapportant une augmentation de
l'abondance des macroinvertébrés suite à la pullulation
des populations des fourmis. L'absence totale des vers de terre à 200 m
du bassin à Kipushi serait due aux activités agricoles
exercées sur ce milieu. L'effet des activités agricole a
déjà été rapporté dans la littérature
(
Tondho, 2007 ;
Zirbes et al., 2009 ;
Lemtiri, 2015).
La diversité des macroinvertébrés a
été étudiée en fonction de l'éloignement au
bassin de décantation. Les forts indices de diversité de Shannon
et Simpson ont été observées à 100 m du bassin dans
tous les deux sites étudiés, pendant que les valeurs nulles sont
observées à 0 m près du bassin. La répartition est
plus équitable à 100 m et à 150 m du bassin. Les faibles
diversités près des bassins de décantation sont
probablement dues à l'immersion permanente sur ce milieu. Ce milieu est
donc peu favorable au développement des macroinvertébrés
en raison des conditions asphyxiques (
Lee, 1985 ;
Avel, 1959 ;
Boyer, 1973;
Bachelier, 1978 ;
Lepage et al., 1974).
4.3. Relations entre les
paramètres physico-chimiques du sol et la macrofaune du sol.
Il est signalé un certain niveau d'affinité
entre les paramètres de caractérisation physico-chimiques des
sols et l'abondance de la macrofaune des sites étudiés. L'analyse
des corrélations (tableau 3-7) a montré que les facteurs
édaphiques influençant significativement la répartition de
la macrofaune à Kipushi sont : K total et Fe total pour les
termites, CO pour les fourmis, les vers de terre ne sont influencés par
aucun paramètre. Concernant le bassin de Musoshi, l'analyse a
montré que les vers de terre, les termites et les fourmis sont
significativement influencés par l'acidité
échangeable ; en plus, les fourmis sont significativement
influencées par le cuivre totale. Ces corrélations expliquent les
différentes relations (d'antagonisme et de synergie) entre ces
différents paramètres physico-chimiques du sol et la
répartition de la macrofaune dans les sites étudiés.
Les métaux lourds, en particulier, le cuivre, ont des
effets négatifs sur la répartition des fourmis (
Eeva et al., 2004). Le cuivre en
particulier, pose des stress extra à la population des fourmis en
agissant sur la reproduction, la croissance et la résistance aux autres
facteurs environnementaux (
Pinementel, 1994). Les corrélations
négatives entre les métaux lourds (Cu) ont été
reportées dans la littérature (
Rabitsch, 1997). Les recherches (
Maavara et al., 1994 ;
Martin et al., 1999) ont reporté
une variation des teneurs en métaux lourds le long des castes des
fourmis (des ouvriers à la reine). Les résultats de cette
étude montrent donc que les espèces des fourmis recensées
sont probablement tolérantes aux fortes concentrations en Cu. Toutefois
cette hypothèse reste à vérifier par d'autres
études approfondies.
L'influence du potassium et du fer sur la répartitions
des termites peut trouver justification dans l'alimentation de ces derniers (
Laker et al., 1982 ;
Stewart et al., 2011). Les teneurs
élevées en potassium ont déjà été
observée dans les nids des fourmis (
Stewart et al., 2011 ;
Jouquet et al., 2005). Cependant, les
résultats obtenus au cours de cette étude ont montré un
effet contradictoire. Cette situation peut être expliquée par
l'effet antagoniste du fer. Il semble donc que le fer influence plus la
distribution des termites que le potassium.
La corrélation significative entre les fourmis et le
carbone organique observé à Kipushi explique une
dépendance de celles-ci à la matière organique
rapportée dans la littérature (
De Bruyn & Conacher, 1990 ;
Lenoir et al., 2001). La matière
organique est la principale source énergétique de la faune du sol
(
Guild, 1955). Cet avis est partagé parplusieurs
auteurs (
Lee, 1985 ;
Oyedele et al., 2006 ;
Don et al., 2008 ;
Roy-Noël, 1974 ;
De Bruyn & Conacher, 1990 ;
Lenoir et al., 2001 ;
Bourguignon et al., 2011). Ceci qui
justifie doncla forte abondance observée à KPS 5. L'absence de
fourmis à KPS 1 se justifie par les teneurs élevée en
métaux lourds (en cuivre particulièrement) et l'immersion
pimentant.
L'acidité échangeable influence la distribution
de trois groupes (vers de terre, fourmis et termites). L'explication à
ce phénomène est qu'une forte l'acidité échangeable
implique une forte mobilité de l'aluminium (
Boyer, 1973). Cet aluminium a la
propriété de fixer (sous forme ionique) certains cations basiques
comme le potassium, la phosphore, etc. (Veitch cité par
Ségalen, 1973 ;
Laudelout, 1950) qui sont essentiels dans
l'alimentation de la macrofaune du sol. Les recherches (
Pieri, 1974 ;
Dambrine et al., 1995 ;
Girard et al., 2005) ont rapporté
que l'aluminium échangeable inhibait l'activité de la microflore
et la macrofaune du sol.
Les corrélations significatives entre les
paramètres physico-chimiques des sols de sites étudiés ont
déjà été mises en évidence dans plusieurs
études (
Kaniki, 2008 ;
Abdallaoui, 1998 ;
Ibhi, 2013 ;
Giroux et Sen Tran, 1984).
D'une manière générale, la distribution
de la macrofaune observée dans les sols environnant les deux bassins de
décantation est beaucoup plus influencée par les teneurs en
métaux lourds (fer et cuivre), mais aussi d'autres facteurs comme le
potassium, l'acidité échangeable impliquant le pH et le carbone
organique (impliquant la matière organique).Les études ont
déjà mis en évidence les effets de quelques métaux
lourds comme le Mercure (
Dasilva, 2013), l'Arsenic et l'Antimoine (
Jana, 2009) en milieu contrôlé. Cette
étude vient donc d'ajouter un effet du cuivre et du fer dans la
répartition de la macrofaune du sol, particulièrement les fourmis
et les termites. Il est donc à comprendre que le complexe
fertilité-métaux lourds serait à l'origine de
répartition des macroinvertébrés dans les sols des sites
étudiés.
Conclusion
Cette étude s'est fixé comme objectif global
d'étudier l'impact des activités minières sur la
macrofaune du sol. Spécifiquement, il s'agissait de caractériser
les sols des sites étudiés ;d'évaluer l'abondance
ainsi que la diversitéde la macrofaune ; mais aussi de relever la
relation entre la macrofaune et les paramètres environnementaux. Les
principaux résultats ont montré qu'à Kipushi, l'ensemble
des paramètres (à l'exception du Phosphore disponible et de
l'Azote total)diminuaient avec l'éloignement au bassin. Par contre,
à Musoshi, tous les paramètres augmentaient avec
l'éloignement au bassin. L'augmentation des teneurs en métaux
lourds ont été aussi observée ; cependant, les
teneurs restaient inférieures à ceux
rapportéesconcernantles sols naturels des collines
métallicoles.
Pour les deux sites, l'abondance et la diversité des
macroinvertébrés sont élevées dans les sols
localisés loin du bassin. La diversité la plus
élevé était enregistré à 100 m
au-delà du bassin.En ce qui concerne les relations entre la macrofaune
du sol et les paramètres physico-chimiques, à Kipushi, le
potassium et le fer ont influencé significativement la
répartition de termite, situation similaire en ce qui concerne le
carbone organique avec les fourmis. A Musoshi, l'acidité
échangeable a influencé l'ensemble de la macrofaune et le cuivre
a particulièrement influencé les fourmis.
Tout en ayant pas envie de limiter la recherche, les
prochaines études pourront l'élargir le transect à une
longue distance du bassin et multiplier les analyses afin de confirmer ou
d'infirmer les théories avancées dans cette étude. Il est
envisageable de mener aussi des études dans le milieu
contrôlé afin d'évaluer l'impact direct de ces
métaux lourds sur l'activité de la macrofaune.
Bibliographie
Abdallaoui A., 1998. Contribution
à l'étude du phosphore et des métaux lourds contenus dans
les sédiments et de leur influence sur les phénomènes
d'eutrophisation et de la pollution. Cas du bassin versant de l'oued Beht et de
la retenue de barrage El Kansera. Thèse en Sciences Physique,
Université Moulay Ismail, 213 pp.
Abe S.S., Yoshinori W., Taisuke O.,
Takashi K., Toshiyuki W., 2016. Nutrient storage in termite (Macrotermes
bellicosus) mounds and the implications for nutrient dynamics in a
tropical savanna Ultisol. Soil Science and Plant Nutrition, 57:6,
786-795, DOI: 10.1080/00380768.2011.640922.
Anderson J.M., Ingram J. (Eds).
1993. Tropical Soil Biology and Fertility. A Handbook of Methods.
2nd Edition. CAB, Oxford. 221p.
Anonyme, 2004. Situation de la
pollution de la nappe aquifère à Lubumbashi. Nouvelle
dynamique syndicale (NDS), Lubumbashi, R.D.C.
Avel M., 1959. Classe des
Annélides Oligochètes. In « Traité de
Zoologie » Masson éd. (Paris), T.V., fasc. I, 224-470.
Bâ A., Samba R, Sylla S., Le
Roux C., Neyra M., Rousteau A., Imbert D., Toribio A., 2004. Characterization
of the diversity of symbiotic microorganisms in Pterocarpus officinalis in
swamp forests of Guadeloupe and Martinique.Revue d' Ecologie -La Terre et
La Vie 59 (12): 163-170.
Ba A., Samba R., Sylla S., Le Roux
C., Neyra M., Rousteau A., Imbert D., Toribio A., 2004. Characterization of the
diversity of symbiotic microorganisms in Pterocarpus officinalis in swamp
forests of Guadeloupe and Martinique. Revue d' Ecologie -La Terre et La
Vie 59 (12): 163-170.
Bachelier G., 1978. La faune
des sols, son écologie et son action, IDT N°38. ORSTOM, Paris,
391 pp.
Banza C., Nawrot T., Haufroid V.,
Decrees S., Deputter T., Smolodemn E., Kabyla B., Ilunga A., Lubeya O., Mutombo
A., Nemerly B., 2009. High Human experure to cobalt and other metals in Katanga
a mining area of the Democratic Republic of Congo. Vol. 109 n° 6. 745-752
pp.
Barley M.P., 1961. The abundance of
earthworms in agricultural land and their possible significance in agriculture.
Advances in Agronomy. 13, 249-268.
Barois I., 1992. Mucus production and
microbial activity in the gut of two species of Amythas
(Megascolecidae) from cold and warm tropical climates. Soil Biology and
Biochemistry. 24, 1507-1510 pp.
Belyaeva O.N., Haynes, R.J.,
Birukova O.A., 2005. Barley yield and soil microbial and enzyme activities as
affected by contamination of two soils with lead, zinc or copper. Biol.
Fertil. Soils. 41, 85-94.
Benyamina A., 2013.
Application des algorithmes de colonies de fourmis pour l'optimisation et la
classification des images. Thèse de doctorat en Sciences en
Informatique. Univerité des Sciences et de la technologie d'Oran Mohamed
Boudiaf, 153 pp.
Bernard F., 1951. Adaptations au
milieu chez les fourmis sahariennes. Bull. Soc. Hist. Nat. Toulouse.
86, 85-96.
Beyer W.N., Chaney R.L., Mulhern
B.M., 1982. Heavy metal concentrations in earthworms from soil amended with
sewage sludge. J. Environ. Qual. 11, 381-385.
Binet F., Curmi P., 1993.
Structural effects of Lumbricusterrestris (Oligochaeta: Lumbricidae)
on the soil-organic matter system: micromorphological observations and
autoradiographs. Soil Biol. Biochem. 24, 1519-1523.
Bouché M.B., Al-Addan
F., 1997. Earthworms, water infiltration and soil stability: some new
assessments. Soil Biol. Biochem. 29, 441-452.
Bourguignon T., Sobotnik J.,
Lepoint G., Martin J.M., Hardy O.J., Dejean A., Roisin Y., 2011. Feeding
ecology and phylogenetic structure of a complex neotropical termite assemblage,
revealed by nitrogen stable isotope ratios. Ecological Entomology. 36
(2):261-269.
Bowen H.J.M, 1979. Environmental
chemistry of the elements. New York : Academic Press.
Boyer Ph., 1973. Action de certains
Termites constructeurs sur l'évolution des sols tropicaux. Ann. Sci.
Nat. Zoologie (Paris), 128 sér., T. 15, 329-498.
Cattan P., Cabidoche Y.M., Lacas
J.G., Voltz M., 2005. Occurrence of runoff on high infiltrability andosol under
two banana cropping systems. Soil Tillage Research.
Cobert R.G., 1977, Effect of coal
mining on ground and surface water quality. Monongalia county. West Virginia.
Sci. Total. Environ. 8-12.
Curry, J.P., 2004. Factors affecting
the abundance of earthworms in soils. In: Edwards,C. (Ed.), Earthworm
Ecology. , 2nd edition. CRC Press, Boca Raton.
Czerwinsiki Z., Jakubczyk
H., Petal J., 1971. The influence of ants of the genus Myrmica on the
physico-chemical and microbiological properties of soil within the compass of
ant hills in the Strzeleckie meadows. Pol. J. Soil Sci. 2, 51-58.
Da Silva E., 2013. Interactions
"sol - vers de terre" et dynamique du mercure en Guyane française.
Thèse de doctorat en Sciences de la Terre. Université Paris-Est.
276p.
Dabin B (1974). Evolution des
phosphates en sol acides des régions tropicales. Extrait de Science
du Sol - Billletin de l'A.F.E.S., no 2 - 1974, 87-104
Dabin B., (1985). Sols tropicaux
acide. Cah. ORSTOM, ser. Pedol., vol. XXI, no 1,7-19
Dambrine E., Ulrich E.,
Cénac N., Durand P., Gauquelin T., Mirabel P., Nys C., Probst A., Ranger
J., Zephoris, M., 1995. Atmospheric deposition in France and possible relation
with forest decline. In: Forest Decline and atmospheric deposition effects
in the french mountains. G. Landmann M. Bonneau (Eds.), Springer Verlag,
Berlin, Germany, 177-200 pp.
De Bruyn Lobry L.A,
Conacher A.J., 1990. The role of ants in the soil modification: a review.
Australian Journal of Soil Research. 28: 55-93.
Decaëns T., Lavelle P.,
Escobar G., Ripptein G., 1994. Impact of land management on soil macrofauna in
the Orient Llanos of Colombia. European Journal of Soil Biology. 30,
157-168.
Decaëns T., Mariani L.,
Lavelle, P. 1999. Soil surface macrofaunal communities associated with
earthworm casts in grasslands of the Eastern plains of Colombia. Appl. Soil
Ecol. 13: 87-100.
Demers I., 2008. Formes et
disponibilité du phosphore de composts utilisés comme amendements
de sols agricoles, pour l'obtention du grade de maître des sciences
(M. Se.), Laval, Québec, 92p.
Deneubourg J.L., Goss S.,
Franks N., Sendova-Franks A., Detrain C., Chretien L., 1991. «The dynamic
of collective sorting robot-like ants and ant-like robots», in J. A. Meyer
and S. W. Wilson (eds), SAB 90 - 1st Conference On Simulation of Adaptive
Behavior: From Animals to Animats, MIT Press.
Depta B., Koscielniak A., Rozen
A., 1999. Food selection as a mechanism of heavy metal resistance in
earthworms. Pedobiologia. 43, 608-614.
Don A., Steinberg B., Schöning
I., Pritsch K., Joschko M., Gleixner G., 2008. Organic carbon sequestration in
earthworm burrows. Soil Biology and Biochemistry 40, 1803-1812.
Donzé A., 2011. Approche
expérimentale et théorique de l'écologie des fourmis des
bois. Bulletin de la Société des Enseignants
Neuchâtelois de Sciences, n° 40, Biologie, 20 pp.
Drouet T.H., 2010.
Pédologie, BING-F-302. Ed. Lagev, 140p.
Duchauffour P., 1997.
Abrégé de Pédologie : sol,
végétation, environnement. 5ème Edition,
Paris, 291 pp.
Duvignaud P., 1958. La
végétation du Katanga et de ses sols métallifères.
Bull. Soc. R. Bot. Belg. 90, 127-296 p.
Duvigneaud P.,
Denaeyer de Smet S., 1963. Etudes sur la végétation du Katanga et
de ses sols métallifères. 7. Cuivre et végétation
au Katanga. Bulletin de la Société Royale de Botanique de
Belgique 96, 93-231.
Edwards C.A., Bohlen P.J.,
1996. Biology and Ecoloy of Earthworms 3rd ed. Chapman and
Hall, London, 426 pp.
Edwards W.M., Shipitalo M.J., Traina
S.J., Edwards C.A., Owens L.B., 1992. Role of Lumbricusterrestris
burrows on quality of infiltrating water. Soil Biol. Biochem. 24,
1555-1561.
Eevaa T., Sorvaria J., Koivunenb
V., 2004. Effects of heavy metal pollution on red wood ant (Formica s. str.)
populations. Environmental Pollution 132, 533-539
Ernst W.H.O., Nelissen
H.J.M., 2000. Life-phase of a zinc- and cadmium-resistant ecotype of Silene
vulgaris in risk assessment of polymetallic mine soils. Environmental
Pollution 107 : 329-38.
Folgarait P.J., Thaomas F.,
Desjardins T., Grimaldi M., Tayasu I., Curmi P., Lavelle P., 2003. Soil
properties and the macrofauna community in abandoned irrigated rice fields of
northeastern Argentina. Biology and Fertility of Soil. 38, 349-357.
Foucault A. 1995. Dictionnaire
de géologie, 4ème édition, Masson, Paris, 324 p.
Fragoso C., Lavelle P.,
1992. Earthworm tropical communities of rain forests. Soil Biology and
Biochemistry 24, 1397-1408.
François A., 1974.
Stratigraphie, tectonique et minéralisations dans l'arc
cuprifère du Shaba (République du Zaïre). Centenaire de
la société géologique de la Belgique, gisements
stratiformes et provinces curpifères, Liège, 79-101 pp.
Gass F., Gillet S., Ponge J.F.,
2006. The use of directional traps for the assessment of short-term
phenanthrene effects upon soil springtail communities.
EnvironmentalPollution. 140, 364-370.
Girard M.-C., Walter C.,
Rémy J.-C., Berthelin J., Morel J.L., 2005. Sols et
environnement. Dunod, Paris. 816 pp.
Giroux M., Sen Tran T.,
1984. Evalution du Phosphore assimilable des sols acides avec
différentes méthodes d'extraction en relation avec le rendement
de l'avoine et les propriétés du sol. Can. J. Soil Sci.
65: 47-60.
Gobat J.M., Aragno M., Matthey W.,
2003. The living soil: basic pedology-soil biology (2nd edition).
Chapman and Hall, London, 569 pp.
Gouyer, S., 2001. Evaluation du
transport par ruissellement de surface sur andosol. Mémoire de fin
d'étude, ISTOM.
Grassé P.-P., 1984a.
Termitologia : nid, construction. Masson `edition'. Fondation
Singer-Polignac, Paris, 613 p.
Guild W.J.M.L., 1955. Earthworms and
soil structure. In: Kevan D.K.M.E. (Eds), Soil Zoology. Butterworths,
London, 83-98 pp.
Harper D.A.T. (ed.). 1999.
Numerical Palaeobiology. John Wiley & Sons.
Harun Y., 2003. Le miracle de la
fourmi. Editions AL-MADINAH, 25 pp.
Herzog D.C., Reagan T.E.,
Sheppard D.C. et al., 1976. Solenopsis invicta Buren:
influence on Louisiana Pasture soil chemistry. Environmental
Entomology. 5, 4, 160-162.
Hopkins W.G., 2003. Physiologie
végétale. Ed. de Boeck, Belgique, 514p.
Huynh T.M.D., 2009. Impacts des
métaux lourds sur l'interaction plante/ver de terre/microflore
tellurique. Thèse de Doctorat en Ecologie Microbienne,
Université Paris-Est, 151 pp.
Ibhi A., 2013. Mécanismes de
rétention des métaux lourds par des apatites naturelles: exemple
de la fluorapatite des phosphates de Bou-Craa (Maroc). J. Mater. Environ.
Sci. 5 (4) 1027-1032
Ilunga I.E., 2010.
Caractérisation des relations plantes-sol sur la colline
cuprifère de Kinsevere. Mémoire de DEA inédit,
Faculté des Sciences Agronomiques/Université de Lubumbashi,
76p.
Ilunga I.E., 2014. Les
communautés végétales des affleurements de roches
métallifères : Une ressource biologique pour la restauration des
mines et des sols dégradés par les activités
minières dans le Haut Katanga (R.D. Congo). Thèse de
doctorat, Faculté des Sciences Agronomiques/Université de
Lubumbashi, 131p.
Impes R., Fagot J., Avril C.,
1991. Gestion des sols contaminés par les métaux lourds.
Article des annales de Gembloux, 5080, Gembloux (Belgique)
Inward D.J., Vogler A.P.,
Eggleton P., 2007a. A comprehensive phylogenetic analysis of termites
(Isoptera) illuminates key aspects of their evolutionary biology. Mol
Phylogenet Evol. 44: 953-967
Jaffe K., Ramos C., Issa S., 1995.
Trophic interactions between ants and termites that share common nests.
Ann. Am. Entom. Soc. 24(3): 328-333.
Jana U., 2009. Etude des
interactions entre la plante Arabidopsis thaliana (L.) Heynh et le ver de terre
Aporrectodea caliginosa (Savigny) : application à la
phytoremédiation de l'arsenic et de l'antimoine. Thèse en
science de l'univers et de l'environnement, Université Paris-Est,
251pp.
Jiménez J.J.,
Decaëns T., 2004. The impact of soil organisms on soil functioning under
neotropical pastures: a case study of a tropical anecic earthworm species.
Agriculture, Ecosystem and Environment. 103, 329-342 pp.
Jones C.G., Lawton J.H., Shachak
M., 1994. Organisms as ecosystem engineers. Oikos. 69, 373-386.
Joschko M., Diestel H., Larink
O., 1989. Assessment of earthworm burrowing efficiency in compacted soil with a
combination of morphological and soil physical measurements. Biol. Fert.
Soils. 8, 191-196.
Jouquet P., Barré P.,
Lepage M., Velde B., 2005. Impact of subterranean fungus-growing termites
(Isoptera, Macrotermitinae) on soil properties in a West African savanna.
Biol. Fertil. Soil 41, 365-370.
Kabulo K.L., 2010. La
réorganisation du secteur agricole et son impact dans l'économie
congolaise (cas de la province du Katanga). Mémoire, FSA,
Université de Lubumbashi, Inédit.
Kaniki T.A., 2008.
Caractérisation environnementale des rejets
minéro-métallurgiques du copperbelt congolais. Thèse
de doctorat, Faculté des Sciences Appliquées, Université
de Liège, Liège.
Kashimbo K.S., Mbikayi E., Ngoy
S.M., Lukens L., 2015. Evaluation du risque de contamination de la chaine
Alimentaire en éléments traces métalliques de trois
espèces maraichères cultivées au bord de la rivière
Lubumbashi (KATANGA/RD CONGO). International Journal of Innovation and
Applied Studies, ISSN 2028-9324 Vol. 10 No. 4, 1125-1133.
Kasongo L.M.E., 2009.
Système d'évaluation des terres à multiples
échelles pour la détermination de l'impact de la gestion agricole
sur la sécurité alimentaire au Katanga, R.D. Congo.
Thèse de doctorat, Faculté des Sciences, Université de
Gent, 280p.
Katemo M.B., Clinet G., André
L., Chocha M.A. Marquet J-P., Micha J-C., 2010. Les éléments
traces (Cu, Co, Zn, Pb, Cd, U, V et As) dans le bassin de la Lufira
supérieure (Katanga/RD Congo). TROPICULTURA, 28, 4, 246-252.
Kitobo W., 2009.
Dépollution et valorisation des rejets miniers sulfurés du
Katanga. Cas des tailings de l'Ancien Concentrateur de Kipushi.
Thèse de doctorat en Scinces de l'ingénieur, Université de
Liège, 254 p.
Kitobo W., Kalenga P., Ilunga
N.A., Luboya O., Frenay J., 2007. Caractérisation de la mobilité
des éléments traces métalliques contenus dans les rejets
de l'Ancien Concentrateur de Kipushi en R.D. Congo. Annales du Pôle
Mines-Géologie, Université de Lubumbashi 1,
133-142.
König H., Fröhlich J.,
Hertel H., 2006. Diversity and lignocellulolytic activities of cultured
microorganisms In: Konig H., Varma A., (Eds) Intestinal microorganisms of
termites and other invertebrates, Springer Berlin Heidelberg, 271-301
pp.
Laker M.C., Hewitt P.H., Nel A.,
Hunt R.P., 1982. Effects of the termite Trinervitermes trinervoides Sjostedt on
the pH, electrical conductivities, cation exchange capacities and extractable
base contents of soils. Fort Hare Papers 7: 275-286.
Lakhani K.H., Satchell
J.E., 1970. Production by Lumbricusterrestris (L.). J. Anim.
Ecol. 39, 473-492.
Laudelout, 1950. Etude
pédologique d'un essai de fumure minérale de l'Elaeis à
Yangambi. Publ. Z.N.E.A.C. (Bruxelles), Sér. Sci. N° 47,
20 p.
Laveelle P., Dangerfield J.M.,
Fragoso C., Escherbrenner V., Lopez-Hermander D., Pashanasi B., Brussaard L.,
1994. The relationship between soil Macrofauna and tropical soil ferlity. In:
Swift M.J., Woomer P. (Eds). Tropical Soil Biology and Fertility. John
Wiley-Sayce, New York, 137-169 pp.
Lavelle P., 1971. Étude
démographique et dynamique des populations de Millsoniaarzomala
(Acanthodrilidae, Oligochètes). Thèse (Paris,
19-4-197 l), 88 p.
Lavelle P., 1996. Diversity of soil
fauna and soil function. Biol. Intern. 33, 3-16.
Lavelle P., 2002. Fuctional domains
in soils. EcologicalResearch. 17, 441-450.
Lavelle P., Bignelle D., Lepage
M., Wolters V., Roger P., Ineson P., Heal O.W., Dhillion S., 1997. Soil
function in a champing world: the role of invertebrate ecosystem engineer.
Eur. J. Soil. Biol. 33, 159-193.
Lavelle P., Blanchart E., Martin
A., Spain A.V., Martin S., 1991. Impact of soil fauna on the properties of
soils in the humid tropics. Myths and science of soils of the tropics. Soil
Sc. Soc. Amer. and Amer. Soc. of Agr. Special publication n°
29. Madison, 157-185.
Lavelle P., Fragoso G.,
2000. La macrofaune du sol : une ressource en danger dans un monde en
changement. IBOY 2000 (International Biodiversity Observation Year),
rapport du colloque international du 19 au 23 Juin 2000, Bondy (France).
Lavelle P., Spain A.V., 2001.
Soil Ecology. Kluwer Academic Publishers, Dordrecht. 686 p.
Lawton J.H., 1994. What do species do
in ecosystems. Oikos. 71, 367-374.
Lee K.E., 1985. Earthworms: their
ecology and relationship with soils and land use. Academic Press, Sydney,
411 pp.
Legendre F., Whiting M.F.,
Bordereau C., Cancello E.M., Evans T.A., Grandcolas P., 2008. The phylogeny of
termites (Dictyoptera: Isoptera) based on mitochondrial and nuclear markers:
Implications for the evolution of the worker and pseudergate castes, and
foraging behaviors. Mol Phylogenet Evol. 48: 615-627
Legendre P., Legendre L.,
1998. Numerical Ecology, 2nd English ed. Elsevier, 853 pp.
Lemtiri A., 2015. Effects of
agricultural practices and heavy metal contamination on the community dynamics
of earthworms in relation to soil physical and chemical factors in agricultural
fields (Belgium). PhD thesis in Agronomic Sciences and Biological
Engineering, University of Liège, 196pp.
Lenoir L., Persson T., Bengtsson
J., 2001. Wood ant nest as potential hot spots for carbon and nitrogen
mineralization. Biology and Fertility of Soils. 34: 235-240.
Lepage M., Morel G., Resplendino
Cl., 1974. Découverte de galeries de termites atteignant la nappe
phréatique profonde dans le nord du Sénégal. C.R.
Acad. Sci. (Paris), sér. D, T. 278, 14, 1855-1858.
Leteinturier B., Baker A.
J. M., Malaisse F., 1999. Early stages of natural revegetation of metalliferous
mine workings in South Central Africa: a preliminary survey.
Biotechnologie, Agronomie, Société et Environnement,
3(1), 28-41.
Li M.S., 2006. Ecological restoration of
mine land with particular reference to the metalliferous mine wasteland in
China: A review of research and practice. Science of the Total
Environment. 357, 38-53.
Ljungstrom A.J.,
Reinecice P.O., 1969. A ecological study of earthworms from the banks of the
Mooi river in Potchefstroom, South Africa. Pedobiologia. 9, 1/2,
106-111.
Maavara V., Martin A.-J., Oja
A., Nuorteva P., 1994. Sampling of different social categories of red wood ants
(Formica s. str.) for biomonitoring. In: Markert, B. (Ed.), Environmental
Sampling for Trace Analysis. Weinheim, New York, pp. 465-489.
Malaisse F., 1997. Se nourrir
en forêt claire Africaine. Approche écologique et
nutritionnelle. Centre Technique de Coopération Agricole et Rurale,
CTA. Les presses agronomiques de Gembloux. 384 p.
Malaisse F., Brooks R.R., Baker
A.J.M., 1994. Diversity of vegetation communities in relation to soil heavy
metal content at the Shinkolobwe copper/cobalt/uranium mineralization, Upper
Shaba, Zaire. Belgian Journal of Botany 127, 3-16.
Martin A.-J., Amos T., Maavara
V., Nuorteva P., Oja A., 1999. Influence of cadmium pollution on social
homeostasis in red wood ant colonies. Proceedings of the XXIV Nordic
Congress of Entomology, 87-94.
MATF (ministère de
l'Aménagement du Territoire français), 1998. Teneurs limites de
concentration en ETM dans le sol. Arrêté du 8 janvier 1998.
Journal Officiel de la République Française du 31 janvier
1998.
Mayeux V., Savanne D., 1996.
La faune, indicateur de la qualité des sols. Ademe, Direction
Scientifique Service Recherche impacts et milieux, 62 pp.
Mbenza M., Aloni K. & Muteb
M. (1989). Quelques considerations sur la pollution de l'air à
Lubumbashi (Shaba, Zaïre). Géo-eco-trop. 13 (1-4):
113-125.
Mees F., Masalehdani M.N.N., De
Putter T., D'Hollander C., Van Biezen E., Mujinya B.B., Potdevin J.L., Van
Ranst E., 2013. Concentrations and forms of heavy metals around two ore
processing sites in Katanga, Democratic Republic of Congo. Journal of
African Earth Sciences. 77: 22-30
Michel T., 2005. Quelques notions
de la fertilisation. Ed. Conseil pour le développement de
l'agriculture du Québec, 50p.
Millenium
Ecosystem Assessment, 2005. Ecosystems and human well-being, Synthesis,
Disponible sur
http://millenniumassessment.org/documents/document.356.aspx.pdf
(consulté en Décembre 2015), 155 pp.
MINEO Consortium, 2000.
Review of potential environmentalcand social impact of mining
http://www2.brgm.fr/mineo/UserNeed/IMPACTS.pdf
Montgomery C.W., 2003.
Environmental Geology. Sixth edition. Mc Grow Hill companies, Inc.
USA, 306-310pp.
Mpundu M.M., 2010. Contaminations
des sols en éléments traces métalliques à
Lubumbashi (Katanga RDC). Évaluation des risques de contamination de la
chaine alimentaire et choix des solutions de remediation. Thèse de
doctorat, Université de Lubumbashi, 401 p.
Mujinya B.B., Adam M., Mees F.,
Bogaert J., Vranken I., Erens H., Baert G., Ngongo M., Van Ranst E., 2014.
Spatial patterns and morphology of termite (Macrotermes falciger) mounds in the
Upper Katanga, D.R. Congo. Catena 114, 97-106
Mujinya B.B., Mees F., Boeckx
P., Bodé S., Baert G., Erens H., Delefortrie S., Verdoodt A., Ngongo M.,
Van Ranst E., 2011. The origin of carbonates in termite mounds of the
Lubumbashi area, D.R. Congo. Geoderma. 165, 95-105.
Munyemba K.F., 2010.
Quantification et modélisation de la dynamique paysagère dans
la région de Lubumbashi : évaluation de l'impact
écologique des dépositions issues de la
pyrométallurgie. Thèse de doctorat, Université de
Lubumbashi, 284 p.
Nahmani J., Hodson M.E., Black
S., 2007. Effects of metals on life cycle parameters of the earthworm
Eiseniafetida exposed to field-contaminated, metal-polluted soils.
Environmental pollution. 149, 44-58.
Ngoy S. M, Mpundu M. M, Fauconc
M-P., Ngongo L. M., Visserd M., Colinet G., Meert P., 2010. Phytostabilisation
of Copper-Contaminated Soil in Katanga: An Experiment with Three Native Grasses
and Two Amendments. International Journal of Phytoremediation,
12:616-632.
Ngoy S. M., 2007.
Phytostabilisation des sols contaminés en métaux lourds au
Katanga: mise au point de Rendlia altera (Rendle) chiov. Mémoire de
DEA. Faculté des sciences agronomiques, UNILU. Inédit.
OCDE, 2004. Lignes directrices de
l'OCDE pour les essais de produits chimiques. 1-19 pp.
Ouadfel S., 2006. Contributions
à la Segmentation d'images basées sur la résolution
collective par colonies de fourmis artificielles. Thèse de doctorat
de l'université de Batna. Discipline : Informatique.
Oyedele D.J., Schjønning
P., Amusan A.A., 2006. Physicochemical properties of earthworm casts and
uningested parent soil from selected sites in southwestern Nigeria.
Ecological Engineering 28, 106-113.
Pelosi C., 2008. Modélisation
de la dynamique d'une population de vers de terre Lumbricusterrestris
au champ. Contribution à l'étude de l'impact des systèmes
de culture sur les communautés lombriciennes. Thèse de doctorat
en Sciences et Industries du Vivant et de l'Environnement, Agro Paris Tech,
95pp.
Pieri C., 1974. Premiers
résultats expérimentaux sur la sensibilité de l'arachide
à la toxicité aluminique. L'Agron. Tropic, 29, 6-7 :
635-696.
Pimentel D., 1994. Insect
population responses to environmental stress and pollutants. Environmental
Reviews 2, 1-15.
Pizl V., Josens G., 1995.
Earthworm communities along a gradient of urbanization. Environmental
Pollution 90, 7-14.
Pomeroy D.E., 1977. The distribution
and abundance of large termite mounds in Uganda. J. appl. Ecol. 14, 2,
465-475
Prabha K., Padmavathiamma,
Loretta Y.Li., 2007. Phytoremediation Technology: Hyper-accumulation Metals in
Plants. Water Air Soil Pollut. 184, 105-126.
Prince B., 2007. Exploitation
minière et déforestation : cas des territoires de sakania et
Kipushi. Table ronde organisée à Lubumbashi (salle familia)
le 10/02/2007.
PROMINE, 2014. Evaluation
stratégique environnementale et sociale du secteur minier en
République Démocratique Du Congo. Rapport, Kinshasa, le 14
février 2014.
Rabitsch W.B., 1997. Seasonal metal
accumulation patterns in the red wood ant Formica pratensis (Hymenoptera) at
contaminated and reference sites. Journal of Applied Ecology 34,
1455-1461.
Ranst V.E., Verloo M., Demeyer A.,
Pauwels J.M., 1999. Manual for the soil chemistry and fertility laboratory:
analysacal methods for soils and plants equipment, and management of
consumables. University of Ghent, Belgium.
Robert M., 1956. Géologie
et Géographie du Katanga. Bruxelles, 620p.
Roggy J.C., Moiroud A., Lensi R.,
adn Domenach A.M., 2004. Estimating N transfer between N2-fixing actinorhizal
species and the non-N2-fixing Punus avium under partially controlled
conditions. Biol. Fertil. Soils 39: 312-319.
Roose E., 1975. Erosion et
ruissellement en Afrique de l'ouest, vingt années de mesures et petites
parcelles expérimentales. multigr., ORSTOM, Adiopodoumé,
Côte d'ivoire.
Roy-Noël J., 1974. Recherche
sur l'écologie des Isoptères de la presqu'île du Cap-Vert
(Sénégal).I°- Introduction et Milieu. Bull. IFAN.
sér. A, T. 36, n°2, 291-371.
Rufus L.C., Minnie M., Yin M.L.,
Sally L.B., Eric P.B., Scott-Angle J., Alan J.M.B., 1997. Phytoremediation of
soil metals. Current Opinion in Biotechnology 8, 279-284.
Ruiz N., Lavelle P., Jiménez
J., 2008. Soil macrofauna field manual: Technical level. FAO and IRD,
100 pp.
Ruwet A., Agana P., Sengele N.,
Totiwe T., 1985. Paramètres moyens et extrêmes principaux du
climat des stations du réseau I.N.E.R.A. Tome 2, 46 p.
Salt D.E., Smith R.D., Raskin I.,
1998. Phytoremediation. Plant Physiol.Plant Mol. Biol. 49, 643-68
Samia M., El-Bahi, Amany T.,
Sroor, Najat F., 2013. Arhoma, Saher M. Darwish, 2013. XRF Analysis of Heavy
Metals for Surface Soil of Qarun Lake and Wadi El Rayan in Faiyum, Egypt, Open
Journal of Metal, 3, 21-25.
Sarr M., Agbogba C., Rusell-Smith
A., Masse D., 2001. Effects of soil faunal activity and woody shrubs on water
infiltration rates in a semi-arid fallow of Senegal. Applied Soil
Ecology. 16, 283-290.
Saussey M., 1966. Contribution
à l'étude des phénomènes de diapause et de
régénération caudale chez Allolobophoraicterica
(Savigny) (Oligochète Lombricien). Mem. Soc. Linn. De
Normandie, nouv. ser., sect. zool. 3, mémoire n°1,
1-158 pp.
Schmitz A., 1952. Essai sur la
délimitation des régions naturelles dans le Haut-Katanga.
Bulletin Agricole du Congo Belge. Volume XLIII, 3: 697-734.
Ségalen P., 1973.
L'aluminium dans les sols. Init. Dot. tech., O.R.S.T.O.M., Paris. no
22. 281 p.
Sims R.W., Gerard B.M., 1999.
Earthworms. FSC Publications, London, 167 pp.
Spurgeon D.J., Hopkin S.P.,
1999. Tolerance to zinc in populations of the earthworm Lumbricus
rubellus from uncontaminated and metal-contaminated ecosystems. Arch
Environ Contam Toxicol 37, 332-337.
Spurgeon D.J., Svendsen C.,
Rimmer V.R., Hopkin S.P., Weeks J.M., 2000. Relative sensitivity of life-cycle
and biomarker responses in four earthworm species exposed to zinc.
Environmental Toxicology and Chemistry. 19, 1800-1808.
Stewart A.D., Anand R.R., Laird
J.S., Verrall M., Ryan C.G., 2011. Distribution of Metals in the Termite
Tumulitermestumuli (Froggatt): Two Types of Malpighian Tubule
Concretion Host Zn and Ca Mutually Exclusively. PLoSONE 6(11):
e27578.
Swift M., Bignell D., (Eds).
2001. Standard method of the assessment of soil biodiversity and land-use
practice, International Centre for Research in Agroforestry, South East Asian
Regional Research Programme, ASB Lecture Note 6B, Bogor, Indonesia,
www.fao.org/ag/agl/agll/soilbiod/docs/manual-soil%20bioassessment.pdf
Sys C., 1960. La carte des sols du Congo
Belge et du Rwanda-Urundi. Pédologie. 10: 48-122 p.
Tembo B.D., Sichilongo K., Cernak
J., 2005. « Distribution of copper, lead, cadmium and zinc concentrations
in soils around Kabwe town in Zambia ». Elsevier, Chemosphere 63.
497-501.
Thieuleux L., 2006.
Biodisponibilité de l'azote en cultures bananières sur
nitisol. Application à la gestion de la fertilisation
azotée. Thèse en Sciences agronomiques, biotechnologies,
agro-alimentaire, Université des Antilles et de la Guyane, 105pp.
Thomas F., 2006. Rôle de
deux ingénieurs de l'écosystème : le termite
Cornitermes sp. Et l'annélide Andiodrilus pachoensis sur le
fonctionnement du sol dans le Sud-Est amazonien. Thèse de doctorat
en Sciences et Techniques Environnementales, Université Paris 12 Val de
Marne, 272 pp.
Tomlin A.D., Shipitalo M.J.,
Edwards W.M., Protz R., 1995. Earthworms and their influence on soil structure
and infiltration. In: Hendrix P.F. (ed.), Earthworm ecology and
biogeography in North America. Lewis Publ., Boca Raton, FL., 159-183
pp.
Tondho E.J., Lavelle P.,
2005. Population dynamics of Hyperiodrilusafricanus (Oligochaeta,
Eudrilidae) in Ivory Coast. Journal of Tropical Ecology. 21:
493-500.
Tondoh E.J., 2007. Effet de la mise
en culture des forêts secondaires sur les peuplements de
macroinvertébrés du sol dans la zone de contact
forêt-savane de Côte d'Ivoire. Sciences & Nature Vol.
4 N°2 : 197 - 204.
Villeneuve F.,
Désiré C., 1965. Zoologie. Ed. BORDAS, France, 324 p.
Wang Q.R., Cui Y.S., Liu X.M., Dong
Y.T., Christie P., 2003. Soil contamination and plant uptake of heavy metals at
polluted sites in China. J. Environ. Sci. Health Part AToxic/ Hazard.
Subst. Environ. Eng. 38, 823-838.
Warnecke F., Luginbuhl P.,
Ivanova N., Ghassemian M., Richardson T.H., Stege J.T., Cayouette M., et
al., 2007. Metagenomic and functional analysis of hindgut microbiota
of a wood-feeding higher termite. Nature. 450: 560-565
Watson J.P., 1974. Termites in
relation to soil formation groundwater, and geochemical pcospecting. Soils
and Fertilizers. 37, 5, 11 1-1 14.
Zirbes L., Collin C., Dufey J.,
Khanh T.P., Duyet N., Francis F., Lebailly F., Haubruge E., Brostaux Y., 2009.
Mise en relation de la diversité des vers de terre et des
caractéristiques du sol de Thua Thien Hue (Centre Vietnam). Tropical
Conservation Science Vol.2(3):282-298.
|
|



