|
1
DEDICACE ABSTRACT RESUME
L'aire d'étude est située de part et d'autre du
20ème parallèle. Elle est soumise à un climat
saharien à dominante océanique. La réalisation de 12
relevés a permis de rencontrer 6 espèces ligneuses reparties
comme suit: l'espèce la plus fréquente est Capparis decidua
avec (35.2%) suivie de Maerua crassifolia (22.44%) et Acacia tortilis (20.4%)
puis Boscia senegalensis (12.75%) et Acacia ehrenbergiana (8.67%) et enfin
Cocculus pendulus ( un seul individu). Le traitement statistique de ces
relevés phyto-écologique conduit aux espèces ligneuses
résistantes aux conditions de contrainte du milieu telle que Bosia
senegalensis et surtout Maerua crassifolia qui se
régénère bien. L'effet de contrainte est
déterminant sur la structure des ligneux, l'essentiel du peuplement
ligneux correspond à la strate inférieur à 5 m de hauteur
dans laquelle l'effet anthropique et broutage des camélins
empêchent un grand nombre d'individus de Maerua crassifolia et
Boscia senegalensis issus de régénération de se
développer et de se dégager de la strate arbustive. Les individus
âgés plus résistants à la sécheresse
(Acacia tortilis) car ils recouvrent mieux que les autres
espèces avec la plus grande surface térriere.

2
Je tiens à remercier tout particulièrement mon
responsable d'unité et mon encadrant Mr Mohamed ATER et mon co-encadrant
Mr Abdel jelil Ould HOUEIBIB pour leurs précieux conseils.
Je remercie également Mr Ahmedou Ould SOULE professeur
à l'ENS (École Normale Supérieure) pour son aide tout au
long de mon travail et je remercie Mr Ahmedou Ould EL MOUSTAPHA professeur
à la FST (Faculté des Sciences et Techniques) et coordinateur du
projet Bilan perspectif et le Groupe de Recherche des Zones Humides pour
l'organisation de ma mission sur le terrain. Je témoigne toute ma
reconnaissance à l'administration du PNBA pour ses
ressources bibliographiques
3
TABLES DES ILLUSTRATIONS
Liste des figures
Fig.1: la carte du PNBA
Fig.2: phénomène d'upwelling
Fig.3.a: répartition des relevés
de Oued Chibca sur la carte du PNBA
Fig.3.b: répartition des relevés
de Chami sur la carte du PNBA
Fig.4: répartition spatiale des
relevés et des espèces dans le plan des facteurs 1×2 de
l'Analyse Factorielle des Correspondances
Fig.5: répartition spatiale des relevés et
des espèces dans le plan des facteurs 1×3 de
l'Analyse Factorielle des Correspondances
Fig.6.a: dendrogramme des espèces
Fig.6.b : dendrogramme des relevés
Fig.7: Box plot de la hauteur du peuplement
Fig.8: Structure du peuplement
ligneux:répartition des effectifs (%) par classes de
Hauteur .
Fig.9, Structure du Capparis decidua:
répartition des effectifs par classes de hauteur
Fig.10, Structure du Maerua
crassifolia: répartition des effectifs par classes de hauteur
Fig.11, Structure du Acacia tortilis:
répartition des effectifs par classes de hauteur .
Fig.12, Structure du Boscia
senegalensis: répartition des effectifs par classes de hauteur.....
Fig.13, Structure du Acacia ehrenbergiana:
répartition des effectifs par classes de hauteur.
Fig.14, Structure du peuplement
ligneux:répartition des effectifs par classes de
Circonférence
Fig.15: Structure du
Capparis decidua: répartition des effectifs par classes de
circonférence Fig.16, Structure du Maerua
crassifolia: répartition des effectifs par classes de
circonférence .
Fig.17, Structure du
Acacia tortilis: répartition des effectifs par classes de
circonférence
Fig.18, Structure du
Boscia senegalensis: répartition des effectifs par classes
de
circonférence
Fig.19, Structure du
Acacia ehrenbergiana:répartition des effectifs par classes
de
circonférence .
Fig.20, répartition des modalités
en fonction des effectifs .
Liste des tableaux
Tableau 1:les quarante derniers
millénaires du quaternaire en Mauritanie occidental ..
Tableau 2 : répartition des
espèces inventoriées à la zone Chami-Chibca (au PNBA) .
Tableau 3:paramètres des espèces
ligneuses recensées au niveau de la zone
Tableau 4 : paramètres du peuplement
Tableau 5:valeurs propres et pourcentages
d'inertie
Tableau 6:statistiques simple du peuplement par
classe de hauteur
Tableau 7:statistique simple de la distribution
de Capparis decidua par classe de
hauteur .
4
Tableau 8: statistique simple de la
répartition de Maerua crassifolia par classe de
hauteur .
Tableau 9:statistique simple de
répartition de Acacia tortilis par classe de la hauteur ..
Tableau 10:statistique simple de distribution de
Boscia senegalensis par classe de
hauteur .
Tableau 11:statistique simple de
répartition de Acacia ehrenbergiana par classe de
hauteur .
Tableau 12:statistique simple de la
distribution du peuplement par classe de
circonférence
Tableau 13:statistique
simple de la distribution de Capparis decidua par classe de
circonférence
Tableau 14: statistique simple de la
distribution de Maerua crassifolia par classe de
circonférence ...
Tableau 15:
statistique simple de la distribution de Acacia tortilis par classe de
circonférence
Tableau 16: statistique simple de la
distribution de Boscia senegalensis par classe de circonférence
Tableau 17: statistique simple de la distribution de
Acacia ehrenbergiana par classe de
circonférence
Tableau 18: fréquences et effectifs par
modalité
5
INTRODUCTION
D'une étendue comparable au delta du Nil
(12.000km2 dont 6.300km2 maritime et 5.700km2
terrestre), le Parc National du Banc d'Arguin (PNBA) occupe la moitié
orientale du Golfe d'Arguin. Partagé, de façon presque
équivalente en milieu terrestre et marin, le PNBA est l'un des plus
grands Parcs nationaux d'Afrique. Il représente 30% du linéaire
côtier de Mauritanie et 60% des petits fonds marins inférieurs
à 20m.
Le Parc est aussi un témoin unique du passé
saharien humide: collecteur d'anciens écoulements, il apparaît
comme la coalescence d'anciens estuaires; avec ses chenaux et ses mangroves
(les plus septentrionales d'Afrique) et ses prairies à spartines (les
plus méridionales de la côte ouest-africaine), il fonctionne comme
une charnière biogéographique, aux frontières d'influences
contrastées actuelles ou passées
La partie terrestre, témoin d'un « morceau »
du désert saharien océanique, est, avant tout, une combinaison de
dunes vives, de regs, de sebkhas, de zones planes, gréseuses ou
calcaires. En dépit d'un nombre d'espèces végétales
sensiblement plus important (plus de 200 espèces),
l'écosystème terrestre présente une productivité
beaucoup plus faible que celle du milieu marin. En bordure de mer la
végétation terrestre est relativement abondante profitant d'une
certaine humidité sous forme de rosée ou de brouillards. Dans les
lits des anciens oueds, subsiste une végétation vivace. A ces
plantes vivaces vient s'ajouter les plantes éphémères dont
l'apparition est tributaire des rares averses. La faune y est d'une
rareté extrême.
Ce territoire a beaucoup souffert des sécheresses des
dernières décennies, même si l'on assiste depuis quelques
années au retour d'une pluviométrie un peu plus abondante. Il
n'est parcouru que par quelques pasteurs et éleveurs ; il fut beaucoup
plus occupé par le passé, comme en atteste les très
nombreux sites archéologiques ; mais il est très mal connu et
fortement délaissé.
Notre travail a pour but d'apporter une contribution modeste
à l'étude de la végétation dans les zones de Chibca
et Chami. Il reste cependant très limité car nous avons
été obligé de faire les relevés pendant la mauvaise
saison et donc à nous limiter aux ligneux.
Le travail que nous présentons s'articule autour de
trois principales parties:
La première portant sur le cadre de l'étude : il
s'agit pour nous de dresser les différents aspects physiques
(géologie, géomorphologie, climatologie, ...) et vivants ( faune
,flore et humain) composant le PNBA c'est également l'occasion de
présenter un bref aperçu des aires protégées en
Mauritanie, où l'aridité est l'une des contraintes majeures pour
toute activité de conservation, il est opportun de voir ce que fait
l'état Mauritanien en matière de stratégie sur la
biodiversité dont la conservation internationale a été
signée en 1999. La deuxième partie se présente en
étude de la composition floristique, (diversité, recouvrement,
6
densité, surface terrière, indices de
diversité,...). La troisième et la dernière partie parle
de la répartition des individus selon la taille et selon le substrat et
détermine l'état de régénération des
peuplements.
7
CONTEXTE GENERALE SUR LA MAURITANIE
La Mauritanie s'étend sur une superficie de 1.030.000
km2 entre les latitudes N 27° et 14° 45' et les longitudes
W 5° et 17°. Pays de transition entre le Sahara et le sahel, la
Mauritanie est limitée à l'Ouest par l'océan atlantique au
Nord par l'Algérie et au Nord Ouest par le Maroc et à l'Est et
Sud Est par le Mali, au sud par le Sénégal. La Mauritanie pas
totalement désertique dans sa partie nord et sahélien dans sa
partie sud, se caractérise par un climat généralement
chaud et sec marqué des hivers relativement doux (avec des
températures minimales moyennes de 19 à 23C°) et des
périodes d'hivernage très courtes (environs 3mois). En saison
sèche, les températures dépassent le seuil de 40C°
dans la quasi-totalité des régions du pays (exception faite de
Nouadhibou), le domaine sahélien connaît des précipitations
annuelles comprises entre 150 et 600mm alors que le domaine saharien se
caractérise par une pluviométrie annuelle inférieure
à 150mm.
La Mauritanie est habituellement divisée en cinq zones
bioclimatiques ou écologiques
Zone aride ou zone saharienne :
Elle correspond à la zone de pluviométrie
inférieur à 150 mm à l'exception de la façade
maritime et couvre actuellement 75% de la superficie du pays.
Zone sahélienne Ouest :
Elle correspond à la zone comprise entre les
isohyètes 200 et 400 mm et couvre 7% de la superficie du pays, elle
s'étend depuis la limite sud de la zone aride jusqu'à la limite
Nord de la zone du fleuve.
Zone sahélienne Est :
Elle correspond les parties Sud des 4 mitages ce qui couvre
une superficie de 22000Km2 soit 2% de la superficie nationale, l'agriculture
constitue l'essentiel de l'activité économique du pays. Elle est
basée principalement sur la culture irriguée et la culture
pluviale. C'est aussi la zone qui recèle le plus de ressources
forestières avec la présence de nombreuses forêts
classées.
Zone littorale :
Elle correspond à la zone comprise entre Nouadhibou et
Keurmacéne qui s'étend sur environ 8000 km de long et 50 km de
large cette zone se caractérise par une activité
économique essentiellement tournée vers les ressources
halieutiques. Toutefois, la présence des deux principales villes du
pays
8
Nouakchott et Nouadhibou confère à cette zone un
développement commercial et industriel important. Cette zone
recèle une richesse écologique inestimable puisqu'elle abrite les
principales aires protégées du pays : le Parc National du Banc
d'Arguin, la Parc National du Diawling, le Chat-tboul et la réserve
satellite du Cap Blanc (Plan directeur du PNBA, 1995 in BLANDINE,
2003).
Les vents :
Le territoire mauritanien est soumis au cours de
l'année à l'alternance des trois régimes de vents suivants
:
L'alizé maritime : de direction dominante
Nord-Est/Sud-est qui a pour origine l'anticyclone des Açores et souffle
sur le littoral tout au long de l'année c'est un vent frais qui se
dessèche au fur et à mesure qu'il progresse vers
l'intérieur du pays.
L'alizé continental appelé aussi Harmattan : de
direction dominante Nord-Est/Sud-Ouest, ce vent provient des zones de haute
pression qui règnent sur le Sahara en hiver et sur la mer
Méditerranée en été. C'est un vent très sec
dont la température varie du jour à la nuit, il est porteur de
poussière (brume sèche) ou de sable (vent de sable)
Les vents de Moussons: générés par
l'anticyclone de sainte héléne ils ne soufflent qu'une fois par
an, lorsque le Front Inter Tropical (FIT) atteint sa position la plus
septentrionale, durant le mois de Juillet et Août, ils sont porteurs des
précipitations annuelles qui touchent le tiers inférieur du pays
avec une décroissance d'Est en Ouest
La pluviométrie
L'essentiel des pluies est fourni par la mousson au sud. Le
nord ouest du pays peut cependant être le siège de pluies
d'intensité variable qui font suite à des « gouttes froides
», sorte de coulée d'air polaire (froid et saturé en
humidité) en provenance du nord de l'Europe et qui parvient à
s'insinuer entre les 2 zones de haute pression (Açores d'une part et du
Sahara de l'autre). Cependant, la Mauritanie est caractérisée par
une forte aridité mais aussi un contact pluviométrique important
entre la partie Nord et la partie sud.
La température
Elle varie selon les zones écologiques, cependant une
différence importante de température est enregistrée entre
les milieux littoral et continental. En effet : Le littoral est
caractérisé par des températures fraîches, voire
quelques fois froides, des écarts diurnes et nocturnes réduits et
une humidité constante les
9
maxima de température sont enregistrés au mois
de septembre alors que les minima se situent aux mois de Décembre et de
Janvier.
La partie continentale se différencie par des
températures beaucoup plus contractées sous l'action de la
mousson, un noyau de chaleur intense, d'abord limité au Sud-est du pays
aux mois d'Avril et de Mai, glisse vers le Nord en suivant le FIT pour occuper
sa position la plus septentrionale aux mois de Juillet et d'Août. En fin
il rétrograde en direction du sud en septembre sous l'influence
boréal. Sur le plan géologique, la Mauritanie est formée
de grandes étendues désertiques, et des massifs montagneux parmi
lesquels on peut citer ceux du Tagant, de l'Assaba, de l'Affolé, de
l'Adrar ou encore du Tiris Zemour ces derniers récelent les altitudes
les plus importantes du pays puisqu'ils culminent à 915m au niveau de la
Kédiet El-jill.
La géologie de la Mauritanie comprend quatre grands
ensembles :
V' Le socle cristallin précambrien
représenté par la dorsale de Rguibat qui couvre tout le nord du
pays.
V' La chaîne hercynienne des mauritanides,
formé de matériel cristallin et métamorphique, bordant le
socle au nord-ouest et caractérisé par des mouvements techniques
latéraux importants,
V' Le bassin paléozoïque et secondaire de
Taoudenni à l'Est, dont la partie occidentale présente des
formations inclinées vers l'Est,
V' Le bassin côtier
sénégalo-mauritanien d'âge secondaire, tertiaire et
quaternaire orienté vers l'atlantique.
Les ressources en eau sont très limitées, tant
au niveau des eaux de surface que des eaux souterraines. Le réseau
hydraulique du pays est endoreique dans son ensemble, excepté le Fleuve
Sénégal et ses affluents. Le Fleuve Sénégal se
caracterise par les débits variables qui peuvent devenir nuls pendant
une partie de l'année, au cours de la saison chaude (Mai- Juillet) ;le
principal affluent du Sénégal est le Gorgol. Les eaux
souterraines sont constituées de plusieurs nappes aquiféres
d'inégale importance (le centre et l'Est du pays est constitué
par un socle rocaileux, dont l'exploitation, très difficile et
aléatoire à l'avancée du desert et à l'implantation
désordonnée des points d'eau, phénoménes qui
s'ajoutent aux effets de la concentration humaine et animale.
Les ressources pédologiques se dégradent aussi
de maniére croissante, compte tenu de l'interference de plusieres
facteurs, notamment le déficit hydrique et la disparition progessive du
couvert végétal (herbacé, arbustif et arboré).
10
1. PRESENTATION DU MILIEU D'ETUDE
Le PNBA crée en 1976, devenu site « Ramsar »
en 1982 et site du patrimoine mondial de l'Unesco en 1989, le Parc National du
Banc d'Arguin est régi par une Loi 2000/24 qui a été
offerte symboliquement par le Gouvernement mauritanien comme don à la
Terre le 14 mars 2001.
Au territoire proprement dit du Parc, on doit ajouter le site
de la Réserve satellite du Cap Blanc, au sud de Nouadhibou. Son
rôle premier est d'assurer la préservation de la faune marine et
côtière et, plus spécifiquement, celle des phoques moines
qui vivent à ses abords. Ils constituent l'une des dernières
populations viables, d'une espèce qui compte parmi les plus
menacées de la planète.
Le PNBA est un établissement public à
caractère administratif (EPA). Il est sous la tutelle directe du
Secrétariat Général du Gouvernement. L'administration du
Parc dispose d'un siège à Nouakchott, d'un centre d'accueil et de
réunion à Mamghar, d'une base de vie et d'accueil pour les
scientifiques à Iwik, de huit postes dans les villages et d'une antenne
à Nouadhibou.
La nouvelle loi qui régit le Parc (Loi 2000/24),
définit comme principaux objectifs du Parc de contribuer au
développement national, d'appuyer le développement des
populations résidentes et le maintien de l'intégrité et de
la productivité des ressources naturelles, d'assurer la protection, la
conservation et l'aménagement des différents
écosystèmes qui constituent son territoire. Cette loi, qui
souffre encore de l'absence de Décrets d'application, n'en est pas moins
déjà partiellement opérationnelle; elle est
considérée comme allant dans le sens souhaité par ses
gestionnaires.
Parce qu'il représente un site exceptionnel,
d'intérêt mondial, les appuis extérieurs sont
également essentiels. La communauté internationale a toujours
été présente et ce, depuis le début, aux
côtés du Gouvernement mauritanien. La liste des partenariats du
Parc est l'une des plus importante pour une aire protégée
d'Afrique occidentale.
Parmi ses partenaires traditionnels on trouve, de façon
relativement constante, la France (au travers de plusieurs institutions
étatiques ou associatives), l'UNESCO (Centre du Patrimoine mondial),
l'UICN, le WWF, l'Union Européenne, le PNUD, et le FIDA et surtout la
FIBA. La Fondation Internationale du Banc d'Arguin a été
créé en 1986 pour aider le Parc. Elle se caractérise par
le fait que le Directeur du Parc en est membre d'office et que le Chef de
l'Etat mauritanien en est membre d'honneur.
Aujourd'hui, et depuis quelques années le Parc
bénéficie de nouveaux partenaires techniques et financiers :
l'Allemagne, l'Espagne et les Pays Bas. Ils apportent, à des niveaux
différents, des contributions ciblées à cet effort
international. La Banque mondiale, la Belgique, le Canada, ont, par ailleurs,
manifesté un intérêt récent.
11
Pourtant, à part son importance pour les oiseaux,
internationalement reconnue, le PNBA constitue aussi le refuge le plus
important de la sous-région pour la faune marine en
général et pour plusieurs espèces de poissons en
particulier, dont la pêche constitue un des plus importants supports
économiques de la Mauritanie et des pays voisins. Plusieurs programmes
de recherche ont permis de mieux connaître les populations d'oiseaux qui
fréquentent la zone littorale, le fonctionnement de
l'écosystème marin, certaines populations de poissons
ciblées par les pêcheurs et leurs stratégies
d'exploitation.
.
1.1. Le milieu physique
Le PNBA, situé de part et d'autre du
20ème parallèle, il longe le littoral atlantique
mauritanien sur plus de 180 Km et couvre une superficie de 12000 km2
de manière a peu prés équivalente entre un domaine
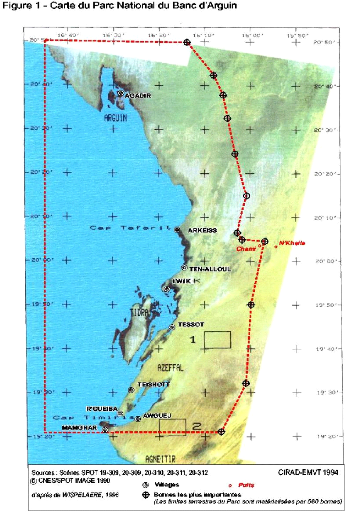
terrestre et un domaine maritime (Fig.1).
Pour bien visualiser les situations caractristiques du PNBA,
précisons que les territoires maritimes englobent en plus de l'element
aquatique, plus de 6000 km2 de vasiéres découvrantes
et près de 300 km2 de sites insulaires dont le plus grand
occupe à lui seul 250 km2 et le plus petit 20 km2
et quinze îles qui parsèment le banc, dix interéssent
veritablement l'avifaune reproductrice, ce qui represente une superficie
maximale de seulement 36 km2 (MAHE, 1985).
12
13
1.1.1. Le climat
Au niveau du PNBA il n'y a pas de station
météorologique installée, pour cela une approximation
s'effectue à partir des stations météorologiques de
NOUAKCHOTT et de NOUADHIBOU
Le PNBA est sous l'influence d'un climat régional aride
à dominante océanique L'alizé maritime boréal est
le facteur déterminant de ce désert côtier, ceci induit:
? Des températures relativement modérées
à faible amplitude annuelle avec des moyennes maximales de 28 et
32C° et des moyennes minimales de 16 et 19C° respectivement pour les
villes de NOUAKCHOTT et NOUADHIBOU
? Une humidité importante avec une forte
nébulosité
? La quasi omniprésence du vent de dominante NO
à NE avec une vitesse qui atteint son maximum aux mois de Mai et de Juin
9m/s et son minimum au cours des mois de Novembre et de Décembre 6m/s
? Les précipitations généralement
localisées entre le mois de Juillet et de Septembre y sont faibles, des
moyennes annuelles d'environ 35 mm à NOUADHIBOU et 100 mm à
NOUAKCHOTT
? Une humidité relative est forte conséquemment
aux influences marines, de grandes variations sont à noter sur une
période de 24h. Les valeurs pour NOUAKCHOTT sont plus faibles, mais les
conditions du Parc semblent identiques sinon parfois localement
supérieures à celles de NOUADHIBOU
D'après QUEZEI 1965, l'évaporation annuelle
à NOUAKCHOTT est de 2275 mm les maximums journaliers concernant le mois
de Décembre, et les minimums le mois de Juillet.
Environnement océanique
Le Parc est soumis de fait à trois courants
différents qui correspondent à deux saisons hydrologiques
Le courant des canaries : c'est le principal courant
qui affecte de PNBA descend depuis le Sud des cotes ibériques jusqu'aux
îles du Cap Vert avant de se transformer en courant équatorial de
l'atlantique Nord (MALLE, 2005). Il est présent toute l'année et
s'accentue durant la saison froide (ou plutôt fraîche) avec des
eaux marines dont la température se situe entre 17 et 20c0
Le courant de guinée :
caractérisé par des eaux chaudes dont la température
moyenne 29.5C0 (Domain, 1980 in MALLE, 2005) et
résulte de l'influence des pluies de mousson et de l'apport des fleuves
en zone tropicale humide eaux dites«Ibériques» poussées
par le vent de la mousson, elles viennent baigner les côtes
mauritaniennes entre le Cap Blanc en Août/Septembre
14
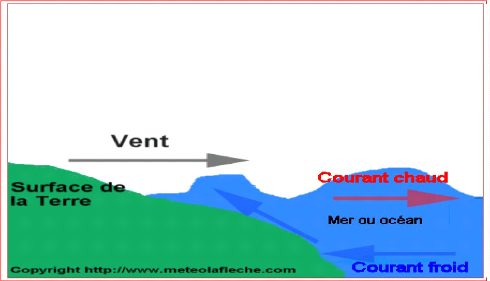
L'upwelling :il s'agit du phénomène
hydrodynamique permanent le plus important de la côte mauritanienne,
rencontré surtout entre le Cap Blanc et le Cap Timiris, cette
remontée d'eau froide et moyennement salée est liée au
reflux vers le large, sous la poussée des alizés continentaux,
des eaux chaudes de surface, qui laissent ainsi la place à des eaux
profondes et riches en nutriments (Fig.2), qui favorisent le
développement d'une chaîne trophique remarquable et est notamment
responsable de la richesse ichtyologique de ces côtes qui sont
considérées comme étant parmi les plus poissonneuses du
monde. Cette richesse ichtyologique entraîne généralement
une abondance de l'avifaune qui constitue un des éléments
remarquables à l'origine de la création du Parc.
Fig. 2 : Phénomène d'upwelling
1.1.2. Géologie
Le PNBA se situe dans la bordure ouest du bassin
Sénégalo-Mauritanien. L'histoire géologique de ce bassin
est marquée par une série de transgressions et de
régressions marines accompagnées de variations climatiques
considérables (GOWTORPE, 1993) l'examen des principaux
étages a permis de retracer les principaux traits géologiques de
cette région :
15
Tafaritien : le 1er épisode
transgressif (200.000 an B.P) lors de cette transgression la mer envahit un
vaste golf le golf de Tafoli s'étendant du delta du
Sénégal au sud jusqu'à l'actuelle frontière de la
Mauritanie au nord, ce golf s'enfonce vers l'est sur plus de 20 km au niveau de
NOUAKCHOTT.
Akcharien (150.000 à 100.000 B.P) à la
suite d'un soulèvement implorant la mer se retire ce qui fait
l'assistance à une phase d'aplanissement aboutissant à la
formation d'un reg à cailloutés de quartz et pheldispadh.
Aioujien (depuis 10.000 à 70.000 BP) c'est la
2ème régression marine du quaternaire mauritanien
intense deux golfs : Souhel El-Abiod (bordure Est de la baie de lévrier)
et Tafoli -inchiri séparés par une zone émergée
:
Aguerguerien (70.000 à 40.000 BP)
l'épisode régressif correspondant à cet étage se
traduit par une entaille des dépôts de l'Aioujien, certains
auteurs placent pendant cette période le début de
l'édification des grands massifs dunaires
Inchirien (40000 à 30000 B.P) débutant
par une phase d'encroûtement et d'aridité.
Ogolien (20.000 B.P) : constitue le maximum de la
régression marine (-120 m) dans lequel les lacs et les rivières
sont asséchés
Tchadien (vers 9000 B.P) au climat aride de l'Ogolien
succède, après une remontée du niveau de la mer
jusqu'à la cote -20, un épisode humide correspondant à la
mise en place de petits lacs dans les dépressions inter dunaires. Les
sédiments qui en résultent sont de nature argilo-calcaire
à forte teneur en sable pouvant être considérés et
renfermant des gastropodes
Nouakchottien (6000 à 4000 B.P) lors de la
transgression marine du
quaternaire, la mer nouakchotienne va atteindre la cote 3 m,
le golf de Tafoli s'est insinué dans les dépressions inter
dunaires. Certaines espèces euryhalines se développent en milieu
lagunaire chaud ; prennent une importance considérable (Tricat, 1961),
à la fin du Nouakchotien vers 4000 B.P, le régime des vents
change et les deux golfs du Tafoli vont évoluer vers une lagune. Un
cordon littoral s'édifiant en travers des baies. Le confinement ainsi
obtenu se traduit au niveau de la faune par une prolifération des
espèces euryhalines et un nanisme d'autre formes (Anadara
sensilis).
Tafolien (4000 à 2000 B.P) une
régression vers le niveau actuel commence du Tafolien accompagnée
par une fermeture de la quasi-totalité des golfs qui deviennent
sursalés et évoluent en Sebkhas. Les dernières
modifications jusqu'à
16
l'actuel consisteront en un remaniement des dunes ogoliennes et
des dépôts de gypse Tafolien. (Tableau 1)
Tableau1: Les quarantes derniers
millénaires du quaternaire en Mauritanie occidental
|
Age (Année B.P)
|
Etage
|
Grands faits géologique et climatique
|
|
0
10 000 20 000 30 000 40 000
|
Actuel
|
Aridification croissante et réactivations des ergs
|
|
Tafolien
|
Aridification et régression marine
|
|
Nouakchottien
|
Transgression marine et dépôt lacustre
|
|
Tchadien
|
Humidité et transgression marine Fixation des ergs
|
|
Ogolien
|
Régression marine importante et formation d'un vaste
erg dont les dunes sont orientées SW/NE
|
|
Inchirien
|
Transgression marine importante
|
|
|
(BLANDINE, 2003)
1.1.3. Géomorphologie
Le PNBA présente des caractéristiques simples,
les différentes formes que nous avons rencontrées ont une forte
influence sur la répartition de la végétation au sein du
milieu.
En effet la végétation est surtout
différente de part et d'autre d'un accident topographique. La
différence peut aller de la simple densité de répartition
à un changement de la flore toute entière.
Géomorphologie sous marine :
L'ensemble de la zone du Parc constitue un complexe
anciennement laguno-marin comprenant des hauts-fonds dont la profondeur moyenne
est inférieure à 15 m
Géomorphologie littorale :
- La côte parfois rocheuse avec des dunes de sables vifs
qui vont se jeter dans la mer
17
- Les principaux Caps (Tafarit, Tagarit...etc.) sont d'anciens
îlots rocheux rattachés au continent séparés par
d'importantes dépressions au sols gypseux moux
- le Cap Timiris non rocheux se trouve au contact de l'erg
Azefal, Agneitir et de l'Océan.
Géomorphologie continentale :
Cette partie du PNBA se résume essentiellement en un
désert de sable et de pierres. Le Nord du Parc est constitué de
buttes et de quelques bas plateaux limités vers l'intérieur par
le socle précambrien. L'ensemble de ces deux formations est recouvert
par les dunes vives des ergs Azefal, Akchar et les dunes fixes de
l'Agneitir.
1.1.4. Hydrologie
(PAG du PNBA 2003-2008)
Eaux souterraines:
La zone du PNBA est alimentée par deux sources
hydrologiques essentielles : Le bassin côtier et la chaîne de
Mauritanide. Le premier constitué de grès d'argiles et de
calcaires recèle d'importantes ressources en eau sous forme de nappes
superposées, les nappes de Benichabs et de Boulenoir en constituent des
exemples .Ces ressources en eau peuvent être fragilisées par la
proximité des eaux salées de la mer et les risques de son
éventuelle intrusion. La seconde est composée de roches
magmatiques et métamorphiques souvent imperméables.
Néanmoins la fracturation et l'altération superficielles sont de
nature à fragiliser ces aquifères vis à vis des
pollutions.
Eaux superficielles:
Le PNBA est une vaste formation de hauts fonds couvrant plus
de 6000 km2 dont environ un tiers sont effectivement inclus dans les
limites du Parc. La hauteur d'eau sur le banc ne dépasse pas 5 m aux
marées de vives eaux les plus fortes, ils sont pour l'essentiel mobiles.
Seules quelques portions sont fixées et fossilisées d'eau douce
faisant évoluer cette zone vers un milieu de type lagunaire,
exclusivement soumis au régime de marées.
Hydrologie marines:
Trois milieux différents peuvent être
distingués : (MAIGRET, 1986)
18
- le Nord-ouest constitué par des hauts fonds où
les bancs de sable sont immergés, la profondeur moyenne est de 4m mais
les chenaux peuvent atteindre 12 a 15 m. Les fonds sont majoritairement
sablo-vaseux portant d'immenses herbiers à phanérogames.
- le Nord-Est vers l'est du milieu précédent est
constitué d'une poche dont la profondeur maximale est de 15m. Les fonds
sont constitués de sables et de vases avec quelque formation rocheuses
en bordure de rivage.
-le Sud du Cap Blanc est constitué par une côte
sablonneuse et des vasières découvertes à marée
basse.
1.2. Milieu vivant
1.2.1. Composantes végétales
En se basant sur la répartition de la
végétation de la mer vers le continent et selon l'organisation
concentrique au niveau des sebkhas on distingue :
Phytoplancton
Il diminue depuis la mer vers les hauts fonds : les
microplanctons semblent dominer avec l'ensemble particulier Skeletonema
costatum (qui occupe majoritairement la zone centrale) alors que les
nanoplanctons sont représentés par Cocolitoporidées
(qui se trouvent dans les parties orientales). Dans les chenaux ce sont
les cyanobactéries et les diatomées qui dominent.
Végétation côtière
:
? Essentiellement représentée par les
Cymodocées (Cymodosa nodosa et Holodule wrightii et
les Zostéracées (Zostera noltii). Ces derniers se
composent d'immenses herbiers et constituent un des principaux facteurs de la
richesse halieutique du Parc.
? Une superficie importante recouverte par Avicenia
qui constitue les
mangroves Ouest africaines les plus septentrionales.
Ces mangroves qui appartenant pour la plupart au genre Rhizophora se
rencontrent dans le Parc uniquement au niveau du Cap Timiris et au Nord de
l'île Tidra
? Les espèces supra-littorales qui sont situées
sur les borelets de sables littoraux et les cordons dunaires. Il s'agit
principalement de Sporobolus spicatus, Atriplex halimis, Lycuium
intricatum, Traganum moquinii, Zygophyllum waterlotii, Nitraria retusa.
Flore continentale :
19
Malgré l'aridité prévalant dans la zone
du PNBA, la diversité floristique est étonnante sur plus de 200
espèces recensées (voir Annexe), on peut rencontrer des arbres et
arbustes typiques de zone aride (Acacia tortils, A. ehrenbergiana
Capparis decidua, Balanite aegiptiaca, Boscia
senegalensis, Maerua
crass,folia, Calligum comosum, Euphorbia
balsamifera) et des graminées (Panicum turgidum , Stipagrostis
sp., ) . Cette végétation se diffuse en densité
faible quand elle occupe de vastes étendues et se contracte suivant le
tracé de lit d'oued ancien où elle peut présenter des
densités importantes. Ces végétaux se distinguent en
fonction du substrat (CORREORA, 2001).
La végétation des sables dunaires et
para- dunaires
Les espèces telles que Stipagrostis pungens et
Cornulaca monacantha sont caractéristiques tandis que Calligum
comosum et Leptadenia pyrotechnica paraissent relativement peu
communs. Par contre les sables diffusés peuvent admettre de beaux
peuplements d'Euphorbia balsamifera
La végétation des grands lits d'oueds
Les oueds importants sont très rares dans le Parc (Oued
Zidine, Chibca, Nouaferd) : il s'agit de tracés hydrographiques en voie
d'asphyxie par ensablement et même le plus souvent de zones
d'épandages plus ou moins linéaires et très plates en
surface par une ligne d'arbres Acacia tortils raddiana, Acacia
ehrenbergiana (rare), Caparis decidua (Caractéristique)
Maerua crassifolia, Boscia senegalensis. L'absence au moins
apparente des Balanites (présent à l'extérieur du
Parc au nord, aux abords de Hassi Adeibt N'sil) reste surprenante, les arbres
sont accompagnés de deux graminées (Panicum turgidum et
Stipagrostis acutiflora), de divers chaméphytes
(Nicularia, Chrozophora, Fagonia, Crotalaria saharae) et
d'herbacées (Limeum, etc.)
La végétation des zones
d'épandages sablo argileuses
(BLANDINE, 2003)
Les cuvettes sablo -argileuses recèlent une flore
particulière ; celle dite Graret lehmir aux environ d'Iwik et à
proximité de la mer (fond de la baie d'aouatil ), présente des
espèces telles que Nuclaria perrini, Salsola sieberi Suaeda
vermiculata, Zygophyllum waterlotii, Corcorus depressus, C. triloculais,
Euphorbia dracumculoides, Caylusea hexagyna, Lotus jolyi, L. glinoides,
Psoralea plicata (caractéristique,) centaurea peraotti,
Megadhtoma pusillum, Convolvulus prostratus, Cresa crtica, Asphodelus
tennifolus, Dipcadi sp.
20
La végétation des regs
Les plaines de graviers où à proximité du
littoral de coquilles marines sub-fossiles (Arca sensilis, Donax
rugosus, etc.) sont couvertes d'une steppe buissonnante lâche
à Zygophyllum waterlotii et chénopodiacées
(Traganum nudatum, Suaeda vermiculata Salsola baryosma et
S.longifolia Nuclaria perrini), avec un cortège
d'espèces sahariennes banales, chaméphytes ou
éphémérophytes (Fagonia sp., Heliotropuim bacciferum,
Monsonia nivea Crotolaria saharae , Pergularia, Asthenatherum,
Stipagrostis, etc.)
La végétation des hamadas
Il ne semble pas exister en fait de véritables hamadas
dans les limites du Parc en dehors des talles sommitales de surface très
réduites des îles Kiaone. Les plateaux du Tafaritien (Mounane,
Aguilal, Dlo Amotaye, etc.) sont plutôt à classer parmi les ergs.
En dehors du Parc, les niveaux calcaires et calco -gréseux de l'Aioujien
constituent par contre des hamadas (Timazine, Berouaga, El-Aiouj Boulenoir,
etc.). La végétation pérenne est ici encore une steppe
buissonnante, à peu prés de même composition que celle des
regs plus méridionaux, mais vasculaires, qui confèrent au paysage
un aspect régional caractéristique.
La végétation des reliefs
rocheux
La végétation des falaises, des éboulis
et des pentes rocheuses mérite sans doute de constituer une mention
particulière, malgré le très peu de surface qu'elle
occupe, car les terrains récents du Parc restent sans reliefs
importants. Les affleurements du Tafaritien peuvent se présenter sous
forme de buttes, de petits plateaux et très localement, en bordure de
mer, de falaises littorales.
1.2.1.1. Adaptation à la sécheresse
(GOWTHORPE, 1993)
Dans les régions arides, le facteur limitant n'est pas
la température mais la disponibilité de l'eau, la période
critique n'est donc pas «l'hiver»-au sens occidental du terme-, mais
la saison sèche. En période sèche, les
végétaux désertiques ont deux alternations : Pour les
végétaux temporaires, les parties aériennes vont
complètement disparaître et seuls les graines ou les organes
souterrains (bulbes ou rhizomes) resteront en vie ralentie, sans pouvoir
profiter ni de la chaleur ni de la lumière qui deviennent alors des
facteurs aggravants, ni des éléments nutritifs du sol qui peuvent
être absorbés faute d'eau pour les dissoudre. Alors que les
végétaux permanents, qui conservent leurs parties
aériennes mais un ensemble de dispositif anatomiques et physiologiques
(encore
21
mal connus) viennent assurer une meilleure alimentation en eau
et une réduction des pertes par évaporation.
Résistances aux autres facteurs
Les plantes ont aussi à lutter contre d'autres facteurs
:
La température : en milieu sec, la température
devient un facteur aggravant car elle augmente l'évaporation.
Le vent : il intervient par sa violence, par les particules
qu'il transporte et qui peuvent déchirer les parties aériennes
des plantes, et par les remaniements qu'il provoque dans le sol et par le fait
qu'il peut également chausser les végétaux, mettant
à nu leurs parties souterraines et les exposent ainsi à la
dessiccation( d'autant plus qu'il augmente énormément
l'évaporation).Par contre son action peut être favorable par
exemple lorsqu'il provoque un important dépôt de sable sur des
sols salés qui étaient stériles ou bien lorsqu'il
contribue à la dissémination des graines .
Le sel : lorsque la salure est forte, seules peuvent vivre une
petite minorité de plantes adaptées et notamment les
Chénopodiacées.
Les parties comestibles des plantes (feuilles, rameaux, tiges,
écorces...) présentent pour les herbivores du Sahara une
importance particulière. Si un certain nombre de plantes sont
respectées par ce qu'elles sont malodorantes ou acres d'autres pourtant
réputées fortement toxiques ne sont pas toujours
évitées par les animaux...
1.2.1.2. Phytogéographie
Le Banc d'Arguin peut être considéré comme
un véritable carrefour biogéographique où la surimposition
de plusieurs gradients détermine différentes subdivisions
floristiques.
Le Professeur TH. Monod considère cette zone comme une
limite de haut niveau hiérarchique et l'ensemble des naturalistes
estiment qu'elle constitue une charnière entre deux empires floraux : le
Paléarctique et Paléo - tropique. En effet, beaucoup de
végétaux (comme d'autre êtres vivants) trouvent ici leur
limite de répartition, soit septentrionale pour certaines espèces
tropicales (notamment Avicenia africana), soit méridionale pour
des espèces d'origine tempérée ainsi Spartina maritima
dont les prairies jouxtent cette mangrove Avicenia.
Autre la confrontation des espèces
tempérées, des espèces tropicales, ce gradient Nord-sud
fait se juxtaposer des espèces franchement sahariennes (Cornulaca
monacantha) et des espèces sahéliennes (Sancris
bifloris).
De plus, la présence océanique introduit un
gradient Ouest Est : les condensations occultes (brouillards et rosées)
relativement fréquentes et importantes favorisent la croissance de
certains végétaux sur la frange littorale
22
(on trouve même des champignons et des lichens notamment
sur les pieds d'Euphorbia balsamifera)
1.2.2. La faune Invertébrés
Le Parc national du banc d'arguin abrite plusieurs types de
crustacés dont les plus importantes sont les langoustes Palunirus
mauritanicus (langouste rose). Palinirus regius (langouste verte)
et Palinirus charlestoni( langouste du Cap vert), des cigales
(Scyllaridés) et des Crabes (Ocpodidea). Des crevettes
ont également été signalées dans le PNBA à
proximité du Cap El sass. Dans les zones exondables, le crabe Uca
tangeri est dominant (Francour, 1998 in PAG 2000-2008). En zones
inondées la grande majorité de la macrofauna est
constituée de crustacés décapodes (crevettes et quelques
crabes)
Poissons
Les poissons (faune dite ichtyologique) sont
très nombreux, mais, paradoxalement, encore mal connus ; leur
densité fluctue en fonction des saisons On peut rencontrer quatre types
de poissons :
? Espèces tempérées :
Elle passe toute la vie dans des eaux peu profondes. Ces
espèces ne sont pas commercialisées, les raies notamment la raie
guitare (Rhinobatos sp.) les Sparidés (pagres
dentés, pageot sp.), les ariidés (machoirons)
et les serranidés (mérou)
? Espèces tropicales :
Rassemblent les larves et les juvéniles des
espèces des eaux profondes, ces espèces sont commercialisables
? Espèces de milieu lagunaire ou de zone estuaire
:
Regroupent les immigrants saisonniers, les requins en
concentration importante (Carcharhinus sp. Rhizoprionodon acutus, Sphyrca
sp.) et les Sardinelles dont l'ethmalose (Ethmalosa
frimbriata),
? Espèces dans des eaux
sursalées
On note que la présence de ciclidés
(Ex: Sarotherodon melanothetdon) est un indice du passé
estuarien de cette zone
23
Les reptiles
Les tortues vertes (Chélonia mydas) facilement
observables dans le tapis de zostère, mais aussi la tortue luth
(Dermochelys coriacea), la caouanne (Caretta caretta), et la
tortue à écailles imbriquées (Erethmochelis
imbricata), plus rare sur le site. Leurs pontes sont assez rares ; il
s'agit donc d'espèces, avant tout, migratrices ; peu recherchées,
elles sont néanmoins les victimes accidentelles des pêcheurs
Imraguen, qui ne dédaignent pas leur consommation. Et les lézards
sont fréquent dans l'Agneitir notamment Acanthodactylus sp.
Les oiseaux
Le PNBA accueil et nourrit prés de 2.5 Millions
d'oiseaux dont 2.3 millions de limicoles paléarctique. Les oiseaux
constituent en quelque sorte la partie visible de l'iceberg. Ils constituent en
même temps l'indicateur de son maintien en bon état
écologique. Le Parc est le plus important site mondial pour la
reproduction de plusieurs espèces de nicheurs. La plupart des oiseaux
qui fréquentent le Parc sont des espèces migratrices venant aussi
bien de hautes que de basses latitudes et signifiant de ce fait le
caractère de carrefour biogéographique du Banc d'Arguin. Parmi
ces espèces migratrices, les limicoles paléarctiques (dont
certains viennent de Sibérie ou du Groenland) sont les groupes les plus
abondamment représentés. En hiver, le Banc d'Arguin accueille un
nombre d'oiseaux d'eau qui dépassent les totaux de tout autre site sur
la voie migratoire de l'Atlantique oriental. Pour certains il concentre alors
plus de la moitié des individus d'une l'espèce. Pour le cas des
spatules européennes, c'est 80% des individus de l'espèce qui se
rassemblent au Banc d'Arguin.
Mais le Banc est également fréquenté,
tout au long de l'année, par des espèces endémiques:
sternes (dont la sterne Caspienne), cormorans, goélands, hérons,
aigrettes, flamants roses, spatules. Certaines espèces, le héron
cendré pâle, la spatule blanche du Banc, une bergeronnette
printanière se sont adaptées, à l'instar de certaines
espèces végétales, à ces milieux et en sont
devenues des sous-espèces endémiques.
Mammifères marins
l Phoque moine (Monachus monachus) sa
répartition la plus méridionale est Cap Blanc. Cette
espèce fait partie des douze espèces les plus menacées du
monde
l Parmi les cétacés on a Tursiops truncatus
(grand dauphin) qui est observé fréquemment près de
la côte et se fait parfois le partenaire plus ou moins volontaire de la
pêche Imraguen au mulet. Souza teuszii dauphin à bosse de
l'Atlantique ou (dauphin de Guinée), plus difficile à observer
Orcinus orca (orque épaulard) font partie des hôtes
habituels du Parc.
24
Mammifères terrestres
Caractérisés par une faible diversité
taxonomique et une faiblesse des effectifs, qui est aggravée par la
chasse, Gazella dorcas est la seule survivante locale de la grande
faune.
Sur la région de l'Agneitir « Lepus capensis
» peut s'observer et quelques rongeurs de
Gerbilidées.
Parmi les carnivores on peut noter la présence de
Canis aureus (Chacal divré) et de Hyena hyena.
1.3. Communautés humaines
Le Parc est habité par 1500 Imraguen regroupés
en neuf villages côtiers (voir carte) dont les activités
principales sont la pêche, qu'ils pratiquent à pied ou à
partir de Lanches à voiles, et l'élevage qu'ils pratiquent dans
les pâturages saisonniers du désert côtier.
La pêche saisonnière, pratiquée à
pieds, exclusivement ciblée sur les mugilidés, plus
particulièrement le mulet jaune, a, au cours des siècles,
façonné la "culture Imraguen". La technique du filet
d'épaule, nappe d'environ 8 mètres de long sur 1,20 mètres
de chute, impose une approche communautaire de l'activité de
pêche, les filets étant déployés côte à
côte en cercles concentriques pour entourer le banc de mulets
repéré au préalable. Pêche de subsistance par
excellence, elle permettait d'occuper toutes les composantes du groupe. Dans
ces communautés, la coordination et la responsabilité des
affaires de l'entité villageoise ou du campement sont, le plus souvent,
attribuées à une personne choisie par la Jamaa parmi les plus
âgées et en qui cette Jamaa voit un guide. Aux habitants
originaires du Parc -les Imraguen- s'ajoute un petit nombre de personnes qui
à raison de leurs fonctions y séjournent
régulièrement. Ce sont en particulier, les agents du Parc, les
autorités civiles et militaires (préfecture de Nouamghar), ainsi
que quelques rares particuliers ; si la majorité des habitants du Parc
se trouvent donc dispersés le long du littoral, la partie terrestre
n'est cependant pas totalement inoccupée : en plus de méharistes
chargés de la surveillance mobile du Parc, s'y déplacent aussi
des nomades accompagnés de leurs troupeaux. En nombre
indéterminé mais réduit, principalement au voisinage des
deux puits encore fonctionnels, celui d'Anagoum au SE (eau saumâtre) et
celui de Bir Elgareb NE (eau salée). (MATHEL, 1990).
Le statut de Parc national constitue un outil qui doit
permettre de préserver tant le patrimoine culturel que l'ensemble des
milieux naturels dans leur intégrité écologique et leur
équilibre fonctionnel
25
A l'heure où bon nombre de (zones humides)
s'appauvrissent ou régressent, le Parc semble relativement à
l'écart et apparaît encore comme une des dernières
régions humides ayant conservé ses caractéristiques
naturelles.
1.4. Risques de dégradation
Les risques de dégradation sont liés en premier
lieu à certains impacts du développement non
régulés des activités maritimes et infrastructures
littorales en périphérie du Parc :
V' La pêche artisanale et côtière
Cette activité attire de plus en plus de candidats en
Mauritanie. Elle constitue un bassin d'emploi important pour la région
littorale mais contribue aussi à accentuer la pression sur la ressource
et à accroître sa vulnérabilité. Des pirogues sont
régulièrement arraisonnées à l'intérieur des
limites du Parc en dépit d'un système de surveillance
opérationnel. La faiblesse de la régulation de l'accès aux
ressources pour ces activités constituent à terme des facteurs
croissants de conflits d'usages sur les ressources partagées entre le
Parc et les zones de pêche extérieures.
V' La pêche industrielle
Bien que située par définition dans des zones de
plus grande profondeur et donc hors du Parc, cette activité n'en est pas
moins insidieuse : des navires hauturiers pénètrent
régulièrement à l'intérieur du Parc. Cette forme de
braconnage à haut risque d'échouage ou d'arraisonnement est un
indicateur du degré de surexploitation des ressources à
l'extérieur du Parc. Une augmentation de la flotte de pêche
industrielle contribuerait à accroître également cette
pression. Elle s'inscrit dans le cadre de la baisse des stocks halieutiques
enregistrés un peu partout dans le monde, et conduit à rechercher
les zones encore réputées productives. La notoriété
des eaux marines mauritaniennes en la matière constitue un facteur
d'attraction incontestable.
V' Les prospections pétrolières et
gazières et la mise en activité en 2006 du premier site
d'exploitation offshore
Le danger de la mise en exploitation du premier site ne cible
pas directement le Parc. Cependant l'accroissement du trafic maritime en
périphérie du Golfe d'Arguin, combiné avec l'existence
dans la même zone de nouveaux sites offshore augmentent progressivement
les risques d'accidents maritimes qui auraient, s'ils survenaient, des
conséquences catastrophiques sur le milieu,
26
compte tenu des caractéristiques de la partie marine du
Parc (zones de hauts fonds de très grande étendue) qui rendraient
très difficile toute intervention sur site, en cas de pollution majeure.
Un autre danger de l'exploitation serait l'utilisation des retombées
financières de cette activité pour le renforcement des
activités de pêche.
.
? La route Nouakchott-Nouadhibou
Les impacts de sa réalisation ne sont pas encore
précisément cernés mais on peut craindre que certains
d'entre eux puissent être négatifs comme une altération du
mode de fréquentation du territoire du Parc (partie terrestre et partie
maritime) ou la multiplication d'installations ou d'activités sur les
sites côtiers ou encore une menace sur le pastoralisme au Parc soit
directement par accident routier entre véhicules et chameaux
qu'indirectement par concentration de troupeaux autour des nouveaux points
d'eau qui ont été créés le long de la route et
dégradation des pâturages.
27
2. MATERIEL ET METHODE
L'analyse de la végétation a été
faite à l'aide de douze relevés effectués dans les deux
sites de Chami et Chibca. Dans chaque site des placettes d'un hectare (100 m x
100 m) ont été délimitées dans des zones les plus
homogènes et les plus représentatives possibles du faciès
ligneux auquel elles appartiennent. Dans ces placettes
d'échantillonnage, l'analyse a porté sur la description et la
caractérisation de la végétation par la méthode de
relevés de végétation.
Ainsi donc, dans chacune des placette, un dénombrement
exhaustif du peuplement ligneux a été réalisé. Pour
chaque individu vivant, les paramètres suivants ont été
mesurés :
- la hauteur totale afin d'établir la structure
verticale du peuplement. Elle est mesurée à l'aide d'une perche
confectionnée localement, d'une longueur de 5 m. Dans le cas des arbres
mesurant plus de 5m nous avons estimé leur hauteur par la méthode
du «point de chute» qui consiste à estimer la hauteur d'un
arbre en mesurant la distance séparant le pied de cet arbre du point de
chute de son extrémité supérieure.
- la circonférence à la base du tronc à
environ 30cm afin d'estimer la surface terrière. Pour les individus
multicaules on a mesuré la circonférence de la plus grosse tige.
Ces mesures de circonférence sont établies à l'aide d'un
mètre ruban souple.
- Le diamètre de houppier pour évaluer le
recouvrement. Il correspond à la projection verticale du houppier et est
mesuré à l'aide du décamètre. Nous avons
mesuré le diamètre dans deux directions E-W et S-N et nous avons
fait la moyenne des deux.
Les cordonnées de ces douze relevés ont
été enregistré à l'aide d'un GPS.
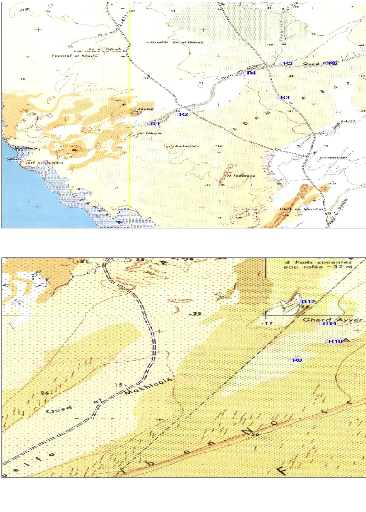
Fig.3.a : répartition des relevés de Oued Chibca
sur la carte du PNBA
Fig.3.b : répartition des relevés de Chami sur la
carte du PNBA
28
3. TRAITEMENT DES DONNEES
A partir de ces 12 relevés on a établi une
matrice de présence / absence que nous avons Analyse Factorielles de
Correspondance. Et une analyse descriptive faite au niveau de la hauteur et de
circonférence des espèces ligneuses à l'aide du logiciel
XLSTAT
Un traitement de donnée a été
effectué avec le tableur Excel, ce traitement a permis d'établir
la structure des ligneux, la diversité spécifique, la
densité, la surface terrière et le recouvrement.
La fréquence de présence d'une espèce
étant le nombre de points où cette espèce a
été rencontrée soit Fsi ; la fréquence
centésimale (Fc) est égale au rapport en (%) de
Fsi au nombre (n) de points échantillonnés . La
fréquence centésimale permet de préciser l'espèce
la plus fréquente dans un milieu donné :
Fc= (Fsi / n) *100
L'étude de la diversité spécifique peut
être réalisée suivant une approche quantitative à
partir des indices de diversité. L'indice de diversité le plus
utilisé est celui de Shannon Weaver (H'), cet indice
est basé sur la théorie de l'information. La valeur de l'indice
donne une estimation de l'incertitude avec laquelle on peut prédire
correctement l'espèce à laquelle appartient le prochain individu
collecté.
La formule utilisée pour le calcul de cet indice est :
n
H'= -? pi Log pi i=1
Où pi est le recouvrement relative de chaque
espèce. Il paraît judicieux d'utiliser l'indice de
régularité (J?) qui est une portion de la valeur
maximale que cet indice aurait si les individus étaient
distribués de façon totalement égale parmi les
espèces. Il apparaît comme un terme de comparaison plus rigoureux
(Devineau et al, 1984, in Mayer Diouf, 2000).
29
J?= H'/ H'max (H'max=LnS; S
est le nombre d'espèces).
30
La dominance d'une communauté (=diversité
spécifique) : c'est le degré dont les individus sont
répartis de façon inéquitable entre les espèces
c'est l'inverse de l'équitabilité :
n
Dominance de Simpson Is =1/ ? (pi)
2
i=1
La surface terrière d'un arbre est la surface de la
section transversale de cet arbre à hauteur d'homme (à 1,3 m ou
à 1.5 m) de part l'irrégularité de leur forme. Les
surfaces de sections des tiges d'arbres ne peuvent être
déterminées de manière précise que par
planimétrie ou par intégration. Dans la pratique, on les
déterminera à partir de la circonférence
g= c2 / 4ð
g: surface terrière c: circonférence
4. RESULTAT
4.1. Composition spécifique du
peuplement
Nous avons recensé sur les douzes relevés
effectués dans les zones de Chami et Chibca 13 espèces parmi
lesquelles 6 sont ligneuses et
comportent 196 individus.
Les espèces ligneuses recensées appartiennent
à 3 familles (Tableau 1). Les Mimosacées
présentent deux espèces Acacia tortilis et
Acacia ehrenbergiana. Les Capparidacées en comptent
trois : Capparis decidua, Maerua crassifolia et Boscia
senegalensis. Les Menispermacées présentent une
seule espèce qui est Cocculus pendulus
Sur la base du Fc (Tableau 2), Capparis decidua
est l'espèce la plus fréquente (100%) suivie de Acacia
tortilis (91%) et de Maerua crassifolia (75%), Acacia
ehrenbergiana (33%), Boscia senegalensis (25%), et Cocculus
pendulus ne présente qu'un seul relevé
Tableau 2:Répartition des espèces
effectuées à la zone Chami-Chibca (au PNBA)
|
Effectifs
|
Présence
|
|
Familles
|
Espèces
|
Ni (nb
d'ind.)
|
Fr. %
|
Fc %
|
|
Mimosaceae
|
Acacia erhebergiana
|
17
|
8,673
|
33
|
|
ehrenbergiana Acacia tortilis
|
40
|
20,408
|
91
|
|
Capparidaceae
|
Boscia senegalensis
|
25
|
12,755
|
25
|
|
Capparis decidua
|
69
|
35,204
|
100
|
|
Maerua crassifolia
|
44
|
22,449
|
75
|
|
Menispermaceae
|
Cocculus pendulus
|
1
|
0,510
|
16
|
Ni :Nombre d'individu i ; Fr. :Fréquence ;
Fc :Fréquence centésimale 4.1.1.
Effectif
Au niveau des 12 relevés d'inventaires, 196 individus
ont été recensés et se repartissent comme suit (Tableau
1)
Capparis decidua représente 35,2 % des
individus, Maerua crassifolia 22,5 %, Acacia tortilis 20,4 %,
Boscia senegalensis 12,75%, Acacia ehrenbergiana 8,67% et
enfin Cocculus pendulus qui est représenté par un seul
individu.
4.1.2. Densité
31
La densité est de 16 individus par hectare. Elle varie
selon les espèces.
32
Ainsi, elle est de 5,75 ind. /ha pour Capparis decidua
; 3,67 ind. /ha pour Maerua crassifolia ; 3,33 ind. /ha pour
Acacia tortilis et deux ind. / ha pour Boscia senegalensis
(Tableau 3).
4.1.3. Surface terrière
C'est la surface d'encrage évaluée à la
base du tronc de l'arbre et exprimée en m2 / ha (Roberts
et al, 1999). Nous avons obtenu une valeur de 19,2 m2 / ha,
deux espèces constituant à elles seules 17,2 m2 / ha
Capparis decidua 8,8 m2 /ha, Acacia tortilis 8,4
m2 /ha. (Tableau 3).
4.1.4. Recouvrement
Le recouvrement est défini comme étant la
projection du houppier au sol. Dans nos stations d'étude il est de 3690
m2 / ha pour le peuplement soit 36,9 % de la superficie
échantillonnée. Acacia tortilis occupe 56,76 % de
recouvrement total suivie par Capparis decidua qui couvre 22,2%. Trois
espèces représentent 22% : ce sont Boscia senegalensis
avec 7,47 %, Acacia ehrenbergiana avec 6,6% et Maerua
crassifolia avec 5,47 % (tableau 3)
Tableau 3: Paramètre des espèces
ligneuses rencontrées au niveau de la zone Chami-Chibca au PNBA
|
Espèces
|
Densité (Nb d'ind. /ha)
|
Recouvrement
(%)
|
Surface terrière (m2/ha)
|
|
Acacia ehrenbergiana
|
1,42
|
2
|
0,4
|
|
Acacia tortilis
|
3,33
|
21
|
8,4
|
|
Boscia senegalensis
|
2,08
|
3
|
0,5
|
|
Capparis decidua
|
5,75
|
8
|
8,8
|
|
Cocculus pendulus
|
0,08
|
1
|
0,0
|
|
Maerua crassifolia
|
3,67
|
2
|
1,1
|
|
Peuplement
|
16,33
|
36,9
|
19,2
|
Nb d'ind. /ha=Nombre d'individus par hectare
4.1.5. Paramètres de diversité
La richesse spécifique moyenne qui correspond au nombre
d'espèces par relevé et par unité de milieu est de 3,3
espèces. L'indice de Shannon est de 0,84 tandis que l'indice de
régularité est de 0,47 (Tableau 4).
33
Tableau 4: les Paramètres du
peuplement
|
Richesse spécifique
|
6
|
|
Richesse spécifique moyenne
|
3,3
|
|
Densité (Nombre d'individus / ha)
|
16,33
|
|
Recouvrement (%)
|
36,9
|
|
Surface terrière (m2/ha)
|
19,2
|
|
Indice de Shannon
|
0,84
|
|
Indice de régularité
|
0,47
|
4.2. Structure du peuplement
4.2.1. Répartition spatiale des différentes
espèces
Pour apprécier la répartition actuelle de la
végétation ligneuse, nous avons résumé
l'information du tableau des données en donnant une écriture
simplifiée sous forme graphique par l'analyse factorielle des
correspondances.
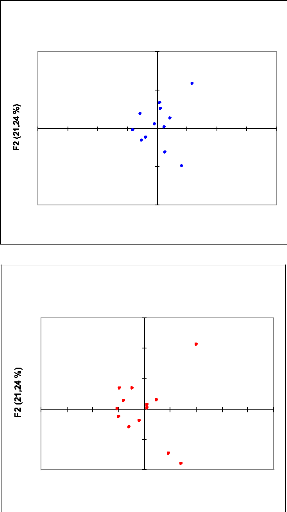
Le taux d'inertie permet de quantifier la part d'information
contenue par chaque axe. Il est de 33,75 pour le premier, 22,77 pour le second
et 16,73 pour le troisième. Ces trois axes constituent 73% de l'inertie
totale (tableau 5),
Tableau 5 : Valeurs propres et pourcentages
d'inertie :
|
F1
|
F2
|
F3
|
|
Valeur propre
|
0,387
|
0,262
|
0,193
|
|
Les lignes dépendent des colonnes (%)
|
33,572
|
22,778
|
16,737
|
|
% cumulé
|
33,572
|
56,351
|
73,088
|
Les contributions des variables (espèces) et des
observations (relevés) permettent une description des axes et leur
interprétation. En ce qui concerne les variables on retiendra les
espèces suivantes : Stipagrostis pungens (25%), Nicularia
perinii (24,8%), Fagonia olivieri (17%), Maerua crassifolia
(15,9%), Boscia senegalensis (11%) pour l'axe 1, et Cocculus
pendulus (43%), Fagonia olivieri (17.1%), Maerua crassifolia
(16.6%), Nicularia perinii (11.2%) pour l'axe 2. Ces valeurs
indiquent clairement que l'axe 1 est surtout décrit par les
espèces caractéristiques de l'unité de
végétation (Stipagrostis pungens, Nicularia
perinii, Fagonia olivieri, Boscia senegalensis) tandis que l'axe
2 est surtout décrit par les espèces (Cocculus pendulus,
Fagonia olivieri, Maerua crassifolia, Nicularia
perinii). Ce plan exprime donc l'importance de ces espèces dans le
secteur étudié (importance écologique). Nous avons
différencié par rapport à ce plan principal (1 X 2) deux
groupes :
L'axe 1 oppose deux espèces psamophiles
caractéristiques du milieu saharien qui sont Stipagrostis pungens
et Nicularia perini (Kerin Dalsted, 1982) aux autres
espèces). Le long de l'axe 2 on distingue trois sous groupes le
premier
34
constitué de 2 espèces qui sont Cocculus
pendulus et Fagonia olivieri. Ce sont des espèces
sahariennes qui se rencontrent sur les regs (Blandin, 2003). Le
deuxième sous-groupe se compose de Capparis decidua, Maerua
crassifolia, Acacia tortilis, Boscia senegalensis ce sont des
espèces sahéliennes et se trouvent essentiellement dans les lits
d'oueds ensablés (E.MAHE, 1985). Le troisième sous groupe
présente une seule espèce qui est Psoralea plicata
espèce sahélienne caractérisée par les zones
d'épandages sablo-argileuse (PAG du PNBA, 3003-2008).
R7
R5
Graphique symétrique des
lignes
(axes F1 et F2 :
45,88 %)
R11
R9
R1
R3
R12
R10
-1
R2
-2
2
1
0
-4 -3 -2 -1 0 1 2 3 4
F1 (24,65 %)
Graphique symétrique des
colonnes
(axes F1 et F2 :
45,88 %)
-4 -3 -2 -1 0 1 2 3 4 5
F1 (24,65 %)
Cc
Mc
Cd
At
Np
Spu
Spl
Ae
Bs
Fa
Hb
Cp
Pt
3
2
1
0
-1
-2
R6
R4 R8
35
Fig.4: Répartition spatiale des relevés et des
espèces dans le plan des facteurs 1×2 de l'Analyse Factorielle des
Correspondances
Graphique symétrique des
lignes
(axes F1 et F3 :
40,69 %)
R11
R3
R1
R9
R2
R10
R12
1
0,5
0
-0,5
-1
-2 -1,5 -1 -0,5 0 0,5 1 1,5 2
F1 (24,65 %)
36
Le plan (1× 3) ci-dessous montre que l'axe F3 est
caractérisé par Stipagrostis pungens (27%) et qui
caractérise l'axe 1, et par Psoralea plicata (25%) ; on peut
considérer que cet axe est un axe de l'humidité qui sépare
deux groupes : le premier de trois espèces Stipagrostis
pungens, Psoralea plicata, Nicularia perinii qui ont une
tendance xérique importante et l'autre groupe caractérisé
par un degré d'humidité modéré.
Graphique symétrique des
colonnes
(axes F1 et F3 :
40,69 %)
Cc
Hb
Cp
Fo
At
Cd
Bs
Ae
Spl
Mc Np
Spu
-4 -3 -2 -1 0 1 2 3 4
F1 (24,65 %)
37
38
2
1
0
-1
-2
Pt
Fig.5 : répartition spatiale des relevés et des
espèces dans le plan des facteurs 1×3 de l'Analyse Factorielle des
Correspondances
L'analyse par Classification Ascendante
Hiérarchisée (CAH) permet de distinguer deux grandes classes, la
première classe associe Stipagrostis pungens et Nicularia
perinii tandis que la deuxième classe est constituée des
autres espèces (Fig.6.a). Ces variations inter classes résultent
d'une variable géomorphologique qui est l'altitude car la
première classe s'installe sur les dunes alors que l'autre est
caractérisée par les zones inter-dunaires. Cette dernière
classe est constituée de deux sous groupes qui se distinguent suivant
les substrats avec une variance intra groupe de 2,85 et une distance moyenne
aux barycentres de 1,52 pour le premier sous groupe et de 0,5 de chacun de deux
pour le deuxième sous groupe . Ces données confirment la
répartition des espèces selon l'analyse factorielle des
correspondances
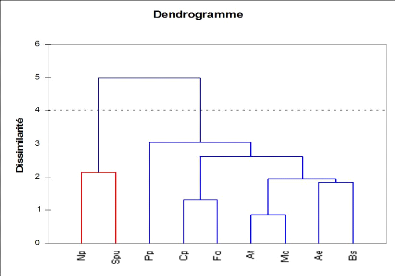
Fig.6.a: Dendrogramme des espèces
L'analyse du dendrogramme des relevés (Fig.6.b) permet
la distinction de deux familles, la famille F1 est formée par les
relevés (R10, R12, R11, R1, R9, R5, R8). Cette famille peut être
subdivisée en 2 sous familles (SF) : la SF1 intègre les
relevés R10, R12 à faible teneur en sable et la SF2 qui
intègre les relevés (R11, R1, R9, R5, R8) à forte teneur
en sable. La famille F2 est formée par R2, R3, R7, R4, R6 et peut
être subdivisée en 2 sous familles : la première (SF1)
intègre les relevés R2, R3 caractérisé par les
dunes de sables.
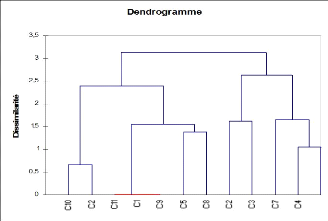
Fig.6.b:dendrogramme des relevés
39
4.2.2. Distribution selon la taille
4.2.2.1. Répartition selon la hauteur
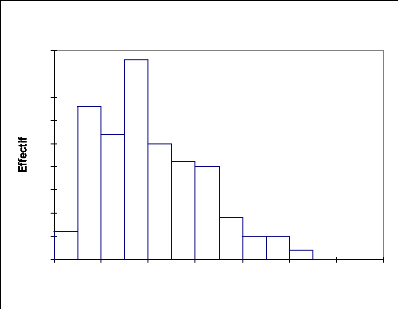
La courbe de la structure du peuplement (Fig.8) se
présente en deux groupes : le premier groupe dont la hauteur est
inférieure ou égale à 5 m correspond à une forte
proportion d'individus de la strate arbustive (5,6%) ; le deuxième
groupe d'une hauteur supérieure à 5 m, représente (44,4
%). Ce peuplement ligneux a une hauteur moyenne d'environ 4 m avec un
écart type de 2,2 (Tableau 6).
Tableau 6: Statistique simple du peuplement par
classe de la hauteur
Variable Observations Minimum Maximum Moyenne
Écart-type
Haut (m) 196 0,1 10,5 3,967 2,199
Les hauteurs : maximale, minimale et moyenne sont
représentées dans la Fig.7.
Box plot (Haut (m))
12
10
8
6
4
2
0
Fig.7: Box plot de la hauteur du peuplement
45
40
35
30
25
20
15
10
5
0
0 2 4 6 8 10 12 14
Peuplement
Haut (m)
40
Fig.8: Structure du peuplement ligneux : répartition des
effectifs (%) par classes de Hauteur
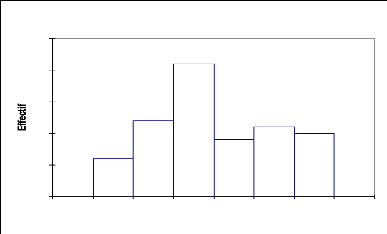
La courbe de structure de Capparis decidua illustre
le modèle Gaussien (Fig.9) : les jeunes individus (0-4 m) sont plus
représentés avec 56,5% et les arbres de 5 à 7 m
constituent 43,5%. Donc Capparis decidua se compose des deux strates
avec une dominance de la strate arbustive.
Tableau 7: statistique simple de la
distribution de Capparis decidua par classe de hauteur
Variable Observations Minimum Maximum Moyenne
Écart-type
Haut (m) 69 1 6,8 3,829 1,503
25
20
15
10
5
0
0 1 2 3 4 5 6 7 8
Capparis decidua
Haut (m)
41
Fig.9: Structure du Capparis decidua :
répartition des effectifs par classes de hauteur
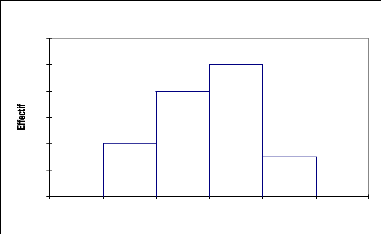
La courbe représentant la répartition de
Maerua crassifolia (Fig.10) montre que 90% des individus sont de
petite taille (0 à 4 m) tandis que les individus de grande taille ne
représentent que 10 %. Cette espèce appartient donc à la
strate arbustive.
Tableau 8: Statistiques simples de la
répartition de Maerua crassifolia par classe de
hauteur
Variable Observations Minimum Maximum Moyenne
Écart-type
Haut (m) 44 0,500 7 2,34 1,658
25
20
15
10
5
0
0 2 4 6 8 10
Maerua crassifolia
Haut (m)
Fig.10:Structure du Maerua crassifolia :
répartition des effectifs par classe de hauteur
42
La figure 11 qui représente la réparation des
effectifs par classe de hauteur montre que de la population de Acacia
tortilis (Fig.11), montre que les jeunes individus de 0 à 4 m sont
négligeable (2,5%) et que les arbres âgés de (5 à12
m) constituent l'essentiel de la population de cette espèce (97,4%).
Cette espèce appartient donc à la strate arborée.
Tableau 9 : statistique simple de
répartition de Acacia tortilis par classe de hauteur
Variable Observations Minimum Maximum Moyenne
Écart-type
Haut (m) 40 0,1 10,5 6,793 1,992
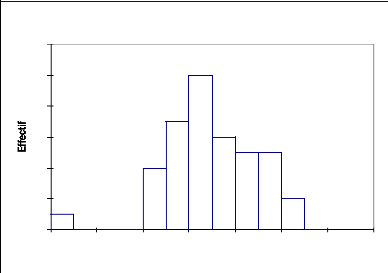
12
10
4
8
6
2
0
0 2 4 6 8 10 12 14
Acacia tortilis
Haut (m)
Fig.11, Structure de Acacia tortilis :
répartition des effectifs par classe de hauteur
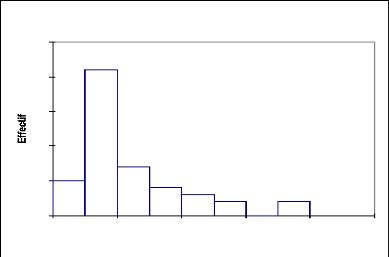
La courbe représentant la structure de Boscia
senegalensis (Fig.12) montre que cette espèce ne dépasse pas
5m de hauteur et que 88% des individus ont des hauteurs entre 0 à 4 m et
qu'enfin 12% seulement des individus appartient à la classe 5 m. Il
s'agit donc essentiellement d'une strate arbustive avec une hauteur moyenne de
2,86 m et un écart type de 0,86 (Tableau 10).
Tableau 10: statistique simple de
distribution de Boscia senegalensis par classe de hauteur
Variable Observations Minimum Maximum Moyenne
Écart-type
Haut (m) 25 1 4 2,868 0,859
12
10
4
8
6
2
0
0 1 2 3 4 5 6
Boscia senegalensis
Haut (m)
43
Fig.12, Structure du Boscia senegalensis :
répartition des effectifs par classe de hauteur
La répartition des effectifs par classe de hauteur chez
Acacia ehrenbergiana (Fig.13) illustre la présence des deux
strates avec une proportion plus élevée (58,9%) pour les classes
de 0 à 4 m de hauteur contre 41,1% pour les individus ayant une hauteur
supérieure ou égale à 5 m.
Tableau 11 : statistique simple de
répartition de Acacia ehrenbergiana par classe de hauteur
Variable Observations Minimum Maximum Moyenne
Écart-type
Haut (m) 17 1 5 3,526 1,091
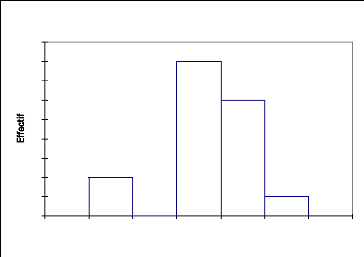
4
9
8
7
6
5
3
2
0
1
0 1 2 3 4 5 6 7
Acacia erhenbergiana
Haut (m)
Fig.13, Structure de Acacia ehrenbergiana
: répartition des effectifs par classe de hauteur
44
4.2.2.2. Répartition selon la
circonférence
Lorsque l'on considère la distribution des ligneux par
rapport à leur circonférence (Fig.14), on trouve que les classes
dont la circonférence est supérieure ou égale à 50
cm renferment 61,3% des individus alors que les jeunes individus de 0 à
40 cm de circonférence ne représentent que 27,5%. Le peuplement a
une circonférence moyenne de 22,44 in avec un écart type de 35,7
(Tableau 12).
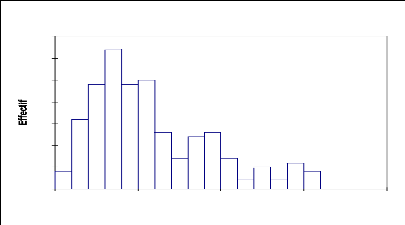
Tableau 12: statistique simple de la
distribution du peuplement par classe de circonférence
Variable Observations Minimum Maximum Moyenne
Écart-type
Circonférence (cm) 196 8 155 57,082 35,701
35
30
25
20
15
10
5
0
0 50 100 150 200
Circonférence(cm)
Peuplement
Fig.14, Structure du peuplement ligneux : répartition des
effectifs par classes de Circonférence
La population de Capparis decidua (Fig.15) est
constituée en majorité par des arbres dont la
circonférence est comprise entre 50 et 150 cm avec une fréquence
de 11% pour la classe de 60 cm, tandis que les individus de petite
circonférence ne constituent que 30 %.
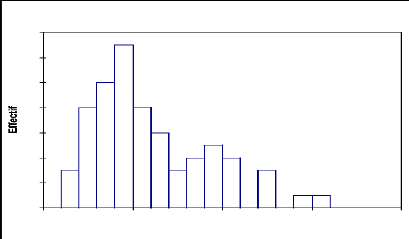
Tableau 13: statistique simple de la
distribution de Capparis decidua par classe de circonférence
Variable Observations Minimum Maximum Moyenne
Écart-type
Circonférence (cm) 69 15 153 58,362 31,750
14
12
10
4
8
6
2
0
0 50 100 150 200
Capparis decidua
Circonférence(cm)
45
Fig.15, Structure du Capparis decidua:
Répartition des effectifs par classes de circonférence
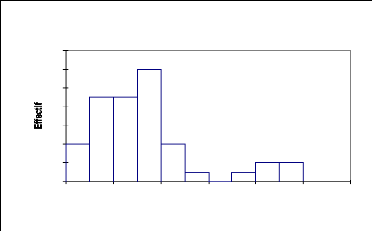
La courbe de la structure de la population de Maerua
crassifolia (Fig.16) montre que la fréquence est plus
élevée dans les premières classes (50 % dans les classes
10, 20 et 30cm ; 27.3% dans la classe 40 cm. Ceci s'explique par le fait que
cette espèce se régénère bien.
Tableau 14: statistique simple de la
distribution de Maerua crassifolia par classe de
circonférence
Variable Observations Minimum Maximum Moyenne
Écart-type
Circonférence (cm) 44 8 99 32,727 23,221
14
12
10
4
8
6
2
0
0 20 40 60 80 100 120
Maerua crassifolia
Circonférence(cm)
Fig.16, Structure du Maerua crassifolia:
répartition des effectifs par classe de circonférence
46
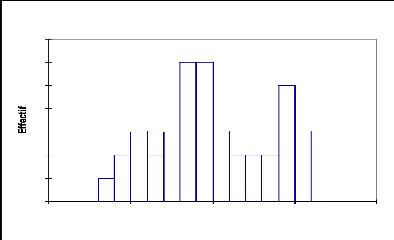
La répartition des effectifs par classe de
circonférence chez Acacia tortilis (Fig.17) montre que seul le
deuxième groupe est présent, ce qui explique qu'il n'y a pas de
régénération. Les individus de cette espèce se
répartissent avec une moyenne de circonférence de 57 cm et un
écart type de 33,25(Tableau 15).
Tableau 15: statistique simple de la
distribution de Acacia tortilis par classe de circonférence
Variable Observations Minimum Maximum Moyenne
Écart-type
Circonférence (cm) 40 34 155 98,125 33,258
4
7
6
5
3
2
0
1
0 50 100 150 200
Acacia tortilis
Circonférence(cm)
Fig.17, Structure du Acacia tortilis :
répartition des effectifs par classes de circonférence
La distribution de Boscia senegalensis (Fig.18)
indique que 68% des individus sont répartis aux premières classes
(0 à 40 cm) alors que les gros individus représentent 32%. La
régénération de Boscia senegalensis est donc
raisonnable.
Tableau 16 : statistique simple de la
distribution de Boscia senegalensis par classe de
circonférence
Variable Observations Minimum Maximum Moyenne
Écart-type
Circonférence (cm) 25 15 67 36,840 13,912
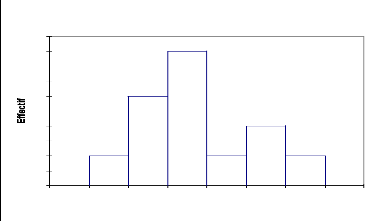
10
4
9
8
7
6
5
3
2
0
1
0 10 20 30 40 50 60 70 80
Boscia senegalensis
Circonférence(cm)
47
Fig.18, Structure du Boscia senegalensis :
répartition des effectifs par classes de circonférence
Pour la répartition de Acacia ehrenbergiana
(Fig.19) montre que 83% des individus sont du deuxième groupe (50
à 70 cm de circonférence) alors que les jeunes individus ne
représentent que 15,24%.
Tableau 17: Statistique simple de la
distribution de Acacia ehrenbergiana par classe de
circonférence
Variable Observations Minimum Maximum Moyenne
Écart-type
Circonférence (cm) 17 12 63 48,529 15,601
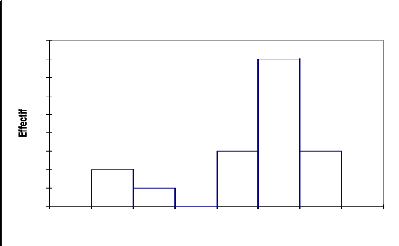
4
9
8
7
6
5
3
2
0
1
0 10 20 30 40 50 60 70 80
Acacia erhenbergiana
Circonférence(cm)
Fig.19, Structure du Acacia ehrenbergiana
: répartition des effectifs par classe de circonférence
48
4.2.2.3. Répartition des espèces selon la
modalité
Capparis decidua constitue l'espèce la plus
fréquente avec une proportion de 35,2%, suivie par Maerua
crassifolia 22,5% puis Acacia tortilis 20,4%, Boscia
senegalensis 12,75%, Acacia ehrenbergiana 8,67% et Cocculus
pendulus qui n'est représenté que par un seul individu
(Fig.20 et Tableau 18).
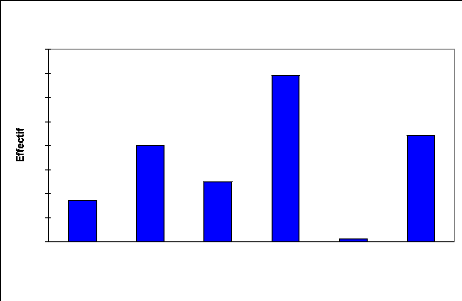
40
80
70
60
50
30
20
10
0
Acacia
erhenbergiana
Acacia tortilis Boscia
Effectif (Espece)
senegalensis decidua
Modalités
Capparis
Cocculus
pendulus
M aerua
crassifolia
Fig.20, répartition des modalités en fonction des
effectifs
Tableau 18: fréquence et effectif par
modalité
Mode Mode Modalité Effectif par Fréquence par
(effectif) modalité modalité (%)
Capparis decidua 69 Acacia ehrenbergiana 17
8,673
Acacia tortilis 40 20,408
Boscia senegalensis 25 12,755
Capparis décidua 69 35,204
Cocculus pendulus 1 0,510
Maerua crassifolia 44 22,449
49
V- DISCUSSION ET CONCLUSION :
Dans l'unité de végétation
échantillonnée, le peuplement ligneux est riche de 6
espèces reparties en trois familles, il présente une
densité très faible.
Capparis decidua est l'espèce la plus
fréquente avec (35,2%) suivie par Maerua crassifolia (22,4%) et
Boscia senegalensis (20.4%)
la densité de Capparis decidua est la plus
élevée mais le recouvrement de Acacia tortilis est le
plus important, la surface terrière pour les deux espèces est
à peu près équivalente, la quasi totalité des gros
individus du peuplement est représenté par Acacia
tortilis. L'absence de jeunes plantes de certains ligneux (Acacia
tortilis) serait liée aux conditions physiques, les ligneux aux
stade jeunes plantes ne peuvent pas survivre durant la saison sèche
(sharman, 1987 in Diouf 2003). Les jeunes plantes des ligneux tels que
Boscia senegalensis et Maerua crassifolia paraissent
résistants aux conditions externes car ils sont broutés par les
animaux essentiellement les camelins, donc cet effet de broutage peut
être considéré comme une stratégie d'adaptation
à la sécheresse pour les deux espèces.
La distribution des ligneux en fonction de la hauteur met en
relief deux groupes : Le groupe inférieur, maintenu sous l'action
anthropique constituant l'essentiel du peuplement, le deuxième groupe
avec moins d'individus est constitué par des ligneux rescapés
plus résistants.
La structure par classe de circonférence montre que le
peuplement ligneux se régénère mal (38.4% entre 0 et 40
cm). L'analyse structurale des différentes espèces et les
observations de terrain permet d'émettre les hypothèses
suivantes: - la population de Acacia tortilis est vieillissante
- Maerua crassifolia et Boscia senegalensis
ont un nombre élevé d'individus de petite taille
- Maerua crassifolia est à l'origine de
l'accroissement des jeunes du peuplement ligneux. En ce qui concerne
l'évolution de la taille du peuplement, les jeunes arbres poussent dans
un premier temps rapidement en hauteur et cette croissance se ralentit
considérablement pour les arbres âgés alors que leur
diamètre continue à augmenter ; il en est de même pour les
arbustes comme Boscia senegalensis mais contrairement aux arbres dont
la taille est importante et dont l'accroissement s'effectue sur une seule tige,
les arbustes atteignent rarement 4 m et l'accroissement de leur diamètre
s'effectue aussi bien par la formation de nouvelles tiges que par la croissance
des tiges préexistantes.
L'AFC et CAH nous permet de distinguer quatre groupes de
végétations selon le substrat :
La végétation des dunes de sables, des regs, des
zones sablo-argileuses et des lits d'oueds
50
GLOSSAIRE
Alizés
Vents réguliers qui soufflent sous les tropiques du
nord-Ouest, s'intensifiant au printemps.
B.P
Erg
Abréviation de « Before Present » qui signifie :
avant la date aujourd'hui, avant la date actuelle.
Massif dunaire
Isohyète
Courbe joignant les points du globe terrestre qui
reçoivent la même hauteur de précipitations pour une
période donnée
Lanche
Bateau à voile latine, d'origine canarienne-
précédemment utilisé comme annexe de goélette-,
employée par les Imraguen depuis une soixantaine d'années
seulement.
Ligneux
Constitué de lignine, élément du base du
bois
PARSEM
Projet d'Appui à la Rénovation du Système
Educatif Mauritanien
Phytogéographie
Etude de la répartition des plantes
PNBA
Parc National du Banc d'Arguin
Reg
Zone plane, sableuse ou argilo-sableuse recouverte de
graviers de diamètre variable, de couleur
généralement
sobre.
Régression (marine)
Recul de la mer lié à un abaissement du niveau
marin
Rhizophore
Racine en forme d'échasse des Palétuviers du genre
Rhizophora.
Upwelling
Remontée, depuis les profondeurs de l'océan vers
le littoral, de masses d'eau froides et riches en sels nutritifs, en
compensation des eaux de surface poussées au large par la force de
friction occasionnée par les Alizés.
51
REFFERENCES BIBLIOGRAPHIQUE
Akpo. L. E. et M. Grouzis, 1998- Influence du couvert ligneux
sur la diversité spécifique de la végétation
herbacée dans la forêt classée de Bakor (Haute Casamence).
AAU Reports 39 : 169-181
BLANDINE. R, 2003 - la dynamique sol-
végétation des zones humides du sud du Parc national du banc
d'arguin ( Mauritanie ) par télédétection
satellitaire, Maîtrise de géologie, option environnement,
laboratoire sciences de l'environnement et de l'aménagement ,
Université de géographie d'Angers,94p.
CAMPREDON. P, 2000 - entre le sahara et l'atlantique,
le Parc national du banc d'arguin, FIBA, la tour du valat, Arles, France.
pp-124.
CORRERA. A, 2001-utilisation de l'espace et des ressources
fourragères par le troupeau camelin d'une famille de pasteurs nomades du
PNBA. Étude spécifique du comportement alimentaire des camelins,
mémoire de DEA, université de Paris 7, p .39.
DENINS. M, 1992- arbres et arbustes guinéens des
savanes maliennes, édition KARTHALA et ACCT, Paris 478p.
E. MAHE, 1985- contribution à l'étude
scientifique de la région du Parc (littoral mauritanien 21° 20'/
19° 20') peuplement Avifaunestiques, Thèse d'obtention le
grand de docteur d'université, mention sciences naturels,
spécialité écologie, Université des sciences et
techniques du Languedoc, Académie de Montpellier, 150p.
FKEURDE. L, 1939 - les imraguens: les pécheurs du
désert. L'île d'Yeu : Gallimard, 80p.
GOWTHORPE. P, 1993 - une visite au Parc national du banc
d'arguin, itinéraires- présentation des principales composantes
naturelles. Édition Parc national du banc d'arguin -Nouakchott,
Mauritanie, tirés sur les presses de l'imprimerie nouvelle, Nouakchott,
Mauritanie, 193p.
JASQUES. V, 1983 - plan directeur préliminaire.
Parc national du banc d'arguin (Mauritanie).-world wildlife fund et
l'union
52
internationale pour la conservation de la nature, institut
royal des sciences naturelles des Belgique Bruxelles, (1984), 139p.
JASQUE. V, 1984- plan directeur préliminaire
wildlife fund, union internationale pour la concentration de la nature,
institue royal des sciences naturelles de Belgique, Bruxelles, Belgique,
1984,138p.
JASQUE. R,- la mesure des arbres et des peuplements
forestiers les processus agronomique de Gemboux.166p.
JEAN. C. M, 1973 - Analyse quantitative des ligneux dans
une savane arbustive preforestiere de cote d'ivoire, travail inscrit dans
le cadre des recherches effectuées à la station d'écologie
tropicale, 1977, 1(2)p :77-94.
KEVIN. D, SAMMIEL. A, JOHN. F, STEPHEN. S, CHRISTOPHE. S,
FREDRICH. W, 1982 - inventaire de ressources du sud ouest mauritanien,
subventionnée par Mauritanie et l'agence des états unis pour le
développement internationale, projet de la gestion de ressources
renouvelables contrat N° Aid/Afr-c-1619 en coopération avec
SDSU-RSI-82-03, 391p.
ELIE AKPO. L, MICHEL. C, 1996-influence du couvert sur la
régénération de quelques espèces ligneuses
sahéliennes (Nord Sénégal, Afrique occidental. webbia
50(2) :247-263.
AKPO. L. E, M.DIOUF, FBADA, M. DIATTA, M. GROUZIS, 2001-
Relation herbe/arbre dans une savane arbustive : influence du couvert sur
la diversité et la productivité des herbages
soudano-sahéliens. Webbia 56(1) :181-199
MAIGRRET. J et LY. B, 1986-les poissons de Mauritanie, centre
National de Recherche Océanographique et des pêches, sciences Nat
: 213pp.
MALLE. D, 2005-Approche spatiale de la biodiversité
(flore et végétation) dans une aire protégée
saharienne : le Parc National du Banc d'Arguin (Mauritanie)
Développement d'un outil de gestion. Thèse de doctorat,
option Environnement et paysages, Ecole doctorale d'Angers, Université
d'Angers (UFR. Sciences).
53
MARIE. F. P, DELGADILO. J, MARIO. S, 1989 -
l'écosystème forestière de basse Californie :
composition floristique, variables écologiques principales,
dynamique. Acta ecologia Ecol.Plant., Vol.10, n°3.p.275-293.
MATTHEL. H, HATTI .M, MOHAMED ALI .M, 1990 - politique et
législation pour la protection et la mise en valeurs du Parc
(Mauritanie).-Rome: FAO, 177pages.
MAYECOR. D, 2000- dynamique des écosystèmes
sahéliens : effets des microsite topographiques sur sa diversité
de la végétation ligneuse au Ferlo (nord Sénégal).
Diplôme d'études approfondies (DEA) de biologie
végétale, faculté des sciences et techniques,
université cheikh Anta Diop de Dakar.
MAYCOR. D, ELIE. L AKPO, ALAIN. R, FREDRIC. D, VENCESLAS. G,
AMADOU. L. D, 2002- dynamique du peuplement ligneux d'une
végétation sahélienne au nord Sénégal
(Afrique de l'ouest). Journal des sciences, vol.2.N°1.
OZENDA. P, 1983- Flore du sahara,
2ème édition du CNRS (centre National de la Recherche
scientifique), Paris, 62p.
OZENDA. P, 1991 - Flore et végétation du sahara
CNRS, paris 662pp
PNBA (2003-2008) - plan d'aménagement et de gestion du
PNBA, version Provisoire (draft5), 119p.37p.
ROBERTS. P, PATICIA, et L. GILLESPIE, 1999 - protocoles de
suivi de la Biodiversité végétale terrestre,
collection des rapports hors séries, rapport n°9, bureau de
coordination de sa surveillance écologique, Burlington (Ontario).
WARANKA BA, 2003 - proposition d'une stratégie de
conservation de la Biodiversité pour le gouvernement de la
république islamique de Mauritanie cas du Parc national du banc
d'arguin. Rapport de stage, école de la faune, Cameroun, 42p.
54
TABLE DES MATIERES
REMERCIMENT .
TABLE DES ILLUSTRATION
Liste des figures
Liste des tableaux ..
RESUME ..
ABSRACT
INTRODUCTION
CONTEXTE GENERAL SUR MAURITANIE
1. PRESENTATION DU MILIEU D'ETUDE
1.1. Milieu physique
1.1.2. Climatologie et environnement océanique
1.1.3. Géologie
1.1.4. Géomorphologie
1.1.4.1. Géomorphologie Sous marins
1.1.4.2. Géomorphologie Littoral
1.1.4.3. Géomorphologie Continental
1.1.5. Hydrologie
1.1.5.1. Eau souterraine
1.1.5.2. Eau superficielle
1.1.5.3. Hydrologie marine
1.2. Milieu vivant ...
1.2.1. Composantes végétales
Phytoplancton
Végétation côtière
Végétation continentale
55
1.2.1.1. Adaptation à la sécheresse .
1.2.1.2. phytogéographie
1.2.2. Faune .
Invertébrés
Poissons .
Reptiles .
Oiseaux
Mammifères marines
Mammifères terrestres
1.2.3. Les communautés humaines
1.2.4. Risques de dégradation .
2. MATERIEL ET METHODE
3. TRAITEMENT DE DONNEE
4. RESULTAT
4.1. Composition spécifique du peuplement
4.1.1. Effectif
4.1.2. Densité
4.1.3. Surface terrière
4.1.4. Recouvrement .
4.1.5. Paramètres de diversité
4.2. Structure du peuplement spatiale
4.2.1. Distribution spatiale suivant les axes
4.2.2. Distribution suivant la taille
4.2.2.1. Réparation selon la hauteur
4.2.2.2. Répartition selon la circonférence
4.2.2.3. Réparation selon la modalité
5. DISCUTION ET CONCLUSION
56
GLOSSAIRE .
REFFERENCE BIBLIOGRAPHIQUE
ANNEXE 1
ANNEXE 2
Catalogue de la flore du PNBA et régions limitrophes
Liste établie par Th. Monod (1988)
réactalisée (1993) avec la collaboration des enseignants du
secondaire travaillant dans le cadre du PERSEM* et encadrés par B.
Lamarche ; séquence selon Th. Monod, 1988
ANNEXE 1: Flore du PNBA
A. CRYPTOGAMES 1. ALGUES
2. CHAMIGNONS Tulostoma volvulatum Agaricus disporis
Sphacelotheca creunta Fungi imerfecti
3. LICHENS
Diploicia subcanescens Lecania cyrtelloides Xantoria lobulata
C . circumalbata
B. SPERMATOHYTES
ZOSTERACEAE Zostera noltii
CYMODOCEACEAE Cymodocea nodosa Halodule
wrightii
POACEAE
Aeluropus lagooides A. Repens
Asthenatherum forskalii Cenchrus biflorus (initi)
C. ciliarus (tilimit)
Chloris virgata (
Coelachyrum brevifolium
Cymboprogon schoenanthus (eidh-khir)
Eremopogon foveolatus Lasiurus scindicus
Panicum turgidum (oumrokba) Polypogon maritimus
P.monspeliensis
P.semiverticillatus Sorghum sp.
57
Sparina maritima
Sporobolus spicatus
Stenotaphrum dimidiatum
Stipagrostis acutiflora
S. ciliata
S. obtusa
S. papposa
S. plumosa
S. vulnerans
S. pungens
CYPERACEAE
Cyperus conglomeratus Scirpus maritimus
LILIACEAE Androcymbuim graineum Asparagus
altissimis Asphodelus tenuifoluis
AMARILIDIACEAE Dipcadi serotinum Pancrium
trianthum
POLYGONACEAE Callygonum comosum Emex
spinosus Polygonum argyrocoleum
CYMORIACEAE Cymorium coccineum
CHENOPOIACEAE Beta vulgaris Patellifolia
patellaris Chenopodium rubrium Chenopodium sp. Atriplex halimus Atriplex glauca
Bassia muricata
Bassia tomentosa
Arthrocnemum acrostachyum
Sacocornia perennis
Traganum moquini
Traganum nudatum
Nucularia perrini (askaf)
Suaeda vermiculata
Suaeda maritima
Suaeda arguinensis
Suaeda fruticosa
Salsola baryosma
Salsola tetrandra
Salsola tetragona
Salsola sieberi
Anabasis articulata
Hammada scoparia
Cornulaca monacantha (el. Hadh)
AMARANTHCEAE Aerva pesica
Amaranthus angustifolius Amaranthus muricatus
AIZOACEAE (FICOIDACEAE) Aizoon
canariense
Limeum obovatum
Mesembryanthemum crystallinum Mesenbryanthemum nodiflorum
Mesenbryanthemum cryptnthum Sesuvium portulacastrum
Zalea pentanra
FRANKENIACEAE Frankenia corymbosa Frankenia
pulverulenta
CARYOPHYLACEAE Gymnocaros decaner Polycarpon
delileanum Polycarpon niveum Polycarpon prostratum Polycarpon repens
Sclerocephalus arabicus
58
Spergularia salina
NICTAGINACEAE Boerhaavia repens Commicarpus
verticillatus
MENISPERMACEAE Cocculus pendulus
(allenda)
CAPPARIDACEAE
Boscia senegalensis (eizzen) Capparis decidua
(ignine) Cleome amblyocarpa
Maerua crassifolia (atil)
BRASSICACEAE
Anastatica hierochintica Eremobium aegyptiacum Farsetia
stylosa
Morettia canescens (touzbaguet)
RESEDACEAE
Cayluseae hexagyna (edh dhemban)
NEURADACEAE Neurada procumbens
MIMOSACEAE
Acacia ehrenbergiana (temat) Acacia nilotica
(émour)
Acacia tortilis (talh)
CAESALPINIACEAE Cassia italica
(efelegit)
PAPILIONACEAE Astragalus vogelii Cortalaria
arenaria Crotalaria saharae (l'foulé) Indigofera argentea
Lotononis platycarpa Lotus chazalieri
Lotus glinoides
Lotus jolyi (oum-mahallous) Ononis
tournefortii
Psoralea plicata (tatraret) Rhynchosia memnonia
Vigna unguiculata
GERANIACEAE Monsonia nivea
ZYGOPHYLLACEAE
Fagonia arabica
Fagonia glutinosa
Fagonia latifolia
Fagonia olivieri
Seetzenia orientalis
Tribulus longipetalus
Tribulus tersetris
Zygophyllum fontanesii
Zygophyllum simplex (agayé)
Zygophyllum watrlotii (elmerrar))
NITRARIACEAE Nitraria retusa
BALANITACEAE
Balanites aegyptiaca (teichott)
POLYGALACEAE Polygala erioptera
EUPHORBIACEAE Andrachne gruvli
Chrozophora senegalensis Euphorbia balsamifera (ifernan)
Euphorbia calyptrata Euphorbia dracunculoides Euphorbia forsskalii
Euphorbia granulata (kbeidt dheb) Euphorbia scordifolia
(tanout)
RHAMNACEAE Zyziphus lotus
(sder)
CELASTRACEAE Maytenus senegalensis
59
SALVADORACEAE Salvadora persica
MALVACEAE Abutilon pannosum Malva
parviflora
TILIACEAE
Corchorus depressus (l'san thor) Corchorus
fascicularis
TAMARICACEA Tamarix amplexicaulis Tamarix
balansae Tamarix gallica Tamarix passerinoides Tamarix aphylla
APIACEAE
Pituranthiose scoparius
PLUMBAGINACEAE Limonium chazaliei Limonium
tuberculatum
ASCLEPIADACEA Calotropus procera
(tourjé) Leptadenia pyrotechnica (titarect) Pergularia
tomentosa
CONVOLVULACEAE Convolvulus prostratus Cressa
cretica
Ipomea asarifolia
BORAGINACEAE
Echiochilon chazaliei
Heliotropium bacciferum (Lehbalya)
Megastoma pusillum
Moltkiopsis ciliata
60
AVICENIACEAE Avicenia africana
LAMIACEAE
Salvia aegyptiaca
Teucrium chadonianum
SOLANACEAE Hyoscyamus muticus Lycium
intricatum Nicotiana glauca Solanum nigrum
SCROPHULARIACEAE Kichxia aegyptiaca Linaria
sagittata
OROBANCHACEEAE Cistanche phelypae
CUCURBITACEAE Citrullus colocynthis
Citrullus vulgaris
ASTERACEAE Centaurea perrotteti Cichozium
intybus Cotula cinerea
Ifloga spicata
Launaea arborescens Launaea capitata Launaea nudicaulis
Launaea resedifolia Nolletia chysocomoides Pulicaria burchardii Pulicaria
crispa Pulicaria incisa Senchrus oleraceus

ANNEXE 2 : Photos des espèces
ligneuses

Maerua crassifolia à l'etat brouté
Acacia tortilis
61
Maerua crassifolia à l'état jeune
Coculus pendulus associé à A. tortilis
62
| 


