|
Novembre 2012
UNIVERSITE DE LUBUMBASHI
FACULTE DES SCIENCES AGRONOMIQUES Diplôme d'Etude
Approfondie en Gestion des Ressources Naturelles et de Biodiversité de
la forêt claire Option : Faune et Flore

Caractérisation des communautés
végétales du
Miombo en lien aux paramètres physiques du
sol.
Réserve de Mikembo, Lubumbashi
(RD. Congo)
Par WIMANA KIZILA Pacifique
Mémoire présenté et défendu pour
l'obtention du diplôme d'étude approfondie en gestion des
ressources naturelles et de biodiversité de la forêt claire.
Promoteur: Professeur Grégory MAHY (ULg GxABT)
Encadreur: Professeur François MUNYEMBA
(UNILU)
I
REMERCIEMENTS
Mes plus vifs remerciements s'adressent au Professeur
Grégory Mahy, directeur de mon D.E.A, pour des nombreuses remarques
éclairées et suggestions enrichissantes proposées au cours
de l'année et son aide précieuse pour la réalisation du
document final.
Je remercie très sincèrement monsieur Michel
Anastasiou, connu sous le nom du chef Mikembo, pour son implication personnelle
dans la réussite de ce projet. Twatotela sana. Ce projet a
été financé entièrement par BAK Asbl dont nous
remercions les responsables: Docteur Michel Hasson et Vanessa anastasiou pour
un soutien indéfectible ainsi que la sensibilité avec laquelle
vous réagissiez pour trouver des solutions aux problèmes
liés au bon déroulement de notre formation.
Que tous les professeurs et chercheurs des Universités
Belges et Congolaises se sentent aussi remerciés. Les Professeurs :
Pierre Meerts (ULB), Jan Bogaert (ULg GxABT), Philippe Lejeune (ULg GxABT),
Mylor Ngoy (UNILU), Michel Ngongo (UNILU), Gilles Colinet (ULg GxABT), Guy
Josens (ULB), Nathalie Verbruggen (ULB), Michel Mpundu (UNILU), François
Munyemba (UNILU), Michel Louette & Rudy Jocqué (Tervuren),
François Chipeng (UNILU), Adrian Craig (Rhodes University), Arnaud monty
(ULg GxABT), Jérôme Degreef & André De Kesel
(Laboratoire de Meise), Nicolas vereecken (ULB).
Au Docteur Michel Pierre Faucon qui gouverna mes premiers pas
dans le domaine de l'écologie. Pour son optimisme et ses encouragements.
Aksanti sana.
Aux professeurs émérites Jean Lejoly et
François Malaisse, pour avoir transmis des connaissances ethnobotaniques
inégalées.
Grande est ma reconnaissance au personnel du sanctuaire
Mikembo : papa Kyakaba F., papa Kasongo J., papa Auguy.
J'ai apprécié la collaboration de Muyle M.,
Séleck M., Lebrun J., Hick A. dans le traitement des données et
la rédaction du document final. Aksanti sana.
Que mes collègues de promotion se sentent remercier.
Une mention particulière au chef de promotion CABALA S., pour son souci
de maintenir la cohésion du groupe.
Toute ma reconnaissance à Mauwa Chancelle ma
fiancée, pour ton soutien spirituel et moral. Pour toute ma famille
représentée ici par mes parents: Kizila F. et Masupa A.
A ma soeur Wabiwa Kizila Judith, dont le dessein n'a pas voulu
que nous participions tous à cette oeuvre, il nous l'a ravi trop
tôt.
Pour tous ceux qui n'ont pas vu leur noms ici, rassurez-vous que
vous êtes dans mon coeur.
II
RESUME
Dans le Miombo, les études sur les
différents modèles d'associations des espèces
végétales ainsi que les facteurs qui influencent leurs
répartitions sont moins connues. Alors que, les études sur la
restauration de ces écosystèmes exigent la compréhension
de leurs fonctionnements. Ce présent travail se propose d'établir
des corrélations entre trois facteurs édaphiques (Profondeur de
la charge-profondeur sol-couleur) et différentes communautés
végétales issues d'un inventaire. Huit communautés ont
été déterminées par ordination NMDS. Parmi les
paramètres considérés, les profondeurs du sol sont
significativement différentes par rapport aux différentes
communautés. Les analyses sur la dynamique de
régénération ont montrées que dans la plus part des
cas, les mêmes espèces ont été retrouvées
dans différentes strates ainsi que dans la
régénération. Les espèces indicatrices ont
été établies pour tous les paramètres
édaphiques. Ensuite, parmi les 5 espèces emblématiques du
Miombo choisies, Julbernardia globiflora et J. paniculata
ont un bon profil de régénération en condition
naturelle, alors que Marquesia macroura, Brachystegia boehmii et
Uapaca nitida accusent des faiblesses de
régénération.
Mots clés: Communauté
végétale, Espèce indicatrice, Miombo,
Régénération, Restauration.
ABSTRACTS
In the Miombo, the studies on the different models of
associations of the plant species as well as the factors that influence their
distributions are less known. Whereas the studies on restoration of these
ecosystems require the understanding of their workings. This present work
intends to establish some interrelationships enter three soil factors (Depth of
the charge-depth soil-color) and different community's plants come from an
inventory. Eight communities were defined by NMDS ordination. Among the
considered parameters, the depths are meaningfully different in relation to the
different communities. The analyses on the dynamics of regeneration showed that
in the more part of the cases, the same species have been recovered in
different strata as well as in regeneration. The indicatory species have been
established for all soil parameters. In continuation, among the 5 emblematic
species of the Miombo chosen, Julbernardia globiflora and
J. paniculata have a good profile of regeneration in natural
condition, whereas Marquesia macroura, Brachystegia boehmii
and Uapaca nitida accuse weaknesses of regeneration.
Key words: Indicatory species,
Miombo, Plant community, Regeneration, Restoration.
III
TABLE DES MATIERES
REMERCIEMENTS I
RESUME II
ABSTRACTS II
TABLE DES MATIERES III
LISTE DES FIGURES IV
LISTE DES TABLEAUX V
INTRODUCTION 1
1. SYNTHESE BIBLIOGRAPHIQUE 2
1.1. Définition et distribution de la forêt claire
2
1.2. La forêt claire zambézienne au Katanga
(Miombo). 3
1.2.1 Conditions environnementales 4
1.2.2. Dégradation et déforestation du Miombo
Katangais 5
1.3. La restauration des groupements végétaux
6
1.3.1. Définition 6
1.3.2. Etapes de la restauration des groupements
végétaux 7
2. OBJECTIFS 8
3. MILIEU, MATERIELS ET METHODES 9
3.1. Milieu d'étude 9
3.2. Cartographie des communautés
végétales. 11
3.3. Inventaire floristique. 13
3.4. Observations et mesures 13
3.5. Analyse des données 14
3.5.1. Caractérisation des communautés
végétales. 14
3.5.2. Détermination des espèces indicatrices et
les espèces abondantes dans différentes communautés
végétales. 15
3.5.3. Structure des communautés végétales.
15
3.5.4. Paramètres du sol. 16
4. RESULTATS. 17
4.1. Carte de végétation et inventaires. 17
4.2. Caractérisation des communautés. 17
4.3. Structure des communautés. 23
4.4. La distribution de tiges par catégorie de
diamètre dans différentes communautés
végétales. 25
4.5. Facteurs édaphiques 31
4.6. Influence de la charge caillouteuse 32
5. DISCUSSION. 35
5.1. Discussion de la méthodologie. 35
5.2. Hétérogénéité de la
végétation. 35
5.3. Caractérisation des communautés
végétales et la dynamique de régénération.
36
5.4. Influence des paramètres du sol sur la
répartition des placettes dans différentes communautés
végétales. 38
6. CONCLUSION ET PERSPECTIVE 39
BIBLIOGRAPHIE 41
ANNEXE 44
IV
LISTE DES FIGURES
Figure 1: Répartition de la forêt claire et du
Miombo en Afrique (WHITE, 1983). 2
Figure 2: La carte de Mikembo. 9
Figure 3: Carte de sol de Mikembo basée sur une
extrapolation de 53 points de sondage ___ 10 Figure 4 : La distribution
annuelle des pluies à Lubumbashi et ses environs.
(
http://www.ecoles.cfwb.be/icesquaregnon/climats/frclimtypes.html).
10
Figure 5: La carte de végétation
préliminaire de Mikembo. 17
Figure 6: Les six groupes issus de la première ordination
réalisée sur 69 placettes. 18
Figure 7: Les 5 groupes issus de la deuxième
classification effectuée sur les groupes a; b ; d
(Nombre de placettes : 43). 19
Figure 8: La distribution des
tiges par classe de diamètre dans la forêt de
régénération à
Uapaca sp. 25
Figure 9: La distribution de tiges par classe de
diamètre d'U. nitida dans la forêt de
régénération à Uapaca sp. 25
Figure 10: La distribution de fréquence dans la
forêt hétérogène à J. paniculata. 26
Figure 11: La structure de J. paniculata dans la forêt
hétérogène à J. paniculata. 26
Figure 12: La structure de la forêt ancienne à P.
tinctorius. 27
Figure 13: La structure de la savane boisée à C.
adenogonium. 27
Figure 14: La structure de la Forêt
hétérogène à J.globiflora. 28
Figure 15: La distribution de tiges par classe de diamètre
pour M. macroura. 28
Figure 16: La structure de J. globiflora. 29
Figure 17: La structure de la Forêt
hétérogène à B. boehmii. 29
Figure 18: La structure de l'espèce B. boehmii dans la
Forêt hétérogène à B. boehmii. 30
Figure 19: La structure de la savane arborée à
Acacia spp. 30
Figure 20: La structure de la savane arborée à A.
polyacantha. 31
V
LISTE DES TABLEAUX
Tableau 1. Le nombre de placettes en fonction de la
superficie des formations végétales. __ 11 Tableau 2. Le nombre
de placettes et la superficie des formations végétales de
Mikembo. _ 12 Tableau 3. La répartition des placettes dans
différents groupes après la première ordination.
18
Tableau 4. La distribution des placettes dans
différents groupes après la troisième ordination
20
Tableau 5. Les abondances des espèces par strates, par
peuplement et dans la régénération
pour les 8 communautés végétales
(Abod . Abondance). 21
Tableau 6. Les espèces indicatrices par
strate, par peuplement et dans la régénération
pour
les 8 communautés végétales.
22
Tableau 7. Reclassification des communautés
végétales tenant compte de la structure et de la
composition floristique. 23
Tableau 8. Différents
paramètres de structure dans différentes communautés
végétales. La valeur sous parenthèse représente
l'erreur standard, les lettres représentent les groupes. _ 24
Tableau 9. Moyenne de caractéristique des
paramètres de communautés végétales. 24
Tableau 10. Répartition des placettes en fonction des
couleurs du sol. 31
Tableau 11. Influence de la profondeur du sol sur la
répartition de placettes. 32
Tableau 12. Espèces indicatrices en fonction de la
présence ou absence de la charge
caillouteuse 33
Tableau 13. Les espèces indicatrices suivant
différentes profondeur du sol. 34
Tableau 14: Répartition des 69 placettes en 6 groupes
résultant d'une ordination 44
Tableau 15 . Répartition de 44 placettes en 5 groupes
après la deuxième ordination. 44
Tableau 16. Les espèces indicatrices en fonction du
sol et de la couleur. 45
Tableau 17. La liste de 80 espèces de l'inventaire de
Mikembo. 46
1
INTRODUCTION
En Afrique Centro australe, la forêt claire du
Miombo occupe une superficie de 3.6 million de Km2 (Giliba
et al., 2011). Elle occupe 80 % de la végétation
naturelle en Zambie, 11 % pour la république de démocratique du
Congo (Banda et al., 2006). Elle est distribuée sur 11 pays :
République démocratique du Congo, République
Sud-Africaine, Malawi, Burundi, Tanzanie, Angola, Zimbabwe, Zambie, Mozambique,
Kenya, Botswana (Campbell et al., 2007).
Environ 100 millions des personnes habitant les milieux ruraux
et urbains dépendent de cet écosystème (Timberlake &
Chidumayo, 2011). Avec des particularités écologique et
économique importantes (Frost, 1996). Elle est pourvoyeur de bois
d'oeuvre et de bois de chauffe. Elle fournit la matière première
pour la production du charbon de bois (Luoga, 2005). Elle est également
source de fourrage et de divers produits forestiers non ligneux contribuant
à l'alimentation des populations locales (Fanshawe, 1971; Malaisse,
1997). Elle est aussi importante pour des raisons spirituelles et culturelles
des populations locales (Gambiza et al., 2000). Cet
écosystème a connu au cours du 20e siècle un
taux de dégradation élevé sous l'effet de
l'accélération des pratiques anthropiques : surexploitation de la
ressource bois (bois d'oeuvre et charbon de bois), conversion pour
l'agriculture et le pâturage, modifications des régimes de
perturbation liés au feu (Campbell, 1996), alors que, le Miombo
est une cible importante pour la conservation de la biodiversité et
le suivi de changement de la végétation (Panteleo et al.,
2011).
Face à ces défis, la restauration du Miombo
est un enjeu majeur. La restauration écologique doit s'appuyer
à la fois sur une connaissance approfondie du fonctionnement
écologique des écosystèmes et de leur réponse aux
perturbations humaines (Clevel et Aronson, 2010).
2
1. SYNTHESE BIBLIOGRAPHIQUE
1.1. Définition et distribution de la forêt
claire
Située presqu'entièrement dans la zone tropicale
australe, la forêt claire comprend deux bandes : La première
s'étend entre la latitude 5°N et 23°N, avec une
végétation à prédominance de diverses
espèces d'acacias ; et la seconde bande va de 5° S 25° S de
latitude. Un massif homogène qui se prolonge jusqu'en Afrique du Sud.
Elle est caractérisée par une végétation à
dominance de la sous famille de Caesalpinioideae du genre :
Brachystegia-Isoberlinia-Julbernardia ; lesquelles espèces sont
rarement trouvées en dehors de la forêt claire du Miombo
(Strömquist & Backéus, 2010). De par les
précipitations et la richesse floristique, la forêt claire a
été subdivisée en deux :
? Le Miombo humide, dont les précipitations
sont supérieures à 1000 mm de pluies/an. Il est dominé par
les espèces telles que : Brachystegia floribumda, B. wangermeeana,
Marquesia macroura.
? Le Miombo sec, dont les précipitations sont
inférieures à 1000 mm de pluies/an. Il est dominé par les
espèces telles que : B. spiciformis, B. boehmii, Julbernardia
paniculata. La présente étude s'intéresse à la
forêt claire du sud de l'équateur appelée
Miombo.
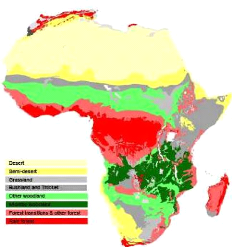
Figure 1: Répartition de la forêt claire et
du Miombo en Afrique (WHITE, 1983).
3
1.2. La forêt claire zambézienne au Katanga
(Miombo).
La forêt claire zambézienne est la formation
végétale la plus répandue du haut Katanga, elle couvre 11%
du territoire national de la R.D. Congo (Timberlake & Chidumayo, 2011).
Cette formation est dominée par les genres
Brachystegia-Julbernardia-Isoberlinia, et parsemée par les
grandes termitières à originalité floristique très
élevée (Schmitz, 1971).
8500 espèces sont recensées à ce jour
(Malaisse, 1997). La végétation de la plaine de Lubumbashi a
déjà fait l'objet des quelques études :
Sys et Schmitz (1959) ; ont démontré qu'il
existe dans le Miombo Katangais une corrélation entre la
structure, la texture du sol et la végétation en place.
Par exemple, un peuplement à Brachystegia boehmii
indique la présence dans le sol de cailloux et latérites.
Schmitz (1971) a isolé au sein du Miombo
Katangais différentes alliances et associations d'espèces
végétales. Ces alliances et associations ont été
définies en fonction de la végétation, la topographie, la
texture et la couleur du sol. Il s'agit de: l'alliance
Berlinio-Marquesion, (elle regroupe les types forestiers en liaison
entre les forêts semi- caducifoliées et tropophiles) ; l'alliance
Mesobrachystegion (ce sont des forêts tropophiles à
Brachystegia sur sol argileux/ sablo-argileux et profond avec une
bonne économie d'eau), l'alliance Xerobrachystegion (ce sont
des latosols bruns/ ocre-jaune, moins riche en éléments, sec et
profond). Au sein de ces alliances, on retrouve des sous-associations suivant
la nature et les propriétés physiques et chimiques des sols.
Malaisse (1997) a tenu compte des critères
physionomiques et floristiques tout en ignorant les paramètres du sol.
Il ressort de cette analyse que la végétation de la plaine de
Lubumbashi est subdivisée en des savanes arbustives à
espèces typiques et des forêts claires à Brachystegia
spp.
La forêt claire du Katanga se situe dans le sous-centre
endémisme Katanguien, qui appartient au domaine zambézien et se
partage entre un secteur lunda à l'ouest et un secteur bemba à
l'est (Malaisse, 1993).Le Haut Katanga appartient au secteur de l'Est (Secteur
Bemba).
La majeure partie de la réserve minérale est
concentrée dans les couches superficielles du sol (Chidumayo, 1997).
4
Dans ce secteur, la diversité d'espèces
endémiques est élevée dans différentes familles et
genres, tels que les genres Crotalaria, espèces et
variétés de Brachystegia, Uapaca, Cassia, Protea, Thesium,
Polygonum, ... (Schmitz, 1971).
1.2.1 Conditions environnementales
La forêt claire du Katanga est sous un climat à
« saisonnalité » prononcée. Celle-ci est sous
dépendance non seulement des précipitations, mais
également, de la température (Schmitz, 1971).
Cette saisonnalité, couplée au passage du feu
anthropique, influence le fonctionnement de cet écosystème
(Malaisse, 1979).
Au Haut Katanga, la moyenne des précipitations
annuelles est de 1225 l/m2. Avec une moyenne de température
de 20.0°C. La saison sèche a une durée moyenne de 5 mois
(Mai-Septembre); Et la saison pluvieuse dure 4 mois (Novembre-Mars). Cela
soumet la végétation à un contraste bien marqué
(Schmitz, 1971). Ce pourrait être un facteur majeur qui détermine
la limite sud de la distribution du Miombo dans la région
zambézienne (Werger & Cootzee, 1978).
La géologie du Katanga est complexe. Elle tire son
origine à partir des invasions marines par accumulation de
sédiments, des mouvements tectoniques violents comme la
dépression « Kamalondo ». Il s'en est suivi la
formation des pénéplaines et des hauts plateaux qui sont une
conséquence des grands effondrements et des différentes phases
d'érosions. Ces processus ont débouchés à la
formation des Hauts plateaux à sable blanc (Kalahari), des collines
à affleurements rocheux ou non, des plaines, et des ravins (Schmitz,
1971).
Au Katanga les sols sont ferralitiques, profonds, à
horizons peu contrastés et de transition graduelle. Les sols les plus
fréquents sont du type ferralitique de couleur rouge et jaune, souvent
associés à des lithosols sur cuirasses ferrugineuses, ou sur des
sédiments meubles sableux (Duvigneaud, 1958).
5
Le Miombo des environs de Lubumbashi évolue
sur des latosols zonaux subdivisés en trois séries suivant la
teneur en oxyde de Fer (Schmitz, 1971) :
? Les sols rouges sur roches carbonatées et
dolomitiques.
? Les sols ocres-rouges sur roches argileuses ou siliceuses.
? Les sols jaunes sur roches argileuses ou siliceuses, nappe peu
profonde.
1.2.2. Dégradation et déforestation du
Miombo Katangais
La dégradation est perçue comme une atteinte
à la qualité des milieux forestiers (Kabulu et al.,
2008). La dégradation et la déforestation sont des processus
très liés. Le premier terme a trait aux aspects qualitatifs,
alors que le second a trait aux aspects quantitatifs. Elles sont
associées à l'érosion de la diversité floristique
et faunistique.
Dans le Miombo, 191 espèces d'arbres sont en
danger dû à la production de charbon de bois, au feu et à
l'agriculture. 140.000 ha de Miombo sont perdus par année, soit
un taux de 4-6% (Timberlake, 2000).
Au Haut Katanga, avant les années 1910, la
périphérie de la ville de Lubumbashi était couverte par le
Miombo parsemé des tâches de forêts denses
sèches et de forêts galeries. Les études de Keay et al.
(1988), cité par Malaisse (1997), montrent qu'environ 80 % de ces
forêts ont disparu ; ce qui représente environ 1000 km2
autour de la ville de Lubumbashi.
L'OSFAC (Observatoire Satellital des Forêts d'Afrique
Centrale), a estimé la perte du couvert à 2.3 %. Soit un taux
annuel de 0.323 % entre 2000 et 2005.
Plus récemment, une étude de la dynamique
spatio-temporelle des forêts claires au tour de Lubumbashi a
montré que la vitesse de déforestation entre 1958-2009 est de
2.4% par an (Munyemba, 2010).
Les causes de cette déforestation sont multiples. Elle
a été corrélée avec les densités de
populations et la croissance des activités minières ( Ernst &
Verhegghen, 2010) . A cela s'ajoute une urbanisation anarchique due à
l'expansion démographique , l'agriculture qui entraine une savanisation
du Miombo, le prélèvement abusif des essences
forestières pour la fabrication de charbon de bois, le braconnage qui
s'est accentué après la chute de la Gécamines (principale
entreprise minière de la région) à la fin des
années 1980 (Faucon, 2009) et les feux de brousse. Leur fréquence
et intensité, sont deux facteurs qui influencent la
Les objectifs majeurs de la restauration peuvent être
appréhendés à deux niveaux (S.E.R.I.S.P.W, 2004):
6
survie des espèces et la formation de graines (Nangendo
et al., 2005). Le feu a une grande influence sur le cycle de vie des
diverses espèces. Lors de son passage, le feu affecte même les
jeunes pousses, ce qui les rend vulnérables (Campbell, 1996).
La Province s'est industrialisée à partir de
1911 avec l'expansion des activités minières au Katanga, et a
connu une croissance exponentielle ces 15 dernières années.
L'exploitation minière est directement liée à la
déforestation. Des grandes superficies de forêts claires
disparaissent chaque jour pour permettre l'accès aux gisements, et
même pour l'extraction des minerais. Ce qui facilite aussi l'accès
aux charbonniers à des forêts autrefois inaccessibles !
En plus, la plupart des entreprises minières du Katanga
utilisent encore des techniques archaïques et non respectueuses de
l'environnement. Il convient de signaler que, depuis quelques temps, les
exploitants miniers tentent d'étendre leurs activités
d'exploitation aux forêts faisant partie du domaine public de l'Etat
(forêts classées). On place dans cette catégorie, les parcs
nationaux (réserves intégrales), les domaines de chasse, les
forêts urbaines, les jardins botaniques et les périmètres
de reboisement de l'Etat ou des entités décentralisés
(Code forestier, 2002).
Le processus de restauration et de conservation de la
biodiversité doit passer par une étude approfondie de la
question. Seule une gestion raisonnée des écosystèmes
pourra limiter le nombre d'extinction des espèces sauvages (Olivieri
& Vitelis, 2001).
1.3. La restauration des groupements
végétaux 1.3.1. Définition
La restauration écologique est un processus qui assiste
l'autoréparation d'un écosystème qui a été
dégradé, endommagé ou détruit (Society for
Ecological Restoration International Science & Policy Working Group.,
2004).
Si les écosystèmes des pays du Sud sont
surexploités et dégradés, il faut retenir que toute
politique d'aménagement doit avoir à l'esprit que la population
locale demeure la force motrice dans les écosystèmes naturels
(Aronson et al., 1995).
La distribution du Miombo est bien connue. Cependant,
les groupements végétaux, les différents modèles
d'associations des espèces et les facteurs influençant la
distribution des
7
? Au niveau des écosystèmes : Maintenir ou
accroître la productivité primaire ou secondaire et
améliorer la biodiversité.
? Au niveau des paysages : Faciliter la
réintégration au cas où, le paysage a été
fortement fragmentés.
Il est difficile de reconstituer exactement le fonctionnement
des écosystèmes historiques, mais il est possible de
ré-établir les espèces des groupements
végétaux connues (Aronson et al, 1995).
1.3.2. Etapes de la restauration des groupements
végétaux
Les gestionnaires de l'environnement sont confrontés
à des difficultés dans la mise en place des pratiques de
restauration écologiques des écosystèmes (Bioret,
2006).
La confrontation des données paléo
écologiques, génétiques, associées aux
caractéristiques biologiques des espèces charismatiques des
groupements végétaux, conduit à améliorer les
connaissances sur la réactivité future des groupements
végétaux (Whattaker et al., 2005).
La connaissance des conditions historiques est un point de
départ important dans la détermination de la zone de
référence (état dans lequel se trouvait l'habitat avant
qu'il soit modifié) et de la zone à réhabiliter (Society
for Ecological Restoration International Science & Policy Working Group,
2004).
Les sources des données qui seront utilisées
dans la délimitation de la zone de référence/zone à
réhabiliter sont notamment:
Les descriptions écologiques, les photographies
aériennes de la végétation (anciennes et récentes),
les vestiges du site qui restent à restaurer (indiquant les conditions
physiques et le biotope antérieurs), les descriptions écologiques
(d'écosystèmes similaires intacts), les spécimens des
herbiers.
Ceci permet de représenter sur un graphique la
trajectoire des groupements végétaux à restaurer, à
partir de données écologiques et de modèles de
prédiction (Society for Ecological Restoration International Science
& Policy Working Group, 2004).
8
espèces sont mal expliqués. Alors que, la
gestion durable des écosystèmes du Miombo doit passer par leur
compréhension.
2. OBJECTIFS
L'objectif général de cette étude est de
caractériser les communautés végétales de
Mikembo en lien avec les paramètres édaphiques.
Pour atteindre cet objectif, trois objectifs
spécifiques:
· Caractériser différentes communautés
végétales par des critères objectifs.
· Caractériser les sols à l'aide d'un nombre
limité des paramètres édaphiques
· Etablir des relations entre les différentes
communautés végétales et les paramètres
édaphiques mesurés.
Dans le cadre de cette étude, on veut savoir :
· Quelles sont les communautés
végétales que l'on retrouve dans le sanctuaire Mikembo.
Comment se caractérisent-elles au niveau de la composition
floristique ?
· Comment s'expliquent-elles en fonction des
paramètres dendrométriques ? Retrouve-t-on les mêmes
espèces indicatrices au sein des différentes strates ? Et dans la
régénération ?
· Peut-on expliquer la variabilité des
communautés végétales par un nombre limité des
paramètres physiques édaphiques ?
· Comment se répartissent les communautés
végétales par rapport aux paramètres édaphiques
mesurés ?
· Quelle est la relation entre les paramètres
édaphiques mesurés et les paramètres
dendrométriques ?
9
3. MILIEU, MATERIELS ET METHODES 3.1. Milieu
d'étude
La présente étude a été
menée dans le site de Mikembo (Fig. 2) localisé au
niveau du village Kinsangwe, à 33 km de la ville de Lubumbashi sur l'axe
Lubumbashi-Kasenga (Province du Katanga, RD Congo) Le site est localisé
à 11°28'36,43» Sud, 27°39'58,00»Est et à une
altitude de 1181 m.
La concession de Mikembo a une superficie de 800 ha
dont 442 ha sont mise en défend depuis une dizaine d'années. La
présente étude a été réalisée dans
les 442 ha.
La végétation de Mikembo est
dominée par une végétation du type Miombo
à dominance de Brachystegia boehmii, Julbernardia globiflora,
J. paniculata, Pterocarpus angolensis, Marquesia macroura, et plusieurs
espèces de Combretum.
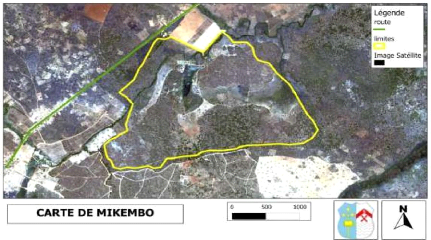
Figure 2: La carte de Mikembo.
Les sols dominant à Mikembo sont ocre-rouge,
suivi du rouge, en suite ocre et gris dont la profondeur est variable (Fig.
3).
10
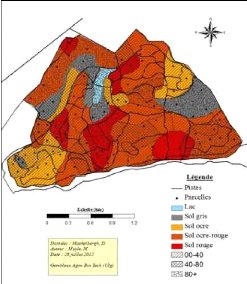
Figure 3: Carte de sol de Mikembo basée
sur une extrapolation de 53 points de sondage (Muyle & Maekelbergh,
2012).
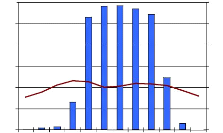
Le climat de Mikembo est similaire à celui de
la ville de Lubumbashi. La température moyenne annuelle est de 20°
C. Précipitation moyenne annuelle : 1225 l/m2. La saison
sèche dure moyenne de 5 mois (Mai-Septembre); Et la saison pluvieuse 4
mois (Novembre-Mars).
Lubumbashi, RDC (20.0°C, 1225 l/m2) 11°S
27°E
12300
100
80
30
20
10
0
60
40
20
0
J A S O N D J F M A M J
Figure 4 : La distribution annuelle des pluies à
Lubumbashi et ses environs. (
http://www.ecoles.cfwb.be/icesquaregnon/climats/frclimtypes.html).
11
Ce choix a été motivé
premièrement par le caractère conservatoire de la
biodiversité attribué à Mikembo depuis 2001. En
effet le sanctuaire Mikembo est l'un des rares sites de la province
où la coupe de bois est interdite de manière rigoureuse depuis
une dizaine d'années, le feu de brousse est scrupuleusement
contrôlé par une équipe permanente.
3.2. Cartographie des communautés
végétales.
La cartographie des communautés
végétales a été réalisée uniquement
sur les 442 ha de forêt claire conservée à Mikembo.
Elle a consisté en une classification supervisée (Image
satellitaire World view-2. Résolution 5 m × 5 m. Projection:
UTM-35S. Mai, 2011) de différentes communautés
végétales basée sur les critères physionomiques :
La dominance des espèces, la présence et la hauteur moyenne des
gros arbres, la densité des tiges.
De cette classification, une première version de la
carte de végétation a été établie. Ensuite,
pour chaque communauté, les points aléatoires ont
été générés dans le Logiciel QGIS1.7.4
(logiciel gratuit) et projetés sur l'image World view-2. Au total, 69
points ont été distribués dans différentes
communautés en fonction de leur superficie comme illustrer dans le
tableau 1. Ce nombre a été fixé en tenant compte des
contraintes de temps et de la disponibilité des appareils de mesures.
Le Tableau 1, montre les nombres des placettes à
installer en fonction de la superficie des différentes formations
végétales.
Tableau 1: Le nombre de placettes en fonction de la
superficie des formations végétales.
Surface de la formation végétale Nombre de
placettes
=25 4
De 12 à25 3
de 5 à12 2
< à 5 1
En effet, on peut déterminer le nombre de placettes
à installer en fonction du temps que l'on dispose de la manière
suivante (Rondeaux, 1999) :
Soit C, la totalité de jours dont on
dispose, et C1, la durée que prend l'échantillonnage, , la
durée requise pour terminer le travail dans une placette, n le
nombre d'unité d'échantillonnage à installer, alors :
.
?? = ??1 + ????2 . D'où ?? =
(??-????)
????
12
Dans le cas de cette étude ; la totalité des
jours dont on disposait était de 91 jours, la durée de
l'échantillonnage était de 80 jours, alors que la durée
moyenne par placette était de 4 heures, soit 0.16 jour. Dans ce cas
n = (91-80)/0.16, soit 69 placettes
correspondant à un taux de sondage de 1.7%. Le tableau 2 reprend les
différentes formations végétales inventoriées sur
base des critères physionomiques (hauteur moyenne, présence de
gros arbres,...) et la dominance des espèces, leur surface et le nombre
total de placettes.
Tableau 2: Le nombre de placettes et la superficie des
formations végétales de Mikembo.
Formations végétales
|
Acronyme
|
Surface (ha)
|
Nombre de
placettes
|
Forêt à Brachystegia
|
BR
|
8.5
|
3
|
Forêt à Brachystegia
|
BN
|
5.3
|
2
|
Forêt à Brachystegia
|
BCA
|
2.7
|
1
|
Forêt à Brachystegia boehmii
|
BBC
|
46.9
|
4
|
Forêt à Julbernardia
|
JSE
|
14.2
|
3
|
Forêt à Julbernardia
|
JN
|
10.4
|
2
|
Forêt à Julbernardia
|
JCA
|
6.2
|
2
|
Forêt à Julbernardia paniculata
|
JP
|
26.2
|
4
|
Forêt à Marquesia -
Brachystegia
|
MB
|
8.1
|
4
|
Forêt à Marquesia -
Julbernardia
|
MJ
|
62.8
|
4
|
Forêt à Uapaca - Julbernardia
|
UJ
|
12.8
|
3
|
Forêt à Uapaca en mélange
|
UM
|
33.7
|
4
|
Forêt ancienne à Marquesia
|
MA
|
11.8
|
4
|
Forêt de transition
|
ZT
|
19.7
|
3
|
Forêt mélangée
|
FM
|
1.5
|
1
|
Pénéplaine
|
PN
|
18.0
|
3
|
Savane à Uapaca
|
SU
|
5.9
|
3
|
Savane arborée
|
ZHR
|
14.1
|
3
|
Savane arborée
|
ZHN
|
11.4
|
2
|
Savane arborée
|
ZHL
|
4.7
|
1
|
Savane arborée
|
CA
|
1.4
|
2
|
Savane arborée (ancien champ d'arachides)
|
CHA
|
1.6
|
0
|
Savane arborée à Acacia polyacanta
|
AP
|
3.3
|
1
|
Savane boisée à Terminalia
|
TB
|
14.9
|
3
|
Savane boisée à Terminalia
|
TN
|
11.8
|
2
|
Savane boisée à Terminalia
|
TS
|
11.6
|
2
|
Savane boisée à Terminalia
|
TMB
|
3.1
|
1
|
Savane boisée à Terminalia
|
TL
|
1.9
|
1
|
Savane herbeuse
|
H
|
39.1
|
1
|
TOTAL
|
|
413.6
|
69
|
|
? La couleur du sol a été
déterminée à l'aide d'un chart munsell. Elle
pourrait avoir une signification chimique.
13
3.3. Inventaire floristique.
Dans cette étude, seules les strates arborescente et
arbustive ont été prises en compte. Les termitières ont
été évitées parce qu'elles constituent des
micro-habitats très particuliers qui nécessitent une étude
à part entière. Lorsque le point tombe sur une termitière,
on change l'emplacement en prenant une direction aléatoire.
La variabilité en espèce a permis de fixer la
taille de la placette à 10 ares. Soit une placette circulaire de 18 m de
rayon, délimitée à l'aide d'un
télémètre à ultra son (vertex). Cette forme a
été adoptée parce qu'elle réduit les risques de
confusion pour les individus en bordure, elle évite la
subjectivité de la direction lors de l'implantation, et minimise le
rapport périmètre/surface (Giliba et al., 2011).
Dans chaque placette, tous les arbres et arbustes de
diamètre supérieur ou égal à 2 cm ont
été inventoriés et mesurés. Pour la
régénération, les individus de moins de 2 cm de
diamètre et supérieur à 20 cm de hauteur ont
été comptés.
L'identification des espèces rencontrées sur
terrain a été effectuée à l'aide des flores
suivantes : flora zambesiaca (
http://apps.kew.org/efloras/.),
flora of Zambia (
http://zambiaflora.com/), flora
of Zimbabwe, National Botanic Garden of Belgium. The BR Herbarium catalogue
(
http:// www.br.fgov.be)
ainsi que la flore d'Afrique Centrale.
3.4. Observations et mesures
Les paramètres suivants ont été
mesurés ou observés sur les végétaux:
? Diamètre à hauteur de la poitrine (dhp
à 130 cm du sol) à l'aide du ruban forestier, la hauteur à
l'aide d'un télémètre à ultrason (vertex),
? le mode de régénération (graine, tige,
souche) : Un comptage des tiges qui se développent sur souche, tige et
graine a été effectué. Ceci permet de quantifier la
dynamique de reproduction.
Les paramètres édaphiques suivants ont
été prélevés dans cette étude :
14
· La profondeur du sol. Elle a été
mesurée avec un bâton gradué (cm) et rigide à partir
du sondage réalisé avec une tarière. Trois classes ont
été générée en fonction des profondeurs
rencontrées : Sol peu profond (0-40cm), Sol profond (40-80 cm), Sol plus
profond (plus de 80 cm). Ces classes ont été établies en
fonction du jeu de donnée en notre possession.
· La profondeur de la charge caillouteuse a
été mesurée directement avec un bâton gradué
(cm).
Les deux derniers paramètres ont été
choisis comme proxy de la texture et de la structure du sol.
3.5. Analyse des données
3.5.1. Caractérisation des communautés
végétales. Les communautés
végétales ont été déterminées par
:
· Une ordination (NMDS) sur base des distances de
Bray Curtis calculée sur le log(x+1) des abondances; parce
qu'il offre la même contribution de dissimilarité entre
les espèces quel que soit leurs abondance/leur rareté.
· Suivi d'une classification non-hiérarchique
(K-means) sur les coordonnées des points de la NMDS en
utilisant un critère objectif afin de déterminer le nombre de
communautés optimal (critère de Calinski) (Legendre and
Legendre 1998).
Les espèces seront traitées
indépendamment les unes des autres en tenant compte des
différentes strates.
Les strates ont été définies en fonction
des hauteurs (Smith & Allen, 2004) :
· Strate arbustive : Tous les individus dont la hauteur est
inférieure ou égale à 7 m.
· Strate arborée dominée : Tous les
individus dont la hauteur est comprise entre 7 et 14 m de hauteur.
· Strate arborée dominante : Tous les individus
dont la hauteur est supérieure à 14 m.
15
3.5.2. Détermination des espèces
indicatrices et les espèces abondantes dans
différentes communautés
végétales.
La méthode de groupement IndVal (indicator value
index) a servi pour déterminer les espèces
indicatrices des communautés végétales. Le
principe repose sur la comparaison des
fréquences et des abondances au sein d'une espèce
(Dufrêne 2004).
?????? = ???????????????????????? ; ?????? =
????????????????
?????????????? (5)
???? ??????????????????
???????????????? = ?????? * ?????? * 100 (6)
Avec, Aij : La mesure de spécificité,
Bij : La mesure de fidélité.
· Nij : nombre moyen d'individus de l'espèce i dans
le groupe j
· Ni : somme des nombres moyens d'individus de
l'espèce i parmi tous les groupes.
· Nij : nombre de sites du groupe j où
l'espèce i est présente.
· Ni : nombre total de sites dans le groupe j.
· IndValij : indice IndVal pour l'espèce
i du groupe j.
A partir des abondances des espèces, l'abondance
relative de chaque espèce a été calculée dans
chaque communauté.
Les espèces indicatrices et les espèces
abondantes ont été déterminées dans chaque
communauté végétale, par strate ainsi que dans la
régénération.
3.5.3. Structure des communautés
végétales.
Pour chaque communauté végétale, la
caractérisation était basée sur le calcul des variables
dendrométriques suivantes :
· La surface terrière à l'hectare (GHA).
· Le nombre de tiges par hectare (NHA).
· Hauteur moyenne (Hmoy).
· Hauteur dominante du peuplement (Hdom) : Hauteur
moyenne de 20% des arbres les plus gros.
· Diamètre moyen du peuplement (Dmoy).
· Nombre de tiges de régénération
par hectare (NHA régénération).
· Hauteur moyenne dans la
régénération (Hmoy régénération).
16
A cela s'ajoute trois paramètres pour la dynamique de
reproduction :
? Moyenne des tiges régénérées par
graine (Pgr). ? Moyenne des tiges régénérées sur
souche (Pso). ? Moyenne des tiges régénérées sur
tronc (Ptr).
Les graphiques des distributions des tiges par classes de
diamètre ont été établis pour chaque
communauté végétale.
Ensuite des graphiques pour les espèces qui dominent la
canopée des différentes communautés
végétales de Mikembo en particulier et du Miombo
en général. Ce sont les espèces : Brachystegia
boehmii, Julbernardia paniculata, Julbernardia
globiflora, Uapaca nitida et Marquesia macroura. Ces
graphiques ont permis de distinguer les espèces ayant un bon profil dans
la dynamique de régénération du Miombo.
Enfin, l'effet groupe a été testé sur les
différents paramètres au niveau du peuplement par une analyse de
la variance suivi d'une structuration de moyenne dans Minitab 16.
3.5.4. Paramètres du sol.
Des relations ont été établies entre
d'une part, les abondances et la couleur, la profondeur du sol; Et d'autre
part, les espèces indicatrices et la couleur, la profondeur du sol et de
la charge.
En enfin, un test de khi carré suivi de la
structuration de moyenne a été effectuée dans Minitab
16. Pour voir si la répartition de placettes dans
différentes communautés est fonction des paramètres
édaphiques mesurés.
17
4. RESULTATS.
4.1. Carte de végétation et
inventaires.
La Figure 5, illustre les 19 formations végétales,
qui occupent 413 ha sur 442 ha. Les points noirs sont les 69 placettes
projetées aléatoirement.
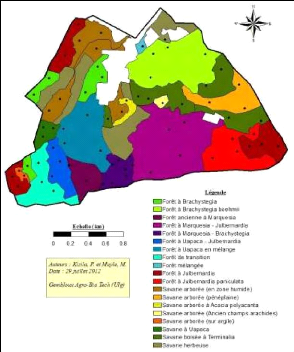
Figure 5: La carte de végétation
préliminaire de Mikembo.
4.2. Caractérisation des
communautés.
La Figure 6, montre la première ordination qui a
révélé 6 groupes de placettes. Les savanes arborées
sont reprises dans le groupe f, les zones humides
dans le groupe c et les peuplements à Brachystegia boehmii dans
le groupe e. Les groupes a, b et
d sont mélangés.
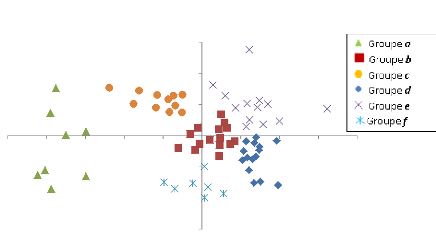
18
0,5
0
-2,5 -2 -1,5 -1 -0,5 0 0,5 1 1,5 2
NMDS1
-0,5
-1
-1,5
1,5
1
NMDS2
Figure 6: Les six groupes issus de la première
ordination réalisée sur 69 placettes.
Le tableau 3, reprend les placettes dans différents
groupes définit par la première ordination. Toutes les savanes
boisées sont reprises dans le groupe f, les
savanes arborées dans le groupe
c et les peuplements à
Brachystegia boehmii dans le groupe e. Dans
le groupe d, on trouve des nombreuses formations
à Julbernardia, des Marquesia et
Brachystegia, Les groupes a, b et
d sont moins différenciés.
Tableau 3: La répartition des placettes dans
différents groupes après la première
ordination.
Groupe a Groupe b
Groupe c Groupe d
Groupe e Groupe
f
BR3 BCA1 PN1 JCA1 BBC1 AP1
JN2 BN1 PN2 JCA2 BB CA1
JSE3 BN2 PN3 JN1 BBC3 CA2
MA2 BR2 TL1 JP1 BBC4 FM1
MB4 MA1 ZHL1 JP2 BR1 TB1
MJ1 MA3 ZHR1 JP3 TN1 TB2
MJ2 MA4 ZHR2 JP4 TN2 TB3
MJ3 SU1 ZHR3 JSE1 TBBC1
UJ1 SU2 JSE2 TMB1
UJ2 SU3 MB1 TS1
UM3 TS2 MB2 ZHN1
UM4 UJ3 MB3
ZT1 UM1 MJ4
ZT2 UM2
ZT3 ZHN2
Une deuxième ordination a été
effectuée avec les placettes des groupes qui ce sont
révélés très hétérogène
(groupes a, b et
d). Soit un total de 43 placettes.
Le résultat de cette deuxième analyse
présente une distribution des placettes en 4 groupes et une placette
isolée.
19
Le groupe 1 comprend les placettes des forêts de
transition, le groupe 2, reprend les peuplements à Julbernardia
spp., alors que le groupe 3, regroupe toutes les placettes des zones
matures à gros fûts. Le groupe 4, est constitué du reste
des placettes forestières. Le groupe 5 est constitué d'une
placette isolée qui a été supprimée.
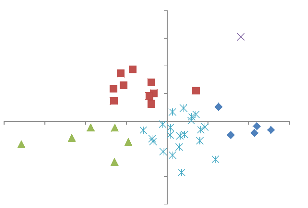
2
NMDS2
1,5
1
0,5
Groupe 1 Groupe 2 Groupe 3 Groupe 4 Placette isolée
0
-2 -1,5 -1 -0,5 0
NMDS1
0,5 1 1,5
-0,5
-1
-1,5
Figure 7: Les 5 groupes issus de la deuxième
classification effectuée sur les groupes a; b ; d
(Nombre de placettes : 43).
Les groupes a, e
et i de la première
classification, et le groupe 4 de la seconde classification ont
été remis, pour une troisième ordination. Les
résultats de cette analyse ont montrés que, mise à part le
groupe e (zones humides) de la première
analyse, séparer ces placettes étaient inutile parce qu'ils
reflètent la réalité de terrain.
La distribution définitive des placettes dans
différents groupes est reprise dans le tableau 4.
Le groupe F est constitué des placettes qui se situe
dans la savane, le groupe G, est constitué des placettes en zone humide,
le groupe I, a été exclu parce que c'est une placette
isolée des autres groupes.
20
Tableau 4: La distribution des placettes dans
différents groupes après la troisième
ordination
Groupe Groupe Groupe Groupe Groupe Groupe Groupe Groupe
Groupe
A B C D E F G H I
BR3 JCA1 BR2 AP1 BCA1 SU1 PN1 ZHL1 BBC1 JN1 UM4 JCA2 MA3 CA1 BN1
SU2 PN2 ZHR1 BB
ZT1 JP1 MB1 CA2 BN2 SU3 PN3 ZHR2 BBC3
ZT2 JP2 MB2 FM1 JN2 TS2 TL1 ZHR3 BBC4
ZT3 JP3 MB3 TB1 JSE3 UJ1 BR1
JP4 UM1 TB2 MA1 UJ2 TN1
JSE1 TB3 MA2 UJ3 TN2
JSE2 TBBC1 MA4 UM2 JN1
MJ3 TMB1 MB4 UM3
MJ4 TS1 MJ1 ZHN2
ZHN1 MJ2
Pour les groupes restant, les résultats sur l'abondance
et les espèces indicatrices dans différentes strates
(arbustes-arborée dominé-arborée dominante) ainsi que la
régénération est repris dans les tableaux 5 et 6.
Le tableau 3, reprend les abondances des espèces
à différentes strates et dans la
régénération dans les 8 communautés
végétales.
Au niveau du peuplement : On remarque que U. nitida
est plus abondante dans le groupe 1, avec 39.6%. Dans les groupe 2 c'est
J. paniculata (43.1%) ; P. tinctorius (13.5%) dans le groupe
3 ; C. adenogonium (36.9%) dans le groupe 4 ; J. globiflora
(26.2%) dans le groupe 5 ; Acacia spp. (36.9) dans le groupe 6 ;
A. polyacantha (89.6%) dans le groupe 7 ; et B. boehmii
(62.5%) dans le groupe 8.
Au niveau des strates : Les deux premiers groupes sont
dominés par U.nitida, le groupe 3 par P. tinctorius ;
le groupe 4 : C. adenogonium, groupe 5 : J.globiflora ;
groupe 6 : Acacia sp. Le groupe 7 : A polyacantha. Et le
groupe 8 : B.boehmii.
Au niveau de la régénération les
espèces les plus dominantes par ordre de numéro des groupes :
U.nitida, J. globiflora, D. boehmii, D. boehmii, J. globiflora, A. venosum,
A. polyacantha, B.boehmii.
21
Tableau 5: Les abondances des espèces par strates,
par peuplement et dans la régénération pour les 8
communautés végétales (Abod : Abondance).
|
Groupe
|
Peuplement
|
|
Peuplement par strate
|
|
Régénération
|
|
|
Espèce
|
Abod (%)
|
Espèce
|
Abod
|
Espèce
|
Abod (%)
|
|
|
|
|
(%)
|
|
|
|
A
|
Uapaca nitida
|
39.6
|
Uapaca nitida arbu.
|
36.0
|
Uapaca nitida
|
30.4
|
|
Uapaca sansibarica
|
11.5
|
Uapaca pilosa arbu.
|
9.1
|
Julbernardia globiflora
|
19.7
|
|
Uapaca pilosa
|
9.4
|
Uapaca sansibarica arbu.
|
8 .2
|
Uapaca pilosa
|
9.0
|
|
B
|
Julbernardia paniculata
|
43.1
|
Uapaca nitida arbu.
|
36.0
|
Julbernardia globiflora
|
28.6
|
|
Diplorhynchus condylocarpon
|
6.9
|
Uapaca pilosa arbu.
|
9.1
|
Julbernardia paniculata
|
15.6
|
|
Julbernardia globiflora
|
5.9
|
Uapaca sansibarica arbu.
|
8.2
|
Diplorhynchus condylocarpon
|
5.5
|
|
C
|
Pterocarpus tinctorius
|
13.5
|
Pterocarpus tinctorius arbu.
|
11.4
|
Dalbergia boehmii
|
34.9
|
|
Diplorhynchus condylocarpon
|
12.3
|
Pseudolachnostylis maprouneifolia arbu.
|
6.8
|
Brachystegia boehmii
|
22.3
|
|
Pseudolachnostylis maprouneifolia
|
9.9
|
Dalbergia boehmii arbu.
|
6.1
|
Brachystegia spiciformis
|
5.0
|
|
D
|
Combretum adenogonium
|
36.9
|
Combretum adenogonium arbu.
|
34.4
|
Dalbergia boehmii
|
20.7
|
|
Terminalia sp.
|
18.3
|
Terminalia sp. arbu.
|
12.3
|
Combretum adenogonium
|
18.0
|
|
Dalbergia boehmii
|
9.4
|
Dalbergia boehmii arbu.
|
8.4
|
Terminalia sp.
|
11.2
|
|
E
|
Julbernardia globiflora
|
26.2
|
Julbernardia globiflora arbu.
|
22.3
|
Julbernardia globiflora
|
51.4
|
|
Dalbergia boehmii
|
7.9
|
Dalbergia boehmii arbu.
|
6.6
|
Dalbergia boehmii
|
6.7
|
|
Diplorhynchus condylocarpon
|
7.6
|
Diplorh. condylocarpon arbu.
|
5.6
|
Brachystegia spiciformis
|
4.5
|
|
F
|
Acacia sp.
|
36.9
|
Acacia sp. arbu.
|
28.2
|
Antidesma venosum
|
36.7
|
|
Acacia polyacantha
|
23.9
|
Piliostigma thonningii arbu.
|
21.7
|
Markhamia obtusifolia
|
26.4
|
|
Piliostigma thonningii
|
21.7
|
Acacia polyacantha arbo.
|
13.0
|
Terminalia sp.
|
25.0
|
|
G
|
Acacia polyacantha
|
89.6
|
Acacia polyacantha arbo.
|
41.3
|
Acacia polyacantha
|
54.5
|
|
Markhamia obtusifolia
|
3.4
|
Acacia polyacantha arbu.
|
36.2
|
Harungana madagascariensis
|
45.4
|
|
Allophylus africanus
|
1.7
|
Acacia polyacantha dom.
|
12.0
|
|
|
|
H
|
Brachystegia boehmii
|
62.5
|
Brachystegia boehmii arbu.
|
36.7
|
Brachystegia boehmii
|
57.2
|
|
Brachystegia longifolia
|
7.3
|
Brachystegia boehmii arbo.
|
23.3
|
Uapaca nitida
|
7.7
|
|
Pseudolachnostylis maprouneifolia
|
4.0
|
Brachystegia longifolia arbu.
|
4.0
|
Phyllocosmus lemerianus
|
6.7
|
22
Le Tableau 6, montre les espèces indicatrices dans le
peuplement, dans différentes strates et dans la
régénération. Au niveau du peuplement, le groupe A, a
quatre espèces indicatrices, le groupe B : J. paniculata, dans
les groupes C et F : il n'y a pas des espèces indicatrices. Le groupe D
: C. adenogonium et Terminalia sp. Le groupe E : J.
globiflora. Le groupe G : A. polyacantha. Le groupe H : B.
boehmii et B. longifolia. Au niveau de différentes strates ce sont
les genres : Uapaca, Monotes, Julbernardia, Annona, Combretum, piliostigma,
Acacia, Brachystegia. Alors que dans la régénération
on a les genres : Monotes, Uapaca, Parinari, Julbernardia, Dalbergia,
Combretum, Piliostigma, Brachystegia, Pseudolachnostylis, Plyllocosmus.
Tableau 6: Les espèces indicatrices par strate,
par peuplement et dans la régénération pour les 8
communautés végétales.
|
Groupe
|
Peuplement
|
|
Peuplement par strate
|
|
Régénération
|
|
|
Espèce
|
IV
|
Espèce
|
IV
|
Espèce
|
IV
|
|
|
(%)
|
|
(%)
|
|
(%)
|
|
A
|
Uapaca nitida
|
86.7
|
Uapaca nitida arbu.
|
88.5
|
Monotes katangensis
|
77.6
|
|
Uapaca sansibarica
|
78.1
|
Uapaca sansibarica arbu.
|
80.3
|
Uapaca nitida
|
73.3
|
|
Uapaca pilosa
|
74.1
|
Uapaca pilosa arbu.
|
73.6
|
Parinari curatellifolia
|
69.5
|
|
Monotes katangensis
|
66.7
|
Monotes katangensis arbu.
|
71.1
|
Uapaca pilosa
|
58.5
|
|
|
|
Uapaca sansibarica arbo.
|
57.3
|
|
|
|
|
|
Uapaca nitida arbo.
|
57.2
|
|
|
|
B
|
Julbernardia paniculata
|
89.1
|
Julbernardia paniculata arbo.
|
88.9
|
Julbernardia paniculata
|
77.4
|
|
|
|
Julbernardia paniculata arbu.
|
88.8
|
|
|
|
|
|
Julbernardia paniculata dom.
|
70
|
|
|
|
C
|
|
|
Annona senegalensis arbo.
|
54.4
|
Dalbergia boehmii
|
37.6
|
|
|
|
Diplorhynchus condylocarpon arbo.
|
40.6
|
|
|
|
D
|
Combretum adenogonium
|
93.1
|
Combretum adenogonium arbu.
|
94.7
|
Combretum adenogonium
|
69.1
|
|
Terminalia sp.
|
74.7
|
Terminalia sp. arbu.
|
74.9
|
|
|
|
E
|
Julbernardia globiflora
|
65.4
|
Julbernardia globiflora arbu.
|
73.9
|
Julbernardia globiflora
|
55.1
|
|
F
|
|
|
Piliostigma thonningii arbu.
|
62.5
|
Piliostigma thonningii
|
43.2
|
|
G
|
Acacia polyacantha
|
72.1
|
Acacia polyacantha arbu.
|
78.2
|
|
|
|
|
|
Acacia polyacantha arbo.
|
53.3
|
|
|
|
H
|
Brachystegia boehmii
|
91.7
|
Brachystegia boehmii arbo.
|
94.8
|
Brachystegia boehmii
|
84.8
|
|
Brachystegia longifolia
|
49.5
|
Brachystegia boehmii arbu.
|
89.5
|
Pseudolachnostylis maprouneifolia
|
59.7
|
|
|
|
Brachystegia longifolia arbo.
|
53.2
|
Phyllocosmus lemaireanus
|
50.5
|
23
Suite à cette première analyse, le Tableau 7
illustre la nouvelle classification des groupes: 8 communautés ont
été créées sur base de la structure et de la
composition floristique. On a trois forêts
hétérogènes, deux savanes arborées, une savane
boisée, forêt de régénération, forêt
ancienne.
Tableau 7: Reclassification des communautés
végétales tenant compte de la structure et de la composition
floristique.
|
Classification selon
la structure
|
Classification selon la
composition
|
Classification finale
|
|
A
|
Forêt de régénération
|
Uapaca spp.
|
Forêt de régénération à
Uapaca spp.
|
|
B
|
Forêt hétérogène
|
J. paniculata
|
Forêt hétérogène à J.
paniculata
|
|
C
|
Forêt ancienne
|
P. tinctorius
|
Forêt ancienne à P. tinctorius
|
|
D
|
Savane boisée
|
C. adenogonium et Terminalia sp.
|
Savane boisée à C. adenogonium et
Terminalia sp.
|
|
E
|
Forêt hétérogène
|
J. globiflora
|
Forêt hétérogène à J.
globiflora
|
|
F
|
Savane arborée
|
Acacia spp.
|
Savane arborée à Acacia spp.
|
|
G
|
Savane arborée
|
A. polyacantha
|
Savane arborée à A. polyacantha
|
|
H
|
Forêt hétérogène
|
B. boehmii
|
Forêt hétérogène à B.
boehmii
|
4.3. Structure des communautés.
Les Tableau 8 et 9, montre qu'il existe des différences
significatives entre communautés pour différents
paramètres dendrométriques. Les valeurs de p sont
inférieures à 0,05. Alors que pour la hauteur dominante il n'y a
pas des différences significatives p=0.077.
Il existe des différences significatives entre
communautés pour tous ces paramètres (p<0.05), sauf le
pourcentage de régénération par tige (p=0.43).
Lorsqu'on observe le Tableau 8, les forêts
hétérogènes (B. boehmii, J. globiflora, J.
paniculata), et la forêt ancienne, enregistrent des surfaces
terière entre 13.5 m2/ha et 16.1 m2/ha. Cette
gamme de valeurs relève de la forêt claire. Alors que dans les
savanes, deux gammes de valeurs peuvent être distinguées: 3.2
m2/ha pour les deux savanes à Acacia
sp. et 5.3 m2/ha, pour la
savane à Combretum et Terminalia.
24
Tableau 8: Différents paramètres de
structure dans différentes communautés végétales.
La valeur sous parenthèse représente l'erreur standard, les
lettres représentent les groupes.
|
GROUPES
|
Forêt
hétérogène
à
B. boehmii
|
Forêt
hétérogène
à
J.
globiflora
|
Forêt
hétérogène
à
J.
paniculata
|
Forêt
de
régénération
à
Uapaca
spp.
|
Forêt
ancienne à P.
tinctorius
|
Savane
arborée à
Acacia
spp.
|
|
Nombre
placette
|
7
|
21
|
10
|
5
|
6
|
4
|
|
GHA (m2/ha)
|
13.7abcd (1.2)
|
13.5abcd (1.4)
|
16.1cd(2)
|
11.5abc (2.3)
|
15bcd (2.4)
|
3.2a (1.2)
|
|
NHA (tiges/ha)
|
1134ab (199)
|
1319a(157)
|
1437a(155)
|
1328a(154)
|
689ab(151)
|
113b(32)
|
|
Hmoy(m)
|
6.3a (1.2)
|
5.8a (1.5)
|
7.9ab(2)
|
5.5a (1.3)
|
7.7ab (2.2)
|
5.8ab (1.5)
|
|
Hdom(m)
|
10.3ab (3.2)
|
10.7ab (2.3)
|
13.4ab (3.4)
|
9.0a (2.5)
|
13.7ab (5.1)
|
10.6ab (4.1)
|
|
Dmoy(m)
|
8.6ab (3.1)
|
7.2ab (2.4)
|
8.2ab (2.9)
|
6.9ab (1.7)
|
11.1ab (4.7)
|
10.1b (4.5)
|
|
NHA (régé)
|
2325c (368)
|
1919bc(249)
|
1655abc(247)
|
1800abc(296)
|
1035abc(283)
|
167a(55)
|
|
Hmoy (régé)
|
1.1a (0.5)
|
1.2a (0.7)
|
1.1a (0.8)
|
0.8ab (0.1)
|
1.0ab (0.4)
|
0.6bc (0.1)
|
|
Savane Savane boisée à
C.
arborée à A. adenogonium
et
polyacantha Terminalia sp.
|
p-value
|
|
4
|
11
|
|
|
3.2a (1.0)
|
5.3ab (0.9)
|
0,017
|
|
142b(49)
|
642ab(123)
|
0,001
|
|
7.4a (3.4)
|
4.4a (1.4)
|
0,077
|
|
11.7ab (4.3)
|
7.7a (2.5)
|
0,000
|
|
12.6ab (2.8)
|
6.4a (2.4)
|
0,002
|
|
27ab(27)
|
505ab(126)
|
0,002
|
|
0.3c (0.1)
|
1.0ab (0.3)
|
0,001
|
|
Tableau 9: Moyenne de caractéristique des
paramètres de communautés végétales.
|
|
|
|
|
|
GROUPES
|
Forêt
|
Forêt
|
Forêt hétérogène
|
Forêt de
|
Forêt ancienne
|
Savane arborée
|
Savane arborée
|
Savane boisée à
|
p
|
|
hétérogène à B.
boehmii
|
hétérogène à
J.
globiflora
|
à J. paniculata
|
régénération
à
Uapaca spp.
|
à P. tinctorius
|
à Acacia spp.
|
à A.
polyacantha
|
C. adenogonium
et Terminalia
sp.
|
value
|
|
Nombre de
placettes
|
7
|
21
|
10
|
5
|
6
|
4
|
4
|
11
|
|
|
Pgr.
|
30.6 a (55.9)
|
35.7 a (52.3)
|
31.7 a (68.0)
|
44.7 ab (28.2)
|
43.2 ab (34.6)
|
24.7 a (121.9)
|
80.7 c (24.3)
|
15.6 a (57.1)
|
0,000
|
|
Pso.
|
49.7 ab (42.1)
|
60.1 a (32.9)
|
62.1 ac (35.7)
|
50.8 ab (25.4)
|
48.1 ab (38.1)
|
75.3 a (39.9)
|
17.8 ab (115.2)
|
77.5 a (8.6)
|
0,000
|
|
Ptr.
|
19.6 b (76.4)
|
4.1 a (73.0)
|
6.1 ab 81.7
|
4.3 a 46.3
|
8.7 ab (111.5)
|
0a /
|
1.4 a (200.0)
|
6.8 ab (104.5)
|
0,43
|
25
4.4. La distribution de tiges par catégorie de
diamètre dans différentes communautés
végétales.
La figure 8, montre la distribution de fréquence dans
la forêt de régénération à Uapaca.
La distribution est asymétrique. La classe 5, a moins d'individus. La
classe 10 enregistre plus d'individus que toutes les autres.
3500
3000
2500
NHA
2000
1500
1000
500
0

5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
Classe de diamètre
Figure 8: La distribution des tiges par classe de
diamètre dans la forêt de régénération
à Uapaca sp.
La figure 9, montre la distribution de fréquence
d'Uapaca nitida dans la forêt de
régénération à Uapaca sp. qui
présente une distribution asymétrique. Il n y a pas d'individus
dans les classes 25, 30, 35.
|
1800 1600 1400 1200 1000 800 600 400 200
|
|
|
|
NHA
|
|
|
|
0
|
|
|
|
Classe de diamètre
Figure 9: La distribution de tiges par classe de
diamètre d'U. nitida dans la forêt de
régénération
à Uapaca sp.
26
La figure 10, montre la distribution de tiges par classe de
diamètre dans la forêt hétérogène à
J. paniculata, environs 6000 tiges/ ha, alors que la classe de
recrutement n'a qu'environ 4900 tiges/ha.
7000
6000
5000
2000
1000
0
5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
Classe de diamètre
Figure 10: La distribution de fréquence dans la
forêt hétérogène à J.
paniculata.
La figure 11, illustre la distribution de tiges par
catégorie de grosseur de J. paniculata dans la forêt
hétérogène à J. paniculata. La classe 5
enregistre environs 1700 tiges/ha. La classe 10 a environs 2800 tiges/ ha.
3000
2500
2000
NHA
1500
1000
500
0
5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
Classe de diamètre
Figure 11: La structure de J. paniculata dans la
forêt hétérogène à J.
paniculata.
5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
27
La figure 12, montre la distribution de tiges par
catégorie de diamètre dans la forêt ancienne à
P.tinctorius. La structure est inéquiènne avec des
ondulations.

2000
5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
Classe de diamètre
Figure 12: La structure de la forêt ancienne
à P. tinctorius.
La figure 13. Montre la distribution de tiges par
catégorie de grosseur dans la savane boisée à C.
adenogonium. Dans cette communauté, le nombre de tiges dans la
classe 10 est plus élevé. Par contre le nombre de tiges dans la
classe 5 semble relativement faible. Entre la classe 30 et la classe 55, il y a
un vide.
|
NHA
|
3500 3000 2500 2000 1500 1000 500
0
|
Classe de diamètre
Figure 13: La structure de la savane boisée
à C. adenogonium.
La figure 14, représente la distribution de
fréquence de la forêt hétérogène à
J. globiflora qui est inéquiènne comme toute structure
naturelle. Mais il convient de signaler que dans les classes 60 ; 65 ; 85 et
95, il y a absence d'individus.
|
NHA
|
14000 12000 10000 8000 6000 4000 2000
0
|
28
5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
Classe de diamètre
Figure 14: La structure de la Forêt
hétérogène à J.globiflora.
La figure 15, illustre la distribution de tiges de M.macroura
par catégorie de grosseur dans la forêt
hétérogène à J. globiflora.
M. macroura présente une distribution dont
plusieurs classes manquent d'individus. Cela s'observe surtout à partir
de la classe 40 jusqu'à la classe 100. Donc les individus
âgés. Par contre, on observe une régularité
d'individus entre les classes 5-35.
|
90
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
80
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
70
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60
|
|
|
|
|
|
|
|
|
NHA
|
|
|
|
|
|
|
|
|
50 40 30 20 10 0
|
|
|
|
|
|
|
|
5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
Classe de diamètre
Figure 15: La distribution de tiges par classe de
diamètre pour M. macroura.
La figure 16, montre la distribution de tiges par
catégorie de grosseur de J. globiflora dans la forêt
hétérogène à J globiflora.
29

NHA
4500
4000
5000
3500
3000
2500
2000
1500
1000
500
0
5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
Classe de diamètre
Figure 16: La structure de J.
globiflora.
La figure 17, illustre la distribution de fréquence de
la forêt hétérogène à B.boehmii. La
structure est asymétrique à gauche. La classe 10 contient
environs 3500 tiges/par. Alors que la classe 5 étant
considéré comme la classe de recrutement n'a qu'environs 2300
tiges/ ha.
5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
4000 3500 3000 2500
NHA
2000
1500 1000 500 0
Classe de diamètre
Figure 17: La structure de la Forêt
hétérogène à B. boehmii.
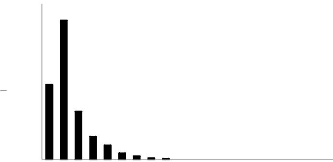
La figure 18, illustre la distribution de tiges par
catégorie de grosseur de l'espèce B.boehmii dans la
forêt hétérogène à Brachystegia.
La structure reste asymétrique comme pour la forêt
hétérogène à B. boehmii.
30
NHA
2500
2000
1500
1000
500
0
5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
Classe de diamètre
Figure 18: La structure de l'espèce B. boehmii
dans la Forêt hétérogène à B.
boehmii.
La figure 19, montre la distribution de tiges par
catégorie de diamètre dans la savane arborée à
Acacia spp. La classe de recrutement enregistre peu de tiges. La
classe 10 renferme environs 220 tiges.
5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
Classe de diamètre
Figure 19: La structure de la savane arborée
à Acacia spp.
Le Nombre de tiges /ha des savanes arborées à
Acacia spp.est faible, le maximum de tiges se concentre dans la classe
10, suivi de la classe 15. Par contre la classe 5 qui est
considérée comme la classe de recrutement enregistre peu de
tiges.
La figure 20, illustre la distribution de tiges par classe de
diamètre en savane arborée à A. polyacantha.
5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
31
Le NHA est relativement faible, environs 190 tiges/ ha pour la
classe 15, suivi de la classe 10 qui enregistre environs 160 tiges/ ha. Il
convient de signaler que la classe 40 n'a pas d'individus. Environs 20 tiges
dans la classe 45.

Classe de diamètre
Figure 20: La structure de la savane arborée
à A. polyacantha.
4.5. Facteurs édaphiques
Le Tableau 10, montre la répartition des placettes
suivant la couleur du sol. Le test Khi carré a montré que la
couleur du sol, influence moins la répartition des placettes dans
différentes communautés végétales (Khi
carré: 64,789; dl: 24; p=0.07). La valeur de p (p-value) est
une approximation qui n'est probablement pas valide. Parce qu'il y a beaucoup
de vides. Les forêts hétérogènes à B.
boehmii, à J. globiflora et paniculata, ainsi que
la forêt de régénération se situent sur sol ocre,
ocre-rouge, et rouge. 100% des savanes sont sur sol Gris. Par contre, la
forêt à P.tinctorius et La savane boisée à
C. adenogonium semblent n'est pas avoir des préférences.
La forêt de régénération à Uapaca spp.
semble s'établir sur sol ocre et ocre-rouge. Les trois forêts
hétérogènes sur sol ocre-ocre rouge et rouge.
Tableau 10: Répartition des placettes en fonction
des couleurs du sol.
|
Couleur
sol.
|
Forêt
hétérogène
à
B.
boehmii
|
Forêt
hétérogène
à
J.
globiflora
|
Forêt
hétérogè
ne à J.
paniculat
a
|
Forêt de
régénération
à
Uapaca spp.
|
Forêt
ancienne
à P.
tinctorius
|
Savane
arborée à
Acacia
spp.
|
Savane
arborée à
A.
polyacan
tha
|
Savane
boisée à C.
adenogoniu
m et
Terminalia
sp.
|
|
Gris
|
|
|
|
|
1 4 4
|
3
|
|
Ocre
|
3
|
5
|
2
|
3
|
1
|
3
|
|
Ocre-
|
3
|
14
|
7
|
2
|
4
|
4
|
|
Rouge
|
|
|
|
|
|
|
|
Rouge
|
1
|
2
|
1
|
|
|
1
|
32
Le Tableau 11, illustre la répartition des placettes
par groupe selon les différentes profondeurs de sol. Les sols les plus
profonds hébergent 100 % des placettes de la savane arborée
à Acacia spp.
Le teste Khi carré a montré qu'il existe une
agrégation des placettes en fonction de différentes profondeurs
du sol (Khi carré: 27,681; dl: 16; p : 0,035). La savane
arborée à Acacia polyacantha est absente sur sol moins
profond, alors que la forêt de régénération et celle
à B. boehmii sont aussi manquants sur sol plus profond. Les
autres n'ont pas une spécificité.
Tableau 11: Influence de la profondeur du sol sur la
répartition de placettes.
|
Prof. sol
|
Forêt
hétérogène
à
B.
boehmii
|
Forêt
hétérogè
ne à J.
globiflor
a
|
Forêt
hétérogène
à
J.
paniculata
|
Forêt de
régénératio
n
à
Uapaca
spp.
|
Forêt ancienn e à P. tinctori
us
|
Savane
arborée à
Acacia
spp.
|
Savane
arborée à
A.
polyacan
tha
|
Savane boisée
à C.
adenogonium
et Terminalia
sp.
|
|
00-40
|
5
|
7
|
3
|
3
|
1
|
|
|
1
|
|
40-80
|
2
|
8
|
6
|
2
|
2
|
2
|
|
6
|
|
80+
|
|
6
|
1
|
|
3
|
2
|
4
|
4
|
4.6. Influence de la charge caillouteuse
Le Tableau 12, montre les espèces indicatrices de la
charge caillouteuse dans différentes strates ainsi que dans la
régénération. La présence de la charge caillouteuse
a peu d'influence sur la répartition des placettes. Presque toutes les
espèces sont indicatrices des sols avec charge. Par contre ; seule
M. katangensis a présenté une valeur indicatrices de 27%
pour les sols sans charge.
M. macroura et J. paniculata sont des
espèces indicatrices de la charge dans la strate arborée
dominante et arborée dominée. M. macroura est absente
dans la régénération. Alors que J. paniculata est
présente. B.boehmii dans les strates arborée
dominée et arbustive. Uapaca spp. est présent dans la
régénération et dans la strate arbustive.
33
Tableau 12: Espèces indicatrices en fonction de la
présence ou absence de la charge caillouteuse
|
Charge caillouteuse
|
Pas de charge
|
|
Espèce
|
IV (%)
|
Espèce IV (%)
|
|
Peuplement par strate
|
Dalbergia boehmii arbo.
|
43.1
|
|
|
Albizia antunesiana arbo.
|
38.8
|
|
Pericopsis angolensis arbo.
|
35.4
|
|
Julbernardia paniculata arbo.
|
35.3
|
|
Julbernardia paniculata dom.
|
33.3
|
|
Strychnos innocua arbo.
|
26.6
|
|
Ekebergia benguelensis arbu.
|
25.3
|
|
Brachystegia boehmii arbu.
|
24
|
|
Brachystegia boehmii arbo.
|
22.5
|
|
Marquesia macroura dom.
|
20
|
|
Combretum collinum dom.
|
19.1
|
|
Marquesia macroura arbo.
|
17.3
|
|
Albizia adianthifolia dom.
|
14.3
|
|
Brachystegia wangermeeana arbo.
|
14.3
|
|
Uapaca sp. arbu.
|
14.3
|
|
Brachystegia wangermeeana arbu.
|
14.1
|
|
Anisophyllea boehmii arbo.
|
13.4
|
|
Peuplement
|
Albizia antunesiana
|
46.3
|
|
|
Phyllocosmus lemaireanus
|
41
|
|
Julbernardia paniculata
|
32.4
|
|
Strychnos innocua
|
31.3
|
|
Ekebergia benguelensis
|
25
|
|
Brachystegia boehmii
|
23
|
|
Marquesia macroura
|
20.5
|
|
Uapaca sp.
|
14.3
|
|
Brachystegia wangermeeana
|
14.2
|
|
Régénération
|
Phyllocosmus lemaireanus
|
61.2
|
Monotes katangensis 27
|
|
Pseudolachnostylis maprouneifolia
|
52.8
|
|
|
Ochna schweinfurthiana
|
47.2
|
|
Rothmannia engleriana
|
32.5
|
|
Anisophyllea boehmii
|
27.3
|
|
Julbernardia paniculata
|
26.3
|
|
Canthium crassum
|
25.7
|
|
Brachystegia boehmii
|
24.2
|
|
Dicrostachus cynerea
|
19.2
|
|
Ouvariastrum hexaloboides
|
17
|
|
Brachystegia wangermeeana
|
14.3
|
|
Erythrophleum africana
|
13
|
|
Uapaca sp.
|
12.6
|
34
Le Tableau 13, montre que M. macroura est un
indicateur des sols peu profond. Cette espèce a une valeur indicatrice
de 34.6% dans le peuplement, et 34.1%, dans la strate dominante, 28.7% la
strate arborée, ainsi que dans la régénération
40.5%.
Pour les sols profonds (40-80cm), C. adenogonium
apparait comme l'espèce indicatrice, parce qu'elle se retrouve dans
différentes strates. Mais absente dans la
régénération. Les sols plus profonds (80 cm et plus),
enregistrent le genre Uapaca au niveau du peuplement (U.
sensibarica, U. nitida, U. pilosa), dans différentes strates, et
même dans la régénération (U. nitida). Les
sols plus profonds semblent ne pas avoir une spécificité en
espèce.
Tableau 13: Les espèces indicatrices suivant
différentes profondeur du sol.
|
Peuplement
|
|
Peuplement par strate
|
|
Régénération
|
|
|
Espèce
|
IV
(%)
|
Espèce
|
IV
(%)
|
Espèce
|
IV
(%)
|
|
00-40
|
Marquesia macroura
|
34.6
|
Marquesia macroura dom.
|
34.1
|
Marquesia macroura
|
40.5
|
|
(cm)
|
Albizia versicolor
|
24.3
|
Brachystegia spiciformis dom.
|
31.7
|
Albizia adianthifolia
|
24.3
|
|
|
|
Marquesia macroura arbo.
|
29.7
|
|
|
|
|
|
Albizia antunesiana dom.
|
25
|
|
|
|
|
|
Brachystegia taxifolia dom.
|
18.7
|
|
|
|
40-80
|
Combretum
|
31.3
|
Combretum adenogonium arbu.
|
27.6
|
Pseudolachnostylis
|
44.2
|
|
(cm)
|
adenogonium
|
|
|
|
maprouneifolia
|
|
|
|
|
Combretum adenogonium arbo.
|
26.9
|
|
|
|
80+
|
Uapaca sansibarica
|
70.6
|
Uapaca sansibarica arbu.
|
75.6
|
Monotes katangensis
|
55.6
|
|
(cm)
|
Uapaca nitida
|
62.4
|
Parinari curatellifolia arbu.
|
62.5
|
Parinari curatellifolia
|
40.2
|
|
Parinari curatellifolia
|
58.4
|
Julbernardia globiflora arbu.
|
57.7
|
Uapaca nitida
|
39.1
|
|
Julbernardia globiflora
|
52.5
|
Uapaca nitida arbu.
|
55.1
|
|
|
|
Monotes katangensis
|
52.5
|
Monotes katangensis arbu.
|
52.3
|
|
|
|
Uapaca pilosa
|
49.4
|
Pseudolachnostylis maprouneifolia arbu.
|
51.4
|
|
|
|
Pseudolachnostylis maprouneifolia
|
47.01
|
Uapaca pilosa arbu.
|
49.4
|
|
|
|
Pterocarpus tinctorius
|
35.5
|
Diplorhynchus condylocarpon arbu.
|
45.5
|
|
|
|
Syzygium guineense
|
28.8
|
Albizia antunesiana arbu.
|
38.4
|
|
|
|
Monotes africana
|
25.6
|
Monotes africana arbu.
|
27.1
|
|
|
|
|
|
Pterocarpus tinctorius arbo.
|
24.7
|
|
|
|
|
|
Acacia polyacantha dom.
|
16.7
|
|
|
35
5. DISCUSSION.
5.1. Discussion de la méthodologie.
La technique des relevés temporaires aléatoire a
permis la collecte des données sur la flore du sanctuaire
Mikembo. 69 placettes de 18 m de rayon ont été
distribuées sur une superficie de 442 ha. Soit un taux de sondage de
1.7%. Dans le souci d'augmenter la précision, l'idéale aurait
été de diminuer la taille de la placette, mais, augmenter leur
nombre pour ce même taux de sondage (Rondeux, 1999). Pour
améliorer la qualité de la carte de végétation, il
était important d'utiliser les relevés systématiques
(Rondeux, 1999). Mais cependant, les relevés aléatoires se
prêtent mieux dans les analyses statistiques parce qu'ils attribuent
à tous les individus la même probabilité de faire partir de
l'inventaire.
La taille du relevé est variable et fonction de la
diversité en espèce suivant la région d'étude. Dans
la région zambézienne cette taille est de 1000 m2
(Jayakumar et al., 2011 ) et le diamètre de pré-comptage
est généralement de 10 cm, pour la strate arborée (Sokpon
et al., 2006). On pourrait aller en dessous surtout s'il s'agit des
études de la dynamique de régénération comme l'a
proposé Hakizimana (2012). Ce pourquoi dans le cas présent, le
diamètre de pré-comptage a été fixé à
2 cm. De plus, vus les objectifs poursuivis, ce diamètre de
pré-comptage a facilité l'inventaire de la flore globale de la
zone d'étude comme le confirme certains auteurs dans la région
zambézienne (Banda et al., 2006 ; Schwartz & Caro,
2003).
Pour des études de la dynamique des communautés
végétales, il serait intéressant de faire un suivi
temporel de placettes permanentes, ce qui n'a pas été possible
par manque de temps. Ce pourquoi, les résultats de cette étude ce
sont basés sur une approche indirecte prenant en compte les comparaisons
de composition floristique entres différents stades au sein des
groupements végétaux, tout en considérant uniquement les
ressemblances floristiques entre groupements végétaux. Les
analyses sur les relations sol-communautés végétales,
seront discutées avec prudence. Vu que la carte de sol utilisée
dans cette étude reste encore provisoire. Elle résulte d'une
extrapolation de 53 points de sondage réalisé sur une superficie
de 442 ha.
La concession de Mikembo renferme une
hétérogénéité de la végétation
sur une petite zone. Les résultats de l'inventaire floristique sur
l'ensemble de 442 ha ont révélés 80 espèces
5.2. Hétérogénéité de
la végétation.
36
(Tableau 17 en annexe). Ces résultats avoisinent la
richesse en espèce aperçue par Backeus et al., (2005) :
86 espèces ; Luoga (2002) : 79 espèces ; dans d'autres
réserves forestières du Miombo de superficie
similaire.
Après analyse par ordination, 8 communautés
végétales ont été définies sur base de
critères objectifs. Il s'agit de : La forêt
hétérogène à B.boehmii, à J.
paniculata, à J. globiflora, la forêt de
régénération à Uapaca sp., la forêt
ancienne à P. tinctorius, la savane à Acacia
sp., la savane à A. polyacantha et la savane boisée
à C. adenogonium (Tableau 7).
La forêt ancienne à Pterocarpus a comme
espèces indicatrice : Diplorhynchus condilocarpon dans la
strate arborée et Dalbergia boehmii dans la
régénération. La forêt
hétérogène à B.boehmii, renferme B.
boehmii, comme espèce abondante et indicatrice, et
quelques Uapaca dans la régénération. Alors que
la forêt à J. paniculata a comme espèce
indicatrice : J. paniculata et Diplorhynchus condilocarpon.
Ces communautés appartiennent à l'ordre de
Julbernardio-Brachystegietalia spiciformis dans l'alliance
Mesobrachystegion en accord avec la description des groupements
végétaux décrits par Schmitz (1971). Trois
communautés végétales ont des surfaces terrières
entre 13m2/ha et 16 m2/ha. Pour la savane boisée,
5.3 m2/ha, les savanes arborées, 3.2 m2/ha
(Tableau 8). Ces valeurs coïncident avec celles déterminées
par François Malaisse (communications personnelles F. Malaisse).
5.3. Caractérisation des communautés
végétales et la dynamique de
régénération.
La plus part des espèces les plus abondantes au niveau
du peuplement et même dans différentes strates ont
été trouvées aussi dans la
régénération (tableau 5).
La densité de la régénération (dhp
< 2 cm) varie entre 27 tiges/hectare (Savane arborée à A.
polyacantha) et 2105 tiges/hectare (Forêt
hétérogène à B. boehmii). Ceci montre une
grande variabilité en termes de paramètres
dendrométriques.
Comme on a peu d'information sur l'histoire récente des
communautés végétales à Mikembo, on
pourrait se servir des paramètres dendrométriques mesurés
et de la structure des peuplements pour tenter d'expliquer la dynamique de la
régénération, le degré de perturbation, ainsi que
l'évolution de différentes communautés
végétales. (Hakizimana, 2012).
L'allure générale de la distribution de
fréquence dans différentes communautés
végétales dans la concession de Mikembo reste une courbe
en « J » inversé comme dans tout peuplement naturel.
Mais il convient de signaler quelques anomalies sur la plus part des
37
structures des communautés végétales. La
forêt hétérogène à B.boehmii (Fig.
17), montre une structure dont la classe de recrutement (5 cm) a 2300 tiges,
alors que la classe de 10 cm enregistre 3400 tiges/ha. Et lorsqu'on observe le
tableau 9. Environ 50 tiges se développent sur souche et 20 sur tige.
Comme le sol de cette communauté est parsemé des affleurements
rocheux, il est donc difficile de cultiver dans cette zone ; par contre, ceci
serait expliqué par une exploitation de bois dans le passé comme
le confirme aussi Schmitz (1971). Pour la communauté à J.
globiflora, on remarque quelques troués dans les classes
supérieures (Fig.14).
La composition floristique de la communauté renseigne
que, M. macroura présente les arbres les plus gros dans cette
communauté parce que son bois est difficile à exploiter (Smith
& Allen, 2004). En effet, les plus gros individus de M. macroura
résistent mal aux orages (observations personnelle). Malgré
cela, sa régénération est difficile dans un peuplement
fermé (Schmitz, 1971). La structure de M. macroura dans cette
communauté à P. tinctorius confirme cette
hypothèse (Fig. 15). On pourrait dire que la chute
régulière des gros individus de M. macroura serait
à la base de ces vides qui, par contre favoriserait l'installation des
jeunes individus de J. globiflora dont la structure est dominée
par les tiges de petit diamètre dans la même
communauté(Fig. 16).
La structure de la savane boisée à C.
adenogonium est inéquiènne. Toutefois, cette
communauté enregistre 77.5% de tiges sur souches (Tableau 9). Avec un
faible nombre des tiges par ha dans la régénération
(Tableau 8). On pourrait supposer que ces zones furent occupées par des
anciens villages grâce à sa proximité au cours d'eau, et
que les espèces se régénèrent mal.
La structure de la savane arborée à Acacia
spp. et à A. polyacantha
montre que la classe de recrutement à peu de tiges/ ha (Fig. 19 et
20). Mais ces deux conditions semblent avoir différentes origines. Dans
la savane à Acacia spp., en moyenne 25 tiges/ha se
développe à partir des graines contre 75 tiges sur souche. Alors
que dans la savane à Acacia polyacantha, 80 tiges/ha
proviennent des graines, contre 18 tiges/ha régénère par
souche.
Pour A. polyacantha ce blocage serait dû
à la difficulté que les graines ont pour germer, étant
donné qu'il se développe sur sol engorgé d'eau de
façon permanente; Alors que pour Acacia spp., il semble que
cette partie était occupée par des anciens champs qui pour leur
installation, des quantités énormes de bois ont été
coupées tout en laissant des souches. A ce jour, cette communauté
serait en train de se régénérer à partir des
souches abandonnées sous terre. La
38
régénération par graine constitue environ
25% seulement (Tableau 9). Ce sont donc des peuplements sans avenir parce que
la classe de recrutement est faiblement approvisionnée par germination
de graine.
La structure de la forêt claire de
régénération à Uapaca sp., semble
asymétrique gauche. Malgré cela, la communauté semble
inéquiènne bien que la classe 5 a moins d'individus que la classe
10 (Fig. 8). Par contre l'espèce U. nitida enregistre
très peu d'individus dans la classe de recrutement et un vide anormal
dans les classes 25-30-35 (Fig. 9). La moitié de tiges ce sont
développées sur souche et une autre moitié par graine
(Tableau 9); Bien que la communauté ait présentée des
signes de dégradation dans le passé (présence des
billons). Ceci s'expliquerait par le fait que, les Uapaca, ont une
capacité de se régénérer par rejet des souches et
se développent bien en condition naturelle grâce aux associations
avec les champignons (Ramanankierana, 2006).
5.4. Influence des paramètres du sol sur la
répartition des placettes dans différentes communautés
végétales.
Le test khi carré a montré que la couleur du sol
a moins d'influence sur la répartition des placettes (Tableau 10). Cette
répartition serait contrôlée par d'autres facteurs.
Mais cependant, le même test a montré une
différence significative entre la répartition des placettes dans
différentes communautés en fonction de la profondeur du sol (Khi
carré : 27.681; dl: 16; p= 0.035) (Tableau 11). Alors que, des
nombreuses études ont montrée des relations positives entre la
couleur, la profondeur du sol et la végétation en place (Schmitz,
1971; Lawton 1978; Smith & Allen, 2004). Néanmoins, à partir
des Tableaux 10 et 11, on pourrait tirer des informations intéressantes
sur les communautés végétales qui ont la totalité
de leurs placettes sur un même type de sol. Telle que la savane à
Acacia polyacantha, et à Acacia sp.
Il semble que A. polyacantha et acacia sp.,
ont des préférences sur sols de couleur gris (Tableau
10).
Acacia polyacantha étant une espèce qui
colonise les zones alluvionnaires périodiquement inondées (Luoga
et al., 2004), la présence de l'eau presqu'en permanence dans
le sol de cette communauté pourrait justifier le choix de cette
espèce au détriment des autres.
La présence de la charge caillouteuse a
révélé des espèces telles que : J.
paniculata, dans la strate dominante; Dalbergia boehmii dans la
strate dominée; Ekebergia bengwelensis, dans la
39
strate arbustive. Et dans la régénération
on retrouve, Phyllocosmus lemaireanus et Pseudolachnostylis
maprouneifolia, M. macroura.
Alors que l'absence de la charge n'a
révélé qu'une espèce : Monotes katangensis
(Tableau 12). Toutes les espèces indicatrices de la charge se
retrouvent dans la communauté à P. tinctorius.
6. CONCLUSION ET PERSPECTIVE
Cette étude s'inscrit dans le cadre de la contribution
à la gestion durable des écosystèmes forestiers
(Miombo) au Katanga. La croissance démographique
enregistrée dans cette province au cours de la dernière
décennie, avec comme conséquence, augmentation de l'exploitation
des ressources forestières, principalement le bois, a causé la
perte et la fragmentation des habitats naturels.
Cette première étude de la
végétation de Mikembo a identifié huit
communautés végétales sur base des critères
objectifs.
Il existe des relations positives entre, la profondeur du sol
et les communautés en place. Par contre la couleur semble
indépendante des communautés végétales dans le cas
présent. Les trois facteurs édaphiques choisis pour
caractériser le sol s'avèrent approximatifs pour un domaine aussi
vaste et complexe comme le sol. Cette étude devra être
répétée dans une zone plus étendue et pendant deux
périodes de l'année tout en intégrant les aspects
chimiques du sol, pour comprendre au mieux les relations entre facteurs
édaphiques et communautés végétales en place. Les
analyses chimiques proposées sont : Les bases échangeables, la
teneur en Fer mobile, l'Azote, le Phosphore.
L'écologie de la régénération des
espèces du Miombo en condition naturelle est mal connue. Ce qui
rend difficile l'adoption d'une stratégie de gestion pour des zones plus
ou moins intactes ou la restauration des zones fortement fragmentées.
Parmi les 5 espèces emblématiques du Miombo
retenues dans cette étude, J. paniculata et J. globiflora,
semble avoir un bon profil de régénération vu leur
structure diamétrique (en « j » inversé) en
condition naturelle. Alors que, la régénération de
Marquesia macroura, Uapaca nitida et Brachystegia boehmii,
semble difficile. Il serait important d'effectuer des tests de germination
de ces espèces en condition contrôlée et in situ.
Et comme ce sont en majorité des
40
espèces ectomicorhizées, des études
d'identifications d'inoculum spécifiques devraient être
menée en marge de cette étude. En suite comparer
l'efficacité de ces deux conditions.
41
BIBLIOGRAPHIE
Aronson J., Floret E., Floch L., Ovalle C., Pontanier
R., 1995. Restauration et réhabilitation des
écosystèmes dégradés en zones arides et
semi-arides. Le vocabulaire et les concepts. John Libbey Eurotext, Paris, pp.
11-29.
Backeus I., Pettersson B., Stromquist L., Ruffo C.,
2006. Tree communities and structural dynamics in Miombo
(Brachystegia-Julbernardia) woodland, Tanzania. Forest Ecology and
Management 230 (2006) 171-178.
Banda T., Schwartz W., Caro T., 2006. Woody
vegetation structure and composition along a protection gradient in a
Miombo ecosystem of western Tanzania. Forest Ecology and Management
230 (2006) 179-185.
Bioret, 2006. Association
végétales nouvelles du littoral du Pays Basque. J. Bot. Soc.
France. Vol. 34: 71-80.
Campbell B., 1996. The Miombo in transition:
woodlands and walfare in Africa. Éd. CIFOR. Bogor, Indonesia. ISBN:
979-8764-07-2. 273p.
Campbell B., Angelsen A., Cunningham A., Katerere Y.,
Sitoe A., and Wunder S., 2007. Miombo wood Lands -Opportunities and
barriers to sustainable forest management. Centre for international Forestry
Research, Bogor 30p.
Chidumayo E., 1997. Miombo ecology and
management an introduction. Stockholm environment institute (SEI). 103-105.
Southampton Row, London, WC 1B 4HH, UK, 166p.
Clewell A., Aronson J., 2010. La restauration
écologique : Principes, valeurs et structured'une profession
émergente. Actes Sud. 340p.
Dufrêne M., 2004. Indval or how to
identify indicator species of a sample typology? Retrieved 17/07/2012, from:
http://ald.biodiversite.Wallonie.be/outils/indval/.
Duvigneaud P., 1958. La
végétation du Katanga et de ses sols
métallifères. Bull. Soc. Roy. Bot. Belgique, 90, pp
127-286.
Ernst C., Verhegghen A., 2010. Cartographie
du couvert forestier et des changements du couvert forestier en Afrique
centrale. Les forêts du bassin du Congo - Etat des forêts 2010.
COMIFAC: 23-42.
Fanshawe D., 1971. Botany; plant communities;
Zambia. Lusaka vol: 7.iv, 67p.
Faucon M., 2009. Ecologie et biologie de la
conservation des métallophytes. Le cas de Crepidorhopalonperennis
et C. tenuis (Scrophulariaceae) des sols
cupro-cobaltifères du
42
Katanga. Thèse de doctorat. Présenter à
l'ULB, Laboratoire d'Ecologie végétale et Biogéochimie,
Faculté des Sciences, Ecole doctorale « Biodiversité,
Ecologie, Evolution ».191p.
Flora of Zambia: (
http://zambiaflora.com/).
National Botanic Garden of Belgium - The BR Herbarium
Catalogue: (
http://www.br.fgov.be).
Flora Zambesiaca: (
http://apps.kew.org/efloras//).
Frost P., 1996. The ecology of Miombo
Woodlands. The Miombo in Transition: Woodlands and Welfare in Africa. B.
Campbell. Bagor, Center for International Forestry Research: 11-58.
Gambiza J., et al., 2000. Special
section: Land use option in dry tropical wood land ecosystems in Zimbabwe.
Ecological economics 33(2000)353-368.
Giliba R., Kayombo C., Musamba E., Kashindye A., Shayo
P., 2011. Species Composition, Richness and Diversity in
MiomboWoodland of Bereku Forest Reserve, Tanzania. J Biodiversity, 2(1): 1-7
(2011).
Hakizimana P., 2012. Analyse de la
composition de la structure spatiale et des ressources végétales
naturelles prélevées dans la forêt dense de Kigwana et dans
la forêt claire de Rumonge au Burundi. (Thèse de doctorat).
Université Libre de Bruxelles. 149 p.
http://www.ecoles.cfwb.be/icesquaregnon/climats/frclimtypes.html.
Jayakumar S., Seong S., Joon H., 2011.
Floristic inventory and diversity assessment - a critical review. Proceedings
of the International Academy of Ecology and Environmental Sciences, 2011,
1(3-4):151-168.
Jonathan Timberlake, 2000. Biodiversity of
the Zambezi Basin. Biodiversity Foundation for Africa P.O. Box FM730, Famona,
Bulawayo, Zimbabwe. Occasional Publications in Biodiversity No. 9. 22 p.
Journal officiel de la république
démocratique du Congo, 2002. Code forestier. 35p.
Kabulu D., Bamba I., Munyemba K., Defourny P.,
Vancutsem C., Nyembwe N., Ngongo L.M. et Bogaert J., 2008. Analyse de
la structure spatiale des forêts au Katanga. Ann Fac. SC. Agro., I, (2),
2008, 12-18.
Legendre P., Legendre L., 1998. Numerical
Ecology. Amsterdam, Elsevier.
Luoga E., Witkwski E., Balkwill K., 2002.
Harvested and standing wood stocks in protected and communal Miombo
woodlands of eastern Tanzania. Forest Ecology and Management. 164(2002)
15-30.
43
Luoga E., Witkwski E., Balkwill K., 2004.
Regeneration by coppicing (resprouting) of Miombo (African savanna) trees in
relation to land. Forest Ecology and Management 189: 2335.
Luoga E., Witkwski E., Balkwill K., 2005. Land
cover and use changes in relation to the
institutional framework and tenure of land and resources in
eastern Tanzania Miombo woodlands. Environment, Development and Sustainability
(2005) 7:71-93.
Malaisse F., 1997. Se nourrir en forêt
claire africaine: Approche écologique et nutritionnelle. Gembloux, Les
presses agronomiques de Gembloux.
Malaisse F., 1979. "L'homme dans la forêt
claire zambézienne. Contribution à l'étude de
l'écosystème forêt claire (Miombo)." African Economic
History 7.
Malaisse F., 1993. Endémisme,
biodiversité et spéciation dans le centre « domanial »
d'endémisme shabo-zambien : remarques préliminaires. Laboratoire
d'Ecologie. Faculté des sciences agronomiques. 2, passage des
Déportés 5030 Gembloux - Belgique.195-201pp.
Munyemba F., 2010. Quantification et
modélisation de la dynamique paysagère dans la région de
Lubumbashi : évaluation de l'impact écologique des
dépositions issues de la pyrométallurgie. Thèse de
doctorat. Université de Lubumbashi. 234p.
Nangendo G., Stein A., teege H., Bongers F., 2005.
Changes in woody plant composition of three vegetation types exposed
to a similar fire regime for over 46 years. Forest Ecology and Management 217,
351-361.
Olivieri I., Vitelis, 2001. La biologie des
extinctions. MS-Med.SC. 17(1) : 63-69.
Pantaleo K., Ruwa-Aichi P., Temu, and Soka G., 2011.
Plant communities and tree species associations in a Miombo ecosystem
in the Lake Rukwa basin, Southern Tanzania: Implications for conservation.
Journal of Ecology and the Natural Environment Vol. 3(2), pp. 63-71. Research:
11-58.
Ramanankierana, 2006. La symbiose
mycorhiziènne dans la domestication de Uapaca bojeri
(Euphorbiaceae), plante ligneuse endémique de Madagascar
(Thèse de Doctorat en Biochimie). Université d'Antananarivo.
Rondeux J., 1999. La mesure des arbres et des
peuplements forestiers. Les presses Agronomiques de Gembloux.375-430p.
Schmitz A., 1971. Végétation de
la plaine de Lubumbashi. (Haut-Katanga). I.N.E.A.C. Série scientifique
n°113. 329 p.
44
Schwartz W., Caro T., 2003. Effect of
selective logging on tree and understory regeneration in Miombo wood land in
werstern Tanzania. African journal of Ecology.(1)75-82.
Smith P., Allen Q., 2004. Field Guide to the
Trees and Shrubs of the Miombo Woodlands. Royal Botanic Gardens, Kew.Richmond,
Surrey, TW9 3AB, UK. 176p.
Society for Ecological Restoration International and
IUCN Commission on Ecosystem Management, 2004. Ecological Restoration,
a means of conserving biodiversity and sustaining livelihoods. Society for
Ecological Restoration International, Tucson, Arizona, USA and IUCN, Gland,
Switzerland. 6p.
Sokpon N., Biaou S., Ouinsavi C., Hunhyet O., 2006.
Bases techniques pour une gestion durable des forêts claires du
Nord-Bénin : rotation, diamètre minimal d'exploitabilité
et régénération. Laboratoire d'études et de
recherches forestières (Lerf) Université de Parakou
Faculté d'agronomie. BP 123, Parakou Bénin. Bois et forêts
des tropiques, 2006, n° 287 (1).45-57.
Sys C., Schmitz A., 1959. Carte des sols et
de la végétation du Congo belge et du Ruanda-Urundi.
9-Région d'Elisabethville (Haut-Katanga). Bruxelles, Publications de
l'institut national pour l'étude agronomique du Congo belge
(I.N.E.A.C.).
Timberlake J., Chidumayo E., 2011. Miombo
EcoregionVision Report.Biodiversity Foundation for Africa P.O. Box FM730,
Famona, Bulawayo, Zimbabwe Occasional Publications in Biodiversity No.
20.46p.
Werger M., & Coetzee J., 1978. The
Sudano-ZambézianRegion. In M.J.A. Werger (ed): Biogeography and Ecology
of Southern Africa. Junk Publ., The Hague, MonographiaeBiologicae, 31:
301-462p.
Whattaker R., Arauj M., Jepso P., Ladle R., Watson J.,
Willis K., 2005. Conservation Biogeography: assessment and prospect.
Diversity and Distribution: 11. 3-23.
White F., 1983: The vegetation of Africa. A
descriptive memoir to accompany the Unesco/AETAFT/UNISO vegetation map.
44
ANNEXE
Tableau 14: Répartition des 69 placettes en 6
groupes résultant d'une ordination
Groupe 1 Groupe 2 Groupe 3 Groupe 4 Groupe 5 Groupe 6
BR3 BCA1 PN1 JCA1 BBC1 AP1
JN2 BN1 PN2 JCA2 BB CA1
JSE3 BN2 PN3 JN1 BBC3 CA2
MA2 BR2 TL1 JP1 BBC4 FM1
MB4 MA1 ZHL1 JP2 BR1 TB1
MJ1 MA3 ZHR1 JP3 TN1 TB2
MJ2 MA4 ZHR2 JP4 TN2 TB3
MJ3 SU1 ZHR3 JSE1 TBBC1
UJ1 SU2 JSE2 TMB1
UJ2 SU3 MB1 TS1
UM3 TS2 MB2 ZHN1
UM4 UJ3 MB3
ZT1 UM1 MJ4
ZT2 UM2
ZT3 ZHN2
Tableau 15 : Répartition de 44 placettes en 5
groupes après la deuxième ordination.
Groupe 1 Groupe 2 Groupe 3 Groupe 4 Placette
isolée
BR3 JCA1 BR2 BCA1 SU1 JN1
UM4 JCA2 MA3 BN1 SU2
ZT1 JP1 MB1 BN2 SU3
ZT2 JP2 MB2 JN2 TS2
ZT3 JP3 MB3 JSE3 UJ1
JP4 UM1 MA1 UJ2
JSE1 MA2 UJ3
JSE2 MA4 UM2
MJ3 MB4 UM3
MJ4 MJ1 ZHN2
MJ2

45
Tableau 16: Les espèces indicatrices en fonction
du sol et de la couleur.
|
Peuplement
|
|
|
Régénération
|
|
|
Nbre
|
Espèce
|
Ab.
|
Nbre
|
Espèce
|
Ab.
|
|
d'espèce
s
|
|
(%)
|
d'espèces
|
|
(%)
|
|
59
|
Julbernardia
|
12.
|
49
|
Julbernardia
|
41.
|
|
globiflora
|
0
|
|
globiflora
|
7
|
|
Julbernardia paniculata
|
9.2
|
|
Brachystegia spiciformis
|
5.0
|
|
Brachystegia boehmii
|
7.8
|
|
Diplorhynchus
condylocarpon
|
4.0
|
|
65
|
Julbernardia
|
12.
|
55
|
Julbernardia
|
20.
|
|
paniculata
|
7
|
|
globiflora
|
7
|
|
Brachystegia
|
9.2
|
|
Dalbergia
|
13.
|
|
boehmii
|
|
|
boehmii
|
1
|
|
Dalbergia boehmii
|
8.4
|
|
Brachystegia boehmii
|
9.8
|
|
55
|
Julbernardia
|
15.
|
43
|
Julbernardia
|
26.
|
|
paniculata
|
1
|
|
globiflora
|
1
|
|
Julbernardia
|
13.
|
|
Julbernardia
|
14.
|
|
globiflora
|
0
|
|
paniculata
|
0
|
|
Diplorhynchu s condylocarpo n
|
6.9
|
|
Dalbergia boehmii
|
9.2
|
|
32
|
Julbernardia
|
27.
|
19
|
Julbernardia
|
39.
|
|
paniculata
|
6
|
|
globiflora
|
3
|
|
Julbernardia
|
13.
|
|
Markhamia
|
11.
|
|
globiflora
|
1
|
|
obtusifolia
|
4
|
|
Brachystegia
|
10.
|
|
Julbernardia
|
9.5
|
|
wangermeean a
|
0
|
|
paniculata
|
|
|
33
|
Brachystegia
|
15.
|
23
|
Brachystegia
|
51.
|
|
boehmii
|
6
|
|
boehmii
|
1
|
|
Brachystegia
|
11.
|
|
Dicrostachys
|
6.9
|
|
longifolia
|
3
|
|
cinerea
|
|
|
Rothmannia
engleriana
|
6.4
|
|
Pseudolachnostyli s maprouneifolia
|
6.6
|
|
54
|
Julbernardia
|
24.
|
38
|
Dalbergia
|
27.
|
|
globiflora
|
0
|
|
boehmii
|
8
|
|
Parinari
|
7.6
|
|
Julbernardia
|
20.
|
|
curatellifolia
|
|
|
globiflora
|
6
|
|
Dalbergia boehmii
|
6.8
|
|
Combretum collinum
|
8.0
|
Couleur Prof Peuplement par strate
|
Nbre
d'espèce
s
|
|
00-40
|
113
|
|
40-80
|
127
|
|
80+
|
99
|
|
00-40
|
54
|
|
40-80
|
53
|
|
80+
|
90
|
Espèce Ab.
(%)
Julbernardi a globiflora arbu.
Julbernardi a paniculata arbo.
Uapaca pilosa arbu.
Julbernardi a globiflora arbu.
Dalbergia boehmii arbu.
Pterocarpu s tinctorius arbu.
Julbernardi a globiflora arbu.
Julbernardi a paniculata arbu.
Julbernardi a paniculata arbo.
Julbernardi a paniculata arbo.
Julbernardi a paniculata arbu.
Julbernardi a globiflora arbu.
Brachystegi a boehmii arbu.
Brachystegi a boehmii arbo.
Brachystegi a boehmii dom.
Julbernardi a globiflora arbu.
Parinari curatellifoli a arbu.
Dalbergia boehmii arbu.
Ocre-Rouge
Rouge
8.3
6.0
4.2
6.8
5.9
5.2
9.8
8.5
6.0
17.6
8.1
6.8
7.8
7.8
6.4
22.7
6.6
5.6
46
Sources:
? Flora of Zambia (
http://zambiaflora.com/).
? National Botanic Garden of Belgium - The BR Herbarium
Catalogue
(
http://www.br.fgov.be).
? Flora Zambesiaca (
http://apps.kew.org/efloras//).
Tableau 17. La liste de 80 espèces de l'inventaire
de Mikembo.
Familles Sous famille Genre Espece Auteurs
Anacardiaceae Lannea discolor
(Sond.) Engl
Anisophylleaceae Anisophyllea
boehmii Engl.
Annonaceae Annona senegalensis
Pers. subsp.
senegalensis
Hexalobus monopetalus (A. Rich.) Engl. &
Diels
Uvariastrum hexaloboides (R.E.Fr.) R.E.Fr.
Apocynaceae Diplorhynchus
condylocarpon ** (Muell. Arg.)
Pichon
Bignoniaceae Markhamia obtusifolia
(Baker) Sprague
Celastraceae Gymnosporia sp.
(Wight & Arn.) Hook.
f.
Chrysobalanaceae Parinari
curatellifolia Planch. ex Benth.
Clusiaceae Garcinia huillensis **
Welw. ex Oliv.
Combretaceae Combretum acutifolium
Exell
Combretum collinum Fresen.
Combretum molle R.Br ex G. Don
Combretum zeyheri Sond.
Combretum sp. Loefl.
Terminalia sp. L.
Connaraceae Rourea orientalis
Baill.
Dipterocarpaceae Marquesia macroura
Gilg
Monotes africanus A. DC.
Monotes katangensis (De Wild.) De Wild.
Euphorbiaceae Maprounea africana
Müll. Arg.
Fabaceae Caesalpinioideae Afzelia
quanzensis Welw.
Caesalpinioideae Brachystegia boehmii Taub.
Caesalpinioideae Brachystegia longifolia
Benth.
Caesalpinioideae Brachystegia spiciformis
Benth.
Caesalpinioideae Brachystegia stipulata De
Wild.
Caesalpinioideae Brachystegia taxifolia Harms
Caesalpinioideae Brachystegia wangermeeana De
Wild.
Caesalpinioideae Erythrophleum africanum (Welw. ex
Benth.)
Harms
Caesalpinioideae Julbernardia globiflora (Benth.)
Troupin
47
Caesalpinioideae Julbernardia paniculata (Benth.)
Troupin
Caesalpinioideae Piliostigma thonningii (Schumach.)
Milne-
Redh.
Caesalpinioideae Senna petersiana (Bolle) Lock
Mimosoideae Acacia polyacantha Willd.
subsp.campylacantha (Hochst. ex A. Rich.) Brenan
Mimosoideae Acacia sp. Mill.
Mimosoideae Albizia adianthifolia (Schumach.) W.
Wight
Mimosoideae Albizia antunesiana Harms
Mimosoideae Albizia versicolor Welw. ex
Oliv.
Mimosoideae Dichrostachys cinerea (L.) Wight &
Arn.
Faboideae Bobgunnia madagascariensis (Desv.) J.H.
Kirkbr. &
Wiersama
Faboideae Dalbergia boehmii Taub. subsp.
boehmii
Faboideae Dalbergia nitidula Welw. ex Baker
Faboideae Erythrina abyssinica Lam. ex DC.
Faboideae Pericopsis angolensis (Baker) Meeuwen
Faboideae Philenoptera katangensis * (De Wild.)
Shrire
Faboideae Pterocarpus angolensis DC.
Faboideae Pterocarpus tinctorius * Welw.
Hypericaceae Harungana
madagascariensis Lam. ex Poir.
Psorospermum febrifugum Spach
Ixonanthaceae Phyllocosmus
lemaireanus (De Wild. & T.
Durand) T. Durand & H. Durand
Lamiaceae Vitex madiensis
Oliv. subsp. madiensis
Loganiacee Strychnos cocculoides
Baker
Strychnos innocua Delile
Strychnos spinosa Lam.
Malvaceae Thespesia garckeana
F. Hoffm.
Melastomataceae Memecylon
flavovirens Baker
Meliaceae Ekebergia benguelensis
Welw. ex C.DC.
Moraceae Ficus ingens (Miq.)
Miq.
Ficus sp. L. - Figs
Myrtaceae Syzygium guineense
(Willd.) DC.
Ochnaceae Ochna schweinfurthiana
F. Hoffm.
Phyllanthaceae Antidesma venosum
E. Mey. ex Tul.
Bridelia duvigneaudii J. Léonard
Hymenocardia acida Tul.
Phyllanthus muellerianus (Kuntze) Exell
Pseudolachnostylis maprouneifolia Pax
Uapaca kirkiana Müll. Arg.
48
|
Uapaca Uapaca Uapaca Uapaca
|
nitida pilosa sansibarica sp.
|
Müll. Arg. Hutch.
Pax
Baill.
|
|
Polygalaceae
|
Securidaca
|
longipedunculata
|
Fresen.
|
|
Proteaceae
|
Protea
|
angolensis
|
Welw.
|
|
Rhamnaceae
|
Ziziphus
|
abyssinica
|
Hochst. ex A. Rich.
|
|
Rubiaceae
|
Canthium
|
crassum
|
** Hiern
|
|
Gardenia
|
ternifolia
|
Schumach. & Thonn.
|
|
Rothmannia
|
engleriana
|
(K. Schum.) Keay
|
|
Sapindaceae
|
Allophylus
|
africanus
|
P. Beauv.
|
|
Sterculiaceae
|
Sterculia
|
quinqueloba
|
(Garcke) K. Schum.
|
|
Dombeya
|
rotundifolia
|
(Hochst.) Planch.
|
49
Fiches des inventaires.
|
Fiche placette
|
|
Nom site :
|
|
|
Communauté :
|
|
|
ID placette :
|
|
|
X :
|
|
|
Y :
|
|
|
N° Waypoint :
|
|
|
N° Photos :
|
|
|
Récolteur dendro :
|
|
|
Récolteur herbacé :
|
|
|
Récolteur pédo :
|
|
|
Date dendro :
|
|
|
Date herbacé :
|
|
|
Date pédo :
|
|
|
Sol
|
|
N° éch :
|
|
|
Profondeur :
|
|
|
Charge :
|
|
|
pH :
|
|
|
Couleur :
|
|
|
Couvert strates (%)
|
|
Dominante
|
|
|
Dominée
|
|
|
Herbacée
|
|
|
Total
|
|
|
Strate herbacée (cm)
|
|
Hauteur N
|
|
|
Hauteur E
|
|
|
Hauteur S
|
|
|
Hauteur O
|
|
|
Arbres références
|
|
Numéro arbre
|
Distance (m)
|
|
|
|
|
|
|
|
Pourcentage de la surface occupée par une
termitière
|
|
Azimut
|
Pourcentage
|
|
|
|
Nombre tiges mortes
|
|
|
Remarques
|
50
Fiche d'inventaire du peuplement (>2 cm de diamètre)
Espèce
Diamètre (cm)
Hauteur
(m)
N°
Arbre
Souche
Azimut
Dégats
51
Fiche d'inventaire de la régénération (<
2 cm de diamètre).
Nombre de tiges
Hauteur
min
(cm)
Hauteur
max
(cm)
Dénombrement
Espèce
Tiges
abrouties
| 


