|
UNIVERSITE MARIEN N'GOUABI
|
|
|
Institut Supérieur d'Éducation Physique
et Sportive
|
Année académique :2021-2022 N°
d'ordre :002
MEMOIRE
Pour l'obtention du diplôme de Licence
|
Mention :
Domaine :
|
Motricité et Intervention
Science et Technique des Activités physiques et
Sportives
|
|
Parcours :
|
Licence
|
|
Spécialité :
Option :
|
Entraînement sportif, préparation physique,
mentale et nutritionnelle
Sport
|
Présenté et soutenu à
l'Institut Supérieur d'Éducation
Physique et Sportive
Le 01/12 /2022
Par
NGOMA SOLO Estime Farèse
Titulaire d'un Baccalauréat série D
TITRE :
Test de Yo-Yo intermittent et réponses des
cellules immunitaires chez les footballeuses séniores
DIRECTEUR DE RECHERCHE
NSOMPI Florent, Maître-Assistant CAMES,
Université Marien N'GOUABI
Composition du jury
Président : MABOUNDA KOUNGA Paul
Roger, Maître-Assistant CAMES, Université Marien
N'GOUABI
Membre : NGABELE Adrien Severin,
Doctorant, INJS
|
|
UNIVERSITE MARIEN N'GOUABI
|
|
|
Institut Supérieur d'Éducation Physique
et Sportive
|
Année académique : 2021-2022
N° d'ordre : 002
MEMOIRE
Pour l'obtention du diplôme de Licence
|
Mention :
Domaine :
|
Motricité et Intervention
Science et Technique des Activités physiques et
Sportives
|
|
Parcours :
|
Licence
|
|
Spécialité :
Option :
|
Entraînement sportif, préparation physique,
mentale et nutritionnelle
Sport
|
Présenté et soutenu à
l'Institut Supérieur d'Éducation Physique
et Sportive
Le 01/12 /2022
Par
NGOMA SOLO Estime Farèse
Titulaire d'un Baccalauréat série D
TITRE :
Test de Yo-Yo intermittent et réponses des
cellules immunitaires chez les footballeuses séniores
DIRECTEUR DE RECHERCHE
NSOMPI Florent, Maître-Assistant CAMES,
Université Marien N'GOUABI
Composition du jury
Président : MABOUNDA KOUNGA Paul
Roger, Maître-Assistant CAMES, Université Marien
N'GOUABI
Membre : NGABELE Adrien Severin,
Doctorant, INJS
IN MEMORIUM
A
Mon petit frère NGOMA SOLO MFOUTOU Fridrey
Prévu, que ton âme repose en paix.
DEDICACES
Je dédie ce travail :
Ø A mon père Serge Wilfrid NGOMA SOLO
Ø A mon oncle paternel Heidy Endulrich NGOMA SOLO
REMERCIEMENTS
Nous nous rendons grâce à cet Être qui
était et qui sera, de nous avoir fait venir surtout en nous octroyer un
équilibre de l'esprit et la stabilité de corps ; bref :
la fécondité du mental qui nous a permis l'accomplissement du
présent bouquet.
J'adresse tous mes remerciements :
Ø Au Docteur Florent NSOMPI Maitre-Assistant CAMES,
Directeur de ce travail, qui en dépit de ses multiples occupations
administratives, pédagogiques, et scientifique a consacré assez
de temps dans la conduite de ce travail ;
Ø A tous les personnels Enseignant et non enseignant de
l'ISEPS pour leur formation adéquate ;
Ø A toute ma famille de près ou de loin de
m'avoir assisté par les conseils et contributions dans
l'élaboration de ce présent travail ;
Ø Je remercie enfin mes collègues
étudiants de la promotion 2022, Licence 3 Sport.
LISTE DES SIGLES ET ABREVIATIONS
ATP : adénosine triphosphate ;
BCR : récepteur membranaire des lymphocytes
B ;
CMH : complexe majeur
d'histocompatibilité ;
DC : cellules dendritiques ;
FC max : fréquence cardiaque maximale ;
Ig : immunoglobuline ;
IL : interleukine ;
ILC : cellule lymphoïde innée ;
NK: natural killer;
PAMPs: pathogen associated molecular patterns;
RNS : les espèces réactives de
l'azote ;
ROS : espèces réactives de
l'oxygène ;
SNC : système nerveux central ;
TCR : récepteur d'antigène des lymphocytes
T ;
TLRs: toll-like receptors;
VO2 max: volume d'oxygène maximal;
YYIR1: test Yo-Yo Intermittent Recovery Level 1;
YYIR2: test Yo-Yo Intermittent Recovery Level 2;
YYIRT: test Yo-Yo Intermittent Recovery.
LISTE DES TABLEAUX
Tableau I : valeurs descriptives de l'âge et des
paramètres anthropométrique des
footballeuses.........................................................................................21
Tableau II : comparaison des valeurs moyennes avant,
après et 2h après le test
Yo-Yo......................................................................................................21
Tableau III : comparaison entre les valeurs moyennes de
leucocytes et de lymphocytes avant et après le
test..........................................................................................22
Tableau IV : comparaison des valeurs moyennes entre les
leucocytes et les lymphocytes avant effort et 2h après
effort.............................................................................22
Tableau V : comparaisons des valeurs moyennes de
lymphocytes après le test et 2h après le
test.......................................................................................................23
Tableau VI : comparaison des valeurs moyenne de la
température et de l'humidité
avant et après le test
yo-yo
intermittente...........................................................23
LISTE DES FIGURES
|
Figure 1 : organisation générale du
système
immunitaire..........................................................
|
4
|
|
Figure 2 : défense de l'immunité
innée...............................................................................
|
6
|
|
Figure 3 : organisation de l'immunité
adaptative...................................................................
|
7
|
|
Figure 4 : toise en bois sur
socle.......................................................................................
|
15
|
|
Figure 5 : impédance
mètre.............................................................................................
|
16
|
|
Figure 6 : hydromètre
électronique....................................................................................
|
17
|
|
Figure 7: automate « Elite
3 »..........................................................................................
|
18
|
|
Figure 8: test Yo-Yo
intermittent.....................................................................................
|
19
|
LISTE DES PHOTOS
|
Photo 1 : Mesure de la
taille...........................................................................................
|
27
|
|
Photo 2 : Mesure de la masse
corporelle.............................................................................
|
27
|
|
Photo 3 : Prise du
sang..................................................................................................
|
27
|
|
Photo 4 : Déroulement du test Yo-Yo
intermittent.................................................................
|
27
|
SOMMAIRE
|
Introduction.........................................................................................................
|
1
|
|
Chapitre I : Revue de la
Littérature..............................................................................
|
3
|
|
Chapitre II : Matériel et
méthodes...............................................................................
|
15
|
|
Chapitre III :
Résultats.............................................................................................
|
21
|
|
Chapitre IV :
Discussion..........................................................................................
|
24
|
|
Conclusion..........................................................................................................
|
26
|
|
Annexe..............................................................................................................
|
27
|
|
Référence...........................................................................................................
|
28
|
|
Table des
matières..................................................................................................
|
32
|
INTRODUCTION
Contexte et justification
Le football est un sport intermittent
caractérisé par des mouvements soutenusincorporant de
fréquentes périodes d'activité de haute intensité
entrecoupées de périodes de récupération
régulières (Omar et al., 2013). Lors d'exercices intermittents de
haute intensité et/ou de longue durée, la sensation
d'essoufflement ressentie lorsque le sujet approche du point
d'épuisement volontaire s'est avérée être un facteur
significatif limitant la tolérance à l'exercice (Tong et al.,
2003).La majorité de ces exercices sont effectués à des
intensités qui sollicitent le fonctionnement des cellules immunitaires
pendant les périodes intenses du jeu. La réaction
coordonnée de ces cellules et molécules porte le nom de
réponse immunitaire (François et al., 2018). Sur le plan
physiologique, le système immunitaire joue un rôle important pour
prévenir les infections, éradiquer les infections
déclarées et empêcher la prolifération tumorale
(François et al., 2018).
En particulier, le test Yo-Yo intermittent recovery (YYIRT) a
été spécialement conçu pour évaluer la
capacité à effectuer des exercices intermittents de haute
intensité (Omar et al., 2013). Le test de Yo-Yo ou test de course
navette, est largement utilisé dans les sports d'équipe où
les caractéristiques du jeu sont similaires à ces tests :
accélérations, sprints, dribbles, changements de direction etc
(Bangsbo, 1994). L'exercice Yo-Yo intermittent inclut des actions
d'accélération, de décélération et de
récupération (Bangsbo, 1994). En considérant ce qui
précède, nous nous sommes proposés de mener l'étude
suivante : « Test de Yo-Yo intermittent et
réponses des cellules immunitaires chez les footballeuses
séniores. ».
Problématique
Le système immunitaire est très réactif
à l'exercice, l'étendue et la durée reflète le
degré de stress physiologique imposé par la charge de travail
notamment l'intensité et la durée de l'effort appliqué
(Said et al., 2009). En effet, la pratique d'un exercice intense pourrait avoir
un impact sur le fonctionnement des cellules immunitaire. L'augmentation ou
diminution des paramètres telle que le lymphocyte et le granulocyte a
été liée à la fois à l'intensité et
à la durée de l'exercice (Omar et al., 2013). Durant un exercice
d'intensité élevé les lymphocytes augmentent et baissent
après un travail de longue durée (Olivier, 2005). Ainsi, il est
logique d'évaluer la réponse des cellules immunitaires au test
Yo-Yo intermittent chez les footballeuses.
Cependant, le test intermittent Yo-Yo en tant que test sur le
terrain pour évaluer les performances des joueurs de sports
d'équipe (Carlo et al., 2007). Boris et al. (2018), intitule que le test
a été initialement introduit pour mesurer la capacité
à effectuer de manière répétée des exercices
intenses, y compris le potentiel de récupération rapide d'un tel
exercice avec un accent particulier sur les sports intermittents tels que le
football ou le basket-ball. De plus, des variantes du test Yo-Yo ont
été proposées pour déterminer la capacité de
performance aérobie et ainsi estimer la consommation maximale
d'oxygène (VO2max).
Question de recherche
Ø Le test Yo-Yo intermittent induit-il des variations
post exercice des cellules inflammatoires ?
Hypothèse
L'exercice intermittent Yo-Yo induit des variations post
exercice des cellules inflammatoires.
Objectif général
L'objectif de cette étude est :
D'évaluer les variations post exercice des cellules
immunitaires chez les footballeuses séniores.
Intérêt de l'étude
C'est de mettre en évidence la mobilisation des
cellules inflammatoire lors du test Yo-Yo intermittent chez les footballeuses
séniores.
Structuration du Travail
Notre travail comprendra :
- La revue de la littérature ;
- Le matériel et
méthodes ;
- Les résultats ;
- La discussion ;
- La conclusion ;
- Les annexes ;
- Les références
bibliographiques.
Chapitre I : Revue de la Littérature
I.1. Système Immunitaire
Le système immunitaire contribue au maintien de
l'intégrité de l'organisme par l'exclusion des constituants
étrangers (microorganismes, greffes) et de constituants du
« soi » modifiés. Il assure cette fonction en
étroite relation avec les autres systèmes nerveux et endocrinien,
avec lesquels il communique par l'intermédiaire de médiateurs
solubles (neurotransmetteurs, hormones, cytokines) et de récepteurs
spécifiques communs à ces systèmes (Kouassi et al., 2003).
L'activation du système immunitaire entraîne la libération
de cytokines qui peuvent être classées en anti-inflammatoires.
L'exercice physique chronique peut guider la réponse du système
immunitaire en favorisant un statut anti-inflammatoire, qui semble être
le facteur clé de l'amélioration de la santé,
principalement dans les maladies chroniques. L'activation du système
immunitaire est une réponse à un facteur de stress, visant
à rétablir l'homéostasie cellulaire. Le processus
inflammatoire joue un rôle crucial dans l'homéostasie,
principalement par la défense active contre divers stimuli nocifs tels
que les infections virales neurotropes et/ou les dommages traumatiques,
favorisant le rétablissement de la fonction cellulaire et tissulaire
(Débora et al., 2020). L'inflammation implique plusieurs types de
cellules immunitaires, y compris les macrophages et les neutrophiles, et est un
médiateur important du stress oxydatif. Les espèces réactives de l'oxygène
(ROS) ou les espèces réactives de
l'azote (RNS) sont des molécules à double tranchant. Les
ROS/RNS peuvent jouer le rôle d'effecteurs inflammatoires importants en
soutenant l'élimination des agents pathogènes par le
système immunitaire et la réparation des tissus musculaires
endommagés, ou ils peuvent amplifier l'inflammation chronique (par
exemple, pendant l'obésité) et induire des lésions
tissulaires (
David
et al., 2018).
I.1.1. Définition
Selon le dictionnaire Larousse, Le système immunitaire
est l'ensemble des organes, tissus, cellules et molécules assurant l'
immunité d'un
organisme. Il fonctionne grâce à un ensemble de
cellules hétérogènes
dans leur forme, leurs fonctions, leur capacité à se multiplier (
divisioncellulaire)
et à se transformer (
différenciation),
ainsi que dans la durée de leur vie : ce sont les globules blancs,
ou
leucocytes,
qui naissent dans la
moelle
des os, puis circulent dans tout l'organisme, transportés par
le
sang et
par la
lymphe.Pour
François et al. (2018), le système immunitaire fait
référence aux mécanismes de défense d'un organisme
vivant contre des agents étrangers, notamment infectieux, ou contre des
agressions internes, notamment transformation tumorale, susceptibles de menacer
son bon fonctionnement ou sa survie.
I.1.2. Composant du Système
immunitaire
Le système immunitaire est constitué d'un
ensemble complexe d'organes individualisés et de tissus entre lesquels
circulent en permanence des cellules de l'immunité innée et de
l'immunité adaptative. Le système immunitaire à trois
propriétés essentielles : une importante capacité
d'échange d'informations, par contacts membranaires intercellulaires ou
par libération de médiateurs solubles. Ces échanges ont
lieu entre des acteurs du système immunitaire (par exemple des
interactions entre les cellules de l'immunité innée et celles de
l'immunité adaptative), mais également avec d'autres
systèmes (par exemple des échanges neuro-immuno-endocriniens) ;
un bras effecteur performant capable de protéger
l'intégrité de l'organisme; une forte régulation qui est
cruciale pour préserver, à tout moment et à tout endroit,
l'équilibre du système immunitaire ou homéostasie et
garantir une réponse immunitaire adaptée (Jonathan et al., 2018).
Le système immunitaire comporte deux types de défense :
l'immunité innée ou naturelle et l'immunité acquise ou
adaptative (Olivier, 2005).
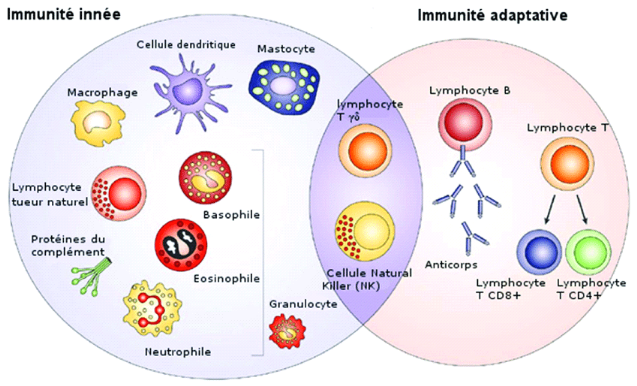
Figure 1 :Organisation générale du
système immunitaire (www.researchgate.net).
I.1.2.1. Immunité innée ou
naturelle
Cellule immunitaire innée conditionnelle et
système de capteurs métaboliques. L'immunité
innée est la première ligne de défense de l'hôte,
fournissant une défense initiale non spécifique contre les
signaux de danger. Les cellules immunitaires innées
professionnelles comprennent les cellules
dendritiques (DC), les monocytes, les macrophages et les lymphocytes B (
Lizhe
et al., 2020). Des structures moléculaires communes à de
très nombreux microorganismes vont interagir avec des molécules
complémentaires préformées de l'hôte (en solution ou
à la surface de cellule) pour déclencher un signal de
« danger » conduisant à l'exclusion du
pathogène. Lors de l'infection d'une cellule par des virus, des
modifications membranaires (telles que la diminution de l'expression des
molécules de classe I du complexe majeur
d'histocompatibilité [CMH]) vont permettre la destruction de la cellule
infectée par des lymphocytes cytotoxiques NK (« natural
killer » : cellules tueuses de l'immunité naturelle). Au
total, l'immunité naturelle est caractérisée par sa mise
en jeu rapide et par le développement de réactions inflammatoires
(bactéries, parasites) ou cytotoxique (virus) conduisant souvent
à l'exclusion du pathogène (Kouassi et al., 2003). Lizhe et al.
(2020) ajoute que, l'inflammation est un processus pathologique tissulaire dont
le but principal est de résoudre l'infection et de réparer les
tissus.
En outre, Débora et al. (2020) à leurs tours on
dit que « Les cellules tueuses naturelles et les phagocytes, y
compris les neutrophiles, les monocytes et les macrophages, représentent
la première ligne du système immunitaire inné contre les
infections virales et sont très sensibles à l'exercice
aérobie aigu ». Cavaillon (2010) a aussi ajouté
l'inflammation et l'immunité innée sont deux processus qui se
chevauchent et, qui, depuis la découverte des récepteurs des
pathogènes et des signaux endogènes de danger, ont reçu
une attention nouvelle. En effet, notre vision de la réponse immunitaire
a évolué, et la recherche sur l'immunité innée est
dans une période de renaissance. Pendant de nombreuses années,
l'immunologie était divisée en deux grands thèmes :
l'immunité « spécifique » et l'immunité «
non spécifique », avec forcément moins d'attention pour
l'immunité qui était définie par une négation.
Depuis que l'expression « immunité non spécifique » a
été remplacée par le concept d'immunité
innée ou d'immunité naturelle, celle-ci est maintenant sous les
projecteurs. Avec la découverte des toll-like receptors (TLRs). Les TLRs
reconnaissent spécifiquement des déterminants microbiens
nommés pathogen associated molecular patterns (PAMPs). Il est clair que
l'immunité innée n'est certainement pas un processus non
spécifique de défense de l'hôte.
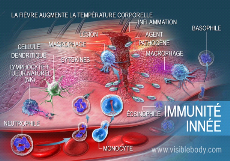
Figure 2 : l'immunité innée en
action contre l'augmentation de la température corporelle due à
la fièvre.
I.1.2.2. Immunité adaptative ou
spécifique
Intervient secondairement après une phase de
reconnaissance de l'antigène, de prolifération lymphoïde et
de différenciation en cellules productrices d'anticorps (lymphocytes B /
plasmocytes) et de cytotoxicité (lymphocytes TCD3+). Cette
immunité adaptative est douée de mémoire et un
deuxième contact avec l'antigène permet une réponse rapide
et puissante de type secondaire (Olivier, 2005). L'immunité adaptative,
antérieurement qualifiée d'immunité spécifique, est
nécessaire pour le contrôle des infections de longue durée
et pour la mise en place d'une mémoire immunologique sur laquelle
s'appuie la vaccination (Cavaillon, 2010). Kouassi et al. (2003) intitule que,
l'immunité spécifique est apparue lors de la divergence entre
vertébrés et invertébrés. Elle est
caractérisée par un ensemble de molécules de structure
extrêmement diversifiée appartement toutes à la
superfamille des immunoglobulines (Ig) : les
anticorps, les récepteurs d'antigène
des lymphocytes T (TCR) et les molécules CMH. Les molécules d'Ig
existent sous forme soluble (les anticorps répartis en cinq classes de
fonctions biologiques différentes chez l'homme : IgM, IgG, IgA, IgD
et IgE) et sous forme de récepteurs
membranaires des lymphocytes B (BCR). La molécule d'anticorps,
formée en général de 2 chaînes
légères, interagit par son site de liaison ou paratope avec une
zone de l'antigène appelée épitope. Chaque épitope
correspond à une zone de 2 à 3 nm de diamètre (soit
environ 15 acides aminés).
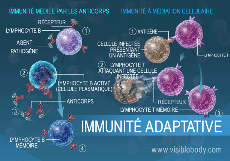
Figure 3 : organisation de l'immunité
adaptative (immunité médiée par les anticorps et
immunité à médiation cellulaire).
I.1.3. Cellules immunitaires
Le système immunitaire est composé d'organes et
de tissus dits lymphoïdes dévolus à la production de
lymphocytes et aux fonctions immunitaires. Ils sont connectés par les
vaisseaux sanguins et lymphatiques. Le foie foetal est le premier organe de
différentiation des cellules immunitaires, relayé à la
naissance par la moelle osseuse. Les Cellules souches lymphoïdes
poursuivent leur maturation en lymphocytes B ou T au sein des organes
lymphoïdes primaires (ou centraux) où ils acquièrent, entre
autres, un récepteur propre à chaque cellule : c'est la
constitution des répertoires T et B (Jonathan et al., 2018). Les cellules lymphoïdes innées (ILC)
orchestrent les réponses immunitaires aux signaux tels que les
cytokines, les alarmines, les neuropeptides et les hormones, interagissant avec
les cellules hématopoïétiques et non
hématopoïétiques. Les ILC manquent de récepteurs
antigéniques réarrangés et bien qu'ils résident
principalement dans les tissus, ils sont également observés dans
la circulation et les tissus lymphoïdes secondaires où ils
présentent des fonctions spatiales et temporelles distinctes. En
dehors des rôles dans l'immunité, les ILC jouent un rôle
clé dans le maintien de l'homéostasie tissulaire, la promotion de
la réparation tissulaire et la régulation de l'inflammation.
Alors que le système nerveux central (SNC)
est considéré comme un site privilégié sur le plan
immunitaire avec un infiltrat immunitaire minimal, des ILC ont
été identifiées dans le SNC d'humains et de souris en
bonne santé, représentant environ 2,5 % des leucocytes par
séquençage (
Julia
et al., 2022). Les ILC humains présentent une plasticité
importante, définie comme la capacité d'une population ILC mature
à acquérir les caractéristiques associées à
une autre population ILC mature. Cette caractéristique dynamique
des ILC humaines pourrait être un moyen efficace d'adapter rapidement
l'immunité aux conditions prédominantes dans les tissus sans
recrutement de cellules provenant d'autres sources tissulaires. Les
mécanismes sous-jacents à la plasticité de l'ILC servent
évidemment de cibles thérapeutiques intéressantes. Les
caractéristiques distinctes des ILC et des lymphocytes T permettent une
complémentarité et une redondance entre ces systèmes
immunitaires innés et adaptatifs. Alors que les lymphocytes T sont
activés par des interactions MHC-peptide-TCR et des signaux de
costimulation, les ILC manquent généralement d'expression de
récepteurs antigéniques réarrangés. Au lieu de
cela, ces cellules sont amorcées par les cytokines, les hormones et les
médiateurs lipidiques environnants et peuvent en outre être
sensibles aux stimuli environnementaux. Dans le milieu humain, les ILC servent
sans aucun doute de sources importantes de cytokines qui entraînent la
pathologie. De plus, en agissant dans un réseau d'autres cellules
immunitaires, l'ILC peut propager leurs fonctions au-delà de celles
directement médiées par les ligands de surface et les cytokines
effectrices sécrétées (
Mazzurana
et al., 2018).
I.1.3.1. Rôle et fonction des cellules
immunitaires
À l'état basal, l'épiderme joue une
barrière physique naturelle empêchant la pénétration
de la bactérie pathogène. Cette protection est renforcée
par une compétition pour les nutriments avec la flore commensale
cutanée ainsi que la présence de peptides et enzymes
antibactériens. Une rupture de cette barrière (coupure,
piqûre...) est donc nécessaire afin que la bactérie
pénètre dans l'organisme. À ce moment-là, les
cellules immunitaires innées résidentes du tissu
sous-cutané, macrophages et cellules dendritiques immatures, vont
pouvoir reconnaître comme anormale (PAMPs et signal « danger »)
la présence de ces bactéries via leurs immuno
récepteurs, les internaliser par phagocytose puis initier une
réponse inflammatoire. La principale conséquence est une
modification de la perméabilité vasculaire permettant aux
cellules et aux protéines sanguines de traverser l'endothélium,
en particulier les granulocytes neutrophiles jouant un rôle crucial dans
l'élimination des bactéries, les immunoglobulines et le
complément. En parallèle, les cellules dendritiques immatures,
suite aux signaux dangers reçus, entament un processus de maturation et
migrent vers les organes lymphoïdes secondaires. C'est ici qu'elles
interagiront avec les cellules du système immunitaire adaptatif, les
lymphocytes B et les lymphocytes T CD4+, capables de reconnaître les
antigènes bactériens via leur immuno- récepteur
de surface. Cette interaction tripartite est indispensable afin d'engendrer une
activation efficace du lymphocyte B et du lymphocyte T qui vont alors
proliférer de manière clonale et donner naissance à des
lymphocytes mémoires qui joueront un rôle crucial dans le cas
d'une deuxième infection. Les lymphocytes B activés
générés poursuivent également leur maturation afin
de devenir des plasmocytes, cellules productrices d'anticorps dirigés
contre les protéines bactériennes qui diffuseront dans l'ensemble
de l'organisme via la circulation sanguine. Au niveau du site de
l'infection, ces anticorps auront la capacité de détruire
directement les bactéries par activation du complément ou bien de
favoriser leur phagocytose par les macrophages. Une fois que l'ensemble des
bactéries est éliminé, un certain nombre de processus
permettent la réparation tissulaire, étape importante afin que
l'intégrité de l'épithélium soit retrouvée
et sa protection restaurée (Jonathan et al., 2018).
Grâce à leur capacité à faire
avancer la cascade de réactions inflammatoires, les ILC sont
impliquées dans une myriade d'interactions avec d'autres cellules
immunitaires. Les cellules myéloïdes sont capables de
détecter les signaux de danger provenant d'agents pathogènes
envahissants ou de tissus endommagés et sécrètent des
cytokines qui instruisent par conséquent les ILC. Les
réseaux de cytokines impliqués dans l'interaction entre les ILC
et les cellules myéloïdes ont récemment fait l'objet d'une
revue approfondie par Mortha et Burrows. Ainsi, dans la présente
revue, nous résumerons la compréhension actuelle de la
façon dont les ILC interagissent avec d'autres cellules d'origine
lymphoïde (Mazzurana et al., 2018). Les paires de molécules de
point de contrôle immunitaire jouent un rôle essentiel dans la
connexion des cellules immunitaires innées et adaptatives pour une
réponse immunitaire stimulatrice ou inhibitrice, et dirigent la
réponse immunitaire vers l'une ou l'autre des cellules par des
réactions de point de contrôle immunitaire unidirectionnelles ou
bidirectionnelles. Il est important de noter que, les cellules immunitaires
subissent une reprogrammation métabolique au cours des réponses
immunitaires, qui se caractérise par une altération de la
production d'énergie, de la biosynthèse et de la reprogrammation
épigénétique (Lizhe et al., 2020). Pour répondre
aux demandes énergétiques et biosynthétiques accrues de
réponse de défense et de réparation des dommages, les
cellules immunitaires activées ont tendance à augmenter
l'activité de glycolyse mais à diminuer la phosphorylation
oxydative pour une production rapide d'adénosine triphosphate (ATP) afin
d'adopter un statut prolifératif et des fonctions effectrices
pro-inflammatoires. Comme l'une des conséquences des changements du
métabolisme cellulaire, une reprogrammation
épigénétique distincte a également
été trouvée dans les cellules immunitaires activées
en raison de l'accessibilité altérée du donneur de groupe
acétyle/méthyle et de l'activité modulée par les
métabolites des enzymes épigénétique. Une
acétylation élevée mais une méthylation
supprimée est souvent associée à un statut
pro-inflammatoire dans les cellules immunitaires dans de nombreux cas (Lizhe et
al., 2020).
I.2. Exercice physique et cellules
immunitaires
La pratique du sport entraîne des modifications non
négligeables de la répartition des populations cellulaires
circulantes impliquées dans la réponse immunitaire innée
et adaptative. Ces changements passent par une production de cytokines
pro-inflammatoires et la libération des hormones du stress, conduisant
à des redistributions cellulaires. La nature des interactions est
complexe et passe en partie par l'expression de molécules
d'adhésion, le recrutement de lymphocytes matures plus que de
lymphocytes naïfs ainsi que par des altérations des
phénomènes d'apoptoses du potentiel mitotique. En pratique
quotidienne le médecin peut recommander la pratique de l'exercice
régulier en excluant les entraînements exténuants pour le
muscle et le système lymphoïde d'immuno-surveillance (Olivier,
2005).
La pratique de l'exercice physique peut provoquer des
réponses biochimiques et physiologiques aiguës ou chroniques en
fonction de la fréquence, du volume et de l'intensité de
l'exercice. Les réponses physiologiques aiguës sont
associées, par exemple, aux effets immédiats d'une seule
séance d'exercice, qui induisent des altérations de
l'homéostasie de l'ensemble du corps. La pratique de l'exercice physique
consomme intrinsèquement de l'énergie, génère des
ROS et active le système immunitaire, ayant à la fois des effets
positifs et éventuellement nocifs selon le type et le degré des
réponses du système immunitaire activé. L'activation du
système immunitaire est une réponse à un facteur de
stress, visant à rétablir l'homéostasie
cellulaire. Le processus inflammatoire joue un rôle crucial dans
l'homéostasie, principalement par la défense active contre divers
stimuli nocifs tels que les infections virales neurotropes et/ou les dommages
traumatiques, favorisant le rétablissement de la fonction cellulaire et
tissulaire (Débora et al., 2020). Au cours d'exercices aérobies
d'intensité modérée et vigoureuse d'une durée
inférieure à 60 minutes, l'activité anti pathogène
des macrophages tissulaires se produit parallèlement à une
recirculation accrue des immunoglobulines, des cytokines anti-inflammatoires,
des neutrophiles, des cellules NK, des lymphocytes T cytotoxiques et des
lymphocytes B immatures. Cellules, qui jouent toutes un rôle essentiel
dans l'activité de défense immunitaire et la santé
métabolique. L'exercice intense stimule l'échange de cellules et
de composants du système immunitaire inné entre les tissus
lymphoïdes et le compartiment sanguin. Bien que transitoire, un effet
de sommation se produit au fil du temps, avec une amélioration de
l'immuno-surveillance contre les agents pathogènes et les cellules
cancéreuses et une diminution de l'inflammation systémique. En
général, l'exercice intensif est maintenant
considéré comme un adjuvant important du système
immunitaire pour stimuler l'échange continu de leucocytes entre la
circulation et les tissus. Le contraste des réponses immunitaires
aiguës à un effort intense (par exemple, une course de marathon) et
à une marche de 30 à 45 minutes. L'activation immunitaire est
associée aux demandes d'oxygène et de biosynthèse, et les
cellules immunitaires doivent s'engager dans une reprogrammation
métabolique pour générer suffisamment d'énergie
pour alimenter ces demandes. Bien que des recherches
supplémentaires soient nécessaires, des données
préliminaires confirment que la capacité métabolique des
cellules immunitaires est réduite pendant la récupération
après des périodes d'exercice intensif exigeantes sur le plan
physiologique, entraînant un dysfonctionnement immunitaire transitoire
(David et al., 2018).
La plupart des études sur les effets de l'exercice sur
le système immunitaire ont été réalisées en
évaluant certains paramètres avant et après la performance
physique. Des séances uniques d'exercices d'intensité
modérée sont "immuno-améliorantes" et, en fait, sont
responsables d'une réduction de l'inflammation, du maintien de la masse
thymique et d'une immuno-surveillance améliorée. D'autre
part, certaines études montrent des changements négatifs dans les
niveaux et la fonction de nombreux composants du système immunitaire en
réponse à un exercice intense et prolongé (Olga et al.,
2021). Durant cette phase, appelée « fenêtre ouverte
», l'hôte est plus sensible aux micro-organismes tels que les virus
et les bactéries avec un plus grand risque de contracter des
infections. Différents mécanismes contribuent à ces
altérations, tels que le stress résultant d'un exercice intense,
les modifications de la concentration des hormones, des cytokines et de la
température corporelle, l'augmentation du flux sanguin, l'apoptose
lymphocytaire et la déshydratation. En particulier, les exercices
d'endurance à haute intensité ont été
associés à une modification du nombre de globules blancs des
athlètes, telle qu'une augmentation des granulocytes et des monocytes,
une diminution des lymphocytes et une augmentation des neutrophiles et des
éosinophiles. Un rôle intéressant semble être
joué par les cellules « natural killer », dont
l'activité semble exaltée lors de l'effort physique, avec une
augmentation des cellules CD16+. De plus, après un exercice physique
intense, la protection immunitaire des voies respiratoires supérieures
est plus faible en raison d'une diminution des sécrétions nasales
et salivaires avec de faibles niveaux d'IgA, d'une augmentation du transit du
mucus ciliaire nasal et d'une fonction nasale compromise des neutrophiles (Olga
et al., 2021). Cependant, la modulation du système immunitaire
inné à l'exercice physique peut changer en fonction du type, de
l'intensité et du volume d'exercice, voire du moment de la mesure par
rapport à la séance d'entraînement. Par exemple,
après un exercice vigoureux aigu se produit un afflux spectaculaire de
cellules tueuses naturelles et de lymphocytes T CD8 + qui présentent une
cytotoxicité élevée et un potentiel de migration
tissulaire (Débora et al., 2020).
Bien que l'hypothèse de la « fenêtre
ouverte » immunologique après un exercice physique intense
soit largement diffusée dans la littérature, certains aspects
concernant la dynamique immunologique après un exercice physique aigu
restent controversés. L'hypothèse de la "fenêtre ouverte"
suggère qu'une altération du système immunitaire
après un exercice vigoureux augmente le risque de contracter une
infection des voies respiratoires supérieures (Débora et al.,
2020). Au cours d'un exercice aérobie vigoureux, on observe une
augmentation des lymphocytes du sang périphérique,
suggérant une activation du système immunitaire induite par
l'exercice. Cependant, 1h ou 2h après l'exercice, une diminution
des lymphocytes du sang périphérique est observée,
représentant pour l'athlète une période de risque de
contracter des infections et renforçant l'hypothèse selon
laquelle l'exercice favorise une fenêtre d'immunosuppression à
court terme (Débora et al., 2020).
I.3. Test Yo-Yo intermittent
Le test Yo-Yo Intermittent
Recovery (YYIRT) a été développé sur la base du
test maximal multi étapes 20 m Shuttle-run (20-MST). L'objectif
principal du test YYIR était de mesurer la capacité à
effectuer de manière répétée des exercices
intenses, y compris le potentiel de récupération rapide d'un tel
exercice. Au cours du test YYIR, les participants effectuent des courses
répétées de 2 × 20 m à une vitesse
progressivement croissante, interrompues par des périodes de
récupération active de 10 secondes. Le test est effectué
jusqu'à épuisement total du participant (c'est-à-dire
comme test de performance maximale). Le rythme est contrôlé
par un dispositif acoustique automatisé, indiquant le départ, le
virage et l'arrivée, mais il est obligatoire que le test soit
supervisé par du personnel expérimenté. Le test YYIR peut
être effectué à deux niveaux différents,
appelés test Yo-Yo Intermittent Recovery
Level 1 (YYIR1) et test Yo-Yo Intermittent Recovery
Level 2 (YYIR2) (
Boris
et al., 2018). Le YYIRT consiste en des allers retours
répétés de 20 m entre les lignes de départ, de
virage et d'arrivée, et à une vitesse progressivement
augmentée, qui est contrôlée par des bips sonores d'un
magnétophone (
Yusuf,
2012). En particulier, le YYIRT a été spécialement
conçu pour évaluer la capacité à effectuer des
exercices intermittents de haute intensité. Ce test est largement
utilisé par les scientifiques et les entraîneurs pour surveiller
la condition cardio respiratoire des joueurs de football car il est en
corrélation avec les performances des matchs. En effet, les mesures
physiologiques ont montré que le renouvellement
énergétique aérobie atteignait des valeurs maximales et
que le système énergétique anaérobie était
fortement sollicité vers la fin du test (Omar et al., 2012). Par rapport
aux tests de laboratoire standard, des méthodes de test sur le terrain
ont été développées pour amener les tests d'effort
à un cadre plus réaliste avec l'avantage pratique
supplémentaire de déterminer la capacité d'exercice
également en groupe (Krustrup et al., 2003). A cet égard, les
tests de course en navette incluent également une composante
d'agilité immanente aux sports qui impliquent des exercices
intermittents tels que le football ou le basket-ball (Bangsbo et al., 2008).
I.4. Football
Selon Wikipédia, Le football est un sport collectif qui
se joue avec un ballon sphérique entre deux équipes de onze (11)
joueurs. Elles s'opposent sur un terrain rectangulaire équipé
d'un but à chaque extrémité. L'objectif de chaque camp est
de mettre le ballon dans le but adverse plus de fois que l'autre équipe,
sans que les joueurs utilisent leurs bras à l'exception des gardiens de
buts. Pour Yang et al., (2013), le football est l'un des sports les plus
populaires au monde. Il est pratiqué à différentes
catégories d'âge. C'est un sport balistique opposant deux
équipes de 11 joueurs et le match se joue pendant au moins 90 minutes
dans les compétitions officielles.
Le football est un sport intermittent
caractérisé par des mouvements explosifs
répétés. Durant un match de football, le joueur parcourt
entre 8 et 12 km avec une fréquence cardiaque proche de 90 % de la fréquence cardiaque maximale (FC max) et
exécute 10 à 20 sprints, 8 têtes et 11 tacles (Khanfir et
al., 2013). Les actions décisives en football sont des mouvements
explosifs qui sont généralement réalisés sur un
fond d'endurance (Khanfir et al., 2013). Un match de football est
constitué de deux périodes de quarante-cinq (45) minutes chacune
et entre la première et la deuxième période, il y'a une
pause de quinze (15) minutes. D'autres périodes de pause sont
observées lors des arrêts de jeu suite aux infractions aux
règles et à l'occasion des changements (Jacquet et al., 2002).
Parvenir au footballeur ou footballeuse complet demande le développement
de nombreuses qualités physiologiques ; endurance, résistance,
vitesse, souplesse, force, coordination. La détermination de la
capacité aérobie est plus délicate. Elle s'exprime de
classique par la mesure du temps d'endurance. C'est-à-dire du temps
pendant lequel un sujet travaille à un haut pourcentage de son volume
d'oxygène maximal (VO2 max) en
général de 85-90% celle-ci est évidente que plus ce temps
sera long plus l'athlète sera capable d'utiliser sur le terrain un
pourcentage élevé de sa VO2 max. La mesure du seuil
ventilatoire à la même signification comme celle du seuil dit
« anaérobie » d'augmentation des lactates (situé
à aviron 2mmol/1). Ces seuils sont à environ 50% de la
VO2 max chez les sujets non entraînés et peuvent se
déplacer jusqu'à 80% de celle - ci chez les marathoniens. Plus le
seuil ventilatoire est élevé, plus l'athlète peut
poursuivre longtemps un effort à un niveau élevé de sa
VO2 max ceci apparaissant particulièrement important en
matière de football (Goudiaby, 2008).
Chapitre II : Matériel et
Méthodes
II.1.
Matériel
II.1.1. Mesure de la taille

La mesure de la taille en position debout est une des mesures
physiques fondamentales pour quantifier la taille du corps humain. Elle a
été effectuée à l'aide d'une toise en bois sur
socle (figure 4) installée sur une surface dure, horizontale et stable,
tout en maintenant l'angle de la toise perpendiculaire au sol. Lors de la prise
de la mesure, le sujet était en position verticale, dos à la
toise afin que la tête, les épaules, les fesses et les talons
soient appuyés sur la barre verticale de la toise, tout en maintenant
une courbure lombaire naturelle. Le sujet était pieds nus. Il devait
avoir les mains le long du corps, paumes face aux cuisses, jambes tendues et
maintenir la tête droite en regardant droit devant lui. Avant la mesure,
le sujet devait prendre une grande inspiration et la maintenir jusqu'à
ce que la partie mobile de la toise soit descendue sur sa tête et que la
mesure soit terminée.
Figure 4 : Toise en bois sur socle
II.1.2. Mesure de la masse corporelle
La mesure de la masse corporelle a été
effectuée à l'aide d'uneimpédance mètre
électronique de marque TANITA BC-545N JAPAN d'une portée maximale
de 150 kg et ayant une précision de 0,1 kg près, installée
sur une surface dure, horizontale, stable et exempte de vibrations. Avant toute
mesure, les données de l'année de naissance, mois et jour ont
été insérées suivi après la taille.
Après insertiondes données, le sujet se met debout en
plaçant les pieds sur les électrodes et en tenant les
électrodes avec les deux mains. En moins d'une minute un bip sonore
déclare la fin de l'opération et tous les résultats ont
été affichés sur l'écran.

Figure 5 : Impédance
mètre
II.1.3. Hydromètre électronique
L'hydromètre électronique exposé à
ciel ouvert, a permis de mesurer simultanément la température
ambiante en degré Celsius et l'humidité relative en
pourcentage.

Figure 6 : Hydromètre
électronique
II.1.4. Automate de numération
« Elite 3 »
II.1.4.1. Caractéristiques
techniques
Automate Elite 3, Chine. L'automate, avec ses trois
réactifs (le diluent, la lyse et le cleaner), est mis en marche en
appuyant le bouton « On/Off », puis l'écran de
démarrage apparait ensuite on le touche avec son doigt sur la fonction
« Mesure ». L'appareil fait son nettoyage, vérifie
le compteur des globules blancs, rouges et plaquettes puis s'apprête
à réaliser l'hémogramme.
II.1.4.2. Fonction
L'Automate Elite 3 a été utilisé pour la
numération de la lignée blanche (globules blancs) notamment les
leucocytes, lymphocytes, monocytes et les granulocytes.
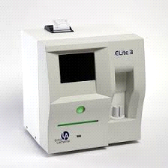
Figure 7 : Automate « Elite
3 »
II.2. Méthodes
II.2.1. Cadre et type d'étude
L'équipe senior Damme de football la Source a
été choisie comme cadre de recherche de notre étude. La
Source est l'une des équipes de football évoluant au championnat
national Congolaise. L'équipe fait ses entrainements à l'enceinte
du complexe sportive de Makélékélé (Brazzaville)
plus précisément à l'Institut Supérieur d'Education
Physique et Sportive (ISEPS).
C'est une étude expérimentale
réalisés à l'ISEPS dans la période allant du 25 au
31 mai 2022.
II.2.2. Population
23 footballeuses séniores de l'équipe La Source
ont constitué la population de notre étude.
II.2.3. Echantillon
Sur 23 footballeuses séniores, 14 ont participent
à l'étude.
II.2.4. Critères de sélection
Les sujets ont participé à l'étude selon
le critère de sélection ci-après :
· Critères d'inclusion
Etaient inclus à cette étude les footballeuses
:
- régulières aux entrainements ;
- participant au championnat national ;
· Critère d'exclusion
Etaient exclus de l'étude les footballeusesabsentes et
malades le jour des tests.
II.2.5. Protocole expérimental
Procédures
Le test Yo-Yo intermittent a
été réalisé le matin de 7h 30 à 10h 30
à l'Institut Supérieur d'Education Physique et Sportive (ISEPS).
Les prélèvements sanguins ont été effectués
avant effort, après effort et 2h après le test d'effort.
Test Yo-Yo intermittent (YYIR)
L'objectif principal du test YYIR est de mesurer la
capacité à effectuer de manière
répétée des exercices intenses, y compris le potentiel de
récupération rapide d'un tel exercice. Le niveau atteint par
chaque joueur est retenu dès l'arrêt de la course (Robergs et
Landwehr, 2002). Ce test consiste à courir le plus longtemps possible
une distance de 20 mètres en aller et retour, avec une
récupération de 10 secondes tous les 40 mètres. Le rythme
de course était marqué par un bip sonore. Les sujets ont
passé la ligne des 20 mètres avec un pied en même temps que
le bip sonore retentit. Le test se termine lors que le sujet s'arrête
pour cause d'épuisement ou lorsqu'il échoue deux fois de suite
à franchir la ligne avant que le bip sonore retentisse. La distance
totale parcourue est utilisée pour évaluer les performances du
sujet, même si l'étape n'est pas terminée. La vitesse
finale atteinte a également été enregistrée,
même si la dernière étape n'était pas
terminée.
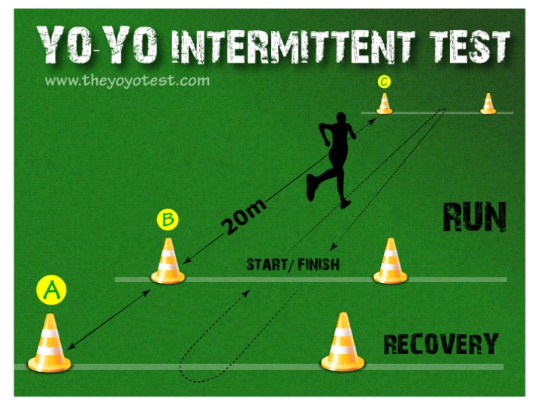
Figure 8 : test Yo-Yo intermittent
Numération formule sanguine ou
hémogramme
Les examens d'hémogramme étaient
réalisés à partir des échantillons de sang
prélevés avant, après et 2h après effort. Ces
examens ont permis de déterminer les concentrations de leucocytes,
lymphocytes, monocytes et granulocytes. Ces examens ont été faits
au laboratoire de la clinique COGEMO. Les prélèvements des
échantillons de sang ont été effectués par les
agents de la santé.
II.2.6. Variables étudiées
Trois types de variables ont été
répertoriés à savoir : la variable indépendante, la
variable
dépendante et la variable de confusion. Le Test Yo-Yo
Intermittent a constitué la variable indépendante de
l'étude. Les cellules inflammatoires notamment les leucocytes,
lymphocytes, monocytes et granulocytes ont constituées les variables
dépendantes. La température ambiante et l'humidité
relative ont constituées les variables confondantes.
II.3. Analyse statistique
Les statistiques descriptives ont été
utilisées pour générer les moyennes et les
écart-types des variables anthropométriques et de cellules
inflammatoires. La normalité et l'homogénéité
n'étant pas vérifiées, le test non paramétrique de
Friedman a été utilisé pour comparer les variables de
cellules inflammatoires enregistrées avant, après et 2h
après effort. Lors que le test de Friedman a montré une
différence significative, la comparaison binaire a été
faite à partir du test non paramétrique de Wilcoxon. Lorsque le
test de Friedman n'a pas présenté de différence
significative, la comparaison binaire des variables par le test de Wilcoxon
n'est pas possible. Les données ont été traitées
par le logiciel IBM SPSS (v.22.0, SPSS Inc., Chicago, Illinois,
États-Unis). Le niveau de significativité a été
fixé à p ? 0,05.
Chapitre III : Résultats
Les valeurs moyennes des caractéristiques
anthropométriques des footballeuses sont représentées dans
le tableau I.
Tableau I : valeurs descriptives de
l'âge et des paramètres anthropométrique des
footballeuses
|
Valeurs mini
|
Valeurs maxi
|
Moyenne #177; SD
n= 14
|
|
Age (an)
|
19,00
|
32,00
|
26,43 #177; 3,41
|
|
Taille (cm)
|
156,00
|
171,00
|
163,79 #177; 5,69
|
|
MC (Kg)
|
47,90
|
66,80
|
57,60 #177; 6,05
|
|
IMC (Kg /m2)
|
16,60
|
22,90
|
19,69 #177; 1,86
|
MC : Masse corporelle ; IMC : Indice de masse
corporelle.
Les caractéristiques anthropométriques des
Athlètes, l'âge, la taille, la masse corporelle et l'indice de
masse corporelle des footballeuses étaient respectivement de 26,43 #177;
3,41 ans, 163,79 #177; 5,69 cm, 57,60 #177; 6,05 kg et 19,69 #177; 1,86
kg/m2 (Tableau I).
Les valeurs anthropométriques obtenues avant le test
Yo-Yo Intermittent, après et 2h après le test sont
représentées dans le Tableau II.
Tableau II : comparaison des valeurs
moyennes avant, après et 2h après le test Yo-Yo
|
Avant effort n=14
|
Après effort n=14
|
2h après effort n=14
|
Valeur p
|
|
Leu (103/uL)
|
4,56 #177; 0,96
|
5,87 #177; 0,78
|
5,14 #177; 1,15
|
0,002
|
|
Lym (103/uL)
|
1,88 #177; 0,67
|
2,15 #177; 0,47
|
1,66 #177; 0,40
|
0,011
|
|
Mon (103/uL)
|
0,40 #177; 0,088
|
0,49 #177; 0,12
|
0,43 #177; 0,13
|
0,338
|
|
Gra (103/uL)
|
2,64 #177; 1,19
|
2,80 #177; 0,60
|
3,09 #177; 0,92
|
0,395
|
Leu : Leucocyte ; Lym : Lymphocyte ;
Mon : Monocyte ; Gra : Granulocyte.
Les valeurs moyennes de leucocytes et lymphocytes
enregistrées avant effort, après et 2h après effort
physiqueont présenté une différence significative entre
les trois moyennes enregistrées. Cependant les monocytes et les
granulocytes enregistrés avant effort, après et 2h après
effort n'ont pas présenté de différence significative
(Tableau II). Lorsque le test de Friedman a montré une différence
significative, la comparaison binaire a été faite à partir
du test non paramétrique de Wilcoxon. Cependant, lorsque le test de
Friedman n'a pas présenté de différence significative, la
comparaison binaire des variables par le test de Wilcoxon n'est pas
possible.
Tableau III : comparaison entre les
valeurs moyennes de leucocyte et de lymphocyte avant et après le test
|
Avant effort n=14
|
Après effort n=14
|
p
|
|
Leu (103/uL)
|
4,56 #177; 0,96
|
5,87 #177; 0,78
|
0,002
|
|
Lym (103/uL)
|
1,88 #177; 0,67
|
2,15 #177; 0,47
|
0,245
|
Leu : Leucocyte ; Lym : Lymphocyte
Les valeurs moyennes de leucocytes obtenues
immédiatement après effort étaient significativement
augmentées comparées à celle obtenues avant effort. Par
contre les valeurs moyenne de lymphocytes enregistrées avant effort et
celle obtenues après effort ne présentaient aucune
différence significative (Tableau III).
|
Avant effort n=14
|
2h après effort n=14
|
P
|
|
Leu (103/uL)
|
4,56 #177; 0,96
|
5,14 #177; 1,15
|
0,124
|
|
Lym (103/uL)
|
1,88 #177; 0,67
|
1,66 #177; 0,40
|
0,140
|
Tableau IV : comparaison des valeurs
moyennes entre le leucocyte et le lymphocyte avant effort et 2h après
effort
Leu : Leucocyte ; Lym : Lymphocyte
Les valeurs moyennes de leucocyte et de lymphocyte
enregistrée avant effort et celle obtenues 2h après effort n'ont
présenté aucune différence significative (Tableau IV).
Tableau V : comparaisons des valeurs
moyennes de lymphocyte après le test et 2h après le test
|
Après effort n=14
|
2h après effort n=14
|
P
|
|
Lym (103/uL)
|
2,15 #177; 0,47
|
1,66 #177; 0,40
|
0,002
|
Lym : Lymphocyte
Les valeurs moyennes obtenues au niveau de lymphocytes 2h
après effort étaient significativement inférieure à
celle obtenu après effort (Tableau V).
Tableau VI : Comparaison des valeurs
moyenne de la température et de l'humidité
avant et
après le test yo-yo intermittente
|
Début d'effort
|
Fin d'effort
|
Valeur p
|
|
TA (°C)
|
28,95 #177; 0,86
|
28,96 #177; 0,61
|
0,647
|
|
HR (%)
|
54,31 #177; 1,93
|
54,34 #177; 1,90
|
0,916
|
TA : Température Ambiante ; HR :
Humidité Relative.
Les valeurs moyennes de la température ambiante et de
l'humidité relative enregistrée au début de l'effort et
celle obtenue à la fin d'effort n'ont présenté aucune
différence significative (Tableau VI).
Chapitre IV : Discussion
L'objectif de cette étude était
d'évaluer les variations post exercice des cellules immunitaires chez
les footballeuses séniores. Les principaux résultats de notre
étude ont montré que le test Yo-Yo intermittent a induit une
augmentation significative des valeurs moyennes de leucocytes
enregistrées après effort par rapport à celles obtenues
avant effort. Les valeurs moyennes de lymphocytes obtenues 2h après
effort étaient significativement inferieure à celles
enregistrées après effort.
Dans la présente
étude, les valeurs moyennes de Leucocytes enregistrées
après effort ont significativement augmenté par rapport à
celles obtenues avant effort (5,87 #177; 0,78 103/uL vs 4,56 #177;
0,96 103/uL, p = 0,002) (tableau III). Ces résultats montrent
une leucocytose post effort qui peuvent s'expliquer par le nombre de lymphocyte
circulant (Hansen et al., 1991, MacNeil et al., 1991 et McCarthy et al., 1987).
Les études ont montré que l'entraînement sportif et
l'exercice peuvent entraîner une augmentation transitoire du nombre total
de globules blancs (Leucocyte) (David et al. 2018). Cette étude apporte
la preuve que l'activité sportive a une influence post exercice sur les
cellules inflammatoires. Signalons que les
variations de leucocyte post effort dépend du type d'effort de son
intensité et de sa durée (Said et al., 2009). Le test Yo-Yo
intermittent a induit une inflammation leucocytaire. Les valeurs moyennes de
leucocytes enregistrées avant effort et celles obtenues 2 h après
effort n'ont pas présenté de différence significative
(4,56 #177; 0,96 103/uL vs 5,14 #177; 1,15 103/uL, p =
0,124) (tableau IV). Ces résultats montrent que les valeurs moyennes de
leucocytes enregistrées 2h après effort reviennent à la
ligne de base.
Par ailleurs, il a
été observé une différence significative entre les
valeurs moyennes de lymphocytes enregistrées avant effort, après
et 2h après effort (1,88 #177; 0,67 103/uL vs 2,15 #177; 0,47
103/uL vs 1,66 #177; 0,40 103/uL, p = 0,011) (tableau
II). Cette variation lymphocytaire est due en réponse à l'effort
physique. Les valeurs moyennes de lymphocytes post effort n'ont pas
étaient significativement mobilisées par rapport aux valeurs
moyennes de lymphocyte prés effort. Cependant, une diminution
significative des valeurs moyennes de lymphocytes obtenues 2h après
effort par rapport à celles enregistrées immédiatement
après effort a été observées (2,15 #177; 0,47
103/uL vs 1,66 #177; 0,40 103/uL, p = 0.002) (tableau V).
L'étude menée par Débora et al. (2020),
ont montré une diminution des lymphocytes du sang
périphérique observée 1-2 h après l'exercice,
représentant pour l'athlète une période de risque de
contracter des infections et renforçant l'hypothèse selon
laquelle l'exercice favorise une fenêtre d'immunosuppression à
court terme. Un exercice physique intense induit des réponses du
système immunitaire similaires à celles induites par une
infection. Par contre nos résultats n'ont pas présenté de
différence significative entre les valeurs moyennes de lymphocytes
obtenues 2h après effort et celles enregistrées avant effort. Ces
résultats ont montré un retour à la ligne de base de
concentrations des lymphocytes obtenues 2h après effort.
Les résultats de l'étude de Débora et
al., (2020) ont montré une immunosuppression lymphocytaire 1h ou 2h
après effort provoquant une fenêtre ouverte pour les
bactéries, les virus etc. Signalons que nos résultats ne vont pas
dans le même sens que ceux trouvé par Débora et al.,
(2020). Cependant, il a été observé dans cette
étude une diminution significative de lymphocytes obtenus 2h
après effort par rapport à ceux enregistrées après
effort. Signalons que l'augmentation de lymphocytes
obtenues après effort n'as pas été significative par
rapport à ceux enregistrées avant effort. Cette augmentation de
lymphocytes après effort a été de 14,36% donc non
négligeable. Il sied de noter que les effets de l'exercice sur la
fonction immunitaire dépendent de la nature de l'exercice, de son
intensité, de sa durée ainsi que de la forme physique et de
l'âge du sujet.
CONCLUSION
Cette étude avait pour objectif d'évaluer les
variations post exercice des cellules immunitaires chez les footballeuses
séniores.La présente étude a été
réalisée sur la base de l'hypothèse ci-après
:L'exercice intermittent Yo-Yo induit des variations post exercice des cellules
inflammatoires. Les résultats obtenus ont montré des variations
de leucocytes et de lymphocytes après effort et 2h après effort.
Ces résultats majeurs sont les suivants : Une augmentation au niveau de
lymphocytes et leucocytes après effort et cette augmentation
présentait une différence significative au niveau de leucocytes.
Ces augmentations suggèrent qu'il y a des variations des cellules
inflammatoires dû à l'effort. Nous avons constaté aussi une
diminution significative de lymphocytes 2h après effort.Vue ces
résultats, notre hypothèse a étévalidé.
Références Bibliographiques
1- Bangsbo J, Iaia M, Krustrup P. (2008). Le test de
récupération intermittente Yo-Yo : un outil utile pour
l'évaluation de la performance dans les sports intermittents.
Médecine sportive, 2008 ;38 : 3751
2- Bangsbo J. (1994). Fitness training in football: a
scientific approch. Bagsvaerd, Denmark: HO+Storm; p. 1-336
3- Boris S,
Carina
P, Kiana K, Matthias B, Andreas F, Stefan MB. (2018). The Yo-Yo
Intermittent Tests: A Systematic Review and Structured Compendium of Test
Results. Avant Physiol. 2018; 9: 870. doi:
10.3389/fphys.2018.00870
4- Carlo C, Franco MI, Ermanno R, Stefano O, Vincenzo M.
(2007). Le test de récupération intermittente Yo-Yo chez les
basketteurs. 1440-2440/$ -- voir avant-propos (c) 2007 Sports Medicine
Australia. Publié par Elsevier Ltd. Tous droits réservés.
doi:10.1016/j.jsams.2007.02.013
5- Cavaillon JM. (2010). The immune response to invasion: the
ABCs. The innate immune system. Réanimation (2011) 20:S393-S405. DOI
10.1007/s13546-010-0127-9
6- David C. Nieman, Laurel M. Wentz. (2018). The compelling
link between physical activity and the body's defense system. J Sport
Santé Sci. 2019 mai ; 8(3) :
201-217. doi: 10.1016/j.jshs.2018.09.009
7- Débora da Luz Scheffer, Alexandra Latini. (2020).
Exercise-induced immune system response: Anti-inflammatory status on peripheral
and central organs. Biochim Biophys Acta Mol Base Dis. 1er octobre 2020 ;
1866(10) : 165823. doi:10.1016/j.bbadis.2020.165823
8- François L, Marie CB, Jean DL, Guislaine C. (2018).
Introduction générale au système immunitaire, chapitre 1
du livre Immunologie fondamentale et immunopathologie. Elsevier Masson SAS, 65,
rue Camille-Desmoulins, 92442 Issy-les-Moulineaux cedex, France, 2e
édition, de l'ASSIM : Collège des Enseignants d'Immunologie.
9- Goudiaby S. (2008). Profil
physique et physiologique des footballeurs de première division du
Sénégal : cas particulier Union Sportive d'Ouakam (U.S.O) et
Jeanne d'Arc (J.A) : Mémoire de maitrise es-sciences ettechniques
des activités physiques etsportives (S.T.A.P.S). INSEPS de Dakar
(Sénégal).
10- Hansen JB, Wilsgard L, Osterud B. (1991). Biphasic changes
in leukocytes induced by strenuous exercise. Eur JAppl Physiol. 1991; 62(3):
157-61
11- Jacquet A, Morlans JP,
Blaquart F, Domenech R, Doyen J, Dusseau C et al., (2002). Analyses et
enseignement de la coupe du monde 2002. Direction technique nationale de la
Fédération française de football, CTNFS et FFF, Marszalek
et le Guillard. 2002.
12- Jonathan V, Guislaine C, Michelle R. (2018). La structure
et l'organisation générale du système immunitaire,
chapitre 2 du livre Immunologie fondamentale et immunopathologie. Elsevier
Masson SAS, 65, rue Camille-Desmoulins, 92442 Issy-les-Moulineaux cedex,
France, 2e édition, de l'ASSIM : Collège des
Enseignants d'Immunologie.
13- Julia MM, Louis N, Arthur M, Sarah QC. (2022).
Tissue-Dependent Adaptations and Functions of Innate Lymphoid Cells. Immunol
avant. 2022; 13: 836999. doi: 10.3389/fimmu.2022.836999
14- Khanfir MA, Kamoun A, Heubert
R, Masmoudi L. (2013). Concurrent strength and endurance training in young
footballplayers. 0765-1597/$ - see front matter (c) 2013 Elsevier Masson SAS.
Tous droits réservés.
http://dx.doi.org/10.1016/j.scispo.2013.09.005
15- Kouassi E, Revillard JP, Fournier M, Ayotte P, Roy R,
Brousseau P, Hadji L. (2003). Système immunitaire. In environnement
et santé publique - fondements et pratiques, pp 687 - 698
16- Krustrup P, Mohr M, Amstrup T, Rysgaard T, Johansen J,
Steensberg A, et al. (2003). Le Yo-Yo Test de récupération
intermittente : réponse physiologique,
fiabilité et
validité. Med Sci Sport Exer, 2003 ; 35 : 697-705
17- Lizhe Sun, Xianwei Wang, Jason Saredy, Zuyi Yuan, Xiao
feng Yang, Hong Wang. (2020).Innate-adaptive immunity interplay and redox
regulation in immune response. Redox Biol. 2020 Oct; 37: 101759.
doi: 10.1016/j.redox.2020.101759
18- MacNeil B, Hoffan, Goetz L, Kendall A, Honston M, Alumagam
Y. (1991). Lymphocite proliferation responses after exercise in men :
fitness, intensity, and duration effects. JAppl Physiol. 1991; 70: 179-85. Doi:
10.1152/Jappl.1991.70.1.179
19- Mazzurana L, Rao A, Van AA, Mjösberg J. (2018). The
roles for innate lymphoid cells in the human immune system. Semin
Immunopathol. 2018 ; 40(4) : 407-419. doi
: 10.1007/s00281-018-0688-7
20- McCarthey DA, Perry JD, Malson RD, Dale MM. (1987).
Leucocytosis induced by exercise. Med J.1987, 295: 636. Doi:
10.11.36/bmj.295.6599
21- Olga S, Barbara L, Mariarita B,
Cristina M, Arturo C, Fabio F et al., (2021). Exercise, Immune System,
Nutrition, Respiratory and Cardiovascular Diseases during COVID-19: A Complex
Combination. Int J Environ Res Public Health. 2021
février ; 18(3): 904.
doi: 10.3390/ijerph18030904
22- Olivier MEYER. (2005). Sports, exercice et système
immunitaire. Service de Rhumatologie. Hôpital Bichat. 46 rue Henri
Huchard 75018 Paris.
23- Omar H, Hamdi C, Anis C, Henda C, Nidhal Z, Abdelhedi et
al., (2013). Biochemical Responses to Level-1 Yo-Yo Intermittent Recovery Test
in Young Tunisian Football Players. Asian J Sports Med. 2013 Mar; 4(1):
23-28. doi:
10.5812/asjsm.34522
24- Said, M, Feki Y, Aouni Z, Machghoul S, Hamza M, Amri M.
(2009). Effects of sustained intensive physical activities on immune cells
circulating and pro-inflammatory cytokines production in trained and untrained
humans. Elsevier Masson SAS. 0765-1597/$ - see front matter (c) 2009.
doi:10.1016/j.scispo.2008.12.003
25- Tong, T.K., Fu, F.H., Chow, B.C., Quach, B., and Lu, K.
(2003). Increased sensations of intensity of breathlessness impairs maintenance
of intense intermittent exercise. Eur. J. Appl. Physiol. 88: 370-379.
doi:10.1007/s00421-002-0724-z. PMID:12527965.
26- Yang SM, Lee WD, Kim JH, Kim
MY, Kim J.(2013). Differences in body componentsand electrical characteristics
betweenyouth soccer players and non-athletes.Health, 5:
1010-1015.Doi:10.4236/health.2013.56134
27- Yusuf Köklü. (2012). A Comparison Of
Physiological Responses To Various Intermittent And Continuous Small-Sided
Games In Young Soccer Players. J Hum Kinet. 2012 Mar; 31: 89-96.
doi : 10.2478/v10078-012-0009-5
ANNEXE


Photo 1 : Mesure de la taille
Photo 2 : Mesure de la masse corporelle

Photo 3 : Prise du sang
Photo 4 : Déroulement du test Yo-Yo
intermittent
TABLE DES MATIERES
|
IN
MEMORIUM............................................................................................................
|
i
|
|
Dédicace.....................................................................................................................
|
ii
|
|
Remerciements..............................................................................................................
|
iii
|
|
Liste des sigles et
abréviations.............................................................................................
|
iv
|
|
Liste des
tableaux...........................................................................................................
|
v
|
|
Liste des
figures.............................................................................................................
|
vi
|
|
Liste des
photos.............................................................................................................
|
vii
|
|
INTRODUCTION...........................................................................................................
|
1
|
|
Contexte et
justifications...................................................................................................
|
1
|
|
Problématique...............................................................................................................
|
1
|
|
Hypothèses..................................................................................................................
|
2
|
|
Objectifs.....................................................................................................................
|
2
|
|
Intérêt de
l'étude............................................................................................................
|
2
|
|
Structuration du
travail.....................................................................................................
|
2
|
|
Chapitre I : REVUE DE LA
LITTERATURE..........................................................................
|
3
|
|
I.1. Système
Immunitaire..................................................................................................
|
3
|
|
I.1.1.
Définition.............................................................................................................
|
3
|
|
I.1.2. Composant du Système
immunitaire..............................................................................
|
4
|
|
I.1.2.1. Immunité innée ou
naturelle.......................................................................................
|
4
|
|
I.1.2.2. Immunité adaptative ou
spécifique...............................................................................
|
6
|
|
I.1.3. Cellules
immunitaires...............................................................................................
|
7
|
|
I.1.3.1. Rôle et fonction des cellules
immunitaires.....................................................................
|
8
|
|
I.2. Exercice physique et cellules
immunitaires........................................................................
|
10
|
|
I.3. Test Yo-Yo
intermittent...............................................................................................
|
12
|
|
I.4.
Football..................................................................................................................
|
13
|
|
Chapitre II : MATERIEL ET
METHODES.............................................................................
|
15
|
|
II.1.
Matériel..................................................................................................................
|
15
|
|
II.1.1. Mesure de la
taille...................................................................................................
|
15
|
|
II.1.2. Mesure de la masse
corporelle....................................................................................
|
16
|
|
II.1.3. Hydromètre
électronique..........................................................................................
|
16
|
|
II.1.4. Automate de numération « Elite
3 »..............................................................................
|
17
|
|
II.1.4.1. Caractéristiques
techniques......................................................................................
|
17
|
|
II.1.4.2.
Fonction............................................................................................................
|
17
|
|
II.2.
Méthodes...............................................................................................................
|
18
|
|
II.2.1. Cadre et type
d'étude...............................................................................................
|
18
|
|
II.2.2.
Population............................................................................................................
|
18
|
|
II.2.3.
Echantillon............................................................................................................
|
18
|
|
II.2.4. Critères de
sélection................................................................................................
|
18
|
|
II.2.5. Protocole
expérimental.............................................................................................
|
19
|
|
II.2.6. Variables
étudiées...................................................................................................
|
20
|
|
II.3. Analyse
statistique....................................................................................................
|
20
|
|
Chapitre III :
RESULTATS...............................................................................................
|
21
|
|
Chapitre IV :
DISCUSSION...............................................................................................
|
24
|
|
CONCLUSION.............................................................................................................
|
26
|
|
Annexes......................................................................................................................
|
27
|
|
Références...................................................................................................................
|
28
|



