|
République Algérienne Démocratique
et Populaire
Ministère de l'Enseignement Supérieur et
de la Recherche Scientifique
UNIVERSITE AMAR TELIDJI-LAGHOUAT
FACULTE DES SCIENCES ET DE L'INGENIERIE
DEPARTEMENT DE BIOLOGIE

MEMOIRE DE FIN D'ETUDES
En vue de l'obtention du diplôme
d'Ingénieur d'Etat en Biologie
Option : Génie Biologique
Thème
Effets des extraits de quelques plantes
médicinales locales sur l' -
|
Présenté par :
|
Encadré par :
|
KHACHEBA Ihcen
BENAMAR Hanane
|
Mr YOUSFI Mohamed
Mr DJERIDANE Amar
|
Juin 2008
Dédicace
Ce mémoire qui est le
résultat et le fruit d'un travail de longue haleine, de nuits
interminables, de recherche et de documentation, d'une multitude
d'expériences au niveau du laboratoire et de contacts sans relâche
pour des enquêtes ethnobotaniques sur le terrain.
Je le dédie avec grand
amour
A ma mère Khadidja
A mon père Mohamed
A mes deux soeurs Hajer et Iness
Ces êtres chères qui
m'ont tant aidé, orienté et conseillé et qui ont fait
preuve d'une patience sans égal face à tous mes caprices
d'étudiante exigeante, perfectionniste et infatigable
Qui n'ont jamais douté de
moi et encouragé tout au long de mes études et leur soutien
pendant cette longue et pénible épreuve que représente ce
mémoire
Je leur dis tout simplement merci
Que dieu vous bénisse
Ihcen
Dédicace
À celui qui m'a indiqué
la bonne voie en me rappelant que la science et la volonté forgent les
grands esprits
À mon père
À celle qui m'a appris que
la patience est la clé du succès et de la Victoire.
À ma mère
À celui qui m'a toujours
soutenu et encourage psychologiquement
À mon frère
Et à ceux qui m'ont
élevé et réchauffé durant mon enfance
Mes grands parents
Tous m'ont couvert avec la chaleur de
leurs amours et leurs soutiens
Je leur dédie les premiers
fruits de ma réussite et prie dieu le tout puissant de leur donner
santé et longue vie
Ainsi à toutes les amies qui
ont répondu à notre invitation.
Hanane
Remerciements
Ce travail a été
réalisé au laboratoire des sciences fondamentales de
l'université Amar Telidji - Laghouat - sous la direction du docteur
YOUSFI Mohamed, maître de conférences à l'université
de Laghouat.
Nous adressons nos remerciements à
monsieur D. Benbertal directeur du laboratoire des sciences fondamentales de
nous avoir accueilli et mis à notre disposition tout le matériel
et réactifs nécessaires à la réalisation de ce
travail.
À monsieur YOUSFI Mohamed,
qui malgré ses nombreuses obligations, a accepté de nous encadrer
et de nous choisir un thème. Nous sommes très honorés
d'avoir pu bénéficier de son encadrement, il nous a accueilli
dans son laboratoire avec la plus grande bienveillance, ses encouragements et
sa confiance nous ont guidé tout au long de ce travail. Nous tenons
à l'assurer de notre grande estime et en témoignage de notre
profonde gratitude, nous lui adressons nos remerciements les plus
sincères
À monsieur DJERIDANE .Amar, co -
promoteur de ce mémoire, dont les remarques et compétences tout
au long de ces trois mois de mémoire nous ont été
très utiles. Nous tenons à lui présenter notre profonde
reconnaissance. Nous garderons en mémoire ses grandes qualités,
tant humaines, qu'intellectuelles, sa gentillesse et son humour.
Et on voudrait adresser plus
particulièrement des remerciements plein de reconnaissance et de
gratitude à nos professeurs des départements de biologie,
d'agronomie et de chimie qui ont toujours été à la hauteur
de leur noble mission d'enseignants assidus, ponctuels, attentifs et
généreux.
Nos remerciements iront également
à toutes les personnes qui, grâce à leur
disponibilité et à leur bonne humeur, nous ont soutenu en rendant
agréable les moments passés ensemble : Massouda, Hadjira,
Kaltoum, Assia, Sarha et Linda.
Une pensée pour toutes nos amies
étudiantes du département de biologie qui nous ont soutenues au
cours de ces années.
À notre jury de mémoire, qu'il
ne soit ainsi permis de vous remercier très sincèrement pour
avoir spontanément accepté de juger ce travail et d'en être
le rapporteur et tenons à vous assurer de notre considération la
plus respectueuse.
Abréviations
ADN : acide désoxy ribo
nucléique
ARN : acide ribo nucléique
°C : degré Celsius
CuSO4 : Sulfate de cuivre
DID : diabète insulino
-dépendant
DNID : diabète non
insulinodépendant
DO : densité optique
g : gramme
HCl : acide chlorhydrique
[I] : Concentration de l'inhibiteur
Ki : constante d'inhibition
KM : constante de
Michaelis et Menten
l: litre
ul : microlitre
M : molaire
uM : micromolaire
mg: milligramme
ml : millilitre
mM: Millimolaire
mmol : millimoles
:
Maturity Onset Diabetes in the Young
m/v: masse / volume
ppm: partie par millions
NaCl : chlorure de sodium
Na2CO3: Carbonate de sodium
nm: nanomètre
OH : groupement hydroxyle
pH : potentiel hydrogène
[S] : Concentration du substrat
UV : ultraviolet
Vmax : Vitesse maximale
XXème siècle :
20ème siècle
? : Alpha
MS : Matière sèche
Liste des figures
Partie bibliographique
|
Figure III . 1 : Variations de la vitesse
initiale de la réaction enzymatique en fonction de la concentration en
substrat.
Figure III . 2 : Variation de 1 / V en fonction de 1 /
[S].
Figure III . 3 :Graphique Michaelis-Menten d'inhibition
compétitive.
Figure III . 4 : Graphique Dixon d'inhibition
compétitive.
Figure III . 5 : Variation des pentes du
graphique Lineweaver - Burk en fonction des [I] pour l'inhibition
compétitive.
Figure III . 6 : Graphique Lineweaver - Burk
d'inhibition non compétitive.
Figure III . 7
: Graphique Dixon d'inhibition non compétitive
Figure III . 8 : Variation de 1 / V'max
en fonction de [I] pour l'inhibition non compétitive.
Figure III. 9 :
Graphique Lineweaver - Burk d'inhibition incompétitive
Figure III. 10 : Graphique Dixon d'inhibition
incompétitive.
Figure III . 11 :
Variation de 1 / K'M en fonction de [I] pour l'inhibition
incompétitive.
Figure III . 12 : Variation de 1 / V'max en
fonction de [I] pour l'inhibition incompétitive.
Figure II . 13 : Variation des pentes du graphique
Lineweaver - Burk en fonction des [I] pour l'inhibition
mixte.
r
Partie expérimentale
r
Figure I. 1 : Produits de dégradation de l'
-amylase.
Figure II. 1 :
La courbe d'étalonnage de l'acide gallique.
Figure II. 2: La courbe d'étalonnage de
la rutine.
Figure II. 3:
La courbe d'étalonnage du maltose
Figure II. 4 : La cinétique
de l' - amylase
Figure II. 5 : La représentation de Lineweaver ? burk
de l' - amylase
.
Figure II. 6 : Représentation de Lineweaver ? burk de
l'extrait aqueux la plante "Salvia officinalis"
Figure II. 7 : Représentation graphique de Dixon de
l'extrait aqueux de la plante "Salvia officinalis"
Figure II. 8 : Représentation de Lineweaver ? burk de
l'extrait méthanolique de la plante "Salvia officinalis"
Figure II. 10 : Représentation graphique de
l'extrait méthanolique de la plante "Salvia officinalis"
|
17
17
18
18
18
19
19
19
20
20
20
20
21
35
40
42
46
47
47
51
52
52
53
|
Liste des tableaux
|
Partie bibliographique
Tableau II . 1 : Les principales classes de
composés phénoliques.
Tableau IV. 1 : Quelques propriétés des -
amylases.
Partie expérimentale
Tableau I . 1 : Noms des plantes
investiguées et les différentes parties utilisées.
Tableau I . 2 : Nom, pharmacopée, et
photo des plantes investiguées.
Tableau II . 1: Teneurs, aspects et couleurs des
extraits aqueux.
Tableau II . 2 : La teneur en phénols
totaux dans les 23 extraits aqueux.
Tableau II . 3 : La teneur en
flavonoïdes dans les 23 extraits aqueux.
Tableau II . 4 : Teneurs, couleurs et aspects
des extraits méthanoliques
Tableau II . 5 : La teneur en
phénols totaux et flavonoïdes dans les 6 extraits
méthanoliques.
Tableau II . 6 : Taux d'inhibition des 23
extrais aqueux.
Tableau II. 7 : Inhibition l' - amylase par les
extraits aqueux et méthanloniques.
|
12
23
29
30
39
41
43
44
45
48
50
|
Table des matières.
|
Introduction
Partie bibliographique
I. Le diabète
1. Définition
2. Classification
3. Les deux principales classes du diabète
sucré
3. 1. Diabète de type I
3. 1. 1. Définition
3. 1. 2. Circonstances d'apparition
3. 1. 3. Signes cliniques
a- Les signes fonctionnels et généraux
b - Signes biologiques
3. 1. 4. Traitements
3. 2. Diabète de type II
3. 2. 1. Définition
3. 2. 2. Circonstances d'apparition
3. 2. 3. Les Signes
3. 2. 4. Les traitements
4. Complication
II. Les composés
phénoliques
1. Les polyphénols
1.1. Définition
1.2. Structure
3. Localisation
4. Classification
1. 5. Le rôle des composés
phénolique
Importance biologique
2. Les flavonoïdes
2. 1. Définition
2. 2. Structure
3. 3. Localisation
2. 4. Classification
2. 5. Propriétés des flavonoïdes
III . Cinétique enzymatique et
inhibition
1. Définition d'une enzyme
2. Le site actif
3. Théorie de Michaelis et Menten
4. Méthode de Lineweaver et Burk
5. Graphiques de Dixon
6. Inhibition enzymatique
6. 1. Définition
6. 2. Différents types d'inhibiteurs
6. 2. 1. Inhibition compétitive
A - Détermination des valeurs de Ki pour l'inhibition
compétitive
6. 2. 2. Inhibition non compétitive :
A - Détermination des valeurs de Ki pour l'inhibition non
compétitive
6. 2. 3. Inhibition incompétitive
A - Détermination des valeurs de Ki pour l'inhibition
incompétitive
6. 2. 4. Inhibition mixte
A - Détermination des valeurs de Ki pour l'inhibition
mixte
IV . L' - amylase
1. Définition
2. Localisation de ces enzymes
3. Attaque des grains d'amidon par les - amylases
4. Structure du site catalytique
5. Mécanisme d'action
6. Les acides aminés impliqués dans le
mécanisme catalytique
6. 1. Localisation
6. 2. Identification
7. Produits formés
8. L'inhibition de l' - amylase
Partie expérimentale
I. Méthodes d'études:
1. Choix des plantes
2. Préparation des extraits
3. Dosage des composés phénoliques
3. 1. Dosage des phénols totaux
3. 1. 1. Principe
3. 1. 2. La courbe d'étalonnage de l'acide
gallique
3. 2. Dosage des flavonoïdes
3. 2. 1. Principe
3. 2. 2. La courbe d'étalonnage de la
rutine
4. Cinétique de l' -amylase
4. 1. La courbe d'étalonnage du maltose
4. 2. Dosage de l'activité enzymatique de
l'?-amylase
5. Tests d'inhibition
II. Résultats et discussions
1. Analyse des extraits aqueux
1. 1. Teneurs des extraits aqueux
1. 2. Quantité des phénols totaux des
extraits aqueux
1. 3. Quantité des
flavonoïdes dans les extraits aqueux
2. Cinétique de l' -amylase
3. Tests d'inhibition
4. Evaluation de l'effet inhibiteur des extraits sur l' -
amylase
Conclusion
Bibliographie
Annexe 1
Annexe 2
Annexe 3
|
2
6
6
7
7
7
7
7
7
7
8
8
8
8
9
9
9
11
11
11
11
11
13
13
13
13
13
14
14
14
16
16
16
17
17
17
17
17
17
18
18
19
19
20
20
21
23
23
24
24
24
25
25
25
25
26
29
32
32
32
32
32
33
33
33
33
36
36
37
37
39
39
40
42
48
49
55
58
62
65
71
|
Introduction
On a longtemps employé des remèdes
traditionnels à base de plantes sans savoir à quoi étaient
dues leurs actions bénéfiques. (Bahorun. T, 1997)
En Algérie la liste de plantes entrant
précisément dans ce cadre est exhaustive. Elles sont
utilisées sous forme de tisanes, extraits ou préparations
complexes, sans savoir les molécules responsables de l'action. En effet,
certains effets pharmacologiques prouvés sur l'animal aient
été attribués à des composés tels que les
alcaloïdes et dérivés, des terpènes, des
stéroïdes et des composés polyphénoliques.
Les substances naturelles issues des
végétaux ont des intérêts multiples mis à
profit dans l'industrie : en alimentation, en cosmétologie et en
dermopharmacie. Parmi ces composés, on retrouve dans une grande mesure
les métabolites secondaires qui se sont surtout illustrés en
thérapeutique. La Pharmacie utilise encore une forte proportion de
médicaments d'origine végétale, pour la recherche plantes
des molécules actives nouvelles, ou des matières premières
pour la semi synthèse. (Bahorun. T, 1997)
Le présent travail entre dans le cadre de la
valorisation de quelques plantes médicinales locales, utilisées
en thérapeutique traditionnelle dans la région de Laghouat, comme
antidiabétique. L'intérêt de ces plantes, est lié
aux différents principes actifs qu'elles renferment. On distingue parmi
eux, les composés phénoliques dont de nombreux
travaux ont été consacrés ces dernières
années à l'étude de leurs propriétés
chimiques et biologiques ainsi que de leurs mécanismes d'actions. La
structure chimique de ces substances leur confère une capacité
très développée pour réagir avec toutes sortes de
molécules, essentiellement les protéines. (Djelili farida
et al, 2008).Certains polyphénols jouent un rôle
très important dans l'inhibition des enzymes digestifs y compris l' -
amylase.
L' - amylase, est l'enzyme clé de la
première étape du processus digestif des hydrates de carbone.
D?où, une augmentation de la glycémie. Les inhibiteurs de cette
enzyme retardent et prolongent l'hydrolyse des hydrates de carbone, en
évitant la monté du taux de glucose plasmatique par la
réduction de son taux d'absorption (Megh Raj Bhandari et al,
2008)
2
L'objectif de notre travail est la confirmation de
l'activité antidiabétique de ces plantes par l'inhibition de
l'enzyme clé qui est l' -amylase.
Notre travail sera réalisé selon les étapes
suivantes:
La première partie est consacrée à une
étude bibliographique sur le diabète un aperçu
général sur les composés phénoliques ainsi qu' un
rappel sur la cinétique enzymatique.
La deuxième partie est réservée à la
description du protocole expérimental
L'interprétation et la discussion des résultats
obtenus serait présentées dans la dernière partie.
3
Partie bibliographique
L'activité biologique connaît, des accidents et des
anomalies. Celles-ci se manifestent chez le sujet qu'elles atteignent par des
troubles, passagers ou permanents, bénins ou graves, parmi lesquels la
douleur, la souffrance, le malaise, ect. Certains de ces troubles peuvent
être suffisamment graves pour interrompre les fonctions vitales et leur
arrêt, souvent après des jours ou des mois de souffrances
intolérables.
Certaines maladies sont passagères, maîtrisables et
dont les causes sont connues tel les maladies infectieuses, maladies des dents
et des gencives (Caratini Roger, 1985). D'autres
maladies sont permanentes, et n'ont pas de cause connue, mais le
système biologique affecté peut être identifié.
(Encarta, 2006) Tel les cancers, les maladies immunologiques,
hématologiques, endocriniennes et métaboliques. Le
métabolisme des glucides est l'un des métabolismes qui peut
être déréglé provocant ainsi le
diabète pancréatique (Caratini Roger , 1985).
1. Définition:
Le mot « diabète » vient du grec ancien
dia-baïno, qui signifie « passer au travers ». Les
médecins grecs avaient observé que les malades semblaient uriner
aussitôt ce qu'ils venaient de boire, comme s'ils étaient «
traversés par l'eau » sans pouvoir la retenir
(Wikipedia).
Le diabète pancréatique est aussi
appelé diabète sucré (= maladie de Willis) car
est marqué biologiquement par une élévation importante du
taux de glucose dans le sang et l'apparition de sucre dans l'urine. Chez un
sujet normal, le taux de glucose sanguin ou glycémie est
comprie entre 4,5 et 6,1 mmol/l, au-delà de 6,1 mmol/l à jeun, on
parle d'hyperglycémie, au dessous de 4,5 mmol/l on
parle d'hypoglycémie (Caratini Roger,
1985).
2. Classification: (Wikipedia)
Différentes formes de diabète sont
répertoriées, en fonction de leur
:
Les diabètes de
(Maturity Onset
Diabetes in the Young), englobant plusieurs formes de diabètes
héréditaires.
Le
, des
diabètes secondaires à des maladies, notamment celles du
pancréas (
notamment).
6
Le
, lié
à un défaut de la réabsorption d'eau au niveau du rein, se
manifestant par des urines abondantes et non sucrées.
Le
,
lié à un défaut de réabsorption du glucose par le
rein, donnant une urine sucrée (
) sans anomalies de la
glycémie.
Le diabète secondaire à
une mutation de l'ADN mitochondrial (associé à une
surdité de perception et caractérisé par une
hérédité maternelle).
Le diabète lipoatrophique :
caractérisé par la disparition du
, avec
insulino-résistance majeure.
3. Les deux principales classes du diabète
sucré :
3. 1. Diabète de type I :
3. 1. 1. Définition :
Autrefois appelé « diabète
insulino-dépendant » (DID, ou encore diabète
juvénile), cette maladie est une forme de
qui apparaît le
plus souvent de manière brutale chez l'enfant ou chez le jeune adulte.
Le diabète de type 1 est une
, aboutissant
à une destruction totale des cellules bêta des
. Ces cellules
sont chargées du contrôle de la
(taux de glucose dans le
sang), par la production d'
en fonction de la
glycémie : ainsi, en cas d'hyperglycémie, l'insuline est
produite en plus forte quantité. (Wikipedia)
3. 1. 2. Circonstances d'apparition :
Le début est rapide, voire brutal dans 80 % des cas.
L'évolution de la maladie est accélérée par les
infections, stress et autres chocs, ce qui fait que le diagnostic se fait
souvent lors de consultations pour autre chose. Cependant, cela ne veut en
aucun cas dire que l'infection présente est la cause du
diabète. (Wikipedia)
3. 1. 3. Signes cliniques : (Wikipedia)
a- Les signes fonctionnels et
généraux :
Une
importante.
Une
parallèle.
Un amaigrissement rapide de plusieurs kilos.
Infections favorisées par l'hyperglycémie.
Des maux de tête et d'estomac ainsi que des
nausées.
b - Signes
biologiques :
La glycosurie (quantité de glucose dans les urines).
L'hyperglycémie.
7
L'hémoglobine glyquée (dosage de fraction de l'
) le taux chez un
diabétique peut être supérieur à 10 %.
Auto-anticorps.
3. 1. 4. Traitements :
Les diabétiques de type I doivent s'injecter de l'insuline
plusieurs fois par jour tout au long de leur vie et manger de manière
équilibrée. Cet équilibre glycémique étant
précaire, traitement et alimentation varient au jour le jour en fonction
des circonstances (activités, émotions, horaires, maladies,
etc.). Le diabétique se doit donc d'être autonome dans sa gestion
de la maladie. (Wikipedia)
3. 2. Diabète de type II :
3. 2. 1. Définition:
Le « diabète de type
2 » ou « diabète non
insulinodépendant » (DNID) (aussi appelé
« diabète insulinorésistant » ou
« diabète de l'âge mûr »), est une
maladie
touchant la
provoquant à
terme un
. Sur le plan
physiopathologique, le diabète non insulinodépendant se
caractérise par une résistance à l'insuline de l'organisme
(Wikipedia), l'insulinorésistance décrite
entraîne pendant 10 à 20 ans un hyperinsulinisme (A.
Grimaldi, 2000). Le
fabrique de plus en plus
d'insuline (Wikipedia), permettant pendant des années
de maintenir la glycémie à jeun (A . Grimaldi,
2000) jusqu'a l'épuisement et lorsque la quantité
d'insuline ne suffit plus à contrer les résistances, le taux de
sucre devient anormalement élevé. (Wikipedia)
L'insulinémie décroît progressivement en même temps
que la glycémie augmente à jeun. (Grimaldi. A,
2000)
3. 2. 2. Circonstances d'apparition :
Le diabète de type 2 résulte d'une interaction
entre des facteurs génétiques et des facteurs d'environnement
(Roberfroid Marcel B, 2002). Ainsi que suite à la prise
de certaines médications (par exemple, l'utilisation prolongée de
). Il y a également
un puissant facteur
dans l'étiologie
de cette maladie : avoir des membres de la famille atteints de
diabète de type 2. La majorité des patients atteints du
diabète de type 2 sont obèses - l'obésité chronique
induit une résistance accrue à l'insuline qui peut évoluer
en diabète. Le diabète de type 2 a plus de risque
d'apparaître s'il y a manque d'activité physique, une alimentation
riche (graisses, sucres). (Wikipedia)
3. 2. 3. Signes :
8
Le diabète de type 2 est généralement
asymptomatique durant de longues années, son dépistage et son
diagnostic reposent sur l'examen biologique de la glycémie à jeun
ou après stimulation par l'ingestion de sucre (glycémie
post-prandiale ou hyperglycémie provoquée).À la
différence du diabète de type 1, les symptomes et complications
du diabète de type 2 apparaissent tardivement dans l'évolution de
la maladie. Mais il peut parfois être difficile de faire la
différence entre ces deux maladies notamment chez l'adolescent.
(Wikipedia)
3. 2. 4. Les traitements : (Wikipedia)
Les mesures
hygiéno-diététiques : Le diabète de
type 2 est traité au départ par des mesures de régime et
par la
.
Dans cette perspective, la pratique d'exercices physiques,
éventuellement dans le cadre d'
est
recommandée.
Les traitements oraux : un traitement par
des antidiabétiques oraux ex :
.
Traitement préventif : Il repose
essentiellement sur une perte de poids et l'exercice physique.
4. Complication:
Le diabète peut résulter en conséquences
lourdes pour la santé. Le diabète est un facteur de risque
important de :
.
.
.
Des
tissulaires, conduisant
à l'
.
Le diabète est une maladie aggravant l'invalidité,
provocant la diminution de l'espérance de vie, et engendrant de forts
coûts médicaux. (Wikipedia)
9
1. Les polyphénols :
1. 1. Définition :
Le terme polyphénol a été
introduit en 1980. (wikipedia). Les
composés phénoliques ou polyphénols
constituent une famille de molécules organiques largement
présente dans le règne végétal (wikipedia), se sont
des métabolites secondaires, caractérisés par la
présence d'un cycle aromatique portant des groupements hydroxyles libres
ou engagés avec un glucide.( Boizot N et Charpentier J.
P,2006).
1. 2. Structure :
Les polyphénols naturels regroupent un vaste
ensemble de substances chimiques (wikipedia).
L'élément fondamental qui les caractérise est la
présence d'au moins un noyau benzénique (aromatique), auquel est
directement lié au moins un groupe hydroxyle, libre ou engagé
dans une autre fonction : éther, ester, ou
hétéroside. (Laraoui. H, 2007) Ils peuvent aller
de molécules simples, comme les acides phénoliques, à des
composés hautement polymérisés, de plus de 30000 Dalton,
comme les tanins. (wikipedia)
3. Localisation :
Ils sont présents dans toutes les parties des
végétaux supérieurs (racines, tiges, feuilles, fleurs,
pollens, fruits, graines et bois) .( Boizot N et Charpentier J.
P,2006). Ils sont présents aussi dans diverses substances
naturelles : dans les fruits rouges, le raisin (en relation avec les
), dans les
, et sous forme de
dans le
, dans les
, les
......etc.
(wikipedia) Parmi les composés phénolique, dont
8000 sont connus : les flavonoïdes, les quinones phénoliques,
ligans, les xanthomes, les coumarines et d'autres classes existent en nombre
considérable (Laraoui. H, 2007).
4. Classification :
Les composés phénoliques sont
commodément classés selon le nombre d'atomes de carbone dans le
squelette de base. (Laraoui. H, 2007). Les différentes
classes principales de ces composés phénoliques isolées
des plantes sont illustrées dans le (tableau II. 1)
11
Tableau II . 1 : Les principales classes
de composés phénoliques. (Macheix Jean-jacques et al ,
2005)
|
Squelette carboné
|
Classe
|
Exemple
|
Origine
|
|
C6
C6 - C1
C6 - C3
C6 - C4
C6 - C2- C6
C6 - C3- C6
(C6 - C3)2
(C6 - C3)n
(C15)n
|
Phénols simples
Acides hydroxybenzoiques
Acides hydroxycinamiques
Coumarines
Napthoquinones
Stilbènes
Flavonoides
Flavonols
Anthocyanes
Flavonols
Flavonones
Isoflavonoides
Lignanes
Lignines
Tannins
|
Cathécol
P - hydroxybenzoique
Acides caféique, férulique
Scopolétine, esculétine
Juglone
Resvératrol
Kaemférol, quercétine
Cyanidine, pélargonidine
Catéchine, épicatéchine
Narigénine
Daidzéine
pinorésinol
|
Epices, fraise
Pomme de terre, pomme
Citrus
Noix
Vigne
Fruits, légumes, fleurs
Fleurs, fruits rouges
Pomme, raisin
Citrus
Soja, pois
Pin
Bois, noyau des fruits
Raisin rouge, kaki
|
Les formules chimiques de chaque exemple sont regroupées
dans (Annexe 1)
12
5. Le rôle des composés
phénolique : (Macheix Jean - Jacques et al, 2005)
Le rôle des composés phénoliques
est maintenant reconnu dans différents aspects de la vie de la plante et
dans l'utilisation que fait l'homme des végétaux. Ils peuvent en
effet intervenir :
Dans certains aspecs de la physiologie de la plante.
Dans les interactions des plantes avec leur environnement
biologique et physique.
Dans les critères de qualité.
Importance biologique :
12
Les métabolites secondaires font l'objet de
nombreuses recherches, Ceci est notamment le cas des polyphénols
végétaux (Bahorun.T, 1997) qui prennent une
importance croissante notamment, à cause de leurs effets
bénéfiques sur la santé (Wikepedia), dans
la protection de l'homme vis - à - vis de certaines maladies, en raison
de leur action possible avec de nombreuses enzymes. (Macheix Jean -
Jacques et al, 2005)
Ils sont largement utilisés en
thérapeutique comme vasculoprotecteurs, anti-inflammatoires, inhibiteurs
enzymatiques, antiradicaires et antioxydants (Bahorun. T,
1997). En effet, leur rôle d'antioxydants naturels suscite de
plus en plus d'intérêt pour la prévention et le traitement
du cancer, des maladies inflammatoires et cardiovasculaires . Ils sont
également utilisés comme additifs pour l'industrie
agroalimentaire, pharmaceutique et cosmétique
(wikipedia), en particulier les flavonoïdes et les
proanthocyanidines. (Bahorun.T, 1997)
2. Les flavonoïdes :
2. 1. Définition :
Les flavonoïdes ont été découverts
par
. Le terme
flavonoïde (ou bioflavonoïde) est attribué à une classe
de
secondaires
(wikipedia). Le terme
« flavonoïdes » désigne une très
large gamme de composés naturels, appartenants à la famille des
polyphénols. Ils sont considérés comme les pigments
quasiment universels des végétaux. (Portet
Bénédicte, 2007)
2. 2. Structure :
13
Tous les flavonoïdes (plus de 4000) (Portet
Bénédicte, 2007) présentent un squelette de base
à 15 atomes de carbone, fait de deux cycles en C6 reliés par une
chaîne en C3. Le pont à 3 carbones entre les deux phényles
forme généralement un troisième cycle pyrone.
Ils couvrent une grande gamme de couleur du rouge à
l'ultraviolet en passant par le jaune. Leur couleur dépend de leur
structure mais aussi de l'acidité du milieu (
), on en trouve
aussi de nombreux sous forme d'
. On en retrouve dans le
rouge des
et des
, dans les baies de
, le
, le raisin. On donne aux
pigments flavonoïdes le nom d'
.
(Wikipedia).
3. 3. Localisation :
Les flavonoïdes sont largement rencontrés dans le
règne végétal. Ils sont cependant rares chez les
végétaux inférieurs. Par contre, on les trouve en
abondance dans les familles suivantes : Polygonacees, Rutacees,
Legumineuses, Apiacees et Asteracees
De plus, leur localisation au sein de la plante est
caractéristique. En effet, les flavonoïdes ce répartissent
volontiers dans les organes aériens jeunes (jeunes feuilles, boutons
floraux) où ils sont localisés dans les tissus superficiels. Ils
se répartissent aussi volontiers dans les racines.Au niveau cellulaire,
les flavonoïdes sont dissous dans le suc vacuolaire ou localisés
dans les chloroplastes et les membranes des végétaux.
(Hadi Milaine, 2004)
Chez les angiospermes, la diversité structurale des
flavonoïdes est maximale. Ils sont de façons très
générale localisés dans les feuilles, dans les fleurs ou
encore dans les fruits (Portet Bénédicte, 2007).
2. 4. Classification :
Ils peuvent être regroupés en une douzaine de
classes selon le degré d'oxydation du noyau pyranique central.
(Portet Bénédicte, 2007) Ce groupe de
molécules comporte plusieurs classes : les flavanones, les
isoflavonoïdes, les flavones, les flavonols ainsi que les anthocyanidines.
(Girotti - Chanu Catherine, 2006)
2. 5. Propriétés des flavonoïdes :
Ce sont des molécules douées de plusieurs
propriétés biologiques : Propriétés anti -
inflammatoires, antivirales et antibactériennes, anti -
carcinogènes, antioxydante, pro - oxydante (Hadi Milaine,
2004). Inhibitrices d'enzymes, elles sont impliquées dans
d'importantes fonctions cellulaires, en affectant l'activité de nombreux
systèmes enzymatiques in vitro mais également in vivo. Certaine
possèdent des propriétés lypolitiques, protectrices de
l'ADN (Girotti - Chanu Catherine, 2006)
14
Les réactions chimiques de la vie sont sous la
dépendance des enzymes. Ces catalyseurs remarquables sont tous
spécifiques pour des réactions données. Dans l'ensemble,
les enzymes sont très versatiles, dans la mesure où des quelques
milliers d'enzymes actuellement connues catalysent des réactions aussi
diverses que : hydrolyse, polymérisation, transferts de groupes
fonctionnels, oxydo-réduction, déshydratation et
isomérisation. L'enzyme, n'est pas des surfaces passives sur lesquelles
se déroulent les réactions, mais plutôt des machines
moléculaires qui fonctionnent grâce à des mécanismes
très variés. (Voet Donald et Voet Judith C,
1995)
1. Définition d'une enzyme :
Une enzyme, est une molécule
protéique, [à l'exception de quelques unes dont
leur structure chimique est une association d'une partie protéique
(apoenzyme) et d'une partie non- protéique (cofacteur) ] ou
ARN dans le cas des ribozymes). Agissant comme
catalyseur, permettant d'accélérer
jusqu'à des millions de fois les réactions chimiques du
métabolisme se déroulant en chaque instant dans le milieu
cellulaire ou extracellulaire. (Wikipedia) Ella modifie la
vitesse d'une réaction sans être elle -même modifiée.
Les enzymes sont hautement spécifiques et leur activité peut
être régulée. (Hames. B.D et al, 2000)
2. Le site actif :
Le site actif d'une enzyme est la région qui fixe le
substrat et le convertir en produit. Il s'agit en général, d'une
petite partie de l'ensemble de la molécule d'enzyme, et c'est une
entité tridimensionnelle formé par des acides aminés,
pouvant être éloignés sur la chaîne polypeptidique
linéaire. Le site actif est souvent une crevasse ou une fissure à
la surface de l'enzyme, formant un environnement essentiellement apolaire qui
favorise la liaison du substrat. Le ou les substrats sont liés au site
actif par de multiples interactions faibles (interaction
électrostatique, liaisons hydrogène, liaison de Vander Walls et
interaction hydrophobe). Certains cas par liaisons covalentes
réversibles. (Hames. B.D et al, 2000)
3. Théorie de Michaelis et Menten :
16
Au début du XXème siècle, Maud
Menten et Leonar Michaelis se sont intéressés à la
cinétique des réactions enzymatiques. Après des
développements mathématiques complexes, ils ont pu définir
un paramètre lumineux de la cinétique enzymatique, la constante
de Michaelis -Menten (KM). Elle correspond à la concentration en
substrat pour la quelle la vitesse est égale à la moitié
de Vmax. La cinétique de Michaelis - Menten décrit les variations
de la vitesse initiale de la réaction enzymatique en fonction de la
concentration en substrat. Le model considère une quantité fixe
d'enzyme. (Horn Florian et al, 2005)
La vitesse de la réaction pour une concentration
déterminée de substrat est donnée par la relation de
Michaelis -Menten :
Vmax X [S]
V =
[S] + KM

Figure III . 1 : Variations de la vitesse
initiale de la réaction enzymatique en fonction de la concentration en
substrat. (Horn Florian et al,2005)
4. Méthode de Lineweaver et Burk:
(Horn Florian et al,2005)
Pour préciser la valeur de Vmax, Lineweaver et Burk ont
développé une méthode graphique en inversant les deux
termes de la relation de Michaelis -Menten.
Lineweaver et Burk ont développés une
méthode graphique en inversant les deux termes de la relation de
Michaelis -Menten. Ceci donne :
[S] + KM
1 / V =
Vmax X [S]

Figure III. 2 : variation de 1 / V en fonction
de 1 / [S] (Horn Florian et al,2005)
5. Graphiques de Dixon:
En 1953, Dixon a proposé une façon
alternative pour déterminer la valeur de Ki, en
utilisant un graphique de 1 / V = f ([I]). Dans un graphique de Dixon,
les droites déterminées à différentes
concentrations de substrat se croisent à -Ki.
(Keillor Jeffrey W, 2004)
6. Inhibition enzymatique :
6. 1. Définition :
17
D'une manière générale, un inhibiteur est
tout composé dont la fixation sur la molécule enzymatique
entraîne son inactivation partielle (ou totale), ce qui se traduit par
une baisse (ou une annulation) de la vitesse initiale. (Weil
Jacques-Henry, 2001).
6. 2. Différents types d'inhibiteurs :
6. 2. 1. Inhibition compétitive :
Un inhibiteur compétitif entre en
compétition avec les molécules de substrat pour se lier au site
actif de l'enzyme. L'effet d'un inhibiteur compétitif peut être
réversible à des concentrations élevées de
substrat.Sur la représentation de Lineweaver-Burk, un inhibiteur
compétitif peut être reconnu du fait qu'il augmente KM
mais laisse Vmax inchangée (Hames B.D et al, 2000)


Figure III . 3 : Graphique Lineweaver - Burk
Figure III . 4 : Graphique Dixon
d'inhibition compétitive (Keillor J. W,
2004) d'inhibition compétitive. (Keillor
J. W, 2004)
A - Détermination des valeurs de Ki pour
l'inhibition compétitive
On peut déterminer la valeur de Ki à l'aide d'un
graphique. Il s'agit de la préparation d'un graphique secondaire des
pentes du graphique Lineweaver-Burk en fonction des concentrations
d'inhibiteur L'abscisse à l'origine donne la valeur de Ki
(Keillor Jeffrey W, 2004)
18

Figure III . 5 : Variation des pentes du
graphique Lineweaver - Burk en fonction des [I] pour l'inhibition
compétitive. (Keillor Jeffrey W, 200
6. 2. 2. Inhibition non compétitive
:
Un inhibiteur non compétitif se lie
à un site autre que le site actif de l'enzyme et diminue la vitesse
réactionnelle de l'enzyme en modifiant sa conformation
tridimensionnelle. L'effet d'un inhibiteur non compétitif ne peut
être inversé par une élévation des concentrations du
substrat. Sur la représentation de Lineweaver-Burk d'un inhibiteur
non compétitif, on visualise une diminution de Vmax
mais une invariance de KM (Hames B.D et al, 2000)


Figure III . 6 : Graphique Lineweaver - Burk
Figure III . 7 : Graphique Dixon
d'inhibition non D'inhibition non compétitive .
(Keillor J. W, 2004) compétitive. (Keillor
J. W, 2004)
A - Détermination des valeurs de Ki pour
l'inhibition non compétitive :
La détermination des valeurs de Ki peut ce faire à
l'aide d'un graphique. les valeurs de1 / V'max , sont obtenues directement de
l'ordonné à l'origine du graphique Lineweaver-Burk en fonction
des concentrations. L'abscisse à l'origine donne la valeur de Ki
(Keillor Jeffrey W, 2004)
19

Figure III . 8 : Variation de 1 / V'max
en fonction de [I] pour l'inhibition non compétitive.
(Keillor Jeffrey W, 2004)
6. 2. 3.
Inhibition incompétitive :
Dans un système ou l'inhibiteur se combine de façon
réversible exclusivement au complexe enzyme - substrat, l'effet est une
inhibition dite in compétitive. Elle n'est pas levée par
l'addition de substrat. (Weinman Serge, 2004).


Figure III . 9 : Graphique Lineweaver - Burk
Figure III . 10 : Graphique Dixon
d'inhibition
d'inhibition incompétitive. (Keillor J. W,
2004) incompétitive. (Keillor J. W,
2004)
A - Détermination des valeurs de Ki pour
l'inhibition incompétitive :
La détermination des valeurs de Ki peut se faire à
l'aide d'un graphique. les valeurs 1 / K'M ou de 1 / V'max , sont
obtenues directement des axes x et y du graphique
Lineweaver-Burk, en fonction des concentrations. L'abscisse à l'origine
donne la valeur de Ki (Keillor Jeffrey W, 2004)


Figure III . 11 : variation de 1 / K'M
en fonction Figure III . 12 : variation
de 1 / V'max en fonctionde [I] pour l'inhibition
incompétitive. (Keillor J. W. de [I] pour
l'inhibition incompétitive.
20
, 2004)
(Keillor J. W, 2004)
6. 2. 4. Inhibition mixte :
Si l'enzyme et le complexe enzyme - substrat fixent tous les deux
l'inhibiteur, (Voet Donald et Voet Judith C, 1995), mais avec
des affinités différentes (Wikipedia) dans ce
cas de figure l'inhibition est appelée inhibition mixte. (Voet
Donald et Voet Judith C, 1995)
A - Détermination des valeurs de Ki pour
l'inhibition mixte :
La détermination des valeurs de Ki peut se faire à
l'aide d'un graphique. Les valeurs de K'M / Vmax sont obtenues
directement des ordonnées à l'origine du graphique
Lineweaver-Burk, en fonction des concentrations L'abscisse à l'origine
donne la valeur de Ki (Keillor Jeffrey W., 2004)

Figure II . 13 : Variation des pentes du
graphique Lineweaver - Burk en fonction des [I] pour l'inhibition
mixte. (Keillor Jeffrey W, 2004)
21
1. Définition :
Les - amylases existent dans le règne animal,
végétal et microbien. (Baron. A et al, 1985).
Elles apparaissent au cour de la germination des
céréales. Elles sont aussi présentes dans la salive et
dans le suc pancréatique. (Weil Jacques-Henry, 2001).
Les - amylases salivaires et pancréatiques ont
été les plus étudiées à cause de leur
accessibilité et de leur rôle dans les phénomènes de
digestion chez les mammifères. (Baron A et al,
1985).
Les - amylases (1, 4 - - D ? glucane, 4 glucanohydrolase; EC
3. 2. 1. 1) ont la capacité d?hydrolyser les liaisons de types
- (1,4) à l?intérieur des chaînes d?amidon. Ce
sont donc des endo ? enzymes. (Lévêque Emmanuel
et al, 2000)
Plusieurs - amylases végétales, animales
(mammifères) et microbienne (bactériennes, fongique ?. Ect) ont
été purifiées et étudiées. (tableau IV
. 1)
Tableau IV. 1 : Quelques
propriétés des - amylases. (Baron. A et al,
1985)
|
Enzymes d'origine
|
Poids moléculaire
|
pH optimal
|
Température optimale (°C)
|
|
Animal :
Salive humaine
Pancréas de porc
Végétale
Malt d'orge
Blé
Microbienne
Bacillus coagulans
Aspergillus oryzae
|
50 000
50 000
59 500
59 500
49 000
52 600
|
6,9
6,9
4,7 - 5,4
4,6
5,2
5,5 - 6,9
|
40
37
50 -55
60 - 66
57
40
|
2. Localisation de ces enzymes :
La majeure partie des - amylases se trouve à
l?extérieur des cellules productrices : en effet, l?amidon
étant une grosse molécule, il ne peut pénétrer
à l?intérieur des cellules pour y être digérer. Ces
dernières sont donc contraintes de sécréter leurs -
amylases dans le milieu extracellulaire. Ces enzymes peuvent alors attaquer
l?amidon et libérer des sucres de plus petite taille, capables de
franchir les barrières cellulaires (membrane et parois).
(Lévêque Emmanuel et al , 2000)
23
3. Attaque des grains d'amidon par les -
amylases :
Leur action sur le grain d'amidon natif semble être
liée aux possibilités de pénétration de l'enzyme
à l'intérieur du grain et en particulier, à ses
possibilités d'attaque en surface. De ce fait, chaque grain appartenant
à une population d'un type d'amidon donné, a sa propre
sensibilité à l'attaque de l'enzyme. On distingue
généralement, les amidons faciles à s'hydrolyser par l' -
amylase (amidon de céréales et de légumineuses à
teneur normale en amylose) et les amidons plus résistants à l? -
amylase (amidon de pomme de terre). (Baron A et al, 1985)
L'attaque du grain d'amidon se fait essentiellement au niveau de
l'amylose. Les - amylases capables d?hydrolyser
l?amidon natif (insoluble et sous forme de granules) possèdent un site
de fixation à l?amidon natif. Ce site, nommé strach ? binding
? domain (SBD), qui est situé, dans la
majorité des cas dans la partie C ? terminale de la
protéine, et est éloigné du site actif de l?enzyme.
(Lévêque Emmanuel et al , 2000)
L'action des - amylases sur les chaînes d?amidon est
séquentielle : l?enzyme se fixe au hasard sur la chaîne puis
poursuit son attaque en se déplaçant le long de la chaîne
d?amidon. Lorsqu?elle rencontre une liaison de type - (1,6) elle ne peut pas
l?hydrolyser et s?arrête donc. Elle se décroche alors de la
chaîne d?amidon et va initier un nouveau site d?attaque à un
endroit différent. (Lévêque Emmanuel et al ,
2000)
4. Structure du site catalytique :
Le site catalytique des - amylases peut être
subdivisé en plusieurs sous ? sites numérotés à
partir de celui qui lie le glucose le plus proche de l?extrémité
non ? réductrice du substrat. Un sous ? site peut être
défini comme une partie du site actif capable d?interagir avec un
résidu glucose du substrat. (Lévêque Emmanuel et al
, 2000)
Les spécificités des enzymes amylolytiques
pourraient également s'expliquer par le nombre de leurs sous - sites,
par la nature des acides aminés formant ces sous - sites et par la
localisation des acides aminés catalytiques au niveau de ces sous -
sites. Par exemple, les glucoamylases fongiques possèdent
généralement sept sous - sites tandis que l' - amylase
d?Aspergillus oryzae en possèderait six.
(Lévêque Emmanuel et al , 2000)
5. Mécanisme d'action :
24
Les - amylases catalysent la dégradation de
l?amidon par un mécanisme catalytique acide dans lequel le
« catalyseur général » - l?acide aminé
à l?origine de l?attaque ? est un acide glutamique. Ce résidu
agirait en protonant (ajout d?un ion H +) l?oxygène de la
liaison glycosidique à couper. Lors de la seconde étape de la
réaction catalytique, dans la majorité des cas, le carbone C1
impliqué dans la liaison glucosidique subit une attaque
nucléophile, soit par une molécule d?eau activée par
l?acide aspartique, soit directement par cet acide aspartique. Dans ce dernier
cas, un second acide aspartique activerait ensuite une molécule d?eau
pour permettre l?hydrolyse au niveau du carbone C1.
Pour la grande majorité des - amylases, l?ion calcium
Ca2+ a un effet positif sur leur activité enzymatique. En
contrôlant la géométrie du site actif de ces enzymes, il
régule leur activité. Les - amylases peuvent donc
être considérées comme étant des métallo ?
enzymes « enzymes nécessitant un ion métallique pour
leur activité. (Lévêque Emmanuel et al ,
2000)
Cependant, si le calcium, à faibles doses, a un effet
activateur sur les - amylases, cette activation peut diminuer, à des
doses élevées, pour certaines de ces enzymes.
(Lévêque Emmanuel et al , 2000)
6. Les acides aminés impliqués dans le
mécanisme catalytique :
6. 1. Localisation :
Les acides aminés impliqués dans le
mécanisme général de la catalyse étaient communs
à la plupart des enzymes amylolytiques. (Lévêque
Emmanuel et al , 2000)Les acides aminés impliqués dans
la catalyse ou dans la fixation du substrat sont localisésdans la partie
C - terminale des feuillets ou à l?intérieur des boucles reliant
un feuillet à une hélice .( Lévêque
Emmanuel et al , 2000)
6. 2. Identification :
Chez les - amylases, il y?a neuf acides aminés
invariants : Asp 117, Val 119, His 122, arg 204, Asp 206, Lu 230, His 296
et Gly 323, huit d?entre eux appartiennent au site actif.
L'acide glutamique 230 semble jouer un rôle important dans
la catalyse. Ce résidu serait un donneur de proton et aurait donc une
fonction de catalyseur général acide. De même, l'acide
aspartique 297 jouerait le rôle de catalyseur général,
basique. (Lévêque Emmanuel et al , 2000)
7. Produits formés :
25
L'action des - amylases sur les chaînes d?amidon aboutit,
dans le cas des chaînes linéaires (amylose), à l?hydrolyse
totale en unités de maltose. Mais dans le cas de l?amylopectine,
l?hydrolyse des liaisons - 1,4 - glucosidiques se fait mal au voisinage des
points de ramification et, en outre les liaisons - 1,6 - glucosidiques qui
constituent ces points de ramification ne sont pas attaquées.
D?où l?obtention d?un mélange de maltotriose et de dextrines
résiduelles (ou dextrines limites) formées d?oligo ? et
polyosides branchés (Weil Jacques-Henry, 2001).
Ces polyosides de 3 à 5 résidus de
glucose contiennent toute des liaisons - 1,6 de la macromolécule
d?origine. (Baron. A et al, 1985) Et plus rarement
l?obtention de glucose. (Lévêque Emmanuel et al ,
2000)
Les produits d'hydrolyse de l'amidon varient selon l'origine de
l' - amylase, celle du substrat et les conditions d?hydrolyse.
Cela permet de classer les - amylases en deux
catégories :
Les - amylases liquéfiantes qui hydrolysent 30
à 40 % de l?amidon.
Les - amylases saccharifiantes qui peuvent hydrolyser
jusqu?à 50 à 60 %. de l?amidon.
8. L'inhibition de l' - amylase :
Pour agir sur une voie métabolique, il faut disposer d'un
médicament effecteur agissant spécifiquement sur un enzyme de
cette voie métabolique (Horn Florian et al 2005).
L' - amylase de mammifère, sécréter par
la glande pancréatique comme étant une enzymes glycolytiques
à travers le suc pancréatique dans l?intestin, est l?enzyme
clé qui catalyse la première étape du processus digestif
des hydrates de carbone (glucides).
D'où, les inhibiteurs de l'hydrolyse des hydrates de
carbone par l' - amylase dans le tractus digestif retardent leur digestion et
prolongent son temps, causant une réduction dans le taux d?absorption du
glucose (Megh Raj Bhandari et al 2008), et par
conséquent diminution des niveaux de glucose plasmatique et abaissement
de l?hyperglycémie. (Hong Gao et al 2008)
.
26
Partie expérimentale
1. Choix des plantes:
Dans un premier temps, nous avons commencé notre
étude par une collecte d'information sur les plantes
antidiabétiques utilisées par la population locale de la ville de
Laghouat. Cette enquête nous a permis de recenser vingt et une plantes.
Les noms des plantes ainsi que les parties utilisées de chaque plante
sont résumées dans le (Tableau I. 1)
Tableau I. 1 : Noms des plantes
investiguées et les différentes parties utilisées
|
Partie utilisée
|
Nom de la plante
|
|
Commun
|
Systématique
|
|
Toute la partie aérienne
Les résines
Les fleurs
L'écorce
Les feuilles et les tiges
Les grains
Les feuilles
Toute la partie aérienne
Les fleurs
Toute la partie aérienne
Toute la partie aérienne
Toute la partie aérienne
Les feuilles
Les feuilles
Les gousses
Les feuilles
Les grains
Les fleurs
Toute la partie aérienne
Toute la partie aérienne
Les fleurs
Les grains
Toute la partie aérienne
|
Chendgoura
marou' esabr
Nougd
Oud griss
El kassa
Denb el kail
Moraret el hanech
Remth
Reguig
Tmiroute
Gardoufa
Tassalhine
Hinaina
Henet el ibil
Gouzeh
Arfage
Siwak el nabie
Jiaida
Thafsia
Helba
Agga
|
Ajuja iva
Aloe socotrina
Anthemis arvensis
Berberis Vulgaris
Cistus
Equisetum arvense
Erythraea centaurium
Haloxylon scoparium
Helianthemum lipplii
Marubium vulgae
Matricaria pubescens
Rhamnus alaternus
Ononis angustissima
Oudneya africana
Pituranthos chloranthus
Rhantherium adpressum
Salvia offisinalis
Teucrium polium
Thapsia garganica
Trigonella faenum
Zygophyllum album
|
29
Les plantes choisies pour l'étude de l'activité
inhibitrice vis-à-vis de l' - amylase, sont de nombre de six. Les noms,
la pharmacopée et les photos de ces plantes sont
présentées dans le (Tableau I . 2).
Sauf la plante "El kassa" ??????(Cistus) dont le genre n'a
pas pu être déterminé
Tableau I . 2 : Nom, pharmacopée, et
photo des plantes investiguées.
|
Photo
|
Pharmacopée
|
Nom
|
|

Photo prise de l'encyclopédie
Wikipedia
|
Elle a un effet important comme reminéralisant .
Utilisé pour soigner les tissus conjonctifs et fracture mais
également les parois artérielles. un effet positif sur
l'hémorragie.
Elle favoriserait le ralentissement des
dégénérescences tumorales.
Anti-inflamatoire, astringente et
Cicatrisante (Wikipedia)
|
Denb el kail -
EquisetaceaeEquisetum arvense (Wikipedia)
|
|

Photo prise du site
|
Pour le rhumatismes, courbatures, déshydratation,
dentition, afféctions oculaires, toux, allergie et piqure de scorpions
(Maiza. K et Hammiche. V, 1993)
|
Gardoufa -
AsteraceaeMatricaria pubescens
(Maiza. K et Hammiche. V, 1993)
|
30
|

Photo prise du site
|
Au Maroc elle est consommée comme bon traitement pour
les maladies de l'intestin. Au sud Algérien, elle est indiquée
pour les maladies de la peau en usage externe, sous forme de pâte,
mélangée avec du Henné. (Dr Chehma Abdelmadjid,
2006)
|
Henat l'ibel -
BrassicaceaeOudneya africana (Dr Chehma
Abdelmadjid, 2006)
|
|

Photo prise de l'encyclopédie
Wikipedia
|
Elle est antiseptique, stimulante, tonique, stomachique et
hypoglycémiante. Elle possède aussi divers degrés des
propriétés antispasmodiques, antisudorales. En usage externe (en
décoction), ses propriétés sont, antiseptiques et
cicatrisantes. En tisane ou en aromate elle facilite la digestion.
(Baba aissa Farid, 2000)
|
siwak el nabie -
LamiaceaeSalvia officinalis
(Wikipedia)
|
31
|
En médecine populaire algérienne, l'usage de cette
plante toxique est réservé aux traitements externes,
énéralement sous forme de décoction aqueuse ou de
macération huileuse de racine, en applications locales contre les
douleurs rhumatismales, ou quelquefois sur le thorax pour traiter les
bronchites. (Baba aissa Farid, 2000)
|
Bounnafaa dérias
OmbélliféreaeThapsia garganica
(Wikipedia)
|
9 plantes, sont connues par les différents herboristes
de la ville de Laghouat par leurs vertus thérapeutiques contre le
diabète sucré. Elles diminuent la glycémie, et
confèrent un soulagement aux diabétiques non
insulinodépendants sans qu'ils prennent les médicaments
antidiabétiques, par contre les autres ont été
récoltées dans les environs de la ville de Laghouat et qui ont
déjà fait l'objet des études sur leur activité
antioxydante dans le laboratoire des sciences fondamentales de
l'université de Laghouat.
2. Préparation des extraits:
En supposant que les principes actifs sont des composés
polaires, l'extraction de ces derniers a été faite dans un
premier temps avec de l'eau distillée. Les parties utilisées ont
été broyées manuellement, tamisées pour
éliminer les grosses graines. Environ 1g de chaque poudre ainsi
obtenue est macéré dans 20 mL d'eau distillée à
75°C pendant 20 minutes. Après filtration et évaporation de
l'eau à pression réduite à 75°C , les résidus
sont pesés solubilisés dans 5 ml d'eau distillée puis
conservés sous une température de 4°C.
3. Dosage des composés
phénoliques :
3. 1. Dosage des phénols
totaux :
3. 1. 1. Principe :
Le dosage des phénols totaux a été
effectué par une méthode adaptée de Singleton et
Ross (1965) avec le réactif de folin-Ciocalteu commercial.
(T Bahorun, 1997)
Le réactif de Folin constitué par un mélange
d'acide phosphotungestique (H3PW12 O40 ) et d'acide phosphomolybdique
(H3PMO12 O40 ), est réduit lors de l'oxydation des
phénols, en un mélange d'oxydes bleus de tungstène et de
molybdène. (Nathalie Boizot, Jean-Paul Charpentie). La
coloration bleue produite, dont l'absorption maximum est à 755
nm est proportionnelle à la quantité de
polyphénols présente dans les 23 extraits aqueux. La
quantification des phénols totaux dans les extraits nécessite de
tracer une courbe d'étalonnage d'un phénol étalon
(standard) comme l'acide gallique.
3. 1. 2. La courbe d'étalonnage de l'acide
gallique:
A partir d'une solution mère aqueuse d'acide gallique, de
concentration massique de 0,5 g/l, une gamme étalon de solutions
filles en milieu aqueux a été
préparée.
32
A l'aide d'une micropipette, 100 ul de chaque solution fille
sont mis dans un tube à essai puis 500 ul du réactif de
folin-Ciocalteu à 10 % (10 fois diluée dans de l'eau
distillée) est additionné. Après deux minutes
d'incubation, 2 ml de carbonate de sodium Na2CO3 à 2 % sont
ajouté. Les tubes sont ensuite agités et placés à
l'obscurité pendant 30 minutes à température ambiante.
La lecture de l'absorbance de chaque solution
préparée est mesurée à l'aide d'un
spectrophotomètre UV-Visible de type Shimadzu 1601, à une
longueur d'onde de 755 nm contre un blanc préparé de la
même manière sauf qu'il ne contient pas d'acide gallique mais de
l'eau distillée à la place. Les valeurs de l'absorbance de chaque
concentration nous ont permis de tracer la courbe d'étalonnage de
l'acide gallique.
Pour la quantification de phénols totaux dans nos
extraits, nous avons suivi la même procédure décrite
précédemment.
3. 2. Dosage des flavonoïdes
:
3. 2. 1. Principe :
Les teneurs des flavonoïdes ont été
mesurés par une méthode adaptée de Lamaison et
Carnat (1991). (T Bahorun, 1997), en utilisant le
trichlorure d'aluminium (AlCl3) comme réactif. La présence d'une
case libre dans AlCl3 forme une liaison dative avec les doublets libres de
l'oxygène des groupements OH des flavonoïdes, en produisant un
complexe de couleur jaune, dont son absorbance maximale est enregistrée
à 409 nm. Les quantités des flavonoïdes dans nos extraits,
ont été calculées à partir d'une courbe
d'étalonnage d'un flavonoïde étalon (la rutine).
3. 2. 2. La courbe d'étalonnage de la
rutine:
Une solution mère de rutine de concentration massique
0,2 g/l a été préparée dans le méthanol. A
partir de cette solution mère, une gamme étalon de concentration
allant de 0,01 g/l jusqu'à 0,07 g/l, a
été préparée en milieu aqueux.
1 ml de chaque solution fille est placé dans un tube
à essai suivi par l'addition d' 1 ml du trichlorure d'aluminium 2 %. Les
tubes sont ensuite agités légèrement et incubés
à l'obscurité pendant 20 minutes à température
ambiante. La lecture de l'absorbance de chaque solution préparée
a été mesurée dans le même spectrophotomètre
à une longueur d'onde de 409 nm contre un blanc. Les valeurs de
l'absorbance ainsi obtenues nous ont aidé à tracer la courbe
d'étalonnage de la rutine.
Le dosage des flavonoïdes dans nos extraits a
été effectué de la même manière que la courbe
d'étalonnage.
4. Cinétique de l' -amylase :
33
La mesure de l'activité enzymatique revient à un
dosage indirect du substrat transformé ou du produit
apparu par unité de temps dans des conditions opératoires bien
définies.
Dans notre cas on s'intéresse au dosage
spectrophotométrie indirect du maltose libéré lors de
l'hydrolyse de l'amidon par l' - amylase fongique d?Aspergillus
oryzae.
La méthode est basée sur le pouvoir
réducteur du produit. Le maltose et les autres produits (Figure I . 1)
ont un pouvoir réducteur car le carbone 1 de leur glucose terminal porte
le OH hémiacétalique plus réactif que les autres OH.
Chaque produits libérés (une liaison hydrolysée) a la
capacité de réduire la solution A (Bleue) (glycine (0,21 M),
Na2CO3 (0,38 M) et le CuSO4 (1,8 mM)) en un complexe coloré (jaune
à rouge) avec la solution B : la néocoproïne. La coloration
mesurée à 450 nm est proportionnelle à la quantité
de produit libéré.
Pour doser l'activité enzymatique de l' - amylase, une
courbe d'étalonnage du maltose a été préalablement
établie.
34

Amidon
Action de l'
-amylase
 Maltose
Maltose
Maltotriose
 Dextrines limite
Dextrines limite
Figure I. 1 : Produit de
dégradation de l'amidon par l' -amylase.
35
4. 1. La courbe d'étalonnage du
maltose:
A partir d'une solution mère de maltose de concentration
molaire de 0,2 mM préparé dans un tampon phosphate (20 mM, 6 mM
NaCl pH = 6,9), une gamme étalon de solutions filles a
été préparée pour des concentrations allant de 20
uM jusqu'à 140 uM.
Dans un tube à essai, 100 ul de chaque solution fille sont
mélangés avec 0.5 ml de la solution A et 0.5 ml de la solution B.
Le milieu réactionnel est agité vigoureusement, puis porté
à l'ébullition pendant 10 minutes. À leur sortie du bain,
les tubes sont refroidis dans du l'eau de robinet (à température
ambiante) , puis 3,5 ml d'eau distillée sont ajoutés au milieu
réactionnel.
La lecture de l'absorbance de chaque solution
préparés a été enregistrée à 450 nm
contre un blanc. Les valeurs de densité optique ainsi obtenues, nous
ont permis de tracer la courbe d'étalonnage du maltose.
4. 2. Dosage de l'activité enzymatique de
l'?-amylase :
Le dosage de l'activité enzymatique de l'?-amylase a
été exprimé en fonction de la concentration du maltose
libéré, lors de la dégradation de l'amidon, dans un
intervalle de temps bien déterminé. La quantité du maltose
libéré est calculée à partir de la courbe
d'étalonnage du maltose.
Nous avons préparé deux solutions à savoir
une solution mère aqueuse d'amidon à 1 % et une solution d'
-amylase 0,5 mg /ml dans le tampon phosphaté à pH 6,9, les deux
solutions sont conservées à une température de 4°C.
A partir d'une solution mère aqueuse
d'amidon (1% m/v), nous avons préparé une gamme de
dilutions de concentrations allant de 0,2 g / l jusqu'à 10 g /l. Le
mélange réactionnel contient 300 ul du tampon phosphate, 100 ul
de chaque dilution et 100 ul d' -amylase de concentration portée
à 0.5 mg/ml. Le mélange est placé dans un bain marie
à 37 °C pendant 4 min, puis la réaction enzymatique est
stoppée par l'ajout d'1 ml de la solution A. Ensuite, 1 ml de la
solution B est ajouté et les tubes sont agités et placés
immédiatement dans un bain marie porté à
l'ébullition. Après 10 minutes de chauffage, les tubes sont
sortis du bain marie, refroidis dans de l?eau de robinet. Le volume final du
mélange réactionnel est ajusté à 4.6 ml avec de
l'eau distillée.
36
Les mesures de la densité optique de chaque solution
préparée ont été effectuées à 450 nm
contre un blanc dans le même spectrophotomètre utilisé
précédemment. Les résultats obtenus nous ont permis de
déterminer la concentration du maltose libéré dans le
milieu réactionnel et par conséquent, de tracer la courbe de la
cinétique enzymatique de l'?-amylase.
5. Tests d'inhibition :
En premier temps, nous avons testé l'effet des 23 extraits
aqueux à la même concentration sur l'activité enzymatique
de l' -amylase. Le choix de la concentration du substrat (amidon) a
été maintenu dans le domaine de la linéarité de la
courbe cinétique de l'enzyme.
Le milieu réactionnel contient : 200 ul du tampon,
100 ul d'amidon, 100 ul de chaque extraits aqueux et 100 ul d' -amylase. Un
témoin a été préparé de la même
façon sans inhibiteur. Ensuite, le mélangé
réactionnel est traité de la même manière que celle
appliquée pour le dosage de l'activité ?-amylasique et les
mesures de l?absorbance ont été enregistrées à 450
nm contre un blanc. L?activité inhibitrice de chaque plante est
calculée selon la formule suivante (Megh Raj Bhandari et al,
2008)
(DO contrôle - DO échantillon du test)
Activité inhibitrice (%) =
x 100
DO contrôle
DO contrôle : Densité optique du
control ou témoin
DO échantillon du test : Densité
optique de l'échantillon sans inhibiteur
37
1. Analyse des extraits aqueux:
1. Teneur des extraits aqueux :
Les rendements des extraits, leurs couleurs et aspects sont
consignés dans le (Tableau II.1). Les rendements des extraits aqueux
varient de 0.46 à 31.32 % dans les différentes plantes
étudiées. La teneur la plus élevée est
enregistrée pour les feuilles de la plante "Oudenaya africana"
par contre la plante "Trigonella faenum" est la plus pauvre en extrait
aqueux. La majorité des plantes atteint plus de 10% d'extraits. Tous
les extraits montrent des couleurs différentes, les aspects des extraits
sont tous visqueux.
Tableau II . 1: Teneurs, aspects et couleurs
des extraits aqueux.
|
Plantes
|
Aspect et couleur
|
Teneurs
mg / g
|
Rendement (%)
|
|
Ajuja iva
Aloe socotrina
Anthemis arvensis
Berberis Vulgaris
Cistus
Equisetum arvense
? Les grains
? Les feuilles
Erythraea centaurium
Haloxylon scoparium
Helianthemum lipplii
Marubium vulgare
Matricaria pubescens
Ononis angustissima
Oudneya africana
? Les gousses
? Les feuilles
Pituranthos chloranthus
Rhamnus alaternus
Rhantherium adpressum
Salvia offisinalis
Teucrium polium
Thapsia garganica
Trigonella faenum
Zygophyllum album
|
Visqueux - jaune foncé
Visqueux - marron foncé
Visqueux - marron
Visqueux - marron
Visqueux - marron
Visqueux - jaune
Visqueux - marron
Visqueux - marron
Visqueux - marron
Visqueux - jaune
Visqueux - marron
Visqueux - marron
Visqueux - jaune
Visqueux - jaune
Visqueux - marron
Visqueux - marron
Visqueux - marron
Visqueux - marron
Visqueux - marron
Visqueux - marron
Visqueux - jaune
Visqueux - jaune clair
Visqueux - jaune
|
131,1
156,7
193,4
179,5
210,8
60,6
144,6
194,4
182,9
39,4
119,3
190,4
76,3
185
313,3
113,9
242,1
57,3
154
106,9
236,3
4,6
98,2
|
13,12
15,67
19,33
17,95
21,08
6,06
14,46
19,44
18,29
3,94
11,93
19,02
7,62
18,5
31,32
19,39
5,73
15,39
10,69
23,63
0,46
9,82
|
39
1. 2. Quantité des phénols totaux des
extraits aqueux:
A l'aide de la courbe d'étalonnage de l'acide gallique
(Figure II . 1), nous avons calculé la quantité des
phénols totaux présents dans les 23 extraits aqueux en
équivalent d'acide gallique. Les résultats sont
résumés dans le (Tableau II . 2)

Figure II . 1 : La courbe
d'étalonnage de l'acide gallique
Le dosage des composés phénoliques dans les 23
extraits aqueux des 20 plantes étudiées a donné des
teneurs en composés phénoliques qui varient de la plus petite
valeur : 0,18 mg /g de matière sèche celle de
« Trigonella faenum » à la plus grande
valeur : 43,088 mg /g de matière sèche celle de
« Cituse ».
40
Tableau II . 2 : La teneur en phénols
totaux dans les 23 extraits aqueux.
|
Nom de la plante
|
Teneur en phénols totaux : mg / g MS
|
Taux de phénols
totaux (%)
|
|
Ajuja iva
Aloe socotrina
Anthemis arvensis
Berberis Vulgaris
Cistus
Equisetum arvense
? Les grains
? Les feuilles
Erythraea centaurium
Haloxylon scoparium
Helianthemum lipplii
Marubium vulgare
Matricaria pubescens
Ononis angustissima
Oudneya africana
Les gousses
? Les feuilles
Pituranthos chloranthus
Rhamnus alaternus
Rhantherium adpressum
Salvia offisinalis
Teucrium polium
Thapsia garganica
Trigonella faenum
Zygophyllum album
|
1,80
8,91
3,94
6,74
43,08
2,48
1,92
7,32
26,71
1,39
1,71
1,36
1,91
9,17
15,86
3,62
3,01
2,48
16,12
5,61
8,10
0,18
2,16
43,08
|
1,37
5,68
2,03
3,75
20,43
4,09
1,32
3,76
14,60
3,52
0,89
1,14
2,50
4,95
5,06
3,17
5,25
1,18
10,46
5,25
3,42
3,91
2,20
20,43
|
41
Si on compare les valeurs de ces teneurs en composés
phénoliques ( Tableau II . 2) à celles des teneurs des extraits
aqueux bruts (Tableau II . 1), on remarque qu'elles sont toutes
inférieures à ces dernières, ce qui indique que les
extraits bruts aqueux obtenus contiennent d'autres composés polaires
à part les phénols tel que : les protéines, les sucre
simple (glucose), les glycoprotéines. Par exemple pour la plante
"Csitus" qui a enregistré la teneur la plus
élevée en phénols totaux, la masse de son extrait aqueux
est de 210,8 mg/g alors que la quantité des phénols totaux ne
dépasse pas la valeur 43,08 mg/g qui représente que 20,43 % de
l'extrait aqueux brut. Il faut noter que les teneurs en extraits bruts et en
phénols totaux ne varient pas dans le même sens, car on remarque
que pour des teneurs élevées en extraits aqueux on enregistre
des quantités faibles en phénols totaux. Cette constatation est
valable pratiquement pour toutes les plantes et notamment dans la plante
"Oudenaya africana" car cette plante a enregistré la valeur la
plus élevée en extrait aqueux brut alors que ce n'est pas le cas
pour les teneurs en phénols totaux.
1. 3. Quantité des flavonoïdes
dans les extraits aqueux:
A partir de la courbe d'étalonnage de la rutine (Figure
I I. 2), nous avons déterminé la quantité des
flavonoïdes présents dans les 23 extraits aqueux en
équivalent de la rutine. Les résultats sont
résumés dans le (Tableau II . 3) .

Figure II . 2 : La courbe
d'étalonnage de la rutine.
42
Le dosage des flavonoïdes dans les 23 extraits aqueux des 20
plantes étudiées a donné des teneurs en flavonoïdes
qui varient de 0,041 mg /g de matière sèche celle dans la
plante « Trigonella faenum » à 11,613 mg /g de
matière sèche pour la plante « Salvia
offisinalis».
Tableau II . 3 : La teneur en
flavonoïdes dans les 23 extraits aqueux.
|
Nom de la plante
|
Teneur en flavonoïdes mg / g MS
|
Taux de flavonoïdes (%)
|
|
Ajuja iva
Aloe socotrina
Anthemis arvensis
Berberis Vulgaris
Cistus
Equisetum arvense
? Les grains
? Les feuilles
Erythraea centaurium
Haloxylon scoparium
Helianthemum lipplii
Marubium vulgre
Matricaria pubescens
Ononis angustissima
Oudneya africana
Les gousses
? Les feuilles
Pituranthos chloranthus
Rhamnus alaternus
Rhantherium adpressum
Salvia offisinalis
Teucrium polium
Thapsia garganica
Trigonella faenum
Zygophyllum album
|
0,66
8,39
0,95
0,53
2,07
0,06
0,50
6,49
1,73
1,35
0,20
0,43
1,16
3,61
6,54
0,91
2,11
1,11
11,61
3,00
2,83
0,04
1,97
|
36,84
94,16
24,41
7,85
67,26
2,62
26,30
88,66
6,47
97,12
15,01
25,43
60,73
39,40
41,26
25,13
73,26
36,87
72,02
53,51
34,97
22,22
71,22
|
43
Si on compare les valeurs de ces teneurs en flavonoïdes
(Tableau II. 3) à celles des teneurs en composés
phénoliques des extraits aqueux bruts ( Tableau II. 2), on remarque
qu'elles sont toutes inférieures à ces dernières, ce qui
indique que les extraits contiennent d'autres composés
phénoliques possédant autres structures chimiques que celles des
flavonoïdes (Acide phénoliques, tanins, stilbènnes...).
Quelques plantes ont montré leur richesse en flavonoïdes à
savoir: Aloe socotrina, Erythraea centaurium, Helianthemum lipplii.
Suivant les résultats obtenus sur le test d'inhibition de
l'enzyme décrits dans la partie (3) (des
résultats et discussion), nous avons sélectionné six
plantes de l'ensemble des plantes investiguées :
« Cistus », « Oudneya
africana », « Equisetum arvense»,
«Matricaria pubescens », « Salvia officinalis
» et «Thapsia garganica », qui exposent des taux
d'inhibition supérieur à 70%. Les six plantes
sélectionnées sont soumises à une succession d'extraction
par de l'eau distillée et le méthanol. 1 g de la poudre
végétale dans 20 ml d'eau distillée a été
chauffée pendant 20 min à 75°C. Après filtration, les
résidus de la matière végétale sont
séchés puis macérés dans 10 mL de méthanol
pendant 72 heures. Les filtrats obtenus des deux étapes d'extraction,
sont alors évaporés sous vide et les résidus obtenus sont
repris dans 5 ml d'eau distillée et 5 ml du méthanol pur pour
les extrait aqueux et les extraits méthanoïques respectivement.
La quantification des phénols totaux et des
flavonoïdes dans les extraits préparés a été
déterminée par les mêmes procédures décrites
précédemment. La détermination des constantes et les types
d'inhibition de tous les extraits a été achevée suivant le
protocole expérimental décrit auparavant. Les teneurs des
extraits méthanoliques, les couleurs ainsi que leurs aspects sont
regroupés dans le (Tableau II . 4).
Tableau II . 4 : Teneurs, couleurs et aspects
des extraits méthanoliques.
|
Plantes
|
Aspect et couleur
|
Teneur mg/g
|
Rendement
(%)
|
|
Cistus
Equisetum arvense (Les grains)
Matricaria pubescens
Oudneya africana (Les gousses)
Salvia offisinalis
Thapsia garganica
|
Poudre cristalline verte
Poudre cristalline verte
Poudre cristalline verte
Poudre cristalline verte
Poudre cristalline verte
Poudre cristalline verte
|
33,45
61,41
32,12
67,56
28,24
20,21
|
2,78
6,14
3,21
6,75
3,39
2,01
|
44
D'après les résultats mentionnés dans le
tableau précèdent, on remarque que les valeurs des rendements
d'extraction varient entre 2.01 et 6.75% pour « Thapsia garganica
» et les gousses de la plante « Oudneya
africana » respectivement. Les extraits présentent un
aspect poudreux de même couleur verte sauf pour l'extrait
« Equisetum arvense » qui a une couleur Jaune
A l'aide des courbes d'étalonnage de l'acide gallique et
de la rutine, nous avons calculé les quantités des phénols
totaux et des flavonoïdes présents dans les 6 extraits
méthanolique. Les résultats sont résumés dans le
(Tableau II . 5).
Tableau II . 5 : La teneur
en phénols totaux et flavonoïdes dans les 6 extraits
méthanoliques.
|
Nom de la plante
|
Teneur en phénols totaux : mg / g MS
|
Taux de
phénols
totaux (%)
|
Teneur en flavonoïdes :
mg / g MS
|
Taux de flavonoïdes
(%)
|
|
Cistus
Equisetum arvense (Les grains)
Matricaria pubescens
Oudneya africana (Les gousses)
Salvia offisinalis
Thapsia garganica
|
5,71
2,45
3,16
7,06
11,42
1,87
|
20,48
3,98
9,83
10,44
33,68
9,31
|
2,03
0
1,04
0,27
0,02
0
|
35,61
0
32,85
3,86
0,12
0
|
Le dosage des composés phénoliques dans les six
extraits méthanoliques, a donné des teneurs en composés
phénoliques qui varient entre 2,45 mg /g et 11,42 mg /g de la
matière sèche équivalent en acide gallique pour les
extraits de « Equisetum arvense » et « Salvia
offisinalis » respectivement.
D'après les valeurs obtenues des teneurs en
composés phénoliques (Tableau II . 5) et celles des extraits
bruts (Tableau II . 4), on peut déduire que les extraits
méthanoliques bruts ne contiennent pas uniquement des composés
phénoliques, mais peut être que d'autres composés sont
extractibles par le méthanol.
45
Si on compare les teneurs en composés phénoliques
des extraits méthanoliques et aqueux des six plantes
étudiées, (Tableau II. 5) on constate que les extraits aqueux
renferment des teneurs en phénols totaux plus élevées par
rapport aux extraits méthanoliques. Une explication simple peut
être envisagée dont le fait que, l'extraction méthanolique
a été déjà précédée par une
extraction aqueuse et elle n'a extrait que le reste qui n'est pas passé
dans l'eau distillée. Par contre, l'extrait méthanolique de
«Matricaria pubescens » a présenté une
teneur en phénols totaux supérieure à celle de l'extrait
aqueux ce qui peut être expliqué par le fait que la plante
«Matricaria pubescens » contient d'autres composés
phénoliques non extractible par l'eau et qui sont passés dans le
méthanol. Egalement, l'eau distillée a la capacité
d'extraire d'autres composés polaires que les polyphénols, tels
que les alcaloïdes, les protéines, les sucres et d'autres
composés qui sont dosables par le réactif de Folin Cioncalteu, ce
qui entraîne une augmentation des teneurs en composés
phénoliques.
A travers les résultats cités dans le tableau
précèdent, on constate que les plantes étudiées
renferment un matériel pauvre en flavonoïdes et notamment pour les
extraits de "Thapsia garganica" , "Salvia offisinalis" et
"Equisetum arvense "(Les grains). Ils présentent tous des
teneurs en flavonoïdes inférieurs à 35 %
2. Cinétique de l' -amylase :
En se basant sur la courbe d'étalonnage du maltose (Figure
II. 3), nous avons pu déterminer les concentrations du maltose
libéré dans le milieu réactionnel pour des
différentes concentrations d'amidon. Les valeurs obtenues des
concentrations, nous ont permis de tracer la courbe de la cinétique de
l'enzyme (Figure II. 4)

46
Figure II. 3 : La courbe
d'étalonnage du maltose.
La représentation graphique V = f ([S]) (Figure II. 4),
montre que l'enzyme -amylase suit une cinétique michaelienne.
D'après ce graphe, on constate que la relation est proportionnelle entre
la concentration et la vitesse enzymatique dans un domaine de
linéarité qui s?arrête à une concentration de
substrat de 0,5 g / l où la courbe dévie, montrant un plateau qui
est expliqué par le fait que le site actif de l?amylase est
saturé.

Figure II . 4 : La cinétique de l'
-amylase.
La représentation de Lineweaver - burk 1 / V = 1 / ([|S])
(Figure VII. 25) nous a permit de déterminer les différents
paramètres cinétiques de l'amylase à savoir la vitesse
maximale Vmax et la constante de Michaelis - Menten KM
- 1 / KM

47
Figure II . 5 : Représentation de
Lineweaver - burk de l' -amylase.
À partir de la représentation de Lineweaver -
burk de l' -amylase, la vitesse maximale est de 107,52 uM /
min et la constante de Michaelis ? Menten KM = 1,19 g / l .
3. Tests d'inhibition :
En vue de repérer les plantes ayants une capacité
inhibitrices vis-à-vis l' - amylase, des tests d'inhibitions ont
été effectués pour une même concentration des
extraits. La concentration a été fixée à 0.9 g/l.
Les taux d'inhibition ont été calculés et les
résultats sont résumés dans le (Tableau II . 6).
Tableau II . 6 : Taux d'inhibition des 23
extrais aqueux.
|
Nom de la plante
|
Taux d'inhibition (%)
|
48
|
Zygophyllum album
|
70,31
30,19
61,95
48,17
100
100
32,48
25,69
53,61
43,1/8
8,29
86,90
19,25
100
51,38
43,18
76,75
77,81
51,47
76,75
0
0
|
D'après les résultats obtenus, on remarque que
touts les extraits ainsi préparés inhibent l' - amylase avec
différents taux d'inhibition. Les valeurs calculées sont
comprises entre 8,29 et 100 %. Les pourcentages d'inhibition les plus
importants sont remarqués pour les extraits de « Cistus
», les gousses de la plante « Oudneya
africana » et les grains de la plante « Equisetum
arvense » à l'exception des deux plantes
« Zygophyllum album » et
« Trigonella faenum ».
D'après l'enquête ethnobotanique effectuée
auprès des herboristes qui confirment l'utilisation de la plante
« Zygophyllum album »en médecine
traditionnelle contre le diabète, on peut expliquer l'action anti -
hyperglycémiante de son extrait aqueux, qui est due à
l'inhibition de l' -glucosidase, ou il agit à un autre niveau pour
diminuer la glycémie élevée en favorisant la
sécrétion de l?insuline. Une autre explication est
envisagée est que les principes actifs responsables à
l'inhibition de l'enzyme ne sont pas extractibles par l'eau distillée.
4. Evaluation de l'effet inhibiteur des extraits sur l' -
amylase :
Dans notre étude, l'activité enzymatique de l' -
amylase a été mesurée à l'aide du substrat
l'amidon. Nous avons néonmoins choisi l'amidon comme substrat
essentiellement pour la commodité de réaliser le dosage par les
méthodes photométriques.
Dans le but de trouver un inhibiteur naturel de l' - amylase,
nous avons donc étudié l'effet des extraits aqueux et
méthanoliques sur l'activité de l' - amylase à des
concentrations variables d'extraits. Les mesures ont été
effectuées avec l'amidon comme substrat de l'enzyme. L'influence du
temps d'incubation sur l'inhibition de l'activité enzymatique par les
extraits aqueux et méthanoïques a été examiné
jusqu'à 4 min.
D"après les tracés (Annexe 2 et 3) figurant la
variation de l'inverse des vitesses réactionnelles en fonction des
concentrations d'extraits exprimés en g / l et la variation de l'inverse
des vitesses réactionnelles en fonction de l'inverse des concentration
exprimé en l / g pour différentes concentrations de substrat,
nous avons déterminé les types et la constante d'inhibition (Ki)
de chaque échantillon.
Les constantes d'inhibition (Ki) sont calculées à
partir de ces graphes, par la projection du point d'intersection des droites
sur l'axe des abscisses, tendis que le type d'inhibition est déduit
à partir du point de rencontre de ces tracés. Le tableau II. 7
regroupe les différents résultats obtenus.
49
Tableau II. 7 : Inhibition l' - amylase par les
extraits aqueux et méthanloniques.
Ki : constante d'inhibition; K'i : constante d'inhibition par
rapport aux phénols totaux.
|
Nom de la plante
|
Type d'inhibition
|
Ki (g/l)
|
K'i (ppm)
|
|
Extraits aqueux
|
|
Cistus
Equisetum arvense (Les grains)
Matricaria pubescens
Oudneya africana (Les gousses)
Salvia offisinalis
Thapsia garganica
|
Inhibition compétitive
Inhibition compétitive mixte
Inhibition compétitive mixte
Inhibition compétitive
Inhibition compétitive mixte
Inhibition compétitive
|
0.24
0,21
0,35
0,37
0,07
0,39
|
50,36
8,88
3,17
18,69
8,07
13,47
|
|
Extraits méthanoliques
|
|
Cistus
Equisetum arvense (Les grains)
Matricaria pubescens
Oudneya africana (Les gousses)
Salvia offisinalis
Thapsia garganica
|
Inhibition compétitive mixte
Inhibition compétitive mixte
Inhibition compétitive mixte
Inhibition compétitive mixte
Inhibition compétitive mixte
Inhibition compétitive mixte
|
0.22
0,21
0,36
0,13
0,02
0,58
|
45,67
8,64
36,09
13,58
8,08
54,65
|
L'ensemble des résultats obtenus montrent que la
totalités des extraits aqueux et méthanoliques de nos plantes ont
la capacité d'inhiber l'activité de l' - amylase avec des
valeurs des Ki de l'ordre de ppm par rapport aux phénols totaux, en
présentant des inhibitions de type : Inhibition compétitive mixte
et Inhibition compétitive. Ces deux derniers types d'inhibition peuvent
être expliqués par le fait que, les extraits aqueux et
méthanoliques possèdent des composés portant des
groupements fonctionnels proches de ceux du substrat qui est l'amidon, ce qui
l'a déplacé du site actif de l'enzyme.
Les valeurs de Ki par rapport aux concentrations d'extraits
bruts, déterminée des deux représentation de Dixon et
de Lineweaver - burk varient de 0,074
g/l à 0,393 g/l , et de 0,024 à 0,587 g/l pour les extraits
aqueux et méthanoliques respectivement.
50
On remarque que la plante «Salvia
offisinalis » pressente un Ki faible pour les deux
extraits aqueux et méthanoliques ce qui prouve que c'est un bon
inhibiteur. Par contre par rapport aux phénols totaux c'est la plante
" Matricaria pubescens" qui montre la plus faible valeur par rapport
au phénols totaux pour les extraits aqueux, mais parcrapport au
phénols totaux pour les extraits méthanoliques c'est la plante
«Salvia offisinalis»
Les figures ci-dessous montrent les représentations de
Lineweaver - burk et Dixon de la plante «Salvia
offisinalis»
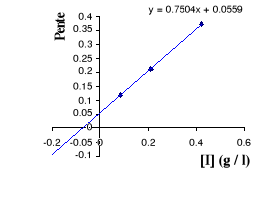

Figure II. 6 : Représentation de
Lineweaver - burk de l'extrait aqueux la plante
«Salvia offisinalis »
51

Figure II. 7 : Représentation de
Dixon de l'extrait aqueux de la plante «Salvia
offisinalis »
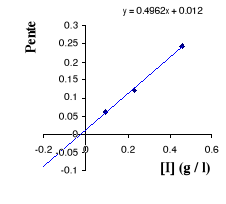

Figure II. 8 : Représentation de
Lineweaver - burk de l'extrait méthanolique de la plante
«Salvia offisinalis»
52

Figure II. 9 : Représentation de
Dixon de l'extrait méthanolique de la plante «Salvia
offisinalis »
53
Conclusion
Plusieurs raisons ont mené au retour de l'usage des
plantes médicinales, la découverte des puissances curatives des
plantes et les principes actifs qui agissent de façon non violente, en
profondeur sans agresser l'organisme, en stimulant ses défenses
plutôt que de se substituer à elles, en sont les meilleurs
arguments.
Dans ce contexte et pour enrichir les banques de donnés
de référence de la phytothérapie, nous nous somme
intéressés à six plantes de différentes familles
à savoir : Equisetum arvense, Cistus, Matricaria pubescens,
Oudneya africana, Salvia officinalis et Thapsia garganica, en
tenant en compte leur importance en thérapeutique traditionnelle. Le
chois tactique de ces plantes est basé sur des tests
préliminaires vis-à-vis l'activité -amylasique,
indiquant leur possession d'un pourcentage d'inhibition supérieur
à 70 %.
Dans un premier temps, nous avons réalisé une
extraction aqueuse et méthanolique pour les six plantes
médicinales choisies. Dans un second lieu, nous avons
procédé à la quantification des composés
phénoliques par des méthodes spectrophotométriques. Le
dosage des phénols totaux a été réalisé par
la méthode de folin - Ciocalteu, en utilisant l'acide gallique comme
étalon. Tandis que l'évaluation des composés
flavonoïdiques par rapport à la rutine a été
effectuée par dosage compléxométrique avec le trichlorure
d'aluminium.
Les résultats montrent clairement que les teneurs en
phénols totaux varient entre 1,71 et 16,12 mg/g et de 1,87 et 11,42 mg/g
équivalent en acide gallique pour les extraits aqueux et
méthanoliques respectivement. L'analyse quantitative du contenu en
flavonoïdes nous a conforté dans l'idée que ces plantes
étaient en possession d'un matériel relativement faible en
flavonoïdes . A partir des valeurs des quantités des
flavonoïdes qui sont comprises entre 0,06 et 11,61 mg/g et de 0 et 2,03
mg/g équivalent en rutine, on peut conclure que la majorité de
ces plantes présentent des pourcentages en flavonoides inférieurs
à 50 % par rapport à la masse des phénols totaux.
55
Nous avons pu mettre en évidence pour la première
fois in vitro, l'effet inhibiteur de certains extraits de plantes sur
l' - amylase. Les résultats obtenus à travers ce test montrent
que la majorité de ces plantes présentent des effets inhibiteurs
importants. Les valeurs des constantes (Ki) ainsi obtenu, indiquent
que ces plantes peuvent être investiguées à des fin
pharmacothérapeutique, et notamment, la plante "Salvia
officinalis" qui a présentée les plus faibles valeurs de
constante d'inhibition pour les deux extraits aqueux et méthanolique.
L'ensemble de ce travail a permis de mieux connaître
l'intérêt de ces plantes vis-à-vis leur activité
anti-amylasique, ce qui nous encourage à approfondir la recherche pour
caractériser les molécules responsables à cette
inhibition. De même, il est envisageable d'élargir le panel des
tests d'inhibition, en utilisant d'autres substrats ou d'autres types
d'enzymes. Il reste encore d'autres plantes locales utiles qui n'ont pas
été analysées et qui mériteraient de
déterminer leur potentialité dans le domaine
étudié.
56
Bibliographie
Baba Aissa Farid, 2000, Encyclopédie des
plantes utiles, flore d'Algérie et du Maghreb, substances
végétales d'Afrique d'orient et d'occident, p 228, p 252, p
276.
Bahorun T, 1997, Substances naturelles
actives : La flore mauricienne, une source d'approvisionnement
potentielle, Food and Agricultural Research, pages 83 - 94.
Baron. A, Bertheau. y, Brillquet. J. M, Cassagne. C,
Coleno. A, Gripon. J. C, Hoebler. C, Kotoujansky. A, Mercier. C, Odier. E,
Rouau. X, Thibault. J. F, Valin. C et Verger. R, 1985, Hydrolases et
dépolymérases enzymes d'intérêt industriel, P 113,
114, 116.
Boizot Nathalie et Charpentier Jean-Paul,2006,
Méthode rapide d'évaluation du contenu en composés
phénoliques des organes d'un arbre forestier, INRA - Amélioration
génétique et physiologie Forestières, Laboratoire
d'analyses biochimiques, le cahier des technique de l'INRA, P 79, 80.
Caratini Roger, 1985, La médecine,
édition Bordas, p 35, p 76, p 100.
Dr Chehma Abdelmadjid, 2006, Catalogue des
plantes spontanées du Sahara septentrional algérien,
édition Dar elhouda, Ain M'lila, P 14, 18, 38,51, 66, 73, 137.
Dr. Helmi abdel kader, 2004, Les plantes
médicinales en Algérie, p 61, p 156
Djelili Farida, Madani Khodir et Chibane Mohamed,
2008, Extraction et analyse quantitative de composés
phénoliques de quelques plantes de la région de Beni - Djellil,
université Abderrahmane Mira de Bejaia, Séminaire Agriculture,
environnement et santé S. N. A. E. S. 2008, pages 159 - 165.
58
Girotti - Chanu Catherine, 2006, Etude de la
lipolyse et de la synthése de composés d'un derme sous l'effet de
la cirsimarine, flavone extraite de Microtea debilis , Ecole doctorale
interdisciplinaire science - Santé, Formation doctorale :
Biochimie, p 32, 33, 34, 35 . (Thèse de Doctorat).
Grimaldi. A, 2000, Diabétologie,
Université Paris - VI, faculté de médecine Pierre et Marie
CURIE, questions d'internat, P 23.
Hadi Milaine, 2004, La quercétine et ses
dérivés : molécules à caractère pro -
oxydant ou capteurs de radicaux libres ; études et applications
thérapeutiques, Université Louis Pasteur Strasbourg l
Domaine : pharmacochimie, p 23, 29, 30, 31, 32, 33, 34, 35. (Thèse
de Doctorat).
Hames. B.D, Hooper. N. M et Houghton. J. D,
2000, Biochimie, édition Berti, P 61, 76, 77.
Hong Gao, Yi - Na Huang, Bo Gao, Pei - Yu Xu, Chika
Inagaki et Jun Kawabata, 2008, - Glucosidase inhibitory effect bu the
flower buds of Tussilogo farfara L , Journal of
Food chemistry, Pages 1195
-1201.
Horn Florian, Lindenmeier Gerd, Grillhosl Christian, Moc
Isabelle, Berghold Silke, Schneider Nadine et Munster Birgit, 2005,
Biochimie humaine, édition Flammarion, P 65, 66, 76.
Keillor Jeffrey W, 2004, Enzymologie inhibition
des réactions enzymatiques, Université de montréal,
faculté des arts et des sciences, département de chimie, P 5, 6,
11, 12, 17, 18, 19, 20, 23, 24.
Laraoui Habiba, 2007, etude phytochimique de
l'extrait chloroformique de Bulpleurum atlanticum, Université
El Hadj Lakhdar Batna, Option : chimie organique, p 35. (Thèse de
Magister).
Lévêque Emmanuel, Haye
Bernard et Belarbi Abdel, 2000, l'amidon et ces dérivés
applications industrielles, éditions scientifiques et médicales
Elservier SAS, P17, 18, 19, 20, 21, 35.
59
Macheix Jean-jacques, Fleuriet Annie et jay - Allemand
Christian, 2005, Les composés phénoliques des
végétaux un exemple de métabolites secondaire d'importance
économique, presses plytechnique et universitaires romandes, p Viii, 1,
3, 5, 7, 10.
Maiza K et Hammiche V, 1993, Pharmacopée
traditionnelle Saharienne : Sahara septentrional, Laboratoire de botanique
médicale, INSSM / Alger, médicament et alimants : l'approche
ethnopharmacologique, pages 169 - 171.
Megh Raj Bhandari, Nilubon Jong-Anurakkn, Gao Hong, jun
Kawabata, 2008, - Glucosidase and ? amylase inhibitory activities of
Nepalese medicinal herb Pakhanbhed ( Bergenia Ciliata, Haw.),
Journal of Food
chemistry, Pages 247 ? 252.
Microsoft Encarta (CD), 2006
Portet Bénédicte, 2007, Recherche
bioguidée de molécules antipaludiques d'une plante guyanaise
Piper hostmannianum, Université Paul Sabatier Toulouse
spécialité : Chimie - Biologie - Santé p 22
(Thèse de Doctorat).
Voet Donald et Voet Judith C, 1995, Biochimie,
édition 1998, P 351, 359
Weil Jacques-Henry, 2001, Biochimie
générale, 9ème édition Dunod, P 216.
Weinman Serge, 2004, Toute la biochimie,
édition Dunod, P 142.
Wikipedia encyclopedia, 2005.
.
60
Annexe
Annexe. 1. Les formules chimiques de quelques
polyphénols.


Phénol simple :
Catéchol
L'acide gallique

Acide
hydrobenzoïque :
p - Hydroxybenzoïque

Acide
hydroxycinnamique :
Acide
caféique

Naphtoquinone :
62
Juglone

Stilbène :
Le resvératol
Flavonoïde


Flavonol :
Quercétine
Rutine

Anthocyane :
63
Cianidine

Flavanols :
Catéchine

Flavanones :
Naringénique

Lignanes :
64
Pinorésinol
Annexe. 2. Les représentations de
Lineweaver- burk.
Représentations graphiques de 1 / V = f ( 1 / [S]
) des extraits aqueux des plantes choisis :
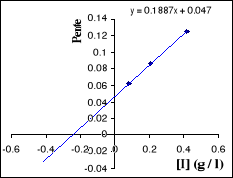

Représentation de Lineweaver - burk de
l'extrait aqueux la plante
«Cistus »
65


Représentation de Lineweaver - burk de
l'extrait aqueux de la plante
«Equisetum arvense »
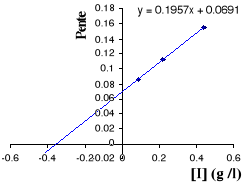

66
Représentation de Linweaver - burk de
l'extrait aqueux la plante «Matricaria
pubescens »
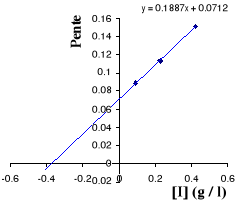

Représentation de Lineweaver - burk de
l'extrait aqueux la plante
«Oudneya africana »
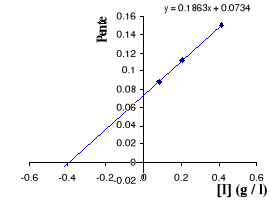

Représentation de Lineweaver - burk de
l'extrait aqueux la plante
67
«Thapsia garganica»
Représentations graphiques de 1 / V = f ( [ I] )
des extraits méthanoliques des plantes choisis :
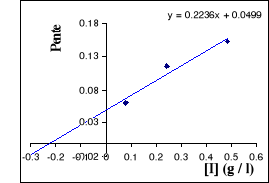

Représentation de Lineweaver - burk de
l'extrait méthanolique de la plante «Cistus
»
68
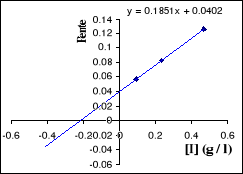

Représentation de Linweaver - burk de
l'extrait méthanolique de la plante «Equisetum
arvense »
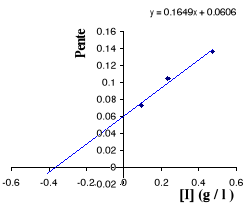

Représentation de Linweaver - burk de
l'extrait méthanolique de la plante «Matricaria
pubescens »
69
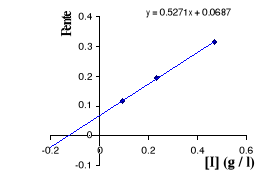

Représentation de Lineweaver - burk de
l'extrait méthanolique de la plante «Oudneya africana
»
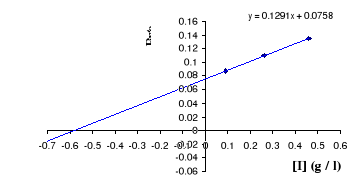

Représentation de Lineweaver - burk de
l'extrait méthanolique de la plante «Thapsia
garganica»
70
Annexe. 2. Les représentations de
Dixon.
Représentations graphiques de 1 / V = f ( [I] )
des extraits aqueux des plantes choisis :

Représentation de Dixon de l'extrait aqueux de
la plante
«Equisetum arvense »

Représentation de Dixon de l'extrait
aqueux de la plante «Cistus »
71

Représentation de Dixon de l'extrait
aqueux la plante
«Matricaria
pubescens »

Représentation de Dixon de l'extrait
aqueux de la plante
72
«Oudneya africana »

Représentation de Dixon de l'extrait
aqueux la plante
«Thapsia garganica»
Représentations graphiques de 1 / V = f ( [ I] )
des extraits méthanoliques des plantes choisis :

73
Représentation de Dixon de l'extrait
méthanolique de la plante «Equisetum
arvense »

Représentation de Dixon de l'extrait
méthanolique de la plante «Oudneya africana
»

Représentation de Dixon de l'extrait
méthanolique de la plante «Thapsia garganica»
74

Représentation de Dixon de l'extrait
méthanolique de la plante «Matricaria
pubescens »

Représentation de Dixon de l'extrait
méthanolique de la plante «Cistus »
75
ÈÇá.
ÊÞáíÏíÇ.
Ç. Ê1.340 / 43.088 / 0.067 / 11.613 / . 2 % 0.041
/ 11.613 / 0.0097 / 1.591 / í.
í. (Ki) . 55 . 8 .
.
ÇáãÇÊíÍ:
- -.
Résumé
Depuis quelques temps, il a eu un intérêt croissant
pour la nourriture, l'industrie pharmaceutique et dans les soins
préventifs pour la santé, pour le développement et
l'évaluation d'inhibiteurs d'enzymes naturelles dérivés de
plantes médicinales. En Algérie, la liste des plantes qui
rentrent précisément dans ce cadre sont exhaustives et
nombreuses d'entres elles sont considérés traditionnellement
comme antidiabétique.
Dans le présent travail, nous avons étudié
les effets inhibiteurs d'extraits aqueux et méthanoliques de six plantes
médicinales Algériennes connues par leurs vertus
thérapeutiques contre le diabète. La teneur en composés
phénoliques totaux, doser en utilisant le réactif de
Folin-Ciocalteu, des échantillons varient de 1,340 mg / g à
43,088 mg / g et de 0,067 mg / g à 11,613 mg / g en équivalent
acide gallique (GAME), respectivement. Alors que les concentrations des
flavonoïdes détectés en utilisant le chlorure d'aluminium
2% varient de 0,041 mg / g à 11,613 mg / g et de 0,0097 mg / g
à 1,591 mg /g en équivalents de la rutine (RE), pour les
extraits aqueux et méthanolique respectivement.
La majorité des plantes inhibaient l'activité
enzymatique de l' - amylase d'Aspergillus oryzae. Les valeurs des
constantes d'inhibition (Ki) ont été déterminées en
utilisant deux méthodes de Dixon et de Lineweaver-Burk. Les
résultats montrent que les valeurs Ki sont inférieures à
55 ppm pour tous les extraits. Une forte inhibition a été
trouvée chez l'extrait phénolique de Salvia officinalis
avec un Ki de 8 ppm. Ces résultats nous encouragent à amplifier
plus l'investigation biologique et d'identifier les molécules
inhibitrices responsable de cette activité.
Mots clés : antidiabètique,
polyphénols, - amylase, activité enzymatique ,Salvia
officinalis.
Abstract
Since recent times, there is a growing interest in the food
and pharmaceutical industry and in preventive health care for the development
and evaluation of natural enzyme inhibitors from medicinal plant materials. In
Algeria, the list of plants entering precisely in this domain is exhaustive and
numerous among of them are considered traditionally as antidiabete.
In the present work, we have studied the inhibitory effects of
aqueous and alcoholic extracts of six Algerian medicinal plants known by their
virtues therapeutic against the diabete. The total phenolic compounds content,
assayed using Folin-Ciocalteu's reagent, of the samples ranged from 0,183 mg /g
to 43,088 mg /g and from1,197 mg /g to 7,445 mg /g, expressed as gallic acid
equivalent (GAE), for the respectively. Whereas, the total flavonoïds
concentrations, detected using 2% of the aluminum chloride ranged from 0,041 mg
/g to 11,613 mg /g and from 0,0097 mg /g to 1,591 mg /, expressed as rutin
equivalents (RE), for the aqueous and methanolic extracts respectively.
The major plants were found to inhibit enzymatic activitie of
Aspergillus oryzae - -amylase in a concentration dependent manner.
The values of the inhibition constants (Ki) have been determined
according to the Dixon and Lineweaver-Burk methods. the results showed that the
Ki values were less than 55 ppm for the all extracts. A strong
inhibition was founed in the phenolic extract of Salvia officinalis with
a Ki of 8 ppm . These results encourage us to perform further
biological investigation and to identify molecule inhibitors responsible of
this activity.
Key worlds: antidiabete, phenolic compounds, -
amylase, enzymatic activitie and Salvia officinalis.
|
|



