II.2.3 - La dépassivation des armatures
Si un acier est préalablement recouvert de produits
passivants (cas du béton sain), cette protection est
altérée le plus souvent par l'introduction de deux agents pouvant
se présenter simultanément : le dioxyde de carbone
C02 (carbonatation) et l'ion chlorure Cl- (chloruration)
en excès au niveau des armatures. Il se produit alors une
dépassivation.
Les deux phénomènes de carbonatation et de
chloruration interagissent entre eux puisque la carbonatation, en changeant la
structure du réseau poreux, peut affecter la diffusion des chlorures au
sein du béton. En effet, après carbonatation, il a
été observé une réduction de la porosité
totale et une redistribution de la taille des pores, rendant plus difficile la
pénétration des chlorures ( ).
Le mécanisme de dépassivation comprend les
étapes suivantes :
- la couche passivante est détruite localement
là où la teneur en chlorure ou en dioxyde de carbone est
très forte ;
- de la rouille se forme là où la passivation a
disparu ;
- la rouille se transforme en des oxydes (ou hydroxydes)
poreux si la teneur en oxygène est assez élevée.
Lorsque le pH du béton est inférieur à
environ 9, les teneurs critiques en chlorures et en carbonates provoquant la
dépassivation de l'acier sont très faibles et correspondent
à des eaux naturelles, potables. C'est pourquoi, en pratique, ce PH est
souvent considéré comme étant la valeur critique de
dépassivation des aciers.
· La carbonatation
La carbonatation est engendrée par
réaction entre le dioxyde de carbone de l'air et certains constituants
du béton tel que le ciment. Le dioxyde de carbone gazeux
pénètre par diffusion dans le réseau poreux du
béton et réagit avec la portlandite Ca(OH)2 pour
former des carbonates tel que le calcite CaCO3, ce qui provoque un
abaissement du pH a 9 environ, suivant la réaction suivante en milieu
aqueux :
CO2 + Ca (OH)2
CaC03+ H2O (6)
En présence de bases alcalines, telles que Na0H ou
K0H, la solubilité de la chaux est relativement faible et la
réaction peut se ralentir. Cependant ces bases alcalines se carbonatent
elles aussi :
CO2 + 2X0H X2CO3 +
H2O (7)
Avec X= Na ou K
La carbonatation des bases alcalines augmente la
solubilité de la chaux qui peut alors se carbonater en plus grande
quantité :
X2CO3 + Ca (OH)2
CaCO3 + 2XOH (8)
Avec X = Na ou K
La carbonatation est un phénomène
progressif qui, avec le temps, atteint des couches de plus en plus
importantes.
La vitesse de carbonatation est fonction de nombreux
paramètres dont les plus importants sont la perméabilité
et le taux d'humidité relative du milieu ambiant. La vitesse de
carbonatation est maximale pour une humidité comprise entre 40% et 80%,
60% étant considéré comme la valeur la plus critique. Dans
les environnements secs, la quantité d'eau est insuffisante pour
dissoudre le CO2, alors que dans les environnements très
humides, le béton étant saturé, la diffusion de
CO2 est considérablement ralentie.
De très fortes teneurs, dans un béton, en
cendres volantes (>30%) et en laitiers (>50%) peuvent
accélérer significativement sa vitesse de carbonatation.
La carbonatation commence donc à la surface du
béton et concerne une certaine épaisseur (dite profondeur de
carbonatation) de ce matériau.
pH > 11
Béton non carbonaté
Béton carbonaté
Extérieur
Alimentation en CO2
pH < 9
Zone carbonatée
Intérieur
Le schéma de la figure 4 illustre le principe
de la formation de la carbonatation.
Figure 4 : Schéma de principe de la
formation de la carbonatation.
· Les ions chlorures
La corrosion des armatures
générée par les ions chlorures est la principale cause de
dégradation des structures en béton armé.
Les chlorures agissent dans les mécanismes de
corrosion en diminuant la résistivité de l'électrolyte et
en permettant un amorçage plus rapide de la corrosion en
dépassivant la couche superficielle. La corrosion qui en résulte
sous forme de piqûres à la surface de l'acier est une corrosion
localisée. Les chlorures agissent aux zones anodiques, de surface bien
plus petite que celles des zones cathodiques, et la vitesse de corrosion sur
les zones anodiques s'en trouve fortement augmentée. Une fois la
corrosion amorcée, il est bien plus difficile d'y remédier que
dans le cas de la carbonatation car le processus est autocatalytique.
Les chlorures présents dans le béton
peuvent provenir de deux sources différentes. Soit ils sont
présents au moment du gâchage : utilisation d'eau contenant
des chlorures ou agrégats contaminés. Soit ils proviennent de
l'environnement (atmosphère marine, sels de déverglaçage,
produits chimiques) et ont diffusés dans le béton. Les chlorures
existent sous deux formes dans le béton.
- Les chlorures libres qui sont dissous dans la solution
interstitielle ;
- Les chlorures piégés ou liés qui sont
combinés à des hydrates du ciment et à des
agrégats, ou absorbés physiquement sur les parois des pores.
Les ions chlorures qui pénètrent dans le
béton peuvent réagir chimiquement avec l'aluminate tricalcique
(C3A en nomenclature des cimentiers) et former des
monochloroaluminates hydratés (C3A. CaCl2.
10H2O), relativement stables dans le béton.
La concentration en hydroxydes dans la solution
interstitielle agit de façon significative sur la proportion des
chlorures liés : plus la concentration en hydroxydes est
élevée, moins il y aura de chlorures dans la solution. Une
élévation de température, quant à elle, diminue la
capacité de chlorures à se lier. Typiquement, 40 à 50% des
chlorures totaux sont liés.
Seuls les chlorures libres participent à la corrosion
des armatures.
Les chlorures ayant atteint l'armature attaquent l'acier
initialement passivé, en certains points localisés. Le film
passif est alors détruit localement et laisse apparaître des zones
anodiques où l'acier est dissout. Le reste de la surface qui est encore
passivée correspond aux zones cathodiques. La surface des zones
cathodiques étant bien plus importante que celle des zones anodiques, la
dissolution de l'acier croit en profondeur plutôt qu'en surface de
l'acier formant ainsi des piqûres ou des cavernes. Le mécanisme de
ce type de corrosion est complexe car la composition de la solution à
l'intérieur de la piqûre est modifiée par rapport à
celle de la solution interstitielle qui l'entoure.
Au sein de la piqûre, les ions chlorures s'associent
avec l'ion hydrogène de l'eau pour former de l'acide chlorhydrique.
Fe2+ + Cl- + H2O
Fe0H+ + H+Cl- (9)
H+Cl- H+ +
Cl- (10)
Ces réactions acidifient la solution dans la
piqûre, abaissant fortement le pH entre 3,8 et 5. Les ions chlorures
régénérés continuent d'être actifs pendant
tout le processus de corrosion qui est ainsi autocatalysé.
Les ions hydroxyde de la phase interstitielle du béton
se combinent alors avec les ions ferreux Fe2+ ayant diffusé
hors de la piqûre tandis que la réaction cathodique est la
même que dans le cas de corrosion en absence de chlorure.
Tant que la solution à l'intérieur de la
piqûre est acide, la dissolution de l'acier reste active et les
piqûres croissent en profondeur. Ce mécanisme est
schématisé (Figure 5) par le modèle de PAGE et
al. Les piqûres continuent de croître si la concentration
locale en ions chlorure est suffisante (la concentration des chlorures doit
augmenter tandis que celle des ions hydroxyde doit diminuer). Si ce n'est pas
le cas, la repassivation de l'acier est possible.
Métal
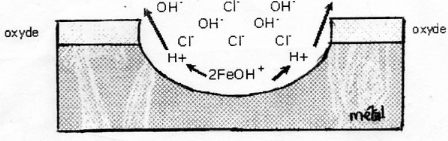
Figure 5 : Modèle de PAGE et al. Attaque de
l'acier par les ions chlorure
Ainsi, une trop faible concentration en ions chlorure dans la
solution interstitielle ne détruira pas le film passif. Il existe donc
une teneur critique en ions chlorure ou un rapport en concentration
chlorures/hydroxydes noté [Cl-] / [OH-].
Dès que le rapport [Cl-] / [OH-] dépasse le
seuil critique égal à 1, la solution est instable : elle
devient plus acide. Cette instabilité correspond à la formation
de produits de corrosion qui, en présence d'oxygène ne
protègent pas l'acier. Mais lorsque ce rapport est inférieur
à 1, les chlorures n'ont pas d'effet sur cette solution qui reste donc
stable.
Sur le plan pratique, les paramètres qui peuvent
influer sur cette teneur critique en chlorure sont : le dosage en ciment
(et le rapport Eau/Ciment), la valeur du pH, la nature du ciment (fixation de
chlorure, etc.) et celle des additifs éventuels (cendres, etc.), la
température moyenne, la teneur en oxygène et l'humidité du
béton. L'état d'enrouillement initial des armatures a
également un effet sur la valeur de la teneur critique en chlorure.
Le seuil critique est considéré atteint s'il y a
0,2 à 0,4% d'ions chlorure par rapport à la masse du ciment.
Il est à noter que la teneur en chlorure qui amorce
une corrosion n'est pas reliée à la vitesse de corrosion des
armatures, une fois dépassivées.
| 


