UNIVERSITE CHEIKH ANTA DIOP DE DAKAR

ECOLE INTER - ETATS DES SCIENCES ET MEDECINE
VETERINAIRES
(E.I.S.M.V.)

ANNEE 2008
N° 42
CONTRIBUTION A LA VACCINATION DES VOLAILLES CONTRE LA
MALADIE DE GUMBORO A L'AIDE DE VACCINS INACTIVES ET VIVANTS DISPONIBLES SUR LE
MARCHE DE DAKAR
THESE
Présentée et
soutenue publiquement le 31
Juillet 2008 à 12 heures devant la Faculté de
Médecine, de Pharmacie et d'Odonto-Stomatologie de Dakar pour obtenir le
grade de DOCTEUR VETERINAIRE
(DIPLÔME D'ETAT)
Par
Fabrice Juliot MOUGANG
Né le 8 Février 1979 à
LOUM-CAMEROUN
Jury
Président : M. Bernard Marcel
DIOP
Professeur à la Faculté de Médecine,
de Pharmacie et d'Odonto-Stomatologie de Dakar
Directeur et
Rapporteur M. Justin Ayayi AKAKPO
de Thèse:
Professeur à l'E.I.S.M.V de Dakar
Membre : M. Serge
NIANGORAN BAKOU
Maître de Conférences Agrégé à
l'E.I.S.M.V de Dakar

______
COMITE DE
DIRECTION
______
LE DIRECTEUR
Professeur Louis Joseph PANGUI
LES COORDONNATEURS
Professeur Moussa ASSANE
Coordonnateur des Etudes
Professeur Malang SEYDI
Coordonnateur des Stages et
de la Formation Post-Universitaire
Professeur Justin Ayayi AKAKPO
Coordonnateur Recherches et
Développement
Année Universitaire 2007 - 2008
PERSONNEL ENSEIGNANT
?PERSONNEL ENSEIGNANT EISMV
?PERSONNEL VACATAIRE (PREVU)
?PERSONNEL EN MISSION (PREVU)
?PERSONNEL ENSEIGNANT CPEV (PREVU)
A. DEPARTEMENT DES SCIENCES BIOLOGIQUES
ET PRODUCTIONS ANIMALES
CHEF DE DEPARTEMENT : Ayao MISSOHOU ;
Professeur
SERVICES
1. ANATOMIE-HISTOLOGIE-EMBRYOLOGIE
Serge N. BAKOU Maître de conférence
agrégé
Gualbert Simon NTEME ELLA Assistant
Camel LAGNIKA Docteur
Vétérinaire Vacataire
Paul Fabrice SHE Moniteur
2. CHIRURGIE -REPRODUCTION
Papa El Hassane DIOP Professeur
Alain Richi KAMGA WALADJO Assistant
Bilkiss V.M ASSANI Docteur
Vétérinaire Vacataire
Fabrice Juliot MOUGANG Moniteur
3. ECONOMIE RURALE ET GESTION
Cheikh LY Professeur
Adrien MANKOR
Assistant
Claude Michel WOMBOU TOUKAM Moniteur
4. PHYSIOLOGIE-PHARMACODYNAMIE-THERAPEUTIQUE
Moussa ASSANE Professeur
Rock Allister LAPO Assistant
Clarisse INGABIRE
Moniteur
5. PHYSIQUE ET CHIMIE BIOLOGIQUES ET
MEDICALES
Germain Jérôme SAWADOGO Professeur
Nongasida YAMEOGO Assistant
Sylvain HABIMANA Moniteur
6. ZOOTECHNIE-ALIMENTATION
Ayao MISSOHOU Professeur
Simplice AYESSIDEWEDE Assistant
Sosthène HABUMUREMYI
Docteur Vétérinaire Vacataire
Francklin Noël JAOVELO Moniteur
B. DEPARTEMENT DE SANTE PUBLIQUE ET
ENVIRONNEMENT
CHEF DE DEPARTEMENT : Rianatou BADA ALAMBEDJI,
Professeur
S E R V I C E S
1. HYGIENE ET INDUSTRIE DES DENREES
ALIMENTAIRES
D'ORIGINE ANIMALE (HIDAOA)
Malang SEYDI Professeur
Bellancille MUSABYEMARIYA Assistante
Khalifa Babacar SYLLA Assistant
Gérard Guéboul DIOP
Moniteur
David RAKANSOU Moniteur
2. MICROBIOLOGIE-IMMUNOLOGIE-PATHOLOGIE
INFECTIEUSE
Justin Ayayi AKAKPO Professeur
Mme Rianatou ALAMBEDJI Professeur
Philippe KONE
Assistant
Raoul BAKARI Docteur
Vétérinaire Vacataire
Abdel-Aziz ARADA IZZEDINE Docteur Vétérinaire
Vacataire
3. PARASITOLOGIE-MALADIES PARASITAIRES-ZOOLOGIE
APPLIQUEE
Louis Joseph PANGUI Professeur
Oubri Bassa GBATI Maître-assistant
Koffi Benoît AMOUSSOU Docteur Vétérinaire
Vacataire
Ayéko Dieudonné DOSSOU Moniteur
4. PATHOLOGIE MEDICALE-ANATOMIE PATHOLOGIQUE
-
CLINIQUE AMBULANTE
Yalacé Yamba KABORET Maître de
Conférences Agrégé
Yaghouba KANE Maître-assistant
Mireille KADJA WONOU Assistante
Hubert VILLON
Assistant
Medoune BADIANE Docteur Vétérinaire
(SOVETA)
Omar FALL
Docteur Vétérinaire (WAYEMBAM)
Alpha SOW Docteur
Vétérinaire (PASTAGRI)
Abdoulaye SOW Docteur Vétérinaire
(FOIRAIL)
Ibrahima WADE Docteur Vétérinaire
Vacataire
Charles Benoît DIENG Docteur Vétérinaire
Vacataire
Arouna NJAYOUNGAPAGNA Docteur
Vétérinaire Vacataire
François Xavier NDUNGUTSE Docteur
Vétérinaire Vacataire
5. PHARMACIE-TOXICOLOGIE
Félix Cyprien BIAOU Maître-Assistant
(en disponibilité)
Gilbert Komlan AKODA Assistant
Assiongbon TEKO AGBO Assistant
Egide ISHIMWE
Moniteur
Fara Hanta RATALATA RALAIVAO Monitrice
C. DEPARTEMENT COMMUNICATION
CHEF DE DEPARTEMENT : PROFESSEUR YALACE YAMBA
KABORET
SERVICE
1. BIBLIOTHEQUE
Mariam DIOUF Documentaliste
2. SERVICE AUDIO-VISUEL
Bouré SARR Technicien
D. SCOLARITE
El Hadji Mamadou DIENG Vacataire
Naomie KENMOGNE Docteur
Vétérinaire Vacataire
Aimable UWIZEYE
Moniteur
PERSONNEL VACATAIRE (Prévu)
1. BIOPHYSIQUE
Mamadou MBODJ Maître-Assistant
Faculté de Médecine UCAD
Boucar NDONG
Assistant Faculté de Médecine UCAD
2. BOTANIQUE
Kandouioura NOBA
Maître de Conférences (Cours)
Mame Samba MBAYE Assistant
(TP)
Faculté des Sciences et Techniques UCAD
3. AGRO-PEDOLOGIE
Fary DIOME
Maître-Assistant
Institut de Science et de la Terre (IST)
4. ZOOTECHNIE
Abdoulaye DIENG Docteur Ingénieur
Enseignant à ENSA - THIES
Léonard Elie AKPO
Maître de Conférences
Faculté des Sciences et Techniques
UCAD
Alpha SOW Docteur Vétérinaire Vacataire
5. H I D A O A
. NORMALISATION ET ASSURANCE
QUALITE
Mme Mame S. MBODJ NDIAYE Chef de la division
Agro-Alimentaire de
l'Institut Sénégalais de Normalisation
. ASSURANCE QUALITE - CONSERVE DES PRODUITS DE LA
PECHE
Abdoulaye NDIAYE Docteur Vétérinaire
AMERGER
6. ECONOMIE
Oussouby TOURE Sociologue
PERSONNEL EN MISSION (Prévu)
1. ANATOMIE
Mohamed OUSSAT
Professeur
Institut Agronomique et Vétérinaire
Hassan II Rabat (Maroc)
2. TOXICOLOGIE CLINIQUE
A. EL HRAIKI Professeur
Institut Agronomique et Vétérinaire
Hassan II Rabat (Maroc)
3. PATHOLOGIE MEDICALE
Marc KPODEKON
Maître de Conférences Agrégé
Université d'ABOMEY-CALAVI
(Bénin)
4. PARASITOLOGIE
Sahdou SALIFOU Maître de Conférences
Agrégé
Université d'ABOMEY-CALAVI
(Bénin)
5. BIOCHIMIE
Georges Anicet OUEDRAOGO Maître de Conférences
Agrégé
Université de BOBO-DIOULASSO
(Burkina Faso)
6. H.I.D.A.O.A
Youssouf KONE
Maître de conférences
Université de NOUAKCHOTT
(Mauritanie)
7. REPRODUCTION
Hamidou BOLY
Professeur
Université de BOBO-DIOULASSO
(Burkina Faso)
8. ZOOTECHNIE
Abdoulaye GOURO
Professeur
CIRDES de BOBO-DIOULASSO
(Burkina Faso)
PERSONNEL ENSEIGNANT CPEV (Prévu)
1. MATHEMATIQUES
Abdoulaye MBAYE Assistant
Faculté des Sciences et Techniques UCAD
2. PHYSIQUE
Issakha YOUM Maître de Conférences
(Cours)
Faculté des Sciences et Techniques UCAD
André FICKOU Maître-Assistant
(TP)
Faculté des Sciences et Techniques
UCAD
3. CHIMIE ORGANIQUE
Abdoulaye SAMB Professeur
Faculté des Sciences et Techniques
UCAD
4. CHIMIE PHYSIQUE
Abdoulaye DIOP Maître de
Conférences
Faculté des Sciences et Techniques
UCAD
Rock Allister LAPO Assistant
(TP)
EISMV - DAKAR
5. BIOLOGIE VEGETALE
Aboubacry KANE Maître-Assistant
(Cours)
Ngansomana BA Assistant Vacataire
(TP)
Faculté des Sciences et Techniques
UCAD
6. BIOLOGIE CELLULAIRE
Serge Niangoran BAKOU Maître de
conférences agrégé
EISMV - DAKAR
7. EMBRYOLOGIE ET ZOOLOGIE
Karomokho DIARRA
Maître de conférences
Faculté des Sciences et Techniques UCAD
8. PHYSIOLOGIE ANIMALE
Moussa ASSANE Professeur
EISMV - DAKAR
9. ANATOMIE COMPAREE DES VERTEBRES
Cheikh Tidiane BA Professeur
Faculté des Sciences et Techniques
UCAD
10. BIOLOGIE ANIMALE (T.P.)
Serge Niangoran BAKOU Maître de
conférences agrégé
EISMV - DAKAR
Oubri Bassa GBATI Assistant
EISMV - DAKAR
11. GEOLOGIE
. FORMATIONS SEDIMENTAIRES
Raphaël SARR Maître de
Conférences
Faculté des Sciences et Techniques UCAD
. HYDROGEOLOGIE
Abdoulaye FAYE Maître de Conférences
Faculté des Sciences et Techniques
UCAD
12. CPEV TP
Naomie KENMOGNE
Docteur Vétérinaire Vacataire
Aimable UWIZEYE
Moniteur
DEDICACES
Je dédie ce travail...
A l'Eternel mon DIEU, le détenteur du
savoir.
A mes très chers parents : mon
père Jean Claude TCHONGOUAHA et ma mère
Pauline MENPE.
En ce jour solennel, aucune dédicace
très chers parents, ne pourrait exprimer la profondeur des sentiments
que j'éprouve pour vous et la gratitude d'un fils qui s'est toujours
vanté de vous avoir comme père et mère.
Ni les mots, ni les paroles ne sauront
exprimer la profondeur de mon amour, de mon estime et de l'infinie
reconnaissance pour tous les sacrifices consentis avec dévouement pour
mon éducation et mes longues années d'études.
Vous m'avez toujours soutenu par votre
bonté et vos sacrifices dans les moments les plus difficiles.
Vos sacrifices constants pour mon
éducation, vos prières et vos conseils m'ont permis d'atteindre
le but désiré.
Que Dieu, le tout puissant, vous comble de
santé, de bonheur, de prospérité et vous accorde une
longue vie.
Que ce travail soit un remerciement et un
témoignage de ma reconnaissance et mon grand attachement.
A la mémoire de
ma grande mère DJOMO Marthe et ma grande soeur
DJOMO Yvette ;
Vous avez partagé avec moi les longues périodes
d'angoisse, d'incertitude et surtout d'espoir mais vous n'êtes plus
là pour partager avec moi les fruits de l'obstination. Que DIEU
(exalté soit-il) vous accueille dans ses paradis les plus
élevés.
A mes grandes soeurs : Mme
NZOUNDJA Lydie et Mme KEPMOU Clarisse.
Vous m'avez vu grandir et vous n'avez jamais cessé de
me soutenir et m'encourager dans mes efforts. Je ne saurais assez vous
remercier. Ce travail est aussi le votre.
A ma petite soeur chérie :
Pulchérie Niclaise SEUACHE.
J'espère avoir atteint aujourd'hui le but de ton
espérance. Tous mes remerciements pour ton amour, ta bonté et ton
soutien inlassable.
Sache que je t'aime.
A Josiane T. GOUHOUE.
Par ta présence, ton attention, ton amour, ton apport
à la réalisation de ce travail est inestimable. Pour cela je te
dédie ce travail. Le meilleur reste à venir...
A mes frères et soeurs :
Blériot Armand, Florine Laure, Alvine Mireille, Sandrine
Aimée, Mirabeau et Monique.
Que tous les liens sacrés qui nous unissent fortifient
et raffermissent notre famille. Recevez ce travail comme gaga de mon amour
fraternel, faites mieux que moi et soyez toujours humble dans la vie.
A la mémoire de
Monsieur NZOUNDJA Etienne.
La mort vous arraché si tôt à notre
affection. C'est en pensant à toute la joie que tu aurais
éprouvé aujourd'hui que j'ai eu la joie et le courage d'aller
jusqu'au bout. Rassures toi, tu vivras toujours dans mon coeur ; repose en
paix.
A ma tante Tata Monique, en
témoignage de ton affection et de tes conseils.
A mon oncle Tonton Ferdinand,
pour ton soutien et tes conseils.
A mes neveux et nièces :
Stéphane, Cyrille Magloire, Eric, Endurant, Liliane, Gislaine,
Jeannine, Guillène.
Les études restent pour toujours la clé de la
réussite. Puisse ce travail qui est aussi le votre, vous encourager
à faire plus.
A Monsieur KEPMOU
Apollinaire, pour ton attention et ton soutien indispensables.
A ma grande mère paternelle
SEUACHE Rebecca, merci pour ton amour.
A mon parrain Monsieur Jean
SIMO.
Tu m'as toujours fait savoir que la vie est combat et qu'on ne
pourrait jamais réussir sans sacrifices. Profonde gratitude.
A mes cousins et cousines,
Vous êtes si nombreux que je n'ose pas vous citer. Toute
mon affection
Au Gouvernement Camerounais
à travers le MINESUP pour le financement de mes études à
l'E.I.S.M.V. de DAKAR
A mes amis du Lycée de
Loum : SIMO Christian, EDIMO Ferdinand Bertrand, Njiki Alain
Bruno et Dr Pierre Michel KAMENI.
A tous mes compatriotes de la
35ème Promotion : Dr ZANGA, Dr HOULIBELE, Dr
RAKANSOU, Dr WOMBOU, Dr ETENE, Dr SHE, Dr TENE, Dr BELLA, Dr NKOA, Dr ISMA-IL,
Dr BADAI, Dr MOUNDJOA, Dr AZEBAZE, Dr BOFIA, DEMANOU et ANDELA.
A tous mes amis de
Dakar : Gilbert A., Gabriel T., ALKAISSOU, MIGUIRI, Marcel S.,
OUMATE, KERBAI, BELLO, Dr DOVONOU, Dr DOSSOU, Dr HOUNYO, Dr NKOLO, Dr ZOMBOU,
Dr AROUNA, Dr MOSSUS, Dr MOCTAR, Dr FEUSSON, Dr EDIMON, Dr DOMBOU, Contant S.,
Vitrice, DANGAR, Elie Michel KEDJO ; la liste n'est pas exhaustive.
Tous ces moments passés ensemble vont me manquer.
A toutes mes amies de
Dakar : Nathalie T., Rachèlle B., Sabine N.,
Françoise B., Maïmounatou, Angélique, Nadia, Laetitia, Dr
NAKURE, Dr ALICE M., Dr NODJIMADJI, Dr PENDA, Dr NAOMIE, Dr BILKISS, Francine
K., Elvire F., Viviane M., Suzy D., Mirabelle B., Khady, Dr Tening SENE,
Gaëlle T., Laurence, Agnès, Sylvie, Dembaye, Josiane, Marieme, et
toutes celles que j'ai pas cité.
Votre charmante compagnie m'a beaucoup fortifié.
A toute la 35è
promotion, je ne saurai pas citer de noms.
Nous avons connu les joies et les peines du combattant durant
ces cinq dernières années. Le « Véto »
nous a inculqué les valeurs de guerrier, et « Belgique
2007 » résume le travail, le courage, l'entente et la
solidarité.
A tous les étudiants de
l'A.E.V.D.
A mes frères de la Cameroonian
Veterinary Students Association (CAVESTAS).
A ma patrie le CAMEROUN et
à BANGOU mon village d'origine.
Au pays de l'hospitalité
légendaire, le Sénégal.
REMERCIEMENTS
Nos sincères remerciements :
· Au professeur Louis Joseph PANGUI et
à tous les enseignants de l'E.I.S.M.V. de Dakar pour
avoir tant contribuer à la réalisation de ma vocation.
· Au professeur Justin Ayayi AKAKPO
· Au professeur Moussa ASSANE
· Au professeur Yalacé Yamba KABORET, professeur
accompagnateur de la 35ème promotion
· Au professeur Rianatou BADA ALAMBEDJI
· Au professeur Serge Niangoran BAKOU
· Au professeur Papa El Hassane DIOP
· Au Docteur Alain Richi KAMGA WALADJO
· A Monsieur Pierre HAZETTE, Parrain de la
35ème promotion
· Au Docteur Arada Izzedine ABDEL-AZIZ
· A Monsieur Doudou DIAGNE, Technicien du Laboratoire
d'Histopathologie de l'E.I.S.M.V.
· A Monsieur Moussa SENE, Technicien du Laboratoire de
M.I.P.I. de l'E.I.S.M.V.
· A Madame Mariam DIOUF, bibliothécaire à
l'E.I.S.M.V.
· A Lise Christelle LEUMENI
· A Cyrille T. DEMANOU
· A tous ceux que je n'ai pas cité, et qui de
près ou de loin ont contribué à la réalisation de
ce travail.
Trouvez dans ce travail une dette qui, malheureusement de part sa
nature, n'est pas remboursable.
A NOS MAITRES ET JUGES
A notre maître et président du
jury, Monsieur Bernard Marcel Diop
Professeur à la faculté de Médecine, de
pharmacie et d'Odonto-Stomatologie de Dakar ;
Vos grandes qualités scientifiques et votre
renommé sont connus de tous. C'est donc un immense honneur pour nous de
vous voir présider le jury de notre soutenance de thèse.
Hommage respectueux et sincères remerciements.
A notre maître et directeur de thèse,
Monsieur Justin Ayayi AKAKPO
Professeur à l'E.I.S.M.V.de Dakar ;
Vous m'avez inspiré et donné les moyens de
réaliser ce travail. L'enseignement que nous avons reçu de vous
au cours de notre formation nous guidera sans aucun doute dans la vie
quotidienne et professionnelle.
Votre rigueur intellectuelle, vos remarques pertinentes, vos
conseils avisés ont donné à ce travail son cachet
scientifique.
Votre simplicité, vos compétences et votre
goût de la perfection dans le travail, ne nous ont échappé.
Nous en gardons un souvenir instructif.
Acceptez nos remerciements et votre reconnaissance pour tout
ce que vous faites pour nous.
A notre maître et juge, Monsieur
Serge Niangoran BAKOU
Maître de conférences Agrégé
à l'E.I.S.M.V. de Dakar ;
Votre disponibilité à l'égard des
étudiants est assurément la manifestation de vos qualités
humaines et professionnelles. Nous avons admiré la clarté de vos
enseignements tout au long de notre formation.
Votre sens de rigueur scientifique et méthode
pragmatique nous ont toujours émerveillé
Sincère reconnaissance.
« Par délibération la
faculté de Médecine, de pharmacie et d'Odonto-stomatologie et
l'Ecole Inter-Etats des sciences et de Médecine
Vétérinaires de Dakar ont décidé que les opinions
émises dans les dissertations qui leur seront présentées,
doivent être considérées comme propre à leurs
auteurs et qu'elles n'entendent donner aucune approbation ni improbation.»
Liste des figures
Figure 1 : Carte du
Sénégal
............................................................4
Figure 2 : Pathogénie de la
maladie de Gumboro..................................28
Figure 3 : Courbe
caractéristique de mortalité de la forme aiguë de la maladie
de Gumboro
..............................................................................31
Figure 4: Carte de Dakar
........................................... ..................42
Figure 5: Evolution du titre en
anticorps du lot1 de la bande N°1 de poulets de
chair.......................................................................................54
Figure 6: Evolution du titre en
anticorps du lot2 de la bande N°1 de poulets de
chair.......................................................................................55
Figure 7 : Evolution du titre en
anticorps du lot témoin de la bande N°1 de poulets de chair
..........................................................................55
Figure 8 : Evolution des titres
en anticorps de la bande NO1 de poulets de chair
.............................................................................................56
Figure 9: Evolution du titre en
anticorps du lot1 de la bande N°2 de poulets de
chair.......................................................................................57
Figure 10 : Evolution du titre en
anticorps du lot témoin de la bande N°2 de poulets de
chair..........................................................................58
Figure 11 : Evolution des titres
en anticorps de la bande NO2 de poulets de chair
.......................................................................................59
Figure 12 : Evolution du titre en
anticorps du lot1 de la bande de
coquelets..................................................................................61
Figure13 : Evolution du titre en
anticorps du lot témoin de la bande de
coquelets................................................................................
..61
Figure14 : Evolution des titres
en anticorps de la bande de coquelets...........62
Liste des tableaux
Tableau I : Origine des
poussins mis en élevage au Sénégal en
2006.......................................................................................11
Tableau II : vaccins utilisés
...........................................................43
Tableau III : Protocole de vaccination
de la bande NO1 de poulets de
chair.......................................................................................44
Tableau IV : Protocole de vaccination
de la bande NO2 de poulets de
chair.......................................................................................45
Tableau V : Protocole de vaccination
de la bande de coquelets..................46
Tableau VI: Dates de
prélèvements du sang de la bande NO 1 de
chairs.......................................................................................48
Tableau VII: Dates de
prélèvements du sang de la bande NO2 de
chairs.......................................................................................49
Tableau VIII: Dates de
prélèvements du sang de la bande de
coquelets..................................................................................50
Tableau IX : Résultats
sérologiques de la bande NO1 de poulets de
chair.......................................................................................53
Tableau X : Résultats
sérologiques de la bande NO2 de poulets de
chair.......................................................................................57
Tableau XI : Résultats
sérologiques de la bande de
coquelets..................................................................................60
Liste des Abréviations
ARN : Acide Ribonucléique
CAM : Complexe Avicole de Mbao
CAMAF : Compagnie Africaine de
Maraîchage d'Aviculture et D'Arboriculture Fruitière
DO : Densité Optique
DPS : Direction de la Prévision
et de la Statistique
EISMV : Ecole Inter-Etats des Sciences
et de Médecine Vétérinaires
ELISA : Enzyme Linked Immunosorbent
Assay
EOPS : Exempte d'Organismes
Pathogènes spécifiques
FAFA : Fédération des
Acteurs de la Filière Avicole
FCFA : Franc de la communauté
Financière Africaine
IBDV : Infectious Bursal Disease
Virus
LNRV : Laboratoire Nationale d'Elevage
et de Recherche Vétérinaires
MIPI : Microbiologie
Immunologie Pathologie Infectieuse
NH3 : Ammoniac gaz
NMA : Nouvelle Minoterie Africaine
PIB : Produit Intérieur Brut
SEDIMA : Sénégalaise de
Distribution de Matériel Avicole
SEEMAAP-Industries :
Société d'exploitation des EMAAP-Industries
UNAFA : Union nationale des acteurs de
la Filière Avicole
USA: United State of America
VI: Vaccin Inactivé
VV : Vaccin Vivant
TABLE DES MATIERES
INTRODUCTION
1
Première Partie
20
CHAPITRE 1 : GENERALITES SUR L'ELEVAGE
AVICOLE DANS LA REGION DE DAKAR
20
1.1. PRESENTATION DE LA REGION DE DAKAR
20
1.1.1. SITUATION GEOGRAPHIQUE
20
1.1.2. RELIEF
20
1.1.3. CLIMAT
20
1.1.3.1. Les vents dominants
20
1.1.3.2. La pluviométrie
20
1.1.3.3. Température
20
1.1.3.4. L'hygrométrie
20
1.1.4. MILIEU HUMAIN
20
1.2. L'ELEVAGE AVICOLE DANS LA REGION DE
DAKAR
20
1.2.1. SYSTEMES DE PRODUCTION
20
1.2.1.1. SYSTEME TRADITIONNEL
20
1.2.1.2. SYSTEME MODERNE
20
1.2.1.2.1. Evolution des effectifs des
volailles mis en élevage
20
1.2.1.2.2. Caractéristiques de l'aviculture
moderne
20
1.2.1.2.3. Origine des poussins
20
1.2.1.2.4. Différents types de
production
20
1.2.1.2.4.1. Production de viande de volaille
20
1.2.1.2.4.2. Production d'oeufs de consommation
20
1.2.1.2.5. Organisation de la production
20
1.2.1.2.6. Circuits de commercialisation d'oeufs et
de poulets de chair
20
1.2.1.2.7. Niveaux de consommation d'oeufs et de
poulets de chair au Sénégal
20
1.2.2. CONTRAINTES DE L'ELEVAGE AVICOLE DANS LA
REGION DE DAKAR
20
1.2.2.1. CONTRAINTES ZOOTECHNIQUES
20
1.2.2.2. CONTRAINTES TECHNICO-ECONOMIQUES
20
1.2.2.3. CONTRAINTES SANITAIRES
20
1.2.2.4. CONTRAINTES PATHOLOGIQUES (BULDGEN et
coll., 1992)
20
CHAPITRE 2 : LA MALADIE DE GUMBORO
20
2.1. GENERALITES
20
2.1.1. DEFINITION
20
2.1.2. IMPORTANCE
20
2.1.3. HISTORIQUE
20
2.1.4. ESPECES AFFECTEES
20
2.1.5. REPARTITION GEOGRAPHIQUE
20
2.2. ETIOLOGIE
20
2.2.1. MORPHOLOGIE ET STRUCTURE
20
2.2.2. CARACTERISTIQUES PHYSICO-CHIMIQUES ET
CLASSIFICATION
20
2.2.3. CARACTERES CULTURAUX
20
2.2.4. PROPRIETES BIOLOGIQUES
20
2.2.4.1. Pouvoir pathogène
20
2.2.4.2. Pouvoir antigénique et
immunogène
20
2.3. PATHOGENIE
20
2.3.1. MECANISME PATHOGENIQUE
20
2.3.2. CONSEQUENCES PHYSIOPATHOLOGIQUES
20
2.4. EPIDEMIOLOGIE
20
2.4.1. EPIDEMIOLOGIE DESCRIPTIVE
20
2.4.2. EPIDEMIOLOGIE ANALYTIQUE
20
2.4.3. EPIDEMIOLOGIE SYNTHETIQUE
20
2.5. DIAGNOSTIC DE LA MALADIE DE
GUMBORO
20
2.5.1. DIAGNOSTIC SUR LE TERRAIN
20
2.5.1.1. ELEMENTS CLINIQUES ET
EPIDEMIOLOGIQUES
20
2.5.1.2. ELEMENTS NECROPSIQUES
20
2.5.1.3. DIAGNOSTIC DIFFERENTIEL
20
2.5.2. DIAGNOSTIC DE LABORATOIRE
20
2.5.2.1. DIAGNOSTIC HISTOPATHOLOGIQUE
20
2.5.2.2. DIAGNOSTIC VIROLOGIQUE
20
2.5.2.2.1. L'inoculation
20
2.5.2.2.2. L'immunofluorescence
20
2.5.2.3. DIAGNOSTIC SEROLOGIQUE
20
2.6. METHODES DE LUTTE
20
2.6.1 TRAITEMENT
20
2.6.2. PROPHYLAXIE
20
2.6.2.1. SANITAIRE
20
2.6.2.2. MEDICALE
20
CHAPITRE 1 : MATERIEL ET METHODES
20
1.1ZONE ET PERIODE D'INVESTIGATION
20
1.2. MATERIEL
20
1.2.1. MATERIEL ANIMAL
20
1.2.2. VACCINS UTILISES
20
1.2.3. MATERIEL DE PRISE DE SANG
20
1.3. METHODES DE TRAVAIL
20
1.3.1. PROTOCOLES DE VACCINATION
20
1.3.1.1. Bandes de poulets de chair
20
1.3.1.2. Bande de coquelets
20
1.3.2. TECHNIQUE DE PRELEVEMENTS
20
1.3.2.1. Bandes de poulets de chair
20
1.3.2.2. Bande de coquelets
20
1.3.3. METHODES DE LABORATOIRE
20
1.3.3.1. Technique de récolte du
sérum
20
1.3.3.2. Méthode d'analyse
sérologique
20
1.3.3.2.1 Définition - Principe
20
1.3.4. ANALYSES STATISTIQUES
20
1.3.5. INTERPRETATIONS DE RESULTATS
20
CHAPITRE 2 : RESULTATS SEROLOGIQUES
20
2.1. RESULTATS DE LA VACCINATION DES
POULETS DE CHAIR
20
2.2. RESULTATS DE LA VACCINATION DE
COQUELETS
20
CHAPITRE 3 : DISCUSSION ET RECOMMANDATIONS
20
3.1. DISCUSSION
20
3.1.1. DISCUSSION DE LA METHODOLOGIE
20
3.1.1.1. ZONE ET PERIODE D'ETUDE
20
3.1.1.2. CHOIX DE L'ELEVAGE
20
3.1.1.3. CHOIX DES ANIMAUX
20
3.1.1.4. VACCINS UTILISES
20
3.1.1.5. MODE D'ADMINISTRATION DES VACCINS
20
3.1.1.6. METHODE D'ANALYSE
20
3.1.2. DISCUSSION DES RESULTATS
20
3.1.2.1. RESULTATS SELON LE MODE DE VACCINATION
20
3.1.2.1.1. Vaccination avec le vaccin vivant
atténué
20
3.1.2.1.2. Vaccination avec le vaccin
inactivé
20
3.1.2.1.3. Vaccination avec une association vaccin
vivant atténué et vaccin inactivé
20
3.1.2.2. RESULTATS COMPARATIFS DES BANDES
20
3.2. RECOMMANDATIONS
20
3.2.1. AUX CHERCHEURS
20
3.2.2. AUX PROPRIETAIRES DES COUVOIRS
20
3.2.3. AUX ELEVEURS
20
3.2.4. AU POUVOIR PUBLIC
20
CONCLUSION GENERALE
20
BIBLIOGRAPHIE
20
ANNEXES
INTRODUCTION
La filière avicole, particulièrement
l'aviculture moderne basée sur l'exploitation des poulets de chair pour
la production de viande et des poules pondeuses pour la production des oeufs
occupe une place de choix dans le secteur de l'élevage au
Sénégal.
La situation démographique croissante chaque
année, la production locale de viande de volaille et d'oeufs de
consommation augmente aussi. En effet, entre 2005 et 2006 la production
nationale a connu une hausse de 27 % générant à la vente
au détail, des chiffres d'affaires de 17 milliards et de 18 milliards de
francs CFA, respectivement pour la viande de volaille et les oeufs de
consommation. Ce dernier chiffre dénote de l'effectif important de
poussins « ponte » mis en élevage pour la production
des oeufs suite à l'arrêt d'importation des poussins (
DIREL/CNA,2006).
La région de Dakar regroupe l'essentiel de cette
activité. Malheureusement dans sa pratique, l'intensification de cette
production rencontre beaucoup de contraintes qui sont non seulement techniques,
institutionnelles (HABRYARIMANA, 1998), économiques (AHAMET, 2004 ;
BAKARI, 2006) mais aussi pathologiques (M'BAO, 1994.BIAOU, 1995 ;
ABDEL-AZIZ, 2007).
Ces contraintes constituent un frein au développement
de cette production et par conséquent à l'auto insuffisance en
protéines animales (viandes de volailles) et d'origine animale
(oeufs).
Les maladies infectieuses aviaires sont multiples et
variées. Parmi celles-ci la maladie de Gumboro qui représente
une véritable entrave à la rentabilité des élevages
à cause de la mortalité et surtout de la morbidité qu'elle
provoque au sénégal. De prévalence relativement
élevée, c'est la maladie virale de plus en plus fréquente
au Sénégal et qui fait payer un lourd tribut à
l'aviculture sénégalaise.
Des mesures de lutte on été entreprises pour
éradiquer cette maladie. Outre les mesures sanitaires
préconisées et qui par à elles seules ne suffisent pas
dans une zone d'enzootie comme la région de Dakar, les mesures
médicales sont constamment sollicitées.
Des études épidémiologiques et
expérimentales ont été menées sur cette maladie
(DIALLO,1978;TIAMA,1990;M'BAO,1994;BIAOU,1995;TCHAMDJA,2001;AHAMET,2004 ;BAKARI,2006 ;ABDEL-AZIZ,2007).
Mais, malgré la vaccination, la maladie de Gumboro continue de
sévir dans les élevages. Les raisons de ces échecs
à la vaccination ne sont pas bien connues.
L'objectif général de notre travail est de
promouvoir la rentabilité de l'élevage avicole par une
maîtrise de la couverture sanitaire des oiseaux. L'objectif
spécifique est d'apprécier la couverture immunitaire des oiseaux
dans les élevages suite à l'application de la prophylaxie
médicale, et de proposer un protocole de prophylaxie médicale
fiable.
Le présent travail comporte deux parties. La
première partie qui est bibliographique est consacrée aux aspects
généraux de l'élevage avicole dans la région de
Dakar ; aux généralités sur la maladie de Gumboro. La
deuxième partie présentera nos travaux qui portent sur
l'évaluation des protocoles de vaccination suite à la protection
vaccinale sur les bandes expérimentales.
Les résultats obtenus nous permettront de tirer des
conclusions et de faire des recommandations.
Première Partie
Données bibliographiques sur l'aviculture dans
la région de Dakar ET la maladie de Gumboro.
CHAPITRE 1 : GENERALITES SUR L'ELEVAGE AVICOLE DANS LA
REGION DE DAKAR
Ce chapitre est consacré à la
présentation de la région de Dakar, puis à la situation
actuelle de l'élevage avicole et les problèmes auxquels il est
confronté.
1.1. PRESENTATION DE LA REGION DE DAKAR
1.1.1. SITUATION GEOGRAPHIQUE
Pays de l'Afrique de l'Ouest, la république du
Sénégal ouverte sur l'océan Atlantique est un carrefour de
grandes routes maritimes et aériennes. Le Sénégal est
compris entre les 12° et 16°30 latitude Nord et entre les 11°30
et 17°30 longitude Ouest (INSTITUT GEOGRAPHIQUE NATIONAL, 1977). Il
couvre une superficie de 197 161 km² et est limité au
Nord par la Mauritanie, à l'Est par le Mali, au Sud-est par la
Guinée et au Sud par la Guinée-Bissau. La Gambie constitue une
enclave tout en longueur dans le sud du Sénégal, à
l'intérieur duquel elle pénètre profondément.
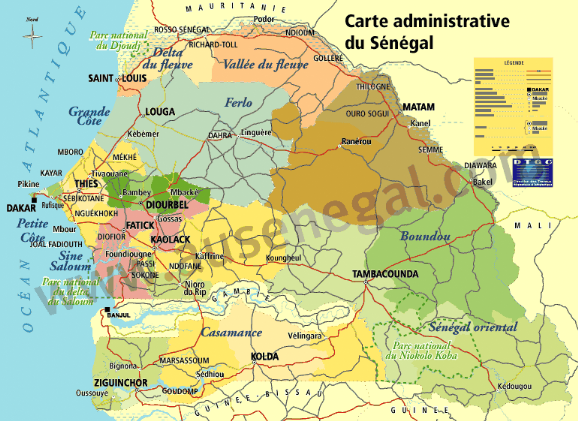
Figure 1 : Carte du
Sénégal (source : -
www.au-senegal.com/-Geographie-.htlm
)
Située à l'extrême Ouest du
Sénégal et du continent africain, la région de Dakar se
présente comme une presqu'île de 550 km², représentant
ainsi seulement 0,28% de la superficie nationale. Elle est contiguë
à l'Est par la région de Thiès et entourée par
l'océan Atlantique sur ses limites Nord, Ouest et Sud. La région
de Dakar est divisée en quatre départements :
Ø département de Dakar
Ø département de Guediawaye
Ø département de Pikine
Ø département de Rufisque
Cette situation géographique fait que cette
région présente des caractéristiques climatiques
particulières, notamment un microclimat de type côtier.
1.1.2. RELIEF
Le relief sénégalais, presque plat est
constitué de vastes plaines avec une côte basse et sablonneuse,
rocheuse par endroit. Les altitudes sont partout inférieures à
150 m sauf au Sud-est dans la région de Tambacouda (JEUNE AFRIQUE,
2000).
La région de Dakar est représentée par
une bande côtière à dépression interdunaire humide
communément appelée zone des « Niayes ». Elle
s'étend de Dakar à Saint-Louis et couvre une superficie d'environ
183 km².
Cette région présente un microclimat propice
à l'élevage en général et à l'aviculture en
particulier.
1.1.3. CLIMAT
Les grands traits climatiques découlent de l'influence
entre de nombreux facteurs géographiques. Au Sénégal, le
climat est de type sahélo-soudanien dans son ensemble. Il existe des
spécificités propres à chaque région.
La région de Dakar, de part sa position par rapport
à la mer présente une évolution climatique
différente de celles des autres régions du pays.
1.1.3.1. Les vents dominants
La connaissance des vents dominants d'une région ou
d'une localité est d'une importance capitale en aviculture. En effet, en
plus de son impact sur la ventilation, le vent peut jouer un rôle dans le
transport des agents pathogènes et des substances néfastes au
confort des volailles.
La région de Dakar est exposée à trois
types de courants d'air aux caractéristiques thermiques,
hygrométriques et directionnelles différentes. D'après
JEUNE AFRIQUE, 2000, Ces dernières sont représentées
par :
· L'Alizé maritime : issu des archipels des
Açores, c'est un vent humide et frais qui balaie les régions
côtières en apportant un climat relativement doux. Il souffle du
Nord vers le Nord-Ouest pendant les mois de Novembre à Mai, mais
n'apporte pas de précipitations.
· L'Alizé continental ou Harmattan : c'est un
vent irrégulier particulièrement chaud et sec qui souffle de
l'Est vers le Nord-Est pendant une période assez longue de
l'année, allant du mois de mars jusqu'au début de la saison des
pluies. Ce vent transporte la poussière et du sable, qui jouent un
rôle dans la dissémination de certaines maladies respiratoires,
surtout chez les volailles.
· La Mousson : elle prend naissance au sud de
l'équateur au niveau de l'anticyclone de Sainte-Hélène.
c'est un vent très humide et chaud qui apporte la pluie du Sud-Ouest de
juin à novembre.
L'alternance de ces trois types de vents dont les
déplacements sont facilités par la platitude du relief, favorise
la saisonnalité du climat.
1.1.3.2. La pluviométrie
La pluviométrie est caractérisée par deux
types de saisons :
· La saison sèche ou non pluvieuse, qui n'est
sèche qu'à l'intérieur du pays ; la côte
bénéficiant d'une humidité relativement
élevée du fait de l'influence de la mer.
· La saison pluvieuse, chaude et humide coïncide
avec l'arrivée de la mousson qui envahit progressivement le pays. Les
précipitations s'installent du Sud vers le Nord.
Malgré sa position par rapport à la mer, la
région de Dakar reçoit généralement une faible
quantité d'eau. Comme le soulignent FARUQUI et coll. 2006, 450mm d'eau
ont été enregistrés en 2002 ; les plus grandes
quantités l'ont été au mois de septembre.
1.1.3.3. Température
La température est l'un des paramètres
très importants en élevage avicole, car elle influence la prise
alimentaire et constitue une source de stress chez les volailles.
La région de Dakar, par sa situation est la
région la plus fraîche du pays et par conséquent, la plus
propice à l'aviculture (ITAVI, 1996). Elle dépasse rarement
30°C.
1.1.3.4. L'hygrométrie
L'hygrométrie est la quantité d'eau ou de vapeur
d'eau contenue dans l'air ambiant. Elle représente un facteur important
dans l'implantation d'un élevage avicole à cause de ses effets
directs ou indirects sur les oiseaux. Le degré d'hygrométrie
détermine en partie la quantité d'eau consommée par les
oiseaux. La région de Dakar connaît une humidité constante
qui se manifeste même en saison sèche par des condensations
nocturnes fréquentes.
1.1.4. MILIEU HUMAIN
En 2007, la population du Sénégal était
estimée à 12,5 millions d'habitants, soit une densité
moyenne de 65 habitants au km2 (SENEGAL - MSN Encarta, 2008). Elle
est inégalement repartie sur le territoire et compte une vingtaine
d'ethnies.
La région de Dakar abrite les 25% de cette population
avec un taux de croissance de 3.69 % de 1998 à 2001.le taux
d'urbanisation est de 43 % en 1999 et la densité est de 4231 habitants
au km² (SENEGAL/MEF/DPS, 2001)
La zone des NIAYES comprend plus de 65% de la population
sénégalaise d'après les statistiques de la Direction de la
Prévision et de la Statistique (DPS) cités par AHAMET (2004).
Ce facteur démographique associé aux conditions
climatiques favorables, fait de la région de Dakar une place de choix
pour le développement de l'aviculture moderne (HABAMENSHI, 1994).
Ceci s'explique par l'installation d'un grand nombre de
fermes avicoles modernes dans la région de Dakar.
1.2. L'ELEVAGE AVICOLE DANS LA REGION DE
DAKAR
1.2.1. SYSTEMES DE PRODUCTION
L'élevage avicole au Sénégal contribue
pour 30 % au Produit Intérieur Brut (PIB) du secteur primaire et 6 % au
Produit Intérieur Brut global (SENEGAL/MAE, 2001). L'aviculture est
pratiquée selon un mode traditionnel ou un mode moderne.
1.2.1.1. SYSTEME TRADITIONNEL
L'aviculture traditionnelle est un type d'élevage
pratiqué essentiellement en milieu rural sous un mode extensif où
chaque famille paysanne possède un effectif relativement faible de
poules (RAVELSON, 1990). La volaille est élevée en liberté
autour des concessions et des techniques employées sont rudimentaires.
Il n'y a pas de spécialisation de la production. Ce système
traditionnel exploite les races locales et se caractérise par un apport
minime voire nul d'intrants (aliments, médicaments) et une faible
productivité : une poule locale produit en moyenne 40 à 50
oeufs par an et pèse environ 1,2 kg à 26 semaines
d'âge ; un coq de même age pèse 1,4 kg (BULDGEN et
coll., 1996). Ces productions sont pour l'essentiel destinées à
l'autoconsommation ; les ventes sont occasionnelles.
Au Sénégal les races locales sont
estimées à 19.542.683 têtes. Cet effectif a
progressé de 3,5 % entre 2000 et 2001 (SENEGAL/MAE, 2001). La couverture
sanitaire moderne en aviculture traditionnelle est presque inexistante, mais
lorsqu'une maladie apparaît, les soins se résument en
l'administration des produits de la pharmacopée traditionnelle. C'est
ainsi que les extraits de piment ou de feuilles et d'écorces
d'Azadirachta indica dilués dans l'eau de boisson sont utilisés
comme vermifuges (BULGEN et al, 1992).
1.2.1.2. SYSTEME MODERNE
Secteur en expansion, l'élevage moderne est
développé autour des centres urbains en raison de l'existence
d'un grand marché de consommation. Il exige un niveau d'investissement
et une organisation des différents intervenants.
Dans ce système moderne, on distingue deux types
d'élevages: élevage industriel et élevage semi industriel
ou amélioré.
L'élevage industriel se définit d'après
LISSOT cité par KOE (2001) comme un établissement qui
possède des effectifs importants, qui utilise des poussins d'un jour
provenant des multiplicateurs des souches sélectionnées, qui
nourrit les volailles avec des aliments complets ou des aliments
supplémentés et qui pratique des mesures de lutte (prophylaxie,
traitement). Ce type d'élevage utilise des équipements modernes
et des techniques perfectionnées en ce qui concerne les
différentes opérations.
En tenant compte de cette définition, plusieurs auteurs
s'accordent sur le fait qu'il existe peu d'élevages de ce type dans la
région de Dakar. Toutefois, l'élevage industriel est à ses
débuts avec l'exemple de la Société de Distribution du
Matériel Avicole (SEDIMA).
L'élevage moderne pratiqué dans la région
de Dakar reste du type semi industriel (GUEYE, 1999). Il utilise des poussins
d'un jour importés d'Europe ou produits au Sénégal par des
couvoirs de la Société de Distribution du Matériel
Avicole (SEDIMA), la Compagnie Africaine de Maraîchage d'Aviculture
et d'Arboriculture Fruitière (CAMAF) et le Complexe Avicole de Mbao
(CAM) entre autres.
La plus grande productivité de l'élevage
semi-industriel par rapport à l'élevage traditionnel justifie
notre intérêt pour le secteur moderne sur lequel portera la suite
de notre travail
1.2.1.2.1. Evolution des effectifs des volailles mis
en élevage
L'effectif de l'élevage avicole moderne est
passé de 4 955 651 unités à 8 568 527
unités entre 1997 et 2006.
En 2004, l'élevage avicole dit semi-industriel est
composé de 1 289 788 poussins ponte et de 3 994 879 poussins de chair.
Ainsi 96 % des poussins retrouvés dans la filière avicole
sénégalaise sont issus de la production locale, et les 4%
restants proviennent de l'importation (SENEGAL.ME.CNA, 2007). L'annexe I
présente les détails de ces effectifs.
En 2006, il n'y a pas eu d'importations de poussins chair ou
ponte. La production locale représente 8 568 527 sujets par rapport
à l'année 2005 qui était de 6 752 167.
Le nombre total de poussins mis en élevage a subi une
hausse en valeur absolue de 1 816 360 sujets par rapport à 2005,
soit 27 % en valeur relative.
1.2.1.2.2. Caractéristiques de l'aviculture moderne
L'aviculture moderne utilise des races ou souches
améliorées (annexe II), ces dernières reçoivent un
aliment de qualité et en quantité précise. En outre, elles
bénéficient d'une protection sanitaire et leurs logements sont
aussi bien contrôlés.
En 2001 l'effectif total de volaille (race locale et
améliorée) est passé à 25.658.000 sujets contre
24.495.000 sujets en 2000 soit une hausse de 4,7 %. L'élevage
traditionnel est estimé à 19.542.683 sujets et l'élevage
moderne à 6.115.317 sujets en 2001 (SENEGAL.MAE, 2001).
L'évolution des effectifs de volailles au Sénégal est
caractérisée par une croissance progressive de la production
locale (SENEGAL.ME.CNA, 2006).
1.2.1.2.3. Origine des
poussins
Les volailles mises en élevage en 2006 ont toute une
origine sénégalaise (tableau I). La part de la production
nationale de poussins nés au Sénégal (poussins nés
des oeufs à couvés importés et poussins 100%
sénégalais) a connu une hausse par rapport à
l'année 2005, avec un taux de 100% en 2006 contre 97,4% en 2005 à
cause de l'arrêt des importations de poussins d'un jour.
La part des poussins 100% sénégalais a connu un
hausse par rapport à l'année précédente 2005soit
une valeur absolue de 366 021.
Tableau I : Origine des poussins mis en
élevage au Sénégal en 2006
|
Type de poussins
|
commentaires
|
Quantités
|
Pourcentage (%)
|
|
Poussins importés
|
Importés vivant à 1 jour
|
0
|
0
|
|
Poussins nés d'oeufs à couver importés
|
Déterminé en appliquant un taux
d'éclosion de 80% sur les 9 614 630 oeufs importés de
janvier à décembre 2006
|
7 691 704
|
81
|
|
Poussins 100% sénégalais
|
Nés de reproducteurs élevés au
Sénégal
|
1 774 804
|
19
|
|
Total
|
|
9 466 508
|
100
|
SOURCE : SENEGAL.ME.CNA, 2007
1.2.1.2.4. Différents types de
production
L'aviculture moderne connaît trois types de
spéculations à savoir :
· la spéculation « chair »
avec des élevages qui ne produisent que des poulets de chair ;
· la spéculation « ponte »
avec des élevages qui ne produisent que des pondeuses ;
· la spéculation « mixte »,
qui est l'association des deux spéculations
précédentes.
Actuellement, l'élevage des reproducteurs de souches
améliorées s'est ajouté à ces trois
opérations précédentes.
1.2.1.2.4.1. Production de viande de
volaille
La production nationale de viande de volailles industrielles,
estimée à partir des effectifs de souches
améliorées de poussins « chair » mis en
élevage en 2004, 2005 et 2006 et des pondeuses reformées est
résumée dans l'annexe III.
A ces effectifs, on applique les paramètres
zootechniques qui sont : le taux de mortalité et le poids moyen
à l'abattage (HABYARIMANA, 1998).
La production nationale de la viande de volailles a
été de 11 229 tonnes en 2006, représentant à la
vente au détail un chiffre d'affaire de l'ordre de 17 milliards de
francs CFA. Cette production a connu une hausse en valeur absolue de 1936
tonnes soit 23 % en valeur relative par rapport à l'année 2005.
(SENEGAL/ME/CNA, 2007).
1.2.1.2.4.2. Production d'oeufs de
consommation
La production nationale d'oeufs de consommation a
été estimée d'une part à partir de poussins
« ponte » mis en place entre mars 2004 et juin 2006 (qui
ont permis de déterminer un effectif moyen de 1 424 814 pondeuses
en production) et d'autre part, en tenant compte de certains paramètres
:
· taux de mortalité : 7 % à l'entrée
en ponte ;
· taux de mortalité : 3 % pendant la
période de ponte ;
· durée d'élevage avant l'entrée en
ponte : 6 mois ;
· performance annuelle d'une pondeuse : 280 oeufs
par poule et par an ;
· prix de l'oeuf : 50 francs CFA l'unité.
La production nationale d'oeufs de consommation a
été de 371 millions d'unité en 2006, soit un chiffre
d'affaire à la vente au détail de l'ordre de 18 milliards de
francs CFA.
Cette production d'oeufs a connu une croissance progressive
par rapport à l'année 2005, soit une valeur absolue de 47
millions d'unités (SENEGAL.ME.CNA, 2007). Ceci s'explique par le nombre
important de reconversion d'éleveurs de poulets de chair en
éleveurs de poules pondeuses. Cette production d'oeufs est
essentiellement assurée par l'aviculture moderne car le poids de
l'aviculture traditionnelle en production d'oeufs est presque nul. Ces
différents types de productions sont pratiqués dans un cadre bien
organisé.
Cependant, l'arrêt des importations de produits avicoles
(poussins d'un jour, d'oeufs de consommation et viande de volailles) a eu un
impact positif sur les importations d'oeufs à couvés. Pour
l'année 2006, on a un cumul de 9 614 630 oeufs à
couvés importés par la filière. Ce chiffre constitue un
record et représente presque le double de l'année 2005 qui
était de 4 834 550 oeufs à couvés. Ce qui
confirme encore une fois de plus la demande importante et croissante en
poussins d'un jour.
1.2.1.2.5. Organisation de la production
La filière avicole est l'une des rares filières
agroalimentaires où il existe une structure professionnelle relativement
bien organisée. Deux fédérations coexistent : l'Union
Nationale des Acteurs de la Filière Avicole (UNAFA) qui
représente les gros producteurs tandis que la Fédération
des Acteurs de la Filière Avicole (FAFA) est le porte parole des petits
éleveurs.
L'aviculture moderne est un secteur organisé dans
lequel interviennent divers acteurs : les sélectionneurs, les
accouveurs, les éleveurs de reproducteurs, les producteurs, les
provendiers et les encadreurs.
Le rôle de chacun de ces acteurs est capital pour le bon
fonctionnement du secteur.
· Les accouveurs et éleveurs de reproducteurs
Les éleveurs de reproducteurs font l'élevage des
souches sélectionnées dans le but de produire des oeufs
fécondés dont l'incubation donnera des poussins d'un jour
destinés aux producteurs d'oeufs de consommation ou de poulets de chair.
Le rôle des accouveurs se limite à l'incubation artificielle
d'oeufs fécondés importés de l'étranger ou
achetés auprès des éleveurs de reproducteurs locaux afin
de fournir des poussins d'un jour aux producteurs. C'est le cas de la
Société de Distribution du Matériel Avicole (SEDIMA), de
la Compagnie Africaine de Maraîchage d'Aviculture et d'Arboriculture
Fruitière (CAMAF), du Complexe Avicole de Mbao (CAM), Aviculture
Sénégalaise (AVISEN), la Nouvelle Minoterie Africaine (NMA) etc.
· Les producteurs
Ils achètent les poussins d'un jour et les
élèvent pour la production des oeufs de consommation ou de
poulets de chair selon la spéculation choisie.
· Les provendiers
Au Sénégal, la fabrication et la vente des
provendes en aviculture sont assurées par des sociétés
locales telles que : la SEDIMA, le CAM, la Nouvelle Minoterie Africaine
(NMA), SENTENAC etc. (SENEGAL.MA.DIREL, 1996).
· Les encadreurs
Ce sont des agents de structures publiques d'encadrement, les
vétérinaires privés et les fournisseurs d'intrants et de
poussins (HABYARIMANA, 1998).
1.2.1.2.6. Circuits de commercialisation d'oeufs et de
poulets de chair
Tous les produits issus de l'aviculture sont
commercialisés essentiellement sur les marchés urbains pour la
filière moderne, et ruraux pour la filière traditionnelle, mais
également par l'intermédiaire des Bana-banas (les revendeurs
informels). Les oeufs de consommation se retrouvent dans tous les circuits de
distribution, du petit étal de marché aux grandes surfaces.
1.2.1.2.7. Niveaux de consommation d'oeufs et de
poulets de chair au Sénégal
La consommation d'oeufs peut être assimilée
à la quantité d'oeufs produite par le secteur moderne puisque les
importations d'oeufs de consommation sont négligeables voire
inexistantes et que la production du secteur traditionnel est presque nulle
(SENEGAL.ME.CNA, 2006).
En 1995 la consommation d'oeuf était estimée
à 19,64 oeufs par habitant au Sénégal, cette consommation
est en nette augmentation depuis 1998 (KOE, 2001).
La consommation de poulets de chair correspond à la
quantité de poulets de chair produite par le secteur moderne et les
importations de poulets congelés.
En effet, en 2004, le volume des importations était de
13.700 tonnes pour une valeur de près de 13 milliards de francs CFA. Les
morceaux congelés ont constitué 75 % du volume des importations.
Si en 2004, la production locale de poulet de chair n'a été que
de 7267 tonnes, on se rend donc compte que la majorité des consommateurs
sénégalais ont privilégié les poulets
congelés importés à la production locale (FRANCE.MEFI,
2005).
Compte tenu du contexte actuel de la grippe aviaire, tout
porte à croire qu'avec l'arrêt des importations de viande de
volailles, une nette amélioration de la production locale de poulets de
chair se fera sentir ; à condition que les producteurs locaux
parviennent à mieux gérer les contraintes que rencontre la
filière avicole au Sénégal.
1.2.2.
CONTRAINTES DE L'ELEVAGE AVICOLE DANS LA
REGION DE DAKAR
On distingue plusieurs types de contraintes:
· Les contraintes zootechniques ;
· Les contraintes technico-économiques ;
· Les contraintes sanitaires ;
· Les contraintes Pathologiques.
1.2.2.1. CONTRAINTES ZOOTECHNIQUES
L'insuffisance du niveau technique des éleveurs et
l'insuffisance d'organisation des producteurs sont des facteurs qui entravent
la productivité des élevages modernes.
Les défaillances observées dans l'application
des normes techniques d'élevage sont à l'origine de mauvaises
performances. En effet, la mauvaise conception des bâtiments, les vides
sanitaires mal effectués et l'absence d'hygiène souvent
constatée dans les fermes ont des conséquences néfastes en
élevage intensif (BIAOU, 1995). La qualité nutritive des aliments
fabriqués de façon artisanale dans certaines fermes avicoles non
qualifiées, la distribution irrégulière et en
quantité insuffisante des aliments ainsi que la rupture prolongée
des stocks d'aliments dans les fermes ne favorisent pas une production optimale
de ces fermes. A ces problèmes zootechniques s'ajoutent, les contraintes
technico-économiques.
1.2.2.2. CONTRAINTES TECHNICO-ECONOMIQUES
L'élevage des poulets de chair comme celui des poules
pondeuses n'est pas accessible à toutes les couches de la population
sénégalaise. En effet, cet élevage demande des moyens
financiers importants. En général, les poussins, les
médicaments et 85 % du maïs destinés aux fabriques
d'aliments sont des intrants importés. Les producteurs éprouvent
d'énormes difficultés pour obtenir des financements
nécessaires à l'achat des équipements avicoles
(HABAMENSHI, 1994).
La mauvaise organisation du marché et le manque de
chaîne de froid pour conserver les produits invendus font que beaucoup
d'aviculteurs sénégalais se limitent à des
opérations ponctuelles liées à des festivités
d'origines religieuses, coutumières ou familiales. (SENEGAL/MA/DIREL,
1995). En plus des contraintes technico-économiques s'ajoutent les
contraintes sanitaires.
1.2.2.3. CONTRAINTES SANITAIRES
Les contraintes sanitaires sont représentées par
les facteurs de risque dans les poulaillers. Ces facteurs de risques sont
nombreux et peuvent agir en synergie ou individuellement. Parmi ces facteurs,
on peut citer :
· La température
C'est un facteur de stress aussi bien chez les poussins que
chez les poules adultes (PARENT et coll., 1989). L'oiseau en réagissant
face à l'agression thermique, s'épuise et s'expose davantage aux
maladies.
· L'humidité
L'humidité favorise la croissance optimale des agents
infectieux et infectants.
Lorsqu'un poulet est soumis à un environnement à
forte humidité, il devient plus réceptif aux maladies que celui
qui n'est pas dans le même cadre de vie (BRUGERE-PICOUX et SAVAD,
1987).
· La ventilation
Le rôle de la ventilation est bien connu en aviculture
car elle permet le renouvellement de l'air du poulailler. C'est d'ailleurs
l'élément important qui est recherché dans l'orientation
et la conception des bâtiments. Tout en évitant les grands vents,
les poussières (sources d'agents pathogènes), Une bonne
ventilation permet de minimiser les effets de la température et de
l'humidité (IBRAHIMA, 1991).
· Polluants chimiques
L'ammoniac (NH3) est le polluant chimique le plus important.
Il provient des oiseaux eux-mêmes ou résulte de la
dégradation de la litière.
Les facteurs physiques associés aux facteurs chimiques,
favorisent l'apparition et l'évolution de nombreuses pathologies
aviaires.
1.2.2.4. CONTRAINTES PATHOLOGIQUES (BULDGEN et coll.,
1992)
Les pathologies sont principalement d'origine parasitaire ou
infectieuse.
· Les maladies parasitaires
Elles sont les plus nombreuses et sont responsables de la
mortalité ou des retards de croissance dans les élevages. On
retrouve entre autres :
· les coccidioses aviaires (Emeria tenella, E. necatrix,
E. maxima, E. brunetti, E. proecox) ;
· l'ascaridiose (Ascaridia, Cappillaria, Heterakis);
· les Téniasis (Rallietina, Hymenolopis).
· Les maladies infectieuses
Elles rassemblent les maladies bactériennes et virales.
Ø Les maladies bactériennes et mycoplasmiques
Parmi ces maladies on peut citer :
· le cholera aviaire dû à Pasteurella
multocida ;
· les colibacilloses dues à Escherichia coli et
autres colibacilles ;
· les salmonelloses aviaires dues à Salmonella
pullorum gallinarum ;
· les mycoplasmoses dues à Mycoplasma
gallisepticum, M. synoviae et les autres mycoplasmes.
Ø Les maladies virales
Ce sont les maladies les plus graves. Elles entraînent
d'énormes dégâts car il n'existe aucun traitement contre
ces maladies. On peut citer entre autres :
· La maladie de Gumboro due à un
Birnavirus ;
· La maladie de Newcastle ou pseudo peste aviaire due
à un Paramyxovirus ;
· La variole aviaire due à un Poxvirus ;
· Les leucoses aviaires dues à des
rétrovirus ;
· La bronchite infectieuse due à un
Coronavirus ;
· La maladie de Marek due à un Herpes virus.
Bien que les maladies parasitaires soient les plus
fréquentes à cause du manque d'hygiène, il faut remarquer
que les maladies infectieuses (bactérienne et virale) sont les plus
redoutables, puisque leurs pronostics médicaux et économiques,
sont généralement catastrophiques.
A l'issue de la présentation de l'aviculture au
Sénégal il ressort que les contraintes pathologiques entravent
sérieusement son développement. Ainsi OUMAR (1994) a
montré que la maladie de Gumboro avait une prévalence de 26 % par
rapport aux autres pathologies aviaires ; ensuite BAKARI (2006) a
montré que cette maladie peut entraîner dans une bande de poulets
de chair une perte économique de 75,81 %.
Le prochain chapitre sera consacré à la
présentation de la maladie de Gumboro.CHAPITRE 2 : LA MALADIE DE GUMBORO
2.1.
GENERALITES
2.1.1. DEFINITION
La maladie de GUMBORO est une maladie infectieuse, virulente,
inoculable et contagieuse due à un virus lymphotrope de la famille des
Birnaviridae dénommé IBDV (Infectious Bursal Disease Virus).
Le virus attaque principalement les cellules lymphoïdes
produites par la bourse de Fabricius et l'infection est suivie d'une
immunodépression (VINDEVOGEL, 1992).
Elle frappe tous les gallinacés et se
caractérise cliniquement par des troubles digestifs (diarrhée
aqueuse), des plumes ébouriffées, une mobilité
réduite, de l'apathie, de l'anorexie, des tremblements et une
prostration.
Sur le plan anatomopathologique, elle se manifeste par une
inflammation nécrosante de la bourse de Fabricius, une
déshydratation très apparente au niveau des muscles, qui
présentent également de nombreuses hémorragies et
ecchymoses, une hypertrophie et une décoloration des reins, avec une
accumulation de cristaux d'urates dans les tubules (PICOUX M., 1983). C'est la
bourse de Fabricius qui présente les lésions essentielles pour le
diagnostic : chez les sujets qui meurent en phase aiguë de
l'infection, la bourse de Fabricius est hypertrophiée, turgescente, avec
une décoloration jaune pâle. Des hémorragies
intrafolliculaires peuvent être présentes et dans certains cas la
bourse de Fabricius peut être totalement hémorragique et prendre
l'aspect d'un caillot de sang (« cerise noire »).
2.1.2.
IMPORTANCE
La maladie de Gumboro a une importance à la fois
économique et médicale.
Ø Sur le plan économique, elle entraîne
une morbidité moyenne de 20% pouvant atteindre parfois 100%
accompagnée d'une prostration sévère de la plupart des
animaux durant 5 à 7 jours. La mortalité dont le taux est faible
s'élève brusquement pendant 2 jours puis décline
rapidement durant les 2 à 3 jours suivants. Habituellement, cette
mortalité varie de 5 à 10 %, mais elle peut atteindre un pic de
60 % (VANMARCK, 1992). Les conséquences de la maladie en dehors de la
mortalité se traduisent par une chute de ponte, un retard de croissance
et une hétérogénéité du lot (PICAULT J. P.,
1998).
Ø Sur le plan médical, la maladie a un effet
immunodépresseur marqué pouvant être à l'origine de
certains échecs de vaccination contre la maladie de Newcastle par
exemple selon STEWART et coll. (1993), rapporté par KOUZOUKENDE
(2004).
2.1.3. HISTORIQUE
La maladie a été décrite pour la
première fois par COSGROVE (1962) sur les jeunes volailles. Elle
sévissait depuis 1957 aux USA dans l'Etat de DELAWARE plus
précisément Dans la ville de Gumboro (VINDEVOGEL, 1992)
A l'autopsie les poussins présentent des lésions
rénales et de la bourse de Fabricius d'où la dénomination
de « Néphrose aviaire » ou maladie de Gumboro.
En 1962, WINTERFIELD et HITCHNER aux USA ont observé
sur les poulets des lésions rénales semblables à celles
décrites par COSGROVE qu'ils ont nommé « syndrome
néphrite néphrose ». Puis ils ont isolé deux
virus, l'un des reins et l'autre de la bourse de Fabricius de poulets atteints
de cette pathologie. Ils ont démontré que le virus isolé
de la bourse de Fabricius est le seul responsable des lésions induites
dans cet organe. Ainsi l'appellation « maladie de Gumboro »
fut dès lors réservée à l'affection virale
caractérisée par la dégénérescence et la
nécrose des cellules lymphoïdes de la bourse de Fabricius.
Il existe deux types des souches baptisées
« Holte » et « Gray » qui ont des
apparentées immunologiques avec le virus de la bronchite infectieuse.
Mais ils différent par le fait que celui de la bronchite entraîne
des troubles respiratoires et celui de la maladie de Gumboro entraîne des
lésions spécifiques au niveau de la bourse de Fabricius.
En février 1975 la maladie de Gumboro a
été signalée pour la première fois au
Sénégal (SAGNA, 1975).
2.1.4. ESPECES AFFECTEES
La maladie de Gumboro est une maladie des
gallinacés.
Dans les conditions naturelles, la maladie ne s'exprime
cliniquement que chez la poule. La dinde, le canard, la pintade la caille, les
passereaux, l'oie et l'autruche peuvent être occasionnellement
infectés mais sous une forme subclinique (VINDEVOGEL, 1992).
Dans les conditions expérimentales, la poule reste
sensible uniquement à l'inoculation par voie buccale. Mais la maladie de
Gumboro peut être reproduite chez la poule par l'inoculation du virus par
voie intraperitonéale, intracérébrale ou intraveineuse
tandis que chez la souris blanche âgée de 1-14 jours elle n'est
possible que par voie intracérébrale ou intraperitonéale
selon BENTON et coll. (1967).
2.1.5. REPARTITION
GEOGRAPHIQUE
La maladie de Gumboro est une maladie cosmopolite. Des USA,
elle s'est propagée dans le reste du monde, à savoir l'Europe via
la grande Bretagne, l'Asie et l'Afrique où son identification a
été tardive. Le virus est largement répandu à
travers le monde, mais on pensait qu'il était absent dans la
majorité des îles du pacifique. Cependant il a été
signalé à Fidji en Polynésie française, en Nouvelle
Zélande et à Vanuatu (SAVILLE, 1999).
De nos jours plusieurs pays africains sont touchés par
la maladie de Gumboro dont le Sénégal.
2.2. ETIOLOGIE
2.2.1. MORPHOLOGIE ET
STRUCTURE
Il a été démontré que les
particules virales du virus de la maladie de Gumboro, formées par des
protéines VP2 et VP3, présentent une symétrie
icosaédrique de triangulation T= 13, avec un diamètre d'environ
700Å. Cette structure du virus est déterminée par
cristallographie à 7Å de résolution (REY et coll., 2004).
Le phénotype de virulence accrue est déterminé par la
protéine majeure de capside VP2. Cette protéine constitue d'une
part le moteur de la morphogenèse par ses capacités
d'auto-assemblage et d'autre part un déterminant du tropisme du virus
par son interaction avec des récepteurs cellulaires (COULIBALY et coll.,
2003).
Le génome viral est constitué d'une chaîne
d'acide ribonucléique (ARN) bicaténaire et bisegmentée.
2.2.2. CARACTERISTIQUES PHYSICO-CHIMIQUES ET
CLASSIFICATION
Le virus de la maladie de Gumboro a fait l'objet de plusieurs
controverses :
Ø En 1967, CHEVILLE rapporté par DIALLO (1978)
décrivit des zones de regroupements du virus dans le cytoplasme de
macrophages de poulets infectés. Les particules virales étaient
entourées d'une trame filamenteuse. L'existence de cette trame, les
caractères morphologiques de ces particules et les différentes
propriétés physico-chimiques l'amenèrent à admettre
que le virus de la maladie de Gumboro était un réovirus.
Ø PETEK et coll., en 1967 l'assimilèrent
également à un réovirus.
Cette hypothèse fut réfutée par LUNGER et
MADDUX qui en 1972 étudièrent au microscope électronique
les transformations cellulaires survenant après infection. Ils
constatèrent une altération primitive du noyau des macrophages et
l'apparition d'inclusions cytoplasmiques qui sont uniquement d'origine
macrophagique et non des fragments de lymphocytes phagocytés.
La réplication du virus de la maladie de Gumboro, ainsi
que les phénomènes morphologiques qui l'accompagnent, ressemblent
à la réplication du virus Nodaruma étudié par
MURPHY (1968). Ce virus Nodaruma est un picornavirus transmis par les
arthropodes.
En 1991, le virus de la maladie de Gumboro a été
définitivement identifié et classé dans la famille des
Birnaviridae. Ce virus est très stable, non enveloppé, d'un
diamètre de 60 nm. Il est composé d'un double brin d'ARN
entouré d'une capsule protéique et présente une attirance
pour les tissus lymphoïdes notamment la bourse de Fabricius. Il
détruit les lymphocytes dans tous les organes lymphoïdes provoquant
une immunodépression plus ou moins sévère.
Ce virus a une très grande facilité d'expansion
et peut contaminer toutes les régions à forte densité
avicole.
Le virus de la bursite infectieuse est très
résistant aux agents chimiques et physiques. Il résiste à
un pH supérieur à 2 et inférieur à 12. Il
présente une grande résistance à la chaleur dans le
milieu extérieur. A 70° C il résiste pendant 30 minutes et
à 56° C pendant 5 heures.
Il présente également une grande
résistance à certains agents chimiques : chloroforme,
éther, acides, formol à 1% et à l'eau de javel. Il est
inactivé à pH=2 (VINDEVOGEL, 1992) mais certains
désinfectants sont actifs contre lui : le chloramine à 2 %,
le glutaraldehyde ; le formol quant à lui n'agit qu'à une
température supérieure à 20° C d'où son
efficacité relative s'il est employé en hiver ou à des
températures relativement basses.
2.2.3. CARACTERES CULTURAUX
· Sur oeufs embryonnés
La culture est faite sur oeufs embryonnés sans
anticorps spécifiques ou Exempte d'Organismes Pathogènes
Spécifiques (EOPS) âgés de 6 à 10 jours par
inoculation intra chorio-allantoïdienne. L'embryon meurt dans 3 à 5
jours.
A l'autopsie il présente :
- des lésions d'oedème sur la tête, le cou
et l'abdomen ;
- des congestions ;
- des hémorragies ;
- une coloration verdâtre au niveau du jaune d'oeuf et
du liquide allantoïque.
· Sur culture cellulaire
Elle est faite sur les fibroblastes du poulet, des cellules
de l'embryon de dindon, de canard ou sur les lignées cellulaires des
reins de lapin et de singe.
2.2.4. PROPRIETES BIOLOGIQUES
2.2.4.1. Pouvoir pathogène
Il est variable :
· Dans les conditions naturelles
Le virus de la maladie de Gumboro est naturellement
pathogène pour les oiseaux plus précisément les
gallinacés. Cette sensibilité est fonction de l'âge,
d'où chez les sujets de 5 jours, il n'y a pas expression de la maladie.
L'infection entraîne une immunodépression durable.
Chez les sujets qui ont entre 3 et 6 semaines, la forme
aiguë d'apparition brutale, est la plus observée et elle se
manifeste par une diminution de l'immunité maternelle.
La pathogénie est variable en fonction des souches
virales. On a des souches « traditionnelles » connues
depuis 1962 et qui entraînent 5 à 10 % de mortalité
(BRICOUT et coll., 1974). Certains pathotypes apparus depuis 1987
entraînent un taux de mortalité de 5 à 60 % (VANMARCK,
1992).
L'effet pathogène du virus dans la maladie naturelle se
traduit par une hypertrophie suivie d'une atrophie de la bourse de
Fabricius.
· Dans les conditions expérimentales
L'embryon de moins de 6 jours est moins sensible au virus que
celui de 12 jours.
Le passage en série sur une culture cellulaire du virus
entraîne l'atténuation de son pouvoir pathogène. Le virus
atténué peut être utilisé pour la production des
vaccins.
2.2.4.2. Pouvoir antigénique et
immunogène
Le virus de la bursite infectieuse possède des
antigènes qui induisent la formation des anticorps neutralisants et
précipitants qu'on peut mettre en évidence par
l'immunofluorescence ou par la technique ELISA.
Deux sérotypes ont été
identifiés:
Ø Le sérotype I comprend plusieurs souches
comportant les antigènes différents entre souches classiques et
variantes. C'est une souche très pathogène pour le poussin et
peut vaincre la protection passive des jeunes oiseaux grâce à sa
différence antigénique avec la souche standard vaccinale
(persistance des anticorps maternels).
Ø Le sérotype II a été
isolé du dindon chez lequel il ne provoque qu'une affection subclinique
inapparente qui serait quand même immunosuppressive
Le sérotype I est responsable de la maladie chez les
poules, alors que le sérotype II se rencontre principalement chez les
dindes (SAVILLE, 1999). Les deux sérotypes peuvent interférer
aussi bien chez les poulets que les dindons.
Par ailleurs WINTERFIELD (1969) montra que les poulets
guéris de la maladie ou ayant été mis en contact avec une
souche atténuée du virus, possédaient des anticorps
dirigés contre les souches homologues et hétérologues. Ces
travaux montrent donc l'existence de neutralisations croisées entre les
différentes souches et ceci présente un grand
intérêt dans la préparation des vaccins où il n'est
pas nécessaire d'inclure toutes les souches connues du virus comme
principe actif.
Le même auteur démontre par la même
occasion que l'âge où doit se faire le contact du virus avec le
poussin importe beaucoup, car les poussins de trois semaines infectés
développaient un taux d'anticorps neutralisants très
inférieur à celui produit par les poussins de quatre semaines.
Les anticorps précipitants dont l'existence a
été démontrée par FARAGHER (1972) apparaissent du
2ème au 6ème jour après
l'infection de la bourse de Fabricius.
Il existe une variation de localisation de pouvoir
pathogène :
· Les souches virulentes se multiplient dans les zones
inter folliculaires de la bourse de Fabricius
· Les souches virulentes se multiplient dans les
follicules.
2.3. PATHOGENIE
2.3.1. MECANISME PATHOGENIQUE
Le virus entre dans l'organisme par la voie orale. L'incubation
de la bursite infectieuse est très brève. Le virus transite dans
les lymphocytes et les macrophages intestinaux quelques heures après
l'infection orale. L'envahissement hépatique précède la
virémie qui assure la contamination des organes cibles dont la bourse de
fabricius. Cette atteinte correspond à une « bursectomie
virale » détruisant les lymphocytes B porteurs de
l'immunité à médiation humorale. Il y a réaction
inflammatoire de la bourse de Fabricius le 4ème jour qui suit
l'infection, puis atrophie et dégénérescence en une
semaine qui accompagne la nécrose des autres organes
lymphoïdes.
Virus
Muqueuse intestinale
Macrophages, lymphocytes
Foie
Virémie
Bourse de Fabricius (multiplication du virus dans les
cellules lymphoïdes B)
Hypertrophie
Atrophie
Figure 2 : Pathogénie de la maladie de
Gumboro
La bourse de Fabricius est un organe lymphoïde primaire,
impair et médian rencontré uniquement chez les oiseaux. Cet
organe présente également certaines propriétés des
organes lymphoïdes secondaires.
Elle est située dorsalement au cloaque. Sa
cavité est recouverte longitudinalement par un épithélium
plissé, formant environ 15 bourrelets primaires et 7 secondaires. Le
développement de la bourse de Fabricius commence à partir du
4ème jour de la vie embryonnaire et atteint son maximum à
l'âge de 4 semaines. La bourse de Fabricius régresse entre la
10ème et la 23ème semaine, ce qui
consiste à un épuisement lymphoïde physiologique qui
s'achève vers l'âge de la maturation sexuelle.
Au cours de la vie embryonnaire, les cellules souches des
lymphocytes vont migrer du foie et du jaune d'oeuf vers le thymus et la bourse
de Fabricius. C'est ainsi que les lymphocytes T issus du Thymus seront
responsables de l'immunité à médiation cellulaire, et les
lymphocytes B issus de la bourse de Fabricius seront responsables de
l'immunité humorale grâce aux immunoglobulines qu'ils fabriquent
(SALIM et REKIK, 1992).
Une fois passés dans la lymphe et le sang, les
lymphocytes seront chargés de bloquer une éventuelle intrusion
des agents porteurs des antigènes correspondants.
La présence de la bourse de Fabricius est surtout
nécessaire pendant les deux premières semaines, ce qui ne
signifie pas que l'oiseau puisse s'en passer sans risque, de la 2ème
à la 10ème semaine (SCALA et coll., 1988).
C'est dans cet organe lymphoïde que le virus attaque les
lymphocytes B et s'y multiplie avec un effet cytolytique entraînant les
réactions inflammatoires qui se traduisent par une hypertrophie de la
bourse de Fabricius.
A la suite de la destruction des lymphocytes B, il se produit
une dépression immunitaire. Cette dépression nuit à la
protection contre les maladies bactériennes telles que les
colibacilloses et les salmonelloses (WYETH, 1976).
2.3.2. CONSEQUENCES PHYSIOPATHOLOGIQUES
Les conséquences immédiates de cette affection
sont une immunosuppression quasi immédiate entraînant de graves
échecs aux vaccinations diverses (Newcastle, bronchite infectieuse,
Marek).
La disparition de certaines barrières immunitaires
entraînera l'éclosion d'affections parasitaires, virales et
bactériennes variées. Diverses hypothèses sont
émises quant à l'origine des lésions et symptômes
des formes graves :
· Coagulation intra vasculaire disséminée
ou CIVD (il y a libération de thromboplastine à partir de la
bourse de Fabricius lésée) ;
· La maladie à immuns complexes, avec vascularite
qui provoquerait les lésions hémorragiques et en partie
l'atteinte rénale.
Les autres conséquences physiopathologiques sont entre
autre des diarrhées entraînant des déshydratations
aggravées par l'absence d'abreuvement. Ce qui a pour conséquence
l'accumulation de cristaux d'urate dans les reins et les uretères
laissant présager un pronostic médical sombre ;
L'infection précoce chez les poussins de 5 jours
entraîne une immunodépression subclinique tandis qu'a partir de la
3ème semaine on a la forme clinique aiguë.
2.4. EPIDEMIOLOGIE
2.4.1. EPIDEMIOLOGIE DESCRIPTIVE
La maladie de Gumboro affecte naturellement les poulets mais
aussi les dindons, les cailles, les passereaux et les canards.
Les zones les plus affectées sont les zones où
se concentre un grand nombre de volailles.
Les mortalités enregistrées évoluent
selon une courbe de mortalité en cloche pathognomonique de la maladie de
Gumboro ou courbe de PARKHUST (figure 3).
A Dakar, la maladie de Gumboro évolue
généralement sous une forme enzootique.
Cependant, il y a des périodes particulières
comme l'hivernage où nous assistons à des épizooties.
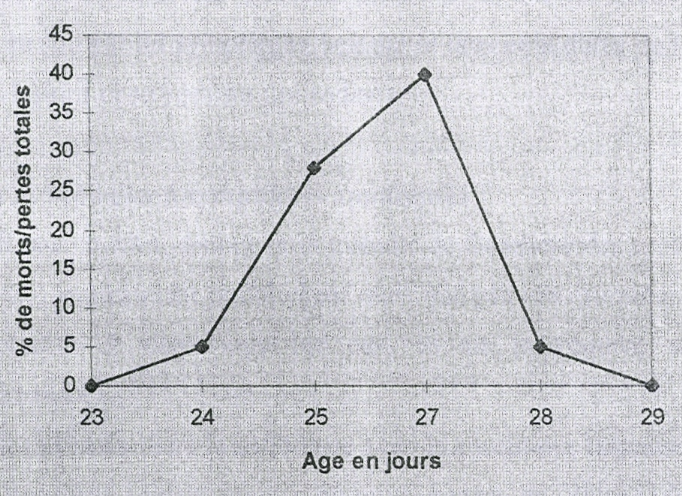
Figure 3 : Courbe caractéristique de
mortalité de la forme aiguë de la maladie de Gumboro selon PARKHUST
cité par ABDEL-AZIZ (2007).
2.4.2. EPIDEMIOLOGIE ANALYTIQUE
Ø Espèce
La maladie se rencontre surtout chez le genre Gallus, le
canard et le dindon développent des formes subcliniques inapparentes.
Les sources sont les animaux malades ou morts, les fientes,
l'eau, les litières et les aliments contaminés.
Ø L'âge
La maladie de Gumboro se nomme souvent « la maladie
aux deux visages » car durant les deux premières
décades de vie, l'infection précoce provoque une
immunosuppression sévère. De 3 à 6 semaines c'est l'age de
la plus grande sensibilité au virus. L'immunité naturelle est
fonction de l'état immunitaire des reproducteurs.
Ø L'individu
Les variations de sensibilité individuelles sont
liées aux résidus d'immunité passive (persistance des
anticorps maternels).
Ø Le milieu
Le stress et les mauvaises conditions d'hygiène sont
les facteurs favorisants l'apparition et la persistance de la maladie de
Gumboro chez les animaux sensibles au virus.
Ø Transmission
Les animaux se contaminent soit par contact direct avec les
malades soit par l'intermédiaire des vecteurs passifs contaminés
par les fientes. L'excrétion virale persiste deux semaines après
la contamination et tous les animaux peuvent être porteurs. La voie de
contamination est soit orale soit respiratoire.
Il n'y a pas de transmission par l'oeuf.
2.4.3. EPIDEMIOLOGIE SYNTHETIQUE
L'introduction du virus dans le milieu se fait par le biais
des échanges commerciaux des volailles. L'existence de nombreux vecteurs
passifs (eau contaminée, litière contaminée etc.) et des
animaux réservoirs du virus (canards, dindons) font que la maladie
évolue durant toute l'année.
2.5. DIAGNOSTIC DE LA
MALADIE DE GUMBORO
2.5.1. DIAGNOSTIC SUR LE TERRAIN
2.5.1.1. ELEMENTS CLINIQUES ET
EPIDEMIOLOGIQUES
Un troupeau affecté présentera une
morbidité très élevée sur les poulets de 3 à
6 semaines accompagnée d'une prostration sévère de la
plupart des animaux durant 5 à 7 jours. La mortalité
s'élève brusquement pendant 2 jours puis décline
rapidement durant les 2 à 3 jours suivants. Habituellement, la
mortalité varie de 5 à 10 %, mais elle peut atteindre 30 à
40 %. Les principaux symptômes sont une diarrhée aqueuse pouvant
contenir des caillots de sang (BRUGERE-PICOUX, 1974 ; ROSENBERGER,
1989 ; VINDEVOGEL, 1992), des plumes ébouriffées, une
mobilité réduite, de l'anorexie, des tremblements et une
prostration.
2.5.1.2. ELEMENTS NECROPSIQUES
On peut reconnaître la maladie de Gumboro lors de
l'ouverture du cadavre de poulet suspect. Les lésions observables
à l'examen nécropsique incluent une déshydratation
très apparente au niveau des muscles, qui présentent
également de nombreuses hémorragies et ecchymoses, une
hypertrophie et une décoloration des reins, avec une accumulation de
cristaux d'urates dans les tubules. C'est la bourse de Fabricius qui
présente les lésions essentielles pour le diagnostic : chez les
sujets qui meurent en phase aiguë de l'infection, la bourse de Fabricius
est hypertrophiée, turgescente, avec une décoloration jaune
pâle (HANSON, 1967). Des hémorragies intrafolliculaires ou des
substances caséeuses sur les feuillets peuvent être
présentes (ROSENBERGER, 1989 ; VINDEVOGEL, 1992) et dans certains
cas la bourse de Fabricius peut être totalement hémorragique et
prendre l'aspect d'un caillot de sang «cerise noire ». Un
oedème péribursal de couleur jaune paille est présent chez
de nombreux sujets.
Il faut cependant être prudent pour écarter les
affections qui peuvent ressembler à la maladie de Gumboro ;
d'où l'intérêt de prendre en compte les
éléments différentiels.
2.5.1.3. DIAGNOSTIC DIFFERENTIEL
Certaines maladies peuvent prêter à confusion
avec la maladie de Gumboro soit par les syndromes, soit par le taux et la
durée de la mortalité, soit par des lésions
observées sur des cadavres.
Il faut en effet distinguer la maladie de Gumboro des
symptômes toxiques qui certes, apparaissent brutalement mais peuvent
entraîner jusqu'à 100 % de mortalité et dans tous les cas,
ils ne provoquent pas de lésions caractéristiques.
Aussi il faut faire la différence avec la coccidiose
qui est responsable de la diarrhée et de mortalité brutale mais
n'entraîne jamais de lésions de bourse de Fabricius.
L'une des affections à ne pas confondre avec la maladie
de Gumboro est la maladie de Newcastle. Elle provoque des lésions
hémorragiques et affecte tous les animaux quelque soit leur âge et
persiste plus longtemps dans l'élevage avec des mortalités
élevées (jusqu'à 100%). Elle provoque en outre, des signes
nerveux et respiratoires qui n'apparaissent pas dans la maladie de Gumboro.
Les hémorragies au niveau du proventricule sont situées sur les
papilles sous forme de taches.
Du fait de l'atteinte rénale, il faut aussi
écarter le syndrome néphrite néphrose qui s'accompagne de
signes respiratoires et qui n'entraîne aucune lésion de la bourse
de Fabricius.
On peut écarter aussi la lipoïdose
hépatorénale, qui du fait de la faible mortalité qu'elle
entraîne sur des sujets de 3 semaines et les lésions
rénales peuvent être confondues avec la maladie de Gumboro. Mais,
là encore il n'y a pas de lésions de la bourse de Fabricius.
Cependant, il y a des affections comme l'avitaminose A, la
leucose lymphoïde et la maladie de Marek qui peuvent entraîner des
lésions de la bourse de Fabricius mais à l'histologie on
s'aperçoit que dans l'avitaminose A, il s'agit d'une métaplasie
épithéliale et dans la maladie de Marek et les leucoses, il
s'agit des processus tumoraux. Si le doute persiste encore malgré toutes
les investigations, on fait appel au diagnostic de laboratoire.
2.5.2. DIAGNOSTIC DE LABORATOIRE
2.5.2.1. DIAGNOSTIC HISTOPATHOLOGIQUE
L'examen histopathologique met en évidence des
lésions oedémateuses, hémorragiques et nécrosantes
ou l'atrophie folliculaire de la bourse de Fabricius.
2.5.2.2. DIAGNOSTIC VIROLOGIQUE
Deux techniques sont couramment utilisées pour mettre
en évidence le virus de la maladie de Gumboro. Il s'agit de
l'immunofluorescence et la technique de l'inoculation.
2.5.2.2.1. L'inoculation
Elle consiste à inoculer des broyats de bourse de
Fabricius suspects aux poulets sensibles (3 à 6 semaines d'âge et
dépourvus d'anticorps spécifiques).
Ensuite rechercher au bout de 3 jours sur les bourses de Fabricius des poulets
inoculés des lésions histopathologiques caractéristiques.
Et enfin au bout de 6 jours, rechercher des lésions macroscopiques sur
les cadavres.
En raison de la contamination fréquente de la bourse
de Fabricius par d'autres virus on préfère utiliser la rate qui
donne de bons résultats.
Les prélèvements peuvent aussi être
inoculés à la membrane chorioallantoidienne des oeufs
embryonnés de 10 jours dépourvus d'anticorps spécifiques.
Les embryons meurent au bout de 3 à 4 jours et les lésions
observées sont des oedèmes de la tête, du cou et de
l'abdomen ; des congestions et des hémorragies dans le tissu
conjonctif sous cutané et une coloration verdâtre du jaune d'oeuf
et du liquide allantoïdien.
L'inoculation peut aussi se faire sur culture cellulaire de
fibroblastes de poulet, des cellules d'embryon de dindon ou de canard. La
multiplication du virus provoque au voisinage des noyaux des cellules
infectées, des inclusions cytoplasmiques éosinophiles à
contours irréguliers.
2.5.2.2.2. L'immunofluorescence
Elle consiste à mettre en évidence les
antigènes du virus au niveau des calques de la bourse de Fabricius sur
lame, grâce à la réaction antigène - anticorps en
utilisant des immunoglobulines antivirus Gumboro marquées par la
fluorescéine.
2.5.2.3. DIAGNOSTIC SEROLOGIQUE
La sérologie met en évidence le passage des
antigènes viraux.
En effet, des prélèvements seront
effectués sur les oiseaux à des intervalles bien définis
pour voir la cinétique des anticorps.
Trois techniques sont utilisées :
· la technique de précipitation en milieu
gélosé : sensible et peu onéreuse ;
· la technique de séroneutralisation :
sensible mais délicate et onéreuse;
· la technique ELISA (Enzyme Linked Immunosorbent
Assay) : facile à mettre en oeuvre mais nécessite des Kits
ELISA relativement coûteux. Elle est utilisée pour la
détection des anticorps induits par l'IBDV et donne de très bons
résultats.
2.6. METHODES DE
LUTTE
2.6.1 TRAITEMENT
Il n'y a pas de traitement spécifique contre la maladie
de Gumboro. Un traitement symptomatique peut consister en l'administration
d'électrolytes dans l'eau de boisson et lutter contre les agents
opportunistes (coccidies et bactéries).
2.6.2. PROPHYLAXIE
2.6.2.1. SANITAIRE
Elle repose sur les règles d'hygiène de base
dans l'élevage aviaire :
· élevage bien isolé avec des locaux bien
conçus, faciles à nettoyer, à désinfecter à
dératiser etc.
· élevage en bande unique avec pour chaque
poulailler, un ouvrier et du matériel propre ;
· le nettoyage et la désinfection doivent
être effectués après chaque bande suivant un ensemble de
procédures strictes ; un vide sanitaire de 15 jours au minimum doit
précéder l'arrivée d'une nouvelle bande.
2.6.2.2. MEDICALE
Le virus est très résistant et persiste
longtemps dans le milieu extérieur. La rencontre du virus et du poussin
est donc inévitable, précoce et individuelle car il n'y a pas de
transmission verticale. La contagion est simultanée pour tous les
poussins. Une bonne protection des poussins passe par la vaccination des
parents car les anticorps maternels persistent quatre semaines si les poules
sont bien vaccinées.
La vaccination est actuellement la seule méthode
efficace dans la prévention des maladies virales. Elle permet de
renforcer les défenses immunitaires de l'individu contre un microbe, en
injectant ce dernier sous une forme qui n'est plus pathogène (qui ne
provoque pas la maladie) ou qui ne peut pas se répliquer. Ainsi la
vaccination protège l'organisme contre le virus qui a servi à
fabriquer le vaccin.
Idéalement, les vaccins devraient protéger non
seulement contre les manifestations cliniques et mortalité, mais encore
prévenir la perte en gain de poids et l'immunosuppression
associée à la maladie. Une gamme de vaccins a été
décrite dans des rapports par THORNTON et PATTISON (1975) et THORNTON
(1976) dans lesquels il a été montré que certains vaccins
réunissaient ces qualités idéales, mais d'autres
étaient encore suffisamment virulents pour provoquer la maladie qu'ils
étaient destinés à prévenir.
On distingue deux sortes de vaccins :
· Vaccins à virus inactivés :
En 1964, WINTERFIELD et HITCHNER rapportent que les vaccins
inactivés sont inefficaces en matière d'immunité. Cette
conception a été révisée. En effet selon BENNEJEAN
(1977) des vaccins inactivés ont été
expérimentés, mais les concentrations virales nécessaires
à l'obtention de l'immunité sont actuellement trop
élevées pour permettre une production industrielle.
DESBORGES (1999) a montré que le vaccin inactivé
est totalement insensible aux anticorps maternels des poussins. Ce vaccin
induit une protection progressive et de longue durée.
· Vaccins à virus vivants :
Dans ce domaine les vaccins ont connu deux
périodes : une première période où on
utilisait des vaccins à virus pleinement virulents et une période
où les vaccins furent atténués.
Les vaccins à virus pleinement virulents sont
préparés à partir de suspension de bourse de Fabricius de
poulets infectés. A l'heure actuelle, ces vaccins sont abandonnés
au profit des vaccins à virus atténués.
CONSTANTIN (1988) a montré que les vaccins vivants
atténués utilisés très précocement seront
neutralisés par les anticorps d'origine maternelle chez les poussins.
Pour une vaccination
efficace contre la maladie de Gumboro avec les vaccins vivants, FERRE et coll.,
(2005) ont montré qu'il faut un taux d'anticorps d'origine maternelle
compatible avec la souche vaccinale soit 350 en ELISA (kit IDEXX, dilution
1/500) pour les vaccins intermédiaires et 500 pour les vaccins à
souches dites « chaudes ».
· Programme de vaccination :
Il faut chercher à obtenir des poussins un niveau
immunitaire élevé et uniforme. Le relais immunitaire actif du
poussin doit être pris au moment optimum : les poussins sont
sensibles entre trois et six semaines au virus de Gumboro et la persistance des
anticorps maternels peut entraver la bonne réponse vaccinale. Il faut
bien choisir le protocole vaccinal. Il y a actuellement recrudescence de cas
aiguës malgré la vaccination. Une vaccination trop précoce
est neutralisée par les anticorps maternels ce qui permet l'installation
d'un virus sauvage plus pathogène. Il faut suffisamment d'anticorps
maternels pour maîtriser une éventuelle souche sauvage mais pas
trop pour ne pas neutraliser le virus vaccinal. De plus le stock d'anticorps
maternels se dilue plus ou moins vite en fonction de la vitesse de croissance
du poussin. Une souche lourde diluera beaucoup plus vite son immunité
transmise qu'une souche label à croissance lente. Il existe donc un
moment optimum de vaccination difficile à déterminer
Les poussins venant des reproducteurs vaccinés
héritent d'un taux d'anticorps élevé, destinés
à les protéger pendant les 3 premières semaines de vie.
Cette protection théorique est, malheureusement souvent prise à
défaut lorsque la pression virale est élevée ou lorsqu'on
est en face de souches sauvages très virulentes. La sensibilité
du poussin au virus de la maladie de Gumboro et le risque d'infection
précoce nécessite une vaccination au cours des premiers jours de
la vie (VINDEVOGEL et coll., 1976). Tel est le cas des oiseaux
dépourvus d'anticorps maternels : ils doivent alors être
vaccinés à la naissance avec une souche atténuée
qui n'entraîne ni lésions de la bourse de Fabricius, ni un effet
immunodépresseur. Dans le cas contraire, la vaccination doit être
différée, car les souches vaccinales atténuées sont
neutralisées par les anticorps maternels ou doit être
pratiquée avec des souches plus agressives, qui confèrent une
bonne protection en présence d'anticorps maternels, sans qu'apparaissent
les lésions de la bourse liées au manque d'innocuité
relatif de ces souches.
L'étude expérimentale de la dynamique des
anticorps maternels révèle que ces derniers disparaissent en une
dizaine de jours dans le cas des anticorps précipitants et en 20
à 30 jours dans le cas des anticorps de type neutralisant.
En effet, dans la pratique il existe des grandes variations du
taux des anticorps maternels chez les poussins car ces derniers proviennent de
troupeaux de reproducteurs différents.
Dans la région de Dakar, l'observation de la
cinétique des anticorps a révélé que 52,6% des
poussins produits à Dakar avaient un seuil de protection bas à
partir de la 3ème semaine (CARDINALE et coll., 1998).
Il se peut donc, en retardant la vaccination avec des souches
atténuées, que la contamination intervienne à une
période où l'immunité active n'a pas pris le relais de
l'immunité passive, ou en utilisant des souches plus agressives. Il se
peut que les poussins ne possèdent pas un taux d'anticorps maternels
suffisants pour empêcher le développement des lésions de la
bourse (VINDEVOGEL et coll., 1976). Dans ces conditions, il serait
souhaitable d'immuniser les reproducteurs dont la descendance est soumise
à des risques possibles d'infection.
Une deuxième vaccination est obligatoire entre le
25ème et le 28ème jour de la vie. Faute de quoi les sujets
porteurs d'anticorps à la naissance mais qui ne sont plus
protégés entre le 25ème et le 30ème jour peuvent
payer un lourd tribut au virus (signes cliniques et dépression
immunitaire)
Malgré les mesures sanitaires et médicales
préconisées pour lutter contre la maladie de Gumboro, on observe
sur le terrain de plus en plus des échecs de la vaccination.
C'est dans le but de mieux comprendre et expliquer les raisons
de l'échec de la vaccination contre la maladie de Gumboro, que nous
avons entrepris une étude comparative des taux d'anticorps et de
lymphocytes B produites par la bourse de Fabricius et responsables de
l'immunité dans la maladie de Gumboro en conditions
expérimentales. Ceci fera l'objet de la deuxième partie de notre
travail.
DEUXIEME PARTIE : ETUDE EXPERIMENTALE
CHAPITRE 1 :
MATERIEL ET METHODES
1.1. ZONE ET PERIODE D'INVESTIGATION
Notre travail s'est déroulé de septembre 2007
à juin 2008, soit une durée de dix mois.
Lors de cette expérimentation, les bandes de poussins
étaient conduites dans les bâtiments situés dans l'enceinte
de l'Ecole Inter Etats des Sciences et de Médecine
Vétérinaires de Dakar (E.I.S.M.V.).
Figure 4:
Carte de Dakar (source : www.senegal-online.com)
1.2. MATERIEL
1.2.1. MATERIEL ANIMAL
Le matériel animal est
représenté par des coquelets de souche Isabrown et des poulets de
chair de souche Cobb500. La bande de poulets de chair comportait 520 poussins
et celle de coquelets 160 poussins.
Les poussins d'un jour provenaient du couvoir de la
Sénégalaise de Distribution de Matériel Avicole (SEDIMA)
pour les coquelets et les poulets de chair. Les poussins ont
été nourris avec de l'aliment de SEDIMA pour le stade
démarrage et l'aliment industriel de la Nouvelle Minoterie Africaine
(NMA) pour les stades croissance et finition aussi bien des poulets de chair et
des coquelets.
Avant l'arrivée des poussins, nous avons
effectué un vide sanitaire dans le bâtiment d'élevage. Le
local a été nettoyé avec de l'eau et des
détergents, rincé et ensuite désinfecté. Pendant 15
jours la salle a été close afin de permettre la destruction des
germes de surface. Elle a été ouverte 24h avant l'arrivée
des poussins. La litière, composée de copeaux de bois a
été installée ainsi que quelques cartons pour servir de
cloisons pour délimiter une aire de démarrage d'environ 2 m2. Pour assurer le chauffage
des oiseaux, nous avons utilisé des ampoules de 100 watts
disposées à environ 1 m du sol.
Les poulets de chair et les coquelets ont été
nourris avec deux types d'aliments : l'aliment SEDIMA pour le stade de
démarrage et l'aliment NMA pour les stades de croissance et
finition.
1.2.2. VACCINS
UTILISES
Nous avons utilisé dans notre élevage, les
différents vaccins disponibles sur le marché
sénégalais (tableau II).
Tableau II :
vaccins utilisés
|
Nom du vaccin
|
Caractéristiques du vaccin
|
N° de lot de vaccin
|
|
GUMBOPEST ND
|
Vaccin inactivé adjuvé bivalent (antiGumboro et
antiNewcastle)
|
L191644
|
|
AVI IBD inter ND
|
Vaccin vivant atténué lyophilisé (souche
intermédiaire)
|
0205P1HKA
|
|
AVI IBD inter ND
|
Vaccin vivant atténué lyophilisé (souche
intermédiaire)
|
0307P1S2C
|
|
CEVAC IBDL ND
|
Vaccin vivant atténué lyophilisé (souche
chaude)
|
2305R2S1B
|
1.2.3. MATERIEL DE PRISE DE
SANG
Pour le prélèvement de sang, nous avons
utilisé des seringues, des aiguilles, des tubes à essai, des
portes tubes, une glacière contenant des carboglaces pour la
conservation. Des marqueurs ont été utilisés pour
identifier les échantillons.
1.3. METHODES DE TRAVAIL
1.3.1. PROTOCOLES DE VACCINATION
1.3.1.1. Bandes de poulets de
chair
Dans notre élevage expérimental, nous avons
utilisé pour les deux bandes de poulets de chair trois types de
vaccins :
v le vaccin inactivé adjuvé qui a
été utilisé par voie sous cutanée ;
v les vaccins vivants lyophilisés souche
intermédiaire et souche chaude qui ont été
administrés par voie occulo-nasale (trempage du bec).
Les différents protocoles de vaccination
utilisés dans les bandes sont fixés par nous même (tableaux
III et IV).
Le protocole de vaccination de la bande NO1 de
poulets de chair est récapitulé dans le tableau III.
Tableau III : Protocole de vaccination
de la bande NO1 de poulets de chair
|
Lots d'oiseaux
|
Protocole
|
Effectif d'oiseaux
|
|
Jour
|
Voie d'inoculation
|
N° de lot du vaccin
|
|
Lot 1 (VI)
|
J9
|
Injection en S/C
|
L191644
|
150
|
|
Lot 2 (VI+VV)
|
J9
|
Injection en S/C
|
L191644
|
150
|
|
J25
|
Occulo-nasale ou « trempage du bec »
|
0205P1HKA
|
|
Lot témoin
|
-
|
-
|
-
|
50
|
J9= 9ème jour de la vie ; J25=
25ème jour de la vie ; S/C = sous cutanée
Les poussins du lot1 étaient vaccinés à
J9 avec le vaccin inactivé adjuvé (L191644) en injection par la
voie sous cutanée.
Les poussins du Lot2 quant à eux ont été
vaccinés deux fois à J9 et J25 respectivement avec un vaccin
inactivé adjuvé (L191644) et un vaccin vivant lyophilisé
à souche intermédiaire (2305R2S1B)
Le protocole de vaccination de la bande NO2 de
poulets de chair est récapitulé dans le tableau IV.
Tableau IV : Protocole de vaccination
de la bande NO2 de poulets de chair
|
Lots d'oiseaux
|
Protocole
|
Effectif d'oiseaux
|
|
Jour
|
Voie d'inoculation
|
N° de lot du vaccin
|
|
Lot 1 (VV)
|
J18
|
Occulo-nasale ou « trempage du bec »
|
2305R2S1B
|
100
|
|
Lot témoin
|
-
|
-
|
-
|
50
|
J18= 18ème jour de la vie
Les poussins du lot1 étaient vaccinés à
J18 avec le vaccin vivant à souche chaude (2305R2S1B) par la voie
occulo-nasale.
Nous avons utilisé différents vaccins et
différentes modalités de vaccination à des dates
différentes. Les poussins ont été regroupés en lots
identifiables avant d'être vaccinés. Un marquage à la
peinture a permis d'identifier les oiseaux de différents lots. Certains
poussins ont été marqués sur la tête et d'autres sur
les ailes avec des peintures de différentes couleurs. Le marquage est
refait régulièrement lorsqu'il commence à s'effacer.
Pour éviter la contamination par le virus vaccinal
(vaccin vivant atténué), les lots témoins ont
été élevés dans des bâtiments
différents des lots vaccinés.
1.3.1.2. Bande de coquelets
Le protocole de vaccination de la bande de coquelets est
récapitulé dans le tableau V.
Tableau V :
Protocole de vaccination de la bande de coquelets
|
Lots d'oiseaux
|
Protocole
|
Effectif d'oiseaux
|
|
Jour
|
Voie d'inoculation
|
N° de lot du vaccin
|
|
Lot1
|
J20
|
Occulo-nasale ou « trempage du bec »
|
0307P1S2C
|
100
|
|
Lot témoin
|
-
|
-
|
-
|
50
|
J20= 20ème jour de la vie.
Nous avons fait de la bande de coquelets un seul lot. Les
poussins de ce lot ont été vaccinés à J20 avec un
vaccin vivant atténué lyophilisé souche
intermédiaire (0307P1S2C).
La conduite de cet élevage expérimental est
assurée par nous même. L'alimentation et l'eau d'abreuvement ont
été distribuées ad libitum.
Les poussins du lot témoin n'ont reçu aucun
vaccin.
Tous les vaccins vivants atténués
lyophilisés ont été reconstitués
extemporanément avec de l'eau minérale et administrés par
voie occolo-nasale.
1.3.2. TECHNIQUE DE
PRELEVEMENTS
Dans notre élevage, 10 poussins ont été
sacrifiés dans chaque nouvelle bande pour récupérer du
sang dans le but de connaître le niveau en anticorps maternels à
la naissance avant toute vaccination.
Les prises de sang sont effectuées au niveau de la
veine alaire à l'aide d'une seringue, ceci chez les oiseaux dont la
veine alaire est un peu développée, tandis que chez les poussins
de 1 à 6 jours nous les avons décapité pour recueillir le
sang.
Les autres prélèvements ont été
effectués sur 10 poulets de chaque lot de chaque bande et par
séance de prise de sang.
1.3.2.1. Bandes de
poulets de chair
Les différentes dates de prélèvements de
chaque lot de la bande NO1 sont récapitulées dans le
tableau VI.
Tableau VI: Dates de
prélèvements du sang de la bande NO 1 de chair
|
Lots d'oiseaux
|
Dates de prélèvements
|
|
Lot
témoin
|
1er prélèvement J2
|
|
2ème prélèvement J3
|
|
3ème prélèvement J4
|
|
4ème prélèvement J5
|
|
5ème prélèvement J6
|
|
6ème prélèvement J9
|
|
7ème prélèvement J20
|
|
8ème prélèvement J25
|
|
9ème prélèvement J30
|
|
10ème prélèvement J40
|
|
11ème prélèvement J50
|
|
12ème prélèvement J60
|
|
Lot 1 (VI)
|
1er prélèvement J2
|
|
2ème prélèvement J3
|
|
3ème prélèvement J4
|
|
4ème prélèvement J5
|
|
5ème prélèvement J6
|
|
6ème prélèvement J9
|
|
7ème prélèvement J20
|
|
8ème prélèvement J25
|
|
9ème prélèvement J30
|
|
10ème prélèvement J40
|
|
11ème prélèvement J50
|
|
12ème prélèvement J60
|
|
Lot (VI +VV)
|
1er prélèvement J2
|
|
2ème prélèvement J3
|
|
3ème prélèvement J4
|
|
4ème prélèvement J5
|
|
5ème prélèvement J6
|
|
6ème prélèvement J9
|
|
7ème prélèvement J20
|
|
8ème prélèvement J25
|
|
9ème prélèvement J30
|
|
10ème prélèvement J40
|
|
11ème prélèvement J50
|
|
12ème prélèvement J60
|
VI : vaccin inactivé ; VV : vaccin
vivant.
Les différentes dates de prélèvements de
chaque lot de la bande NO2 sont récapitulées dans le
tableau VII.
Tableau VII: Dates de
prélèvements du sang de la bande NO2 de chair
|
Lots d'oiseaux
|
Dates de prélèvements
|
|
Lot
témoin
|
1er prélèvement J1
|
|
2ème prélèvement J13
|
|
3ème prélèvement J18
|
|
4ème prélèvement J28
|
|
5ème prélèvement J38
|
|
6ème prélèvement J48
|
|
7ème prélèvement J58
|
|
Lot 1 (VV)
|
1er prélèvement J1
|
|
2ème prélèvement J13
|
|
3ème prélèvement J18
|
|
4ème prélèvement J28
|
|
5ème prélèvement J38
|
|
6ème prélèvement J48
|
|
7ème prélèvement J58
|
VV : vaccin vivant
1.3.2.2. Bande de
coquelets
Nous avons réalisé plusieurs
prélèvements sur la bande de coquelets. Les dates de
prélèvements sont présentées dans le tableau
VIII.
Tableau VIII: Dates de
prélèvements du sang de la bande de coquelets.
|
Lots d'oiseaux
|
Dates de prélèvements
|
|
Lot
témoin
|
1er prélèvement J1
|
|
2ème prélèvement J6
|
|
3ème prélèvement J10
|
|
4ème prélèvement J16
|
|
5ème prélèvement J20
|
|
6ème prélèvement J30
|
|
7ème prélèvement J40
|
|
8ème prélèvement J50
|
|
9ème prélèvement J60
|
|
10ème prélèvement J70
|
|
11ème prélèvement J80
|
|
12ème prélèvement J90
|
|
13ème prélèvement J100
|
|
Lot 1 (VV)
|
1er prélèvement J1
|
|
2ème prélèvement J6
|
|
3ème prélèvement J10
|
|
4ème prélèvement J16
|
|
5ème prélèvement J20
|
|
6ème prélèvement J30
|
|
7ème prélèvement J40
|
|
8ème prélèvement J50
|
|
9ème prélèvement J60
|
|
10ème prélèvement J70
|
|
11ème prélèvement J80
|
|
12ème prélèvement J90
|
|
13ème prélèvement J100
|
VV : vaccin vivant.
1.3.3.
METHODES DE LABORATOIRE
1.3.3.1. Technique de récolte du sérum
Après rétraction du caillot, les
échantillons sont centrifugés à 3500 tours/mn pendant 10
minutes. Les sérums sont recueillis dans de petits tubes en plastique
(Cryotubes), identifiés puis conservés dans un
congélateur.
1.3.3.2. Méthode d'analyse sérologique
1.3.3.2.1 Définition - Principe
Le test ELISA (Enzyme Linked ImmunoSorbend Assay) a
été utilisé pour le titrage des anticorps.
Le test ELISA est une technique de dosage immuno-enzymatique
basée sur la réaction entre un antigène et son anticorps
spécifique et quantifiée par l'intermédiaire d'une
réaction enzymatique. Il existe plusieurs types de tests ELISA (ELISA
direct, ELISA indirect, ELISA sandwisch, ELISA compétition).
Nous avons utilisé ELISA indirect dont le principe est
le suivant :
Des antigènes connus et immobilisés sur une
phase solide en matière plastique sont mis en incubation avec des
anticorps correspondants présents dans les sérums à
tester. Il se forme un complexe antigène-anticorps. L'excès
d'anticorps n'ayant pas réagi est éliminé par lavage.
Le système antigène-anticorps-conjugué
porteur d'une enzyme en présence de son substrat spécifique va
provoquer une réaction colorée dont l'intensité est
proportionnelle à la quantité d'enzyme et donc à la
quantité du système antigène-anticorps-conjugué.
L'intensité de la réaction colorée est
donnée sous forme de densité optique (DO) par un lecteur de
plaque ELISA.
Pour la transformation de la densité optique (DO) du
titre en anticorps nous avons utilisé le logiciel KC junior.
Nous avons utilisé le kit CIVTEST AVI IBD (LABORATORIOS
HIPRA, 2007), le détail technique se trouve en annexe n°4.
1.3.4.
ANALYSES STATISTIQUES
Les données récoltées ont
été saisies et traitées par le tableur EXCEL
de Microsoft et le logiciel EPI-INFO.
1.3.5.
INTERPRETATIONS DE RESULTATS
Le sérum est positif si son titre en anticorps est
supérieur à 357, il est négatif si son titre est
inférieur à 268.
Les sérums dont les titres sont très
élevés, ont été retirés et dilués
à nouveau.
Notre travail effectué selon le plan
étalé précédemment nous a donné des
résultats qui seront présentés dans le chapitre
suivant.
CHAPITRE 2 : RESULTATS SEROLOGIQUES
2.1.
RESULTATS DE LA VACCINATION DES POULETS DE CHAIR
2.1.1 BANDE N°1 DE POULETS DE CHAIR
Le tableau IX donne l'ensemble des résultats
sérologiques de la bande NO1 de poulets de chair.
Tableau IX : Résultats
sérologiques de la bande NO1 de poulets de chair
|
Lots d'oiseaux
|
Effectif d'oiseaux
|
Vaccin/ date de vaccination
|
Titre moyen en Acs
|
Interprétation
|
Age de prélèvement (jours)
|
|
Acs maternels
|
|
-
|
7320,06383
|
Positif
|
J2
|
|
Lot 1 (VI)
|
150
|
L191644 / J9
|
6218,2863
|
Positif
|
J3
|
|
5552,1993
|
Positif
|
J4
|
|
5009,8072
|
Positif
|
J5
|
|
4465,6072
|
Positif
|
J6
|
|
2120,28
|
Positif
|
J9
|
|
2975,19
|
Positif
|
J20
|
|
3000,25
|
Positif
|
J25
|
|
3068,16
|
Positif
|
J30
|
|
3240,63
|
Positif
|
J40
|
|
4001,96
|
Positif
|
J50
|
|
5223,19
|
Positif
|
J60
|
|
Lot 2 (VI+VV)
|
150
|
L191644 / J9 et 0205P1HKA /J25
|
6218,2863
|
Positif
|
J3
|
|
5552,1993
|
Positif
|
J4
|
|
5009,8072
|
Positif
|
J5
|
|
4465,6072
|
Positif
|
J6
|
|
2120,28
|
Positif
|
J9
|
|
2975,19
|
Positif
|
J20
|
|
3000,25
|
Positif
|
J25
|
|
4467,28
|
Positif
|
J30
|
|
5669,18
|
Positif
|
J40
|
|
6766,21
|
Positif
|
J50
|
|
9777,24
|
Positif
|
J60
|
|
Lot témoin
|
50
|
-
|
6218,2863
|
Positif
|
J3
|
|
5552,1993
|
Positif
|
J4
|
|
5009,8072
|
Positif
|
J5
|
|
4465,6072
|
Positif
|
J6
|
|
2120,28
|
Positif
|
J9
|
|
218,15
|
Négatif
|
J20
|
|
190,56
|
Négatif
|
J25
|
|
108,75
|
Négatif
|
J30
|
|
95,85
|
Négatif
|
J40
|
|
71,91
|
Négatif
|
J50
|
|
50,95
|
Négatif
|
J60
|
Acs : Anticorps
La figure 5 illustre l'évolution du titre en
anticorps du lot1 de la bande NO1 vacciné avec le vaccin
inactivé (L191644) à J9.
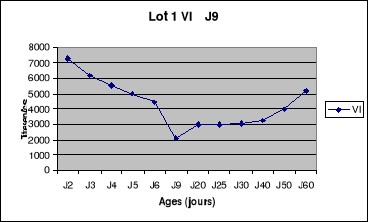
Figure 5: Evolution du titre en
anticorps du lot1 de la bande N°1 de poulets de chair
Après la vaccination, le titre en anticorps de 2120,28
à J9 a connu une augmentation brusque à J20, puis il remonte
progressivement jusqu'à J60.
La figure 6 décrit l'évolution du titre en
anticorps du lot2 vacciné avec une association d'un vaccin
inactivé et d'un vaccin vivant; un vaccin inactivé (L191644)
à J9 puis un vaccin vivant (0205P1HKA) à J25.
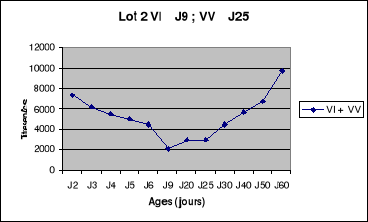
Figure 6: Evolution du titre en
anticorps du lot2 de la bande N°1 de poulets de chair
Après la vaccination, le titre en anticorps du lot2 a
connu une montée constante de 2975,19 à J20 jusqu'à J25.
La croissance du niveau titre en anticorps est spectaculaire de J30 à
J60.
La figure 7 illustre l'évolution du titre en anticorps
du lot témoin non vacciné de la bande de poulets de chair.
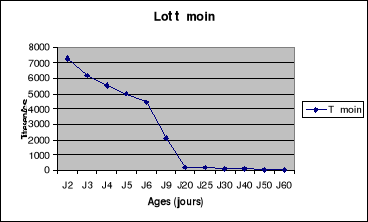
Figure 7 : Evolution du titre en
anticorps du lot témoin de la bande N°1 de poulets de chair
Sans vaccination, le titre en anticorps du lot témoin
de 7320,6383 à J2 a chuté considérablement jusqu'à
218,15 à J20. Il continue de diminuer avec le temps atteignant une
valeur de 50,95 à J60.
La figure 8 récapitule les différentes courbes
d'évolutions du titre en anticorps de la bande NO1de poulets
de chair.
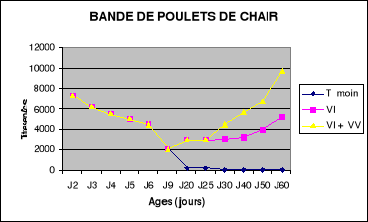
Figure 8 : Evolution des titres
en anticorps de la bande NO1 de poulets de chair
2.1.2 BANDE N°2 DE POULETS DE CHAIR
Le tableau X donne l'ensemble des résultats
sérologiques de la bande NO2 de poulets de chair.
Tableau X : Résultats
sérologiques de la bande NO2 de poulets de chair
|
Lots d'oiseaux
|
Effectif d'oiseaux
|
Vaccin/ date de vaccination
|
Titre moyen en Acs
|
Interprétation
|
Age de prélèvement (jours)
|
|
Acs maternels
|
|
-
|
4506,94
|
Positif
|
J1
|
|
Lot 1 (VV)
|
100
|
2305R2S1B/ J18
|
1556,19
|
Positif
|
J13
|
|
710,37
|
Positif
|
J18
|
|
5161,16
|
Positif
|
J28
|
|
6342,36
|
Positif
|
J38
|
|
7867,44
|
Positif
|
J48
|
|
867,39
|
Positif
|
J58
|
|
Lot témoin
|
50
|
-
|
1556,19
|
Positif
|
J13
|
|
710,37
|
Positif
|
J18
|
|
203,65
|
Négatif
|
J28
|
|
116,14
|
Négatif
|
J38
|
|
97,56
|
Négatif
|
J48
|
|
60,38
|
Négatif
|
J58
|
Acs : Anticorps
La figure 9 illustre l'évolution du titre en
anticorps du lot1 vacciné avec le vaccin vivant à souche chaude
(2305R2S1B) à J18
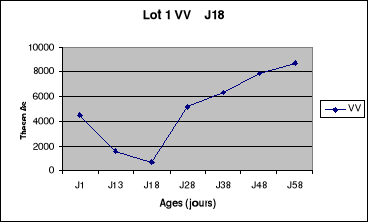
Figure 9: Evolution du
titre en anticorps du lot1 de la bande N°2 de poulets de chair.
Après la vaccination, le titre en anticorps de 710,37
à J18 a connu une augmentation spectaculaire à J28, puis il
remonte progressivement jusqu'à J58.
La figure 10 illustre l'évolution du titre en anticorps
du lot témoin non vacciné de la bande N°2 de poulets de
chair.
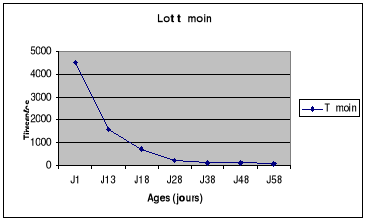
Figure 10 : Evolution du titre en
anticorps du lot témoin de la bande N°2 de poulets de chair
Le titre en anticorps sans vaccination, du lot témoin
de 4506,94 à J1 a chuté considérablement jusqu'à
710,37 à J18. Ce taux continue de diminuer au fil de temps pour
atteindre une valeur de 60,38 à J58.
La figure 11 récapitule les différentes courbes
d'évolutions du titre en anticorps de la bande NO2 de poulets
de chair.
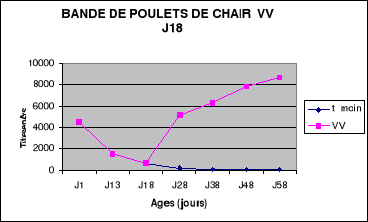
Figure 11 : Evolution des titres
en anticorps de la bande NO2 de poulets de chair
2.2.
RESULTATS DE LA VACCINATION DE COQUELETS
Le tableau XI présente les résultats
sérologiques de la bande de coquelets vaccinée une seule fois par
le vaccin vivant atténué (0307P1S2C).
Tableau XI : Résultats
sérologiques de la bande de coquelets
|
Lots d'oiseaux
|
Effectif d'oiseaux
|
Vaccin/ date de vaccination
|
Titre moyen en Acs
|
Interprétation
|
Age de prélèvement (jours)
|
|
Acs maternels
|
|
-
|
7252,84
|
Positif
|
J1
|
|
Lot 1 (VV)
|
100
|
0307P1S2C / J20
|
5258,9
|
Positif
|
J6
|
|
2291,2
|
Positif
|
J10
|
|
1716,9
|
Positif
|
J16
|
|
816,36
|
Positif
|
J20
|
|
2108,44
|
Positif
|
J30
|
|
2866,39
|
Positif
|
J40
|
|
3545,11
|
Positif
|
J50
|
|
4954,67
|
Positif
|
J60
|
|
5415,6
|
Positif
|
J70
|
|
7483,13
|
Positif
|
J80
|
|
8866,3
|
Positif
|
J90
|
|
9855,7
|
Positif
|
J100
|
|
Lot témoin
|
50
|
-
|
5258,9
|
Positif
|
J6
|
|
2291,2
|
Positif
|
J10
|
|
1716,9
|
Positif
|
J16
|
|
816,36
|
Positif
|
J20
|
|
413,55
|
Positif
|
J30
|
|
203,77
|
Négatif
|
J40
|
|
181,62
|
Négatif
|
J50
|
|
156,45
|
Négatif
|
J60
|
|
70,58
|
Négatif
|
J70
|
|
58,26
|
Négatif
|
J80
|
|
42,33
|
Négatif
|
J90
|
|
34,22
|
Négatif
|
J100
|
Acs : Anticorps
Les figures 12 et 13 illustrent respectivement les
évolutions des titres en anticorps du lot1 vacciné avec le vaccin
vivant atténué (0307P1S2C) à J20 et du lot témoin
non vacciné de la bande de coquelets.
Figure 12 : Evolution du titre en
anticorps du lot1 de la bande de coquelets.
Avant la vaccination, le titre en anticorps de 7252,84
à J1 a chuté fortement jusqu'à atteindre 816,36 à
J20. Après la vaccination, il a connu une montée progressive de
J30 à J100.
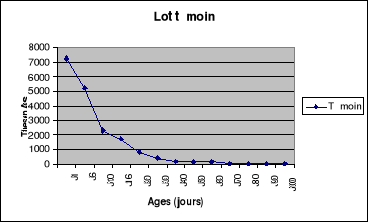
Figure13 : Evolution du titre en
anticorps du lot témoin de la bande de coquelets
Sans vaccination, le titre en anticorps du lot témoin
de 7252,84 à J1 a chuté de manière considérable
jusqu'à 203,77 à J40. Il continue de diminuer avec le temps
atteignant une valeur de 34,22 à J100.
La figure 14 montre l'ensemble des courbes d'évolutions
de différents titres en anticorps de la bande de coquelets.
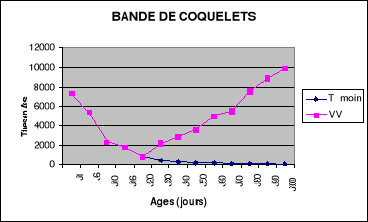
Figure14 : Evolution des titres
en anticorps de la bande de coquelets
CHAPITRE 3 : DISCUSSION
ET RECOMMANDATIONS
3.1. DISCUSSION
3.1.1. DISCUSSION DE LA METHODOLOGIE
3.1.1.1. ZONE ET PERIODE D'ETUDE
Dans le cadre de notre étude, nous avons choisi de
travailler dans la région de Dakar particulièrement dans le
département de Dakar. Le choix de cette zone se justifie par le fait
qu'il existe plusieurs fermes modernes ou semi- industrielles.
Notre étude s'est déroulée de septembre
2007 à juin 2008. Nous avons choisi cette période parce qu'elle
est favorable à la mise en place des bandes de poulets. Pendant cette
période, la température moyenne est comprise entre 22 et
25°C.
3.1.1.2. CHOIX DE L'ELEVAGE
Le choix de notre élevage dans l'enceinte de
l'E.I.S.M.V. est basé sur le fait qu'il y'ait des bâtiments
disponibles pour notre expérimentation. Ces derniers sont
également plus proches de notre habitation, permettant ainsi un meilleur
suivi des animaux.
3.1.1.3. CHOIX DES ANIMAUX
Nous avons travaillé sur des poussins qui provenaient
du couvoir de la Sénégalaise de Distribution de Matériel
Avicole (SEDIMA) pour les coquelets et les poulets de chair.
Il est à noter que le choix des animaux à
sacrifier pour prélever le sang est fait au hasard.
3.1.1.4. VACCINS UTILISES
Lors de notre étude, nous avons utilisé des
vaccins que l'on trouve sur le marché sénégalais.
3.1.1.5. MODE D'ADMINISTRATION DES VACCINS
Le choix de la voie d'administration des vaccins repose sur la
nature du vaccin. Ainsi nous avons pratiqué les vaccinations
individuelles (injection en sous cutané pour le vaccin inactivé
et l'administration des vaccins vivants atténués a
été faite par voie occulo-nasale).
3.1.1.6. METHODE D'ANALYSE
Nous avons utilisé le test d'ELISA pour le
titrage des anticorps. Ce dernier est un test d'utilisation courante au
laboratoire.
C'est aussi un test de mise au point récent, très
sensible, reproductible et qui est plus commode d'utilisation que le test de
substitution (qui est la précipitation en milieu
gélifié).
3.1.2. DISCUSSION DES
RESULTATS
3.1.2.1. RESULTATS SELON LE MODE DE VACCINATION
La vaccination contre la maladie de Gumboro
dépend surtout du niveau du titre en anticorps d'origine maternelle des
poussins. En effet, une vaccination est efficace lorsqu'il existe un taux
d'anticorps d'origine maternelle compatible avec la souche vaccinale soit un
titre de 1/350 en ELISA (kit IDEXX) pour les vaccins intermédiaires et
1/500 pour les vaccins à souches dites « chaudes »
(FERRE et coll., 2005). Ainsi, au moment de la vaccination le niveau du titre
en anticorps de nos poussins était de 1/2120 pour les poulets de chair
et 1/816 pour les coquelets.
Quant à la
vaccination avec le vaccin inactivé, elle peut se faire sans
problème à l'âge d'un jour, car le vaccin inactivé
est insensible aux anticorps maternels (DESBORGES, 1999).
3.1.2.1.1. Vaccination avec le vaccin vivant
atténué
Il faut souligner que le niveau élevé en
anticorps maternels inhibe la réponse immunitaire à la
sollicitation antigénique. Ici, nous présentons les
résultats de chaque vaccin vivant utilisé puis nous les
comparons.
§ Lot1 de coquelets vaccinés avec AVI
IBD inter (0307P1S2C)
Le résultat du lot1 (VV à J20) de la bande de
coquelets montre que les coquelets ont très bien réagi à
la vaccination. On observe une bonne séroconversion (figure 12). Le
niveau du titre en anticorps de 1/816 à J20 est donc compatible avec une
prise vaccinale. On constate aussi une montée graduelle des anticorps.
Ces résultats confirment les études réalisées par
CARDINALE et coll. (1998) et ceux de ABDEL-AZIZ (2007).
§ Lot1 de poulets de chairs vaccinés
avec IBDL inter CEVAC (2305R2S1B)
Les résultats du lot 1 (VV à J18) de la bande de
poulets de chair NO2, montrent que la réaction immunitaire
est spectaculaire.
On observe que le lot 1 de la bande de poulets de chair
NO2 vacciné avec le vaccin CEVAC IBDLND a
très bien réagi par rapport au lot 1de la bande de coquelets
vacciné avec le vaccin AVI IBD interND. Ceci peut être
dû au fait que CEVAC IBDLND est un vaccin à souche
chaude, plus immunogène que la souche intermédiaire du vaccin
AVI IBD interND .
La différence observée entre les lots des bandes
de poulets de chair NO2 et de coquelets est significative (P <
0,05).
3.1.2.1.2. Vaccination avec
le vaccin inactivé
Le résultat observé sur le lot1 de la bande de
poulets de chair montre que les poussins ont bien répondu à la
vaccination (figure 5). Nos résultats corroborent avec ceux de
ABDEL-AZIZ (2007). Mais ce dernier a travaillé sur des coquelets.
3.1.2.1.3. Vaccination avec
une association vaccin vivant atténué et vaccin
inactivé
§ Lot 2 de poulets de chair vaccinés
avec un vaccin vivant AVI IBD inter (0205P1HKA) et vaccin inactivé
Gumbopest (L191644)
Les résultats du lot2 de la bande poulets de chair
montrent que le titre en anticorps connaît une augmentation
considérable à J30 (figure 6). Nos résultats confirment
ceux de KOUZOUKENDE (2004) et de ABDEL-AZIZ (2007).
3.1.2.2. RESULTATS
COMPARATIFS DES BANDES
§ Bande NO1 de poulets de
chair
Les résultats de la
bande N°1 de poulets de chair montrent que le lot 1 et le lot 2 ayant
reçus respectivement un vaccin inactivé (VI) et une association
des vaccins (VI+VV), ont des titres en anticorps bien au dessus du seuil de
protection qui est de 1250 selon GARDIN (1991) durant toute la durée de
la bande (figure 8).
On observe que la courbe des anticorps du lot 2 est au dessus
de celle du lot 1. Ceci peut être du à la combinaison des deux
vaccins (VI+VV) chez les poussins du lot 2. La différence
observée entre les lots de cette bande de poulets de chair est
significative (P < 0,05).
3.2. RECOMMANDATIONS
3.2.1. AUX CHERCHEURS
Etant donné que qu'il n'existe pas encore de date exacte
de vaccination contre la maladie de Gumboro, nous recommandons que d'autres
études soient faites dans le même sens avec les mêmes types
de vaccins tant en expérimentation que dans différents
élevages sur le terrain afin de pouvoir déterminer une date
optimale de vaccination proche du seuil de positivité en anticorps
maternels.
3.2.2. AUX PROPRIETAIRES DES COUVOIRS
Les couvoirs doivent mettre à la disposition
des éleveurs des titres en anticorps maternels après chaque
éclosion afin de permettre aux techniciens d'élevage de
déterminer la date de vaccination
3.2.3. AUX
ELEVEURS
A l'issue de notre étude expérimentale, il ressort
que l'association d'un vaccin vivant et d'un vaccin inactivé permet une
meilleure protection des volailles par rapport aux autres vaccins
utilisés individuellement.
Le vaccin inactivé, insensible aux anticorps maternels,
induit une protection humorale progressive et durable alors que le vaccin
vivant quant à lui engage une course contre le virus sauvage pour
coloniser les cellules de bursiques. Ce vaccin vivant assure une protection
précoce, mais moins durable que celle du vaccin inactivé.
Par ailleurs il est à noter que le vaccin vivant doit
être préparé extemporanément avec de l'eau
minérale et administré par voie occulo-nasale.
Ainsi nous recommandons, une meilleure collaboration avec
les agents de la santé animale afin que cette étude soit à
nouveau faite dans les différents élevages sur le terrain.
3.2.4. AU POUVOIR
PUBLIC
Nous pensons que l'Etat doit :
· Subventionner les vaccins inactivés pour les
rendre plus accessibles aux éleveurs.
· Mettre sur pied un programme d'éradication de la
maladie de Gumboro.
CONCLUSION
GENERALE
La filière avicole, particulièrement
l'aviculture moderne basée sur l'exploitation des poulets de chair pour
la production de viande et des poules pondeuses pour la production des oeufs de
consommation occupe une place de choix dans le secteur de l'élevage au
Sénégal.
Pour répondre au besoin de viandes de volaille et
d'oeufs de consommation face à la situation démographique
croissante chaque année, le Sénégal s'est engagé
sur la voie de l'aviculture afin d'augmenter sa production en protéines
animales. Cette aviculture a connu un essor considérable ces
dernières années avec la multiplication des fermes avicoles dans
les zones périurbaines. Au Sénégal, la contribution de
cette filière au PIB national était estimée à 6% en
2001 (SENEGAL.MAE, 2001).
Malheureusement l'envol de cette aviculture se trouve
confronté à des contraintes zootechniques,
technico-économiques, institutionnelles et pathologiques. Si les autres
contraintes peuvent être maîtrisées facilement, les maladies
restent une préoccupation majeure. La maladie de Gumboro entraîne
de lourdes pertes économiques. A ces pertes s'ajoutent les coûts
élevés de la médication et les phénomènes de
résistance.
Afin de trouver une solution à ce problème nous
avons mené cette étude expérimentale sur quelques vaccins
contre la maladie de Gumboro disponibles sur le marché
sénégalais.
Notre étude s'est déroulée de septembre
2007 à juin 2008 dans l'enceinte de l'Ecole Inter Etats des Sciences et
de Médecine Vétérinaire de Dakar. Elle a pour objectif
d'évaluer les protocoles de vaccination à partir des vaccins
disponibles sur le marché de Dakar.
Nous avons réalisé un suivi sérologique
sur 3 bandes dont 2 bandes de poulets de chairs et une bande de coquelets. Au
total 760 sérums ont été analysés en ELISA pour le
suivi des anticorps vaccinaux contre la maladie de Gumboro.
Les résultats que nous avons obtenus montrent, que les
protocoles de vaccination pratiqués lors de notre expérimentation
ne laissent aucun risque que les oiseaux soient atteints de la maladie de
Gumboro avant la date de vaccination; car ces protocoles fixés par nous
même respecte exactement la décroissance réelle des
anticorps maternels des poussins mis en place.
Dans la bande N°1 de poulets de chair, le lot 1 et lot 2
ayant reçus respectivement un vaccin vivant inactivé et une
association des vaccins (vaccin inactivé +vaccin vivant), ont
très bien réagi à la vaccination et ont pu garder leurs
titres en anticorps au dessus du seuil de protection qui est de 1250 selon
GARDIN (1991) pendant toute la durée de l'élevage. En outre on
observe que la courbe d'évolution du titre en anticorps du lot 2 (VI +
VV) est au dessus de celle du lot 1 (VV). Cette différence
observée entre les lots est significative (P< 0,05).
Dans le lot 1 de la bande N°2 de poulets de chair,
vaccinés uniquement avec le vaccin vivant à souche chaude, une
bonne réponse immunitaire a été observée. De
même que dans le lot 1 de la bande de coquelets vaccinés avec le
vaccin vivant à souche intermédiaire où le titre en
anticorps est resté supérieur au seuil de protection durant tout
l'élevage. Mais la réponse immunitaire des oiseaux
vaccinés avec le vaccin à souche chaude est nettement
supérieure à celle des oiseaux qui ont reçu le vaccin
à souche intermédiaire.
Ces résultats montrent que l'association vaccin
inactivé et vaccin vivant donne de meilleurs résultats car le
vaccin inactivé, insensible aux anticorps maternels, induit une
protection humorale progressive et durable alors que le vaccin vivant assure
une protection précoce, mais moins durable que celle du vaccin
inactivé.
Au terme de notre étude, nous recommandons la
réalisation d'un autre essai dans les différents élevages
sur le terrain qui viendrait en appoint à nos résultats et nous
suggérons au pouvoir public de Subventionner les vaccins
inactivés pour les rendre plus accessibles aux éleveurs et enfin
aux couvoirs de mettre à la disposition des clients et des
vétérinaires prescripteurs le niveau du titre en anticorps
maternels des poussins à chaque éclosion afin que les
vétérinaires puissent déterminer facilement l'âge
optimal de la vaccination.
BIBLIOGRAPHIE
1- ABDEL-AZIZ A. I., 2007
Contribution à la lutte contre la maladie de
Gumboro : Détermination du meilleur protocole de vaccination
à partir des vaccins disponibles sur le marché de Dakar.
Thèse: Méd.Vét. : Dakar ; 48
2- AHAMET M., 2004
Incidence économique de la maladie de Gumboro sur les
performances des poules pondeuses : Cas des poules élevées
en cage dans la région de Dakar (SENEGAL).
Thèse: Méd.Vét. : Dakar ; 20
3- BAKARI. A. R., 2006
Incidence économique de la maladie de Gumboro sur les
performances des poulets de chair dans la zone périurbaine de Dakar.
Thèse: Méd.Vét. : Dakar ; 30
4- BENNEJEAN G., 1977
Session générale du comité de l'O.I.E.
Rapport n° 216 XLV ème
Paris 23-28 Mai 1977. - Paris : OIE.
5- BENOIT J., 1950
Les glandes Endocrines (290-334)
In : Grassé : Traité de zoologie
Tome XV, Oiseaux.
Paris : Masson Edt. 290-334.
6- BIAOU F. C., 1995
Contribution à l'étude des causes aggravantes de
la maladie de Gumboro dans les élevages des poulets de chair de la
région de Dakar.
Thèse: Méd.Vét. : Dakar ; 5
7- BRICOUT F. ; JOUBERT L. et HURAUX J.M.,
1974
Maladie de Gumboro (495-497).
In : Diagnostic sero-immunologique des viroses
humaines et animales.
Paris : Maloine.-581 p.
8- BRUGERE-PICOUX J.F., 1974
La maladie de Gumboro.
Rec. Méd.Vét.,
150 : 883-889.
9- BRUGERE-PICOUX J.F. et SAVAD D., 1987
Environnement, stress et pathologie respiratoire chez les
volailles. Note 1 : facteurs physiques.
Rec. Méd.Vét.,
138 (4): 339-340.
10- BRUGERE-PICOUX J. et T SILIM A., 1992
Manuel de pathologie aviaire.
Paris : Edition France Agricole. - 381p
11- BULDGEN A.; DETIMMERMAN F.; SALL B. et COMPERE
R., 1992
Etude des paramètres démographiques et
zootechniques de la poule locale dans le bassin arachidier
sénégalais.
Revue Elev. Méd.Vét. Pays trop.,
45 :341-647.
12- BULDGEN A. ; PARENT R. ; STEYAET
P. et LEGRAND D., 1996
Aviculture semi- industrielle en climat tropical : guide
pratique.
Gembloux : Les Presses agronomiques de Gembloux. - 112
p.
13- CARDINALE E. ; ARBELOT B. ; KABORET
Y. ; DAYON J.F. ; BIAOU C. et BADA ALGOM O., 1998.
La maladie de Gumboro dans les élevages
semi-industriels de la région de Dakar.
Revue Elev. Méd.Vét. Pays
trop.,51 (4): 293-296.
14- CHATELAIN E., 1986
Anatomie des volailles.
Lyon ;Laboratoire d'anatomie. E NV de Lyon.
15- CHEVILLE N. F., 1967.
Studies on the pathogenesis of Gumboro disease in the bursa of
Fabricius, spleen and thymus of the chickens.
Am. J. Path, 51: 527- 551.
16- COSGROVE A.S., 1962
An apparently new disease of chickens avian nephrosis.
Avian dis, 6: 385- 389.
17- CONSTANTIN A., 1998
Le système immunitaire des oiseaux.
Revue du Syndicat National des Vétérinaires
Inspecteurs du Ministère de l'Agriculture Français,
(100-103) : 455-475.
18- DESBORGESP., 1999
Gallivac IBD : Détermination de la date de
vaccination. Lyon : MERIAL.- (Information des Services Techniques aviaires
de MERIAL)
19- DIALLO Y.H., 1978
Contribution à l'étude de la maladie de Gumboro
au Sénégal.
Thèse : Méd.Vét. : Dakar ;
5
20- DIOP A., 1982
Le poulet de chair au Sénégal: production,
commercialisation et perspectives de développement.
Thèse: Méd.Vét. : Dakar ; 8
21- FARAGHER J.T., 1972
Infectious bursal disease of chicken.
Vet. Bull., 42: 361-369.
22- FERRE J. ET BELLOC C., 2005
Détermination de la date de vaccination contre la
maladie de Gumboro en élevage de poulets label. (370-374)
In : Sixièmes journées de la
Recherche Avicole, Saint Malo, 30 et 31 mars 2005 : 370-374
23- FRANCE. MINISTERE DE L'ECONOMIE DES FINANCES ET DE
L'INDUSTRIE, 2005
La filière avicole au Sénégal :
Rapport de la mission économique auprès de l'Ambassade de France
à Dakar. Paris: MEFI. - 4 p
24- GUEYE L., 1999
Contribution à l'étude de la qualité
microbiologique des oeufs de consommation de la région de Dakar.
Thèse : Méd.Vét.: Dakar ; 7
25- HABAMENSHI P. E., 1994
Contribution à l'étude des circuits de
commercialisation du poulet de chair au Sénégal : Cas de la
région de Dakar.
Thèse : Méd. Vét.: Dakar ; 12
26- HABYARIMANA W., 1998
Contribution à l'étude des contraintes au
développement de l'aviculture moderne dans la région de
Dakar : Aspects techniques et institutionnels.
Thèse : Méd.Vét.: Dakar ; 8
27- HANSON B.S., 1967
Post mortem lesion diagnostic of certain poultry disease.
Vet. Rec., 80 :109-122.
28- IBRAHIMA H., 1991
Influence des facteurs climatiques sur l'état
sanitaires et les performances zootechniques des poulets de chair dans la
région de Dakar (Sénégal) études
bibliographiques et observation sur le terrain.
Thèse : Méd.Vét. : Dakar ;
25
29- INSTITUT GEOGRAPHIQUE NATIONAL, 1977
Atlas du Sénégal.
Paris : IGN.-147p
30- ITAVI, 1996
La production et la gestion d'un élevage de volailles
fermières
Paris : ITAVI,. -112p.
31- JEUNE AFRIQUE, 2000
Atlas du Sénégal.
Paris : Les éditions jeune Afrique.-84 p
32- KOE P. F., 2001.
Contribution à l'étude de l'impact de la
coccidiose chez les poules pondeuses dans les élevages semi-industriels
au Sénégal.
Thèse: Méd.Vét. : Dakar; 7
33- KOUZOUKENDE T. N., 2004.
Contraintes liées à la durée de
production de poulets de chair en période de chaleur : adaptation
du protocole de vaccination contre la vaccination de la Maladie de Gumboro.
Mémoire DEA: Productions Animales: Dakar (EISMV); 13
34- LISSOT G., 1941
Poules et oeufs.
Paris: Flammarion. - 163p
35- LUNGER P. D. et MADDUX T. C., 1972
Fine structure studies of the avian infectious boursal
agent.
I. In ovo viral morphogenesis
Avian dis, 16: 874- 893.
36- MURPHY C. D., 1968
Epidemiological analysis of disease reports of the southern
conference on Avian Disease Poult. Sci., 47: 1700
.37- OUMAR B. A., 1994
Contribution à l'étude des dominantes
pathologiques dans les élevages avicoles semi-industriels de la
région de Dakar : enquêtes anatomopathologiques.
Thèse: Méd.Vét. : Dakar ; 21
38- PARENT R. ; ALOGNINOUWA T.
et KABORET Y., 1989.
Analyse de quelques stress fréquents en aviculture en
Afrique intertropicale. Communication aux journées de
l'élevage : 25-26 novembre 1989 à Thiès,
Sénégal.
39- PETEK M.; FELLUGA B. ; BORGHI G. ET
BARONI A., 1967.
Proprieta biologiche di un reovirus isolata da un focolaio di
malattia Gumboro.
Atti. Soc. Ital. Sci. Vet.,
22 : 875- 879.
40- PICAULT J. P., 1988
Les maladies immunodépressives des volailles.
Revue du syndicat National des vétérinaires
inspecteurs du Ministère de l'Agriculture français
(100-103) : 545 - 550
41- PICOUX M., 1983
Maladies infectieuses de volailles
Rev. Avi., 5: 15-18
42- RAVELSON C., 1990
Situation et contraintes de l'aviculture villageoise à
Madagascar (135-138).
In: CTA-seminar proceedings on Smallholder Rural
Poultry Production 9-13 October Thessaloniki Greece. - Wageningen: CTA. -
182p
43- ROSENBERGER J.K., 1989
Infectious bursal disease
In: A laboratory manual for isolation and
identification of avian pathogens: 3ème éd. -
University of Pennsylvania: American Association of Avian
Pathologist, p. 165-166
44- SAGNA F., 1975
Note préliminaire concernant l'apparition d'une
nouvelle affection aviaire au Sénégal: la maladie de Gumboro.
Dakar : Laboratoire national d'Elevage et de Recherche
Vétérinaires (L.N.E.R.V).- 7p
45- SALIM A. ET REKIK R.M., 1992
Immunologie des oiseaux. (87-96)
In : Manuel de Pathologie Aviaire.
-Maisons-Alfort : ENV. - 381p
46- SCALA G. ; CORONA M. ; PELAGAGALLI G.
V. et GERMANA G., 1988
Sur l'évolution de la bourse de Fabricius chez le
canard.
Anat. Histol. Embry., 17 : 97-
106.
47- SENEGAL .ministère de l'agriculture.
Direction de l'élevage., 1995
Rapport annuel.
Dakar: DIREL.-64p
48- SENEGAL. ministère de l'agriculture et de
l'élevage, 2001.
Statistiques 2000 sur la filière avicole moderne.
Dakar: DIREL; CNA.- 10p.
49- SENEGAL ministere de l'elevage. centre national
d'aviculture, 2007.
Statistiques 2006 sur la filière avicole moderne.
Dakar : CNA-11p
50- SENEGAL. ministere de l'elevage. centre national
d'aviculture, 2006.
Statistiques 2005 sur la filière avicole moderne.
Dakar : CNA-11p
51- STEWART-BROWN B. ; GRIEVE D. et HEIHTSH M.,
1993
La maladie de Gumboro : une pathologie mondiale.
L'aviculteur, 545 : 72-75
52- TCHAMDJA E., 2001
Evaluation de la protection vaccinale contre la maladie de
Gumboro et de la maladie de Newcastle chez les poulets de chair et les poules
pondeuses dans les élevages semi industriel de la région de
Dakar : Détermination expérimentale du meilleur protocole
vaccinal.
Thèse : Méd.Vét. : Dakar ;
19
53- THORTON D. H., 1976
Standard requirement for vaccine against infection bursal
disease
Develop.biol. standard, 33: 343
54- THORTON D. H. et PATTISON M., 1975
Comparison of vaccines against infectious bursal disease
J. Comp. Path, 85: 597
55- TOIVANEN P., NAUKKARINENE H. et D
VANNINO O., 1987
whate is the function of the bursa of Fabricius.
Avian immunology (Basis and practice), Vol
1: 79-92.
56- VANMARCK E. J., 1992
La maladie de Gumboro : la vaccination précoce.
Afrique agriculture, 197 :
59-61
57- VINDEVOGEL H., 1992
La maladie de Gumboro. (155-163)
In : Manuel de pathologie aviaire.-Maison-Alfort,
France ; ENV. - 381p
58- VINDEVOGEL H., 1976
Gumboro disease.
Avian Path, 5; P 31.
59- VINDEVOGEL H. ; MEULEMANS G. et HALEN
P., 1976
Nécessité d'une prophylaxie de la maladie de
Gumboro
Bulletin technique avicole Nobilis, (1): 19-20
60- WINTERFIELD R. W., 1969
Immunity response to the bursal infectious agent.
Avi.dis., 13:
548-557.
61- WINTERFIELD R. W. et HITCHNER S.B.,
1964
Gumboro disease
Poult. Dig., 23: 206-207.
62- WINTERFIELD R. W. et HITCHNER S.B.,
1962
Etiology of an infectious nephritis- nephrosis syndrome of
chickens.
Vet. Res., 23: 1273-1279
63- WYETH P. J., 1976
La dépression immunitaire
Bull. Tech. Avicole nobilis, 1:
10-11.
WEBOGRAPHIE
64- COULIBALY F.; CHEVALIER C.; POUS J.;
BRESSANELLI S.; LEPAULT J.; NAVAZA J.; DELMAS B. et REY
F., 2003.
Structure de particules sous virales
dodécaédriques des birnavirus : identification des
déterminants d'assemblage, d'antigénicité et de virulence.
<En ligne >
Accès Internet :
http//www.Imcp.jussieu.fr/afc/doc-pdf/AF003/VB-06.pdf
(Page consultée le 23 /01/2008)
65- FARUQUI N.I.; NIANG S. ET REDWOOD M., 2006
Untreated wastewater use in market gardens: a case study of
Dakar,
Sénégal <En ligne >
Accès Internet:
http://www.idrc.ca/en/ev-68338-201-1-DO_TOPIC.html
(Page consultée le 12 /10/2007)
66- SAVILLE P., 1999
La bursite infectieuse
Santé animale : Fiche technique
N°2/COMMUNAUTE du PACIFIQUE/Secrétariat. <En ligne >
Accès Internet :
http//www.spc.int/rahs/publication/leaflets/AHAL%2002F.pdf
(Page consultée le 12 /01/2008)
67- SENEGAL.MINISTERE DE L'EQUIPEMENT ET DES
TRANSPORTS. DIRECTION DES TRAVAUX GEOGRAPHIQUES ET CARTOGRAPHIQUES,
2007
La carte des collectivités locales.
Dakar : DTGC. <En ligne >
Accès Internet :
http//www.au-senegal.com/dtgc/index.html
(Page consultée le 11 /12/2007)
68- SENEGAL - MSN Encarta, 2008
<En ligne >
Accès Internet :
http//www.fr.encarta.msn.com/encyclopedia_761555319_2/s%C3%A9n%C3%A9gal.html
(Page consultée le 12 juillet 2008)
ANNEXES
Annexe I : Evolution des effectifs de volailles mis en
élevage de 1997 à 2006
|
Poussins
|
Origine
|
1997
|
1998
|
1999
|
2000
|
2001
|
2002
|
2003
|
2004
|
2005
|
2006
|
|
|
Production locale
|
467 423
|
555 285
|
630 001
|
774 595
|
1 187 792
|
1 277 757
|
1 109 378
|
1 141 222
|
1 508 054
|
1 511 895
|
|
PONTE
|
Importations
|
468 785
|
186 336
|
117 240
|
202 557
|
137 070
|
91 903
|
81 220
|
148 566
|
107 682
|
0
|
|
Total
|
936 208
|
741 621
|
747 241
|
977 152
|
1 324 862
|
1 369 660
|
1 190 598
|
1 289 788
|
1 615 736
|
1 511 895
|
|
|
Production locale
|
3 103 748
|
4 099 932
|
3 577 130
|
4 521 672
|
4 635 135
|
3 784 489
|
3 443 435
|
3 918 643
|
5 244 113
|
7 056 632
|
|
CHAIR
|
Importations
|
915 695
|
445 633
|
385 812
|
96 353
|
155 320
|
20 106
|
60 000
|
76 236
|
75 180
|
0
|
|
|
Total
|
4 019 443
|
4 545 565
|
3 962 942
|
4 618 025
|
4 790 455
|
3 804 595
|
3 503 435
|
3 994 879
|
5 319 293
|
7 056 632
|
|
|
Production locale
|
3 571 171
|
4 655 217
|
4 207 131
|
5 296 267
|
5 822 927
|
5 062 246
|
4 552 813
|
5 059 865
|
6 752 167
|
8 568 527
|
|
TOTAL
|
Importations
|
1 384 480
|
631 969
|
503 052
|
298 910
|
292 390
|
112 009
|
141 220
|
224 802
|
182 862
|
0
|
|
|
Total général
|
4 955 651
|
5 287 185
|
4 710 183
|
5 595 177
|
6 115 317
|
5 174 255
|
4 694 033
|
5 284 667
|
6 935 029
|
8 568 527
|
|
% Production locale ponte / total ponte
|
50
|
75
|
84
|
79
|
90
|
93
|
93
|
88
|
93
|
100
|
|
% Production locale chair / total chair
|
77
|
90
|
90
|
98
|
97
|
99
|
98
|
98
|
98
|
100
|
|
% Production locale / total général
|
72
|
88
|
89
|
95
|
95
|
98
|
97
|
86
|
97
|
100
|
SOURCE : SENEGAL.ME.CNA, 2007
Annexe II : Les principales souches de volailles
exploitées au Sénégal
|
Rubriques
|
Chair
|
Ponte
|
|
Souches
|
|
OEufs blancs
|
OEufs colorés
|
|
Cobb500
Arbor acces
Dercos-109
Hubbard
Vedette
Atlas,Kabir
Jupiter, Ross
|
Leghorn
Lohmann-white
Hyline w.77
Ross blanche
Starcoss-288
Shaver
|
Isabrown
Stracoss-579
Lohmann brown
Hyline-brown
Harco
Sussex
|
SOURCE : TCHAMDJA
(2001)
Annexe III : Estimation de la production de la
viande de volaille industrielle en 2006
|
Effectif initial
|
Taux de mortalité
|
Effectif final
|
Poids à l'abattage (en kg)
|
Production nationale (tonnes)
|
|
Poulets *
|
6 671 685
|
(chair) 5%
|
6 338 101
|
1,5
|
9 507
|
|
Poules
réformées**
|
1 327 918
|
(poulette) 7%
|
1 195 126
|
1,5
|
1 793
|
|
(ponte) 3%
|
|
TOTAL
|
7 999 603
|
|
7 533 227
|
|
11 299
|
SOURCE : SENEGAL.ME.CNA, 2007
* Mises en élevage décembre 2005 à novembre
2006 inclus
** Mises en élevage de mars 2004 à février
2005 inclus
SERMENT DES VETERINAIRES DIPLOMES DE DAKAR
« Fidèlement attaché aux directives de
Claude BOURGELAT, fondateur de l'enseignement
vétérinaire dans le monde, je promets et je jure devant mes
maîtres et mes aînés :
v d'avoir en tous moments et en tous lieux le souci de la
dignité et de l'honneur de la profession
vétérinaire ;
v d'observer en toutes circonstances les principes de
correction et de droiture fixés par le code de déontologie de mon
pays ;
v de prouver par ma conduite, ma conviction, que la fortune
consiste moins dans le bien que l'on a, que dans celui que l'on peut
faire ;
v de ne point mettre à trop haut prix le savoir que je
dois à la générosité de ma patrie et à la
sollicitude de tous ceux qui m'ont permis de réaliser ma vocation.
Que toute confiance me soit retirée s'il advient
que je me parjure. »
|
CONTRIBUTION A LA VACCINATION DES VOLAILLES CONTRE LA
MALADIE DE GUMBORO A L'AIDE DE VACCINS INACTIVES ET VIVANTS DISPONIBLES SUR LE
MARCHE DE DAKAR
|
|
Résumé
La maladie de Gumboro, due à un Birnavirus
représente une véritable entrave à la rentabilité
des élevages avicoles au Sénégal.
Pour promouvoir la rentabilité de l'élevage
avicole par une maîtrise de la couverture sanitaire des oiseaux, une
étude expérimentale a été réalisée
dans l'enceinte de l'Ecole Inter Etats des Sciences et de Médecine
Vétérinaire de Dakar de septembre 2007 à juin 2008, en vue
d'apprécier la couverture immunitaire des oiseaux suite à
l'application de la prophylaxie médicale, et de proposer un protocole de
prophylaxie médicale fiable.
Les résultats montrent que l'association
« vaccin inactivé et vaccin vivant » donne de
meilleurs résultats car le vaccin inactivé, insensible aux
anticorps maternels, induit une protection humorale progressive et durable
alors que le vaccin vivant assure une protection précoce, mais moins
durable que celle du vaccin inactivé.
Au terme de cette étude, des recommandons ont
été faites à savoir :
Ø La réalisation d'un autre essai dans les
différents élevages sur le terrain qui viendrait en appoint
à nos résultats ;
Ø La subvention des vaccins inactivés par le
pouvoir public pour les rendre plus accessibles aux éleveurs ;
Ø La mise à la disposition des clients et des
vétérinaires prescripteurs par les couvoirs, du titre en
anticorps maternels des poussins à chaque éclosion afin que ces
derniers puissent déterminer facilement l'âge optimal de la
vaccination.
|
|
Mot-clés : Maladie de Gumboro- Vaccination -
Poulets de chair - Coquelets
|
|
Adresse : Fabrice Juliot MOUGANG BP : 05
MANDJO
Téléphone : (+237) 77 23 58 92
E-mail :
fabriceplus@yahoo.fr
|




