
~épu6lique )1lgérienne Démocratique et
Populaire
Ministère de L'enseignement
Supérieur et dela ~echerche Scienti~ique
'Université
)16ou(Be"r(Bel"aid
T'aculté Des
Sciences
Département De
(Biologie
La6oratoire De recherche : Produits
Waturels
~~~~~~~ ~~ ~~~ ~~ ~~~~~~~~~~~ ~~ ~~~~~~~a,9*(eiWeeie
Mridop,
gee.- eneaaeee,9.-
efiéeze-mride,ebeeee !~~"~~~
Thème

Etude Phytochimique et Activité Biologique de
Zygophyllum geslini Coss.
Présenté par :
Melle MEDJDOUB Houria
Devant Ce jury composé de :
|
Mr TALEB BENDIAB S.M
|
Professeur
|
Université de Tlemcen
|
Président
|
|
Mme ATIK F
|
MC
|
Université de Tlemcen
|
Examinatrice
|
|
Mr CHABANE SARI D
|
Professeur
|
Université de Tlemcen
|
Examinateur
|
|
Mr DJAZIRI R
|
MC
|
Université de Tlemcen
|
Examinateur
|
|
Mr TABTI B
|
Professeur
|
Université de Tlemcen
|
Promoteur
|
Année universitaire 2005-2006
~ ~~ ~~ ~~~~~
~ ~~~ ~~~~ ~~~~~ ge..
~~
~~~~ ~~~~ ~~~~~~~~~~
~~me~~~~me~I
Mes sincères remerciements vont à monsieur
TABTI B, professeur à l'université Abou Bakr Belkaid,
Faculté des Sciences, Département de Chimie pour la confiance
qu'il a voulu m 'accordée en réalisant ce modeste
travail.
Ma reconnaissance va tout spécialement à
monsieur GOUZI H, étudiant en Magistère, Produits Naturels,
Département de Biologie, pour sa patience, son pragmatisme, ses
précieux conseils et sa grande disponibilité pour l'aboutissement
de ce travail.
Que les honorables membres du jury veuillent croire en mes
remerciements anticipés pour leur acceptation d'examiner ce
travail.
Mes remerciements s'adressent aussi aux membres du
laboratoire Produits Naturels, monsieur : MOUSSAOUI A, CHABANE SARI D, à
madame ATIK F, madame BELARBI M, pour leur aide.
J'exprime ma profonde reconnaissance à monsieur
MAHBOUBI A, Chargé de cours au Département de Biologie,
Université Abou Bakr Belkaid pour sa contribution.
Je tiens à remercier spécialement toutes mes
amies, Asma, Wahiba, Nabila, Zohra pour leurs encouragements.
Je tiens à remercier, également, tous ceux qui
ont participé de près ou de loin à la réalisation
de ce modeste travail.
Avant-propos
Ce travail constitue une contribution à
l'étude de l'activité biologique de Zygophyllum geslini
appelée communément Aggaya. L'inventaire réalisé
par Benmehdi en 2000 ainsi que les données rassemblées sur
l'utilisation thérapeutique de cette espèce, montrent qu'elle est
d'une activité antidiabétique. Cette herbe est très
utilisée par la population tlemcenienne pour abaisser
l'hyperglycémie. Effectivement, c'était notre premier objectif,
étudier cette activité.
Cette contribution était réalisée sur
des rats Wistar rendus diabétiques par la streptozotocine. Les animaux
ont été suivis à long terme afin de pouvoir visualiser
l'effet de l'extrait éthanolique (Partie aérienne) sur
l'évolution du diabète sucré. De plus, il était
crucial de suivre l'évolution de la glycémie, des heures
après le traitement par l'extrait étudié. D'autres tests
ont été effectués dans le but de se rapprocher du
mécanisme par lequel agit l'extrait éthanolique.
Le présent travail contient, également, une
partie consacrée à 'étude phytochimique de la plante.
Celle-ci a été effectuée en fonction des moyens
disponibles.
Les études sur le genre Zygophyllum sont
très limitées. Peu de travaux sont réalisés dans ce
contexte surtout pour Z. geslini. De ce fait, ce modeste travail constitue une
originalité dans le domaine de recherche de nouveaux agents
antidiabétiques.
Une grande partie de ce modeste travail a
été effectuée au niveau de l'Animalerie,
Département de Biologie, et au sein du Laboratoire de Recherche Produits
Naturels.
Résumé
Zygophyllum geslini Coss. appelée
communément aggaya est une plante de la famille des
zygophyllacées, très répandue dans le Sahara
algérien.
Dans ce travail on a recherché d'éventuels
effets antidiabétiques de l'extrait éthanolique de la partie
aérienne de Z. geslini administré par voie orale aux
rats Wistar rendus diabétique par l'injection intraveineuse de 50 mg/kg
de la streptozotocine.
La présente étude est divisée en deux
parties essentielles. La première est consacrée à
l'étude de l'effet de cet extrait en suivant l'évolution de la
glycémie, la cholestérolémie, les protéines totales
et le poids corporel, pendant cinq semaines. Durant cette période, une
diminution non significative de la glycémie était
remarquée.
En revanche, la deuxième partie consiste au suivi de la
variation de la glycémie des rats traités par le même
extrait pendant 7 heures. Effectivement, on a noté une diminution
hautement significative de la glycémie, 7 heures après
l'administration de 1 g/kg de l'extrait éthanolique. Cette
réduction peut aller jusqu'à 75 % de al glycémie
basale.
Parallèlement, l'étude phytochimique a
dévoilé que la plante est très riche en saponosides, en
tanins et en flavonoides. Elle contient, également, d'autres familles de
composés.
Effectivement, l'extrait éthanolique à une dose
de 1 g/kg est doué d'une activité antidiabétique
remarquable. De ce fait il peut constituer une ressource naturelle de nouvelles
substances antidiabétiques.
Summary
Zygophyllum geslini Coss. commonly called aggaya is a
zygophyllacae, it is very widespread in the Algerian Sahara.
In this work, possible antidiabetic effects of the ethanolic
extract of the Z. geslini aerial part managed by oral way is
investigated in wistar rats diabetic-induced by the intravenous injection of 50
mg/kg of streptozotocin.
The present study consists of two essential parts. First is
devoted to the study of the effect of this extract while following the
evolution of the glycaemia, cholesterol, triglycerides, total proteins and the
body weight, during five weeks. During this period, a non significant reduction
of glycaemia was noticed.
On the other hand, the second part consists of the follow-up
of the variation of the glycaemia after treatment by the same extract during 7
hours. Indeed, a highly significant reduction in the glycaemia, 7 hours after
administration of 1 g/kg ethanolic extract. This reduction can go up to 75 % of
basal glycaemia.
In parallel, the phytochimic study revealed that the plant is
very rich in saponines, tannins and flavonoides. It also contains other
families of compounds.
Indeed, the extract ethanolic with at 1 g/kg is endowed with a
remarkable antidiabetic activity. From this fact, it can constitute a natural
resource of new antidiabetic substances.
Keywords: Zygophyllum geslini Coss;
Streptozotocin; Ethanolic extract

~~ É Ñ%?" ÉJ A (Zygophyllacées)
Ê~~~~~~~~~~Ç 4i~~,i ~~~~~~~~~~ ~~~~~~Â
~~~~,jÇ 4
. 4~~~Ç~&~Ç ÁÇ~()~Ç
u-9' ù! ~+;<~Å í~>~~Ç
7ÇÏ~ ÉÏ~2! ái~~ Ï~6æ
4~iÇ~~(Å 4~ÇÑÏ ~~Å ÇÐå
~~1~2æ~ ~ ~ ~~+Ñ,~ 4"ÇN~~Ç (Wistar) "
Ñ~~Gæ " äÇÏ~6 5
·1
4~Ñ"94 L.JÇ6~ 7ÇJ64" BÐ æ . 4Ç b@A~
~~Ç~A~Ç 7&~~ ~~~(Â
. ( Streptozotocine) "
ù~G~~æÒ~~"ÇJ~~~Ç " ÉÏtA ùA
t:Â /S 50 ù~P ù1 Ì~Ç~~Ç
í~>~~Ç 7ÇÏ"
J~~~Ç4~~~ ÊÇÑ~<~ 1 u-9Ç
Ñt% 4GÇÑ]" u-9 áæ`Ç . ù~G~G
ù ~~+ 'sÅ 4GÇÑ]~Ç ^~å
_~~~~
áÇJØ ~~LPi . e~"~G 44 á;f
äÒjiÇ Ó ~~+ Ç@Â æ
Ê~~::iæJ~6lÇ 4~%;a1Ç
ÊÇÏ~~~~b~Ç áæ~~~~~>~Ç
ã]1Ç ~~ . ã]~Ç çç ~
J>~~Ç 4 ÓJ~(-4 J~j Ø~~å u-~f~"~'t"
46IÇ.LAIÇ É~~~
u-'9~'~~Ç ùA SÂ /Û 1.
äÇÏ~&~Ç 4&tLA -: ã]1Ç ~
j~~~Ç 4 ÊÇ~~b~ 4"" _A aÇ _~~~Ç
ä~A~ í@~Ç æ 41Ñ6~Ç Ðf
]~" ÊÇ1Ç~ 7 J~.~Ç 4 Ó~~(! ]6
ØJ~å ~~gPh . Ê~1~G 7 É]!1Çiå æ
~~~p~.1Ç
.%75JN~ ä
]~Ò~~~~~~~" 4j ~~~~~~Ç 4 äÇ
4~~~~~Â~~~p~Ç 4GÇÑ]~Ç q"
4+"Ç~~Ç L.ÑÇ6i~ Ç e!
ÊÇÒÇ~~~~"
qÇ~~Â~ ~~1L2~ ì~~(~ ~~Â
(Flavonides) ]~~j~j~;pit" Ç@Â æ (Tanins) ù
~<~Ç æ (dessaponosS)
. ì~f
ù> Ç@A" æ í~>~~~ 7Ç]~
ÉÏ~2! 4~~~ æÐ S /Û 1 41&"
~~~(>~Ç u-9Ç ä Ç~~ ù" Ñ.3`Ç
~~
. 4"<Ç 4À~p~Ç ÊÇÐ
É]~]6 ÏÇjAiÑ'. .-~Â
bÑÇ"~1Ç
Liste des abréviations
|
OMS
|
Organisation Mondiale de la Santé
|
%
|
Pourcentage
|
|
mn
|
Minute
|
P/V
|
Poids/Volume
|
|
h
|
Heure
|
mM
|
Millimolaire
|
|
g
|
Gramme
|
t/mn
|
Tours/Minute
|
|
kg
|
Kilogramme
|
°C
|
Degré Celsius
|
|
mg
l
ml
|
Milligramme Litre
Millilitre
|
nm
|
Nanomètre
|
Liste des figures
Figure 01 : Evolution de la glycémie
(A) et du poids (B) des rats normaux et
diabétiques traités et témoins durant les cinq semaines de
traitement par 500 mg/kg d'extrait éthanolique.
Figure 02 : Evolution des paramètres
sériques: Cholestérolémie (A),
Triglycéridémie (B) et
Protéinémie (C) durant les cinq semaines de
traitement par 500 mg/kg d'extrait éthanolique.
Figure 03 : Test de réponse des rats
à 1 g/kg de l'extrait éthanolique après 5 semaines de
traitement par le même extrait (A) ;
(B) : Pourcentage de diminution de la glycémie exprimant
la réponse des rats à la fin des 5 semaines.
(C) : Comparaison entre le pourcentage de diminution de la
glycémie basale des rats postérieurement traités ** (5
semaines) et celui des rats qui n'ont subi aucun traitement
préalable*.
Figure 04 : Evolution de la glycémie des
rats suivis 7 heures après gavage (ou non) de 1 g/kg d'extrait
éthanolique.
Figure 05 : Pourcentage de diminution de la
glycémie des rats diabétiques traités (ou témoins)
par 1 g/kg d'extrait éthanolique durant les sept heures qui suit le
traitement.
Figure 06 : Test de tolérance chez des
rats normaux traités 1 heure (par 1 g/kg de l'extrait
éthanolique) avant gavage de 3 g/kg de glucose.
Figure 07 : Effet de la concentration
(exprimée en mg/g) en acide ascorbique sur le pourcentage de
réduction du DPPH.
Figure 08 : Effet de la concentration
(exprimée en mg/g) de l'extrait éthanolique sur le pourcentage de
réduction du DPPH.
Figure 09 : (A) représente la relation
entre la concentration et le pourcentage d'inhibition
(B) montre la relation entre le temps
nécessaire pour atteindre la stabilité et la concentration en
acide ascorbique correspondante.
Figure 10 : (A) représente la relation
entre la concentration et le pourcentage d'inhibition
(B) montre la relation entre le temps
nécessaire pour atteindre la stabilité et la concentration de
l'extrait éthanolique correspondante.
Introduction
Le diabète sucré est une maladie
métabolique. Il touche environ 150 millions de la population mondiale
dont 90% sont des diabétiques de type 2. Le traitement de cette maladie
constitue une des plus grandes préoccupations scientifiques à
travers le monde. Ceci est en vue de trouver de nouvelles solutions pour
prévenir, voir ralentir la survenue des complications organiques et
métaboliques résultantes de l'hyperglycémie chronique.
En générale, tous les agents
antidiabétiques (antidiabétiques oraux, insuline) ne
répondent pas aux besoins des patients en tant qu'un traitement
efficace. Eventuellement, plusieurs accidents risquent d'être à
l'origine d'un état indésirable.
Actuellement, le recours au traitement du diabète
sucré par les plantes attire tous les flashes. Justement, il existe dans
le monde, plus de mille plantes utilisées traditionnellement pour lutter
contre cette maladie, et certaines d'entre elles ont reçu une
évaluation scientifique et médicinale de leur
efficacité.
De fait, plusieurs phytothérapeutes à travers le
monde s'intéressent à la recherche de nouvelles substances
d'origine végétale pouvant avoir ce secret.
I- Phytothérapie :
I-1. Définition :
A travers des siècles passés, l'homme a connu
plusieurs maladies. Il a toujours cherché à traiter, à
guérir ou à calmer ses douleurs. Sa souffrance l'a poussé
à trouver des solutions. Mais quelles solutions ? Ce sont des
remèdes naturels, d'origine animale, végétale ou
minérale, des thérapies manuelles ou spirituelles. C'est la
médecine traditionnelle ou la médecine populaire.
Plusieurs horizons s'ouvrent dans ce sens dont la
thérapie par les plantes « Phytothérapie » qui signifie
la thérapie par les plantes ayant des propriétés
thérapeutiques que l'on appelle alors plantes médicinales.
I-2. Les chiffres de l'OMS :
En Afrique, jusqu'à 80% de la population utilise la
médecine traditionnelle pour répondre à ses besoins de
soins de santé [OMS, 2002]. Précisément, dans certains
pays d'Afrique, les plantes médicinales représentent la seule
source de médicaments pour près de 90% de la population
[Anne-Laure, 2002]. De même, dans de nombreux pays asiatiques la
médecine traditionnelle continue d'être largement utilisée,
même si l'allopathie est facilement disponible. En Chine, l'utilisation
des remèdes traditionnels représente 40% de tous les soins de
santé. En même temps, pour certains pays de l'Amérique
Latine, il a été rapporté que 71% de la population de
Chili et 40% de la population de Colombie ont utilisé la médecine
traditionnelle.
La médecine traditionnelle est également
très populaire dans de nombreux pays développés parce
qu'elle est fermement intégrée à des systèmes de
croyance plus globaux [OMS, 2002].
Tous ces chiffres montrent que les gens se tournent, de nouveau,
vers la médecine traditionnelle et surtout vers les plantes
médicinales.
I-3. Pourquoi le recours à cette forme de
médecine ?
L'usage de la médecine traditionnelle est très
répandu et revêt une importance sanitaire et économique
croissante. Dans les pays en voie de développement, l'usage
répandu de la médecine traditionnelle est accessible et abordable
particulièrement pour les patients les plus pauvres du monde vue le
coût élevé de certains médicaments ainsi que
leur indisponibilité sur le marché.
Parallèlement, dans de nombreux pays
développés, la popularité de la médecine
traditionnelle (dite : médecine complémentaire) est
alimentée par les inquiétudes au sujet des effets nocifs
des médicaments chimiques, par la remise en question des
démarches et présomptions de l'allopathie et par l'accès
de plus en plus facile du grand public à l'information sur la
santé [OMS, 2002].
Durant ces deux dernières décennies, la
recherche en phytothérapie devient une des plus grandes
préoccupations scientifiques [Nyah Njike et al., 2005]. De
fait, l'OMS a mis une stratégie pour la médecine traditionnelle
dont le but est de maximiser les possibilités de cette forme de
médecine en tant qu'une source de soins de santé, et de
protéger la matière première surtout dans le cas des
plantes [OMS, 2002].
Justement, la pharmacie utilise encore une forte proportion de
médicaments d'origine végétale et la recherche trouve chez
les plantes de nouvelles molécules actives, ou des matières
premières pour la semi-synthèse.
II- Diabète sucré :
II-1. Présentation de la maladie :
Traiter, soigner, ou guérir les maladies, c'est le but
des phytothérapeutes à travers le monde. De ce fait plusieurs
maladies qui posent de très graves problèmes à
l'échelle mondiale sont pris en charge par les chercheurs dans ce
domaine afin de trouver de nouveaux remèdes.
Une des maladies les plus dangereuses est le diabète
sucré qui est considéré parmi les maladies les plus
fréquentes de notre civilisation. Il touche quelques 5 à 7% de la
population mondiale [Waeber, 2000]. Le diabète sucré est un
groupe de maladies métaboliques caractérisées par une
hyperglycémie chronique résultante d'un défaut de la
sécrétion de l'insuline et/ou de l'action de cette hormone
[Raccah, 2004].
II-2. De l'hyperglycémie chronique aux
complications organiques :
L'hyperglycémie chronique est associée à
terme avec des complications organiques spécifiques touchant
particulièrement les yeux, les nerfs, les reins, le coeur et les
vaisseaux [Raccah, 2004].
Les complications de cette affection restent très
graves et posent un risque de mortalité très élevé.
A titre d'exemple la mortalité cardiovasculaire en France chez les
personnes atteintes d'un diabète sucré de type 2 est
approximativement le double de celle des sujets non diabétique [Drouin
et al., 1999].
Les diabétiques de type 2, précisément,
sans aucun passé coronaire avaient un risque d'infarctus myocardique
aussi élevé que celui des témoins non diabétiques
qui avaient déjà présenté antérieurement un
infarctus [Buysschaert et al., 1999].
II-3. Le stress oxydant et les complications de la
maladie :
Ces complications sont fortement liées à nombre
de facteurs. A coté de l'hyperglycémie chronique et la glycation
non enzymatique des protéines, un facteur très important
impliqué dans la génèse de ces complications est le stress
oxydatif [Punitha et al., 2005 ; Raccah, 2004; Guerci et al.,
2001].
Le métabolisme cellulaire normale de l'oxygène
produit de manière continue de faibles quantités d'espèces
oxygénées activées dont font partie les radicaux libres
(O2., OH., ...), le
peroxyde d'hydrogène et l'oxygène singulet [Pincemail et
al., 1999 ; Huang et al., 2004]. Dans certaines conditions, une
surproduction d'espèces oxygénées activées (EOA)
dû
à l'activation de diverse mécanismes
biochimiques peut submerger rapidement les défenses antioxydants, c'est
le stress oxydatif [Punitha et al., 2005 ; Pincemail et al.,
1999].
Les EOA sont des molécules instables, potentiellement
toxique pour l'organisme car elles peuvent inactiver des protéines,
induire des cassures au sein de l'ADN avec, comme conséquence, une
altération du message génétique, dégrader les
sucres, oxyder les lipoprotéines et initier des processus de
peroxidation lipidique au sein de la membrane cellulaire en s'attaquant aux
acides gras polyinsaturés [Raccah, 2004]. Parfaitement, le
diabète sucré provoque une augmentation de la production des EOA
d'une part et d'autre part, une diminution des antioxydant, ce qui est à
l'origine des micro et des macro angiopathies [Eshrat, 2002].
II-4. Traitement du diabète sucré :
Evidemment, un bon contrôle glycémique du
diabète sucré est recommandé pour retarder, voir
prévenir la survenue et ralentir la progression des complications
[Jaspreet et al., 2003]. Pour atteindre ces objectifs, plusieurs
thérapeutiques sont à notre disposition. Un régime
alimentaire bien équilibré en glucides, en protéines et en
lipides [Gin et Regalleau, 1999] ainsi que l'exercice physique [Charbonnel et
Cariou, 1997] sont des composantes essentielles du traitement de diabète
sucré.
Encore, l'insulinothérapie occupe une place importante
dans l'arsenal thérapeutique du diabète de type 1 [Gin et
Regalleau, 1999] et du diabète de type 2 [Dirckx, 1998]. Ce dernier
nécessite chez la majorité des patients et surtout pendant les
premiers stades, une prise en charge médicamenteuse et cela par
l'intervention des antidiabétiques oraux qui sont classés selon
leur mode d'action en trois catégories.
Les sulfamides hypoglycémiants stimulent la
sécrétion d'insuline par les cellules 13 du pancréas en
les sensibilisant à l'action du glucose [Dey et al., 2002].
Les biguanides classés en deuxième lieu n'agissent
par sur la sécrétion insulinique, ce sont des potentialisateurs
d'effets de l'insuline [ Sulkin et al., 1997].
Les inhibiteurs des alpha-glucosidases constituent la
troisième classe des antidiabétiques oraux. Ils atténuent
la glycémie post-prandiale par leur action directe comme agent
inhibiteur des alpha-glucosidases intestinales en ralentissant la digestion des
polysaccharides [Herman, 1998].
II-5. Les antidiabétiques : de
l'efficacité à la toxicité :
Généralement, tous ces agents
antidiabétiques causent différents effets secondaires qui varient
selon la classe et la génération du médicament [Marles et
Farnsworth, 1994].
Précisément, les sulfamides provoquent un
état d'hypoglycémie. Cet effet est considéré comme
principal [Dey et al., 2002] à coté de
l'hyponatrémie, l'hépatite, les atteintes hématologiques,
l'éventuelle réaction dermatologique [Marles et Farnsworth, 1994]
ainsi qu'un gain de poids dû à l'hyperinsulinémie [Dey
et al, 2002].
A cause de leurs effets secondaires très graves,
certains Biguanides ont été éliminés du
marché. La metformine, le biguanide le plus commercialisé dans le
monde, n'est plus disponible aux Etats Unies car il provoque des états
d'acidose lactique [Marles et Farnsworth, 1994], fatigues, nausées ainsi
qu'une toxicité rénale [Dey et al., 2002].
Similairement, les autres antidiabétiques oraux ne sont
pas sans effets secondaires. L'acarbose, un médicament de la classe des
inhibiteurs des alpha-glucosidases présente divers effets secondaires,
principalement : les gaz, le ballonnement et la diarrhée [Dey et
al., 2002].
Effectivement, tous les antidiabétiques oraux
provoquent des effets secondaires néfastes pour le patient
diabétique, ce qui complique le traitement et accroît la
souffrance des malades.
II-6. Avenir du traitement de la maladie :
Pour diminuer la souffrance des diabétiques, de
nouvelles solutions font l'objet de recherches, à savoir: la
transplantation des Ilots [Barrou et al., 2004], l'insuline
administrée par voie nasale ou à travers l'oeil, les analogues de
l'insuline pouvant être pris par voie orale et les agents bloquant les
dommages de l'auto-immunité [Dirckx, 1998].
En parallèle, la recherche de nouvelles substances
à partir des plantes attire actuellement tous les flashes et constitue
une étape substantielle dans le développement de nouveaux
médicaments.
III- Plantes antidiabétiques :
Ardemment, plus de 1123 plantes sont utilisées
traditionnellement pour traiter le diabète sucré [Marles et
Farnsworth, 1994]. Cependant, juste une minorité de ces plantes
connaissent une évolution scientifique, citons essentiellement,
Momordica charantia, Catharanthus roseus, Trigonella
foenum-greacum, Allium cepa, Allium sativum, et autres
[AlAchi, 2005]. Ce qui est remarquable, c'est l'existence de plusieurs
composés d'origine végétale, semblent donner cet effet
bénéfique. Leur nature différente les font agir à
différents sites.
III-1. Quelques exemples :
Les guanidines furent extraits la première fois
à partir de Galega officinalis. Ils constituent une source
naturelle pour la semi-synthèse des Biguanides. Ces derniers sont moins
toxiques que les guanidines [Dey et al., 2002]. D'autres
composés ont été identifiés à partir d'une
série de plantes ayant subi une évaluation scientifique. Ces
composés, leur nature, leur mode d'action ainsi que leur source
végétale sont classés dans le tableau suivant :
|
Composé
|
Nature chimique
|
Source
|
Mécanisme d'action possible
|
|
Polypeptide P
|
Polypeptide
|
Momordica charantia
|
Insulinomimétique administré par voie sous
cutanée chez des diabétiques de type 1 [Marles et Farnsworth,
1994].
|
|
Charantine
|
Hétéroside stéroidique
|
Momordica
charantia [Dey et
al., 2002] Momordica foetida [Marles
et
Farnsworth, 1994]
|
Mécanisme d'action exacte reste inconnu. Des études
ont rapporté que :
Le jus de M. charantia peut améliorer la
tolérance au glucose chez les diabétiques de type 2 [Welihinda
et al., 1986].
L'extrait aqueux de M. charantia diminue
la
glycémie post prandial avec une
réduction du taux de
l'hémoglobine
glycosylé [Srivastava et al., 1993].
Augmente l'utilisation hépatique du
glucose et inhibe
la néoglucogenèse, il
réprime l ' insulinorésistance en
augmentant le taux des transporteurs
membranaires de glucose
[Al-Achi, 2005]
|
|
Catharantine Leurosine Lochnerine
Tetrahydroalsto m Vindoline Vindolinine
|
1.m A caloides
|
Catharanthus roseus
|
Il était difficile d'étudier ces composés
vue leur toxicité élevée [Marles et Farnsworth, 1994]
|
|
Trigonelline
|
Alcaloide
|
Trigonella foenum- greacum
[Marles et
Farnsworth 1994
, ;
Dey et al., 2002]
|
Les études réalisées sur les extraits bruts
ont montré les effets suivants :
Diminution de la glycémie post prandial. . .
Dmunution du taux de glucagon,
somatostatine, insuline, cholestérol total et des
triglycérides avec une augmentation de taux d'HDL-Cholestérol [
Ribes et al., 1984].
Resensibilisation des cellules à l'actin de l'insuline
[Al-Achi, 2005]
|
|
Allyl propyl
disulfide
|
.
Dérivés de la cystéine
|
Allium cepa
|
Ces deux composés semblent agir par compétition
avec l'insuline sur son récepteur [Marles et Farnsworth, 1994 ; Dey
et al., 2002 ; Al-Achi, 2005].
|
|
Diallyl disulfide oxide
|
.
Dérivés de la cystéine
|
Allium sativum
|
|
Ginsenosides
|
Hétéroside stéroidique
|
Panax ginseng
|
La plante provoque une augmentation du nombre des
transporteurs de glucose au niveau du foie avec stimulation de la
synthèse de l'insuline [Al-Achi, 2005].
|
D'autres espèces végétales
réputées antidiabétiques semblent agir à des
niveaux différents. Leurs principes actifs sont de nature organique:
polysaccharides, acides aminés [Al-Achi, 2005], flavonoïdes,
saponosides, acides gras, alcaloïdes [Marles et Farnsworth, 1994 ; Dey
et al., 2002] ou de nature minérale, tel que chez Atriplex
halimus où le chrome organique (Glucose Tolerance Factor: GTF)
régule la glycémie en potentialisant l'effet de l'insuline
[Aharonson et al., 1969 ; Evans et Bowman, 1992].
A coté du chrome, le vanadium, un
insulinomimétique [Thompson et Godin, 1995] connu avant la
découverte de l'insuline, a été utilisé pour le
contrôle de la glycémie [Dey et al., 2002]. Des
études ont montré que cet élément améliore
la tolérance au glucose par son mécanisme au niveau
post-récepteur [Thompson et Godin, 1995]. D'autres minéraux tels
que le magnésium [Dey et al., 2002], le cuivre, le
sélénium et le fer ont également des effets
bénéfiques [Thompson et Godin, 1995 ; Ducros et Favier, 2004].
Toute cette discussion aboutit à la
réalité confirmée que la plante constitue une source
naturelle. Elle contient en effet, des principes actifs servant comme prototype
pour la chimie de synthèse.
IV- Zygophyllum geslini :
En Algérie, plusieurs plantes sont utilisées
traditionnellement pour traiter le diabète sucré. Parmi elles, le
Zygophyllum geslini Coss. [Smati et al., 2004], objet de
notre étude.
IV-1. Description botanique :
Le Zygophyllum geslini est une Zygophyllacées
vivace de la classe des Magnoliopsides, de l'ordre des Sapindales. C'est une
plante en petits buissons ramifiés, à rameaux blanchâtres,
à petites feuilles charnues et composées de deux folioles. Les
fleurs sont petites et blanches et le fruit est prolongé en lobes,
piriforme régulièrement dilaté depuis la base jusqu'au
sommet mais non muni de cornu recourbé en crochet. Il est une fois et
demie plus long que large.
Le pédoncule est fructifère, aussi long que le
fruit. La portion libre des carpelles est trois à quatre fois plus
courte que la portion soudée, faisant à peine saillie [Ozenda,
1977].
|
Photo : Zygophyllum geslini de la
région d'Adrar
|
IV-2. Usage :
Le zygophylle geslini est une espèce très
répondue dans le Sahara septentrional. Plusieurs espèces du
même genre partagent avec le zygophylle geslini le nom vernaculaire de
«aggaya» telles que Z. album, Z. cornutum [Baba
Aïssa, 1999], Z. gaetulum et Z. waterlot [Jouad et
al., 2001 ; Eddouks, 2002]. Ces espèces sont utilisées en
médecine traditionnelle comme remèdes de différentes
affections. Notamment, le Z. gaetulum qui est très
utilisé au Maroc contre le diabète sucré. Des
études réalisées sur cette plante montrent que l'extrait
aqueux peut diminuer la glycémie des rats rendus diabétiques
[Jouhari et al., 2000]. Il est également efficace chez des
patients souffrant du diabète de type 2 [Jouhari et al., 1999].
De même pour Zygophyllum cornutum, Aggaya de la Tunisie,
où il a été rapporté que cette espèce est
très efficace testée sur le lapin [Perez et Paris, 1958].
Le premier objectif de notre travail était
d'étudier l'efficacité de l'extrait éthanolique de
Zygophyllum geslini Coss. sur le diabète sucré. Pour
cela, on a voulu aborder deux questions : 1/ Si on traite les animaux pendant
des semaines par cet extrait, quel effet peut-on avoir ?
2/ Quelle sera la réponse des animaux à l'extrait
étudié dans un intervalle de 7 heures ?
En parallèle, il était nécessaire de
réaliser une étude phytochimique de la plante et de l'extrait en
question pour identifier les grandes familles de composés existants.
De ce fait, cette étude est, essentiellement,
divisée en deux parties : une biologique et la deuxième
chimique.
I- Etude chimique :
I-1. Tests phytochimiques :
Trois solvants de polarité différente sont
utilisés, l'eau, l'éthanol, et l'éther diéthylique.
Pour les trois extraits l'extraction se fait par décoction du
matériel végétal à raison de 10 % (P/V : 10 :100)
dans le solvant pendant 30 minutes. Le mélange est filtré et
ensuite soumis aux différents tests phytochimiques. Ces tests sont vu en
détail plus loin (Annexe 1).
I-2. Détermination de la teneur en flavonoides, tanins,
et saponosides : Flavonoides :
Cinq g du matériel végétal sont
mélangés avec 50 ml du méthanol 80 % ; l'extraction se
fait à température ambiante. Le mélange est rapidement
filtré et ensuite re-extrait pour la deuxième et la
troisième fois avec le même solvant. Les filtrats obtenus sont
évaporés jusqu'à l'obtention d'un résidu sec dont
le poids exprime le rendement en flavonoides pour 5g de matière
végétal [Okwu, 2005].
Tanins :
L'extraction des tanins se fait par l'acétone aqueuse
à 70 %. Dix g du matériel végétal sont
macérés dans 100 ml du solvant pendant 30 minutes.
L'opération est répétée trois fois. Après
filtration et évaporation le résidu sec est pesé afin de
calculer le rendement en tanins [Troszynska et Ciska, 2002].
Saponosides
Dix g du matériel végétal sont
dispersés dans 100 ml de l'éthanol 20 %. L'extraction est
réalisée dans un bain marie à 55° sous agitation.
Cette étape qui dure 4 heures est répétée une
deuxième fois pour le résidu obtenu après filtration. Les
filtrats collectés sont concentrés jusqu'au volume égal
à 40 ml. Ensuite on procède à une série
d'extraction liquide-liquide. La première se fait par 20 ml
d'éther diéthylique en répétant cette
opération. Après on élimine la phase étherique et
on entame la deuxième extraction liquide-liquide par le n-butanol, en
ajoutant 40 ml de ce dernier à la phase aqueuse obtenue après
extraction par l'éther. On refait cette extraction trois fois. La phase
n-butanol est lavée deux fois par 20 ml de solution de NaCl à 5 %
et ensuite concentrée jusqu'à l'obtention d'un résidu sec
dont le poids exprime le rendement en saponosides [Okwu, 2005].
II. Partie biologique :
II-1. Préparation de l'extrait
éthanolique :
Le zygophyllum étudié dans cette
approche provient du Sahara algérien (Wilaya d'Adrar). L'espèce
Zygophyllum geslini Coss. a été identifiée
d'après Ozenda (1977). Après récolte, le matériel
végétal est séché à l'aire libre et à
l'abri de la lumière et de la chaleur. L'extrait éthanolique est
préparé par macération de la poudre à
température ambiante dans l'éthanol 95° à raison de
20 % (P/V) pendant 24 heures. Il faut noté que le matériel
végétal est bien mélangé avec l'éthanol on
utilisant l'ultraturrax (UltratTurrax T25 basic IKA-WERKE) pendant environ 15
minutes.
Après 24 heures l'extrait est ensuite filtré. Le
filtrat est évaporé à sec à 40°C afin
d'éviter toute éventuelle altération des molécules
en solution. Peser et solubilisé le résidu sec ainsi obtenu dans
du Tween 80 à 5 % afin d'obtenir une solution aqueuse dont la
concentration est connue [Babu et al., 2003].
II.2 Administration de l'extrait :
La solution finale est administrée par voie orale aux
rats traités par l'extrait éthanolique. Concurremment, les rats
témoins reçoivent le même volume de la solution de Tween 80
à 5 %.
II-3. Les animaux :
Ce travail a été réalisé sur des
rats males Rattus norvegicus Variété Wistar.
L'élevage des animaux ainsi que les différents tests sont
réalisés au sein de l'animalerie au niveau de l'université
de Tlemcen (Faculté des Sciences Département de Biologie).
II-4. Induction du diabète sucré chez le rat :
Le diabète sucré est induit chez les rats par
injection intraveineuse de la streptozotocine "STZ" (S-0130 Sigma) à
raison de 50 mg/kg à travers la veine de la queue [Babu et al.,
2003]. La STZ est préparée dans du tampon citrate 100 mM, pH 4,5
à concentration de 50 mg/ml ? [Crouch et al., 1978].
Les rats maintenus à jeun pendant une nuit, sont
anesthésiés avec du chloral hydraté administré par
voie intrapéritonéale à une dose de 400 mg/kg [Calapai,
1999].
II-5. Recherche de toxicité :
Afin d'éviter tout éventuel risque de
toxicité lors des tests biologiques, il était nécessaire
de réaliser des essais de toxicité, pour cela on a
administré aux rats des deux sexes différentes concentrations de
l'extraits éthanolique solubilisé dans le tween 80, et bien sur
il est impératif d'ajouter un lot témoin auquel on administre la
solution de tween 80 à 5%.
? Vue leur instabilité en solution ainsi qu' à
température ambiante, la STZ doit être préparée
juste avant l'injection. Il est déconseillé de conserver la
solution même à basse température [Chen et Ianuzzo,
1981].
II-6. Prélèvement du sang :
Le prélèvement du sang est effectué
à l'aide d'une pipette pasteur héparinée à travers
le sinus rétro-orbital au niveau de l'oeil. Le sang
récupéré est ensuite centrifugé à 4000 t/min
pendant 10 mn à 10°C, en vue de l'analyse des paramètres
biochimiques (glycémie, triglycéridémie,
cholestérolémie, et protéinémie).
II-7. Techniques analytiques des paramètres
sanguins :
· Dosage du glucose :
Le dosage du glucose sérique est basé sur une
technique enzymatique colorimétrique par Kit-Prochima par la
méthode de Trinder (1969). Le D-glucose est transformé par la
glucose oxydase en acide gluconique et en peroxyde d'hydrogène lequel
oxyde, en présence de la peroxydase, le phénol en un complexe
chromogène coloré en rouge dont l'absorbance est mesurée
à 505 nm.
· Dosage du cholestérol :
Ce dosage se fait par Kit Prochima, par la méthode de
Fasce (1982). Les esters de cholestérol sont hydrolysés par une
cholestérol ester hydrolase en acides gras et cholestérol. Ce
dernier et celui préexistant sont oxydés par une
cholestérol oxydase en A4-cholestenone et peroxyde
d'hydrogène, celui-ci, en présence de peroxydase, oxyde le
chromogène amino-4- antipyrine en un composé coloré en
rouge d'absorbance maximale à 505 nm..
· Dosages des triglycérides :
Le glycérol libéré par hydrolyse des
triglycérides par la lipoprotéine lipase est transformé en
glycérol-3-phosphate par la glycérokinase. Le glycérol
3-phosphate subit l'action de la glycérol phosphate oxydase pour former
la dehydroxyacétone phosphate et du peroxyde d'hydrogène. Celui
ci en présence du peroxydase oxyde un groupement chromogène 4-
aminoantipyrine/phénol pour former un composé coloré en
rouge. Ce dosage se fait par KitProchima selon la méthode de Fassati et
Prencipe (1982).
· Dosage des protéines :
Le dosage des protéines se fait par la méthode
au Biuret selon Henry et al., 1974. En solution alcaline les
protéines forment avec les ions cuivriques un complexe coloré
d'absorbance mesurée à 540 nm. La détermination des
différentes concentrations se fait à l'aide d'une droite
d'étalonnage de la sérumalbumine humaine (voir Annexe
2).
Remarque : La lecture
spectrophotométrique se fait par un spectrophotomètre UV-VIS
(6405 Jenway).
II-8. Chronologie des testes biologiques :
Afin de rechercher d'éventuels effets
antidiabétiques de l'extrait éthanolique, on a
réalisé des tests biologiques sur des rats males Wistar
âgés de plus de trois mois et de poids corporel situé entre
2 15-275 g. Les tests ont été fait en trois étapes :
~ Suivi à long terme :
Après l'installation du diabète chez les rats,
ces derniers sont repartis en quatre groupes: Groupe
1 : Normaux témoins ; Groupe 2
: Normaux traités ; Groupe
3 : Diabétiques témoins ; Groupe
4 : Diabétiques traités.
Les groupes 2 et 4 sont traités pendant 5 semaines par
l'extrait éthanolique à une dose de 500 mg de résidu sec
par kilogramme de poids en monoprise. Parallèlement les groupes 1 et 3
reçoivent le même volume de la solution de Tween 80. Le traitement
se fait par gavage.
A la fin de chaque semaine, le sang est prélevé
pour la détermination des paramètres sériques
mentionnés précédemment. De plus le poids des animaux a
été pris.
Après cette période un test de réponse des
rats à 1 g/kg de l'extrait éthanolique a été
effectué dont on a suivi la glycémie 1 et 3 heures après
gavage de cet extrait.
~ Suivi à court terme :
De la même manière, les rats rendus
diabétiques ainsi que les normaux sont repartis en quatre groupes. La
dose administrée est de 1 g/kg. La glycémie est mesurée
avant gavage, 1, 2, 3, 5, et 7 heures après traitement.
~ Test de tolérance au glucose :
Ce test a été réalisé sur des rats
normaux, répartis en deux lots. Le premier témoin, et un
deuxième traité -1 heure avant le gavage de 3 g/kg de glucose-
par l'extrait éthanolique à raison de 1 g/kg. L'évolution
de la glycémie était suivie chaque une demi heure jusqu'à
2 heures.
II-9. Evaluation du pouvoir antioxydant :
Le DPPH (Diphenylpicrilhydrazyl) est, pratiquement, le radical
libre le plus stable. En solution dans le méthanol, le DPPH est
caractérisé par une couleur violette dont l'intensité est
mesurée à 515 nm. En présence d'un donneur
d'hydrogène, le DPPH est réduit à la forme non radicalaire
de couleur jaune pâle. Ce passage, de la première forme à
la deuxième, est accompagné d'une diminution de l'absorbance qui
peut exprimer le pourcentage de réduction de DPPH.
% DPPH réduit = [(DO contrôle - DO E) / DO
contrôle] × 100
Où : DO contrôle est l'absorbance du DPPH
à t0.
DO E est l'absorbance après avoir ajouté
l'acide ascorbique (ou l'extrait).
Effectivement, on a recherché d'éventuelle
efficacité antiradicalaire de l'extrait éthanolique. De ce fait,
différentes concentrations de cet extrait ainsi que de l'acide
ascorbique ont été étudiées.
Par définition, une telle concentration de l'acide
ascorbique (extrait) peut réduire 50% du DPPH est dite EC50
(exprimée en mg de substrat/g de DPPH). TEC50 est le temps
nécessaire pour atteindre l'état d'équilibre
(stabilité de l'absorbance). EC50 et
TEC50 sont
calculée graphiquement (voir résultats). En plus de
ces deux paramètres, un nouveau paramètre a été
calculé : Efficacité Antiradicalaire (EA) [Sánchez-Moreno
et al., 1998].
EA = 1/ EC50 × TEC50
A 1 ml de la solution du DPPH à 0,005 g/l
(préparé dans du méthanol), on ajoute 1 ml de
l'échantillon à étudier (l'acide ascorbique ou l'extrait
éthanolique)* préalablement solubilisé dans le
méthanol. La variation de l'absorption est suivie en fonction du temps
jusqu'à la stabilité [Molyneux, 2004].
III- Evaluation statistique :
L'étude statistique de comparaison entre les quatre
lots est réalisée par un test de Student de distribution
bilatérale et de type hétéroscédastique (type 3).
Ce test nous donne le degré de signification P où :
On dit que la différence est : Peu significative Si P <
0,05 (*)
Significative Si P < 0,01 (**)
Très significative Si P < 0,00 1 (***)
Hautement significative Si P < 0,0005 (****)
~ Les résultats sont
représentés sous la formule : Moyenne #177; Erreur standard
* Pour la préparation de l'extrait éthanolique
dont on a étudié l'efficacité antiradicalaire, voir : II.1
Préparation de l'extrait éthanolique.
I- Partie phytochimique :
Les tests phytochimiques réalisés sur les trois
extraits (étherique, éthanolique et aqueux)
révèlent la présence de plusieurs familles de
composé (voir tableau n°1, Annexe 1). Ces résultats
montrent que la plante est très riche en saponosides ; les deux classes
sont présentes : les saponosides à génines
stéroidiques et ceux à génines triterpéniques.
On note aussi la présence des tanins, flavonoides,
alcaloïdes, composés réducteurs (coumarines et
anthracénosides), huiles volatiles et acide gras.
D'autre part, les dosages montrent que la plante contient 7,72 %
de flavonoides, 26,5 % de tanins et 13,55 % de saponosides.
II- Partie biologique :
II-1. Toxicité de l'extrait éthanolique
:
Sept doses de l'extrait éthanolique ont
été testées sur des lots de 4 rats. Les doses sont : 0,45
; 0,9 ; 1 ; 11 ; 12 ; 15 ; et 19 g/kg administrées par voie orale.
D'après les résultats obtenus, aucune toxicité n'a
été remarquée.
II-2. Evolution de la glycémie pendant les 5
semaines :
Après l'installation de l'hyperglycémie (48
heures au minimum), on a commencé le gavage d'une dose
journalière de 500 mg/kg. La figure 1 (A)
schématise les résultats obtenus durant les 5 semaines où
on a noté une diminution de la glycémie, dès la
première semaine, chez les rats diabétiques traités et
témoins. Après ce point (première semaine) on observe une
re-augmentation de la glycémie des deux lots. A partir de la
troisième semaine, une diminution de la glycémie des rats
diabétiques traités commence à se percevoir jusqu'à
la fin de l'expérimentation. Parallèlement, l'analyse statistique
de ces résultats n'a montré aucune différence
significative. Pour ce qui concerne les rats normaux traités aucun
changement de la glycémie n'a été marqué. Celle ci
reste dans les limites normales.
césuitate et
fnter~rétation
0 1 2 3 4 5
Temps (semaine)
(B)
0 1 2 3 4 5
Temps (semaine)
|
Normaux témoins Normaux traités Diabétiques
témoins Diabétiques traités
|
Figure 01 : Evolution de la glycémie (A) et du
poids (B) des rats normaux
et diabétiques traités et
témoins durant les cinq semaines de traitement par
500 mg/kg
d'extrait éthanolique.
II-3. Evolution du poids des rats :
La variation du poids des rats constitue un paramètre
très important. Le suivi régulier des animaux nous a amené
à obtenir les valeurs relatives à la figure 01
(B). Distinctement, une différence entre la croissance
des rats diabétiques et celle des normaux a été
notée. Encore remarquable, c'est que l'extrait éthanolique n'a
aucun impact sur la croissance des rats normaux.
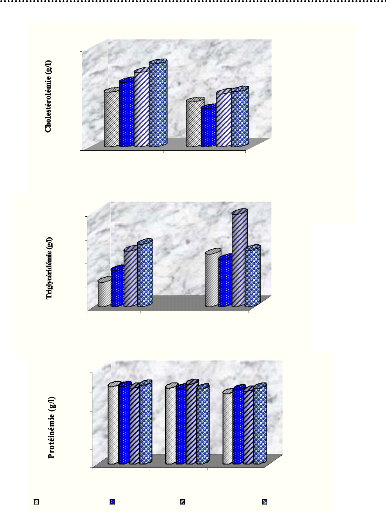
II-4. Evolution des paramètres lipidiques
:
Deux paramètres lipidiques sont suivis, la
cholestérolémie et la triglycéridémie. Les
résultats accordés à la figure 02 (A) et
(B) montrent une diminution de la
cholestérolémie chez les quatre groupes particulièrement
pour les normaux traités où la diminution a eu une signification.
Paradoxalement, on a remarqué une élévation du taux des
triglycérides chez les groupes 1, 2 et 3. Pour le groupe 4
(diabétiques traités), aucune augmentation n'a été
notée.
II-5. Evolution de la protéinémie
:
Deux informations à tirer à partir de la figure 02
(C).
1 : Aucune différence de
protéinémie entre les quatre groupes.
2 : Essentiellement, pas d'augmentation (ou de
diminution) du taux de protéines sériques.
césuitate et
fnter~rétation
1,2
0,8
*
(A)
0,4
0
0 3
Temps (semaine)
1,60
(B)
1,20
0,80
0,40
0,00
0 3
Temps (semaine)
100,00
80,00
(C)
60,00
40,00
20,00
0,00
0 3 5 Temps (semeine)
Normaux témoins Normaux traités Diabétiques
témoins Diabétiques traités
Figure 02 : Evolution des paramètres
sériques : Cholestérolémie (A),
Triglycéridémie
(B) et Protéinémie (C) durant
les cinq semaines de traitement par 500 mg/kg
d'extrait
éthanolique.
II-6. Test de réponse des rats à 1 g/kg de
l'extrait étudié :
A la fin de l'expérimentation (5 semaines), les ratsO
reçoivent 1 g/kg d'extrait éthanolique afin de visualiser leur
réponse à une dose plus élevée. La figure 03
(A) dévoile la réponse positive des animaux
à l'extrait éthanolique. Une diminution de 4 à 1,64 g/l,
qui représente 67% de la glycémie basale, était
marquée trois heures après l'administration de l'extrait. Ce
résultat sera ultérieurement comparé avec celui obtenu
avec les animaux qui n'ont pas subi un traitement postérieur.
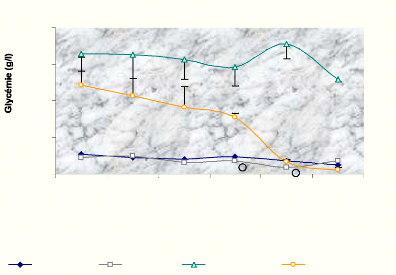
II-7. Evolution de la glycémie à courte
durée :
La glycémie des rats est suivie pendant 7 heures
(Figure 04). Effectivement, après gavage de 1g/kg de l'extrait
éthanolique, on remarque une diminution de la glycémie qui
commence dès la première heure qui suit le gavage. Celle-ci
devient hautement significative après 7 heures. En terme de pourcentage
(Figure 05), on constate une baisse de 9,13 % de la glycémie basale 1
heure après gavage, et atteint 75,30 % 7 heures après. Pour les
diabétiques témoins, la diminution de la glycémie reste
faible et lente. Il ressort, également, que l'extrait éthanolique
à 1 g/kg a entraîné une légère
réduction (P< 0.05) de la glycémie des rats normaux (Figure
04). Celle-ci reste dans les limites normales.
II-8. Comparaison entre la réponse des rats
à 1 g/kg : effet du traitement préalable :
Il est, évidemment, constatable que le traitement
préalable des rats par l'extrait éthanolique influe sur leur
réponse à la dose testée (figure 03 (C)).
On observe une réponse rapide des rats préalablement
traités, comparée à celle des rats de la deuxième
catégorie.
O Les rats sont maintenus à jeun pendant 16
heures.
~ésuitate et Interrétation
(A)
|
|
|
|
|
0,64
|
|
|
0,75
|
|
1,64
|
|
3,22
|
|
|
|
|
0,76
|
|
|
|
|
|
0
2,47 0,68
|
|
3,23
|
|
|
|
0,87
|
|
|
1,13
|
|
4,04
|
3,29
Glycémie (g/l)
Diabétiques témoins Diabétiques
traités Normaux traités Normaux témoins




3
1
10,91
67,06
6,50
42,98
(B)
Pourcentage de diminution

Diabétiques traités Diabétiques
témoins
3
1
42,98
67,06
,13
27,10
(C)
Pourcentage de diminution
Diabétiques traités ** Diabétiques
traités *


Figure 03 : Test de réponse des rats à 1
g/kg de l'extrait éthanolique après 5 semaines de traitement par
le même extrait (A) ;
(B) : Pourcentage de diminution de la glycémie
exprimant la réponse des rats à la fin des 5
semaines.
(C) : Comparaison entre le pourcentage de diminution
de la glycémie basale des rats postérieurement traités **
(5 semaines) et celui des rats qui n'ont subi aucun traitement
préalable*.
césuitate et
fnter~rétation
4,50
3,50
2,50
0,50
1,50
Normaux témoins Normaux traités Diabétiques
témoins Diabétiques traités
0 1 2 3 5 7
Temps (heure)
*
*
**
****
Figure 04 : Evolution de la glycémie des rats
suivis 7 heures après gavage (ou non) de 1 g/kg d'extrait
éthanolique.
* La signification de la différence entre les
diabétiques témoins et les traités. O La signification de
la différence entre les diabétiques témoins et les
traités.
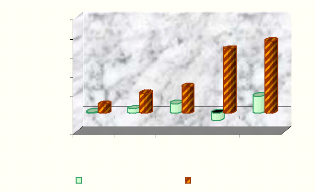
100,00
80,00
% 60,00
-20,00
40,00
20,00
0,00
Diabétiques témoins Diabétiques
traités
1 2 3 5 7
9,13
2
20,23 27,10
66,88 75,30
Temps (heure)
Figure 05 : Pourcentage de diminution de la
glycémie des rats diabétiques traités
(ou
témoins) par 1 g/kg d'extrait éthanolique durant les sept
heures qui suit le traitement.
II-9. Test de tolérance au glucose :
Chez des rats normaux traités 1 h auparavant avec 1
g/kg d'extrait éthanolique, le gavage de 3 g/kg de glucose,
entraîne un état d'hyperglycémie supérieur à
la normal (témoins). La figure 06 montre, également,
l'évolution de la glycémie durant les 2 heures.
|
Glycémie
(g/l)
|
2,40 2,00 1,60 1,20 0,80 0,40 0,00
|
|
0 30 60 90 120
Temps (mn)
|
Normaux témoins Normaux traités
préalablement
|
Figure 06 : Test de tolérance chez des rats
normaux traités 1 heure (par 1
g/kg de l'extrait éthanolique)
avant gavage de 3 g/kg de glucose.
II-10. Evaluation du pouvoir antiradicalaire :
La recherche d'une éventuelle efficacité
antiradicalaire à partir de l'extrait éthanolique, nous a
amené à obtenir les résultats illustrés dans la
figure 08 et 10. Le traitement de ces données révèle une
EC50 = 4943 mg/g et TEC50 = 9,64 mn (calculés graphiquement). De ce fait
l'efficacité antiradicalaire sera de 2. 10 -5.
Parallèlement, pour l'acide ascorbique (figure 07 et 09),
l'EC50 est de 123,94 mg/g avec un TEC50 égal à 1,06
mn, encore une efficacité antiradicalaire de l'ordre de 7,5.
10-3.
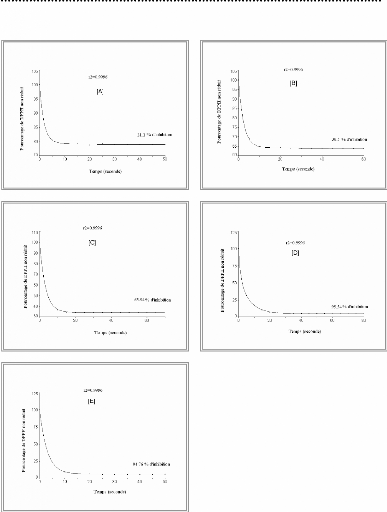
Figure 07 : Effet de la concentration
(exprimée en mg/g) en acide ascorbique sur le pourcentage de
réduction du DPPH :
(A) 48 mg/g; (B) 150 mg /g;
(C) 160 mg/g; (D) 240 mg/g; (E)
320 mg/g

Figure 08 : Effet de la concentration
(exprimée en mg/g) de l'extrait éthanolique sur le pourcentage de
réduction du DPPH :
(A) 4000 mg/g; (B) 8000 mg /g;
(C) 16000 mg/g; (D) 26600 mg/g; (E)
40000 mg/g
césuitate et
fnter~rétation
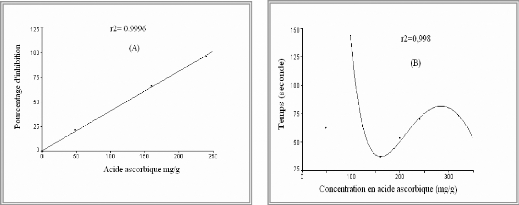
Figure 09 : (A) représente la relation
entre la concentration et le pourcentage d'inhibition
(B) montre la relation entre le temps
nécessaire pour atteindre la stabilité et la concentration en
acide ascorbique correspondante.
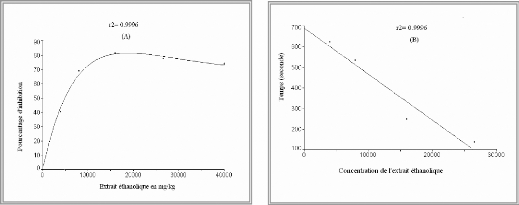
Figure 10 : (A) représente la relation
entre la concentration et le pourcentage d'inhibition
(B) montre la relation entre le temps
nécessaire pour atteindre la stabilité et la concentration de
l'extrait éthanolique correspondante.
L'utilisation des plantes médicinales est aujourd'hui
la forme de médecine la plus répandue à travers le monde.
Le recours au traitement par les plantes ainsi que la recherche de nouvelles
substances à activité biologiques constituent une des plus
grandes préoccupations scientifiques.
De ce fait, plusieurs travaux ont été
réalisés pour l'évaluation des secrets des plantes
médicinales dont la présente étude qui est
consacrée à la recherche d'éventuels effets
antidiabétiques à partir de l'extrait éthanolique de la
partie aérienne de Zygophyllum geslini Coss.
Dans cette direction de recherche , le choix de la plante, la
voie d'administration , le diabète induit ainsi que les
paramètres suivis sont des point essentiels à discutés.
Le Zygophylle comme d'autre plantes du même genre est
très utilisé pour traiter le diabète sucré,
notamment, chez les deux populations, marocaine et algérienne. En
Algérie, cette espèce est, généralement,
consommée comme condiment par les sahariens.
Un inventaire réalisé en 2000 par Benmehdi,
classe cette plante parmi les herbes pratiquement les plus utilisés par
la population tlemcenienne pour soigner le diabète sucré.
Désormais, cette plante nous a attirée vers ses vertus
thérapeutiques, particulièrement sur ses propriétés
antidiabétiques. Elle constitue alors, une matière
première de notre sujet de recherche.
La voie d'administration choisie est la voie orale pour de
multiples raisons. D'une part, car le choix de la plante s'était
fondé sur des bases ethnopharmacologiques; les gens l'utilisent pour
traiter le diabète sucré en avalant les tisanes qui en
découlent ou en la consommant entièrement. Subséquemment,
c'est la voie la plus proche de la réalité, c'est la mère
nature.
D'autre part, c'est une voie d'administration physiologique,
elle offre certain nombre de critères, d'efficacité et de
commodité. De plus elle ne nécessite aucun matériel
particulier. De point de vue pharmacologique, la voie orale est la plus
couramment utilisée (70 à 80% des
médicament sont administrés per os). Cette
voie est, généralement, bien acceptée par les patients
[Bourin et Jolliet, 1999].
Les données rassemblées sur l'utilisation
traditionnelle de cette herbe font ressortir que la plante était
consommée sous sa forme brute. De ce fait, on s'est basé sur
l'extrait éthanolique qui contient plus de composés, chose
confirmée par les tests phytochimiques réalisés sur les
trois extraits (Tableau n°1,Annexe 1).
Plusieurs techniques sont couramment utilisées afin de
produire, chez l'animal, un état comparable au diabète
sucré, en vue de mieux comprendre le diabète sucré de
l'homme ou de trouver de nouvelle thérapie.
Le diabète sucré peut être induit chez
l'animal par différentes techniques dont l'injection de la STZ qui est
largement utilisée [Szkudelski, 2001]. La STZ est un glucosamine
nitrosé [Anderson et al, 1974; Povoski et al., 1993],
elle entraîne un effet cytotoxique sélectif des cellules â
des îlots de Langerhans [Anderson et al, 1974 ; Robbins et
al, 1980 ; Crouch et al, 1978].
Le mécanisme d'action de cet agent
diabétogène reste encore mal connu. Cependant, les études
postérieures ont montré son action sur les îlots de
Langerhans en réduisant la masse des cellules â, par
conséquent une insulinopénie caractéristique d'une
hyperglycémie chronique ou transitoire [Aughsteen, 2000; Szkudelski,
2001; Chen et Ianuzzo, 1981].
Bien étudié, son impact sur le
métabolisme des hydrocarbures. La STZ provoque une altération du
métabolisme glucidique, lipidique et protéique due à la
défaillance en insuline [Szkudelski, 2001; Szkudelski et Szkudelska,
2002; Junod et al, 1969]. En revanche, des études
antérieures ont dévoilé l'effet indirect de cette toxine
sur la signalisation de l'insuline. La STZ, plus précisément
l'hyperglycémie chronique est à l'origine d'une
insulinorésistance résultante d'une diminution
d'autophosphorylation du récepteur de cette hormone [Kadowaki et
al, 1984]. Récemment démontré, elle active
l'expression de la protéine kinase C, protéine responsable de la
déphosphorylation du récepteur de l'insuline [Davidoff et
al, 2004]. De plus, l'injection de la STZ est à l'origine d'une
chute de poids [Junod et al, 1969; Chen et Ianuzzo, 1981].
Dans la présente étude, nous avons
injecté une dose de 50 mg/kg de STZ par voie intraveineuse, ceci a
provoqué un état d'hyperglycémie. Une glycémie
située entre 3,5 et 4 g/l était notée. Le diabète
induit par cette substance a, également, entraîné chez les
rats une polyphagie, polydipsie et une polyurie. De plus, une glucosurie a
été révélée. Ces signes, observés
chez l'animal, confirment l'installation du diabète sucré (*).
Les résultats obtenus durant les 5 semaines montrent
une légère diminution de la glycémie des rats
diabétiques. Celle-ci reste statistiquement non significatif. Il ressort
aussi de cette étape que l'extrait éthanolique n'a aucun impact
sur la glycémie des normaux où il est constatable que l'extrait
étudié à 500 mg/kg par voie orale administré
quotidiennement au rats normaux n'était pas toxique.
Le traitement des rats, par 500 mg/kg de l'extrait
éthanolique pendant 5 semaines, n'a aucun effet significatif sur la
glycémie. Plusieurs questions se posent. Pourquoi ? Est ce que la plante
est inefficace ? ...Simultanément, les réponses seront des
hypothèses à confirmer ou à infirmer.
L'explication qui vient dès le début est que la
plante semble inefficace ou que son effet n'est pas considérable. Si
elle en était, quelle était la cause du résultat obtenu
à la 3ème, 4ème et la 5ème
semaine ?
Déchiffrant, attentivement, l'évolution de la
glycémie des rats diabétiques témoins. La glycémie
diminue après la première semaine et ensuite on observe une
re-augmentation. Junod et al (1969) ont étudié la
relation entre la dose de la STZ et son effet diabétogène. Ils
ont rapporté que la STZ à une dose de 55 mg/kg administrée
par voie intraveineuse provoque une hyperglycémie de l'ordre de 3.4 g/l
24 heure après l'injection. Une semaine après, elle chute
à 2.04 g/l pour qu'elle se re-stabilise ensuite jusqu'à la
4ème semaine. Ceci confirme que le diabète induit par
la STZ passe par des étapes. Dans notre étude le diabète
des témoins se complique après la première semaine.
Certainement ce groupe est le miroir qui reflète l'évolution du
diabète sucré chez les rats traités.
(*) Malgré qu'il est très employé, le
terme de diabète sucré pourrait être mal placé. Il
serait beaucoup plus juste de dire que c'est un état semblable au
diabète sucré ou un état de dysglycémie.
Le suivi de la glycémie pendant 7 heures après
gavage de 1 g/kg de l'extrait montre une réponse positive des rats
à cet extrait. La diminution hautement significative peut aller
jusqu'à 75 % de la glycémie basale sept heures après. De
même, le test de réponse des rats à 1 g/kg
réalisé après la 5ème semaine montre une
réponse positive des rats. Une réduction de l'ordre de 67%, de la
glycémie basale, était observée 3 heures après le
gavage. Ce pourcentage était marqué chez les rats qui n'ont pas
reçu un traitement préalable après une durée de 5
heures.
En rapprochant les idées, l'hypothèse de
l'inefficacité de l'extrait sera complètement
éliminée. La seule explication est que la dose de 500mg/kg est,
probablement, insuffisante et loin d'inhiber les complications du
diabète résultantes de l'injection de 50 mg/kg de STZ par voie
intraveineuse.
Il est, peut être, constatable que le traitement
préalable des animaux améliore leur réponse à
l'extrait. Cette conclusion trouve son utilité dans le travail de
Jaouhari et al (1999) où ils ont visualisé
l'efficacité de l'extrait aqueux de Zygophyllum gaetulum sur
des patients diabétiques préalablement traités pendant une
semaine par le même extrait. Le résultat obtenu était
très intéressant comparé avec celui obtenu avant le
traitement.
Dans la présente étude, les rats rendus
diabétique présentent une chute de poids. Ceci est dû,
mentionné précédemment, à la STZ. Les deux groupes,
traités ou témoins ont la même allure de la courbe de
croissance; statistiquement pas de différence. Par conséquent,
l'extrait éthanolique à 500 mg/kg n'a pas d'impact sur la
croissance des rats. Son effet était neutre, ni positif, ni
négatif. Une conclusion à tirer : l'extrait étudié
n'était pas toxique et en même temps n'avait pas d'effet
bénéfique.
En ce qui concerne les paramètres lipidiques,
cholestérolémie et triglycéridémie, l'effet du
macérât était probablement masqué ou qu'il n'a pas
d'efficacité. Les valeurs obtenues restent indémontrables ainsi
que pour les protéines, où rien n'avait d'attirance.
Le test de tolérance des rats, préalablement
traités, à 3 g/kg de glucose montre une différence entre
leur réponse et celle des rats qui n'ont pas subi le traitement.
L'extrait éthanolique n'a pas pu améliorer la tolérance
des animaux au glucose. Il est donc constatable,
d'une part, que la plante n'agit pas au niveau intestinal et
précisément pas sur l'absorption du glucose. D'autre part, elle
ne stimule pas la sécrétion d'insuline, parce que si
c'était le cas, il y aurait une réponse positive. Ce test simple
peut nous orienter à postuler le mécanisme d'action par lequel
agit la plante en diminuant la glycémie.
Notre étude reste préliminaire et peu indicatif sur
le mécanisme d'action exact, néanmoins il est possible de
proposer les hypothèses suivantes :
~ A un premier regard et à partir du test de
tolérance au glucose réalisé sur les rats normaux, il
semble que l'extrait éthanolique contient un ou des composés qui,
éventuellement, agissent en compétition avec l'insuline sur sans
récepteur ou sur un site post récepteur. C'est-à-dire
qu'une fois absorbées, les substances responsables de l'effet
antihyperglycémiant vont probablement occuper les site d'action de
l'insuline qui est sécrétée suite au gavage du glucose. Il
est aussi bien remarquable que la glycémie ait un maximum 30 mn
après le gavage, et qu'elle reste dans les limites stable. Ceci indique
que le glucose en plus n'était pas stocké, il est donc probable
que les molécules actives n'agissent pas sur le stockage du glucose,
plus précisément, pas sur la synthèse du glycogène.
Cette hypothèse peut avoir une certaine probabilité surtout qu'il
existe dans la nature des substances agissant en compétition avec
l'insuline, c'est le cas des composés soufrés
dérivés de la cystéine extraits à partir
d'Allium sativum et A. cepa [Marles et Farnsworth, 1994 ; Dey
et al., 2002 ; Al-Achi, 2005].
~ La deuxième hypothèse vient, en quelques
sortes, compléter la première. Si la plante n'a pas d'effet sur
le stockage du glucose et qu'elle diminue la glycémie à jeun donc
il faut poser la question suivante : d'où vient l'hyperglycémie
à jeun ? Il est confirmé que l'élévation ou le
maintien du taux de glucose à jeun et la conséquence de la
glycogénolyse et/ou de la néoglucogenèse [Naik et
al., 1990]. Encore bien étudié est que la streptozotocine
augmente la production hépatique en glucose [Fisher et Kahn, 2003]. Il
est, également, probable que les composés actifs agissent en
inhibant la lyse des réserves glucidiques et/ou en inhibant la
synthèse du glucose (néoglucogenèse).
~ Nous avons cherché d'éventuelle
efficacité antiradicalaire à partir de l'extrait
éthanolique in vitro. Ceci pourrait avoir une relation avec
l'action de l'extrait in vivo. Si on prend en considération le
dommage induit par la STZ, cet axiome sera, donc, accepté. Plusieurs
travaux réalisés en vue de mieux comprendre le mécanisme
pathogène de la STZ, ont montré que ce produit diminue la
défense antioxydant de la cellule, particulièrement une
inhibition de l'activité superoxide dismutase [Robbins et al.,
1980; Gandy et al., 1982; Crouch et al., 1978; Rajasekaran
et al., 2005].
~ En dernier lieu, on peut penser aux enzymes. Les substances
peuvent avoir une certaine interaction (effecteur) avec un système
enzymatique.
Loin d'étudier le mécanisme d'action, la plante
constitue un ensemble riche en substances actives. Les résultats obtenus
peuvent être, ardemment, attribués à un des composés
ou une conjugaison de substances, aux saponosides surtout que la plante est en
très riche, aux flavonoïdes, ou à une autre famille de
composés présente dans l'extrait éthanolique.
A la lumière des résultats figurés dans
ce mémoire, notre objectif était abouti, l'extrait
éthanolique de la partie aérienne de Zygophyllum geslini
est doué d'une activité antihyperglycémiante (~)
remarquable. De fait, il sera très intéressant de réaliser
des études ultérieures sur cette plante et de rechercher la ou
les molécules actives responsables des effets trouvés.
(?) Plusieurs auteurs préfèrent
cette terminologie pour distinguer l'effet d'une substance sur la
glycémie normale (hypoglycémiant) de celui sur
l'hyperglycémie (antihyperglycémiant). Dans la présente
étude, l'extrait éthanolique n 'a pas entraîné un
état d'hypoglycémie chez les rats normaux d'où l'effet
antihyperglycémiant.
Conclusion
A la lumière des résultats figurés dans
ce mémoire, on peut conclure que le Zygophyllum geslini
appelée aggaya est très riche en saponosides, en tanins et en
flavonoides. Les tests biologiques réalisés sur les rats Wistar
ont prouvé l'efficacité de la plante étudiée contre
le diabète sucré.
Ce travail reste préliminaire et peu indicatif sur le
mécanisme réel par lequel agit l'extrait éthanolique en
diminuant l'hyperglycémie. Par conséquent, la réalisation
d'une étude postérieure sur des cellules isolées ou sur un
autre espèce animale est d'une importance cruciale. Ceci sera
enrichissant et peut nous conduire vers la découverte de nouvelles
substances à activité antidiabétique.
La réalisation d'une étude toxicologique est une
étape substantielle afin de pouvoir cerné tout effet
indésirable et de mieux comprendre les sites d'action des substances
actives.
La contribution à la recherche de
propriétés antioxydants à partir l'extrait
éthanolique reste introductive. Celle-ci constitue une estimation d'une
éventuelle activité antiradicalaire in vivo qui
pourrait, également, prévenir contre plusieurs maladies hors le
diabète sucré.
c~~~reez ces E~Ef~o~rc~eiyues
· Aharonson Z, Shani J (Mishkinsky), Sulman FG.
Hypoglycaemic effect of the salt bush (Atriplex halimus) - a Feeding
source of the sand rat (Psammomys obesus). Diabetologia.
1969; 5: 379- 383.
· Al-Achi A. Herbs that affect blood glucose levels.
Women 's Health in Primary Care. 2005; 8(7): 325-330.
· Anderson T, Schein PS, McMenamin MG, Cooney DA.
Streptozotocin Diabetes: Correlation with extent of depression of pancreatic
islet nicotinamide adenine dinucleotide. Journal of clinical investigation.
1974; 54:672-677.
· Anne-Laure. Phytochemical investigation of plants used
in African traditional medicine: «Dioscorea sylvatica»
(Dioscoreaceae), «Urginea altissima» (Liliaceae),
«Jamesbrittenia fodina» and «J.
Elegantissima» (Scrophulariaceae). Thèse de Doctorat,
Université de Lausanne. 2002.
· Aughsteen AA. An ultrastructural study on the effect of
streptozotocin on the islets of Langerhans in mice. J of Electron
Microscopy. 2000; 49(5):681-690.
· Baba Aïssa F. Encyclopédie des plantes
utiles. Flore d'Algérie et du Maghreb. Ed. Librairie
Moderne-Rouiba (1999). Alger.
· Babu V, Gangadevi T, Subramoniam A. Antidiabetic
activity of ethanol extract of Cassia klainii leaf in streptozotocin
induced diabetic rats and isolation of an active fraction and toxicity
evaluation of the extract. Indian Journal of Pharmacology. 2003;
35:290-296.
· Barrou B, Bitker MO, Grimaldi A, Debré P, Richard
F. Transplantation pancréatique: indications, résultats et
perspectives. EMC-Endocrinologie. 2004; 1:43-53.
· Bourin M, Jolliet P. Pharmacologie générale
et pratique. Ed ellipse (1999). Paris. p142.
· Buysschaert M, Vandeleene B, Parus I, Hermans MP. Le
diabète sucré d'une réalité d'aujourd'hui à
un défi de demain. Louvain Med. 1999; 118 : S189-S195.
· Calapai G, Corica F, Corsonello A, Sautebin L, Di Rosa
M, Campo GM, Buemi M, Mauro VN, Caputi1 AP. Leptin increases serotonin turnover
by inhibition of brain nitric oxide synthesis. J. Clin. Invest. 1999;
104:975-982.
· Charbonnel B, Cariou B. Diabète non
insulinodépendant: indications thérapeutiques.
Médecine thérapeutique. 1997 ; 3 : 103-111.
· Chen V, Ianuzza CD. Dosage effect of streptozotocin on
rat tissue enzyme activities and glycogen concentration. Can J Physiol
Pharmacol. 1981; 60: 1251-1256.
· Crouch R, Kimsey G, Priest DG, Sarda A, Buse MG. Effect
of streptozotocin on erythrocyte and retinal superoxide dismutase.
Diabetologia. 1978; 15:53-57.
· Davidoff AJ, Davidson MB, Carmody MW, Davis ME, Ren J.
Diabetic cardiomyocyte dysfunction and myocyte insulin resistance: role of
glucose-induced PKC activity. Molecular and Cellular Biochemistry.
2004; 262:155-163.
· Dey lucey MD, Anoja S, Attele DDS, Chun-Su Yuan MD.
Alternative therapies for type 2 diabetes. Alternative medicine
Review. 2002; 7(1): 45-58.
· Dirckx JH. The Honeyed Siphon: Diabetes Mellitus Past,
Present and Future. Perspectives Fall. 1998; 35-41.
c~~~reez ces E~Ef~o~rc~eiyues
· Drouin P, Buckle JF, Charbonnel B, Eschwege E,
Guillausseau PJ, Plauin PF, Daninos JM, Balarac N, Sauvanet JP. Diagnostic et
classification du diabète sucré : les nouvelles critères.
Diabète et métabolisme. 1999; 25 :72-83.
· Ducros V, Favier A. Métabolisme du
sélénium. EMC-Endocrinologie. 2004; 1(1) : 19-28.
· Eddouks M, Maghrani A, Lemhadri M, Ouahidi M.-L, Jouad
H. Ethnopharmacological survey of medicinal plants used for the treatment of
diabetes mellitus, hypertension and cardiac diseases in the south-east of
Morocco (Tafilalet). J of Ethnopharmacology. 2002; 82:97-103.
· Edeoga HO, Okwu DE, Mbaebie BO. Phytochemical
constituents of some Nigerian medicinal plants. African Journal of
Biotechnology. 2005; 4(7): 685-688.
· Eshrat HM. Hypoglycaemic, hypolipidemic and
antioxidant properities of combination of curcumin from Curcuma
longa Linn. And partially purified product from Abroma augusta
inn. in streptozotocin induced diabetes. Indian Journal of Clinical
Biochemistry. 2002; 17(2): 33-43.
· Evans GW, Bowman TD. Chromium Picolinate Increases
Membrane Fluidity and rate of Insulin Internalization. J of Inorganic
Biochemistry. 1992; 46: 243-250.
· Fasce CP. Serum cholesterol determined colorimetrically
with enzyme. Clin Chem. 1982; 18:901.
· Fassati P, Prencipe L. Serum triglycerides determined
colorimetrically with an enzyme that produces hydrogen peroxide. Clin
hem. 1982; 28: 2077-2080.
· Fisher SJ, Kahn R. Insulin signalling is required for
insulin's direct and indirect action on hepatic glucose production. J of
clinical investigation. 2003; 111:463-468.
· Gandy SE, Buse MG, Crouch RK. Protective role of
superoxide dismutase against diabetogenic drugs. America society for
clinical investigation. 1982; 70: 650-658.
· Gin H et Rigalleau V. Diabétiques et
diabète. EMC- Endocrinology nutrition. 1999; 10-366-R-10:
6p.
· Guerci B, Bohme P, Kearney-Schwartz A, Zannad F, Drouin
P. Endothelial dysfunction and type 2 diabetes. Diabetes Metab. 2001;
27: 436-447.
· Henry RJ, Cannon DC, Winkelman JW. Clinical
Chemistry-Principles and techniques. Harper et Row, 2nd Ed.
(1974).
· Hermans MP. Diabète de type 2 et adaptation
thérapeutique. Louvain Med. 1998; 118 : S2-S8.
· Huang DJ, Lin CD, Chen HJ, Lin YH. Antioxidant and
antiproliferative activities of sweet potato
(Ipomoea batatas [L.]
Lam `Tainong 57') constituents. Bot. Bull. Acad. Sin. 2004; 45:
179-186.
· Jaouhari JT, Lazrek HB, Jana M. the hypoglycaemic
activity of Zygophyllum gaetulum extracts in alloxan-induced
hyperglycaemic rat. J ofEthnopharmacolog. 2000; 69:17-20.
· Jaouhari JT, Lazrek HB, Seddik A, Jana M.
hypoglycaemic response to Zygophyllum gaetulum extracts in patients
with Non-Insulino-Dependent Diabetes Mellitus. J of Ethnopharmacology.
1999; 64:211-217.
· Jaspreet V, Sivakami S, Shahani S, Sulhar AC, Banavalikar
MM, Biyani MK. Antihyperglycemic effect of three extracts from Momordica
charantia. J of ethnopharmacology. 2003; 88: 107-111.
· Jouad H, Haloui M, Rhiouani H, El Hilaly J, Eddouks M.
ethnobotanical survey of medicinal plants used for the treatment of diabetes,
cardiac and renal diseases in the north centre region of Morocco
(Fez-Boulemane). J of Ethnopharmacology. 2001; 77: 175-182.
c~~~reez ces E~Ef~o~rc~eiyues
· Junod A, Lambert AE, Stauffacher W, Renold AE.
Diabetogenic action of streptozotocin:
relationship of dose to metabolic
response. J of Clinical Investigation. 1969; 48:2129-2139.
· Karumi Y, Onyeyili PA, Ogugbuaja VO. Identification of
active principles of M. balsamina (Balsam Apple) leaf extract. J
Med Sci. 2004; 4(3):179-182.
· Kin TV, Bosmand Krentz AJ. Contra-indications to
metformine therapy in patients with NIDDM. Diabetes care. 1997; 20:
925-928.
· Marles RJ, Farnsworth NR. Plants as sources of
antidiabetic agents. Econ Med Plant Res. 1994; 6:149-187.
· Molyneux P. The use of the stable free radical
diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity.
Songklanakarin J. Sci. Technol.2004; 26(2): 211-219.
· Naik RS, Filho JM, Dhuley JN, Deshmukh V. Probable
mechanism of hypoglycaemic activity of bassic acid, a natural product isolated
from Bumelia sartorum. J of Ethnopharmacology. 1991;
33:37-44.
· Niyah Njike G, Watcho P, Nguelefack TB, Kamanyi A.
Hypoglycaemic activity of the leaves of Bersama engleriana in rats.
Afr J Trad. 2005; 2(3): 215-221.
· Okwu DE. Phytochemicals, vitamins and mineral contents of
two Nigerian medicinal plants. Int J Mol Adv Sci. 2005; 1(4):
375-381.
· OMS. Stratégie de l'OMS pour la médecine
traditionnelle pour 2002-2005. WHO /EDM /TRM /2002.1.
· Ozenda P. Flore du Sahara. 2ème
édition (Ed du Centre National de la Recherche scientifique).
Paris.1977. 318-320.
· Perez CMM, Paris R. Sur une nouvelle plante
hypoglycémiante, le Zygophyllum cornutum Cosson. Mémoire
présenté à l'Académie de Pharmacie. Paris ;
1958.
· Pincemail J, Meurisse M, Limet R, Defraigne JO.
L'évaluation du stress oxydatif d'un individu : une
réalité pour le médecin. Vaisseaux, Coeur,
Poumons.1999; 4(5)
· Povoski SP, McCullough PJ, Zhou W, Bell RH. Induction
of diabetes mellitus in Syrian Golden Hamster using stored equilibrium
solutions of streptozotocin. American association for laboratory animal
science. 1993; 43(4):310-314.
· Punitha ISR, Rajendran K, Shirwaikar A, Shirwaikar A.
Alcoholic stem extract of Coscinium fenestratum regulates carbohydrate
metabolism and improves antioxidant status in streptozotocinnicotinamide
induced diabetic rats. eCAM. 2005; 2(3): 375-381.
· Raccah D. Epidémiologie et physiopathologie des
complications dégénératives du diabète
sucré. EMC-Endocrinologie. 2004; 1(1) : 29-42.
· Rajasekaran S, Sivagnanam K, Subramaniam S. Antioxidant
effect of Aloe vera gel extract in streptozotocin-induced diabetes in
rats. Pharmacological Reports. 2005; 57: 90-96.
· Ribes G, Sauvaire Y, Baccou JC. Effects of fenugreek
seeds on endocrine pancreatic secretions in dogs. Ann Nutr Metab.
1984; 28:37-43.
· Robbins MJ, Sharp RA, Slonim AE, Burr IM. Protection
against streptozotocin-induced diabetes by superoxide dismutase.
Diabetologia. 1980; 18:55-58.
· Sánchez-Moreno C, Larrauri JA, Saura-Calixto F. A
procedure to measure the antioradical afficiency of polyphenols. J Sci Food
Agric. 1998; 76:270-276.
c~~~reez ces E~Ef~o~rc~eiyues
· Smati D, Longeon A, Guyot M. 3 â-(3,
4-Dihydroxycinnamoyl)-erythrodiol, a cytotoxic constituent of Zygophyllum
geslini collected in the Algerian Sahara. J of Ethnopharmacology.
2004; 95: 405-407.
· Srivastava Y, Venkatakrishna-Bhatt H, Verma Y.
Antidiabetic and adaptogenic properties of Momorica charantia extract.
An experimental and clinical evaluation. Phytother Res. 1993;
7:285-289.
· Szkudelski T, Szkudelska K. Streptozotocin induces
lipolysis in rat adiposytes in vitro. Phys Res. 2002; 51:255-259.
· Szkudelski T. The mechanism of alloxan and streptozotocin
action in B cells of the rats pancreas. Physiol Res. 2001;
50:536-546.
· Thompson KH, Godin DV. Micronutrients and antioxidants in
the progression of diabetes. Nutrition Research. 1995; 15(9):
1377-1410.
· Trinder P. determination of glucose in blood using
glucose oxidase with an alternative oxygen receptor. Ann Clin Biochem.
1969; 6: 24-27.
· Troszynsta A, Ciska E. Phenolic compounds of seeds coats
of white and coloured varieties of Pea (Pisum sativum L.) and their
total antioxidant activity. Csech J Food Sci. 2002; 20:15-22.
· Weaber G. Diabétologie expérimentale.
Revue médicale de la Suisse Romande. 2000; 120 : 907- 913 .
· Welihinda J, Karunanayake EH, Sheriff MH, Jayasinghe KS.
Effect of Momorica charantia on glucose tolerance in maturity onset
diabetes. J Ethnopharmacology. 1986; 17:277-282.
~~~~~~~~~~~~~~~~~~~~~~

Annexe 1 ~
Tests phytochimiques:
1- Tanins :
A 2 ml de la solution à tester ajouter 2 à 3
gouttes de solution de FeCl3 à 2%. Un test positif est
révélé par l'apparition d'une coloration bleue-noire et un
précipité (laisser reposer quelques minutes) [Karumi et
al., 2004].
2- Saponosides :
Test 1 : 5 ml des trois extraits,
étherique, éthanolique et aqueux sont bien mélangés
avec 10 ml d'eau distillée pendant 2 mn. La formation d'une mousse
persistante après 15 mn confirme la présence des saponosides
[Karumi et al., 2004].
Test 2 : Evaporer 10 ml d'extrait
éthanolique. Traiter le résidu obtenu avec 10 ml de chloroforme
anhydre. Mélanger 5 ml de la solution chloroformique avec 5 ml
d'anhydride acétique. Ajouter quelques gouttes d'acide sulfurique
concentré. Agiter puis laisser reposer. L'apparition d'une coloration
violacée fugace virant au vert confirme la présence des
hétérosides stéroidiques [Benmehdi, 2000].
Test 3 : 5 ml de chaque extrait sont
mélangés avec 2 ml de chloroforme et 3 ml d'acide sulfurique
concentré. Une couleur rouge-marronne de la couche d'interface indique
la présence des triterpène hétérosidique [Edeaga,
2005].
3- Flavonoides :
Traiter 5 ml de chaque extrait avec quelques gouttes d'HCl
concentré. Ajouter une quantité de tournures de magnésium
(Laisser agir). La présence des flavone aglycone est confirmée
par l'apparition d'une couleur rouge ou orange [Karumi et al.,
2004].
~JlJle,ce8
4- Composés réducteurs :
Ce test est basé sur la réaction de
Keller-Kiliani. A 1 ml de chaque extrait ajouter 5 ml d'acide acétique
contenant des traces de FeCl3 et 5 ml d'acide sulfurique contenant des traces
de FeCl3. La présence des composés réducteurs est
confirmé par la formation de deux phases, une colorée en brun
rouge (acide acétique) et la deuxième en bleu-vert (acide
sulfurique) [Edeoga et al., 2005].
·
· Coumarines :
Placer 1 g d'échantillon de la plante humide dans un
tube à essai. Couvrir le tube avec un papier imbibé d'une
solution de NaOH et le placer dans un bain marie pendant quelques minutes.
Ajouter 0,5 ml de NH4OH (10%). Mettre deux taches sur un papier filtre et
examiner sous la lumière ultraviolette. La fluorescence des taches
confirme la présence des coumarines [Benmehdi, 2000].
·
· Anthracénosides :
Ce test est réalisé sur l'extrait
éthanolique. En premier lieu, prendre 25 ml de l'extrait
éthanolique, ajouter 15 ml d'HCl 10%, porter à reflux pendant 30
mn, refroidir la solution et l'extraire 3 foix avec 15 ml d'éther
diéthylique afin d'obtenir deux phases, aqueuse et étherique.
Le test de la présence des anthracénosides est
basé sur la réaction de Borntrager. Evaporer 8 ml de la phase
étherique, récupérer le résidu avec 2 ml d'eau
chaude, ajouter quelques gouttes d'NH4OH à 10%. Test positif par
l'apparition d'une coloration rouge orangée.
·
· Anthocyanosides
:
Doser la phase aqueuse, obtenu auparavant, avec du NaOH, s'il y
a un virage de couleur à pH différent, ceci indique la
présence des anthocyanosides.
L'apparition d'une couleur rouge à pH< 3 et bleue
entre 4 et 6, caractérise les anthocyanosides [Benmehdi, 2000].
5- Alcaloïdes :
~JlJle,ce8
* Réactif de Mayer : 5 g de KI et 1,358 g
de HgCl2 solubilisés dans 100 ml d'eau distillée.
* Réactif de Wagner : 2 g de KI et 1,27g
d'I2 solubilisé dans 100 ml d'eau distillée.
Sur l'extrait éthanolique : Ce test est
fait pour révéler la présence ou l'absence des
alcaloïdes sels.
Evaporer 25 ml de l'extrait éthanolique à sec,
ajouter 5 ml d'HCl 2N au résidu et chauffer dans un bain marie.
Filtrer le mélange et réaliser les tests avec le réactif
de Mayer et/ ou de Wagner. La présence de turbidité ou de
précipitation indique la présence des alcaloïdes sels.
Sur l'extrait aqueux : Encore, ce test est
typique pour les alcaloïdes sels dans un milieu aqueux.
Prendre 25 ml de l'extrait aqueux, ajouter 15 ml d'HCl 10%,
porter l'ensemble à reflux pendant 30 mn, refroidir le mélange et
l'extraire 3 fois avec l'éther diéthylique. Décanter et
effectuer les tests sur les deux phases avec le réactif de Wagner ou de
Mayer.
Sur l'extrait étherique : Ce test
permet de révéler la présence ou l'absence des
alcaloïdes bases. Pour cela, évaporer 10 ml de la solution
étherique, dissoudre le résidu obtenu dans 1,5 ml d'HCl 2%.
Ajouter quelques gouttes du réactif de Mayer. La formation d'un
précipité blanc jaunâtre indique la présence des
alcaloïdes bases [Benmehdi, 2000].
6- Amidon :
Traiter l'extrait aqueux avec le réactif d'Amidon.
L'apparition d'une coloration bleue violacée indique la présence
d'amidon [Benmehdi, 2000].
* Réactif d'Amidon : 1,2 g d'I2 et 2,5
g de KI solubilisés dans 500 ml d'eau distillée.
7- Anthraquinones :
Bouillir 1 g de la plante pendant quelques minutes en
présence de 10 ml de KOH 0,5 N et 1 ml d'H2O2 à 5%.
Refroidir le mélange, filtrer puis acidifier le filtrat avec l'acide
acétique. Extraire la solution acide obtenue avec 10 ml de
benzène. Agiter l'extrait benzénique an présence de 5 ml
de NH4OH. Une réaction positive est révélée par la
formation d'une couleur rouge au niveau de la couche alcaline [Benmehdi,
2000].
~JlJle,ce8
8- Huiles volatiles et acides gras :
Evaporer 20 ml de solution étherique, le résidu
ainsi obtenu est dissout dans l'éthanol. La solution éthanolique
obtenue est ensuite concentrée à sec (le résidu* qui reste
après solubilisation est conservé pour le test d'acides gras). Un
test positif est révélé par l'obtention d'un résidu
arôme.
Le résidu* est saponifié en ajoutant 10ml de
KOH 2 N. Ensuite extraire avec l'éther diéthylique. La
phase étherique obtenue est évaporer à sec. Un test
positif est révélé par l'obtention d'un résidu
gras.
9- Emodols :
Evaporer 3 ml de l'extrait étherique. Ajouter 1 ml
d'NH4OH. L'apparition d'une teinte vive variant de l'orangé rouge au
violet pourpre, indique la présence des emodols.
~~ ~JlJle,ce8
|
Composé
|
Résultat obtenu
|
|
Tanins
|
+ avec l'extrait éthanolique et l'extrait aqueux.
|
|
Saponoside
|
Deux tests de détection et de caractérisation de
cette famille de composé ont été réalisés
révèlent la présence des hétérosides
stéroidiques et triterpénique au niveau des trois extraits.
|
|
Flavonoides
|
+ avec l'extrait éthanolique.
|
|
Composés
réducteurs
|
+ avec l'extrait éthanolique et aqueux.
+ Anthracénosides : + avec l'extrait
éthanolique. + Anthocyanosides : - avec l'extrait
éthanolique. + Coumarines : + test
réalisé sur la plante humide.
|
|
Alcaloïdes
|
- avec l'extrait éthanolique
+ avec l'extrait aqueux ? Alcaloïdes sels
+ avec l'extrait étherique ? Alcaloïdes bases
|
|
Amidon
|
- réalisé sur la plante entière.
|
|
Anthraquinone
|
- réalisé sur la plante entière.
|
|
Huiles volatiles
|
+ réalisé sur l'extrait étherique.
|
|
Acides gras
|
+ réalisé sur l'extrait étherique.
|
|
Emodols
|
- réalisé sur l'extrait étherique.
|
+ Résultat positif
- Résultat
négatif
Tableau n° 1 : Les résultats des
tests phytochimique réalisés sur les trois extraits et sur
la
plante entière.
e11110,X08

Annexe 2
Dosage des protéines totales :
ces Préparation du
réactif de Biuret : Le réactif contient :
· Tartrate de sodium st de potassium 21 mmol/l
· Sulfate de cuivre 7 mmol/l
· Hydroxyde de sodium 1.15 N
· Iodure de potassium 6 mmol/l
Pour la préparation, solubiliser la NaOH, ensuite ajouter
les autres composants. ces Droite d'étalonnage
:
On prépare différentes concentrations de la
sérumalbumine humaine. Dans des tubes à hémolyse, mettre 1
ml du réactif de Biuret, ajouter 20 ul de la solution à doser (ou
sérum) agiter et laisser reposer 30 mn. Lire l'absorbance à 540
nm. Le blanc contient que le réactif de Biuret.
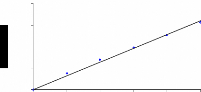
0,8
y = 0,0064x
R2 = 0,9951
0,6
0,4
0,2
0
0 20 40 60 80 100
Concentration en protéines (g/l)
eilile«eleS

Annexe 3
Résultats des tests biologiques :
Remarque : les lignes en gris représentent la
Moyenne #177; Erreur standard
Tableau 1 : Evolution de la glycémie
(g/l) des rats normaux et diabétiques traités et
témoins
durant les cinq semaines de traitement par 500 mg/kg
d'extrait éthanolique.
|
Temps (semaine)
|
0
|
1
|
2
|
3
|
4
|
5
|
|
1,03
|
0,94
|
1,09
|
0,98
|
1,3
|
0,75
|
|
1,11
|
0,97
|
1,11
|
1,05
|
1,02
|
0,97
|
|
1,02
|
0,92
|
0,98
|
|
|
|
|
1,15
|
0,99
|
0,83
|
0,78
|
1,41
|
0,81
|
|
1,17
|
0,99
|
1,18
|
1
|
1,2
|
0,83
|
|
Normaux témoins
|
0,91#177; 0,03
|
0,96#177; 0,02
|
1,04#177; 0,07
|
0,95#177; 0,07
|
1,23#177; 0,1
|
0,84#177; 0,05
|
|
0,91
|
0,97
|
1
|
|
|
0,7
|
|
0,99
|
1,35
|
1,23
|
0,96
|
1,23
|
0,95
|
|
1,11
|
1,11
|
1,11
|
0,87
|
1,32
|
1,13
|
|
0,92
|
0,93
|
1,19
|
0,88
|
1,01
|
|
|
0,79
|
1,13
|
0,89
|
0,93
|
0,96
|
0,74
|
|
Normaux traités
|
0,94 #177; 0,06
|
1,10 #177; 0,8
|
1,08 #177; 0,07
|
0,91 #177; 0,02
|
1,13 #177; 0,1
|
0,88 #177; 0,12
|
|
5,56
|
1,13
|
2,03
|
1,9
|
3,82
|
5,73
|
|
3,83
|
2,57
|
4,34
|
4,84
|
4,87
|
5,69
|
|
3,32
|
1,09
|
1,56
|
0,83
|
1,14
|
2,36
|
|
4,01
|
4,16
|
5,01
|
4,48
|
5,93
|
6,65
|
|
Diabétiques témoins
|
4,18#177; 0,56
|
2,24#177; 0,84
|
3,24#177; 0,98
|
3,01#177; 1,13
|
3,94#177; 1,19
|
5,11#177; 1,09
|
|
3,65
|
1,36
|
3,01
|
1,64
|
3,05
|
|
|
3,47
|
1,29
|
1,91
|
1,78
|
1,85
|
1,64
|
|
3,91
|
3,29
|
3,91
|
2,58
|
4,07
|
3,69
|
|
Diabétiques traités
|
3,68#177; 0,16
|
1,98#177; 0,80
|
2,94#177; 0,71
|
2,00#177; 0,36
|
2,99#177; 0,79
|
2,67#177; 1,45
|
Tableau 2 : Evolution du poids (g) des rats
normaux et diabétiques traités et témoins durant
les
cinq semaines de traitement par 500 mg/kg d'extrait éthanolique.
|
Temps (semaine)
|
0
|
1
|
2
|
3
|
4
|
5
|
|
255
|
263
|
268
|
273
|
279
|
280
|
|
255
|
264
|
276
|
286
|
294
|
299
|
|
275
|
281
|
275
|
|
|
|
|
227
|
235
|
247
|
258
|
260
|
261
|
|
240
|
233
|
233
|
237
|
243
|
248
|
|
Normaux témoins
|
250,4#177; 9,02
|
255,2#177;10,32
|
259,8#177;9,5
|
263,5#177;12,17
|
269#177;12,85
|
272#177;12,88
|
|
235
|
233
|
230
|
234
|
244
|
255
|
|
258
|
258
|
265
|
278
|
285
|
290
|
|
231
|
231
|
235
|
239
|
242
|
250
|
|
267
|
267
|
272
|
277
|
281
|
|
|
248
|
248
|
248
|
246
|
256
|
262
|
|
Normaux traités
|
247,8#177;7,58
|
247,4#177;7,80
|
250#177;9,14
|
254,8#177;10,58
|
261,6#177;10,15
|
264,25#177;10,32
|
|
200
|
188
|
185
|
185
|
188
|
199
|
|
225
|
220
|
232
|
239
|
234
|
233
|
|
240
|
233
|
243
|
247
|
239
|
240
|
|
230
|
220
|
226
|
220
|
206
|
200
|
|
Diabétiques témoins
|
223,75#177;9,84
|
215,25#177;11,08
|
221,5#177;14,64
|
222,75#177;15,95
|
216,75#177;13,90
|
218#177;12,46
|
|
245
|
246
|
250
|
254
|
244
|
|
|
210
|
215
|
230
|
227
|
217
|
218
|
|
215
|
215
|
205
|
201
|
183
|
186
|
|
Diabétiques traités
|
223,33#177;13,43
|
225,33#177;12,69
|
228,33#177;15,99
|
227,33#177;18,8
|
214,67#177;21,68
|
202#177;22,63
|
|
Temps (semaine)
|
0
|
3
|
|
0,84
|
0,52
|
|
0,11
|
0,6
|
|
0,96
|
|
|
0,66
|
0,59
|
|
0,72
|
0,43
|
|
Normaux témoins
|
0,66#177; 0,16
|
0,54#177;0,05
|
|
0,96
|
|
|
0,84
|
0,51
|
|
0,86
|
0,55
|
|
0,38
|
|
|
0,88
|
0,31
|
|
Normaux traités
|
0,78#177;0,12
|
0,46#177;0,09
|
|
0,98
|
0,59
|
|
0,9
|
0,74
|
|
0,85
|
0,36
|
|
0,87
|
0,89
|
|
Diabétiques témoins
|
0,9#177;0,03
|
0,64#177;0,13
|
|
0,83
|
|
|
0,96
|
0,88
|
|
1,21
|
0,46
|
|
Diabétiques traités
|
1#177;0,14
|
0,67#177;0,30
|
|
Temps (semaine)
|
0
|
3
|
|
0,41
|
1,06
|
|
0,47
|
0,7
|
|
0,34
|
|
|
0,43
|
0,88
|
|
Normaux témoins
|
0,41#177;0,03
|
0,88#177;0,10
|
|
0,88
|
|
|
0,5
|
0,74
|
|
0,76
|
0,91
|
|
0,46
|
0,97
|
|
0,4
|
0,53
|
|
Normaux traités
|
0,60#177;0,10
|
0,79#177;0,11
|
|
1,03
|
1,42
|
|
0,77
|
1,98
|
|
0,42
|
1,39
|
|
1,52
|
1,42
|
|
Diabétiques témoins
|
0,94#177;0,27
|
1,55#177;0,16
|
|
0,53
|
1,53
|
|
0,73
|
0,84
|
|
1,89
|
0,45
|
|
Diabétiques traités
|
1,1#177;0,52
|
0,9#177;0,39
|
Tableau 3 : Evolution de la
cholestérolémie Tableau 4 : Evolution de la
triglycéridémie
(g/l) (g/l)
Tableau 5 : Evolution de la
protéinémie (g/l).
|
Temps (semaine)
|
0
|
3
|
6
|
|
85,46
|
84,37
|
69,68
|
|
80,57
|
74,06
|
74,68
|
|
85,46
|
|
|
|
80,14
|
83,9
|
79,21
|
|
75,89
|
76,5
|
70,78
|
|
Normaux témoins
|
81,50#177;2,02
|
79,71#177;3,01
|
73,59#177;2,5
|
|
85,25
|
87,8
|
|
|
81,85
|
|
80,62
|
|
78,87
|
82,34
|
83,9
|
|
77,8
|
72,6
|
78,43
|
|
81,42
|
72,18
|
68,75
|
|
Normaux traités
|
8 1,04#177;1,45
|
78,73#177;4,42
|
77,93#177;3,77
|
|
82,91
|
81,56
|
83,59
|
|
71,63
|
86,56
|
72,34
|
|
75,25
|
74,53
|
73,59
|
|
89,72
|
92,8
|
77,03
|
|
Diabétiques témoins
|
79,87#177;4,67
|
83,86#177;4,47
|
76,63#177;2,91
|
|
82,06
|
|
|
|
85,04
|
74,06
|
83,75
|
|
81
|
83,43
|
75,46
|
|
Diabétiques traités
|
82,7#177;1,49
|
78,74#177;6,63
|
79,60#177;5,86
|
Tableau 6 : Test de réponse des rats
traités pendant 5 semaines à 1 g/kg de
l'extrait
éthanolique (glycémie en g/l)
|
Temps (heure)
|
0
|
1
|
3
|
|
0,83
|
0,64
|
0,75
|
|
0,85
|
0,82
|
0,64
|
|
0,92
|
0,82
|
0,52
|
|
Normaux témoins
|
0,87#177;0,03
|
0,76#177;0,07
|
0,64#177;0,08
|
|
1,06
|
0,69
|
0,75
|
|
1,15
|
0,57
|
0,68
|
|
1,17
|
0,77
|
0,81
|
|
Normaux traités
|
1,13#177;0,04
|
0,68#177;0,07
|
0,75#177;0,05
|
|
4,76
|
4,94
|
5,08
|
|
3,2
|
3,41
|
3,78
|
|
1,91
|
1,34
|
0,81
|
|
Diabétiques témoins
|
3,29#177;1,01
|
3,23#177;1,028
|
3,22#177;1,55
|
|
5,53
|
4,43
|
4,1
|
|
3,17
|
1,66
|
0,3
|
|
3,42
|
1,32
|
0,52
|
|
Diabétiques traités
|
4,04#177;0,92
|
2,47#177;1,21
|
1,64#177;1,51
|
Tableau 7 : Test de réponse des rats
traités pendant 5 semaines à 1 g/kg de
l'extrait
éthanolique (la diminution de la glycémie en %).
|
Temps (heure)
|
1
|
3
|
|
|
|
|
-3,78
|
-6,72
|
|
-6,56
|
-18,13
|
|
29,84
|
57,59
|
|
Diabétiques témoins
|
6,50#177;14,37
|
10,91#177;28,95
|
|
19,89
|
25,86
|
|
47,63
|
90,54
|
|
Diabétiques traités
|
42,98#177;15
|
67,06#177;25.39
|
Tableau 8 : Evolution de la glycémie
(g/l) des rats suivis 7 heures après gavage (ou non) de 1 g/kg d'extrait
éthanolique.
|
Temps (heure)
|
0
|
1
|
2
|
3
|
5
|
7
|
|
1,01
|
0,92
|
0,9
|
0,96
|
0,87
|
0,71
|
|
0,93
|
0,96
|
1,05
|
1,06
|
0,93
|
0,77
|
|
0,93
|
0,96
|
0,7
|
0,89
|
0,79
|
0,79
|
|
1,27
|
1,01
|
0,93
|
1,05
|
0,92
|
0,71
|
|
1,03
|
0,92
|
0,96
|
0,87
|
0,77
|
0,72
|
|
Normaux témoins
|
1,03#177;0,07
|
0,95#177;0,02
|
0,91#177;0,06
|
0,97#177;0,04
|
0,86#177;0,04
|
0,74#177;0,02
|
|
1,02
|
0,94
|
0,81
|
0,82
|
0,79
|
0,77
|
|
0,9
|
1
|
0,78
|
0,85
|
0,56
|
1,33
|
|
0,87
|
0,98
|
0,81
|
0,83
|
0,69
|
0,61
|
|
1,17
|
0,99
|
0,84
|
0,86
|
0,62
|
0,79
|
|
0,77
|
1,04
|
0,79
|
0,9
|
0,74
|
0,83
|
|
Normaux traités
|
0,95#177;0,08
|
0,99#177;0,02
|
0,81#177;0,01
|
0,85#177;0,02
|
0,68#177;0,05
|
0,87#177;0,14
|
|
3,8
|
3,76
|
3,9
|
3,78
|
4,5
|
3,15
|
|
4,24
|
4,39
|
3,96
|
3,63
|
3,88
|
3,1
|
|
3,31
|
3,11
|
3
|
2,83
|
3,76
|
3
|
|
Diabétiques témoins
|
3,78#177;0,33
|
3,75#177;0,45
|
3,62#177;0,38
|
3,41#177;0,36
|
4,05#177;0,28
|
3,08#177;0,05
|
|
2,95
|
2,78
|
2,25
|
2,03
|
0,88
|
0,56
|
|
2,17
|
2,1
|
1,82
|
1,97
|
0,79
|
0,66
|
|
3,69
|
3,01
|
2,92
|
2,18
|
|
|
|
Diabétiques traités
|
2,94#177;0,54
|
2,63#177;0,34
|
2,33#177;0,39
|
2,06#177;0,08
|
0,83#177;0,06
|
0,61#177;0,06
|
Tableau 9 : Pourcentage de diminution de la
glycémie des rats diabétiques traités
(ou
témoins) par 1 g/kg d'extrait éthanolique durant les sept heures
qui suit le traitement.
|
Temps (heure)
|
1
|
2
|
3
|
5
|
7
|
|
1,05
|
-2,63
|
0,52
|
-18,42
|
17,1
|
|
-3,53
|
6,6
|
14,38
|
8,49
|
26,88
|
|
6,04
|
9,36
|
14,5
|
-13,59
|
9,36
|
|
Diabétiques témoins
|
1,19#177;3,37
|
4,44#177;4,42
|
9,80#177;5,66
|
-7,84#177;10,1
|
17,78#177;6,18
|
|
5,76
|
23,72
|
31,18
|
70,17
|
81,01
|
|
3,22
|
16,12
|
9,21
|
63,59
|
69,58
|
|
18,42
|
20,86
|
40,92
|
|
|
|
Diabétiques traités
|
9,13#177;5,73
|
20,23#177;2,70
|
27,10#177;11,44
|
66,88#177;4,65
|
75,30#177;8,08
|
Tableau 10 : Test de tolérance chez des
rats normaux (glycémie en g/l) traités 1 heure (par 1
g/kg de
l'extrait éthanolique) avant gavage de 3 g/kg de glucose.
|
Temps (mn)
|
0
|
30
|
60
|
90
|
120
|
|
1,21
|
1,48
|
1,48
|
1,24
|
1,23
|
|
1,19
|
1,42
|
1,5
|
1,25
|
1,14
|
|
1,07
|
1,17
|
1,09
|
1,27
|
1,17
|
|
1,04
|
1,18
|
1,38
|
1,04
|
1,19
|
|
1,07
|
1,52
|
1,18
|
1,34
|
1,2
|
|
Normaux témoins
|
1,12#177;0,4
|
1,35#177;0,08
|
1,33#177;0,09
|
1,23#177;0,05
|
1,19#177;0,02
|
|
0,74
|
1,89
|
1,63
|
1,61
|
1,61
|
|
0,9
|
1,5
|
2,15
|
1,93
|
1,79
|
|
0,75
|
1,36
|
1,18
|
1,18
|
1,35
|
|
0,96
|
1,28
|
1,42
|
1,09
|
1,33
|
|
0,95
|
2,37
|
2,15
|
2,14
|
2,08
|
|
Normaux traités préalablement
|
0,86#177;0,05
|
1,68#177;0,22
|
1,71#177;0,22
|
1,59#177;0,23
|
1,63#177;0,16
|
Sommaire
Introduction . 1
Synthèse bibliographique
I- Phytothérapie 2
I-1. Définition .. 2
I-2. Les chiffres de l'OMS . 2
I-3. Pourquoi le recours à cette forme de médecine
? .... 3
II- Diabète sucré ... 3
II-1. Présentation de la maladie 3
II-2. De l'hyperglycémie chronique aux complications
organiques . 4
II-3. Le stress oxydant et les complications de la maladie 4
II-4. Traitement du diabète sucré 5
II-5. Les antidiabétiques : de l'efficacité
à la toxicité 6
II-6. Avenir du traitement de la maladie ..... 7
III- Plantes antidiabétiques 7
III-1. Quelques exemples 7
IV- Zygophyllum geslini ..... 9
IV-1. Description botanique 9
IV-2. Usage 10
Matériels et
méthodes
I- Etude chimique 11
I-1. Tests phytochimiques 11
I-2. Détermination de la teneur en flavonoides, tanins,
et saponosides 11
II. Partie biologique 12
II-1. Préparation de l'extrait éthanolique . 12
II.2 Administration de l'extrait 13
II-3. Les animaux 13
II-4. Induction du diabète sucré chez le rat
13
II-5. Recherche de toxicité 13
II-6. Prélèvement du sang 14
II-7. Techniques analytiques des paramètres sanguins
14
II-8. Chronologie des testes biologiques 15
II-9. Evaluation du pouvoir antioxydant 16
III- Evaluation statistique 17
Résultats et interprétation
I- Partie phytochimique 18
II- Partie biologique 18
II-1. Toxicité de l'extrait éthanolique 18
II-2. Evolution de la glycémie pendant les 5 semaines
18
II-3. Evolution du poids des rats 20
II-4. Evolution des paramètres lipidiques 20
II-5. Evolution de la protéinémie 20
II-6. Test de réponse des rats à 1 g/kg de
l'extrait étudié 22
II-7. Evolution de la glycémie à courte
durée 22
II-8. Comparaison entre la réponse des rats à 1
g/kg : effet du traitement préalable.... 22
II-9. Test de tolérance au glucose 25
II-10. Evaluation du pouvoir antiradicalaire 26
Discussion 30
Conclusion 36
Références bibliographiques
37
Annexes



