Conclusion
A la lumière des résultats figurés dans
ce mémoire, on peut conclure que le Zygophyllum geslini
appelée aggaya est très riche en saponosides, en tanins et en
flavonoides. Les tests biologiques réalisés sur les rats Wistar
ont prouvé l'efficacité de la plante étudiée contre
le diabète sucré.
Ce travail reste préliminaire et peu indicatif sur le
mécanisme réel par lequel agit l'extrait éthanolique en
diminuant l'hyperglycémie. Par conséquent, la réalisation
d'une étude postérieure sur des cellules isolées ou sur un
autre espèce animale est d'une importance cruciale. Ceci sera
enrichissant et peut nous conduire vers la découverte de nouvelles
substances à activité antidiabétique.
La réalisation d'une étude toxicologique est une
étape substantielle afin de pouvoir cerné tout effet
indésirable et de mieux comprendre les sites d'action des substances
actives.
La contribution à la recherche de
propriétés antioxydants à partir l'extrait
éthanolique reste introductive. Celle-ci constitue une estimation d'une
éventuelle activité antiradicalaire in vivo qui
pourrait, également, prévenir contre plusieurs maladies hors le
diabète sucré.
c~~~reez ces E~Ef~o~rc~eiyues
· Aharonson Z, Shani J (Mishkinsky), Sulman FG.
Hypoglycaemic effect of the salt bush (Atriplex halimus) - a Feeding
source of the sand rat (Psammomys obesus). Diabetologia.
1969; 5: 379- 383.
· Al-Achi A. Herbs that affect blood glucose levels.
Women 's Health in Primary Care. 2005; 8(7): 325-330.
· Anderson T, Schein PS, McMenamin MG, Cooney DA.
Streptozotocin Diabetes: Correlation with extent of depression of pancreatic
islet nicotinamide adenine dinucleotide. Journal of clinical investigation.
1974; 54:672-677.
· Anne-Laure. Phytochemical investigation of plants used
in African traditional medicine: «Dioscorea sylvatica»
(Dioscoreaceae), «Urginea altissima» (Liliaceae),
«Jamesbrittenia fodina» and «J.
Elegantissima» (Scrophulariaceae). Thèse de Doctorat,
Université de Lausanne. 2002.
· Aughsteen AA. An ultrastructural study on the effect of
streptozotocin on the islets of Langerhans in mice. J of Electron
Microscopy. 2000; 49(5):681-690.
· Baba Aïssa F. Encyclopédie des plantes
utiles. Flore d'Algérie et du Maghreb. Ed. Librairie
Moderne-Rouiba (1999). Alger.
· Babu V, Gangadevi T, Subramoniam A. Antidiabetic
activity of ethanol extract of Cassia klainii leaf in streptozotocin
induced diabetic rats and isolation of an active fraction and toxicity
evaluation of the extract. Indian Journal of Pharmacology. 2003;
35:290-296.
· Barrou B, Bitker MO, Grimaldi A, Debré P, Richard
F. Transplantation pancréatique: indications, résultats et
perspectives. EMC-Endocrinologie. 2004; 1:43-53.
· Bourin M, Jolliet P. Pharmacologie générale
et pratique. Ed ellipse (1999). Paris. p142.
· Buysschaert M, Vandeleene B, Parus I, Hermans MP. Le
diabète sucré d'une réalité d'aujourd'hui à
un défi de demain. Louvain Med. 1999; 118 : S189-S195.
· Calapai G, Corica F, Corsonello A, Sautebin L, Di Rosa
M, Campo GM, Buemi M, Mauro VN, Caputi1 AP. Leptin increases serotonin turnover
by inhibition of brain nitric oxide synthesis. J. Clin. Invest. 1999;
104:975-982.
· Charbonnel B, Cariou B. Diabète non
insulinodépendant: indications thérapeutiques.
Médecine thérapeutique. 1997 ; 3 : 103-111.
· Chen V, Ianuzza CD. Dosage effect of streptozotocin on
rat tissue enzyme activities and glycogen concentration. Can J Physiol
Pharmacol. 1981; 60: 1251-1256.
· Crouch R, Kimsey G, Priest DG, Sarda A, Buse MG. Effect
of streptozotocin on erythrocyte and retinal superoxide dismutase.
Diabetologia. 1978; 15:53-57.
· Davidoff AJ, Davidson MB, Carmody MW, Davis ME, Ren J.
Diabetic cardiomyocyte dysfunction and myocyte insulin resistance: role of
glucose-induced PKC activity. Molecular and Cellular Biochemistry.
2004; 262:155-163.
· Dey lucey MD, Anoja S, Attele DDS, Chun-Su Yuan MD.
Alternative therapies for type 2 diabetes. Alternative medicine
Review. 2002; 7(1): 45-58.
· Dirckx JH. The Honeyed Siphon: Diabetes Mellitus Past,
Present and Future. Perspectives Fall. 1998; 35-41.
c~~~reez ces E~Ef~o~rc~eiyues
· Drouin P, Buckle JF, Charbonnel B, Eschwege E,
Guillausseau PJ, Plauin PF, Daninos JM, Balarac N, Sauvanet JP. Diagnostic et
classification du diabète sucré : les nouvelles critères.
Diabète et métabolisme. 1999; 25 :72-83.
· Ducros V, Favier A. Métabolisme du
sélénium. EMC-Endocrinologie. 2004; 1(1) : 19-28.
· Eddouks M, Maghrani A, Lemhadri M, Ouahidi M.-L, Jouad
H. Ethnopharmacological survey of medicinal plants used for the treatment of
diabetes mellitus, hypertension and cardiac diseases in the south-east of
Morocco (Tafilalet). J of Ethnopharmacology. 2002; 82:97-103.
· Edeoga HO, Okwu DE, Mbaebie BO. Phytochemical
constituents of some Nigerian medicinal plants. African Journal of
Biotechnology. 2005; 4(7): 685-688.
· Eshrat HM. Hypoglycaemic, hypolipidemic and
antioxidant properities of combination of curcumin from Curcuma
longa Linn. And partially purified product from Abroma augusta
inn. in streptozotocin induced diabetes. Indian Journal of Clinical
Biochemistry. 2002; 17(2): 33-43.
· Evans GW, Bowman TD. Chromium Picolinate Increases
Membrane Fluidity and rate of Insulin Internalization. J of Inorganic
Biochemistry. 1992; 46: 243-250.
· Fasce CP. Serum cholesterol determined colorimetrically
with enzyme. Clin Chem. 1982; 18:901.
· Fassati P, Prencipe L. Serum triglycerides determined
colorimetrically with an enzyme that produces hydrogen peroxide. Clin
hem. 1982; 28: 2077-2080.
· Fisher SJ, Kahn R. Insulin signalling is required for
insulin's direct and indirect action on hepatic glucose production. J of
clinical investigation. 2003; 111:463-468.
· Gandy SE, Buse MG, Crouch RK. Protective role of
superoxide dismutase against diabetogenic drugs. America society for
clinical investigation. 1982; 70: 650-658.
· Gin H et Rigalleau V. Diabétiques et
diabète. EMC- Endocrinology nutrition. 1999; 10-366-R-10:
6p.
· Guerci B, Bohme P, Kearney-Schwartz A, Zannad F, Drouin
P. Endothelial dysfunction and type 2 diabetes. Diabetes Metab. 2001;
27: 436-447.
· Henry RJ, Cannon DC, Winkelman JW. Clinical
Chemistry-Principles and techniques. Harper et Row, 2nd Ed.
(1974).
· Hermans MP. Diabète de type 2 et adaptation
thérapeutique. Louvain Med. 1998; 118 : S2-S8.
· Huang DJ, Lin CD, Chen HJ, Lin YH. Antioxidant and
antiproliferative activities of sweet potato
(Ipomoea batatas [L.]
Lam `Tainong 57') constituents. Bot. Bull. Acad. Sin. 2004; 45:
179-186.
· Jaouhari JT, Lazrek HB, Jana M. the hypoglycaemic
activity of Zygophyllum gaetulum extracts in alloxan-induced
hyperglycaemic rat. J ofEthnopharmacolog. 2000; 69:17-20.
· Jaouhari JT, Lazrek HB, Seddik A, Jana M.
hypoglycaemic response to Zygophyllum gaetulum extracts in patients
with Non-Insulino-Dependent Diabetes Mellitus. J of Ethnopharmacology.
1999; 64:211-217.
· Jaspreet V, Sivakami S, Shahani S, Sulhar AC, Banavalikar
MM, Biyani MK. Antihyperglycemic effect of three extracts from Momordica
charantia. J of ethnopharmacology. 2003; 88: 107-111.
· Jouad H, Haloui M, Rhiouani H, El Hilaly J, Eddouks M.
ethnobotanical survey of medicinal plants used for the treatment of diabetes,
cardiac and renal diseases in the north centre region of Morocco
(Fez-Boulemane). J of Ethnopharmacology. 2001; 77: 175-182.
c~~~reez ces E~Ef~o~rc~eiyues
· Junod A, Lambert AE, Stauffacher W, Renold AE.
Diabetogenic action of streptozotocin:
relationship of dose to metabolic
response. J of Clinical Investigation. 1969; 48:2129-2139.
· Karumi Y, Onyeyili PA, Ogugbuaja VO. Identification of
active principles of M. balsamina (Balsam Apple) leaf extract. J
Med Sci. 2004; 4(3):179-182.
· Kin TV, Bosmand Krentz AJ. Contra-indications to
metformine therapy in patients with NIDDM. Diabetes care. 1997; 20:
925-928.
· Marles RJ, Farnsworth NR. Plants as sources of
antidiabetic agents. Econ Med Plant Res. 1994; 6:149-187.
· Molyneux P. The use of the stable free radical
diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity.
Songklanakarin J. Sci. Technol.2004; 26(2): 211-219.
· Naik RS, Filho JM, Dhuley JN, Deshmukh V. Probable
mechanism of hypoglycaemic activity of bassic acid, a natural product isolated
from Bumelia sartorum. J of Ethnopharmacology. 1991;
33:37-44.
· Niyah Njike G, Watcho P, Nguelefack TB, Kamanyi A.
Hypoglycaemic activity of the leaves of Bersama engleriana in rats.
Afr J Trad. 2005; 2(3): 215-221.
· Okwu DE. Phytochemicals, vitamins and mineral contents of
two Nigerian medicinal plants. Int J Mol Adv Sci. 2005; 1(4):
375-381.
· OMS. Stratégie de l'OMS pour la médecine
traditionnelle pour 2002-2005. WHO /EDM /TRM /2002.1.
· Ozenda P. Flore du Sahara. 2ème
édition (Ed du Centre National de la Recherche scientifique).
Paris.1977. 318-320.
· Perez CMM, Paris R. Sur une nouvelle plante
hypoglycémiante, le Zygophyllum cornutum Cosson. Mémoire
présenté à l'Académie de Pharmacie. Paris ;
1958.
· Pincemail J, Meurisse M, Limet R, Defraigne JO.
L'évaluation du stress oxydatif d'un individu : une
réalité pour le médecin. Vaisseaux, Coeur,
Poumons.1999; 4(5)
· Povoski SP, McCullough PJ, Zhou W, Bell RH. Induction
of diabetes mellitus in Syrian Golden Hamster using stored equilibrium
solutions of streptozotocin. American association for laboratory animal
science. 1993; 43(4):310-314.
· Punitha ISR, Rajendran K, Shirwaikar A, Shirwaikar A.
Alcoholic stem extract of Coscinium fenestratum regulates carbohydrate
metabolism and improves antioxidant status in streptozotocinnicotinamide
induced diabetic rats. eCAM. 2005; 2(3): 375-381.
· Raccah D. Epidémiologie et physiopathologie des
complications dégénératives du diabète
sucré. EMC-Endocrinologie. 2004; 1(1) : 29-42.
· Rajasekaran S, Sivagnanam K, Subramaniam S. Antioxidant
effect of Aloe vera gel extract in streptozotocin-induced diabetes in
rats. Pharmacological Reports. 2005; 57: 90-96.
· Ribes G, Sauvaire Y, Baccou JC. Effects of fenugreek
seeds on endocrine pancreatic secretions in dogs. Ann Nutr Metab.
1984; 28:37-43.
· Robbins MJ, Sharp RA, Slonim AE, Burr IM. Protection
against streptozotocin-induced diabetes by superoxide dismutase.
Diabetologia. 1980; 18:55-58.
· Sánchez-Moreno C, Larrauri JA, Saura-Calixto F. A
procedure to measure the antioradical afficiency of polyphenols. J Sci Food
Agric. 1998; 76:270-276.
c~~~reez ces E~Ef~o~rc~eiyues
· Smati D, Longeon A, Guyot M. 3 â-(3,
4-Dihydroxycinnamoyl)-erythrodiol, a cytotoxic constituent of Zygophyllum
geslini collected in the Algerian Sahara. J of Ethnopharmacology.
2004; 95: 405-407.
· Srivastava Y, Venkatakrishna-Bhatt H, Verma Y.
Antidiabetic and adaptogenic properties of Momorica charantia extract.
An experimental and clinical evaluation. Phytother Res. 1993;
7:285-289.
· Szkudelski T, Szkudelska K. Streptozotocin induces
lipolysis in rat adiposytes in vitro. Phys Res. 2002; 51:255-259.
· Szkudelski T. The mechanism of alloxan and streptozotocin
action in B cells of the rats pancreas. Physiol Res. 2001;
50:536-546.
· Thompson KH, Godin DV. Micronutrients and antioxidants in
the progression of diabetes. Nutrition Research. 1995; 15(9):
1377-1410.
· Trinder P. determination of glucose in blood using
glucose oxidase with an alternative oxygen receptor. Ann Clin Biochem.
1969; 6: 24-27.
· Troszynsta A, Ciska E. Phenolic compounds of seeds coats
of white and coloured varieties of Pea (Pisum sativum L.) and their
total antioxidant activity. Csech J Food Sci. 2002; 20:15-22.
· Weaber G. Diabétologie expérimentale.
Revue médicale de la Suisse Romande. 2000; 120 : 907- 913 .
· Welihinda J, Karunanayake EH, Sheriff MH, Jayasinghe KS.
Effect of Momorica charantia on glucose tolerance in maturity onset
diabetes. J Ethnopharmacology. 1986; 17:277-282.
~~~~~~~~~~~~~~~~~~~~~~

Annexe 1 ~
Tests phytochimiques:
1- Tanins :
A 2 ml de la solution à tester ajouter 2 à 3
gouttes de solution de FeCl3 à 2%. Un test positif est
révélé par l'apparition d'une coloration bleue-noire et un
précipité (laisser reposer quelques minutes) [Karumi et
al., 2004].
2- Saponosides :
Test 1 : 5 ml des trois extraits,
étherique, éthanolique et aqueux sont bien mélangés
avec 10 ml d'eau distillée pendant 2 mn. La formation d'une mousse
persistante après 15 mn confirme la présence des saponosides
[Karumi et al., 2004].
Test 2 : Evaporer 10 ml d'extrait
éthanolique. Traiter le résidu obtenu avec 10 ml de chloroforme
anhydre. Mélanger 5 ml de la solution chloroformique avec 5 ml
d'anhydride acétique. Ajouter quelques gouttes d'acide sulfurique
concentré. Agiter puis laisser reposer. L'apparition d'une coloration
violacée fugace virant au vert confirme la présence des
hétérosides stéroidiques [Benmehdi, 2000].
Test 3 : 5 ml de chaque extrait sont
mélangés avec 2 ml de chloroforme et 3 ml d'acide sulfurique
concentré. Une couleur rouge-marronne de la couche d'interface indique
la présence des triterpène hétérosidique [Edeaga,
2005].
3- Flavonoides :
Traiter 5 ml de chaque extrait avec quelques gouttes d'HCl
concentré. Ajouter une quantité de tournures de magnésium
(Laisser agir). La présence des flavone aglycone est confirmée
par l'apparition d'une couleur rouge ou orange [Karumi et al.,
2004].
~JlJle,ce8
4- Composés réducteurs :
Ce test est basé sur la réaction de
Keller-Kiliani. A 1 ml de chaque extrait ajouter 5 ml d'acide acétique
contenant des traces de FeCl3 et 5 ml d'acide sulfurique contenant des traces
de FeCl3. La présence des composés réducteurs est
confirmé par la formation de deux phases, une colorée en brun
rouge (acide acétique) et la deuxième en bleu-vert (acide
sulfurique) [Edeoga et al., 2005].
·
· Coumarines :
Placer 1 g d'échantillon de la plante humide dans un
tube à essai. Couvrir le tube avec un papier imbibé d'une
solution de NaOH et le placer dans un bain marie pendant quelques minutes.
Ajouter 0,5 ml de NH4OH (10%). Mettre deux taches sur un papier filtre et
examiner sous la lumière ultraviolette. La fluorescence des taches
confirme la présence des coumarines [Benmehdi, 2000].
·
· Anthracénosides :
Ce test est réalisé sur l'extrait
éthanolique. En premier lieu, prendre 25 ml de l'extrait
éthanolique, ajouter 15 ml d'HCl 10%, porter à reflux pendant 30
mn, refroidir la solution et l'extraire 3 foix avec 15 ml d'éther
diéthylique afin d'obtenir deux phases, aqueuse et étherique.
Le test de la présence des anthracénosides est
basé sur la réaction de Borntrager. Evaporer 8 ml de la phase
étherique, récupérer le résidu avec 2 ml d'eau
chaude, ajouter quelques gouttes d'NH4OH à 10%. Test positif par
l'apparition d'une coloration rouge orangée.
·
· Anthocyanosides
:
Doser la phase aqueuse, obtenu auparavant, avec du NaOH, s'il y
a un virage de couleur à pH différent, ceci indique la
présence des anthocyanosides.
L'apparition d'une couleur rouge à pH< 3 et bleue
entre 4 et 6, caractérise les anthocyanosides [Benmehdi, 2000].
5- Alcaloïdes :
~JlJle,ce8
* Réactif de Mayer : 5 g de KI et 1,358 g
de HgCl2 solubilisés dans 100 ml d'eau distillée.
* Réactif de Wagner : 2 g de KI et 1,27g
d'I2 solubilisé dans 100 ml d'eau distillée.
Sur l'extrait éthanolique : Ce test est
fait pour révéler la présence ou l'absence des
alcaloïdes sels.
Evaporer 25 ml de l'extrait éthanolique à sec,
ajouter 5 ml d'HCl 2N au résidu et chauffer dans un bain marie.
Filtrer le mélange et réaliser les tests avec le réactif
de Mayer et/ ou de Wagner. La présence de turbidité ou de
précipitation indique la présence des alcaloïdes sels.
Sur l'extrait aqueux : Encore, ce test est
typique pour les alcaloïdes sels dans un milieu aqueux.
Prendre 25 ml de l'extrait aqueux, ajouter 15 ml d'HCl 10%,
porter l'ensemble à reflux pendant 30 mn, refroidir le mélange et
l'extraire 3 fois avec l'éther diéthylique. Décanter et
effectuer les tests sur les deux phases avec le réactif de Wagner ou de
Mayer.
Sur l'extrait étherique : Ce test
permet de révéler la présence ou l'absence des
alcaloïdes bases. Pour cela, évaporer 10 ml de la solution
étherique, dissoudre le résidu obtenu dans 1,5 ml d'HCl 2%.
Ajouter quelques gouttes du réactif de Mayer. La formation d'un
précipité blanc jaunâtre indique la présence des
alcaloïdes bases [Benmehdi, 2000].
6- Amidon :
Traiter l'extrait aqueux avec le réactif d'Amidon.
L'apparition d'une coloration bleue violacée indique la présence
d'amidon [Benmehdi, 2000].
* Réactif d'Amidon : 1,2 g d'I2 et 2,5
g de KI solubilisés dans 500 ml d'eau distillée.
7- Anthraquinones :
Bouillir 1 g de la plante pendant quelques minutes en
présence de 10 ml de KOH 0,5 N et 1 ml d'H2O2 à 5%.
Refroidir le mélange, filtrer puis acidifier le filtrat avec l'acide
acétique. Extraire la solution acide obtenue avec 10 ml de
benzène. Agiter l'extrait benzénique an présence de 5 ml
de NH4OH. Une réaction positive est révélée par la
formation d'une couleur rouge au niveau de la couche alcaline [Benmehdi,
2000].
~JlJle,ce8
8- Huiles volatiles et acides gras :
Evaporer 20 ml de solution étherique, le résidu
ainsi obtenu est dissout dans l'éthanol. La solution éthanolique
obtenue est ensuite concentrée à sec (le résidu* qui reste
après solubilisation est conservé pour le test d'acides gras). Un
test positif est révélé par l'obtention d'un résidu
arôme.
Le résidu* est saponifié en ajoutant 10ml de
KOH 2 N. Ensuite extraire avec l'éther diéthylique. La
phase étherique obtenue est évaporer à sec. Un test
positif est révélé par l'obtention d'un résidu
gras.
9- Emodols :
Evaporer 3 ml de l'extrait étherique. Ajouter 1 ml
d'NH4OH. L'apparition d'une teinte vive variant de l'orangé rouge au
violet pourpre, indique la présence des emodols.
~~ ~JlJle,ce8
|
Composé
|
Résultat obtenu
|
|
Tanins
|
+ avec l'extrait éthanolique et l'extrait aqueux.
|
|
Saponoside
|
Deux tests de détection et de caractérisation de
cette famille de composé ont été réalisés
révèlent la présence des hétérosides
stéroidiques et triterpénique au niveau des trois extraits.
|
|
Flavonoides
|
+ avec l'extrait éthanolique.
|
|
Composés
réducteurs
|
+ avec l'extrait éthanolique et aqueux.
+ Anthracénosides : + avec l'extrait
éthanolique. + Anthocyanosides : - avec l'extrait
éthanolique. + Coumarines : + test
réalisé sur la plante humide.
|
|
Alcaloïdes
|
- avec l'extrait éthanolique
+ avec l'extrait aqueux ? Alcaloïdes sels
+ avec l'extrait étherique ? Alcaloïdes bases
|
|
Amidon
|
- réalisé sur la plante entière.
|
|
Anthraquinone
|
- réalisé sur la plante entière.
|
|
Huiles volatiles
|
+ réalisé sur l'extrait étherique.
|
|
Acides gras
|
+ réalisé sur l'extrait étherique.
|
|
Emodols
|
- réalisé sur l'extrait étherique.
|
+ Résultat positif
- Résultat
négatif
Tableau n° 1 : Les résultats des
tests phytochimique réalisés sur les trois extraits et sur
la
plante entière.
e11110,X08

Annexe 2
Dosage des protéines totales :
ces Préparation du
réactif de Biuret : Le réactif contient :
· Tartrate de sodium st de potassium 21 mmol/l
· Sulfate de cuivre 7 mmol/l
· Hydroxyde de sodium 1.15 N
· Iodure de potassium 6 mmol/l
Pour la préparation, solubiliser la NaOH, ensuite ajouter
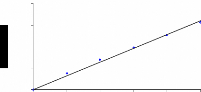
les autres composants. ces Droite d'étalonnage
:
On prépare différentes concentrations de la
sérumalbumine humaine. Dans des tubes à hémolyse, mettre 1
ml du réactif de Biuret, ajouter 20 ul de la solution à doser (ou
sérum) agiter et laisser reposer 30 mn. Lire l'absorbance à 540
nm. Le blanc contient que le réactif de Biuret.
0,8
y = 0,0064x
R2 = 0,9951
0,6
0,4
0,2
0
0 20 40 60 80 100
Concentration en protéines (g/l)
eilile«eleS

Annexe 3
Résultats des tests biologiques :
Remarque : les lignes en gris représentent la
Moyenne #177; Erreur standard
Tableau 1 : Evolution de la glycémie
(g/l) des rats normaux et diabétiques traités et
témoins
durant les cinq semaines de traitement par 500 mg/kg
d'extrait éthanolique.
|
Temps (semaine)
|
0
|
1
|
2
|
3
|
4
|
5
|
|
1,03
|
0,94
|
1,09
|
0,98
|
1,3
|
0,75
|
|
1,11
|
0,97
|
1,11
|
1,05
|
1,02
|
0,97
|
|
1,02
|
0,92
|
0,98
|
|
|
|
|
1,15
|
0,99
|
0,83
|
0,78
|
1,41
|
0,81
|
|
1,17
|
0,99
|
1,18
|
1
|
1,2
|
0,83
|
|
Normaux témoins
|
0,91#177; 0,03
|
0,96#177; 0,02
|
1,04#177; 0,07
|
0,95#177; 0,07
|
1,23#177; 0,1
|
0,84#177; 0,05
|
|
0,91
|
0,97
|
1
|
|
|
0,7
|
|
0,99
|
1,35
|
1,23
|
0,96
|
1,23
|
0,95
|
|
1,11
|
1,11
|
1,11
|
0,87
|
1,32
|
1,13
|
|
0,92
|
0,93
|
1,19
|
0,88
|
1,01
|
|
|
0,79
|
1,13
|
0,89
|
0,93
|
0,96
|
0,74
|
|
Normaux traités
|
0,94 #177; 0,06
|
1,10 #177; 0,8
|
1,08 #177; 0,07
|
0,91 #177; 0,02
|
1,13 #177; 0,1
|
0,88 #177; 0,12
|
|
5,56
|
1,13
|
2,03
|
1,9
|
3,82
|
5,73
|
|
3,83
|
2,57
|
4,34
|
4,84
|
4,87
|
5,69
|
|
3,32
|
1,09
|
1,56
|
0,83
|
1,14
|
2,36
|
|
4,01
|
4,16
|
5,01
|
4,48
|
5,93
|
6,65
|
|
Diabétiques témoins
|
4,18#177; 0,56
|
2,24#177; 0,84
|
3,24#177; 0,98
|
3,01#177; 1,13
|
3,94#177; 1,19
|
5,11#177; 1,09
|
|
3,65
|
1,36
|
3,01
|
1,64
|
3,05
|
|
|
3,47
|
1,29
|
1,91
|
1,78
|
1,85
|
1,64
|
|
3,91
|
3,29
|
3,91
|
2,58
|
4,07
|
3,69
|
|
Diabétiques traités
|
3,68#177; 0,16
|
1,98#177; 0,80
|
2,94#177; 0,71
|
2,00#177; 0,36
|
2,99#177; 0,79
|
2,67#177; 1,45
|
Tableau 2 : Evolution du poids (g) des rats
normaux et diabétiques traités et témoins durant
les
cinq semaines de traitement par 500 mg/kg d'extrait éthanolique.
|
Temps (semaine)
|
0
|
1
|
2
|
3
|
4
|
5
|
|
255
|
263
|
268
|
273
|
279
|
280
|
|
255
|
264
|
276
|
286
|
294
|
299
|
|
275
|
281
|
275
|
|
|
|
|
227
|
235
|
247
|
258
|
260
|
261
|
|
240
|
233
|
233
|
237
|
243
|
248
|
|
Normaux témoins
|
250,4#177; 9,02
|
255,2#177;10,32
|
259,8#177;9,5
|
263,5#177;12,17
|
269#177;12,85
|
272#177;12,88
|
|
235
|
233
|
230
|
234
|
244
|
255
|
|
258
|
258
|
265
|
278
|
285
|
290
|
|
231
|
231
|
235
|
239
|
242
|
250
|
|
267
|
267
|
272
|
277
|
281
|
|
|
248
|
248
|
248
|
246
|
256
|
262
|
|
Normaux traités
|
247,8#177;7,58
|
247,4#177;7,80
|
250#177;9,14
|
254,8#177;10,58
|
261,6#177;10,15
|
264,25#177;10,32
|
|
200
|
188
|
185
|
185
|
188
|
199
|
|
225
|
220
|
232
|
239
|
234
|
233
|
|
240
|
233
|
243
|
247
|
239
|
240
|
|
230
|
220
|
226
|
220
|
206
|
200
|
|
Diabétiques témoins
|
223,75#177;9,84
|
215,25#177;11,08
|
221,5#177;14,64
|
222,75#177;15,95
|
216,75#177;13,90
|
218#177;12,46
|
|
245
|
246
|
250
|
254
|
244
|
|
|
210
|
215
|
230
|
227
|
217
|
218
|
|
215
|
215
|
205
|
201
|
183
|
186
|
|
Diabétiques traités
|
223,33#177;13,43
|
225,33#177;12,69
|
228,33#177;15,99
|
227,33#177;18,8
|
214,67#177;21,68
|
202#177;22,63
|
|
Temps (semaine)
|
0
|
3
|
|
0,84
|
0,52
|
|
0,11
|
0,6
|
|
0,96
|
|
|
0,66
|
0,59
|
|
0,72
|
0,43
|
|
Normaux témoins
|
0,66#177; 0,16
|
0,54#177;0,05
|
|
0,96
|
|
|
0,84
|
0,51
|
|
0,86
|
0,55
|
|
0,38
|
|
|
0,88
|
0,31
|
|
Normaux traités
|
0,78#177;0,12
|
0,46#177;0,09
|
|
0,98
|
0,59
|
|
0,9
|
0,74
|
|
0,85
|
0,36
|
|
0,87
|
0,89
|
|
Diabétiques témoins
|
0,9#177;0,03
|
0,64#177;0,13
|
|
0,83
|
|
|
0,96
|
0,88
|
|
1,21
|
0,46
|
|
Diabétiques traités
|
1#177;0,14
|
0,67#177;0,30
|
|
Temps (semaine)
|
0
|
3
|
|
0,41
|
1,06
|
|
0,47
|
0,7
|
|
0,34
|
|
|
0,43
|
0,88
|
|
Normaux témoins
|
0,41#177;0,03
|
0,88#177;0,10
|
|
0,88
|
|
|
0,5
|
0,74
|
|
0,76
|
0,91
|
|
0,46
|
0,97
|
|
0,4
|
0,53
|
|
Normaux traités
|
0,60#177;0,10
|
0,79#177;0,11
|
|
1,03
|
1,42
|
|
0,77
|
1,98
|
|
0,42
|
1,39
|
|
1,52
|
1,42
|
|
Diabétiques témoins
|
0,94#177;0,27
|
1,55#177;0,16
|
|
0,53
|
1,53
|
|
0,73
|
0,84
|
|
1,89
|
0,45
|
|
Diabétiques traités
|
1,1#177;0,52
|
0,9#177;0,39
|
Tableau 3 : Evolution de la
cholestérolémie Tableau 4 : Evolution de la
triglycéridémie
(g/l) (g/l)
Tableau 5 : Evolution de la
protéinémie (g/l).
|
Temps (semaine)
|
0
|
3
|
6
|
|
85,46
|
84,37
|
69,68
|
|
80,57
|
74,06
|
74,68
|
|
85,46
|
|
|
|
80,14
|
83,9
|
79,21
|
|
75,89
|
76,5
|
70,78
|
|
Normaux témoins
|
81,50#177;2,02
|
79,71#177;3,01
|
73,59#177;2,5
|
|
85,25
|
87,8
|
|
|
81,85
|
|
80,62
|
|
78,87
|
82,34
|
83,9
|
|
77,8
|
72,6
|
78,43
|
|
81,42
|
72,18
|
68,75
|
|
Normaux traités
|
8 1,04#177;1,45
|
78,73#177;4,42
|
77,93#177;3,77
|
|
82,91
|
81,56
|
83,59
|
|
71,63
|
86,56
|
72,34
|
|
75,25
|
74,53
|
73,59
|
|
89,72
|
92,8
|
77,03
|
|
Diabétiques témoins
|
79,87#177;4,67
|
83,86#177;4,47
|
76,63#177;2,91
|
|
82,06
|
|
|
|
85,04
|
74,06
|
83,75
|
|
81
|
83,43
|
75,46
|
|
Diabétiques traités
|
82,7#177;1,49
|
78,74#177;6,63
|
79,60#177;5,86
|
Tableau 6 : Test de réponse des rats
traités pendant 5 semaines à 1 g/kg de
l'extrait
éthanolique (glycémie en g/l)
|
Temps (heure)
|
0
|
1
|
3
|
|
0,83
|
0,64
|
0,75
|
|
0,85
|
0,82
|
0,64
|
|
0,92
|
0,82
|
0,52
|
|
Normaux témoins
|
0,87#177;0,03
|
0,76#177;0,07
|
0,64#177;0,08
|
|
1,06
|
0,69
|
0,75
|
|
1,15
|
0,57
|
0,68
|
|
1,17
|
0,77
|
0,81
|
|
Normaux traités
|
1,13#177;0,04
|
0,68#177;0,07
|
0,75#177;0,05
|
|
4,76
|
4,94
|
5,08
|
|
3,2
|
3,41
|
3,78
|
|
1,91
|
1,34
|
0,81
|
|
Diabétiques témoins
|
3,29#177;1,01
|
3,23#177;1,028
|
3,22#177;1,55
|
|
5,53
|
4,43
|
4,1
|
|
3,17
|
1,66
|
0,3
|
|
3,42
|
1,32
|
0,52
|
|
Diabétiques traités
|
4,04#177;0,92
|
2,47#177;1,21
|
1,64#177;1,51
|
Tableau 7 : Test de réponse des rats
traités pendant 5 semaines à 1 g/kg de
l'extrait
éthanolique (la diminution de la glycémie en %).
|
Temps (heure)
|
1
|
3
|
|
|
|
|
-3,78
|
-6,72
|
|
-6,56
|
-18,13
|
|
29,84
|
57,59
|
|
Diabétiques témoins
|
6,50#177;14,37
|
10,91#177;28,95
|
|
19,89
|
25,86
|
|
47,63
|
90,54
|
|
Diabétiques traités
|
42,98#177;15
|
67,06#177;25.39
|
Tableau 8 : Evolution de la glycémie
(g/l) des rats suivis 7 heures après gavage (ou non) de 1 g/kg d'extrait
éthanolique.
|
Temps (heure)
|
0
|
1
|
2
|
3
|
5
|
7
|
|
1,01
|
0,92
|
0,9
|
0,96
|
0,87
|
0,71
|
|
0,93
|
0,96
|
1,05
|
1,06
|
0,93
|
0,77
|
|
0,93
|
0,96
|
0,7
|
0,89
|
0,79
|
0,79
|
|
1,27
|
1,01
|
0,93
|
1,05
|
0,92
|
0,71
|
|
1,03
|
0,92
|
0,96
|
0,87
|
0,77
|
0,72
|
|
Normaux témoins
|
1,03#177;0,07
|
0,95#177;0,02
|
0,91#177;0,06
|
0,97#177;0,04
|
0,86#177;0,04
|
0,74#177;0,02
|
|
1,02
|
0,94
|
0,81
|
0,82
|
0,79
|
0,77
|
|
0,9
|
1
|
0,78
|
0,85
|
0,56
|
1,33
|
|
0,87
|
0,98
|
0,81
|
0,83
|
0,69
|
0,61
|
|
1,17
|
0,99
|
0,84
|
0,86
|
0,62
|
0,79
|
|
0,77
|
1,04
|
0,79
|
0,9
|
0,74
|
0,83
|
|
Normaux traités
|
0,95#177;0,08
|
0,99#177;0,02
|
0,81#177;0,01
|
0,85#177;0,02
|
0,68#177;0,05
|
0,87#177;0,14
|
|
3,8
|
3,76
|
3,9
|
3,78
|
4,5
|
3,15
|
|
4,24
|
4,39
|
3,96
|
3,63
|
3,88
|
3,1
|
|
3,31
|
3,11
|
3
|
2,83
|
3,76
|
3
|
|
Diabétiques témoins
|
3,78#177;0,33
|
3,75#177;0,45
|
3,62#177;0,38
|
3,41#177;0,36
|
4,05#177;0,28
|
3,08#177;0,05
|
|
2,95
|
2,78
|
2,25
|
2,03
|
0,88
|
0,56
|
|
2,17
|
2,1
|
1,82
|
1,97
|
0,79
|
0,66
|
|
3,69
|
3,01
|
2,92
|
2,18
|
|
|
|
Diabétiques traités
|
2,94#177;0,54
|
2,63#177;0,34
|
2,33#177;0,39
|
2,06#177;0,08
|
0,83#177;0,06
|
0,61#177;0,06
|
Tableau 9 : Pourcentage de diminution de la
glycémie des rats diabétiques traités
(ou
témoins) par 1 g/kg d'extrait éthanolique durant les sept heures
qui suit le traitement.
|
Temps (heure)
|
1
|
2
|
3
|
5
|
7
|
|
1,05
|
-2,63
|
0,52
|
-18,42
|
17,1
|
|
-3,53
|
6,6
|
14,38
|
8,49
|
26,88
|
|
6,04
|
9,36
|
14,5
|
-13,59
|
9,36
|
|
Diabétiques témoins
|
1,19#177;3,37
|
4,44#177;4,42
|
9,80#177;5,66
|
-7,84#177;10,1
|
17,78#177;6,18
|
|
5,76
|
23,72
|
31,18
|
70,17
|
81,01
|
|
3,22
|
16,12
|
9,21
|
63,59
|
69,58
|
|
18,42
|
20,86
|
40,92
|
|
|
|
Diabétiques traités
|
9,13#177;5,73
|
20,23#177;2,70
|
27,10#177;11,44
|
66,88#177;4,65
|
75,30#177;8,08
|
Tableau 10 : Test de tolérance chez des
rats normaux (glycémie en g/l) traités 1 heure (par 1
g/kg de
l'extrait éthanolique) avant gavage de 3 g/kg de glucose.
|
Temps (mn)
|
0
|
30
|
60
|
90
|
120
|
|
1,21
|
1,48
|
1,48
|
1,24
|
1,23
|
|
1,19
|
1,42
|
1,5
|
1,25
|
1,14
|
|
1,07
|
1,17
|
1,09
|
1,27
|
1,17
|
|
1,04
|
1,18
|
1,38
|
1,04
|
1,19
|
|
1,07
|
1,52
|
1,18
|
1,34
|
1,2
|
|
Normaux témoins
|
1,12#177;0,4
|
1,35#177;0,08
|
1,33#177;0,09
|
1,23#177;0,05
|
1,19#177;0,02
|
|
0,74
|
1,89
|
1,63
|
1,61
|
1,61
|
|
0,9
|
1,5
|
2,15
|
1,93
|
1,79
|
|
0,75
|
1,36
|
1,18
|
1,18
|
1,35
|
|
0,96
|
1,28
|
1,42
|
1,09
|
1,33
|
|
0,95
|
2,37
|
2,15
|
2,14
|
2,08
|
|
Normaux traités préalablement
|
0,86#177;0,05
|
1,68#177;0,22
|
1,71#177;0,22
|
1,59#177;0,23
|
1,63#177;0,16
|
Sommaire
Introduction . 1
Synthèse bibliographique
I- Phytothérapie 2
I-1. Définition .. 2
I-2. Les chiffres de l'OMS . 2
I-3. Pourquoi le recours à cette forme de médecine
? .... 3
II- Diabète sucré ... 3
II-1. Présentation de la maladie 3
II-2. De l'hyperglycémie chronique aux complications
organiques . 4
II-3. Le stress oxydant et les complications de la maladie 4
II-4. Traitement du diabète sucré 5
II-5. Les antidiabétiques : de l'efficacité
à la toxicité 6
II-6. Avenir du traitement de la maladie ..... 7
III- Plantes antidiabétiques 7
III-1. Quelques exemples 7
IV- Zygophyllum geslini ..... 9
IV-1. Description botanique 9
IV-2. Usage 10
Matériels et
méthodes
I- Etude chimique 11
I-1. Tests phytochimiques 11
I-2. Détermination de la teneur en flavonoides, tanins,
et saponosides 11
II. Partie biologique 12
II-1. Préparation de l'extrait éthanolique . 12
II.2 Administration de l'extrait 13
II-3. Les animaux 13
II-4. Induction du diabète sucré chez le rat
13
II-5. Recherche de toxicité 13
II-6. Prélèvement du sang 14
II-7. Techniques analytiques des paramètres sanguins
14
II-8. Chronologie des testes biologiques 15
II-9. Evaluation du pouvoir antioxydant 16
III- Evaluation statistique 17
Résultats et interprétation
I- Partie phytochimique 18
II- Partie biologique 18
II-1. Toxicité de l'extrait éthanolique 18
II-2. Evolution de la glycémie pendant les 5 semaines
18
II-3. Evolution du poids des rats 20
II-4. Evolution des paramètres lipidiques 20
II-5. Evolution de la protéinémie 20
II-6. Test de réponse des rats à 1 g/kg de
l'extrait étudié 22
II-7. Evolution de la glycémie à courte
durée 22
II-8. Comparaison entre la réponse des rats à 1
g/kg : effet du traitement préalable.... 22
II-9. Test de tolérance au glucose 25
II-10. Evaluation du pouvoir antiradicalaire 26
Discussion 30
Conclusion 36
Références bibliographiques
37
Annexes
|
|



