|

REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE MinistIre
de l'enseignement supérieur et de la recherche scientifique
Université d'Alger
Faculté de Médecine
Département de Pharmacie
Mémoire de fin d'étude de
résidanat
en parasitologie-mycologie médicales
|
Séroprévalence de la Trichineiose
dans
la région de Tlemcen
|
Sebbagh Ibtissem
Mémoire soutenu le 11 Juillet 2012 au laboratoire de
parasitologiemycologie médicales de la faculté centrale
d'Alger
Directrice de mémoire : Professeur Adjmi-Hamoudi
Haiet
Remerciements
Avant tout, je tiens à remercier toutes les personnes qui
m'ont aidé et soutenu dans la réalisation de cette
étude.
Je remercie l'ensemble de mes enseignant(e)s de
spécialité qui ont contribué à ma formation durant
tout mon cursus de résidanat. Un immense MERCI à vous tous !!
En premier lieu, mes remerciements vont au Professeur Adjmi
pour avoir consenti à m'initier à la recherche, en acceptant la
direction de ce mémoire. Sa totale disponibilité, son sens
élevé de la rigueur scientifique et son idéal de
l'excellence ont largement contribué à la réalisation de
ce travail.
Je remercie également le Professeur Hamrioui, sa
passion pour la recherche et son amour du travail bien fait m'ont permis de
viser haut et de m'accrocher.
Merci au Docteur Abdelouahed pour ses idées, ses
encouragements, son aide durant toute l'année et sa supervision dans les
analyses statistiques du présent travail.
Le support du personnel du laboratoire de parasitologie
médicale de l'HCA était essentiel à la réalisation
pratique de ce mémoire, un grand merci à Abdelkader, Souad,
Toufik, particulièrement pour son humour spécial, que je
n'oublierai jamais ; et à tous les autres.
Je suis reconnaissante à la population de Tlemcen, en
particulier les patients qui ont participé à l'étude.
Merci au Professeur Benyoucef, au Professeur Berber, au
Professeur Taouli, au Docteur Benabadji et au Docteur Ben Yahia, qui nous ont
permis de recueillir les prélèvements de sang dans de bonnes
conditions.
Un merci particulier à Mahieddine qui n'a jamais
lésiné sur les moyens pour nous aider, et à toute
l'équipe du CHU de Tlemcen pour sa franche collaboration.
Un immense MERCI à ma famille et en particulier
à mes parents, à qui je dois et je dédie ce
mémoire. Merci d'avoir été présents depuis le
début et tout au long de mes études, méme si je sais que
le départ pour Alger n'a pas été facile. J'espère
que ce mémoire vous emplira de fierté et de bonheur, VOUS LE
MERITEZ.
Papa, Maman, je vous aime.
Merci à mes petites soeurs, mes amours, je vous adore
!!
Merci à ma Mamie, que dieu te garde pour nous le plus
longtemps possible.
Merci à tous mes amis, de Tlemcen, d'Alger et d'ailleurs.
Merci à mon petit rayon de soleil !!
Les mots me manquent pour exprimer tout ce que vous m'avez tous
apporté, alors je vous dirai juste MILLE FOIS MERCI !!.
Lisle des figures:
Figure n°1: Morphologie de l'adulte male de
Trichinella spiralis 19
Figure n°1bis: Morphologie de l'adulte femelle
de Trichinella spiralis et de la larve nouveau-née
20
Figure n°2: Morphologie de la larve musculaire
infestante de Trichinella spiralis.21
Figure n°3 : Larve de Trichinella
encapsulée dans le tissu musculaire
...21
Figure n°4: Répartition
géographique des espèces du genre Trichinella
.22
Figure n°5 : Cycle parasitaire de Trichinella
spiralis 31
Figure n°6 : Déroulement de la
trichinellose chez l'Homme .33
Figure n°7 : Schéma d'une larve infestant
une fibre musculaire .35
Figure n°8 : Formation de la cellule
nourricière~~~~~~~~~~~~~...36
Figure n°9 : Schéma d'une larve de
Trichinella spiralée dans la capsule de collagène et formation du
réseau capillaire ...36
o
Figure n°10 : Larve non encapsulée et
réaction inflammatoire musculaire
(quelques semaines après
l'infection)...................39 o
Figure n°11 : OEdeme de la face et des paupieres
chez une malade atteinte de trichinellose
.42
Figure n°12: Résumé complet des
principaux symptômes et signes cliniques, résultats de tests
diagnostiques chez des patients souffrant de forme légère
à sévère de trichinellose
.43
Figure n°13: Tomodensitométrie
cérébrale en coupe axiale transverse après injection
d'iode par voie veineuse~~~~~~~~~~~~~~~~ 44
Figure n°14: Imagerie par résonance
magnétique cérébrale 45
Figure n°15: Communes de la wilaya de Tlemcen
.57
Figure n°16 : Larve de Trichinella en
immunofluorescence indirecte 64
Figure n°17: Aspect d'immunoempreinte (Western
Blot)~~~~~~~~~~..65 o
Figure n°18 : Etapes de la réalisation du
test ELISA Trichinella IgG (EIA-3521) / IVD- BIO advance- DRG International,
Inc. USA 86
Liste des tableaux:
Tableau n°I : Répartition des
espèces et genotypes de
Trichinellao00000024
Tableau n°II : Délai d'apparition et
durée moyenne des différents symptômes liés
à
la
trichinellose000000000000000000000000000.41
Tableau
n°III : Répartition des patients selon l'ge et le
sexe~0000000...51
Tableau n°IV : Répartition des patients
selon les communes 00000000 52 Tableau
n°V : Répartition des patients selon les services du CHU de
Tlemcen
pourvoyeurs des prélèvements
sanguinso0000000000000000.53 Tableau n°VI :
Résultats globaux des sérologies répartis selon le
sexeo0000.69 Tableau n°VII:
Distribution des fréquences de certaines variables dans
la
population
étudiée0000000000000000000000000...71
Tableau n°VIII : Distribution de la variable
« consommation de viande bien ou peu
cuite » dans la population
étudiéeo000000000000000000..72
Tableau n°IX : Distribution de la variable
« consommation ou non de gibiers » dans
la population
étudiée000000000000000000000000...72
Tableau n°X : Distribution de la variable «
consommation ou non de viande
chevaline » dans la population
étudiéeo0000000000000000...73
Tableau n°XI : Distribution de la variable
« consommation ou non de viandes
inhabituelles » dans la population
étudiéeo000000000000000.73
Tableau n°XII : Distribution de la variable
« pratiques de chasse ou de trappe» dans
la population
étudiée000000000000000000000000...74
Tableau n°XIII : Distribution de la variable
« notion de voyage à l'étranger» dans la population
étudiée0000000000000000000000000...74
Abréviations
ADN acide désoxyribonucléique
ARNm acide ribonucléique messager
Ag antigène
ALAT Alanine Amino Transférase
ASAT Aspartate Amino Transférase
ECG Electro Cardio Gramme
EDTA Acide Ethylène Diamine Tétraacétique
ELISA Enzym Linked Immuno Sorbant Assay
E/S excrétion-sécrétion
°C Degré Celsius
CCI Clinique de Chirurgie Infantile
CHU Centre Hospitalo-Universitaire
CPK Créatine PhosphoKinase
CRP Protéine C Réactive
CTS Centre de Transfusion Sanguine
DO Densité Optique
GALT Gut Associated Lymphoide Tissue
g/l Gramme/Litre
IFI ImmunoFluorescence Indirecte
IgA, IgE, IgG, IgM immunoglobulines A, E, G, M
IL Interleukine
IRM Imagerie par Résonance Magnétique
kDa kilodaltons
L1 larve de 1er stade de croissance
L2 larve de 2ème stade de croissance
L3 larve de 3ème stade de croissance
L4 larve de 4ème stade de croissance
L1M trichine de stade larvaire L1 musculaire
L1NN trichine de stade larvaire L1 nouveau-né
LDH Lactate Déshydrogénase
ìm micromètre
ml millilitre
ìl microlitre
N° Numéro
nm nanomètre
ORL Oto-Rhino-Laryngologie
OTR Orthopédie et Traumatologie
pb paire de base
PBS phosphate buffer saline
PCR Polymerase Chain Reaction
TDM Tomodensitométrie
Th1/Th2 Lymphocyte T Helper 1/2
TMB TétraMéthylBenzidine
TSL-1 Antigène du groupe 1 de stade larvaire de T.
spiralis
T.T1 Trichinella spiralis
T.T2 Trichinella nativa
T.T3 Trichinella britoviT.T4 Trichinella
pseudospiralis
T.T5 Trichinella murrelliT.T6, T8, T9 et T12
Trichinella T6, T8, T9 et T12
T.T7 Trichinella nelsoniT.T10 Trichinella
papuae
T.T11 Trichinella zimbabwensis
UI/L Unité internationale/Litre
UMC Urgences Médico-chirurgicales
UV ultra violets
VIH Virus de l'Immunodéficience Humaine
Table des matières
Chapitre I : partie théorique
Remerciements 1
Liste des figures 3
Liste des tableaux 4
Abréviations 5
Introduction 13
Problématique 14
Historique 16
1. Epidémiologie 17
1- 1. Agents pathogènes 17
1- 1. 1. Taxonomie 17
1- 1. 2. Morphologie 18
1- 2. Répartition géographique des espèces
et génotypes de Trichinella 22
1- 3. Cycle évolutif 31
2. Pathogénie - Déroulement de la parasitose chez
l'homme 33
2- 1. Pouvoir pathogène 33
2- 1. 1. Action pathogène des adultes 33
2- 1. 2. Action pathogène des larves 33
2- 2. Déroulement de la parasitose chez l'homme 33
2- 2. 1. Phase d'infestation 34
2- 2. 2. Phase de dissémination 34
2- 2. 3. Phase d'enkystement 34
2- 3. Durée de vie des trichines 37
3. Physiopathologie de la trichinellose 38
3- 1. Phase d'infestation et perturbations intestinales 38
3- 2. Phase de dissémination et migration larvaire 39
3- 3. Phase d'enkystement larvaire et conséquences
musculaires 40
4. Clinique 41
4- 1. Symptomatologie 41
4- 1. 1. Incubation 41
4- 1. 2. Phase intestinale 41
4- 1. 3. Phase de dissémination et d'installation des
larves dans les muscles 41
4- 1. 4. Période d'état 42
4- 1. 5. Evolution 43
4- 2. Complications 44
4- 3. Clinique chez la femme enceinte 45
4- 4. Clinique chez l'enfant 46
4- 5. Clinique chez l'immunodéprimé 46
5. Diagnostic 47
5- 1. Arguments d'orientation 47
5- 2. Diagnostic indirect 47
5- 3. Diagnostic direct de certitude 47
6. Traitement 48
7. Prophylaxie individuelle 49
Chapitre II : partie pratique
1. Matériel et méthodes 51
1- 1. Matériel humain 51
1- 2. Matériel de laboratoire 54
1- 2. 1. Appareillage 54
1- 2. 2. Matériel consommable 54
1- 2. 3. Solutions et réactifs 54
1- 3. Méthodes 56
1- 3. 1. Devis d'étude, échantillonnage et
transport des prélèvements 56
1- 3. 2. Origine géographique de l'échantillon
investigué 56
1- 3. 3. Collecte des données 60
1- 3. 4. Questionnaire / Renseignements 60
2. Diagnostic 61
2- 1. Diagnostic d'orientation 61
2- 2. Diagnostic sérologique 62
2- 3. Diagnostic parasitologique de certitude 66
2- 4. Diagnostic différentiel 67
2- 5. Confirmation de cas 67
3. Résultats 69
3- 1. Résultats des sérologies
anti-Trichinella de l'échantillon étudié 69
3- 2. Revue des dossiers médicaux 70
3- 3. Résultats des examens biologiques
réalisés 71
3- 4. Distribution des variables 71
3- 4. 1. Influence de la variable consommation de viandes bien ou
peu cuites 72
3- 4. 2. Influence de la variable consommation ou non de gibiers
72
3- 4. 3. Influence de la variable consommation ou non de viande
chevaline 73
3- 4. 4. Influence de la variable consommation ou non de viandes
inhabituelles 73
3- 4. 5. Influence de la variable pratiques de chasse ou de
trappe 74
3- 4. 6. Influence de la variable notion de voyage à
l'étranger 74
4. Discussion 75
Conclusion 79
Bibliographie 88
RESUME 98


Introduction:
La trichinellose est une zoonose cosmopolite, due à un
petit nématode du genre Trichinella.
Elle est transmise à l'homme par ingestion de viande
parasitée contenant la larve enkystée.
La parasitose est représentée par deux formes
cliniques :
- Une forme toxi-infectieuse intestinale aigue due aux vers
adultes,
- Suivie rapidement d'une forme chronique résultant de
l'évolution des larves dans les muscles striés.
Dans notre pays peu de cas sont rapportés. Nous avons
jugés utile de rechercher une éventuelle contamination dans la
région de Tlemcen.
Problématique :
A partir du XXe siècle, on assiste à une
augmentation du nombre de cas mondiaux, en effet, la trichinellose sévit
sur toute la planète de façon endémique dans certaines
régions, sous forme de petites épidémies familiales chez
les consommateurs de sangliers ou de porcs d'élevages familiaux, mais
également sous forme d'épidémies de plusieurs centaines de
cas (De Bruyne A., 2006).
La trichinellose humaine a été documentée
dans 55 pays dans le monde, son incidence moyenne annuelle est probablement
proche de dix mille cas mondiaux avec un taux de mortalité d'environ 0,2
%, mais le nombre de cas est probablement sous-estimé dans de nombreux
pays en raison de l'absence de tests sérologiques et de la
méconnaissance de la parasitose par les médecins (Pozio E.,
2007).
En Europe, (De Bruyne A., 2006), les épidémies de
trichinellose ont connu une réelle recrudescence, dans les années
1980-2000, ce qui était à l'origine de plusieurs centaines de cas
principalement dans des zones urbaines et impliquant, pour certaines d'entre
elles, le cheval comme source de contamination.
C'est ainsi qu'en France, depuis 1976, huit
épidémies touchant plus de 2 000 personnes étaient dues
à la consommation de viande chevaline trichinée.
Cette parasitose, qui semblait avoir disparu dans les pays de
haut niveau de protection sanitaire, est redevenue une préoccupation de
santé publique tant dans le domaine médical que
vétérinaire.
Depuis le début des années 2000, la France a de
ce fait, considérablement renforcé son système de
prévention au niveau des abattoirs et s'est dotée depuis 2002
d'un Centre national de référence des Trichinella (CNR
des Trichinella, Paris).
En 2007, Edouardo Pozio, déclara que parmi 53 pays
Africains, la trichinellose a été documentée dans sept
pays, mais dans la majorité des cas, la parasitose touchait les
touristes et une minorité des natifs autochtones, car ne consommant pas
de viande crue ou celle de certaines espèces animales.
En Algérie, (Pozio E., 2007), la trichinellose a
été documentée au moins au cours de six
épidémies, chez environ 50 expatriés Français.
Il y avait six foyers associés à la consommation de
porc domestique (Sus scrofa domesticus) et de sangliers (Sus
scrofa).
En 2004, un cas a été diagnostiqué chez un
algérien (N'gaous), suite à la consommation de viande de chacal
(Canis aureus), l'identification moléculaire par amplification
génique multiplex, effectuée par le Centre international de
référence des Trichinella (Rome, Italie) à partir
d'une larve isolée par biopsie musculaire, l'a désignée
comme appartenant à l'espèce Trichinella britovi (Nezri
et al, 2006).
Dans la plupart des cas décrits de trichinellose, le
diagnostic est retenu sur la base de plusieurs critères cliniques et
biologiques (De Bruyne A., 2006).
Nous avons donc ciblé une population globale, chez qui
nous avons tenté de réunir le plus d'informations pour nous
rapprocher des définitions référentielles.
Le diagnostic de laboratoire est réalisé par la
technique ELISA.
Notre étude a concerné une cohorte de 1212
patients. Elle s'est déroulée sur un semestre, à partir de
Décembre 2011.
Nos objectifs sont :
· Déterminer la séroprévalence des
anticorps anti-Trichinella,
· Faire le diagnostic de la parasitose, en associant les
critères référentiels plus les facteurs de risque.
Historique:
La description de Trichinella spiralis et la
découverte de son cycle parasitaire remontent au XIXe siècle;
Tiedemann, fût le premier anatomiste qui, en 1822, a remarqué la
présence de « petits corps », qui furent baptisés
quelques années plus tard trichines (Klenner F. R., 1954 ; Neghina R.,
et al, 2012 ; Sattmann H., 2005).
Peacock, en 1828, découvre des larves enkystées
dans les muscles de patients autopsiés (Pannozzo A. N., et al, 1965 ;
Touratier L.,et al, 1998), un spécimen de la trichine
préparé par Peacock est conservé au musée de
l'hôpital de Guy à Londres (Drake E. H.,et al, 1935).
Hilton, en 1833, signala la présence de larves
enkystées (Howard H. S., 1964 ; Touratier L., et al, 1998).
James Paget 21 ans, jeune étudiant en première
année de médecine à l'hôpital Saint Bartholomew de
Londres découvre en 1835, au cours d'une séance de dissection des
petits grains blancs dans le diaphragme d'un cadavre. Il décide de les
étudier au microscope et observe alors des vers encapsulés
à l'intérieur des muscles.
Richard Owen publia la même année la description du
parasite comme une nouvelle espèce qu'il nomme Trichina spiralis
(Despommier D.D., 2000).
En 1846, l'anatomiste Leidy, aux Etats-Unis (Philadelphie),
observe des kystes contenant des larves de trichine dans de la viande de
porc.
En 1859, en Allemagne, Rudolf Virchow décrit les adultes,
et c'est en 1860 que des expérimentations mettent en évidence la
pathogénéïcité et le pouvoir létal du parasite
ainsi que la transmission de la maladie à l'homme par ingestion de
viande de porc contaminée (De Bruyne A., 2006).
Les signes cliniques de la trichinellose sont alors connus ce
qui permet de décrire de nombreux cas aux Etats-Unis, en Irlande, en
Grande Bretagne et en Allemagne. A la fin du XIXe siècle de
fréquentes contaminations humaines incriminant des viandes
américaines sont constatées en France déclenchant une
intensification des contrôles par trichinoscopie.
En 1896, Alcide Railliet, constatant que le nom de Trichina
était déjà attribué à un genre
d'insecte, proposa le nom de Trichinella.
La découverte la plus ancienne de capsules de
Trichinella remonte à 1200 ans avant JC, et fut faite
rétrospectivement en 1974 dans le muscle intercostal d'une momie
égyptienne de 3200 ans (Millet et al. 1980).
1. Epidémiologie :
1- 1. Agents pathogènes:
1- 1. 1. Taxonomie:
Dans la classification conventionnelle du Règne Animal,
les trichines étaient classées comme suit (Ripert C., 1998) :
Phylum : Némathelminthes
Classe : Nematoda (Rudolphi, 1808)
Sous classe : Adenophorea (Aphasmidia)
Ordre : Enoplida (Chitwood, 1933)
Super famille : Trichinelloidea (Hall, 1916)
Famille : Trichinellidea (Raillet, 1916)
Genre : Trichinella (Owen, 1835)
Espèce type : Trichinella spiralis (Railliet,
1895)
Dans la dernière classification du Règne Animal
(Hodda M. ; 2011), on admet que les trichines appartiennent au:
Phylum : Nematoda (Cobb, 1932)
Classe : Dorylaimea (Hodda, 2007)
Sous classe : Trichocephalia (Hodda, 2007)
Super ordre : Trichocephalica (Hodda, 2007)
Ordre : Trichocephalida (Spasski, 1954)
Sous ordre : Trichinellina (Hodda, 2007)
Super famille : Trichinelloidea (Ward, 1907)
Famille : Trichinellidea (Ward, 1907)
Genre : Trichinella (Railliet, 1896)
Espèce type : Trichinella spiralis (Railliet,
1896)
En raison de l'absence de critères morphologiques
distinctifs, il a longtemps été suggéré que T.
spiralis était la seule espèce du genre.
Dans les années 70, des expériences de croisement
entre des isolats d'origines géographiques différentes et la
présence ou l'absence de capsule autour des larves musculaires avaient
permis de différencier en sus de T. spiralis spiralis dans les
zones
tempérées, T. spiralis nativa dans les
zones arctiques, T. spiralis nelsoni dans les zones tropicales et
T. pseudo-spiralis (non encapsulée) (De Bruyne A., 2006).
A l'heure actuelle, des techniques moléculaires ont
permis d'établir que le genre Trichinella comporte deux
groupes, un représenté par les formes encapsulées
constitué de 5 espèces et 4 génotypes et un autre
représenté par les formes non encapsulées constitué
de 3 espèces.
Ces espèces et génotypes sont
numérotés de T1 à T12 (Pozio et al. 2009).
1- 1. 2. Morphologie:
(Chassaing J., P., 2001 ; Poirrier M., 2010 ; Pozio E., 2007;
Ripert C., 2007 ; In : Poirrier M., 2010)
Les espèces du genre Trichinella sont des vers
dont la section est cylindrique (nématodes), vivipares, à sexes
séparés et qui passent successivement par deux phases, adulte et
larvaire.
1- 1. 2. 1. Adulte:
La trichine est un petit ver blanc submicroscopique,
allongé et cylindrique. Il est effilé aux deux
extrémités et à peine visible à l'oeil nu. Les
mâles mesurent 1,5 mm de long sur 30 ìm de diamètre et les
femelles longues de 3 à 4 mm ont un diamètre de 60 ìm. La
taille peut varier selon l'importance de l'infestation; en effet, plus elle
sera importante, plus petit sera le ver.
La partie antérieure du corps contenant le tube digestif
est plus fine que la partie postérieure contenant l'appareil
génital. Le corps est recouvert d'une mince cuticule chitineuse
striée.
Les détails de la microscopie électronique sont
rapportés dans les schémas des figures (de droite) n°1a,
n°1b et n°2.
Les deux sexes présentent une extrémité
antérieure étroite, qui comporte un orifice buccal simple, muni
d'un petit stylet et s'ouvrant dans un long oesophage tubulaire
s'étendant sur environ la moitié du corps chez le male, et qui
est entouré de cellules empilées sur un rang (les stichocytes),
et caractéristiques de la famille des Trichinellidae. Ces stichocytes
forment le stichosome, responsable de la sécrétion de substances
antigéniques. A la suite de l'oesophage, il y a une glande intestinale
où abouche l'intestin moyen puis un intestin postérieur
s'abouchant dans le cloaque.
Le système nerveux est composé d'un anneau
céphalique et de quatre nerfs principaux cardinaux.
Le mâle, monorchide, présente une
extrémité postérieure occupée presque exclusivement
par un volumineux testicule unique, auquel fait suite un canal
déférent et une vésicule séminale, celle-ci s'ouvre
sur le cloaque. L'appareil copulateur est constitué de deux petits
appendices copulateurs coniques visibles sur la figure n°1a.
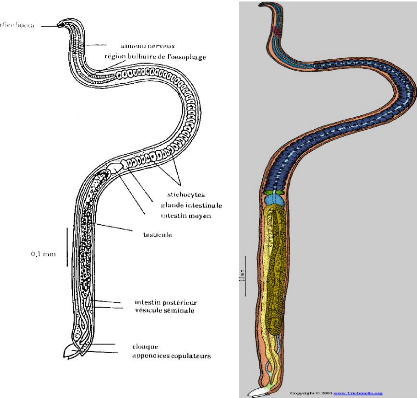
Figure n° 1: Morphologie de 4'/du4teIPk4eIde
Trichinella spiralis.
(Villela J.B., 1970 ; In : Chassaing J.,
P., 2001 )
L'appareil reproducteur de la femelle est constitué d'un
seul ovaire, d'un oviducte, d'un utérus et d'une vulve s'ouvrant juste
en arrière du stichosome.
La femelle vivipare donne naissance à des larves
nouveau-nées comme le montre la figure n°1b.
Elle pond entre 500 à 2000 larves par jour.
Les oeufs intra-utérins sont sphériques (30
à 40 ìm de diamètre) avec une membrane vitelline
très fine et sans vraie coque.
Les embryons cylindriques, se développent in utero
et se débarrassent de la membrane vitelline qui les entoure. Ils
mesurent 100 à 160 ìm de long sur 9 ìm de large.

Figure n° 1bis : Morphologie de l'adulte
femelle de Trichinella spiralis et de la
larve
nouveau-née.
(Villela J.B., 1970 ; In : Chassaing J.,
P., 2001 )
1- 1. 2. 2. Stades larvaires:
-La larve nouveau-née : Ln-n, mesure de
100 à 160 ìm de long pour 9 ìm de diamètre, elle
présente un stylet à la partie antérieure de l'oesophage
(figure n°1b).
-La larve musculaire ou infestante : L1,
rosée, mesure 1mm de long et 30 ìm de diamètre et est
encapsulée dans le muscle.
Elle a perdu le stylet buccal mais le tractus digestif est
complet.
Le stichosome formé de 50-55 stichocytes occupe la
moitié antérieure du corps et présente des
propriétés antigéniques.
L'appareil reproducteur est présent sous la forme d'une
ébauche indifférenciée mais permettant néanmoins de
distinguer le mâle (ébauche génitale émoussée
et rectum long) de la femelle (ébauche génitale pointue et rectum
court) (Figure n°2).

b oes ---bulbe de l'oesophage c----cuticule
eg ébauche génitale gi---glande intestinale
im intestin moyen ip---intestin postérieur
st stichocytes
Figure n° 2. Morphologie de la larve
musculaire infestante de Trichinella spiralis.
(Villela J.B.,
1970 ; In : Chassaing J., P., 2001 )
La larve s'enroule ensuite sur elle-méme et il y a alors
formation d'une capsule l'entourant qui permet sa survie dans le muscle
(Figure n°3). L'évolution est alors interrompue
jusqu'à l'ingestion du muscle parasité par un autre individu
réceptif.

Figure n°3. Larve de Trichinella
encapsulée dans le tissu musculaire.
1- 2. Répartition géographique des
espèces et génotypes de Trichinella: (De Bruyne A., 2006)
Des méta-analyses ont permis depuis les années
1970 de définir des souches biologiquement et géographiquement
distinctes de l'espèce originale Trichinella spiralis : T1
découverte par Railliet en 1896.
Les critères qui ont suscité le reclassement des
espèces de Trichinella se basaient sur des caractères
biologiques: différences dans le pouvoir infectieux vis-à-vis des
hôtes éventuels, spécificité de leur
répartition géographique ainsi que la présence ou
l'absence de capsules entourant les larves dans les tissus infestés.
Ainsi, deux nouvelles sous-espèces et une nouvelle
espèce avaient alors été identifiées: T. nativa
: T2 (zone arctique), T. nelsoni : T7 (zone tropicale) et T.
pseudospiralis : T4 (non encapsulée) en 1972. Mais les faibles
différences
morphologiques et la répartition cosmopolite des
parasites rendaient les critères d'identification usuels insuffisants
(Figure n°4).
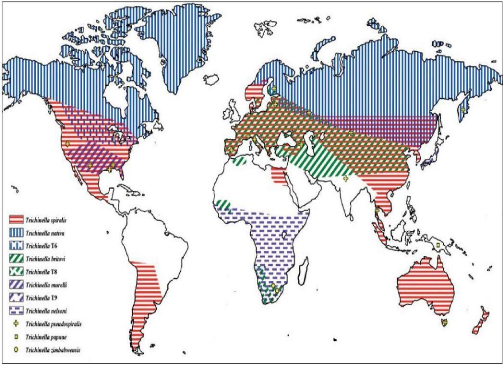
Figure n°4: Répartition
géographique des espèces du genre
Trichinella.
(De Bruyne A., 2006)
Des méthodes enzymatiques se basant sur les
activités fumarate réductase, succinate
déshydrogénase et malate déshydrogénase ont permis
de mettre en évidence les différences entre les espèces et
les sous-espèces.
Ces travaux ont conduit à une nouvelle classification
en huit génotypes distincts : les quatre espèces initiales (soit
T1, T2, T7 et T4), une nouvelle espèce : T. britovi T3, et
trois autres populations T5, T6, T8 (La Rosa G. et al., 1992 ; Pozio E.,
1992).
En 1999, les méthodes de biologie moléculaire ont
permis de caractériser une autre population parasitaire : T9
(Nagano I. et al., 1999).
Deux nouvelles espèces non encapsulées, T.
papuae : T.10 et T. zimbabwensis : T.11 ont été
décrites respectivement en 1999 et 2002 (Pozio E. et al., 2002) et T5
renommée en 2000 T. murelli (Pozio E., La Rosa G., 2000)
(Figure n°4).
En Argentine, une nouvelle population semble avoir
été découverte ; il s'agit de T12. Parmi ces
espèces, six ont été isolées chez l'homme.
Le tableau ci-dessous (Tableau n°I)
résume l'état actuel de la classification : le genre
Trichinella est classé en huit espèces et quatre
génotypes additionnels (T6, T8, T9 et T12).
Tableau n°1: Re'partition des especes et
genotypes de Trichinella. (d'apres Ripert C., 2007)
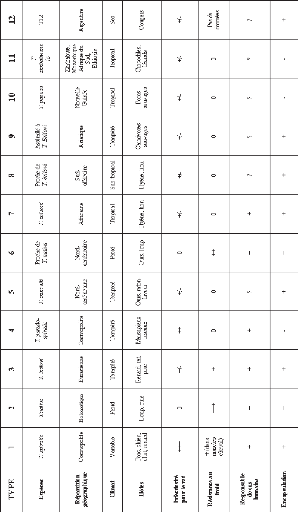
Une nouvelle classification a vu le jour (Pozio E., Murrell D.,
2006). Celle-ci est basée sur l'aptitude de la larve à
s'encapsuler ou non, ce qui a aboutit à la dichotomie suivante : les
espèces encapsulées (uniquement chez les mammifères) et
les espèces non encapsulées (chez les mammifères, les
oiseaux et les reptiles).
Les espèces encapsulées sont décrites ainsi
: - Trichinella spiralis (Railliet, 1896) :
T1
C'est la première trichine découverte et la plus
étudiée, du faite de son importance en santé humaine et de
son utilisation comme modèle pour les enquêtes au cours des
recherches biologiques de base, ceci est en grande partie attribuable à
sa fréquence relativement élevée, à la fois, chez
les animaux domestiques et sauvages et à sa forte infectiosité
pour les animaux de laboratoire.
La diffusion du parasite et de ses hôtes a
été particulièrement facilitée par la colonisation
européenne du Nord, l'Amérique centrale et celle du Sud, la
NouvelleZélande, Hawaï, et l'Egypte à partir du 16 au 20 e
siècle. Sa faible résistance aux basses températures de
l'environnement peut avoir inhibé sa propagation parmi les animaux
vivant dans des zones glaciales.
Trichinella spiralis a été
identifiée dans des isolats provenant de porcs domestiques, de sangliers
(Boadella M., et al ; 2012), de chevaux domestiques, de rats synanthropes et
à partir d'isolats provenant de tatous synanthropes (Chaetophractus
villosus) (Pozio et Murrell, 2006), ainsi qu'à partir de chiens
(Sandoval L. O. F., et al ; 2012).
Dans de nombreuses régions du monde, cette espèce a
été transmise à certains animaux de la faune qui sont
devenus hôtes du parasite (p. ex les blaireaux [Meles meles],
les renards [Pseudolopex gracilis, Urocyon cinereoargentatus, Vulpes
vulpes], les loups [Canis lupus], les ours noirs et bruns
[Ursus americanus et Ursus arctos], les lions de montagne
[Puma concolor], le lynx roux [Lynx rufus], ainsi qu'aux
chiens raton laveur [Nyctereutes procyonoides]) du fait de
l'exposition à des dépotoirs, ou la recherche de nourriture
près des lieux de vie des hommes, à partir des restes de viande
de porc et d'abats ou provenant d'animaux abattus qui ont été
dispersés dans la nature (Pozio et Murrell, 2006).
Dans certains pays d'Amérique, d'Europe et d'Asie, T.
spiralis est aussi un parasite de la faune maintenu dans la nature par un
cycle sylvatique (Pozio et Zarlenga, 2005).
Cette espèce est l'agent étiologique de la plupart
des trichinelloses humaines et est responsable de nombreux décès
dans le monde.
- Trichinella nativa (Britov et Boev,
1972) : T2
Cette espèce est connue pour résister au gel de
l'Arctique, elle est très répandue au sein de la faune des
régions arctique et subarctique d'Amérique, d'Europe et
d'Asie.
La limite sud de sa distribution a été
identifiée entre les isothermes -5 ° C à -4 ° C en
Janvier (Pozio et Zarlenga, 2005).
Les principales caractéristiques biologiques de T.
nativa sont un indice de faible capacité reproductive chez les
rongeurs de laboratoire et chez le porc domestique et sauvage ainsi qu'une
grande résistance à la congélation dans les muscles de
carnivores (Pozio et Murrell, 2006).
Les hôtes communs sont des carnivores terrestres et marins
vivant dans les régions arctiques et subarctiques (plusieurs
espèces de mustélidés [Martes pennant, Martes
martes, Martes zibellina, Meles metes, Gulo gulo, Musteta erminea,
Mustela nivalis]; le renard arctique [Alopex lagopus]; le renard
rouge [Vulpes vulpes]; le loup [Canis lupus]; le chien
viverrin [procyonoides Nyctereutes]; les chats domestique et sylvestre
[Felis silvestris, Felis euptilura], le lynx [Lynx lynx], le
tigre de Sibérie [Panthera tigris], l'ours noir [Ursus
americanus], l'ours brun [Ursus arctos], l'ours blanc [Ursus
maritimus], les morses [Odobenus rosmarus] et plusieurs
espèces de phoques [Phoca groenlandica, Phoca fasciata, Erignathus
barbatus, Pusa hispida]).
Cette espèce a rarement été isolée
chez les porcs domestiques ou sauvages.
L'importance des carnivores sylvestres autant que
réservoirs de T. nativa dans la nature, est attestée par
le fait que ce parasite survit dans la musculature de ces hôtes pendant
au moins 20 ans.
Les populations humaines (esquimaux +++) vivant dans ces
régions glaciales s'infestent par T. nativa en consommant de la
viande crue des morses (Odobenus rosmarus), des ours et d'autres
gibiers (Pozio et Murrell, 2006).
Cette trichine a tendance à induire chez l'homme une
affection grave et chronique.
- Trichinella britovi (Pozio et Al,
1992) : T3 (Pozio E., Zarlenga D.S., 2005)
Les isolats européens et asiatiques de cette
espèce ont été précédemment nommés
T. nelsoni par les scientifiques russes: Britov et Boev, 1972;
Shaikenov et Boev, 1983.
Parmi les espèces sylvestres, T. britovi
possède la plus grande aire de répartition géographique,
se répartissant dans la faune des régions tempérées
d'Europe et d'Asie, de la péninsule ibérique à
l'Extrême-Orient et s'étendant vers le sud à l'Afrique du
nord et de l'Ouest. La limite nord de sa distribution est
déterminée par les isothermes -6 ° C à -5 ° C en
Janvier.
Cette espèce est sympatrique avec T. nativa
entre les isothermes -4 ° C et -6 ° C, et il ya plusieurs cas
rapportés, d'infections mixtes au sein d'un même hôte en
Estonie, Finlande et en Lituanie (Pozio et Murrell, 2006).
Cette espèce est répandue chez les carnivores
sylvestres tels que les mustélidés (Meles meles, Martes
foina, Martes martes, Lutra lutra), les Viverridae (Nandinia binotata,
Viverra civetta), le renard roux (Vulpes vulpes), le chacal
(Canis aureus), le loup (Canis lupus) et l'ours brun
(Ursus arctos).
En Europe, elle a été identifiée dans
des isolats provenant de renards roux (Boadella M., et al ; 2012) (Vulpes
vulpes), de sangliers (Sus scrofa) et de porcs domestiques.
L'infestation des rats (Rattus norvegicus) vivant dans des fermes ou
des dépotoirs a été signalée en Italie et en
Estonie, bien que les larves de cette espèce aient un temps de survie
très court au sein de cet hôte.
Cette espèce peut être transmise à l'homme
par la consommation de viande de sanglier (Sus scrofa), de renard roux
(Vulpes vulpes), de chacal (Canis aureus), de cheval et de
porc domestique à partir d'étendus systèmes de
pâturage ou d'alimentation avec des restes de carnivores sylvestres
(Pozio et Murrell, 2006).
Cette trichine a une faible capacité de reproduction et
de résistance à la congélation et s'avère
modérément infestante pour l'homme.
- Trichinella murelli (Pozio et La
Rosa, 2000) : T5
Cette espèce est répartie au sein des carnivores
sylvestres (par exemple le lynx roux [Lynx rufus], l'ours noir
[Ursus americanus], le coyote [Canis latrans], le raton
laveur [Procyon lotor], la martre des pins [Martes americana]
et le renard roux [Vulpes vulpes]) et des animaux domestiques (par
exemple le chien domestique, le cheval et le chat) à travers les
États-Unis d'Amérique (USA) (Californie, Connecticut,
Géorgie, Illinois, Indiana, Maryland, Nouveau-Mexique, Pennsylvanie,
Virginie, Wisconsin et au Texas) et dans la région de Vancouver au
Canada (Pozio et Murrell, 2006).
L'isotherme -6 ° C en Janvier peut être un facteur
déterminant de la limite nord de sa distribution. La limite
méridionale est inconnue en raison de l'absence de données
d'enquêtes suffisantes en provenance du Mexique et d'Amérique
centrale.
Une infestation mixte par les larves de 7'. murrelli et
7'. spiralis a été mise en évidence chez un ours
noir (Ursus americanus) en Californie.
Cette espèce n'a, à priori jamais
été isolée lors d'une infestation naturelle chez le
porc.
7'. murrelli peut être transmise à l'homme
suite à la consommation de viande d'ours noir (Ursus
americanus) et de cheval.
Une grande partie des caractéristiques cliniques sur
cette espèce a été étudiée lors d'une
épidémie en 1985 en France, suite à la consommation de
viande chevaline importée du Connecticut (Ancelle, 1998).
- Trichinella nelsoni (Britov et
Boev, 1972) : T7
Cette espèce se répartit en Afrique de l'Est, du
Kenya à l'Afrique du Sud, mais ceci est basé que sur quelques
enquêtes, de ce fait, son aire de répartition peut être
beaucoup plus large.
La gamme d'hôtes comprend la hyène rayée et
tachetée (Hyène hyène et Crocuta
crocuta), le chacal à flancs rayés (Canis adustus),
le chacal à dos noir (Canis mesomelas), la chauve-souris
à oreilles de renard (Otocyon megalotis), le chien domestique,
le lion (Panthera led), le léopard (Panthera pardus),
le guépard (Acinonyx jubatus), et le serval (Leptailurus
serval), et dans quelques rares cas les potamochères
(Potamochoerus larvatus) et les phacochères (Phacochoerus
aethiopicus), dont certains ont été la source d'infections
pour l'homme (Nelson, 1970).
Cette espèce montre une infectiosité faible pour
les rongeurs de laboratoire et les porcs (Nelson et al, 1966;. Kapel et Gamble,
2000) par rapport à T. spiralis.
T. nelsoni est plus résistante que les autres
aux fortes températures de cuisson.
Moins de 100 cas d'infection humaine ont été
documentés pour cette espèce au Kenya et en Tanzanie.
- Trichinella 6 (Pozio et al. 1992) :
T6 (La Rosa G. et al., 2003).
Ce génotype est très répandue chez les
carnivores (l'ours noir et brun [Ursus americanus et Ursus
arctos]; le loup [Canis lupus]; le renard gris [Urocyon
cinereoargenteus]; le coyote [Canis latrans]; le carcajou
[Gulo gulo]; le pêcheur [Martes pennanti]; le lion de
montagne [Puma concolor]; le lynx roux [Lynx rufus]) de
l'Arctique et des régions subarctiques du Canada et le long des
montagnes Rocheuses et les Appalaches aux Etats-Unis (Alaska, l'Idaho, Montana,
Ohio, la Pennsylvanie, du Wyoming et de l'Ontario) (Pozio et Murrell, 2006).
Ce génotype se distingue de T. nativa par des
caractères biochimiques et moléculaires différents,
malgré leur capacité à se croiser, tant au laboratoire que
dans la nature (des hybrides ont été retrouvés chez les
loups [Canis lupus] de l'Alaska, ce qui suggère une
séparation récente) (La Rosa et al. 2003).
Trichinella T6 et T. nativa sont très
similaires concernant leurs caractéristiques biologiques: la
résistance au gel élevé des larves dans les muscles de
carnivores; ainsi que l'infectiosité faible chez les souris de
laboratoire, les rats et les porcs domestiques et sauvages (Kapel et Gamble,
2000).
- Trichinella 8 (Pozio et al. 1992) :
T8
Trichinella T8 n'a été identifié
qu'à partir d'un lion (Panthera leo) du Parc national de
l'Ethosa en Namibie et d'un autre lion (Panthera leo) et d'une
hyène tachetée (Crocuta crocuta) du Parc national Kruger
de l'Afrique du Sud, où il vit en sympatrie avec T. nelsoni.
Ce génotype peut être facilement distingué
par certains caractères biochimiques et moléculaires de T.
britovi (Pozio et al. 1992).
Aucun cas humain dû à ce génotype n'a
été rapporté.
- Trichinella 9 (Nagano et al. 1999) :
T9
A l'origine identifiée comme étant T.
britovi (Pourtant l'étude génique montre une ressemblance
plus importante avec T. murrelli) de la faune japonaise (chien
viverrin [Nyctereutes procyonoides]; ours noir japonais [Ursus
thibetanus]) il a été maintenant démontré par
des méthodes moléculaires que ce génotype diffère
des souches européennes, et est désigné par
Trichinella T9.
Les larves musculaires de ce génotype ont
été également détectées chez les renards
roux (Vulpes vulpes) de lile d'Hokkaido, où ils vivent en
sympatrie avec T. nativa.
Aucun cas humain dû à ce génotype n'a
été rapporté (Pozio et Murrell, 2006).
- Trichinella 12 :
T12
Uniquement détectée chez des couguars en
Argentine.
C'est le dernier génotype identifié à ce
jour (Dupouy-Camet J. et al., 2010).
Les différentes espèces non encapsulées
sont décrites ainsi :
- Trichinella pseudospiralis (Garkavi,
1972) : T4
T. pseudospiralis est une espèce cosmopolite
infestant les mammifères et les oiseaux. Trois populations, qui peuvent
être distinguées sur une base moléculaire, ont
été isolées en Paléarctique, Néarctiques et
en Australie (Tasmanie) (La Rosa et al, 2001).
Cette espèce est caractérisée par l'absence
de capsule dans les kystes intramusculaires. De plus les larves sont plus
petites que celles de T. spiralis. Elle est aussi pathogène
pour l'homme mais son pouvoir pathogène est nettement moins
marqué que celui de T. spiralis ; la réaction
inflammatoire étant beaucoup moins sévère.
Chez la souris il faut au minimum 20 000 larves pour atteindre
la dose létale, tandis que le même effet est obtenu par une
infestation avec 4 500 larves de T. spiralis.
Ce parasite a été isolé chez 14
espèces de mammifères et 13 espèces aviaires (Pozio,
2005), où le nombre de cas rapportés chez les mammifères
est beaucoup plus élevé que ceux chez les oiseaux.
C'est probablement le résultat d'un biais en faveur de
l'examen de mammifères à la recherche de ce parasite par rapport
au nombre de volailles examinées.
Un seul cas humain, sans doute contracté en Tasmanie,
et trois foyers impliquant 92 personnes, dans le Kamchatka, la Thaïlande
et la France ont été documentées (Pozio et Murrell,
2006).
- Trichinella papuae (Pozio et al,
1999) : T10
Cette espèce a été isolée chez les
truies domestiques, les cochons sauvages (Sus scrotum) et les
crocodiles d'élevage d'eau salée (Crocodylus porosus) de
PapouasieNouvelle-Guinée nourris avec de la chair des porcs sauvages
(Sus scrotum) (Pozio et Murrell, 2006).
Au cours d'infestations expérimentales, cette
espèce montre une grande capacité de reproduction (RC) chez les
crocodiles et les varans (Varanus exanthematicus, Caiman crocodylus),
mais une RC très faible chez les tortues et les pythons (Python
molurus, Pelomedusa subrufa).
La découverte d'espèces de Trichinella
infestant aussi bien les mammifères que les reptiles peut fournir une
explication de cas humains rapportés, en relation avec la consommation
de viande de tortue et de lézard brun (Varanus nebulosus) en
Thaïlande (Khamboonruang, 1991).
- Trichinella zimbabwensis (Pozio et
al. 2002) : T11 (Pozio et al., 2002) Cette espèce est très
similaire à T. papuae, en effet, elle partage avec elle
d'importantes caractéristiques biologiques telles que
l'infectiosité pour les mammifères et les reptiles (Python
molurus, Pelomedusa subrufa, Varanus exanthematicus, Caiman
crocodylus).
Elle a été isolée seulement chez les
reptiles sauvages et d'élevage (Crocodylus niloticus et
Varanus niloticus) d'Afrique (Zimbabwe, Mozambique et Ethiopie) bien
qu'expérimentalement, elle est capable d'infecter des souris, rats,
hamsters, renards (Vulpes vulpes), les porcs et singes (Papio spp,
Cercopithecus aethopis.) (Pozio et Murrell, 2006; Pozio et al, 2007.).
Lors de la première découverte en 1995, les
larves de T. zimbabwensis ont été isolées
à partir de 256 élevages de crocodiles du Nil (Crocodylus
niloticus), et à partir de 18 fermes de crocodiles du Zimbabwe.
Des cas humains n'ont pas encore été
signalés.
1- 3. Cycle évolutif:
La trichinellose est transmise d'un animal à un autre par
ingestion de muscles contaminés par des larves de trichine.
150 espèces de mammifères répartis sur
divers climats de la planète, peuvent héberger
Trichinella.
Sa vaste distribution géographique serait probablement en
relation avec le non développement externe du parasite, mais aussi avec
son adaptation à des conditions climatiques rigoureuses.
L'homme ne constitue qu'un hôte particulier, en relation
avec certaines habitudes culinaires.
Les modalités de transmission du parasite peuvent se
regrouper au sjn de deux principaux cycles (Chassaing J., 2001)
interdépendants: (Figure n°5)

Figure n°5 : Cycle parasitaire de Trichinella
spiralis.
-un cycle domestique ou synanthropique :
Dans lequel le porc est l'acteur principal, la transmission de
la trichine s'effectue entre le porc et le rat ; ce dernier constituant
l'espèce réservoir.
Omnivore, le porc ne répugne pas à consommer le
cadavre d'un rat ou d'un autre petit mammifère sauvage, ni méme
le cadavre ou la queue d'un de ces congénères.
Le chien, le chat et le rat présentent également
des sources d'infestation très variées.
Le cheval et l'homme s'insèrent dans ce cycle mais
l'homme constitue, de par son statut de super-prédateur, un cul-de-sac
épidémiologique.
-un cycle sauvage ou sylvestre :
Faisant intervenir des animaux sauvages prédateurs ou
charognards.
Les prédateurs, consommant des proies contaminées,
et les charognards se nourrissant de cadavres d'animaux infestés,
assurent la pérennité de ce cycle.
Ce deuxième mode de transmission est facilité par
la grande résistance des larves enkystées à la
putréfaction et aux basses températures des souches arctiques.
Il existe plusieurs variantes de ce cycle suivant les grandes
zones climatiques (zones tempérée, tropicale et arctique).
2. Pathogénie - Déroulement de la
parasitose chez l'homme:
2- 1. Pouvoir pathogène: (Ripert, 2007; In:
Poirrier M., 2010)
2- 1. 1. Action pathogène des adultes:
Le pouvoir pathogène est essentiellement imputable aux
femelles puisque les mâles meurent rapidement après
l'accouplement. Il s'agit d'actions :
- Mécanique et irritative par perforation de la
muqueuse.
- Toxique et antigénique, les extraits de parasite
provoquant hyperthermie et asthénie.
2- 1. 2. Action pathogène des larves:
Le pouvoir pathogène des larves se manifeste par deux
types d'actions :
- Toxique et irritative puisque la larve, dans la fibre
musculaire, provoque dégénérescence et formation de la
capsule.
- Antigénique, donnant lieu à l'instauration d'une
immunité.
Le pouvoir pathogène de Trichinella va donc
s'exercer aux différents stades de l'évolution chez l'hôte
:
- Action entérotrope des vers adultes déterminant
le syndrome intestinal. - Action musculotrope des larves déterminant le
syndrome musculaire.
2- 2. Déroulement de la parasitose chez
l'homme:
La trichinellose se caractérise par trois phases
évolutives chez l'homme ( Figure n°6).
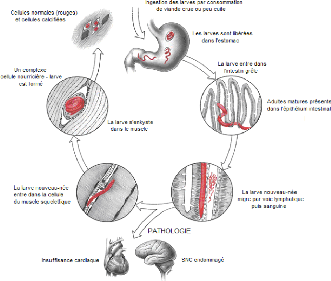
Figure n°6: Déroulement de la
trichinellose chez l'Homme.
2- 2. 1. Phase d'infestation:
L'ingestion de viande trichinée (renfermant des larves
enkystées (encapsulées ou non selon l'espèce)) non ou mal
cuite, est suivie par la lyse de la coque des kystes par les sucs digestifs.
L'épicuticule est altérée par la lyse
alcaline et par l'action de la bile, des enzymes digestives et
pancréatiques (Stewart G.L. et al., 1987).
Les larves libérées immatures vont alors
pénétrer dans l'épithélium des villosités
intestinales.
Dans l'intestin gréle, les larves vivent au sein des
entérocytes qu'elles tunnelisent sous une forme sinusoïdale
créant des syncytiums.
Elles ne sont extracellulaires que de façon transitoire
lorsqu'elles se mobilisent pour passer d'une cellule à l'autre.
Au cours de leur migration à la recherche d'un
partenaire, elles sont nommées alors L1M, subissent 4 mues successives
dans le tube digestif durant les douze heures qui suivent l'ingestion de la
viande contaminée.
Dans l'épithélium intestinal, elles deviennent
adultes après 36 heures, et sont capables de s'accoupler en
sécrétant des facteurs chimiotactiques facilitant leur rencontre.
L'accouplement se fait dans la lumière intestinale, les mâles
meurent juste après, et les femelles fécondées continuent
seules leur cycle, en s'enfonçant dans la muqueuse intestinale par les
glandes de Lieberkuhn et les plaques de Peyer (voie lymphatique). Les oeufs
éclosent dans l'utérus de la femelle et sont expulsés sous
forme de larves L1NN (larves « nouveau-nées »).
La ponte commence deux jours après l'accouplement et peut
durer jusqu'à six semaines, selon la réponse immunitaire
développée par l'hôte (Ripert C., 2007 ; In : Poirrier M.,
2010).
2- 2. 2. Phase de dissémination:
Les larves L1NN migrent par voie lymphatique, puis sanguine,
(seul stade libre du cycle) passant par le coeur droit et les poumons.
Le coeur gauche, atteint le jour suivant l'expulsion des larves,
les disperse dans la circulation générale.
Les larves atteignent les muscles striés (site de
prédilection) où elles sont capables de s'enkyster. Les autres
sont détruites par les défenses immunitaires.
Enfin, il a été décrit des localisations
erratiques dans l'encéphale, le foie, les poumons et le coeur. (Ripert
C., 2007 ; In : Poirrier M., 2010).
2- 2. 3. Phase d'enkystement:
(Poirrier M., 2010)
Les larves quittent les vaisseaux sanguins pour se retrouver
dans les fibres musculaires où elles poursuivront leur
développement en larves L1M (Figure n°7).
Celles-ci s'enroulent très rapidement en spirale,
d'où le nom de spiralis donné à la
première espèce de trichine découverte.

Figure n°7: Schéma d'une larve
infestant une fibre musculaire.
Les larves L1NN se caractérisent par leur tropisme pour
les cellules musculaires striées squelettiques, elles y
pénètrent et subissent des modifications selon un ordre
chronologique précis au cours des heures et des jours suivant
l'invasion, ce qui aboutira à une perte totale de la
différenciation (dédifférenciation) de la cellule
musculaire striée.
Le programme de transformation de la cellule musculaire
(re-différenciation) en cellule nourricière est
déclenché spécifiquement par la trichine et la survie de
cette cellule nourricière devient étroitement dépendante
de celle du parasite (Despommier D.D., 1998).
Un véritable dialogue existe entre le parasite et la
cellule hôte.
Des médiateurs protéiques d'origine parasitaire
sont impliqués mais aucun n'a encore été identifié
avec certitude.
La cellule nourricière est une conséquence unique
et originale de l'association de la cellule hôte avec la larve L1
infestante des espèces encapsulées de Trichinella sp .
Elle fonctionne vraisemblablement pour la nourrir aussi bien que pour la
protéger des réactions immunitaires (Figure
n°8).
La fibre musculaire parasitée se trouve ainsi
profondément modifiée (Despommier D.D.,1990).

Figure n°8: Formation de la cellule
nourricière. Il y a au moins deux phases distinctes
au
processus de formation de la cellule nourricière : une
dédifférenciation de la cellule
musculaire et une autre de
re-différenciation de la cellule musculaire en cellule
nourricière.
L'élaboration de la cellule nourricière dure
environ 20 jours, on constate une disparition des myofilaments, un important
épaississement du sarcolemme et une augmentation des tubules
transverses. La larve L1 s'enroule sur elle-même dans une cavité
ovoïde circonscrite par une paroi composée de fibres de
collagène. Parallèlement, un réseau capillaire se met en
place, il sert à apporter les nutriments nécessaires à la
survie de la larve.

Figure n°9: Schéma d'une larve de
Trichinella spiralée dans la capsule de
collagène et formation
du réseau capilaire.
Les larves L1M encapsulées dans les muscles peuvent
survivre des années (voir indéfiniment) après
l'infestation, (Figure n°9) mais peuvent
dégénérer suite à une synthèse abondante de
collagène étouffant la cellule nourricière qui se
calcifie.
Le processus d'enkystement des larves dans le muscle
strié, survient environ trois semaines après l'ingestion de
viande trichinée.
Le cycle de Trichinella est original, puisqu'il peut
se dérouler chez un seul et unique hôte, omnivore ou carnivore,
dont l'homme, et dans certaines situations particulières, il peut se
réaliser également chez les herbivores (le cheval !!).
On le qualifie de cycle auto-hétéroxène
(Ripert C., 1998).
Ce cycle converge étonnamment vers un cycle viral du fait
de la localisation intra cytoplasmique de Trichinella, d'une
spécificité tissulaire élective et de son amplification
chez un même hôte (Boireau P. et al., 2001).
L'hôte est à la fois (Ripert C., 1998) :
- Hôte définitif, hébergeant les formes
adultes du nématode.
- Hôte intermédiaire, où évoluent les
formes larvaires.
- Vecteur (statique): les tissus parasités doivent
être ingérés par un nouvel hôte pour assurer la
transmission du parasite.
- Réservoir : les larves enkystées peuvent vivre
des années hébergées dans les muscles de leur hôte,
en particulier, si ce dernier appartient à une espèce très
réceptive (carnivores).
2- 3. Durée de vie des trichines:
Les femelles adultes pondeuses meurent après 3 à 4
mois de vie intra-luminale dans l'intestin gréle, les males ne vivent
que quelques jours (le temps de s'accoupler). Les larves par contre, survivent
plus longtemps; lorsqu'elle mue, la larve est plutôt fragile, mais une
fois enkystée, elle peut vivre des dizaines d'années ou plus,
mais il semblerait que les années passant elle perde son pouvoir
infestant.
Les parasites ont développé de nombreuses
stratégies adaptatives leur permettant d'échapper à la
réaction immunitaire de l'hôte : séparation anatomique par
une structure antigéniquement amorphe, mais perméable aux
nutriments : la capsule.
La durée de vie du parasite dépend donc du stade
auquel on s'intéresse et de sa localisation (Ripert C., 1998).
Dans les muscles des animaux vivants, une survie de plusieurs
années est de règle.
Dans les cadavres la survie atteint trois semaines voir plus, et
ce malgré la putréfaction, mais les larves ne peuvent pas se
multiplier.
Sur le sol, les larves peuvent résister quelques jours
après élimination fécale.
Seuls la chaleur, le froid et les irradiations peuvent
détruire les larves enkystées.
La congélation domestique est à
déconseiller comme méthode d'assainissement compte tenu de la
résistance constitutionnelle au froid de certaines espèces
(T. nativa et T. britovi) et de l'augmentation de cette
résistance quand des espèces habituellement sensibles sont chez
des hôtes inhabituels.
C'est ainsi que T. spiralis, sensible à la
congélation dans la viande de porc, devient partiellement
résistante au froid dans de la viande de cheval.
3. Physiopathologie de la trichinellose:
La physiopathologie de la trichinellose est en diapason avec le
cycle biologique de Trichinella et se caractérise par des
réactions inflammatoires au niveau de la muqueuse intestinale
(duodénum, jéjunum), au niveau circulatoire puis dans les tissus
musculaires (De Bruyne A. et al, 2006).
3- 1. Phase d'infestation et perturbations
intestinales :
Durant la première phase les larves de Trichinella
envahissent l'épithélium intestinal. Tous les stades y sont
présents (L1M, L2, L3, L4, adultes et L1NN) puisque c'est à cet
endroit que les mues successives ont lieu.
Le déplacement de la trichine lèse
l'épithélium en perforant les entérocytes qui bordent la
lumière intestinale.
Au cours de ce passage, il y a sécrétion de
nombreux antigènes parasitaires provenant de sécrétions
spécifiques ou des mues (Boireau P. et al., 1997).
Les adultes présents dans le tube digestif augmentent le
péristaltisme intestinal et perturbent les sécrétions
gastriques, intestinales et pancréatiques ainsi que l'absorption du
glucose.
Il existe une corrélation entre l'amplitude de
l'hypercontractilité des muscles intestinaux et l'intensité de la
réponse inflammatoire.
On peut donc en déduire que c'est la réponse
inflammatoire de l'hôte qui permet l'expulsion du parasite.
L'invasion de cet épithélium provoque une atrophie
des villosités et une infiltration de la muqueuse par des cellules
inflammatoires telles que: mastocytes, éosinophiles, macrophages,
lymphocytes et plasmocytes (Figure n°10).
Ces cellules induisent la libération d'histamine, de
sérotonine, de leucotriènes et de prostaglandines qui modifient
la physiologie de la muqueuse avec perméabilisation de
l'épithélium et modification des contractions des muscles
lisses.
Toutes ces perturbations associées à une
hypersécrétion de mucus par les cellules caliciformes, et
à l'action cytotoxique des éosinophiles interagissent afin
d'expulser et de détruire le parasite (De Bruyne et al., 2006).

Figure n°10 : Larve non encapsulée et
réaction inflammatoire musculaire (quelques
semaines
après l'infection)
Des études sur des petits rongeurs infestés par
T. spiralis ont montré l'existence d'une immunité
protectrice spécifique d'espèce au niveau du tissu lymphoïde
associé au tube digestif (GALT : Gut Associated Lymphoide Tissue), plus
spécifiquement au niveau de la lamina propria où les
lymphocytes T sont activés (Bell R.G. et al, 1998). L'immunité
est d'abord de type Th1 (avec libération d'interféron ã,
IL2 et IL3), elle est suivie par une commutation vers le type Th2 (avec
sécrétion d'IL4, IL5, IL9, IL10 et IL13) ceci après 4
jours d'infestation (Ramaswamy K., et al., 1996).
La libération des IL4 et IL13 et leur reconnaissance par
leur récepteur provoque une augmentation de la motricité
intestinale par l'activation d'une voie de transduction médiée
par la protéine STAT 6 (Signal Transducer and Activator of Transcription
factor 6) (Khan
WI. et al, 2001).
La synthèse de cytokines est accompagnée d'une
production d'anticorps IgG1 et IgE (confirmant un profil à orientation
Th2).
Les anticorps protecteurs de l'hôte sont dirigés
contre l'antigène majoritaire des granulations stichocytaires (TSL1) et
contre la surface du parasite.
Les IgE totaux et spécifiques sont augmentés ce
qui aurait un double effet : protecteur de l'hôte contre une
réaction anaphylactique et l'échappement du parasite à la
réponse immunitaire par compétition des IgE spécifiques et
non spécifiques.
Les IgG, les cytokines libérées et les
éosinophiles sont les facteurs essentiels pour le blocage du passage du
parasite dans la circulation sanguine (Finkelman F.D. et al., 1997).
3- 2. Phase de dissémination et migration
larvaire :
(De Bruyne et al., 2006) La présence de larves L1NN dans
la circulation sanguine induit une libération de facteurs
pro-inflammatoires ce qui aboutit à une fièvre intense chez le
malade.
L'hyperéosinophilie sanguine et tissulaire est
très importante et la libération de ces différents
médiateurs inflammatoires induit une vascularite
généralisée avec oedème de la face et
fièvre.
Les larves L1NN peuvent transiter par le cerveau, le myocarde et
la rétine et entraîner localement des nodules granulomateux
composés d'éosinophiles et de cellules
mononucléées. Une réaction immunitaire locale avec
synthèse d'anticorps spécifiques (IgA inhibant l'expulsion de
L1NN des femelles, IgG et IgE intervenant dans des
réactions de cytotoxicité dépendante des
anticorps) permet à l'hôte parasité de lutter contre ces
larves mais avec une efficacité moindre que celle du tube digestif .
Les lésions cérébrales pourraient
résulter de l'association d'emboles larvaires responsables d'une
ischémie localisée, de réactions immunoallergiques (la
vascularite, les thromboses ainsi que les hémorragies punctiformes de la
substance blanche en seraient la traduction) et d'un effet prothrombotique,
voire neurotoxique des éosinophiles.
Les larves L1 ne peuvent pas s'encapsuler dans les fibres
myocardiques, ceci serait dû à la faible taille de ces
dernières ainsi qu'à leur incapacité de
régénération.
3- 3. Phase d'enkystement larvaire et
conséquences musculaires :
(De Bruyne et al., 2006) La cellule musculaire subit des
réarrangements graduels qui permettent la croissance et la nutrition du
parasite.
La fibre musculaire est donc profondément
modifiée; les myofilaments disparaissent, le sarcolemme
s'épaissit d'une trentaine de fois, le système des tubules
transverses prolifére (augmentant la surface d'échange entre la
fibre musculaire et le milieu extérieur). Le nombre et le volume des
noyaux de la fibre sont augmentés et leurs nucléoles
hypertrophiés.
Des antigènes parasitaires ont été mis en
évidence dans le noyau des cellules et certains travaux suggèrent
que ceux-ci pourraient interférer avec la synthèse de la myosine
(Despommier
DD. et al, 1990 ; Jasmer DP., 1995).
Les myofilaments et les autres structures apparentées au
tissu musculaire sont remplacés pendant les 15 premiers jours de
l'invasion cellulaire.
Une surexpression du collagène de type IV et type VI est
détectable.
La synthèse du collagène est impliquée dans
l'élaboration de la capsule.
La formation d'une complexe cellule musculaire
dédifférenciée-parasite constitue la véritable
forme de résistance du parasite aux conditions extrêmes :
congélation, résistance à la putréfaction,
résistance aux températures élevées.
Autour de la fibre parasitée, une réaction
inflammatoire locale (action de polynucléaires neutrophiles, de
lymphocytes, d'éosinophiles, d'IL10 antiinflammatoire puis de cellules
géantes) est insuffisante pour empêcher le développement de
la cellule nourricière.
L'afflux des polynucléaires au contact de la fibre
musculaire modifierait la perméabilité de la fibre,
entraînant une augmentation du taux des enzymes musculaires
sériques.
Une réponse spécifique se met en place entre 20 et
50 jours suivant l'infection, d'abord grace au développement d'anticorps
d'isotypes divers dirigés contre les antigènes larvaires
somatiques, puis des IgG1 dirigées contre l'antigène de tyvelose
excrété ou sécrété.
L'inflammation chronique est dirigée par une
réponse de type Th2 (Beiting
DP. et al, 2004 ; Fabre M. V., 2009).
4. Clinique:
La symptomatologie trichinienne succède à un repas
infestant.
4- 1. Symptomatologie : (Dupouy-Camet J., et al,
2007)
4- 1. 1. Incubation :
Dure environ une dizaine de jours.
Elle est silencieuse et correspond à la transformation de
la forme infestante (kyste, larve L1M) ingérée en adultes,
après libération dans l'estomac puis passage dans l'intestin
gréle de l'hôte.
4- 1. 2. Phase intestinale :
Phase de début, elle correspond à l'installation
des vers adultes au niveau des cellules épithéliales de
l'intestin grêle.
Phase de catarrhe intestinal, elle peut commencer dés la
48éme heure, et est marquée par d'intenses
diarrhées aiguës pouvant entraîner une déshydratation,
nausées, vomissements et des gastralgies violentes.
Ces symptômes apparaissent dans les 9 à 17 jours
suivant le repas infestant et durent de un à plusieurs jours.
La fièvre peut persister plusieurs semaines, elle est en
plateau et peut atteindre 40°C. L'élévation thermique est en
général proportionnelle à la gravité de la maladie
(Tableau n°II).
Cette phase peut néanmoins passer inaperçue
(Roumier M. et al., 1992).
Tableau n°II : Délai d'apparition et
durée moyenne des différents symptômes liés
à
IllIllIILIll IL1I1I 1111111. (Ripert
C., 1998)

4- 1. 3. Phase de dissémination et d'installation
des larves dans les muscles :
Après dissémination, les larves vont
présenter une localisation musculaire élective. Cette phase
commence de 8 à 12 jours après le repas infestant et peut durer
de 20 à 40 jours (Tableau n°II).
C'est une période très pénible pour le
malade avec une très grande fatigue, des courbatures et des myalgies
très douloureuses qui peuvent durer plusieurs mois.
L'éosinophilie est très élevée durant cette phase
(50 à 65% des leucocytes).
Le signe constant de la maladie, que l'on retrouve même
dans les cas frustres, est un oedème de la face (d'où
l'appellation « maladie des grosses têtes ») qui apparaît
vers le 10ème jour.
Ce signe semble être une manifestation allergique ; il
siège particulièrement dans la région périorbitaire
et s'accompagne fréquemment d'une conjonctivite (Figure
n°11).

Figure n°11: OEdeme de la face et des
paupières chez une malade atteinte de
trichinellose. Noter
l'aspect après guérison. (De Bruyne et al., 2006)
Une urticaire, des arthralgies et une dyspnée
asthmatiforme sont les manifestations des réactions allergiques aux
toxines parasitaires.
Les larves libérées passent dans la circulation
sanguine et commencent à s'enkyster. Cette phase s'arrete au moment
où les femelles, trop vieilles, cessent de produire des larves.
Ces femelles sont alors expulsées lors de la
défécation.
4- 1. 4. Période d'état :
Correspond à la phase musculaire de la maladie, qui
aboutit à la formation des kystes, blancs, en forme de citron,
pratiquement invisibles à l'oeil nu.
Il y a généralement une larve par kyste.
Cela entraîne l'apparition de troubles
généraux secondaires : asthénie, crampes,
fatigabilité musculaire importante (Figure n°12).
Les myalgies atteignent le plus souvent les muscles les plus
actifs : muscles oculomoteurs, masséters (provoquant un trismus),
langue, muscles respiratoires, muscles du tronc et de la nuque (provoquant une
raideur) et muscles fléchisseurs des membres (De Bruyne et al.,
2006).
Ces myalgies entraînent une diminution de la force
musculaire.
L'intensité des myalgies est variable et conduit parfois
au repos complet au lit. Elles peuvent persister 2 à 3 semaines
(Tableau n°II).
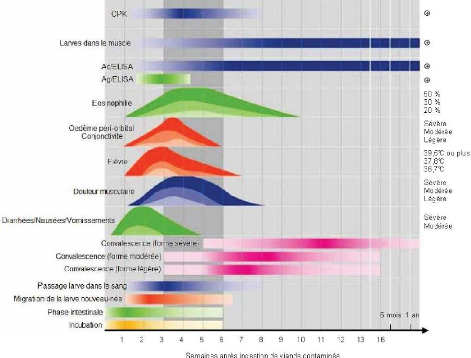
Figure n°12: Résumé complet des
principaux symptômes et signes cliniques,
résultats de tests
diagnostiques chez des patients souffrant de forme légère
(couleur
pâle) à sévère (couleur foncée)
de trichinellose.
A gauche les aspects qualitatifs de l'infection sont
étudiés, tandis que ceux-ci donnent à droite une
évaluation quantitative de chacun. Les couleurs correspondent aux
différentes étapes de l'infection (citées en bas à
gauche). La partie hachurée corrèle avec la période
d'infection dans laquelle la mort du patient est possible si la dose de
parasite ingérée est très importante. (Capo V., et
al., 1996)
4- 1. 5. Evolution :
L'organisme élimine très lentement des larves
de trichines (plusieurs années). Le processus de destruction du kyste
trichineux a lieu au niveau tissulaire par dégénérescence
kystique et mort de la larve.
L'ensemble devient alors de couleur marron foncé, avec en
son centre un résidu noirâtre correspondant aux débris de
la larve.
La calcification, quand elle se produit, n'est que très
lente, voir exceptionnelle.
4- 2. Complications : (Poirrier M., 2010)
Les complications de la trichinellose touchent le plus souvent
le sujet âgé et peuvent dans certains cas mettre en jeu le
pronostic vital du patient.
Ces complications peuvent être d'ordre:
Oculaire : elles peuvent être très graves avec
photophobie, diplopie, douleur, mydriase, exophtalmie.
Pulmonaire : ce sont des manifestations allergiques s'observant
au début de la maladie : asthme, toux spasmodique, bronchite,
dyspnée.
Ce sont les manifestations neurologiques et cardiaques qui font
la gravité de cette affection.
Ces complications touchent principalement les sujets
âgés, et peuvent engager le pronostic vital. Leur fréquence
est très variable selon les épidémies : elle peut parfois
concerner jusqu'à 30 % des cas pour les complications neurologiques, et
5 à 20 % pour les complications cardiaques et vasculaires.
Neurologiques (De Graef M. et al., 2000) : les complications
neurologiques surviennent le plus souvent lors de la phase de migration
larvaire.
Le mécanisme de l'atteinte neurologique reste
discuté. La symptomatologie est polymorphe, il peut s'agir d'une
méningite, d'un déficit focal ou dans des cas plus rares d'une
panencéphalite généralisée.
L'hyperéosinophilie est toujours présente et des nodules
granulomateux entourent parfois les larves.
On ne sait pas encore si c'est la réaction
immuno-allergique qui cause les troubles ou si c'est l'envahissement direct du
système nerveux central par des emboles larvaires qui seraient
responsables d'une ischémie localisée. Des examens
complémentaires sont à réaliser devant toute suspicion
d'atteinte neurologique, type électroencéphalogramme, TDM
(Tomodensitométrie) et IRM (Imagerie par Résonance
Magnétique) (Figure n°13 et Figure n°14).
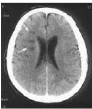
Figure n°13: Tomodensitométrie
cérébrale en coupe axiale transverse après
injection
d'iode par voie veineuse. Zones hypodenses, non rehaussées
après contraste au
niveau du centre semi-ovale droit
(flèches). (De Bruyne et al., 2006)
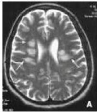
Figure n°14: Imagerie par résonance
magnétique cérébrale. Zones
bilatérales
d'hypersignal sans effet de masse (flèches) au
niveau des centres semi-ovales.
(De Bruyne et al., 2006)
Cardiaques : (Lachkar S. et al., 2008)
L'atteinte cardiaque se traduit par des lésions de
myocardite, plus rarement de péricardite, d'endocardite ou de thrombose
murale ou des coronaires.
Pouvant engager le pronostic vital, les complications cardiaques
doivent être recherchées systématiquement, en particulier
par l'électrocardiogramme (ECG), même en l'absence de tachycardie
ou d'hypotension.
On peut aussi utiliser la troponine comme marqueur d'atteinte
cardiaque et pratiquer une IRM cardiaque.
Les larves L1NN ne s'encapsulent pas dans les fibres
myocardiques, probablement en raison de la faible taille de ces
dernières et de leur incapacité de
régénération.
4- 3. Clinique chez la femme enceinte : (De Bruyne et
al., 2006)
Chez les femmes enceintes, la trichinellose peut causer un
avortement spontané ou un accouchement prématuré.
Les mécanismes en cause ne sont pas encore clairement
démontrés, néanmoins, ces complications pourraient
être dues à des modifications de la synthèse des bêta
HCG, de progestérone ou des cytokines.
L'existence de transmission verticale de trichinellose n'a
pas été clairement établie; cependant, la plupart des
femmes infestées pendant leur grossesse ont accouché de
nouveau-nés sains (Kociecka W., 2000).
4- 4. Clinique chez l'enfant : (Ozdemir D. et al.,
2005)
Lors d'infestation par Trichinella, les enfants
développent des signes et des symptômes, identiques à ceux
qui se déclarent chez les adultes, bien que les myalgies et la
diarrhée soient moins fréquentes.
Les signes cliniques et les symptômes sont globalement
moins prononcés et la régression est plus rapide.
De même la fréquence des complications est
inférieure.
L'image clinique est plus douce, probablement due au fait que
les doses de contamination sont inférieures et que la réaction
allergique est moins intense.
4- 5. Clinique chez l'immunodéprimé
:
Seulement trois cas de trichinellose ont été
documentés chez des immunodéprimés. Des charges
parasitaires musculaires très élevées (1 400 larves/g) ont
été rapportées chez un greffé du rein, mais la
symptomatologie aiguë était passée inaperçue (Doby
JM, et als, 1984).
Un cas rapporté chez un sidéen n'a pas
présenté de gravité particulière (Louthrenoo W, et
als, 1993).
En revanche, un cas très grave a été
décrit chez une personne atteinte d'une leucémie
myéloïde chronique (Jacobson ES, et als, 1977).
5. Diagnostic :
5- 1. Arguments d'orientation :
(De Bruyne et al., 2006; Dieusaert P., 2005)
L'orientation vers le diagnostic de la trichinellose est souvent donnée
par la symptomatologie clinique assez typique pendant la phase d'état ou
par la notion de petite épidémie familiale et d'habitudes
alimentaires.
L'interrogatoire des patients permet toujours de mettre en
évidence une tendance à la consommation de viande peu cuite
d'espèces de mammifères (cheval, ours, sanglier, porc...,)
particulièrement sensibles à la trichinellose.
L'analyse de la formule numération sanguine (FNS) avec
une forte éosinophilie et une élévation des enzymes
circulantes musculaires (créatine phosphokinase CPK, lactate
déshydrogénase LDH) sont de bons indicateurs.
On note également un syndrome inflammatoire plus ou
moins marqué, qui entraine une accélération de la vitesse
de sédimentation et une augmentation du taux de CRP (Protéine C
Réactive).
5- 2. Diagnostic indirect :
Le diagnostic sérologique consiste en la recherche
d'anticorps anti Trichinella dont la détection a une bonne
valeur diagnostique.
Le diagnostic immunologique est basé sur la
détection d'IgG spécifiques qui apparaissent dès les 10-20
ème jours après infestation.
Cependant, le taux d'anticorps est très variable en
fonction des individus, de la charge parasitaire et des espèces
infestantes (Bruschi et al., 1990; Pozio et al., 1993).
Les tests sérologiques indirects sont nombreux et font
appel à la technique d'immunofluorescence indirecte (IFI) et surtout la
méthode ELISA, qui sont les deux méthodes les plus
utilisées pour le dépistage de la trichinellose, mais de
nombreuses méthodes sérologiques ont été
décrites : hémagglutination indirecte, agglutination au latex,
contre-immunoélectrophorèse, et le test de confirmation consiste
en une immuno-empreinte ou competitive inhibition assay (western
blot).
5- 3. Diagnostic direct de certitude :
(Ripert C., 2007; In : Poirrier M., 2010) Il est
rarissime de retrouver les larves de Trichinella dans le sang ou dans
les selles. De même, les adultes sont très rarement
identifiés dans les selles puisque lysés dans le tube
digestif.
On peut en trouver quelquefois dans le liquide du tubage
duodénal ou dans le liquide céphalo-rachidien s'il y a eu une
atteinte méningée.
Le meilleur moyen pour rechercher la présence du parasite
est la biopsie musculaire. Cet examen est fondé sur une digestion
artificielle adaptée ou un examen microscopique après
écrasement pour identifier les larves.
L'étude anatomopathologique de la pièce (fixation,
coupe et coloration) visualise non seulement la larve mais aussi la
réaction inflammatoire.
La biopsie musculaire permet également l'isolement et
le typage de la souche de Trichinella, par amplification
génomique, réservée uniquement aux laboratoires
spécialisés.
6. Traitement :
(De Bruyne et al., 2006 ; Dorosz P., 2010 ; Dupouy-Camet J.,
Murrell K.D., 2007 ; Poirrier M.,2010)
Le traitement anthelminthique lors de la trichinellose serait
d'autant plus efficace que sa mise en route ait été
précoce.
En effet son action cible majoritairement les formes
parasitaires encore dans l'intestin, ou en phase de migration
c'est-à-dire les formes non tissulaires. Ces phases sont très
courtes et nécessitent une action rapide avant l'apparition des signes
cliniques. Cependant, n'ayant précisément établi ni le
délai de survie des adultes, ni celui d'émission des larves, on
recommande l'administration d'anthelminthiques pendant la période allant
de 4 à 6 semaines après infection.
Les benzimidazoles sont suffisamment diffusibles et peuvent
de ce fait atteindre les larves L1M ; mais après enkystement des larves,
il est très difficile de les atteindre. Si le diagnostic de la
trichinellose a été posé précocement, les
anthelminthiques qui peuvent être utilisés pour le traitement sont
:
En tête de liste, l'albendazole (Zentel®) qui est une
molécule dérivée des benzimidazoles. C'est un inhibiteur
de la polymérisation de la béta tubuline qui agit sur de nombreux
cestodes et nématodes. Il va donc agir sur le cytosquelette des
helminthes en inhibant cette polymérisation. On a donc un blocage de
l'absorption du glucose qui provoque la mort du parasite.
Il est actuellement conseillé d'utiliser l'albendazole,
en raison de sa bonne tolérance (Dupouy Camet J. et al., 2002).
Cette molécule est disponible sous forme de
comprimés dosés à 400 mg pour l'adulte et l'enfant de plus
de six ans ou de suspension buvable à 400 mg/10 ml
réservée à l'enfant de moins de six ans, (AMM non
délivré en Algérie pour l'albendazole).
La posologie pour l'enfant est de 15 mg/kg/j, au moment d'un
repas (pour améliorer la tolérance digestive) répartie en
deux prises par jour.
Pour l'adulte, la posologie est de 800 mg soit un
comprimé de 400 mg deux fois par jour. La durée du traitement est
de 10 à 15 jours selon la sévérité de la
symptomatologie et la précocité de la prise en charge.
L'albendazole est contre-indiqué chez les femmes
enceintes bien que les enfants nés de femmes enceintes ayant reçu
accidentellement de l'albendazole à de hautes doses n'aient pas
montré de malformations à la naissance (Bradley M., Horton J.,
2001).
Le mébendazole présente une efficacité
équivalente à celle de l'albendazole.
Le thiabendazole (Mintezol®) est efficace mais n'est
plus prescrit car il présentait de trop nombreux effets
indésirables (dans 50 % des cas) comme nausées, vomissements,
somnolence, vertiges, anorexie, céphalées, diarrhées mais
aussi neutropénie, fièvre et rash cutané.
Le traitement symptomatique (antalgiques, antipyrétiques)
est ici, très important. L'adjonction ou non de glucocorticoïdes
est encore discutée puisqu'il n'y a eu encore
aucune étude en prouvant le bénéfice. Elle
n'a pas d'action sur les parasites. Au contraire, elle pourrait favoriser leur
enkystement et prolifération (en ralentissant leur expulsion) car elle
diminue les réactions immunitaires de l'hôte, c'est pour cette
raison que la corticothérapie doit toujours être
administrée en association avec un antihelminthique.
Les femmes enceintes et les enfants de moins de deux ans ne sont
donc à priori pas traités.
Son efficacité sur les symptômes
généraux du malade est spectaculaire. Une corticothérapie
n'est donc pas forcément prescrite devant un tableau clinique de
symptomatologie peu prononcée mais est indispensable devant tout signe
de manifestation aiguë ou de complication, en effet la destruction massive
de larves L1 circulantes peut exacerber la réponse inflammatoire de
l'hôte et aggraver la clinique. Il en est de méme pour
l'hospitalisation ; les formes graves peuvent d'ailleurs nécessiter des
mesures de réanimation.
Le glucocorticoïde le plus généralement
utilisé est la prednisolone, qui est disponible en comprimés de 1
mg ou 5 mg et est administré à un dosage de 30 mg à 60 mg
par jour, pendant 10 à 14 jours.
7. Prophylaxie individuelle :
Une cuisson suffisante de la viande est la méthode de
prévention idéale, la destruction des larves infestantes de
trichine se fait en trois minutes à 58 °C et quasi
instantanément à 63°C. Ces températures sont
atteintes lorsque la viande est grise à coeur (les fours à
micro-ondes ne sont pas validés car ne cuisent pas la viande
uniformément).
La congélation, avec obtention de température d'au
moins - 25°C pendant un temps prolongé permet aussi de tuer les
larves de trichine (- 25°C pendant 10 jours et 20 jours pour une
épaisseur de la viande de 10 cm et 50 cm, respectivement). Toutefois, la
congélation domestique est à déconseiller comme
méthode
d'assainissement compte tenu de la cryorésistance de
certaines espèces (T. nativa et T. britovi) et de
l'augmentation de la cryorésistance d'espèces habituellement
sensibles chez certains hôtes (cheval, ours...).
Les larves résistent à la salaison et au
fumage.
Enfin, Il convient d'informer le milieu
cynégétique des risques relatifs à cette anthropozoonose
et des précautions à prendre pour éviter une
contamination.
il faut observer de bonnes mesures d'hygiène
personnelle lors de la manipulation de la viande de gibier, soit éviter
de boire, de manger, de fumer pendant la manipulation de la viande, bien se
laver les mains à la fin des manipulations et laver les instruments de
travail qui ont été en contact avec la viande de gibier en vue
d'éviter la contamination des autres aliments.


Dans ce deuxième chapitre, nous présentons
l'étude de séroprévalence de la trichinellose à
Tlemcen.
Nous décrivons ensuite, la méthodologie de
l'étude, suivie des résultats et de la discussion.
1. Matériel et méthodes :
1- 1. Matériel humain :
Les prélèvements sont représentés
par :
Des prélèvements de sang
périphérique sur tube sec ou gélosé : 1212
prélèvements effectués chez 1212 personnes,
répartis comme suit :
· Des malades se présentant au laboratoire pour
différents prélèvements (bilan systématique, ...)
;
· Des sujets sains (groupage sanguin,...);
· Des malades de différents services
(médecine nucléaire, chirurgie, médecine interne,
gastro-entérologie,...).
Dans les tableaux ci-après, nous rapportons notre
effectif selon :
- l'âge et le sexe : Tableau n° III,
- l'origine des communes : Tableau n° IV,
- les services du CHU de Tlemcen pourvoyeurs de ces
prélèvements : Tableau n° V.
Tableau n°III: Répartition des patients
selon l'âge et le sexe
Adultes
|
Enfants
|
Sexe
Age
|
Féminin
|
Masculin
|
Sexe
Age
|
Féminin
|
Masculin
|
15-25 ans
|
78
|
59
|
0-3 ans
|
1
|
2
|
25-35 ans
|
98
|
82
|
3-6 ans
|
13
|
10
|
35-50 ans
|
173
|
201
|
6-10 ans
|
9
|
14
|
> 50 ans
|
195
|
243
|
10-15 ans
|
13
|
21
|
Total
|
544
|
585
|
Total
|
36
|
47
|
Taille de l'échantillon : 1212 individus
|
|
Nous remarquons une légère prédominance
masculine au sein des deux groupes, adultes et enfants.
Tableau n°IV: Répartition des patients
selon les communes
Commune
|
Patients
|
Dar Yaghmouracene
|
07
|
Beni Boussaid
|
00
|
|
|
|
126
|
Fellaoucene
|
17
|
Marsa Ben M'Hidi
|
04
|
Beni Mester
|
58
|
Azails
|
06
|
Nedroma
|
18
|
Aïn Tallout
|
18
|
Sebaa Chioukh
|
05
|
Sidi Djillali
|
04
|
Remchi
|
86
|
Terny Beni Hdiel
|
25
|
Beni Bahdel
|
13
|
El Fehoul
|
05
|
Bensekrane
|
22
|
El Bouihi
|
00
|
Sabra
|
28
|
Aïn Nehala
|
01
|
Honaïne
|
24
|
Ghazaouet
|
98
|
Hennaya
|
40
|
Tienet
|
00
|
Souani
|
03
|
Maghnia
|
05
|
Ouled Riyah
|
14
|
Djebala
|
12
|
Hammam Boughrara
|
02
|
Bouhlou
|
10
|
El Gor
|
12
|
Souahlia
|
08
|
Beni Khellad
|
07
|
Oued Lakhder
|
26
|
MSirda Fouaga
|
02
|
Aïn Ghoraba
|
12
|
Aïn Fezza
|
79
|
Aïn Fettah
|
03
|
Chetouane
|
68
|
Ouled Mimoun
|
50
|
El Aricha
|
24
|
Mansourah
|
102
|
Amieur
|
08
|
Souk Tlata
|
00
|
Beni Semiel
|
05
|
Aïn Youcef
|
17
|
Sidi Abdelli
|
13
|
Aïn Kebira
|
14
|
Zenata
|
31
|
Sebdou
|
35
|
TOTAL
|
1212
|
Beni Snous
|
34
|
Beni Ouarsous
|
09
|
|
01
|
Sidi Medjahed
|
01
|
|
|
Nous notons une grande diversité de l'origine des sujets
prélevés.
Nous avons également remarqué, que la
majorité des patients prélevés, vivent ou font des
séjours réguliers en zone rurale.
Tableau n°V: Répartition des patients
selon les services du CHU de Tlemcen
pourvoyeurs des
prélèvements sanguins
Service
|
Patients
|
Ophtalmologie
|
04
|
|
|
|
200
|
Médecine interne
|
13
|
Microbiologie
|
99
|
Rhumatologie
|
02
|
Hémobiologie
|
264
|
Pneumologie
|
01
|
Urologie
|
02
|
CCI
|
12
|
Néphrologie
|
05
|
Cardiologie
|
06
|
Maladies infectieuses
|
14
|
Gastro-entérologie
|
58
|
Médecine nucléaire
|
102
|
Hématologie clinique
|
88
|
Chirurgie B
|
47
|
Psychiatrie
|
07
|
Chirurgie A
|
31
|
Neurochirurgie
|
21
|
ORL
|
06
|
Dermatologie
|
09
|
OTR
|
18
|
Réanimation médicale
|
10
|
Neurologie Médicale
|
15
|
Gynécologie obstétrique
|
01
|
UMC
|
11
|
CTS
|
97
|
Pédiatrie
|
23
|
Médecine Légale
|
01
|
Médecine du travail
|
00
|
Oncologie
|
45
|
Epidémiologie
|
00
|
TOTAL
|
1212
|
|
|
Nous remarquons que les services les plus pourvoyeurs en
prélèvements sanguins sont:
· La médecine nucléaire, le CTS et
l'hématologie clinique ;
· L'effectif le plus important est constitué par les
prélèvements des
laboratoires suivant: > Hémobiologie, >
Biochimie,
> Microbiologie.
1- 2. Matériel de laboratoire :
1- 2. 1. Appareillage :
· Centrifugeuse
· Agitateur á barreau magnétique
· Vortex
· Spectrophotomètre (lecteur de plaque ELISA avec
filtres á 450 nm et de 650 á 620 nm)
· Imprimante
· Chambre froide pour conservation des échantillons
de sérums et réactifs á utiliser (2 - 8
°C)
1- 2. 2. Matériel consommable :
· Eprouvette graduée (500 ml)
· Tubes pour dilution des échantillons
· Pipettes (fixes ou réglables): 10 ul, 100 ul, 630
ul
· Flacon hermétique pour la solution de lavage des
barrettes (flacon recommandé à ouverture étroite ou celui
spécialement fourni s'utilisant avec un laveur automatique)
· Gants en Latex propres
· Portoirs pour tubes á 10 ml
· Papier absorbant
· Paraffine
· Embouts jaunes (volume de faible contenance) et bleus
(volume de plus grande contenance)
· Papier pour impression des résultats de lecture
des DO
· Bacs pour récupération des
déchets
1- 2. 3. Solutions et réactifs :
Les réactifs fournis dans le coffret d'analyse ELISA IgG
Trichinella spiralis (IVD Inc.):
· Barrettes tests : micro-puits contenant les
antigènes Trichinella- 96 puits sur un support de barrettes
;
· Conjugué enzymatique : un flacon contenant 11ml de
Protéine A conjuguée á la peroxydase ;
· Sérum de contrôle positif : un flacon
contenant 1 ml de sérum positif dilué de lapin ;
· Sérum de contrôle négatif : un flacon
contenant 1 ml de sérum négatif dilué humain;
· Chromogène : un flacon contenant 11 ml de
chromogène tétraméthylbenzidine (TMB) ;
· Solution de lavage concentrée (20X) : un
flacon contenant 25 ml de tampon concentré et du surfactant ;
· Tampon de dilution : deux flacons contenant 30 ml de
solution tampon et protéine ;
· Solution d'arrêt : un flacon contenant 11 ml
d'acide phosphorique 1 M.
La solution de lavage concentrée (20X) doit être
diluée avant son utilisation, pour cela nous avons utilisé une
eau distillée : 25 ml de la solution de lavage concentrée (20X)
diluée dans 475 ml d'eau distillée, ce qui nous permet de
constituer 500 ml de solution de lavage préte à l'emploi.
1- 3. Méthodes :
1- 3. 1. Devis d'étude, échantillonnage et
transport des
prélèvements:
Il s'agit d'une étude descriptive transversale qui vise
à déterminer la séroprévalence de la trichinellose
dans la communauté Tlemcenienne.
Elle s'intègre dans une enquête destinée
à recueillir des données sociales et sanitaires sur un
échantillon hospitalier (patients externes et hospitalisés)
aléatoire réalisé pour être le plus
représentatif de la population.
Brièvement, l'échantillon était tiré
au hasard dans la population générale des personnes
résidant au niveau de la wilaya de Tlemcen, et qui se sont rendu au
centre hospitalo-universitaire (CHU) de Tlemcen pour tous motifs confondus
(bilan sanguin systématique, hospitalisation, intervention chirurgicale,
suivi postopératoire, consultation médicale,...etc.).
Pour des raisons pratiques, nous nous sommes limités aux
prélèvements sanguins provenant des personnes ayant visité
le CHU de Tlemcen, malades ou pas, ceci durant la période allant de
Décembre 2011 à mars 2012.
Nous nous sommes rendues au CHU de Tlemcen, munies du
matériel nécessaire pour la réalisation des
prélèvements de sang (épicrâniennes, tubes
gélosés et tubes secs), la centrifugation des échantillons
se faisait le jour de la réception du prélèvement, et les
sérums sanguins étaient alors conservés à +4°C
; nous avons utilisé des glacières pour le transport des
prélèvements jusqu'à l'HCA afin de ne pas rompre la chaine
de froid et garantir des conditions optimales de conservation.
Le recrutement des patients terminé, la taille de
l'échantillon a atteint 1212 patients.
1- 3. 2. Origine géographique de
l'échantillon investigué : La wilaya de Tlemcen est
située à l'extrême ouest du pays, elle est limitée
géographiquement comme suit :
> Au nord par la mer méditerranéenne ;
> A l'est par les wilayas de Sidi Bel Abbes et Aïn
Témouchent ; > A l'ouest par le Maroc ;
> Au sud par la wilaya de Naâma.
Conformément à la dernière organisation
territoriale du pays, la wilaya de Tlemcen regroupe actuellement 20 daïras
et 53 communes (A.N.D.I., 2006).
La population résidente dans la wilaya de Tlemcen a
été estimée à 949 135 personnes en 2008, soit 482
364 personnes de sexe masculin et 466 771 personnes de sexe féminin
(O.N.S., 2008).
On estimerait actuellement la population Tlemcenienne à
environ un million d'habitants.

Wilaya de Sidi Be! Abbes
MAROC
Wilaya d'Aïn Temouchent
Mer
Méditérranée
Wilaya de Naama
Figure n°15: Communes de la wilaya de
Tlemcen (codes ONS)
01 . Tlemcen
· 02 .
Beni Mester
· 03 . Aïn Tallout
·
04 . Remchi
· 05 . El Fehoul
· 06 . Sabra
· 07 .
Ghazaouet
· 08 . Souani
· 09
. Djebala
· 10 . El Gor
·
11 . Oued Lakhdar
· 12 . Aïn
Fezza
· 13 . Ouled Mimoun
· 14
. Amieur
· 15 . Aïn Youcef
·
16 . Zenata
· 17 . Beni Snous
· 18 . Bab El Assa
· 19
. Dar Yaghmouracene
· 20 . Fellaoucene
· 21 . Azaïls
· 22 .
Sebaa Chioukh
· 23 . Terny Beni Hdiel
·
24 . Bensekrane
· 25 . Aïn
Nehala
· 26 . Hennaya
· 27
. Maghnia
· 28 . Hammam Boughrara
·
29 . Souahlia
· 30 . MSirda Fouaga
· 31 . Aïn Fetah
· 32
. El Aricha
· 33 . Souk Tlata
·
34 . Sidi Abdelli
· 35 . Sebdou
· 36 . Beni Ouarsous
· 37 .
Sidi Medjahed
· 38 . Beni Boussaid
·
39 . Marsa Ben M'Hidi
· 40 . Nedroma
· 41 . Sidi Djillali
· 42 .
Beni Bahdel
· 43 . El Bouihi
· 44
. Honaïne
· 45 . Tienet
·
46 . Ouled Riyah
· 47 . Bouhlou
· 48 . Beni Khellad
· 49 .
Aïn Ghoraba
· 50 . Chetouane
·
51 . Mansourah
· 52 . Beni Semiel
· 53
. Aïn Kebira
Le climat de Tlemcen, de type méditerranéen, est
caractérisé par deux saisons : une saison humide qui
s'étend d'octobre à mai avec des précipitations
irrégulières et irrégulièrement réparties
sur le territoire dans l'espace et dans le temps.
Si la moyenne de la pluviométrie se situe autour de 400
mm, ce chiffre peut atteindre 850 mm dans les monts de Tlemcen et moins de 300
mm au sud de Sebdou.
La température moyenne pour cette saison oscille
généralement autour de 10° avec une température
minimale absolue pouvant aller jusqu'à moins 6°.
Les hivers sont donc assez rigoureux avec vent, neige et
gel..
Une saison sèche : elle va du mois de juin au mois de
septembre.
La température moyenne en cette saison oscille autour de
26° avec un maximum pouvant atteindre 40°. La température
moyenne annuelle est de 18°.
La situation géographique, les différences
d'altitude rendent le climat plus complexe par la création de nombreux
microclimats et confèrent à la région de Tlemcen une
richesse floristique endémique tant rupicole, messicole que sylvicole,
ainsi qu'une faune particulière. (Korti M., 1994)
La connaissance de la faune présente un caractère
important pour étudier les tendances à l'origine des
différences des habitudes culinaires et des pratiques de chasse, selon
les régions et communes de la wilaya.
Les informations présentées concernant la faune
Tlemcenienne locale ont été tirées à partir des
données du parc national de Tlemcen (2006-2010).
Les espèces animales vivant au sein du Parc national de
Tlemcen constituent une richesse naturelle considérable qui reste
néanmoins très peu connue vu le nombre très réduit
des recherches et études dans ce sens, néanmoins, elles peuvent
nous renseigner sur la faune locale tlemcenienne, à laquelle, nous
rajoutons les animaux d'élevage communs : bovins, ovins et
équidés (surtout le cheval) ; néanmoins il faut savoir que
la wilaya ne dispose pas de bouchers agréés délivrant de
la viande chevaline.
Une collecte bibliographique ainsi que des observations sur
terrain appuyées par des enquêtes auprès des riverains,
chasseurs et amateurs de la nature, réalisées par l'équipe
technique du Parc a permis de mettre en évidence une liste
d'espèces totalisant 201 espèces qui reste non exhaustive vu le
manque enregistré pour certaines classes.
Nous nous limiterons dans cette liste qu'aux mammifères
et oiseaux, sachant que le parc compte, 18 espèces de reptiles et 07
espèces d'amphibiens :
- Les mammifères :
Ce groupe compte actuellement 21 espèces avec une
espèce probable qui est la loutre normalement disparue du territoire du
Parc mais qui a été récemment observée ailleurs
à proximité des oueds ; sa disparition doit être
forcément liée à la disparition de ce type de milieux
(plans d'eau.)
On cite l'existence d'espèces comme le chacal
doré, le chat forestier, le renard famélique, le caracal
très rarement observés et le porc épic qui devient
à son tour assez rare.
Le daim introduit en 1988 dans la réserve de chasse
à Moutas est souvent observé dans la forét de Haffir et
d'après les témoignages de riverains et de chasseurs les gazelles
de l'Atlas et de cuvier font apparition de temps à autre dans le
territoire du Parc.
Par ailleurs les nouvelles espèces observées sont
:
. Gazelle de cuvier (08) : Gazella cuvieri
(espèce protégée)
. Gazelle dorcas (09) : Gazella dorcas (espèce
protégée)
. Hyène rayée (14) : Hyena hyena
(espèce protégée)
. Renard famélique (19) : Vulpes ruppelli
(espèce protégée)
Les mammifères les plus chassés sont le
lièvre et le lapin sans pour autant que leur densité soit
très touchée (nombre de chasseurs non élevé) ;
Par contre le sanglier connait ces années des battues
massives suite à sa prolifération qui a causé de grands
dégâts aux cultures.
A ce niveau on doit tenir compte du fait de l'absence totale de
prédateurs du sanglier dont la régulation des densités
sera toujours assurée par les battues administratives.
- Les oiseaux :
Plus de 124 espèces d'oiseaux sont listées.
Ce tableau présente les espèces d'oiseaux
récemment répertoriées :

(P) : espèce protégée
L'aire et l'environnement du parc comptaient des espèces
qui ont forcément disparu, comme l'aigle ravisseur et l'aigle
impérial et peut être méme le milan royal.
Le vautour fauve observé sur les hauteurs de l'Ourit,
figurerait parmi les derniers spécimens de cette espèce car
apparemment les conditions actuelles ne lui permettent pas de nicher dans la
région.
Le petit nombre de percnoptères traduit un manque de
ressources pour les charognards, par contre les autres rapaces sont bien
représentés.
La huppe fasciée est très recherchée par
les riverains mais son caractère fugitif et son envol rapide ne facilite
pas toujours sa capture.
Pour ce qui est de la chasse ou du braconnage une
enquête auprès des riverains ainsi que des saisies ont
révélé une certaine pression sur les rapaces dont les
éperviers, les buses et les faucons, des fois méme l'aigle royal
ainsi que sur des passereaux dont le plus prisé est certainement le
chardonneret.
1- 3. 3. Collecte des données :
Le protocole a été entériné par le
comité d'éthique de l'Université Abou Bekr Belkaid de
Tlemcen (Annexe (1)).
Après avoir donné un consentement
éclairé, les participants ont répondu à un
questionnaire, et les échantillons de sang ont été
collectés.
1- 3. 4. Questionnaire / Renseignements :
Le questionnaire (Annexe (2)) s'inspirait des outils
déjà utilisés par le réseau de surveillance du
centre national de référence (CNR) des Trichinella en
France.
Les informations qui étaient collectées au cours
de l'entrevue portaient sur les caractéristiques
sociodémographiques (âge, sexe, niveau de scolarité,
commune de résidence, profession), la présence d' animaux
domestiques à la maison ou dans l'entourage, la notion de voyage
à l'étranger, les caractéristiques liées aux
activités de chasse et de trappe, (la manipulation des fourrures et de
la viande, le port de gants, le nombre d'années d'activités, les
activités de camping, le type d'activités en forêt, les
espèces et quantités d'animaux tués ou capturés au
cours de la dernière année) et les habitudes alimentaires
(fréquence de consommation de viandes peu courantes, crues ou
insuffisamment cuites).
2. Diagnostic :
2- 1. Diagnostic d'orientation : (De Bruyne et al.,
2006 )
La symptomatologie peut parfois être impressionnante ce
qui peut attirer l'attention, il s'agit surtout de la triade : fièvre
intense, myalgie et oedème de la face ; les autres symptômes
étant très généraux.
Par ordre d'apparition, suivant l'évolution du cycle
biologique, chez le malade on peut noter de la diarrhée, de
l'asthénie, un rash, une fièvre, des myalgies et un oedème
facial. Ces symptômes s'estompent en 4 à 26 jours.
L'anamnèse peut faire état de consommation de
viande (notamment de porc, de sanglier ou de cheval à l'état cru,
séché (saucisson) ou saignant).
Si cette parasitose est suspectée, on procède au
diagnostic biologique.
· Examens biologiques d'orientation:
(De Bruyne et al., 2006 ; Dieusaert P., 2005 ; Mougeot G., 1995 ;
Poirrier M., 2010)
L'hyper éosinophilie sanguine est le plus souvent de
règle, il s'y associe une augmentation des enzymes musculaires et un
discret syndrome inflammatoire : L'hémogramme montre alors une hyper
leucocytose à 15000 ou 20000 globules blancs par ml
caractérisée surtout par une hyper éosinophilie atteignant
parfois 60%. Le taux des enzymes musculaires est très
élevé: CPK (six fois supérieur à la normale : 20
à 200 UI/l) et secondairement la lactate déshydrogénase
(LDH).
Cette élévation souligne la souffrance
métabolique des cellules musculaires vers la septième ou
huitième semaine de l'infestation.
L'inflammation entraine une accélération de la
vitesse de sédimentation (VS) et à la phase aiguë de la
maladie, le taux de CRP (Protéine C Réactive) est très
élevé.
On note une augmentation des ASAT (55 UI/l) et des ALAT (45
UI/l) seulement chez 10 à 25 % des malades.
Toutes ces perturbations disparaissent en un à trois
mois.
On observe une hypoprotidémie.
Le protidogramme est perturbé : augmentation des alpha 1
et des alpha 2 globulines. L'immunoélectrophorèse des
protéines montre une élévation des IgM et des IgG, ainsi
que de l'haptoglobine et de l'orosomucoïde.
On observe également une
hypocholestérolémie et le lipidogramme est également
perturbé avec une diminution très nette des lipides totaux.
Enfin on remarque une hypoglycémie (par diminution de
l'absorption intestinale des glucides), et une hypocalcémie. Cependant
ces derniers signes (hypoprotidémie, hypoglycémie,
hypocalcémie) sont peu spécifiques.
Ces éléments orientent le diagnostic, mais la
confirmation de la trichinellose ne peut se faire que par les examens
parasitologiques ou sérologiques.
2- 2. Diagnostic sérologique:
(De Bruyne A. et al., 2006; Dupouy-Camet et al., 2002 ; Gamble
H.R. et al, 2004)
Le diagnostic sérologique consiste en la recherche
d'anticorps anti Trichinella dont la détection a une bonne
valeur diagnostique.
Les anticorps peuvent être détectables à
partir du 15e jour suivant l'infestation, (délai de
positivité des anticorps: de 15 à 30 jours, atteignant le taux
maximal en 4 mois). La recherche d'IgA spécifiques dirigées
contre les larves L1NN pourrait permettre une détection précoce
de l'infection : plus de 80 % des sujets sont séropositifs après
3 semaines (Mendez-Loredo B, 2001).
Le délai d'apparition des anticorps dépend de
l'espèce de Trichinella et de la dose infestante (plus celle-ci
est faible, plus les anticorps apparaissent tardivement).
Une sérologie négative associée à
des signes fortement évocateurs ne doit pas faire éliminer
définitivement le diagnostic, et il ne faut pas hésiter à
renouveler cet examen quelques jours plus tard.
Les IgG atteignent un maximum en 4 mois et persistent ensuite
plusieurs années (Harms G, 1993).
Flusieurs techniques ont été décrites pour
la détection de la trichinellose chez l'homme, l'hémagglutination
indirecte (HAI), la floculation bentonite, l'agglutination au latex,
l'immunofluorescence indirecte et l'ELISA sont les tests les plus couramment
utilisés pour le dépistage de la parasitose surtout, le dernier
étant le plus sensible (Murrell et Bruschi, 1994;. Dupouy-Camet et al,
2002).
Actuellement, la technique ELISA est la méthode la plus
couramment utilisée pour le dépistage de la trichinellose chez
l'homme, car elle est économique, fiable, facilement standardisée
et fournit un équilibre acceptable entre sensibilité et
spécificité. Récemment, il semblerait, que la technique du
Western Blot, pourrait apporter une aide au diagnostic de la trichinellose, en
confirmant ou infirmant les résultats de l'ELISA .
Nous avons employé lors de notre étude
séro-épidémiologique une technique ELISA
anti-Trichinella, que nous allons décrire ci-après :
· Source d'antigenes -technique ELISA- :
(Gamble H.R. et als, 2004) Dans les années 1970 les
antigènes somatiques préparés à partir d'extraits
de corps entiers de larves musculaires ont été utilisés
pour la technique ELISA dans la détection des anticorps anti-
Trichinella chez les porcs (Ruitenberg et al, 1974.; Ruitenberg et
als, 1977).
Cet extrait brut de larves, produit à partir des larves
musculaires L1 recueillies par digestion artificielle, ne doit pas être
utilisé pour les tests sérologiques chez les animaux ou les
humains en raison d'une forte probabilité de réactions
croisées avec d'autres agents pathogènes.
Par exemple, des réactions croisées se
produisent avec des échantillons de sérum provenant d'individus
infestés par Loa loa, Toxocara sp, et
Anisakis (J. DupouyCamet, communication personnelle; E. Pozio,
données non publiées).
Au cours des années 1980, la spécificité du
test ELISA a été améliorée par l'utilisation des
antigènes d'excrétion-sécrétion (ES) obtenus
à partir de l'incubation in vitro de larves musculaires L1 de
Trichinella (Gamble et al., 1983).
Ces antigènes, provenant de sécrétions
larvaires, sont de structure glycoprotéique. Les informations concernant
les antigènes de Trichinella ont été
résumées par Appleton et al. (1991) et Ortega-Pierres et al.
(1996).
L'épitope immuno-dominant de l'antigène reconnu
par les animaux et les humains infestés par Trichinella
spiralis, ou par d'autres espèces de Trichinella
actuellement connue, est le groupe TSL-1.
Les antigènes TSL-1 se trouvent dans les cellules des
stichocytes et sur la surface de la cuticule du parasite; ils sont activement
sécrétés par les larves musculaires L1.
Ces antigènes sont produits pour usage diagnostique par
culture in vitro de larves musculaires isolées ou par des
méthodes biochimiques de récupération de ce même
stade parasitaire.
Les Méthodes de préparation de ces
antigènes ont été publiés(Gamble et al, 1983;.
Seawright et al, 1983;. Grencis et al, 1986;. OIE, 2000) (pour une description
détaillée des méthodes).
Comme indiqué précédemment, les
épitopes antigéniques TSL-1 reconnus par les anticorps
anti-Trichinella des animaux et humains infestés sont communs
à toutes les espèces encapsulées et non encapsulé
(Appleton et al., 1991).
Par conséquent, l'antigène Trichinella
peut être systématiquement préparés à partir
de larves musculaires de T. spiralis, car cette espèce est
facilement maintenue sur des souris de laboratoire, et utilisé pour
détecter une infection par des espèces de Trichinella
par ELISA.
Les antigènes TSL-1 partagent un épitope
glucidique commun (le tyvelose), qui a été
synthétisé (Reason et al, 1994;.. Wisnewski et al, 1993).
Le Tyvelose synthétique est disponible dans le commerce
(Safe-Path Laboratoires, LLC, Carlsbad, CA), et a été
évalué dans plusieurs projets de recherche, où ses
performances se comparaient favorablement avec les antigènes ES lors de
tests sur les humains, les porcs et d'autres animaux (Gamble et al, 1997;
Bruschi. et al, 2001;. Owen et al,
2001;. Pozio et al,.2002a).
L'antigène carbohydrate synthétique offre les
avantages de la stabilité et de la standardisation. Il a
été démontré qu'il offre une plus grande
spécificité, chez de nombreuses espèces, mais peut
sacrifier de la sensibilité.
Des rapports récents sur d'éventuelles
réactions croisées obtenues avec l'antigène tyvelose et la
preuve que des glycanes contenant du tyvelose dans d'autres oeufs de
nématodes, soutiennent qu'il faudra d'autres études pour mieux
définir sa spécificité (Dea-Ayuela et al, 2001;.. Pozio et
al, 2002a).
L'immunofluorescence indirecte (IFI) (Figure n°16)
et surtout la méthode ELISA sont alors les deux méthodes les
plus utilisées pour le dépistage, mais de nombreuses
méthodes sérologiques ont été décrites.
L'IFI utilise comme antigène soit des coupes de muscles
de rats trichinés (diaphragme) soit des larves extraites de leur kyste
par digestion chlorhydropepsique des muscles.
L'inconvénient réside dans le fait qu'il y a une
possibilité de réaction croisée, à des taux
faibles, avec d'autres helminthes.

Figure n°16 : Larve de Trichinella en
immunofluorescence indirecte
La méthode la plus largement utilisée reste alors
la méthode ELISA qui est beaucoup plus récente.
Elle a donné des résultats très prometteurs
(spécificité : 77-87%) (J. Dupouy-Camet, communication
personnelle).
Cette dernière permet de détecter plus
précocement les anticorps IgG que l'IFI. Les tests ELISA sont
très sensibles mais ont une spécificité plus faible.
Le Western Blot permet donc la distinction des réactions
croisées (sensibilité : 99%) (Figure n°17) et donc
la confirmation des méthodes de dépistage.
Il utilise comme antigènes un extrait larvaire de T.
spiralis.
L'interprétation du test (présence de 3 bandes
spécifiques : 43, 44 et 64 kDa) tient compte de la présence
d'anticorps spécifiques dirigés contre les antigènes de la
famille du groupe TSL-1.

Figure n°17: Aspect d'immunoempreinte (Western
Blot). (De Bruyne et al., 2006) Profil 1 : profil
négatif chez un patient avec un test de dépistage (ELISA)
positif. Profil 2 : profil positif (présence de 3 bandes à 43, 44
et 64kDa).
Profil 3 : profil négatif.
· Diagnostic de laboratoire de
l'échantillon étudié:
Les échantillons de sang ont été
analysés pour vérifier l'éventuelle présence
d'anticorps anti-Trichinella.
Le diagnostic de laboratoire a consisté en une
sérologie par la technique immunoenzymatique (ELISA) pour la
détection des anticorps IgG anti-Trichinella (IVD Inc.) (Annexe
(3)).
Le diagnostic parasitologique de certitude n'a pas pu
être réalisé au cours de notre étude,
néanmoins, nous avons jugé utile de le rappeler.
2- 3. Diagnostic parasitologique de certitude:
(Ripert C., 2007; In : Poirrier M., 2010)
Il est rarissime de retrouver les larves de Trichinella
dans le sang ou dans les selles. De même, les adultes sont
très rarement identifiés dans les selles puisque lysés
dans le tube digestif.
On peut en trouver quelquefois dans le liquide du tubage
duodénal ou dans le liquide céphalo-rachidien s'il y a eu une
atteinte méningée.
Le meilleur moyen pour rechercher la présence du parasite
est la biopsie musculaire. Mais cet examen ne sera positif qu'après
enkystement des larves dans les muscles après la quatrième
semaine.
La biopsie est pratiquée au trocart (mais les
pièces sont petites) ou au bistouri (mais il persiste une cicatrice).
Elle est effectuée soit au niveau du deltoïde
(assez près de la tête humérale), triceps, quadriceps et
des muscles intercostaux, soit au niveau des muscles les plus atteints selon
les myalgies et les données de l'électromyogramme.
On procède à un examen complet de la pièce,
par écrasement entre lame et lamelle. Il permet de voir rapidement les
larves enkystées dans leur intégralité par examen direct
au microscope.
Une autre technique consiste à faire digérer la
pièce opératoire par une solution chlorhydropepsique : les larves
sont ainsi libérées et bien visibles (digestion artificielle).
L'intérêt des biopsies est double : elle permet la
confirmation du diagnostic et l'isolement puis le typage de la souche
après transfert à un animal réceptif (souris
immunodéprimée par injection de cyclophosphamide) ou directement
par amplification génomique (réservée à un
laboratoire spécialisé).
La spécificité de la biopsie musculaire est quasi
parfaite mais sa sensibilité est médiocre, notamment dans les
faibles infestations (inférieures à une larve par gramme de
muscle). Cette technique est réservée, soit au dépistage
des premiers cas (cas index) qui posent un problème diagnostique, soit
aux formes graves hospitalisées non confirmées par d'autres
techniques (De Bruyne et al., 2006).
Enfin, l'étude anatomopathologique de la pièce
(fixation, coupe et coloration) visualise non seulement la larve mais aussi la
réaction inflammatoire.
La prescription de la biopsie musculaire pose souvent un
problème éthique ; sa
rentabilité est maximale quelques jours après la
guérison clinique du malade et elle n'apporte pas de
bénéfice au patient. Elle est donc rarement pratiquée et
reste réservée soit au dépistage des cas qui posent un
problème diagnostique, soit aux formes graves hospitalisées non
confirmées par d'autres techniques.
2- 4. Diagnostic différentiel : (De Bruyne A.
et al., 2006)
Les premiers cas de trichinellose qui se déclarent sont
souvent ignorés ou attribués à un banal syndrome grippal
surtout en période hivernale épidémique.
L'hyperéosinophilie permet de redresser le diagnostic.
Une toxi-infection alimentaire ou une salmonellose peut
être suspectée en cas de diarrhée fébrile mais, en
cas de trichinellose, les coprocultures sont négatives et la survenue de
myalgies doit attirer l'attention.
D'autres causes de myosite peuvent également être
confondues : polymyosite idiopathique, dermatomyosite, connectivites
(Churg-Strauss), pyomyosites bactériennes et éventuellement
sarcoïdose et cysticercose.
Le diagnostic repose alors sur la biopsie musculaire et le
sérodiagnostic.
Le syndrome éosinophilie - myalgie, d'individualisation
récente, est exceptionnel et incite à rechercher une
éventuelle consommation de dérivés du L-tryptophane.
La myalgie épidémique estivale de Bornholm, due
à un virus coxsackie, ne s'accompagne pas d'hyperéosinophilie.
Une distomatose ou une toxocarose peuvent également
être évoquées devant une forte éosinophilie
accompagnée de fièvre.
Plus rarement, on pourra évoquer une hydatidose rompue,
une hypodermose, ou une bilharziose en phase d'invasion, qui peut parfois
s'accompagner d'un oedème facial.
2- 5. Confirmation de cas : (De Bruyne et al.,
2006)
La confirmation de cas véritables, s'appuie sur plusieurs
critères, en particulier en cas de limites de tel ou tel moyen de
diagnostic :
- soit une biopsie musculaire objectivant une ou plusieurs
larves de Trichinella sp associée à une clinique
suggérant la trichinellose (triade symptomatique +++),
- soit une sérologie positive en IFI, ELISA et/ou Western
Blot avec des signes et symptômes récents de trichinellose
- soit au moins trois des arguments cliniques ou biologiques
suivants suggérant la trichinellose : éosinophilie
supérieure à 500 cellules par mm3, fièvre,
myalgie, oedème péri orbital.
Nous présentons ci-dessous un algorithme diagnostique
des trichinelloses chez l'homme (De Bruyne et al., 2006).
Groupe Caractéristiques
A Fièvre
OEdèmes de la face et périorbitaire
Myalgies
B Signes neurologiques
Signes cardiaques
Conjonctivite
Hémorragie sous-unguéale
Éruptions cutanées (exanthème
maculopapulaire) Diarrhée
C Éosinophilie (>1G/l) et/ou
élévation des IgE totales
Élévations des enzymes musculaires (CPK,
aldolase)
D Sérologie positive avec
présence d'anticorps spécifique
Séroconversion
Biopsie musculaire positive
Le diagnostic de trichinellose est :
peu probable : lors de la
présence d'un signe A ou d'un signe B ou d'un signe C ;
suspect : lors de l'association d'un signe A ou de
deux signes B et d'un signe C ; hautement probable :
lors de l'association de trois signes A et de deux signes C ;
certain lors de l'association de trois signes A, deux
C et un D ou lors de l'association de quelques signes A ou B, d'un C et un
D.
Une enquête épidémiologique (puisqu'un porc
permet de nourrir plus d'une cinquantaine de personnes et un cheval plus d'un
millier) doit affirmer le diagnostic, et des mesures adéquates doivent
être prises.
3. Résultats :
Dans cette section, nous présentons la compilation des
données sérologiques obtenues, la revue des dossiers
médicaux pour les patients avec des sérologies positives et les
résultats des analyses univariées réalisées pour
mettre en lumière les facteurs en relation avec la
séroprévalence documentée dans notre
échantillon.
Rappelons qu'au total, 1212 patients ont fourni des
échantillons de sang pour notre étude.
L'age moyen de l'ensemble des patients est d'environ 38 ans avec
une étendue de 2 ans à 81 ans.
Il y avait 580 personnes de sexe féminin (âge moyen
de 42 ans environ) avec une étendue de 2 ans à 78 ans ; et 632
personnes de sexe masculin (âge moyen de 34 ans environ) avec une
étendue de 2 ans et demi à 81 ans.
3- 1. Résultats des sérologies
anti-Trichinella de l'échantillon étudié :
Sur un total de 1212 échantillons de sang collectés,
nous avons obtenu 4 cas présentant une sérologie ELISA (IVD Inc.)
positive pour Trichinella sp, ce qui correspond à une
séroprévalence de 0,33 %
Les résultats des sérologies anti-Trichinella
de l'échantillon investigué, réalisées par la
technique ELISA (IVD Inc.) sont présentés dans le tableau
n°VI.
Tableau n°VI: Résultats globaux des
sérologies répartis selon le sexe
Sérologie
|
Sexe féminin
|
Sexe masculin
|
|
Positive
|
03
|
01
|
04
|
Négative
|
577
|
631
|
1208
|
TOTAL
|
1212
|
|
Pour déterminer le Khi2 observé pour chaque
échantillon de l'expérience, on applique la formule suivante:
Khi2 = (fréquence observée - fréquence
théorique) 2 / fréquence théorique
Pour tirer une conclusion sur la dépendance (H1)
(hypothèse alternative) ou l'indépendance (H0) (hypothèse
initiale ou nulle), on somme tous les Khi2 observés et on compare
ensuite la valeur globale à une valeur de la table de Khi2, selon :
· La valeur du degré de liberté (DDL) qui se
calcule de la manière suivante : (k-1). (r-1) avec k le
nombre de colonnes et r le nombre de lignes du tableau étudié.
· L'intervalle de confiance : nous avons adopté un
intervalle de confiance de 95%, la marge de confiance est donc assez importante
et le risque d'erreur est de 5% seulement.
Si le khi2 observé est plus grand que le Khi2
théorique, alors on rejette l'hypothèse nulle (H0) et on adopte
donc H1 qui signifie que les deux critères (variable et
sérologie) sont dépendants, qu'il y a donc un lien entre eux au
seuil du risque de 5%.
Le test du Khi2 calculé pour le tableau n°VI est de
1,185 ; pour un degré de liberté (DDL) égale à 01
et pour un intervalle de confiance de 95 %, cette valeur calculée est
inferieure à celle théorique : 3,841.
Du fait de la sensibilité du test du Khi2, à la
fois à l'effectif total (qui doit être important, condition
respectée) ainsi qu'à celui des cases (dans notre cas, 2 cases
parmi 4 présentent un effectif inferieur à 5), nous avons
jugé utile d'apporter une correction au test du Khi2 par le V
de Cramer, qui se calcule de la manière suivante : la valeur du
÷2 calculé est divisée par l'effectif total
lui-même multiplié par la plus petite dimension du tableau (nombre
de lignes ou de colonnes) à laquelle on aura enlevé un. Puis on
fait la racine carrée de tout ça :
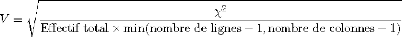
La valeur du V est toujours comprise entre 0 et 1, plus
le V est élevé (proche de 1), plus la dépendance
entre les deux variables est forte. Plus le V est faible (proche de
0), plus les variables se rapprochent de l'indépendance.
Le V de notre tableau est égal à : V=
0,031
Par conséquent, nous pouvons dire qu'il n'y a pas de
différence significative entre les résultats des
sérologies anti-Trichinella réalisées pour les
deux populations : féminine et masculine (variables indépendantes
: sérologies et sexe masculin ou féminin).
3- 2. Revue des dossiers médicaux :
Nous avons recherché dans les dossiers médicaux
-essentiellement des malades hospitalisés- des informations sur les
manifestations cliniques qu'auraient présentées les personnes
chez qui une sérologie anti-Trichinella positive ou douteuse a
été documentée.
Les dossiers médicaux ont été
vérifiés en fonction des périodes de persistance des
anticorps: les 5 dernières années pour les patients ayant une
sérologie positive pour Trichinella sp (cela était
réalisable chez seulement deux patients).
Parmi les 04 patients investigués :
· 2 n'avaient présenté aucun tableau
clinique d'une quelconque pathologie (leur prélèvement
était réalisé dans le cadre d'un bilan
systématique),
· et pour les 2 restants, la symptomatologie clinique se
confondait avec leur pathologie sous-jacente.
3- 3. Résultats des examens biologiques
réalisés :
Tous nos patients (04) qui avaient présenté une
sérologie positive anti-Trichinella, par la technique ELISA
(IVD Inc.), avaient des taux de CPK et de LDH dans les normes. Les
polynucléaires éosinophiles étaient explorés chez
3patients parmi les 04 cités, leur nombre était également
dans les normes.
La vitesse de sédimentation (VS) était
calculée les 4 patients, elle était dans les normes sauf pour un,
la VS était légèrement accélérée (14
mm à la première heure).
3- 4. Distribution des variables :
Nous avons étudié les facteurs de risque suivants
pour la trichinellose :
· consommation de viandes peu cuites,
· consommation de gibiers,
· consommation de viande chevaline,
· consommation de viande inhabituelles (chameau, gazelle,
renard, sanglier),
· pratiques de chasse ou de trappe,
· notion de voyage à l'étranger.
Le tableau n°VII présente la distribution des
fréquences des variables en rapport avec la consommation de viandes peu
cuites (25 patients), de gibiers (460 patients), de viande chevaline (5
patients) ou autres (chameau, gazelle, renard, sanglier) (42 patients), les
pratiques de chasse ou de trappe (10 patients) et la notion de voyage à
l'étranger (402 patients).
Tableau n°VII: Distribution des
fréquences de certaines variables dans la
population
étudiée
|
Consommation
de viandes peu
cuites
|
Consommation
de gibiers
|
Consommation
de viande
chevaline
|
Consommation
de viande
inhabituelle
|
Chasse
ou trappe
|
Notion de
voyage à
l'étranger
|
Fréquence
|
2,06 %
(25 patients)
|
37,95 %
(460 patients)
|
0,41 %
(5 patients)
|
3,46 %
(42 patients)
|
0,82 %
(10
patients)
|
33,17 %
(402
patients)
|
|
3- 4. 1. Influence de la variable consommation de viandes
bien ou peu cuites :
Tableau n°VIII : Distribution de la variable
« consommation de viande bien ou peu
cuite » dans la population
étudiée
Sérologie
Variable
Consommation de viande
peu cuite
|
Positive
|
Négative
|
|
25
|
Consommation de viande
bien cuite
|
04
|
1183
|
|
Le test du Khi2 calculé est de 0,085 ; pour un
degré de liberté (DDL) égale à 01 et pour un
intervalle de confiance de 95 %, cette valeur calculée est inferieure
à celle théorique : 3,841.
Le V de notre tableau est égal à : V=
0,0084
Par conséquent, nous pouvons dire qu'il n'y a pas
d'interaction statistiquement significative, entre la positivité de la
sérologie anti-Trichinella et la consommation de viande bien ou
peu cuite, dans la population étudiée.
3- 4. 2. Influence de la variable consommation ou non de
gibiers :
Tableau n°IX : Distribution de la variable
« consommation ou non de gibiers » dans
la population
étudiée
Sérologie
Variable
|
Positive
|
Négative
|
Consommation de gibiers
|
04
|
456
|
Non consommation de
gibiers
|
00
|
752
|
|
Le test du Khi2 calculé est de 6,56 ; pour un
degré de liberté (DDL) égale à 01 et pour un
intervalle de confiance de 95 %, cette valeur calculée est
supérieure à celle théorique : 3,841.
Le V de notre tableau est égal à : V=
0,073
Nous notons alors, qu'il existe une interaction statistiquement
significative, entre la positivité de la sérologie
anti-Trichinella et la consommation de gibiers, dans la population
étudiée.
3- 4. 3. Influence de la variable consommation ou non de
viande chevaline :
Tableau n°X : Distribution de la variable
« consommation ou non de viande
chevaline » dans la population
étudiée

Variable
Consommation de viande
chevaline
Non consommation de
viande chevaline
Sérologie
Positive
02
02
Négative
1205
03
Le test du Khi2 calculé est de 240,197 ; pour un
degré de liberté (DDL) égale à 01 et pour un
intervalle de confiance de 95 %, cette valeur calculée est largement
supérieure à celle théorique : 3,841.
Le V de notre tableau est égal à : V=
0,445
Nous notons alors, qu'il existe une interaction
statistiquement significative, entre la positivité de la
sérologie anti-Trichinella et la consommation de viande
chevaline, dans la population étudiée.
3- 4. 4. Influence de la variable consommation ou non de
viandes inhabituelles :
Tableau n°XI : Distribution de la variable
« consommation ou non de viandes
inhabituelles » dans la
population étudiée

Variable
Sérologie
Positive
Négative
Consommation de
viandes inhabituelles
01
41
Non consommation de
viandes
inhabituelles
Le test du Khi2 calculé est de 5,564 ; pour un
degré de liberté (DDL) égale à 01 et pour un
intervalle de confiance de 95 %, cette valeur calculée est
supérieure à celle théorique : 3,841.
Le V de notre tableau est égal à : V=
0,068
Nous notons alors, qu'il existe une interaction statistiquement
significative, entre la positivité de la sérologie
anti-Trichinella et la consommation de viandes inhabituelles (chameau,
gazelle, renard, sanglier), dans la population étudiée.
3- 4. 5. Influence de la variable pratique de chasse ou de
trappe :
Tableau n°XII : Distribution de la variable
« pratiques de chasse ou de trappe» dans
la population
étudiée
Sérologie
Variable
|
Positive
|
Négative
|
Pratiques de chasse ou de
trappe
|
00
|
10
|
Absence de la notion de
pratiques de chasse ou
de
trappe
|
04
|
1198
|
|
Le test du Khi2 calculé est de 0,033 ; pour un
degré de liberté (DDL) égale à 01 et pour un
intervalle de confiance de 95 %, cette valeur calculée est
inférieure à celle théorique : 3,841.
Le V de notre tableau est égal à : V=
0,0052
Nous notons alors, qu'il n'y a pas d'interaction statistiquement
significative, entre la positivité de la sérologie
anti-Trichinella et la notion de pratiques de chasse ou de trappe,
dans la population étudiée.
3- 4. 6. Influence de la variable notion de voyage
à l'étranger :
Tableau n°XIII : Distribution de la variable
« notion de voyage à l'étranger» dans la
population
étudiée

Variable
Sérologie
Positive
Négative
Notion de voyage àl'étranger
03
399
Pas de notion de voyage
àl'étranger
Le test du Khi2 calculé est de 3,167 ; pour un
degré de liberté (DDL) égale à 01 et pour un
intervalle de confiance de 95 %, cette valeur calculée est
inférieure à celle théorique : 3,841.
Le V de notre tableau est égal à : V=
0,051
Nous notons alors, qu'il n'y a pas d'interaction
statistiquement significative, entre la positivité de la
sérologie anti-Trichinella et la notion de voyage à
l'étranger, dans la population étudiée.
4. Discussion :
Cette étude séro-épidémiologique a
permis d'investiguer, à partir de la persistance des anticorps
secondaires à l'infection, les personnes qui ont été en
contact avec Trichinella sp.
Nous discutons ici les résultats de la
séroprévalence de cette anthropozoonose, la trichinellose, en
regard de la littérature, et en particulier, des prévalences et
des facteurs de risque connus dans les autres communautés et territoires
du monde déjà investigués.
Dans le cadre de la présente étude, nous avons
obtenu des taux de participation relativement importants (1212 pour 1 million
d'habitants).
Même si l'échantillon à l'étude a
été choisi de façon à être
représentatif de la population générale de la wilaya de
Tlemcen, il y a lieu de se questionner sur la validité externe des
résultats présentés. Malgré tout, nous croyons que
l'étude fournit des données fortes intéressantes pour
cette population concernant leur exposition à la trichinellose en lien
avec leur mode de vie.
Une séroprévalence de 0,33 % a été
obtenue pour Trichinella sp.
Cette valeur a été comparée à celles
rapportées dans d'autres régions déjà
étudiées, comme par exemple :
? En Indonésie (Chomel BB., et als, 1993), où la
majorité de la population est musulmane ne consommant, à
fortiori, pas de porc ou de viande de carnivores, la prévalence du
portage des anticorps anti-Trichinella sp a été
estimé à 19,5 % dans une population composée de jeunes
enfants et d'adolescents au niveau
de l'île de Bali, qui sont apparemment en majorité
hindous ; ce qui est nettement supérieure à la valeur obtenue
dans la région de Tlemcen, indiquant
une certaine incohérence entre les données des
expositions de ces deux populations, ce qui serait dû à des
facteurs de risque, qui seraient inexistants dans nos contrés (Les
habitudes alimentaires et la mauvaise hygiène peut expliquer la
fréquence des infestations par Trichinella chez les enfants et
les adolescents à Bali).
· Par contre, une autre étude en
Biélorussie (Skripova L.V. et al ; 1994), région
de culture et de moeurs très différentes par
rapport aux nôtres, a conclue à une
séroprévalence de 0,55 %, valeur très
proche de celle que nous avons obtenu.
· En Chine (Cui J., et als,
2011), une étude séro-épidémiologique, a
déterminée
une séroprévalence globale de 3,19 %.
Les taux étaient différents selon les
régions, par exemple ceux les plus élevés
étaient enregistrés dans les régions
occidentales, où les gens avaient des habitudes alimentaires
particulières, comme manger de la viande crue, surtout celle du porc
(surtout les Thaïlandais et même les Tibétains).
On remarque que les séroprévalences Tlemcenienne
et Chinoise sont différentes, ce qui serait du à des habitudes
culinaires et des moeurs religieuses complètement différentes.
En raison de méthodes d'échantillonnage
populationnel ou encore d'analyses de laboratoire qui peuvent différer
de la présente étude, les résultats de
séroprévalence de la trichinellose issus des autres études
menées dans le monde au cours des dernières années ne sont
pas toujours aussi comparables.
Néanmoins, les données de ce travail peuvent nous
aider à estimer l'importance relative des résultats
rapportés ici.
En fonction des facteurs de risque précédemment
étudiés, nous remarquons que les deux groupes, ceux ayant une
sérologie anti-Trichinella positive et ceux ayant une
sérologie négative, présentent une différence de
fréquences qui ne serait statistiquement pas due au hasard, selon le
test du Khi2.
La consommation de gibiers, de viande chevaline ou d'autres
types de viandes pas très courantes (dans notre cas il s'agissait
surtout de la viande de chameau, de sanglier, de gazelle et même de
renard), sont des variables à prendre en compte, car il existe bel et
bien une dépendance entre une sérologie anti-Trichinella
positive et ces facteurs de risque.
Dans le cadre de l'interprétation des
sérologies anti-Trichinella ELISA (IVD Inc.) des patients
investigués, nous avons considéré qu'une densité
optique supérieure à 0,1 et inférieure à 0,3
était en faveur d'un faux négatif et donc considéré
comme un résultat douteux.
Nous avons obtenu 12 sérologies à réaction
douteuse.
Nous avons donc testé la spécificité :
· Avec d'autres parasitoses :
+ Distomatose :
Sérodiagnostic de la distomatose par
hémagglutination indirecte (FUMOUZE®).
La réaction est considérée comme
significative en faveur d'une distomatose évolutive pour un titre =
1/320.
7 sérums ont présenté une
réaction négative et les 5 sérums restants ont
donné une réaction douteuse au titre = 1/160, ce qui pourrait
être expliqué par une éventuelle communauté
antigénique entre les deux helminthes : Trichinella et
Fasciola.
+ Bilharziose :
Sérodiagnostic de la bilharziose par
hémagglutination indirecte (FUMOUZE®). La réaction
est considérée comme significative en présomption d'une
bilharziose évolutive pour un titre = 1/160.
Les sérologies des 12 sérums sont revenues
négatives.
+ Toxocarose :
Sérodiagnostic de la toxocarose par la technique
immuno-enzymatique ELISA (IVD Inc.).
La réaction est considérée comme positive
en présomption d'une toxocarose, pour une absorbance lue
supérieure ou égale à 0.3 unités de DO.
Les sérologies des 12 sérums sont revenues
négatives.
+ Leishmaniose :
Les sérologies des 12 sérums sont revenues
négatives.
+ Toxoplasmose :
Sérodiagnostic de la toxoplasmose par la technique
immuno-enzymatique ELISA (Bio Advance).
La réaction est quantitative et le seuil
considéré en présomption d'une toxoplasmose, est de 50
UI/ml (pour les IgG).
5 sérums ont présenté des taux d'IgG >
50 UI/ml, et les 7 restants ne renfermaient pas d'anticorps
anti-Toxoplasma.
· Avec des maladies auto-immunes :
2 sérums présentant des anticorps
anti-mitochondries de type II, 2 présentant des anticorps anti-estomac,
12 présentant des anticorps anti-nucléaires, 15 présentant
un facteur rhumatoïde positif, et un présentant une cirrhose
auto-immune, ont été testés. Deux sérums dont un
présentant un facteur rhumatoïde positif et l'autre une cirrhose
auto-immune, ont donné un résultat douteux avec le Test ELISA
Trichinella IgG (IVD Inc.).
· Avec des processus cancéreux :
12 sérums provenant de malades présentant un
cancer thyroïdien, 10 présentant un cancer du sein, 5
présentant un cancer du col de l'utérus, 28 présentant des
cancers hématologiques (toutes étiologies confondues), 7
présentant un cancer du rein et 2 présentant un cancer du poumon,
ont été testés.
4 sérums de cancéreux ont donné un
résultat douteux avec le Test ELISA Trichinella IgG (IVD
Inc.).
Dans ce genre de cas, il est très difficile de donner une
conclusion satisfaisante car beaucoup de tableaux de cancers s'accompagnent
d'un taux anormalement élevé d'anticorps, qui peut de ce fait
interférer lors de sérologies réalisées dans le
cadre de la recherche d'une parasitose par exemple, comme c'est le cas pour la
trichinellose, par conséquent, il peut s'agir d'une simple
interférence.
· Avec des infections virales :
15 sérums de sidéens, 16 présentant une
hépatite (B ou C), ont été testés.
Aucun des sérums testés n'a donné une
réaction significative avec le Test ELISA Trichinella IgG
(IVD Inc.).
· Avec des infections bactériennes :
5 sérums de tuberculeux ont été
testés.
Aucun des sérums testés n'a donné une
réaction significative avec le Test ELISA Trichinella IgG
(IVD Inc.).
En conclusion, nous pouvons dire que l'interprétation de
la sérologie ELISA anti- Trichinella est délicate, elle
associe la recherche des facteurs de risque, précédemment
décrits, la symptomatologie du patient, l'éventuelle existence
d'une pathologie sous jacente et bien sûr la sensibilité
individuelle de chaque patient.
De ce fait, il existerait des faux positifs, par interaction
avec d'autres parasitoses (particulièrement avec des helminthoses,
notion de communauté antigénique), ou lors de certains
états pathologiques particuliers, comme les cancers ou les maladies
autoimmunes, où on note des taux énormes d'anticorps qui
pourraient interférer avec la sérologie
anti-Trichinella. Ainsi que des faux négatifs ou douteux, lors
des mêmes situations que celles rencontrées avec les faux positifs
mais à des taux moindres, ou bien lors de cas témoignant d'une
infection très ancienne, où le taux d'anticorps est devenu trop
bas.
La confirmation par une autre technique sérologique de
sensibilité supérieure, le Western Blot n'a malheureusement pas
pu être réalisée du fait de sa non disponibilité au
niveau de notre laboratoire.
Conclusion :
Cette étude séro-épidémiologique
permet d'avoir une première idée sur la trichinellose dans la
région de Tlemcen.
Elle fournit la séroprévalence de cette
anthropozoonose ainsi que les facteurs de risque qui lui sont associés
pour la population générale des adultes et des enfants de la
région de Tlemcen.
Nous avons obtenu un taux de séroprévalence de la
trichinellose de 0,33 % et nous avons pu identifier quelques facteurs de risque
associés à cette anthropozoonose.
La consommation de gibiers, de viande chevaline ou autres
viandes inhabituelles (chameau, gazelle, renard, sanglier), sont
significativement associées à la séropositivité
pour Trichinella.
La population devrait être informée de l'existence
de la trichinellose et des mesures à prendre pour en prévenir la
transmission notamment :
· le lavage des mains avec de l'eau et du savon
après avoir manipulé des animaux, des cadavres d'animaux ou de la
viande crue ainsi qu'avant de toucher ou de manger des aliments.
· le port de gants imperméables (caoutchouc ou
latex) et de vêtements protecteurs (combinaison, bottes et lunettes) au
moment du nettoyage et de la préparation du gibier et des animaux
à fourrure.
· la non-consommation de la viande crue ou insuffisamment
cuite, et le
nettoyage de la planche à découper et tous les
ustensiles de cuisine.
Il en est de même pour le personnel médical
concernant les signes et symptômes de la trichinellose, de façon
à les rechercher, en particulier en présence de symptômes
compatibles et d'une fièvre élevée inexpliquée.
En effet, l'intensité de l'expression de la trichinellose
est variable, elle peut être asymptomatique, discrète, se
déclarant dans le cadre d'une toxi-infection alimentaire ou être
très grave voire mortelle.
Au delà de 1000 larves par gramme de muscle, le pronostic
est très sombre et la survie peu probable.
L'intensité des signes est aussi en rapport avec la
sensibilité individuelle de chaque patient.
Par conséquent, la trichinellose ne se manifeste
cliniquement que chez un petit nombre de sujets parasités ayant
ingérés un grand nombre de larves et de ce fait de nombreux cas
sporadiques passeraient inaperçus (Losson B., 1994).
Enfin, avec un peu plus de 5000 cas publiés en Europe,
la trichinellose est classée comme une maladie rare « Orpheline
» déclarée par une groupe appelé Rare Diseases Task
Force (RDTF), qui présente comme objectifs d'élaborer une
stratégie commune et de conseiller la direction de la santé
publique de la commission européenne (SG SANCO, Public Health and
Consumer Protection Directorate Genera et DG SANCO, Direction
générale santé et consommation) sur les maladies rares et
les médicaments orphelins, ceci afin de tenter de venir à bout
des difficultés liées aux maladies orphelines (Lamoril J., et
als, 2007) :
· l'errance diagnostique,
· l'absence d'information tant sur l'accès aux
médecins spécialistes des maladies rares que sur les maladies
rares elles-mêmes ;
· le manque de données scientifiques que ce soit
pour le diagnostic, pour la prévention ou le traitement ;
· l'inégalité d'accès aux
médicaments : certains nouveaux médicaments ne sont pas
accessibles à tous ;
· le manque de formation des médecins aux
maladies rares : outre l'ignorance de nombreux médecins sur l'existence
de maladies rares, d'autres difficultés peuvent apparaître.
Nous espérons que cette étude soit poursuivie par
un échantillon représentatif, de la population de Tlemcen, afin
de situer son importance.
Elle ouvre donc, des perspectives certaines, pour la
connaissance de cette parasitose.
Annexe (1)

Annexe (2)
Fiche de renseignements -Trichinellose-
Identification du patient:
NOM
|
|
PRENOMS
|
|
AGE
|
EMARGEMENT
|
|
Race/Nationalité: Profession:
Commune de résidence: Clinique:
Symptomatologie
|
OUI
|
NON
|
NSP
|
|
Complications
|
OUI
|
NON
|
NSP
|
Troubles digestifs
|
|
|
|
|
|
|
|
Fièvre> 39°C
|
|
|
|
|
|
|
|
Myalgies
|
|
|
|
|
|
|
|
OEdème facial
|
|
|
|
|
|
|
|
|
Autres:
|
|

Nombre de cas familiaux ou dans l'entourage
Date supposée de la contamination
Lieu supposé de la contamination
Cause supposée: Sanglier
|
Cheval
|
Porc
|
Autre
|
|
Provenance: Détaillant
|
Grande surface
|
Chasse
|
Restaurant
|
Autre
|
|
Mode de préparation de la viande: Activité
de chasse/ gibier:
Examens complémentaires:
Biochimie
|
OUI
|
NON
|
NSP
|
|
Hémogramme
|
OUI
|
NON
|
NSP
|
CPK
|
|
|
|
|
|
|
|
LDH
|
|
|
|
|
|
|
|
ASAT-ALAT
|
|
|
|
|
|
|
|
Hypoglycémie
|
|
|
|
|
|
|
|
|
Annexe (3)
Test ELISA Trichinella IgG (EIA-3521) / IVD-
BIO advance- DRG
International, Inc. USA
Indication :
La sérologie ELISA Trichinella spiralis IgG est
utilisée en diagnostic In Vitro, elle est destinée au screening
qualitatif des anticorps IgG dirigés contre Trichinella dans le
sérum.
Principe du test :
Les puits de la microplaque sont coatés avec
l'antigène Trichinella, qui est un antigène
d'excrétion-sécrétion (ES) purifié de la larve de
porcs infectés de haut degré de spécificité pour
Trichinella spiralis.
Durant la première incubation avec les sérums de
patients dilués, tout anticorps qui réagit avec l'antigène
se fixe sur les puits coatés.
Après une étape de lavage pour éliminer
le reste de l'échantillon, le conjugué enzymatique est
ajouté. Si les anticorps se sont fixés sur les puits, le
conjugué enzymatique doit donc se fixer à son tour à ces
anticorps.
Après d'autres séries de lavages, un
chromogène (tétraméthylbenzidine ou TMB) est
ajouté. Si le conjugué enzymatique est présent, la
péroxydase va catalyser une réaction qui consommera le
péroxyde et transforme la couleur du chromogène du clair au
bleu.
L'addition de la solution d'arrêt termine la
réaction et change la couleur bleue en une couleur jaune brillant.
La réaction peut alors être lue visuellement ou
avec un lecteur ELISA .
Précautions d'utilisation des réactifs
:
· Ne pas utiliser les solutions si elles ont
précipité ou sont devenues troubles. La solution de lavage
concentrée peut cristalliser au cours de la conservation à
2-8°C. La cristallisation doit disparaître après sa
dilution.
· Ne pas utiliser un sérum qui peut avoir subi une
croissance microbienne, ou s'il est trouble à cause d'un contenu
lipidique élevé. Les échantillons avec des contenus en
lipides élevés doivent être clarifiés avant
utilisation.
· Traiter tous les sérums comme potentiellement
infectieux. Le contrôle négatif a été testé
et trouvé négatif pour l'antigène de surface de
l'Hépatite B et pour l'anticorps anti-VIH par les méthodes de
tests recommandées. Ce produit doit être utilisé dans le
respect des conditions de sécurité appropriées qui doivent
être respectées pour tout agent infectieux potentiel.
· Ne pas ajouter les azides aux échantillons ou
à tout autre réactif.
Réalisation du test : (figure
n°18)
1. Prélever le nombre de puits nécessaires (deux
pour les contrôles plus le nombre d'échantillons à tester)
et placer les sur le support de barrettes.
2. Ajouter 100 ul (ou deux gouttes) du contrôle
négatif dans le puits N°1, 100 ul du contrôle positif dans le
puits N°2 et 100 ul d'échantillons dilués au 1:64 à
tester dans les puits restants (faire une dilution des sérums des
patients au 1:64 avec le tampon de dilution : nous avons choisi la combinaison
: 10 ul de sérums et 630 ul de tampon de dilution).
Remarque : les contrôles négatif
et positif sont fournis pré-dilués. Ne pas les diluer.
3. Incuber à température ambiante (15 à
25°C) pendant 10 minutes.
4. Eliminer le contenu et laver 3 fois avec le tampon de lavage
dilué. Taper la plaque contre le papier absorbant pour éliminer
l'excès d'humidité. Remarque : les lavages se
font par : remplissage des puits jusqu'à ra-bord, élimination du
contenu et remplissage. Eviter la formation des bulles d'air dans les puits
durant les étapes de lavage.
Nous avons utiliser durant cette étape un laveur
automatique que nous avons réglé selon les modalités de
lavage stipulées sur le kit.
5. Ajouter deux gouttes du conjugué enzymatique dans
chaque puits.
6. Incuber à température ambiante pendant 5
minutes.
7. Eliminer le contenu et laver 3 fois avec le tampon de lavage
dilué. Taper la plaque contre le papier absorbant pour éliminer
l'excès d'humidité.
8. Ajouter deux gouttes du chromogène dans tous les
puits, en travaillant avec un minimum de lumière.
9. Incuber à température ambiante pendant 5
minutes, à l'abris de la lumière.
10. Ajouter deux gouttes de la solution d'arrêt et
mélanger en tapotant le support des barrettes.
Lecture des résultats :
Visuellement : observer à l'oeil nu
chaque puits sur un fond blanc (exemple du papier absorbant) et enregistrer
comme réaction claire ou +, ++ ou +++.
Lecteur ELISA : lecture du zéro sur
l'air.
Fixer les lectures en bichromatique à 450/650-620 nm.
Contrôle de qualité :
L'utilisation des contrôles permet la validation de la
stabilité du kit. Le kit ne doit pas être utilisé si un des
contrôles est hors gamme. Les valeurs attendues pour les contrôles
sont :
Négatif : 0.0 à 0.3 unités
de DO
Positif : 0.5 unités de DO et plus
Interprétation des résultats - lecteur
ELISA :
Faire le zéro du lecteur ELISA sur air. Lire tous les
puits à 450/650-620 nm.
Négatif : absorbance lue inferieure
à 0.1 unités de DO
Positif : absorbance lue supérieure ou
égale à 0.3 unités de DO
Une DO lue négative indique que le patient n'a pas un taux
détectable en anticorps. Ceci est dü à l'absence d'infection
ou à une réponse immune très faible chez le patient.
Les critères d'interprétation de l'analyse
sérologique par ELISA (IVD Inc.) Trichinella spiralis IgG se
basent sur le degré de la coloration éventuellement
développée, qui est appréciée par la mesure de la
densité optique (DO) à l'aide d'un lecteur ELISA à 450/620
nm :
Une DO < 0,1 unités est considérée comme
résultat négatif ;
Une DO = 0,3 unités est considérée comme
résultat positif.
La persistance des anticorps IgG anti-Trichinella dure
de neuf à dix huit mois.

86

Bibliographie: (ouvrages et articles)
· Agence Nationale de Développement de
l'Investissement (A.N.D.I.), Ministère de l'Industrie et de la
Population des Investissements, Wilaya de Tlemcen- Potentialités
d'investissement et perspectives de développement ; 2006.
· Akkoc N, Kuruuzum Z, Akar S, Yuce A, Onen F, Yapar N,
Ozgenc O, Turk M, Ozdemir D, Avci M, Guruz Y, Oral AM, Pozio E; Izmir
Trichinellosis Outbreak Study Group. A large-scale outbreak of trichinellosis
caused by Trichinella britovi in Turkey. Zoonoses Public Health, 2009
Mar;56(2):65-70.
· Ancelle T. History of trichinellosis outbreaks linked to
horse meat consumption 1975-1998. Eurosurveillance, 1998, 3, 86-89.
· Andiva S., Yera H., Haeghebaert S., Tourte-Schaefer C.,
Magnaval J.F., Dupouy-Camet J. Evaluation comparative d'un test d'agglutination
au latex, de deux tests Elisa et d'un test western blot pour le diagnostic
sérologique de la trichinellose humaine. Annales de Biologie
Clinique., 2002, 60 : 79-83.
· Appleton J.A., Bell R.G., Homan W. & Van Knapen F.
Consensus on Trichinella spiralis antigens and antibodies.
Parasitology Today, 1991, 7, 190- 192.
· Barabé P, Motte M, Larbi M, Thomas D, Bobin P,
Foullon X, La trichinose aiguë : à propos de 2 observations
algériennes. Méd Armées, 1977,
5, 37-40.
· Beiting DP, Bliss SK, Schlafer DH, Roberts VL,
Appleton JA. Interleukin-10 limits local and body cavity inflammation during
infection with muscle-stage Trichinella spiralis. Infect
Immun, 2004;72:3129-37.
· Bell R.G. The generation and expression of immunity to
Trichinella spiralis in laboratory rodents. Adv. Parasitol.,
1998, 41: 149-217.
· Boadella M., Barasona J.A. , Pozio E., Montoro V.,
Vicente J., Gortazar C., Acevedo P. Spatio-temporal trends and risk factors for
Trichinella species infection in wild boar (Sus scrofa)
populations of central Spain: a long-term study. International Journal for
Parasitology, (June 2012).
· Boireau P., Vayssier M., Fabien J.F., Perret C., Calamel
M., Soule C. Characterization of eleven antigenic groups in Trichinella
genus and identification of stage and species markers.
Parasitology, 1997, 115: 641-651
· Boireau P. et al. Outils de la biologie
moléculaire appliqués à
l'épidémiologie
des trichinelloses animales,
Epidémiol. et
santé anim., 2001, 39 : 75-84.
· Bokken G.C.A.M., van Eerden E., Opsteegh M.,
Augustijn M., Graat E.A.M.,
Franssen F.F.J., Görlich K., Buschtöns
S., Tenter A.M., van der Giessen
J.W.B., Bergwerff A.A., van Knapen F., Specific serum antibody
responses following a Toxoplasma gondii and Trichinella
spiralis co-infection in swine. Veterinary Parasitology 184
(2012) 126- 132.
· Bourrée P., Aide mémoire de parasitologie
et de pathologie tropicale, 4ème édition, Médecine
sciences Flammarion, 2008.
· Bradley M., Horton J., Assessing the risk of
benzimidazole during pregnancy. Trans, roy. Soc. trop. Med. Hyg.,
2001, 95 : 72-73.
· Bruschi, F., Tassi, C., Pozio, E., Parasite-specific
antibody response in Trichinella sp. 3 human infection: a one year
follow-up. Am J Trop Med Hyg,1990, 43, 186-193.
· Bruschi F., Moretti A., Wassom D. Piergili-Fioretti D.
The use of a synthetic antigen for the serological diagnosis of human
trichinellosis. Parasite, 2001, 8, S141-S143.
· Cameron, A.R., The consequences of risk-based
surveillance: Developing output-based standards for surveillance to demonstrate
freedom from disease. Preventive Veterinary Medicine (2012).
· Capo V., Despommier D.D., Clinical Aspects of Infection
with Trichinella spp. CLINICAL MICROBIOLOGY REVIEWS, American
Society for Microbiology, Jan. 1996, Vol. 9, No. 1, p. 47-54
· Chassaing J., P.. Contribution à l'étude de
la trichinose du sanglier (Sus scrofa L., 1758). Résultats
d'une étude épidémiologique dans le camp militaire de
Canjuers (VAR). thèse pour obtenir le grade de docteur
vétérinaire ; présentée et soutenue publiquement en
2001 devant l'université Paul-Sabatier de Toulouse.
· Chomel BB., Kasten R., Adams C., Lambillotte D., Theis
J., Goldsmith R., Koss J., Chioino C., Widjana DP., Sutisna P., Serosurvey of
some major zoonotic infections in children and teenagers in Bali,
Indonesia. Southeast Asian J Trop Med Public Health. 1993
Jun;24(2):321-6.
· CNR des Trichinella, Paris, site web:
http://monsite.wanadoo.fr/cnrdestrichinella/.
· Cui J., Wang Z.Q., Xu B.L., The epidemiology of human
trichinellosis in China during 2004-2009. Acta Tropica 118 (2011)
1-5
· Dea-Ayuela M.A., Romaris F., Ubeira F.M.,
Rama-Iniguez S., Martinez-
Fernandez A., Bolas F. Possible presence of common
tyvelose-containing glycans in Trichinella L1 larvae and embryonated
eggs of several helminths. Parasite, 2001, 8, S120-S122.
· De Bruyne A., Delanos-Grégoire N., Ancelle T.,
Dupouy-Camet J., La trichinellose : un risque parasitaire persistant en France.
Spectra Biologie n°153 ; Juin-Juillet 2006.
· De Bruyne A., Vallée I., Ancelle T.,
Brochériou I., Bonafé A., Boireau P., Dupouy-Camet J.
Trichinelloses. EMC (Elsevier Masson SAS, Paris), Maladies
infectieuses, 8-517-A-10, 2006
· De Graef M. Smadja P., Benis J., Turpin F., Liouane M.,
Viaud B., et al., Neurotrichinose : à propos d'une observation
documentée par IRM. Journal de Radiologie, 2000, 81:
817-819.
· Despommier D.D., Trichinella spiralis: the worm
that would be virus. Parasitol. Today, 1990, 6:
193-196.
· Despommier D.D., How does Trichinella spiralis
make itself at home? Parasitol. Today, 1998, 14
: 318-323.
· Despommier D.D., Gwadz R., Hotez P., Knirsch C.,
Trichinella spiralis, Parasitic diseases; Apple Trees Producions,
LLC; 4th edition (September 30, 2000), chapter 21, pp. 125-132.
· Dieusaert P., Guide pratique des analyses
médicales, 4éme édition, Maloine, 2005.
· Doby JM. Couatarmanac'h A, Campion JP, Beurton D, Gendre
B. Trichinose humaine et immunodépression. Un cas chez un greffé
rénal. Med Mal Infect 1984;14:293-8.
· Dorosz P., Guide pratique des médicaments,
29ème édition, Maloine, 2010.
· Drake E. H., Hawkes R. S., Mortimer Warren , AN EPIDEMIC
OF
TRICHINOSIS IN MAINE. JAMA. 1935;105(17):1340-1343.
· Dupouy-Camet J., Kociecka W., Bruschi F., Bolas Fernandez
F., Pozio E., Opinion on the diagnosis and treatment of human trichinellosis.
Expert Opin. Pharmacother., 2002, 3 : 1117- 1130.
· Dupouy-Camet J. et Murrell K.D., FAO/WHO/OIE
guidelines for the
surveillance, management, prevention and control of
trichinellosis, World Organisation for Animal Health Press, Paris, 2007.
· Dupouy-Camet J., Talabani H., Ancelle T., Trichinellose:
une zoonose parasitaire bien contrôlée en France. La Revue du
Praticien, 2010, 60 : 159- 164.
· Euzeby J., Une vieille anthropozoonose toujours actuelle
: la trichinose. Revue Méd. Vét., 1994,
145, 11, 795-818
· Fabre M. V., Beiting D. P., Bliss S. K., Appleton J. A.,
Immunity to Trichinella spiralis muscle infection. Veterinary
Parasitology 159 (2009) 245- 248
· Finkelman F.D., Shea-Donohue T., Goldhill J., Sullivan
C.A., Morris S.C., Madden K.B. et al., Cytokine regulation of host defence
against parasitic gastrointestinal nematodes : lessons from studies with rodent
models. Annu. Rev. Immunol., 1997, 15: 505-533.
· Gérard, R., Petite épidémie de
trichinose en Algérie. Revue Médecine Navale 1, 1946,
355-362 ; In : Nezri, M., Ruer, J., De Bruyne, A., Cohen-Valensi, R., Pozio,
E., Dupouy-Camet, J.,. Première observation d'un cas humain de
trichinellose à Trichinella britovi en Algérie
après consommation de viande de chacal (Canis aureus).
Bull. Soc. Pathol. Exotique 99, 2006, 94-95.
· Gamble H.R., Anderson W.R., Graham C.E. & Murrell
K.D. Diagnosis of swine trichinosis by enzyme-linked immunosorbent assay
(ELISA) using an excretory-secretory antigen. Veterinary Parasitology,
1983, 13, 349-361.
· Gamble H.R., Wisnewskin., Wassom D. Detection of
trichinellosis in swine by enzyme immunoassay using a synthetic glycan antigen.
American Journal of Veterinary Research, 1997, 58,
417-421.
· Gamble H.R., Pozio E., Bruschi F., Nöckler K., Kapel
C. M. O., Gajadhar A. A., International Commission on Trichinellosis :
Recommendations on the Use of Serological Tests for the Detection of
Trichinella Infection in Animals and Man. 2004
· Grencis R.K., Crawford C., Pritchard D.I., Behnke J.M.,
Wakelin D. Immunization of mice with surface antigens from the muscle larvae of
Trichinella spiralis. Parasite Immunology, 1986, 8,
587-596.
· Harms G, Binz P, Feldmeier H, Zwingenberger K,
Schleehauf D, Dewes W, et al. Trichinosis: a prospective controlled study of
patients ten years after acute infection. Olin Infect Dis
1993;17:637-43.
· Hodda M., Monograph in Animalia Biodiversity, Zootaxa
3148. Magnolia Press, December 2011 ; pp 63-95.
· Houzé S., Ancelle T., Matra R., Boceno C., Carlier
Y., Gajadhar A. A., Dupouy-Camet J., Trichinellosis acquired in Nunavut, Canada
in September 2009 : meat from grizzly bear suspected. Euro Surveill.
2009;14(44):
· Howard H. Steel, Orthopedic Considerations of
TrichinosisReport of a Patient With Osseous Complaints and Myoperiosteal Larval
Infiltration. JAMA. 1964;187(8):619-620.
· Jacobson ES, Jacobson HG. Trichinosis in an
immunosuppressed human host. Am J Olin Pathol
1977;68:791-4.
· Jasmer DP. Trichinella spiralis and subversion
of differentiated mammalian skeletal muscle cells. Parasitol Today,
1995;11:185-8.
· Kapel C.M.O. & Gamble H.R. Infectivity,
persistence, and antibody response to domestic and sylvatic Trichinella
spp. in experimentally infected pigs. Int. J. Parasitol., 2000,
30, 215-221.
· Khamboonruang C. The present status of trichinellosis in
Thailand. Southeast Asian J. trop. Med. public Hith,1991, 22,
312-315.
· Khan WI, Vallance BA, Blennerhassett PA, Deng Y, Verdu
EF, Matthaei KI, et al. Critical role for signal transducer and activator of
transcription factor 6 in mediating intestinal muscle hypercontractility and
worm expulsion in Trichinella spiralis- infected mice. Infect
Immun 2001;69:838-44.
· Klenner Fred R., The Treatment of Trichinosis with
Massive Doses of Vitamin C and Para-Aminobenzoic Acid. Tri-State Medical
Journal, April 1954, Vol. 2, No. 2, pp. 25-30.
· Kociecka W., Trichinellosis: human disease, diagnosis and
treatment. Vet. Parasitol., 2000, 93 : 365-383.
· Korti Mohamed, Guide touristique de Tlemcen et de sa
région. Edition de l'Office du Tourisme de Tlemcen, 1994,
Imprimerie « Ibn Khaldoun » Tlemcen.
· Kang Shin Ae, Cho Min Kyoung, Park Mi-Kyung, Kim
Dong-Hee, Hong Yeon Chul, Lee Yong Seok, Cha Hee-Jae, Ock Mee Sun, Yu Hak Sun,
Alteration of helper T-cell related cytokine production in splenocytes during
Trichinella spiralis infection. Veterinary Parasitology 186 (2012)
319- 327.
· Lachkar S., Abbouda P., Garagala G., Etienne M., Gauliard
E., Tron C., Favennec L., Gueit I., Caron F., Dupouy-Camet J., Myocardite
asymptomatique au cours d'un cas de trichinellose :
intérét du dosage de la troponine. La Revue de
médecine interne, 2008, 29 : 246-248.
· Lamoril J., Bogard M., Ameziane N., Deybach J.-C.,
Bouizegarène P., Les maladies rares (ou orphelines) : organisation
générale de leur prise en charge en 2007. Immuno-analyse et
biologie spécialisée 22 (2007) 282-297.
· La rosa G., Pozio E., Rossi P., Murrell K.D. Allozyme
analysis of Trichinella isolates from various host species and geographical
regions. J. Parasitol. 1992, 78: 641-646.
· La Rosa G., Marucci G., Zarlenga D.S. & Pozio E.
Trichinella pseudospiralis populations of the Palearctic region and
their relationship with populations of the Nearctic and Australian regions.
Int. J. Parasitol., 2001, 31,297-305.
· La rosa G., Marucci G., Zarlenga D.S., Casulli A., Zarnke
R.L., Pozio E., Molecular identification of natural hybrids between
Trichinella nativa and Trichinella T6 provides evidence of
gene flow and ongoing genetic divergence. Int. J. Parasitol., 2003,
33: 209-216.
· Losson B., La faune sauvage et les anthropozoonoses
parasitaires, Ann. Méd. Vét., 1994,
138, 269-275
· Louthrenoo W, Mahanuphab P, Sanguanmitra P, Thamprasert
K. Trichinosis mimicking polymyositis in a patient with human immunodeficiency
virus infection. Br J Rheumatol 1993;32: 1025-6.
· Marincu Iosif, Neghina Adriana Maria, Calma Crenguta
Livia, Neghina Raul, New foci of trichinellosis in Western Romania, 2011,
Acta Tropica 121 (2012) 47- 49
· Mendez-Loredo B, Martinez Y, Zamora R, Chapa-Ruiz R,
Salinas-Tobon R. Class specific antibody responses to newborn larva antigens
during Trichinella spiralis human infection. Parasite
2001;8:152-7.
· Millet, N.B., GD, H., TA, R., MR, Z., PK, L.,
Mummification for the common people In: E.Cockburn, A.C.a. (Ed.) Mummies,
Disease and Ancient Cultures. Cambridge University Press, Cambridge, 1980,
pp. 71-74.
· Mougeot C., Conduite des examens en parasitologie,
5ème édition, Masson, 1995.
· Nagano I., Wu Z., Matsuo I., Pozio E., Identification of
Trichinella genotypes by polymerase chain reaction-restriction
fragment length polymorphism of mitochondrial cytochrome c oxidase subunit I
gene. Int. J. Parasitol., 1999, 29 : 1113-1120.
· Neghina Raul, Iacobiciu Ioan, Neghina Adriana Maria,
Marincu Iosif, Trichinellosis, another helminthiasis affecting the central
nervous system. Parasitology International 60 (2011) 230.
· Neghina Raul, Moldovan Roxana, Marincu Iosif, Calma
Crenguta L., Neghina Adriana M., The roots of evil: the amazing history of
trichinellosis and Trichinella parasites. Parasitol Res (2012)
110:503-508.
· Nelson G.S. Trichinosis in Africa. In
Trichinosis in man and animals (S.E. Gould, ed.). C.C. Thomas
Publisher, Springfield, 1970, 473-492.
· Nezri, M., Ruer, J., De Bruyne, A., Cohen-Valensi, R.,
Pozio, E., DupouyCamet, J.,. Première observation d'un cas humain de
trichinellose à Trichinella britovi en Algérie
après consommation de viande de chacal (Canis aureus).
Bull. Soc. Pathol. Exotique 99, 2006, 94-95.
· Office International des Epizooties. Manual of standards
for diagnostic tests and vaccines, Paris, France, 322-327, 2000.
· Office National des Statistiques (O.N.S.) Algérie,
Population résidente par âge, par sexe et par wilaya ; 2008.
· Ortega-Pierres M.G., Yepez-Mulia L., Homan W., Gamble
H.R., Lim P., Takahashi Y., Wassom D.L., Appleton J.A. Workshop on a detailed
characterization of Trichinella spiralis antigens: A platform for future
studies on antigens and antibodies to this parasite. Parasite Immunology, 1996,
18, 273-284.
· Owen I.L., Pozio E., Tamburrini A., Danaya R.T., Bruschi
F., Gomez Morales M.A. Focus of human trichinellosis in Papua New Guinea.
American Journal of Tropical Medicine and Hygiene, 2001, 65,
553-557.
· Ozdemir D., Ozkan H., Akkoc N., Onen F., Gurler O.,
Sari I., Akar S., Birlik
M., Kargi A., Ozer E., Pozio E., Acute trichinellosis in
children compared with adults. Pediatr Infect Dis., 2005,
24: 897-900.
· Pannozzo Anthony N., Johnson Ernest W., The
Electromyogram in the Diagnosis of Trichinosis. JAMA.
1965;193(7):616-618.
· Parc national de Tlemcen, Phase A du plan de gestion II,
2006-2010, phase descriptive et analytique.
· Poirrier M., La trichinellose : mise au point des
connaissances en 2010, thèse présentée pour
l'obtention du titre de docteur en pharmacie, diplôme d'état ;
université Joseph Fourier, faculté de pharmacie de Grenoble,
2010.
· Pozio E, La Rosa G, Rossi P, Murrell KD. Biological
characterisation of Trichinella spiralis: Behavior, structure, and
biochemistry of larvae following exposure to components of the host enteric
environment. Exp. Parasitol., 1987, 63: 195-202.
· Pozio E., La rosa G., Murrell K.D., Lichtenfels J.R.,
Taxonomic revision of the genus Trichinella. J. Parasitol.,
1992, 78: 654-659.
· Pozio, E., Varese, P., Morales, M.A., Croppo, G.P.,
Pelliccia, D., Bruschi, F., Comparison of human trichinellosis caused by
Trichinella spiralis and by Trichinella britovi. Am J
Trop Med Hyg, 1993, 48, 568-575.
· Pozio E., La Rosa G., Trichinella murrelli :
etiological agent of sylvatic trichinellosis in temperate areas of North
America. J. Parasitol. 2000, 86 : 134-139.
· Pozio E., Sofronic-Milosavljevic L., Gomez Morales M.A.,
Boireau P., Nöckler K.. Evaluation of ELISA and Western blot analyses
using three antigens to detect anti-Trichinella IgG in horses.
Veterinary Parasitology, 2002a, 108, 163-178.
· Pozio E., Foggin C.M., Marucci G., La Rosa G., Sacchi L.,
Corona S., Rossi P., mukaratirwa S., Trichinella zimbabwensis, a new
non-encapsulated species from crocodiles (Crocodylus niloticus) in
Zimbabwe also infecting mammals. Int. J. Parasitol., 2002b, 32
: 1787-1799.
· Pozio E., Zarlenga D.S., Recent advances on the taxonomy,
systematics and epidemiology of Trichinella. International Journal for
Parasitology, 2005, 35: 1191-1204.
· Pozio E., Murrell K.D., Systematics and Epidemiology
of Trichinella. Advances in Parasitology, 2006, 63
: 367-439.
· Pozio E., Taxonomy, biology and epidemiology of
Trichinella parasites. FAO/WHO/OIE Guidelines for the surveillance,
management, prevention and control of trichinellosis, chapter 1, pp.
14-48, 2007.
· Pozio E., World distribution of Trichinella spp.
infections in animals and humans. Veterinary Parasitology, 149, 2007,
3-21.
· Pozio E., Hoberg E., La Rosa G., Zarlenga D. S.,
Molecular taxonomy, phylogeny and biogeography of nematodes belonging to the
Trichinella genus. Infection, Genetics and Evolution 9 (2009)
606-616.
· Ramaswamy K., Negrao-Correa D., Bell R., Local intestinal
immune responses to infections with Trichinella spiralis : realtime,
continuous assay of cytokines in the intestinal (afferent) and efferent
thoracic duct lymph of rabitts. J. Immunol., 1996,
156: 4328-4337.
· Reason A.J., Ellis L.A., Appleton J.A., Wisnewski N.,
Grieve R.B., Mcneil M., Wassom D.L., Morris H.R., Dell A. Novel
tyvelose-containing tri- and tetra-antennary N-glycans in the immunodominant
antigens of the intracellular parasite Trichinella spiralis.
Glycobiology, 1994, 4, 593-603.
· Ripert C., Epidémiologie des maladies
parasitaires, Lavoisier, Paris, 2007 ; In : Poirrier M., La
trichinellose : mise au point des connaissances en 2010, thèse
présentée pour l'obtention du titre de docteur en pharmacie,
diplôme d'état ; université Joseph Fourier, faculté
de pharmacie de Grenoble, 2010.
· Roumier M., Milhe Ph. Hautefort B., Benoist B., Quatre
cas de trichinose en Camargue par consommation de viande de sanglier,
Méd. Mal. Infect., 1992, 22, 947-948
· Ruitenberg E.J., Steerenberg P.A., Brosi B.J., Buys J.
Serodiagnosis of Trichinella spiralis infections in pigs by
enzyme-linked immunosorbent assays. Bulletin of the World Health
Organization, 1974, 51, 108-109.
· Ruitenberg E.J., Van Knapen F. Enzyme-linked
immunosorbent assay (ELISA) as a diagnostic method for Trichinella spiralis
infections in pigs. Veterinary Parasitolology, 1977, 3,
317-326.
· Sandoval Luz Ofelia Franco, Caballero Garcia Maria
de Lourdes, Hernandez Gabriela Rebeles , Garcia Maria Alejandra Moreno, Cardoso
Enedina Jiménez, Molecular similarities and differences between
Trichinella spp., isolated from canine skeletal muscle in Zacatecas,
Mexico. Experimental Parasitology 131 (2012) 148-152.
· Sattmann Helmut, Prosl Heinrich, Zur Geschichte der
Trichinenforschung in Österreich. HELMINTHOLOGISCHE FACHGESPRÄCHE,
2005.
· Seawright G.L., Despommier D., Zimmermann W. &
Isenstein R.S. Enzyme immunoassay for swine trichinellosis using antigens
purified by
immunoaffinity chromatography. American Journal of Tropical
Medicine and Hygiene, 1983, 32, 1275-1284.
· Skripova L.V. & Kovchur V.N., Trichinellosis in
Byelorussia. Wiadom. Parazytol., 1994, 40, 389-391.
· Stewart G.L., Despommier D.D., Burnham J., Raines K.M.
Trichinella spiralis: Behavior, structure, and biochemistry of larvae
following exposure to components of the host enteric environment. Exp.
Parasitol., 1987, 63: 195- 202.
· Stewart G.L., Despommier D.D., Burnham J., Raines K.M.
Trichinella isolates from various host species and geographical region. J
Parasitol 1992;78:647- 53.
· Touratier L., Ripert Christian, Epidémiologie des
maladies parasitaires, chapitre VI- Trichinellose. Editions
Médicales Internationales, Paris, 1998.
· Villela J.B.. Life cycle and morphology. Trichinellosis
in Man and Animals. S.E. Gould Ed., Charles C. Thomas, Springfield,
Illinois, 1970, 19-60
· Wisnewskin N., Mcneil M., Grieve R.B., Wassom D.L.
Characterization of novel fucosyl and tyvelosyl-containing glycoconjugates from
Trichinella spiralis muscle stage larvae. Molecular and
Biochemical Parasitology, 1993, 61, 25-35.
RESUME
Nous avons réalisé une étude
séro-épidémiologique dans le but de déterminer la
situation de la trichinellose dans la population Tlemcenienne.
Nous avons donc ciblé une population globale, chez qui
nous avons tenté de réunir le plus d'informations pour nous
rapprocher des définitions référentielles.
Cette étude fournit la séroprévalence de
cette anthropozoonose ainsi que les facteurs de risque qui lui sont
associés pour la population générale adulte et enfant de
la région de Tlemcen.
La consommation de certaines viandes est significativement
associée à la séropositivité pour
Trichinella.
La population devrait être informée de l'existence
de la trichinellose et des mesures à prendre pour en prévenir la
transmission, il en est de même pour le personnel médical
concernant les signes et symptômes de la trichinellose, de façon
à les rechercher, en particulier en présence de symptômes
compatibles et d'une fièvre élevée inexpliquée. En
effet, l'intensité de l'expression de la trichinellose est variable,
elle peut être asymptomatique, discrète, se déclarant dans
le cadre d'une toxi-infection alimentaire ou être très grave voire
mortelle.
Au delà de 1000 larves par gramme de muscle, le pronostic
est très sombre et la survie peu probable.
L'intensité des signes est aussi en rapport avec la
sensibilité individuelle de chaque patient.
Par conséquent, la trichinellose ne se manifeste
cliniquement que chez un petit nombre de sujets parasités ayant
ingérés un grand nombre de larves et de ce fait de nombreux cas
sporadiques passeraient inaperçus.
Mots dles : Trichinella, Tlemcen,
sérologie, épidémiologie, séroprévalence,
anticorps.
| 


