|
A l'Eternel Dieu de récompense,
A toute
la famille BARUKA,
A tous les hommes courageux qui croient en une
réussite méritée après un travail
ardu
Je dédie ce travail BARUKA
GRACE
REMERCIEMENTS
Nous voulons à travers ces lignes, nous acquitter de
l'humble devoir d'exprimer notre reconnaissance à tous ceux qui ont
posé une pierre à l'édification de notre «
identité ».
Nos remerciements s'adressent avant tout au Professeur
Ordinaire DUDU AKAIBE et aux Chef de Travaux Jean Claude MUKINZI ITOKA pour
avoir respectivement accepté de diriger et d'encadrer ce travail
malgré leurs diverses occupations.
Nous restons reconnaissants envers tous les enseignants de la
Faculté d&é Sciences pour leurs conseils et orientations.
Que nos parents BARUKA MANENO et UMUNGA YANANA Charlotte
trouvent à travers ces lignes l'expression de notre sentiment de
reconnaissance pour leur amour et les sacrifices consentis dans la
réussite de notre formation.
Nous témoignons notre gratitude à tous nos
soeurs et frères de la famille BARUKA : Salama BARUKA, Jethro BARUKA,
Dodo BARUKA, Rachel BARUKA, Dan BARUKA, David BARUKA, Aimé BARUKA et
Benedi BARUKA pour leur encouragement et amour.
Nous remercions également tous les ami(e)s et camarades
dont le soutien sans faille nous a permis d'atteindre notre objectif.
Nos remerciements s'adressent également à toute
personne qui, de près ou de loin ; nous a porté assistance tout
au long de notre vie universitaire.
BARUKA GRACE
INTRODUCTION
1. GENERALITES
De nos jours, à travers le monde, la famille de
Soricidae est la plus vaste dans l'ordre de Soricomorpha (Gambalemoke,
2008).
Cette famille comprend 26 genres et 376 espèces contre
45 genres et 428 espèces de Musaraigne connues au monde. Elle est
subdivisée en trois sous familles qui sont Crocidurinae, Myosoricinae et
Soricinae. Parmi celles ci, seules les Crocidurinae et Myosoricinae sont
présentes en Afrique avec 9 genres (Congosorex, Crocidura,
Paracrocidura, Surdisorex, Rwenzorisorex, Suncus, Sylvisorex et Scutisorex) et
147 espèces .8 de ces 9 genres africains, à l'exception de
Surdisorex, et 48 espèces sont représentées en
République Démocratique du Congo (Mukinzi, 2009).
La méconnaissance des communautés des
Musaraignes en Afrique tropicale tient notamment aux difficultés de
capture mais surtout de l'identification spécifique, souvent
réalisable uniquement à partir des crânes (Barrière
et al, 2000).
Aucune partie du corps des Mammifères n'est plus propre
que le crane par la richesse de ses caractères, les
particularités spécifiques de l'animal sous une forme durable et
apparemment rigide (Klatt, 1949 in Grassé, 1967). Son importance dans
les études taxonomiques ne cesse de croitre malgré les
avancées apportées par les études moléculaires
(Nicolas et al, 2006).
Plusieurs études sur les petits mammifères ont
attesté l'utilité des analyses morphométriques notamment
celles de Van Der Straeten(1984), Mys et al(1985).Elles ont prouvé que
les mesures biométriques permettent de différencier les
espèces dans ce groupe. Et selon Van Der Straeten et Verheyen (1981), la
séparation biométrique entre deux espèces est obtenue soit
à base des caractères extérieurs et crâniens, soit
uniquement à base des caractères crâniens.
C'est dans ce cadre que l'on peut citer les études
biométriques réalisées par Van Der Straeten(1984) sur deux
sous- espèces du genre Dephomys de la côte d'Ivoire dans le but de
constater une éventuelle distinction biométrique entre elles
ainsi que sur deux genres Dephomys et Stochomys afin de trouver
d'éventuelles indications biométriques, permettant de
déterminer la situation taxonomiques de ces deux genres.
Selon Van Der Straeten et Verheyen (1981), la taxonomie du
genre Praomys (petit mammifère comme les Musaraignes) a toujours
été une histoire obscure, jusqu'au moment où quelques
chercheurs (Petter, 1965 ; Rosevear, 1969 et Eisentraut, 1970) sur base des
caractères crâniens et chromosomiques apportèrent quelque
clarté.
Chez les Primates des études effectuées sur le
Colobus verus (Verheyen, 1962) ont démontré qu'il est
possible, par des données craniométriques, de le
caractériser par rapport à tous les autres Colobinae africain.
S'il est prouvé qu'il est difficile de se passer des études
craniométriques dans la détermination taxonomique chez les grands
et les petits mammifères, il est encore davantage chez les Musaraignes
(Soricidae) où les individus présentent une similarité
morphologique déconcertante. C'est à ce titre que des
espèces nouvelles ne cessent de s'ajouter partant des études
biométriques entreprises et confirmée par le
séquençage moléculaires. Nous pouvons à titre
d'exemple citer, Hutterer et Schlitter (1996), Hutterer et al (2009), Mukinzi
et al (2009), Kerbis et al (2008), Quérouil et al (2003).
L'age des animaux peut être estimé en fonction de
leur usure dentaire et leur poids (Nicolas et al, 2003).
Il est largement admis que pour décrire et comprendre
la structure des communautés, il est nécessaire de prendre en
compte sa variabilité à la fois dans le temps et l'espace
(Nicolas, 2005).
2. PROBLEMATIQUE
Etant donné que le milieu peut avoir une influence sur
la morphologie des organismes au fil du temps, existerait il une
différence craniométrique entre des individus appartenant
à Crocidura olivieri ou à Scutisorex somereni
des différents blocs et localités. Par exemple, le crâne de
Crocidura olivieri de la rive gauche serait il identique à
celui de la rive droite ou celui de Masako aurait il les mêmes mesures
que celui de la Yoko ?
Le travail d'Akuboy (2009) était axé seulement
sur la recherche du dimorphisme sexuel secondaire à partir des mesures
craniométriques. Le nôtre, en plus du dimorphisme sexuel sur bases
de caractères craniométriques, se penche sur les
variabilités inter localités et inter blocs des populations
étudiées.
Partant de ce qui précède, nous pensons que
notre étude serait un apport supplémentaire dans le domaine de la
craniométrie pour ces deux espèces.
Chez les petits mammifères en général et
plus particulièrement les Musaraignes, il n'est pas assez facile de
déterminer la classe d'age à la quelle appartiennent les
individus à partir de leur morphologie externe.
Contrairement à Dudu (1991) et d'autres auteurs qui ont
utilisé le poids et les caractères reproductifs qui pourraient
varier selon les circonstances, nous estimons que l'état de l'usure
dentaire et de la fusion de la suture entre le basioccipital et
basisphénoïde permettraient d'établir avec un peu plus de
certitude la structure des populations des petits mammifères.
3. HYPOTHESE

Les populations étudiées présenteraient les
mêmes caractéristiques quelque soient leur localisation.
Toutes les mesures craniométriques seraient stables au
sein de ces deux populations. La structure des populations
étudiées serait dominée par les adultes et subadultes. Par
ailleurs les juvéniles et les séniles seraient moins
représentés.
4. OBJECTIFS
Dans ce travail, nous nous proposons de :
v' Déterminer sur base des mesures
craniométriques, les variabilités intraspécifiques des
espèces étudiées au sein d'un méme bloc forestier,
entre les divers blocs ainsi qu'entre les diverses localités où
sont issus les collections.
v' Vérifier au moyen des analyses statistiques des
variables permettant de distinguer les individus au sein des populations
étudiées.
v' Déterminer les différentes classes d'age de
la collection des Musaraignes étudiées selon les blocs forestiers
à partir de l'état de l'usure dentaire et de la fusion de la
suture entre le basioccipital et le basisphénoïde.
5. INTERETS
Ces données permettront d'identifier les mesures
craniométriques fiables pouvant permettre de ressortir
d'éventuelles variations au sein de ces espèces.
Ce travail est un apport important à la connaissance de la
structure des populations de Crocidura olivieri et Scutisorex
somereni.
6. TRAVAUX ANTERIEURS
Plusieurs études biométriques sur les petits
mammifères ont déjà été effectuées
à travers le monde. Parmi celles-ci, nous citons : Mys et al(1985) sur
l'étude biométrique de Sorex aranaeus et
S.coronatus, Van Der Straeten(1984) sur l'étude
biométrique des genres Delphomys et Stochomys, etc
Dans la région de Kisangani, nous comptons aussi
beaucoup d'étude sur les petits mammifères, divers aspects
confondus, notamment Ngongo (1987) sur la craniométrie des Muridae ;
Dudu (1991) et Mukinzi (1999) sur le peuplement des Insectivores et Rongeurs ;
Luzembe (1991), Otepa (1994) et Iyongo (1997) sur la structure de population de
Rongeurs ;Mukinzi (2009) sur la composition et la structure du peuplement des
Musaraignes,Gambalemoke (2008) sur la biodiversité des Musaraignes,
Katuala (2009) sur la biodiversité et biogéographie des Rongeurs
; etc
Le plus récent travail sur les Musaraignes plus
particulièrement sur la craniométrie de Crocidura
olivieri et Scutisorex somereni est celui d'Akuboy (2009).
CHAPITRE 1. MILIEU D'ETUDE
Les Soricidae qui constituent l'objet de ce travail ont
été capturés dans les localités se trouvant sur les
deux rives du fleuve Congo et sur les iles.
1.1. RIVE DROITE 1.1.1. Masako
Nommée CEFOC (Centre d'Ecologie Forestière au
Congo), la réserve de Masako est située à 14 km au
Nord-est de la ville de Kisangani, sur l'ancienne route Buta. Elle a une
superficie de 2105 ha et est entièrement comprise dans une grande boucle
de la rivière Tshopo.
En effet, cette réserve se trouve dans la
collectivité de Lubuya-Bera, commune de la Tshopo, ville de Kisangani.
Ses coordonnées géographiques sont respectivement 0° 36'N et
25° 13' E, avec une altitude moyenne de 500 m.
Masako et ses environs jouissent globalement du climat de
Kisangani, nonobstant quelques petites modifications liées au couvert
végétal de la réserve et à son hydrographie qui est
assez dense .Kisangani est comprise dans la zone bioclimatique de la
forêt dense ombrophile sempervirente équatoriale.
Cette zone est caractérisée par un climat de
type «Afi» de la classification de Koppen. Dans la dite
classification « A » désigne un climat chaud avec les douze
moyennes mensuelles supérieures à 18°c ; « f » le
climat humide dont la pluviosité est repartie sur toute l'année,
c'est-à-dire sans saison sèche absolue et dont la hauteur
mensuelle des pluies du mois le plus sec est supérieur à 60 mm ;
et « i » signale une très faible amplitude thermique.
Les forêts de la région de Kisangani se classent
dans la catégorie des forêts ombrophiles sempervirentes
équatoriales (Juakaly, 2007).
1.1.2. Maïko
Cette localité est située sur la rive gauche de la
rivière Maïko, à 00° 09'N, 25° 34'E ,443 m
d'altitude, au point kilométrique 65 sur l'axe routier
Kisangani-Lubutu.
La végétation de cette contrée est
constituée de forêts denses originelles et caractéristiques
de la région et les divers stades de leur reconstitution après
les dégradations naturelles et anthropiques. On y rencontre la
forêt primaire mixte fortement dégradée par les
activités anthropiques, des forêts secondaires, jachères
arbustives et herbacées (Katuala, 2009).
1.1.3. Jardin zoologique de Kisangani
Ce jardin se situe sur la rive droite de la rivière
Tshopo, du côté gauche de l'actuelle route Bouta, à 1 km du
pont Tshopo et à 4 km de la ville, du côté Nord.Sa
superficie est de 84 ha. Ses coordonnées, qui ont été
prise par Balekage (2009), sont 00° 31' N, 025° 12'E et 386 m
d'altitude.
La végétation du jardin zoologique de Kisangani
présente des caractéristiques d'une forét artificielle.
1.1.4. Yelenge
C'est une localité se trouvant sur la rive gauche de la
rivière Lindi, à environ 20 km sur la route Kisangani-Yangambi
à 00° 37'N, 25° 5' E, 392 m d'altitude.
Sa proximité de la ville de Kisangani fait que la
végétation originelle a subi une forte dégradation pour
faire place aux cultures vivrières. De ce fait, les jachères et
les forêts secondaires de différents âges sont les
principales formations végétales caractéristiques des
alentours de Yelenge tandis que la forêt primaire est actuellement
située à environ 8 km au Nord. C'est une forét primaire
mixte plus au moins dégradée dont les espèces
caractéristiques de la canopée sont notamment Scorodophloeus
zenkeri (Fabaceae), Piptadeniastrum africanum (Fabaceae),
Gilbertiodendron dewevrei (Fabaceae) ,Canarium scheveinfurthii
(Fabaceae) ,Dalium pachyphylum (Acanthaceae) ,Pentaclethra
macrophylla (Fabaceae) Pterocarpus soyauxii (Fabaceae)
,Polyalthia suaveoleus (Arantacea) ,Celtis tessmanii
(Araceae) (Katuala,op cit).
1.1.5. Malimba
La forêt de Malimba se retrouve au Nord-est de la ville de
Kisangani, à la rive droite de la rivière Tshopo, au point
kilométrique 8, axe routier secondaire Alibuku.
1.2. RIVE GAUCHE
1.2.1. La réserve forestière de la Yoko
Cette réserve est délimitée par la ville
de Kisangani et les forêts perturbées au Nord, au Sud et à
l'Est par la rivière Biaro qui forme une demie boucle en suivant cette
direction à l'Ouest par la voie ferrée et la route le long de la
quelle elle se prolonge des points kilométriques 21 à 38.
Elle est baignée par la rivière Yoko qui la
subdivise en deux blocs dont le bloc nord avec 3700 ha et le bloc Sud avec 3605
ha soit une superficie globale de 6975 ha. Elle a comme coordonnées
géographiques ,00° 29' 40,2 Nord ; 25° 28' 90,6 Est et 435m
d'altitude. Cette réserve est située dans le district de la
Tshopo, dans le territoire d'Ubundu et dans la collectivité
Bakumu-Mangongo.
Par sa situation à la périphérie de
Kisangani, la réserve de la Yoko bénéficie globalement du
climat de la ville de Kisangani du type Afi de la classification de Koppen
.Cependant elle peut présenter des petites variations microclimatiques
dues à une couverture végétale plus importante et au
réseau hydrographique très dense (Baruka, 2008).
La végétation naturelle de la Réserve
Forestière de la Yoko est celle de la cuvette centrale congolaise,
caractérisé par des forêts ombrophiles sempervirentes et
des forêts liées aux sols hydromorphes.
La végétation de la partie Nord a
été classée dans le groupe des forêts
mésophiles sempervirentes à Brachystegia laurentia de
l'alliance à Brachistegia laurenti dans l'ordre de
Gilbertiodendron dewevrei et la classe de
Strombosi-Parinarietea.
Le cadre phytosociologique du bloc sud de la Réserve
appartient au type de forêts mésophiles sempervirentes à
Scorodophloeus zenkeri, de l'alliance OxystigmoScorodophleion,
ordre des Piptadenia celtidetalia et à la classe des
Strombosio-Parinarietea. (Lomba, 2007).
1.2.2. Djabir
Djabir est une localité située sur la rive
gauche de la rivière Lomami, au Sud de la cité d'Isangi, chef
lieu du territoire du méme nom. Ses coordonnées sont 00°
31'N, 24° 10'E et 408 m d'altitude.
La végétation est du groupe de forêts
mésophiles semi-caducifoliés à Scorodophloeus
zenkeri, alliance Oxystigmo-scorodophloeion, ordre de
PiptadenioCeltidetalia, classe Strombosi-Parinareitea (Katuala, op cit).
1.3. MILIEUX INSULAIRES
1.3.1. Ile Kungulu
Cette ile est située à 15 km au Nord-Ouest de
Kisangani en aval du Beach bac sur la rivière Lindi (axe routier
Kisangani-Yangambi).
Celle-ci mesure 4 km de long sur environ 500 m de large.
0° 37'N et 25° 11' E sont ses coordonnées
géographiques. Elle débouche en aval sur le fleuve Congo qui
balaie tout le faciès aval gauche par ses eaux.
Sa végétation comprend 4 types de formations
végétales à savoir la forêt primaire, forêt
secondaire, jachère et la végétation des sols
hydromorphes.
Elle est soumise au méme type de climat que la ville de
Kisangani. C'est à dire un climat « Afi » selon la
classification de Koppen (Mukinzi, 1999).
1.3.2. Ile Mbiye
L'Ile Mbiye est une Ile du fleuve Congo qui est située
dans la partie Est de la ville de Kisangani. Elle se localise près de
l'Equateur à 0° 31' de latitude Nord et 25° 11' de longitude
Est ,390 m d'altitude .Sa pointe en aval est située à environ 3
km en amont des chutes wagenia, après l'ile Tundulu et sa longueur
mesurée à partir de l'échelle sur photo aérienne
est de 14 km sur 4 km de longueur maximale (Nshimba, 2008).
Etant située au sein du fleuve et ayant une
végétation particulière, l'ile Mbiye pourrait avoir un
microclimat caractéristique. De part sa position sur l'Equateur et sa
proximité de la ville de Kisangani, elle
bénéficie du climat chaud et humide de type Afi selon la
classification de Koppen (Musema, 2000).
La forét de l'ile Mbiye se classe dans le groupe des
foréts mésophiles semicaducifoliées à
Scorodophloeus zenkeri (Malemba, 2000).
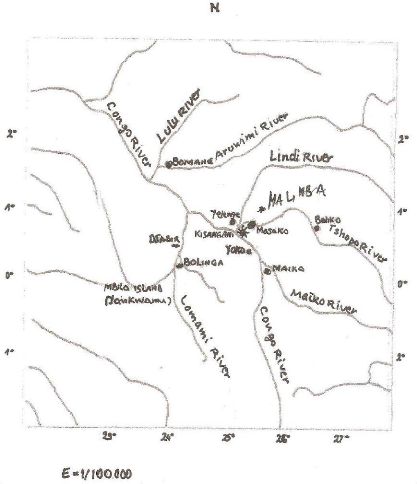
Fig. (1) : Réseau hydrographique de la région de
Kisangani avec les quelques localités de capture de Soridicae
étudié (Katuala, 2009).
CHAPITRE 2. MATERIEL ET METHODES
2.1. MATERIEL BIOLOGIQUE
Notre matériel biologique est constitué de 152
spécimens des Musaraignes dont 81 Crocidura olivieri et 71
Scutisorex somereni. Ces spécimens font partie d'une collection
des Soricidae capturés dans le cadre des travaux effectués par le
Laboratoire d'Ecologie et de Gestion des Ressources Animales (LEGERA) autour de
Kisangani de l'année 2004 à 2010.
La répartition de nos matériels par blocs est
donnée en détail dans le sous point qui suit en fonction de
l'espèce.
1° Crocidura olivieri
- Milieu Insulaire : 29 spécimens (ile
kungulu : 9 et ile Mbiye : 20)
- Rive Droite : 40 spécimens (Masako :
17, Malimba : 8, Masako : 11, Yelenge : 1, Jardin zoo:3)
- Rive Gauche : 12 spécimens (Djabir : 3
et Yoko : 9)
2° Scutisorex somereni
- Milieu Insulaire : 24 spécimens ('ile
Kungulu : 3 et l'ile Mbiye : 21)
- Rive Droite : 16 spécimens (Maïko
: 7, Malimba : 8, Jardin zoologique : 1) - Rive Gauche : 31
spécimens (Yoko : 31)
2.2. METHODES
La capture de notre matériel était
principalement faite par la technique de piégeage en ligne au moyen de
seaux appelés « pitfall >>.qui de fois, comme à l'ile
Mbiye ,kungulu, Masako était associé aux pièges Sherman et
Victor.
2.2.1. Morphométrie
Les mesures morphométriques externes qui ont
été prélevées sur ces spécimens n'ont pas
été prises en compte dans ce travail. Le sexe était
déterminé en examinant les organes génitaux des individus.
Ces données morphométriques ont été relevées
par d'autres chercheurs au cours des études
précédentes.
2.2.2. Craniométrie
2.2.2.1. Préparation du crâne
Chaque crane extrait du reste du corps était
trempé dans l'eau contenue dans une boite à tomate.
L'étiquette du spécimen était marquée sur la boite
contenant son crane pour éviter d'éventuelles confusions.
Trois jours plus tard, on changeait de l'eau ; ensuite
après avoir totalisé 6 jours la chair se ramollissait. Cette
dernière était enlevée sur les cranes progressivement
à l'aide d'une pince. Nous utilisions une seringue pour aspirer la masse
de cerveau enfin de la vider du crâne .Celui-ci était rincé
avec une brosse pour enlever de petites chairs restantes.
Après cette opération, le crâne était
exposé au soleil pendant 3 heures pour séchage. Nous
étiquetions les crânes et les bocaux dans lesquels ils seront
ensuite conservés. 2.2.2.2. Mesures
craniométriques
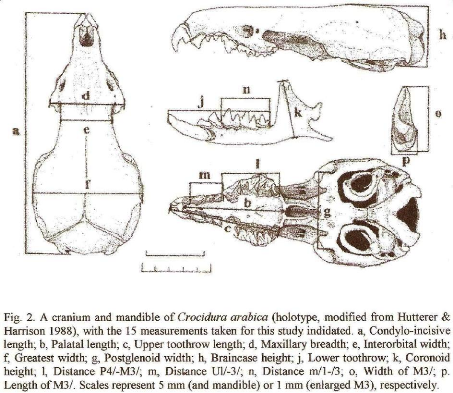
Sur chaque crâne, nous prenions 15 mesures comme
proposées par Stanley et Hutterer, 2000 à l'aide d'un pied
à coulisse de marque Mitutoyo (précision 0,01 mm).
Le diagramme des mesures effectuées est donné la
Fig.1
Les mesures craniométriques prise sont :

La longueur du condylo-incisive (CI)
La longueur palatale (PL)
La longueur de la rangée dentaire supérieure
(UTR)
La longueur du maxillaire (MB)
La longueur inter-orbitale la plus petite (IW)
La longueur maximale du crâne (GW)
La longueur du post-glénoïde (PGW)
La hauteur de la boite crânienne (HB)
La longueur de la rangée dentaire inférieure (LTR)
La hauteur de coronoïde (CH)
La distance entre les prémolaires (P4-M3)
La distance entre les cuspides ou unicuspides (U1-U3) La distance
entre les molaires inférieures (m1-m3)
La largeur de la base du molaire M3 (M3W)
La longueur du molaire M3 (M3L)
2.2.3. L'état du crâne
A l'aide d'un binoculaire, nous observions le degré de
l'usure dentaire des molaires supérieures (PM4, M1 et M2) et de
l'état de fusion de la suture entre la basioccipital et le
basisphénoïde pour déterminer la classe d'age dans laquelle
appartient le spécimen.
En se référant à Nicolas et al (2005) in
Mukinzi (2009),les individus sont classés en juvéniles(TW1),
subadultes(TW2A), jeunes adultes (TW2B), adultes (TW3A), vieux adultes(TW3B) et
très vieux adultes ou séniles(TW4).
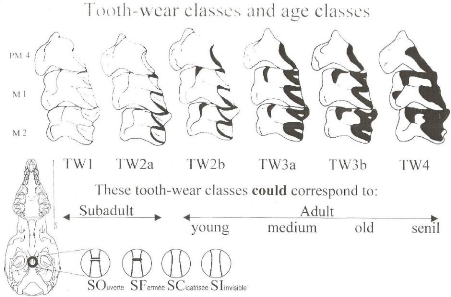
Fig. (3).Planche utilisée détermination des classes
d'age dentaires 2.2.4. Analyse des données
Nous avons utilisé Microsoft Excel(2007) en
téléchargeant son utilitaire d'analyse et le logiciel « Past
2.0» pour effectuer les différents traitements statistiques de nos
données. Pour tous les tests effectués, nous avons utilisé
le seuil de signification de 0,05.
Avant toute analyse, nous procédions d'abord aux
analyses descriptives en vue de ressortir les moyennes, les écarts
types, les variances, les minima et maxima ainsi que les coefficients de
variation pour chaque paramètre étudié et par blocs. Les
mesures sont supposées stables si leurs coefficients de variation sont
inférieurs à 5.
Pour déterminer la variabilité
craniométrique inter blocs (rive droite, rive gauche et les iles) de
chaque espèce, nous avons utilisé le test F de
Snédécor. Ce test nous a aussi servi pour vérifier le
dimorphisme sexuel de deux espèces.

Fcal : Valeur de F calculée par rapport aux variances des
2 échantillons comparé ; Si la probabilité(p) < 0,05,
la différence est significative (DS) ;
Si la probabilité(p) >0,05, la différence est
non significative (DNS).
Au moyen de l'utilitaire d'analyse, nous avons procedé
au test d'Anova à un facteur pour comparer les variables
craniométrique entre les localités. Pendant cette
opération, nous avons élagué les données de Yelenge
(pour Crocidura olivieri) et de l'ile Kungulu (pour Scutisorex
somereni) et avons mis ensemble celles de Yoko et Djabir (pour
Crocidura olivieri) ainsi que celles de Malimba et du Jardin
zoologique (pour le Scutisorex somereni) à cause du nombre
réduit de leurs échantillons. Chaque fois que les
résultats de l'Anova présentaient une différence
significative, nous procédions au test post hoc au moyen du logiciel
« Past 2.0 » en utilisant le test de Tuckey, de manière
à ressortir les groupes dans les quels la différence était
observée.
Enfin pour vérifier la solidité de nos
résultats, nous avons procédé à l'analyse en
composante principale (ACP) en vue de dégager les variations attendue
entre les individus de 3 blocs : rive droite, rive gauche et les iles.
CHAPITRE 3. RESULTATS
Une collection de 152 spécimens de Musaraignes
reparties en deux espèces : 81 Crocidura olivieri et 71
Scutisorex somereni issus de diverses localités autour de
Kisangani, constitue le matériel biologique qui nous a permis de
réaliser ce travail.
Nos résultats sont présentés dans
différents tableaux et graphiques. Certains détails concernant
ces résultats sont repris en annexes.
3.1. VARIABILITE CRANIOMETRIQUE
3.1.1. Variabilité intra blocs
Nous avons au moyen des analyses descriptives
déterminé les paramètres pouvant présenter une
certaine variabilité à l'intérieur des espèces
étudiées. Les détails sur ces paramètres sont
présentés en annexe 2.
a) Variabilité intra blocs chez Crocidura
olivieri
D'une manière globale, sur base des coefficients de
variation, il s'avère que chez Crocidura olivieri, les mesures
stables sont celles reprises dans le tableau (1).
Tableau(1).Valeurs statistiques de mesures stables chez
Crocidura olivieri
|
Milieux
|
Mesures
|
n
|
moy
|
s2
|
Min
|
max
|
S
|
C.V
|
|
Global
|
UTR
|
81
|
14,07
|
0,47
|
10,8
|
15,5
|
0,69
|
4,9
|
|
Insulaire
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Rive
droite
5/15
|
PL
|
40
|
14,054
|
0,3913
|
12,7
|
15,86
|
0,6256
|
4,4512
|
|
UTR
|
40
|
14,179
|
0,3324
|
13
|
15,51
|
0,6256
|
4,0665
|
|
LTR
|
40
|
12,776
|
0,2767
|
11,35
|
13,98
|
0,526
|
4,117
|
|
P4-M3
|
40
|
7,4395
|
0,1212
|
6,63
|
8,14
|
0,3482
|
4,68
|
|
m 1- m 3
|
40
|
6,1278
|
0,0773
|
5,1
|
6,65
|
0,2147
|
4,5375
|
|
Rive
gauche
7/15
|
CI
|
10
|
30,003
|
1,3359
|
27,85
|
31,78
|
1,1558
|
3,8523
|
|
PL
|
12
|
13,618
|
0,3973
|
12,55
|
14,53
|
0,6303
|
4,6282
|
|
UTR
|
12
|
13,472
|
0,1212
|
12,8
|
13,87
|
0,3482
|
2,5844
|
|
LTR
|
12
|
12,197
|
0,1684
|
11,51
|
12,97
|
0,4104
|
3,3645
|
|
CH
|
12
|
7,4683
|
0,1223
|
6,85
|
8
|
0,3497
|
4,682
|
|
P4-M3
|
12
|
7,1208
|
0,0919
|
6,48
|
7,65
|
0,3031
|
4,2568
|
|
m 1- m 3
|
12
|
5,8967
|
0,0111
|
5,77
|
6,08
|
0,1053
|
1,7865
|
Légende
n : effectif
moy : moyenne
s2 : variance
Min : minimum
Max : maximum
S : écart type
C.V : Coefficient de Variation
Le tableau (1) révèle que sur le plan global,
seule une mesure (UTR) sur les 15 paraît stable, les autres mesures
présentent une forte variabilité. Les mesures prises en fonction
des blocs montrent :
· A la rive droite, 5 mesures sur les 15 (PL, UTR, LTR,
P4-M3 et m1-m3) sont stables, les autres présentent une
variabilité élevée (C.V>5%).
· A la rive gauche, 7 mesures sur les 15 (CI, PL, UTR, LTR,
CH, P4-M3 et m1-m3) sont stables.
· Dans les iles, aucune mesure n'est stable attestant une
variabilité entre les individus mesurés.
b) Variabiité intra blocs chez Scutisorex
somereni
Tableau(2).Valeurs statistiques de mesures stables chez
Scutisorex somereni
Milieux
|
Mesures
|
n
|
Moy
|
s 2
|
min
|
max
|
S
|
C.V
|
Global
5/15
|
CI
|
70
|
30,766
|
1,646
|
24,35
|
32,92
|
1,283
|
4,1701
|
|
71
|
13,988
|
0,446
|
10,3
|
14,95
|
0,6678
|
4,7743
|
|
71
|
13,551
|
0,2948
|
10,83
|
14,48
|
0,543
|
4,0068
|
|
71
|
12,306
|
0,2515
|
9,66
|
13,16
|
0,5015
|
4,0752
|
|
71
|
6,8748
|
0,1148
|
5,78
|
7,88
|
0,3389
|
4,9293
|
Insulaire
3/15
|
CH
|
23
|
7,83
|
0,146
|
7,28
|
8,81
|
0,3822
|
4,8807
|
|
24
|
6,7971
|
0,114
|
5,99
|
7,55
|
0,3376
|
4,9671
|
|
24
|
5,6608
|
0,0778
|
4,83
|
6,11
|
0,2789
|
4,927
|
Rive
droite
10/15
|
CI
|
16
|
30,93
|
0,6347
|
29,45
|
32,8
|
0,7967
|
2,5757
|
|
16
|
14,192
|
0,1456
|
13,55
|
14,95
|
0,3816
|
2,6887
|
|
16
|
13,833
|
0,1193
|
13,33
|
14,44
|
0,3454
|
2,4967
|
|
16
|
9,1519
|
0,1813
|
8,46
|
9,85
|
0,4258
|
4,2956
|
|
16
|
6,4606
|
0,077
|
5,69
|
6,83
|
0,2775
|
4,2956
|
|
16
|
9,2144
|
0,1895
|
8,47
|
9,84
|
0,4353
|
4,7242
|
|
16
|
7,7119
|
0,1061
|
6,81
|
8,2
|
0,3258
|
4,2247
|
|
16
|
12,576
|
0,1074
|
11,85
|
13,16
|
0,3277
|
2,6057
|
|
16
|
7,6281
|
0,104
|
7,06
|
8,24
|
8,24
|
0,3225
|
|
16
|
6,9825
|
0,1082
|
6,42
|
7,88
|
0,3289
|
4,711
|
Rive
gauche
9/15
|
CI
|
31
|
30,805
|
1,3933
|
26,27
|
32,92
|
1,1804
|
3,8319
|
|
31
|
13,926
|
0,2973
|
12,69
|
14,85
|
0,5453
|
3,9156
|
|
31
|
13,515
|
0,2164
|
11,97
|
14,37
|
0,4652
|
3,442
|
|
31
|
8,8206
|
0,1452
|
8,06
|
9,6
|
0,381
|
4,3195
|
|
31
|
9,0545
|
0,1889
|
7,54
|
9,7
|
0,4347
|
4,8004
|
|
31
|
12,278
|
0,1421
|
11,22
|
13,1
|
0,3769
|
3,0696
|
|
31
|
7,3942
|
0,1078
|
6,74
|
7,93
|
0,3283
|
4,4399
|
|
31
|
6,8794
|
0,1154
|
5,78
|
7,47
|
0,3397
|
4,9386
|
|
31
|
5,6884
|
0,0385
|
5,23
|
6,1
|
0,1962
|
3,4488
|
|
Légende :
n : effectif
moy : moyenne
Min : minimum
Max : maximum
S : écart type
C.V : Coefficient de Variation
Ce tableau nous signale que sur le plan global, 5 mesures
(CI, PL, UTR, LTR, P4-M3) sur les 15 paraissent stables, les autres mesures
présentent une variabilité supérieure à 5%. Les
mesures prises en fonction des blocs indiquent :
· Dans les iles, 3 mesures CH, P4-M3 et m1-m3) sur les 15
sont stables, les autres présentent une forte variabilité.
· A la rive droite, 10 mesures (CI, PL, UTR, MB, IW, PGW,
HB, LTR, CH et P4-M3) sur les 15 sont stables.
· A la rive gauche, il existe 9 mesures (CI, PL, UTR, MB,
PGW, LTR, CH, P4-M3 et m1-m3) attestant une variabilité entre les
individus mesurés.
3.1.2. Variabilité inter blocs
Nous avons, au moyen de test F de Snédécor
réalisé une comparaison deux à deux de divers blocs
étudiés. Les résultats sont progressivement
présentés dans les tableaux (3) ; (4) et (5) pour C.
olivieri puis dans les tableaux (6), (7), et (8) pour Scutisorex
somereni.
3.1.2.1. Variabilité inter blocs de Crocidura
olivieri
Tableau(3). Résultats du test F de
Snédécor relatifs à la variabilité
craniométrique de Crocidura olivieri entre les milieux
insulaires et la rive droite
|
Paramètres Bloc
|
n
|
ddl
|
variance
|
F test
|
Probabilité
|
Décision
|
|
CI
|
Insulaire
|
28
|
27
|
3,32496336
|
1,36998716
|
0,18690828
|
DNS
|
|
R. droite
|
37
|
36
|
2,4270033
|
|
|
|
|
PL
|
Insulaire
|
29
|
28
|
0,718067
|
1,83492899
|
0,03965696
|
DS
|
|
R. droite
|
40
|
39
|
0,39133231
|
|
|
|
|
UTR
|
Insulaire
|
29
|
28
|
0,67035419
|
2,01650558
|
0,02145701
|
DS
|
|
R. droite
|
40
|
39
|
0,33243359
|
|
|
|
|
MB
|
Insulaire
|
28
|
27
|
2,62803122
|
9,3779271
|
4,609E-10
|
DS
|
|
R. droite
|
40
|
39
|
0,28023583
|
|
|
|
|
IW
|
Insulaire
|
29
|
28
|
0,16708867
|
1,60128815
|
0,08623065
|
DNS
|
|
R. droite
|
40
|
39
|
0,10434641
|
|
|
|
|
GW
|
Insulaire
|
28
|
27
|
0,92619788
|
1,09631464
|
0,39315826
|
DNS
|
|
R. droite
|
37
|
36
|
0,84482853
|
|
|
|
|
PGW
|
Insulaire
|
29
|
28
|
0,19945271
|
0,77549541
|
0,24414839
|
DNS
|
|
R. droite
|
39
|
38
|
0,25719393
|
|
|
|
|
HB
|
Insulaire
|
28
|
27
|
0,15604137
|
0,94712565
|
0,44739236
|
DNS
|
|
R. droite
|
37
|
36
|
0,16475255
|
|
|
|
|
LTR
|
Insulaire
|
29
|
28
|
0,60484754
|
2,18608702
|
0,01207123
|
DS
|
|
R. droite
|
40
|
39
|
0,27668045
|
|
|
|
|
CH
|
Insulaire
|
27
|
26
|
0,20700256
|
0,42166478
|
0,01155463
|
DS
|
|
R. droite
|
40
|
39
|
0,49091737
|
|
|
|
|
P4-M3
|
Insulaire
|
29
|
28
|
0,1591936
|
1,31325903
|
0,21303367
|
DNS
|
|
R. droite
|
40
|
39
|
0,12122026
|
|
|
|
|
U1-U3
|
Insulaire
|
29
|
28
|
0,19962562
|
1,55503416
|
0,10022366
|
DNS
|
|
R. droite
|
40
|
39
|
0,12837378
|
|
|
|
|
m1-m3
|
Insulaire
|
29
|
28
|
0,14818498
|
1,91675859
|
0,03008537
|
DS
|
|
R. droite
|
40
|
39
|
0,07731019
|
|
|
|
|
M3W
|
Insulaire
|
28
|
27
|
0,02011892
|
0,43631282
|
0,0132714
|
DS
|
|
R. droite
|
40
|
39
|
0,04611122
|
|
|
|
|
M3L
|
Insulaire
|
28
|
27
|
0,0058787
|
0,72170501
|
0,18895241
|
DNS
|
|
R. droite
|
40
|
39
|
0,00814558
|
|
|
|
Le tableau (3) comparant les spécimens de Crocidura
olivieri capturés dans les milieux insulaires et à la rive
droite révèle qu'il existe une différence significative
(DS) pour 7 paramètres notamment : la longueur palatale (PL), la
longueur de la rangée dentaire
supérieure (UTR), la longueur du maxillaire (MB), la
longueur de la rangée dentaire inférieure (LTR), la hauteur du
coronoide (CJI), la distance entre les molaires inférieures (m1- m3), et
la largeur de la base de molaire M3 (M3W).
Tableau(4). Résultats du test F de
Snédécor relatifs à la variabilité
craniométrique de Crocidura olivieri entre les milieux
insulaires et la rive gauche
|
Paramètres Bloc
|
n
|
ddl
|
variance
|
F test
|
Probabilité
|
Décision
|
|
CI
|
Insulaire
|
28
|
27
|
3,32496336
|
2,48894996
|
0,07687055
|
DNS
|
|
R. gauche
|
10
|
9
|
1,33589
|
|
|
|
|
PL
|
Insulaire
|
29
|
28
|
0,718067
|
1,80758781
|
0,1507976
|
DNS
|
|
R. gauche
|
12
|
11
|
0,39725152
|
|
|
|
|
UTR
|
Insulaire
|
29
|
28
|
0,67035419
|
5,53028379
|
0,00242967
|
DS
|
|
R. gauche
|
12
|
11
|
0,12121515
|
|
|
|
|
MB
|
Insulaire
|
28
|
27
|
2,62803122
|
11,5582902
|
7,6291E-05
|
DS
|
|
R. gauche
|
12
|
11
|
0,22737197
|
|
|
|
|
IW
|
Insulaire
|
29
|
28
|
0,16708867
|
1,69738912
|
0,17860278
|
DNS
|
|
R. gauche
|
12
|
11
|
0,09843864
|
|
|
|
|
GW
|
Insulaire
|
28
|
27
|
0,92619788
|
1,42853144
|
0,29675373
|
DNS
|
|
R. gauche
|
10
|
9
|
0,64835667
|
|
|
|
|
PGW
|
Insulaire
|
29
|
28
|
0,19945271
|
0,51041482
|
0,07395077
|
DNS
|
|
R. gauche
|
12
|
11
|
0,39076591
|
|
|
|
|
HB
|
Insulaire
|
28
|
27
|
0,15604137
|
0,3018338
|
0,00754775
|
DS
|
|
R. gauche
|
10
|
9
|
0,51697778
|
|
|
|
|
LTR
|
Insulaire
|
29
|
28
|
0,60484754
|
3,59198976
|
0,01481966
|
DS
|
|
R. gauche
|
12
|
11
|
0,16838788
|
|
|
|
|
CH
|
Insulaire
|
27
|
26
|
0,20700256
|
1,69299973
|
0,18095768
|
DNS
|
|
R. gauche
|
12
|
11
|
0,1222697
|
|
|
|
|
P4-M3
|
Insulaire
|
29
|
28
|
0,1591936
|
1,73260512
|
0,16915457
|
DNS
|
|
R. gauche
|
12
|
11
|
0,09188106
|
|
|
|
|
U1-U3
|
Insulaire
|
29
|
28
|
0,19962562
|
1,21662802
|
0,38022733
|
DNS
|
|
R. gauche
|
12
|
11
|
0,16408106
|
|
|
|
|
m1-m3
|
Insulaire
|
29
|
28
|
0,14818498
|
13,3536433
|
3,63E-05
|
DS
|
|
R. gauche
|
12
|
11
|
0,01109697
|
|
|
|
|
M3W
|
Insulaire
|
28
|
27
|
0,02011892
|
1,3546709
|
0,30613132
|
DNS
|
|
R. gauche
|
12
|
11
|
0,01485152
|
|
|
|
|
M3L
|
Insulaire
|
28
|
27
|
0,0058787
|
1,01569226
|
0,5164605
|
DNS
|
|
R. gauche
|
12
|
11
|
0,00578788
|
|
|
|
Selon le tableau ci-haut, les 5 mesures suivantes : la
longueur de la rangée dentaire supérieure (UTR), la longueur du
maxillaire (MB), la hauteur de la boite crânienne (JIB), la longueur de
la rangée dentaire inférieure (LTR) et la distance entre les
molaires
inférieures (m1-m3) présentent des
différences significatives (DS). Par contre, toutes les autres mesures
ont des différences non significatives.
Tableau(5). Résultats du test de
Snédécor relatifs à la variabiité
craniométrique de
Crocidura olivieri entre la rive droite et le
rive gauche
|
Paramètres Bloc
|
n
|
ddl
|
variance
|
F test
|
Probabilité
|
Décision
|
|
CI
|
R. droite
|
37
|
36
|
2,4270033
|
1,8167688
|
0,17247869
|
DNS
|
|
R. gauche
|
10
|
9
|
1,33589
|
|
|
|
|
PL
|
R. droite
|
40
|
39
|
0,39133231
|
0,9850996
|
0,45163455
|
DNS
|
|
R. gauche
|
12
|
11
|
0,39725152
|
|
|
|
|
UTR
|
R. droite
|
40
|
39
|
0,33243359
|
2,7425086
|
0,03776263
|
DS
|
|
R. gauche
|
12
|
11
|
0,12121515
|
|
|
|
|
MB
|
R. droite
|
40
|
39
|
0,28023583
|
1,2324995
|
0,37119987
|
DNS
|
|
R. gauche
|
12
|
11
|
0,22737197
|
|
|
|
|
IW
|
R. droite
|
40
|
39
|
0,10434641
|
1,0600148
|
0,48888301
|
DNS
|
|
R. gauche
|
12
|
11
|
0,09843864
|
|
|
|
|
GW
|
R. droite
|
37
|
36
|
0,84482853
|
1,3030305
|
0,35346801
|
DNS
|
|
R. gauche
|
10
|
9
|
0,64835667
|
|
|
|
|
PGW
|
R. droite
|
39
|
38
|
0,25719393
|
0,658179
|
0,16490574
|
DNS
|
|
R. gauche
|
12
|
11
|
0,39076591
|
|
|
|
|
HB
|
R. droite
|
37
|
36
|
0,16475255
|
0,318684
|
0,00682987
|
DS
|
|
R. gauche
|
10
|
9
|
0,51697778
|
|
|
|
|
LTR
|
R. droite
|
40
|
39
|
0,27668045
|
1,6431138
|
0,19001159
|
DNS
|
|
R. gauche
|
12
|
11
|
0,16838788
|
|
|
|
|
CH
|
R. droite
|
40
|
39
|
0,49091737
|
4,0150371
|
0,00855334
|
DS
|
|
R. gauche
|
12
|
11
|
0,1222697
|
|
|
|
|
P4-M3
|
R. droite
|
40
|
39
|
0,12122026
|
1,3193171
|
0,32218403
|
DNS
|
|
R. gauche
|
12
|
11
|
0,09188106
|
|
|
|
|
U1-U3
|
R. droite
|
40
|
39
|
0,12837378
|
0,7823803
|
0,27282659
|
DNS
|
|
R. gauche
|
12
|
11
|
0,16408106
|
|
|
|
|
m1-m3
|
R. droite
|
40
|
39
|
0,07731019
|
6,9667841
|
0,00073965
|
DS
|
|
R. gauche
|
12
|
11
|
0,01109697
|
|
|
|
|
M3W
|
R. droite
|
40
|
39
|
0,04611122
|
3,1048157
|
0,0238254
|
DS
|
|
R. gauche
|
12
|
11
|
0,01485152
|
|
|
|
|
M3L
|
R. droite
|
40
|
39
|
0,00814558
|
1,407351
|
0,27891647
|
DNS
|
|
R. gauche
|
12
|
11
|
0,00578788
|
|
|
|
Sur tous les paramètres considérés au
cours de cette étude, Crocidura olivieri de la rive gauche et
de la rive droite présentent des différences significatives pour
les 5 paramètres suivants : La longueur de la rangée dentaire
supérieure (UTR), la hauteur de la boite crânienne (HB), la
hauteur du coronoide(CH), la distance entre les molaires inférieure
(m1-m3) et la largeur de la base de molaire M3(M3W).
3.1.2.2. Variabilité inter blocs de Scutisorex
somereni
Tableaux(6). Résultats du test F de
Snédécor relatifs à la variabilité
craniométrique de Scutisorex somereni entre les iles et la rive
droite
|
Paramètres Bloc
|
n
|
ddl
|
variance
|
F test
|
Probabilité
|
Décision
|
|
CI
|
Insulaire
|
23
|
22
|
2,77936364
|
4,37924943
|
0,00248384
|
DS
|
|
R. droite
|
16
|
15
|
0,63466667
|
|
|
|
|
PL
|
Insulaire
|
24
|
23
|
0,83708098
|
5,74906738
|
0,0005223
|
DS
|
|
R. droite
|
16
|
15
|
0,14560292
|
|
|
|
|
UTR
|
Insulaire
|
24
|
23
|
0,45964348
|
3,8536986
|
0,00469792
|
DS
|
|
R. droite
|
16
|
15
|
0,11927333
|
|
|
|
|
MB
|
Insulaire
|
24
|
23
|
0,55641957
|
3,06934363
|
0,01432174
|
DS
|
|
R. droite
|
16
|
15
|
0,18128292
|
|
|
|
|
IW
|
Insulaire
|
23
|
22
|
0,31975336
|
4,15158517
|
0,00329579
|
DS
|
|
R. droite
|
16
|
15
|
0,07701958
|
|
|
|
|
GW
|
Insulaire
|
24
|
23
|
0,65064275
|
1,27108868
|
0,32048351
|
DNS
|
|
R. droite
|
16
|
15
|
0,51187833
|
|
|
|
|
PGW
|
Insulaire
|
24
|
23
|
0,67372101
|
3,55538891
|
0,00705781
|
DS
|
|
R. droite
|
16
|
15
|
0,18949292
|
|
|
|
|
HB
|
Insulaire
|
24
|
23
|
0,52380851
|
4,93462619
|
0,00124785
|
DS
|
|
R. droite
|
16
|
15
|
0,10614958
|
|
|
|
|
LTR
|
Insulaire
|
24
|
23
|
0,43696938
|
4,06918456
|
0,00354315
|
DS
|
|
R. droite
|
16
|
15
|
0,107385
|
|
|
|
|
CH
|
Insulaire
|
23
|
22
|
0,14604545
|
1,40442388
|
0,25195619
|
DNS
|
|
R. droite
|
16
|
15
|
0,10398958
|
|
|
|
|
P4-M3
|
Insulaire
|
24
|
23
|
0,11398678
|
1,05341731
|
0,46970613
|
DNS
|
|
R. droite
|
16
|
15
|
0,10820667
|
|
|
|
|
U1-U3
|
Insulaire
|
24
|
23
|
0,2393558
|
1,87367548
|
0,10577703
|
DNS
|
|
R. droite
|
16
|
15
|
0,12774667
|
|
|
|
|
m1-m3
|
Insulaire
|
24
|
23
|
0,07779058
|
0,0691214
|
2,6617E-08
|
DS
|
|
R. droite
|
16
|
15
|
1,12541958
|
|
|
|
|
M3W
|
Insulaire
|
23
|
22
|
0,0142166
|
0,57603731
|
0,11663851
|
DNS
|
|
R. droite
|
16
|
15
|
0,02468
|
|
|
|
|
M3L
|
Insulaire
|
23
|
22
|
0,00578024
|
1,05679662
|
0,46622258
|
DNS
|
|
R. droite
|
16
|
15
|
0,00546958
|
|
|
|
Le tableau(6) nous signale que plus de la moitié (soit
9) mesures prélevées présentent de différences
significatives (DS) entre les Scutisorex somereni des iles et de la
rive droite. La longueur du condylo-incisive (CI), la longueur palatale (PL),
la longueur de la rangée dentaire supérieure (UTR), la longueur
du maxillaire (MB), la longueur inter-orbitale
la plus petite (IW), la longueur du post-glénoïde
(PGW), la hauteur de la boite crânienne (HB), la longueur de la
rangée dentaire inférieure (LTR), la distance entre les molaires
inférieures (m1-m3).
Tableau (7). Résultats du test F de
Snédécor relatifs à la variabilité
craniométrique entre les milieux insulaires et la rive
gauche
|
Paramètres Bloc
|
n
|
ddl variance
|
F test
|
Probabilité
|
Décision
|
|
CI
|
Insulaire
|
23
|
22
|
2,77936364
|
1,99478876
|
0,03946609
|
DS
|
|
R. gauche
|
31
|
30
|
1,39331226
|
|
|
|
|
PL
|
Insulaire
|
24
|
23
|
0,83708098
|
2,81525201
|
0,00420066
|
DS
|
|
R. gauche
|
31
|
30
|
0,29733785
|
|
|
|
|
UTR
|
Insulaire
|
24
|
23
|
0,45964348
|
2,12385991
|
0,02678411
|
DS
|
|
R. gauche
|
31
|
30
|
0,21641892
|
|
|
|
|
MB
|
Insulaire
|
24
|
23
|
0,55641957
|
3,83298196
|
0,00034938
|
DS
|
|
R. gauche
|
31
|
30
|
0,14516624
|
|
|
|
|
IW
|
Insulaire
|
23
|
22
|
0,31975336
|
2,81808591
|
0,00443261
|
DS
|
|
R. gauche
|
31
|
30
|
0,11346473
|
|
|
|
|
GW
|
Insulaire
|
24
|
23
|
0,65064275
|
1,12660503
|
0,37474244
|
DNS
|
|
R. gauche
|
31
|
30
|
0,57752516
|
|
|
|
|
PGW
|
Insulaire
|
24
|
23
|
0,67372101
|
3,5660654
|
0,00065099
|
DS
|
|
R. gauche
|
31
|
30
|
0,18892559
|
|
|
|
|
HB
|
Insulaire
|
24
|
23
|
0,52380851
|
1,87830987
|
0,05266611
|
DNS
|
|
R. gauche
|
31
|
30
|
0,27887226
|
|
|
|
|
LTR
|
Insulaire
|
24
|
23
|
0,43696938
|
3,07607987
|
0,00215651
|
DS
|
|
R. gauche
|
31
|
30
|
0,14205398
|
|
|
|
|
CH
|
Insulaire
|
23
|
22
|
0,14604545
|
1,35505191
|
0,21682119
|
DNS
|
|
R. gauche
|
31
|
30
|
0,10777849
|
|
|
|
|
P4-M3
|
Insulaire
|
24
|
23
|
0,11398678
|
0,98752917
|
0,49427283
|
DNS
|
|
R. gauche
|
31
|
30
|
0,11542624
|
|
|
|
|
U1-U3
|
Insulaire
|
24
|
23
|
0,2393558
|
2,87977556
|
0,00355538
|
DS
|
|
R. gauche
|
31
|
30
|
0,08311613
|
|
|
|
|
m1-m3
|
Insulaire
|
24
|
23
|
0,07779058
|
2,02120065
|
0,03552312
|
DS
|
|
R. gauche
|
31
|
30
|
0,03848731
|
|
|
|
|
M3W
|
Insulaire
|
23
|
22
|
0,0142166
|
0,5723963
|
0,08951272
|
DNS
|
|
R. gauche
|
31
|
30
|
0,02483699
|
|
|
|
|
M3L
|
Insulaire
|
23
|
22
|
0,00578024
|
1,3877583
|
0,19959296
|
DNS
|
|
R. gauche
|
31
|
30
|
0,00416516
|
|
|
|
Ce tableau signale que seules quelques mesures (GW, HB, CH,
P4-M3, M3W et M3L) ne présentent pas de différences
significatives(DNS).Ces mesures indiquent qu'il
existe une variabilité sur le plan craniométrique
entre les individus de Scutisorex somereni des iles et de la rive
gauche.
Tableau(8). Résultats du test F de
Snédécor relatifs à la craniométrique de
Scutisorex somereni entre la rive droite et la rive gauche
|
Paramètres Bloc
|
n
|
ddl variance
|
F test
|
Probabilité
|
Décision
|
|
CI
|
R. droite
|
16
|
15
|
0,63466667
|
0,45550928
|
0,05488184
|
DNS
|
|
R. gauche
|
31
|
30
|
1,39331226
|
|
|
|
|
PL
|
R. droite
|
16
|
15
|
0,14560292
|
0,48968847
|
0,07274359
|
DNS
|
|
R. gauche
|
31
|
30
|
0,29733785
|
|
|
|
|
UTR
|
R. droite
|
16
|
15
|
0,11927333
|
0,4011374
|
0,03235665
|
DS
|
|
R. gauche
|
31
|
30
|
0,29733785
|
|
|
|
|
MB
|
R. droite
|
16
|
15
|
0,18128292
|
0,83764817
|
0,36787445
|
DNS
|
|
R. gauche
|
31
|
30
|
0,21641892
|
|
|
|
|
IW
|
R. droite
|
16
|
15
|
0,07701958
|
0,53056127
|
0,09774521
|
DNS
|
|
R. gauche
|
31
|
30
|
0,14516624
|
|
|
|
|
GW
|
R. droite
|
16
|
15
|
0,51187833
|
0,88633079
|
0,41495588
|
DNS
|
|
R. gauche
|
31
|
30
|
0,57752516
|
|
|
|
|
PGW
|
R. droite
|
16
|
15
|
0,18949292
|
1,0030029
|
0,47741101
|
DNS
|
|
R. gauche
|
31
|
30
|
0,18892559
|
|
|
|
|
HB
|
R. droite
|
16
|
15
|
0,10614958
|
0,38063873
|
0,02571031
|
DS
|
|
R. gauche
|
31
|
30
|
0,27887226
|
|
|
|
|
LTR
|
R. droite
|
16
|
15
|
0,107385
|
0,75594504
|
0,2883984
|
DNS
|
|
R. gauche
|
31
|
30
|
0,14205398
|
|
|
|
|
CH
|
R. droite
|
16
|
15
|
0,10398958
|
0,96484539
|
0,48846853
|
DNS
|
|
R. gauche
|
31
|
30
|
0,10777849
|
|
|
|
|
P4-M3
|
R. droite
|
16
|
15
|
0,10820667
|
0,93745296
|
0,46326924
|
DNS
|
|
R. gauche
|
31
|
30
|
0,11542624
|
|
|
|
|
U1-U3
|
R. droite
|
16
|
15
|
0,12774667
|
1,53696603
|
0,15396789
|
DNS
|
|
R. gauche
|
31
|
30
|
0,08311613
|
|
|
|
|
m1-m3
|
R. droite
|
16
|
15
|
1,12541958
|
29,2413143
|
8,0979E-14
|
DNS
|
|
R. gauche
|
31
|
30
|
0,03848731
|
|
|
|
|
M3W
|
R. droite
|
16
|
15
|
0,02468
|
0,99367922
|
0,51436525
|
DNS
|
|
R. gauche
|
31
|
30
|
0,02483699
|
|
|
|
|
M3L
|
R. droite
|
16
|
15
|
0,00546958
|
1,31317444
|
0,25446922
|
DNS
|
|
R. gauche
|
31
|
30
|
0,00416516
|
|
|
|
Le tableau (8) signale qu'il n'existe que deux mesures : la
longueur de la rangée dentaire supérieure (UTR) et hauteur de la
boite crânienne (HB) qui présentent de différences
significatives. Et les autres mesures ont une différence non
significative (DNS) attestant une faible variabilité entre les individus
de cette espèce se trouvant entre les 2 rives.
3.1.3. Variabilité inter localités
Pour estimer la variabilité des mesures
prélevées entre les localités, nous avons comme
signalé dans la partie méthode, utilisé le test d'analyse
des variances (Anova) pour chaque mesure afin de comparer les moyennes au sein
des localités. Nous présentons ici les résultats de
l'Anova pour les paramètres où les mesures présentaient
des différences significatives en précisant pour chaque cas, les
résultats du test de Tukey.
3.1.3.1. Crocidura olivieri
Tableau (9). Résultats de test d'Anova relatifs
à la variabilité craniométrique de Crocidura
olivieri
|
Paramètre
|
N
|
a
|
b
|
F
|
Probabilité
|
Fcrit.
|
Décision
|
Localités
|
|
CI
|
73
|
5
|
68
|
1,79402839
|
0,12574718
|
2,34957301
|
DNS
|
|
|
PL
|
79
|
5
|
74
|
1,65230142
|
0,15688954
|
2,33827763
|
DNS
|
|
|
UTR
|
79
|
5
|
74
|
3,24256817
|
0,01057876
|
2,33827763
|
DS
|
Mk-yo,Ku-Yo
|
|
MB
|
78
|
5
|
73
|
3,14301469
|
0,01263185
|
2,34002757
|
DS
|
Ms-Ku,Ku-Yo
|
|
IW
|
79
|
5
|
74
|
1,74428051
|
0,13509572
|
2,33827763
|
DNS
|
|
|
GW
|
73
|
5
|
68
|
1,6137871
|
0,16818289
|
2,34957301
|
DNS
|
|
|
PGW
|
78
|
5
|
73
|
2,57330387
|
0,03359207
|
2,34002757
|
DS
|
Ku-Yo
|
|
HB
|
73
|
5
|
68
|
0,81657893
|
0,54205092
|
2,34957301
|
DNS
|
|
|
LTR
|
79
|
5
|
74
|
3,21023661
|
0,01118483
|
2,33827763
|
DS
|
Mk-Yo, Ku-Yo
|
|
CH
|
77
|
5
|
72
|
5,57109788
|
0,00021506
|
2,34182753
|
DS
|
Mk-Yo, Ku-Yo, Mb-Yo
|
|
P4-M3
|
79
|
5
|
74
|
3,17920501
|
0,01179923
|
2,33827763
|
DS
|
Mk-Yo
|
|
U1-U3
|
79
|
5
|
74
|
5,79678991
|
0,00014336
|
2,33827763
|
DS
|
Ms-Yo, Ml-Ku,Mk-Yo,
Mb-Yo, Ku-Yo
|
|
m1-m3
|
79
|
5
|
74
|
2,65877097
|
0,02890373
|
2,33827763
|
DS
|
Mk-Yo
|
|
M3W
|
78
|
5
|
73
|
2,59782818
|
0,03221182
|
2,34002757
|
DS
|
Ms-Yo
|
|
M3L
|
78
|
5
|
73
|
1,42304079
|
0,2261423
|
2,34002757
|
DNS
|
|
Légende :
N : Total de ddl (degré de liberté),
a : ddl entre les groupes,
b : ddl à l'intérieur des groupes ,
F : test effectué,
Mk : Maïko, Yo : Yoko, Ku : Kungulu, Ms : Masako, Ml :
Malimba, Mb : Mbiye,
DS : Différence Significative,
DSN : Différence Non Significative.
Le tableau (9) montre qu'il existe une variabilité
inter localités pour les mesures suivantes : UTR, MB, PGW, LTR, CH,
P4-M3, U1-U3, m1-m3 et M3W. Ces différences significatives
affichées sur le plan craniométrique entre les individus de C.
olivieri issus des différentes localités varient selon mesures de
la manière suivante :
Pour la longueur de la rangée dentaire supérieure
(UTR), la différence significative(DS) se présente entre les
localités Maïko-Yoko et Kungulu-Yoko.
Pour la longueur du maxillaire (MB), elle est observée
entre Masako-Kungulu et KunguluYoko.
Pour la longueur du post-glénoïde (PGW), elle
s'observe entre Kungulu-Yoko.
Pour longueur de la rangée dentaire inférieure
(LTR), cette différence est entre Maïko-Yoko et Kungulu-Yoko.
La hauteur de coronoïde (CH) présente une
différence significative entre Maïko-Yoko, Mbiye-Yoko et
Kungulu-Yoko.
Pour la distance entre les prémolaires (P4-M3), elle
s'observe entre Maïko-Yoko.
Pour la distance entre les cuspides ou unicuspides (U1-U3),
c'est entre MasakoYoko,Malimba-Kungulu, Maïko-Yoko, Mbiye-Yoko et
Kungulu-Yoko qu'a été observée cette différence.
Pour la mesure m1-m3, cette différence s'observe entre
Maïko-Yoko.
Pour la largeur de la base de molaire M3 (M3W), elle est
présente entre Masako-Yoko.
3.1.3.2. Scutisorex somereni
Tableau (10). Résultats du test d'Anova relatif
à la variabilité craniométrique de Scutisorex
somereni
|
Paramètres
|
N
|
a
|
b
|
F
|
Probabilité
|
F crit.
|
Décision
|
Localités
|
|
CI
|
67
|
3
|
64
|
0,99343221
|
0,40167539
|
2,74819091
|
DSN
|
|
|
PL
|
67
|
3
|
64
|
0,90756048
|
0,44244388
|
2,74819091
|
DSN
|
|
|
UTR
|
67
|
3
|
64
|
2,8174834
|
0,04601138
|
2,74819091
|
DS
|
Mb-Mk
|
|
MB
|
67
|
3
|
64
|
1,93176689
|
0,13332487
|
2,74819091
|
DSN
|
|
|
IW
|
67
|
3
|
64
|
4,75952171
|
0,00466401
|
2,74819091
|
DS
|
Mk-Yo
|
|
GW
|
67
|
3
|
64
|
0,36314132
|
0,77981983
|
2,74819091
|
DSN
|
|
|
PGW
|
67
|
3
|
64
|
1,56245249
|
0,2071262
|
2,74819091
|
DSN
|
|
|
HB
|
67
|
3
|
64
|
1,77914276
|
0,16003503
|
2,74819091
|
DSN
|
|
|
LTR
|
67
|
3
|
64
|
3,12051549
|
0,03201186
|
2,74819091
|
DS
|
Mb-Mk
|
|
CH
|
66
|
3
|
63
|
6,36230026
|
0,00077653
|
2,75054116
|
DS
|
Yo-Mk
|
|
P4-M3
|
67
|
3
|
64
|
0,93629752
|
0,42841907
|
2,74819091
|
DSN
|
|
|
U1-U3
|
67
|
3
|
64
|
1,89045618
|
0,14008803
|
2,74819091
|
DSN
|
|
|
m1-m3
|
67
|
3
|
64
|
1,19898609
|
0,31733464
|
2,74819091
|
DSN
|
|
|
M3W
|
66
|
3
|
63
|
4,51393564
|
0,00624239
|
2,75054116
|
DS
|
|
|
M3L
|
66
|
3
|
63
|
1,34380766
|
0,26820007
|
2,75054116
|
DSN
|
|
Légende :
N : Total de ddl (degré de liberté),
a : ddl entre les groupes,
b : ddl à l'intérieur des groupes,
F : test effectué,
Mk : Maïko, Yo : Yoko, Mb : Mbiye, DS : Différence
Significative,
DSN : Différence Non Significative.
De ce tableau, se dégage des différences
significatives (DS) au niveau des paramètres suivants : UTR, IW, LTR,
CH, M3W.
Pour le paramètre longueur de la rangée dentaire
supérieure (UTR), la différence significative s'observe entre les
localités Maïko-Mbiye.
Pour la longueur inter-orbitale la plus petite (IW), elle
s'observe entre Maïko-Yoko.
Pour la longueur de la rangée dentaire inférieure
(LTR), cette différence se présente entre Maïko-Mbiye.
Pour la hauteur de coronoïde (CH), elle s'observe entre
Mbiye-Yoko.
Pour largeur de la base de la molaire M3 (M3W), le test a
signalé l'existence d'une différence significative mais n'a pas
pu indiquer si cette différence se situe entre quelles
localités.
Concernant les résultats présentés dans
les tableaux (9) et (10), les p values (test de Tukey) qui nous ont permis
d'identifier avec précisions les localités qui présentent
des différences significatives entre elles pour certaines mesures sont
présentées en annexes.
3.2. VERIFICATION DE LA VARIABILITE DES DONNEES
CRANIOMETRIQUES PAR ACP (Analyse en Composantes Principales)
Un essai de regroupement des données
craniométriques par l'ACP (Fig.4) à partir de la matrice de
corrélation des variables montre que hormis les variables injustement
considérés comme C.olivieri notamment les N° 9907 ;
Leg1736, (qui après vérification est un S.somereni mais
traité comme C.olivieri), MBA 09, ( jeune S.somereni)
les individus de trois blocs semblent former un seul groupe. Tel est aussi le
cas pour S.somereni (Fig.5) chez qui les N° 9897, MBA 16, Leg
2859 ne sont pas des S.somereni mais plutôt des individus de
taille intermédiaires.
.
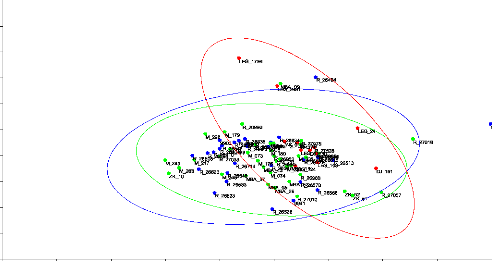
Fig. (4) A.c.p des individus de C.olivieri (composantes
1&2) de trois blocs forestiers toutes localités confondues:
milieu insulaire (en bleu), rive droite (en vert) et Rive
gauche (en rouge).

Fig. (5) Acp des individus de S.somereni (composantes
1&2) de trois blocs forestiers toute localités confondues:
milieu insulaire (en bleu), rive droite (en vert) et Rive
gauche (en rouge).
3.3. DIMORPHISME SEXUEL SECONDAIRE SUR BASE DES DONNEES
CRANIOMETRIQUES
Nous avons, juste à titre indicatif fait le dimorphisme
sexuel pour les deux espèces car cet aspect a déjà
été abordé par Akuboy (2009). Nos analyses se rapportent
aux collections de Crocidura olivieri de la rive droite et
Scutisorex somereni de la rive gauche à cause du nombre
réduit des échantillons dans d'autres blocs
étudiés.
a) Crocidura olivieri
Tableau(11). Résultats du test F de
Snédécor relatifs au dimorphisme sexuel secondaire chez
Crocidura olivieri de la rive droite
|
Paramètres Sexe
|
Eff
|
ddl
|
variance
|
F test
|
Probabilité Décision
|
|
CI
|
M
|
18
|
17
|
3,69038
|
2,71470429
|
0,0369076
|
DS
|
|
F
|
14
|
13
|
1,3594
|
|
|
|
|
PL
|
M
|
20
|
19
|
0,57781
|
3,03536503
|
0,022743
|
DS
|
|
F
|
14
|
13
|
0,19036
|
|
|
|
|
UTR
|
M
|
20
|
19
|
0,43466
|
2,2676251
|
0,0676656
|
DS
|
|
F
|
14
|
13
|
0,19168
|
|
|
|
|
MB
|
M
|
20
|
19
|
0,42714
|
3,85472682
|
0,0082309
|
DS
|
|
F
|
14
|
13
|
0,11081
|
|
|
|
|
IW
|
M
|
20
|
19
|
0,15605
|
2,85176917
|
0,0291403
|
DS
|
|
F
|
14
|
13
|
0,05472
|
|
|
|
|
GW
|
M
|
18
|
17
|
0,83956
|
0,83903139
|
0,3610406
|
DNS
|
|
F
|
14
|
13
|
1,00062
|
|
|
|
|
PGW
|
M
|
19
|
18
|
0,41752
|
4,3923103
|
0,0047015
|
DS
|
|
F
|
14
|
13
|
0,09506
|
|
|
|
|
HB
|
M
|
18
|
17
|
0,23085
|
2,13543831
|
0,0853749
|
DNS
|
|
F
|
14
|
13
|
0,10811
|
|
|
|
|
LTR
|
M
|
20
|
19
|
0,38357
|
2,47078693
|
0,0500061
|
DNS
|
|
F
|
14
|
13
|
0,15524
|
|
|
|
|
CH
|
M
|
20
|
19
|
0,88541
|
6,92996052
|
0,0004661
|
DS
|
|
F
|
|
|
0,12776
|
|
|
|
|
P4-M3
|
M
|
20
|
19
|
0,15951
|
1,42992296
|
0,2577952
|
DNS
|
|
F
|
14
|
13
|
0,11155
|
|
|
|
|
U1-U3
|
M
|
20
|
19
|
0,1621
|
1,34642416
|
0,2956886
|
DSN
|
|
F
|
14
|
13
|
0,12039
|
|
|
|
|
m1-m3
|
M
|
20
|
19
|
0,11553
|
2,25376216
|
0,0691017
|
DNS
|
|
F
|
14
|
13
|
0,05126
|
|
|
|
|
M3W
|
M
|
20
|
19
|
0,05329
|
1,03494581
|
0,4863381
|
DNS
|
|
F
|
14
|
13
|
0,05149
|
|
|
|
|
M3L
|
M
|
20
|
19
|
0,00899
|
1,03455903
|
0,4866257
|
DNS
|
|
F
|
14
|
13
|
0,00869
|
|
|
|
Il ressort de ce tableau que 7 mesures (CI, PL, UTR, MB, IW,
PGW et CH) présentent des différences
significatives attestant qu'elles permettent d'établir un dimorphisme
sexuel secondaire chez les individus de Crocidura olivieri de la rive
droite de notre collection.
b) Scutisorex somereni
Tableau(12). Résultats du test F de
Snédécor relatifs au dimorphisme sexuel secondaire chez
Scutisorex somereni de la rive gauche
|
Paramètres Sexe
|
Eff
|
ddl
|
variance
|
F test
|
Probabilité Décision
|
|
CI
|
M
|
12
|
11
|
1,02266
|
1,95182298
|
0,1412971
|
DNS
|
|
F
|
12
|
11
|
0,52395
|
|
|
|
|
PL
|
M
|
12
|
11
|
0,42806
|
2,68409852
|
0,0581526
|
DNS
|
|
F
|
12
|
11
|
0,15948
|
|
|
|
|
UTR
|
M
|
12
|
11
|
0,17545
|
2,07898021
|
0,1202188
|
DNS
|
|
F
|
12
|
11
|
0,08439
|
|
|
|
|
MB
|
M
|
12
|
11
|
0,08937
|
0,59921778
|
0,204445
|
DNS
|
|
F
|
12
|
11
|
0,14915
|
|
|
|
|
IW
|
M
|
12
|
11
|
0,07377
|
2,60698222
|
0,0635395
|
DNS
|
|
F
|
12
|
11
|
0,0283
|
|
|
|
|
GW
|
M
|
12
|
11
|
0,38669
|
1,40202821
|
0,2923483
|
DNS
|
|
F
|
12
|
11
|
0,27581
|
|
|
|
|
PGW
|
M
|
12
|
11
|
0,10762
|
1,07769458
|
0,4517333
|
DNS
|
|
F
|
12
|
11
|
0,09986
|
|
|
|
|
HB
|
M
|
12
|
11
|
0,13309
|
1,44482092
|
0,2759518
|
DNS
|
|
F
|
12
|
11
|
0,09212
|
|
|
|
|
LTR
|
M
|
12
|
11
|
0,0731
|
0,60731999
|
0,2105808
|
DNS
|
|
F
|
12
|
11
|
0,12036
|
|
|
|
|
CH
|
M
|
12
|
11
|
0,10204
|
0,76966019
|
0,335847
|
DNS
|
|
F
|
12
|
11
|
0,13258
|
|
|
|
|
P4-M3
|
M
|
12
|
11
|
0,18494
|
3,18035435
|
0,0337716
|
DS
|
|
F
|
12
|
11
|
0,05815
|
|
|
|
|
U1-U3
|
M
|
12
|
11
|
0,10584
|
2,75186622
|
2,7518662
|
DNS
|
|
F
|
12
|
11
|
0,03846
|
|
|
|
|
m1-m3
|
M
|
12
|
11
|
0,04393
|
1,4199236
|
0,2853738
|
DNS
|
|
F
|
12
|
11
|
0,03094
|
|
|
|
|
M3W
|
M
|
12
|
11
|
0,02018
|
0,67736439
|
0,2644913
|
DNS
|
|
F
|
12
|
11
|
0,02979
|
|
|
|
|
M3L
|
M
|
12
|
11
|
0,00323
|
0,89568875
|
0,4291495
|
DNS
|
|
F
|
12
|
11
|
0,0036
|
|
|
|
Le tableau(12) révèle qu'il existe un seul
paramètre (P4-M3) permettant de dégager un dimorphisme sexuel
secondaire chez les individus Scutisorex somereni de la rive gauche
qui constitue notre matériel.
3.4. STRUCTURE DES POPULATIONS
3.4.1. Crocidura olivieri
1° Males
Nous illustrons la manière dont se présentent les
classes d'age dans la population des mâles chez Crocidura
olivieri de notre collection et cela par localité.
|
7 6 5 4 3 2 1 0
|
|
|
TW2A TW2B TW3A TW3B TW4
|
Fig. (6) : Les différentes classes d'age des males de
Crocidura olivieri par localité.
La figure (6) illustre que 4 classes d'age (Subadultes, jeunes
adultes, adultes, vieux adultes) sur les 5 sont représentées dans
diverses localités qui ont été identifiées dans
l'ensemble de nos matériels. De collections étudiées,
celles de Kungulu et Maiko présentent les 4 classes d'age. On observe un
pic élevé des adultes (TW3A) à Maïko et Mbiye. Aucun
Sénile n'a été observé pour les males Crocidura
olivieri de notre collection.
2° Femelles
Voyons comment se présente la structure de population des
femelles chez Crocidura olivieri du point de vue classe d'age.
|
5
4,5
4
3,5
3
2,5
2
1,5
|
|
|
TW2A TW2B TW3A TW3B TW4
|
|
1
0,5
0
|
|
Fig. (7) : Les différentes classes d'age des femelles de
Crocidura olivieri par localités.
Cette figure montre que même pour les femelles
Crocidura olivieri, les adultes sont nombreux avec le pic le plus
élevé dans la localité de Maïko. Un seul individu
sénile a été observé dans cette même
localité.
3.4.2. Scutisorex
somereni1°Mâles
Nous présentons la répartition des
différentes classes d'age constituant le male de cette espèce de
notre collection en tenant compte de la localité où elle fut
capturée.
9
8
7
6
5
4
3
2
1
0
KUNG MAIKO
MALIMBA MBIYE
YOKO
TW2A TW2B TW3A TW3B TW4
Fig. (8) : Les différentes classes d'age des males chez
les Scutisorex somereni
Ce graphique signale une grande représentativité
des adultes avec le nombre le plus élevé dans la réserve
de la Yoko et l'ile Mbiye. Les séniles et les subadultes sont faiblement
représentés d'une manière générale.
2° Femelles
Nous faisons autant pour les femelles de cette espèce.
0
KUNG MAIKO MALI MBIYE YOKO
6
5
4
3
2
1
TW2A TW2B TW3A TW3B TW4
Fig. (9) : Les différentes classes d'age des males chez
les Scutisorex somereni.
Celui-ci démontre que les adultes et les jeunes adultes
sont représentés dans toutes les localités à
l'exception de l'ile Kungulu où on ne trouve aucune femelle mais c'est
à la Yoko qu'on observe un grand nombre d'adultes. Il signale aussi
l'absence des séniles dans toutes les localités.
CHAPITRE 4. DISCUSSION
Nous avons prélevé 15 mesures
craniométriques (paramètres) contrairement à Akuboy (2009)
qui en avait seulement prélevé 13 pour son étude sur le
dimorphisme sexuel secondaire chez Crocidura olivieri et
Scutisorex somereni.
Comme le signale les tableaux (1) et (2) qui nous
présentent des valeurs statistiques des mesures craniométriques
de C.olivieri et S.somereni, il existerait des mesures
stables (qui varient très peu càd dont le coefficient de
variation est inférieur à 5%) dans les deux populations qui
pourraient être considérer comme fiables pour dégager des
éventuelles variabilités craniométriques.
Pour le test F de Snédécor, les tableaux (3),
(4), (5), (6), (7), (8) ont montré qu'il existe plusieurs mesures
présentant des différences significatives qui
témoigneraient une certaine variabilité craniométrique au
sein de différents blocs étudiés. Cette variabilité
s'expliquerait d'abord par le fait que les caractéristiques de ces
habitats sont différentes.
Beaucoup d'auteurs comme Katuala (2009) par exemple qui ont
effectués des études biogéographiques sur les petits
mammifères de la région ont signalé que le fleuve Congo
jouerait le rôle de barrière écologique pour ce groupe
d'animaux. La variabilité observée entre les individus de la rive
gauche et ceux de la rive droite de ces deux espèces
étudiées serait due à la présence de cette
barrière et expliquerait l'existence des mesures craniométriques
qui ont des différences significatives entre les spécimens de ces
deux rives.
En faisant le test d'Anova pour voir s'il existerait une
variabilité inter localités, les tableaux (9) et (10)
appuyé par l'annexe 3, signalent que bien qu'il existe une quelconque
variabilité entre les localités, celle-ci respecte la logique de
variabilité inter blocs. C'est à dire qu'on n'a pas trouvé
des mesures qui se démarquent entre les individus des localités
se situant dans un même bloc. Ce constant corrobore ce que nous avons dit
plus haut.
Nous restons tout de même sans explication pour le fait
que pour le tableau(10), le test d'Anova a signalé qu'il existerait une
différence significative(DS) pour le paramètre M3W (largeur de la
base de la molaire M3) mais le test post hoc (le test de Tuckey) au moyen du
logiciel « Past 2.0 >> n'a pas su déterminer avec
précision si celle-ci se retrouverait entre quelle localité et
quelle autre.
Les ACP (Analyses en Composantes principales) nous ont permis
de confirmer que notre matériel appartenait effectivement soit à
C.olivieri soit S.somereni comme considérait au
départ à l'exception de quelques spécimens qui se sont
démarqués de leur groupe et appartiendraient à un autre
groupe que celui dans lequel il était répertorié. Cette
démarcation serait peut être aussi due au fait que l'individu
serait encore jeune et que ses différentes mesures prises ne
correspondent pas encore à celles de son groupe.
Considérant les tableaux (11) et (12) relatifs au
dimorphisme sexuel secondaire, chez C.olivieri de la rive droite,
plusieurs mesures craniométriques ont présenté des
différentes significatives et permettraient d'établir le
dimorphisme sexuel secondaire. Un seul paramètre (P4-M3) chez
S.somereni permettrait d'établir ce dimorphisme.
Akuboy (2009) avait aussi répertorié plusieurs
mesures permettant d'établir le dimorphisme sexuel mais n'avait obtenu
aucune mesure présentant une différence significative et de ce
fait ne permettant pas d'établir un dimorphisme sexuel chez
C.olivieri et S.somereni des localités de Bomane,
Batiamanoka et Kasugho.
Il nous conviendra tout de même de retenir que nous avons
effectué ce dimorphisme sexuel dans notre travail juste à titre
indicatif.
Pour la détermination de classes d'age, nous avons
seulement observé degré de l'usure dentaire des molaires
supérieures et de l'état de fusion de la suture entre la
basioccipital et le basisphénoïde tandis que Nicolas et al (2003)
lors de son étude sur la structure de population et la reproduction de
Heimyscus fumosus avait utilisé deux méthodes : le
degré de l'usure dentaire ainsi que le poids de la bête pour
estimer l'age des animaux.
Il s'est avéré que les adultes étaient
nombreux dans les populations de ces deux espèces dans la plupart des
localités. Les juvéniles sont totalement absent et les
séniles sont faiblement représentés. Ce résultat
s'expliquerait par le fait que comparativement à d'autres classes d'age,
les juvéniles et les très vieux adultes sont moins actifs et se
font difficilement capturés.
En étudiant les Musaraignes de la forêt tropical
du Gabon, Nicolas et al(2004) signala que pour les deux sexes, les vieux
adultes (TW3B et TW4) ont été représentés mais
à faible proportion dans la population. Il remarqua aussi qu'aucun
spécimen des juvéniles de Crocidura batesi et
Paracrocidura schoutedeni n'a été capturé.
Etant donné que notre matériel a
été prélevé d'une collection se trouvant au
laboratoire LEGERA, nous pensons que si on considérait ces populations
en entièretés selon leur milieu de capture, leur structure de
population se pourrait se présenter autrement.
CONCLUSIONS ET SUGGESTION
CONCLUSIONS
Notre matériel biologique était constitué
de 152 spécimens des Musaraignes (81 Crocidura olivieri et 71
Scutisorex somereni) qui font partie d'une collection des Soricidae
capturés par le laboratoire LEGERA à Kisangani et diverses
localités de ses environs.
Sur chaque crâne, nous prenions 15 mesures. Pour la
détermination des classes d'age, nous observions le degré de
l'usure dentaire des molaires supérieures et l'état de la fusion
de la suture entre le basioccipital et le basisphénoïde.
Nous avons fait le test F de Snédécor et le test
d'Anova suivi d'un test post hoc de Tukey pour les traitements statistiques de
nos données. Et pour y arriver, nous nous sommes servis du logiciel
« Past 2.0 ».
Il existe des mesures fiables (qui varient peu) permettant de
dégager d'éventuelles variabilités.
Pour Crocidura olivieri, globalement, une seule
mesure (UTR) est stable. Dans les milieux insulaires, il y a aucune mesure
stable. La rive gauche en compte 7 et la rive droite 5 sur les 15 mesures
considérées. De celles-ci, les mesures suivantes se
répètent : PL, UTR, LTR, P4- M3 et m1-m3.
Pour Scutisorex somereni, globalement, 5 mesures (CI,
PL, UTR, LTR, P4-M3) sont stables. Dans les iles, la rive droite et la rive
gauche, nous comptons respectivement 3,10 et 9 mesures sur les 15. Celles qui
se répètent dans les trois blocs sont : CH et P4-M3.
Plusieurs paramètres (mesures craniométriques)
témoignent qu'il existe une certaine variabilité
craniométrique entre les individus de Crocidura olivieri et
Scutisorex somereni de différents blocs
considérés.
Pour C. olivieri, les mesures suivantes : UTR et
m1-m3 ont présenté des différences significatives pour
tous les blocs (les iles, la rive droite et la rive gauche) confondus pris deux
à deux.
Pour S. somereni, seul le paramètre HB a
présenté une différence significative pour les trois blocs
confondus comparés deux à deux.
Mais alors méme s'il existe cette variabilité entre
les blocs chez les individus des espèces étudiées, elle ne
s'observe pas entre les localités d'un méme bloc.
Chez C. olivieri, la mesure qui a signalé une
variabilité dans plusieurs localités est U1-U3. Les
localités dont les individus présentent des différences
significatives pour cette mesure sont : Masako-Yoko, Malimba-Kungulu,
Maïko-Yoko, Mbiye-Yoko et Kungulu-Yoko.
Chez S. somereni, les différences sont
significatives pour :
- La mesure UTR entre les localités
Malimba et Maïko.
- La mesure IW entre les localités
Maïko et Yoko
- La mesure LTR entre les localités
Malimba et Maïko
- La mesure CH entre Yoko et Maïko
Les analyses en composantes principales ont
précisées que dans notre matériel, les individus
identifiés comme C. olivieri ou S. somereni sont
effectivement de ce groupe à l'exception de quelques uns qui s'en
écartent.
D'une manière générale, les populations
de Crocidura olivieri et celles de Scutisorex somereni de
notre collection se repartissent en 5 classes d'age qui sont : les subadultes
(TW2A), les jeunes adultes (TW2B), les adultes (TW3A), vieux adultes (TW3B) et
les séniles (TW4). On note l'absence des juvéniles (TW1) et une
faible représentativité des séniles (très vieux
adultes).
Conclusion et suggestions
SUGGESTION
Nous souhaiterions que les travaux se multiplient dans ce sens
surtout sur la variabilité craniométrique de ces deux
espèces mais aussi pour d'autres car si l'existence de cette
variabilité se confirmait par d'autres travaux futurs, la science fera
un pas de plus dans la connaissance des Musaraignes.
REFERENCES BIBLIOGRAPHIQUES
1. Akuboy, B., 2009. Etude craniométrique
comparée de quelques Musaraignes capturées dans les
localités de Baliko, Batianoka, Bomane et Kasugho.Mémoire
inédit, Fac des Sc. UNIKIS, 57 p.
2. Balekage, B., 2009. Contribution à la connaissance
de la biodiversité des Musaraignes (Soricomorpha,Mammalia) de l'habitat
Forestier du jardin zoologique de Kisangani. TFC inédit, Fac des Sc.
UNIKIS, 29 p.
3. Barrière, P., Nicolas, V. Maro, R., K.,
Yangoundjana, G. et Colyn, M., 2000.Ecologie et structuration des peuplements
de Micromammifères musaraignes et Rongeurs, projet ECOFA II-Forêt
de Ngotto, R.C.A, 55 p.
4. Baruka, G., 2008.Contribution à l'étude du
peuplement de Soricidae (Soricomorpha, Mammalia) de la forêt primaire
dans la réserve forestière de la Yoko (Kisangani, R.D.Congo) .TFC
inédit, Fac des Sc. UNIKIS, 21 p.
5. Dudu,A.,1991. Etude du peuplement d'Insectivores et
Rongeurs de la forét ombrophile de basse altitude du Zaïre
(Kisangani,Masako).Thèse inédite, Univ Antwerpen, vol.1,Belgique,
171 p.
6. Gambalemoke, M., 2008.Contribution à l'étude
de la Biodiversité des Musaraignes (Soricomorpha,Mammalia) des blocs
forestiers inter-rivières du bassin du congodans la région de
kisangani(R.D.Congo) .DES, tome I,Fac.sc,UNIKIS, 121 p.
7. Grassé, P., 1976.Traité
dezoologie:Anatomie,Systématique,Biologie:Mammifères,
Téguments, Squelette.Tome XVI,Fasci I, 405-549 p.
8. Hutterer, R et Schlitter, D,.1996.Shrews of Korup Natinal
Park.Cameroun,with the description of a new Sylvisorex (Mammalia :Soricidae).
57-59 p.
9. Hutterer, R, Riegert,R and Sedlacek,O.,2009.A tiny new
species of Sylvisorex (Mammalia : Soricidae) from the Bamennda
Highlands,Cameroun.Bonner zoologische zoologische Beitrage 56 :151-157 p.
10. Juakaly, M., 2007. Résilience et Ecologie des
Araignées du sol d'une forét Equatoriale de basse altitude
(Réserve Forestière de Masako, Kisangani, R.D.Congo).Thèse
de doctorat inédite, Fac. Sc., Kisangani, 149 p.
11. Lomba, B., 2007. Contribution à l'étude de la
phytodiversité de la Réserve Forestière de la Yoko.DES
Fac.Sc, UNIKIS, 121 p.
12. Katuala, G., 2009.Biodiversité et
biogéographie des Rongeurs Myomorphes et Sciuromorphes (Rodentia :
Mammalia) de quelques blocs forestiers de la région de
Kisangani(R.D.Congo).Thèse de doctorat inédite, Fac.Sc,
Kisangani, 149 p.
13. Kerbis, P,Hutterer,R,Kaliba,P and Mazibuko,L.,2008. First
record of Myosorex (Mammalia :Soricidae) from Malawi with description as a new
species,Myosorex gnoskei.Journal of East African Natural Histoty 97 :65-76.
14. Malemba, K., 2000.Contribution à la
systématique et à l'Ecologie de la Pédofaune (Arthropodes)
de l'Ile Mbiye (Kisangani, R.D.Congo), Mémoire inédit, Fac.Sc,
UNIKIS, 36 p.
15. Mukinzi, I., 1999.Contribution à l'étude
des peuplements des Rongeurs et des Insectivores de l'Ile Kungulu et de la rive
gauche de la rivière Lindi (Kisangani, R.D.Congo). Mémoire
inédit, Fac.Sc, UNIKIS, 74 p.
16. Mukinzi, I., 2009. Composition et structure du peuplement
de Soricidae (Soricomorpha, Mammalia) de la Reserve Forestière de la
Yoko et ses environs (Kisangani, R.D.Congo). DES Fac.Sc, UNIKIS, 68 p.
17. Mukinzi, I, Hutterer, R and Barriere, P., 2009.A new
species of Sylvisorex (Mammalia : Soricidae) from lowland forests north
Kisangani,Democratic Republic of Congo.Mammalia 73 :130-134 p.
18. Musema, B., 2000.Contribution à la connaissance
des Oiseaux de l'le Mbiye (Kisangani, R.D.Congo) : Inventaire,
systématique et étude écoéthologique.Mémoire
inédit, Fac Sc, UNIKIS, 69 p.
19. Mys, B, Van Der Straeten, E and Verheyen, W., 1985.The
biometrical and morphological identification and the distribution of Sorex
aranaeus L., 1758 and S.coronatus Millet, 1828 in Belgium (Insectivora,
Soricidae).Lutra, vol.28, Belgium, 55-69 p.
20. Nicolas, V, Barrière, P et Colyn, M, 2003. Impact of
removal pitfall trapping on the community of Shrews (Mammalia: Soricidae) in
two African tropical forest site, 138 p.
21. Nicolas, V, Wim,W, Verheyen,W, and
Colyn,M.,2003.Population structure and Reproduction of Heimyscus fumosus
(Brosset et al, 1965) in South Western Gabon.Rev.Ecol(Terre de vie),vol.58,
209-215 p.
22. Nicolas, V, Barriere,P and Colyn,M.,2004.Seasonal
variation in population and community structure of Shrews in a tropical forest
of gabon.universsité de Rennes,161- 169 p.
23. Nicolas, V., 2005. Systématique et écologie
des communautés Afrotropicales de Muridae (Mammalia : Rodentia) et de
Soricidae (Mammalia : Insectivora). Thèse de doctorat, université
de Rennes 1, 242 p.
24. Nshimba, S., 2008. Etude floristique, écologique et
phytosociologique des foréts de l'ile Mbiye à Kisangani,
R.D.Congo. Thèse de doctorat inedite, ULB, 255 p.
25. Querrouil, S, Verheyen, E, Dillen, M and Colyn, M,.
2003.Pattern of diversification in two African forest shrews :Sylvisorex
johnstoni and Sylvisorex
ollula(Soricidae,Insectivora) in relation to
paleo-environnemental changes.25-37 p.
26. Van Der Straeten, E., 1984.Etude biométrique des
genres Delphomys et Stochomys avec quelques notes taxonomiques (Mammalia,
Muridae).Rev.zool.afr, vol.98, Fasc.4, 771- 798 p.
27. Verheyen,W., 1962.Contribution à la craniologie
compare des Primates.Les genres Collobus(1811) et
Cercopithecus(Linné(1758).Musée royal de l'afrique
central,annalsserie N°8,sciences zoologiques N°105, 201 p.
TABLE DES MATIÈRES
DEDICACE
REMERCIEMENTS RESUME
SUMMARY
INTRODUCTION 1
1. GENERALITES 3
2. PROBLEMATIQUE 4
3. HYPOTHESE 5
4. OBJECTIFS 5
5. INTERETS 6
6. TRAVAUX ANTERIEURS 6
CHAPITRE 1. MILIEU D'ETUDE 7
1.1. RIVE DROITE 7
1.1.1. Masako 7
1.1.2. Maïko 8
1.1.3. Jardin zoologique de Kisangani 8
1.1.4. Yelenge 8
1.1.5. Malimba 9
1.2. RIVE GAUCHE 9
1.2.1. La réserve forestière de la Yoko 9
1.2.2. Djabir 10
1.3. MILIEUX INSULAIRES 10
1.3.1. Ile Kungulu 10
1.3.2. Ile Mbiye 10
CHAPITRE 2. MATERIEL ET METHODES 13
2.1. MATERIEL BIOLOGIQUE 13
2.2. METHODES 13
2.2.1. Morphométrie 13
2.2.2. Craniométrie 14
2.2.2.1. Préparation du crâne 14
2.2.2.2. Mesures craniométriques 14
2.2.3. L'état du crane 15
2.2.4. Analyse des données 16
CHAPITRE 3. RESULTATS 18
3.1. VARIABILITE CRANIOMETRIQUE 18
3.1.1. Variabilité intra blocs 18
3.1.2. Variabilité inter blocs 21
3.1.2.1. Variabilité inter blocs de Crocidura olivieri
22
3.1.2.2. Variabilité inter blocs de Scutisorex somereni
25
3.1.3. Variabilité inter localités 28
3.1.3.1. Crocidura olivieri 28
3.1.3.2. Scutisorex somereni 30
3.2. VERIFICATION DE LA VARIABILITE DES DONNEES CRANIOMETRIQUES
PAR ACP (Analyse en Composantes Principales) 31
3.3. DIMORPHISME SEXUEL
SECONDAIRE SUR BASE DES DONNEES
CRANIOMETRIQUES 34
3.4. STRUCTURE DES POPULATIONS 36
3.4.1. Crocidura olivieri 36
3.4.2. Scutisorex somereni 38
CHAPITRE 4. DISCUSSION 40
CONCLUSIONS ET SUGGESTION 43
CONCLUSIONS 43
SUGGESTION 45
REFERENCES BIBLIOGRAPHIQUES 46
TABLE DES MATIÈRES 49
|
|



