II -6) Corrosion des armatures :
La corrosion des armatures est induite par la
carbonatation et par la pénétration des ions chlores, c'est pour
cette raison, qu'il faut mieux connaître ces deux altérations
chimiques avant d'étudier la corrosion des bétons armés.
II -6-1) Définition de la corrosion:
Le béton, du fait de sa forte alcalinité,
apporte aux armatures une excellente protection face à la corrosion.
Dans ces conditions de pH, l'acier est protégé grâce
à la formation d'un film extrêmement mince et adhérent
appelé film passif pouvant être constitué de divers
oxydes.
En présence d'eau et d'oxygène, ce film est
détruit par différents agents tels que les chlorures, les
sulfates et le gaz carbonique. Le métal est alors
dépassivé et la corrosion devient possible avec formation de
nouveaux oxydes, dont le volume au moins deux fois supérieur
(jusqu'à six fois supérieur pour certains oxydes) à
celui du fer initial entraînera des fissurations du béton qui
accéléreront le processus de corrosion en facilitant la diffusion
de l'oxygène et des espèces corrosives.
La corrosion des armatures est issue d'un processus
électrochimique qui ne peut se produire que si certaines conditions sont
réunies. En effet pour qu'un acier se corrode, il doit y avoir
simultanément :
- un électrolyte ayant une conductivité
ionique non négligeable ;
- une quantité suffisante d'oxygène
accédant à la zone catholique ;
- la présence d'un agent agressif (comme les ions
chlores). [22]
 
a) Fissuration
b) Éclatement localisé
 
c) Corrosion d'armature.
Figure II -31: Exemples
de détériorations dues à la corrosion des poteaux en
béton armé
dans une bâtisse à Mascara (Photo
A.Bensafir)
II -6-2) Processus de la corrosion :
Il est d'abord important de souligner que la
durabilité de n'importe quelles structures est conditionnée par
le béton qui protège physiquement et chimiquement l'acier de la
corrosion. En effet, la forte alcalinité (pH =13) de la solution
interstitielle contenue dans les pores du béton permet la formation
d'une couche passivante d'oxydes et d'hydroxydes de fer qui protège les
aciers de la corrosion. Cependant, certaines espèces chimiques
délétères, provenant du milieu environnant, peuvent
traverser la barrière physique que constitue le béton d'enrobage,
perturber la stabilité chimique de la couche passivante et corroder les
armatures. La carbonatation du béton par le dioxyde de carbone
(CO2) de l'atmosphère et la pénétration des
ions chlorures (provenant de l `eau de mer, des embruns marins ou des sels de
déverglaçage) sont les deux principales causes de ce
phénomène. [21]
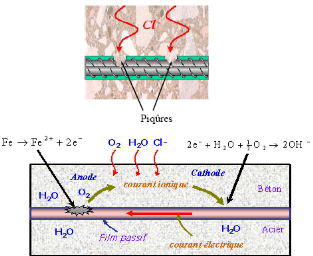
Figure II -32 :
Processus de corrosion dans le béton armé.
[21]
Les processus fondamentaux de la corrosion des aciers dans le
béton sont illustrés sur la figure II -33
suivante :
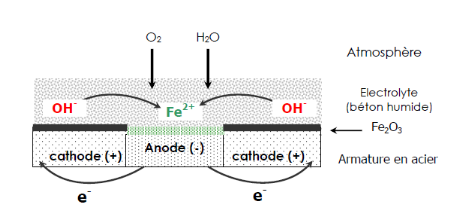
Figure II -33:
Représentation schématique de processus de base de la
corrosion des aciers dans le béton.
L'oxygène qui peut diffuser dans le béton
via le réseau poreux, se dissout dans la solution interstitielle et
finit par atteindre la surface de l'acier. Sur cette surface, dans la zone
catholique, l'oxygène est réduit en ion hydroxyde
(OH-) selon la réaction électronique :
O2 + 2H2O ?
4e- + 4OH-
C'est, dans la plupart des cas, la réaction
cathodique associée à la corrosion des aciers dans le
béton. Cependant, dans le cas d'un béton carbonaté ayant
un pH moins élevé (8-9), l'eau peut être réduite en
dihydrogène selon la réaction:
2H2 O+ 2e- ? H2 +
20H-
Quelque soit la réaction cathodique mise en jeu, la
production d'ions hydroxyde fait augmenter le PH de la solution interstitielle
au niveau de la zone cathodique.
La réaction anodique correspondante est la
dissolution de l'acier conformément à la réaction :
Fe? Fe2+ + 2e- . Celle-ci entraîne une
diminution de la section de l'acier qui peut finir par rompre.
Les ions Fe2+, produits intermédiaires
de la corrosion, pouvant s'oxyder ensuite en Fe3+ sous certaines
conditions, s'accumulent à la surface de l'acier ou sont dissous dans la
solution interstitielle ou bien encore diffusent loin de l'armature en fonction
des caractéristiques du milieu.
Dans la solution interstitielle du béton,
normalement riche en oxygène et possédant un pH
élevé, les ions Fe2+ peuvent rester sous la forme
Fe (OH)2 ou être oxydés en ions
Fe3+, qui hydrolysés se trouvent alors sous la forme Fe
(OH)3, formant ainsi un mince film passif à la surface
de l'acier, ce qui va retarder la dissolution du fer. Dans ce cas, l'acier est
bien protégé et il n'y aura pas de dommages détectables
dus à la corrosion.
Sous certaines conditions, le cas lorsque le béton
a été carbonaté et que le pH de la solution interstitielle
est descendu en dessous de 9 ou lorsqu'une qualité suffisante d'ions
chlorure (Cl-) a pénétré dans le béton,
saturé en eau, et atteint l'armature de ce fait, la section de l'acier
peut continuer de se réduire et la rupture de l'armature se produire. Ce
processus, préjudiciable à la durée de vie d'un ouvrage,
est favorisé lorsque le béton est saturé en eau car
l'évacuation des ions Fe2+ de la surface de l'acier est
facilitée. Ces ions peuvent alors migrer à la surface du
béton et y former des rouilles mais ce type de dommage dû à
la corrosion n'a pas d'impact significatif sur l'enrobage du
béton ; il améliore même l'adhérence du
béton sur l'acier.
La corrosion devient préjudiciable lorsque la
vitesse de corrosion de l'acier est très élevée et que les
produits de corrosion, ne pouvant être évacués de la zone
de corrosion, s'accumulent à la surface de l'acier. C'est le cas si la
solution interstitielle est riche en oxygène et en espèces
agressives, et si l'enrobage de béton n'est pas assez humide. Une partie
des ions Fe2+ dissous peuvent alors s'oxyder et être
transformés en oxydes ferriques hydratés
(Fe2O3, H2O) qui se déposent ensuite,
avec des oxydes et hydroxydes ferreux, à l'interface acier béton.
Le volume des produits de corrosion étant 2 à 6 fois
supérieur à celui du métal, une contrainte d'expansion se
crée à cette interface plus acier est corrodé, plus cette
contrainte est importante, et lorsque celle-ci devient plus importante que la
résistance à la traction de l'enrobage, des fissures
apparaissent. Ces fissures vont accélérer la
pénétration des espèces agressives et de ce fait les
processus de corrosion. Un processus corrosion ? fissures
?pénétration d'espèces agressives ? plus de corrosion ?
plus de fissures ?plus d'espèces agressives ... s'instaure.
[22]
| 


