|
Université Abdelmalek Essaâdi
i
Faculté des Sciences
Tétouan
Département de Biologie
|
|

Licence d'Etudes Fondamentales
Filière : Science de la vie
Parcours : Biologie cellulaire et moléculaire
Titre :
1 La maladie de
Basedow : rôle du système immunitaire.
Présenté par :
CHAJAI Karim
Soutenu le 29/06/2013
Devant les membres du jury :
|
Nom et Prénom
|
Etablissement
|
Qualité
|
|
Pr. Sanae ZINBI
|
Faculté des sciences
|
Président
|
|
Pr. Zaynab M'GHARA
|
Faculté des sciences
|
Examinateur
|
|
Pr. Ali OUAROUR
|
Faculté des sciences
|
Directeur
|
Année Académique 2012/2013
2
Remerciements
Dans ce remerciement, je tiens tout d'abord à
remercier Dieu le tout puissant et miséricordieux, qui m'a donné
la force et la patience d'accomplir ce modeste travail.
Je tiens à remercier particulièrement mon
encadrant Pr. Ali OUAROUR d'avoir accepté d'encadrer ma recherche ;
Vos précieux conseils, vos explications et orientations qui m'ont
éclairé la méthodologie de la recherche et votre aide
durant toute la période de la réalisation de ce modeste
travail.
Mes vifs remerciements vont également aux membres
du jury Pr. Sanae ZINBI et Pr. Zaynab M'GHARA pour l'acceptation d'examiner mon
travail.
Je profite l'occasion pour exprimer mes sincères
remerciements, généralement, à tous mes enseignants qui
ont veillé à me donner du savoir tout au long de ma
carrière scolaire et, en particulier, à tous mes professeurs de
la faculté des sciences de Tétouan qui m'ont enseigné et
qui par leurs compétences m'ont soutenu durant toutes ces 3
années de licence.
![]()
Je dédie ce travail
A Mes très chers parents ;
Vous êtes perpétuellement à mes
cotés pour me soutenir et m'encourager.
Aucun hommage ne saurait exprimer la grandeur de mon amour,
mon estime, et ma profonde reconnaissance pour les sacrifices et les efforts
consentis pour moi. J'espère avoir été à la hauteur
de vos attentes, et que Dieu vous garde afin que je puisse vous combler
à mon tour.
A mon frère et ma soeur ;
Que ce modeste travail soit le net reflet de ma
reconnaissance pour le soutien moral, l'affection fraternelle, ainsi que la
compréhension et les encouragements dont vous avez toujours fait preuve.
Que Dieu voue protège et guide vos pas avec mes voeux de succès
et bonheur à l'éternité.
A toutes ma famille ;
Je me permets, par le biais de ce modeste travail, de vous
apporter la chaleur de notre affection, témoignage de liens affectueux
qui m'attache.
A tous mes amis ;
Vous m'avez offert ce qu'il y a de plus cher : la
sincère amitié.
Que Dieu puisse vous combler de la santé et de
longue vie avec notre affection la plus profonde.
Résumé
Le système immunitaire est normalement conçu
pour protéger l'être vivant contre les attaques dues aux agents
pathogènes étrangers par le biais de sa capacité de
distinguer les propres constituants des organismes, le "soi", de ceux des
agents exogènes, le "non soi". Cependant, Le phénomène de
tolérance au "soi" peut,
parfois, se dérégler et aboutir à des réponses qui
perdent leur destination et attaquent des cibles du
"soi" : C'est l'auto-immunité.
Elle est la conséquence directe de la rupture de la tolérance du
"soi" provoquant ce qu'on appelle des
maladies auto-immunes. Il s'agit de pathologies
hétérogènes durant lesquelles le système
immunitaire peut attaquer des auto-antigènes partagés par
plusieurs cellules de l'organisme comme il peut attaquer des
auto-antigènes spécifiques d'un organe donné. La
thyroïde représente l'un des organes les plus menacés par
les attaques auto-immunes dans le corps humain.
La glande thyroïde est une glande endocrine qui, par
l'excrétion de ses hormones sous l'influence de la
thyréostimuline
(thyroid-stimulating hormone, TSH), assure le déroulement
métabolique normal des cellules de l'organisme. Lorsque des
auto-anticorps fabriqués par les lymphocytes B se lient aux
récepteurs membranaires de la thyréostimuline, la thyroïde
devient hyperactive en secrétant plus d'hormones thyroïdiennes
provoquant une maladie auto-immune dite la maladie de Basedow.
Ce travail tente d'expliquer les facteurs prédisposant
responsables de l'apparition de cette maladie, le rôle du
mécanisme auto-immun dans l'apparition de l'hyperthyroïdie, et par
quelles approches thérapeutiques les dégâts peuvent-ils se
corriger.
Mots clés : auto-immunité, glande
thyroïde,
thyréostimuline
(TSH), auto-anticorps anti-récepteur TSH (TRAK).
Liste d'abréviations
Ac : Anticorps
Ag : Antigène
ATS :
AntiThyroïdiennes de
Synthèse
auto-Ac :
Auto-Anticorps
auto-Ag :
Auto-Antigène
CMH : Complexe
Majeur
d'Histocompatibilité
HLA : Antigène
Leucocytaire Humain
HT : Hormone
Thyroïdiennes
I131 : Iode Radioactif
LB : Lymphocyte B
LED : Lupus Erythémateux
Disséminé
LT : Lymphocyte T
LT rég: Lymphocyte T régulateur
MAI : Maladie Auto-Immune
R-TSH : Récepteur de la TSH
SI : Système Immunitaire
T3 : Triiodothyronine
T4 : Thyroxine
Tg : Thyroglobuline
TPO : Thyroperoxydase
TRAK : Anticorps Anti-récepteurs de la TSH
TSH : Thyroid-Stimul Hormon
Sommaire
1. INTRODUCTION
3
2. Le
phénomène de l'auto-immunité
14
2.1. Généralité : la
tolérance immunitaire
14
2.2. Définition
16
2.3. Types de réponses
auto-immunes
17
2.4. Causes de l'auto-immunité
18
2.4.1. Facteurs génétiques
19
2.4.2. Facteurs environnementaux
21
2.5. Mécanismes d'attaque
23
3. La glande
thyroïdienne
26
3.1. Anatomie
26
3.2. Histologie
27
3.3. Mode de fonctionnement et hormones
thyroïdiennes
28
3.3.1. Structure des hormones
thyroïdiennes
29
3.3.2. Mode de fonctionnement des
follicules et synthèses des hormones thyroïdiennes
29
3.3.3. Régulation de la fonction
thyroïdienne
31
3.4. Rôles physiologiques
32
4. La maladie de
Basedow
34
4.1. Généralité
34
4.2. Facteurs prédisposant :
génétiques et environnementaux
37
4.3. Mécanismes
immunopathologiques
41
4.4. Symptômes et formes
cliniques
44
4.5. Diagnostic
49
4.6. Traitements
50
4.6.1. Traitement médical
50
4.6.2. Traitement par iode radioactif
52
4.6.3. Traitement par chirurgie
52
4.7. Complications et maladies
associées
53
4.8. Conclusions et perspectives
54
Références
bibliographiques
55
Préambule
Les maladies auto-immunes constituent la troisième
cause de mortalité dans le monde après les cancers et les
maladies cardiovasculaires ; ce sont la conséquence d'une
réponse inappropriée des cellules du système immunitaire
vis-à-vis des constituants propres de l'organisme : ces derniers
sont attaqués comme s'il s'agissait de substances
étrangères.
Les maladies auto-immunes, telles que les dysthyroïdies
auto-immunes, résultent d'une combinaison de plusieurs
phénomènes immunologiques qui conduisent, au final, à la
rupture de la tolérance périphérique aux antigènes
du «soi» et donc à une réponse auto-immune.
Ce modeste travail de mémoire sera consacré
à un type particulier de dysthyroïdies auto-immunes, la maladie de
Basedow ou maladie de graves. Il s'agit d'une cause principale de
l'hyperthyroïdie où plusieurs facteurs, tant
génétiques qu'environnementaux, contribuent au
développement de la maladie et à la persistance d'auto-anticorps
stimulants dirigés contre la thyroïde.
Ce travail présentera, dans un premier chapitre, une
revue générale sur le phénomène
d'auto-immunité, puis, par un second chapitre, il apportera des
généralités sur le fonctionnement normale de la glande
touchée par la maladie, la glande thyroïde, pour en fin,
grâce à un troisième chapitre, seront discutés
certains facteurs prédisposant à l'apparition de la maladie de
Basedow, les principaux symptômes, le diagnostic et les approches
thérapeutiques disponibles contre cette maladie.
INTRODUCTION
Dans l'environnement qui nous entoure (air, eau, terre,
aliments, etc.), il existe de nombreux organismes pathogènes
microscopiques qui sont en contacte permanent avec notre corps, et qui
représentent un véritable danger pour notre santé
puisqu'ils sont souvent les causes directes de maladies. La seule chose qui
nous protège de leurs dangers et qui nous permet de rester souvent en
bonne santé c'est l'immunité.
L'immunité est donc définie comme la
résistance aux maladies, et plus spécifiquement aux maladies
infectieuses. L'ensemble des cellules, des tissus et des molécules qui
concourent à opposer une résistance aux infections est
appelé système immunitaire (SI), et la réaction
coordonnée de ces cellules et molécules contre les germes
pathogènes porte le nom de réponses immunitaires
(
Abbas
et
Lichtman,
2008). Le SI est un système diffus constitué de nombreuses
structures discrètes, comprenant la moelle osseuse, le thymus, la rate,
et les ganglions lymphatiques, ainsi que de nombreuses sortes de cellules
sanguines circulant librement dans le sang, appelées lymphocytes :
Ce sont les petites cellules rondes que l'on appelle « globules
blancs ». Les cellules du SI sont produites dans la moelle osseuse et
certaines reçoivent une éducation supplémentaire dans le
thymus où ils terminent leur maturation, notamment les lymphocytes T
(LT). Elles se déploient alors pour aller occuper l'ensemble du corps,
à l'exception du cerveau, (Rensberger, 1999) prêtes
à commencer leurs fonctions protectrices.
La fonction physiologique du SI est de prévenir et
d'éradiquer les infections déclarées (
Abbas
et
Lichtman,
2008) tout en répondant de façon appropriée
à un nombre considérable d'agents distincts et potentiellement
pathogènes qui pénètrent et envahissent l'organisme humain
(
Boutammina,
2012).
Le système de défense de l'organisme se compose
d'une immunité innée ou naturelle, responsable de la protection
initiale contre les infections (dont les éléments participants
sont une surface épithéliale ou barrière, des neutrophiles
et des macrophages, des cellules Natural killer, un certain nombre de
protéines incluant des cytokines et des composants du système du
complément (
Kierszenbaum,
2006), et d'une immunité adaptative ou acquise qui se
développe plus lentement et met en oeuvre une défense tardive et
plus efficace contre les infections. Cette dernière se subdivise en une
immunité humorale, dans laquelle des anticorps (Ac) fabriqués par
les lymphocytes B (LB) neutralisent et éliminent les microbes et les
toxines extracellulaires, et en une immunité cellulaire, dans laquelle
des LT éliminent les microbes intracellulaires. Ces cellules de
l'immunité acquise, c'est-à-dire les lymphocytes, expriment des
récepteurs qui reconnaissent, de manière spécifique,
différentes substances produites par les microbes, ainsi que des
molécules non infectieuses : Ces substances sont appelées
antigènes (Ag). Tandis que les
mécanismes de l'immunité naturelle reconnaissent des structures
partagées par plusieurs classes de microbes, qui sont appelés
PAMPs (Pathogen-associated molecular patterns). Le terme
d'immunité innée fait référence au fait que ce type
de défense développé par l'hôte est toujours
présent chez les individus sains, prêt à bloquer
l'entrée des microbes et à éliminer rapidement ceux qui
ont réussi à pénétrer dans les tissus de
l'hôte. Tandis que l'immunité adaptative est le type de
défense qui est stimulé par les microbes qui envahissent les
tissus, c'est-à-dire qu'elle s'adapte à la présence des
micro-organismes invasifs (
Abbas
et
Lichtman,
2008).
Généralement, tous les lymphocytes sont produits
dans la moelle osseuse hématopoïétique, à partir de
cellules souches multipotentes. Ces lymphocytes (B ou T) sont capables de
reconnaitre une molécule ou un Ag par l'intermédiaire d'un
récepteur spécifique : immunoglobuline de surface ou B
cell receptor (BCR) pour le LB et T cell receptor (TCR) pour le
LT. Ces récepteurs sont produits par l'association aléatoire de
gènes et génèrent une capacité de reconnaissance
phénoménale. Les LB peuvent reconnaitre l'Ag sans que celui-ci ne
soit modifié. Les LT, en revanche, ne reconnaissent l'Ag qu'une fois
dégradé et présenté dans une molécule du
complexe majeur d'histocompatibilité (CMH). Ce complexe tire son nom des
réactions intenses qu'il suscite lors de la transplantation d'organes
incompatibles. En présentant des peptides antigéniques aux LT,
ces molécules de CMH, qui chez l'Homme s'appelle antigènes
leucocytaires humains (HLA, human leucocyte antigen), jouent un
rôle fondamental dans la réponse immunitaire. Il s'agit de
glycoprotéines de surface réparties en deux classes, I et II,
caractérisées par un important polymorphisme
génétique, c'est-à-dire que chaque locus comporte de
multiples allèles. En conséquence, la variabilité
génétique entre individus est très grande ; à
moins qu'ils n'appartiennent à une famille, ils ont le plus souvent des
HLA différents.
Ce complexe contient au mois 128 gènes fonctionnels
parmi lesquels plus de 20% ont une fonction dans l'immunité ; c'est
la région du génome humain avec la densité de gènes
la plus élevée. C'est aussi la région à laquelle
sont associées le plus de maladies : la plupart sinon toutes les
maladies auto-immunes (MAI) sont associées à des gènes du
CMH, ce qui met en évidence le rôle essentiel de ces
molécules dans la sélectivité des réponses
immunitaires (Hachulla et Hatron, 2006 ; Chapel et al.,
2004).
Les gènes du CMH sont désignés par des
lettres comme montré dans la figure1. Les gènes codant pour les
molécules de CMH sont traditionnellement répartis en trois
classes : les gènes du CMH de classe I et II qui codent pour les
molécules du CMH présentatrices d'Ag, et les gènes de
classe III, un groupe de gènes assez disparates codant pour d'autres
molécules immunitaires (DeFranco et al., 2009).
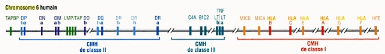
Figure. 1. Les gènes de CMH
humain (DeFranco et al., 2009).
Diagramme simplifié du CMH sur le chromosome 6 humain.
(Seuls les gènes de classe III qui ont une fonction immunitaire
identifié sont représentés).
DP, DQ, DR, A, E : Gènes
classiques de classe II
HLA-A, HLA-B, HLA-C, K, D, L :
Gènes de classe I
DN, DM, DO, M, O : Gènes non
classique de classe II
MICA, MICB, HLA-E, HLA-G, HLAf, HFE, Q, T,
M : gènes de molécules non classiques du CMH de
classe I
C4A, , Bf : gènes de
molécules du complément
LMP : gènes de composants du
protéasome, le complexe enzymatique qui dégrade les proteines en
peptides dans le cytoplasme
LT : gènes de la lymphotoxine
TAP : gènes du transpoorteur
responsable de l'entrée des peptides du cytoplasme dans le
réticulum endoplasmique
TAPBP : gène de la tapasine, une
moélcule chapéronne ipliquée dans le chargement des
peptides CMH de classe I
TNF : gènes du facteur de
nécrose tumorale, une cytokine importante
En fait, les molécules du CMH présentatrices
d'un Ag peptidique sont parfois appelées molécules CMH
classiques. Il existe aussi des molécules structuralement
apparentées à ces deux classes, mais dont la fonction n'est pas
la présentation de l'Ag aux cellules T : elles sont appelées
molécules CMH apparentées à la classe I ou à la
classe II ou molécules non classiques du CMH (DeFranco et al.,
2009).
Ces réactions de défense immunitaire sont
basées sur la capacité du SI à distinguer le
« soi » du « non soi » et, donc sur la
capacité à préserver l'individualité et
l'intégrité de l'organisme. Le « soi » peut
être défini comme l'ensemble des tissus, cellules et
molécules faisant partie intégrante de l'organisme, et qui sont
codés par le génome. Le « non soi » est
constitué par tout le reste
(Schaechter et al., 1999), et
forme, d'après les auteurs, les micro-organismes (bactéries,
virus, parasites et champignons), les toxines bactériennes,
différents poisons, les éléments constituant les cellules
tumorales, les greffons et les transplants (
Boutammina,
2012 ). Cette capacité de distinction est, en fait, un
apprentissage par divers mécanismes tout au long du processus de
maturation des lymphocytes. Les lymphocytes sont exposés aux Ag du "soi"
dans un but d'éliminer tous les lymphocytes qui les reconnaîtront
et de laisser passer ceux qui n'en reconnaitraient pas lors de leur dernier
stade de développement (DeFranco et al., 2009 ;
Chapel et al., 2004).
Dans des conditions normales, ces réactions
immunitaires de défense suffisent le plus souvent à
protéger notre corps. Malheureusement, elles ne sont plus parfois
capables d'assurer ces fonctions protectrices correctement. Ainsi, il
résulte de ce fait des maladies. Les anomalies de fonctionnement du SI
peuvent être des causes de maladies essentiellement de deux
manières : par un déficit immunitaire (réponse
immunitaire insuffisante) ou par une attaque immunitaire inappropriée
(réponse immunitaire excessive ou erreur de cible) qu'on rencontre dans
l'allergie, les MAI et les maladies de complexes immuns dans lesquelles des Ac
produits en excès endommagent des tissus normaux (Sherwood et
Molotchnikoff, 2006).
En raison de leur capacité à distinguer les
cellules étrangères, la majorité des cellules du SI se
comportent correctement la plupart du temps. Elles se retiennent "poliment"
d'attaquer les protéines et les cellules dont est constitué leur
propre corps. Parfois, cependant, le SI peut perdre sa capacité à
distinguer le « soi » du « non-soi ».
Les agents des réponses immunitaires peuvent brusquement se
révéler déloyaux, échapper à tout
contrôle et attaquer les propres constituants de l'organisme.
Les cellules du SI peuvent, par exemple, mélanger leurs
gènes et leur faire subir des mutations dont les combinaisons
amèneront les cellules B et T à considérer comme
étrangères des protéines parfaitement normales et
fonctionnelles de leur propre corps. Les attaques de ce type peuvent être
fatales aux cellules du corps, les tuant aussi facilement que le feraient des
bactéries. Le résultat est ce qu'on appelle des MAI
(Rensberger, 1999). Il s'agit de maladies causées par le
détournement de l'immunité adaptative vers des cibles
constituées par des cellules et des tissus sains de l'organisme
lui-même. Au cours des MAI, les tissus qui sont attaqués (les
cibles des réactions auto-immunes) et les symptômes qui se
manifestent sont très variés. Dans la plupart des cas,
l'incidence diffère entre hommes et femmes, celles-ci en étant
plus souvent victimes. Un caractère typique de ces maladies est la
présence d'Ac et de cellules T spécifiques des Ag exprimé
par les tissus cibles, ces Ag sont appelés auto-antigènes
(auto-Ag) et les effecteurs de l'immunité adaptative qui les
reconnaissent sont appelés auto-anticorps (auto-Ac) et
cellules T auto-immunes (Parham, 2003).
Les SI renégats ne sont malheureusement pas rares. Ils
provoquent plusieurs maladies relativement courantes. Ceci comprend la
sclérose en plaques (le SI attaque les cellules spéciales qui
forment un revêtement isolant autour des nerfs, provoquant un
« court-circuit » des nerfs, exactement comme des fils
électriques ayant perdu leur isolation), l'arthrite rhumatoïde (le
SI attaque les articulations, détruit leurs tissus et provoque une
inflammation douloureuse ainsi qu'un gonflement), la myasthénie grave
(le SI attaque les récepteurs des cellules musculaires qui
reçoivent des signaux chimiques du système nerveux, laissant les
muscles paralysés parce qu'ils ne peuvent plus recevoir le signal pour
se mouvoir), et le diabète de types I (le SI attaque des cellules
particulières à l'intérieur du pancréas, dont le
travail consiste à fabriquer de l'insuline). Dans toutes ces maladies et
dans bien d'autres moins connues, le SI n'est plus capable de
distinguer un Ag étranger d'un élément qui appartient
à son propre corps. Les cellules immunitaires attaquent les cellules
natives aussi vigoureusement que si elles étaient des ennemies mortelles
de leur corps (Rensberger, 1999).
Les experts ont constaté que tous les organes
endocriniens et pratiquement toutes les cellules endocrines pouvaient
être victimes de cette auto-agression (Chapel et al.,
2004). Les réactions auto-immunes peuvent alors être
dirigées contre des cellules endocrines, leurs récepteurs, les
hormones ou les récepteurs de celles-ci sur des cellules cibles. Il
existe plusieurs mécanismes d'agression auto-immune, autrement-dit plus
d'un mécanisme pouvant intervenir dans une maladie donnée. Les
cellules T et les Ac semblent opérer en parallèle dans la
pathogénie de la maladie endocrine auto-immune. Grosso modo, on
peut dire que les cellules T (tant CD4+ que
CD8+) sont responsables de la destruction glandulaire et
que les Ac perturbent la fonction physiologique de la glande affectée
(Chapel et al., 2004).
La thyroïde est parmi les glandes endocrines
considérées comme cibles potentielles des attaques
erronées du SI. Elle intervient par ses hormones, la tri-iodothyronine
(T3) et la thyroxine (T4) sécrétées
sous l'influence de la TSH (thyroid-stimulating hormone)
antéhypophysaire, dans la régulation du métabolisme des
lipides, des protides et des glucides. Ces hormones régissent notamment
l'oxydation du glucose par les cellules et sa conversion en énergie
chimique. Puisque toutes les cellules de l'organisme dépendent de
l'apport continu d'énergie, elles sont donc toutes des cibles pour les
hormones thyroïdiennes (HT). Ces dernières, par leurs actions
métaboliques, participent également à la
thermorégulation (effet thermogène ou calorigène), ainsi
qu'au métabolisme hydrique et minéral. Elles sont essentielles
à la croissance et au développement du squelette, des muscles,
des organes génitaux et du système nerveux. Elles agissent sur
les tissus pour augmenter la réactivité nerveuse, mais aussi la
fréquence cardiaque et la pression artérielle. Toutes
déficiences ou excès en hormones thyroïdiennes sont donc
extrêmement perturbateurs pour l'organisme (Cornet,
2009).
Les cellules thyroïdiennes expriment de nombreux Ag,
pouvant servir de cibles aux auto-Ac : thyroperoxydase (enzyme clé
de la synthèse des HT, TPO), thyroglobuline (précurseur des HT,
Tg) et récepteur de la TSH (R-TSH), qui rendent, malheureusement, la
thyroïde susceptible d'être attaquée par des lésions
auto-immunes par un mécanisme mal élucidé
où
les immunités à médiation humorale et cellulaire
interviendraient toutes les deux amenant à des anomalies du
fonctionnement, ou même, à la destruction de cette glande
(Perlumuter et Hernandez 2002).
Les R-TSH constituent l'interface indispensable entre le
thyrocyte (cellule endocrine de la thyroïde) et la TSH (hormone
hypophysaire régulant la fonction et la croissance des cellules
thyroïdiennes) (Kubab et Kubab 2011). Il arrive que des Ac se
trompent et attaquent ces récepteurs, perturbant leur déroulement
normal, ce sont les Ac anti-R-TSH (TRAK). Ces TRAK se
combinent au R-TSH et miment les effets de la TSH (Weil et Batteux,
2003) provoquant une stimulation prolongée des cellules de la
thyroïde qui aboutit à l'hyperthyroïdisme (augmentation de la
teneur du sang en HT) (Karp 2010). Ainsi, le métabolisme est
sur stimulé et passe en surrégime. Du coup, le coeur bat trop
vite, les muscles sont hypertoniques, le système nerveux est en
état d'alerte permanente, etc (Nys, 2012). De telles
réactions sont rencontrées dans une maladie dite maladie de
Basedow relative au médecin allemand Carl Adolph von Basedow qui,
en 1840, fut le premier à décrire une hyperfonction de la
thyroïde,
désormais connue sous le nom de
maladie de
Basedow. Il s'agit essentiellement d'une
hyperthyroïdie d'origine auto-immune. Par ailleurs, Il est possible de
rencontrer l'état contraire, une hypothyroïdie, suite à une
destruction totale de la glande.
Qu'est-ce que c'est que l'auto-immunité ?
Pourquoi et comment intervient-elle dans l'apparition de
l'hyperthyroïdie ? Comment une hyperthyroïdie perturbe tout le
métabolisme de l'organisme ? Y a-t-il une solution pour contrer
cette mésaventure ?
1. Le
phénomène de l'auto-immunité
1.1. Généralité : la tolérance
immunitaire
L'une des caractéristiques les plus remarquables du SI
normal est qu'il est capable de répondre à une
variété considérable de microbes sans pour autant
réagir aux Ag propres à l'individu, le
« soi ». Cette absence de réponse aux Ag du soi est
qualifiée de tolérance immunitaire, elle se maintient
bien que les mécanismes par lesquels les récepteurs des
lymphocytes sont exprimés ne soient pas génétiquement
déterminés à ne produire que des récepteurs d'Ag
étrangers. En d'autres termes, des lymphocytes capables de
reconnaître des Ag du "soi" sont constamment formés au cours du
processus normal de maturation des lymphocytes. En outre, le SI est facilement
accessible à de nombreux Ag du "soi", de telle sorte que l'absence de
réponse à ces Ag ne peut pas simplement être maintenue en
cachant ces Ag aux lymphocytes. Il doit, par conséquent, exister des
mécanismes qui empêchent le déclenchement des
réponses immunitaires contre les Ag du "soi". Ces mécanismes sont
responsables d'une des caractéristiques essentielles du SI, sa
capacité à distinguer les Ag du "soi" des Ag du "non soi"
(généralement microbiens). Si ces mécanismes sont
altérés, le SI risque de s'attaquer aux propres cellules et
tissus de l'individu (
Abbas
et
Lichtman,
2008).
La tolérance immunitaire est établie et
entretenue par des mécanismes centraux et périphériques
(DeFranco et al., 2009). En effet, au cours de
leur développement, les LT et B passent par un test de sélection
où ils rencontrent les Ag du "soi" présentés par des
cellules spécifiques appartenant ou pas au SI. Les mécanismes
centraux de la tolérance immunitaire, constituant une
tolérance centrale, sont induits lorsque les lymphocytes en
développement rencontrent les Ag du "soi" dans les organes
lymphoïdes primaires, c'est-à-dire la moelle osseuse et le thymus,
tandis que les mécanismes périphériques,
représentant la tolérance périphérique,
sont réalisés lorsque les lymphocytes matures rencontrent les Ag
du "soi" dans les tissus périphériques de l'organisme (ou les
organes lymphoïdes secondaires, c'est-à-dire la rate et les
ganglions lymphatiques) (Abbas et
Lichtman,
2008). Etant donné que les LT, en particulier les LT
CD4+, contrôlent presque toutes les réponses
immunitaires, leur tolérance au "soi" est plus importante pour
prévenir l'auto-immunité. Par conséquent, la plupart des
LB spécifiques du "soi" seront incapables de produire des auto-Ac s'ils
ne reçoivent pas l'aide appropriée des LT (Chapel et
al., 2004).
Le mécanisme de la tolérance centrale concerne
exclusivement les Ag du "soi" qui sont présents dans les organes
lymphoïdes primaires et la tolérance envers les Ag du "soi" qui ne
sont pas présentés dans ces organes doit être induite et
maintenue par les mécanismes de la tolérance
périphérique.
Le SI assure ses fonctions de protection de l'organisme contre
les infections sous le contrôle de plusieurs mécanismes de
régulation. Tout d'abord, au cours de l'ontogenèse, il est
éduqué pour distinguer les auto-Ag - qu'il faut préserver
- des substances et agents potentiellement toxiques, à éliminer.
Cette étape d'éducation passe par l'élimination de la
majorité des lymphocytes, soit parce qu'ils sont incapables de produire
des récepteurs efficaces, soit parce qu'au contraire, ils risquent
d'agresser les propres constituants de l'organisme (Hachulla et Hatron,
2000).
Les mécanismes d'élimination (apoptose)
sont, toutefois, insuffisants car des cellules auto-réactives qui
reconnaissent avec peu d'affinité nos constituants antigéniques
persistent à l'état physiologique après la
sélection centrale. Des mécanismes de tolérance
périphérique, donc, prennent le relais pour éviter une
activation inappropriée des cellules auto-réactives. Les
contrôles s'effectuent à plusieurs niveaux : tout d'abord,
les conditions d'activation des cellules immunitaires sont strictement
maitrisées ; leur activation ne peut aboutir que s'il existe une
interaction coopérative entre l'Ag et les lymphocytes lesquels
échangent des signaux d'activation. Si un seul maillon de cette
signalisation vient à manquer, la cellule immunitaire est
éliminée ou bloquée dans son programme fonctionnel
(induction d'un état dit d'Anergie). Le contrôle s'exerce
également après l'activation du SI, où plusieurs
mécanismes concourent à freiner cette réponse (rôle
des LT régulateur, LT rég) et des cytokines
anti-inflammatoires (Hachulla et Hatron, 2000).
Grosso modo, c'est la rupture de ces
mécanismes de tolérance qui conduirait à l'action
destructrice du SI et à l'apparition de MAI. Le répertoire des
récepteurs des LT et LB étant produit au hasard des
recombinaisons génétiques, le SI est conduit, alors, à
reconnaître les composants du "soi". Et, pour éviter les
inconvénients d'une auto-réactivité, l'individu doit
développer les mécanismes complexes de tolérance pour
distinguer le "soi" du "non-soi". Cependant, tout mécanisme
physiologique comporte un risque d'erreurs ; les mécanismes de
reconnaissance du "soi" ne font pas exception à cette règle et
l'on connait de nombreuses maladies ou les auto-Ac sont abondants et des LT
auto-réactifs sont très nombreux. (Hachulla et Hatron,
2000).
1.2. Définition
En 1897, le microbiologiste allemand Paul Ehrlich
découvrait l'une des caractéristiques fondamentales du SI :
son pouvoir de discriminer le "soi" du "non-soi". Par l'expression horror
autotoxicus, il était le premier à définir la
capacité du SI de rejeter les substances étrangères tout
en laissant intactes les structures de l'organisme. Ehrlich postulat alors que
toute anomalie dans la reconnaissance du "soi" et du "non-soi" pouvait
déclencher l'apparition d'une réaction immunitaire contre un ou
plusieurs des constituants de l'organisme, entrainant son auto-destruction.
Ehrlich venait de définir la pathologie auto-immune (Bernard et
batteux, 2003).
Les réponses auto-immunes sont une conséquence
naturelle des répertoires étendus des récepteurs des
cellules B et T, ce qui leur permet de reconnaître n'importe quel
pathogène. Bien que ces répertoires soient purgés de la
plupart des récepteurs qui se lient avec une forte affinité aux
Ag du "soi" rencontrés au cours de leur développement, ils
contiennent toujours des récepteurs de faible affinité qui
réagissent contre certains Ag du "soi". Les experts ne savent pas
exactement ce qui déclenche l'auto-immunité pathologique, mais
des facteurs environnementaux et génétiques,
particulièrement le génotype du CMH, sont couramment
mentionnés. C'est seulement lorsque les réponses auto-immunes
sont prolongées et qu'elles causent des lésions tissulaires
durables qu'elles attirent l'attention du corps médical (Janeway et
Travers, 2003). Ainsi, une MAI est une lésion tissulaire ou
l'altération d'une fonction physiologique causée par une
réaction auto-immune. Il importe de faire cette distinction car des
réactions auto-immunes peuvent survenir en absence de maladies ou en
présence de maladies relevant d'autres mécanismes (comme
l'infection). La preuve que l'auto-immunité cause une maladie
particulière doit répondre à un certain nombre de
critères, comme dans les postulats de Koch à propos de
l'implication de micro-organismes dans des pathologies infectieuses
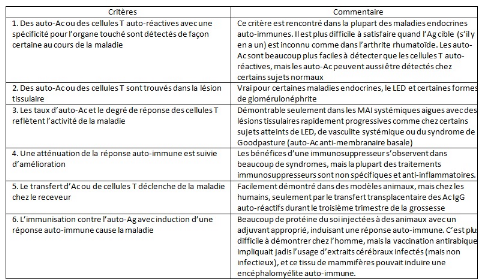
(Tab.1.) (Chapel et al., 2004).
L'auto-immunité constitue une cause importante dans le
large répertoire des pathologies. On a estimé qu'au moins 1
à 2% de personnes souffrent de MAI dans les pays
développés, alors que la prévalence parait s'élever
dernièrement. Toutefois, dans de nombreux cas, des maladies
associées à des réponses immunitaires
incontrôlées sont qualifiées d'auto-immunes sans que des
réponses contre des Ag du "soi" aient été clairement
démontrées (Chapel et al., 2004).
Tableau. 1. Critères qu'une réponse auto-immune
particulière doit satisfaire pour être considérée
responsable d'une maladie auto-immune (Chapel et al., 2004).
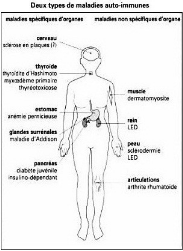
1.3. Types de
réponses auto-immunes
Figure. 2. Les maladies
auto-immunes non spécifiques d'organes peuvent atteindre à la
fois la peau, les articulations, les reins et les muscles. Certaines d'entre
elles ont cependant une affinité élective pour un organe
particulier : les reins pour le LED, les articulations pour l'arthrite
rhumatoïde (Roitt et al., 2002).
LED : Lupus
érythémateux disséminé
La réponse auto-immune pathologique (ou une MAI) se
déclare lorsque l'organisme déclenche une réponse
immunitaire adaptative délétère à l'encontre d'un
des constituants du "soi". Les lésions tissulaires qui découlent
de cette réponse immunitaire dépendent de la localisation de
l'auto-Ag. Si celui-ci est confiné au sein d'un tissu ou d'un organe,
les répercussions cliniques sont limitées à ce tissu et on
parle de MAI spécifique d'organe où les cibles
antigéniques peuvent être des molécules exprimées
à la surface de cellules vivantes ou de molécules
intracellulaires, en particulier des enzymes. Les raisons de cet aspect
restreint à certains organes et cibles antigéniques restent
inconnues. En revanche, si l'auto-Ag est largement distribué dans
l'organisme, les lésions sont disséminées au sein de
différents tissus et on parle de MAI non spécifique
d'organe (ou systémique). Ces maladies, alors, touchent de
multiples organes et sont en général associés à des
réactions auto-immunes contre des molécules du "soi"
distribuées largement dans tout l'organisme, et particulièrement
contre des molécules intracellulaires impliquées dans la
transcription et la traduction génétiques. Beaucoup de ces MAI
sont multisystémiques et font partie des pathologies
désignés par le terme
« connectivités » ; même cette
dénomination est trompeuse puisque le tissu conjonctif n'est ni anormal
ni lésé (Weil et Batteux, 2003 ; Chapel et
al., 2004).
Dans les maladies spécifiques d'organe, les organes
cibles généralement atteints sont les glandes thyroïdes et
surrénales, l'estomac et le pancréas. Les MAI non
spécifiques d'organe dont font partie certains rhumatismes
inflammatoires atteignent typiquement la peau, les reins, les articulations et
les muscles (Roitt et al., 2002).
1.4. Causes de
l'auto-immunité
L'approche fondamentale des mécanismes effecteurs de
l'auto-immunité à été largement facilité par
la mise au point de modèles expérimentaux ;
néanmoins, si les mécanismes immunologiques mis en jeu au cours
de l'auto-immunité sont aujourd'hui mieux connus, les causes du
déclenchement de la réaction auto-immune demeurent en revanche
énigmatiques (Bernard et batteux, 2003). Comme décrit
précédemment, les principaux facteurs contribuant au
développement de l'auto-immunité sont, d'une part, des
gènes de susceptibilité et, d'autre part, des facteurs
environnementaux déclenchant, comme les infections.
L'auto-immunité peut consister en la production d'Ac
contre des Ag du "soi" ou l'activation de cellules T réactives envers
des auto-Ag. Des gènes de susceptibilité peuvent
interférer avec les voies de l'auto-tolérance et conduire
à la persistance de LT et LB auto-réactifs. Des stimuli
environnementaux et des lésions tissulaires peuvent aboutir à
l'activation de ces lymphocytes autoréactifs. Néanmoins,
malgré la connaissance croissante des anomalies immunologiques
susceptibles d'entrainer une auto-immunité, les experts ne connaissent
pas suffisamment l'étiologie des MAI humaines. Cette absence de
compréhension est principalement due aux trois facteurs suivants :
les MAI humaines sont généralement
hétérogènes et multifactorielles ; les auto-Ag
inducteurs et cibles des réactions auto-immunes sont souvent
inconnues ; les maladies peuvent apparaître sur le plan clinique
longtemps après que les réactions auto-immunes aient
été induites (
Abbas
et
Lichtman,
2008).
En général, toutes les MAI impliquent une
rupture de la tolérance immunologique. Comme la tolérance au
"soi" est assurée de plusieurs façons différentes, elle
peut donc être rompue par divers mécanismes où les facteurs
génétiques et environnementaux contribuent à la perte de
tolérance qui conduit aux MAI (Parham, 2003).
1.1.1. Facteurs
génétiques
Chez l'Homme, toutes les MAI spécifiques, ou non,
d'organe, ont une composante génétique. Et, la meilleure preuve
de l'existence des gènes de prédisposition à
l'auto-immunité est fournie par des études familiales, tout
particulièrement sur les jumeaux. Une technique semi-quantitative pour
mesurer qu'elle est la proportion de la prédisposition à une
maladie particulière qui provient de facteurs génétiques
consiste en la comparaison de l'incidence d'une maladie chez des jumeaux
monozygotes et dizygotes. Si une maladie est commune à tous les jumeaux,
la maladie peut être causée par des facteurs
génétiques ou environnementaux. En revanche, si la maladie n'est
commune qu'aux jumeaux monozygotes, il est alors probable que les facteurs
génétiques sont plus importants que les facteurs
environnementaux. Autrement dit, si un vrai jumeau développe une MAI,
l'autre jumeau a beaucoup plus de risques de développer la même
maladie qu'un membre non apparenté (
Janeway et
Travers,
2003 ; Weill et Batteux, 2003).
Des études sur des jumeaux ont été
entreprises concernant plusieurs maladies humaines dans lesquelles la part de
l'auto-immunité est importante, dont le diabète
insulinodépendant de type 1, la polyarthrite rhumatoïde, la
sclérose en plaques et le LED. Dans chaque cas, environ 20% des paires
de jumeaux monozygotes avaient une maladie commune, contre moins de 5% des
jumeaux dizygotes. Une technique similaire consiste à comparer la
fréquence d'une maladie telle que le diabète chez les
frères et soeurs de patients souffrant de diabète avec la
fréquence de cette maladie dans la population générale. Le
rapport de ces deux fréquences donne une mesure du facteur
héréditaire dans cette maladie, bien que des facteurs
environnementaux communs dans les familles puissent également
être, au moins en partie, responsables d'une fréquence accrue
(
Janeway
et
Travers,
2003).
Des analyses d'association portant sur l'ensemble du
génome ainsi que des études de croisements chez l'animal ont
permis l'identification de certains des gènes qui peuvent contribuer
à la genèse des différentes MAI. Il s'avère que la
plupart des MAI sont polygéniques et sont associées à de
multiples locus, les plus importants étant ceux du CMH (
Abbas
et
Lichtman,
2008).
De nombreuses MAI chez l'Homme et chez les animaux consanguins
sont liées à des allèles particuliers du CMH.
L'association entre des allèles HLA et les MAI chez l'Homme à
été mise en évidence il y a de nombreuses années,
et a constitué l'un des arguments principaux en faveur du rôle
important joué par les LT dans ce type de maladies (dans la mesure
où la fonction des molécules du CMH est de présenter les
Ag peptidiques aux LT). L'incidence d'une MAI particulière est souvent
supérieure chez les individus qui héritent d'un ou plusieurs
allèles HLA particuliers que dans la population générale.
Cette augmentation de l'incidence porte le nom de « risque
relatif » de l'association HLA-maladie. Il est important de souligner
qu'un allèle HLA n'est pas, par lui-même, la cause de cette
maladie. En fait, la grande majorité des individus qui héritent
d'un allèle HLA fréquemment associé à une
pathologie ne la développent jamais. Des allèles particuliers du
CMH peuvent contribuer au développement d'une auto-immunité car
soit ils s'avèrent inefficaces dans la présentation des Ag du
"soi", ce qui empêche la sélection négative des LT, soit
les Ag peptidiques présentés par ces allèles du CMH ne
parviennent pas à stimuler les LT rég (
Abbas
et
Lichtman,
2008).
Cependant, de nombreux gènes non-HLA sont
également associés à des MAI. Les jumeaux monozygotes qui
ont en commun l'ensemble de leurs gènes ont, en effet, beaucoup plus de
risque de développer la même MAI que des jumeaux dizygotes qui
partagent le même génotype HLA. Ceci démontre que d'autres
facteurs génétiques peuvent intervenir dans la
prédisposition à la maladie (Weill et Batteux,
2003).
Par ailleurs, les gènes du complément peuvent
également être impliqués. En effet, des déficits
homozygotes de certaines protéines du complément (c1q, , C4) sont
fortement associés au développement du LED. Le mécanisme
de cette association est inconnu mais l'altération de la voie classique
d'activation du complément limite les possibilités
d'élimination des complexes immuns (Weill et Batteux,
2003).
De la même manière, des variantes
alléliques des gènes codant le récepteur des fragments Fc
des immunoglobulines n'ayant pas les mêmes propriétés
opsonisante, peuvent influer sur l'élimination des complexes immuns
(Weill et Batteux, 2003).
Chez l'Homme et chez la souris, des mutations de gènes
codant pour des protéines impliquées dans la régulation de
l'apoptose lymphocytaire comme Fas ou Fas Ligand sont fortement
associées à certaines formes de maladie lupique, ce qui montre
que les gènes des récepteurs de la mort cellulaire peuvent
être impliqués (Weill et Batteux, 2003).
Il semble que certaines variantes alléliques de
gènes codant pour des cytokines pro-inflammatoires comme l'IL-6 et le
TNF-alpha, puissent augmenter la prédisposition à certaines MAI
en modifiant le niveau d'expression de ces molécules (Weill et
Batteux, 2003).
1.1.2. Facteurs
environnementaux
La présence d'allèles à haut risque peut
être nécessaire pour l'apparition de certains MAI chez un
individu, mais ce n'est pas le seul facteur causal. Des recherches sur des
jumeaux identiques montrent que, si un des jumeau est atteint d'une MAI, la
probabilité pour que la maladie apparaisse chez l'autre est comprise
entre 25 et 75%, et non de 100% comme ce serait le cas si
l'hérédité était le seul facteur en cause. Ce type
de recherche prouve que les facteurs de l'environnement jouent également
un rôle. Les plus susceptibles de déclencher
l'auto-immunité comprennent des hormones, des infections, des
médicaments et divers autres agents comme les rayons ultraviolets
(
Karp,
2010 ; Chapel et al., 2004).
Une des observations épidémiologiques les plus
remarquables à propos des MAI est le fait que les femmes courent un
risque beaucoup plus grand que les hommes de développer une affection
auto-immune. Il s'agit manifestement d'une prédisposition
génétique, mais cette prévalence accrue chez les femmes
dépend aussi fortement des hormones. Comme leur
activité peut être modulée facilement de
l'extérieure, l'étude de leur influence peut avoir sa place parmi
celles des autres facteurs (Chapel et al., 2004).
La plupart des MAI débutent pendant les années
d'aptitude à la reproduction. De nombreuses observations
expérimentales et quelques études cliniques impliquent les
oestrogènes dans le déclenchement de ces pathologies.
L'ovariectomie prévient l'auto-immunité spontanée chez des
modèles animaux, en particulier les modèles de LED ; et
l'administration d'oestrogènes favorise l'apparition de la maladie. Le
mécanisme d'action des oestrogènes n'est pas connu, mais les
observations dont les experts disposent suggèrent qu'ils sont capables
de stimuler certains types de réponses immunitaires (Chapel et
al., 2004).
La prolactine, une hormone hypophysaire, stimule
également les mécanismes immunitaires, en particulier la fonction
des LT. Le taux de prolactine s'élève immédiatement
après la grossesse ce qui pourrait expliquer la tendance de certaines
MAI, en particulier l'arthrite rhumatoïde, à se développer
à ce moment (Chapel et al., 2004).
En ce qui concerne l'infection, l'importance des
agents pathogènes dans l'apparition des MAI a été
démontrée d'abord lors de recherches sur le rhumatisme
articulaire aigu, qui apparait chez les enfants quelques semaines après
une infection de la gorge (angine) par des Streptocoques. Le rhumatisme
articulaire se manifeste quand le tissu cardiaque est attaqué par les Ac
produits en réponse aux Streptocoques. Ce tissu devient la cible de ces
Ac à la suite d'un phénomène de
« mimétisme moléculaire ». Dans ce
cas, une des composantes de la paroi cellulaire de la bactérie est
semblable à une glycoprotéine de la surface des cellules qui
tapissent les valves cardiaques. Il en résulte que les Ac produits en
réponse à l'infection bactérienne peuvent réagir
avec le tissu cardiaque (
Karp,
2010).
En fait, des similarités de structures entre des
protéines provenant de micro-organismes et celles du "soi" peuvent
également être à l'origine d'une réaction
auto-immune. Un peptide du "soi", présent en faible concentration et
dépourvu d'accès à des cellules présentatrices d'Ag
peut être l'objet d'une réaction croisée avec un peptide
microbien de structure similaire. Lors d'une infection systémique, ces
réactions croisées vont provoquer l'expansion de populations de
LT spécifiques qui peuvent alors reconnaître le peptide du "soi"
si la situation locale (comme une lésion tissulaire) permet la
présentation de ce peptide et l'accès des LT aux tissus
(Chapel et al., 2004).
La relation entre infection et auto-immunité est la
plus évidente dans le cas de mimétisme moléculaire, mais
d'autres liens existent sans doute. L'infection de l'organe cible peut jouer un
rôle clé dans l'augmentation de l'expression de molécules
de costimulation et aussi dans les modifications de la dégradation et de
la présentation des Ag déclenchant ainsi des réactions
auto-immunes en absence de mimétisme (Chapel et al.,
2004).
Aussi, de très nombreux médicaments peuvent
induire des MAI. Les médicaments agissent souvent comme des
haptènes et deviennent immunogéniques après liaison avec
une protéine porteuse. C'est le cas, notamment, des thrombopénies
(par exemple, cas de la thrombopénie induite par la quinine) et des
anémies hémolytiques auto-immunes (Weill et Batteux,
2003). Certains médicaments peuvent aussi favoriser la survenue de
MAI telles des anémies hémolytiques en inhibant les fonctions des
cellules régulatrices (alpha-méthyle-DOPA) (Weill et
Batteux, 2003).
Divers autres facteurs sont suspectés de pouvoir
déclencher une MAI, mais leur importance reste inconnue, en particulier
le stress psychologique et la nutrition (Chapel et al.,
2004).
1.2. Mécanismes
d'attaque
Il est clair maintenant qu'une MAI survient lorsqu'une
réponse immunitaire adaptative spécifique se développe
contre les Ag du "soi". La conséquence normale d'une réponse
immunitaire adaptative contre un Ag étranger est l'élimination de
l'Ag de l'organisme. Les cellules infectées par un virus, par exemple,
sont détruites par les cellules T cytotoxiques (Tc), tandis
que les Ag solubles sont éliminées par la formation de complexe
Ag-Ac, qui sont pris en charge par des cellules du système des
phagocytes mononucléaires comme les macrophages. Cependant, lorsqu'une
réponse immunitaire adaptative se développe contre les Ag du
"soi", il est généralement impossible pour les mécanismes
effecteurs de l'immunité d'éliminer complètement l'Ag, et
c'est ainsi qu'une réponse prolongée apparaît, en plus d'un
apport constant de nouveaux auto-Ag, ce qui amplifie la réponse. Mais,
il existe une exception à cette règle, le diabète
insulinodépendant de type I, pour lequel la réponse auto-immune
détruit complètement l'organe cible ce qui aboutit à
l'incapacité de produire l'insuline. Le manque d'insuline est à
son tour responsable du phénotype du diabète. La
conséquence en est l'induction par les voies effectrices de
l'immunité de lésions tissulaires inflammatoires chroniques qui
peuvent s'avérer mortelles. Les mécanismes de lésion
tissulaire dans les MAI sont par essence les mêmes que ceux
opérant dans l'immunité protectrice (Janeway et Travers,
2003).
Les lésions tissulaires peuvent être liées
aux actions effectrices des cellules B et T. L'Ag, ou le groupe d'Ag, contre
lequel la réponse auto-immune est dirigée et le mécanisme
par lequel le tissu qui porte l'Ag est endommagé, détermine
à la fois la pathogénie et l'expression clinique de la maladie
(Janeway et Travers, 2003).
Dans une réaction protectrice, les réponses
immunitaires adaptatives commencent par l'activation de cellules T
spécifiques de l'Ag. Il semble que l'auto-immunité soit
amorcée de la même façon. Les réponses des cellules
T envers les Ag du "soi" sont responsables d'atteintes tissulaires directes ou
indirectes. Les réponses des cellules Tc et l'activation
inopportune des macrophages par les cellules TH1 peuvent provoquer
d'importantes lésions tissulaires, tandis qu'une stimulation
inappropriée des cellules B auto-réactives par des cellules T
peut mener à la production d'auto-Ac nocifs. Ainsi, les lésions
tissulaires auto-immunes peuvent être causées par des Ac
(hypersensibilité de types II et III), par des macrophages
activés par les LT CD4+ ou par des LT cytotoxiques
(hypersensibilité de type IV). L'un ou l'autre des mécanismes
prédomine dans la plupart des MAI, mais les lésions
causées par les Ac et par l'immunité cellulaire se superposent
souvent : cas des maladies à complexe immuns
(hypersensibilité de type III) (
Janeway
et
Travers,
2003 ; Chapel et al., 2004).
Les MAI peuvent être regroupées selon le type de
réponse immunitaire et le mécanisme qui provoque les
lésions tissulaires (Tab.2.). Les mécanismes immuno-pathologiques
sont provoqués par des réactions d'hypersensibilité.
Plusieurs mécanismes interviennent en parallèle dans beaucoup de
MAI, comme l'illustre bien l'arthrite rhumatoïde, par exemple, dont la
pathogénie relève de plus d'une catégorie de
mécanismes immuno-pathologiques (
Janeway
et
Travers,
2003).
Les auto-Ac peuvent également être
pathogènes en se liant à des sites fonctionnels d'Ag du "soi",
comme des récepteurs hormonaux, des récepteurs de
neurotransmetteurs et des protéines plasmatiques. Ces auto-Ac imitent ou
bloquent l'action du ligand endogène de la protéine du "soi", et
ainsi causent des anomalies de fonction sans nécessairement entrainer
une inflammation ou des lésions tissulaires, comme ce qui ce passe,
particulièrement, dans le système endocrinien (Chapel et
al., 2004). En général, il est admis que les
lésions tissulaires auto-immunes ne peuvent être causées
par des auto-Ac que lorsque ceux-ci reconnaissent un Ag qui est libre dans le
liquide extracellulaire ou exprimé à la surface de cellules.
Cependant, il a été constaté, qu'in vitro,
certains Ac dirigés contre des Ag intracellulaires étaient
capables de pénétrer dans des cellules vivantes et de perturber
leur fonction. L'importance de ce mécanisme pathogénique dans les
MAI demeure, toutefois, inconnue (Chapel et Al,. 2004).
Tableau. 2. Maladie auto-immune classée par type de
mécanisme de lesion tissulaire (
Janeway
et
Travers,
2003 ; Parham, 2003).
|
Certaines maladies auto-immunes classées suivants leurs
mécanismes immunopathogéniques
|
|
Maladie auto-immune
|
Autoantigène
|
conséquence
|
|
Anticorps dirigés contre des antigènes de la
surface cellulaire ou de la matrice extracellulaire (Type II)
|
Antigène des groupes sanguins Rh, antigène I
Destruction des globules rouges par le complément et les
phagocytes FcR+, anémie
Intégrine GpIIb : IIIa des plaquettes
Saignements anormaux
Domaine non-collagènes du collagène de type 4 des
membranes basales
Glomérulonéphrites, hémorragie
pulmonaire
Cadhérine épidermique
Vésicules cutanées (lésions bulleuses de
la peau)
Récepteur de l'acétylcholine
Faiblesse progressive
Antigènes de la paroi des streptocoques Les anticorps
réagissent avec le muscle cardiaque
Arthrite, myocardite, cicatrices persistantes des valvules
cardiaques
|
|
|
|
maladie induite par des complexes immuns (Type III)
|
Complexes de facteurs rhumatoïdes IgG (avec ou sans
antigènes de l'éhpatite C)
Vasculite systémique
ADN, histones, ribosomes, SnRNP, ScRNP
Glomérulonéphrite, vasculite, arthrite
Complexes de facteurs rhumatoïdes IgG
Arthrite
|
|
|
|
maladie induite par les cellules T (Type IV)
|
Antigène de la cellule â du pancréas
Destruction des cellules â
Antigène inconnu de la synovie des articulations
Inflammation et destruction des articulations
Protéine basique de la myéline
protéolipide, glycoprotéine des oligodendrocytes
Invasion du cerveau par des cellules T CD4+, faiblesse
SnRNP : petites ribonucléoprotéines
nucléaires ; ScRNP : petites ribonucléoprotéines
cytoplasmiques ; GpIIb/IIIa :
inhibiteurs
de la glycoproteine membranaire iib-iiia ; Rh :
Rhisus
Des auto-Ac peuvent également être
pathogènes en se liant à des sites fonctionnels d'Ag du "soi". Le
R-TSH, situé à la surface des cellules de la glande
thyroïde, constitue un bon exemple où les TRAK perturbent le
déroulement normal de la thyroïde en imitant l'action du ligand
endogène de ce récepteur. Chez la plupart des personnes
présentant les symptômes de la maladie de Basedow, le sérum
présente une quantité élevée de ces types d'auto-Ac
ce qui suggère que ce phénomène est à la base de
la maladie de Basedow.
2. La glande
thyroïdienne
2.1. Anatomie
La thyroïde est une petite glande endocrine, agissant sur
le métabolisme de la plupart des cellules de l'organisme, qui pourrait
passer inaperçue si elle ne jouait un rôle central dans notre
équilibre physique, mental et émotionnel. Mais ses faibles
dimensions (4 cm de hauteur et 2 cm de largeur, pour un volume de 10 à
15 cm3 et un poids d'environ 20 à 30 g) font d'elle un
élément discret de notre dispositif métabolique
(Wémeau, 2011 ; Nys, 2012).
Son nom est issu du terme grec thuroeidês qui
signifie « bouclier ». Ses découvreurs l'ont ainsi
nommée car elle leur apparaissait comme un bouclier protecteur. De fait,
elle est située à la base du cou, juste sous la peau, en avant de
deux conduits essentiels : la trachée (en regard du
troisième cartilage trachéal) à laquelle elle est
rattachée par le ligament de Grüber qui conduit l'air jusque dans
les poumons, et l'oesophage par lequel transitent les aliments entre la
cavité buccale et l'estomac (Wémeau, 2011 ; Nys,
2012).
Elle est de consistance souple et élastique, et de
couleur rougeâtre. Sa forme ressemble vaguement à celle d'un
papillon déployant ses ailes ou d'un H. Elle est constituée de
deux lobes étalés, reliés par un corps central,
l'isthme thyroïdien. Celui-ci est surmonté d'une partie
plus charnue, la pyramide de Lalouette. La thyroïde est accrochée
à un cartilage, invisible chez la femme mais souvent perceptible chez
l'homme : la pomme d'Adam qui monte et descend lorsqu'on avale. Sur sa
partie arrière sont insérées quatre petites glandes dites
parathyroïdes, de forme ovoïde et d'environ 8 mm de grand axe, qui
participent à la régulation du taux de calcium sanguin. Cette
face est également parcourue par une série de nerfs (les nerfs
récurrents) qui assurent la mobilité des cordes vocales
(Wémeau, 2011 ; Nys, 2012).
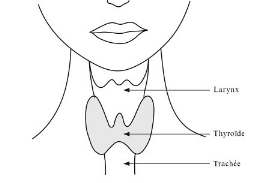
Figure. 3. La forme et
l'emplacement de la thyroïde (Nys, 2012).
2.2. Histologie
La thyroïde comprend deux sortes de cellules
indépendantes les unes des autres (Renate, 2011) : Les
thyrocytes T d'origine endodermique et les thyrocytes C provenant de la
crête neurale (Fig.4.) . Les cellules folliculaires, en premier
lieu, ou thyrocytes T, sont des cellules polarisées reposant sur une
lame basale et s'assemblant en une assise unistratifiée réalisant
une formation sphérique : le follicule (ou vésicule) de
diamètre compris entre 50 et 900 ìm (Wémeau,
2011 ; Nys, 2012).
La thyroïde est entourée d'une capsule
fibreuse comportant deux feuillets. On trouve entre ceux-ci les ramifications
des vaisseaux irriguant la thyroïde et les parathyroïdes. Le feuillet
interne émet vers l'intérieur de la thyroïde des septa qui
la divisent en lobules. Chaque lobule contient de nombreux follicules
bordés par un épithélium simple et remplis d'une masse
homogène non structurée, la colloïde, substance amorphe et
jaunâtre, lieu de stockage et de synthèse des HT. La colloïde
forme après fixation un matériel coriace et difficile à
sectionner (souvent déformé dans les coupes en paraffine par des
trous et des artéfacts de toutes sortes) (Wémeau,
2011 ; Nys, 2012).
Les cellules folliculaires représentent 99% du
contingent cellulaire thyroïdien, elles assurent la production des HT et
de la Tg. Le pôle apical des thyrocytes projette des
microvillosités dans la lumière du follicule qui contient la
colloïde où sont stockées et synthétisées les
hormones thyroidiennes qui peuvent ensuite être déversées
dans la circulation sanguine via le pôle basolatéral,
lui-même en contact avec les capillaires. Les faces latérales des
cellules folliculaires adjacentes sont réunies entre elles par des
complexes de jonction, et l'interstice entre les follicules contient une
membrane basale et un réseau serré de capillaires à
endothélium fenêtré (Wémeau, 2011).
L'aspect des thyrocytes T ainsi que la taille des follicules
et la hauteur de leur épithélium varient selon leur état
d'activité. Au repos, les cellules sont aplaties avec une colloïde
abondante devenant très acidophile. A l'inverse, en cas
d'hyperactivité, les cellules prennent une forme cylindrique, les
organites de synthèse protéique sont plus nombreux tandis que la
substance colloïde se raréfie et se colore mois vivement.
Les cellules parafolliculaires, ou cellule C,
représentent l'autre type de cellules de la thyroïde, elles
produisent la calcitonine et représentent moins de 1% du parenchyme
thyroidien. Elles sont en contact avec la lame basale du follicule, d'où
leur appellation de cellules parafolliculaires. Elles sont reconnaissables en
microscopie électronique par leurs grains de sécrétion
contenant la calcitonine libérée par exocytose
(Wémeau, 2011).
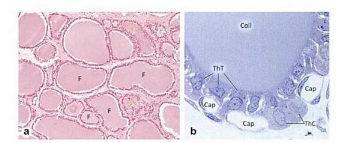
Figure. 4. Coupes histologiques de
la glande thyroïde en MO, (Renate,
2008).
Cap capillaire ; F
follicule ; ThC thyrocytes C ; ThT
thyrocytes T
a faible grossissement (thyroide
humaine, hématoxyline-éosine, x 75) : les follicules
thyroïdiens sont bien visibles. (Organisation folliculaire du parenchyme
thyroïdien)
b Fort grossissement (rat, coupe
semifine, bleu de toluidine, x 800).
2.3. Mode de
fonctionnement et hormones thyroïdiennes
Comme toutes les glandes endocrines, la thyroïde
sécrète des hormones qui sont déversées dans le
sang. Celles-ci jouent un rôle central car elles contrôlent et
régulent l'ensemble du métabolisme. Les hormones sont, en fait,
des messagers chimiques, produits en très petite quantité par des
cellules spécifiques concentrées dans les glandes (les thyrocytes
T dans la glande thyroïde). Chaque hormone délivre son message
à un type de tissu particulier possédant des récepteurs
capables de le recevoir et de le déchiffrer. A la manière d'une
clé s'insérant dans une serrure, l'hormone
« ouvre » alors la porte de la cellule et y
déclenche une série de réactions. Chaque hormone
possède ainsi ses cellules-cibles. Celles des HT sont très
nombreuses et concernent un grand nombre de tissus (Nys, 2012).
La thyroïde fabrique ses hormones à partir d'une
substance majeure, l'iode, qui nous est apportée par l'alimentation.
Cette glande renferme d'ailleurs une bonne partie de nos réserves en
iode (environ 20%). Elle produit deux types d'hormones : Les T4
qui représentent 80% de la production thyroïdienne, et les
T3 qui constituent les 20% restants.
2.3.1. Structure des hormones
thyroïdiennes
Les HT T3 et T4 contiennent,
respectivement, 3 et 4 atomes d'iode, sont fabriquées par les cellules
folliculaires, et possèdent une structure organique commune : la
thyronine, dérivant de l'acide aminé tyrosine et comprenant deux
cycles phénols réunis par un pont diphényl-éther.
Ils ne diffèrent que par le nombre et la position des atomes d'iode
qu'elles portent (Wémeau, 2011).
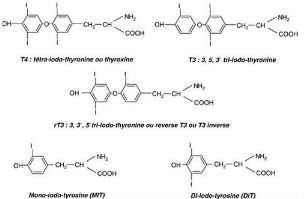
Figure. 5. Structures des
hormones thyroïdiennes, (Wémeau, 2011).
2.3.2. Mode de fonctionnement
des follicules et synthèses des hormones thyroïdiennes
Les cellules folliculaires sont intimement liées et
doivent donc être traitées ensemble (Fig. 6.). Les thyrocytes T ne
fabriquent, cependant, pas directement les deux hormones mais bien une
glycoprotéine, la thyroglobuline (Tg), dans laquelle les
précurseurs hormonaux font partie intégrante de la chaine
peptidique sans pourtant avoir déjà fixé l'iode. La Tg est
expulsée par exocytose vers la lumière du follicule
où elle s'accumule. L'ensemble de ces processus de synthèse et de
transport est lié à la présence d'un réticulum
endoplasmique granuleux bien développé, d'appareils
golgiens, de nombreuses petites vésicules dans le
cytoplasme apical et de jonctions serrées entre les thyrocytes
T (verouillage de la lumière du follicule à l'encontre de
l'interstitium) (Renate, 2008).
Les thyrocytes T de l'épithélium folliculaire se
caractérisent par leur capacité à accumuler l'iodure dans
leur cytoplasme au moyen d'un transporteur à symport (ou symporteur)
Na+ /I- (NIS) (Fig.6.). La concentration en iodure
libre est jusqu'à 40 fois plus élevée que celle du plasma.
La captation de l'iodure est indirectement réalisée par la
Na+/K+-ATPase. L'iodure est transféré dans
la lumière du follicule grâce à la présence dans le
plasmalemme apical d'un transporteur anionique, la pendrine. Il y est
oxydé (éventuellement sous forme de radicaux I0 d'iode
ou d'ions iodonium I*) pour permettre l'ioduration des
résidus tyrosyle de la Tg. La T3 et la T4
résultent du couplage de résidus tyrosyle de la Tg. Toutes les
étapes de la transformation (oxydation, ioduration et couplage) sont
catalysées par une enzyme membranaire du plasmalemme basal, la
thyroperoxydase (TPO), dont les nombreuses microvillosités augmentent la
surface (Renate, 2008).
La sécrétion des hormones dans le sang passe par
les stades suivants : endocytose de colloïde par les
thyrocytes T (contenant de ce fait des vésicules d'endocytose
et de « gouttelettes » de colloïde plus grandes
dans leur cytoplasme apical), fusion des vésicules avec des lysosomes,
dégagement des hormones T3 et T4 par
découpage protéolytique de la Tg. Et, enfin, sortie des hormones
de la cellule (Renate, 2008).
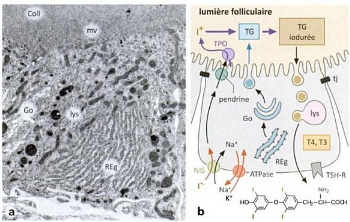
Figure. 6. Thyrocytes T dans
l'épithélium des follicules thyroidiens, (Renate,
2008).
a Ultrastructure (rat, x 6 000).
b Schéma simplifié du
fonctionnement.
Coll colloïde ; Go appareil golgien ; Lys lysosomes
; mv microvillosités ; NIS symporteur
Na+/I- ; Reg réticulum endoplasmique
granuleux ; TG thyroglobuline ; tj jonction serrée ; TPO
thyropyroxydase ; TSH-R récepteur à la TSH
A gauche, formation des hormones : le
précurseur protéique (thyroglobuline) est
synthétisé dans le Reg, emballé dans des vésicules
golgiennes et transféré dans la lumière du follicule par
exocytose ; les ions d'iodure I- sont captés par un
symporteur Na+/I- et transportés dans la
lumière par un transporteur anionique (pendrine) ; TPO du
plasmalemme apical catalyse l'oxydation de l'iodure, de même que
l'ioduration et le couplage des résidus tyrosyle.
A droite, sécrétion des
hormones : endocytose de la thyroglobuline iodurée, fusion
des vésicules d'endocytose avec des lysosomes et dégagement
protéolytiques des hormones T3 et T4 qui traversent passivement le
plasmalemme basal.
2.3.3. Régulation de la
fonction thyroïdienne
Les HT ne sont pas fabriquées à la demande.
Elles sont régulièrement synthétisées par la glande
qui les stock dans sa partie centrale (la colloïde). Elle les
libère ensuite en fonction des besoins, sur ordre de deux autres glandes
qui supervisent tout le système : l'hypophyse et l'hypothalamus
(Fig.7.). La première sécrète la TSH
(thyréostimuline), le second produit la TRH (Thyroid releasing
hormon) (Renate, 2008).
La TSH, hormone thyréostimuline
antéhypophysaire, est une glycoprotéine de 211 acides
aminés sécrétée de manière pulsatile par
l'hypophyse. Elle comporte deux sous-unité á et â, la sous
unité á étant identique à celles des FSH, LH et HCG
(hormones de stimulation folliculaire, lutéinisante et chorionique
gonadotrophique, respectivement). La sécrétion de TSH est
stimulée par la TRH hypothalamique. La TSH exerce son action
via un récepteur couplé aux protéines G et
favorise la sécrétion des HT en stimulant les différentes
étapes de la biosynthèse hormonale : synthèse de la
Tg, synthèse des iodothyronines, endocytose et hydrolyse de la Tg,
sécrétion des HT. Elle possède aussi un rôle
trophique en stimulant la prolifération des thyrocytes et leur
organisation en follicules (Wémeau, 2011).
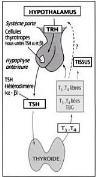
Figure.7.
L'axehypothalamo-hypophyso-thyroïdien et
représentation du rétrocontrôle négatif
exercé sur la production et la sécrétion de TSH par
T3 (et T4 converti en T3 dans la cellule
thyréotrope) (Hennen, 2001)
Les HT exercent un rétrocontrôle négatif
sur leur propre production en inhibant la sécrétion de TRH et de
TSH ainsi que les cellules folliculaire elles-mêmes. Sur le plan
hypothalamo-hypophysaire, le mécanisme implique TRbeta2 (thyroid
hormone receptor beta2) spécifiquement exprimé au niveau
cérébral ; en l'absence de T3, celui-ci agit
comme activateur de l'expression de la TSH en facilitant l'accès des
facteurs de transcription à l'ADN. La liaison de la T3 au
TRbeta2 génère une compaction de la chromatine qui entrave la
transcription (Wémeau, 2011). Ainsi, lorsque la
thyroïde ne sécrète pas assez d'hormones, la production de
TSH et de TRH augmente, comme si ces deux superviseurs multipliaient les
messages en direction de l'organe déficient pour stimuler son
fonctionnement ; à l'inverse, lorsque la glande thyroïde
s'active de trop, l'hypothalamus et l'hypophyse diminuent leur production de
TSH et de TRH (Nys, 2012).
2.4. Rôles
physiologiques
La thyroïde n'est donc ni un bouclier anatomique, ni un
fragile papillon. C'est une glande endocrine essentielle à notre
équilibre et à notre santé (Nys, 2012). La
T3 et la T4 agissent sur de nombreuses cellules du corps
où elles influencent le métabolisme de diverses manières,
notamment en augmentant la consommation d'O2 et la production de
chaleur (Renate, 2008). Une grande partie des T3 et des
T4 libérées circulent dans le sang en s'accrochant
à des protéines de transport, ce qui les rend inactives. Le reste
constitue des « hormones libres », directement utilisables
par les cellules. En effet, la T4 constitue environ 90% des hormones
sécrétées par la thyroïde, or son activité
biologique est environ quatre fois moindre que celle de la T3. Plus
précisément, c'est la T3 qui agit au niveau des
récepteurs cellulaires. La T4 libre doit donc être
transformée en T3 libre pour que le message hormonal soit
délivré aux cellules. De ce fait, l'essentiel de la T4
sécrétée est convertie en T3,
c'est-à-dire activée par soustraction d'un atome d'iode. Cette
amputation se fait naturellement en dehors de la glande thyroïde, au
niveau des organes périphériques surtout dans le foie et les
reins (Nys, 2012 ; Sherwood et Molotchnikoff, 2006).
Presque chaque tissu de l'organisme est influencé
directement ou indirectement par les HT, elles sont le principal facteur
déterminant le métabolisme de base et ont aussi d'autres effets,
notamment sur la production de chaleur, l'activité du coeur, la
croissance, le système nerveux, etc.
Les HT augmentent le métabolisme de base qui est le
régime de croisière du métabolisme. C'est le principal
facteur déterminant la consommation d'O2 et la dépense
d'énergie au repos. En plus, l'effet calorigénique (producteur de
chaleur) est étroitement lié à l'effet des HT sur le
métabolisme car l'augmentation de celles-ci va de paire avec celle de la
production de chaleur.
Les HT ont également un effet sympathomimétique.
Elles ont, en effet, des actions semblables à celles causées par
le système nerveux sympathique en augmentant la réponse des
cellules cibles aux catécholamines, noradrénaline des neurones
postganglionnaires du système nerveux sympathique et adrénaline
produite par la médullosurrénale. Les HT exercent cet effet par
le biais de l'augmentation du nombre de récepteurs spécifiques
des catécholamines des cellules cibles. D'ailleurs, beaucoup des
symptômes liés à la sécrétion excessive d'HT
sont semblables à ceux qui accompagnent l'activation du système
sympathique (Sherwood, Molotchnikoff, 2006).
Les HT renforce l'effet des catécholamines aussi sur le
coeur ; elles l'accélèrent et stimulent sa force de
contraction d'où l'augmentation du débit cardiaque (Sherwood
et Molotchnikoff, 2006).
Les HT sont indispensables à la croissance normale en
raison de leur effet sur l'hormone de croissance, la somatotrope (STH), non
seulement en stimulant la sécrétion de STH, mais en favorisant
aussi l'action de celle-ci (ou des somatomédines) sur la croissance du
squelette et la synthèse de protéines. La croissance est
arrêtée chez les enfants souffrant d'insuffisance
thyroïdienne ; un effet réversible par l'administration d'HT
de remplacement est observable. A la différence de la STH, les HT ne
causent pas une croissance excessive (Sherwood et Molotchnikoff,
2006). En plus, le développement normal du système nerveux
est fortement perturbé si l'insuffisance thyroïdienne existe
dès la naissance : Les HT ont un rôle crucial dans le
développement normal du système nerveux, surtout, central. Elles
sont aussi importantes pour son fonctionnement normal chez l'adulte
(Sherwood et Molotchnikoff, 2006).
Tout dérèglement au niveau de la
régulation de la fonction thyroïdienne peut
déséquilibrer les processus physiologiques habituels du corps.
Lorsque les HT sont produites en quantité insuffisante, l'organisme
fonctionne au ralenti, le rythme cardiaque diminue, la température
corporelle s'abaisse, les dépenses énergétiques
s'amenuisent, les pensées s'enlisent, le moral est en berne, etc
(Nys, 2012).
A l'inverse, trop d'HT et nos fonctions s'emballent : le
coeur bat plus vite ; les dépenses énergétiques
s'envolent provoquant un amaigrissement excessif ; la température
corporelle augmente ; la nervosité s'installe, etc. La
thyroïde dans cette situation est dite en état
d'hyperthyroïdie dont la cause la plus fréquente est la maladie de
Basedow (ou maladie de Basedow-Graves), causée par un
détournement de cellules immunitaires vis-à-vis des constituants
des cellules folliculaires de la thyroïde.
3. La maladie de Basedow
3.1. Généralité
La maladie de Basedow, encore appelée maladie de Graves
dans la littérature anglo-saxonne, est la cause la plus fréquente
des hyperthyroïdies (plus de 85% des cas) dues à une production et
une libération excessive, et en permanence, d'HT. Un terme similaire,
thyréotoxicose, fait référence aux
phénomènes biochimiques et physiologiques qui surviennent quand
les tissus reçoivent une quantité excessive d'HT (Stanley et
Beare, 2005). La maladie de Basedow est une MAI dans laquelle des auto-Ac
sont produits par des plasmocytes dérivés de LB
sensibilisés contre les R-TSH présents au niveau de la face
basale des cellules folliculaires thyroïdiennes
(Kierszenbaum,
2006).
Normalement, les HT sont synthétisées en
permanence dans les thyrocytes, stockées dans la colloïde et ne
sont libérées que si la TSH est fixée sur son
récepteur. Et, cela se fait en réponse aux besoins de
l'organisme. Dans la maladie de Basedow, les auto-Ac se fixent sur ces
récepteurs et reproduisent l'effet de la TSH, stimulant la production
d'AMPc. Ainsi, les cellules folliculaires thyroïdiennes deviennent
cylindriques et sécrètent, de manière
incontrôlée, de grandes quantités d'HT dans la circulation
sanguine
(Kierszenbaum,
2006).
Comme les MAI sont des maladies multifactorielles dont la
plupart se développent lors de l'association d'un terrain
génétique favorable et de stimulations environnementales, les
attaques auto-immunes thyroïdiennes ne font pas exception à cette
situation. Dans la maladie de Basedow, les deux facteurs prédisposant
majeurs influençant la survenue de la maladie sont le sexe et
l'hérédité, en plus de certains facteurs
déclenchant comme le stress brutal et une forte tension mentale qui
stimule de façon brusque et prolongée le SI. Les femmes ont 3
à 10 fois plus de risque d'être atteintes que les hommes. La
maladie peut survenir à n'importe quel âge, mais son incidence
maximale se situe entre 20 et 40 ans (Stanley et Beare, 2005 ;
Barbara,
2010 ;
Henry
et Thomson, 2004 ; Revue dans Vigreux, 2009).
Les scientifiques pensent que la maladie est une anomalie
héréditaire du SI. Environ 15% des patients atteints de la
maladie de basedow ont un membre proche de leur famille souffrant de la
même maladie, suggérant une composante génétique non
négligeable dans l'origine de cette pathologie auto-immune (Stanley
et Beare, 2005 ; Gurnell, 2009).
Comme dans le décours de beaucoup d'autres MAI, celui
de la maladie de Basedow présente habituellement des périodes
d'exacerbation et de rémission. Le sérum de beaucoup de patients
atteints de cette maladie contient un stimulateur à longue durée
de la thyroïde qui stimule la fonction thyroïdienne (Stanley et
Beare, 2005). L'étude du rôle de l'auto-immunité dans
la maladie de Basedow-Graves est limitée par l'absence de modèle
expérimental bien défini. La première indication d'une
origine immunologique de l'hyperthyroïdie a été fournie par
l'étude du facteur de stimulation de la thyroïde à longue
durée d'action ou LATS (long acting thyroid stimulator). Le
sérum de malades atteints d'hyperplasie diffuse de la thyroïde est
capable de stimuler de façon prolongée les thyroïdes de
cobayes ou de souris comme le montre la mesure de l'augmentation de la
captation d'iode radioactif. Au contraire, la TSH ne provoque qu'une
brève augmentation de l'incorporation d'iode radioactif (Fudenberg
et al., 1986).
En utilisant des techniques classiques de fractionnement, le
LATS a été isolé du sérum humain dans la fraction
des ã-globulines. Il est également précipitable par un
anti-IgG. Après clivage de ces IgG par la papaïne,
l'activité LATS est retrouvée dans le fragment Fab. De plus, les
antisérums anti-IgG humaines sont capables d'inhiber l'activité
biologique du LATS. Des extraits bruts de thyroïde humaine
possèdent également cette activité inhibitrice ou
neutralisante de l'activité LATS. La présence de la substance
active a pu être détectée à la surface des cellules,
sur la membrane plasmique. Elle est détruite par traitement par des
enzymes protéolytiques. La thyroglobuline humaine purifiée ne
neutralise pas le LATS (Fudenberg et al., 1986).
Bien que le LATS semble réagir spécifiquement
avec la surface des cellules thyroïdiennes, et peut être avec le
récepteur de la TSH, la pathogénie auto-immune de la maladie de
Basedow-Graves ne peut pas être affirmée sur la seule existence de
cet Ac. En fait, le LATS n'est trouvé que chez environ 50% des malades
atteints de la maladie de Basedow-Graves en évolution, et sa
présence n'est que mal corrélée avec la fonction
thyroïdienne (hyperfonctionnement thyroïdien non inhibé par
rétroaction) (Fudenberg et al., 1986). On a
ultérieurement observé que des IgG de malades dépourvus
d'activité LATS démontrables stimulent la glande thyroïde
humain in vitro et protègent le LATS de l'inhibition
provoquée par des extraits thyroïdiens humains (et non murin). Pour
cette raison, ces immunoglobulines non LATS stimulant la thyroïde ont
été appelées « facteurs protecteurs du
LATS » (Fudenberg et al., 1986). Lorsque des
méthodes sensibles sont utilisées, la grande majorité des
sérums de malades porteurs d'une maladie de Basedow-Graves
évolutive possèdent une activité stimulante de la
thyroïde humaine. On a démontré que les Ac responsables de
cette stimulation sont capables de déplacer la TSH de son
récepteur membranaire à la surface des cellules
thyroïdiennes et d'imiter l'activité de l'hormone en activant
l'adényl-cyclase (Fudenberg et al., 1986). Dans
l'hyperthyroïdie de Basedow-Graves, les immunoglobulines pathologiques
(LATS et facteurs protecteurs du LATS) sont donc des Ac anti-récepteurs
qui possèdent la fonction de l'hormone qu'ils déplacent (TSH).
Actuellement, le terme général d'Ac stimulant la thyroïde
(TSab) s'applique à la fois au LATS et aux facteurs protecteurs du
LATS.
D'un point de vue anatomopathologique, l'étude des
pièces de thyroïdectomie de cette maladie révèle une
hyperplasie de l'épithélium thyroïdien, avec de nets signes
de prolifération des thyrocytes. Les cellules folliculaires sont hautes,
et la lumière des follicules est petite, avec une colloïde rare,
témoignant de l'hyperactivité (Fig.8.). Des structures
pseudopapillaires peuvent être observées, se projetant dans la
lumière folliculaire. On trouve entre les follicules des lymphocytes T
et B. Il existe une vasodilatation. La glande est hyperémiée
(Gorochov et Papo, 2000).
En immunohistochimie, on a pu montrer que les LT comprenaient
aussi bien des lymphocytes helper (majoritaires que des lymphocytes
suppresseurs cytotoxiques) que des lymphocytes suppresseurs cytotoxiques. Il a
pu être montré également une expression anormale par les
cellules thyroïdiennes des Ag de classe II du CMH (Gorochov et Papo,
2000). Cette expression est considérée comme un
élément primordial du déclenchement de
l'auto-immunité thyroïdienne. On sait maintenant qu'il s'agit d'un
phénomène secondaire, éventuellement impliqué dans
la perpétuation de la maladie, mais pas dans son
déclenchement (Gorochov et Papo, 2000).

Figure. 8. Coupe transversale schématique d'un
follicule thyroidien hyperfonctionnel (I) et au repos (II), (Maunand,
2002).
La sensibilisation des LT aux Ag intra-thyroïdiens donne
naissance à des auto-Ac dirigés contre ces Ag, plus
particulièrement, les auto-Ac anti-récepteur TSH, ce qui
exagère la sécrétion des HT et élimine la
possibilité de rétrocontrôle négatif. Il en
résulte un tas de troubles physiologiques au niveau de tout l'organisme
dues aux divers symptômes de l'hyperthyroïdie, d'une part, et un
effet pathogène des auto-Ac sur autres cibles, d'autre part. Des
complications plus graves, notamment oculaires et dermiques, peuvent aussi
apparaître.
3.2. Facteurs
prédisposant : génétiques et environnementaux
La maladie de Basedow constitue l'une des principales
dysendocrinies thyroïdiennes auto-immunes avec la thyroïdite de
Hashimoto qui résultent d'une rupture de la tolérance immunitaire
vis-à-vis d'auto-antigènes thyroïdiens. Comme il est
mentionné plus haut, elles se développent essentiellement lors de
l'association d'un terrain génétique favorable et de stimulations
environnementales. De nombreuses recherches ont permis d'identifier plusieurs
facteurs prédisposant au développement des thyroïdites
auto-immunes même si l'évènement initiateur du
dérèglement immunitaire reste inconnu à ce jour
(Revue dans Vigreux, 2009).
Chez l'Homme, les données
épidémiologiques concernant les thyroïdites auto-immunes ont
mis en évidence une répartition hétérogène
de ces dysendocrinies au sein de la population ainsi que des degrés
variables de pénétrance. Dès le début des
années 40, l'observation d'un caractère familial a permis
d'envisager une influence du patrimoine génétique sur le
développement des affections thyroïdiennes auto-immunes sans pour
autant exclure l'implication conjointe de facteurs environnementaux. Dès
1967, il a été remarqué que 33% des frères ou
soeurs d'individus atteints d'une maladie thyroïdienne auto-immune
(maladie de Basedow ou thyroïdite de Hashimoto) développaient
également la maladie, et que près de 56% d'entres-eux
possédaient des anticorps anti-thyroïdiens (contre 7 à 20%
dans la population générale) (Revue dans Vigreux,
2009). Il n'est pas rare d'observer à la fois des cas de
thyroïdite de Hashimoto et des cas de maladie de Basedow chez des
individus d'une même famille ce qui suggère un terrain
génétique commun au développement des diverses maladies
thyroïdiennes auto-immunes (Revue dans Vigreux, 2009).
Ensuite, les preuves les plus évidentes d'une
susceptibilité génétique au développement d'une
thyroïdite auto-immune sont apportées par l'étude des taux
de concordance chez des jumeaux homozygotes et hétérozygotes
(pourcentage de jumeaux tous les deux malades) qui sont, respectivement, de 35%
et 3% pour la maladie de Basedow (Revue dans Vigreux, 2009). La
forte discordance (un seul jumeau homozygote est malade sur les deux)
suggère qu'il n'existe pas un unique gène responsable de
l'auto-immunité mais un ensemble de gènes qui codent pour des
molécules intervenant à différents stades de la
réponse immunitaire (Revue dans Vigreux, 2009).
De études récentes ont identifié deux
loci principaux impliqués dans la prédisposition aux
thyroïdites auto-immunes chez l'Homme: le gène CTLA-4 (gène
codant pour le Cytotoxic T-Lymphocyte-associated Antigen-4) et le CMH.
D'autres gènes de susceptibilité ont été
identifiés, tels que ceux codant pour la CD40, la TSH, le LMP (Large
Multifunctional Proteosome), le TAP (Transport of Antigen
Processing), la PTPN22 (Protein tyrosine phosphatase,
non-receptor type 22). De même, certains haplotypes HLA, et plus
particulièrement ceux codant pour les molécules du CMH II, sont
associés au développement de la maladie de Basedow ; le locus
HLA-DR semble être le principal gène du HLA capable de modifier la
susceptibilité à développer une maladie de Basedow :
l'allèle DR3 prédisposerait à la maladie alors que
l'allèle DR5 aurait un rôle protecteur (Revue dans Vigreux,
2009). L'allèle HLA-DR3 (= HLA-DRB1*03) serait, en effet,
présent chez environs 56% des basedowiens contre 26% dans la population
générale et constituerait un risque relatif de développer
la maladie, proche de 3,7% chez les Caucasiens. Certains allèles HLA
sont plus fréquents chez les basedowiens que dans la population
générale, il s'agit des allèles DRB1*0304, DQB1*02,
DQB1*0301/4 et DQA1*0501. L'haplotype DRB1*0304-DQB1*02-DQA1*0501 serait,
quant-à lui, associé à un risque plus élevé
de développer la maladie de Basedow (Revue dans Vigreux,
2009).
Deux gènes localisés sur la région du HLA
mais ne codant pas pour les molécules du HLA pourraient également
contribuer au développement de la maladie de Basedow : les gènes
LMP (Large Multifunctional Proteosome) et TAP qui codent,
respectivement, pour une sous-unité d'un protéasome
multifonctionnel (complexe enzymatique intracellulaire) responsable de la
dégradation d'antigènes et pour des molécules intervenant
dans le transport des antigènes remaniés vers la surface
cellulaire. Ces gènes, indispensables à la présentation
antigénique aux cellules immunitaires, seraient des gènes de
susceptibilité à la maladie de Basedow (Revue dans Vigreux,
2009). La substitution d'une histidine par un résidu arginine en
position 60 de la LMP2 est, en effet, associée à un risque
élevé de développer la maladie de Basedow. Certains
allèles des gènes TAP1 et TAP2 sont associés à un
risque accru de développer la maladie de Basedow (TAP1*0301 et
TAP2*0101) alors que d'autres sont associés à un risque
réduit (TAP2*0401) (247) (Revue dans Vigreux, 2009).
Plusieurs équipes de recherche ont observé une
association entre le gène CD40 (nommé GD 2), qui code pour la
protéine CD40 (joue un rôle fondamental essentiellement dans la
maturation des LB et la sécrétion des Ac), et la maladie de
Basedow (Revue dans Vigreux, 2009).
Les études menées sur le gène codant pour
le R-TSH (le déterminant antigénique principal de la maladie de
Basedow), situé sur le chromosome 14q31, montrent que certaines
mutations ou polymorphismes génétiques au niveau d'une partie du
gène R-TSH pourraient influencer la pathogénie de
l'auto-immunité basedowienne (Revue dans Vigreux, 2009).
A l'instar de la majorité des maladies
multifactorielles, les histoires familiales des maladies thyroïdiennes
auto-immunes ne suivent pas un schéma de transmission
héréditaire évident avec une pénétrance et
une expressivité variable. Les études
d'épidémiologie génétique et de biologie
moléculaire jouent un rôle majeur dans la détermination de
la susceptibilité génétique à développer une
maladie auto-immune comme la maladie de Basedow. Ces études ont mis en
évidence que les prédispositions génétiques
observées étaient la conséquence de variations mineures
dans un grand nombre de gènes. Ces variations isolées ne
suffisent pas à provoquer la maladie ; c'est leur association
combinatoire et leurs interactions avec d'autres facteurs externes qui
entraînent des effets sur le métabolisme cellulaire, tissulaire et
à l'échelle de l'organisme et qui déclenchent la maladie
(Revue dans Vigreux, 2009).
Le stress parait également jouer un rôle
fondamental dans le déclenchement des MAI. De récentes
études cas-témoins ont démontré que les patients
basedowiens rapportent plus souvent des évènements facteurs de
stress survenus quelques mois précédant le début des
symptômes.
Les mécanismes patho-physiologiques responsables de
l'influence des facteurs de stress sur les processus auto-immuns sont encore
hypothétiques : l'auto-immunité anti-thyroïdienne pourrait
être liée à l'altération de l'axe
hypothalamo-hypophyso-adrénalien pendant et après la
période de stress qui provoquerait une immunosuppression globale
(concernant notamment les cellules immuno-régulatrices). Les
corticostéroïdes, les endorphines et les enképhalines,
libérées au cours du stress, ont des activités
immunosuppressives in vivo (Revue dans Vigreux, 2009). Les
corticostéroïdes jouent un rôle majeur de
rétrocontrôle négatif sur les réponses immunitaires.
Les lymphocytes eux-mêmes peuvent répondre au CRF
(Corticotrophin Releasing Factor) en produisant leur propre hormone
corticotrope qui induit à son tour la sécrétion de
corticostéroïdes. Il a été démontré que
les corticostéroïdes inhibaient la production de cytokines Th1,
tandis qu'ils épargnaient les réponses Th2 : ils orientent donc
les réponses immunitaires vers des réponses à
médiation humorale.
La maladie de Basedow peut être également
attribuée à une infection. Cependant, le rôle d'agents
infectieux dans la pathogénie des thyroïdites auto-immunes reste
hypothétique. Dans la maladie de Basedow, Yersinia
enterolitica, un
bacille
à
Gram
négatif, semble jouer un rôle de
déclenchement de la maladie par le phénomène de
mimétisme moléculaire. Une voie d'évidences est
indiquée, d'une part, par l'observation d'une communauté
antigénique entre le récepteur thyroïdien de la TSH et une
structure de la capsule de Yersinia enterolitica, et d'autre part, par
la prévalence élevée d'anticorps anti-Yersinia
chez les basedowiens, au moins dans certaines populations. Yersinia
enterolitica possède des sites de liaison pour la TSH et les
anticorps provenant de patients basedowiens sont capables de se fixer sur la
bactérie et d'inhiber la liaison de la TSH sur cette dernière.
Deux protéines capsulaires de Yersinia enterolitica de faible
poids moléculaire (5,5 et 8 kDa) contiennent des épitopes
responsables d'une réaction croisée avec le récepteur de
la TSH ; ces protéines sont appelées TSHR-CRP (Thyroid
Stimulating Hormone Receptor CrossReactive Proteins). Zhang H. et son
équipe ont mis en évidence qu'en plus d'être responsables
d'une antigénicité croisée, ces TSHR-CRP sont
également mitogènes des lymphocytes B spléniques chez la
souris car ils stimulent leur prolifération et la production
d'immunoglobulines G et M. Ainsi, Yersinia enterolitica pourrait
être impliquée dans la pathogénie de la maladie de Basedow
par le biais des TSHR-CRP (Revue dans Vigreux, 2009).
3.3. Mécanismes immunopathologiques
La physiopathologie de la maladie de Basedow est mal connue et
cette méconnaissance résulte largement de l'absence
jusqu'à ces dernières années de modèle animal
convaincant. Ce qui est évident c'est que la maladie de Basedow survient
sur un terrain génétiquement prédisposé. Des
facteurs de l'environnement tels qu'une infection capable de déclencher
une stimulation non spécifique du SI, ou des agressions diverses vont
entrainer une réponse auto-immune pathologique, par suite d'un
déficit latent d'une variété des LT, les LT suppresseurs.
Des LT dirigés contre les Ag thyroïdiens vont apparaître,
activant les LB qui vont produire des immunoglobulines stimulant la
thyroïde (Gorochov et Papo, 2000).
Les deux affections majeurs auto-immune de la thyroïde,
la thyroïdite de Hashimoto et la maladie de Basedow, partagent un
mécanisme immunitaire similaire mais, sur le plan histologique, une
infiltration inflammatoire lymphocytaire de degré variable. La
communauté de mécanisme explique la variabilité du cours
respectif de ces affections, une maladie de Basedow pouvant évoluer vers
une thyroïdite de Hashimoto, l'inverse étant aussi possible
(Page web).
Dans la maladie de Basedow, la réponse auto-immune est
dominée par les cellules Th2 CD4+, l'infiltrat lymphocytaire
est moindre et la destruction tissulaire relativement faible (Parham,
2003). Les anomalies biologiques thyroïdiennes
rencontrées sont une TSH infranormale et l'apparition d'Ac
anti-RTSH (95% des cas), anti-TPO (80%) et anti-Tg (25%) (Eyquem, et
al., 2000). La réponse immunitaire à l'origine de
la maladie est détaillée dans la figure ci-dessous. 
Figure. 9. Processus immunologique
à l'origine de la maladie de Basedow et de la thyroïdite de
Hashimoto. (Page web)
L'activation des LT auxiliaires (T helper, Th1
CD4+) se fait par l'agression d'une cellule
présentatrice d'Ag (par exemple, un macrophage) qui induit l'expression
de l'Ag MHC de classe II, permettant ainsi la présentation d'un Ag
auquel répond le T helper (Fig.9, 1a). Cette
activation peut aussi être stimulée par des Ag thyroïdien
(Fig.9, 1b), ou des Ag ressemblant à un Ag
thyroïdien, par exemple, viral. Les cellules T helper
activées induisent la sécrétion de cytokines (Fig.9,
2) et activent les lymphocytes B (Fig.9, 3). Les cytokines
stimulent différentes populations de lymphocytes dont les
CD8+ qui provoquent l'apoptose du thyréocyte (Fig.9,
4). Les LB produisent des Ac antithyroïdiens dont les Ac anti-TPO qui
ont une propriété cytotoxique. La perturbation des
éléments modulateurs (Fig.9, 5) de la réponse
immunitaire peut contribuer à l'apparition de la thyroïdite de
Hashimoto ou de la maladie de Basedow (Page web).
Si les facteurs de prédisposition à la maladie
de Basedow sont encore mal cernés, et si les stades initiaux de
l'auto-immunisation contre la cellule thyroïdienne sont largement
méconnus, le mécanisme d'apparition de l'hyperstimulation de la
thyroïde et de l'hyperthyroïdie parait clair. Parmi les Ac
antithyroïdiens présents au cours de la maladie de Basedow, on
trouve des Ac dirigés contre le R-TSH capables de stimuler ce
récepteur, en particulier par son fragment Fab, et donc d'activer, en
l'absence de TSH, la synthèse et la libération des HT.
La réponse auto-immune dans la maladie de Basedow
repose principalement sur la production d'Ac, les symptômes étant
dus à la fixation des Ac aux récepteurs de TSH
(Fig.10.). En mimant le ligand naturel, les Ac fixés
déclenchent une surproduction chronique d'HT qui est indépendante
de la régulation par la TSH et insensible aux besoins
métaboliques de l'organisme.
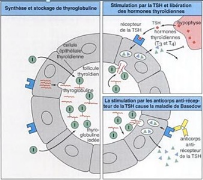
Figure. 10. Dans la maladie de
Basedow, les auto-Ac dirigés contre le récepteur de la TSH
causent une surproduction d'HT (Parham, 2003).
La figure N° 10 représente des follicules
thyroïdiens entourés de cellules épithéliales. La
partie gauche de la figure montre l'absorption d'iodure (cercles verts),
l'iodation de la thyroglobuline et son stockage dans les follicules quand les
HT ne sont pas nécessaires. Le panneau en haut à droite montre ce
qui suit en cas de besoin d'HT. La TSH de l'hypophyse induit l'endocytose et la
dégradation de la Tg iodée, ce qui produit la T3 et la
T4. En plus de l'effet qu'elles exercent sur le métabolisme,
T3 et T4 signalent à l'hypophyse d'arrêter
la sécrétion de TSH. Le panneau en bas à droit montre ce
qui se passe dans la maladie de Basedow. Les auto-Ac miment l'action de la TSH
et entrainant de manière continue la synthèse et la
libération d'HT. Chez les patients souffrant de la maladie de Basedow,
la production d'HT devient indépendante de la TSH (Parham,
2003).
Les mécanismes immunologiques responsables de
l'apparition et de l'évolution des symptômes spécifiques de
la maladie de Basedow, notamment ophtalmo-pathique et dermique, sont encore
obscurs (Gorochov et Papo, 2000).
L'apparition de l'exophtalmie lors de la maladie de Basedow
est peut être liée à un processus différent. Enfin,
des arguments ont été présenté en faveur de
l'existence d'Ac stimulant les récepteurs pour la TSH situés sur
les cellules rétro-orbitaires. On privilégie l'hypothèse
d'une auto-immunité croisée entre un ou des Ag thyroïdiens
et un ou des Ag de l'orbite, et en particulier des muscles oculomoteurs. Le
récepteur de la TSH est un Ag candidat. Certaines équipes ont
montré la présence de son ARN dans les cellules des tissus
orbitaires. Mais la démonstration de la présence de la
protéine elle-même n'est pas faite (Gorochov et Papo,
2000 ; Fudenberg et al., 1986).
3.4. Symptômes et formes cliniques
Puisque l'hyperthyroïdie de la maladie de Basedow est due
à des auto-Ac dirigés contre les auto-Ag de la thyroïde, la
maladie associe, donc, des signes de thyrotoxicose à des signes
liés à la dysimmunité ou à des signes
spécifiques de la maladie de Basedow. Cette dernière est alors
associée à des manifestations cliniques variées qui
peuvent atteindre n'importe quel système (page 42). Les
mécanismes expliquant ces manifestations ne sont pas complètement
connues mais doivent impliquer une augmentation de la sensibilité aux
catécholamines (Mallard, 2010 ; Stanley et Beare, 2005).
· Le syndrome de thyrotoxicose (ou
l'hyperthyroïdie) se manifeste par différents signes ou
troubles
- Signes
généraux :
. asthénie,
. amaigrissement (fonte de la masse musculaire et fonte
graisseuse) contrastant avec une augmentation de l'appétit,
. thermophobie accompagnée d'une main chaude et
moite lors de la pognée de main, et d'une hypersudation ;
- Troubles cardiovasculaires :
. tachycardie permanente,
. palpitations,
. troubles du rythme cardiaque,
. insuffisance cardiaque ;
- Troubles digestifs :
. diarrhée motrice par poussées ;
- Troubles neuromusculaire :
. tremblements diffus (principalement aux
extrémités, majorés par l'émotion),
. asthénie majorée à l'effort,
. troubles psychiques : nervosité,
irritabilité, agitation, anxiété, troubles de l'attention
et de l'humeur, état dépressif ou, au contraire, état
maniaque voire délirant (hallucination etc.) chez les sujets
âgés ;
- Troubles endocriniens :
. baisse de la libido,
. troubles de la menstruation,
. gynécomastie chez l'homme.
· Les signes liés à la
dysimmunité (Mallard, 2010)
- Un goitre :
. diffus,
. homogène,
. mobile,
. indolore,
. thrill vasculaire à la palpitation (sensation de
vibration),
. souffle systolique à l'auscultation,
. non compressif,
. sans adénopathie ;
- Une
ophtalmopathie :
. une exophtalmie bilatérale (yeux
exorbités) et symétrique permet de porter le diagnostic. Elle
s'accompagne de signes qui accentuent l'aspect tragique du regard :
. rétraction de la paupière
supérieure,
. fixité du regard,
. oedème palpébral,
. pigmentation palpébrale,
. oedème conjonctival ;
- Une dermopathie :
. un myxoedème prétibial (aspect peau
d'orange, peau dure et éventuellement brune) localisé à la
face antérieure des jambes ;
- Une acropathie
. épaississement des doigts et des orteils avec
hippocratisme digital et ostéoarthropathie.
Généralement, l'hyperthyroïdie se
caractérise par une tachycardie, un amaigrissement, une moiteur des
mains, une accélération du transit intestinal, une
nervosité et un tremblement des extrémités auxquels
s'ajoutent les signes spécifiques de la maladie comme un goitre, une
ophtalmopathie, une dermopathie (un myxoedème prétibial) et une
acropathie (Mallard, 2010).
Lors de l'excès d'HT, la peau, les poiles et les
phanères peuvent être affectés. En réalité,
le métabolisme augmente la production de chaleur et une vasodilatation
périphérique survient pour dissiper la chaleur excessive ce qui
donne une peau chaude, moite et une augmentation de la transpiration. Les mains
sont généralement moites et rouges. Le teint est habituellement
rose et le patient rougit facilement. Les HT en excès entrainent une
augmentation de la synthèse et de la dégradation des
protéines et des lipides. La dégradation dépasse,
cependant, la synthèse, c'est pourquoi les patients
hyperthyroïdiens peuvent avoir une peau et des cheveux fins et signaler
que leurs cheveux ne restent pas bouclés (Stanley et Beare
,2005).
Avec l'excès d'HT, la synthèse et la
dégradation des protéines augmentent. La dégradation est
plus importante que la synthèse, ce qui entraine une faiblesse et une
fatigabilité au niveau des muscles. La faiblesse est habituellement plus
importante dans les muscles proximaux des membres, et le patient éprouve
des difficultés pour monter les escaliers ou pour maintenir les jambes
étendues. Dans certains cas, la fonte musculaire, en particulier dans
les endroits proximaux, est hors de proportion avec la perte globale de poids.
Cette dégradation des protéines, affectes également les
muscles respiratoires, entraine une dégradation musculaire et par la
suite une faiblesse de ceux-ci amenant une diminution de la capacité
vitale. De plus, comme la demande métabolique est augmentée, les
besoins en oxygène augmentent aussi que la nécessité de
dissiper l'excès de gaz carbonique. Ceci entraine une augmentation de la
fréquence respiratoire et une sensation de dyspnée (Stanley
et Beare ,2005).
La modification la plus caractéristique de
l'hyperthyroïdie est remarquée au niveau du système
cardiovasculaire, en particulier chez les personnes âgées. Etant
donné l'hypermétabolisme, la demande circulatoire pour dissiper
l'excès de chaleur produite augmente. Le volume d'éjection et la
fréquence cardiaque sont tous deux augmentés, ce qui entraine une
augmentation du débit cardiaque. L'augmentation de la demande
métabolique et les effets directes des HT sont responsables d'une
tachycardie même au repos. Les effets adrénergiques des
HT sur le coeur entrainent une augmentation de la force de contraction, ce qui
amène une augmentation de la pression sanguine et des plaintes
cardiaques, et parfois un frottement systolique (Stanley et Beare
,200
Etant donné les modifications du métabolisme des
protéines, les muscles papillaires peuvent subir des altérations
qui entrainent un prolapsus de la valve mitrale. De toutes ces modifications,
les troubles du rythme cardiaque sont les plus fréquents. La tachycardie
paroxystique supraventriculaire et la fibrillaion auriculaire sont des
manifestations habituelles. Suite à l'augmentation du métabolisme
et la sensibilité cardiaque aux catécholamines, le patient
âgé peut ne pas avoir assez de réserve pour supporter ces
troubles du rythme : Une décompensation cardiaque congestive peut
survenir. La réponse aux digitaliques, des classes thérapeutiques
de médicaments utilisés en cardiologie, est diminuée
étant donné que l'excès d'HT accélère la
métabolisation de ce médicament. Et, comme la dégradation
des protéines excède la synthèse, la
protéinémie peut diminuer entrainant une augmentation de la
fragilité capillaire qui serait responsable de pétéchies
et d'ecchymoses (Stanley et Beare ,2005).
Le système gastro-intestinal peut à son tour
être affecté ; l'accélération du
métabolisme ainsi que la dégradation des protéines et des
lipides entrainent une augmentation de l'appétit et de la consommation
des aliments chez la plupart des personnes âgées
présentants une hyperthyroïdie. Cette prise calorique plus
importante peut, malgré tout, être inadéquate et le patient
peut perdre du poids. En effet, un autre facteur contributif intervient sous
forme d'une augmentation de la motilité gastro-intestinale, ce qui
diminue l'absorption des nutriments. Bien qu'une augmentation de
l'appétit chez les personnes âgées hyperthyroïdiennes
soit très fréquente, l'anorexie survient chez environ 1/3 de ces
personnes. Par un mécanisme inconnu, la vidange gastrique rapide et
l'hypermotilité sont fréquentes, ce qui entraine des selles
abondantes et peu formées. Dans certains cas, l'hypermotilité
entraine une légère malabsorption des lipides (Stanley et
Beare ,2005).
Le système nerveux peut également être
touché, les patients ressentent fréquemment, en effet, de la
nervosité, une labilité émotionnelle (qui est
habituellement évidente), de l'hyperkinésie et de la fatigue.
Les mécanismes responsables des modifications dans le système
nerveux n'ont pas encore été élucidés mais peuvent
se manifester par une augmentation de l'activité adrénergique.
La personne âgée peut présenter de l'agitation qui se
traduit par de faibles capacités d'attention et un besoin constant de
bouger (Stanley et Beare ,2005).
Lors de l'hyperthyroïdie, des quantités plus
importantes de calcium et de phosphore sont excrétées dans les
urines et dans les selles. L'organisme répond en libérant plus
d'hormones parathyroïdiennes qui extraient le calcium des os pour
normaliser la calcémie. Cela peut entrainer une
déminéralisation des os et des fractures pathologiques, en
particulier chez les femmes âgées (Stanley et Beare
,2005).
Les personnes âgées présentant une
hyperthyroïdie semblent souvent avoir un regard brillant. Il y a une
rétraction de la paupière supérieure comme le prouve la
présence d'un bord de sclérotique entre la paupière et le
limbe. Il y a aussi une asynergie de la paupière, le déplacement
de la paupière supérieure est en regard sur celui du globe
oculaire quand le patient regarde vers le bas, ainsi qu'une asynergie du globe
oculaire dans laquelle le déplacement du globe est en retard sur celui
de la paupière supérieure quand le patient regarde lentement vers
le haut. Les mouvements des paupières sont vifs, et il peut y avoir un
léger tremblement quand les paupières sont closes. Ces signes et
symptômes sont probablement reliés à une augmentation de
l'activité adrénergique (Stanley et Beare ,2005).
Une manifestation majeure de la maladie de Basedow est
l'ophtalmopathie infiltrative entrainant une exophtalmie qui
résulte d'un épaississement des muscles oculomoteurs (dû
à une infiltration des muscles extraoculaires par des cellules
mononuclées) et d'une hypertrophie du tissu adipeux orbitaire, avec
dépôts de glycosaminoglycanes (GAG), entrainant une protrusion de
l'oeil. L'accumulation des GAG (dérivant de fibroblastes orbitaires)
accentue la rétention liquidienne réduisant de ce fait l'espace
libre à l'intérieur de la cavité orbitaire (Stanley
et Beare ,2005).
Le patient peut ressentir des symptômes précoces
qui sont : l'irritation des yeux et le larmoiement excessif avec une
injection conjonctivale. Le patient peut dormir avec les yeux partiellement
ouverts, ce qui dessèche la cornée et entraine des
ulcérations ou des infections cornéennes. L'exophtalmie survient
bilatéralement mais est habituellement asymétrique. Etant
donné l'infiltration des muscles extraoculaires, le patient
éprouve des difficultés à atteindre et maintenir la
convergence, ce qui entraine des problèmes de mise au point et de
diplopie (Stanley et Beare ,2005).
Les signes oculaires de la maladie de Basedow peuvent
aller de la simple rétraction palpébral, qui peut
s'intégrer aussi bien dans les signes d'hyperadrénergie
(présents dans n'importe quelle forme d'hyperthyroïdie) que dans
l'ophtalmopathie vraie, à l'exophtalmie maligne. Dans l'ophtalmopathie
vraie, la rétraction palpébrale est souvent associée
à l'asynergie oculopalpébrale (Gurnell, 2009 ; Gorochov
et Papo, 2000). Les muscles oculomoteurs, en fait, sont le siège
d'un chémosis.
Enfin, il arrive que le nerf optique lui-même souffre
par compression au pole postérieur de l'orbite par les muscles
hypertrophiés. L'atteinte de la cornée et/ou du nerf optique
s'intègrent dans l'ophtalmopathie maligne avec un risque majeur de
cécité par atteinte ischémique du nerf optique, ou
perforation cornéenne, voire fonte purulente de l'oeil. Les formes les
plus graves résultent souvent de la conjonction des
phénomènes inflammatoires vrais et de phénomènes de
compression et de congestion vasculaire dans l'orbite (Gorochov et Papo,
2000).
Une autre forme typique de la maladie de Basedow est le
myxoedème prétibial lequel est beaucoup plus rare et
toujours associé à une ophtalmopathie basedowienne. Il s'agit
d'une infiltration de la face antérieure de la jambe, dans sa forme la
plus limitée, et d'un épaississement de la peau et du tissu
sous-cutané, avec dilatation des pores desquels saillent des poils
épais (aspect de peau de cochon). On peut noter un aspect
légèrement inflammatoire, chaud et rosé. Dans sa forme la
plus sévère, très rare, l'infiltration devient majeure
réalisant un aspect d'oedème sur éléphantiasique
très invalidant. Cette infiltration correspond à un
dépôt de GAG, comme dans l'ophtalmopathie basedowienne. Une
infiltration lymphoïde a été décrite, beaucoup plus
modeste et semble-t-il uniquement dans les stades initiaux de la maladie
(Gorochov et Papo, 2000).
Une acropathie, même si elle est
exceptionnelle, peut également apparaître. Elle est toujours
associée à une ophtalmopathie et un myxoedème
prétibial. Les doigts sont déformés en baguette de tambour
et les ongles s'arrondissent. C'est une périostite de
l'extrémité inférieure du radius (Gorochov et Papo,
2000).
3.5. Diagnostic
L'hypothèse d'une maladie de Basedow survient lorsque
les observations cliniques mettent en évidence une hypertrophie
symétrique de la thyroïde avec une surface lisse (ou un goitre
diffus) et des signes d'hyperthyroïdie parfois associés à
une ophtalmopathie infiltrative et à un myxoedème
prétibial (Revue dans Vigreux, 2009).
Chez le patient présentant une hyperthyroïdie, le
diagnostic de la maladie de Basedow repose sur l'association d'un goitre diffus
vasculaire (souffle audible à l'auscultation de la thyroïde), d'une
ophtalmopathie éventuelle et de la présence de TRAK. Dans 80% des
cas, le diagnostic peut être posé sans le dosage des TRAK.
L'association de l'hyperthyroïdie et des signes oculaires suffit la
plupart du temps à faire évoquer le diagnostic. Toutefois, les
signes oculaires peuvent manquer et les examens paracliniques sont alors
utiles. Le goitre peut être détecté par une
échographie thyroïdienne qui montre un goitre diffus, à
tendance hypoéchogène, hétérogène
(Gorochov et Papo, 2000 ; Revue dans Vigreux, 2009).
L'hyperthyroïdie Basedowienne n'est pas différente
biologiquement des autres causes d'hyperthyroïdie : TSH
effondrée et T4 et T3 libres augmentées,
parfois seule la T3 libre est augmentée. La preuve
de l'auto-immunité est apportée par la présence d'Ac
antithyroïdiens : Ac anti-TPO, anti-TG et Ac anti-récepteur de
la TSH. Ces derniers sont les plus caractéristiques de la maladie de
Basedow. Ces Ac sont mis en évidence par des techniques
radio-immunologiques ou, plus récemment, par des techniques ELISA
(Guilloux et al., 2006 ; Gorochov et Papo, 2000).
Pour l'ophtalmopathie, lorsque le diagnostic de la maladie de
Basedow est incertain, la tomodensitométrie ou l'IRM des orbites
permettent d'objectiver, outre la protursion oculaire, l'infiltration des
muscles oculomoteurs. La scintigraphie peut également aider au
diagnostic dans certaines situations telles que l'absence
d'ophtalmopathie, de titres en TRAK peu élevés ou d'une
association avec un goitre nodulaire. Dans la maladie de Basedow, la
scintigraphie au technétium, ou à l'iode radioactif, montre un
captage diffus homogène. La courbe de fixation, lorsqu'elle est faite,
montre une augmentation du captage et de l'organification du traceur.
L'échographie est rarement nécessaire mais peut être utile
lorsque la palpation cervicale révèle des formations nodulaires
afin de les caractériser. On peut alors cytoponctionner ou biopsier les
formations nodulaires afin de confirmer le diagnostic (Gorochov et Papo,
2000).
3.6. Traitements
Le repos est nécessaire dans tous les cas, surtout le
repos mental. Au cours de la maladie de Basedow, le traitement est palliatif,
il vise à restaurer et maintenir l'euthyroïdie d'une part, et
à limiter les manifestations extrathyroïdiennes, d'autre part. Ce
qui impose la diminution de la quantité d'HT par usage
d'antithyroïdiens de synthèse (ATS) ou suppression du
tissu thyroïdien, soit par chirurgie (thyroïdectomie
bilatérale subtotal), soit par iode radioactif. Il n'y a pas, en effet,
à ce jour de thérapeutique spécifique de la maladie
auto-immune elle-même.
3.6.1. Traitement
médical
Le traitement médical de la maladie de Basedow repose
sur la réduction de la synthèse hormonale et sur l'inhibition des
effets périphériques des HT. Ce traitement comporte un traitement
par :
- ATS : le plus utilisé est,
surtout, le carbimazole (Néo-mercazole) ; plus rarement, on utilise
le propyl-thio-uracile (PTU). La posologie, élevée au
début du traitement (2 à 3 comprimés de
Néomercazole soit 20 mg par jour), est ensuite progressivementt
diminuée. Outre les mesures purement symptomatiques, sédatifs,
bétabloquants, etc., ce traitement doit être
précédé d'un bilan hépatique et s'accompagner d'une
surveillance hématologique (NFS toutes les semaines pendant les deux
premiers mois, puis NFS tous les 3 mois) (Rouquette, 2002).
Tableau. 3.1. Antithyrodiens de
synthèse, (Rouquette, 2002).

Ces drogues bloquent l'action de la TPO et donc l'iodation de
la Tg indispensable à la synthèse des HT. Le traitement doit
être prolongé, de 12 à 18 mois. Après la phase
d'induction du traitement, la posologie est réduite et l'on tente de
maintenir l'euthyroïdie avec une petite dose ; le maintien de
l'euthyroïdie est facilité par une substitution en HT. Il est
discuté un effet immunosuppresseur propre des antithyroïdiens, ce
qui a justifié le recours à de fortes doses pour favoriser
l'induction d'une rémission, voire d'une guérison, de la maladie.
Cet effet immunosuppresseur n'a pas été prouvé, et les
protocoles associant de fortes doses de méthimazole ou carbimazole en
traitement prolongé à une substitution en HT afin de ne pas
plonger le patient en hypothyroïdie n'ont pas fait la preuve de leur
supériorité sur les traitements classiques (Gorochov et
Papo, 2000 ).
- Betabloquants : ils agissent essensiellement sur les
symptomes cardiovasculaires (tachycardie, palpitations) à un
degré moindre sur les sueurs, la thermophobie, le tremblement. Le
propranolol est souvent utilisé. Associés aux
bétabloquants et aux ATS, sont souvent prescrits des anxiolytiques,
des hypnotiques avec un conseil pour un repos total :
physique, psychique, émotionnel (Molinier, 2007).
Tableau. 3.2. Bétabloquants, (Rouquette,
2002).
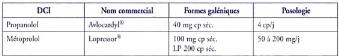
3.6.2. Traitement par iode
radioactif
A l'arrêt du traitement, il existe un risque de rechute
de l'ordre de 30 à 40%. Il n'a pas été identifié
à ce jour de critère formel de risque de rechute ou de
guérison. Lorsque survient une rechute après un traitement
prolongé par les antithyroïdiens, un traitement radical est
proposé : La thyroïdectomie de réduction ou
destruction partielle de la thyroïde par l'iode radioactif (ou
castration par iode radioactif, I131) est une méthode simple,
efficace, peu onéreuse et n'a pas les inconvénients de la
chirurgie. L'I131 est capté et organifié de la
même façon que l'iode naturel mais émet localement des
particules B destructrices qui endommagent les cellules et les tuent en
plusieurs mois. Cependant, là encore, il ne s'agit que d'un traitement
palliatif, visant à éviter la réapparition de
l'hyperthyroïdie. L'I131 est un moyen de traitement sûr
et efficace de la thyrotoxicose, sans modifier le cours évolutif de la
MAI (Gorochoy et Papo, 2000).
Pour certaines équipes, ce traitement radical est
préférable au traitement médical prolongé, compte
tenu de la fréquence des rechutes. Puisque cette méthode est
basée sur la destruction partielle de la thyroïde, l'effet
secondaire le plus fréquent après le traitement est la survenue
de manière insidieuse, et parfois tardive, d'une hypothyroïdie qui
légitime la prescription d'hormones substitutives à dose
physiologique (Gorochoy et Papo, 2000).
Le suivi à long terme des patients ayant reçu de
l'I131 est nécessaire du fait du risque important
d'hypothyroïdie réactionnelle. L'établissement de registres
des patients traités permet de les reconvoquer facilement, une fois par
an, pour effectuer un bilan fonctionnel thyroïdien (Gurnell,
2009).
3.6.3. Traitement par
chirurgie
La thyroïdectomie sub-totale est rarement choisie en
traitement de première ligne d'une thyrotoxicose non compliquée.
En revanche, elle sera indiquée en cas de thyrotoxicose
récidivante, signes de compression, allergies multiples aux traitements
médicamenteux ou mauvaise observance de ces traitements, adénome
toxique ou convenance personnelle. Une brève préparation par les
ATS est également nécessaire afin d'eviter la survenue d'une
crise thyrotoxique post-opératoire (Gurnell, 2009 ; Gilberg
et
Barthe, 2011).
En ce qui concerne l'ophtalmopathologie basedowienne,
l'exophtalmie ne nécessite pas le traitement spécifique
lorsqu'elle est modérée. Et, dans les formes plus
sévères, il y a recours à la corticothérapie.
Diverses thérapeutiques ont pu être utilisées dans les
formes très évolutives, menaçant le pronostic
visuel : plasmaphérèses, bolus de corticoïdes,
immunoglobulines polyvalentes, etc. La place réelle de ces diverses
thérapeutiques reste mal définie (Gorochoy et Papo,
2000).
3.7. Complications et maladies associées
A l'instar de n'importe quelles maladies, auto-immunes ou pas,
les complications sont présentes souvent, surtout, si la maladie n'est
pas traitée dans une brève période. Comme
l'hyperthyroïdie basedowienne provoque une accélération du
métabolisme, il y a une dépense accrue d'énergie. À
long terme, une hyperthyroïdie non traitée augmente le risque
d'être atteint d'
ostéoporose,
car l'absorption du
calcium
par les os est affectée. Egalement, une hyperthyroïdie non
traité provoque plusieurs types d'atteintes organiques
irréversibles. Il peut s'agir d'une détérioration
progressive du système cardiovasculaire conduisant à une
insuffisance cardiaque. Le risque de développer un type d'arythmie
cardiaque appelé fibrillation auriculaire augmente aussi (Stanley
et Beare ,2005).
Les agressions, y compris les infections, peuvent
précipiter une crise ou « tempète »
thyrotoxique. Généralement, les infections sont mal
maîtrisées par les malades thyrotoxiques. Lors d'une telle crise,
tous les signes d'hyperthyroïdie se trouvent réunis et s'expriment
à leur paroxysme, ce qui peut entraîner des complications graves,
comme de l'
insuffisance
cardiaque ou un coma. La personne est confuse et
agitée. Cette situation requiert des soins médicaux d'urgence
(Stanley et Beare ,2005).
De même, l'exophtalmie basedowienne peut
présenter des complications. Elle peut provoquer une kératite et
une atteinte cornéenne ou, pire, une névrite optique et une
cécité (Gorochov et Papo, 2000).
La maladie de Basedow présente des associations propres
avec d'autres maladies. Une atteinte hépatique peut témoigner
soit de la sévérité de l'hyperthyroïdie, soit d'une
authentique hépatite auto-immune associée. Parfois, elle traduira
une intolérance au traitement antithyroïdien (hépatite
toxique ou immunoallergique). L'atteinte musculaire peut être la
conséquence de l'hyperthyroïdie (signe du tabouret), mais il s'agit
parfois d'une myasthénie. Un purpura thrombopénique idiopathique
peut également être associé à la maladie de Basedow
(Gorochov et Papo, 2000).
Des auto-Ac peuvent attaquer les cellules pariétales de
l'estomac entrainant une réduction de l'acide chlorhydrique, qui est
nécessaire à l'absorption de la vitamine B12, indispensable pour
la maturation des globules rouges. La réduction de cette vitamine
entraine une anémie pernicieuse. Quand les globules rouges larges et
immatures de l'anémie pernicieuse pénètrent dans la
circulation, ils s'hémolysent, libérant de la bilirubine.
L'augmentation de la bilirubine entraine un ictère (Stanley et
Beare ,2005).
Peuvent également s'associer à la maladie de
Basedow, comme à la thyroïdite de Hashimoto, d'autres MAI telles
que le diabète de type 1, le vitiligo ou la polyarthrite rhumatoïde
(Gorochoy et Papo, 2000).
4 Conclusions et
perspectives
Il est clair que la cause exacte du déclenchement de la
maladie de Basedow reste mal comprise, mais les facteurs
génétiques et environnementaux prédisposant à son
apparition donnent une vision globale sur le déroulement de la maladie.
Les manifestations cliniques variées de la maladie ainsi que la
possibilité des complications imposent aux patients de suivre un
protocole thérapeutique radical pour un bon traitement et pour
éviter le plus possible le pourcentage de récidive et de rechute
après le traitement en suivant un mode de vie adéquat.
Vu que le traitement n'est que palliatif, même
après ablation de la thyroïde, la production
extra-thyroïdienne d'Ac dans les tissus lymphoïdes explique la
persistance des Ac, en particulier chez la femme enceinte qui conserve le
risque de transmettre ces Ac à son bébé. Cette situation
impose aux chercheurs de se diriger vers une piste de recherche à
l'avenir pour trouver un traitement d'un effet direct sur l'origine auto-immune
de la maladie de Basedow.
Les progrès récents, comme l'identification des
gènes associés aux maladies, l'amélioration des techniques
permettant l'étude des réponses immunitaires spécifiques,
chez l'Homme ainsi que chez les modèles animaux dont les observations
sont extrapolables à des syndromes humains, sont très prometteurs
et devraient permettre de résoudre l'énigme de
l'auto-immunité.
Références
bibliographiques
- Abbas A.k, Lichtman A.H (2008). Tolérance
immunitaire et auto-immunité. In : Les bases de l'immunologie
fondamentale et clinique pp 157-167. Traduction de la 3éme
édition anglaise, Elsevier Masson, Hong-kong.
-
http://www.google.fr/search?hl=fr&sa=G&tbm=bks&tbm=bks&q=inauthor:%22Nasr+Eddine+Boutammina%22&ei=MkpbUfu2FoS0PM7OgBA&ved=0CEAQ9AgwAA&biw=1366&bih=575
Boutammina
N.E (2012). Introduction. In : Le secret des cellules immunitaire -
Théorie bouleversant l'immunologie -. 1er
édition, Books on Demand, Allemagne.
- Chapel H, Haeney M, Misbah S, Snowden N (2004). Maladies
thyroïdiennes, auto-immunité. In Immunologie clinique : de
la théorie à la pratique avec Cas clinique pp 98-110,
276-277. Traduction et mise à jour de la 4e
édition anglaise, De Boeck, Belgique.
- Cornet M sous la direction de Tavernier R, Lizeaux C (2009).
Fonction de quelques glandes endocrine, La thyroïde. In :
Biologie 5e manuel : science générale page
130, 1re édition, De Boeck, Belgique.
- DeFranco A.L, Robertson M, Locksley R.M (2009).
Tolérance et auto-immunité. In : Immunité: La
réponse immunitaire dans les maladies infectieuses page 289, De
Boeck, Belgique.
- Eyquem A, Alouf J, Montagnier L (2000). In :
Traité de microbiologie clinique: deuxièmes mises à
jour et compléments, Piccin, Italie.
- Fudenberg H.H, Stites D.P, Caldwell J.L et Welles J.V
(1986). In : immunologie fondamentale et clinique, Piccin.
- Gilberg
S,
Partouche
H,
Barthe
J
(2011). In : Cas cliniques en médecine
générale, 2e édition, Lavosier.
- Gorochov G et Papo T (2000) Thyroïdites et maladie
de Basedow. In : Immunologie pp 222-226. Doin groupe
Liaisons Sa.
- Guilloux L, Bienvenu J, Kaiserlian D, Nicolas J-f (2006).
In : Allergie aux médicaments : Tests
immuno-biologiques, John Libbey Eurotext.
- Gurnell M (2009). chapitre 2 In : Endocrinologie,
Préface du Dr.Thierry Weitten page 98, De Boeck, Belgique.
- Hachulla É, Hatron P-Y (2006). Auto-immunité
In : Détecter les maladies systémiques auto-immunes page
4, Elsevier Masson.
- Hennen G (2001). La glande thyroïde. In :
Endocrinologie préface du Philipe Bouchard page 236,
1e édition, De Boeck, Espagne.
- Henry M.M., Thompson J.N, Dhem A (2004). La glande
thyroïde In : Chirurgie clinique: Technique et
pratique page 504. Traduction de la 1er édition
anglaise. De boeck, Belgique.
- Janeway C.A, Travers P (2003). In immunobiologie : Le
système immunitaire fondamental et pathologique Page : 509,
2e édition française, Traduction de la 5e
édition américaine, De Boeck, Espagne.
- Karp G (2010). Maladies auto-immunes. In : biologie
cellulaire et moléculaire : concepts and experiments page 725,
3e édition, De Boeck, Belgique.
- Kierszenbaum L.A (2006). Système immunitaire.
In : Histologie et biologie cellulaire, une introduction à
l'anatomie pathologique page 268, Traduction de la 1er
édition américaine, De Boeck, Espagne.
- Kubab N et Kubab S.A (2011). Fiche 45, anticorps antis
récepteurs de la TSH. In : ABC des examens biologiques,
Wolters Kluwer France.
- Mallard B (2010). Hyperthyroïdie In :
Endocrinologie, principaux processus page 38-41, Estem.
- Maunand B (2002). Hyperthyroïdie In :
Endocrino: l'infirmière en endocrinologie page 94,
3e édition, Groupe Liaisons Sa.
- Molinier
A
(2007). Partie 4 : Endocrinologie In : Pathologie
médicale et pratique infirmière: Tome 2 page 204,
Wolters Kluwer France.
- Nys P (2012). Hyperthyroïdie ou le dragster
emballé : trop d'hormone. In : Le régime IG
thyroïde page 38, édition LEDUC.s.
-
Parham P, Masson P.L (2003). Maladie auto-immune.
In : Le système immunitaire page 304, Traduction de
l'anglaise, De Boeck, Italie.
- Perlumuter G, Hernandez M.N, (2002). hypothyroïdie de
l'adulte. In : Endocrinologie, diabétologie et nutrition page
309, 4e édition, Estem.
- Renate L-R (2008). Glande thyroïde. In :
Histologie -1er cycles des études médicales- pp
450-453, De boeck, Belgique
- Rensberger B (1999). De l'autodéfense. In :
Au coeur de la vie, au royaume de la cellule vivante page 273, French
Edition, De Boeck,Belgique.
- Rouquette C (2002). Endicronologie. In :
Médecine, chirurgie et soins infirmiers page 181, Groupe
Liaisons Sa.
- Schaechter
M
, Medoff
G
, Eisenstein
B.I
(1999). Spécificité, distinction entre « SOI et
« NON SOI ». In : Microbiologie et pathologie
infectieuse, Traduction et adaptation de la 2e édition
américaine, De Boeck, France.
- Sherwood L, Molotchnikoff S (2006). Maladies immunitaires.
In : Physiologie humaine : A human perspective page 352,
2e édition, De Boeck, Espagne.
- Stanley M, Beare P.G, (2005).
Hyperthyroïdie. In : Soins infirmiers en gériatrie:
Vieillissement normal et pathologique pp 204-206. Traduction de la
2e édition americaine, De Boeck, Belgique.
- Vigreux C.P.D (2009). Dysendocrinies thyroïdiennes
et pancréatiques auto-immunes du chien et du chat :
Intérêts en pathologie comparée - Mise au point
bibliographique. Thèse de doctorat non publiée, Ecole
Nationale Vétérinaire De Toulouse, Université
Paul-Sabatier, Toulouse.
- Weill B, Batteux F (2003). Maladie auto-immune. In :
immunopathologie et réaction inflammatoires page 66.
1er édition, De Boeck, Belgique.
- Wémeau J-l (2011). Généralité,
anatomie, histologie. In : Les maladies de la thyroïde.
Version électroniques, Elsevier Masson.
Page web:
http://titan.medhyg.ch/mh/formation/article.php3?sid=32218
| 


