Ministère des Enseignements Secondaire et
Supérieur
----------
----------
Ministère de la Santé
Secrétariat Général
Université Polytechnique de Bobo
Dioulasso
Institut des Sciences de la Nature et de la
Vie
----------
----------
----------
Laboratoire National de Santé
Publique
Génie Biologique : option Agro
alimentaire


MEMOIRE DE FIN DE CYCLE
Pour l'obtention de la
Licence professionnelle en Génie
Biologique
Option : Agroalimentaire
THEME :
Effets du temps et de la température de
cuisson sur la formation de l'acrylamide dans les frites de banane plantain
mûre
SOUTENUE PAR
Djakaridja SAWADOGO
sawadogodjakaridja@yahoo.fr
JURY Maître de
stage
Président. Dr Younoussa
MILLOGO M. Karim KOUDOUGOU
Membres. M.Karim KOUDOUGOU
Dr.Julliette TRANCHOT/DIALLO
Directrice de Mémoire
Dr. Juliette TRANCHOT/ DIALLO
DEDICACES
Je dédie ce document :
ü A ma mère Bintou GUIGUENDE et à la
mémoire de mon père Boureima SAWADOGO.
ü A mon tuteur Mahamadi OUEDRAOGO à
Bobo-Dioulasso.
ü A tous mes frères, soeurs, amis, connaissances
et camarades de classe
REMERCIEMENTS
Plusieurs personnes n'ont ménagé aucun effort
pour la réussite du stage et la réalisation de ce document. C'est
le lieu donc de leur exprimer notre gratitude pour leur sympathie et leur
dévouement. Nos remerciements s'adressent à :
ü Monsieur Daouda TRAORE, Directeur Général
du Laboratoire national de santé publique (LNSP).
ü Dr. Juliette Tranchot Diallo, responsable de la
filière génie biologie à l'institut des sciences de la
nature et de la vie(ISNV) de l'Université polytechnique de
Bobo-Dioulasso (UPB), notre Directrice de mémoire
ü Docteur Younoussa MILLOGO, Directeur adjoint de l'ISNV,
notre Président du jury.
ü Monsieur Karim KOUDOUGOU, Directeur du contrôle
des aliments et de la nutrition appliquée du LNSP, notre maître de
Stage.
ü Monsieur Ouiné POUAN Chef de Service de
physico-chimie alimentaire (SPCA).
ü Monsieur Eloi Bakary SANOU, Chef du Service de
toxicologie alimentaire (STA) et toute son équipe.
ü Madame YOUGBARE, chef de service microbiologie(SM) et
toute son équipe.
ü Monsieur Wendkuni Florentin COMPAORE, notre encadreur
sur la paillasse.
ü Monsieur Al Ibrahim TRAORE, Dramane TRAORE qui ont
accepté nous accompagner au cours de notre stage et de partager avec
nous leurs connaissances et expériences professionnelles.
ü Tout le personnel de la Direction du contrôle des
aliments et de la nutrition appliquée (DCANA) pour leur collaboration.
ü L'UPB en général, et à
l'administration de l'ISNV en particulier, dont le souci est la bonne formation
de ses étudiants.
ü Toute personne qui de près ou de loin a
contribué à la bonne marche du stage et à la
réalisation de ce document.
AVANT PROPOS
L'Université Polytechnique de Bobo-Dioulasso (UPB) a
ouvert officiellement ses portes en 1995.
Elle a pour vocation d'assurer la formation initiale des
jeunes cadres qui auront pour mission de mettre leurs compétences au
service des entreprises de la place. Et assure la formation continue des
professionnels afin d'améliorer leur prestation.
En effet, l'UPB regroupe en son sein :
- une école supérieure : l'Ecole
Supérieure d'Informatique (ESI)
- cinq (05) instituts :
Ø l'Institut Universitaire de Technologie
(IUT) ;
Ø l'Institut des Sciences de la Santé
(INSSA) ;
Ø l'Institut de Développement Rural (IDR) ;
Ø l'Institut des Sciences Exactes et Appliquées
(ISEA)
Ø l'Institut des Sciences de la Nature et de la Vie
(ISNV)
Ce dernier dont nous sommes issus, comporte deux
filières de formation :
- la filière D.E.U.G-Agronomique,
- et la filière Génie Biologique
Les étudiants inscrits en D.E.U.G-Agronomique sortent
avec un Diplôme d'Étude Universitaire Général,
après deux (02) ans, et peuvent continuer à l'IDR ou à
l'Université de Ouagadougou. Quant à la filière
Génie Biologique, elle est une filière de formation
professionnalisante, qui délivre pour le moment une licence
professionnelle, après trois (03) ans de formation. La branche comporte
trois options : analyse biomédicale, nutrition
diététique et agroalimentaire.
La formation professionnelle ne saurait être de bonne
qualité que si elle intègre surtout la pratique. Pour cela
l'Administration de l'ISNV a jugé bon d'instaurer six (06) mois de stage
à l'intention des étudiants de la 3ème année
Génie Biologique. C'est ainsi que nous avons été
reçu par le Laboratoire national de santé publique (LNSP) /
OUAGADOUGOU notamment à la Direction du contrôle des Aliments et
de la nutrition appliquée (DCANA) au Service physico-chimie alimentaire
(SPCA).
SOMMAIRE
SOMMAIRE
B
LISTES DES TABLEAUX
10
LISTES DES FIGURES
10
RESUME............................................................................................................................
I. PRESENTATION ET
ORGANISATION DU LNSP
4
I.1. Historique et
Forme juridique
4
I.2. Organisation
du LNSP
4
CHAPITRE I : SYNTHESE
BIBLIOGRAPHIQUE
7
I. DESCRIPTION DE
LA BANANE PLANTAIN
7
II. REACTION DE
MAILLARD
8
III. DESCRIPTION DE
L'ACRYLAMIDE
9
V.1. Propriétés physiques et
chimiques de l'acrylamide
9
V.2. MECANISME DE FORMATION DE
L'ACRYLAMIDE
11
V.3. PROPRIETES TOXICOLOGIQUE DE
L'ACRYLAMIDE.
13
IV. LA
CHROMATOGRAPHIE
13
VI.1. Définition
13
VI.2. Principe
14
VI.3. Le Détecteur
15
CHAPITRE II : MATERIELS ET
METHODES
19
I. SITE DE
L'ETUDE
19
II. MATERIEL
BIOLOGIQUE (Echantillonnage et échantillons)
19
II.1. Huile
19
II.2. La Banane plantain mûre
19
III. MATERIEL DE
LABORATOIRE
19
III. 1. La chaine chromatographique
19
III. 2. Appareillage et verreries
20
III. 3. Solvants et réactifs
21
IV. METHODES
22
IV.1. Analyse de la qualité de
l'huile de friture
22
IV.1.1. Indice d'acide
22
IV.1.2. Indice de peroxyde
23
IV.2. Analyse de la teneur en sucres
réducteurs dans la banane plantain mûre
24
IV.3. Friture de la banane
28
IV.4. Dosage de l'acrylamide
28
CHAPITRE III : RESULTATS ET
DISCUSSIONS
32
I. RESULTATS
32
I.1. Résultats du contrôle de
qualité de l'huile
32
I.2. Résultats d'analyse des sucres
de la banane
32
I.3. Frites de bananes plantain mûres
`'alloco''
32
I.4. Courbe de calibration
33
I.5. Teneur en Acrylamide des frites de
banane plantain mûre en fonction du Temps et de la Température de
cuisson
36
II. DISCUSSION
36
II.1. Contrôle de qualité de
l'huile de friture
36
II.2. Teneur en sucres réducteurs de
la banane plantain mûre
37
II.3. Teneur en acrylamide dans les frites
de banane plantain mûre `'alloco''.
38
CONCLUSION
40
REFERENCES
41
LISTES DES TABLEAUX
Tableau 1:
Propriétés physiques et chimiques de l'acrylamide
2
Tableau 2: Guide de
prélèvement d'échantillon pour analyse de sucres
réducteurs
25
Tableau 3: Teneur en sucre
inverti
27
Tableau 4:
Paramètres analysés de l'huile de friture
32
Tableau 6: Teneur en
Acrylamide des échantillons
36
LISTES DES FIGURES
Figure
1: Diagramme de transformation traditionnelle de la banane
plantain par friture
2
Figure
2: Formation de l'acrylamide à partir de l'asparagine
dans les aliments chauffés (GRANVOGL et al, 2004)
12
Figure 3: Deux voies
possibles de formation d'acrylamide (BECALSKI et al, 2002)
13
Figure 4: Schéma
descriptif du chromatographe HPLC (Académie de rouan, 2001)
15
Figure 5: Echantillons
frits de la banane plantain mûre à différentes
températures
33
Figure 6 : Courbe de
calibration.......................................................................34
Figure 7 : Chromatogramme d'un standard
de 0ug/mL...........................................35
Figure8: Chromatogramme d'un standard de
2ug/mL............................................35
Figure 9: Chromatogramme d'un standard de
6ug/mL...........................................35
Figure 10: Chromatogramme de
l'échantillon E5 contenant de l'Acrylamide..................35
Figure 11 : Variation de la teneur en
acrylamide en fonction du couple
temps/température........................................................................................36
RESUME
Les frites de bananes plantains mûres à l'exemple
des frites de la pomme de terre et de la patate douce, sont des plats de plus
en plus aimés par les consommateurs de nos jours.
Ces frites de bananes plantain sont obtenus par la friture de
la banane plantain mûres du nom botanique musa paradisiaca appartenant
à la famille des musacées généralement
cultivées dans les pays côtiers. Elles constituent l'une des
principales ressources alimentaires dans le monde. L'objectif de cette
étude est de maîtriser l'effet du temps et de la
température de cuisson sur la formation de l'acrylamide dans ces frites.
Afin d'aboutir à cet objectif que nous nous sommes fixés, nous
avions fait la friture de bananes plantains mûres
découpées en morceaux, ces bananes ont étés
achetées sur le marché ouagalais et ensuite faire l'analyse au
HPLC au sein du laboratoire. Pour que cette étude soit effective et
cohérente, nous avions utilisé du matériel tel que la
sonde de température (0-220°C) pour le contrôle de la
température, une plaque chauffante, un cristallisoir dans lequel on a
effectué la friture et quelques ustensiles de cuisine (assiette, louche,
fourchette, couteaux) et un chronomètre pour la prise du temps.
L'ensemble de tout ce matériel nous a permit de bien suivre le temps, la
température et la cuisson de nos échantillons de frites.
Le procédé consistait à mettre le
cristallisoir sur une plaque chauffante dont nous réglons la
température, ensuite introduire des morceaux de banane plantain
mûres découpées en même forme et taille. Avant tout
nous maintenons la sonde dans l'huile chaude pour mieux suivre la
température et parallèlement le chronomètre est
allumé dès la mise des morceaux de bananes dans l'huile
chaude.
Ces échantillons sont ensuite broyés et soumis
à la centrifugation d'ou le surnageant est ensuite recueillir et
injecter au HPLC. Il est vrai que nous remarquons une baisse de la
température à chaque mise des morceaux dans l'huile à
cause de leur humidité, mais nous jouons sur le réglage de la
température de telle sorte à maintenir la fourchette de
température souhaitée.
La détermination de la teneur en acrylamide contenue
dans nos frites par HPLC a révélé que la teneur variait en
fonction du temps et de la température de cuisson. Ainsi, pour des
température allant de 120 à 160°C, nous n'avions rien
obtenu comme acrylamide dans nos échantillons tendis que à la
fourchette de température allant de 160 à 170°C, on a obtenu
une teneur en acrylamide de l'ordre de 5,47 microgramme par kilogramme
INTRODUCTION
De nos jours, le problème de la qualité des
aliments préoccupe plus d'une personne. Les consommateurs de nos jours
deviennent de plus en plus exigeants. Ils sont nombreux aujourd'hui
ceux-là qui sont informés sur la qualité sanitaire,
nutritionnelle et à la variabilité de leur alimentation.
Pour cela, les autorités compétentes en
collaboration avec certaines commissions internationales mettent en oeuvre des
normes de qualité visant à la protection des consommateurs. Pour
atteindre leur objectif, les autorités compétentes font des
contrôles réguliers à travers certaines institutions
nationales telles que les laboratoires d'analyse et les structures de
normalisation en élaborant des réglementations.
Mais, il faut noter que certains problèmes de
qualité sanitaire de nos aliments sont liés à nos
pratiques de transformation et cela existaient depuis les temps anciens.
En effet, la plupart des consommateurs ont l'habitude
d'utiliser la texture et la coloration pour juger la cuisson de certains
aliments ou de leur attribuer une qualité nutritionnelle.
Pourtant, cette manière de juger la cuisson des
aliments n'est pas dans son ensemble avantageux pour la santé des
consommateurs. C'est pourquoi, il est nécessaire d'effectuer plusieurs
suivis au cours des procédés de transformation tant au niveau
industriel qu'au niveau artisanal.
Ainsi, certains procédés de transformation tels
que les cuissons à sec (friture, séchage au four, cuisson au
four) sont responsables de la réaction de Maillard ou brunissement non
enzymatique (BNE).
C'est une réaction généralement
souhaitée par plusieurs consommateurs du fait qu'elle confère
à l'aliment une odeur, une saveur et une couleur caractéristique
du produit d'où une amélioration du goût (PERROTIN,
2004).
Cependant, des recherches récentes de la Swedish
National Food Administration (SNFA) ont montré que la réaction de
Maillard génère des produits toxiques appelés
composés néoformés à partir des
températures supérieures à 120°C. C'est de là
que vient la découverte de l'acrylamide par des chercheurs
Suédois en Avril 2002. Un cancérigène dans les frites de
pommes de terre, les chips de bananes, les biscuits et les farines de
céréales (FAO/OMS). Des études ont montré
également que la formation de l'acrylamide est beaucoup
influencée par la corrélation entre un acide aminé
(l'asparagine) et un sucre réducteur (le glucose) à des fortes
températures (SNFA). Dès lors, nous pouvons
supposer que tout aliment contenant des protéines et des sucres
après une cuisson à sec dans des hautes températures est
susceptible de renfermer un taux d'acrylamide.
Pendant tout le long de notre stage au LNSP nous tenterons
d'élucider ces propos suscités en effectuant une étude sur
l'effet du temps et de la température de cuisson sur la formation de
l'acrylamide dans les frites de bananes plantain mûre communément
appelé `'aloco''.
PRESENTATION DE LA STRUCTURE D'ACCEUIL
PRESENTATION ET ORGANISATION
DU LNSP
I.1.
Historique et Forme juridique
Le laboratoire national de santé publique(LNSP) a
été créé par décret n°99-377/PRES/PM/MS
du 28 octobre 1999. Il a pour objet de servir de laboratoire central de
référence pour les analyses, contrôles et expertises de
toute nature relatives à la biologie médicale, l'alimentation, la
nutrition, la pharmacie, l'eau, l'environnement et tout autre domaine en
rapport avec la santé publique et la sécurité sanitaire.
Le LNSP est placé sous la tutelle technique du ministère de la
santé et la tutelle financière du ministère chargé
des finances.
I.2. Organisation du LNSP
Le LNSP dispose de :
Directions centrales :
- La Direction Générale
- La Direction de la biologie médicale (D.B.M.)
- La Direction de la toxicologie, du contrôle de
l'environnement et de l'hygiène publique (D.T.C.E / H.P)
- La Direction du contrôle des aliments et de la
nutrition appliquée (D.C.A.N.A.)
- La Direction du contrôle des médicaments et des
produits non - alimentaires (D.C.M / P.N.A)
- La Direction de la coordination technique et de l'assurance
qualité (D.C.T.A.Q)
Directions régionales de Ouagadougou et de Bobo
Dioulasso
Notre stage a été effectué au Service de
physico-chimie alimentaire (SPCA) qui est l'un des quatre services de la
Direction du contrôle des aliments et de la nutrition appliquée
(DCANA). En matière d'analyse, le champ d'activités du service
s'étend pour l'instant aux domaines suivants :
o Corps gras d'origines animale et végétale,
o Céréales, légumineuses,
oléagineux et leurs dérivés,
o Boissons, vinaigre, sucre, produits de confisseries.
Le système qualité du LNSP a pour
référentiel la norme ISO CEI 17025 2005.
CHAPITRE I :
SYNTHESE BIBLIOGRAPHIQUE
CHAPITRE I : SYNTHESE
BIBLIOGRAPHIQUE
I. DESCRIPTION DE LA BANANE PLANTAIN
Les bananes plantains (musa paradisiaca) constituent
l'une des principales ressources alimentaires dans le monde. Elles
appartiennent à la famille des musacées. Elles sont
également classées dans la catégorie des produits amylacés. Leur culture est effectuée par
implantation d'un rejet de bananier sous la terre et par la suite on a un
bourgeonnement. Les bananes plantains (musa paradisiaca) peuvent
être consommées en tant que bouillie de banane comme certains
tubercules. Aussi, elles peuvent être consommées en tant que fruit
quand elles sont mûres car la banane lors de sa maturation a presque 80%
de son amidon qui se transforme en sucres grâce à
l'activité des enzymes.
Leurs cultures occupent le 4ème rang mondial des plus
importantes denrées alimentaires après le riz, le blé et
le lait (INIBAP, 2002 ; FAO,
2002). Ainsi, elles jouent un rôle socio-économique
important pour les pays en voie de développement des zones
tropicales et subtropicales, notamment dans les pays d'Afrique de l'Est, du
Centre et de l'Ouest, du Sud-Est Asiatique, de l'Amérique Centrale et du
Sud et des Caraïbes (Frison et al,
1998). La production mondiale avoisine 106 millions de tonnes par an
pour une superficie cultivée de 10 millions d'ha (FAO,
2004), dont 14 % sont destinés à l'exportation, le reste
étant consacré à la consommation locale ou à la
transformation industrielle (Lescot, 1999).
L'Afrique sub-saharienne fournit plus du tiers de la
production mondiale de bananes et de bananes plantains, avec près de 7
millions de tonnes provenant de l'Afrique de l'Ouest et du Centre. Elle
contribue pour environ 70 % à la disponibilité
synergétique alimentaire fournie par les plantains et les autres bananes
à cuire dans le monde. En Afrique, les principaux producteurs sont
l'Ouganda et le Cameroun (FAO, 2004). Dans ce dernier
pays, la production de bananes et plantains représente la
deuxième source économique agricole du pays après le bois
(Bioéthanol. Argon. Soc. Environ. 2008
(1), 89-98). En matière d'alimentation, la banane
plantain mûre nous offre la possibilité d'obtention des plats
frits suivants :
Figure 1:
Diagramme de transformation traditionnelle de la banane plantain par friture
Banane
Mûre
Broyage
Friture
Friture
Claclo
Alloco

II. REACTION DE
MAILLARD
Depuis la maîtrise du feu, il y à 500 000 ans, la
consommation des aliments s'est considérablement diversifiée. De
plus, cela a permis à l'homme de découvrir de nouvelles saveurs
révélant ainsi le début de la gastronomie. Cependant, le
traitement thermique des aliments génère facilement un
brunissement. Trois types de brunissements ont été décrits
dans l'aliment. Tout d'abord, nous pouvons citer :
- le brunissement enzymatique qui est une réaction
d'oxydation catalysée par une enzyme.
- la caramélisation qui a lieu lorsque l'on chauffe
à haute température des sucres réducteurs en l'absence de
composés aminés.
- enfin, le plus répandu est issu d'une réaction
entre une amine et un composé carbonylé, autrement dit la
réaction de Maillard. La réaction de caramélisation se
développe dans des aliments dont la surface est fortement
chauffée. Les produits de caramélisation sont alors
retrouvés dans des denrées alimentaires comme le pain, la viande
grillée, ou les aliments riches en sucres tels que certains jus de
fruits.
Réaction de Caramélisation =
Sucres simples + Eau + Chaleur.
Réaction de Maillard = Sucres simples
+ Acides aminés + Eau + Chaleur
C'est en 1912 que Louis Camille Maillard, chimiste
français, a découvert que la réaction à haute
température entre des sucres réducteurs et des acides
aminés conduit au développement d'une coloration brune. La
réaction est principalement dépendante du temps de traitement
thermique, de la température, du pH, de l'activité de l'eau et de
la composition des aliments (concentration des substrats de la
réaction).
La réaction de Maillard se décompose en quatre
étapes. Une première étape (étape initiale) met en
jeu un acide aminé et un sucre réducteur (aldose ou
cétose) pour former le produit d'Amadori (cétosamine) ou de Heyns
(aldosamine). La seconde étape (étape de propagation) conduit
à la formation de petites molécules dicarbonylées et de
réductones respectivement par scission ou par déshydratation
modérée du produit d'Amadori ou de Heyns. L'étape suivante
de la réaction de Maillard (étape avancée) conduit
à la formation de divers composés aromatiques et
d'aldéhydes de Strecker. Cette étape donne aussi lieu à la
formation de furfurals comme le 5-hydroxyméthylfurfural (HMF) par
déshydratation forte du produit d'Amadori ou de Heyns, ainsi que
d'autres produits avancés de la réaction de Maillard, en anglais
Advanced Glycation End products (AGEs) tels que la carboxyméthyllysine
(CML) ou la pyrraline. Enfin, la dernière étape conduit à
la formation de polymères bruns : les mélanoïdines.
Mais l'apparition de composés néoformés
(CNF) issus principalement de la réaction de Maillard pose aujourd'hui
la question du contrôle de la qualité sanitaire des aliments
transformés. L'acrylamide est un exemple de CNF
détecté très récemment dans diverses denrées
alimentaires (SNFA, Avril 2002).
III. DESCRIPTION DE L'ACRYLAMIDE
V.1. Propriétés physiques et chimiques de
l'acrylamide
Ce monomère de poids moléculaire de 71,08 Dalton
se présente sous une forme cristalline, blanche. Il est soluble dans
l'eau, l'éthanol, le méthanol, l'oxyde diméthyle et
l'acétone. Il polymérise facilement en atteignant le point de
fusion ou à l'exposition à la lumière UV (PISSCH,1996).
L'acrylamide solide est stable à la température ambiante, mais
peut polymériser violemment lorsqu'il est mélangé ou
exposé à des agents oxydants L'acrylamide (2-Propène
amide, Acrylamide monomer, Acrylic acide amide, Acrylique amide, Bio-Acrylamide
50, Ethylenecarboxamide, Propenamide, Vinyle amide) est employé
principalement dans la production de divers polyacrylamides de masse
moléculaire élevée qui conviennent à un large
éventail d'applications industrielles.
De grandes quantités de polyacrylamides sont
utilisées comme floculateurs dans le traitement de l'eau potable et des
eaux d'égout; le traitement des pâtes à papiers;
l'exploitation minière et le traitement du minerai; la
récupération assistée des hydrocarbures et le forage des
puits de pétrole; la stabilisation du sol; la production du
béton. De plus petites quantités servent
d'épaississants dans les savons et les préparations
cosmétiques, les émulsions photographiques et les gels
d'électrophorèse; de produit d'encollage et de produit
imperméabilisant dans la transformation des textiles; de liant dans la
fabrication des adhésifs. En petites quantités, il est
employé comme clarifiant de jus de betterave à sucre.
L'acrylamide est aussi un composant de la fumée du tabac
(www.wikipedia.org /Acrilamide consulté le 12 juillet
2010).
Tableau 1:
propriétés physiques et chimiques de l'acrylamide
|
ACRYLAMIDE
|
|
|
|
GENERAL
|
|
Nom
IUPAC
|
2-propénamide
|
|
Apparence
|
Cristaux blancs
solution limpide incolore
|
|
PROPRIETES CHIMIQUES
|
|
Formule brute
|
C3
H5
N
O
|
|
Masse
molaire
|
71,0779 #177; 0,0033
g·
mol?
C 50,69 %,
H 7,09 %, N 19,71 %, O 22,51 %,
|
|
PROPRIETES
PHYSIQUES
|
|
T°
fusion
|
84,5 °C
|
|
T°
ébullition
|
192,6 °C.
125 °C à 25 mmHg
|
|
Solubilité
|
dans l'eau à 25 °C :
2 040 g·l
|
|
Masse
volumique
|
1,13 g·cm3
2.45 par rapport à
l'air
|
|
'
T°
d'auto-inflammation
|
424 °C
|
(Acrylamide- wikipedia).
V.2. MECANISME DE FORMATION DE L'ACRYLAMIDE
L'annonce de la présence d'acrylamide dans les produits
d'alimentation humaine a été suivie rapidement de recherches sur
les mécanismes de formation de l'acrylamide. Plusieurs mécanismes
théoriques ont été proposés, y compris les voies
à partir des acides aminés seulement, des intermédiaires
de l'acroléine, des intermédiaires de l'acide acrylique et des
précurseurs du brunissement de Maillard. Les études actuelles
montrent que dans les aliments, l'acrylamide se forme principalement dans des
réactions induites à haute température entre le groupement
amine de l'acide aminé libre, l'asparagine, et le groupement carbonyle
de sucres réducteurs, tels que le glucose, pendant la cuisson au four ou
la friture
L'influence du couple temps/température sur la
formation d'acrylamide a surtout été étudiée dans
la pomme de terre.
Les températures de 120 à 230°C ont
été testées et il apparaît qu'une température
minimale de 120°C est nécessaire pour la formation d'acrylamide.
Les résultats montrent que la quantité d'acrylamide est nettement
plus influencée par le temps de chauffage à une certaine
température que par la température elle-même. L'asparagine
fait encore l'objet de nombreuses études. Elle est ainsi devenue le
premier exemple d'acide aminé libre impliqué dans la
qualité sanitaire des aliments chauffés qui en sont riches. Sur
la (figure 2) est représenté le schéma de
formation de l'acrylamide à partir de l'asparagine libre proposé
par GRANVOGL et al, 2004. Après
décarboxylation de l'imine, deux principales voies de synthèse de
l'acrylamide sont probables. L'imine décarboxylée peut se
décomposer directement en acrylamide par élimination de l'imine
(voie 1) ou bien s'hydrolyser pour former le 3-
aminopropionamide (voie 2). Après élimination
d'ammoniac, ce dernier forme l'acrylamide. Cependant, l'acrylamide peut aussi
être formé à partir d'autres constituants de la matrice
comme nous l'avons vu avec le 3-aminopropionamide, ou à partir
d'acroléine et de composés azotés (figure
3)
En effet, plusieurs études ont montré que
l'ammoniac pouvait être à l'origine d'une partie de l'acrylamide
formé dans les aliments au cours de la cuisson.
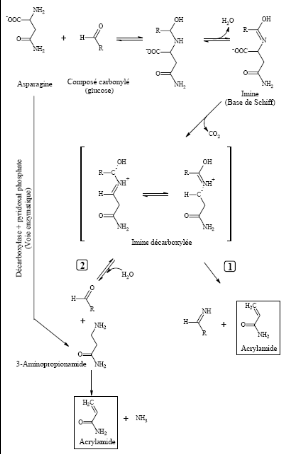
Figure 2:
Formation de l'acrylamide à partir de l'asparagine dans les aliments
chauffés (Zyzak et Coll.)
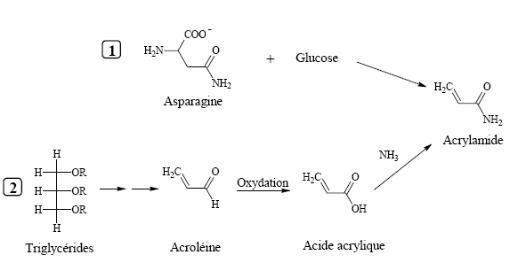
Figure 3:
Deux voies possibles de formation d'acrylamide (BECALSKI et al, 2002)
V.3. PROPRIETES TOXICOLOGIQUE DE L'ACRYLAMIDE.
La toxicité de ce composé est un nouveau sujet
de préoccupation. Cette molécule est classée par le Centre
International de Recherche contre le Cancer (le CIRC, en anglais IARC)
et l'agence de protection de l'environnement des Etats Unis (United
States Environnemental Protection Agency USEPA) comme
étant probablement cancérigène pour l'homme. Ils concluent
que l'exposition devrait être réduite au niveau le plus bas qu'on
puisse raisonnablement atteindre soit 0,2 ug/l par
jour. Des études sur les rongeurs (les rats, les
souris) sur les boeufs sur les
porcs, et sur l'exposition professionnelle ont montré que l'acrylamide
diminue la fertilité masculine, et neurotoxique, et
présente des effets neuropathologies. L'acrylamide induit des
aberrations chromosomiques, des micronucléus, des échanges de
chromatides soeurs (ECS), la polyploïdie, l'aneuploïdie et d'autres
troubles mitotiques (par exemple mitose-C) dans les cellules de
mammifères en l'absence d'activation métabolique (MUCCI,
2003).
IV. LA
CHROMATOGRAPHIE
VI.1. Définition
La chromatographie est une technique d'analyse qualitative et
quantitative de la chimie analytique dans laquelle l'échantillon
contenant une ou plusieurs espèces est entraîné par un
courant de phase mobile (liquide, gaz ou fluide supercritique) le long d'une
phase stationnaire (papier, gélatine, silice, polymère, silice
greffée etc.). Chaque espèce se déplace à une
vitesse propre dépendant de ses caractéristiques et de celles des
deux phases. (MAHUZIER et HAMON, 1990).
VI.2. Principe
La chromatographie est une méthode de séparation
des constituants d'un mélange même très complexe. Il existe
trois principaux types de chromatographie:
· la chromatographie en phase gazeuse (CPG)
· la chromatographie en phase liquide à haute
performance (HPLC)
· la chromatographie en couche mince (CCM).
Les deux premières méthodes peuvent être
assez largement décrites par des théories communes. Dans les deux
cas, un fluide appelé phase mobile parcourt un tube appelé
colonne. Cette colonne peut contenir des "granulés" poreux (colonne
remplie) ou être recouverte à l'intérieur d'un film mince
(colonne capillaire). Dans les deux cas, la colonne est appelée phase
stationnaire. A l'instant initial, le mélange à séparer
est injecté à l'entrée de la colonne où il se dilue
dans la phase mobile qui l'entraîne à travers la colonne.
Si la phase stationnaire a été bien choisie, les
constituants du mélange, appelés généralement les
solutés, sont inégalement retenus lors de la traversée de
la colonne (Université de Nancy-Metz, 9 juin 2010).
De ce phénomène appelé rétention
il résulte que les constituants du mélange injecté se
déplacent tous moins vite que la phase mobile et que leurs vitesses de
déplacement sont différentes. Ils sont ainsi élués
de la colonne les uns après les autres et donc séparés.
Un détecteur placé à la sortie de la
colonne couplé à un enregistreur permet d'obtenir un tracé
appelé chromatogramme. En effet, il dirige sur un enregistreur un signal
constant appelé ligne de base en présence du fluide porteur seul
; au passage de chaque soluté séparé il conduit dans le
temps à l'enregistrement d'un pic.
Notons qu'il existe plusieurs types de détecteurs
(BELLO-PE'REZ et al, 1998) :
ü Détecteur à absorption UV ou visible
ü Détecteur à indice de
réfraction
ü Détecteur UV à barrette de diodes
(DAD)
ü Détecteur à fluorescence
ü Détecteur de type spectromètre de masse
(MS)
ü Détecteur évaporatif à diffusion
de la lumière (DEDL)
ü Détecteur électrochimique (DEC).
ü Dans des conditions chromatographiques données,
le "temps de rétention" (temps au bout duquel un composé est
élué de la colonne et détecté), caractérise
qualitativement une substance. L'amplitude de ces pics, ou encore l'aire
limitée par ces pics et la prolongation de la ligne de base permet de
mesurer la concentration de chaque soluté dans le mélange
injecté. (Académie de rouan, 2001)
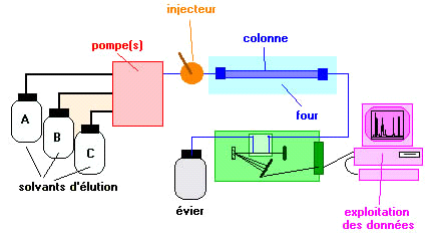
Figure 4:
Schéma descriptif du chromatographe HPLC ( Académie de rouan,
2001)-
VI.3. Le Détecteur
Le détecteur suit en continu l'apparition des
solutés. Il existe plusieurs détecteurs :
réfractomètre différentiel, UV à barrette de
diodes, électrochimique, fluorimétrique...
Ainsi que différents types de couplage :
Spectrométrie infrarouge, Spectrométrie de masse,
Résonance Magnétique Nucléaire.
CHAPITRE II :
MATERIELS ET METHODES
CHAPITRE II :
MATERIELS ET METHODES
I. SITE DE L'ETUDE
L'étude a été réalisée
à Ouagadougou, la capitale politique du Burkina Faso durant les mois
d'avril à octobre 2010. Les zones concernées par
l'échantillonnage sont les secteurs quinze (15) et trente (30).
II. MATERIEL
BIOLOGIQUE (Echantillonnage et échantillons)
II.1. Huile
L'huile utilisée pour la friture des bananes plantains
est une huile de graines de coton raffinée et produite au Burkina Faso.
Il est indiqué sur l'emballage que cette huile est
réservée pour les fritures et les assaisonnements. La date de
fabrication indiquée est le 2ème trimestre 2009 et la
date de péremption fin décembre 2011.
II.2. La Banane plantain mûre
Les bananes plantains utilisées pour l'étude
sont celles rencontrées sur le marché local, apportées des
pays côtiers, plus particulièrement les pays voisins. Toutes les
bananes utilisées pour la friture sont mûres. Après friture
les échantillons sont broyés et analysés.
III. MATERIEL DE LABORATOIRE
III. 1. La chaine chromatographique
Le Chromatographe en phase liquide haute performance (HPLC) de
marque Agilent, modèle 1100, comprenant :
ü Dégazeur de marque Agilent, modèle
1100 ;
ü Pompe quaternaire de marque Agilent, modèle
1100 ;
ü Échantillonneur automatique de marque Agilent,
modèle 1100, capable d'injecter 25 microlitre ;
ü Une colonne analytique SB-C18, 2,1 x 250 mm, dp 5
micromètre (ìm), (n° de pièce 77505-252130 de
Agilent); 150 mm × 4,0 mm Di, particules de 5 ìm ;
ü Un chauffe-colonne capable de maintenir une
température de 28,0 #177;1,0°C ;
ü Détecteur UV de marque Agilent, modèle
1100 ;
ü Un système informatisé de contrôle
du LC et de traitement des données (Chemstation)
III. 2. Appareillage et verreries
ü Plaque chauffante
ü Sonde de température (0-220°C) de marque
HANNA modèle HI 125
ü Chronomètre
ü Cristallisoir
ü Erlenmeyers de 250 ml
ü Burettes
ü Agitateur magnétique
ü Hotte aspirante
ü Autres matériel de laboratoire
ü Broyeur (Analysesenmühle A 10, Janke & Kunkel,
IKA-Werk)
ü Balance analytique à quatre ou cinq
décimales (Mettler Toledo AL 54);
ü Vortex (TecnoKartell TK 3S)
ü Agitateur secoueur horizontal (Heidolph)
ü Centrifugeuse réfrigérée à
haute vitesse (Zentrifugen Mikro Hettigen 22R)
ü Centrifugeuse de laboratoire (Sigma, Type 2-16)
ü Collecteur à vide SPE doté d'un support
pour tubes; (Varian)
ü Cartouche d'extraction en phase solide en mode
échangeuse d'anions forts Varias BonElut SAX, 3 cc, 200 mg, (Varian)
ü Tube à centrifuger en polypropylène, 50
ml, non pyrogenic (Corning)
ü Dispositifs de pipetage à volume variable,
100-1000 ìl, (Eppendorf);
ü Fioles jaugées de classe A, 10 ml, 20 ml, 50 ml,
100 ml et 1000 ml (Schott Duran)
ü Dispositif de pipetage et embouts, 5-10 ml (Eppendorf
et Biohit);
ü Tubes CR 21 jetables
ü Tubes centrifugeuses de 1,5 ml (eppenforf)
ü Filtres à membranes autovials en PTFE Uniprep,
taille des pores de 0,45ìm, (Whatman) et 0,20 ìm.
ü Flacons en verre de 250 ml, 500 ml et de 1l (Schott
Duran)
ü Réfrigérateur (Whirpool).
ü PH-mètre de marque Metrohm modèle 780
ü Erlenmeyer ou ballon avec rodage de 300 ml
ü Réfrigérant à reflux avec manteau
d'env. 40 cm
ü Papier filtre
ü Fioles jaugées de classe A de 100 ml
ü Eprouvette de 25 ml
ü Verrerie courant de laboratoire
III. 3. Solvants et réactifs
ü Ethanol 95°- Ether diéthylique (V/V).
ü Solution de phénolphtaléine à 1%
dans l'éthanol 95°
ü Acrylamide (CH=CHCONH2) = 99 % (Merck)
ü Acetonitrile (CH3CN) de type HPLC 99,9%
(Sigma-Aldrich, USA)
ü Acide sulfurique (H2SO4), 96%
(Aldrich);
ü Méthanol (CH3OH) de type HPLC 99,9%
(Normapur, CE);
ü Hexacyanoferrate de potassium trihydraté
(K4Fe(CN)6-3H2O
ü Acétate de zinc déshydraté
Zn(CH3COO) 2-2H2O
ü Solution d'acide sulfurique 25%: elle a
été préparée en dissolvant 25 ml d'acide sulfurique
pur dans environ 100 ml d'eau ultrapure.
ü Solution carrez I. hexacyanoferrate de potassium : 30g
d'hexacyanoferrate de potassium sont pesés et dissout dans 200 ml d'eau
ultrapure.
ü Solution carrez II. 75 g d'acétate de Zinc sont
pesés et dissout dans 250 ml d'eau ultrapure.
ü Solution cupro-alcaline: dissoudre 25 g de sulfate de
cuivre (CuSO4 * 5 H2O) dans 100 ml d'eau, 50 g d'acide
citrique (C6H8O7 * 1 H2O) dans 50
ml d'eau et 388 g de carbonate de sodium cristallisé
(Na2CO3 * 10 H2O) dans 300 - 400 ml d'eau
tiède. Mélanger prudemment la solution d'acide citrique avec la
solution de carbonate de sodium (attention: effervescence!), puis ajouter la
solution de cuivre. Après refroidissement à la température
ambiante, transvaser la solution dans un ballon jaugé de 1 litre et
compléter jusqu'à la marque. Laisser reposer 24 heures, puis
filtrer la solution en recueillant le filtrat dans un flacon en verre brun
très propre. Une fois le flacon bouché, la solution se conserve
indéfiniment.
ü Iodure de potassium cristallisé
ü Acide sulfurique à 25 %
ü Solution titrée de thiosulfate de sodium 0,1 N
(0.1 mol/l)
ü Solution d'amidon: chauffer un mélange de 500 ml
de glycérol et de 500 ml d'eau jusqu'à env. 70 °C, ajouter
par petites portions 25 g d'amidon soluble (Merck n° 85650), continuer
à chauffer environ 90°C, puis refroidir. Cette solution est stable
pendant au moins 6 mois.
ü Solution de Carrez l: dissoudre dans de l'eau 150 g
d'hexacyanoferrate(II) de potassium (K4[Fe(CN)6] * 3 H2O),
transvaser la solution dans un ballon jaugé de 1 litre et
compléter jusqu'à la marque.
ü Solution de Carrez II: dissoudre dans de l'eau 300 g de
sulfate de zinc (ZnSO4 * 7 H2O), transvaser la solution
dans un ballon jaugé de 1 litre et compléter jusqu'à la
marque.
IV. METHODES
IV.1. Analyse de la qualité de
l'huile de friture
Nous avions effectué l'analyse de certains
paramètres de qualité de notre huile utilisée pour la
friture .Cette analyse a été réalisée dans
le but de nous rassurer que la qualité de l'huile ne va pas intervenir
dans la formation de l'acrylamide pendant la friture (YASUHARA et
al ,2003). Pour cela, nous allons vérifier deux paramètres
déterminés selon les méthodes de référence:
· ISO 660 : détermination de l'indice d'acide
dans les huiles végétales
· ISO 3960-1977(F) : détermination de
l'indice de peroxyde dans les huiles végétales.
IV.1.1. Indice d'acide
Définition
Il donne une évaluation sur la quantité d'acides
gras libres. Ces acides sont responsables d'une plus grande facilité au
rancissement.
On appelle indice d'acide d'une huile, le nombre de
milligramme d'hydroxyde de potassium alcoolique nécessaire pour
neutraliser les acides gras libres contenus dans un (1) gramme (g) de
matière grasse.
Principe
Les matières grasses s'altèrent par
vieillissement en donnant naissance par hydrolyse des acides gras libres. Cette
acidité peut être mesurée par alcalimétrie en milieu
éthéro-alcoolique, à l'aide de l'hydroxyde de potassium
alcoolique titrée.
Mode Opératoire
Une prise d'essai de 10g d'huile est solubilisée dans
un erlenmeyer contenant préalablement un mélange d'ether
diéthylique/éthanol dans les proportions 1/1. Le titrage des
acides gras libres en solution est éffectué avec une solution
à 0,1N d'hydroxyde de potassuim ( KOH) dans de l'ethanol 95° , en
utilisant la phénolphtaléine comme indicateur coloré et
cela sous agitation jusqu'au virage au rose.
Expression des résultats
Le résultat est exprimé en mg de KOH par g
d'huile.
Indice d'acide = [(V*T*56.1) / P]
Avec : V= volume de KOH
T= titre de la solution de KOH
P= prise d'essai en g
IV.1.2. Indice de peroxyde
Définition
Il donne une évaluation sur la quantité de
peroxydes présents dans un corps. C'est ce qui indique en fait la
quantité d'acide gras déjà rance.
L'indice de peroxyde est le nombre de milliéquivalent
d'oxygène actif contenu dans un (1) gramme(g) de produit et oxydant
l'iodure de potassium avec la libération d'iode.
Principe
Un échantillon d'huile dissout dans un solvant anhydre
(chloroforme, acide acétique) est mis en contact avec un excès
d'iodure de potassium (KI), puis l'iode libéré est dosé
par une solution de thiosulfate de sodium.
Mode opératoire
Dans un erlenmeyer contenant une prise d'essai de 2 gramme ,10
millilitre (ml) de chloroforme et 15 mL d'acide acétique
préalablement dégazés y sont introduit. A ce
mélange, 1 ml d'iodure de potassium est ajouté. Ce mélange
est mis à l'obscurité pendant 5 minutes.75 ml d'eau
distillée dégazée est ajoutée et le mélange
est mis sous agitation.
Enfin, en présence de quelques gouttes d'empois
d'amidon comme indicateur coloré, on titre l'iode libéré
par les peroxydes avec une solution de thiosulfate de sodium 0,01N.
Parallèlement un blanc est effectué.
Expression des résultats
Exprimé en milliéquivalents d'oxygène
actif par kg d'échantillon est égal à :
Indice de peroxyde = [(V1 -
V0) ×T / (m)] × 1000
Vo : Volume en millilitres, de la solution
titrée de thiosulfate de sodium utilisé pour l'essai à
blanc ;
V1 : Volume en millilitres de la solution
titrée de thiosulfate de sodium utilisé pour la
détermination ;
T : normalité de la solution de thiosulfate de
sodium utilisée ;
m : masse en gramme de la prise d'essai
IV.2. Analyse de la teneur en sucres
réducteurs dans la banane plantain mûre
Définition
On entend par sucres réducteurs la totalité des
sucres et autres substances réductrices (p. ex.: acide galacturonique,
acide glucuronique, etc.) contenus dans une boisson et qui, sans inversion
préalable, réduisent une solution alcaline de cuivre en
précipitant de l'oxyde de cuivre(I). Pour leur dosage et l'expression
des résultats, on les considère généralement comme
sucre inverti. La méthode détermine la concentration de ces
sucres invertis. Le résultat est déduit du tableau 3 ci-dessous,
exprimé en milligrammes ou gramme.
Principe
Après défécation, les sucres directement
réducteurs contenus dans les aliments sont oxydés par ajout d'un
excès de solution alcaline de cuivre. On titre ensuite en retour, par
iodométrie.
Mode opératoire
ü Prélever (ou peser) à l'aide d'une
pipette jaugée 10,0 , 25,0 ou 50.0 mL (ou g) de l'aliment à
analyser, selon sa teneur en sucres réducteurs (voir Tableau 1) et les
introduire dans un ballon jaugé de 100 ml.
ü Compléter avec de l'eau environ 75 mL, ajouter
5 ml de solution de Carrez I puis, après avoir
mélangé, 5 ml de solution de Carrez II. Après avoir
mélangé à nouveau, compléter avec de l'eau jusqu'au
trait de jauge, laisser reposer pendant 10 minutes.
ü puis filtrer sur filtre plissé.
ü Si la concentration en sucres réducteurs de la
boisson à analyser est supérieure à 25 g/l, diluer la
solution clarifiée selon les indications du Tableau 4. Facteur de
dilution = F.
Tableau 2:
Guide de prélèvement d'échantillon pour analyse
de sucres réducteurs
|
Concentration en sucres réducteurs
|
Clarification:
|
Dilution de la solution
clarifiée
|
Facteur de dilution
|
|
Volume du ballon jaugé
|
Volume de la
prise d'échantillon
|
|
5 g/l ou g
|
100 ml
|
50 ml
|
-
|
2
|
|
5- 25
|
100 ml
|
10 ml
|
-
|
10
|
|
25- 50
|
100 ml
|
25 ml
|
1 + 4
|
20
|
|
50-100
|
100 ml
|
10 ml
|
1 + 4
|
50
|
|
100-250
|
100 ml
|
10 ml
|
1 + 9
|
100
|
ü La solution à analyser ne doit pas contenir plus
de 60 mg de sucres réducteurs.
ü Introduire dans un erlenmeyer de 300 ml 25 mL de
solution cupro alcaline, 25 mL d'échantillon clarifié et
dilué, ainsi que quelques pierres à ébullitions
ü raccorder l'erlenmeyer au réfrigérant
à reflux; amener le contenu de l'erlenmeyer à l'ébullition
en moins de 02 minutes et maintenir l'ébullition pendant exactement 10
minutes
ü refroidir immédiatement le contenu de
l'erlenmeyer à l'eau courante froide jusqu'à ce qu'il ait atteint
la température ambiante
ü ajouter alors à la solution 1-1,5 g d'iodure de
potassium puis, par petites portions et en agitant lentement, 25 mL d'acide
sulfurique à 25 %.
ü après avoir ajouté quelques gouttes de
solution d'amidon, titrer l'iode libéré avec la solution de
thiosulfate de sodium 0.1 N jusqu'au virage à la couleur jaune
crème (1er titrage).
ü Après lecture à la burette, s'assurer de
la justesse du point de virage obtenu par l'ajout de 1-2 gouttes de solution de
thiosulfate; la coloration de la solution titrée ne doit pas perdre son
intensité.
ü Si le titrage nécessite moins de 5 mL de
solution de thiosulfate de sodium 0.1 N, il est recommandé de choisir
une dilution mieux appropriée de l'échantillon
clarifié.
Titre de la solution de cuivre
Effectuer un essai à blanc comme indiqué ci
devant en chauffant 25 mL de solution cupro-alcaline avec 25 mL d'eau au lieu
de l'échantillon. La quantité de solution de thiosulfate de
sodium 0.1 N utilisée dans l'essai à blanc (2èime titrage)
devrait être environ 25 mL.
Calculs et expression des
résultats
La quantité de solution de cuivre utilisée pour
l'oxydation des sucres est calculée selon la formule suivante et
exprimée en ml de solution de thiosulfate:
Solution de thiosulfate 0.1 N, en mL = (a-b) x f
a = quantité de solution de thiosulfate 0.1 N
utilisée pour l'essai à blanc (2e titrage), en ml
b = quantité de solution de thiosulfate 0.1 N
utilisée pour le dosage des sucres (1er titrage), en ml
f = facteur de la solution de thiosulfate de sodium 0.1 N.
La teneur en sucres directement réducteurs de la prise
de 25 mL d'échantillon clarifié et dilué, calculée
en mg/l de sucre inverti, peut être lue dans le Tableau 2. La teneur en
sucres directement réducteurs de l'échantillon est
calculée selon la formule suivante:
Sucre inverti, en g/l = Sa x 0.04 x F où Sa =
quantité de sucre inverti dans la prise de 25 mL d'échantillon
clarifié et dilué, en mg F = facteur de dilution de
l'échantillon
Les résultats sont exprimés en g/l, avec 1
décimale.
Tableau 3:
Teneur en sucre inverti
|
ml de solution de thiosulfate 0,1 N utilisés.
|
Nombre de 1/10 ml de solution de thiosulfate 0,1N
utilisés
|
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
|
Sucre inverti, en mg
|
|
0
|
0,00
|
0,24
|
0,48
|
0,72
|
0,96
|
1,20
|
1,44
|
1,68
|
1,92
|
2,16
|
|
1
|
2,40
|
2,64
|
2,88
|
3,12
|
3,36
|
3,60
|
3,84
|
4,08
|
4,32
|
4,56
|
|
2
|
4,80
|
5,04
|
5,28
|
5,52
|
5,76
|
6,00
|
6,24
|
6,48
|
6,72
|
6,96
|
|
3
|
7,20
|
7,45
|
7,70
|
7,95
|
8,20
|
8,45
|
8,70
|
8 ,95
|
9,20
|
9,45
|
|
4
|
9,70
|
9,95
|
10,20
|
10,45
|
10,70
|
10,95
|
11,20
|
11,45
|
11,70
|
11,95
|
|
5
|
12,20
|
12,45
|
12,70
|
12,95
|
13,20
|
13,45
|
13,70
|
13,95
|
14,20
|
14,45
|
|
6
|
14,70
|
14,95
|
15,20
|
15,45
|
15,70
|
15,95
|
16,20
|
16,45
|
16,70
|
16,95
|
|
7
|
17,20
|
17,46
|
17,72
|
17,98
|
18,24
|
18,50
|
18,76
|
19,02
|
19,28
|
19,54
|
|
8
|
19,80
|
20,06
|
20,32
|
20,58
|
20,84
|
21,10
|
21,36
|
21,62
|
21,88
|
22,14
|
|
9
|
22,40
|
22,66
|
22,92
|
23,18
|
23,44
|
23,70
|
23,96
|
24,22
|
24,48
|
24,74
|
|
10
|
25,00
|
25,26
|
25,52
|
25,78
|
26,04
|
26,30
|
26,56
|
26,82
|
27,08
|
27,34
|
|
11
|
27,60
|
27,87
|
28,14
|
28,41
|
28,68
|
28,95
|
29,22
|
29,49
|
29,76
|
30,03
|
|
12
|
30,30
|
30,57
|
30,84
|
31,11
|
31,38
|
31,65
|
31,92
|
32,19
|
32,46
|
32,73
|
|
13
|
33,00
|
33,27
|
33,54
|
33,81
|
34,08
|
34,35
|
34,62
|
34,89
|
35,16
|
35,43
|
|
14
|
35,70
|
35,98
|
36,26
|
36,54
|
36,82
|
37,10
|
37,38
|
37,66
|
37,94
|
38,22
|
|
15
|
38,50
|
38,78
|
39,06
|
39,34
|
39,62
|
39,90
|
40,18
|
40,46
|
40,74
|
41,02
|
|
16
|
41,30
|
41,59
|
41,88
|
42,17
|
42,46
|
42,75
|
43,04
|
43,33
|
43,62
|
43,91
|
|
17
|
44,20
|
44,49
|
44,78
|
45,07
|
45,36
|
45,65
|
45,94
|
46,23
|
46,52
|
46,81
|
|
18
|
47,10
|
47,39
|
47,68
|
47,97
|
48,26
|
48,55
|
48,84
|
49,13
|
49,42
|
49,71
|
|
19
|
50,00
|
50,30
|
50,60
|
50,90
|
51,20
|
51,50
|
51,80
|
52,10
|
52,40
|
52,70
|
|
20
|
53,00
|
53,30
|
53,60
|
53,90
|
54,20
|
54,50
|
54,80
|
55,10
|
55,40
|
55,70
|
|
21
|
56,00
|
56,31
|
56,62
|
56,93
|
57,24
|
57,55
|
57,86
|
58,17
|
58,48
|
58,79
|
|
22
|
59,10
|
59,41
|
59,72
|
60,03
|
60,34
|
60,65
|
60,96
|
61,27
|
61,58
|
61,89
|
Fidélité de la méthode
Répétabilité r = 0,47 + 0,012 x C g/l
Reproductibilité R = 1,34 + 0,029 x C g/l
Oû C = concentration de l'échantillon en g/l de
sucres directement réducteurs.
IV.3. Friture de la banane
Pour la friture des bananes, le procédé consiste
à effectuer les opérations suivantes :
éplucher les bananes plantain mûres
les découper en rondelle
frire dans de l'huile végétale chaude
faire égoutter
Ces fritures ont été effectuées sur une
plaque chauffante dans le laboratoire de biochimie alimentaire du LNSP sous une
hotte aspirante. Durant l'étape de la friture on contrôle la
température avec une sonde pour se fixer des intervalles de
température de friture.
La technique pour savoir si nos frites sont cuites, est de
fendre avec la main. Si la chair n'est plus gluante alors nous les jugeons
cuites sinon elles ne le sont pas encore. Aussi nous nous referons sur la
persistance du changement de la coloration de nos frites.
Des prélèvements d'échantillon de ces
frites sont effectués à tous les stades de notre cuisson en
fonction des différentes températures et temps de cuisson. Pour
assurer une représentativité minimale de l'échantillon,
cinq portions d'un même produit, du même lot, ont chaque fois
été prélevées et mélangées pour
l'analyse.
Les échantillons prélevés sont
analysés le même jour. Ils sont soumis aux procédures
d'extraction tout au plus une heure après extraction. En outre, si
l'analyse est reportée, les échantillons sont conservés
à environ 4°C à l'obscurité.
IV.4. Dosage de l'acrylamide
Le matériel ci-dessus sera utilisé selon la
méthode ci-dessous qui est issue de la littérature existante sur
la détermination de l'acrylamide par HPLC-UV au laboratoire national de
la santé publique (COMPAORE Wendkuni Florentin, 2008).
Préparation des étalons de
Calibration
ü Étalon d'acrylamide de 500microgramme par
millilitre (ìg/mL); Nous avons pesé précisément
50,00 mg d'acrylamide dans un flacon à échantillons ambré
de 100mL. Une masse calculée d'eau Milli-Q (environ 50 mL) a
été ajoutée pour produire une concentration d'acrylamide
de 250 ìg/mL.
ü Étalon intermédiaire de 10 ìg/mL
d'acrylamide; nous avons dilué 1 ml de l'étalon de 500
ìg/ml (2.1) avec 50 ml d'eau ultrapure dans une fiole jaugée.
ü Préparation des étalons de calibrations
dans une série de fioles de 10 ml, nous avons pipeté 0, 1, 2, 4,
6, 8 et 10 de la solution intermédiaire de 10 ìg/mL et
complété avec de l'eau ultrapure. On obtient alors des solutions
de calibrations allant de 0 à 10ìg/mL.
Préparation des phases
mobiles
La phase mobile (A) a été préparée
à partir d'eau ultrapure et le pH ajusté à 2,00 #177; 0,05
avec la solution d'acide sulfurique 25%. Cette phase mobile est
préparée chaque jour et dégazée avant utilisation
(Phase Mobile A). Une autre phase mobile est préparée à
partir d'acetonitrile pure et contenue dans une autre bouteille (Phase Mobile
B).
Broyage des échantillons et extraction de
l'acrylamide
ü La dimension des particules de l'échantillon a
été réduite en employant le broyeur (Analysesenmühle
A 10, Janke & Kunkel, IKAWerk).
ü 5,0 g de l'échantillon sont pesés
à l'aide de la balance analytique dans un tube de centrifugeuse en
téflon de 50 mL, 25 mL d'eau ultrapure sont ajoutés.
ü 1 ml de la solution carrez I et 1 ml de la solution
carrez II sont ajoutés
ü L'échantillon est agité à haute
vitesse à l'aide du vortex pendant cinq minutes puis à
l'agitateur secoueur horizontal pendant 15 minutes.
ü S'en suit une centrifugation à 67000 tr/min dans
la centrifugeuse de laboratoire Sigma Type 2-16 (Germany) pendant 30minutes.
ü 3 ml du surnageant sont transférés dans
deux tubes centrifugeuses de 1,5 mL et centrifugés à 14500 tr/min
dans la centrifugeuse réfrigérée pendant 30 minutes
à 0°C. Deux (2) mL de la solution échantillon sont
retirés pour la purification de l'échantillon.
Purification
ü La purification de l'échantillon consiste
à filtrer les 2ml de la solution échantillon obtenu après
extraction avec des Filtres à membranes autovials en PTFE Uniprep,
taille des pores de 0,45ìm, (Whatman) et 0,20 ìm.
ü Le filtrat obtenu est conditionné dans des
viales entreposés dans l'obscurité à 4°C jusqu'au
moment de l'analyse.
Paramétrage du
chromatographe
ü Débit : 0,600 ml/min.
ü Volume d'injection : 25 ìl
ü Température de la colonne : 28°C
ü Temps d'élution : faire passer (Phase mobile A)
de 0 à 11 minutes, pendant 3 minutes (11-14 mn) faire croitre le
pourcentage d'acetonitrile (Phase mobile B) jusqu'à 20% et maintenir
pendant 5 mn (14-19mn).
Après, ramener le pourcentage de l'acetonitrile
à 0% pendant 3 mn (19-22 mn) et maintenir la phase mobile
Eau/H2SO4 pendant 23 mn (22-45 mn). Le temps total est
de 45 mn.
ü Longueur d'onde de détection 202 nm.
ü Détection : RT (Temps de Rétention) #177;
5%.
Pour déterminer le temps où le pic d'acrylamide
apparaît (temps de rétention), des standards de calibration
à concentrations variables allant de 0ug/ml à 10ug/ml sont
injectés dans la chaine chromatographique. Les chromatogrammes obtenus
à partir de ces standards permettent de déterminer ce temps et de
s'assurer que la chaine chromatographique est apte à détecter
cette substance dans les échantillons.
ü L'ordre de passage des échantillons a
été établie comme suit : blanc, étalons, intercaler
jusqu'à cinq échantillons et étalons.
Courbe d'étalonnage
La courbe d'étalonnage est générée
en faisant appel à une régression linéaire qui exclue le
point de départ et avec un rapport de pondération de 1/x.
L'équation de la droite est : y = m x + b,
m=constante
b= constante
x= quantité
d'acrylamide en ug/ml
y= aire délimitée par la courbe.
Calculs des résultats
L'équation de droite de la courbe d'étalonnage
permet de déterminer x, la quantité d'acrylamide par ml
d'échantillon par la formule suivante :
x= (y-b) ÷ m
A partir de x obtenu, on détermine la quantité
d'acrylamide dans les produits analysés.
La valeur trouvée doit tenir compte de la prise d'essai
et des différentes dilutions si elles ont lieu. Les résultats
sont formulés en unités de ìg d'acrylamide/kg de
l'échantillon à trois chiffres significatifs.
CHAPITRE III :
RESULTATS ET DISCUSSION
CHAPITRE III :
RESULTATS ET DISCUSSIONS
I. RESULTATS
I.1. Résultats du contrôle de qualité de
l'huile
Les analyses effectuées sur notre huile de friture nous
ont permis d'obtenir les résultats consignés dans le tableau
suivant.
Tableau 4:
Paramètres analysés de l'huile de friture
|
PARAMETTRES
|
VALEURES
|
|
Indice d'acide (mg/kg)
|
0 ,17
|
|
Indice de peroxyde (en méq d'O2/kg)
|
15,10
|
I.2. Résultats d'analyse des sucres de la banane
En se basant sur des méthodes efficaces de
détermination de la teneur en sucres dans les aliments, les analyses
effectuées sur nos bananes plantain mûres ont donné une
teneur en sucres réducteurs de 17.55g /l
I.3. Frites de bananes plantain mûres `'alloco''
La friture de nos bananes plantains mûres dans des
conditions différentes de temps et de température de cuisson nous
a conduit à l'obtention des plats de frites disposés
ci-dessous.

Figure 5:
Echantillons frits de la banane plantain mûre à différentes
températures
E1 : échantillons frit à
120-130°C pendant 10min
E2 : échantillon frit à
130-140°C pendant 9min
E3 : échantillon frit à
140-150°C pendant 7min
E4 : échantillon frit à
160-170°C pendant 5min
E5 : échantillon à
170-180°C pendant 4min
I.4. Courbe de calibration
L'injection des standards de calibration permet
également d'obtenir une courbe de calibration. Cette courbe est
indispensable pour la quantification de l'acrylamide détecté
car, c'est à partir de cette courbe que la formule de calcul est
obtenue. Elle donne également les valeurs des constantes b et m. La
courbe de calibration est représentée dans la figure 6.
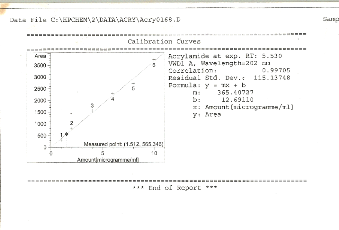
Figure 6 : courbe de
calibration
I.4. Standard de calibration
Le résultat d'une analyse par HPLC se présente
sous forme de courbe du signal détecté en fonction du
temps : c'est le chromatogramme.
Dans nos conditions de préparation et d'injection, le
chromatogramme des standards de calibrations indique que le temps de
rétention de l'acrylamide est d'environ 5,538mn. Les chromatogrammes de
standards à différentes concentrations sont
représentés sur les figures 7, 8,9 et 10.
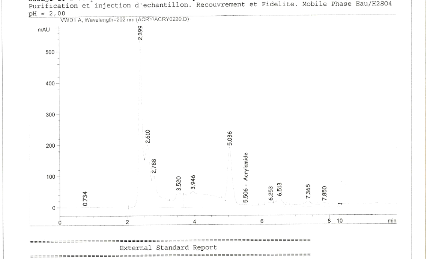
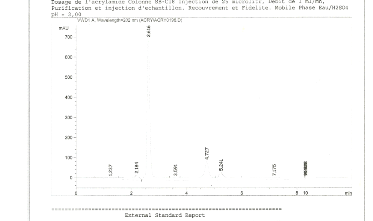
Figure 9: Chromatogramme d'un standard
de 6ug/ml
Figure 10: Chromatogramme de
l'échantillon E5 contenant de l'Acrylamide

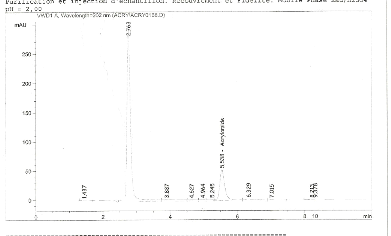
Figure8: Chromatogramme d'un standard
de 2ug/ml
Figure 7 : Chromatogramme d'un
standard de 0ug/ml
Le temps de rétention de l'acrylamide indiqué
dans les chromatogrammes des standards au niveau de la Figure 7 et 8, nous
permet de confirmer la présence d'acrylamide dans le chromatogramme de
l'échantillon E5 dans la Figure 6.
I.5. Teneur en Acrylamide des frites de banane plantain
mûre en fonction du Temps et de la Température de cuisson
Tableau 5:
Teneur en Acrylamide des échantillons
|
Echantillons
|
E1
|
E2
|
E 3
|
E 4
|
E5
|
|
Température
|
120-130°
|
130-140°
|
140-150°
|
150-160°
|
160-170°
|
|
Temps
|
10min
|
9min
|
7min
|
5min
|
4min
|
|
Teneur en acrylamide
en ug/kg
|
0
|
0
|
0
|
0
|
5.47
|

Figure 11: Variation de la teneur en
acrylamide en fonction du couple temps/température.
II. DISCUSSION
II.1. Contrôle de qualité
de l'huile de friture
Après analyse de l'indice d'acide suivant la norme
ISO 660, les résultats montrent que notre huile de friture est de bonne
qualité.
Cette norme fixe la limite d'indice d'acide à 0,6
mg/kg, pour cela notre huile de friture ayant un indice d'acide de 0,1681mg/kg
est classée conforme selon la présente norme.
Mais l'analyse d'indice de peroxyde effectuée sur
notre huile selon la norme citée ci-dessus nous renseigne quant à
la non-conformité de notre huile.
En effet, cette norme (ISO 3960-1977(F)) fixe comme
valeur limite à 10meq d'oxygène actif/kg. La moyenne de l'indice
de peroxyde de notre huile étant de 15,010meq d'oxygène actif
/kg, alors nous pouvons la considérer non-conforme selon la
présente norme.
Ce résultat non-conforme de l'indice de peroxyde montre
que notre huile a été oxydée. L'oxydation de l'huile
serait due d'une part à une mauvaise conservation dans le lieu de vente
(exposition à la lumière, l'air et la chaleur).
D'autre part cette oxydation pourrait avoir comme origine le
traitement technologique effectué à l'usine lors de la
désodorisation.
Cependant, il faut noter que l'huile est d'une part
désodorisée à 210-220°C sous vide afin de faciliter
la distillation des produits issus de la décomposition des peroxydes et
d'autre part stockée dans des cuves suffisamment étanches. Cette
étanchéité des cuves ralentit efficacement le processus
d'oxydation de l'huile raffinée durant son conditionnement
(Soma, 2010).Nous pouvons donc prendre en compte ce
paramètre d'autant plus que l'huile de nature contient des antioxydants
naturels (les tocophérols) qui lui confère une stabilité
lors de sa conservation.
La non-conformité de l'indice de peroxyde seul ne fait
pas forcément appel à un rejet de notre huile. L'indice d'acide
étant en dessous de la valeur limite fixée par la norme, l'huile
ayant une odeur caractéristique propre au produit et une bonne saveur
donc elle peut être considérée non ranci.
II.2. Teneur en sucres réducteurs
de la banane plantain mûre
L'analyse de la teneur en sucres réducteurs de nos
bananes plantains mûres a été effectuée selon une
méthode interne du service physico-chimie alimentaire .les
résultats obtenus comme nous le montre (Tableau 5)
donne une valeur moyenne de la teneur en sucres réducteurs de
nos bananes à 17.55 g /L. Cette valeur est nettement
inférieure comparativement à d'autres valeurs retrouvées
dans la littérature à savoir 20.1g/L lors d'une étude
effectuée sur la composition chimique de quelques denrées
amylacées de la Côte D'Ivoire en 2003 (Unité de
formation et de recherche en sciences et technologies des aliments
(UFR/STA, ABIDJAN) .
Une valeur de 24.5g/L a été retrouvée par
d'autres études de recherche effectué au laboratoire de
biotechnologie de l'Université de Caldas sur la composition
physico-chimique des bananes plantain du Clone en Colombie en 1998
(A.C.CARENO S .et M
.ARISTIZABAL.L).
Vue l'incompatibilité de ces différents
résultats selon les continents, particulièrement les pays, nous
pouvons dire que la teneur en sucres réducteurs des bananes est en
étroite corrélation avec les conditions climatiques et surtout la
composition du sol de la zone dans laquelle elles sont cultivées.
Mais concernant la faible teneur de sucres réducteurs
que nous avions observé dans nos bananes, et surtout que c'est de la
banane importée des pays voisins, nous pouvons donc lier ce faible taux
en sucres par le faite que ces bananes n'ont pas subie un murissement naturel
c'est à dire qu'elles ont été mûries sous l'effet du
carbure.
Cette manière de faire mûrir les bananes de
façon artificielle inhibe l'action des enzymes responsables de la
dégradation de presque 80% de l'amidon contenu dans la banane verte en
sucres lors du mûrissement.
II.3. Teneur en acrylamide dans les
frites de banane plantain mûre `'alloco''.
La méthode utilisée nous a permit avec
efficacité de déterminer le taux d'acrylamide dans nos frites de
bananes.
Ainsi, nous constatons une forte absence d'acrylamide dans les
échantillons de frites cuits à des températures
inférieures à 160°C c'est-à-dire de E1
à E4.
Cependant, l'échantillon frit à
partir de 160°C (E5) contient de l'acrylamide à une
teneur de 5,47ug/kg.
L'absence d'acrylamide dans les échantillons de frites
cuits à des températures inférieures à
160°C pourrait s'expliquer par le faite que le temps et
température de cuisson appliqué à ces échantillons
de frites ne sont pas efficaces à faire inter réagir l'asparagine
et sucres réducteurs contenus dans la matière première et
surtout que le taux de sucres est légèrement faible.
L'appréciation de la coloration faite à l'image
1 pourrait nous apporter un plus dans cette partie quant à
l'intensité de la réaction de Maillard qui a eu lieu avant la
température de 160°C.
La teneur en acrylamide d'environ 5,47ug/kg obtenue au niveau
de l'échantillon E5 à des
températures comprises entre 160-170°C comme l'indique le
Tableau 6, Signifie d'une part que les
réactants à savoir l'asparagine et glucose contenus dans
notre matière première ont interréagie.
Cela vient atténuer la corrélation quant
à l'augmentation du taux d'acrylamide en fonction du couple
Temps/Température (Tareke et al.
2002).
D'autre part, ce taux d'acrylamide constaté pouvait
avoir pour origine notre huile de friture.
En outre des études ont montré que certaines
huiles alimentaires d'origine végétale au délà de
leur température maximale d'ébullition .Engendrent une
pyrolyse c'est-à-dire les lipides se coupent et se réarrangent
pour former des composés toxiques appelés Acroléines
(BEKALSki et al, 2002).
C'est de là que vient le mécanisme de formation
de l'acrylamide à partir des triglycérides illustré par la
voie 2 (Figure 4)
En effet, il y avait une possibilité de lier l'absence
d'acrylamide dans les échantillons fris en dessous de
160°C à notre préparation
d'échantillons.
Mais le résultat des standards de calibration,
particulièrement le temps de rétention de l'acrylamide dans
ceux-ci nous rassure de la non détection d'acrylamide dans ces
échantillons.
Tous les cinq (05) échantillons étant
préparés de la même manière et injectés le
même jour, nous sommes donc ravi.
D'affirmer que le taux d'acrylamide constaté au niveau
de l'échantillon E5 provient effectivement
de l'effet du couple Temps/Température de cuisson.
Ces résultats dans leur ensemble nous confirment d'une
part qu'il existe une étroite corrélation entre la formation de
l'acrylamide dans les aliments frits et le couple
Temps /Température de cuisson, d'autre part que la teneur en
acrylamide peut être en fonction de la coloration de la surface des
aliments due à la réaction de Maillard.
CONCLUSION GENERALE
ET RECOMMADATION
CONCLUSION
Au terme de notre étude, il faut noter que la
méthode de dosage de l'acrylamide dans les aliments par HPLC-UV nous a
permi d'évaluer le taux d'acrylamide dans nos frites de bananes
plantain `'alloco''. Même s'il est vrai que la non détection de
l'acrylamide des échantillons fris en dessous de 160°C
(E1 à E4) encouragent les consommateurs, il
apparaît une détection de l'acrylamide dans l'échantillon
frit entre 160°C et 170°C (E5).
Ce taux d'acrylamide indiqué est à prendre au
sérieux même s'il s'avère faible .Il faut noter
également qu'il est nettement supérieur au taux limite
d'acrylamide fixé par la commission FAO/OMS pour l'eau
traitée qui est de 0.5 ug/kg
Vue cela, il y'a lieu de s'inquiéter car cette
substance après étude sur des animaux de laboratoire est
suggérer probablement cancérigène pour l'homme.
Cependant, il serait meilleur d'apporter certaines
informations plus particulièrement des conseils de bonnes pratiques de
cuisson aux consommateurs en vue de minimiser la teneur d'acrylamide dans les
frites de banane plantain mûre `'alloco'' . Pour cela, il est
recommandé de:
§ réduire le temps et la température de
friture ;
§ éviter de consommer des frits de bananes
plantain cuits à des températures égales ou
supérieures à 160°C
§ préférer des morceaux de frits
épais de banane plantain mûre qui contiennent proportionnellement
moins d'acrylamide (mais qui doivent cuire plus longtemps pour être cuits
à coeur)
§ ajouter des gouttes d'eau de manière
fréquente lors de la friture lorsque la température est
très élevée, cette pratique pourrait réduire le
taux d'acrylamide à 25% dans les recettes.
REFERENCES
Ø Santé Canada, Centre de
Collaboration de l'OMS pour la surveillance de la contamination alimentaire. La
détermination de la présence d'acrylamide dans les aliments par
CL-ESI-SM-SM, Bureau d'innocuité des produits chimiques ; Direction
des
aliments,http://hc-sc.gc.ca/fn-an/res-rech/analy-meth/chem/index_f.html.
Ø Swedish National Food
Administration, 2002. Information about acrylamide in food, 24 April
/http://www.slv.ses.
Ø
YASUHARA.A,Tanaka.Y,Hengel.M,Shibamoto.T.Gas chromatographic
investigation of acrylamide formation in browning model systems.J.agric.Food
chem,51,(2003) 3999-4003.
Ø International Agency for Research on Cancer
(IARC), working Group on the evaluation of the carcinogenic risk to
humans,(Evaluations Globales de la cancérogénicité pour
l'homme,Groupe 2A:Probablement cancérogènes pour l'homme) sur
http://monographs.iarc.fr/, le
16 janvier 2009,CIRC,consulté le 22 juin 2010
Ø Vural Gökmen, H.Z. Senyuva, J. Acar, K.
Sarioglu, Determination of acrylamide in potato chips and crips by
HPLC.J.Chromatogr. A 1088 (2005)193-199.
Ø Brown R., Formation, Occurrence and
Strategies to Address Acrylamide in Food. FDA Food Advisory Committee Meetingon
Acrylamide, February 24-45, 2003, University of Maryland, College Park,
Maryland. http://www.cfsan.fda.gov/~dms/acrybrow.html
Ø Santé Canada, Direction des
médicaments vétérinaires. La validation des
méthodes d'analyse : Méthodologie VICH GL2 ;
Ligne directrice à l'intention de l'industrie, VICH
GL7
Ø Frédéric Mestdagh , Jo Maertens
, Tatiana Cucu , Karel Delporte, Carlos Van Peteghem, Bruno De
Meulenaer.,
Impact of additives to lower the formation of acrylamide in a
potato model system through pH reduction and other mechanisms.Food
Chemistry 107 (2008) 26-31
Ø Rikke V. Hedegaard, Henrik Frandsen, Leif H.
Skibsted., Kinetics of formation of acrylamide and Schiff base
intermediates from asparagine and glucose., Food Chemistry 108 (2008)
917-925
Ø Vural Gökmen, Hamide Z.
Senyuva., Acrylamide formation is prevented by divalent cations during
the Maillard reaction.,Food Chemistry 103 (2007) 196-203
Ø Franco Pedreschi, Karl Kaack, Kit Granby,
Elizabeth Troncoso., Acrylamide reduction under different
pre-treatments inFrench fries., Journal of Food Engineering 79 (2007)
1287-1294
Ø Faso Norme .Norme Burkinabé
NBF 01-140-2009 spécifique aux huiles commestibles de
coton.1ère édition juillet 2009.
Ø Arwa Mustafa, Martin Fink, Afaf Kamal-Eldin,
Johan Rosén, Roger Andersson, Per Åman., Interaction
effects of
fermentation time and added asparagine and glycine on
acrylamide content in yeast-leavened bread., Food Chemistry (2008)
Ø Cheong Tae Kim, Eun-Sun Hwang, Hyong Joo Lee
. An improved LC-MS/MS method for the quantitation of acrylamidein
processed foods. Food Chemistry 101 (2007) 401-409
Ø [pdf] Avis 09.2010 Résumé
première priorité : l'acrylamide,le furane
Ø Conclusion du comité mixte
FAO/OMS d'experts des additifs alimentaires(JECFA) qui a
été en 2005 ,l'innocuité de l'acrylamide dans les
aliments
Ø International system organisation
660.Corps gras d'origine animale et végétale,
détermination de l'indice d'acide. Mise en application le 20/06/05 au
Laboratoire National de Santé.
MEMOIRES DE FIN D'ETUDE
Ø Mémoire de fin de cycle de licence en biologie
appliquée option :Industrie alimentaire (Evaluation de la teneur
en acrylamide par HPLC et UV dans les galettes de mil à Ouagadougou)
.Compaoré Wendkuni Florentin, 2008
Ø Mémoire de fin de cycle de licence
professionnelle en Génie Biologique option : Agroalimentaire
(Raffinage de l'huile de coton : cas de la SN-citec) . Soma
Massieke Abdoul Razaak, 2010
SITES WEEB
www.elsevier.com/locate/foodchem
le 12 juin 2010
www.fao.org/newsroom/fr/news/2005/100102/index.html
le 15 juillet 2010
www.afssa.fr/ftp/afssa/basedoc/acrylamide-resume-du-24-juillet.pdf
le 10 juillet 2010



