|

Numéro d'ordre: 246
UNIVERSITE CHEIKH ANTA DIOP DE DAKAR
Faculté
des Sciences et Techniques
Département de Biologie Animale

DIPLOME D'ETUDES APPROFONDIES
Mémoire
présenté
Par
ISMAÏLA NDOUR
Maître ès Sciences Naturelles
Sur le sujet :
Comparaison des populations de poissons amont1ava du
barrage anti-sel de Maka sur la Casamance
Soutenu le 22 Novembre 2007
devant la commission d'Examen composée de
:
Président : M. Omar Thiom Thiaw, Professeur
UCAD
Membres : MM. Luis Tito de Morais, Chargé de
Recherches IRD
Jean Marc Ecoutin, Chargé de Recherches
IRD
Samba Kâ, Docteur (UCAD)
Justin Kantousan, Docteur (UCAD)
Je dédie ce travail à :
4 mes très chers parents, Aliou Ndour et Dibor
Ndiaye qui m'ont inculqué une une éducation exemplaire et
à qui je souhaite une bonne santé et une longue vie,
4 mes frères: Modou Ndour, Sitor Ndour, Dogou
Ndour, Abou Ndour,
4 mes soeurs: Fatou Ndour, Dib Ndour et à leurs
familles, Nabou Ngom, Mary Ngom, Astou Sène, Sofi sène, Abba
Ngom,
4 mes tuteurs: Hamady Ndour, Mbagnick Ngom, Ndiague
ndour, Demba Sène, Penda Ndour, Diamé Diagne, Khady Ndour, Bineta
Diop
4 Souleye, Madou, Amady, Mbaye, Ousmane, frères
et amis depuis l'enfance,
4 Seydou Faye, Babacar Dione, Abdou Ngom, Modou Ndiaye,
Ablaye Faye, Abou Sarr Ndiaye,
4 Ndeye Fatou Ndiaye, Fatim Sarr, Astou Diagne, Amy
Diouf, Fatou Ndoye, Fatim Ngom, Saly, Seynabou Ndour, Ndeye Débo Sow,
Daba Diagne,
4 mes oncles, mes neveux et nièces:
Tékheye, Aliou Badou, Dib, Astou,
4 tous mes professeurs qui m'ont inculqué ce
savoir,
4 la famille Sadio à Sédhiou et à
tous les pêcheurs de la Casamance
4 Je vous aime, papa et maman. ? Ce travail est
le vôtre.
Avant Propos
Ce travail a été réalisé
dans le cadre d'une collaboration entre l'UR-RAP 070 de l'Institut de Recherche
pour le Développement (IRD) et le Laboratoire de Biologie de la
Reproduction de la Faculté des Sciences et Techniques (FST) de
l'Université Cheikh Anta Diop de Dakar (UCAD). Cette étude entre
dans le cadre du programme de l'Unité de Recherche (UR 070),
Réponses adaptatives des poissons aux pressions de l'environnement
(RAP), qui vise à comprendre les mécanismes d'adaptation des
poissons face aux modifications de l'environnement, conséquences de la
sécheresse qu'a connue la zone sahélienne pendant ces dix
dernières décennies.
Je tiens à remercier tous ceux qui, de loin ou
de près ont participé à la réalisation de ce
travail.
Monsieur le professeur Omar Thiom THIAW, vous avez
accepté de me recruter dans votre laboratoire pour ma formation. Vous
avez ensuite eu l'amabilité de me confier à l'UR RAP 070 pour
l'encadrement de mon stage de DEA. Malgré vos multiples charges, vous
avez marqué par votre empreinte ce mémoire et accepté de
présider ce jury. Veuillez accepter, les sentiments de ma profonde
reconnaissance.
Je tiens à remercier M. Luis TITO DE MORAIS,
Chargé de recherches à l'IRD de m'avoir encadré. M. Tito
de Morais, généreux de coeur et d'esprit, a toujours accompli de
la manière la plus efficace possible son rôle d'encadreur en me
faisant bénéficier de ses connaissances pluridisciplinaires mais
aussi de ses conseils. Qu'il soit assuré de mon éternelle
gratitude.
J'ai eu l'honneur et le plaisir d'avoir comme
Co-encadreur M. Jean Marc ECOUTIN chargé de recherches à l'IRD et
M. François LE LOC'H Ingénieur de recherches. Vos connaissances,
vos suggestions et interventions pertinentes ont été d'une grande
utilité pour moi. M. Ecoutin, j'ai beaucoup apprécié la
rigueur et la clarté de votre raisonnement scientifique. Merci d'avoir
accepté de participer au Jury. M. le Loc'h n'a ménagé
aucun effort pour l'aboutissement de ce travail dans la meilleur de ces formes.
Veuillez recevoir alors mes remerciements les plus sincères.
Je présente mes sincères remerciements
à M. Raymond LAË, Directeur de l'UR 070 « RAP » d'avoir
accepté mon stage dans son unité. Mention spéciale
à Mme Monique SIMIER qui a toujours répondu à chacune de
mes sollicitations avec une pédagogie remarquable.
Je remercie chaleureusement M. Antoine PARISELLE, qui
a beaucoup investi dans ce travail par les pertinentes réponses qu'il a
apporté sans relâche à mes sollicitations. Au Docteur
Justin KANTOUSSAN, par ton apport fructueux dans la réalisation de ce
travail et au Docteur Samba KÂ, je vous prie de trouver ici, l'expression
de toute mon admiration. Je vous remercie d'avoir accepté de participer
au Jury.
J'adresse mes sincères remerciements à
toute l'équipe RAP de l'IRD Bel Air pour son accueil et sa sympathie et
en particulier à Jean Raffray, Omar Sadio, Moussa Guèye, Mbaye
Tine, Mamady Guèye, Ndombour gning, Khady Diouf, Djibril Faye, Claire
Bassène, Elyse senghor.
Merci à mon camarade Mbaye Gning, à
Myrième Diatta, Rose Ngom, Modou Thiaw, Ulrich Panzou, J'associe
à ces remerciements tous mes amis, frères et soeurs qui m'ont
soutenu lors de mon stage.
1
Sommaire
Sommaire 1
Liste des Figures 3
Liste des Tableaux 3
I. Introduction 5
II. Matériels et Méthodes 8
II.1- Présentation du site d'étude
8
II.1.1- La Casamance 8
II.1.1.1- Situation géographique 8
II.1.1.2- Climat et végétation
8
II.1.1.3- Topographie 8
II.1.1.4- Pluviométrie 10
II.1.1.5- Salinité 10
II.1.1.6- Ichtyofaune 12
II.1.2- Le site de Maka 16
II.2- Matériel biologique : Espèces
ciblées 16
II.2.1- Ethmalosa fimbriata (Bowdich, 1825),
figure 6 18
II.2.2- Elops lacerta (Valenciennes, 1846),
figure 6 18
II.2.3- Sarotherodon melanotheron heudelotii
(Duméril, 1859), figure 6 19
II.2.4- Tilapia guineensis (Bleeker in
Günther, 1862), figure 6 20
II.2.5- Hemichromis fasciatus (Peters, 1852),
figure 6 20
II.3- Protocole d'échantillonnage 21
II.3.1- Engins d'échantillonnage 21
II.3.2- Mesure des paramètres environnementaux
23
II.3.3- Prélèvement de gonades
23
II.3.4- Prélèvement de contenus stomacaux
24
II.3.5- Prélèvement de branchies
25
II.4- Exploitation des échantillons au
laboratoire 25
II.4.1- Analyse des contenus stomacaux 25
II.4.2- Analyse de la structure en taille
25
II.4.3- Analyse de la fécondité
26
II.4.4- Détermination des parasites branchiaux
27
II.4.5- Facteur de Condition (K) 27
II.5- Analyses statistiques 28
III. Résultats 28
III 1- Évolution de la salinité et de la
température 28
III 2- Distribution des tailles 30
III.2.1- Sarotherodon melanotheron heudelotii
30
III.2.2- Tilapia guineensis 30
III.2.3- Hemichromis fasciatus 32
III.2.4- Ethmalosa fimbriata 34
III.2.5- Elops lacerta 34
III 3- Facteur de Condition (K) 36
III.3.1- Sarotherodon melanotheron heudelotii
36
III.3.2- Tilapia guineensis 36
III.3.3- Hemichromis fasciatus 36
III.3.4- Ethmalosa fimbriata 36
III.3.5- Elops lacerta 38
2
III 4- Régime alimentaire 38
III.4.1- Sarotherodon melanotheron heudelotii
38
III.4.2- Tilapia guineensis 40
III.4.3- Hemichromis fasciatus 42
III.4.4- Ethmalosa fimbriata 42
III.4.5- Elops lacerta 44
III.5- Reproduction 44
III.5.1- Sarotherodon melanotheron heudelotii
46
III.5.1.1- Fécondité relative
46
III.5.1.2- Diamètres ovocytaires 46
III.5.1.3- Taille de première maturité
sexuelle (L50) 48
III.5.1.4- Rapport gonado-somatique (RGS) 49
III.5.2- Tilapia guineensis 51
III.5.2.1- Fécondité relative
51
III.5.2.2-.Diamètres ovocytaires 51
III.5.2.3-.Taille de première maturité
sexuelle (L50) 53
III.5.2.4-.Rapport gonado-somatique (RGS) 53
III.6- Parasites branchiaux 55
IV Discussion : 55
IV.1- Paramètres environnementaux 55
IV.2- Distribution des tailles 57
IV.2.1- Les tilapias 57
IV.2.2- Ethmalosa fimbriata 61
IV.2.3- Elops lacerta 61
IV.3- Facteur de condition (K) 62
IV.3.1- Les tilapias 62
IV.3.2- Ethmalosa fimbriata et Elops
lacerta 63
IV.4- Régime alimentaire 63
IV.4.1- Sarotherodon melanotheron heudelotii et
Tilapias guineensis 63
IV.4.2- Ethmalosa fimbriata 65
IV.4.3- Hemichromis fasciatus et Elops
lacerta 66
IV.5- Reproduction 66
IV.5.1- Sarotherodon melanotheron heudelotii et
Tilapia guineensis 66
IV.5.1.1-.Fécondité et taille des ovocytes
66
IV.5.1.2-.Taille de première maturité
sexuelle (L50) 69
IV.5.1.3-.Rapport gonado-somatique (RGS) 72
IV.6- Infection parasitaire 73
V. Résumé et Perspectives 75
Références bibliographiques
78
Annexes 83
Résumé 95
3
Liste des Figures
Figure 1 : Situation géographique de la Casamance
et des stations étudiées 7
Figure 2 : Pluie annuelle et pluie moyenne de 1918
à 1970, entre 1970 et 1993 et 9
Figure 3 : Evolution mensuelle et interannuelle de la
salinité de l'estuaire de la Casamance 9
Figure 4 : Les grandes catégories
écologiques dans les peuplements de poissons des milieux
estuariens et lagunaires d'Afrique de l'Ouest (in
Albaret, 1999). 11
Figure 5 : Distribution des espèces
étudiées sur le long du fleuve Casamance : Es = formes
estuariennes strictes, Ec = formes estuariennes continentales, ME = marines
estuariennes, Em = estuariennes d'origine marine. Les traits pleins
correspondent à la saison sèche et les
pointillés à la saison des pluies
(Modifié d'Albaret, 1987) 15
Figure 6 : Photos des cinq espèces de poissons
étudiés (Vidy G. de l'équipe UR RAP) 17
Figure 7 : Sarotherodon melanotheron heudelotii
avec trois classes de tailles (photo : Gueye M.) 22
Figure 8 : Structure des diamètres ovocytaires des
femelles de stades 4 et 5 chez Sarotherodon
melanotheron et Tilapia guineensis
22
Figure 9 : Histogrammes des occurrences moyennes de proies de
Sarotherodon melanotheron
heudelotii suivant les mois (a) et les
stations (b). 37
Figure 10 : Histogrammes des occurrences moyennes de
proies de Tilapia guineensis suivant les
mois (a) et les stations (b). 39
Figure 11:
Histogramme des occurrences moyennes de proies d'Ethmalosa fimbriata
en fonction des
mois d'échantillonnage. 41
Figure 12 :
Courbes des fécondités relatives moyennes des femelles de
Sarotherodon melanotheron
heudelotii en fonction des stations et des
mois d'échantillonnage 45
Figure 13 : Courbes d'évolution du
diamètre ovocytaire des femelles de Sarotherodon
melanotheron
heudelotii en fonction des stations et des mois
d'échantillonnage 47
Figure 14 : Détermination par
méthode graphique de la taille de première maturité
sexuelle (L50) des femelles matures de Sarotherodon melanotheron
heudelotii par intervalle de 10 mm en
fonction des mois (a) et en amont et en aval du
barrage (b) 50
Figure 15 : Courbes des fécondités relatives
des femelles de Tilapia guineensis en fonction des
stations et des mois d'échantillonnage.
54
Figure 16 : Détermination par la méthode graphique de la
taille de première maturité sexuelle (L50) des femelles matures
de Tilapia guineensis par intervalle de 10 mm en fonction des mois
(a)
et en amont et en aval du barrage (b). 56
Figure 17
: Evolution des parasites branchiaux chez Sarotherodon melanotheron
heudelotii en
fonction de la salinité sur le fleuve
Casamance. 60
Liste des Tableaux
Tableau 1 : Richesse spécifique de la Casamance
(Modifié d'Albaret et al, mission février 2005)
13
Tableau 2 : Valeurs de la salinité relevée
dans la partie haute du fleuve Casamance en 2005 par
l'équipe RAP. 15
Tableau 3 : Evolution de la
salinité et de la température dans les différentes
stations
d'échantillonnage sur le fleuve Casamance en
octobre 2006 et en février et mai 2007. 29
Tableau 4 :
Sarotherodon melanotheron heudelotii : Tailles minimales (Min),
moyennes (Moy) et maximales (Max) des individus mesurées par station (A)
et par mois (B) et résultats du test de
Student. n : nombre d'individus mesurés, E-t :
écart type, p : probabilité. 29
Tableau 5 : Tilapia
guineensis : Tailles minimales (Min), moyennes (Moy) et maximales (Max)
des individus mesurés par station (A) et par mois (B) et
résultats du test de Student. n : nombre
d'individus mesurés, E-t : écart type, p :
probabilité. 31
4
Tableau 6 : Hemichromis fasciatus Tailles
minimales (Min), moyennes (Moy) et maximales (Max) des individus
mesurées par station (A) et par mois (B) et résultats du test de
Student. n :
nombre d'individus mesurés, E-t : écart
type, p : probabilité. 31
Tableau 7 : Ethmalosa fimbriata
Tailles minimales (Min), moyennes (Moy) et maximales (Max)
des individus mesurées par station (A) et par mois
(B) et résultats du test de Student. n :
nombre d'individus mesurés, E-t : écart
type, p : probabilité. 33
Tableau 8 : Elops lacerta Tailles
minimales (Min), moyennes (Moy) et maximales (Max) des individus
mesurées par station (A) et par mois (B) et résultats du test de
Student. n : nombre
d'individus mesurés, E-t : écart type, p :
probabilité. 33
Tableau 9 : Valeurs moyennes du facteur (Moy) de
condition chez Sarotherodon melanotheron heudelotii en fonction des
stations et des mois et résultats du test de Student. E-t : écart
type, p
=probabilité. 35
Tableau 10 : Valeurs moyennes (Moy) du facteur de
condition chez Tilapia guineensis 35
Tableau 11 : Valeurs moyennes (Moy) du facteur de
condition chez Hemichromis fasciatus 35
Tableau 12 : Valeurs moyennes (Moy) du facteur de
condition chez Ethmalosa fimbriata 35
Tableau 13 : Valeurs moyennes (Moy) du facteur de
condition chez Elops lacerta 37
Tableau 14 : Occurrences (en %) des espèces de
poissons proies d'Hemichromis fasciatus en fonction
des 41
Tableau 15 : Occurrences (en %) des espèces de
poissons proies d'Elops lacerta en fonction des mois
et des stations. 43
Tableau 16 : Nombre de femelles de
stade 4 capturées en fonction des stations et des mois pour
chaque espèce. 43
Tableau 17 :
Fécondité relative moyenne de Sarotherodon melanotheron
heudelotii en fonction des mois et des stations et résultats du
test de Student. Nb. obs : nombre d'observation, Moy :
moyenne. 45
Tableau 18 : Diamètres ovocytaires
moyens de Sarotherodon melanotheron heudelotii en fonction des mois et
des stations et résultats du test de Student. DO : diamètres
ovocytaires, Nb. obs :
nombre d'observation, Moy : moyenne. 47
Tableau 19 :
Rapport gonado-somatique (RGS) des femelles de stade 4 de Sarotherodon
melanotheron heudelotii en fonction des mois et des stations et
résultats du test de Student.
Nb. obs : nombre d'observation, Moy : moyenne.
52
Tableau 20 : Fécondités relatives moyennes de Tilapia
guineensis en fonction des mois et des stations
et résultats du test de Student. Nb. Obs : nombre
d'observation, Moy : moyenne. 52
Tableau 21 : Diamètres ovocytaires
moyens de Tilapia guineensis en fonction des mois et des stations et
résultats du test de Student. DO : diamètres ovocytaires, Nb. obs
: nombre
d'observation, Moy : moyenne 58
Tableau 22 : Rapport
gonado-somatique (RGS) des femelles de stade 4 de Tilapia guineensis
en
fonction des mois et des stations et résultats du
test de Student. 58
Tableau 23 : Synthèse de différents
résultats sur les tailles maximales observées (TMO) chez
trois
espèces 60
Tableau 24 : Synthèse de
différents résultats obtenus sur la fécondité
relative, le diamètre ovocytaire
et la L50 de Sarotherodon melanotheron
heudelotii et de Tilapia guineensis. 70
5
I. Introduction
Les estuaires sont des milieux d'interface
naturellement perturbés entre le domaine marin et le domaine
continental. Ils sont soumis à des modifications globales du climat qui
ont des conséquences sur les populations de poissons et sur la
structuration des communautés (Blaber, 1997 ; Lévêque &
Paugy, 1999 ; Whitfield & Elliott, 2002 ; Elliott et al., 2007).
Les estuaires sont des écosystèmes fortement influencés
par ces systèmes adjacents qui y établissent ainsi des conditions
environnementales très variables (Albaret, 1999).
Les milieux estuariens et lagunaires de l'Afrique de
l'ouest présentent des peuplements de poissons très
diversifiés et abritent un nombre élevé d'espèces
de manière temporaire ou permanente (Albaret, 1994 ; Albaret &
Diouf, 1994 ; Baran, 1995). Cette richesse spécifique peut être
reliée à certaines caractéristiques de ces
écosystèmes comme la taille du milieu, l'importance et la
permanence des interfaces, la diversité des habitats entre autres
(Albaret, 1999). Ils sont le siège d'une intense activité de
reproduction pour une gamme très large d'espèces (Albaret, 1994 ;
Baran, 1995 ; Diouf, 1996). Ils sont également des
écosystèmes très productifs (Horn & Allen, 1985 ;
Day et al., 1989) et sujets à d'importantes pressions
anthropiques directes ou indirectes (Albaret, 1999).
Jadis peu étudiés, les estuaires et les
lagunes attirent aujourd'hui la communauté scientifique mondiale. Ils
font actuellement l'objet d'un intérêt scientifique lié
d'une part au développement des activités humaines (pêche,
aquaculture, aménagement hydro-agricole, tourisme...) dont ils sont le
siège (Albaret & Ecoutin, 1990 ; Albaret & Diouf, 1994), et
d'autre part à la prise de conscience de l'importance des fonctions
écologiques et économiques de ces écosystèmes
(Warburton, 1978).
Les péjorations climatiques des années
70 (Albergel et al., 1991) ont entraîné une baisse des
apports d'eaux douces et ont établi un gradient de salinité
croissant d'aval en amont (estuaire inverse) avec des salinités
dépassant celles de la mer (sursalinisation). Celles-ci ont ainsi
provoqué un fonctionnement inverse de certains estuaires ouest africains
dont celui de la Casamance au Sénégal. Diverses études ont
été menées sur les peuplements et populations de poissons
le long d'un gradient inverse: sur la Casamance (Albaret 1984, 1987), sur le
Saloum (Albaret & Diouf, 1994 ; Diouf, 1996 ; Vidy, 1998).
Dans ces conditions, la question qui se pose est de
comprendre les différences des traits de vie de populations
d'espèces tolérantes dans des situations extrêmes :
plusieurs approches sont possibles (comparaison de populations naturelles
distantes par exemple).
6
Une situation particulière a été
observée sur le fleuve Casamance (estuaire inverse) au niveau d'un
barrage anti-sel qui sépare une zone totalement dessalée (d'eaux
douces) toute l'année, d'une zone sous influence de l'estuaire inverse
avec de fortes variabilités et des salinités pouvant atteindre
des valeurs maximales (66 à Sakar en mai 2005). L'originalité de
cette situation tient à la présence d'espèces similaires
des deux cotés du barrage: Sarotherodon melanotheron heudelotii,
Tilapia guineensis, Hemichromis fasciatus, Ethmalosa fimbriata, Elops lacerta,
Par la « plasticité éco-physiologique » qu'elles
présentent (Gueye, 2006), ces espèces adopteraient des
stratégies d'adaptation qui pourraient affecter leurs traits de vie
(reproduction, régime alimentaire, croissance etc...).
Les études sur la reproduction des poissons
(Thiaw, 1984 ; Kone & Teugels, 1999, 2003 ; Faunce, 2000 ; Panfili et
al., 2004a, b, 2006), sur leur régime alimentaire (Fagade &
Olaniyan, 1973 ; Hié Daré, 1980 ; Sene, 1994), sur leur
croissance (Legendre, 1983, 1986 ; Gilles, 1995) et sur leur exposition aux
infections parasitaires (Pauly, 1976 ; Pariselle & Euzet, 1996) sont
nombreuses.
D'une manière générale la plupart
des études réalisées jusqu'ici sur les traits de vie des
populations de poissons estuariens sont intégrées dans des
recherches biologiques et écologiques monospécifiques souvent
menées d'ailleurs dans le cadre de projets d'élevage (notamment
chez les Cichlidae) ou dans l'optique de la gestion rationnelle et de la
protection des stocks exploités (Ecoutin et al., 1994).
Plusieurs études ont été menées sur
l'écologie de l'ichtyofaune de la Casamance (Albaret, 1984 ; Le Reste,
1986 ; Albaret, 1987 ; Pandaré et al., 1997).
Notre étude figure parmi les premières
à s'intéresser à la comparaison des traits de vie de
populations de poissons en amont et en aval d'un barrage anti-sel sur la
Casamance. Elle vise à mettre en évidence les différences
en termes de distribution des tailles, de régime alimentaire et de
reproduction entre ces populations, proches spatialement, mais soumises
à des stress halins différents.
Cette étude nous permettra de mieux comprendre
les stratégies adaptatives adoptées par ces poissons dans des
conditions de salinité contrastée et d'affiner les connaissances
déjà acquises sur leur bioécologie.
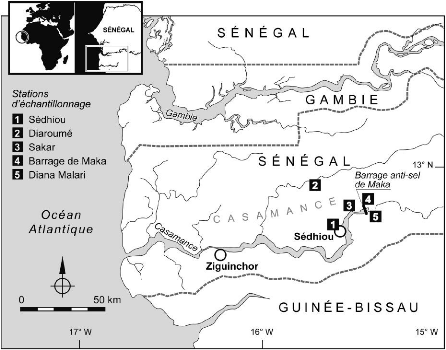
7
Figure 1 : Situation géographique de la Casamance
et des stations étudiées.
8
II. Matériels et Méthodes
II.1- Présentation du site d'étude
II.1.1- La Casamance
II.1.1.1- Situation géographique
Située au sud du Sénégal, la
région de la Casamance est limitée à l'ouest par
l'océan atlantique, à l'est par le fleuve Gambie, au sud par les
frontières de Guinée-Bissau et de Guinée Conakry et au
Nord par la Gambie (figure 1). Le bassin versant du fleuve Casamance couvre 14
000 km2 (Cormier-Salem, 1989). La Casamance est un petit fleuve
cotier caractérisé par une vaste zone estuarienne de plus de 200
km de long (ria ennoyée par la transgression flandrienne (in
Albaret, 1987)). Cet estuaire s'étend comme un long couloir de
près de 350 km kilomètres d'ouest en est et de 100
kilomètres du nord au sud. Il prend sa source aux environs de
Fafakourou, à l'est de Kolda. En saison sèche, il se
réduit en quelques mares (Cormier-Salem, 1989). La pente moyenne (0,07%)
est très faible (Bassel, 1993). Les apports en eaux douces sont
limités (Albaret, 1984). Les influences marines se font sentir
très loin à l'intérieur des terres (Cormier-Salem,
1989).
II.1.1.2- Climat et végétation
Le climat est de type soudano-guinéen,
caractérisé par une période humide (saison des pluies)
s'étendant de juin à octobre (été). La
pluviométrie varie de 800 à 2000 mm d'ouest en est. La
végétation est tropicale vers l'ouest. Des forêts
parcourues par des cours d'eau «bolongs » couvrent 62% de la
superficie. Tout au long des «bolongs » se crée une
végétation de mangrove, palmiers et rizières. A l'est
c'est une savane forestière qui domine (
http://members.tripod.com/casamance/geocasa.htm).
II.1.1.3- Topographie
La géomorphologie de la Casamance est
dominée par de vastes plateaux de grés du Continental Terminal
comme sur l'ensemble du territoire sénégalais. De place en place,
des cuirasses ferrugineuses affleurent en surface. Le relief est
généralement plat avec de basses
Précipitation s (mm)
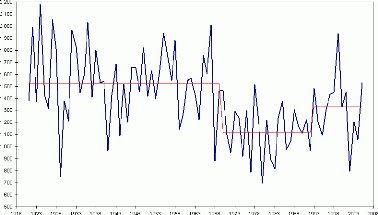
Années
Figure 2 : Pluie annuelle et pluie moyenne de 1918
à 1970, entre 1970 et 1993 et de 1994 à 2005 à Ziguinchor
(in IDEEC, 2007).
Salinité
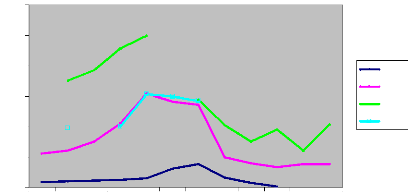
Mois
120
100
80
60
40
20
0
1969 1978 1984 2005
9
Figure 3 : Evolution mensuelle et interannuelle de la
salinité de l'estuaire de la Casamance.
10
altitudes (inférieurs à 40 m) qui
diminuent progressivement du sud-est, depuis les contreforts du Fouta Djalon
pour atteindre enfin à l'ouest le niveau de la mer (Cormier-Salem,
1989).
II.1.1.4- Pluviométrie
La pluviométrie de Ziguinchor qui
reflète globalement celle de la Casamance a suivi un régime
normal jusqu'avant 1970 avec des précipitations dépassant parfois
même 2000 mm. Au début des années soixante-dix, la
pluviométrie annuelle a diminué d'une façon importante.
Durant la période 1970-1995, la pluviométrie annuelle
était plus basse que la pluviométrie moyenne de l'époque
1918-1969. A partir de 1996 une hausse de 22,16% avec une moyenne de 1387,4 mm
a été notée. Parallèlement, la fréquence des
années avec moins de 1000 mm de pluie avait augmentée (IDEEC,
2007), figure 2.
La réduction des apports d'eaux douces suite
à la baisse de la pluviométrie a provoqué une augmentation
de la salinité dans l'estuaire de la Casamance. La salinité y est
régie par les apports d'eau de mer, par l'évaporation mais
surtout par la pluviométrie locale (Albaret, 1987).
II.1.1.5- Salinité
La salinité est certainement le facteur
physique dont les variations sont les plus rapides. Elle est
déterminée essentiellement par les débits fluviaux et,
à un degré moindre par le cycle et le coefficient des
marées surtout pendant l'étiage (in Pasquaud,
2006).
L'évolution interannuelle de la salinité
de la Casamance est marquée par une croissance graduelle de 1969
à 1984. Cette salinité dont la valeur maximale était
inférieure à 20 en 1969, a dépassée 100 en 1984
dans l'estuaire avec une valeur maximale intermédiaire entre ces deux
années en 1978. Les salinités atteintes en 1984 dans l'estuaire
et qui dépassent largement celle de la mer (35-36) traduisent une
sursalinisation de l'estuaire de la Casamance avec un gradient de
salinité positif de l'aval vers l'amont (estuaire inverse), figure
3.
Devant ce phénomène de sursalinisation,
l'évolution de la salinité de la Casamance était devenue
préoccupante pour plusieurs auteurs (Le Reste 1983 ; Albaret, 1984, 1987
; Pagès & Debenay, 1987 ; Bassel, 1993).
Dès la fin de l'hivernage de 1983, Le Reste
(1983) constatait un double fait, jamais observé depuis le début
du siècle en Casamance, en fin de saison des pluies:
11
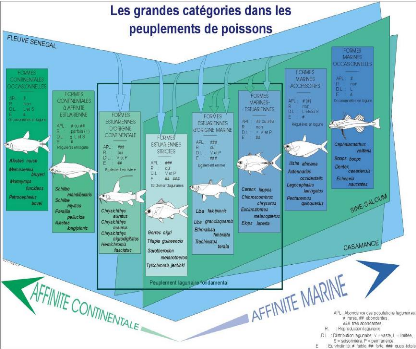
Figure 4 : Les grandes catégories
écologiques dans les peuplements de poissons des milieux estuariens et
lagunaires d'Afrique de l'Ouest (in Albaret, 1999).
APL: abondances des populations lagunaires # : rares,
##abandantes, ### très abondantes; R : reproduction lagunaire ; DL :
distribution lagunaire V = vaste, L = limitées, S = saisonnière,
P = permanente ; E = euryhalinité # faible, ## forte, ###
quasi-totale.
-
12
une salinité supérieure à celle
de l'eau de mer tout le long de la Casamance, au moins jusqu'à
Diattakounda,
- un gradient de salinité positif de l'aval
vers l'amont.
Cette situation a été ensuite
confirmée par les travaux d'Albaret (1984) qui avait dressé un
profil longitudinal de la salinité montrant une allure exponentielle du
moins de l'embouchure jusqu'à Sédhiou (avec une salinité
de 120).
Cette salinité a ensuite
légèrement baissée en 2005, par rapport à
l'année 1984 (figure 3) qui a été marquée par une
sécheresse ayant entraînée une forte baisse de la
pluviométrie au Sénégal en particulier et pratiquement
dans toute la sous région. L'évolution mensuelle de la
salinité montre trois importantes variations. A l'exception de
l'année 1969, les salinités maximales annuelles correspondent
à celles du mois de mai, par contre les salinités minimales
annuelles ont été mesurées en octobre quelle que soit
l'année. Le mois de février est caractérisé par des
salinités moyennes intermédiaires entre octobre et mai (figure
3). Ces observations nous permettent de subdiviser l'année en trois
périodes caractérisées par des salinités
particulières.
· Une saison correspondant au mois d'octobre et
caractérisée par les salinités minimales
annuelles.
· Une saison correspondant au mois de
février symbolisée par les salinités moyennes
annuelles.
· Une saison de mai marquée par les
maxima annuels de la salinité.
II.1.1.6- Ichtyofaune
En rappel, une classification de
l'ichtyocénose estuarienne indispensable pour décrire d'abord,
puis pour aborder certains aspects fonctionnels des peuplements a
été proposée par Albaret (1999). Outre le degré
d'euryhalinité considéré accessoirement, ou pour certaines
espèces à titre principal, les caractéristiques
fondamentales du cycle bio-écologique de chaque espèce (ou
population) ont été prises en compte : lieu de reproduction,
répartition, existence de plusieurs écophases. Cette
classification comprend huit catégories écologiques. A partir
d'un point central, les formes exclusivement estuariennes se
répartissent inégalement sur les deux axes marin et continental
(figure 4).
· Formes estuariennes strictes (Es),
présentes exclusivement en milieu estuarien où se déroule
la totalité du cycle biologique.
13
Tableau 1 : Richesse spécifique de la Casamance
(Modifié d'Albaret et al, mission février 2005). C :
formes continentales.
Famille
|
Espèce
|
Code
|
Catégorie écologique
|
Anabantidae
|
Ctenopoma kingsleyae
|
CKI
|
Co
|
Ariidae
|
Arius heudoletii
|
AHE
|
ME
|
Ariidae
|
Arius latiscutatus
|
AGA
|
ME
|
Ariidae
|
Arius parkii
|
ARP
|
ME
|
Bagridae
|
Chrysichthys sp
|
CHY
|
|
Belonidae
|
Tylosurus crocodilus
|
TCR
|
Mo
|
Carangidae
|
Caranx hippos
|
CHI
|
ME
|
Carangidae
|
Caranx senegallus
|
CAS
|
ME
|
Carangidae
|
Chloroscombrus chrysurus
|
CHL
|
ME
|
Carangidae
|
Hemicaranx bicolor
|
AAM
|
Mo
|
Carangidae
|
Lichia amia
|
LIA
|
Ma
|
Carangidae
|
Trachinotus teraia
|
TFA
|
Em
|
Carcharhinidae
|
Carcharhinus limbatus
|
CLM
|
Mo
|
Cichlidae
|
Hemichromis fasciatus
|
HFA
|
Ec
|
Cichlidae
|
Sarotherodon melanotheron
|
THE
|
Es
|
Cichlidae
|
Tilapia guineensis
|
TGU
|
Es
|
Clariidae
|
Clarias anguillaris
|
CLS
|
Co
|
Clariidae
|
Heterobranchus sp
|
HET
|
C
|
Clupeidae
|
Ethmalosa fimbriata
|
EFI
|
Em
|
Clupeidae
|
Ilisha africana
|
IAF
|
Em
|
Clupeidae
|
Sardinella madarensis
|
SEB
|
ME
|
Cynoglossidae
|
Cynoglossus senegalensis
|
CYS
|
Em
|
Dasyatidae
|
Dasyatis margarita
|
DAM
|
|
Drepaneidae
|
Drepane africana
|
DAF
|
ME
|
Elopidae
|
Elops lacerta
|
ELA
|
ME
|
Ephippidae
|
Chaetodipterus goreensis
|
CHG
|
Mo
|
Ephippidae
|
Chaetodipterus lippei
|
CLI
|
Ma
|
Gerreidae
|
Eucinostomus melanopterus
|
GME
|
ME
|
Gerreidae
|
Gerres nigri
|
GNI
|
Es
|
Haemulidae
|
Brachydeuterus auritus
|
BAU
|
ME
|
Haemulidae
|
Plectorhinchus macrolepis
|
PLM
|
Em
|
Haemulidae
|
Plectorhinchus mediteruneus
|
PME
|
Mo
|
Haemulidae
|
Pomadasys jubelini
|
PJU
|
Em
|
Hemiramphidae
|
Hyporamphus picarti
|
HPI
|
Ma
|
Lutjanidae
|
Lutjanus dentatus
|
LUD
|
Mo
|
Lutjanidae
|
Lutjanus goreensis
|
LGO
|
Ma
|
Mochokidae
|
Synodontis nigrita
|
SNE
|
C
|
Monodactylidae
|
Monodactylus sebae
|
PSB
|
Es
|
Mugilidae
|
Liza dumerili
|
LDU
|
Em
|
Mugilidae
|
Liza falcipinnis
|
LFA
|
Em
|
Mugilidae
|
Liza grandisquamis
|
LGR
|
Em
|
Mugilidae
|
Mugil bananensis
|
MBA
|
ME
|
Mugilidae
|
Mugil cephalus
|
MCE
|
ME
|
Mugilidae
|
Mugil curema
|
MCU
|
Em
|
Paralichthyidae
|
Citarichthys stampflii
|
CST
|
Em
|
Polynemidae
|
Galeoides décadactyles
|
GDE
|
ME
|
Polynemidae
|
Polydactylus quadrifoliés
|
POQ
|
ME
|
Polypteridae
|
Polyptères sp.
|
POL
|
|
Psettodidae
|
Psettodes belcheri
|
PBE
|
Mo
|
|
·
14
Formes estuariennes d'origine marine (Em),
parfaitement adaptées aux conditions estuariennes. La reproduction a
lieu en estuaire (souvent dans son secteur maritime) mais peu également
survenir en milieu marin.
· Formes estuariennes d'origine continentale
(Ec), parfaitement adaptées aux conditions estuariennes. La reproduction
a lieu en estuaire mais également dans les milieux continentaux,
fluviaux et lacustres où elles sont également
représentées.
· Formes marines-estuariennes (ME), d'origine
marine, très euryhalines, ne se reproduisent pas en estuaire, mais
capables d'y effectuer un début de maturation sexuelle (seulement dans
son secteur). Elles sont représentées par des populations
permanentes et abondantes.
· Formes marines accessoires (Ma),
espèces littorales régulièrement capturées en
estuaire bien que rarement très abondantes et dont la présence
est limitée dans l'espace et/ou dans le temps aux zones sous influence
marine prépondérente. Leur reproduction s'effectue en
mer.
· Formes marines occasionnelles (Mo), toujours
très rares voire exceptionnelles dans des captures effectuées en
estuaire.
· Formes continentales à affinité
estuarienne (Ce), parfois abondantes et qu'une certaine tolérence aux
basses salinités les autorise à pénétrer en milieu
saumâtre. La reproduction, lorsqu'elle s'effectue en estuaire est
toujours limitée à proximité de l'embourchure des fleuves
et rivières.
· Formes continentales occasionnelles (Co), dont
la présence est exceptionnelle en estuaire et toujours très
limitéé dans le temps ou l'espace aux eaux totalement douces ou
très légèrement salées. Elles ne se reproduisent
pas en estuaire.
Plusieurs auteurs ont travaillé sur les
peuplements de poissons de l'estuaire de la Casamance (Le Reste, 1983; Albaret,
1984, 1987 ; Pagès & Debenay, 1987). 61 espèces ont
été répertoriées en février 2005 et
réparties dans 32 familles (Albaret et al., 2005). Les familles
les plus représentées étaient : les Carangidae et les
Mugilidae avec chacune 6 espèces, les Heamulidae et les Sciaenidae (4
espèces), les Cichlidae, les Ariidae et les Clupeidae (3
espèces), les Clariidae, les Eppiphidae, les Gerreidae, les Lutjanidae,
les Polynemidae et les Sphyraenidae (2 espèces). Toutes les autres
familles sont représentées par une seule espèce (Tableau
1).
15
Suite et fin du Tableau 1
Schilbeidae
|
Schilbe intermedius
|
SIN
|
Ce
|
Sciaenidae
|
Pseudotolithus brachygnathus
|
PBR
|
ME
|
Sciaenidae
|
Pseudotolithus elongatus
|
PEL
|
Em
|
Sciaenidae
|
Pseudotolithus senegalensis
|
PSN
|
Ma
|
Sciaenidae
|
Pseudotolithus typus
|
PTY
|
ME
|
Serranidae
|
Epinephelus aeneus
|
EAE
|
ME
|
Soleidae
|
Synaptura lusitanica
|
SLU
|
Ma
|
Sphyraenidae
|
Sphyraena afra
|
SPI
|
ME
|
Sphyraenidae
|
Sphyraena guachancho
|
SGU
|
ME
|
Tetraodontidae
|
Ephippion guttifer
|
EGU
|
ME
|
Tetraodontidae
|
Lagocephalus laevigatus
|
LLA
|
Ma
|
Trichiuridae
|
Trichiurus lepturus
|
TLE
|
ME
|
|
Le Code noté dans le tableau correspond à
une abréviation adoptée communément par les chercheurs
pour chaque espèce afin de simplifier l'écriture surtout sur le
terrain.
Tableau 2 : Valeurs de la salinité relevée
dans la partie haute du fleuve Casamance en 2005 par l'équipe
RAP.
Latitude
|
longitude
|
localité
|
Salinité
|
|
|
|
février
|
avril
|
Mai
|
12°59.365
|
15°37.112
|
Pont Soungrougou
|
66
|
-
|
132
|
12°42.475
|
15°33.036
|
Sédhiou
|
42
|
53
|
66
|
12°50.147
|
15°26.400
|
Sakar
|
27
|
52
|
66
|
12°51.552
|
15°17.109
|
Barrage anti-sel aval
|
12
|
42
|
43/53
|
12°51.552
|
15°17.109
|
Barrage amont
|
0
|
2
|
5/4
|
12°50.965
|
15°15.103
|
Diana Malary
|
2
|
4
|
4
|
|
stations
Salinité
D (km)
|
Kafountine Pte St Georges Ziguinchor Goudomp Dimbandi
Sédhiou Mankono Diana karsia Boguel
35 35-46 38-52 49-66 50-79 52-83 12-91 6-75 1-64
0-10
0 25 62 114 158 170 207 218 233 244
|
SME (Es) TGU (Es) HFA Ec) EFI (Em) ELA (ME)
|
|
|
|
|
|
|
|
Figure 5 : Distribution des espèces
étudiées sur le long du fleuve Casamance : Es = formes
estuariennes strictes, Ec = formes estuariennes continentales, ME = marines
estuariennes, Em = estuariennes d'origine marine. Les traits pleins
correspondent à la saison sèche et les pointillés à
la saison des pluies (Modifié d'Albaret, 1987).
16
II.1.2- Le site de Maka
Le barrage de Maka qui porte le nom du village de
Maka est situé à une quarantaine de kilomètres en amont de
Sédhiou par 12°51 de latitude et 15°17 de longitude. Les
principales activités de la population locale sont la riziculture et la
pêche.
La baisse de la pluviométrie à la suite
de la sécheresse des années 70 a entrainé l'invasion des
eaux marines dans tout le réseau hydrographique, la baisse
généralisée des nappes, l'acidification et la salinisation
des vasières (Albergel et al., 1991) jusqu'au niveau des zones
les plus éloignées de l'amont de l'estuaire (cas de Maka). Ceci
compromet l'utilisation des terres pour la riziculture qui est une
activité traditionnelle des populations locales et réduit
également la richesse spécifique en poissons (Albaret,
1987).
Pour faire face à cette sursalinisation
alarmante des terres cultivables, le barrage anti-sel de Maka a
été mis en eau en 1998 par les populations locales, en vue de
rétablir des conditions dulçaquicoles. Cet ouvrage est
constitué d'une digue en latérite et d'un édifice en
béton armé au niveau du lit principal, muni de quatre ouvertures
équipées de vannes (faites de bois) glissantes verticalement.
Dès que le barrage atteint sa côte maximale, les vannes sont
ouvertes pour préserver la digue (Annexe.IX).
La mise en place du barrage anti-sel de Maka a
entraîné une séparation de l'estuaire en deux
environnements de salinité contrastée : la partie aval
salée (43 en mai 2005), la partie amont, d'eau douce (0), ou parfois
très faiblement salée, Tableau 2.
II.2- Matériel biologique : Espèces
ciblées
Cinq espèces ont été choisies
pour cette étude (Hemichromis fasciatus, Tilapia guineensis,
Sarotherodon melanotheron heudelotii, Elops lacerta, Ethmalosa fimbriata),
car elles ont précédemment été capturées en
amont comme en aval du barrage (Ecoutin et al., 2005). Ces cinq
espèces peuvent vivre et se reproduire dans des
écosystèmes aquatiques ayant des salinités très
variables (Albaret, 1987 ; Pandaré et al., 1997 ; Panfili
et al., 2006), figure 5. Dans la suite de ce travail nous utiliserons
parfois les codes de ces espèces pour les nommer : Sarotherodon
melanotheron (SME), Tilapia guineensis (TGU), Hemichromis
fasciatus (HFA), Ethmalosa fimbriata (EFI), Elops lacerta
(ELA).
Les espèces ont été
décrites par Paugy et al, (2003a, b).



17
Figure 6 : Photos des cinq espèces de poissons
étudiés (Vidy G. de l'équipe HR RAP)
18
II.2.1- Ethmalosa fimbriata (Bowdich, 1825), figure 6
C'est une espèce estuarienne d'origine marine
(Albaret, 1999). Ce genre monospécifique se distingue des autres
Clupeidae par l'échancrure médiane dont est pourvue la
mâchoire. Le corps plutôt élevé est assez
comprimé latéralement. E. fimbriata présente une
paupière adipeuse bien développée, une nageoire dorsale
munie de 16 à 19 rayons, une anale de 19 à 23 et des ventrales de
8 rayons. 37 à 42 écailles à bord distal lacinié
sont disposées le long de la ligne longitudinale avec 16 à 19 et
10 à 13 écussons respectivement pré-pelviens et
post-pelviens. Elle a une coloration argentée dans l'alcool avec le dos
brunâtre ou verdâtre. L'arrière de la partie
supérieure de l'opercule est pourvu d'une tâche noire arrondie. La
taille maximale observée (TMO) chez E. fimbriata est de 350 mm
(longueur standard).
Cette espèce est connue des zones
côtières, des estuaires et parfois même des cours
inférieurs de fleuve, de la Mauritanie à l'Angola. Elle se
caractérise par une adaptation extrême aux conditions très
variables des eaux saumâtres et côtières de la côte
ouest africaine (Charles-Dominique, 1982). E. fimbriata tolère
des taux de salinité très élevés y compris au
moment de la reproduction. Des individus en maturation ont été
observés à des salinités de 60. Elle peut supporter des
salinités allant jusqu'à 80 en Casamance (Albaret, 1987). Elle a
été retrouvée à des salinités 130 (Laë
& Vidy comm. intern.) au niveau de l'estuaire du Saloum. Elle a un
régime alimentaire de type planctophage (Bainbridge, 1957 ; Fagade &
Olaniyan, 1972), mais celui-ci reste lié aux disponibilités
alimentaires du milieu (Lazarro, comm. pers.). La reproduction est
étalée dans le temps avec une intensité maximale en saison
sèche (Gerlotto, 1979 ; Albaret et al., 2000). La
fécondité de cette espèce est plus ou moins variable. Elle
est de 150 à 300 ovocytes par gramme de femelle mature (Albaret &
Gerlotto, 1976) mais pouvant atteindre environ 500 ovocytes par gramme de
femelle mature (Fagade, 1974). La croissance d'E. fimbriata est
affecté par les fortes salinités (> 60) qui entrainent sa
réduction (Panfili et al., 2004a).
II.2.2- Elops lacerta (Valenciennes, 1846), figure 6
C'est une espèce marine estuarienne dont les
écophases juvéniles ont lieu en estuaire. Poisson osseux primitif
de la famille des Elopidae, son corps est fusiforme. E. lacerta
présente de gros yeux partiellement recouverts par une
paupière adipeuse. La bouche, largement fendue est terminale et la
mâchoire supérieure dépasse nettement le bord
postérieur de l'oeil, par contre la mâchoire inférieure est
proéminente. Ces deux mâchoires sont
séparées
19
par une plaque gulaire osseuse ventrale. Très
souvent confondu avec Elops senegalensis, il présente 17
à 19 branchiospines sur la partie inférieure du premier arc
branchial et 72 à 83 écailles en ligne latérale,
ornées de tubules non ramifiés. Ses flancs sont argentés
et brillants; le dos noir gris et les nageoires toutes pâles sont
teintées de jaune et plus ou moins largement bordées de gris
sombre. La TMO est de 900 mm (longueur totale).
E. lacerta est présent sur les
côtes ouest africaines de la Mauritanie à la Namibie. Cette
espèce colonise les eaux côtières peu profondes au-dessus
des fonds sablo-vaseux. Elle pénètre en eaux saumâtres et
dans le cours inférieur des fleuves. E. lacerta est susceptible
de supporter des salinités allant de 0 à 110 (Pandaré
et al., 1997). E. lacerta est une espèce
carnassière à tendance piscivore (Hié Daré, 1980).
C'est une espèce à reproduction marine (Albaret, 1987). Sa
croissance est généralement rapide en lagune où elle est
réprésentée par sa phase immature. Il existe une
corrélation positive entre l'âge et la longueur à la
fourche d'E. lacerta. (Hié Daré, 1982).
II.2.3- Sarotherodon melanotheron heudelotii
(Duméril, 1859), figure 6
S. m. heudelotii appartient à la
famille des Cichlidae. C'est une espèce estuarienne stricte (Albaret,
1999). Comme toutes les espèces du genre, elle présente des
écailles ventrales ayant presque la même taille que celles des
flancs. La papille génitale du mâle est petite. L'os pharyngien
inférieur cordiforme est plus long que large ou aussi long que large. Sa
partie dentée est plus courte que la partie antérieure. Cette
espèce se caractérise particulièrement par la
présence en moyenne de 29 écailles en ligne latérale et de
15 à 19 branchiospines sur la partie inférieure du premier arc
branchial. La longueur de la tête constitue 33,5 à 37,7% de la
longueur standard. S. m. heudelotii présente
généralement une coloration bleu-nacré plus foncée
vers l'arrière. Les jeunes poissons sont argentés avec des
nageoires impaires grisâtres ou transparentes. La TMO pour cette
espèce est de 230 mm (longueur standard).
Cette espèce a une large répartition.
Elle est connue des lagunes et estuaires du Sénégal
jusqu'à la Sierra Leone (Freetown). S. m. heudelotii est un
incubateur buccopharygien (Lowe-McConnell, 1982). S m. heudelotii a
une reproduction continue (Albaret, 1987 ; Legendre, 1991 ; Pandaré
et al., 1997) et une fréquence de ponte élevée
avec une protection poussée des oeufs et des larves qui contribuent
largement à l'efficacité de sa reproduction (Albaret, 1994). Sa
fécondité relative est plus élevée en saison
séche qu'en saison des pluies. En enclos d'élevage S m.
heudelotii produit des ovocytes plus petits et plus nombreux que dans le
milieu naturel (Legendre & Ecoutin, 1989). Cette espèce a un
régime alimentaire omnivore (Fagade, 1971). Mais elle peut
altérer son régime alimentaire avec les changements des
conditions
20
environnementales (Kone & Teugels, 2003). Sa
croissance est réduite en environnement hypersalé (au dessus de
60 dans le Saloum (Panfili et al., 2004b)). S. m. heudelotii
est une espèce euryhaline qui a été retrouvée
à des salinités de 130 (Laë & Vidy, comm. intern.) dans
le Saloum. En Casamance elle a été retrouvée à des
salinités supérieures à 90 (Albaret, 1987).
II.2.4- Tilapia guineensis (Bleeker in Günther,
1862), figure 6
Tilapia guineensis appartient
également à la catégorie des espèces estuariennes
strictes (Albaret, 1999). Cette espèce diffère de la
précédente par l'os pharyngien inférieur, qui est aussi
long que large avec la pointe antérieure plus courte que la partie
dentée. Les dents pharyngiennes postérieures sont tricuspides.
Elle présente des dents pharyngiennes médianes élargies et
des dents externes des mâchoires bicuspides, non spatulées. Elle
est pourvue de 2930 écailles en ligne latérale et de 8-10
branchiospines sur la partie inférieure du premier arc branchial. La
coloration est généralement argentée, passant au
blanchâtre sur le ventre et au jaune-vert sur le dos et le dessus de la
tête. Elle présente sur les flancs six à huit bandes
verticales plus sombres et très peu marquées. La nageoire dorsale
est grisâtre et transparente avec une tache « tilapienne » bien
marquée. La caudale n'est pas tachetée mais présente une
partie supérieure grisâtre et une partie inférieure
jaunâtre. La gorge et l'abdomen sont parfois rougeâtres ou
noirâtres après conservation. La TMO est chez T. guineensis
est de 282 mm (longueur standard).
L'espèce est connue des eaux douces et
saumâtres du Sénégal jusqu'en Angola. Tout comme S. m.
heudelotii, T. guineensis a une reproduction continue (Albaret, 1987 ;
Pandaré et al., 1997), une protection poussée des oeufs
et des larves et une croissance lente (Albaret, 1987). En enclos
d'élevage T. guineensis produit plus d'ovocytes mais de tailles
plus petites qu'en milieu naturel (Legendre & Ecoutin, 1989) C'est un
constructeur de nids (Lowe-McConnell, 1982 ; Legendre & Ecoutin, 1989). Son
régime alimentaire est omnivore à forte tendance phytophage
(Fagade, 1971). T. guineensis est une espèce euryhaline
(Albaret, 1999) pouvant supporter des salinités largement
supérieures à celle de la mer. Sa présence a
été notée à des salinités de 89-91 en
Casamance (Albaret, 1987).
II.2.5- Hemichromis fasciatus (Peters, 1852), figure 6
C'est une espèce estuarienne d'origine
continentale (Albaret, 1999). H. fasciatus est un Cichlidae piscivore
très vorace (Fagade & Olaniyan, 1973 ; Adebesi, 1981). Son corps est
cylindrique. Elle a une dentition très réduite ainsi que des
prémaxillaires extrêmement protractiles, une mâchoire
inférieure très proéminente. H. fasciatus dispose
en moyenne 29
21
écailles en ligne latérale et 7<8
branchiospines sur la partie inférieure du premier arc branchial. H.
fasciatus est pourvu de cinq bandes verticales sombres sur chaque flanc.
Le museau présente un profil supérieur droit ou concave. Sa
coloration est généralement rouge cuivrée à
olivâtre jusqu'au brun foncé sur le dos. La partie
inférieure du corps est rouge orangé, plus rose sur le ventre. A
la partie supérieure de l'opercule se trouve une grande tache
irrégulière noire. La TMO est de 204 mm (longueur
satandard).
H. fasciatus est largement distribuée
dans les eaux douces et saumâtres de l'Afrique, depuis le
Sénégal jusqu'à l'Angola (Paugy et al., 2003b).
C'est une espèce extrêmement commune en Côte d'Ivoire tant
en eau douce qu'en eau saumâtre. Hfasciatus est une
espèce monogame gardant et protégeant ces oeufs et alevins mais
ne pratiquant pas l'incubation buccale (Albaret, 1982).
II.3- Protocole d'échantillonnage
La comparaison des différentes espèces
vivant à la fois en amont et en aval du barrage de Maka a
été réalisée à partir des résultats
des pêches professionnelles, menées sur chacun de ces deux
milieux. Certaines de ces pêches sont liées à une
activé traditionnelle de pêche, d'autres correspondent à
une demande explicite de notre équipe de recherche. Pour
compléter notre échantillonnage, deux stations ont
été ajoutées (en plus de l'aval et de l'amont
immédiats du barrage) à notre échantillonnage: l'une plus
en amont (Diana Malary) l'autre plus en aval (Sakar) du barrage, (figure
1).
II.3.1- Engins d'échantillonnage
L'échantillonnage a été
réalisé à l'aide de deux types d'engins de pêche:
l'épervier de maille 29-30 mm et le filet maillant de mailles 25
à 36 mm lors de la première mission et principalement à
partir de pêches à l'épervier (principalement de maille 29
mm) lors des deux dernières missions. Cet engin est moins
sélectif que les filets maillants. Néanmoins des
débarquements provenant de filets de pêcheurs ont
été utilisés dans la mesure où les poissons
étaient en bon état. Pour chaque débarquement d'une
unité de pêche, les individus capturés ont
été déterminés à l'espèce,
comptés et pesés dans leur totalité. Par pêche, un
certain nombre d'individus a été mesuré (longueur à
la fourche en mm), pesé (en gramme) puis sexé pour la
détermination du stade sexuel (stade caractéristique des
différentes étapes de la spermatogenèse et de
l'ovogenèse). Par station et espèce, il a été
échantillonné environ 200 individus selon la proportion des
individus des espèces présentes (à l'exception de la
première mission).

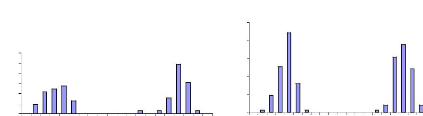
fréquences
(%)
fréquences
(%)
35
SME stade 4 RGS = 4,8
Figure 7 : Sarotherodon melanotheron heudelotii
avec trois classes de tailles (photo : Gueye M.)

Classes de diamètres ovocytaires (mm)
Classes de diamètres ovocytaires (mm)
10,00 8,00 6,00 4,00 2,00 0,00
30 25 20 15
10
5
0
Classes de diamètres ovocytaires (mm)
|
Classes de diamètres ovocytaires (mm)
|
|

SME stade 5
<0,07 0,27 0,47 0,67 0,87 1,07 1,27 1,47 1,67 1,87 2,07 2,27
2,47 2,67 2,87 3,07 3,27 3,47
0
5
10
15
20
25
fréquences
(%)
30
25
20
15
10
5
0
fréquences
(%)
TGU stade 4 RGS = 6,3
TGU stade 4 RGS = 10,3
<0,04 0,24 0,44 0,64 0,84 1,04 1,24 1,44 1,64 1,84
22
Figure 8 : Structure des diamètres ovocytaires des
femelles de stades 4 et 5 chez Sarotherodon melanotheron
et
Tilapia guineensis
23
Dans chaque station, les individus ont
été échantillonnés suivant les différentes
classes de tailles (grande, moyenne et petite taille), figure 7.
II.3.2- Mesure des paramètres environnementaux
Pour chaque campagne et à chaque station, la
salinité a été mesurée au
réfractomètre, la température à l'aide d'un
thermomètre. Un GPS a permis de déterminer la position
géographique de chaque station.
II.3.3- Prélèvement de gonades
L'échelle de maturation adoptée par
Legendre & Ecoutin (1989) a été utilisée pour la
détermination rapide des stades sexuels par examen macroscopique. Elle
est établie après caractérisation de chaque stade par le
rapport gonado-somatique (RGS), la distribution de la fréquence en
taille des ovocytes et l'examen histologique des gonades. Le RGS est la part
d'énergie d'un individu allouée à la reproduction
(Legendre, 1991). Cette échelle est adaptée à une
utilisation multispécifique. Pour les femelles, elle comprend sept
stades dont chacun correspond à une distribution caractéristique
dans la fréquence en taille des ovocytes (figure 8).
Le stade 1 correspond aux individus
complètement immatures. Les gonades sont légèrement
allongées et élargies. Elles ne présentent pas de
vascularisation superficielle.
Le stade 2 est caractérisé par
l'individualisation d'un groupe d'ovocytes de petit diamètre en
prévitellogenèse. A la surface des gonades apparaît une
légère vascularisation.
Au stade 3, Une croissance ovocytaire s'amorce
véritablement avec l'entrée d'une partie des ovocytes en phase de
vitellogenèse (incorporation de la vitellogénine). A ce stade les
individus sont matures c'est à dire que la réversibilité
ovocytaire n'est plus possible. La vascularisation de surface
s'accroît.
Le stade 4 est caractérisé par une
nette séparation du groupe modal d'ovocytes de diamètre le plus
avancé du reste de la population ovocytaire. Ce groupe modal correspond
aux ovocytes qui seront émis à la prochaine ponte, leur
dénombrement permet d'estimer la fécondité. La
quasi-totalité de la cavité abdominale est occupée par les
gonades qui présentent une importante vascularisation
superficielle.
Le stade 5, très fugace, correspond à
l'émission des produits génitaux et à l'ovulation. Les
ovules (femelles) et le liquide spermatique (mâles) sont expulsés
à la moindre pression sur l'abdomen.
24
Les stades 6-2 et 6-3 sont consécutifs à
la ponte et se distinguent principalement des stades 2 et 3 par la
présence dans l'ovaire d'un petit nombre de gros ovocytes
résiduels (non ovulés) en atrésie.
Seules les gonades des femelles de stade 4 sont
prises en considération pour la détermination de la
fécondité. En fait, au stade 5 les ovocytes peuvent avoir
été en partie émis, naturellement, ou lors du tri des
captures. D'ailleurs ce stade est rarement rencontré. Sur le terrain,
pour les individus femelles de stade sexuel > 2, les
gonades ont été prélevées et pesées au
dixième de gramme (balance électronique).
Pour les femelles de stade 4, 10 gonades par
espèce et par station ont été prélevées dans
la mesure du possible. La détermination du stade 4 a été
faite à la fois de manière visuelle et par le calcul du RGS (>
4 pour être prélevée). Ces gonades ont été
conservées dans du liquide de Bouin (75 ml d'acide picrique
saturé ; 20 ml de formol à 40% ; 5 ml d'acide acétique)
lors de la première mission et dans du liquide de Gilson (100 ml
d'éthanol, 9 ml d'acide acétique glacial, 20 ml d'acide nitrique
à 60%, de chlorure de mercure II, et 875 ml d'eau distillée) lors
des deux autres missions. Ces liquides assurent la conservation des ovocytes
même à longue échéance. Mais contrairement au
liquide de Bouin, le Gilson opère une ségrégation
parfaite, aboutissant à la libération des ovocytes par digestion
du stroma ovarien. Ceci explique le changement du Bouin par le Gilson comme
produit de conservation des gonades lors de nos deux dernières missions.
Dans le cas où un stade 5 a été rencontré, la
gonade a été prélevée, pesée et
décrite (par exemple sa couleur, sa position par rapport à la
cavité abdominale, l'aspect des ovocytes) et un ou deux exemplaires ont
été conservés dans le Gilson pour faire une structure des
diamètres ovocytaires (figure 8).
Pour les Cichlidae, les gonades entières
(stade 4) ont été conservées ; pour le cas particulier
d'Ethmalosa fimbriata, la gonade a été
sous-échantillonnée en raison du nombre important d'ovocytes que
la femelle pouvait pondre. Par découpe avec un scalpel, environ 0,5g de
gonade a été prélevé et mis dans du liquide de
Gilson (deux dernières missions). Quant à Elops lacerta
aucune gonade n'a été prélevée en raison de
l'absence de femelle de stade 4 dans nos captures. Les gonades
prélevées étaient agitées au moins une à
deux fois par semaine pour assurer la séparation des ovocytes sous
l'effet du liquide de Gilson.
II.3.4- Prélèvement de contenus
stomacaux
Les prélèvements des estomacs ont
été réalisés de préférence le matin
et l'heure de retour de la pêche a été notée
à chaque fois. Les estomacs de certains poissons
échantillonnés ont été prélevés
à la pince après incision entre les nageoires pectorales et
l'anus. Au moins 10
25
contenus stomacaux par espèce et par station
ont été prélevés et conservés dans du formol
à 10%.
II.3.5- Prélèvement de branchies
Afin d'estimer l'abondance des parasites branchiaux,
5 branchies par espèce et par station ont été
prélevées et conservées dans du formol à 3%.
L'analyse des parasites branchiaux a été menée en
collaboration avec Arfang Diamanka (Laboratoire de
Nématologie).
II.4- Exploitation des échantillons au
laboratoire
II.4.1- Analyse des contenus stomacaux
Plusieurs méthodes ont été
définies par Hyslop (1980), chacune d'elles donne une précision
sur le comportement alimentaire des espèces de poissons : la
méthode des « points », la méthode numérique, la
méthode gravimétrique, la méthode volumétrique, la
méthode calorifique, la méthode de la fréquence
d'occurrence.
Parmi ces différentes méthodes, celle
de la fréquence d'occurrence a été utilisée lors de
cette étude. Elle consiste à exprimer en pourcentage le nombre de
fois qu'une proie ou une catégorie alimentaire est trouvée dans
les estomacs analysés par rapport au nombre total d'estomacs remplis
(Fagade & Olaniyan, 1972). Elle présente l'avantage d'être
rapide et ne requiert qu'un minimum d'appareillage. Elle est bien convenable
dans l'étude des variabilités spatiales et temporelles des
relations trophiques. Cette méthode fournit des informations
qualitatives sur ce qu'un animal a récemment mangé.
L'étude des contenus stomacaux s'est faite par
observation à la loupe binoculaire avec de l'alcool à 70% (permet
des observations morphologiques) comme liquide de montage. Les
proies contenues dans les estomacs ont
été déterminées jusqu'à la limite du
possible. Une détermination de la composition qualitative du
régime alimentaire des différentes espèces de poissons
étudiées a été réalisée en notant
uniquement les aliments et sans pour autant les quantifier.
II.4.2- Analyse de la structure en taille
Les longueurs à la fourche (LF) ont
été utilisées pour élaborer les structures en
taille. Toutes les mesures ont été faites au millimètre
près. Ensuite, des classes de taille de 1 cm ont été
établies. Le choix porté sur la LF s'explique par un souci de
défaut de la longueur standard ou totale des individus sous la pression
de leurs prédateurs.
26
II.4.3- Analyse de la fécondité
La fécondité est définie comme
étant le nombre d'ovocytes constituant le groupe modal le plus
avancé qui sera émis lors d'une ponte par une femelle (Albaret,
1982). Afin de déterminer la fécondité absolue, tous les
ovocytes d'une (première mission) ou des deux gonades (deux
dernières missions) prélevées de chaque femelle de poisson
à l'exception de l'ethmalose, ont été comptés. Pour
ce dernier en raison du nombre important d'ovocytes, les ovocytes contenus dans
0,5g de gonade ont été comptés et rapportés au
poids des deux gonades. La fécondité relative correspond au
nombre total d'ovocytes de chaque femelle rapporté au poids de la
femelle en kg (fécondité relative au poids de la femelle) ou au
poids des ovaires en kg (fécondité relative au poids des
ovaires).
Le RGS tel que nous l'avons calculé est le
poids des gonades (Pg) rapporté au poids total de l'individu (gonades
comprises) : P.
Il a été calculé suivant cette
formule:
RGS = (Pg/P) X 100
Néanmoins le liquide de Gilson présente
un inconvénient par son action rétrécissant du
diamètre des ovocytes (Albaret, 1982). Mais le court séjour des
gonades dans le Gilson lors de notre étude (moins d'un mois), ne peut
induire aucune réduction sur le diamètre des ovocytes (Albaret,
1982). De ce fait le coefficient de réduction de celui-ci n'a pas
été pris en compte.
Pour l'étude du diamètre ovocytaire,
des mesures du diamètre des ovocytes ont été
effectuées. Le principe consiste à utiliser une loupe binoculaire
munie d'un micromètre. Ce dispositif est relié à un
ordinateur pour la prise de photos, mais les mesures se font directement
à l'aide du micromètre. En raison de la forme ovoïde des
ovocytes, nous avons mesuré la grande longueur et la grande largeur de
chacun d'eux, dont la moyenne donne le diamètre ovocytaire en
millimètre en tenant compte du grossissement.
Le maximum possible d'ovocytes a été
mesuré pour chaque gamme d'ovocytes (au moins 50 ovocytes au total). Le
diamètre mesuré était celui d'ovocytes en maturation
avancée (stade 4) et non celui d'ovocytes en pré-ponte. Ceux-ci
(ovocytes de stade 4) sont caractérisés chez de très
nombreuses espèces par une dernière transformation avant la
ponte: leur volume augmente par pénétration d'eau, ils deviennent
translucides et libres à l'intérieur de la gonade. Le stade 5 est
fugace et rarement observé. Par conséquent il ne peut pas
être retenu pour des comparaisons. La structure ovocytaire nous a permis
de mettre en évidence la séparation du
27
groupe modal d'ovocytes qui va à la ponte de
celui de la ponte suivante (Legendre, 1991), figure 8.
La taille de première maturité
(L50) est la taille à laquelle 50% des individus se trouvent
à un stade avancé de leur premier cycle sexuel. Pour les
Cichlidae, les femelles considérées comme matures sont celles
dont les gonades présentent un stade supérieur ou égal
à 3 de l'échelle de maturation sexuelle adoptée par
Legendre & Ecoutin (1989). Rappelons que la L50 ne se détermine
qu'à la période de reproduction. Pour le cas particulier des
espèces à reproduction étalée, le cumul de toutes
les données est nécessaire. La détermination de la taille
de première maturité a été effectuée par la
méthode graphique classique. Cette méthode consiste à
tracer la courbe d'évolution des pourcentages cumulés (en
ordonnée) des individus matures (stade de maturité sexuelle
= 3) en fonction de leur taille (en abscisse). A partir de
l'ordonnée correspondant à 50%, une droite horizontale est
tracée. La verticale passant par la jonction de la droite horizontale et
de la courbe coupe l'axe des abscisses à la taille correspondant
à la L50.
II.4.4- Détermination des parasites branchiaux
A l'aide de la loupe binoculaire, quatre
hémibranchies respiratoires pour chaque individu ont été
placées dans de l'eau distillée et observées. Les
Monogènes (ectoparasites branchiaux de poissons) qui y sont
retrouvés, ont été prélevés et placés
entre lame et lamelle avec un liquide de montage (solution de glycérine
+ eau distillée). Les lames sont observées afin de
déterminer les espèces qui parasitent les poissons. A l'aide
d'une microcaméra appliquée à la loupe binoculaire, des
photos ont été prises.
Sur la base des résultats obtenus par la
recherche de la présence ou de l'absence de parasites branchiaux, le
degré d'infection parasitaire de S. m. heudelotii a
été évalué en fonction de la
salinité.
II.4.5- Facteur de Condition (K)
Le facteur de condition (K), dit de Fulton (1953),
est un paramètre qui renseigne sur la forme physique du poisson. Les
poissons qui vivent dans des milieux difficiles présentent en
général des poids faibles par rapport à leur longueur. Il
a été calculé en utilisant la formule standard à
partir des données du poids et de la taille individuelle:
K=
P
5
3 * 1 0 FL
Où P est le poids total (en gramme) et FL, la
taille à la fourche (mm).
28
II.5- Analyses statistiques
Les comparaisons des tailles moyennes, du facteur de
condition (K), de la fécondité relative, des diamètres
ovocytaires, du RGS en fonction des stations et des mois
d'échantillonnage ont été effectuées par le test de
Student (comparaison de deux moyennes) avec le logiciel Statistica.
Les occurrences de proies ont également fait
l'objet d'analyses statistiques par la méthode d'Analyse à
Composante Principale (ACP) avec le logiciel ADE sous R (Chessel et al.,
2004). Nous avons appliqué cette ACP à des données
quantitatives qui sont représentées par les occurrences des
proies. Notre tableau se présente comme suit : La première
colonne porte les noms des espèces, la deuxième ceux des
stations, la troisième ceux des mois et les colonnes suivantes portent
les noms des variables (V1, V2..... Vn) qui sont constituées par les
différentes proies. En dessous du nom de chaque proie, est
reportée l'occurrence correspondant et cela pour chaque
espèce.
Dans ce cas les objets se regroupent dans le plan
factoriel suivant leur degré de similarité et les variables
viennent se positionner dans le même plan suivant leur degré
d'influence sur les groupes de variables.
III. Résultats
III 1- Évolution de la salinité et de la
température
Les salinités et les températures
moyennes enregistrées au cours de notre étude aux
différentes stations retenues, figurent dans le Tableau 3. Des
salinités faibles, moyennes et proches des maximales annuelles ont
été respectivement mesurées en octobre, en février
et en mai. La salinité montre également une variation en fonction
des stations. Les salinités élevées à Sakar
diminuent vers l'amont, jusqu'à Maka aval, les eaux de la partie amont
du barrage restant généralement douces, sauf au mois de
mai.
L'évolution de la température met
également en évidence des variations spatio-temporelles. A Sakar
et à Maka aval (aval barrage), les températures restent presque
identiques pour une période d'échantillonnage donnée. Au
pied amont du barrage, une faible baisse est généralement
observée. Elles deviennent plus élevées à Diana
Malary. Les températures mesurées en octobre restent beaucoup
plus élevées que celles du mois de février. Cependant
elles sont légèrement supérieures à celles de mai
dans toutes les stations à l'exception de Diana Malary où elles
deviennent plus élevées qu'en octobre.
Tableau 3 : Evolution de la salinité et de la
température dans les différentes stations
d'échantillonnage sur le fleuve Casamance en octobre 2006 et en
février et mai 2007.
mois
|
Salinité
|
Température (°C)
|
octobre février mai
|
Sakar
5
34
75
|
Maka
aval
2
6
66
|
Maka
amont
0
0
19
|
Diana
Malary
0
0
9
|
Sakar
29,4
20,7
27,5
|
Maka aval 29,7 21,6 29,2
|
Maka amont 28,7 22,9 26,8
|
Diana
Malary
30,9
27,7
32
|
|
Tableau 4 : Sarotherodon melanotheron heudelotii
: Tailles minimales (Min), moyennes (Moy) et maximales (Max) des individus
mesurées par station (A) et par mois (B) et résultats du test de
Student. n : nombre d'individus mesurés, E-t : écart type, p :
probabilité.
A
Longueur à la fourche (mm)
Stations
|
n
|
Min
|
Max
|
Moy
|
E-t
|
Test (Student)
|
Sakar
|
427
|
70
|
196
|
138
|
24
|
|
Maka aval
|
458
|
60
|
219
|
139
|
23
|
p = 0,185519
|
Maka amont
|
531
|
72
|
258
|
139
|
24
|
|
Diana Malary
|
576
|
22
|
194
|
134
|
23
|
|
|
B
Longueur à la fourche (mm)
Test (Student) p = 0,0000
29
Mois
n
|
Min
|
Max
|
Moy
|
E-t
|
octobre
|
314
|
70
|
219
|
150
|
20
|
février
|
865
|
60
|
211
|
140
|
21
|
mai
|
813
|
22
|
258
|
132
|
27
|
|
30
III 2- Distribution des tailles
Au cours de notre échantillonnage, au total
3896 individus d'espèces confondues ont été pesés,
mesurés et sexés sur l'ensemble des stations
étudiées. Les structures en tailles des mâles et de
femelles ont été regroupées car le test de Student ne
montre pas de différence significative des tailles entre le sexe (P
> 0.05).
III.2.1- Sarotherodon melanotheron heudelotii
Le nombre total d'individus
échantillonné pour cette espèce s'élève
à 1992 individus. Les structures en tailles sont illustrées dans
l'Annexe I.
Globalement, il n'ya pas de différence de
distribution nette des classes de tailles entre les stations amont et aval du
barrage. Néanmoins en février les classes modales trouvées
en amont (140-150 mm à Diana Malary et 130-140 mm à Maka amont)
étaient plus élevées que celles observées dans les
stations aval du barrage (120-130 mm à Maka aval et à Sakar). Au
mois de mai en particulier, une très forte réduction des classes
de tailles a été notée à Diana Malary (100-120 mm)
par rapport aux stations aval et de Maka amont.
Du point de vue variations saisonnières, une
réduction progressive des classes de tailles a été
notée entre octobre (160-180 mm) et mai (100-120 mm), Annexe
I.
Il n'existe pas de différence significative
entre les tailles moyennes des individus de S. m. heudelotii entre
l'amont et l'aval du barrage (Student, p =0,18 > 0,05). (Tableau
4A). Par contre la taille moyenne des individus de cette espèce
présente une différence hautement significative entre les mois
d'échantillonnage (Student, p=0,000 < 0,05). Elle est plus
élevée au mois d'octobre (150 #177; 20 mm) qu'en février
(140 #177; 21 mm) et mai, mois durant lequel la plus faible moyenne (132 #177;
27 mm), a été trouvée (Tableau 4B).
III.2.2- Tilapia guineensis
Au total 635 individus de T. guineensis ont
été échantillonnés. La distribution des tailles est
représentée dans l'Annexe II. Pour cette espèce, le nombre
d'individus capturés au cours de nos sorties reste faible,
comparé au nombre obtenu pour S. m. heudelotii, surtout en
octobre.
La distribution des classes de tailles des individus
de T. guineensis en amont est partiquement identique à celle
d'en aval du barrage. Mais les classes de tailles observées à
Sakar (130-150 mm) sont inférieures à celles de l'amont du
barrage (140-170 mm) durant les mois d'octobre et février. Dans le cadre
temporel, les classes de tailles ont subi une nette
31
Tableau 5 : Tilapia guineensis : Tailles
minimales (Min), moyennes (Moy) et maximales (Max) des individus mesurés
par station (A) et par mois (B) et résultats du test de Student. n :
nombre d'individus mesurés, E-t : écart type, p :
probabilité.
La même lettre écrite devant les mois
signifie que les moyennes de tailles ne diffèrent pas significativement
entre ces mois. Les lettres différentes signifient qu'il existe une
différence significative entre les mois.
A
Longueur à la fourche (mm)
Stations n Min Max Moy E-t Test (Student)
Sakar 216 89 210 135 23
Maka aval 118 78 220 135 23 p = 0,818342
Maka amont 103 95 265 136 24
Diana Malary 198 67 213 135 23
B
Longueur à la fourche (mm)
Mois
|
n
|
Min
|
Max
|
Moy
|
E-t
|
Test (Student)
|
octobre
|
64
|
70
|
128
|
141
|
25
|
a
|
février
|
198
|
78
|
120
|
142
|
21
|
ab
|
mai
|
373
|
67
|
265
|
131
|
23
|
c
|
|
Tableau 6 : Hemichromis fasciatus : Tailles
minimales (Min), moyennes (Moy) et maximales (Max) des individus
mesurées par station (A) et par mois (B) et résultats du test de
Student. n : nombre d'individus mesurés, E-t : écart type, p :
probabilité.
La même lettre écrite devant les mois
signifie que les moyennes de tailles ne diffèrent pas significativement
entre ces mois. Les lettres différentes signifient qu'il existe une
différence significative entre les mois.
A
|
Longueur à la fourche (mm)
|
Stations
|
n
|
Min
|
Max
|
Moy
|
E-t
|
Test (Student)
|
Sakar
|
4
|
145
|
146
|
156
|
26
|
p = 0,965927
|
Maka aval
|
22
|
117
|
215
|
163
|
22
|
|
101
|
96
|
207
|
163
|
22
|
|
65
|
93
|
202
|
163
|
21
|
|
B
|
Longueur à la fourche (mm)
|
Mois
|
n
|
Min
|
Max
|
Moy
|
E-t
|
Test (Student)
|
octobre
|
53
|
96
|
202
|
169
|
19
|
a
ab
c
|
février
|
91
|
120
|
206
|
163
|
18
|
|
48
|
93
|
215
|
154
|
28
|
|
32
réduction particulièrement au mois de
mai sur toutes les stations (120<130 mm à Maka aval et à
Sakar, 110<130 mm à Diana Malary, 120<130 mm et 140<150 mm
à Maka amont). Par contre elles étaient plus grandes en octobre
(allant de 130 mm à 170 mm suivant les stations) Annexe II.
Le test de Student ne révèle aucune
différence significative de la taille moyenne des individus entre
l'amont et l'aval du barrage (Tableau 5A, Student p = 0,82 > 0,05).
Par contre ce test montre une différence hautement significative de la
taille moyenne des individus de T. guineensis entre octobre et mai
(p = 0,000 < 0,05). Il existe également une
différence hautement significative entre le mois de février et
celui de mai (Student, p = 0,000 < 0,05). Mais il n'y a pas de
différence significative entre octobre et février (Student, p
= 0,86 > 0,05). La plus faible moyenne a été
observée au mois de mai (131 #177; 23 mm), Tableau 5B.
III.2.3- Hemichromis fasciatus
H. fasciatus était pratiquement
absente dans nos prises au niveau de la station de Sakar (en aval du barrage).
Le seul individu capturé dans cette station en mai mesurait 145 mm pour
un poids de 45g.
La distribution des classes de tailles est presque
identique de part et d'autre du barrage. Par conséquent il n'y a pas de
différence significative de la taille moyenne des individus d'H.
fasciatus entre l'amont et l'aval du barrage (Tableau 6A, Student, p =
0,97 > 0,05). Les classes de tailles observées au mois de mai
dans la partie amont du barrage (150<160 mm à Maka amont et
130<140 mm à Diana Malary) sont largement inférieures à
celles rencontrées en octobre et en février. Pour ces deux
derniers mois, elles varient globalement de 160 mm à 180 mm sans grande
différence entre eux, Annexe III. Le test de Student montre une
différence très significative de la taille des individus entre
octobre et mai (Tableau 6B, p = 0,003 < 0,05). Les tailles moyennes
diffèrent également significativement entre février et mai
(p = 0,015 < 0,05). Par contre aucune différence
significative n'a été notée entre le mois d'octobre et
celui de février (p = 0,156 > 0,05).
33
Tableau 7 : Ethmalosa fimbriata : Tailles
minimales (Min), moyennes (Moy) et maximales (Max) des individus
mesurées par station (A) et par mois (B) et résultats du test de
Student. n : nombre d'individus mesurés, E-t : écart type, p :
probabilité.
La même lettre écrite devant les mois
signifie que les moyennes de tailles ne diffèrent pas significativement
entre ces mois. Les lettres différentes signifient qu'il existe une
différence significative entre les mois.
A
|
Longueur à la fourche (mm)
|
Stations
|
n
|
Min
|
Max
|
Moy
|
E-t
|
Test (Student)
|
Sakar
|
172
|
99
|
160
|
115
|
24
|
p = 0.00
|
Maka aval
|
150
|
55
|
143
|
113
|
25
|
|
13
|
57
|
65
|
61
|
3
|
|
B
|
Longueur à la fourche (mm)
|
Mois
|
n
|
Min
|
Max
|
Moy
|
E-t
|
Test (Student)
|
octobre
|
176
|
55
|
144
|
106
|
25
|
a
b
c
|
février
|
161
|
79
|
160
|
130
|
15
|
|
94
|
57
|
160
|
97
|
22
|
|
Tableau 8 : Elops lacerta : Tailles
minimales (Min), moyennes (Moy) et maximales (Max) des individus
mesurées par station (A) et par mois (B) et résultats du test de
Student. n : nombre d'individus mesurés, E-t : écart type, p :
probabilité.
La même lettre écrite devant les mois
signifie que les moyennes de tailles ne diffèrent pas significativement
entre ces mois. Les lettres différentes signifient qu'il existe une
différence significative entre les mois.
A
|
Longueur à la fourche (mm)
|
Stations
|
n
|
Min
|
Max
|
Moy
|
E-t
|
Test (Student)
|
Sakar
|
185
|
100
|
228
|
145
|
28
|
p = 0.0000
|
Maka aval
|
294
|
84
|
230
|
150
|
30
|
|
B
|
Longueur à la fourche (mm)
|
Mois
|
n
|
Min
|
Max
|
Moy
|
E-t
|
Test (Student)
|
octobre
|
75
|
84
|
230
|
146
|
33
|
a
b
ac
|
février
|
66
|
90
|
228
|
130
|
32
|
|
338
|
102
|
228
|
147
|
25
|
|
34
III.2.4- Ethmalosa fimbriata
Pour E. fimbriata, aucun individu n'a
été capturé en amont du barrage en octobre et en
février. Les captures qui ont eu lieu au mois de mai résultent
probablement de la destruction des vannes du barrage. Pour cette raison, il n'y
aura pas de comparaison entre populations d'amont et d'aval du barrage.
Néanmoins, nous pouvons étudier l'évolution de la taille
d'E. fimbriata entre la station de Sakar et celle de Maka aval, mais
également leurs variations temporelles. La taille des ethmaloses
diffère très significativement entre Sakar et Maka aval (Tableau
7A, p = 0,00 < 0,05). La station de Diana Malary n'est pas prise
dans ce test car les ethmaloses y ont été capturés
uniquement en mai. La taille moyenne des individus décroît de
Sakar (115 #177; 24 mm) à Diana Malary (61 #177; 3 mm, mois de mai) en
passant par Maka aval où une moyenne intermédiaire (113 #177; 25
mm) entre ces deux stations a été trouvée (Tableau 7A).
Les tailles moyennes des ethmaloses diffèrent significativement en
fonction des mois (p < 0,05). Elle est plus élevée en
février (130 #177; 15 mm) que durant les mois d'octobre (106 #177; 25
mm) et de mai, mois pendant lequel la plus faible moyenne (97 #177; 22 mm) a
été trouvée Tableau 7B.
III.2.5- Elops lacerta
Un seul individu d'E. lacerta, d'une taille
de 200 mm et 72 g de poids, a été capturé à Maka
amont en octobre. Sinon tout au cours de nos échantillonnages, aucun
individu de cette espèce n'a été capturé en amont
du barrage.
Le test de Student montre une différence
hautement significative de la taille moyenne des individus entre Sakar et Maka
aval (Tableau 8A, p = 0,000 < 0,05). Les individus les
plus fréquents à Sakar (120<140 mm) sont de petites classes de
tailles, comparés à ceux de Maka aval (140<160 mm), Annexe V.
Une différence très significative des tailles moyennes existe
également entre octobre et février (p = 0,004 < 0,05)
et entre février et mai (p = 0,000 < 0,05). Par contre
aucune différence significative n'est notée entre octobre et mai
(p = 0,53 > 0,05). La plus petite taille moyenne des individus a
été observée en février (130 #177; 32 mm), Tableau
8B.
35
Tableau 9 : Valeurs moyennes du facteur (Moy) de
condition chez Sarotherodon melanotheron heudelotii en fonction des
stations et des mois et résultats du test de Student. E-t : écart
type, p =probabilité.
|
Mois
|
octobre
|
février
|
mai
|
Moy
|
E-t
|
Test (Student)
|
Stations
|
Nbre obs.
|
314
|
865
|
811
|
|
|
|
Sakar
|
207
|
2,06
|
2,03
|
1,98
|
2,08
|
0,18
|
amont/aval
p = 0,801185
|
Maka aval
|
217
|
1,98
|
2,12
|
1,88
|
2,05
|
0,18
|
|
187
|
2,11
|
2,17
|
1,92
|
2,04
|
0,19
|
|
200
|
2,13
|
2,08
|
1,96
|
2,02
|
0,21
|
|
|
2,10
|
2,10
|
1,93
|
|
|
|
|
0,14
|
0,19
|
0,20
|
|
|
|
|
Périodes p > 0,196940
|
|
Tableau 10 : Valeurs moyennes (Moy) du facteur de
condition chez Tilapia guineensis en fonction des stations et des mois
et résultats du test de Student. E-t : écart type, p
=probabilité.
|
Mois
|
octobre
|
février
|
mai
|
Moy
|
E-t
|
Test (Student)
|
Stations
|
Nbre obs
|
64
|
194
|
317
|
|
|
|
Sakar
|
156
|
1,71
|
1,90
|
1,96
|
1,95
|
0,17
|
aont/aval
= 0,95794
p = 0,957941
|
Maka aval
|
72
|
1,82
|
1,83
|
1,84
|
1,94
|
0,17
|
|
22
|
1,97
|
2,03
|
1,76
|
1,93
|
0,18
|
|
121
|
2,00
|
2,01
|
1,75
|
1,90
|
0,19
|
Périodes
p > 0,13900
|
Moy
|
|
1,93
|
1,95
|
1,85
|
|
|
|
|
0,20
|
0,18
|
0,19
|
|
|
|
Tableau 11 : Valeurs moyennes (Moy) du facteur de
condition chez Hemichromis fasciatus en fonction des stations et des
mois et résultats du test de Student. E-t : écart type, p
=probabilité.
|
Mois
|
octobre
|
février
|
mai
|
Moy
|
E-t
|
Test (Student)
|
Stations
|
Nbre obs
|
53
|
88
|
47
|
|
|
|
Maka aval
|
22
|
1,70
|
1,64
|
1,61
|
1,64
|
0,13
|
amont/aval
p = 0,098854
|
Maka amont
|
101
|
1,68
|
1,38
|
1,52
|
1,62
|
0,14
|
|
65
|
1,65
|
1,57
|
1,59
|
1,62
|
0,14
|
|
|
1,67
|
1,63
|
1,57
|
|
|
|
|
0,11
|
0,14
|
0,14
|
|
|
|
Périodes p > 0,678119
|
|
|
|
Tableau 12 : Valeurs moyennes (Moy) du facteur de
condition chez Ethmalosa fimbriata en fonction des stations et des
mois et résultats du test de Student. E-t : écart type, p
=probabilité.
|
Mois
|
octobre
|
février
|
mai
|
Moy
|
E-t
|
Test
|
Stations
|
Nbre obs
|
80
|
163
|
77
|
|
|
Sakar/M aval
p = 0,998 927
|
Sakar
|
142
|
1,62
|
1,48
|
1,43
|
1,46
|
0,16
|
|
148
|
1,43
|
1,31
|
1,43
|
1,44
|
0,15
|
|
13
|
|
|
1,21*
|
|
|
Périodes
p > 0,580585
|
Moy
|
|
1,50
|
1,45
|
1,43
|
|
|
|
|
0,16
|
0,15
|
0,14
|
|
|
|
* : Cette valeur n'est pas prise en compte dans le
calcul de la moyenne du K au mois de mai
36
III 3- Facteur de Condition (K)
III.3.1- Sarotherodon melanotheron heudelotii
Il n'y a pas de différence significative du
facteur de condition (K) ni entre l'amont et l'aval du barrage (Student, p
= 0,80 > 0,05) ni en fonction des mois d'échantillonnage
(Student, p = 0,197). Néanmoins la valeur moyenne de K est plus
faible en mai (K = 1,94 #177; 0,04) qu'en février (K = 2,10
#177; 0,19) et octobre (K = 2,10 #177; 0,14) Tableau
9.
III.3.2- Tilapia guineensis
Les valeurs moyennes et les écarts types du
facteur K au niveau des stations sont illustrées en fonction des mois
d'échantillonnage dans le Tableau 10.
Aucune différence significative n'est
révélée par le test de Student sur le facteur de condition
ni entre l'amont et l'aval du barrage (p = 0,96 > 0,05) ni en
fontion des mois d'échantillonnage (p = 0,139). Mais la valeur
moyenne de ce facteur reste plus faible au mois de mai (K = 1,85 #177; 0,19),
Tableau 10.
III.3.3- Hemichromis fasciatus
Il n'existe pas de différence significative du
facteur de condition ni entre l'amont et l'aval du barrage (p = 0,099 >
0,05) ni entre les mois d'échantillonnage (p = 0,68). La
valeur moyenne la plus faible du facteur K a été observée
au mois de mai (K = 1,57 #177; 0,14) Tableau 11.
III.3.4- Ethmalosa fimbriata
Les moyennes du facteur de condition ne
diffèrent pas significativement entre Sakar et Maka aval (p = 0,999
> 0,05). La moyenne de K est légèrement plus
élevée à Sakar (K = 1,46 #177; 0,16) qu'à
Maka aval (K = 1,44 #177; 0,15), Tableau 12. Il n'y a également
pas de différence significative du facteur K de l'ethmalose en fonction
des différents mois (p = 0,58).
La valeur moyenne de K a subi une réduction
progressive d'octobre (K = 1,50 #177; 0,16) à mai (K = 1,45
#177; 0,15) en passant par une valeur intermédiaire en
février (K = 1,43 #177; 0,14), Tableau 12.
37
Tableau 13 : Valeurs moyennes (Moy) du facteur de
condition chez Elops lacerta en fonction des stations et des mois et
résultats du test de Student. E-t : écart type, p
=probabilité.
|
Mois
|
octobre
|
février
|
mai
|
Moy
|
E-t
|
Test (Student)
|
Stations
|
Nbre obs
|
75
|
66
|
332
|
|
|
|
Sakar
|
145
|
0,96
|
0,81
|
0,78
|
0,82
|
0,16
|
Sakar/Maka
aval
p = 0,747730
|
Maka aval
|
187
|
0,83
|
0,93
|
0,76
|
0,79
|
0,08
|
|
|
0,85
|
0,88
|
0,76
|
|
|
|
|
0,27
|
0,09
|
0,07
|
|
|
|
Périodes p = 0,167369
|
|
|
|
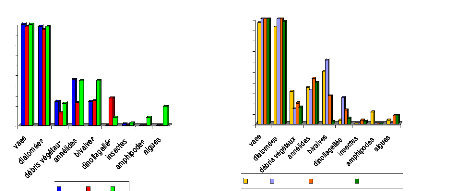
Sakar Maka aval Maka amont Diana Malary
octobre février mai
types de proies
occurences (%)
100
90
80
70
60
50
40
30
20
10
0
occurences (%)
a b
100
90
80
70
60
50
40
30
20
types de proies
10
0
Figure 9 : Histogrammes des occurrences moyennes de
proies de Sarotherodon melanotheron heudelotii suivant les mois (a) et
les stations (b).
38
III.3.5- Elops lacerta
Il n'existe pas de différence significative de
la moyenne du facteur K entre Sakar et Maka aval (p = 0,748 >
0,05). La moyenne trouvée à Maka aval est
légèrement inférieure à celle observée
à Sakar (K = 0,82 #177; 0,16), Tableau 13.
Aucune différence significative n'est
révélée par le test de Student sur le facteur de condition
d'Elops lacerta en fontion des mois (p = 0,167). La plus
grande valeur moyenne de ce facteur a été observée au mois
de février (K = 0,88 #177; 0,09). Elle a été plus
faible en mai (K = 0,76 #177; 0,07) avec une valeur moyenne
intermédiaire entre ces deux mois en février (K = 0,85 #177;
0,27), Tableau 13.
III 4- Régime alimentaire
Au total 449 contenus stomacaux ont été
analysés au cours de cette étude.
III.4.1- Sarotherodon melanotheron heudelotii
Au total 122 estomacs ont été
analysés. 6,6% de ces estomacs étaient vides. Les poissons
étudiés avaient des tailles comprises entre 70 mm et 224 mm. Nous
avons rencontré principalement de la vase et des diatomées
(occurrence : 100% en générale) dans les estomacs des individus
de S. m. heudelotii. Les détails des occurrences sont
présentés dans l'Annexe VII, où apparaissent des
proportions assez importantes d'oeufs de poissons et accessoirement des
gastéropodes, des isopodes et des écailles de poissons. Lors de
nos échantillonnages, quelques mâles ont été
capturés avec des oeufs de poissons dans leur estomac. Nous nous sommes
servis des occurrences les plus sensibles aux variations des conditions
environnementales pour élucider les variations spatio-temporelles du
régime alimentaire de cette espèce.
Ces résultats montrent une occurrence moyenne
importante des bivalves (44,4%) et des dinoflagellés (27,5 %)
respectivement en mai et février-mai. Une nouvelle apparition dans les
estomacs de cette espèce d'amphipodes et d'algues au mois de mai a
été également notée (figure 9a).
Les occurrences moyennes varient également en
fonction des stations. Par rapport aux autres stations, à Sakar (station
la plus salée) une réduction des pourcentages de vase et des
diatomées a été observée au détriment des
débris végétaux (30,8%). Les bivalves ont
été largement plus fréquents dans les estomacs des
individus des stations aval que dans ceux des stations amont du barrage. Des
amphipodes (11,5%) étaient présents dans les estomacs
à
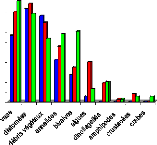
occurences (%) occurences (%)
a
b
100 90 80 70 60 50 40 30 20 10 0
100 90 80 70 60 50 40 30 20 10 0
types de proies
octobre février mai
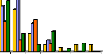
Sakar Maka aval Maka amont Diana Malary
types de proies
39
Figure 10 : Histogrammes des occurrences moyennes de
proies de Tilapia guineensis suivant les mois (a) et les stations
(b).
40
Sakar, par contre ils étaient absents dans ceux
des autres stations (figure 9b). Les algues étaient uniquement
présentes dans les estomacs des individus capturés au niveau des
stations amont du barrage (Maka amont et Diana Malary).
L'ACP des occurrences de proies chez S. m.
heudelotii montre que son régime trophique varie très peu en
fonction du temps et de l'espace. Un détachement de deux points, l'un en
octobre à Maka aval et l'autre en mai à Sakar correspondent
respectivement aux gastéropodes et aux amphipodes. Mais leurs
fréquences d'occurrence sont très faibles. Ces items ne sont donc
pas très représentatifs pour discriminer une variabilité
alimentaire de S. m. heudelotii (Annexe IX).
III.4.2- Tilapia guineensis
119 estomacs de T. guineensis, de tailles
comprises entre 67 et 265 mm, ont été analysés dans cette
étude. Parmi ces estomacs, seulement deux (1,7%) étaient vides.
Les proies rencontrées dans les estomacs de cette espèce sont
constituées essentiellement de débris végétaux et
de diatomées (près de 100%). Des écailles de poissons ont
aussi été trouvées dans ces estomacs. Les détails
des occurrences sont présentés dans l'Annexe VII.
Les occurrences de vase, de bivalves, et d'algues
augmentent progressivement d'octobre à mai avec des valeurs
intermédiaires en février. Les oeufs de poissons ont
également pris de l'importance (50% à Diana Malary, Annexe VII)
dans les estomacs remplis des individus en mai. Contrairement à ce qui a
été observé chez S. m. heudelotii, il y a une
augmentation des pourcentages de vase d'octobre à mai au
détriment des occurrences des débris végétaux qui
diminuent. Il y a également une nouvelle apparition dans les estomacs de
T. guineensis de dinoflagellés, d'amphipodes, des
crustacés (février, mai) et de crabes (mai), figure
10a.
Les occurrences les plus élevées de
vase, d'annélides et de bivalves sont enregistrées dans les
stations aval du barrage. Une réduction des occurrences des
débris végétaux est accompagnée d'une augmentation
des celles de la vase en aval du barrage (figure 10b). L'inverse est
observé en amont du barrage. Des amphipodes, des crustacés et des
crabes ont été observés dans les estomacs à Sakar
et Diana Malary.
Les résultats obtenus par l'ACP (Annexe IX)
montrent que T. guineensis et S. m. heudelotii ont des
spectres trophiques qui se recoupent. Mais celle de T. guineensis est
plus large. Pour ce dernier les amphipodes, les crabes et les crustacés
caractérisent le bol alimentaire des individus
échantillonnés en mai et les dinoflagellés et les insectes
celui de
Tableau 14 : Occurrences (en %) des espèces de
poissons proies d'Hemichromis fasciatus en fonction des mois et des
stations.
Mois
|
Stations
|
Estomacs
remplis (%)
|
Estomacs
vides (%)
|
SME (%)
|
TGU (%)
|
Mugil (%)
|
octobre
|
Diana Malary
|
100
|
0
|
15
|
0
|
0
|
février
|
Maka amont
|
100
|
0
|
20
|
0
|
0
|
|
90
|
10
|
11
|
0
|
0
|
mai
|
Maka aval
|
100
|
0
|
11
|
0
|
9
|
|
90
|
10
|
44
|
33
|
0
|
|
90
|
10
|
56
|
11
|
0
|
|
occurences (%)
100
90
80
70
60
50
40
30
20
10
0
types de proies
octobre février mai
41
Figure 11: Histogramme des occurrences moyennes de proies
d'Ethmalosa fimbriata en fonction des mois
d'échantillonnage.
42
février à Sakar. A Maka aval au mois de
mai, la vase et les bivalves abondent dans les estomacs des spécimens.
En février, dans les stations de Maka amont et de Diana Malary, les
prises alimentaires des individus capturés étaient pour
l'essentielle constituées de débris végétaux,
d'annélides, d'ostracodes et de copépodes. En octobre les oeufs
de poissons étaient présents dans le bol alimentaire de cette
espèce.
III.4.3- Hemichromis fasciatus
H. fasciatus était peu
représenté à Maka aval et pratiquement absent à
Sakar au cours nos échantillonnages. 84 estomacs d'H.
fasciatus, de tailles comprises entre 93 et 215 mm, ont été
analysés lors de cette étude. Cinq estomacs (5,9%) étaient
vides. L'étude des contenus stomacaux ne montre pas de variation nette
du régime trophique de cette espèce dans le temps et dans
l'espace. Nous avions trouvé principalement dans les estomacs des
individus d'H. fasciatus des larves et des juvéniles de
poissons (généralement 100% d'occurrence) durant les trois
périodes d'échantillonnage dans l'ensemble des stations où
cette espèce a été échantillonnée. Les
proies rencontrées dans les estomacs d'H. fasciatus comprennent
également des proportions assez importantes d'oeufs de poissons
(jusqu'à 80% en février en amont) et accessoirement des
crustacés, des isopodes, des insectes (Annexe VIII).
Les espèces de poisons rencontrées dans
les estomacs sont composées principalement de juvéniles de S.
m. heudelotii, mais également au mois de mai de T. guineensis
(en amont du barrage) et même de Mugil (Maka aval), Tableau
14.
Aucune tendance temporelle et spatiale ne se dessine
suite à l'analyse factorielle (ACP) des occurrences de proies d'H.
fasciatus (Annexe IX).
III.4.4- Ethmalosa fimbriata
Parmi les 66 estomacs d'E. fimbriata
examinés, 63 (95,5%) étaient remplis et seulement 3
étaient vides, soit 4,5%. Les spécimens avaient des tailles
allant de 55 mm à 160 mm. Tous les inventaires stomacaux
révèlent du sable ou de la vase mais également des
diatomées et des copépodes. Des écailles ont
été également trouvées dans les estomacs. Les
détails sur les occurrences sont illustrés dans l'Annexe
VIII.
Les occurrences moyennes de vase, de diatomées,
de débris végétaux et de bivalves ont été
plus élevées en octobre et en février qu'au mois de mai.
Par contre les isopodes ont été rencontrés dans ces
estomacs uniquement en octobre. A l'inverse les ostracodes, les algues et les
dinoflagellés ont été rencontrés dans les estomacs
des spécimens examinés seulement au
43
Tableau 15 : Occurrences (en %) des espèces de
poissons proies d'Elops lacerta en fonction des mois et des
stations.
Mois
|
Stations
|
Estomacs
remplis (%)
|
Estomacs
vides (%)
|
ELA (%)
|
EFI (%)
|
SME (%)
|
TGU (%)
|
octobre
|
Maka aval
|
88
|
12
|
9
|
18
|
9
|
0
|
février
|
Sakar
|
100
|
0
|
20
|
0
|
20
|
0
|
|
100
|
0
|
78
|
0
|
44
|
0
|
mai
|
Sakar
|
40
|
60
|
0
|
0
|
0
|
25
|
|
80
|
20
|
13
|
13
|
0
|
0
|
|
Tableau 16 : Nombre de femelles de stade 4
capturées en fonction des stations et des mois pour chaque
espèce.
|
Nombre de femelles de stade 4
|
Stations
|
Périodes
|
SME
|
TGU
|
RFA
|
EFI
|
ELA
|
Sakar
|
octobre
|
-
|
-
|
-
|
-
|
-
|
|
37
|
8
|
-
|
41
|
-
|
|
8
|
12
|
4
|
-
|
-
|
Maka aval
|
octobre
|
3
|
-
|
2
|
-
|
-
|
|
33
|
1
|
-
|
-
|
-
|
|
37
|
14
|
-
|
-
|
-
|
Maka amont
|
octobre
|
-
|
-
|
-
|
-
|
-
|
|
15
|
1
|
3
|
-
|
-
|
|
37
|
4
|
-
|
-
|
-
|
Diana Malary
|
octobre
|
3
|
2
|
-
|
-
|
-
|
|
52
|
4
|
-
|
-
|
-
|
|
20
|
9
|
2
|
-
|
-
|
|
44
mois de mai. Les crustacés et les
copépodes ont été plus fréquents en février
comparés aux autres mois (figure 11).
Dans l'ACP considérant les proies composant le
bol alimentaire d'E. fimbriata, le régime alimentaire des
individus capturés au mois de mai à Sakar est discriminé
par les dinoflagellés qui se détachent de l'origine. Les
copépodes, les isopodes, les crustacés et les algues discriminent
le régime trophique des spécimens capturés en
février en aval du barrage (Sakar et Maka aval). D'autres points
correspondant aux débris végétaux, aux diatomées,
à la vase et aux ostracodes forment un nuage proche de l'origine
dénotant une certaine homogénéité spatio-temporelle
au niveau des proies d'E. fimbriata. L'ACP révèle
plutôt une tendance saisonnière du régime alimentaire de
l'ethmalose (Annexe IX).
III.4.5- Elops lacerta
E. lacerta était pratiquement absent
en amont du barrage au cours de nos échantillonnages. Au total 58
estomacs ont été analysés dont 11 (19%) étaient
vides. Les poissons étudiés avaient des tailles comprises entre
84 mm et 230 mm.
Les résultats d'analyses des contenus
stomacaux de cette espèce ne révèlent pas de changements
spatio-temporels importants au niveau de ces proies. Les juvéniles de
poissons (100% d'occurrence) constituent l'essentielle des proies
rencontrées dans les estomacs d'E. lacerta. Néanmoins
quelques insectes (60% à Sakar), crustacés et isopodes ont
été trouvés dans les contenus stomacaux de cette
espèce en octobre (Annexe VIII). Tout comme H. fasciatus, ces
deux tilapias (S. m. heudelotii et T. guineensis) ont
été trouvés dans le bol alimentaire d'E. lacerta.
Mais les juvéniles d'E. fimbriata et d'E. lacerta
étaient aussi bien représentés dans les estomacs de
cette espèce (Tableau 15).
Tout comme H. fasciatus les résultats
de l'analyse factorielle (ACP) des occurrences de proies d'E. lacerta
ne révèlent aucune tendance temporelle et spatiale (Annexe
IX).
III.5- Reproduction
134 gonades d'espèces confondues (S. m.
heudelotii et T. guinennsis) ont été
prélevées au cours de cette étude. L'absence d'ethmaloses
(octobre et février) et d'E. lacerta (sauf en octobre) en amont
du barrage, ajoutée au faible nombre de femelles de stade 4 d'H.
fasciatus en amont et en aval du barrage au cours des différentes
périodes d'échantillonnage expliquent l'absence d'étude
comparative de la reproduction chez ces trois espèces, Tableau
16.
45
Fécondité relative moyenne (ovocytes/kg de
femelle)
0 2000 4000 6000 8000 10000 12000
Barrage
fevrier mai octobre
Diana Malary Maka amont Maka aval Sakar
Stations d'amont vers l'aval (salinite croissante)
Figure 12 : Courbes des fécondités
relatives moyennes des femelles de Sarotherodon melanotheron heudelotii
en fonction des stations et des mois d'échantillonnage.
Tableau 17 : Fécondité relative moyenne de
Sarotherodon melanotheron heudelotii en fonction des mois et des
stations et résultats du test de Student. Nb. obs : nombre
d'observation, Moy : moyenne.
Stations
|
Périodes
|
Nb obs
|
Moy
|
Ecart type
|
Moy
|
Test
(Student)
|
Sakar
|
octobre
|
-
|
-
|
-
|
6147#177;2344
|
amont/aval
p = 0,019308
|
|
10
|
6867
|
2194
|
|
6
|
7695
|
2248
|
|
octobre
|
3
|
4973
|
1142
|
|
10
|
6088
|
947
|
|
10
|
8137
|
1251
|
|
octobre
|
-
|
-
|
-
|
5442#177;3310
|
février/mai
p = 0,004577
|
|
10
|
3079
|
633
|
|
10
|
6911
|
3581
|
|
octobre
|
3
|
3806
|
813
|
|
10
|
2907
|
368
|
|
10
|
9363
|
1975
|
|
46
En ce qui conserne S. m. heudelotii et T.
guineensis, la fécondité relative, le diamètre
ovocytaire, la taille de première maturité (L50) et le
Rapport gonado-somatique (RGS) des femelles de stade 4 seront
analysés.
III.5.1- Sarotherodon melanotheron heudelotii
III.5.1.1- Fécondité relative
Une fécondité relative moyenne de 6172
#177; 2808 ovocytes/kg de femelle a été trouvée chez
S. m. heudelotii dans cette partie de l'estuaire de la Casamance au
cours de cette étude.
Ce paramètre varie en fonction des mois
d'échantillonnage. Les fécondités relatives moyennes des
femelles capturées au cours du mois de mai étaient plus
élevées que celles observées en février sur toutes
les stations. En raison de l'insuffisance des données disponibles en
octobre, ce mois n'a pas été pris en compte dans la comparaison
de la fécondité relative (figure 12).
Il existe une différence très
significative de la fécondité relative moyenne entre
février et mai (Tableau 17, Student p = 0,005 < 0,05). Une
différence significative n'a pas été notée entre
février et mai à Sakar (p = 0,878 > 0,05). Par contre
il existe une différence hautement significative entre ces deux mois
à Diana Malary (p = 0,000 < 0,05), figure 12.
Il existe une différence significative de la
fécondité relative moyenne entre l'amont et l'aval du barrage
(Student, p = 0,019 < 0,05). La fécondité relative
moyenne est plus forte en aval (6147 #177; 2344 ovocytes/kg de femelle) qu'en
amont (5442 #177; 3310 ovocytes/kg de femelle) du barrage Tableau 17.
Contrairement à Maka amont, une forte fécondité relative
moyenne a été notée dans la station de Diana Malary au
mois de mai (figure 12).
III.5.1.2- Diamètres ovocytaires
Le diamètre ovocytaire moyen de S. m.
heudelotii dans cette partie de l'estuaire de la Casamance est de 1,7
#177; 0,27 mm.
La moyenne des diamètres ovocytaires
trouvée en aval du barrage (1,5 #177; 0,14 mm) est inférieure
à celle observée dans les stations amont du barrage (1,8 #177;
0,23 mm) quelle que soit la période d'échantillonnage. Les
moyennes des diamètres ovocytaires sont très proches d'une part
entre Sakar et Maka aval et d'autre part entre Maka amont et Diana Malary
(Tableau 18, figure 13). Les plus gros ovocytes ont été
observés à Diana Malary en octobre et en février (2,1
#177; 0,27 mm et 1,9 #177; 0,22 mm respectivement). En mai, une faible chute de
la moyenne des diamètres ovocytaires a été notée
dans cette station (1,6 #177; 0,14 mm) par rapport à Maka
47
Diamètre ovocytaire moyen (mm)
1.0 1.5 2.0 2.5 3.0
fevrier mai octobre
Barrage
Diana Malary Maka amont Maka aval Sakar
Stations d'amont vers l'aval (salinite croissante)
Figure 13 : Courbes d'évolution du
diamètre ovocytaire des femelles de Sarotherodon melanotheron
heudelotii en fonction des stations et des mois
d'échantillonnage.
Tableau 18 : Diamètres ovocytaires moyens de
Sarotherodon melanotheron heudelotii en fonction des mois et des
stations et résultats du test de Student. DO : diamètres
ovocytaires, Nb. obs : nombre d'observation, Moy : moyenne.
Stations
|
Périodes
|
Nb obs
|
DO.min (mm)
|
DO.max (mm)
|
DO.moy (mm)
|
Ecart type
|
Moy
|
Test
(Student)
|
Sakar
|
octobre
|
-
|
-
|
-
|
-
|
-
|
15#177;014
, ,
|
amont/aval
p = 0,975460
|
|
499
|
1,3
|
1,7
|
1,4
|
0,14
|
|
312
|
1,4
|
1,6
|
1,5
|
0,08
|
|
octobre
|
161
|
1,5
|
1,9
|
1,7
|
0,18
|
|
522
|
1,2
|
1,7
|
1,5
|
0,15
|
|
510
|
1,4
|
1,7
|
1,5
|
0,11
|
|
octobre
|
-
|
-
|
-
|
-
|
-
|
18#177;023
, ,
|
périodes
p = 0,176310
|
|
500
|
1,5
|
2,1
|
1,9
|
0,24
|
|
514
|
1,5
|
2,0
|
1,8
|
0,17
|
|
octobre
|
183
|
1,9
|
2,4
|
2,1
|
0,27
|
|
|
500
1,5
|
2,3
|
1,9
|
0,22
|
|
510
|
1,3
|
1,7
|
1,6
|
0,14
|
|
48
amont (1,8 #177; 0,17 mm) Tableau 18. Les valeurs
maximales des diamètres ovocytaires observées en aval sont
inférieures à celles trouvées en amont du barrage. Une
légère baisse de la valeur maximale a été
notée au mois de mai (1,7 mm) par rapport à février (2,3
mm) et octobre (2,4 mm) dans la station de Diana Malary, Tableau
18.
Le test de Student ne montre pas de différence
significative du diamètre ovocytaire moyen entre l'amont et l'aval du
barrage (Tableau 18, p = 0,975 > 0.05).
La moyenne des diamètres ovocytaires varie
également en fonction des mois. Celle qui a été
observée au mois d'octobre à Diana Malary (2,1 #177; 0,27 mm) est
de loin supérieure à celles observées durant les autres
mois quelle que soit la station considérer. En amont du barrage, la plus
faible moyenne observée (1,6 #177; 0,14 mm) correspond à cellle
du mois de de mai. (Tableau 18).
De la même manière le diamètre
ovocytaire maximal subit une réduction progressive d'octobre (2,4 mm)
à mai (2,0 mm) en passant par une valeur intermédiaire en
février (2,3 mm) Annexe VI.
Il n'y a pas de différence significative de la
moyenne du diamètre des ovocytes entre les périodes
d'échantillonnage (Tableau 18, p = 0,176).
III.5.1.3- Taille de première maturité
sexuelle (L50)
Nous nous sommes limités à la
L50 des femelles à cause des faibles proportions de
mâles matures capturés au cours de nos
échantillonnages.
La taille de première maturité
(L50) de S. m. heudelotii globalement
déterminée dans cette partie de l'estuaire de la Casamance au
cours de cette étude est de 139 mm.
La taille de première maturité sexuelle
(L50) obtenue en mai (132 mm) était plus faible que celle
trouvée en octobre (152 mm). En février une L50
intermédiaire entre ces deux mois (140 mm) a été
déterminée figure 14a. De la même manière que la
L50, la taille du plus petit individu mature (PPIM) a subi une
réduction graduelle d'octobre (118 mm) à mai (90 mm) avec une
taille intermédiaire entre ces deux mois en février (101 mm)
Annexe VI.
La taille de première maturité sexuelle
(L50) des femelles matures de Sarotherodon melanotheron
heudelotii a également variée entre l'amont et l'aval du
barrage. En amont une taille de première maturité de 130 mm a
été trouvée. Par contre en aval du barrage la
L50 de cette espèce était de 138 mm. La L50
de cette espèce déterminée à Diana Malary au mois
de
49
mai était très faible (106 mm) figure
14b. La taille du PPIM est plus faible dans la partie amont (90 mm) qu'en aval
du barrage (101 mm) Annexe VI.
III.5.1.4- Rapport gonado-somatique (RGS)
Le test de Student ne montre aucune différence
significative du rapport gonado-somatique (RGS) des femelles de stade 4 entre
les mois d'échantillonnage (Tableau 19, p = 0,124). Il n'existe
également pas de différence significative du RGS entre l'amont et
l'aval du barrage (p = 0,966). La plus forte moyenne du RGS correspond
au mois de mai (6,2 #177; 1,76) et la plus faible en octobre (4,7 #177; 0,46)
avec une valeur intermédiaire en février (5,1 #177; 0,96) Tableau
19.
a
fréquences cumulées (%)
100
50
0
Classes de tailles (mm)
Fréquences cumulées (%)
100
b
aval amont
50
0
octobre février mai
50
Classes de tailles (mm)
Figure 14 : Détermination par méthode
graphique de la taille de première maturité sexuelle
(L50) des femelles matures de Sarotherodon melanotheron
heudelotii par intervalle de 10 mm en fonction des mois (a) et en amont et
en aval du barrage (b)
51
III.5.2- Tilapia guineensis
III.5.2.1- Fécondité relative
La fécondité relative moyenne de T.
guineensis trouvée dans cette partie de l'estuaire est de 66379
#177; 28564 ovocytes/kg de femelle.
Pour cette espèce, seule une femelle de stade
4 a été capturée à Maka aval de même
qu'à Maka amont en février. Néanmoins une variation de la
fécondité relative moyenne des femelles de T. guineensis
en fonction du temps a été observée. Cette tendance
est confirmée par les fécondités trouvées à
Sakar et à Diana Malary où nous avions pris plus de femelles de
stade 4 au cours de ce mois. La plus forte fécondité relative a
été rencontrée durant le mois de mai dans la station de
Maka aval (98208 #177; 27295 ovocytes/kg de femelle). Par contre la plus faible
a été trouvée à Diana Malary en février
(36067 #177; 3445 ovocytes/kg de femelle), Tableau 20, figure 15.
Le test de Student montre une différence
hautement significative de la fécondité relative entre
février et mai (Tableau 20, p = 0,0005 < 0,05). La
plus forte fécondité relative a été notée au
mois de mai (77885 #177; 29369 ovocytes /kg de femelle) Tableau
20.
Il n'existe pas de différence significative de
la fécondité relative entre l'amont et l'aval du barrage (p =
0,069 > 0 ,05). Mais la fécondité relative moyenne de
T. guineensis a été plus forte en aval (72166 #177;
30185 ovocytes /kg de femelle) qu'en amont du barrage (57119#177;23596
ovocytes/kg de femelle) Tableau 20.
III.5.2.2-.Diamètres ovocytaires
Un diamètre ovocytaire moyen de 0,9 #177; 0,13
mm a été trouvée chez T. guineensis au cours de
cette étude.
En raison du nombre faible de femelles de stade 4
capturées en octobre, ce mois n'a pas été pris en compte
dans le test statistique. Le test de Student ne révèle pas de
différence significative du diamètre ovocytaire de T.
guineensis entre février et mai (p = 0,511 > 0,05).
Néanmoins les plus gros ovocytes ont été trouvés
durant le mois de février (1,0 #177; 0,11 mm) comparés à
ceux de mai (0,9 #177; 0,14 mm) et d'octobre (0,9 #177; 0,07 mm) Tableau 21.
Mais il est nécessaire de tenir en compte les différences des
proportions des femelles de stade 4 entre ces mois.
Le diamètre moyen des ovocytes de T.
guineensis ne diffère également pas de façon
significative entre l'amont et l'aval du barrage (Student, p = 0,766 >
0,05) Tableau 21.
52
Tableau 19 : Rapport gonado-somatique (RGS) des
femelles de stade 4 de Sarotherodon melanotheron heudelotii en
fonction des mois et des stations et résultats du test de Student. Nb.
obs : nombre d'observation, Moy : moyenne.
Stations
|
Périodes
|
Nb obs
|
RGS.moy (mm)
|
Ecart
type
|
Moy
|
Test (Student)
|
Sakar
|
octobre
|
-
|
-
|
-
|
5,5 #177; 1,3
|
amont/aval
p = 0,965542
|
|
10
|
5,5
|
1,1
|
|
6
|
5,4
|
0,9
|
|
octobre
|
3
|
4,8
|
0,6
|
|
17
|
5,2
|
0,9
|
|
12
|
6,3
|
2
|
|
octobre
|
-
|
-
|
-
|
5,6 #177; 1,6
|
périodes
p = 0,123520
|
|
10
|
4,4
|
0,6
|
|
10
|
6,3
|
1,9
|
|
octobre
|
3
|
4,6
|
0,4
|
|
10
|
5,2
|
1
|
|
13
|
6,4
|
1,8
|
|
Tableau 20 : Fécondités relatives moyennes
de Tilapia guineensis en fonction des mois et des stations et
résultats du test de Student. Nb. Obs : nombre d'observation, Moy :
moyenne.
Stations
|
Périodes
|
Nb obs
|
Moy
|
E-t
|
Moy
|
Test
(Student)
|
Sakar
|
octobre
|
2
|
57020
|
6350
|
72166 #177; 30185
-
|
amont/aval
p = 0,068951
|
|
8
|
51871
|
11022
|
|
10
|
74933
|
32648
|
|
octobre
|
1
|
42580
|
|
|
1
|
50792
|
-
|
|
10
|
98208
|
27295
|
|
octobre
|
4
|
-
|
-
|
57119 #177; 23596
129
|
février/mai
p = 0,000519
|
|
1
|
36810
|
|
|
|
68721
|
12642
|
|
octobre
|
2
|
39018
|
|
|
4
|
36067
|
3445
|
|
9
|
67598
|
26685
|
|
53
III.5.2.3-.Taille de première maturité
sexuelle (L50)
Durant nos échantillonnages, le nombre de
femelles matures (stade = 3) capturées était plus réduit
en octobre (6 femelles matures) qu'en février et mai. Néanmoins
nous avons pu déterminer la L50 de cette espèce
pendant ce mois.
La taille de première maturité
(L50) déterminée globalement chez T. guineensis
dans cette partie de l'estuaire au cours de notre étude est de 125
mm.
La L50 de T. guineensis varie en
fonction des mois d'échantillonnage. La plus faible taille de
première maturité a été trouvée pendant le
mois de mai (115 mm). Par contre la L50 la plus élevée
a été déterminée en octobre (135 mm). Au mois de
février une taille de première maturité sexuelle
intermédiaire entre octobre et mai a été trouvée
(126 mm) figure 16a. La L50 de T. guineensis varie très peu
entre l'amont (129 mm) et l'aval (131 mm) du barrage figure 16b. La
détermination de la L50 à Diana Malary en mai a abouti
à une taille très faible (117 mm) par rapport à celles
trouvées à Maka aval (120 mm), Sakar (125 mm) et Maka amont (130
mm).
Le PPIM a une plus petite taille en mai (94 mm) qu'en
octobre (123 mm) et février (125 mm). La taille du plus petit individu
mature est plus faible en aval (94 mm) qu'amont du barrage (102 mm) Annexe
VI.
III.5.2.4-.Rapport gonado-somatique (RGS)
Il n'existe pas de différence significative du
RGS des femelles de stade 4 entre les mois d'échantillonnage (Student,
Tableau 22 p = 0,257). Le RGS des femelles de stade 4 est plus
élevé en mai (9,3 #177; 3,1) qu'en février (7,2 #177; 2,2)
et octobre (5,6 #177; 0,7) où des valeurs intermédiaires et
minimales de ce paramètre ont été respectivement
trouvées (Tableau 22).
Le RGS ne diffère pas significativement entre
l'amont et l'aval du barrage (Student, Tableau 22, p = 0,970 >
0,05).
Les valeurs du RGS de T. guineensis
observées en aval du barrage (9,1 #177; 3,2) sont plus
élevées que celles d'amont (7,3 #177; 2,4) Tableau
22.
0 20000 40000 60000 80000 120000
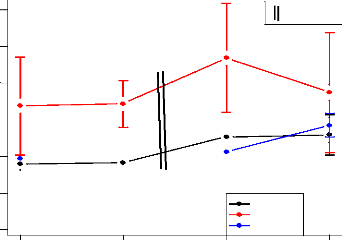
fevrier mai octobre
Barrage
Fecondite relative moyenne(ovocytes/kg de femelle)
54
Diana Malary Maka amont Maka aval Sakar
Stations d'amont vers l'aval (salinite croissante)
Figure 15 : Courbes des fécondités
relatives des femelles de Tilapia guineensis en fonction des stations
et des mois d'échantillonnage.
55
Fréquences cumulées (%)
100
50
0
a

octobre février mai
III.6- Parasites branchiaux
En raison de l'indisponibilité des
résultats sur les parasites des autres espèces, seule l'infection
parasitaire de S. m. heudelotii a été
étudiée.
Les résultats sur les parasites ont
été obtenus suite à une collaboration avec Arfang Diamanka
qui a analysé les parasites sur des prélèvements de
branchies que nous avions effectués.
Les variations des ectoparasites branchiaux chez
S. m. heudelotii suivant le gradient de salinité sur la
Casamance sont représentées sur la figure 17. En ce qui concerne
les parasites nous avons pris en considération le facteur
salinité. Le degré d'infection parasitaire de S. m.
heudelotii est étudié sur l'ensemble des individus
échantillonnés indépendamment des stations et des
mois.
Les résultats obtenus sur l'infection
parasitaire de cette espèce, montrent un faible effectif des parasites
de cette espèce à la salinité 0. Le maximum
d'ectoparasites est observé chez S. m. heudelotii au environ de
la salinité 5. Au-delà de 30 les individus ne sont plus
infectés par les parasites.
IV Discussion :
IV.1- Paramètres environnementaux
Plusieurs auteurs se sont intéressés
à l'évolution de la salinité dans l'estuaire de la
Casamance (Albaret, 1984, 1987 ; Pages & Debenay, 1987 ; Bassel, 1993 ;
Pandaré et al., 1997). Les variations de la salinité au
niveau des différentes stations étudiées sont d'ordre
temporel (d'un mois à un autre) et spatial (d'aval en amont). Tous les
prélèvements effectués révélent que la
salinité à Sakar est restée supérieure à
celle enregistrée à Maka aval. Ces auteurs ont montré au
cours de leurs études une tendance à la sursalinisation de
l'estuaire de l'estuaire avec un gradient de salinité positif d'aval en
amont.
Les variations spatio-temporelles observées,
peuvent s'expliquer par l'influence marine dont la zone aval du barrage est
soumise et par l'obstacle que constitue le barrage au passage de l'eau
salée vers l'amont. Mais elles sont également liées au
phénomène d'évaporation croissante avec l'avancée
de la saison sèche. Ces résultats ont légèrement
varié par rapport aux salinités enregistrées en 2005 en
amont et en aval du barrage (Tableau 2). Ces variations sont liées aux
phénomènes combinés d'ouverture et de dégradation
des vannes dont le barrage
Classes de tailles (mm)
Fréquences cumulées (%)
100
50
0
b

aval amont
Classes de tailles (mm)
56
Figure 16 : Détermination par la méthode
graphique de la taille de première maturité sexuelle
(L50) des femelles matures de Tilapia guineensis par
intervalle de 10 mm en fonction des mois (a) et en amont et en aval du barrage
(b).
57
a fait objet durant cette étude. Mais elles
sont également influencées par une invasion marine plus
importante à Sakar qu'en 2005.
Les salinités enregistrées en amont du
barrage au mois de mai sont dues à la pénétration d'eau
salée dans la partie amont suite à la dégradation
avancée des écluses du barrage.
Les températures sont plus
élevées en octobre et en mai qu'en février, Ce
résultat trouve sa logique car ces deux mois sont situés
respectivement en fin d'été et en fin de saison sèche
(périodes de fortes températures). La légère baisse
des températures notée au pied amont du barrage peut être
liée à l'effet des courants d'eaux salées qui passaient
à travers les vannes et se déversaient dans cette partie du
barrage, car ces courants pourraient provoquer une remontée des eaux
profondes plus fraîches. Par contre les températures plus
élevées à Diana Malary que dans les autres stations
étudiées s'expliquent par l'éloignement de cette station
par rapport au barrage qui constitue de plus un obstacle au passage de ces
courants marins.
IV.2- Distribution des tailles
IV.2.1- Les tilapias
Les tilapias se caractérisent
généralement par une large tolérance à la
salinité. Cette capacité d'adaptation aux eaux saumâtres ou
marines est modulée par les facteurs environnementaux (Prunet &
Bornancin, 1989).
L'aptitude des tilapias à développer
certains mécanismes physiologiques leur permet de survivre après
transfert d'eau douce en eau de mer ou en eau saumâtre. Bien que les
tilapias soient des poissons euryhalins qui tolèrent une large gamme de
salinité, une telle aptitude varie suivant les espèces (Prunet
& Bornancin, 1989).
Les proportions de Tilapia guineensis dans
l'estuaire, révélées par nos échantillonnages,
restent largement en dessous de celles de S. m. heudelotii. Ces
résultats confirment ceux déjà observés par Albaret
(1987) qui évoque que Tilapia guineensis a une aire de
répartition comparable à celle de S. m. heudelotii, mais
il n'est jamais en aussi grand nombre.
L'absence de différence significative de la
taille moyenne des tilapias étudiés suggère une large
tolérence par ces espèces des variations des conditions
environnementales entre l'amont et l'aval du barrage. Des études ont
montré que ces espèces peuvent supporter de larges gammes de
salinité. Elles peuvent vivre et se reproduire à des
salinités allant de 0 à 90 (Albaret, 1987) et jusqu'à 110
pour l'espèce S. m. heudelotii (Gilles et al., 2004).
Cette dernière espèce se maintient dans des salinités de
130 dans le Saloum
58
Tableau 21 : Diamètres ovocytaires moyens de
Tilapia guineensis en fonction des mois et des stations et
résultats du test de Student. DO : diamètres ovocytaires, Nb. obs
: nombre d'observation, Moy : moyenne.
Stations
|
Périodes
|
Nb obs
|
Moy
|
E-t
|
Moy
|
Test
(Student)
|
Sakar
|
octobre
|
162
|
0,8
|
0,06
|
0,95 #177; 0,15
0,00
|
amont/aval
p = 0,766280
|
|
400
|
1,0
|
0,12
|
|
500
|
0,9
|
0,17
|
|
octobre
|
66
|
1
|
|
|
50
|
1,0
|
0,00
|
|
500
|
1
|
0,15
|
|
octobre
|
-
|
-
|
-
|
0,93 #177; 0,11
|
février/mai
p = 0,511385
|
|
49
|
1,2
|
0,00
|
|
200
|
0,9
|
0,04
|
|
octobre
|
191
|
0,9
|
0,04
|
|
200
|
1
|
0,06
|
|
447
|
0,9
|
0,11
|
|
Tableau 22 : Rapport gonado-somatique (RGS) des femelles
de stade 4 de Tilapia guineensis en fonction des mois et des stations
et résultats du test de Student.
Stations
|
Périodes
|
Nb obs
|
Moy
|
E-t
|
Moy
|
Test (Student)
|
Sakar
|
octobre
|
2
|
5,8
|
0,7
|
9,1#177;3,2
|
amont/aval
p = 0,970507
|
|
8
|
7,8
|
2,4
|
|
12
|
8,2
|
2,7
|
|
octobre
|
1
|
6,3
|
|
|
1
|
7,1
|
|
|
13
|
11,8
|
2,8
|
|
octobre
|
|
|
|
7,3#177;2,4
|
Périodes
p = 0,256557
|
|
1
|
7,9
|
|
|
4
|
8,5
|
3,1
|
|
octobre
|
2
|
5
|
0,5
|
|
4
|
5,9
|
1,7
|
|
9
|
7,8
|
2,3
|
|
59
(Laë & Vidy, comm. intern.). Ce fait serait
particulièrement influencé par le passage de l'eau salée
dans la partie amont du barrage au mois de mai qui était longtemps
dominé par des eaux douces. Ceci a entrainé une réduction
de la taille des individus en amont et en particulier à Diana Malary.
Cette situation est renforcée par l'effet de la forte température
enrégistrée dans cette station au mois de mai. Ces nouvelles
conditions augmenteraient la sensibilité des individus, qui ont
demeurée depuis longtemps dans cette station (en eau douce), à
l'augmentation de la salinité en particulier. Watanabe & Kuo (1985)
ont montré que la tolérance à la salinité peut
être augmentée par une exposition précoce du poisson
à la salinité. Si les populations de la station de Maka amont
sont épargnées de cet effet, c'est parce qu'elle était en
contact partielle avec la partie aval du barrage en octobre avec l'ouverture
des vannes. Mais cela peut s'expliquer également par la
différence de température entre Maka amont et Diana
Malary.
La différence significative existant entre les
mois avec des tailles moyennes faibles en mai combinée aux tailles
moyennes plus faibles en aval qu'en amont du barrage pourrait être
attribuée à l'augmentation spatio-temporelle de la
salinité. Une réduction des classes de tailles avec
l'augmentation de la salinité a été observée chez
Tilapia guineensis sur la Casamance (Pandaré et al.,
1997). A l'inverse les spécimens, de grandes tailles,
capturés en amont du barrage en conjonction avec ceux d'octobre seraient
une conséquence des faibles salinités qui y étaient
enregistrées. Cette réduction de la taille des individus de
tilapias que nous pouvons assimiler à une réduction de
croissance, vu la relation linéaire positive entre la tailles maximales
et la croissance (Lauzanne, 1978 ; Legendre & Albaret, 1991), est le
résultat d'une différence de croissance dont le facteur principal
impliqué serait la salinité. Ces résultats recoupent ceux
de Panfili et al, (2004b) qui ont observé une différence
de croissance entre les populations du Saloum et de la Gambie. Les tilapias
utiliseraient une part de l'énergie destinée à leur
croissance au profit du phénomène d'osmorégulation et du
déplacement. Boeuf & Payan (2001) rapportent que la salinité
est le facteur clé de contrôle de la croissance des poissons par
l'osmorégulation mais ils suggèrent une révision du
coût énergétique attribué à ce
phénomène. Des poissons élevés dans un milieu
isotonique possèdent le plus faible taux métabolique standard
comparés à d'autres placés en eau douce. Tandis que la
plus forte dépense énergétique affectée au
déplacement a été notée chez les individus
placés en eau salée (in Boeuf& Payan,
2001).
60
Nombre de parasites1hémibranchie

Salinité
Figure 17 : Evolution des parasites branchiaux chez
Sarotherodon melanotheron heudelotii en fonction de la salinité
sur le fleuve Casamance.
Tableau 23 : Synthèse de différents
résultats sur les tailles maximales observées (TMO) chez trois
espèces.
En gras : nos résultats
Espèces
|
TMO
(mm)
|
TMO (mm)
|
Taille
d'un an
(mm)
|
Type de
longueur
|
Localisation
|
Références
|
Ethmalosa fimbriata
|
160
|
300
|
145
|
FL
|
Afrique
de l'Ouest
|
Charles-Dominique, 1982
|
Tilapia guineensis
|
265
|
315
|
165
|
FL
|
lagune
Ebrié
|
Legendre & Ecoutin 1991
|
Sarotherodon Melanotheron
|
258
|
334
|
180
|
FL
|
lagune
Ebrié
|
Legendre & Ecoutin, 1989
|
|
61
Les tailles maximales observées (TMO) dans
l'estuaire au cours de cette étude sont inférieures à
celles obtenues en lagune Ebrié par Legendre & Ecoutin (1989, 1991)
et dans d'autres lagunes ouest africaines (Charles-Dominique, 1982) Tableau 23.
Ceci suggère que les populations de poissons de la partie amont de
l'estuaire de la Casamance sont très stressées sous l'effet
particulier des fortes salinités qui y sont
enregistrées.
IV.2.2- Ethmalosa fimbriata
La réduction progressive de la taille des
ethmaloses de Sakar à Diana Malary pourrait traduire une migration
anadrome différentielle des classes d'âges d'aval en amont. Les
immatures pénétreraient plus en amont que les adultes dans
l'estuaire. Des résultats identiques ont été
trouvés par Albaret (1984) sur la Casamance et par Salzen (1958) sur
l'estuaire de Freetown. Albaret & Charles-Dominique (1982),
interprètent ce phénomène comme une stratégie
adaptative mise en oeuvre en réponse à la péjoration de
l'environnement. Mais les variations temporelles observées lors de cette
étude, avec des individus de plus grandes tailles en février
qu'en mai et octobre, traduiraient plutôt une migration vers l'amont des
basses classes d'âges en octobre, qui sous la contrainte que constitue de
la digue à leur passage, restent en aval pour atteindre de grandes
tailles en février et même y reproduire (femelles matures
rencontrées). Les individus de petites tailles capturés en mai
seraient la progéniture de ces femelles matures qui regagneraient les
milieux paraliques. Des observations identiques ont été faites
sur les ethmaloses de la lagune Ebrié par Gerlotto (1979).
Néanmoins l'existence de différence significative de la taille
des individus entre les mois avec de très petites tailles en mai
suggère un effet de la salinité sur la variation des classes de
tailles observée. De plus les très petites tailles des individus
à Diana Malary pourraient constituer une réponse au stress de
salinité et de température. Des auteurs ont évoqué
que l'ethmalose serait sensible à la péjoration de son
environnement (nanisme ou maturation précoce, Albaret &
Charles-Dominique, 1982).
IV.2.3- Elops lacerta
Malgré la différence significative
trouvée sur les tailles d'Elops lacerta entre Sakar et Maka
aval, les individus capturés sont immatures. Cette différence
spatio-temporelle s'expliquerait tout simplement par une
pénétration des juvéniles dans l'estuaire. Des
études ont montré que l'utilisation de l'estuaire est surtout le
fait de la phase larvaire (Hié Daré, 1982) et juvénile
(Baran, 1995). Ces immatures peuvent aller plus loin en amont de
l'estuaire
62
(eau douce) et même y rester jusqu'à
certaines tailles pour ensuite retourner en mer pour les besoins de la
reproduction. Ceci recoupe les résultats d'Albaret (1987) sur la
Casamance, qui considère E. lacerta comme une espèce
amphibiotique exclusivement thalassotoque et à reproduction marine. Ces
observations expliquent les grandes classes de tailles rencontrées
à Maka aval par rapport à Sakar, car suite à l'obstacle
que constitue le barrage à leur passage, ces spécimens y restent
et y grandissent. Les différences temporelles qui existent, avec en
particulier des plus petites classes de tailles en février, situeraient
le début de cette entrée des juvéniles dans l'estuaire en
février et avant octobre. De même la variation de la
salinité pourrait avoir influencé également la
répartition des classes de tailles malgré l'instabilité de
cette espèce dans l'estuaire au vu de la différence significative
des tailles en fonction des mois.
IV.3- Facteur de condition (K)
IV.3.1- Les tilapias
L'absence de différence significative du
facteur de condition des tilapias entre les stations et les mois suggère
une tolérance de ceux-ci aux variations des conditions d'amont et d'aval
du barrage. Ce fait peut s'expliquer également par l'effet de l'eau
salée qui avait envahi la partie amont au mois de mai. Ceci aurait
induit un comportement qui n'est pas trop différent de celui des
poissons d'aval du barrage.
Les faibles moyennes du facteur K au mois de mai
montrent que les conditions rencontrées par S. m. heudelotii, T.
guineensis et H. fasciatus durant les mois d'octobre et de
février étaient meilleures que celles dont ces espèces
étaient exposées pendant le mois de mai. Cela peut être
lié aux effets des fortes salinités mesurées durant cette
période. Panfili et al, (2004b) ont constaté une
variation du facteur de condition au Saloum dont ils prétendent
être en relation avec les variations saisonnières de la
salinité. Pour le cas particulier d'Hemichromis fasciatus les
conditions lui ont été plus favorables en octobre (mois où
l'eau était pratiquement douce dans toutes les stations où cette
espèce a été capturée) que pendant les autres mois
d'échantillonnage. La forte valeur atteinte par la salinité
durant le mois de mai constituerait un élément d'explication
à la faible moyenne du facteur K durant cette période. Cette
observation s'avère logique car Hemichromis fasciatus est une
espèce estuarienne d'origine continentale (Albaret, 1999).
63
IV.3.2- Ethmalosa fimbriata et Elops lacerta
L'absence de différence significative entre
les stations situées en aval du barrage s'expliquerait par les faibles
variations de la salinité et de la température qui y sont
enrégistrées. Néanmoins la faible valeur moyenne de K
à Sakar révèle des conditions plus favorables à ces
espèces dans cette station qu'à Maka aval. La plus forte valeur
de K d'E. fimbriata a été observée au mois
d'octobre où la salinité dans cette station était de 5.
Par contre ce facteur était plus élevé pour E. lacerta
en février qu'en octobre et mai. Ces résultats laissent
présumer que les meilleures conditions pour ces deux espèces
correspondraient à des seuils de salinité. Les valeurs faibles du
facteur K d'E. fimbriata en février et mai et surtout à
la station de Diana Malary, montrent qu'en dessous ou en deçà de
ces seuils les conditions deviennent défavorables à ces
espèces. En Gambie les conditions les plus favorables à E.
fimbriata ont été rencontrées en fin de saison des
pluies et elles suivent un cycle annuel (Panfili et al., 2004a). Mais
vu les faibles variations de ce paramètre entre ces deux stations, il
est probable que d'autres paramètres soient impliqués en plus de
la salinité. La catégorie écologique à laquelle
appartient E. fimbriata : estuarienne d'origine marine (Albaret, 1999)
peut aussi servir d'élément explicatif à cette situation
observée. La forte valeur de K en octobre et en février
respectivemen pour E. fimbriata et E. lacerta montre que le
seuil de cette dernière espèce serait plus élevé
que celui d'E. fimbriata. E. lacerta résisterait alors mieux
aux variations de la salinité qu'E. fimbriata. Pandaré
et al, (1997) ont observé une plus large répartition
d'E. lacerta suivant un gradient positive de la salinité que
d'E. fimbriata.
IV.4- Régime alimentaire
IV.4.1- Sarotherodon melanotheron heudelotii et
Tilapias guineensis
Le pourcentage d'estomacs vides chez ces tilapias
peut être relié à la proportion importante des captures aux
filets maillants faites en octobre, étant donné que ce
pourcentage a été plus important pendant ce mois. Par contre
durant les autres périodes d'échantillonnage l'épervier a
été principalement utilisé. T. guineensis et
S. m. heudelotii ont des comportements alimentaires intermittents
(respectivement Fagade, 1971 ; Fagade, 1979). Pour cette dernière
espèce la période de plus faible prise alimentaire est
située entre minuit et trois heures du matin (Fagade, 1979). Les filets
étaient placés lors de nos échantillonnages pendant la
nuit, ce qui pouvait aussi entrainer la poursuite de la digestion pendant le
temps que les poissons étaient encore dans le filet.
64
Cette étude révèle comme d'autres
(Pauly, 1976 ; Fagade, 1979 ; Kone & Teugels, 2003) un rapprochement des
régimes alimentaires de ces deux espèces. Cependant T.
guineensis est à tendance herbivore alors que S. m. heudelotii
est plutôt filtreur de vase. S. m. heudelotii et T.
guineensis diversifient leurs proies en élargissant leur spectre
trophique en aval du barrage et au cours du mois de mai. En d'autres termes il
existerait une corrélation positive entre le régime alimentaire
de ces espèces et de l'augmentation de la salinité. Mais le
spectre trophique de T. guineensis est plus large que celui de S.
m. heudelotii. Fagade (1971) constatait que cette dernière
espèce avait un rapport: poids estomacs/poids corporel plus faible que
T. guineensis. Levêque & Paugy (1999) ont montré
l'existence de variations ontogéniques du régime alimentaire de
plusieurs poissons en Afrique. Ils mettent ces variations chez les Cichlidae en
rapport avec le type de dentition.
Dans tout les cas, le protocole que nous avions
entrepris lors de cette étude, consistant à échantillonner
toutes les classes de tailles dans chaque station et sur tout le long des
périodes d'échantillonnage réduirait les effets
évoqués par ces auteurs.
D'autres auteurs (Ugwemba & Adebisi, 1992) ont
trouvés des changements saisonniers du régime alimentaire de
Sarotherodon melanotheron au Nigeria, qu'ils attribuaient aux
variations d'abondance des types de proies dans l'environnement. Mais des
études faites sur la Casamance (Diouf & Diallo, 1987), ont
montré qu'il existe une relation entre les variations qualitatives et
quantitatives du zooplancton et la salinité. Leur abondance diminue
lorsque la salinité dépasse 70. Durant notre étude une
salinité moyenne de 75 a été mesurée au mois de mai
dans la station de Sakar, où des proies supplémentaires ont
été rencontrées dans les estomacs des spécimens
capturés. Tout ceci confirme que les variations spatio-temporelles
observées chez ces espèces seraient liés aux variations de
la salinité.
Durant cette étude, les bivalves ont
constitué un bon indice de proies pour les fortes salinités en ce
qui concerne ces deux espèces. S. m. heudelotii réduit
les occurrences de vase en faveur des débris végétaux
lorsque la salinité augmente. Par contre l'inverse est observé
chez T. guineensis. Ces tilapias augmenteraient leur spectre trophique
pour compenser les pertes d'énergie dues au phénomène
d'osmorégulation afin d'accomplir leurs activités biologiques. Le
choix porté par ces espèces sur les bivalves dans ces conditions
d'hyperhalinité pourrait être lié à leur composition
en lipides.
Les oeufs rencontrés dans les estomacs de
T. guineensis constituent une proie pour cette espèce. Par
contre ceux trouvés dans les estomacs de S. m. heudelotii,
nécessitent d'être discuté. L'incubation buccale par les
mâles est actuellement un phénomène bien connue à la
suite de plusieurs études (Albaret, 1987 ; Fagade, 1979 ; Legendre &
Ecoutin, 1989, 1996 ;
65
Legendre, 1991). Les estomacs de ces mâles
étaient pratiquement vides avec un nombre élevé d'oeufs
suggérant ainsi leur ingestion sous l'effet de stress. Pauly (1976) et
Fagade (1979) considèrent que les oeufs trouvés dans des estomacs
de S. m. heudelotii, ont été avalés à
cause de la pression de captures des mâles incubateurs. Mais la capture
des ces individus à des périodes et au niveau des stations les
plus salées (en février à Sakar et en mai à Maka
aval), mettrait également en évidence un rôle de la
salinité dans l'amplification de ce phénomène.
IV.4.2- Ethmalosa fimbriata
Le régime alimentaire d'E. fimbriata
a été étudié par plusieurs auteurs
(Bainbridge, 1957 ; Fagade & Olaniyan, 1972 ; Nieland, 1980).
Les résultats d'analyses des contenus
stomacaux révèlent une variation saisonnière du
régime alimentaire des ethmaloses. Mais les migrations
différentielles des classes de tailles dans l'espace et dans le temps
présumées au cours de notre étude compromettent une
interprétation qui relirait cette variation aux fluctuations
spatio-temporelles de la salinité. Fagade & Olaniyan (1972), ont
prouvé l'existence d'une variation ontogénique du régime
des ethmaloses. Les juvéniles sont zooplanctonophage, puis deviennent
par la suite phytoplanctonophage en grandissant. Mais les proies (surtout les
copépodes) trouvées dans les estomacs des spécimens pris
en février, n'illustrent pas une telle relation, car les plus grandes
ethmaloses ont été capturées au cours de ce mois. L'engin
de pêche principalement utilisé à savoir l'épervier,
pourrait réduire l'effet de digestion intra-stomacale des
éléments fragiles tels que le phytoplancton comme le
prétendait Bainbridge (1957). Lazarro (comm. pers.) qui a mené
une étude en lagune Ebrié (Côte d'Ivoire) sur environ 200
contenus stomacaux d'E. fimbriata suggère que ces variations
seraient liées aux disponibilités alimentaires. Mais des
études faites sur la Casamance (Diouf & Diallo, 1987), ont
montrés qu'il existe une relation entre les variations qualitatives et
quantitatives du zooplancton et la salinité. Leur abondance diminue
lorsque la salinité dépasse 70. Durant notre étude une
salinité de 75 a été enregistrée au mois de mai
dans la station de Sakar, où des proies supplémentaires ont
été également rencontrées dans les estomacs des
spécimens capturés. Ces changements du régime alimentaire
de ces espèces pourraient être donc liés directement aux
variations de la salinité ou indirectement par l'intermédiaire de
la disponibilité des proies, car ces dernières sont directement
influencées par les variations de la salinité. Mais les
migrations différentielles des classes de tailles
présumées chez E. fimbriata dans l'espace et dans le
temps lors de cette étude, méritent une attention
particulière dans l'interprétation de la variation de ce trait de
vie chez cette espèce.
66
IV.4.3- Hemichromis fasciatus et Elops lacerta
Les items rencontrés dans les estomacs de ces
espèces sont constitués essentiellement de larves et de
juvéniles de poissons. Des observations identiques ont été
déjà réalisées chez Elops lacerta (Fagade
& Olaniyan, 1973 ; Hié Daré, 1980) et Hemichromis
fasciatus (Adebisi, 1981).
Par ailleurs, l'identification des poissons contenus
dans les estomacs a été plus ou moins difficile pour certains
à cause de leur état de digestion avancée. Aucune
variation spatio-temporelle importante du régime trophique de ces
espèces n'a été notée malgré la
présence quelques fois dans les estomacs de crustacées et
d'insectes. Ceci pourrait susciter une compétition intra et
interspécifique lorsque les espèces proies se raréfient.
Des auteurs ont prouvés que H. fasciatus et E. lacerta
peuvent se nourrir de toutes sortes de poisons se trouvant dans leur
environnement, voire même leurs propres juvéniles pour E
lacerta (Fagade & Olaniyan, 1973).
Dans cette présente étude, quelque soit
la station et le mois d'échantillonnage, E. lacerta oriente ses
prises de proies sur les ethmaloses, les tilapias, mais également ses
propres juvéniles. Par contre H. fasciatus a été
surtout prédateur de tilapias (S. m. heudelotii et T.
guineensis. L'adaptation de ces espèces à divers types de
poissons proies constituerait une stratégie pour réduire la
compétition et subvenir à leurs besoins nutritionnels, surtout
dans un environnement où les poissons sont soumis à des flux
migratoires temporaires. Ceci n'a pas été le cas dans notre
étude, car les poissons principalement rencontrés résident
pour la plupart dans l'estuaire.
Divers études ont été
menées pour la détermination du régime alimentaire de ces
différentes espèces (Pauly, 1976 ; Fagade, 1979 ; Hié
Daré, 1980 etc...). Mais dans notre bibliographie nous n'avons pas
trouvé de travaux relatifs à la comparaison du régime
alimentaire de ces espèces entre l'amont et l'aval d'un barrage
anti-sel. Ainsi, dans l'impossibilité de comparer nos résultats
à d'autres, nous les considérons comme préliminaires en
attendant une étude plus approfondie.
IV.5- Reproduction
IV.5.1- Sarotherodon melanotheron heudelotii et Tilapia
guineensis
IV.5.1.1-.Fécondité et taille des
ovocytes
67
Le choix porté sur l'étude de la
fécondité relative à la place de la
fécondité absolue relève des résultats obtenus sur
cette dernière par diverses études (Legendre & Ecoutin, 1989,
1996). Ces auteurs ont montré une relation nettement positive entre le
nombre d'ovocytes pondus et le poids corporel des femelles. Ceci reflète
l'avantage que présente l'étude du nombre d'ovocytes par kg de
femelle ou d'ovaire par rapport à celle du nombre d'ovocytes produits
par individu mature.
La fécondité et la taille des ovocytes
des poissons varient généralement en fonction des
paramètres environnementaux. En situation environnementale difficile, le
poisson qui se reproduit doit ajuster sa fécondité ainsi que la
qualité des ovocytes produits (Schreck et al., 2001). Plusieurs
auteurs ont montré l'existence d'un équilibre entre la
fécondité et la taille des ovocytes chez les poissons en
général (Albaret, 1982 ; Duarte & Alcaraz, 1989) et chez les
tilapias en particulier (Legendre & Ecoutin, 1989, 1996 ; Duponchelle, 1997
; Gueye, 2006). Les comparaisons des fécondités relatives
moyennes et des tailles moyennes des ovocytes de S. m. heudelotii et
de T. guineensis montrent une tendance inverse entre les
évolutions spatio-temporelles de la fécondité et du
diamètre ovocytaire. Globalement les populations d'aval du barrage ayant
de fortes fécondités relatives ont en conséquence des
ovocytes de petites tailles. Par contre celles d'amont ont des
fécondités relatives faibles et de gros ovocytes. Mais la
population de poissons de Diana Malary a en particulier une forte
fécondité forte en mai.
Cette évolution « en miroir» du
nombre et de la taille des ovocytes a déjà été
observée chez S. m. heudelotii par Legendre & Ecoutin
(1996) en Côte d'Ivoire, par Panfili et al, (2004b) et par Gueye
(2006) dans le Saloum.
Ces observations mettent en évidence une
stratégie adaptative de ces espèces aux variations
spatio-temporelles des paramètres environnementaux, dont la
salinité : paramètre le plus fluctuant dans l'estuaire au cours
de cette étude. Une approche expérimentale du rôle de la
salinité sur la reproduction, réalisée par Gueye (2006)
montre clairement qu'elle peut constituer un facteur limitant pour la
reproduction chez S. m. heudelotii quand celle-ci avoisine 70. Des
résultats similaires ont été obtenus par Panfili et
al, (2004b, 2006) au Saloum.
Ces résutats sont proches de ceux que nous
avons obtenus lors de cette étude. Une salinité maximale de 75 a
été mesurée, salinité où des variations
spatiales et temporelles de la fécondité relative et du
diamètre ovocytaire moyen de S. m heudelotii et de T
guineensis ont été observées. De plus nous avons
travaillé sur des populations (d'amont et d'aval du barrage) qui
pourraient génétiquement se différencier le long du temps
et sous l'effet des conditions particulières dont elles sont
exposées. Pouyaud (comm. pers) rapporte que tous les tilapias
de
68
l'espèce Sarotherodon melanotheron du
Sénégal et de la Gambie appartiennent à la sous<
espèce S. m. heudelotii avec une structuration
génétique des différentes populations probablement
liée à l'échelle temporelle. D'autres auteurs
(Gourène et al., 1993 ; Pouyaud, 1994 ; Falk et al.,
2003) qui ont travaillé sur la génétique des poissons en
Afrique de l'ouest, affirment que les différentes populations de S.
m. heudelotii devraient être génétiquement
différentes.
Ces variations notées sur ces traits de vie
montrent que ces espèces doivent adapter leurs caractéristiques
reproductives aux variations des conditions environnementales et en particulier
à celle de la salinité. En environnement salé tel est le
cas de particulier de la partie aval du barrage et du mois de mai, ces tilapias
produisent un grand nombre de petits ovocytes. Par contre en eau douce ou
faiblement salée (amont du barrage), ils produisent un petit nombre de
gros ovocytes. Diverses études (Legendre & Ecoutin, 1996 ; Panfili
et al., 2004b ; Gueye, 2006) prétendent qu'un poisson dans un
environnement donné doit « choisir» entre: produire un grand
nombre de petits ovocytes ou produire un petit nombre de gros ovocytes. Ces
stratégies reproductives adoptées par ces espèces en amont
et en aval du barrage s'expliquent par le fait qu'elles allouent une partie de
leur énergie à l'osmorégulation au détriment de la
reproduction. Mais également les petits ovocytes en eau salée
(aval du barrage) pourraient diminuer les échanges avec le milieu
extérieur et réduire les dépenses
énergétiques pour le maintien de la pression osmotique. Ces
résultats ont déjà été
démontrés chez S. m. heudelotii (Panfili et al.,
2004b; Gilles et al., 2004). La production de nombreux ovocytes
de petites tailles en aval du barrage peut s'expliquer par l'adoption par ces
populations d'une stratégie particulière
d'accélération de l'effort de reproduction pour assurer leur
pérennité malgré le stress halin. Gueye (2006) avait
trouvé des résultats identiques chez S. m. heudelotii
dans le Saloum. A l'inverse le petit nombre d'ovocytes de grandes tailles
produits par S. m. heudelotii et T. guineensis en amont du
barrage pourrait constituer un choix stratégique afin de donner
naissance à une progéniture peu nombreuse mais très
résistante aux contraintes dont elle pourrait être exposée.
Legendre & Trébaol (1991) attribuaient les fortes variations de la
fécondité absolue en Côte d'Ivoire à l'incubation
buccale. Mais cela n'est pas le cas en amont du barrage, car les mâles
incubateurs capturés, ont été rencontrés à
Sakar (février) et à Maka aval (mai) : stations et
périodes où les plus fortes fécondités relatives
ont été trouvées. Ceci confirme une fois encore le
rôle de la salinité dans ce phénomène.
La forte fécondité relative moyenne et
par conséquent les nombreux ovocytes de petites tailles
rencontrés dans la station de Diana Malary au mois de mai, trouvent
leurs justifications dans l'envahissement de cette station par les eaux
salées de l'aval suite à la destruction des vannes
69
au cours de ce mois mais également à la
forte température. Cette nouvelle situation a pu augmenter la
sensibilité de la population de poisson qui a demeurée longtemps
en eau douce à l'augmentation de la salinité. Watanabe & Kuo
(1985) ont observé une meilleure résistance à la
salinité après une exposition aussi précoce que possible
des individus aux fortes salinités. Ces résultats expliquent
également l'absence d'une induction identique de la population de Maka
amont, station soumise à des invasions temporaires d'eau salée.
Les variations spatio-temporelles de ces caractéristiques biologiques
sont pratiquement identiques pour S. m. heudelotii et T.
guineensis et répondent aux mêmes interprétations.
En revanche, l'absence de différence significative de la
fécondité relative chez T. guineensis entre l'amont et
l'aval du barrage peut être liée au nombre réduit de
femelles de stade 4 capturées en octobre et en février au pied
amont et aval du barrage, mais également à la dégradation
des vannes en mai. Par contre la comparaison des diamètres ovocytaires,
nécessite moins de femelles de stade 4 que celle de la
fécondité relative, d'où l'absence de différence
significative des diamètres ovocytaires s'expliquerait par la large
gamme de tolérence aux variations de la salinité en particulier
dont dispose cette espèce. Mais également aux effets de la
dégradation des vannes en mai. L'absence de différence
significative de la fécondité relative chez ces deux
espèces entre octobre et février serait liée à la
faible variation de la salinité entre ces deux
périodes.
La fécondité relative moyenne de S.
m heudelotii trouvée dans cette partie de l'estuaire de la
Casamance (6172 ovocytes/kg de femelle) peut être rapprochée
à celle obtenue par Gueye (2006) dans le Saloum chez cette même
espèce (6042 ovocytes/kg de femelle). Le diamètre moyen des
ovocytes (1,7 #177; 0,27 mm) trouvé au cours de cette étude est
légèrement inférieur à celui obtenu dans le Saloum
(2,6 #177; 0,06 mm) par Gueye (2006). Ceci suggère que les populations
de poissons de cette partie de la Casamance, qui est un estuaire inverse tout
comme l'estuaire du Saloum, sont très stressées (Tableau
24).
IV.5.1.2-.Taille de première maturité
sexuelle (L50)
Nous avons orienté notre discussion sur la
L50 qui permet une étude comparative de la taille de
première maturité sexuelle d'une espèce vivant dans des
environnements distincts. La L95 est surtout utilisée pour
l'évaluation du potentiel halieutique de l'espèce.
Plusieurs auteurs ont montré que la taille de
première maturité sexuelle varie en fonction des conditions
environnementales chez les tilapias (Lowe McConnell, 1982 ; Eyeson, 1983 ;
Legendre & Ecoutin, 1996 ; Duponchelle, 1997).
70
Tableau 24 : Synthèse de différents
résultats obtenus sur la fécondité relative, le
diamètre ovocytaire et la L50 de Sarotherodon
melanotheron heudelotii et de Tilapia guineensis.
|
Fécondité
relative
|
Diamètre
ovocytaire
|
L50
|
Localisation
|
Références
|
SME
|
6172
|
1,7 #177; 0,27
|
139
|
Casamance
|
Présente étude
|
|
2,61 #177; 0,06
|
78
|
Saloum
|
Gueye, 2006
|
|
|
131
|
Saloum
|
Panfili et al, 2004b
|
|
|
176
|
Ebrié naturel
|
Legendre & Ecoutin
|
|
|
140
|
Ebrié enclos
|
Legendre & Ecoutin, 1989
|
|
|
150
|
Casamance
|
Albaret, 1987
|
TGU
|
|
|
159
|
Ebrié naturel
|
Legendre & Ecoutin, 1989
|
|
|
154
|
Ebrié enclos
|
Legendre & Ecoutin, 1989
|
|
71
Les plus faibles L50 en amont qu'en aval du
barrage de S. m. heudelotii et de T. guineensis sont
liées surtout au fort stress causé par le passage de l'eau
salée en amont du barrage au mois de mai, par la forte
température enrégistrée à Diana Malary pendant ce
mois et par la faible profondeur des eaux en amont de Diana Malary. Cette
dernière situation aurait entraînée les poissons vers les
zones situées plus en aval de l'estuaire (comme Diana Malary), ce qui
peut causer un manque d'espace à ces poissons pour accomplir leurs
activités bioécologiques, d'où une plus forte
agressivité des individus. Ce fait est bien confirmé par les
faibles L50 observées à Diana Malary (106 mm pour
S. m. heudelotii, 117 mm pour T. guineensis) au mois de mai.
Tous ces résultats illustrent les réponses de ces espèces
lorsqu'elles sont exposées de façon brusque à des
salinités élevées après avoir vécu longtemps
en eau douce mais aussi à de fortes températures. Comme l'a
montré l'étude de Watanabe & Kuo (1985), ces tilapias
deviennent plus sensibles à l'augmentation de la salinité que
ceux qui étaient préalablement exposés. Gilles et al,
(2004) affirment que les adultes peuvent être
transférés sans acclimatation de l'eau douce à l'eau mer
et inversement. Mais cela n'exclut pas des variations de leurs traits
biologiques aux conditions changeantes du milieu. De plus, lors de cette
étude les salinités avaient atteint même des valeurs
supérieures à 36 (75). Des variations de la L50 entre
différentes populations ont été déjà
démontrées chez plusieurs espèces tropicales dans tous les
écosystèmes aquatiques ouest africains : en lagune (Guyonnet
et al., 2003), en estuaire (Panfili et al., 2004b) en eau
douce de lac (Duponchelle & Panfili, 1998) et en rivière (Paugy,
2002). La taille à la première maturité sexuelle est un
paramètre biologique particulièrement sensible aux variations
environnementales (Panfili et al., 2006). Les variations temporelles
de la L50 observées au cours de cette étude
suggèrent que ces espèces sont sensibles aux fluctuations de la
salinité et de la température. Des variations sur la taille
à la première maturité sont fréquentes chez les
tilapias (Faunce, 2000). Mais la question qui reste encore à
déterminer est de savoir si ces changements sont dus à une
maturité précoce ou à un phénomène de
nanisme (Eyeson, 1983). Certains auteurs prétendent que ceci pourrait
être une conséquence d'une précocité des individus
(Panfili et al., 2006 ; Gueye, 2006). En revanche une
différence de croissance entre les populations de l'estuaire du Saloum
et de la Gambie a été montrée (Panfili et al.,
2004b). De plus ces auteurs également ont constaté que la
croissance de S. m. heudelotii était inhibée par les
très fortes ou très faibles salinités. D'autres auteurs
ont montré l'effet réducteur de la salinité sur la taille
de T. guineensis et de S. m. heudelotii (Pandaré
et al., 1997) et sur divers poissons en générale (Boeuf
& Payan, 2001) Nos résultats obtenus sur la variation temporelle des
tailles moyennes et maximales
72
appuyés par l'existence de la relation: taille
maximales/croissance (Lauzanne, 1978 ; Legendre & Albaret, 1991),
expliquent ces changements de L50 par une par une différence
de croissance des poissons en réponse au stress de salinité en
particulier. Mais à cause de l'abence de variation significative des
tailles des individus entre l'amont et l'aval du barrage, nous ne pouvons pas
exclure définitivement la précosité des
individus.
Nos résultats ont également
montré que l'augmentation de la salinité et de la
température entraine chez ces tilapias une réduction de la taille
du plus petit individu mature. Cette taille a été plus petite
dans les stations aval que dans celles d'amont du barrage. Mais
également elle a été plus faible en mai qu'en
février et octobre. Ces résultats confirment celles de Panfili
et al., (2006) au Saloum, qui remarquent que le plus petit individu
mature (PPIM) était un bon indicateur de la L50
trouvée dans un environnement donné.
La taille de première maturité sexuelle
trouvée (L50) chez S. m. heudelotii dans cette
partie de l'estuaire (139 mm) peut être rapprochée à celle
trouvée par Panfili et al, (2004b) dans le Saloum (131 mm).
Elle peut également être rapprochée à celle
déterminée en enclos d'élevage en Lagune Ebrié (140
mm) par Legendre & Ecoutin (1989) qui notent une diminution de la
L50 par rapport à celle obtenu en milieu naturel (176 mm).
Quant à la L50 de T. guineensis (125 mm), elle est
inférieure aux L50 déterminées en enclos
d'élevage (154 mm) et en milieu naturel (159 mm) dans la lagune
Ebrié (Legendre & Ecoutin, 1989). Ceci peut être lié au
faible nombre d'invidus matures capturés pour cette espèce au
cours de notre étude. Ces observations révélent que les
populations de S. m. heudelotii et de T. guineensis vivant
dans cette partie de l'estuaire de la Casamance sont plus stressées que
celles d'en milieu naturel de la lagune Ebrié, mais de manière
similaire aux populations vivant dans le Saloum et en enclos d'élevage
pour S. m. heudelotii en particulier. La différence
notée sur la L50 de S. m. heudelotii par rapport
à celle trouvée par Albaret (1987) en Casamance (150 mm)
s'explique par une différence numérique (de femelles matures
capturées) et spatiale d'échantillonnage. Cet auteur a
travaillé sur pratiquement tout le long de l'estuaire, alors que notre
étude a été menée sur un espace plus restreint
(Tableau 24).
IV.5.1.3-.Rapport gonado-somatique (RGS)
Le rapport gonado-somatique moyen varie en fonction
des stations et des saisons. Les RGS les plus élevés en mai par
rapport au autres mois d'échantillonnage et en aval qu'en amont du
barrage révèlent une réponse de ces tilapias au facteur
croissant de salinité par une augmentation du rapport gonado-somatique.
Ces tilapias régulent probablement leur reproduction en augmentant
l'énergie qui lui est alloué au détriment de la
croissance
73
somatique pour préserver l'effort reproductif
malgré le stress halin. Le cycle de reproduction n'étant pas
déterminé dans cette étude à cause d'un manque de
données sur les RGS des stades = 2 sur l'ensemble des mois
d'échantillonnage, la variation de ce paramètre pourrait
également être attribuée à une coïncidence de
cette période à un pic d'activité sexuelle du moins pour
S. m. heudelotii. Cela est d'autant plus confirmer par l'absence de
différence significative du RGS de stade 4 de cette espèce en
fonction entre l'amont et l'aval du barrage. Des études ont
montré que les pics d'activité sexuelle de S. m. heudelotii
étaient situés en fin de saison sèche (Albaret, 1987
; Pandaré et al., 1997). L'activité reproductrice de
T. guineensis paraît maximale en mars et avril (Albaret, 1987).
Ce dernier constat justifierait ces variations par les fluctuations
spatio-temporelles de la salinité. Mais cette interprétation doit
être prise avec précaution car le nombre de femelles de stade 4
capturées pour cette dernière espèce était faible
dans certaines stations.
IV.6- Infection parasitaire
Les parasites sont de bons marqueurs de la
salinité. Ils ne semblent être influencés que par la
salinité, quelle que soit la période ou la station. La
salinité optimale à l'infection parasitaire de S. m.
heudelotii se situerait au environ de 5. L'étude du facteur
biologique de S. m. heudelotii a montré également de
meilleures conditions de cette espèce à des salinités
identiques. Ceci n'est pas étonnant, car S. m. heudelotii est
une espèce estuarienne stricte (Albaret, 1999) et donc ces meilleures
conditions biologiques seraient en eau saumâtre tout comme les parasites
qui l'infectent. S. m. heudelotii n'a pas donc développé
de défense immunitaire contre ces parasites à cette
salinité (5). La réduction du taux d'infection parasitaire de
cette espèce aux salinités élevées s'explique par
le fait que les conditions biologiques optimales aussi bien de l'espèce
que de ces parasites se situeraient aux environs de la salinité 5. Ce
résultat est de plus confirmé par le faible taux d'infection
observé à la salinité 0. Les travaux de Pauly (1976) chez
Tilapia melanotheron dans les lagunes ouest africaines ont abouti
à des résultats identiques qu'il explique par l'origine limnique
des parasites. Le traitement des individus de S. m. heudelotii avec
des salinités supérieures à 35 pourrait constituer un
moyen préventif contre les infections parasitaires.
Synthèse
A travers cette étude, il a été
mis en évidence l'effet du barrage mais également le rôle
capital de la salinité sur les traits biologiques (reproduction,
régime alimentaire, croissance) des espèces vivant en amont et en
aval du barrage de Maka. Les tilapias ont fait preuve de
74
tolérence des variations des conditions
environnementales d'amont et d'aval du barrage. Mais néanmoins ils
adoptent des stratégies différentes, adaptées aux
conditions de salinité et de température sévissant dans
ces environnements respectifs. Le suivi de l'évolution de la
salinité dans ces deux environnements nous a permis de vérifier
le rôle de la salinité sur les variations spatiales et temporelles
des caractéristiques biologiques de ces espèces. Il est devenu
clair que les espèces de tilapias vivant en aval du barrage (Sakar et
Maka aval) ont des tailles moyennes réduites par rapport à celles
vivant en amont. La taille du plus petit individu mature et le diamètre
ovocytaire moyen de ces espèces deviennent en générale
plus faibles, tandis que leur fécondité relative et leur rapport
gonado-somatique sont élevés. S. m. heudelotii et T.
guineensis élargissent également leur spectre trophique en
augmentant simultanément les prises en bivalves. S. m. heudelotii
tend à ingérer d'avantage de débris
végétaux au détriment de la vase. L'inverse est
observé chez T. guineensis qui dispose un spectre trophique
plus large.
Par contre en amont du barrage (Maka amont, Diana
Malary) ces espèces adoptent des stratégies inverses. Leurs
spectres trophiques sont réduits, la taille moyenne des individus
devient plus élevée. Du point de vue de la reproduction, une
diminution du nombre d'ovocytes produits par kilogramme de femelle et une
augmentation simultanée du diamètre ovocytaire moyen sont
notées chez S. m. heudelotii et T. guineensis. Le
rapport gonado-somatique moyen des femelles de stade 4 est plus faible. Les
variations de ces traits biologiques en amont et en aval du barrage suivent la
même tendance que celles observées respectivement en octobre et
mai avec des changements intermédiaires en février. Les valeurs
légèrement plus élevées en aval qu'en amont du
barrage de la taille du plus petit individu mature et de la taille de
première maturité sexuelle sont une conséquence du passage
d'eau salée dans la partie amont, de la forte température
mesurée à Diana Malary en mai et au problème d'occupation
de l'espace dont les poissons ont été confrontés dans
cette station.
Les parasites sont de bons marqueurs de la
salinité indifféremment de la période et de la station. Le
taux d'infection parasitaire de S. m. heudelotii est maximal à
la salinité 5 et s'annule pour des salinités supérieures
à 35. Ethmalosa fimbriata varie son régime alimentaire
en fonction des mois. En revanche Elops lacerta et Hemichromis
fasciatus consomment essentiellement des juvéniles de poissons
comme proies indépendamment des stations et des mois. Les tailles de ces
trois espèces restent également sensibles aux variations de la
salinité. Ces fluctuations chez Ethmalosa fimbriata et
Elops lacerta, peuvent être attribuées soit à la
salinité soit à la migration des individus. Malgré la
restriction de l'aire de répartition
75
d'Hemichromis fasciatus dans les stations d'eaux
douces ou faiblement salées, les changements observés sur ses
paramètres biologiques seraient induits par la
salinité.
V. Résumé et Perspectives
En définitive l'étude comparative des
traits biologiques de ces espèces dans l'espace (amont/aval) et dans le
temps (entre les mois d'échantillonnage) nous a permis d'élucider
le rôle capital de la salinité sur le comportement
bio-écologique de ces différentes populations de poissons.
Malgré les faibles variations de ces traits de vie entre l'amont et
l'aval du barrage. Le barrage n'a pas d'effet majeur sur certains traits de vie
des poissons à l'exception de la fécondité relative et du
régime alimentaire. Ceci est lié à l'établissement
de stress aux populations de poissons de la partie amont du barrage (surtout
à Diana Malary) au mois de mai. Dans des conditions de très forte
salinité (aval barrage et en mai) ces espèces allouent une partie
de leur énergie destinée à la reproduction et à la
croissance au profit de l'osmorégution et augmentent leur spectre
trophique pour compenser les pertes d'énergie. En eau douce ou
faiblement salée elles assurent leur pérennité en
élaborant une progéniture peu nombreuse mais très
résistante à d'eventuelles pressions dans le milieu. Cette
étude nous a également permis de concevoir que les
différences de tailles moyennes et de taille de première
maturité sexuelle des individus pourrait bien être une
conséquence d'une différence de croissance des individus sous
l'effet ici du stress de salinité et non d'une précocité
des individus.
· Pour mieux appréhender les
stratégies de reproduction et de croissance des espèces soumises
en particulier à des flux migratoires (Ethmalosa fimbriata et
Elops lacerta) en fonction des variations de la salinité, il
est nécessaire de travailler en environnement
contrôlé.
· Bien qu'elle soit importante pour
l'étude comparative du régime alimentaire, la méthode
d'analyse des contenus stomacaux présente des limites liées aux
phénomènes de régurgitation et de digestion avancée
des proies et ne donne pas d'information sur l'origine de la matière
organique. Il est donc important de relancer une telle étude en
utilisant un outil moderne d'analyse des réseaux trophiques comme
l'analyse d'isotopes stables du carbone et de l'azote qui renseigne sur
l'origine de la matière organique et le niveau trophique.
· Une étude comparée de
l'âge des individus des différentes populations s'avère
également nécessaire pour confirmer nos
résultats.
76
|
Tilapia, Sarotherodon melanotheron heudelotii
(Duméril, 1859). Comportement alimentaire :
détritivore-omnivore.
Niveau trophique : Consommateur
primaire.
Guilde trophique : filtreur de vase à
tendance microphytophage.
|
Tailles :
70 - 224 mm
|
|
|
Tilapia, Tilapia guineensis (Bleeker in
Günther, 1862). Comportement alimentaire :
herbivore-détritivore. Niveau trophique : Consommateur
primaire.
Guilde trophique : manguer de débris
végétaux
|
Tailles :
67 - 265 mm
|
|
|
Tilapia, Hemichromis fasciatus.
Comportement alimentaire : prédateur
piscivore. Niveau trophique : Consommateur tertiaire
2ème
Guilde trophique : prédateur de
niveau
|
Taille : 93-215 mm
|
|
|
Ethmalose, Ethmalosa fimbriata (Bowdich, 1825).
Comportement alimentaire : zoophytoplanctonophage.
Niveau trophique : Consommateur
secondaire.
Guilde trophique : fitreur de vase à
tendance microphytophage
|
Tailles :
55 - 160 mm
|
|
|
Elops, Elops lacerta.
Comportement alimentaire : prédateur
piscivore. Niveau trophique : Consommateur tertiaire
2ème
Guilde trophique : prédateur de
niveau
|
Taille : 84-230 mm
|
|
·
77
L'étude génétique des
différentes populations permettrait de confirmer si celles-ci se sont
génétiquement différenciées ou si les
réponses des individus au contraste de salinité étaient
tout simplement phénotypiques.
· Il est nécessaire d'entreprendre une
étude expérimentale pour mieux concevoir l'évolution de
l'infection parasitaire de Sarotherodon melanotheron heudelotii et
d'autres espèces en fonction des variations de la
salinité.
· Il est également important
d'entreprendre une étude comparative de populations entre
différents barrages pour appréhender de façon plus globale
les stratégies adoptées par ces espèces dans des
conditions multivariées et l'effet différentiel de divers types
de barrages sur les populations de poissons.
78
Références bibliographiques
Adebisi A.A., 1981. Analyses of the stomach contents
of the piscivorous fishes of the upper ogun river in Nigeria. Hydrobiologia
79, 167-177.
Albaret J.J., 1982. Reproduction et
fécondité des poissons d'eau douce de Côte d'Ivoire.
Revue Hydrobiologie Tropicale 15 (4), 347-371.
Albaret J.J., 1984. Premières observations sur
la faune ichtyologique de la Casamance. Archives Centre de Recherche
Océanographique Dakar-Thiaroye 131, 22pp.
Albaret J.J., 1987. Les peuplements de poissons de la
Casamance (Sénégal) en période de sécheresse.
Revue Hydrobiologie Tropicale 20, 291-310.
Albaret J.J., 1994. Les poissons : biologie et
peuplements. In Durand J.R, Dufour, P., Guiral D., Zabi S.G.,
(eds.).Environnement et ressources aquatiques de Côte d'Ivoire. Tome 2 :
les milieux saumâtres. L'exemple de la lagune Ebrié. Paris,
ORSTOM, 239-279.
Albaret J.J., 1999. Les peuplements des estuaires et
des lagunes. In Lêvêque C. Paugy, D., (eds.). Les poisons des eaux
continentales africaines. Editions IRD, Paris, France, 326-349.
Albaret J.J., Gerlotto F., 1976. Biologie de
l'Ethmalose (Ethmalosa fimbriata Bowdich) en Côte d'Ivoire. I.
Description de la reproduction et des premiers stades larvaires. Document
Scientifique Centre de Recherche Océanographique, Abidjan VII (1),
113-133.
Albaret J.J., Charles-Dominique E., 1982. Observations
d'un phénomène de maturation sexuelle précoce chez
l'Ethmalose Ethmalosa fimbriata S. (Bowdich), dans une baie
polluée de la lagune Ebrié (Cote d'Ivoire). Document
Scientifique Centre de Recherche Océanographique, Abidjan, 13 (2),
23-31.
Albaret J.J., Ecoutin J.M., 1990. Influence des
saisons et des variations climatiques sur les peuplements de poissons d'une
lagune tropicale en Afrique de l'ouest. Acta Oecologia 11 (4),
557-583.
Albaret J.J., Diouf P.S., 1994. Diversité des
poissons des lagunes et des estuaires ouest - africains. In Teuguels G.G.,
Guégan J.F., Albaret J. J., (eds.). Diversité biologique des
poissons des eaux douces et saumâtres d'Afrique. Synthèses
géographiques. Annuaire du Musée référence
Afrique Centre Zoologique, Tervuren 275, 165-177.
Albaret J.J., Guillard J., Simier M., Darboe F.S.,
Raffray J., Richard E., Sow I., Suwarch M., Tito de Morais L., Vidy G., 2000,
Les peuplements de poissons de l'estuaire du fleuve Gambie. Rapport
scientifique (Mission Gambie), 52p.
Albaret J.J., Ecoutin J.M., Sadio 0., 2005.
Environnement, peuplement des poissons et exploitation halieutique en
Casamance. Rapport scientifique (Mission Casamance, février 2005),
15p.
Albergel J., Brunet D., Dubée G., Montoroi
J.P., Zante P., 1991. Gestion d'un barrage anti-sel en Basse Casamance
(Sénégal). AUPELF-UREF, John Libbey Eurotext, Paris.
Département eaux continentales de l'ORSTOM.,
275285.
Bainbridge V., 1957. Food of Ethmalosa dorsalis
(Cuvier and Valenciennes). Nature 179 (4565),
874-875.
79
Baran E., 1995. Dynamique spatio-temporelle des
peuplements de poissons estuariens en Guinée : Relations avec
le
milieu abiotique. Thèse de Doctorat,
Université. Bretagne Occidentale, Brest, ORSTOM, TDM n°242, 226pp.
Bassel M., 1993. Conséquence durable de deux décennies de
sécheresse: l'hypersalinisation de la Casamance entre 1987
et 1992. Rapport DEA Géographie UCAD,
25pp.
Blaber S.J.M., 1997. Fish and fisheries of tropical
estuaries. Chapman & Hall, London, UK, 367p.
Boeuf G., Payan P., 2001. How should salinity
influence fish growth ? Comparative Biochemistry and Physiology Part C
130, 411-423.
Charles-Dominique E., 1982. Exposé synoptique
des données biologiques sur l'Ethmalose (Ethmalosa fimbriata S.
Bowdich ,1825) Revue Hydrobiologie Tropicale 15 (4),
373-397.
Chessel D., Dufour AB., Thioulouse J. 2004. The ade4
package-I- One-table methods. R News 4:5-10. [En ligne]
http://pbil.univ-lyon1.fr/ADE-4/ADE-4F.html.
Consulté le 22 octobre 2007.
Cormier-Salem M.C., 1989. Gestion et Evolution des
espaces aquatiques: la Casamance. Thèse de doctorat, Etudes et
Thèses, ORSTOM, Paris, 571pp.
Day J.M., Hall C.A., Kemp W.M., Yanez-Arancibia A.,
1989. Estuarine ecology. Wiley and Sons, 558pp.
Diouf P.S., 1996. Les peuplements de poissons des
milieux estuariens de l'Afrique de l'Ouest : l'exemple de l'estuaire hyperhalin
du Sine-Saloum. Thèse de Doctorat de 3e cycle.
Université de Montpellier II. 177 p.
Diouf P.S., Diallo A., 1987. Variations
spatio-temporelles du zooplancton d'un estuaire hyperhalin : la Casamance.
Revue Hydrbiologie Tropicale 20 (3-4), 257-269.
Duarte C.M., Alcaraz M., 1989. To produce many small
or few large eggs: a size-independent tactic of fish. Oceologia. 80,
401-404.
Duponchelle F., 1997. Reproduction du tilapia (Pisces,
Cichlidae) Oreochromis niloticus (Linnaeus, 1758) dans les retenues
artificielles de Côte d'Ivoire : analyse comparative des modalités
de reproduction et approche expérimentale de leur déterminisme.
Thèse de doctorat d'Université. Université de Bretagne
Occidentale, Rennes, 167p.
Duponchelle F., Panfili J., 1998. Variations in age
and size at maturity of female Nile tilapia, Oreochromis niloticus,
populations from man-made lakes of Côte d'Ivoire. Environmental
Biology ofFishes 52, 453-465.
Ecoutin J.M., Durand J.R., Laë R., Hié
Daré J.P., 1994. L'exploitation des stocks. In Durand J.R, Dufour, P.,
Guiral D., Zabi S.G., (eds.).Environnement et ressources aquatiques de
Côte d'Ivoire. Tome 2 : les milieux saumâtres. L'exemple de la
lagune Ebrié. Paris, ORSTOM, 399-444.
Ecoutin J.M., Tito de Morais L., Raffray J., Sadio O.,
2005. Comparaison de populations de poissons du fleuve Casamance en situation
environnementale contrastée. Rapport scientifique (Mission Casamance,
mai 2005), 5p.
Elliott M., Whitfield A.K., Potter I.C., Blaber
S.J.M., Cyrus D.P., Nordlie F.G., Harrison T.D., 2007. The guild approach to
categorizing estuarine fish assemblages: a global review. Fish andfisheries
8, 241-268.
Eyeson K.N., 1983. Stunting and reproduction in
pond-reared Sarotherodon melanotheron. Aquaculture 31,
257-267. Fagade S.O., 1971. The food and feeding habits of Tilapia
species in the Lagos lagoon. Journal of Fish Biology 3,
151156.
Fagade S.O., 1974. Age determination in Tilapia
melanotheron (Ruppel) in the Lagos lagoon, Lagos, Nigeria. Proceedings of
the Symposium on ageing of fish, Urwin Broth. Ltd. Edit.,
71-77.
80
Fagade S.O., 1979. Observations on the biology of two
species Tilapia from the Lagos lagoon, Nigeria. Bulletin de l'Institut
Fondamental d'Afrique Noire T. 11, série. A, n° 3,
627-653.
Fagade S.O., Olaniyan C.I.O., 1972. The Biology of the
west african shad, Ethmalosa fimbriata (Bowdich) in the Lagos lagoon,
Nigeria. Journal ofFish Biology 4 (4), 519-533.
Fagade S.O., Olaniyan C.I.O., 1973. The food and
feeding interrelationships of the fishes of lagoon. Journal of Fish Biology
5, 205-227.
Falk T.M., Teugels G.G., Abban E.K., Villwock W.,
Renwrantz L., 2003. Phylogeographic patterns in populations of the blackchinned
tilapia complex (Teleostei, Cichlidae) from coastal areas in West Africa:
support for the refuge zone theory. Molecular Phylogeny Evolution 27,
81-92.
Faunce C.H., 2000. Reproduction of blackchin tilapia,
Sarotherodon melanotheron, within an impounded mangrove ecosystem in
east central Florida. Environmental Biology ofFishes 57,
353-361.
Gerlotto F., 1979. Biologie d'Ethmalosa fimbriata
(Bowdich) en Côte d'Ivoire. III. Etude des migrations en lagune
Ebrié. Document Scientifique Centre. Recherche
Océanographique, Abidjan, ORSTOM, 10 (2),
3-41.
Gilles S., 1995. Comparaison des performances de
croissance en milieu lagunaire de trois populations génétiquement
différenciées de Sarotherodon melanotheron originaire du
Sénégal, de la Côte d'Ivoire et du Congo. In Agnèse
J-F., (ed.). Comptes Rendus de l'Atelier Biodiversité et Aquaculture.
Centre de Recherches Océanographiques, Abidjan, 73-79.
Gilles S., Zamora L., Amiel C., Rodriguez J.L., 2004.
Comparative study of reproductive characteristics of the euryhaline tilapia,
Sarotherodon melanotheron heudelotii in fresh and sea waters.
Journal Aquaculture Tropicale 19 (4), 277-284.
Gourène B., Pouyaud L., Agnèse J.F.,
1993. Importance de certaines caractéristiques biologiques dans la
structuration génétique des espèces de poissons : le cas
de Ethmalosa fimbriata et Sarotherodon melanotheron.
Journal Ivoirien d'Océanologie et de Limnologie, Abidjan 2,
55-69.
Gueye M., 2006. Stratégie de la reproduction du
tilapia estuarien, Sarotherodon melanotheron heudelotii (Duméril,
1859) en milieux naturels, approche expérimentale du rôle de
la salinité sur la fonction de reproduction. Thèse de doctorat,
UCAD, Dakar, 182pp.
Guyonnet B., Aliaume C., Albaret J.J., Casellas C.,
Zerbi A., Lasserre G., Do Chi T., 2003. Biology of Ethmalosa fimbriata
(Bowdich) and fish diversity in the Ebrie Lagoon (Ivory Coast), a
multipolluted environment. ICES Journal ofMarine Science 60,
259-267.
Hié Daré J.P., 1980. Régime
alimentaire de la phase lagunaire d'Elops lacerta. Document
Scientifique Centre de Recherche Océanographique Abidjan. Vol XI
n°1, 73-83.
Hié Daré J.P., 1982. Croissance de la
phase lagunaire d'Elops lacerta. Document Scientifique Centre de Recherche
Océanographique Abidjan, 13 (1), 53-72.
Horn M.H., Allen L.G., 1985. Fish community ecology in
southern California bays and estuaries. In Yanez-Arancibia. A., (ed.). Fish
community ecology in estuaries and coastal lagoons. Mexico, Editorial
Universitaria, 169-190.
Hyslop E.J., 1980. Stomach contents analysis-a review of
methods and their application. Journal of Fish Biology 17,
411-429.
IDEE Casamance, 2007. Exploitation durable des ressources
estuariennes de la région de Ziguinchor, 16p. [En ligne]
http://www.ideecasamance.org/erez.htm.
Consulté le 23 octobre 2007.
81
Kone T., Teugels G.G., 1999. Données sur la
reproduction d'un tilapia estuarien (Sarotherodon melanotheron)
isolé dans un lac de barrage ouest-africain. Aquatic Living
Resources 12, 289-293.
Kone T., Teugels G.G., 2003. Food habits of brackish
water tilapia Sarotherodon melanotheron in riverine and lacustrine
environments of a West African coastal basin. Hydrobiologia 490,
75-85.
Lauzanne L., 1978. Croissance de Sarotherodon
galilaeus (Pisces, Cichlidae) dans le lac Tchad. Cybium
3e série 3, 5-14. Legendre M., 1983. Observations
préliminaires sur la croissance et le comportement en élevage de
Sarotherodon
melanotheron (Ruppel, 1852) et de Tilapia
guineensis (Bleeker, 1862) en lagune ébrié (Cote
d'Ivoire).
Document Scientifique Centre de Recherche
Océanographique Abidjan, 14, 1-36.
Legendre M., 1986. Influence de la densité, de
l'élevage monosexe et de l'alimentation sur la croissance de Tilapia
guineensis et de Sarotherodon melanotheron élevés
en cage-enclos en lagune ébrié (Cote d'Ivoire). Revue
Hydrobiologie Tropicale 19 (1), 19-30.
Legendre M., 1991. Potentialités aquacoles des
Cichlidae (Sarotherodon melanotheron, Tilapia guineensis) et
Clariidae
(Heterobranchus longifilis) autochtones des
lagunes ivoiriennes. Etudes et Thèses, ORSTOM, Paris, 362pp. Legendre
M., Albaret J.J., 1991. Maximum observed lengh as an indicator of growth rate
in tropical fishes. Aquaculture
94, 327-341.
Legendre M., Ecoutin J.M., 1989. Suitability of
brackish water tilapia species from Ivory Coast for lagoon aquaculture. I-
Reproduction. Aquatic Living Resources 2, 71-79.
Legendre M., Ecoutin J.M., 1991. Aspects de la
stratégie de reproduction de Sarotherodon melanotheron : Comparaison
entre une population naturelle (lagune Ebrié, Côte d'Ivoire) et
différentes populations d'élevage. In Proceedings of the 3th
International Symposium on Tilapia, 11-16 nov.1991, Abidjan, Côte
d'Ivoire. ICLARM/CRO, 20p.
Legendre M., Ecoutin J.M., 1996. Aspects of the
reproductive strategy of Sarotherodon melanotheron: comparison between
a natural population (Ébrié lagoon, Côte d'Ivoire) and
different cultured populations. In: Pullin R.S.V., Lazard J., Legendre M., Amon
Kothias J;-B., Pauly D. (Eds.). Proceeding of the 3rd international symposium
on tilapia in aquaculture. ICLARM, Manila, 320-325.
Legendre M., Trébaol L., 1991.
Efficacité de l'incubation buccale et fréquence de ponte de
Sarotherodon melanotheron en milieu d'élevage (lagune
Ebrié, Côte d'Ivoire) : Proceedings of the 3th International
Symposium on Tilapia, 11-16 nov.1991, Abidjan, Côte d'Ivoire. ICLARM/CRO,
18p.
Le Reste L., 1983. Casamance : une situation
extrêmement grave. Document Centre de Recherche
Océanographique Dakar-Thiaroye, 2p.
Le Reste L., 1986. Conséquences sur
l'environnement aquatique et la pêche d'un barrage-écluse anti-sel
en Casamance (Sénégal). In Dost H., (ed.). Selected papers of the
Dakar symposium on Acid Sulphate Soils. Dakar, Sénégal, January
1986. Editions IRD, 202-213.
Lêvêque C., Paugy D., 1999. Impacts des
activités humaines. In Lévêque C., Paugy, D., (Eds.). Les
poisons des eaux continentales africaines. Editions IRD, Paris, France,
366-383.
Lowe-McConnell R.H., 1982. Tilapias in fish
communities. In Pullin, R.S.V., Lowe-McConnell, R.H. (Eds.). The biology and
culture of tilapias. ICLARM, Manila, 83-113.
Nieland H., 1980. Qualitative and quantitative aspects
of the food of Ethmalosa fimbriata (Bowdich) in the Ebrié
lagoon
(Ivory Coast). Document Scientifique Centre de
Recherche Océanographique Abidjan. Vol. XI, n° 1, 85-95.
Pagès J., Debenay J. P., 1987. Evolution saisonnière de la
salinité de la Casamance : Description et essai de
modélisation. Revue Hydrobiologie Tropicale
20 (3-4), 203-217.
82
Pandaré D., Niang S., Diadhiou H., Capdeville
B., 1997. Ichtyofaune du fleuve Casamance : reproduction et distribution en
fonction du gradient de salinité. Bulletin de l'Institut Fondamental
d'Afrique Noire, Dakar. T. 49, serie. A, n°1,
167-190.
Panfili J., Durand J.D., Mbow A., Guinand B., Diop K.,
Kantoussan J., Thior D., Thiaw O., Albaret J.J., Laë R., 2004a. Influence
of salinity on the life-history traits of the bonga shad (Ethmalosa
fimbriata, Pisces, Clupeidae): comparison between Gambia and Saloum
estuaries. Marine Ecology Progress Series 270, 241-257.
Panfili J., Durand J.D., Mbow A., Diop K., Diouf K.,
Thior D., Ndiaye P., Laë R., 2004b. Influence of salinity on the
life-history traits of the West African black-chinned tilapia (Sarotherodon
melanotheron): Comparison between the Gambia and Saloum estuaries.
Aquatic living Resources 17, 65-74.
Panfili J., Thior D., Ecoutin J. M., Ndiaye P.,
Albaret J. J., 2006. Influence of salinity on the size at maturity for fish
species reproducing West Africa estuaries. Journal ofFish Biology 69,
95-113.
Pariselle A., Euzet L., 1996. Cichlodogyrus
Paperna, 1960 (Monogenea, Ancyrocephalidae): gill parasites from West
Africa Cichlidae of the sudgenus Coptodon Regan, 1920(Pisces), with
descriptions of six new species. Systematic Parasitology 34,
109-124.
Pasquaud S., 2006. Les relations trophiques :
élements de structuration des peuplements ichtyologiques en milieu
estuarien. Application à l'estuaire de la Gironde. Thèse de
Doctorat de 3e cycle. Université Bordeaux I. 360
p.
Paugy D., 2002. Reproductive strategies of fishes in a
tropical temporary stream of the Upper Senegal basin: Baoule River in Mali.
Aquatic Living Resources 15, 25-35.
Paugy D., Lévêque C., Teugels G.G., 2003.
Faune des poissons d'eaux douces et saumâtres de l'Afrique de l'Ouest.
Faune et Flore tropicales. Tome I et II. Editions IRD, Paris, France,
815pp.
Pauly D., 1976. The biology, fishery and potential for
aquaculture of Tilapia melanotheron in a small West African
Lagoon. Aquaculture 7, 33-49.
Pouyaud L., 1994. Génétique des
populations de tilapias d'intérêt aquacole en Afrique de l'Ouest.
Relations
phylogénétiques et structurations
populationnelles. Thèse de doctorat d'Université, Montpellier II,
France, 244p. Prunet, P., Bornancin, M., 1989. Physiology of salinity
resistance in tilapia: an update of basic and applied aspects.
Aquatic Living Resources 2,
91-97.
Salzen E.A., 1958. Observations on the biology of the
West-African shad, Ethmalosa fimbriata (Bowdich). Bulletin de
l'Institut Fondamental d'Afrique Noire (A Sciences Naturelles.) 20 (4),
1388-1426.
Schreck C.B., Contreras-Sanchez W., Fitzpatrick M.S.,
2001. Effects of stress on fish reproduction, gamete quality, and progeny.
Aquaculture 197, 3-24.
Sene N., 1994. Contribution à l'étude
qualitative du régime alimentaire de quelques poissons dans l'estuaire
du Sine-Saloum. Mémoire de DEA de Biologie Animale, Dakar, UCAD,
61pp.
Thiaw O.T., 1984. Contribution à la connaissance
de la reproduction chez les Cichlidae. Cas de Haplochromis multicolor.
DEA de Biologie animale, Renne 1, 46pp.
Ugwumba A.A.A., Adebisi A., 1992. The food and feeding
ecology of Sarotherodon melanotheron (Ruppell) in a small freshwater
reservoir in Ibadan, Nigeria. Archives Hydrobiologie 124,
367-382.
URL:
http://members.tripod.com/casamance/geocasa.htm
Vidy G., 1998. Estuarine and mangrove systems and the
nursery concept : which is wich? The case of the Sine Saloum system
(Sénégal). In : poisons et pêches africains. Monpellier :
ORSTOM, 8p.
Watanabe W.O., Kuo C.M., 1985. Observations on the
reproductive performance of Nile tilapia Oreochromis niloticus in
laboratory aquaria at various salinities. Aquaculture 49,
315<323.
Warbuton K., 1978. Community structure, abundance and
diversity of fish in a Mexican coastal lagoon system. Estuarine and coastal
marine science 7, 497<519.
Whitfield A.K., Elliott M., 2002. Fishes as indicators
of environmental and ecological changes within estuaries: a review of progress
and some suggestions for the future. Journal ofFish Biology 61,
229<250.
83
Annexes
Annexe I: Sarotherodon melanotheron heudelotii
octobre février mai
n = 206
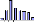
n = 207
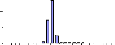
100 80 60 40 20 0
100
80
60
40
20
0
Sakar

100
80
60
40
20
0
100
80
60
40
20
0
n = 201
n = 187
Maka aval
|
100 80 60 40 20 0
|
|
|
|
n = 143
|
|
|
Maka amont
|
n = 217
84 -20
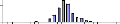
100
|
|
100
|
|
100
|
|
80
|
n = 39
|
80
|
n = 200
|
80
|
|
60
|
|
60
|
|
60
|
|
40
|
|
40
|
|
40
|
|
20
|
|
20
|
|
20
|
|
0
|
|
0
|
|
0
|
|
<2
3-4
5-6
7-8 9-10 11-12 13-14 15-16 17-18 19-20 21-22 23-24 25-26
100
80 n = 258
60
40
classes de tailles (cm)
fréquen ces (%)
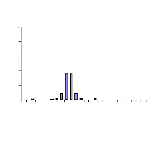
n = 200
19
-22
21-22
classes de tailles (cm)
0
23-24
25-26
fréquen ces (%)
100
80
60
40
20
0
<2 3-4 5-6 7-8 9-10 11-12 13-14 15-16 17-18
Diana Malary
fréquen ces (%)
|
100 80 60 40 20
0
|
|
|
|
n = 118
|
|
|
<2
3-4
5-6
7-8 9-10 11-12 13-14 15-16 17-18 19-20 21-22 23-24 25-26
|
classes de tailles (cm)
Annexe II: Tilapia guineensis
octobre février mai
Sakar
n = 156
100
|
n = 11
|
100
|
|
n = 48
|
100
|
|
80
|
|
80
|
|
|
80
|
|
60
|
|
|
60
|
|
|
60
|
|
40
|
|
|
40
|
|
|
40
|
|
20
|
|
|
20
|
|
|
20
|
|
0
|
|
|
0
|
|
|
0
|
Maka aval
|
100 80 60 40
|
|
100 80 60 40
|
|
|
100 80 60 40
|
|
|
|
n = 6
|
|
n = 39
|
|
|
|
|
n = 72
|
|
|
|
|
|
|
|
|
20
0
|
|
20
0
|
|
20
0
|
|
|
Maka amont
|
|
|
|
|
|
|
|
100 80 60 40
|
n = 7
|
100 80 60 40
|
|
n = 74
|
100 80 60 40
|
n = 22
|
|
|
|
|
|
|
|
|
20
0
|
|
20
0
|
20
0
|
|
|
|
|
|
Diana Malary
fréquen
ces (%) 100
fréquen
ces (%) 100
n = 37
n = 40
80
80
60
60
40
40
20
20
0
0
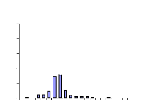
fréquen
ces (%) 100
n = 121
80
60
40
20
0
<6 7-8 9-10 11-12 13-14 15-16 17-18 19-20 21-22 23-24 25-26
>27
<6 7-8 9-10 11-12 13-14 15-16 17-18 19-20 21-22 23-24 25-26
>27
<6
7-8
9-10
11-12
13-14
>27
classes de tailles (cm)
classes de tailles (cm)
15-16
17-18
19-20
21-22
23-24
25-26
85
13- 15- 17-19-
21- 23- 25- >
85
classes de tailles (cm)
Annexe III: Hemichromis fasciatus
octobre février mai
Maka aval
n = 10
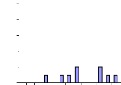
100
n = 10
80
60
40
20
0
100 80 60 40 20
0
Maka amont
|
|
|
|
|
100
|
|
|
|
100 80 60 40
|
|
|
100
|
|
|
n = 20
|
|
|
|
|
|
|
n = 8
|
80
60
40
|
n = 73
|
80
60
40
|
|
|
|
|
|
|
|
|
|
|
20
0
|
|
20
0
|
|
20
0
|
|
|
|
Diana Malary
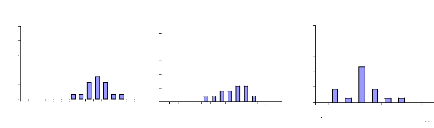
fréquen ces (%)
100
fréquen
ces (%) 100
n = 35
fréquen
ces (%)
100
n = 13
80
n = 17
80
80
60
60
60
40
40
40
20
20
20
0
0
0
<9
>23
15-17
<9 10-11 12-13 14-15 16-17 18-19 20-21
>22
<9 10-11 12-13 14-15 16-17 18-19 20-21
>22
19-21
11-13
86
classes de tailles (cm)
classes de tailles (cm)
classes de tailles (cm)
Annexe IV: Ethmalosa fimbriata
octobre février mai
|
Sakar
|
|
|
|
|
|
100
|
|
n = 30
|
100
|
n = 132
|
100
|
|
80
|
|
|
80
|
|
80
|
|
60
|
|
|
60
|
|
|
60
|
|
40
|
|
|
|
40
|
|
|
40
|
|
20
|
|
|
|
20
|
|
|
20
|
|
0
|
|
|
|
0
|
|
|
0
|
|
|
|
|





n = 10
Maka aval
<5
6-7
8-9 10-11 12-13 14-15 16-17 18-19 20-21 22-23 24-25 26-27
classes de tailles (cm)
classes de tailles (cm)
<5
6-7
8-9 10-11 12-13 14-15 16-17 18-19 20-21 22-23 24-25 26-27

100
n = 31
80
60
40
20
0
fréquen
ces (%)
100
80
60
40
20
0
fréquen
ces (%) 100
80
60
40
20
0
n = 71
n = 50
Diana Malary
fréquen ces (%)
100 80 60 40 20 0
<5
6-7
8-9 10-11 12-13 14-15 16-17 18-19 20-21 22-23 24-25 26-27
87
classes de tailles (cm)
Annexe V: Elops lacerta
octobre février mai
Sakar
100
n = 28
n = 147
100 100
n = 10
80
80
80
60

60
60

40
40
40
Maka aval
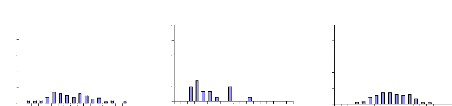
fréquen ces (%)
100
100
n = 38
80
80
80
60
60
60
40
40
40
20
20
20
0
0
0
fréquen
ces (%) 100
fréquen ces (%)
n = 65
n = 191
<8 9-10 11-12 13-14 15-16 17-18 19-20 21-22 23-24
<8 9-10 11-12 13-14 15-16 17-18 19-20 21-22 23-24
<8 9-10 11-12 13-14 15-16 17-18 19-20 21-22 23-24
88
classes de tailles (cm)
classes de tailles (cm)
classes de tailles (cm)
89
Annexe VI : Valeurs maximales du diamètre
ovocytaire (DO max) et taille du plus petit individu mature (PPIM) en fonction
des mois et des stations chez Sarotherodon melanotheron heudelotii et
Tilapia guineensis.
|
Mois
Espèces
|
octobre
|
février
|
mai
|
|
Sarotherodon melanotheron heudelotii
|
DOmax.(mm)
|
2,4
|
2,3
|
2,0
|
|
PPIM (mm)
|
118
|
101
|
90
|
|
Tilapia guineensis
|
DOmax.(mm)
|
1,0
|
1,2
|
1,2
|
|
PPIM (mm)
|
125
|
123
|
94
|
|
Stations
Espèces
|
Aval
|
|
Amont
|
|
Sakar
|
Maka aval
|
Maka
amont
|
Diana
Malary
|
|
Sarotherodon melanotheron heudelotii
|
DOmax.(mm)
|
1,7
|
1,9
|
2,1
|
|
2,4
|
|
1,9
|
|
2,4
|
|
PPIM (mm)
|
101 112
|
97
|
90
|
|
101
|
|
90
|
|
Tilapia guineensis
|
DOmax.(mm)
|
1,2 1,2
|
1,2
|
1,1
|
|
1,2
|
|
1,2
|
|
PPIM (mm)
|
94 97
|
117
|
102
|
|
94
|
|
102
|
90
Annexe VII: Occurrences (%) des proies de
Tilapia guineensis et de Sarotherodon melanotheron heudelotii
en fonction des stations et des mois.
Tableau 1 : Tilapia
guineensis.
|
Poi.
|
Molq.
|
Zooplancton
|
Phytoplancton
|
Divers
|
|
Mois
|
Proies
Stations
|
oeufs
|
écailles
|
bivalves
|
gastéropodes
|
annélides
|
crustacés
|
copépodes
|
amphipodes
|
isopodes
|
crabes
|
ostracodes
|
algues
|
diatomées
|
dinoflagellés
|
vase
|
débris végétaux
|
insectes
|
|
octobre
|
Sakar
|
22
|
|
22
|
|
78
|
|
|
|
11
|
|
|
|
89
|
|
67
|
56
|
56
|
|
Maka aval
|
17
|
|
67
|
|
17
|
|
|
|
|
|
|
|
83
|
|
83
|
67
|
|
|
Maka amont
|
14
|
|
29
|
|
|
|
|
|
|
|
|
29
|
100
|
|
71
|
100
|
14
|
|
Diana Malary
|
68
|
|
16
|
5
|
47
|
|
|
|
|
|
|
|
95
|
|
58
|
100
|
26
|
|
février
|
Sakar
|
11
|
|
44
|
|
89
|
|
|
|
|
|
|
22
|
100
|
|
100
|
100
|
11
|
|
Maka aval
|
|
|
60
|
|
50
|
|
|
|
|
|
|
80
|
90
|
10
|
100
|
20
|
|
|
Maka amont
|
11
|
|
|
|
33
|
|
22
|
|
11
|
|
11
|
56
|
100
|
|
78
|
100
|
|
|
Diana Malary
|
|
|
|
|
50
|
|
|
10
|
40
|
|
10
|
20
|
100
|
60
|
80
|
100
|
10
|
|
mai
|
Sakar
|
30
|
|
60
|
|
100
|
20
|
|
10
|
|
20
|
|
30
|
60
|
20
|
100
|
50
|
10
|
|
Maka aval
|
20
|
|
100
|
|
60
|
|
|
|
|
|
|
|
90
|
20
|
100
|
70
|
|
|
Maka amont
|
50
|
|
10
|
|
50
|
|
|
|
|
|
|
20
|
100
|
20
|
100
|
90
|
30
|
|
Diana Malary
|
40
|
|
10
|
|
60
|
|
|
|
|
|
|
|
100
|
20
|
100
|
40
|
10
|
Tableau 2 : Sarotherodon melanotheron
heudelotii.
|
Poi.
|
Molq.
|
Zooplancton
|
Phytoplancton
|
Divers
|
|
Mois
|
Proies
Stations
|
oeufs
|
écailles
|
bivalves
|
gastéropodes
|
annélides
|
amphipodes
|
isopodes
|
algues
|
diatomées
|
dinoflagellés
|
vase
|
débris végétaux
|
insectes
|
|
octobre
|
Sakar
|
86
|
|
29
|
14
|
14
|
|
|
|
100
|
|
100
|
29
|
|
|
Maka aval
|
63
|
|
63
|
|
63
|
|
|
|
100
|
|
100
|
|
|
|
Maka amont
|
50
|
|
50
|
|
40
|
|
10
|
|
100
|
|
100
|
40
|
|
|
Diana Malary
|
62
|
|
5
|
5
|
52
|
|
5
|
|
95
|
|
100
|
24
|
5
|
|
février
|
Sakar
|
20
|
|
30
|
|
10
|
|
|
|
90
|
|
90
|
20
|
|
|
Maka aval
|
|
|
70
|
|
|
|
|
|
100
|
70
|
100
|
|
|
|
Maka amont
|
|
|
|
|
40
|
|
|
|
100
|
40
|
100
|
20
|
|
|
Diana Malary
|
|
|
|
|
40
|
|
|
|
90
|
|
100
|
10
|
|
|
mai
|
Sakar
|
|
|
89
|
|
78
|
33
|
|
11
|
89
|
11
|
100
|
44
|
|
|
Maka aval
|
30
|
|
50
|
|
40
|
|
|
|
100
|
|
100
|
40
|
|
|
Maka amont
|
10
|
|
30
|
|
50
|
|
|
20
|
100
|
|
100
|
|
10
|
Poi : poissons ; Molq. : Mollusques.
NB : les espaces vides correspondent à des
occurrences égales à 0%.
91
Annexe VIII: Occurrences (%) des proies
d'Ethmalosa fimbriata, d'Hemichromis fasciatus, et
d'Elops lacerta en fonction des stations et des mois.
Tableau 3 : Ethmalosa
fimbriata
|
Poi.
|
Molq
|
Zooplancton
|
Phytoplancton
|
Divers
|
|
Mois
|
Proies
Stations
|
écailles
|
bivalves
|
crustacés
|
copépodes
|
amphipodes
|
isopodes
|
ostracodes
|
algues
|
diatomées
|
dinoflagellés
|
vase
|
débris végétaux
|
insectes
|
|
octobre
|
Sakar
|
|
|
|
|
|
|
|
|
90
|
|
90
|
50
|
|
|
Maka aval
|
|
29
|
47
|
24
|
6
|
53
|
|
|
88
|
|
100
|
6
|
6
|
|
février
|
Sakar
|
|
40
|
40
|
70
|
10
|
|
|
|
100
|
|
70
|
60
|
|
|
Maka aval
|
|
10
|
|
90
|
|
|
|
|
80
|
|
100
|
|
|
|
mai
|
Sakar
|
|
|
|
|
|
|
|
100
|
|
22
|
33
|
|
|
|
Maka aval
|
|
10
|
|
50
|
|
|
10
|
|
100
|
|
100
|
30
|
10
|
Tableau 4 : Hemichromis
fasciatus.
|
Poi.
|
Zoopl.
|
Div.
|
|
Mois
|
Proies
Stations
|
oeufs
|
Lvs et juv.
|
crustacés
|
isopodes
|
insectes
|
|
octobre
|
Maka aval
|
25
|
88
|
13
|
|
13
|
|
Maka amont
|
29
|
100
|
|
|
|
|
Diana Malary
|
45
|
100
|
|
5
|
|
|
février
|
Maka amont
|
80
|
100
|
|
|
|
|
Diana Malary
|
11
|
78
|
11
|
|
11
|
|
mai
|
Maka aval
|
|
100
|
|
|
|
|
Maka amont
|
|
100
|
|
|
|
|
Diana Malary
|
22
|
100
|
|
|
11
|
Tableau 5 : Elops lacerta.
|
Poi.
|
Zoopl.
|
Div.
|
|
Mois
|
Proies
Stations
|
Lvs et juv.
|
crustacés
|
isopodes
|
insectes
|
|
octobre
|
Sakar
|
100
|
|
|
60
|
|
Maka aval
|
95
|
5
|
9
|
18
|
|
février
|
Sakar
|
100
|
|
|
|
|
Maka aval
|
100
|
|
|
|
|
mai
|
Sakar
|
100
|
|
|
|
|
Maka aval
|
100
|
|
|
|
Poi. : Poissons ; Lvs: larves ; juv. : Juvéniles;
Zoopl : Zooplancton ; Div. : Divers; NB : les espaces vides correspondent
à des occurrences égales à 0%.
92
Annexe IX : Résultats du test
statistique d'Analyses factorielles à Composante Principale (ACP) sur
les occurrences de proies chez cinq espèces de poissons
étudiées.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SME
|
|
|
|
|
|
|
|
|
Maka aval
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sakar
|
Diana Malary Maka amont
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TGU
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
vase
|
|
oeufs.de.pois.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
gastéropodes
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
diatomées
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
bivalves
|
|
|
|
|
|
|
|
octobre
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
mai
|
|
|
|
|
|
|
|
|
|
|
|
|
février
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dinoflagellés
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
insectes
|
|
|
|
|
|
|
|
|
|
|
|
|
annelidescstacés
|
amphipodes
|
|
|
|
|
|
|
|
|
|
|
|
|
|
crabes
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
algues
|
copépodes
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
deb.veg
isoodes
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ostracodes
|
|
93
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sakar
|
|
|
|
|
EFI
|
|
|
|
|
|
|
|
Maka aval
|
|
|
|
|
|
ELA HFA
|
|
|
|
anaMaka Mlaryamont
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dinoflagellésalgues
|
|
|
d = 0.2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
vase
|
ostracodes
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
copépodes
|
|
|
|
|
|
diatoms
|
deb.veg
|
|
|
|
|
|
|
|
mai
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
bivalves
|
|
|
insectes
|
|
|
|
|
|
|
féer
octobre
|
|
|
|
|
|
amphipodes
|
iopodes
|
|
|
|
|
|
|
crustaces
|
|
oeufs
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
poissons
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annexe XI : Systématique des espèces
étudiées
Sarotherodon melanotheron heudelotii ; Tilapia
guineensis ; Hemichromis fasciatus
Classe : Actinoptérygiens
Ordre : Perciformes (Perches) Famille :
Cichlidae
Sous famille : Pseudocrenilabrinae
Ethmalosa fimbriata
Classe : Actinoptérygiens
Ordre : Clupeiformes (Anchois, harengs et sardines)
Famille : Clupeidae
Elops lacerta
Classe : Actinoptérygiens
Ordre : Elopiformes (Tarpons) Famille :
Elopidae
|
Barrage anti-sel de Maka
|
|
|
94
|
95
Sujet : Comparaison des populations de poissons
amont1aval du barrage anti-sel de Maka sur la
Casamance
Nom : Ismaïla NDOUR
Nature du document : Mémoire DEA, soutenu le 22
Novembre 2007
Président : M. Omar Thiom Thiaw, Professeur
UCAD
Membres : MM. Luis Tito de Morais, Directeur de
Recherches IRD
Jean Marc Ecoutin, Chargé de Recherches IRD Samba
Kâ, Docteur (UCAD)
Justin Kantousan, Docteur (UCAD)
Résumé
L'étude comparative des traits de vie
(régime alimentaire, reproduction, croissance) des espèces de
poissons vivant de part et d'autre du barrage anti-sel de Maka sur la Casamance
s'appuie sur des échantillonnages effectués en trois
périodes différentes : octobre (salinités minimales
annuelles), février (salinités intermédiaires), mai
(salinités maximales annuelles). Cet ouvrage sépare deux
environnements de salinité contrastée : une partie aval
salée sous influence de l'estuaire inverse et une partie amont d'eau
douce. Les régimes alimentaires des espèces sont abordés
par la méthode classique d'analyse des contenus stomacaux en notant les
occurrences des proies. Les paramètres de la reproduction ont
été quantifiés à partir de l'examen macroscopique
des gonades et du calcul du rapport gonado-somatique, du comptage et des
mesures des diamètres ovocytaires et de la détermination de la
taille de première maturité sexuelle (L50). La croissance est
déduite du calcul des tailles moyennes. Sarotherodon melanotheron
heudelotii et Tilapia guineensis élargissent leur spectre
trophique en aval du barrage et pendant le mois de mai contrairement à
Hemichromis fasciatus et Elops lacerta pour lesquelles aucune
variation du régime alimentaire n'a été observée.
Le régime trophique d'Ethmalosa fimbriata subit une variation
saisonnière. Les ovocytes observés sont petits et nombreux dans
les stations aval du barrage. Par contre, dans la partie amont ils sont gros et
peu nombreux. A l'exception de la fécondité relative aucune
différence significative n'est notée sur les paramètres de
la reproduction et sur les tailles moyennes des individus entre l'amont et
l'aval du barrage. Par contre en mai les ovocytes sont plus petits et plus
nombreux, la L50 plus faible et le rapport gonado-somatique plus
élevé qu'en octobre. Ils sont intermédiaires en
février. Le pic d'infection parasitaire de S. m. heudelotii
semble se situé aux environs de la salinité 5. La
«plasticité» des traits de vie de ces espèces serait
une réponse aux variations spatiales et temporelles de la
salinité. Mais ces variations sont modérées par les stress
(halin, thermique...) dont la population des poissons de Diana Malary (amont) a
été soumise en mai. La comparaison des traits biologiques de ces
espèces montre qu'elles s'adaptent aux différences
spatio-temporelles de salinité en variant leur régime
alimentaire, en modifiant leur reproduction et leur croissance.
Mots clés : Casamance, Estuaire, Barrage
anti-sel, Amont/Aval, Sursalinisation, Reproduction, Régime alimentaire,
Croissance, Parasite, Tilapia guineensis, Sarotherodon melanotheron
heudelotii, Hemichromis fasciatus, Ethmalosa fimbriata, Elops
lacerta.
| 


