

2012-2013
République Algérienne Démocratique
et Populaire
Ministère de l'Enseignement Supérieur et de la
Recherche Scientifique
Université El Hadj Lakhdar -
Batna-
Faculté des Sciences
Département
des Sciences de la Nature et de la Vie
Mémoire de fin d'étude
En vue de l'obtention du diplôme de
MASTER
En Sciences de la Nature et de la
Vie
Spécialité : Biologie de la Conservation
Thème :
|
Diagnostic écologique de la
végétation et bioécologie
de l'avifaune du Chott El Beida
(Wilaya de Sétif, hauts plateaux de l'Est
algérien)
|
Réalisé par :
? RADJAI Fouaz ? BECHINI Habib
Les membres du jury :
Président : Mr. CHARAK Lakhdar (M.A.A.
Université de Batna).
Promoteur : Mr. ALIAT Tewfik (M.A.A.
Université de Bordj Bou-Arreridj). Co-Promoteur : Mr.
SI BACHIR Abdelkrim (Professeur, Université de Batna).
Examinateur : Mlle. NOURI Lylia (M.C.B. Université de
Batna).
ãíÍÑáÇ
äãÍÑáÇ Çááå
ãÓÈ
BECHINI H. et RADJAI F.
REMERCIEMENTS
Arrivé au terme de ce travail, nous voulons remercier
toutes les personnes qui, de près ou de loin, nous ont aidées
dans la réalisation de ce travail.
En premier lieu, nous remercions nos directeurs de
thèse, Mr SI BACHIR A. et Mr ALIAT T. pour ses soutiens inconditionnels
qui ont permis la réalisation de ce travail dans les meilleures
conditions.
Nous exprimons également nos remerciements aux membres
du jury qui ont accepté de juger ce travail, notamment le
président de jury Mr. CHARAK L.
Nous remercions Mr HAMCHI A., BRAMI Y. et Mlle BOULAACHEB N.
pour ses aides à l'identification des espèces
végétales.
Nous remercions également à remercier Mr
CHENCHOUNI H. et Mme NOURI L. de ses aides et ses gentillesses.
Notre remerciements vont également aux:
· Personnel du parc national de Belezma;
· Personnel de la bibliothèque de l'institut de
l'agronomie, université Batna;
Pour ses aides documentaires utiles, et pour leurs accueils et
pour la mise à notre disposition de la bibliothèque et ses
archives des travaux réalisés sur notre sujet.
Nous remercions d'autre part Mr ABASS chef de laboratoire des
forêts, institut de l'agronomie université de Batna pour son
accueil.
Et nous répétons à remercier chef de
laboratoire de l'écologie BOULAACHEB N., département de la
pharmacie, université El Bez, Sétif pour sa disponibilité
et son accueil au niveau de cette laboratoire.
Nous remercions aussi bien BOUABDLLAH W., pour son mise en
service à nous une paire de jumelle.
Enfin, nous remercions encore et sans doute le riverain du
chott TOUATI H. pour son gentillesse et son aide par l'utilisation de son
voiture.
Sommaire
SOMMAIRE
LISTE DES TABLEAUX LISTE DES FIGURES LISTE DES
ANNEXES
INTRODUCTION ....1
METHODES D'ETUDE 4
1. Présentation de la région et du site
d'étude 4
1.1. Aspect général .....4
1.2. Situation géographique .4
1.3. Géomorphologie « Formations superficielles
» ..4
1.4. Géologie et Pédologie 6
1.5. Hydrologie 7
1.6. Climat ....9
1.7. Occupation des sols 16
1.8. Considérations floristique et faunistique 16
1.9. Valeurs sociales et culturelles ....17
2. Méthodes et techniques d'étude de la
biocénose 18
2.1. Méthodes d'étude de la flore et de la
végétation 18
2.1.1. Méthodes de mise en place d'un inventaire
floristique ..18
2.1.2. Catégories biologiques et statut
biogéographique de la végétation 19
2.2. Méthodes d'étude de l'avifaune .20
2.2.1. Méthodes de dénombrement 20
2.2.2. Statuts bioécologiques de l'avifaune ..21
2.2.3. Méthodes d'étude de l'organisation
spatiotemporelle 22
3. Exploitation des données de l'étude de
l'avifaune par des indices écologiques ..22
3.1. Indices de diversité des peuplements ..22
3.1.1. Richesse spécifique totale 23
3.1.2. Richesse spécifique moyenne .23
3.1.3. Indice de diversité de SHANNON 23
3.1.4. Indice d'équipartition (Equitabilité)
24
3.2. Indices de structure et d'organisation des peuplements
.25
3.2.1. Fréquence en nombre ..25
Sommaire
3.2.2. Constance ou fréquence d'occurrence 25
3.2.3. Indice de similitude de SORENSEN .25
4. Analyse statistique de la variation pluriannuelle
des effectifs d'oiseaux d'eau en fonction des
précipitations 26
RESULTATS ET DISCUSSIONS ...27
1. Flore et végétation 27
1.1. Inventaire systématique .27
1.1.1. Résultats ...27
1.1.2. Discussion ..27
1.1.3. Conclusion 30
1.2. Catégories biologiques et statut
biogéographique de la végétation 30
1.2.1. Résultats .30
1.2.2. Discussion ..31
1.2.3. Conclusion .34
2. Bioécologie de l'avifaune recensée
.35
2.1. Inventaire global 35
2.1.1. Résultats .35
2.1.2. Discussion ..36
2.1.3. Conclusion .38
2.2. Statuts bioécologiques 38
2.2.1. Résultats ..38
2.2.1.1. Types fauniques ..38
2.2.1.2. Catégories phénologiques 40
2.2.1.3. Catégories trophiques ..41
2.2.1.4. Catégories de protection ..41
2.2.2. Discussions .42
2.2.2.1. Discussion concernant les types fauniques .42
2.2.2.2. Discussion concernant les catégories
phénologiques ..43
2.2.2.3. Discussion concernant les catégories trophiques
45
2.2.2.4. Discussion concernant les catégories de
protection 47
2.2.3. Conclusion ..48
Sommaire
2.3. Evolution des effectifs d'oiseaux d'eau (Recensements
hivernaux 2003-2011) .49
2.3.1. Résultats ..49
2.3.2. Discussion 49
2.3.3. Conclusion ..53
2.4. Structure et organisation de l'avifaune du Chott El Beida
.53
2.4.1. Répartition spatiotemporelle de l'avifaune 53
2.4.1.1. Résultats ..53
2.4.1.1.1. Dans l'espace ...53
2.4.1.1.2. Dans le temps ..55
2.4.1.2. Discussion 55
2.4.1.2.1. Dans l'espace ...55
2.4.1.2.2. Dans le temps ..56
2.4.1.3. Conclusion ..59
2.4.2. Variation des fréquences d'abondance et de
constance dans le temps .59
2.4.2.1. Résultats .....59
2.4.2.2. Discussion 59
2.4.2.3. Conclusion .62
2.4.3. Similitude des peuplements dans le temps .62
2.4.3.1. Résultats .62
2.4.3.2. Discussion 63
2.4.3.3. Conclusion 63
2.4.4. Diversité du peuplement avien .63
2.4.4.1. Résultats .63
2.4.4.2. Discussion 64
2.4.4.3. Conclusion ..65
2.4.5. Analyse de la variation pluriannuelle des effectifs des
oiseaux d'eau en fonction des
précipitations .65
2.4.5.1. Résultats .....65
2.4.5.2. Discussion .....65
2.4.5.3. Conclusion .....67
CONCLUSION GENERALE 68
REFERENCES BIBLIOGRAPHIQUES 70
ANNEXES 81
Listes des tableaux, des figures et des annexes
LISTE DES TABLEAUX
Tableau 1 : Données climatique
mensuelles de la région d'étude (2003-2011) 10
Tableau 2 : Liste systématique, noms
communs, types biologiques, pérennité et statuts
biogéographiques des espèces
végétales inventoriées dans le Chott El Beida 28
Tableau 3 : Types biogéographiques des
espèces végétales inventoriées à Chott El
Beida 31
Tableau 4 : Comparaison de la flore de
présent travail avec la flore des autres zones ..34
Tableau 5 : La liste systématique des
espèces aviaires recensées au Chott El Beida
(Dénombrement
hivernal de la DGF* durant la période de 2003 à
2011 + Nos observations, 2012) 35
Tableau 6 : Nom
scientifique, nom français et anglais des espèces d'oiseaux
signalées dans le Chott El
Beida .36
Tableau 7 : Nombre et
pourcentages des différentes taxons (Ordres, Familles, Genres et
Espèces) des
oiseaux recensés à Chott El Beida
37
Tableau 8 : Comparaison des nombres des taxons dans le
Chott El Beida avec ceux recensés en Algérie, Sebkha Bazar,
Sebkha El Hamiat, Sebkha Melloul et Chott El
Fraine ..37
Tableau 9 : Répartition de l'avifaune
recensée dans le Chott El Beida par types fauniques (S F.),
catégories phénologiques (C. Ph.), trophiques
(C. T.) et de protection (C. Pr.) ..39
Tableau 10 : Les types fauniques des
espèces d'oiseaux du Chott El Beida selon VOOS (1960) ..40
Tableau 11 : Répartition de l'avifaune
du Chott El Beida sur les catégories
phénologiques 40
Tableau 12 :
Répartition de l'avifaune inventoriée dans le Chott El
Beida en fonction des catégories
trophiques .41
Tableau 13 : Exemple de
l'importance de l'avifaune du Chott el Beida par catégories de
protection à
l'échelle nationale et internationale .42
Tableau 14 : Origines biogéographiques
simplifiées des oiseaux du Chott El Beida .42
Tableau 15 : Caractéristiques des
oeufs d'un gravelot Charadrius sp .45
Tableau 16 : Répartition des
proportions des catégories phénologiques en fonction des
catégories
trophiques de l'avifaune recensée 46
Tableau
17 : Résultats du dénombrement des oiseaux d'eau
réalisés par la direction générale des forêts
à
Chott El Beida en période hivernale (2003 à
2011) ..50
Tableau 18 : Fréquences d'abondance ou
fréquences centésimales (Fc%) des espèces
d'oiseaux recensés
dans le Chott El Beida (Mai et Juin 2012) 60
Listes des tableaux, des figures et des annexes
Tableau 19 : Répartition temporelle et
fréquence d'occurrence (C%) avec l'échelle de constance (EC) :
C : espèce constante ; A :
espèce accessoire, des espèces d'oiseaux d'eau recensées
dans le Chott El
Beida (Mai et Juin 2012) .60
Tableau 20 :
Valeurs de l'indice de similitude de SORENSEN (Qs) pour les
peuplements aviens du Chott
El Beida suivant les dates de sorties prises deux à
deux ..63
Tableau 21 : Paramètres de
diversité du peuplement d'oiseaux recensés en mai et juin 2012
dans le
Chott El Beida 64
Tableau 22 :
Résultat de l'analyse de variance des effectifs
recensées dans Chott El Beida entre 2003-
2011avec l'effet des précipitations 66
LISTE DES FIGURES
Figure 1 : Carte de la situation du Chott El
Beida, wilaya de Sétif et Batna (KHAZNADAR,
2009) 5
Figure 2 : Situation
géographique du bassin versant des hauts plateaux constantinois (07)
(DEMDOUM, 2010) 8
Figure 3 : Carte des sous-bassins des hauts
plateaux constantinois (DEMDOUM, 2010) .8
Figure 4 : Evolution de la température
moyenne annuelle pour la période (2003-2011) 11
Figure 5 : Variation de la température
moyenne mensuelle pour la période (2003-2011) ..11
Figure 6 : Evolution des précipitations
annuelles pour la période (2003-2011) ..12
Figure 7 : Variation des précipitations
moyennes mensuelles pour la période (2003-2011) 13
Figure 8 :
Variation des vitesses moyennes V (km/h) et maximales VM (km/h) du
vent pour le
période (2003-2011) .13
Figure 9 : Diagramme ombrothermique de GAUSSEN
de la région (2003-2011) 15
Figure 10 : Répartition en familles des
espèces végétales inventoriées dans la zone
d'étude (Chott El
Beida) 27
Figure 11 : Répartition de
la flore recensée à Chott El Beida selon le spectre biologique
de
RAUNKIAER 30
Figure 12 : Pourcentages des
catégories de pérennité des espèces
végétales identifiées à Chott El
Beida ...31
Figure 13 : Répartition de l'avifaune du
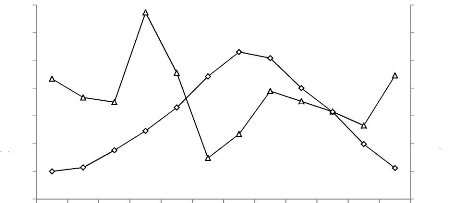
Chott El Beida par catégories phénologiques 44
Figure 14 : Evolution des effectifs des
échassiers (A), anatidés (B), et des limicoles (C) hivernants
dans le Chott El Beida au cours de la période allant 2003 à 2011
.51 Figure 15 : Cartes représentatives du Chott El
Beida et de l'occupation de l'espace adjacent au plan
d'eau (A) et de la zone de stationnement des oiseaux (B) durant
la période d'étude 54
Listes des tableaux, des figures et des annexes
Figure 16 : Répartition spatiale du
peuplement avien du Chott El Beida, le 08 mai 2012 57
Figure 17 : Répartition spatiale du
peuplement avien du Chott El Beida, le 10 mai 2012 57
Figure 18 : Répartition spatiale du
peuplement avien du Chott El Beida, le 16 mai 2012 58
Figure 19 : Répartition spatiale du
peuplement avien du Chott El Beida, le 13 juin 2012 58
Figure 20 : Répartition de l'avifaune
recensée dans le Chott El Beida selon l'abondance (Mai et Juin
2012) 61
Figure 21 : Répartition de
l'avifaune recensée dans le Chott El Beida selon la constance (Mai et
Juin
2012) 62
Figure 22 : Histogramme des Indice de Shannon
et d'Equitabilité par relevé 65
LISTE DES ANNEXES
Annexe 1 : Position de la zone d'étude dans les
subdivisions phytogéographiques d'Algérie d'après
MAIRE (1926), QUEZEL et SANTA (1962-1963)
..81
Annexe 2 : Liste des espèces
protégées par la loi Algérienne (décret N°
83-509 du 20 août 1995)
(ANONYME, 2005) 81
Annexe 3 : Dénombrements hivernaux
annuels des oiseaux d'eau (ANONYME, 2005) 81
Annexe 4 : Les familles des oiseaux
considérés comme oiseaux d'eau (DENALY, 2007) 82
Annexe 5 : Le concept du matorral (AIDOUD,
2003) ...82
Annexe 6 : Renoncule scélérate
systématique et biologie (SITE WEB05) et des personnelles photos de
|
quelques espèces végétales
|
..83
|
|
Annexe 7 : Systématique et biologie de
Frankenia thymifolia (SITE WEB06)
|
85
|
|
Annexe 8 : Liste des espèces aviaires par
statut (BAAZIZ et al., 2011)
|
.86
|
|
Annexe 9 : Le groupe de flamant rose
Phoenicopterus ruber observé sur le Chott
|
87
|
|
Annexe 10 : Le groupe de héron garde
boeufs Areola ibis observé sur le Chott
|
88
|
Annexe 11 : La constance ou la fréquence
d'occurrence des deux rapaces carnivores nicheurs du Chott
El Beida (DGF) 89
Annexe 12 : Lois
Algérienne et conventions internationales pour la protection des oiseaux
et de
l'environnement comme leur habitat 89
Annexe 13 :
L'inscription du Chott El Beida sur la liste RAMSAR des zones humides
d'importance
internationale (Anonyme, 2004) ..91
Annexe 14 :
Situation géographique de l'éco-complexe des zones
humides de la région de Sétif 1: Sebkha Melloul, 2: Sebkha
Bazer-Sakra, 3: Sebkha El-Hamiet, 4: Sebkha El-Fraïne, 5: Chott El
Beida 91
Annexe 15 : Photos originales dans le Chott El
Beida 92
1
Introduction
INTRODUCTION
Les écosystèmes typiquement
méditerranéens ont résulté de l'effet
combiné de facteurs naturels et de l'impact de l'homme. Le bassin
méditerranéen dont fait partie l'Algérie se compte parmi
les régions du monde les plus riches en terme de biodiversité
faunistique et floristique. En effet, MYERS et al. (2001)
considèrent que les pays méditerranéens détiennent
presque 4,5% de la flore mondiale.
DI CASTRI (1981), a énuméré les
principaux facteurs qui reflètent la grande diversité et
l'hétérogénéité de ces
écosystèmes : la transition entre les climats humides et arides ;
les changements paléo-climatiques, la topographie
disséquée et les reliefs. Les zones humides
méditerranéennes constituent un remarquable héritage
naturel, formant une zone de transition entre les systèmes terrestres et
aquatiques. Elles sont caractérisées par une grande richesse
biologique et assurent d'importantes fonctions dans l'écosystème
(WILLIAMS, 1990). La superficie couverte par les zones humides dans le bassin
méditerranéen est estimée à 21.000 Km2,
dont 4.700 Km2 sont les lagunes côtières, 2.800
Km2 de lacs d'eau douce et des marais et 11.600 Km2 sont
les lacs salés temporaires, trouvées majoritairement dans
l'Afrique du Nord (BRITTON et CRIVELLI, 1993).
Les types des zones humides les plus caractéristiques
en Algérie sont les zones humides endoréiques. Ils se composent
des chotts et des sebkhas, comme connus en arabe, aussi appelés lacs
salés athalassic. Le terme athalassic désigne les eaux salines
qui sont isolées à partir de la mer (KRAIEM, 2002).
Les chotts et les sebkhas sont généralement des
zones humides saisonnières qui s'assèchent en été
et sont rénondées en hiver. Selon KAABECHE et al.
(1993), ces termes désignent une structure géomorphologique
à deux niveaux en sel, une zone centrale dénommée Sebkha
où s'accumulent et se concentrent les eaux de pluies fortement
chargées en sel. Le sol de cette zone est dépourvu de
végétation et une zone dénommée Chott constituant
la bordure de la cuvette où se développe en couronne une
végétation halophile. Cette végétation
principalement composée d'espèces halophiles, succulentes et
pérennes. Dans ces environnements les principaux facteurs
contrôlant la végétation sont la salinité de l'eau
durant la saison de croissance, la profondeur et la période des
inondations (WHIGHAM et al., 1993). La végétation sur
les bords du chott comprend principalement des membres de la famille des
chénopodiacées (comme Salsola ssp., Sueda ssp., Salicornia
ssp. et Atriplex ssp.).
Les zones humides en Algérie ont pendant longtemps été une
source d'eau pour les humains et leur bétail, en particulier pendant les
saisons sèches. Elles sont présentes à des latitudes et
donc elles ont des climats différents, ont des pH variés, des
teneurs en matières organiques variables, des taux d'hydromorphie des
sols différents... et sont donc des milieux physionomiquement
diversifiés et riches en espèces. La grande diversité des
communautés végétales et des habitats qui
caractérisent les zones humides leur confère une grande
capacité d'accueil pour un grand nombre d'espèces animales
(YEANN, 2006).
2
Introduction
Par ailleurs, elles sont des lieux d'une biodiversité
riche et sont d'une importance majeure pour les oiseaux migrateurs et
constituent un lieu d'hivernage pour des milliers de canards, les foulques, les
oies et les flamants roses (KRAIEM, 2002).
En effet, elles accueillent également de nombreuses
espèces d'oiseaux qui y trouvent des lieux de reproduction, d'hivernage,
d'alimentation, de protections... adéquates. Une grande partie de
l'avifaune présente dans les zones humides n'est pas résidente
d'une manière permanente. Aussi, beaucoup d'espèces sont
migratrices et ne font que passer ou y restent quelques mois (YEANN, 2006).
En Algérie, peu d'articles démontrent le
rôle écologique joué par les zones humides dans l'entretien
des oiseaux d'eau migrateurs qui les fréquentent (HOUHAMDI, 2002 ;
HOUHAMDI et SAMRAOUI, 20012003 et 2008 ; MAYACHE et al., 2008 ;
METALLAOUI et HOUHAMDI, 2008 ; METALLAOUI et al., 2009). De plus, ils
ne concernent que les régions surplombant le littoral septentrional du
pays. Ainsi, le biomonitoring, la reproduction et les stratégies
d'hivernage de cette avifaune aquatique, surtout dans les hydrosystèmes
continentaux (steppiques et sahariens) restent à enrichir et à
documenter. Les seuls travaux réalisés dans ces régions
concernent la région d'Oum El-Bouaghi dans les hauts plateaux de l'Est
Algérien (MAAZI, 2005 ; 2009 ; SEDDIK, 2005 ; SAHEB et al.,
2006 ; SAMRAOUI et al., 2006 ; BOULEKHSSAIM et al., 2006 et
2009 ; HOUHAMDI et al., 2008). Les vastes écosystèmes
aquatiques de la région de Sétif, souvent inaccessibles n'ont
fait l'objet d'aucune étude antérieure (BAAZIZ et al.,
2011).
L'éco-complexe des zones humides des hauts plateaux de
l'Est d'Algérie (la région de Sétif) constitue une escale
vitale pendant des moments cruciaux pour de nombreux oiseaux d'eau hivernant
dans le Sahara ou de retour vers les lieux habituels de nidification. La
diversité des habitats aquatiques et notamment des ceintures de
végétation attirent de nombreuses populations nicheuses. Les
vastes écosystèmes aquatiques de la région de Sétif
(Sebkha de Melloul, Sebkha de El-Hamiat, Chott El-Fraine, Sebkha de Bazer-Sakra
et Chott El-Beida) sont les plus élevés d'Algérie (environ
1200 m) (BAAZIZ, 2006).
En dépit de leur importance internationale, les zones
humides en Algérie sont constamment sous la menace. La vitesse à
laquelle les zones humides sont perdues en Algérie est inconnue, mais
elle s'est accélérée ces dernières années du
fait des activités menées par l'homme telles que le
surpâturage et l'urbanisation qui affectent la faune et la flore
engendrant ainsi un déséquilibre irréversible de ces
milieux. En effet, l'agriculture menée autour des zones humides est
liée à l'augmentation de la population rurale et du bétail
qui a pratiquement éliminé la végétation
émergente sur les bords de ces dernières conduisant à une
érosion sévère et une mauvaise
régénération (MEDAIL et QUEZZEL, 1999 ; GREEN et
al., 2002). Le déboisement et le drainage ont abouti
à la perte d'habitats humides donc de la biodiversité (AYYAD,
2003).
3
Introduction
Chott El Beida, situé au Nord-est de l'Algérie,
est un bon exemple de l'impact de tous ces facteurs sur la
végétation semi-naturelle, malgré sa désignation
comme site Ramsar du fait qu'il constitue un lieu important pour la
reproduction et l'hivernage de nombreuses populations d'oiseaux rares et
menacés, il s'agit notamment du flamant rose, de la Grue cendrée
et de plusieurs espèces d'Anatidés. Par conséquent, la
protection et la gestion future du site, dépendent de façon
critique de l'établissement d'une bonne base de données
floristique et faunistique. Surtout que la zone est dépourvue de toutes
infrastructures ou équipements et elle ne fait l'objet d'aucune
recherche scientifique (ANONYME, 2004).
Le présent travail s'articule principalement autour de
deux objectifs : Il s'agit de décrire la flore de bordure du Chott El
Beida avec une mise en évidence des catégories biologiques et
biogéographiques de la végétation en place. Le
deuxième objectif porte sur le recensement des oiseaux au niveau du
Chott, dans le but de connaitre, qualitativement, d'une part, en
caractérisant la structure du peuplement avien (espèces aviaires)
et quantitativement, d'autre part avec le nombre d'individus de chaque
espèce.
La distribution et l'évolution des populations
d'oiseaux dans le temps et dans l'espace et en fonction des facteurs
climatiques compte parmi les objectifs de ce travail.
Cette modeste contribution vise principalement à
enrichir la recherche scientifique concernant le site d'étude, visant
principalement l'élaboration ultérieure d'un plan de gestion du
site, pourront apporter des actions assurant d'une façon ou d'une autre
la conservation durable non seulement des oiseaux mais de leurs habitats
habituels.

4
Méthodes d'étude
METHODE D'ETUDE
1. Présentation de la région et du site
d'étude
1.1. Aspect général
Le Chott El-Beida est une zone humide qui se compose d'une
sebkha, ou lac naturel, salé, temporaire, auquel se rattache une prairie
humide permanente couverte par une végétation halophyte
appelée Chott. Il ne s'inonde entièrement que rarement, le niveau
d'eau peut alors atteindre 1,5 m de profondeur. En période sèche,
à partir de juin, les croûtes blanchâtres de sel
s'étalent à perte de vue (ANONYME, 2004 ; BOUMEZBEUR et
BOULAHLIB, 2005).
1.2. Situation géographique
Le site d'étude fait partie de l'ensemble naturel des
hautes plaines sétifiennes, et plus précisément du sous
bassin du Chott El Beida (El-Eulma), qui se situe dans l'Est Algérien,
appartient du bassin versant des hauts plateaux constantinois (DEMDOUM,
2010).
Le site qui chevauche sur 2 wilayas, Sétif et Batna, se
situe à 4 km au sud du village, chef-lieu de Daïra de Hammam Sokhna
et se trouve dans la wilaya de Sétif (Figure 1). La plus grande partie,
située au Nord, revient à Sétif et plus
particulièrement à la commune de Hammam Sokhna, et celle au Sud
à la commune de M'Sil qui fait partie de la wilaya de Batna. La
superficie totale du site s'étend sur 12223ha, avec une altitude de 874
à 887m (ANONYME, 2004). Le site est délimité par les
coordonnées géographiques suivantes (ALIAT, 2007):
? Latitude:35°54' 20" Nord et 35° 57' 80" Nord
? Longitude: 05° 53' 20" Est et 05° 53' 30" Est
Le Chott est limité au Nord par Bled El Mounchar et
Hammam Sokhna, au Sud par Mechta Fredas, Mechta Lachraf, Douar M'sil et Mechta
Romada, à l'Est par Douar Ouled Zaîm et Oum Laadjoul et les
frontières de la wilaya de Batna et à l'Ouest par Douar Tella,
Mechta Baararou, Bled El Guergour, Mechta Ouled Agoun et la route d'El Eulma
(BOUMEZBEUR et BOULAHLIB, 2005).
La zone humide fait partie du domaine public de l'état,
elle est sous la tutelle de trois ministères, l'agriculture et le
développement rural, les ressources en eau, et l'aménagement du
territoire et de l'environnement.
1.3. Géomorphologie « Formations
superficielles »
La région d'étude se présente comme une
surface plane, parsemée de quelques Djebels ou reliefs vigoureux. Cette
surface plane représentait au début des temps quaternaires un
unique lac dont il ne subsisterait plus que quelques témoins (sebkhas :
Bazar, Melloul, El Mallah, El Beida) (BECHTEL, 1975).
5
Méthodes d'étude
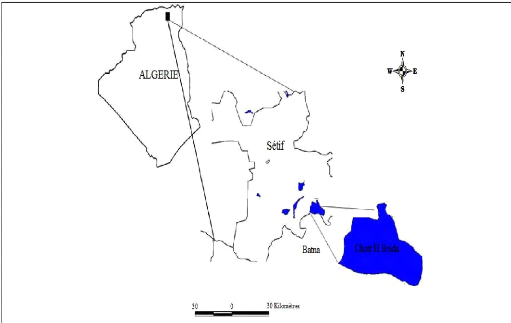
Figure 1 : Carte de la situation du Chott El
Beida, wilaya de Sétif et Batna (KHAZNADAR, 2009).
Trois formes physiographiques importantes se dégagent :
? Les Djebels :
Au Nord de notre zone d'étude, émergent le
Djebel Garsa, Kef El Manchar, et Djebel Tnoutit qui dépasse 1150m
d'altitude, elle est limitée au sud par une chaîne montagneuse
avec les points culminants : Djebels Fourhal (1748m), Drâa Akhennchoub
(1578m), Djebel Mahdjouba (1492m), et Djebel Tafourar (1449m). A l'Est, par
Djebel Aghmarouel qui culmine à 1241m, et à l'Ouest par Kef Tella
(GHEBOULI et BENCHEIKI, 2008 ; DEMDOUM, 2010).
? Surfaces plus ou moins planes :
Ces surfaces correspondent aux glacis, zones
intermédiaires entre la montagne et la cuvette,
caractérisées par de basses pentes (3 à 12%) (ALIAT,
2007), étages conduisant du versant montagneux à une
gouttière. Le remblaiement Plio-quaternaire à
généralement moins de 100 mètres d'épaisseur, les
formes dominantes sont assurées par le glacis anciens (DEMDOUM,
2010).
? La dépression ou la cuvette :
Englobe la sebkha, qui est affecté par des
dépôts fins, elle est dépourvue d'accidents topographiques
avec une pente faible (0 à 3%). Les remblaiements peuvent atteindre 300
à 500 mètres d'épaisseur.
6
Méthodes d'étude
1.4. Géologie et Pédologie
1.4.1. Géologie
Les hautes plaines Sétifiennes appartiennent à
la chaîne alpine qui constitue les reliefs de toute l'Algérie
septentrionale (VILA, 1980). Ces plaines sont de vastes étendues
aplanies ou nivelées autour d'une altitude moyenne de 940
mètres.
Vu l'extrême sensibilité des
végétaux à la salinité, l'examen des sources de
salure dans la zone d'étude nécessaire. Les cartes
géologiques (BATIER et al., 1959 ; VILA, 1977) montrent la
lithomorphologie et la tectonique de la zone et permettent de distinguer les
ensembles suivants :
A. Terrains peu ou pas tectonisés :
Ces terrains sont ceux du quaternaire et du
Mio-pliocène.
? Quaternaire
Les terrains quaternaires sont très
hétérogènes et on y trouve du sable, des limons, des
cailloutis et surtout des argiles. Parmi ces terrains, se trouvent ceux reliefs
aux Chotts et sebkhas, où sont associées les formes classiques
l'endoréisme.
? Mio-pliocène
Le Moi-pliocène correspond à des
dépôts fluvio-lacustres offrant habituellement une coloration
rougeâtre assez prononcée ; la basse du moi-pliocène
formée de calcaires lacustres, au-dessus desquels reposent des marnes
grises, des cailloutis qui contiennent de grosses lentilles
conglomératiques et des niveaux de sels ou de gypse (BOUDOUKHA, 1988).
Au Nord-Est du Chott El Beida, en trouve des calcaires lacustres et des
conglomérats dont l'ensemble a une teinte rose, et les affleurements de
ce type de formation sont localisés autour de Djebel Garsa (GOUMIDI et
KAOUACHE, 1995).
B. Terrains tectonisés
Ces terrains sont représentés par l'ensemble
allochtone Sud Sétifien, qui est formé par une série de
massifs calcaires relevant de l'Eocène calcaire qui affleure à
Oum Laadjoul, Djebel Tafourar, et Djebel Aghmarouel ; du Dogger calcaire qui
affleure a Djebel Tafourar et enfin du Trias où il s'agit de
dépôts lagunaires, riches en gypse, en halite et en argiles
varicolores, qu'on rencontre à Djebel Garsa (BOUDOUKHA, 1988).
Le Trias gypso-salifère joue un rôle important
dans la qualité chimique des eaux en contaminant certains
aquifères voisins (ALIAT, 2007).
1.4.2. Pédologie
Les sols entourant le site, peu salés à
salés, sont alcalins à structures dégradée, avec
présence de calcaire et de gypse qui varient d'une façon
irrégulière est sont caractérisés par une texture
limoneuse,
7
Méthodes d'étude
argilo-limoneuse, argilo-sableuse, limono-sableuse (O.T.I.,
1974 ; BECHTEL, 1975 ; LAHMAR et al., 1993 ; B.N.E.D.E.R., 2000 ;
ALIAT, 2007).
Le Ph basique est de 8,5, la conductivité moyenne varie
entre 0,76 et 8,3 et la composition des sels est souvent dominée par
ceux sulfatés et d'autres chlorurés (ANONYME, 2004).
1.5. Hydrologie
Les Chotts et les sebkhas appartiennent à un
régime hydrographique endoréique, ce caractère
endoréique est bien une conséquence de la sécheresse.
Elles seraient alors alimentées par des venues profondes mal connus,
mais restent cependant sous la dépendance d'apports sporadiques d'eau de
crue plus ou moins abondant, changés souvent en sels, par suite de leur
passage dans les terrains salifères comme les marnes du Miocène
ou le massif Triassique (SAHEB, 2003).
En outre, POUGET (1980) cité par (BOUZID, 2003)
définit les Chotts et les sebkhas comme des systèmes
évaporatoires s'alimentant des apports superficiels de ruissellement et
des nappes plus profondes. Tout autour de la sebkha, la présence d'une
nappe phréatique salée est inégalement profonde, contribue
à la formation des sols halomorphes.
Selon la répartition faite par l'ANRH (Agence Nationale
des Ressources Hydrauliques), l'air d'étude qui se situe dans le sous
bassin versant N° 1 de Chott El Beida (1596km2), l'un des 7
sous bassins constituant le grand bassin versant N° 7 de hauts plateaux
constantinois (qui a une superficie de 9578km2) (Figure 2 et 3),
correspond à un exutoire naturel commun aux massifs limitrophes. (BACHA
et BECHIM, 2005 ; ALIAT, 2007).
Le Chott s'inonde en période pluvieuse et
s'assèche totalement en été, son bassin versant
reçoit un débit moyen annuel de 16 millions de m3 dont
une partie s'infiltre pour alimenter la nappe phréatique (BECHTEL,
2005). Il ne s'inonde entièrement que rarement, son niveau d'eau peut
alors atteindre 1,5 m de profondeur.
En période sèche, à partir de juin, des
croûtes blanchâtres de sol s'étalant à perte de
vue.
Valeurs hydrologiques:
Le Chott est une basse dépression ou viennent
s'accumuler eaux et sédiments, lors des années exceptionnelles
elle joue le rôle de zone d'épandage des crues évitant
ainsi l'inondation des zones avoisinantes (BOUMEZBEUR et BOULAHLIB, 2005).
Méthodes d'étude
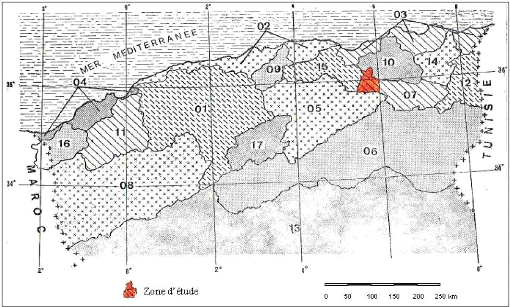
Figure 2 : Situation géographique du
bassin versant des hauts plateaux constantinois (07) (DEMDOUM, 2010).
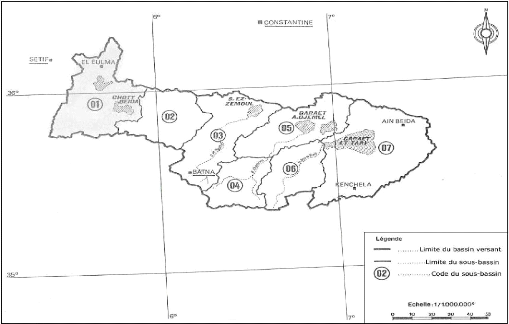
Figure 3 : Carte des sous-bassins des hauts
plateaux constantinois (DEMDOUM, 2010).
8
9
Méthodes d'étude
1.6. Climat
Le climat est un élément important dans
l'étude du milieu, il est à la base de la distribution des
végétaux et des animaux. C'est un facteur clé de
valorisation des milieux naturels, ce qui nécessite une investigation
analytique de ses composantes (MERDAS, 2007).
Le régime climatique des Hautes Plaines
Sétifiennes est commande aussi bien par la Morphologie du secteur que
par sa position en latitude et en altitude. En été elles sont
soumises à l'influence des hautes pressions subtropicales qui repoussent
vers le Nord le Front Polaire. Il en résulte un climat chaud et sec. En
hiver le Front Polaire descendant vers le sud repousse les zones de haute
pression vers des latitudes plus basses. L'effacement partiel de l'anticyclone
des Açores permettra l'apparition d'une circulation d'Ouest et
l'établissement de courants perturbés. Sur la base d'une
série de situations météorologiques qui se
répètent régulièrement, on peut dire que se
développent en Méditerranée trois types de perturbations :
en Décembre, Janvier, et Février.
- Les perturbations d'origine Nord Atlantique suivent une
direction N.NW.S.SE.
- Les perturbations d'origine Sud Atlantique Ouest, Sud-Ouest
à Est, Nord-Est. En Mars et Avril ainsi qu'en Octobre et Novembre, la
région subit aussi des perturbations d'origine Africaine. Dans le
détail, il est possible d'observer un certain nombre de situations
spéciales qui commandent autant de types de temps (DEMDOUM, 2010).
Les masses d'air humides venues de la mer sont contraintes
dans leur cheminement à franchir les crêtes de la chaîne
Kabyle. De ce fait elles se débarrasseront d'une grande partie de leur
humidité et les versants de Kabylie orientés vers la mer
recevront un volume très important de précipitations et ce
d'autant plus que nous sommes dans un secteur où le Front Polaire
dérivé est fréquemment présent. Lorsqu'elles
descendront vers !es Hautes Plaines, les masses d'air se réchaufferont
par effet de Foehn. Plus au Sud, il y aura une nouvelle augmentation de la
pluviosité liée au franchissement de la chaîne du Hodna ou
de celle des Aurès et à la présence des Fronts
Méditerranéens I et II. De la même façon, il y aura
augmentation du volume des précipitations au niveau des massifs
calcaires disséminés sur les Hautes Plaines. A l'inverse. Les
couloirs ouverts entre les Monts des Hodna et ceux, des Aurès
permettront l'avancée vers le Nord des influences Sahariennes. Les
Hautes Plaines Sétifiennes occupant une position élevée en
altitude seront soumises à un climat de montagne chaud pendant la
journée. Froid la nuit. De la même façon. Les hivers seront
froids et la neige fréquente. A El Eulma, la saison pluvieuse se
développe de Septembre à Juin, la période sèche se
limitant aux mois de Juillet et d'Août (DEMDOUM, 2010).
ETUDE DES FACTEURS CLIMATIQUES
Le tableau 1, donne un bref aperçu sur les
données d'observations climatiques allant de 2003 jusqu'à
2011.
10
Méthodes d'étude
Tableau 1 : Données climatique mensuelles
de la région d'étude (2003-2011).
Mois
|
Paramètre*
|
Jan
|
Fév.
|
Mar
|
Avr
|
Mai
|
Juin
|
Juil.
|
Août
|
Sep
|
Oct. Nov.
|
Déc.
|
Moy
|
|
TM (°C)
|
10,6
|
11,2
|
15,0
|
18,4
|
23,4
|
30,0
|
34,9
|
33,8
|
27,4
|
22,4
|
15,9
|
10,6
|
21,1
|
|
Tm (°C)
|
-0,1
|
0,4
|
2,6
|
5,6
|
9,1
|
13,8
|
17,9
|
17,3
|
13,3
|
9,6
|
4,4
|
0,9
|
7,9
|
|
T (°C)
|
5
|
5,7
|
8,8
|
12,3
|
16,5
|
22,1
|
26,5
|
25,4
|
20
|
15,7
|
9,9
|
5,6
|
14,46
|
|
H (%)
|
78,8
|
75,7
|
69,6
|
67,9
|
60,7
|
46,7
|
38,3
|
43,0
|
58,2
|
65,4
|
73,9
|
81,0
|
63,3
|
|
VM (km/h)
|
26,9
|
29,3
|
28,8
|
28,2
|
27,6
|
28,9
|
28,5
|
28,1
|
26,9
|
25,4
|
25,8
|
25,2
|
27,5
|
|
V (km/h)
|
14,1
|
15,7
|
15,1
|
14,7
|
14,1
|
14,4
|
13,5
|
13,7
|
13,0
|
12,6
|
13,6
|
13,0
|
14,0
|
|
VV (km)
|
10,8
|
10,5
|
11,1
|
11,4
|
12,0
|
12,4
|
12,0
|
12,1
|
12,0
|
11,9
|
11,3
|
10,4
|
11,5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
?
|
|
P (mm) FG (jour)
|
43,35
3
|
36,61
2
|
34,94
1
|
67,25
0
|
45,5
0
|
14,82
0
|
23,45
0
|
38,94
0
|
35,22
0
|
31,5
1
|
26,5
2
|
44,54
3
|
442,62
13
|
Source : SITE WEB 01 * :(TM
: Températures maximales ; Tm : Températures minimales ; T :
Températures moyennes ; H : Humidité moyenne ; VM : Vitesse
maximales du vent ; V : Vitesse moyenne du vent ; VV : Moyenne de
visibilité ; P : Précipitations ; FG : Indicateur de la
présence du brouillard).
1.6.1. La température
La température est l'un des éléments
importants pour la caractérisation du climat (RAMADE, 1984 ; DAJOZ,
1985). Elle est liée à la radiation solaire. Son variation influe
sur la transformation des eaux en vapeur, que ce soit à la surface ou
dans le sous-sol. De ce fait, elle influe sur le degré
d'évapotranspiration et par conséquent elle agit sur le taux de
salinité des eaux. Toutefois, la température a un rôle
important dans la variation des composantes du bilan hydrologique (GOUAIDIA,
2008).
1.6.1.1. Variations des températures moyennes
annuelles
Les histogrammes représentant la variation annuelle de
la température, sur une période entre 2003 à 2011, montre
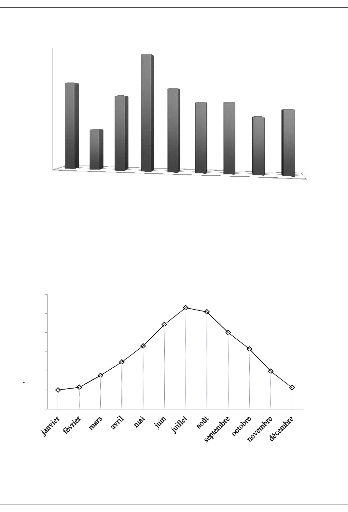
que l'année la plus chaude est l'année 2006 avec une moyenne de
15,1°C, et l'année la plus froide est l'année 2004, avec une
moyenne de 14°C.
Signalons que la température moyenne interannuelle est de
l'ordre de 14,5 °C. (Figure 4).
1.6.1.2. Variations de la température moyenne
mensuelle
L'analyse de la courbe de variation de la température
moyenne mensuelle, montre que les valeurs les plus élevées sont
observées pendant l'été (juin- septembre) avec des
températures allant de 20 à 26,5°C, la plus grande valeur
correspond au mois de juillet. Les valeurs les plus basses, qui varient de 5
à 8,8°C, sont observées durant la période hivernale
(décembre - mars), avec un minimum pendant le mois de janvier
(5°C). L'influence de la température sur la qualité chimique
se fait sentir pendant la période d'été, où on a
une concentration des éléments par évaporation. (Figure
5).
11
Méthodes d'étude
15,1
14,7
14,6
14,4 14,4
14,5
14
14,3
14,2
14
13,8
13,6
13,4
2003 2004 2005 2006 2007 2008 2009 2010 2011
Années
15,2
15
14,8
14,6
14,4
14,2
Figure 4 : Evolution de la température
moyenne annuelle pour la période (2003-2011).
22,1
9,9
8,8
5,6
5 5,7
26,5 25,4
20
16,5
12,3
15,7
0
Mois
30
25
20
15
10
5
Figure 5 : Variation de la température
moyenne mensuelle pour la période (2003-2011).
Température (°C)
Température(°C)
12
Méthodes d'étude
1.6.2. La pluviométrie
L'étude pluviométrique présente un
intérêt considérable en hydroclimatologie, car elle permet
de décrire le régime d'écoulement (GOUAIDIA, 2008).
Les pluies qui tombent en Algérie sont pour la plupart
influencées par le relief, la tranche annuelle augmente dans une
région donnée avec l'altitude (SELTZER, 1946 cité par
ADJEL et MOUICI, 2004). La pluviométrie constitue donc un facteur
écologique d'importance fondamentale car le facteur eau influence
énormément de distribution des organismes (RAMADE, 1984).
1.6.2.1. Variations interannuelles des
précipitations
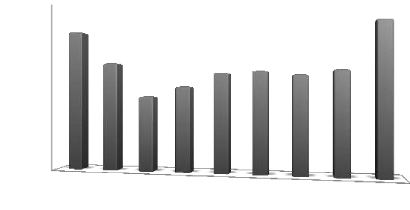
L'analyse de la courbe des variations interannuelles des
précipitations, sur une période de 9 ans (2003-2011), montre que
l'année 2011 est la plus arrosée avec614, 7mm, et l'année
2005 est la plus sèche avec 313,7mm. Notons que les
précipitations moyennes interannuelles s'évaluent à
442,6mm. (Figure 6).
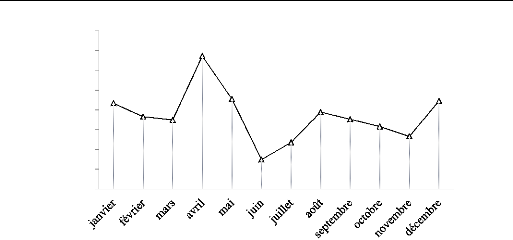
1.6.2.2. Variations moyennes mensuelles des
précipitations
L'analyse des données pluviométriques
reflète la faiblesse et l'irrégularité des
précipitations qui connaissent de grandes fluctuations d'un mois
à un autre
La courbe des variations des moyennes mensuelles des
précipitations, montre que le mois d'avril est le plus pluvieux, avec
67,3mm, alors que le mois de juillet est le plus sec, avec 14,8mm. (Figure
7).
On peut noter que l'irrégularité est plus
accentuée pour les mois d'été que pour les mois d'hiver et
plus marquée lorsque l'on se dirige du Nord au Sud.
700,0
614,7
600,0
590,1
454,9
313,7
354,8
411,2 418,3 403,1 422,7
100,0
0,0
2003 2004 2005 2006 2007 2008 2009 2010 2011
Années
Précipitation (mm)
500,0
400,0
300,0
200,0
Figure 6 : Evolution des précipitations
annuelles pour la période (2003-2011).
Méthodes d'étude
Mois
Précipitation (mm)
40,0
70,0
20,0
60,0
50,0
30,0
80,0
10,0
0,0
67,3
44,5
38,9 35,2 31,5 26,5
43,4
45,5
36,6 34,9
23,5
14,8
Figure 7 : Variation des précipitations
moyennes mensuelles pour la période (2003-2011).
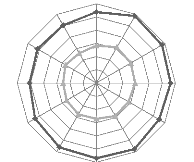
1.6.3. Le vent
Le vent agit soit directement par une action mécanique
sur le sol et les végétaux, soit indirectement en modifiant
l'humidité et la température (OZENDA, 1982). D'autre part, le
vent a une action indirecte sur les êtres vivants et il joue le
rôle de facteur de mortalité vis à vis des oiseaux et des
insectes (DAJOZ, 1983). Dans notre région, les vents sont violents et
quasi- permanents avec des directions différentes selon la saison. Deux
types de vents sont à constater, les vents dominants et le sirocco. Ceux
du premier type soufflent du Nord-Ouest et Ouest durant la période
d'octobre à avril et du Nord et Nord-Est de mai à septembre. Le
second type de vent souffle souvent en saison chaude avec une fréquence
d'environ 10 à 22 jours par an. Le maximum est noté au mois de
juillet (BACHA et BECHIM, 2005).
La vitesse moyenne calculée sur 9 ans est de 14km/h
(3,9m/s), elle peut s'atteindre à 29,3km/h (Tableau 1, Figure 8).
VM (km/h) V (km/h)
Jan
Avr
Oct
Sep
0,0
Mai
Août
Juin
30,0
25,0
Dec
Fév
20,0
Nov
15,0
Mar
10,0
5,0
Juil
13
Figure 8 : Variation des vitesses moyennes V
(km/h) et maximales VM (km/h) du vent pour le période (2003-2011).
14
Méthodes d'étude
1.6.4. L'humidité relative de l'air
Les variations des rythmes quotidiens et saisonniers de
l'hygrométrie atmosphérique jouent un rôle très
important dans l'écologie des organismes terrestres et donc des
écosystèmes continentaux (RAMADE, 2009). Tous les êtres
vivants présentent une sensibilité plus ou moins grandes au
degré hydrométrique du milieu dans la quel ils vivent, leur
approvisionnement en eau et la défense contre les pertes possible
constituent donc des problèmes écologiques fondamentaux (DAJOZ,
1985).
Selon MERTIN (1982) cité par (NASRI, 2000),
l'humidité de l'air varie le plus souvent en fonction inverse da la
température. Le degré hydrométrique de l'air ou
l'humidité relative est la quantité de vapeur d'eau qui se trouve
dans l'air, elle s'exprime souvent en % par rapport à la saturation
(ZATOUT, 2012).
Dans la zone d'étude, l'humidité relative de
l'air connaît de grandes fluctuations d'une année à une
autre et cours des mois de la même année. Elle fluctue entre 38,3
à 81% avec une moyenne de 69,6% (Tableau 1).
Les valeurs les plus élevées sont
enregistrées durant la période hivernale, correspondant notamment
aux mois de Novembre, Décembre, Janvier, et Février où
l'humidité relative dépasse 74%. La sécheresse de l'air
s'établit en été, surtout au cours des mois de Juin,
Juillet, et Août où son pourcentage ne dépasse pas 47%.
1.6.5. Synthèse climatique
La caractérisation du climat d'une zone donnée
à l'aide d'indices ou de diagrammes permet de comparer les climats d'une
région à l'autre. Ils prennent généralement en
compte l'offre pluviométrique, la demande évaporative et les
températures. Ceux qui sont les plus couramment utilisés sont les
suivants : diagramme ombrothermique de GAUSSEN et climagramme d'EMBERGER.
1.6.5.1. Diagramme ombrothermique de GAUSSEN
On doit à BAGNOULS et GAUSSEN (1953) une méthode
simple et efficace de discrimination entre la saison sèche et la saison
pluvieuse : Le critère P = 2T.
La combinaison des deux principaux facteurs température
et précipitation, est intéressante dans la mesure où elle
permet de déterminer les mois véritablement secs. Les
périodes où la pluviosité moyenne P exprimée en mm
est inférieure au double de la température moyenne T
exprimée en degrés Celsius sont considérées
sèches. Inversement, les périodes pour lesquelles la
pluviosité moyenne est égale ou supérieure au double de la
température constituent la saison pluvieuse (LE HOUEROU, 1989).
Comme le montre le graphique pluviothèrmique (Figure 9)
dans lequel les températures sont portées à
l'échelle double des précipitations) de la région ; une
période humide débutant au mois d'octobre qui se termine au mois
de mai, et une période sèche de 4 mois, qui s'étale du
mois de juin jusqu'au mois de septembre.
15
Méthodes d'étude
P (mm) T(°C)
Précipitations(mm)
40
70
20
60
50
30
10
0
Période sèche
25
20
0
35
30
5
15
10
Températures(°C)
Jan Fév Mar Avr Mai Juin Juil Août Sep Oct Nov
Dec
Mois
Figure 9 : Diagramme ombrothèrmique de
GAUSSEN de la région (2003-2011).
1.6.5.2. Climagramme d'EMBERGER
Pour déterminer les climats de la zone
méditerranéenne, LOUIS EMBERGER a proposé la
détermination d'un quotient pluviométrique
Q2, qui dépend des précipitations
moyennes annuelles et des moyennes de températures minima et maxima,
respectivement des mois le plus froid et le plus chaud. Il propose donc la
formule suivante :
( )( )
En Algérie, STEWART (1969, 1975) a montré que le
quotient pluviothermique d'EMBERGER, après simplification (où les
températures représentées par degrés Celsius) peut
s'écrire:
( )
Où :
P : précipitation moyenne
annuelle (mm)
M : moyenne des maxima du mois le plus
chaud (degrés/Kelvin) m : moyenne des minima
du mois le plus froid (degrés/Kelvin)
16
Méthodes d'étude
C'est cette formule, sous-utilisée à notre sens,
abstraction faite des travaux de LE HOUEROU (1982, 1989, 1995, 2004), qui a
prouvé son efficience, que nous retiendrons ici. On peut rappeler que ce
quotient a pour objectif de mettre en évidence la sécheresse
globale d'une station à travers des valeurs moyennes annuelles et que le
climat est d'autant plus sec que ce quotient est plus petit (DAGET, 1977 a et
b).
L'interprétation de quotient pluviothèrmique
nécessite l'emploi d'un abaque qui permet de placer une station dans
l'une des classes de climat méditerranéen qui ont
été définies, ensuite nous nous plaçons à
l'abaque d'EMBERGER :
? En abscisse la température moyenne des minimums de la
saison froide.
? En ordonnée la valeur de Q
3
L'application numérique donne les résultats
suivants :
P = 442,6 mm ;
M= 34,9 °C ; m = -0,1
°C
Ce qui donne : Q3= 43,37
Le point obtenu sur le Climagramme, permet de dire que le climat
de la région d'étude est de type
semi-aride, avec un hiver froid.
1.7. Occupation des sols
Le site se compose de deux habitats, le premier lacustre,
appelé sebkha, est dépourvu de végétation alors que
le second terrestre, appelé Chott, est tapissé d'une
végétation herbacée halophyte, renforcée et
densifiée par une plantation d'Atriplex. Les terrains voisins sont dans
leur grande majorité des exploitations agricoles où la
céréaliculture est l'activité la plus répandue. A
l'échelle du bassin versant, il y a diverses formes d'occupation, des
terrains agricoles de bonne et de mauvaise qualité, des terrains de
parcours, des terrains nus et des formations forestières sur les
hauteurs du relief dans la partie Sud (ANONYME, 2004).
1.8. Considérations floristique et
faunistique
Il est vrai que très peu de travaux ont
été consacrés à la mise en valeur des ressources
biologique et de la biodiversité de la région d'El Eulma, en
particulier du Chott El Beida, les quelques travaux réalisés sur
le site signalent la présence d'une biodiversité assez riche
(ANONYME, 2004 ; BOUMEZBEUR et BOULAHLIB, 2005).
1.8.1. Flore remarquable
Du point de vue biogéographique et d'après le
découpage de MAIRE (1926) ; QUEZEL et SANTA (1962-1963) cité par
(ALIAT, 2007), la région étudiée appartient à
l'empire floral holarctique, à la région
méditerranéenne, à la sous-région
méditerranéenne, au domaine
maghrébin-Méditerranéen, au secteur des hautes plaines
constantinoises et au sous-secteur des haut plateaux constantinois (Annexe
1).
17
Méthodes d'étude
Le Chott, ou prairie humide, abrite sur ces berges une
végétation composée de 42 espèces dont 18
espèces sont annuelles et 24 vivaces. Cette diversité floristique
se réparti en fonction des types biologiques en 18 thérophytes,
13 hémicriptophytes, 9 chaméphytes et 2 géophytes. En
attendant des inventaires exhaustifs qui font cruellement défaut, le
recensement floristique de la zone s'élève provisoirement
à42 espèces, même si certaines thèses qui demandent
à être confirmées en indiquent plus. Les quelques
espèces connues sont Halocnemum strobilaceum, Arthrocnemum indicum,
Sueda fruticosa, Juncus maritimus, Reseda alba, Tamarix gallica, Penagum
harmala, Artemesia campestris, Salicornia fruticosa, Salsola vermiculata,
Atriplex glauca, Atriplex numelaria, Atriplex canensis et Atriplex
halimus (BOUMEZBEUR et BOULAHLIB, 2005).
1.8.2. Faune remarquable
Les renseignements collectés concernent l'avifaune
suivie plus régulièrement lors des dénombrements annuels
hivernaux internationaux des oiseaux d'eau. Le site est fréquenté
par 21 d'espèces d'oiseaux dont une quinzaine est aquatique. La
moitié des espèces observée est protégée
(Annexe 2), parmi elles figurent 2 espèces intéressantes
dépassant le 1% de la population totale, le Tadorne de Belon
(Tadorna tadorna) et le Flamant rose (Phoenicopterus ruber).
Pour le Tadorne de Belon la norme de 1% a été
dépassée en 1975, 1991, 2000 et 2004. Il est à signaler
que les dénombrements n'ont pas eu lieu de 1992 à 1997. Pour le
Flamant rose la norme de 1% a été dépassée en 2000
uniquement (Annexe 3).L'effectif de l'avifaune aquatique qui visite les lieux
est très irrégulier (ANONYME, 2004).
1.9. Valeurs sociales et culturelles
Le site en raison de qualités pastorales sûres
est actuellement mis en défens afin de permettre la reconstitution des
réserves importantes qu'il recèle. Les terrains de parcours qui
limitent le Chott dans sa partie Nord et Nord Est offrent aux ovins des
pâturages naturels de hautes valeurs fourragères. Cette importance
est due aux plantations d'Atriplex (Atriplex sp.)
considérées comme une excellente plante apétale (ANONYME,
2004).
En lisière, au Sud Est, la présence de 2
escargotières prouve la présence de l'homme préhistorique.
Les escargotières, des monticules pouvant atteindre 10 m de haut et 100
à 150 m de long, sont constituées par l'accumulation des cendres,
d'outils, d'ossements et surtout de débris de coquillages d'escargot.
Elles représentent les vestiges d'anciens regroupements humains
remontant à la civilisation capsienne (4.000 à 7.000 ans avant
J.C). Appelées aussi cendrières, elles sont
désignées sous l'appellation arabe «Ramadiyate» ou
« Halazouniate » d'où le nom de la mechta de Romada où
les escargotières sont localisées. Ce genre de vestiges se
rencontre souvent dans les plaines de la région du constantinois
(Constantine, Batna, Khenchela, Sétif, Oum El Bouaghi, etc.) selon des
sources archéologiques qui
18
Méthodes d'étude
toutefois ne confirment pas la protection ou le classement de
ces sites dont l'importance ne trouve pas encore la considération voulue
auprès des administrations chargées de l'archéologie. Ceci
dit, le constat peut être autrement pour la paléontologie car les
investigations scientifiques pourraient réserver des secrets sur les
êtres et leur évolution dans le passé lointain.
L'étude archéologique ou paléontologique devrait
révéler des aspects culturels des populations anciennes
jusque-là inconnues. Une étude spécifique menée par
des spécialistes lèverait le voile sur des milliers
d'années d'histoire et donnerait au site une autre valeur culturelle et
historique importante (ANONYME, 2004).
2. Méthodes et techniques d'étude de la
biocénose
2.1. Méthodes d'étude de la flore et de
la végétation
2.1.1. Méthodes de mise en place d'un inventaire
floristique
Le but de l'inventaire floristique est de recenser d'une
manière systématique toutes les espèces
végétales qui se trouvent dans notre région
d'étude. Cet inventaire constitue un archive référentiel
fournissant beaucoup de renseignements sur la flore caractéristique du
site.
Le mieux couvert végétal s'étend sur le
côté Est et le côté Nord du Chott, lors de chaque
sortie nous avons récoltés des échantillons
représentatifs des espèces végétales pour
être confectionnés en herbier au laboratoire. L'herbier est un
moyen de conservation des spécimens végétaux de la
région étudiée, il permet d'une part d'avoir une base de
données des végétaux, facilement accessibles et d'autre
part d'avoir de servir de moyen de comparaison et d'identification pour des
études taxonomiques ou écologiques. Chaque espèce
observée est automatiquement récoltée.
Au laboratoire, ces échantillons sont dressés
dans du papier journal pour être desséchées, et
collées sur du papier chemise tout en mentionnées les
données pertinentes.
L'identification des espèces inventoriées a
été effectuée à la contribution de trois
spécialistes en botanique, le premier est Mr HAMCHI A (chef du
département "Animation et Information" au parc national de Belezma); il
a utilisé leur expérience et une loupe manuelle au niveau du
laboratoire de l'écologie fonctionnelle -département de la
biologie, université de Batna- pour déterminé la
plupart des genres des espèces mais il a confirmé un nombre
remarquable des espèces, le deuxième est Mr BGHAMI Y (laboratoire
des forêts -institut de l'agronomie, université de
Batna-) et la dernière c'est Mme BOULAACHEB N (laboratoire de
l'écologie- département de la pharmacie université El
Buse, Sétif); au niveau de cette laboratoire et avec Mme BOULAACHEB N,
nous avons identifié 19 espèces en utilisant les clés de
détermination de QUEZEL et SANTA (1962, 1963) et une loupe optique.
Enfin, Mr ALIAT T est rectifié quelques espèces
fréquentées le site (Suaeda mollis, Frankenia
thymifolia, Atriplex halimus). La famille systématique
suivie dans la classification des espèces est celui établi par
CRONQUIST (1981).
19
Méthodes d'étude
2.1.2. Catégories biologiques et statut
biogéographique de la végétation
Après l'identification des spécimens
végétal récoltés, on a obtient un nombre important
d'espèces identifiées, chacune définie par un nom
scientifique ou le nom binomiale de LINNÉ, pour accomplir cette
bi-nomination; on a fait une étude biologique de chacune de ces
espèces par la détermination du leurs type biologique
adopté par L'écologue CHRISTEN RAUNKIAER en 1934 et leurs types
de végétation (annuelle ou vivante. Ces deux types sont faits par
consultation de (ALIAT, 2007) et des sites d'internet qui s'intéressent
de la botanique les plus connus tel Tela-Botanica (SITE WEB 02) et le site du
patrimoine naturel en France (SITE WEB 03).
L'idée de classer les végétaux selon leur
organisation avec l'environnement est déjà évoquée
en 1807 par la naturaliste VON HUMBOLDT (1807). L'écologue CHRISTEN
RAUNKIAER y parvient en prenant pour critère le positionnement des
organes de survie, classification qu'il propose en 1904 lors d'une
conférence à la Société Naturaliste Danoise
(RAUNKIAER, 1904). Il complète cette classification pour aboutir en
1934 au système utilisé de nos jours (RAUNKIAER, 1934).
La classification de RAUNKIAER (types biologiques,
système de RAUNKIAER) est une classification proposée en 1904 et
affinée les années suivantes par le botaniste DANOIS CHRISTEN
RAUNKIAER afin d'organiser tous les végétaux selon le
positionnement des organes de survie (et donc de leur méristèmes
de croissance) de la plante durant la période défavorable. C'est
une classification qui complète la nomenclature binomiale de
Linné.
Types biologiques de RAUNKIAER dans (SITE WEB
04)
On compte 2 catégories, divisées en classes :
? Vivaces ou pérennes
Persistance d'une partie de l'appareil végétatif
pendant la mauvaise saison :
-Phanérophytes (du grec phaneros
: apparent ; phuton : plante) : bourgeons dormants aériens
à plus de 50 cm de la surface du sol. Plante affrontant l'hiver en
exposant à ses rigueurs des tiges porteuses de bourgeons (ex:
Tamarix gallica).
-Chamaephytes (du grec khamai :
à terre ; phuton : plante) : bourgeons dormants aériens
à moins de 50 cm de la surface du sol. On distingue les chamaephytes
frutescents (buissonnants, plus ou moins dressés) et les chamaephytes
herbacés (beaucoup plus proches du sol) (ex: Artemisia herba
alba). -Hémicryptophytes (du grec hemi :
à demi ; kryptos : caché ; phuton : plante) :
bourgeons dormants à la surface du sol. À la « belle saison
», un hémicryptophyte développe une touffe de pousses s'il
est cespiteux, une rosette de feuilles, plus ou moins prostrées s'il est
à rosettes, une tige érigée qui prend appui sur des
supports variés s'il est grimpant (ex: Crepis vesicaria).
20
Méthodes d'étude
-Géophytes (du grec gê
: terre, phuton : plante) ou cryptophytes : bourgeons dormants
sous la surface du sol (distinguer selon la nature de l'organe de conservation
souterrain : géophyte à bulbe, à tubercule, à
rhizome) (ex: Juncus maritimus).
-Hydrophytes : bourgeons dormants sous l'eau,
feuilles immergées.
-Hélophytes (du grec helos :
le maraie, phuton : plante) : bourgeons dormants sous l'eau, feuilles
émergées au moins en partie. Végétaux capables de
prospérer en milieux humides et eaux douces. (Bords de mer, estuaires,
Chotts, marais, rivière). (Ex: phragmites, cariçaies, Typhas,
spartine).
? Annuelles
Passage de la mauvaise saison (qui pour les plantes peut
être soit une saison chaude, soit une saison froide) sous forme de graine
:
-Thérophytes (du grec theros
: saison, phuton : plante) : on désigne par ce terme une
plante qui "boucle" son cycle de vie en quelques mois et dont ne subsistent,
à l'entrée de la mauvaise saison, que les graines qui formeront
de nouveaux individus l'année suivante, synonyme de plante annuelle.
(Exemple: Anacyclus clavatus, Medicago laciniata, Medicago minima,
Medicago Soleirolii).
En ce qui concerne l'aire biogéographique des
espèces inventoriées est déterminée selon celle qui
établit par QUEZEL et SANTA (1962).
2.2. Méthodes d'étude de l'avifaune
2.2.1. Méthodes de dénombrement
Les oiseaux d'eau sont définis comme étant des
espèces écologiquement dépendantes des zones humides,
c'est la définition utilisée par la convention Ramsar pour les
dénombrements internationaux des oiseaux d'eau. Ainsi leur inventaire
des oiseaux considérants oiseaux d'eau (Annexe 4).
Dans le but d'inventorier et de déterminer le statut de
l'avifaune aquatique fréquentant notre site, des recensements ont
été effectués du matin jusqu'à l'après midi
à l'aide de deux paires de jumelles, l'une de marque NUKILA,
modèle 8×22 7,5° 131m/1000m et l'autre de marque WEBER-OPTIK,
d'un grossissement de 12×25. Pour s'assurer de l'identification exacte au
moment même de l'observation, nous nous sommes servi du guide des oiseaux
d'Europe, d'Afrique du Nord et du Moyen-Orient (HEINZEL et al.,
1992).
Nous avons généralement procédé
à un comptage individuel lorsque le groupe d'oiseaux était proche
(à moins de 200 m) et d'effectif inférieur à 200
individus. Dans le cas inverse, lorsque le groupe était très
éloigné ou d'effectif supérieur à 200 individus,
nous avons procédé à des estimations visuelles du groupe
(LAMOTTE et BOURLIERE, 1969 ; BLONDEL, 1975 ; HOUHAMDI et SAMRAOUI, 2002).
Cette technique est la plus utilisée pour les dénombrements et
les comptages hivernaux des populations d'oiseaux d'eau. Elle présente
cependant une marge d'erreur qui est fonction de l'expérience de
21
Méthodes d'étude
l'observateur et de la précision du matériel
optique utilisé, souvent estimée entre 5 et 10% (BLONDEL, 1975),
puisque une différence entre le nombre d'oiseaux détecté
par l'observateur et l'effectif réellement présent existe
toujours (TAMISIER et DEHORTER, 1999). Parallèlement aux recensements
des oiseaux d'eau, les autres espèces rencontrées dans le site et
ses abords sont également notées.
Le dénombrement des oiseaux d'eau hivernants est une
opération qui se fait chaque année à l'échelle
internationale. La date des dénombrements est fixée par le BIROE
(Bureau international de la recherche sur les oiseaux d'eau et les zones
humides) au minimum une fois par an, dans la semaine qui précède
et celle qui suit le 15 du mois de janvier (HOLLIS et SMART, 1986).
Les méthodes d'observation des oiseaux d'eau sont
nombreuses et dépendent des espèces étudiées et du
but poursuivi par les recherches. Les méthodes les plus connues sont les
méthodes relatives et les méthodes absolues. Les premières
consistent à exprimer les résultats d'observations par rapport
à une variable fixée par l'observateur, qui peut être une
distance ou une durée (OCHANDO, 1981). Le plan d'eau que nous avons
étudié étant complètement libre, nous avons
procédé pour le dénombrement des oiseaux d'eau par les
méthodes absolues. Celles-ci consistent à effectuer des visites
sur les lieux et à compter tous les oiseaux qui s'y trouvent. Les
méthodes absolues présentent plusieurs variantes et le choix de
l'une ou de l'autre dépend de la taille du site, de la taille des
populations d'oiseaux à dénombrer et de leur
homogénéité (SCHRICKE, 1985).
2.2.2. Statuts bioécologiques de l'avifaune
On a ajouté des statuts bioécologiques des
oiseaux inventoriés, afin de donner un aperçu sur leurs
caractéristiques bioécologiques. Les statuts
considérés dans notre travail sont les suivants : le statut
faunique, le statut phénologique, le statut trophique et le statut de
protection.
Le statut faunique indique l'aire de répartition
biogéographique d'origine de chaque espèce de l'avifaune
recensée. Le type faunique est établi selon VOOS (1960), puis
nous avons réparti les types fauniques selon les grandes régions
de répartition biogéographique cités par MILLA et
al. (2012).
Le statut phénologique des espèces aviaires
(sédentaire nicheur, sédentaire non nicheur, hivernant, estivant
et migrateur de passage) est déterminé d'après BAAZIZ et
al. (2011) et HEINZEL et al. (1992).
Lors de nos visites au Chott, nous avons essayé de
trouver des sites de nidification. Pour la caractérisation des nids et
des oeufs, nous avons utilisé comme matériels, pied à
coulisse pour déterminer les différents diamètres, et une
balance électronique d'or AND GULF pour déterminer le poids des
oeufs.
La répartition en statuts trophiques est basé
sur la détermination des catégories alimentaires pour chaque
espèce de l'ensemble des espèces recensées suite à
la consultation de plusieurs articles et ouvrages (CHENCHOUNI, 2007 ; RAMADE,
2008 ; CHENCHOUNI, 2011). Ce statut défini 5 types trophiques
(Consommateurs d'invertébrés (I), Polyphagie (Pp), Carnivore (C),
Piscivore (P), Végétarien (V)) et un
22
Méthodes d'étude
caractère complémentaire ([ ] : Principalement).
Par exemple: [I] où une espèce est principalement Consommatrice
d'invertébrés. On a vérifié également s'il y
a des relations entre la phénologie des espèces et leurs
régimes alimentaires. Nous avons aussi dressé un tableau
contenant des proportions combinés entre les deux statuts
(phénologique et trophique).
En ce qui concerne le statut de protection au niveau national,
nous nous sommes basés sur la liste des espèces
protégées par le décret N° 83-509 du 20 août
1983 relatif aux espèces animales non domestiques
protégées en Algérie. A l'échelle internationale,
nous nous sommes référés aux listes et annexes de
différentes conventions internationales :
- La liste rouge de l'UICN (SITE WEB 07).
- Convention de Bonn (SITE WEB 08 ; ANONYME1, 2008).
- Convention de CITES (SITE WEB 09 ; ANONYME, 2010).
- Accord de l'AEWA (SITE WEB 10 ; SITE WEB 11).
- Convention de Barcelone (SITE WEB 12 ; SITE WEB 13).
- Convention d'Alger (SITE WEB 14; SITE WEB 15).
2.2.3. Méthodes d'étude de l'organisation
spatiotemporelle
Les oiseaux se distribuent ou se répartissent dans
l'espace lacustre selon des modalités qui leurs sont propres, rarement
aléatoire, cette distribution répond à des critères
biologiques et écologiques qui caractérisent à la fois
l'espèce et le site (HOUHAMDI, 1998 ; HOUHAMDI et SAMRAOUI, 2002).
La quiétude et le partage des ressources alimentaires
conditionnent d'une manière apparente la répartition des groupes
d'oiseaux dans un site (PIROT, 1981 ; PIROT et al., 1984).
Durant nos sorties et conjointement avec le
dénombrement systématique des oiseaux d'eau, nous avons
essayé de relever sur des cartes l'occupation spatiotemporelle de
diverses populations d'oiseaux en utilisant un repère constant dans le
site (monticule situé au sud du plan d'eau).
Les images satellitaires ont été saisies sous
forme de bases de données dans un logiciel de SIG (MapInfo 6.5
Professionnel) pour élaborer des cartes illustrant les modalités
de l'utilisation du Chott par les oiseaux en représentant la
répartition spatiale et temporelle durant les quatre relevés
concernés par les recensements.
3. Exploitation des données par des indices
écologiques
3.1. Indices de diversité des peuplements
La diversité des peuplements vivants s'exprime
généralement par la richesse spécifique. La richesse
spécifique désigne le nombre d'espèces présent dans
un écosystème donné ou dans une aire
préétablie de ce dernier. On distingue la richesse totale
(S) qui est le nombre total d'espèces
présent dans un biotope ou une station donnée et une richesse
moyenne (Sm), nombre moyen
d'espèces présent dans les échantillons
23
Méthodes d'étude
d'un peuplement étudié. La richesse moyenne
apporte des informations intéressantes sur
l'homogénéité (ou
l'hétérogénéité) de la distribution spatiale
des espèces constituant le peuplement étudié (RAMADE,
2008).
3.1.1. Richesse spécifique totale
C'est le nombre total (S)
d'espèces présentes dans un biotope (RAMADE, 2008). Selon
(BLONDEL, 1975), la richesse spécifique totale est le nombre
d'espèces contractées au moins une seule fois au terme de
N relevés effectués.
L'adéquation de ce paramètre à la richesse réelle
est bien entendu d'autant meilleure que le nombre de relevés est plus
grand.
3.1.2. Richesse spécifique moyenne
C'est le nombre moyen d'espèces
(Sm) présent par échantillon
(RAMADE, 2008). Elle est calculée par le rapport entre le nombre total
d'espèces recensées lors de chaque relevé sur le nombre
total de relevés réalisés.
' esp cesrecensé
eslorsdechaquerelevé
ésréalisé
3.1.3. Indice de diversité de SHANNON
Divers indices ont été proposés pour
mesurer la diversité d'un peuplement ou d'une communauté, les
premiers en date ont été fondés sur des modèle de
distribution des individus en espèces, par exemple, l'indice de
diversité de SORENSON est fondé sur une croissance logarithmique
du nombre d'espèces recensées en fonction du nombre N
d'individus observés.
Ultérieurement ont été
développés des indices de diversité indépendants
d'une hypothèse de distribution et fondés sur la théorie
de l'information. L'indice de diversité de SHANNON
(H'), le plus utilisé de ces derniers (RAMADE,
2008) dérive d'une fonction établie par SHANNON et WIENER qui est
devenue l'indice de diversité de SHANNON (KREBS, 1989 ; MAGURRAN, 2004).
La diversité est fonction de la probabilité de présence de
chaque espèce dans un ensemble d'individus.
La valeur de H'
représentée en unités binaires d'information
ou bits est donnée par la formule suivante :
H' ?L N Loge N
i=1
Où : ni : Effectif de
l'espèce i ; N :
Effectif total du peuplement
Cet indice renseigne sur la diversité des
espèces d'un milieu étudié. Lorsque tous les individus
appartiennent à la même espèce, l'indice de
diversité est égal à 0 bits. Cet indice est
indépendant de la taille de l'échantillon et tient compte de la
distribution du nombre d'individus par espèce (DAJOZ, 2006).
24
Méthodes d'étude
Il mesure le degré et le niveau de complexité du
peuplement. Plus il est élevé, plus il correspond à un
peuplement composé d'un grand nombre d'espèces avec une faible
représentativité. A l'inverse, une valeur faible traduit un
peuplement dominé par une espèce ou un peuplement à petit
nombre d'espèces avec une grande représentativité
(BLONDEL, 1995).
Généralement, H' ° (0 ; 5) bits
(ANONYME, 2008).
- Si H' ° (0 ; 2,5) bits alors H' est
faible, ce qui implique que le milieu est peu diversifié (cas des
milieux spécialisés ou l'on note généralement la
dominance d'une seule espèce ou d'un petit nombre d'espèces sur
l'ensemble des espèces de la communauté.
- Si H' ° (2,6 ; 3,9) bits alors H' peut
être supposé moyen, ce qui implique que le milieu est relativement
riche en espèces.
- Si H' ° (4 ; 5) alors H' peut être
supposé élevé (cas des milieux isotropes ou les
espèces tendent vers l'équiprobabilité).
3.1.4. Indice d'équirépartition
(équitabilité)
L'indice d'équirépartition ou
l'équitabilité (E) Mesure du
degré de régularité dans l'abondance relative des
effectifs des diverses espèces que renferme un peuplement ou une
communauté (RAMADE, 2008). Cet indice est calculé par le rapport
entre la diversité observée (H') et la
diversité maximale (H'max) qui est la
diversité observée dans le cas théorique où toutes
les espèces présentent le même nombre d'individus,
représentée par le Log2 de la richesse totale S
(BLONDEL, 1979).
Où :
H' : Indice de diversité de
SHANNON H'max= Log2S
S : Richesse totale
Cet indice varie de 0 à 1. Lorsqu'il tend vers 0
(E<0,5), cela signifie que la
quasi-totalité des effectifs tend à être concentrée
sur une seule espèce. Il tend vers le 1 lorsque toutes les
espèces ont la même abondance (BARBAULT, 1981).
L'équirépartition permet d'apprécier les
déséquilibres que l'indice de diversité ne peut
détecter. Plus sa valeur a tendance à se rapprocher de 1, plus il
traduit un peuplement bien équilibré (LEGENDRE et LEGENDRE,
1979).
25
Méthodes d'étude
3.2. Indices de structure et d'organisation des
peuplements
3.2.1. Fréquence en nombre
La fréquence centésimale
(Fe) représente l'abondance relative, encore
appelée probabilité d'occurrence de l'espèce
i, elle correspond au pourcentage d'individus d'une
espèce (ni) par rapport au total des individus
recensées (N) d'un peuplement (DAJOZ, 2006 ;
RAMADE, 2008).
L'abondance relative peut être calculée pour un
peuplement ou pour l'ensemble des prélèvements d'une
biocénose (DAJOZ, 2006).
3.2.2. Constance ou fréquence d'occurrence
La constance désigne en écologie le degré
de fréquence avec lequel une espèce d'une biocénose
donnée se rencontre dans les échantillons de cette
dernière (RAMADE, 2008).
La constance, appelée aussi fréquence
d'apparition ou fréquence d'occurrence est calculée par le
rapport du nombre de relevés contenant l'espèce
étudiée (Pi) au nombre total de
relevés (P), exprimée en pourcentage
(DAJOZ, 2006).
C(%)= x1OO
BIGOT et BODOT (1973), rangent les fréquences en quatre
classes ou catégories d'espèces : ? Les espèces
très accidentelles qualifiées de sporadiques, ont une
fréquence inférieure à 10% ? Les espèces
accidentelles sont celles dont la fréquence d'occurrence varie entre 10
à 24% ? Les espèces accessoires sont présentes dans 25
à 49% des prélèvements
? Les espèces constantes sont présentes dans 50% ou
plus des relevés effectués.
3.2.3. Indice de similitude de SORENSEN
Afin de statuer la similitude de composition du peuplement
avien dans le temps, nous avons comparé la composition des
relevés par une analyse discriminatoire en calculant l'indice de
SORENSEN (Q5) (MAGURRAN, 2004).
[ 2ca + b]
Avec :
a : nombre d'espèces
mentionnées dans le relevé 1
b : nombre d'espèces
mentionnées dans le relevé 2
e : nombre d'espèces communes
entre les 2 relevés
Par convention, on dira que la similitude est significative si
Q5 est supérieur ou égal
à 50%.
Méthodes d'étude
4. Analyse statistique de la variation pluriannuelle
des effectifs d'oiseaux d'eau en fonction des précipitations
Les analyses de variance ou analyses factorielles sont des
techniques permettant de savoir si une ou plusieurs variables
dépendantes (variables à expliquer qui vont disposer dans
différentes lignes d'un tableau) sont en relation avec une ou plusieurs
variables dites indépendantes (variables explicatives qui vont disposer
dans différentes colonnes d'un tableau) (RAMOUSSE et al.,
1996).
Nous avons utilisé l'analyse de variance (ANOVA) pour
tester, est ce qu'il y a un effet des précipitations sur l'effectif de
chaque espèce des oiseaux d'eau dénombrés pendant la
période 2003-2011.
Nous nous sommes basés sur trois niveaux d'un facteur
indépendant (Précipitations annuelles, précipitations
décembre et précipitations octobre-novembre-décembre).
Selon cette analyse il y a une signification de l'effet des
précipitations sur la fluctuation de l'effectif de l'une des
espèces étudiées si P est inférieur
à 0,05 (ou l'effectif de l'espèce diffère par les
années en relation avec les variations des précipitations).
Pour cette analyse nous avons utilisé comme programme
d'analyse statistique le XLSTAT version 2012. XLSTAT
c'est un logiciel d'analyse de données et de statistiques pour
Microsoft Excel le plus complet et le plus utilisé. XLSTAT
offre de très nombreuses fonctionnalités qui font
d'Excel un outil performant et facile d'accès pour répondre
à la majorité de nos besoins en analyse de données et
modélisation (SITE WEB 16).
26
LT AT
T
27
Résultats et discussions
RESULTATS ET DISCUSSIONS
1. Flore et végétation
1.1. Inventaire floristique
1.1.1. Résultat
L'inventaire floristique établi sur les bordures nord
du site d'étude nous a permis de dresser un tableau 2
représentant la liste systématique des espèces
végétales recensées qui contient le nom scientifique, le
nom français, la pérennité, le type biologique et la
répartition biogéographique de ces dernières. L'ordre
systématique suivi dans cette classification est celui établi par
CRONQUIST (1981) (Tableau 2).
Suite à la prospection faite sur terrain, nous avons
recensé les espèces présentées dans Tableau 2,
comportant 45 espèces végétales dont 6 non
déterminées : Centaurea sp., Sonchus sp., Lathyrus sp.,
Valeriana sp., Brassica
sp. et Atractylis sp. Ces
espèces appartiennent à 18 familles et 39 genres
différents (Tableau 2).
1.1.2. Discussion
Suite à notre étude, d'un point de vu
systématique, nous avons établi la classification selon celle
adoptée par CRONQUIST (1981). les familles les mieux
représentées sont : Astéracées, Poacées,
Chénopodiacées et Fabacées soit respectivement 11
espèces (15.55%) et 11 genres, 5 espèces (11.11%) et 5 genres, 5
espèces (11.11%) et 4 genres, et 5 espèces avec 3 genres suivi
par les familles des Ranunculacées, Caryophyllacées,
Brassicacées, Cistacées, Liliacées sont
représentées par deux espèces pour chacune. Enfin 9
espèces chacune appartenant à une famille différente
(Figure 10).

Astéracées
24%
Autres familles
20%
Liliacées
4%
Cistacées
4%
Brassicacées
5%
Caryophylacées
5%
Ranunculacées
5%
Chenopodiacées
11%
Fabacées
11%
Poacées
11%
Figure 10 : Répartition en familles des
espèces végétales inventoriées dans la zone
d'étude (Chott El Beida).
28
Résultats et discussion
Tableau 2 : Liste systématique, noms
communs, types biologiques, pérennité et statuts
biogéographiques des espèces végétales
inventoriées dans le Chott El Beida.
|
Familles
|
Espèces
|
Noms communs
|
Types biologiques
|
Pérennité
|
Répartition biogéographique*
|
|
Astéracées
|
Anacyclus clavatus Desf
|
Anacycle en massue
|
Thérophyte
|
Annuelle
|
Eur. Méd.
|
|
Artemisia herba alba Asso
|
Armoise blanche
|
Chamephyte
|
Vivace
|
Eur. As.
|
|
Atractylis sp
|
-
|
-
|
-
|
-
|
|
Calendula arvensis L
|
Boxas des champs
|
Therophyte
|
Annuelle
|
Méd.
|
|
Centaurea sp
|
-
|
-
|
-
|
-
|
|
Chrysanthemum segetum L
|
Chrysanthème des moissons
|
Thérophyte
|
Annuelle
|
Cos.
|
|
Crepis vesicaria L
|
Crépis étoilé
|
Hémicryptophyte
|
Annuelle
|
Submédi.subatla
|
|
Launaea nudicaulis (L.) Hook. f.
|
Schismus barbu
|
Thérophyte
|
Vivace
|
Méd. Sah.-Sind
|
|
Mantisalca salmantica (L.) Briq.
|
Centaurée de Salamanque
|
Thérophyte
|
Vivace
|
Eur. Méd.
|
|
Scorzonera laciniata L
|
Podosperme lacinié
|
Hémicryptophyte
|
Annuelle
|
Méd.
|
|
Sonchus sp
|
-
|
-
|
-
|
-
|
|
Brassicacées
|
Brassica nigra (L.) Koch
|
Moutarde noire
|
Thérophyte
|
Annuelle
|
Euras.
|
|
Brassica sp
|
-
|
-
|
-
|
-
|
|
Caryophyllacées
|
Minuartia tenuifolia (L.) Hiern
|
Minuartie à petites feuilles
|
Thérophyte
|
Annuelle
|
Eur. Méd.
|
|
Spergularia diandra (Guss.) HeIdI'.et Sart
|
Spergulaire à deux étamines
|
Thérophyte
|
Annuelle
|
Sah-Sind-Irano-Tour.
|
|
Chénopodiacées
|
Atriplex glauca L
|
Arroche glauque
|
Chamephyte
|
Vivace
|
Sah. Méd
|
|
Atriplex halimus L
|
Arroche halime
|
Chamephyte
|
Vivace
|
Cosmop.
|
|
Beta vulgaris L
|
Beta vulgaris
|
Hémicryptophyte
|
Vivace
|
Euras.-Méd.
|
|
Salicornia fruticosa L
|
Salicorne
|
Chamephyte
|
Vivace
|
Cos.
|
|
Suaeda mollis (Desf.) Del
|
Salicorne
|
Chamephyte
|
Vivace
|
Sah.
|
|
Cistacées
|
Helianthemum appeninum (L.) Mill
|
Helianthème des Apennins
|
Chamephyte
|
Vivace
|
Méd.
|
|
Helianthemum virgatum (Desf.) Pen
|
-
|
Chamephyte
|
Vivace
|
Ibéro-Maur
|
|
Cypéracées
|
Cyperus laevigatus L
|
Souchet à deux épis
|
Hémicryptophytes
|
Vivace
|
Paléo-trop.
|
|
Fabacées
|
Lathyrus sp
|
-
|
-
|
-
|
-
|
|
Medicago laciniata (L.) Ail
|
Luzerne laciniée
|
Thérophyte
|
Annuelle
|
Méd. Sah. Sind.
|
|
Medicago minima Grufb.
|
Petite luzerne
|
Thérophyte
|
Annuelle
|
Eur. Méd.
|
|
Medicago Soleirolii Duby
|
Luzerne de Soleirol
|
Thérophyte
|
Annuelle
|
Italo-Alg.
|
|
Vicia monantha Retz
|
Vesce à une fleur
|
Thérophytes
|
Vivace
|
Méd.
|
29
|
|
|
|
|
Résultats et discussion
|
|
|
|
|
|
|
|
Frankeniacées
|
Frankenia thymifolia Desf
|
Franquenne à feuilles de thym
|
Chamephyte
|
Vivace
|
End. N.A.
|
|
Juncacées
|
Juncus maritimus Lamk
|
Jonc maritime
|
Géophyte
|
Vivace
|
Eur.
|
|
Liliacées
|
Allium paniculatum L
|
Ail en panicule
|
Géophyte
|
Vivace
|
Paléo-temp.
|
|
Allium roseum L
|
Ail à fleurs rosacés
|
Géophyte
|
Vivace
|
Méd.
|
|
Malvacées
|
Malva parviflora L
|
Mauve à petites fleurs
|
Thérophyte
|
Annuelle
|
Méd.
|
|
Papavéracées
|
Papaver rhoeas L
|
Coquelicot
|
Thérophytes
|
Annuelle
|
Paléo-temp.thérophyte
|
|
Plantaginacées
|
Plantago albicans L
|
Plantain blanchissant
|
Hemicryptophyte
|
Vivace
|
Méd.
|
|
Poacées
|
Bromus rubens L
|
Brome rouge
|
Thérophyte
|
Annuelle
|
Paléo-trop.
|
|
Hordeum murinum L
|
Orge sauvage
|
Thérophyte
|
Annuelle
|
Bor.
|
|
Koeleria pubescens (Lamk.) P. B
|
Koelérie pubscente
|
Thérophyte
|
Annuelle
|
W.Méd.
|
|
Lygeum spartum L
|
Sparte
|
Chamephyte
|
vivace
|
Méd.
|
|
Sphenopus divaricatus (Gouan) Rchb
|
Sphénope
|
Thérophyte
|
Annuelle
|
Paléo-subtrop.
|
|
Rununculacées
|
Adonis annua L
|
Adonis annuelle
|
Thérophyte
|
Annuelle
|
Euras.
|
|
Ranunculus sceleratus L
|
Renoncule scélérate
|
Géophyte
|
Annuelle
|
Paléo-temp.
|
|
Tamaricacées
|
Tamarix gallica L
|
Tamaris commun
|
Nanophanérophyte
|
Vivace
|
Trop.
|
|
Valérianacées
|
Valeriana sp
|
-
|
-
|
-
|
-
|
|
Zygophyllacées
|
Peganum harmala L
|
Harmal
|
Hemicryptophyte
|
Vivace
|
Eur. Irano-Tour.
|
* Bor : Boréal, Cos : Cosmopolite, Eur :
Européen, Euras : Eurasiatique, Ibéro-Maur :
Ibéro-Maurétanien, Ital : Italien, Méd :
Méditerranéen, Paléo-temp :
Paléotempéré, End. N.A : Endémique Nord-Africain,
Eur. Irano-Tour : européen. Irano-Touranien, Eur. Méd :
européen. Méditerranéen, Euras.-Méd : Eurasiatique-
Méditerranéen, Italo-Alg : Italo-Algérien,
Méd.Sah.Sind : Méditerranéen.Saharien.Sindien,
Paléo-subtrop : Paléo-subtropical, Paléo-trop :
Paléo-tropical, Sah : Saharien, Sah.Méd :
Saharien.Méditerranéen, Sah-Sind-Irano-Tour :
Sah-Sind-Irano-Touranien, Submédi.subatla :
Subméditerranéen.subatlantique, Trop : Tropical, W.Méd :
Ouest-Méditerranéen.
30
Résultats et discussions
1.1.3. Conclusion
Notre inventaire systématique de la
végétation dans le site d'étude est donnée une
liste de 45 espèces dont 6 non identifiées réparties sur18
familles. Les familles les mieux représentées
sont : Astéracées, Poacées, Chénopodiacées
et Fabacées avec respectivement 11 espèces, 5 espèces, 5
espèces, et 5 espèces.
1.2. Catégories biologiques et statut
biogéographique de la végétation
1.2.1. Résultat
Le spectre biologique, tel que conçu par RAUNKIAER, est
un spectre de diversité floristique qui ne dépend pas seulement
du milieu mais aussi de l'histoire phylogénétique des taxa. Son
seul intérêt écologique est d'indiquer quels sont les types
biologiques présents ou absents, c'est-à-dire quelle est sa
composition qualitative (EMBERGER, 1967).
Les espèces végétales de notre zone sont
à dominance thérophytique, particulièrement bien
adaptées aux perturbations par leur cycle court (KAZI TANI et al.,
2010). Sur les 45 espèces inventoriées, on
note 19 espèces (48,72 %) de thérophytes, 09 espèces de
chamaephytes (23,02 %), 06 espèces d'hémicryptophytes (15,30 %),
04 espèces de géophytes (10.26 %) et 01espèce de
nanophanérophytes. (Figure 11).
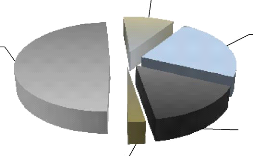
Chamephytes
23%
Thérophytes
49%
Géophytes
10%
Hémicryptophytes
15%
Nanophanérophytes
3%
Figure 11 : Répartition de la flore
recensée à Chott El Beida selon le spectre biologique de
RAUNKIAER.
Les composantes annuelles et vivaces sont en équilibre
avec des valeurs respectives de 19 et 20 correspondants à des
pourcentages respectifs de 49% et 51% (Figure 12).
31
Résultats et discussions

Vivaces
51%
Annuelles
49%
Figure 12: Pourcentages des catégories de
pérennité des espèces végétales
identifiées à Chott El Beida. L'aire de répartition de la
végétation de Chott El Beida est mentionnée dans le
tableau 3. Tableau 3 : Types biogéographiques des
espèces végétales inventoriées à Chott El
Beida.
|
Types
biogéographiques
|
Nbr.
d'espèces
|
%
|
Types
biogéographiques
|
Nbr.
d'espèces
|
%
|
|
Bor.
|
1
|
2,6
|
Méd.
|
8
|
20,5
|
|
Cos.
|
3
|
7,7
|
Méd. Sah. Sind.
|
2
|
5,1
|
|
End. N.A.
|
1
|
2,6
|
Paléo-subtrop.
|
1
|
2,6
|
|
Eur.
|
1
|
2,6
|
Paléo-temp.
|
3
|
7,7
|
|
Eur. As.
|
1
|
2,6
|
Paléo-trop.
|
2
|
5,1
|
|
Eur. Irano-Tour.
|
1
|
2,6
|
Sah.
|
1
|
2,6
|
|
Eur. Méd.
|
4
|
10,3
|
Sah. Méd
|
1
|
2,6
|
|
Euras.
|
2
|
5,1
|
Sah-Sind-Irano-Tour.
|
1
|
2,6
|
|
Euras.-Méd.
|
1
|
2,6
|
Submédi.subatla
|
1
|
2,6
|
|
Ibéro-Maur
|
1
|
2,6
|
Trop.
|
1
|
2,6
|
|
Italo-Alg.
|
1
|
2,6
|
W.Méd.
|
1
|
2,6
|
(Les abréviations des types biogéographiques
signalés dans le tableau 2).
L'analyse de tableau 3 facilite La discussion de la
répartition Biogéographique des espèces, Les
espèces appartiennent à l'Aire méditerranéen sont
les Mieux représentées par 8 espèces (20,5%), suivi par
Eur.méd par 4 espèces (10,3%), Cosm et Paléo-temp par 3
espèces (7,7%) pour chacun, Méd. Sah. Sind, Paléo-trop et
Eurs par 2 espèces (5,1%) pour chacun. Les autres types chacun
représenté par une seule espèce.
1.2.2. Discussion
Notre inventaire floristique contient 45 espèces
appartenant à 18 familles distinctes. La famille indicatrice du milieu
d'étude et la plus commune dans les milieux salins est celle de
chénopodiacée représentée par 5 espèces. Les
chénopodiacées comprennent plus de cent genres et un millier
d'espèces ;
32
Résultats et discussions
ce sont essentiellement des plantes de terrains salés
vivant surtout sous le climat semi-aride (Salicorne, Atriplex, suaeda) (OZENDA,
1991). Ces dernières d'un point de vue physiologique augmentent dans
leurs tissus le taux de Na+, Cl+ et Mg++ aux
dépends du Ca++ et K+ (Atriplex halimus,
Suaeda mollis, etc), contrairement à d'autre espèces
halophiles comme les Poacées paraissent s'adapter en limitant
l'accumulation des sels minéraux (POUGER, 1980). Selon POUGER (1980) il
y a un surpâturage dès que le prélèvement de la
matière végétal par les animaux et supérieur
à la production annuelle, entrainant ainsi une réduction du
couvert végétal. Les plantes sont consommées avant d'avoir
pu constituer des réserves et d'avoir eu le temps de former des
repousses pour les saisons suivantes ; elles dépérissent peu
à peu en même temps que leur système racinaire. De
même, les plantes annuelles ne peuvent fructifier et produire les graines
indispensables à leur survie. De nouvelles espèces non
supportées par les troupeaux s'installent peu à peu (Peganum
harmala) (POUGER, 1980). L'identification d'une vingtaine de plantes
vivaces révèle un couvert assez stable ceci probablement serait
dû à la protection de ces dernières par le
haut-commissariat du développement de la steppe (HCDS) mais la
présence d'une espèce dégradation (Peganum
harmala) nous oblige à dire que le site d'étude va
être menacé par le pâturage pratiqué par les
riverains qui l'entourent. Le surpâturage et l'aridité sont des
facteurs qui entrainent systématiquement le développement de
taxons comme Peganum harmala (GHEZLAOUI et al., 2011).
L'apparition d'unités de Peganum harmala indique un
surpâturage et montre l'ampleur de l'action anthropozoogène
(NEDJRAOUI et al., 1999). L'intervention de l'homme et son troupeau
exercent une certaine influence sur la répartition des
différentes classes des types morphologiques (SIMONEAU, 1961).
Notre zone d'étude appartient à la composante
méditerranéenne qui, par définition est
caractérisée par une forte variation saisonnière. Pour les
différents types de végétation, des critères de
regroupement des espèces peuvent être fondés sur les
stratégies utilisées pour leur survie durant la période
défavorable. Etablie sous des conditions tempérées
froides, la classification des types biologiques de Raunkiaer (1934) est
basée sur la localisation des bourgeons de rénovation par rapport
à la surface du sol. Les bourgeons de rénovation peuvent
être situés : en dessous de la surface du sol (dans le sol), ce
sont les géophytes ; au niveau de la surface du sol, et donc à
moitié cachés : ce sont les hémicryptophytes ; à
25-30 cm de hauteur par rapport à la surface du sol, ce sont les
chaméphytes ; à une hauteur supérieure à 25-30 cm
par rapport à la surface du sol, ce sont les phanérophytes ;
Enfin, seule la graine persiste pendant la saison défavorable chez les
thérophytes à cycle en général annuel, ainsi Le
type biologique n'est cependant pas un caractère indissociable de
l'espèce, c'est souvent le cas de nombreuses hémicryptophytes
qui, sous climat aride, se comportent en thérophytes (exp. Crepis
vesicaria), Par ailleurs Stipa tenacissima, dans les hautes
plaines et l'Atlas saharien en Algérie, se présente souvent comme
une hémicryptophytes en sous-bois de Matorral (Annexe 5) et en
géophyte en steppe aride (AIDOUD, 2003).
33
Résultats et discussions
Les types biologiques sont considérés comme une
expression des stratégies d'adaptation de la flore aux conditions du
milieu MADANI (2008) et représentent selon DAHMANI (1996) un outil
privilégié pour la description de la physionomie de la
végétation. Les types biologiques sont les véritables
formes d'adaptation des espèces au milieu (BOUZENOUNE,
2003). Ces types ont été établis par
RAUNKIAER pour les végétaux des régions
tempérées où la saison défavorable est la saison
froide MADANI (2008), Mais ils peuvent être appliqués aux
végétaux des régions où la saison
défavorable est la saison sèche (DAJOZ, 2003). Notre flore est
dominée par les thérophytes qui peut être expliqué
par l'exposition du site à des inondations brusques dans les saisons
pluviales, qui vont permettre aux plantes annuelles qui ont une germination et
croissance rapide à se développer, vu la capacité de ces
dernières à coloniser des milieux nouvellement
créés par dépôts de sables après être
arrosés par les précipitations saisonnières (CHENCHOUNI,
2012). De même, KHADRAOUI (2007) a indiqué que les rigueurs
climatiques et l'instabilité structurale du sol (texture sableuse et
structure particulaire, ...) favorisent le développement des
espèces à cycle de vie court, surtout les thérophytes. Or
la position de la nappe phréatique salée près de l'horizon
superficiel favorise le développement des halophytes dont la famille des
Chénopodiacées est la mieux représentée en
espèces chamephytiques thermophiles. Il semble là aussi que les
communautés végétales recensées donnent
également une grande importance aux thérophytes et aux
chamaephytes. Ces derniers se sont bien adaptés aux zones steppiques
(GHEZLAOUI et al., 2011). Ces dernières ont une bonne
adaptation aux conditions du milieu, ce qui leur permet d'occuper des
territoires plus ou moins étendus(LE HOUEROU, 1992). Les
hémicryptophytes ne s'expriment pas en abondance, cela probablement peut
s'expliquer par la pauvreté du sol en matières organiques (LE
HOUEROU, 1979). Ce phénomène a été confirmé
par BARBERO et al. (1989). Les géophytes sont
représentés par quatre espèces qui sont : Allium
paniculatum, Allium roseum, Ranunculus sceleratus et Juncus maritimus.
DANIN et ORSHAN (1990) trouvent des proportions plus importantes en
géophytes en domaine méditerranéen que steppique (QUEZEL,
1983). Les Phanérophytes représentent par une seul espèce
Tamarix gallica c'est une espèce introduite par le
haut-commissariat au développement de la steppe (ANONYME, 2004).
Concernant les éléments phytochoriques, QUEZEL
(1983), BOUAZZA et al. (2004) expliquent la diversité
biogéographique de l'Afrique par les modifications climatiques durement
subies dans cette région depuis le Miocène, ce qui entraîne
la migration d'une flore tropicale, notre liste contient une espèce
d'origine tropicale Tamarix gallica L et une espèce
paléo-tropicale Bromus rubens L. la flore de différentes
origines biogéographiques, survivant de formations soit
tempérées soit tropicales qui y ont existé avant
même l'apparition du climat méditerranéen; Ces
espèces se sont adaptées aux nouvelles conditions estivales
essentiellement xériques ou bien ont réajusté leur profil
écologique dans le large spectre d'opportunités offertes par
l'hétérogénéité spatiale et temporelle de
ces zones (AIDOUD, 2003).
34
Résultats et discussions
Dans le site d'étude, l'élément
méditerranéen strict soit 20.5% de l'ensemble tableau 3, et
circumméditerranéen l'emporte sur les autres types; ces origines
confirment l'adaptation des espèces recensées aux
écosystèmes méditerranéens.
Nous avons ajouté un tableau comparatif de la
végétation recensée dans le Chott El Beida avec celle
signalée en Algérie (KAZITANI, 2011), dans des zones humides du
sud constantinois et dans un lac saharien (lac Ayata) il s'agit de : Chott
Tincilt (LABIAL M, 1995), Chott Djendli (CHENCHOUNI, 2007), lac Ayata
(CHENCHOUNI, 2011). Nous avons ajouté deux travaux effectués dans
notre site d'étude il s'agit de (ALIAT, 2007) et (KHAZNADAR, 2008)
(Tableau 4).
Tableau 4 : Comparaison de la flore de
présent travail avec la flore des autres zones.
|
Sites étudiés
|
Superficie (ha)
|
Nombre
de familles
|
Nombre
d'espèces
|
|
Chott Tincilt (LADJIAL, 1995)
|
950
|
11
|
36
|
|
Chott
Djendli (CHENCHOUNI, 2007)
|
3700
|
25
|
58
|
|
lac Ayata (CHENCHOUNI, 2011)
|
155
|
8
|
13
|
|
Chott El Beida (ALIAT, 2007)
|
5355
|
24
|
61
|
|
Chott El Beida (KHAZNADAR, 2008)
|
4000
|
41
|
127
|
|
Chott El Beida (Le présent travail, 2012)
|
5355
|
18
|
45
|
|
Algérie (KAZITANI, 2011)
|
238174100
|
150
|
3139
|
La zone étudiée reflète une richesse
moyenne comme les autres sites (tableau 4). Cette moyennée de la
richesse est liée aux conditions édaphiques et climatiques de la
région (salinité). En effet (OZENDA et al, 2005) notent que les
communautés végétales des sols salés sont
généralement pauvres et caractérisées par la
dominance d'espèces spécialement adaptées à la
salinité des sols.
1.2.3. Conclusion
Notre inventaire systématique de la
végétation dans le site d'étude est donnée une
liste de 45 espèces dont 6 non identifiées réparties sur18
familles. L'élément méditerranéen strict (20,5%) et
circumméditerranéen l'emporte sur les autres types de
distribution de ces espèces. Cette liste reflète une richesse
moyenne en espèces comme les autres sites cités (tableau 4). La
famille commune entre tous les sites salée est celle des
chénopodiacées, c'est une famille indicatrice du milieu
salé. La liste renferme des espèces à affinité de
la salinité (Salicornia fruticosa,....etc), et des
espèces de l'humidité (Juncus maritimus, Ranunculus
sceleratus) (annexe 6). Les deux dernières adaptations à
l'environnement respectivement (la salinité, humidité) indiquent
que le site d'étude est humide salé. Par ailleurs on a
trouvé une espèce commune dans tous les terrains salés des
hauts plateaux et du Sahara septentrional, en particulier aux bords des Chotts
et qui est endémique du nord d'Afrique c'est Frankenia thymifolia
(OZENDA, 1991) (Annexe 7).
Résultats et discussions
2. Bioécologie de l'avifaune recensée
2.1. Inventaire global
2.1.1. Résultats
L'inventaire que nous présentons dans le tableau 5
ci-dessous comprend les oiseaux d'eau ainsi d'autre oiseaux de bordure
fréquentant le site.
Ces résultats sont obtenus par des recensements
hivernaux des oiseaux d'eau au cours de la période de 9 ans (2003-2011)
réalisé par la direction générale des forêts
et par observations personnelle effectuées durant les deux mois de mai
et de juin 2012. La liste systématique des oiseaux
présentée dans le Tableau 5 suit l'Ordre établi par DARLEY
(1985) et HEINZEL et al. (1992).
Tableau 5 : La liste systématique des
espèces aviaires recensées au Chott El Beida (Dénombrement
hivernal de la DGF* durant la période de 2003 à 2011 + Nos
observations, 2012).
Ordre Famille Nom scientifique
|
Ardeidae
|
Ardea cinerea (LINNE, 1758)
|
|
Ciconiiformes
|
Ardeola ibis (LINNE, 1758)
|
|
|
Threskiornithidae Plegadis falcinellus (LINNE, 1766)
Ciconiidae Ciconia ciconia (LINNE, 1958)
Phoenicopteriformes Phoenicopteridae Phoenicopterus ruber
(LINNE, 1758)
Anas platyrhynchos (LINNE, 1758)
Anas penelope (LINNE, 1758)
|
Ansériformes Anatidae
|
Anas clypeata (LINNE, 1758)
|
|
|
Tadorna tadorna (LINNE, 1758)
Tadorna ferruginea (ALLAS, 1764)
Charadrius dubius (SCOPOLI, 1786)
Charadriidae Charadrius sp.
|
|
Vanellus vanellus (LINNE, 1758)
|
|
Charadriiformes
|
Recurvirostridae Himantopus himantopus (LINNE, 1758)
|
|
|
Tringa ochropus (LINNE, 1758)
|
|
|
|
|
Scolopacidae
|
Tringa totanus (LINNE, 1758)
|
|
|
Tringa sp.
Accipitridae Buteo rufinus (CRETZSCHMAR, 1829)
|
Falconiformes
|
Falconidae
|
Falco tinnunculus (LINNE, 1758)
|
|
Falco columbarius (LINNE, 1758)
|
Hirundinidae Hirundo rustica (LINNE, 1758)
|
Passeriformes
|
Motacillidae Motacilla flava (LINNE, 1758)
|
|
|
Sturnidae
|
Sturnus vulgaris (LINNE, 1758)
|
|
Sturnus unicolor (TEMMENINK, 1820)
|
35
Résultats et discussions
Tableau 6 : Nom scientifique, nom
français et anglais des espèces d'oiseaux signalées dans
le Chott El Beida.
|
Nom scientifique Nom français Nom
anglais
|
Recensement
DGF
(2003-2011)
|
Nos
observations
(2012)
|
Ardea cinerea Héron cendré Grey
Heron + -
Ardeola ibis Héron garde-boeufs Cattle egret
+ +
Plegadis falcinellus Ibis falcinelle Glossy ibis
+ -
Ciconia ciconia Cigogne blanche White stork +
+
Phoenicopterus ruber Flamant rose Greater Flamingo
+ +
Anas platyrhynchos Canard colvert Mallard +
+
Anas penelope Canard siffleur Eurasian Wigeon +
-
Anas clypeata Canard souchet Northern Shoveler +
-
Tadorna tadorna Tadorne de belon Common Shelduck
+ +
Tadorna ferruginea Tadorne casarca Ruddy shelduck
- +
Charadrius dubius Petit gravelot Little ringed plover
+ -
Charadrius sp Gravelot sp - +
Vanellus vanellus Vanneau huppé Northern Lapwing
+ -
Himantopus Echasse blanche Black-winged stilt -
+
himantopus
Tringa ochropus Chevalier cul-blanc Green sandpiper
+ -
Tringa totanus Chevalier gambette Common Redshank
+ -
Tringa sp Chevalier sp Redshank - +
Buteo rufinus Buse féroce Long-legged +
-
Buzzard
Falco tinnunculus Faucon crécerelle Common
Kestrel + -
Falco columbarius Faucon émerillon Merlin
+ -
Hirundo rustica Hirondelle de cheminée Barn
Swallow - +
|
Motacilla flava Bergeronnette
printanière
|
Yellow Wagtail - +
|
Sturnus vulgaris Etourneau sansonnet Common Starling
+ -
Sturnus unicolor Étourneau unicolore Spotless
Starling + -
Nombre total des espèces recensées 18
11
DGF : Direction Générale des
Forêts.
+ : Présence de l'espèce
;- : Absence de l'espèce.
2.1.2. Discussion
Les 24 espèces recensées au niveau du Chott El
Beida, réparties sur 6 ordres, 13 familles, et 16 genres. L'ordre le
mieux représenté est celui des Charadriiformes avec 3 familles et
7 espèces (29,2%),
36
Résultats et discussions
suivi par l'ordre des Ansériformes avec une seule
famille et 5 espèces (20,8%) et après l'ordre des Ciconiiformes
avec l'ordre des Passériformes qui sont représentés par 3
familles et 4 espèces chacun soit 16,7% de l'ensemble des oiseaux
recensés (mais les Ciconiiformes présentent 4 genres, alors que
les Passériformes sont représentés avec 3 genres) (Tableau
7).
Tableau 7 : Nombre et pourcentages des
différentes taxons (Ordres, Familles, Genres et Espèces) des
|
oiseaux recensés à Chott El Beida.
|
|
|
|
|
|
|
|
Ordres
|
Familles
|
|
Genres
|
|
Espèces
|
|
|
Nombre
|
%
|
Nombre
|
%
|
Nombre
|
%
|
|
Ciconiiformes
|
3
|
23,1
|
4
|
25
|
4
|
16,7
|
|
Phoenicopteriformes
|
1
|
7,7
|
1
|
6,3
|
1
|
4,2
|
|
Ansériformes
|
1
|
7,7
|
2
|
12,5
|
5
|
20,8
|
|
Charadriiformes
|
3
|
23,1
|
4
|
25
|
7
|
29,2
|
|
Falconiformes
|
2
|
15,4
|
2
|
12,5
|
3
|
12,5
|
|
Passeriformes
|
3
|
23,1
|
3
|
18,8
|
4
|
16,7
|
|
Total
|
13
|
100
|
16
|
100
|
24
|
100
|
Nous avons comparé l'importance des taxons d'oiseaux
recensés dans notre région d'étude avec ceux
signalés en Algérie (ISENNANN et MOALI, 2000), sebkha Bazar,
Sebkha El Hamiat, sebkha Melloul, et Chott El Fraine (recensements hivernant
des oiseaux d'eau au cours de la période de 9 ans (2003-2011)
réalisé par la direction général des forêts)
(Tableau 8).
Tableau 8 : Comparaison des nombres des
taxons dans le Chott El Beida avec ceux recensés en Algérie,
Sebkha Bazar, Sebkha El Hamiat, Sebkha Melloul et Chott El Fraine.
|
Sites
|
Ordre
|
Famille
|
Genre
|
Espèce
|
|
Algérie (ISENNANN et MOALI, 2000)
|
23
|
55
|
173
|
406
|
|
Sebkha Bazar(*)
|
9
|
15
|
25
|
36
|
|
Chott El Beida(*)
|
6
|
13
|
16
|
24
|
|
Sebkha El Hamiat(*)
|
7
|
10
|
13
|
18
|
|
Sebkha Melloul(*)
|
4
|
4
|
6
|
11
|
|
Chott El Fraine(*)
|
1
|
1
|
1
|
1
|
|
(*): (Direction général des forêts,
2003-2011).
|
|
|
|
|
Dans le Chott El Beida, l'avifaune recensée
représente presque un quart des ordres décrits en Algérie
(LEDANT et al., 1981). En nombre de familles, les oiseaux du site sont
repartis sur 13 familles différentes, soit 23,6% de l'ensemble des
familles connues du pays. Les 16 genres recensés représentent
presque 9,3% des genres signalés à l'échelle nationale.
Avec les 24 espèces, le Chott abrite presque 5,9% d'espèces
d'oiseaux d'Algérie (ISENNANN et MOALI, 2000).
37
38
Résultats et discussions
La prospection du site au cours de nos observations sur le
terrain a révélé que le site était totalement
asséché. Seulement un point d'eau au nord du site alimenté
en eau rejeté par le centre d'assainissement de Hammam Sokhna, où
se réunissent les oiseaux. Cependant, ce point s'est assécher
à la fin de mai et le début de juin. Ceci est à l'origine
du déclin aigu du niveau d'eau jusqu'à l'assèchement total
à la mi-juin. Ceci explique la désertion du site par les oiseaux
d'eau.
En outre, nous avons trouvé des difficultés dans
l'identification des espèces, notamment les petits oiseaux
(limicoles).
Le présent travail reporte 9 espèces d'oiseaux
d'eau dont deux non observés durant les dénombrements hivernaux
d'oiseaux d'eau effectués entre 2003-2011 par la direction
générale des forêts qui sont Tadorna ferruginea et
Himantopus
himantopus.de ce fait, nous
avons actualisé le nombre des espèces observées par la DGF
au Chott El Beida par une mise à jour de son avifaune.
2.1.3. Conclusion
Vu que la conservation des forets a été
réalisée seulement les dénombrements hivernaux, le
présent travail a été effectué dans une
durée très étroite de deux mois ou Cinq observations dans
les mois de mai et juin ; l'inventaire de 24 espèces signalées au
niveau du site d'étude s'avère loin le moins exhaustif. Par
ailleurs une étude fait l'objet de connaitre les statuts des peuplements
d'oiseaux d'eau dans l'éco-complexe de zones humides de Sétif
pendant quatre ans ; en conséquence des compagnes bimensuelle ont
été réalisées de septembre 2004 à août
2008. Des résultats obtenu disent que le Chott El-Beida se justifie un
plan d'eau plus diversifié soit a été
fréquenté par la quasi-totalité des espèces
inventoriées de l'éco-complexe ou 66 espèces (BAAZIZ et
al., 2011).
2.2. Statuts bioécologiques
2.2.1. Résultats
Dans le tableau 9, les espèces aviaires
recensées dans le Chott el Beida qui sont établis par le non
français et scientifique repartissent selon leurs statuts
bioécologiques en plusieurs catégories ; fauniques,
phénologiques, trophiques, et de protection.
2.2.1.1. Types fauniques
Les oiseaux inventoriés distribuent sur 9 types
faunistiques établi selon VOOS (1960). Le type du paléarctique a
une dominance par rapport les autres types représenté par 10
espèces soit 45,5% de l'ensemble de l'avifaune recensée, suivi
par celle de holarctique par 4 espèces soit 18,2% et de
Méditerranéen par 2 espèces ou 9,1%. Les autres types
représentés par une espèce soit 4,5% pour chacun (Tableau
10).
Résultats et discussion
Tableau 9 : Répartition de l'avifaune
recensée dans le Chott El Beida par types fauniques (S. F.),
catégories phénologiques (C. Ph.), trophiques (C. T.) et de
|
protection (C. Pr.).
|
|
|
|
|
|
|
Noms français
|
Noms scientifiques
|
S. F.
|
C. Ph.
|
C. T.
|
C. Pr.
|
|
Héron cendré
|
Ardea cinerea
|
P
|
H
|
P
|
LC, A1
|
|
Héron garde-boeufs
|
Ardeola ibis
|
IA
|
SNN
|
[I]
|
NE, A1
|
|
Ibis falcinelle
|
Plegadis falcinellus
|
IA
|
MP
|
P
|
LC, B2, W, A1, D
|
|
Cigogne blanche
|
Ciconia ciconia
|
P
|
E
|
[I]
|
LC, B2, W, A1, D
|
|
Flamant rose
|
Phoenicopterus ruber
|
M
|
SNN
|
Pp
|
LC, B2, , W, N2, A1, D
|
|
Canard colvert
|
Anas platyrhynchos
|
H
|
SN
|
Pp
|
LC, B2, W
|
|
Canard siffleur
|
Anas penelope
|
P
|
H
|
V
|
LC, B2, W
|
|
Canard souchet
|
Anas clypeata
|
H
|
H
|
Pp
|
LC, B2, W
|
|
Tadorne de belon
|
Tadorna tadorna
|
P
|
SN
|
Pp
|
LC, B2, W, D
|
|
Tadorne casarca
|
Tadorna ferruginea
|
PX
|
SN
|
Pp
|
LC, B2, W, D
|
|
Petit gravelot
|
Charadrius dubius
|
P
|
MP
|
I
|
LC, B2, W
|
|
Vanneau huppé
|
Vanellus vanellus
|
P
|
MP
|
[I]
|
LC, B2, W
|
|
Echasse blanche
|
Himantopus himantopus
|
C
|
E
|
I
|
LC, B2, W, D
|
|
Chevalier cul-blanc
|
Tringa ochropus
|
P
|
E
|
I
|
LC, B2, W, D
|
|
Chevalier gambette
|
Tringa totanus
|
P
|
H
|
Pp
|
LC, B2, W
|
|
Buse féroce
|
Buteo rufinus
|
P
|
SN
|
C
|
LC, B2, , A2, D
|
|
Faucon crécerelle
|
Falco tinnunculus
|
A
|
SN
|
C
|
LC, B2, , A2, D
|
|
Faucon émerillon
|
Falco columbarius
|
H
|
H
|
C
|
LC, B2, , A2, D
|
|
Hirondelle de cheminée
|
Hirundo rustica
|
H
|
E
|
I
|
LC
|
|
Bergeronnette printanière
|
Motacilla flava
|
P
|
E
|
I
|
LC
|
|
Etourneau sansonnet
|
Sturnus vulgaris
|
ETH
|
H
|
I
|
LC
|
|
Etourneau unicolore
|
Sturnus unicolor
|
M
|
SN
|
I
|
LC, D
|
Types fauniques (S.F.) : A : Arctique ; C :
Cosmopolite ; ETH : Ethiopien ; H : Holarctique ; IA : Indo-Africain ; M :
Méditerranéen ; P : Paléarctique ; AM : Ancien monde ; PX
: Paléo-xérique.
Catégories phénologiques (C. Ph.) :
SN : Sédentaire nicheur ; SNN : Sédentaire non nicheur ;
E : Estivant ; H : Hivernant ; MP : Migrateur de passage.
Catégories trophiques (C. T.) : C : Carnivore ; I :
Consommateur d'invertébrés ; P : Piscivore ; Pp : Polyphagie ; V
: Végétarien ; [ ] : Principalement. Catégories de
protections (C. Pr.) : La liste rouge de l'UICN [LC :
Préoccupation mineure ; NE : Non évaluée] ; W : Accord de
l'AEWA ; D : Loi Algérienne ; : Convention CITES, Annexe2.
39
Résultats et discussions
Tableau 10 : Les types fauniques des
espèces d'oiseaux du Chott El Beida selon VOOS (1960).
|
Type faunique
|
Oiseaux d'eau
|
Autres
oiseaux
|
Total
|
%
|
|
Arctique (A)
|
0
|
1
|
1
|
4,5
|
|
Cosmopolite (C)
|
1
|
0
|
1
|
4,5
|
|
Ethiopien (E)
|
0
|
1
|
1
|
4,5
|
|
Holarctique (H)
|
2
|
2
|
4
|
18,2
|
|
Indo-Africain (IA)
|
1
|
0
|
1
|
4,5
|
|
Méditerranéen (M)
|
1
|
1
|
2
|
9,1
|
|
Paléarctique (P)
|
8
|
2
|
10
|
45,5
|
|
Ancien monde (AM)
|
1
|
0
|
1
|
4,5
|
|
Paléo-xérique (PX)
|
1
|
0
|
1
|
4,5
|
|
Total
|
15
|
7
|
22
|
100
|
2.2.1.2. Catégories phénologiques
La phénologie des espèces et leur statut de
reproduction sont déterminés d'après BAAZIZ et
al. (2011) et HEINZEL et al. (1992). Les espèces sont
classées selon les catégories phénologiques qui sont
définies en cinq classes comme suit (Annexe 8):
? Estivant (E) : l'espèce observée en saison
estivale.
? Hivernant (H) : l'espèce observée en saison
d'hivernage.
? Migrateur de passage (MP) : oiseau en transit rapide vers autre
lieu, il utilise le site d'une manière très brève (halte
migratoire).
? Sédentaire nicheur (SN) : l'espèce est
présente toute l'année et niche sur le site.
? Sédentaire non nicheur (SNN) : l'espèce est
présente toute l'année mais niche sur d'autres sites.
Les 14 espèces migratrices sont présentées
avec 64% de l'ensemble de l'avifaune recensée, dont 6 espèces
sont hivernantes (27%), 5 espèces sont estivantes (23%), et 3
espèces sont migratrices de passage (14%). Les sédentaires avec 8
espèces sont de l'ordre de 36%, soit nicheurs (6 espèces, 27%),
ou non nicheurs (2espèces, 9%) (Tableau 11).
Tableau 11 : Répartition de l'avifaune du
Chott El Beida sur les catégories phénologiques.
|
Catégories Phénologiques
|
Oiseaux d'eau
|
Autres oiseaux
|
Total
|
|
|
Nombre
|
%
|
Nombre
|
%
|
Nombre
|
%
|
|
Sédentaire nicheur (SN)
|
3
|
14
|
3
|
14
|
6
|
27
|
|
Sédentaire non nicheur (SNN)
|
2
|
9
|
0
|
0
|
2
|
9
|
|
Estivant (E)
|
3
|
14
|
2
|
9
|
5
|
23
|
|
Hivernant (H)
|
4
|
18
|
2
|
9
|
6
|
27
|
|
Migrateur de passage (MP)
|
3
|
14
|
0
|
0
|
3
|
14
|
|
Total
|
15
|
68
|
7
|
32
|
22
|
100
|
|
|
|
|
|
|
|
|
40
|
|
|
|
|
|
41
Résultats et discussions
2.2.1.3. Catégories trophiques
Les oiseaux inventoriés sont classées en 5 types
trophiques différents. Nous citons dans le tableau 12, le nombre de
chaque type trophique, où appartient les espèces définies
ce soit les oiseaux aquatique ou les autres oiseaux. Les espèces du type
consommateurs d'invertébrés sont les mieux
représentées avec 9 espèces soit 42,87% de l'ensemble. Les
polyphagies à leurs tour sont bien présentés par 6
espèces soit 28,57% de l'ensemble de l'avifaune. Les carnivores sont
signalés par 3 espèces soit 14,28% du total. Les espèces
piscivores par 2 espèces et les espèces
végétariennes par une seule espèce soit respectivement
9,52%, 4,76% des oiseaux recensés.
Tableau 12 : Répartition de l'avifaune
inventoriée dans le Chott El Beida en fonction des catégories
trophiques.
|
Catégories trophiques
|
Oiseaux d'eau
|
Autres
oiseaux
|
Total
|
%
|
|
Consommateurs d'invertébrés (I)
|
5
|
4
|
9
|
42,87
|
|
Polyphagie (Pp)
|
6
|
0
|
6
|
28,57
|
|
Carnivore (C)
|
0
|
3
|
3
|
14,28
|
|
Piscivore (P)
|
2
|
0
|
2
|
9,52
|
|
Végétarien (V)
|
1
|
0
|
1
|
4,76
|
|
Total
|
14
|
7
|
21
|
100
|
|
2.2.1.4. Catégories de protection
|
|
|
|
|
Dans notre site, les oiseaux occupent une place importante
dans de tels inventaires (Tableau 13), selon la liste rouge de l'UICN des
espèces menacées, la quasi-totalité des oiseaux
recensés (95,5%) sont de préoccupation mineure, alors qu'une
seule espèce non évaluée, il s'agit de le Héron
garde boeufs Ardeola ibis. 72,7% des oiseaux cités dans
l'annexe 2 de la convention de Bonn sur la conservation des espèces
migratrices appartenant à la faune sauvage (59,1% aquatiques et 13,6%
non aquatiques).
L'accord sur la conservation des oiseaux d'eau migrateurs
d'Afrique Eurasie révèle 13 espèces
protégées dans le Chott, soit 59,1% du total des oiseaux
recensés. 36,4%est mentionné dans la convention d'Alger ou
convention Africaine sur la conservation de la nature et des ressources
naturelles, dont 22,7% qui sont aquatiques dans la classe A et 13,6% non
aquatiques dans la classe B.
Le Flamant rose Phoenicopterus ruber, le seul oiseau
d'eau qui est mentionné sur l'annexe 2 des espèces en danger ou
menacées de la convention de Barcelone sur la protection de
l'environnement marin et des régions côtières de la
Méditerranée, il est noté, avec les trois rapaces, la buse
féroce Buteo rufinus, le faucon crécerelle Falco
tinnunculus, et le faucon émerillon Falco columbarius sur
l'annexe 2 de la convention de Washington sur le commerce international des
espèces de faune et de flore sauvages menacées d'extinction,
connue par son sigle CITES, soit un total de 18,2% de l'avifaune
recensée (Tableau 13).
42
Résultats et discussions
En Algérie, 11 espèces dont sept sont des
oiseaux d'eau, soit 50% des oiseaux signalés dans le Chott El Beida sont
inclus dans la liste des espèces animales non domestiques
protégées par le décret exécutif N° 83-509 du
20 août 1983.
Tableau 13 : Exemple de l'importance de
l'avifaune du Chott el Beida par catégories de protection à
l'échelle nationale et internationale.
|
Traité de protection
|
Catégorie (Symbole)
|
Oiseaux d'eau
|
Autres oiseaux
|
Total
|
|
Nbr.
|
%
|
Nbr.
|
%
|
Nbr.
|
%
|
|
Liste rouge de l'UICN
|
Préoccupation mineure (LC)
|
14
|
63,6
|
7
|
31,8
|
21
|
95,5
|
|
Non évaluée (NE)
|
1
|
4,5
|
0
|
0
|
1
|
4,5
|
|
Convention de Bonn
|
Annexe 2 (B2)
|
13
|
59,1
|
3
|
13,6
|
16
|
72,7
|
|
Convention de CITES
|
Annexe 2 ()
|
1
|
4,5
|
3
|
13,6
|
4
|
18,2
|
|
Accord d'AEWA
|
(W)
|
13
|
59,1
|
0
|
0
|
13
|
59,1
|
|
Convention de Barcelone
|
Annexe 2 (N2)
|
1
|
4,5
|
0
|
0
|
1
|
4,5
|
|
Convention d'Alger
|
Classe A (A1)
|
5
|
22,7
|
0
|
0
|
5
|
22,7
|
|
Classe B (A2)
|
0
|
0
|
3
|
13,6
|
3
|
13,6
|
|
Décret Algérien
|
(D)
|
7
|
31,8
|
4
|
18,2
|
11
|
50
|
|
2.2.2. Discussions
|
|
|
|
|
|
|
|
2.2.2.1. Discussion concernant les types fauniques
L'Afrique du nord appartient à la grande région
paléarctique, elle constitue la limite sud de cette dernière
(BLONDEL, 1979). Ceci indique la dominance du type avifaunistique
paléarctique. De ce fait, l'avifaune de notre site d'étude
détient une aptitude biogéographique d'appartenance à la
région du paléarctique. Selon BLONDEL (1986) et BLONDEL (1990)
l'avifaune actuelle de la région méditerranéenne en
général, à quelques exceptions près est franchement
paléarctique. Les types avifauniques définis par VOOS (1960) sont
triés dans le tableau 14 en quatre grandes régions (MILLA et
al, 2012).
Tableau 14 : Origines biogéographiques
simplifiées des oiseaux du Chott El Beida.
|
Région
|
Chott El Beida (site d'étude)
|
|
|
Type de distribution
|
Oiseaux
d'eau
|
autres
oiseaux
|
Total
|
%
|
%
|
|
Grande région holarctique
|
Holarctique
|
2
|
2
|
4
|
18,2
|
18,2
|
|
Méditerranéen
|
1
|
1
|
2
|
9,1
|
|
|
Région paléarctique
|
Paléarctique
|
8
|
2
|
10
|
45,5
|
63,6
|
|
Paléo-xérique
|
1
|
0
|
1
|
4,5
|
|
|
|
Arctique
|
0
|
1
|
1
|
4,5
|
|
|
Région indo-africaine
|
Ethiopien
|
0
|
1
|
1
|
4,5
|
9,1
|
|
Indo-Africain
|
1
|
0
|
1
|
4,5
|
|
|
|
Espèces à très large distribution
|
Cosmopolite
|
1
|
0
|
1
|
4,5
|
9,1
|
|
Ancien monde
|
1
|
0
|
1
|
4,5
|
43
Résultats et discussions
Nous constatons que dans le site d'étude l'importance
relative des faunes boréale et particulièrement
paléarctique est conforme aux conclusions de BLONDEL (1979). Le dernier
auteur mentionne 37,2 % de l'ensemble des espèces d'oiseaux
d'Algérie appartiennent au paléarctique. D'une manière
générale, l'avifaune du Chott El Beida est une avifaune
paléarctique qui représente 61,91% de l'avifaune recensée.
Plus précisément les origines Paléarctique,
Paléo-xérique, Arctique et méditerranéenne y
occupent une large part (Tableau 14).
Les autres types de distribution soit, holarctique, indo-
africaine et espèces ubiquitaires sont peu représentés.
Les faunes tropicales tertiaires ont été éliminées
dès les premières détériorations climatiques du
Plio-pléistocène. De plus, les grandes ceintures
désertiques orientées de l'ouest vers l'est, comme d'ailleurs les
grands systèmes montagneux du paléarctique, ont joué
depuis la fin du tertiaire un rôle de barrière qui contre la
dispersion des faunes et des flores paléarctiques et afro-tropicales, ce
qui explique le fait que les échanges nord-sud entre les continents ont
joué un rôle plus discret dans l'ancien monde que dans le nouveau,
où les grandes barrières montagneuses sont orientées du
nord vers le sud (BLONDEL ,1986) et (BLONDEL, 1990). Selon BONTER et (2010), la
position biogéographique et la structure des paysages et des habitats
sont quelques-unes des causes qui favorisent l'invasion de certaines
espèces d'oiseaux. En effet, en élargissant la gamme des
certaines espèces envahissantes telles que le Héron garde-boeufs
(Ardeola ibis) (SI BACHIR et al, 2011) est devenu signalé dans
toute l'Algérie.
2.2.2.2. Discussion concernant les catégories
phénologiques
La recherche de la nourriture, présente ou à
venir est la cause première des migrations de l'avifaune (BLONDEL,
1979). DAJOZ (1975), affirme également que c'est le régime
alimentaire de l'oiseau qui détermine notamment son caractère
sédentaire ou migrateur.
Les régions arctiques à l'Afrique sont des
haltes potentielles pour les migrateurs en transit par l'Europe de l'Ouest.
Ceux-ci vont s'y reposer et reprendre des forces. Tranquillité et
disponibilité alimentaire conditionnent la qualité de l'accueil
(FROCHOT et ROCHÉ, 2000). La prédominance des migrateurs montre
l'importance de notre site pour l'accueil d'une telle avifaune dans ces
régions.
Parmi les groupes phénologiques, les deux groupes des
migrateurs hivernants et des sédentaires nicheurs est les mieux
représentés avec un pourcentage de 27%, suivant par les
migrateurs estivants avec 23%, les migrateurs de passage et les
sédentaires non nicheurs avec respectivement 14% et 9% (Figure 13).
L'hivernage est pour les oiseaux d'eau une période de
reconstitution des réserves énergétiques après les
efforts investis dans la reproduction et souvent aussi dans la migration
(FROCHOT et ROCHÉ, 2000). Le site offre des ressources trophiques en
qualité et en quantité suffisantes et forme un refuge propice et
sécurisé au gagnage (CHENCHOUNI, 2007). Ainsi, le plan d'eau
libre peut assurer la fonction
44
Résultats et discussions
de dortoir hivernal pour beaucoup d'espèces, le repos
s'effectue en groupes de quelques individus à plusieurs centaines
d'individus, sur ce lieu de repos, les oiseaux effectuent aussi leur toilette,
activité particulièrement importante pour la protection thermique
du corps en milieu aquatique, et dans le cas particulier des canards (FROCHOT
et ROCHÉ, 2000).
En outre le Chott possède une richesse variée en
nourriture pour les oiseaux sédentaires qui sont faiblement
représentés par rapport aux oiseaux migrateurs.
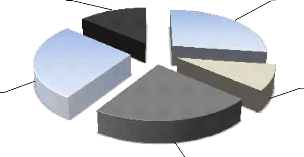
Migrateur de
passage
14%
Hivernant
27%
Estivant
23%
Sédentaire nicheur
27%
Sédentaire non nicheur
9%
Figure 13 : Répartition de l'avifaune du
Chott El Beida par catégories phénologiques.
Les caractéristiques générales du site en
font d'habitat de reproduction privilégié pour certains oiseaux.
Les nicheurs sont présentés avec six espèces soit 27% du
total des oiseaux recensés, dont trois (canard colvert Anas
platyrhynchos, tadorne de belon Tadorna tadorna, tadorne casarca
Tadorna ferruginea) sont des oiseaux d'eau oiseaux d'eau (BAAZIZ et
al, 2011).Les facteurs susceptibles d'influencer la nidification des
oiseaux sont très nombreux. Ils concernent non seulement la structure de
la zone (la végétation et la taille du milieu), mais aussi de
leur fonctionnement (productivité, hydrologie, et dynamique du milieu)
(FROCHOT et ROCHÉ, 2000).
Notre étude révèle la présence
d'une autre espèce nicheuse non identifiée. Il s'agit d'un
gravelot (Charadrius sp), selon BAAZIZ et al. (2011), la
seule espèce qui appartient de la famille des Charadriidés et qui
à avoir un statut sédentaire nicheur est le gravelot à
collier interrompu Charadrius alexandrinus.
La population de ce gravelot niche sur les berges et sur les
ilots, le seul nid d'un diamètre de 9,1 cm a été
trouvé à la mi-juin sur le transect Nord du Chott. Ce dernier est
quasi-totalement asséché à cette période. La ponte
comporte 3 oeufs gris avec des taches noirs, d'une longueur moyenne de 23,4mm,
moyenne largeur de 14,7mm, et le poids avec une moyenne de 3,07g (Tableau
15)
45
Résultats et discussions
Tableau 15 : Caractéristiques des oeufs d'un gravelot
Charadrius sp.
|
OEuf
|
Longueur (cm)
|
Largeur (cm)
|
Poids (g)
|
|
1
|
2,4
|
1,5
|
2,9
|
|
2
|
2,3
|
1,4
|
2,9
|
|
3
|
2,3
|
1,5
|
3,4
|
A l'issue de la reproduction, les oiseaux entament une
période importante de leur cycle annuel : la mue. Ils renouvellent leur
plumage avant de migrer. Durant cette période, les besoins
énergétiques sont élevés car la mue s'accompagne
d'une perte de poids, d'un manque d'isolation du corps et de besoins accrus
pour la constitution du nouveau plumage (FROCHOT et ROCHÉ, 2000).
2.2.2.3. Discussion concernant les catégories
trophiques
L'analyse du tableau 12 va se faire par catégories, on
prenant en considération l'importance par nombre d'espèces de
chaque catégorie.
? Catégorie Consommateurs
d'invertébrés.
Les espèces consommatrices d'invertébrés
fait grande partie dans la liste des espèces recensées
puisqu'elles représentent presque la moitié de ces
dernières 9 espèces (42,87% de l'ensemble des oiseaux
inventoriés). La dominance de cette catégorie expliquée
logiquement par la présence en abondance des invertébrés
aquatique et de l'entomofaune terrestre. Les espèces appartiennent
à l'ordre des charadriiformes sont des consommatrices
d'invertébrés représentées par 4 espèces
parmi les 5 de dernier ordre. Les oiseaux appartiennent aux cette ordre sont
des oiseaux aquatique favorisants les invertébré aquatique. Les
oiseaux non aquatique sont toutes les espèces d'ordre des passeriformes
représentées par 5 espèces consommatrices
d'invertébrés ça indique l'abondance de l'entomofaune
terrestre dans le site. En outre, des espèces considérées
principalement des consommatrices d'invertébrés sont : le vanneau
huppé (Vanellus vanellus), la cigogne blanche (Ciconia
ciconia) et le héron garde-boeufs (Ardeola ibis). Par
ailleurs on a observé dans la prairie humide du site des groupes de
cigogne et d'héron garde-boeufs se nourrissent en voisine l'un de
l'autre, n'est pas loin dans cette prairie on a capté un groupe du
héron garde-boeufs en compagnie du bétail (Annexe 10). La cigogne
blanche est souvent observée dans les aires de gagnage en compagnie de
hérons garde-boeufs (BOUKHEMZA, 2000 et SI BACHIR, 2007). La Cigogne
blanche et le Héron garde-boeufs sont des oiseaux d'eau insectivores et
ils présentent de ce fait un double intérêt agronomique et
écologique, notamment par leur préférence alimentaire aux
Orthoptères (SIEGFRIED, 1971a ; HAFNER, 1977 ; BENTAMER, 1998 ;
BOUKHEMZA et al., 2000-2004 ; SI BACHIR, 2007).Plus récemment,
cette espèce exerce une pression compétitive sur la Cigogne
blanche (Ciconia ciconia) en milieux de gagnages (BOUKHETECHE,
2010).
46
Résultats et discussions
? Catégorie des polyphages
Les polyphagies représentés par 6 espèces
(28,57%). L'ordre des ansériformes est le mieux notés par les
polyphagies soit 4 espèces. On a compté une seule espèce
d'ordre des phoenicopteriformes, elle a de cette catégorie, il s'agit de
flamant rose (Phoenicopterus ruber). Les Flamants roses s'alimentent
de graines de plantes aquatiques, d'invertébrés benthiques et
aquatiques. Leur reproduction dépend de l'explosion estivale
d'invertébrés aquatiques (BECHET et SAMRAOUI, 2010).
? Catégorie des carnivores
Elle est représentée par 3 espèces soit
14,28% de l'ensemble des oiseaux inventoriés. Ces trois rapaces
appartiennent à l'ordre des falconiformes (Faucon émerillon,
faucon crécerelle, Buse féroce). Selon NATURA2000 (2010), le
faucon émerillon s'alimente principalement de petits oiseaux et des
insectes, le faucon crécerelle se nourrit de souris, mulots, campagnols
et jeunes rats ; aussi des insectes et parfois des grenouilles et des vers.
? Catégorie des piscivores
La catégorie des piscivores renferme deux
espèces d'échassiers Ardea cinerea, Plegadis
falcinellus. Ils se nourrissent de poissons et d'autres animaux aquatiques
(RAMADE, 2008).
? Catégorie des végétariens
On a compté une seule espèce
végétarienne (Anas penelope). Selon NATURA2000 (2010),
le canard siffleur (Anas penelope) est principalement
végétarien, il se nourrit de tiges, feuilles, graines et racines
et parfois d'insectes aquatiques et terrestres, coléoptères.
Pour vérifier l'existence des relations entre les
catégories phénologiques et celles des trophiques, nous avons
créé un tableau 16 des proportions combinées des deux
statuts
Tableau 16 : Répartition des
proportions des catégories phénologiques en fonction des
catégories trophiques de l'avifaune recensée.
Catégories trophiques(%)
|
Catégories
phénologiques(%)
|
Consommateurs
d'invertébrés Polyphagies Carnivores
Piscivores Végétariens
|
|
Sédentaire nicheur 4,5 13,6 9,1
|
- -
|
|
Sédentaire non nicheur 4,5 4,5
|
- - -
|
|
Estivant 22,7
|
- - - -
|
Hivernant 5,5 9,1 4,5 4,5 4,5
|
Migrateur de passage 9,1
|
- -
|
4,5 -
|
Nous remarquons que les estivants qui se nourrissent des
invertébrés sont les mieux représentés avec 22,7%.
Ça peut expliquer par l'existence de la nourriture constituée
d'invertébrés dans cette période.
Nous notons également que les oiseaux
sédentaires nicheurs polyphagies bien représentés avec un
taux remarquable (13,6%) de l'ensemble des oiseaux inventoriés ; le site
d'étude est important en
47
Résultats et discussions
nourriture de nature végétale ou animale pour
certaines espèces polyphagies pendant toute l'année. Nous voyons
d'autre part la richesse du site en oiseaux hivernants de toutes
catégories alimentaires ; la période hivernale est la plus humide
où se déclenche la prolifération des espèces proies
par les pluies tombée le début de cette période hivernale,
cette vie riche en nourriture explique l'accueil du site aux espèces de
différents régimes alimentaires. On a deux espèces
carnivores sont sédentaire nicheurs faucon crécerelle Falco
tinnunculus et faucon émerillon Falco columbarius. Selon
les dénombrements hivernaux de la direction générale des
forêts le faucon crécerelle est une espèce accessoire et le
faucon émerillon est une espèce accidentelle (Annexe 11).
2.2.2.4. Discussion concernant les catégories de
protection
Très médiatiques, les oiseaux ont fait prendre
conscience, dans bien des régions, des fonctions et de la valeur des
zones humides. Tributaires d'espèces de plus en plus restreints assurant
pour eux des rôles variés, ils sont aujourd'hui bien plus que de
simples indicateurs de la qualité des milieux humides et qu'un
patrimoine à conserver en tant que tel. Leurs populations et leurs
communautés apparaissent comme particulièrement aptes à
révéler les déséquilibres écologiques de
notre planète (FROCHOT et ROCHÉ, 2000).
D'autre part, le Chott El Beida fait partie des zones humides
du sud constantinois qui a une grande richesse avifaunistique au niveau
national, cette valeur montre l'intérêt particulier que
présente ces plans d'eau pour l'accueil de plusieurs espèces
d'oiseaux aquatique et sa grande importance sur le plan national et
international du point de vue ornithologique. (BACHA et BECHIM, 2005).
La protection des oiseaux et des zones humides comme leurs
habitats est un phénomène ancien qui fut né pour lutter
contre la disparition des espèces et des espaces pallié à
leurs menaces. Actuellement, il y a plus de prise de conscience montrant que la
diminution des zones humides nuit à l'abondance des populations
d'oiseaux d'eau, d'où l'utilité des programmes de surveillance
(SAMRAOUI et SAMRAOUI, 2008).
La conservation des zones humides algérienne
nécessite une gestion rationnelle des peuplements et des milieux qui les
abritent. Les oiseaux sont un maillon important des réseaux trophiques
des zones humides et leur gestion ne peut être conçue sans une
bonne connaissance de la dynamique de leurs populations et l'identification des
contraintes écologiques ou anthropiques auxquelles elles font face
(SAMRAOUI, 2009).
L'Algérie a adopté pour cela une
réglementation (textes, lois, conventions voir (Annexe 12) pour appuyer
les actions de préservation et de conservation des ressources naturelles
et en particulier les oiseaux. L'oeuvre de sauvegarde de la nature et
d'habitats de ces oiseaux a été engagée avec courage
par
48
Résultats et discussions
l'Algérie. Des mesures législatives ont
été prises et ont porté sur la création des parcs
nationaux et des réserves de chasse.
Ainsi l'adhésion à la convention de Ramsar sur
les zones humides d'importances internationales, particulièrement comme
habitats des oiseaux d'eau, traduit l'accent mis, à l'origine, sur la
conservation et l'utilisation rationnelle des zones humides avant tout dans
leur fonction d'habitats pour les oiseaux d'eau (ANONYME, 2011). Le Chott El
Beida a été classé en 2004 dans la liste des sites Ramsar,
répond au critère 6 de la convention (Annexe 13).
La Liste rouge de l'UICN est considérée comme la
source d'informations la plus complète sur le statut de conservation
global des espèces. Elle s'appuie sur un système objectif
d'évaluation du risque d'extinction de chaque espèce (JOE, 2008).
Mais pratiquement aucune évaluation régionale ni nationale ne
s'est réalisée pour définir des statuts nationaux de
conservation des espèces inventoriées (CHENCHOUNI, 2010).
L'évaluation des menaces pesant sur les oiseaux du Chott El Beida
révèle une situation non préoccupante, selon leur
occupation dans la liste rouge.
Les oiseaux du Chott El Beida sont confrontés à
de nombreuses menaces, en raison de mauvaises pratiques agricoles et une
surexploitation pastorale irrationnelle suite à un bouleversement
naturel s'est produit ces dernières années lorsque subitement une
tempête de sable s'est déclenchée localement ayant
provoqués une grave détérioration du milieu naturel, qui
est le refuge et le site de reproduction de plusieurs espèces (ANONYME,
2004 ; BOUMEZBEUR et BOULAHLIB, 2005).
L'ouverture de nouvelles pistes traversant les bordures du
Chott rend le site plus fréquenté et par conséquent les
dérangements deviennent plus répétés. En plus les
oiseaux d'eau préfèrent des espaces protégés, plus
calmes en hiver.
De même, la chasse ou le braconnage des espèces
est un facteur de dégradation majeur liée à un
prélèvement d'oeufs ou d'oisillons aux nids de certaines
espèces nicheuses (gravelot et canards) en bordures du Chott. Ainsi, la
pollution de l'eau par les rejets des eaux usées urbaines due à
la désertion des espèces.
2.2.3. Conclusion
L'avifaune de notre site d'étude détient une
aptitude biogéographique d'appartenance à la région du
paléarctique. D'une manière générale, l'avifaune du
Chott El Beida est une avifaune paléarctique qui représente
61,91% de l'avifaune recensée.
La prédominance des deux catégories, des oiseaux
hivernants et des sédentaires nicheurs avec 27% reflète
l'importance du site pour l'accueil de l'avifaune, particulièrement
aquatique. Le présent travail montre que le Chott el Beida est un site
de nidification pour une espèce d'oiseau d'eau, il s'agit d'un gravelot
sp Charadrius sp.
49
Résultats et discussions
Les espèces consommatrices d'invertébrés
fait grande partie dans la liste des espèces recensées, Les
espèces appartiennent à l'ordre des charadriiformes sont des
consommatrices d'invertébrés représentées par 4
espèces parmi les 5 de dernier ordre. Les polyphagies
représentés par 6 espèces (28,57%). L'ordre des
ansériformes est le mieux notés par les polyphagies soit 4
espèces. On a deux espèces carnivores sont sédentaire
nicheurs faucon crécerelle (Falco tinnunculus) et faucon
émerillon (Falco columbarius).Selon les dénombrements
hivernaux de la direction générale des forêts le faucon
crécerelle est une espèce accessoire (C=44%) et le faucon
émerillon est une espèce accidentelle (C=11%). Annexe 11.
La moitié des espèces recensées dans le
Chott el Beida est protégée par la loi Algérienne (le
décret exécutif N° 83-509 du 20 août 1983). Par
ailleurs, l'emplacement occupé par le peuplement avien sur la liste
rouge de l'UICN révèle une situation non préoccupante.
2.3. Evolution des effectifs d'oiseaux d'eau
(Recensements hivernaux 2003-2011)
2.3.1. Résultats
Le Chott El Beida est un site de passage et une zone de
stationnement hivernal pour plusieurs oiseaux d'eau (échassiers, canards
et limicoles), il offre chaque hiver un accueil privilégié et
d'importance à plus de 13 espèces.
Les résultats tirés des rapports annuels des
recensements hivernants effectués par la direction
générale des forêts nous ont permis de dresser le tableau
17 avec la figue 15, pour suivre l'évolution des effectifs des oiseaux
d'eau dans le Chott au cours de la période allant de 2003 à 2011,
et dans lequel nous avons regroupés les espèces en trois groupes,
des échassiers, des anatidés, et des limicoles.
2.3.2. Discussion
Les effectifs d'oiseaux recensés au cours des
années, renseignent sur la qualité du milieu et les facteurs
limitant leur accueil. Plus de 18 espèces sont observées sur
Chott El Beida durant la période hivernale de 2003 à 2011, dont
13 sont aquatiques.
Ce site placé sur un important stationnement des
oiseaux d'eau de l'éco-complexe des zones humides de Sétif. Une
première approche (BAAZIZ, 2006) cité par (BAAZIZ et al,
2011) à concerner les caractéristiques principales de ce type de
milieu et son importance nationale et internationale pour biodiversité
avienne.
Les oiseaux d'eau sont en effet un des indicateurs
utilisés pour identifier les zones humides d'importance internationale
dans le cadre de la convention de Ramsar. Le site est une aire d'hivernage
importante pour les oiseaux d'eau, en particulier pour le Tadorne de Belon
Tadorna tadorna qui a représenté plus de 1% de sa
population régionale méditerranéenne au cours de 2
années précédentes (2000 et 2004) et pour le Flamant rose
Phoenicopterus ruber, qui a représenté plus de1% de sa
population totale au cours d'une année précédente (2000).
Il est à signaler que les dénombrements n'ont pas eu lieu
50
Résultats et discussion
Tableau 17 : Résultats du
dénombrement des oiseaux d'eau réalisés par la direction
générale des forêts à Chott El Beida en
période hivernale (2003 à 2011).
|
Espèces recensées
|
|
|
Années de recensement
|
|
|
|
|
Groupe
|
Nom français
|
Nom scientifique
|
2003
|
2004
|
2005
|
2006
|
2007
|
2008
|
2009
|
2010
|
2011
|
|
Echassiers
|
Héron cendré
|
Ardea cinerea
|
-
|
-
|
-
|
1
|
1
|
-
|
-
|
2
|
1
|
|
Héron garde-boeufs
|
Ardeola ibis
|
-
|
-
|
2
|
40
|
12
|
16
|
84
|
26
|
150
|
|
Ibis falcinelle
|
Plegadis falcinellus
|
-
|
-
|
5
|
-
|
6
|
-
|
-
|
-
|
-
|
|
Cigogne blanche
|
Ciconia ciconia
|
-
|
-
|
9
|
-
|
-
|
-
|
2
|
-
|
6
|
|
Flamant rose
|
Phoenicopterus ruber
|
335
|
-
|
18
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Anatidés
|
Canard colvert
|
Anas platyrhynchos
|
-
|
-
|
-
|
-
|
13
|
-
|
100
|
70
|
-
|
|
Canard siffleur
|
Anas penelope
|
-
|
-
|
-
|
-
|
-
|
-
|
100
|
-
|
20
|
|
Canard souchet
|
Anas clypeata
|
46
|
-
|
350
|
20
|
-
|
-
|
360
|
-
|
20
|
|
Tadorne de belon
|
Tadorna tadorna
|
650
|
40
|
460
|
177
|
14
|
24
|
-
|
410
|
200
|
|
Limicoles
|
Petit gravelot
|
Charadrius dubius
|
-
|
-
|
80
|
30
|
-
|
-
|
-
|
-
|
-
|
|
Vanneau huppé
|
Vanellus vanellus
|
-
|
-
|
-
|
-
|
4
|
-
|
180
|
15
|
-
|
|
Chevalier cul-blanc
|
Tringa ochropus
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
50
|
-
|
|
Chevalier gambette
|
Tringa totanus
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
30
|
|
Total
|
|
1031
|
40
|
924
|
268
|
50
|
40
|
826
|
573
|
427
|
51
Résultats et discussions
(A)
Echassiers

400
335
200
157
Effectifs
300
86
100
0 34 41 19 16
28
0
2003 2004 2005 2006 2007 2008 2009 2010 2011
Années
(B)
Anatidés
Effectifs
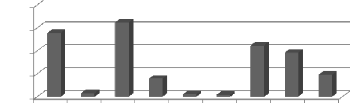
1000
750
250
500
0
696
40
810
197
27 24
560 480
240
2003 2004 2005 2006 2007 2008 2009 2010 2011
Années
(C)
Limicoles
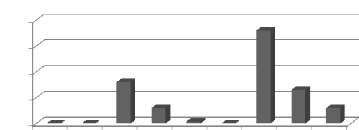
200
180
80
65
30
30
Effectifs
150
0 0
4 0
0
100
50
2003 2004 2005 2006 2007 2008 2009 2010 2011
Années
Figure 14 : Evolution des effectifs des
échassiers (A), des anatidés (B) et des limicoles (C) hivernants
dans le Chott El Beida au cours de la période allant de 2003 à
2011.
52
Résultats et discussions
de 1992 à 1997. L'intérêt ornithologique
du complexe de zones humides de la région de Sétif est important
pour ces deux espèces. La mobilité et la dispersion des oiseaux
sur le grand complexe de zones humides dit du constantinois fait que les
effectifs dénombrés en Janvier ne dépassent que rarement
la valeur de 1%.De plus la région d'Oum El Bouaghi, située
à l'Est de la wilaya de Sétif, abrite habituellement le plus
d'effectifs de Tadorne de belon et de Flamant rose (BOUMEZBEUR et BOULAHLIB,
2005). (Annexe 14).
? Echassiers
Du point de vue effectif, ce groupe est mieux
représenté par le flamant rose Phoenicopterus ruber,
suivant par le héron garde boeufs Ardeola ibis.
La disponibilité en eau influence de manière
marquée la fréquentation des zones humides par les Flamants roses
(BECHET et SAMRAOUI, 2010). L'hivernage du cet oiseau dans notre site est
irrégulier, il s'est signalé que durant les deux années,
2003 avec 335 individus, et 2005 avec seulement 18 individus.
Vraisemblablement, le stationnement est oriente vers autres plans d'eau
(complexe des zones humides de d'Oum El Bouaghi) pour trouver les conditions
optimales d'hivernage. Alors que, la présence du héron garde
boeufs depuis l'année 2005 augmente sensiblement malgré une
indéniable variabilité, avec 2 à 150 individus entre 2005
et 2011.
Ce groupe d'oiseau renferme aussi, la cigogne blanche
Ciconia ciconia, l'ibis falcinelle Plegadis falcinellus, et
le héron cendré Ardea cinerea, qui sont
présentés pendant quelques année avec des faibles
effectifs.
? Anatidés
Quatre espèces d'anatidés sont
régulièrement dénombrées, le canard colvert
Anas platyrhynchos, le canard siffleur Anas penelope, Canard
souchet Anas clypeata, l'espèce mieux
caractérisée du groupe est le tadorne de belon Tadorna
tadorna.
Du point de vue effectif. Ce groupe est le plus important
parmi les autres, ses effectifs subissent de grandes fluctuations d'une
années à une autre passant par des années où
l'espèce est totalement absente, alors que d'autres années les
effectifs sont très faibles (2004, 2006, 2007, 2008), où
l'effectif le moins élevé est signalé en 2008 avec 24
individus, par contre il y a des saisons où les effectifs sont
relativement élevés (2003, 2005, 2009, 2010), dont l'année
2005 est le mieux représentée avec un total de 810 individus.
Différentes raisons peuvent être
évoquées pour expliquer les importantes fluctuations
enregistrées : Certaines années, voire l'assèchement
totale du site, les niveaux d'eau se sont avérés insuffisants
pour permettre des stationnements; si on ajoute que durant ces années
des déficits hydriques ont également été
enregistrés sur les zones de gagnage, le résultat peut être
caractérisé par de faibles effectifs. Tel est par exemple le cas
pour la période 2006-2008.
53
Résultats et discussions
? Limicoles
Les effectifs des limicoles varient entre 4 et 180 individus
dans le Chott, le maximum étant atteint en 2009, le plus faible
effectifs recensé est signalé en 2007. Les deux espèces
les plus abondantes sont le vanneau huppé Vanellus vanellus et
le petit gravelot Charadrius dubius, où le total des effectifs
maximaux de chaque espèce atteint respectivement 199 et 110
individus.
Nous constatons deux périodes de diminution progressive
des effectifs, la première entre 2005 et 2008, suivant par le grand
stationnement du vanneau huppé en 2009 (180 individus), la
deuxième diminution est noté de 2009 à 2011.
2.3.3. Conclusion
La variation des effectifs des groupes d'oiseaux d'eau dans le
Chott El Beida au cours de la période allant de 2003 à 2011
diffère d'une année à une autre et d'un groupe à un
autre. L'analyse des résultats dans le tableau 17, nous permet de dire
que l'année la plus importante du point de vue effectif est celle de
2003. Les effectifs des espèces connaissent de grandes variations dans
le temps. En 2003, nous notons l'effectif le plus élevé avec 1031
individus. Alors qu'en 2011 nous remarquons une régression importante
où le nombre des espèces est environ 427 individus soit un recul
de 59% de l'effectif total par rapport à 2003.
Ces grands écarts dans les effectifs aviaires
reviennent essentiellement à la quantité d'eau présente
dans le Chott pendant le recensement. Par ailleurs, l'absence s'explique
vraisemblablement par la pollution de ces eaux par les rejets des eaux
usées urbaines.
2.4. Structure et organisation de l'avifaune du Chott
El Beida
2.4.1. Répartition spatio-temporelle de
l'avifaune
2.4.1.1. Résultats
La combinaison des différentes observations, nous a
permis de déterminer les modalités d'occupation spatiotemporelle
du site par les oiseaux.
Durant la période d'étude, Le Chott El Beida
à sec, a l'exception d'une seule station qui contient l'eau, où
les oiseaux stationnent sur un plan d'eau très restreint s'étant
sur une superficie estimée de 400 hectares, cette station situe au Nord
du Chott, appartient au territoire de Hammam Sokhna (Figure 15).
2.4.1.1.1. Dans l'espace
Pour caractériser notre région d'étude en
espèces aviaires, nous avons subdivisé l'espace de stationnement
en quatre milieux différents :
o le plan d'eau : milieu occupé par la majorité
des espèces d'oiseaux d'eau.
o les rivages : partie la plus souvent inondé
favorisée habituellement par les limicoles.
54
Résultats et discussions
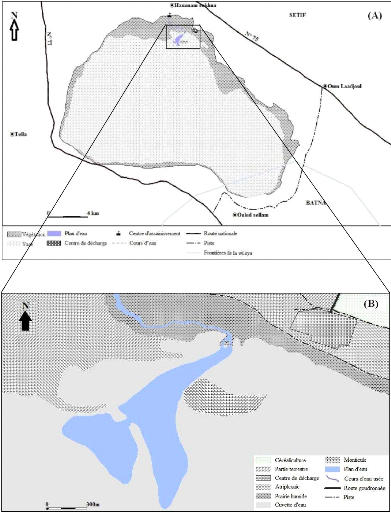
Figure 15 : Cartes représentatives du
Chott El Beida et de l'occupation de l'espace adjacent au plan d'eau (A) et de
la zone de stationnement des oiseaux (B) durant la période
d'étude.
55
Résultats et discussions
o la bordure du Chott : prairie humide
caractérisée par la strate herbacée. elle Abrite deux
groupes d'oiseaux, des ciconiiformes et des passeriformes.
o l'espace aérien : espace dominé par les
rapaces et les hirondelles.
2.4.1.1.2. Dans le temps
Pour une meilleure connaissance de la répartition
temporelle de l'avifaune, nous avons procédé lors de chaque
dénombrement à reporter sur des cartes, la distribution de
diverses populations d'oiseaux sur le plan d'eau et ces abords. Lors de nos
visites au Chott, nous avons remarqué que les oiseaux occupent presque
les mêmes endroits sur le plan d'eau, et se déplacent de la
même manière sur le site, selon leurs besoins.
L'occupation du site par les oiseaux d'eau (soit 81,8% du
total des oiseaux recensés) sur des profondeurs différents de
l'eau est régie par le mode de nutrition de chaque espèce, ce qui
leur permet une grande accessibilité aux proies et aux autres ressources
nutritives (CHENCHOUNI, 2007). Seulement deux oiseaux de bordures
observés durant le dernier relevé (sortie du 13 juin).
Nous avons essayé de montrer les modalités
d'utilisation du site pour les oiseaux d'eau suivant les dates de sorties
(Figure 16, 17, 18 et 19).
2.4.1.2. Discussion
2.4.1.2.1. Dans l'espace
Le plan d'eau
Ce milieu est fréquenté par les oiseaux d'eau ;
le tadorne de belon, le flamant rose, et par fois les autres limicoles. Ils
occupent des endroits distincts sur ce plan avec des différentes
profondeurs d'eau. Ces endroits qui sont appelés remises assurent de
différentes activités pour les espèces, soit
d'alimentation, de sommeil, ou de toilette.
Les rivages
Les abords immédiats du plan d'eau attirent de
nombreuses espèces, notamment les limicoles qui sont
réalisé sur la proximité de l'eau une partie de leur
niche, il s'agit de l'alimentation. Parmi ces espèces nous citons
l'échasse blanche, le chevalier sp, et le gravelot sp. L'autre partie
qui est la reproduction, est réalisée sur des petits îlots
côtoyant le plan d'eau comme dans le cas du gravelot sp Charadrius
sp.
Ce milieu est également lieu de repos pour divers
anatidés(le tadorne de belon, le tadorne casarca, et le canard
colvert).
La bordure du Chott
La prairie humide situant au Nord-est du plan d'eau, est un
lieu privilégié d'installation pour deux populations, les plus
régulières, il s'agit des deux oiseaux d'eau, la cigogne blanche
et le héron garde
56
Résultats et discussions
boeufs. Nous avons noté aussi la présence d'une
autre espèce de bordure, appartient au groupe des passereaux la
bergeronnette printanière. Cette zone assure une fonction d'alimentation
grâce à la grande diversité de ressources
(invertébrés, graines) pour ce peuplement de bordure.
L'espace aérien
L'espace aérien est généralement
dominé par les hirondelles et les rapaces, sans oublier les autres
espèces d'oiseaux d'eau en vol, notamment le flamant rose qui est
effectué un vol en plusieurs cercle avant d'installer sur le plan d'eau.
Cette espace offre une manne importante des insectes au vol pour les
hirondelles de cheminée. Alors que, les rapaces tournent au-dessus du
site à la recherche des proies.
2.4.1.2.2. Dans le temps
Les Ciconiiformes
Ce groupe est représenté par la cigogne blanche
Ciconia ciconia et le héron garde boeufs Ardeola ibis
qui sont présents durant toute la période d'étude.
Les effectifs de ces deux espèces d'oiseaux d'eau qui diminuent dans le
temps tiennent le plus souvent sur la prairie humide, lieu d'une manne
alimentaire abondante des invertébrées.
Les Phoenicopteriformes
Le flamant rose Phoenicopterus ruber qui
présent avec de faible effectifs ne dépassant les 30 individus
lors de deuxième relevé du 16 mai, connaissent de grande
variations dans le temps, cette espèce déplace sur le plan d'eau
d'une manière libre où le maximum de profondeur estimé de
l'eau ne dépasse pas les10 centimètres, elle sélectionne
souvent des endroits offrant la tranquillité et la nourriture en
abondance.
Les Anatidés
Le tadorne de belon Tadorna tadorna est
l'espèce parmi les anatidés qui fréquente exclusivement le
site et ce durant toute la période d'étude, il utilise
différemment les milieux selon ses besoins.
Lors de nos observations, cette espèce séjourne
par plus de 80 individus sur le plan d'eau durant le mois de mai, la plupart du
temps ces effectifs sont stationné sur la zone intérieure la plus
loin du plan d'eau où se nourrissent, pendant la période du midi,
ils quittent le plan d'eau vers sa berge, zone de repos et de dortoir plus
sécurisé avec moins de dérangement. Par ailleurs, l'oiseau
est déserté totalement le site du début du juin
après sa sécheresse totale où l'on note sa faible
effectifs par un seul individu pour la sortie du 13 juin.
Par contre, les deux autres espèces, le tadorne casarca
Tadorna ferruginea et le canard colvert Anas platyrhynchos
sont rencontré une seul fois lors de la sortie de 16 mai avec de
faibles effectifs.
Résultats et discussions
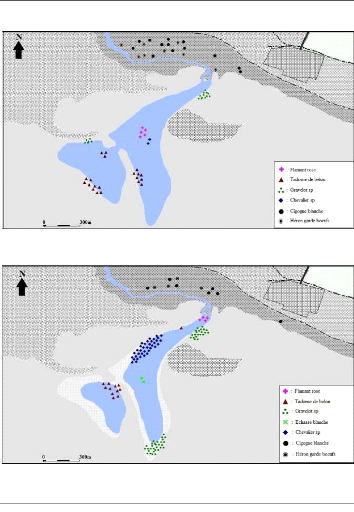
Figure 16 : Répartition spatiale du
peuplement avien du Chott El Beida, le 08 mai 2012.
Figure 17: Répartition spatiale du
peuplement avien du Chott El Beida, le 10 mai 2012.
57
Résultats et discussions
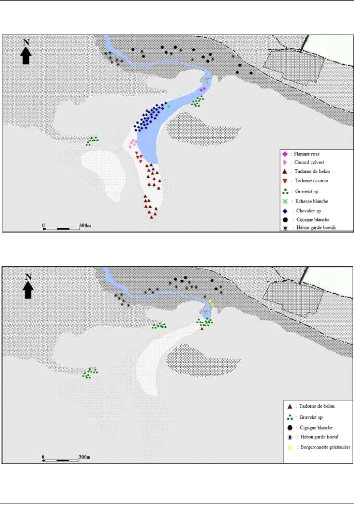
Figure 18 : Répartition spatiale du
peuplement avien du Chott El Beida, le 16 mai 2012.
Figure 19 : Répartition spatiale du
peuplement avien du Chott El Beida, le 13 juin 2012.
58
59
Résultats et discussions
Les limicoles
Le groupe des limicoles qui est représenté avec
les trois populations du gravelot sp Charadrius sp, l'échasse
blanche Himantopus himantopus, ayant une large répartition
spatiale dans le site, les effectifs totaux de ce groupe côtoient le plan
d'eau permanant ainsi les zones inondables situées sur ses cotés
dégagées de végétations, particulièrement
par la salicorne.
2.4.1.3. Conclusion
Durant la période d'étude, le Chott El Beida
présente un intérêt particulier par sa capacité
d'accueil pour l'avifaune, notamment les sédentaires, nonobstant de la
régression importante du niveau d'eau.
Le tadorne de belon, le flamant rose, l'échasse
blanche, et le chevalier sp, sont les oiseaux d'eau les plus utilisés de
la partie restreinte du plan d'eau situant au Nord du Chott. Alors que, les
autres groupes des anatidés et des limicoles préfèrent la
proximité de l'eau et les sables de rivages. La prairie humide situant
au Nord-est, près du plan d'eau, est considéré comme un
lieu privilégié de stationnement pour les deux groupes l'un de
ciconiiformes présentant avec le héron garde boeufs et la cigogne
blanche, et l'autre des passereaux (Bergeronnette printanière).
L'occupation du site par des espèces suivant
différentes position offre sans doute les meilleures conditions de
sécurité et de nutrition, et les effectifs de ses populations
fluctuent dans le temps suivant le niveau d'eau.
2.4.2. Variation des fréquences d'abondance et
de constance dans le temps
2.4.2.1. Résultats
Afin de donner un aperçu sur l'importance
numérique de l'avifaune du Chott El Beida, nous avons opté de
calculer les fréquences d'abondances (Fc) en pourcentages des
espèces inventoriées pour chaque relevé et pour l'ensemble
des relevés réalisés (Tableau 18).
Nous avons également présenté dans le
tableau 19, la répartition temporelle (présence-absence) des
différentes espèces d'oiseau au cours de nos sorties. Leur
fréquence d'occurrence et l'échelle de constance sont
également mentionnées.
2.4.2.2. Discussion
Durant la période d'étude un total de 2307
individus d'oiseaux est dénombré sur le site. Les effectifs les
plus importants du peuplement avien qui sont noté durant les deux
sorties de 10 mai et 16 mai, avec plus de 937 individus soit 40,6% du totale
des effectifs d'oiseaux recensés dû à un stationnement
important des deux espèces d'oiseaux d'eau le chevalier sp Tringa
sp., et le gravelot Charadrius sp, où leurs effectifs
totaux sont dépassé 1600 individus pendant la période
d'étude. Toutefois, la fluctuation des effectifs au cours de ces deux
sorties est complètement différente par rapport
Résultats et discussions
au deux autres sorties celle de 8 mai et l'autre de 13 juin
où les effectifs sont estimé respectivement à 260
individus soit 11,3% et 187 individus soit 8,1% du totale des effectifs de
l'avifaune recensée.
Tableau 18 : Fréquences d'abondance ou
fréquences centésimales (Fc%) des espèces
d'oiseaux recensés dans le Chott El Beida (Mai et Juin 2012).
|
Espèces
|
08 Mai
|
10 Mai
|
16Mai
|
13 Juin
|
Global
|
|
Nbr.
|
Fe
|
Nbr.
|
Fe
|
Nbr.
|
Fe
|
Nbr.
|
Fe
|
Nbr.
|
Fe
|
|
Ardeola ibis
|
30
|
11,5
|
30
|
3,2
|
25
|
2,7
|
45
|
24,1
|
130
|
5,6
|
|
Ciconia ciconia
|
50
|
19,2
|
45
|
4,8
|
40
|
4,3
|
11
|
5,9
|
146
|
6,3
|
|
Phoenicopterus ruber
|
21
|
8,1
|
30
|
3,2
|
2
|
0,2
|
0
|
0
|
53
|
2,3
|
|
Anas platyrhynchos
|
0
|
0
|
0
|
0
|
16
|
1,7
|
0
|
0
|
16
|
0,7
|
|
Tadorna tadorna
|
80
|
30,8
|
80
|
8,5
|
100
|
10,8
|
1
|
0,5
|
261
|
11,3
|
|
Tadorna ferruginea
|
0
|
0
|
0
|
0
|
9
|
1
|
0
|
0
|
9
|
0,4
|
|
Charadrius sp
|
70
|
26,9
|
400
|
42,7
|
30
|
3,3
|
55
|
29,4
|
555
|
24,1
|
|
Himantopus himantopus
|
0
|
0
|
12
|
1,3
|
1
|
0,1
|
0
|
0
|
13
|
0,6
|
|
Tringa sp
|
9
|
3,5
|
340
|
36,3
|
700
|
75,8
|
0
|
0
|
1049
|
45,5
|
|
Hirundo rustica
|
0
|
0
|
0
|
0
|
0
|
0
|
70
|
37,4
|
70
|
3
|
|
Motacilla flava
|
0
|
0
|
0
|
0
|
0
|
0
|
5
|
2,7
|
5
|
0,2
|
|
Total
|
260
|
100
|
937
|
100
|
923
|
100
|
187
|
100
|
2307
|
100
|
Tableau 19 : Répartition temporelle et
fréquence d'occurrence (C%) avec l'échelle de constance
(EC) : C : espèce constante ; A :
espèce accessoire, des espèces d'oiseaux d'eau recensées
dans le Chott El Beida (Mai et Juin 2012).
|
Espèces
|
08 Mai
|
10 Mai
|
16Mai
|
13 Juin
|
C (%)
|
EC
|
|
Ardeola ibis
|
+
|
+
|
+
|
+
|
100
|
C
|
|
Ciconia ciconia
|
+
|
+
|
+
|
+
|
100
|
C
|
|
Phoenicopterus ruber
|
+
|
+
|
+
|
-
|
75
|
C
|
|
Anas platyrhynchos
|
-
|
-
|
+
|
-
|
25
|
A
|
|
Tadorna tadorna
|
+
|
+
|
+
|
+
|
100
|
C
|
|
Tadorna ferruginea
|
-
|
-
|
+
|
-
|
25
|
A
|
|
Charadrius sp
|
+
|
+
|
+
|
+
|
100
|
C
|
|
Himantopus himantopus
|
-
|
+
|
+
|
-
|
50
|
C
|
|
Tringa sp
|
+
|
+
|
+
|
-
|
75
|
C
|
|
Hirundo rustica
|
-
|
-
|
-
|
+
|
25
|
A
|
|
Motacilla flava
|
-
|
-
|
-
|
+
|
25
|
A
|
En termes de nombre total d'individus recensés, le
chevalier sp Tringa sp domine largement les autres espèces. Il
totalise a lui-seul 1049 individus soit 45,5% de l'ensemble des oiseaux
dénombrés, contre555 individus (Fc=24,1%) pour le
gravelot sp Charadrius sp, 261 individus (Fc=11,3%) pour le
tadorne de belon, 146 individus (Fc=6,3%) pour la cigogne blanche
Ciconia ciconia, et 130 individus (Fc=5,6%) pour le
héron garde boeufs Ardeola ibis. Les autres oiseaux d'eaux
totalisent 91 individus avec
60
61
Résultats et discussions
une abondance de 4%, en fin, le dernier rang est occupé
par les deux oiseaux de bordure l'hirondelle de cheminée Hirundo
rustica et la bergeronnette printanière Motacilla flava
avec respectivement 70 individus soit 3% et 5 individus soit 0,2% de
l'ensemble des oiseaux recensés (Figure 20).
La fréquence d'occurrence ou la constance peut
renseigner sur les espèces caractéristiques du site, durant la
période d'étude, l'avifaune répartie seulement sur deux
classes de l'échelle des constances : les espèces constantes
(C=50%), et les espèces accessoires (25%=C=49%), dans
le site, sept espèces sont constantes dont quatre qui sont aquatiques,
le héron garde boeufs Ardeola ibis, la cigogne blanche
Ciconia ciconia, le tadorne de belon Tadorna tadorna, et le
gravelot Charadrius sp, sont omniprésentes durant cette
période avec 100% de constance. Alors que les espèces accessoires
présentent avec une constance de 25%, et qui sont rencontrées une
seule fois sur l'ensemble des relevés réalisés, il s'agit
de deux oiseaux d'eau le canard colvert Anas platyrhynchos et le
tadorne casarca Tadorna ferruginea, et deux oiseau de bords
l'hirondelle de cheminée Hirundo rustica et la bergeronnette
printanière Motacilla flava.
La majorité des espèces constantes (soit 63,6%
de l'ensemble de l'avifaune recensée (figure 21) qui sont dominés
les espèces accessoires (36,4%) sont des sédentaires et beaucoup
plus des nicheurs, elles fréquentent le site durant cette période
pour la reproduction. Alors que, on remarque la présence de quelques
espèces migratrices, ceci signifie que ces oiseaux sont des visiteurs de
passages utilisant le site comme lieu de repos.
Tringa sp
45,5%
Hirundo rustica
3%
Himantopus
himantopus
0,6%
Motacilla flava
0,2%
Ardeola ibis
5,6%
Ciconia ciconia
6,3% Phoenicopterus
ruber
2,3%
Anas platyrhynchos
0,7%
Tadorna tadorna
11,3%
Casarca ferruginea
0,4%
Charadrius sp
24,1%
Figure 20 : Répartition de l'avifaune
recensée dans le Chott El Beida selon l'abondance (Mai et Juin 2012).
62
Résultats et discussions

Accessoires
36%
Constantes
64%
Figure 21: Répartition de l'avifaune
recensée dans le Chott El Beida selon la constance (Mai et Juin
2012).
2.4.2.3. Conclusion
Le groupe des Charadriiformes est le plus important tenant
compte de l'effectif de ses populations. Il présente avec un total de
1617 individus soit 70,1% de l'ensemble de l'avifaune dénombrée,
suivant par le groupe des Anatidés qui englobe 286 individus
(Fc=12,4%). l'effectif de ce groupe est pratiquement égale
celle de Ciconiiformes (Fc=12%). Alors que, le groupe des
Phoenicopteriformes qui présente avec la seule espèce de flamant
rose Phoenicopterus ruber occupe le rang bas par ses effectifs parmi
les oiseaux d'eau (53 individus et Fc=2,3%). Les effectifs du flamant
diminuent dans le temps et sa population quittant vers d'autres sites pour la
nidification.
Les espèces constantes (64% de l'ensemble de l'avifaune
du Chott) sont bien représentées lors des quatre relevés
réalisés dominant l'autre catégorie des accessoires
(C=36%) pour l'ensemble de la période d'étude. Nous
pouvons conclure que la totalité des espèces constantes sont des
oiseaux d'eau et sa majorité fréquentent le site pendant la
période de nidification.
2.4.3. Similitude du peuplement dans le temps
2.4.3.1. Résultats
En se basant sur la présence ou l'absence des
espèces, nous avons comparé, en calculant l'indice de similitude
de SORENSEN, la composition des peuplements aviens recensés suivant les
dates de sorties prises deux à deux (Tableau 20), cet indice est obtenu
à partir du nombre d'espèces communes entre les relevés
pris deux à deux.
63
Résultats et discussions
Tableau 20 : Valeurs de l'indice de
similitude de SORENSEN (Qs) pour les peuplements aviens du Chott El
Beida suivant les dates de sorties prises deux à deux.
|
Relevés
|
08 Mai
|
10 Mai
|
16Mai
|
13 Juin
|
|
08 Mai
|
100
|
92,3
|
80
|
66,7
|
|
10 Mai
|
92,3
|
100
|
87,5
|
61,5
|
|
16Mai
|
80
|
87,5
|
100
|
53,3
|
|
13 Juin
|
66,7
|
61,5
|
53,3
|
100
|
|
2.4.3.2. Discussion
|
|
|
|
|
Les valeurs de l'indice de SORENSEN varient entre 55,33 et
92,31% témoignant ainsi d'une similitude élevée (>50%)
entre la composition spécifique des peuplements d'oiseaux
représentants dans les relevés. La plus importante similitude est
notée entre la sortie du 8 mai et du10 mai. Ainsi les deux valeurs de
l'indice de similitude entre10 mai et 16 mai et 8 mai et 16 mai qui
respectivement 87,5% et 80% sont également importantes, Ceci
dénote de la phénologie des peuplements d'oiseaux qu'accueille le
site où les espèces composant le peuplement estivant qui
séjournent sur le plan d'eau est majoritairement sédentaires et
qui est resté sur le site durant toute la période
d'étude.
2.4.3.3. Conclusion
Les deux relevés réalisés au début
de la période d'étude se rapprochent le plus du point de vue
composition taxonomique du peuplement d'oiseaux recensés. Ces
relevés sont présenté par l'indice de similitude le plus
élevée (Qs=92,3%). Tandis que pour les deux dernier
relevés qui est présenté par la faible valeur de l'indice
de similitude (Qs=53,3%). Le site qui est totalement
asséché lors de derrière sortie accueil un peuplement
d'oiseaux dont la majorité sont des sédentaires voire nicheurs
sur le site.
2.4.4. Diversité du peuplement avien
2.4.4.1. Résultats
Afin d'évaluer la composition du peuplement avien, nous
avons calculé la richesse spécifique totale et moyenne pour
l'ensemble des relevés effectués durant la période
d'étude, une bonne expression de la diversité des populations
d'oiseaux du Chott est fournie par la fonction de Shannon-Wiener. Pour examiner
donc l'organisation et la répartition des espèces par
relevé, nous avons calculé l'indice de diversité de
SHANNON avec l'équitabilité, pour chaque relevé d'une part
et pour l'ensemble des relevés réalisés d'autre part. Les
paramètres de diversité sont rapportés dans le tableau
21.
64
Résultats et discussions
Tableau 21 : Paramètres de
diversité du peuplement d'oiseaux recensés en mai et juin 2012
dans le Chott El Beida.
|
Paramètres*
|
08 Mai
|
10 Mai
|
16Mai
|
13 Juin
|
Global
|
|
N (individus)
|
260
|
937
|
923
|
187
|
2307
|
|
S (espèces)
|
6
|
7
|
9
|
6
|
11
|
|
Sm (espèces)
|
|
|
|
|
7
|
|
H' (bits)
|
2,31
|
1,97
|
1,34
|
1,96
|
2,27
|
|
H'max (bits)
|
2,58
|
2,81
|
3,17
|
2,58
|
3,46
|
|
E
|
0,89
|
0,70
|
0,42
|
0,76
|
0,66
|
* : (N : nombre d'individus ; S
: richesse totale ; Sm : richesse moyenne ; H' : indice
de diversité de SHANNON ; H'max : diversité maximale ;
E : équitabilité).
2.4.4.2. Discussion
Pour la période d'étude, la richesse
spécifique totale varie entre 6 et 9 espèces. Cette richesse qui
est relativement faible, augmente pondant les trois premiers relevés. Le
Chott qu'il a été quasi-totalement asséché durant
cette période, transmuté a un site de reproduction des oiseaux,
ceci serait probablement a l'origine de ces valeurs. Par contre, pour le
relevé 4 (13 juin) où la richesse totale est revient à sa
faible valeur (6 espèces) où l'espèce la plus abondante
parmi les oiseaux d'eau et le gravelot sp Charadrius sp avec un
pourcentage de 49,1%, suivant par le héron garde boeufs Ardeola ibis
(Fc=40,2%). Alors que la faible abondance est celle de la cigogne
blanche Ciconia ciconia (Fc=9,8%) et le tadorne de belon
Tadorna tadorna qui est présenté avec un seul individu
(Fc=0,9%). La richesse moyenne est de 7 espèces.
Les indices de diversité de SHANNON ne
présentent pas une grande variabilité entre les différents
relevés. On peut toutefois remarquer que les relevés
présentent une faible diversité (indices de diversité de
SHANNON=2,31 bits) compris dans l'intervalle (0 ; 2,5) bits.
La figure 22, et le tableau 20, indiquent que le premier
relevé qui correspond à la sortie du 08 mai à l'indices de
diversité de Shannon le plus élevé H'= 2,31 bits,
une équitabilité aussi plus élevée E=
0,89(>0,5) par rapport à toutes les autres relevés. Ce
relevé est donc le plus riche en termes de diversité et dans le
même temps la station où les populations sont équitablement
bien réparties entre les groupes aviaires spécifiques. La sortie
du 16 mai vient en dernière position avec un indice de Shannon
(H'=1,34 bits) faible, un indice d'équitabilité
(E=0,42) faible également qui indique que toute les populations
sont concentrée autour de celle d'une seule, la plus abondante
(Fc=75,8%) qui est le chevalier sp Tringa sp.
65
Résultats et discussions
Indice de Shannon (H') Equitabilité (E)
Valeurs (bits)
2,50
2,00
0,50
0,00
1,50
1,00
2,31
0,89
1,97
0,70
1,34
0,42
1,96
0,76 0,66
2,27
08 Mai 10 Mai 16Mai 13 Juin Global
Relevés
Figure 22 : Histogramme des Indice de Shannon
et d'Equitabilité par relevé.
2.4.4.3. Conclusion
L'avifaune dont elle aquatique, est généralement
l'élément le plus important pour caractériser la richesse
faunistique des zones humides, pour notre étude qui chevauche sur les
deux mois mai et juin, la faible valeur de l'indice de diversité de
SHANNON (H'=2,31 bits) résultant d'une faible valeur de
richesse spécifique totale implique que le site durant cette
période est peu diversifié, et d'une valeur moyenne d'indice
d'équitabilité (E=0,66) qui l'on note
généralement la dominance d'un de nombre considérable
d'espèces sur l'ensemble des espèces recensées, elle
traduit un peuplement assez équilibré. La diminution de la
diversité dans le temps traduit probablement par la régression du
plan d'eau voire sa sécheresse totale du début de juin.
2.4.5. Analyse de la variation pluriannuelle des
effectifs des oiseaux d'eau en fonction des précipitations
2.4.5.1. Résultats
Les résultats obtenus sont en principe
récapitulés dans le tableau 22. On note à partir du
tableau 22 que l'analyse est significative seulement chez deux espèces
qui sont Charadrius dubius et Tringa totanus.
2.4.5.2. Discussion
Le climat du site d'étude est humide dans le
début de la période hivernale, des précipitations moyennes
tombent. Ça donne un niveau d'eau basse au Chott où se former des
vasières qui favorisent la halte de nombreux limicoles.
Les limicoles dominent les vasières de faible
profondeur de l'eau qui leur permet de trouver facilement leurs nourriture
constituée de crustacés (MOREAU SOPHIE D. et al, 2005). Ces
vasière qui
66
Résultats et discussions
Tableau 22 : Analyse de la variance des effectifs des
espèces recensées dans Chott El Beida entre 2003-2011 avec effet
des précipitations.
|
précipitations annuelles
|
Précipitations
de décembre
|
Précipitations
d'octobre-novembre-décembre
|
précipitations
annuelles s*
Précipitations
de décembre
|
précipitations
annuelles *
Précipitations
de octobre-
novembre-décembre
|
Précipitations de
décembre
*
Précipitations
de
octobre-novembre-
décembre
|
|
F
|
P
|
F
|
P
|
F
|
P
|
F
|
P
|
F
|
P
|
F
|
P
|
|
Ardea cinerea
|
0,15
|
0,733
|
0,11
|
0,774
|
0,17
|
0,723
|
0,20
|
0,701
|
0,18
|
0,712
|
0,05
|
0,84
|
|
Ardeola ibis
|
18,50
|
0,05
|
0,06
|
0,824
|
10,67
|
0,082
|
2,67
|
0,244
|
11,06
|
0,08
|
8,11
|
0,104
|
|
Plegadis falcinellus
|
6,72
|
0,122
|
4,01
|
0,183
|
8,24
|
0,103
|
7,01
|
0,118
|
7,12
|
0,116
|
9,97
|
0,087
|
|
Ciconia ciconia
|
0,34
|
0,62
|
3,55
|
0,2
|
0,85
|
0,453
|
2,06
|
0,288
|
0,83
|
0,458
|
0,14
|
0,741
|
|
Phoenicopterus ruber
|
12,61
|
0,071
|
0,37
|
0,605
|
7,97
|
0,106
|
0,02
|
0,903
|
8,25
|
0,103
|
0,34
|
0,619
|
|
Anas platyrhynchos
|
0,52
|
0,544
|
1,21
|
0,386
|
0,85
|
0,454
|
1,05
|
0,413
|
0,79
|
0,469
|
0,65
|
0,505
|
|
Anas penelope
|
2,39
|
0,262
|
1,76
|
0,316
|
2,43
|
0,259
|
2,26
|
0,271
|
2,50
|
0,255
|
1,37
|
0,362
|
|
Anas clypeata
|
0,04
|
0,866
|
0,00
|
0,993
|
0,04
|
0,859
|
0,04
|
0,869
|
0,04
|
0,853
|
0,16
|
0,728
|
|
Tadorna tadorna
|
9,00
|
0,095
|
4,47
|
0,169
|
7,63
|
0,11
|
3,96
|
0,185
|
8,36
|
0,102
|
0,03
|
0,881
|
|
Charadrius dubius
|
8,66
|
0,099
|
20,35
|
0,046
|
10,20
|
0,086
|
12,50
|
0,072
|
10,02
|
0,087
|
0,90
|
0,443
|
|
Vanellus vanellus
|
1,92
|
0,3
|
2,16
|
0,279
|
2,24
|
0,273
|
2,43
|
0,259
|
2,27
|
0,271
|
1,30
|
0,372
|
|
Tringa ochropus
|
0,38
|
0,602
|
0,02
|
0,892
|
0,16
|
0,732
|
0,11
|
0,77
|
0,25
|
0,667
|
0,00
|
0,98
|
|
Tringa totanus
|
7093,27
|
0
|
27475,07
|
<0,0001
|
16,23
|
0,056
|
10568,88
|
<0,0001
|
59,53
|
0,016
|
10,41
|
0,084
|
Abréviations : F (Valeur de FISCHER), P
(Probabilité). La couleur grise indique la signification.
Etabli par : Mr CHENCHOUNI H.
67
Résultats et discussions
existent jusqu'à la fin de la saison
printanière, selon le présent travail nous avons recensé
700 individus de chevalier sp dans la cinquième sortie, où il a
été selon nos observations un plan d'eau de faible profondeur.
Cette relation avec les effectifs des deux limicoles et les
précipitations s'expliquer par l'engendre de ces vasières
préférentiels aux limicoles par les précipitations
tombées dans les mois d'octobre, novembre et décembre.
2.4.5.3. Conclusion
L'analyse statistique n'a montré d'effet des
précipitations que sur les espèces de limicoles. Il n'y a pas
d'impact de précipitation sur les autres espèces aviennes. Ceci
montre l'importance de l'humidité des zones de vasières, qui
permettent l'alimentation des limicoles.
68
Conclusion générale
CONCLUSION GENERALE
Le recensement de l'avifaune dépendante des zones
humides fait l'objet de pleines études dans différents pays, dans
le but de savoir l'évolution des effectifs, organisation
spatiotemporelle, la structure et la diversité des oiseaux de cette
avifaune mais également des études sur leurs habitats et leurs
statuts trophiques.
Le présent travail nous a permet de mettre en
évidence plusieurs paramètres concernant les oiseaux du chott El
Beida en mois de mai et juin de 2012.
Au terme de nos prospections sur la bordure Nord du chott El
Beida, nous avons recensé 45 espèces végétales dont
6 non déterminées. Ces espèces appartiennent
à 18 familles et 39 genres différents. La famille commune entre
tous les sites salée est celle des chénopodiacées, c'est
une famille indicatrice du milieu salé représenté par 5
espèces et 4 genres.
Notre recensement de l'avifaune effectué dans la
période d'étude au niveau du chott El Beida avec celles qui sont
fait par la direction générale des forêts entre 2003-2011
sont donné 24 espèces d'oiseaux, réparties sur 6 ordres,
13 familles, et 16 genres. L'ordre le mieux représenté est celui
des Charadriiformes avec 3 familles et 7 espèces (29,2%), suivi par
l'ordre des Ansériformes avec une seule famille et 5 espèces
(20,8%).
En ce qui concerne les statuts de l'avifaune, on parle sur la
phénologie des espèces inventoriées qui a la
prédominance des deux catégories, des oiseaux hivernants et des
sédentaires nicheurs avec 27% reflète l'importance du site pour
l'accueil de l'avifaune, particulièrement aquatique. Le présent
travail montre que le chott el Beida est un site de nidification pour une
espèce d'oiseau d'eau, il s'agit d'un gravelot Charadrius sp.
Les catégories trophiques de cette avifaune, Nous notons la richesse du
site en oiseaux hivernants de toutes catégories alimentaires ; la
période hivernale est la plus humide où se déclenche la
prolifération des espèces proies par les pluies tombée le
début de cette période hivernale, cette vie riche en nourriture
explique l'accueil du site aux espèces de différents
régimes alimentaires.
La moitié des espèces recensées dans le
chott el Beida est protégée par la loi Algérienne (le
décret exécutif n° 12-235 du 24 mai 2012). Par ailleurs,
l'emplacement occupé par le peuplement avien sur la liste rouge de
l'UICN révèle une situation non préoccupante.
L'année la plus importante du point de vue effectif est
celle de 2003. Les effectifs des espèces connaissent de grandes
variations dans le temps. En 2003, nous notons l'effectif le plus
élevé avec 1031 individus. Alors qu'en 2011 nous remarquons une
régression importante où le nombre des espèces est environ
427 individus soit un recul de 59% de l'effectif total par rapport à
2003.
Ces grands écarts dans les effectifs aviaires
reviennent essentiellement à la quantité d'eau présente
dans le chott pendant le recensement.
69
Conclusion générale
Le tadorne de belon, le flamant rose, l'échasse
blanche, et le chevalier sp., sont les oiseaux d'eau les plus utilisés
de la partie restreinte du plan d'eau situant au Nord du chott. Alors que, les
autres groupes des anatidés et des limicoles préfèrent la
proximité de l'eau et les sables de rivages. La prairie humide situant
au Nord-est, près du plan d'eau, est considéré comme un
lieu privilégié de stationnement pour les deux groupes l'un de
ciconiiformes présentant avec le héron garde boeufs et la cigogne
blanche, et l'autre des passereaux (Bergeronnette printanière).
L'occupation du site par des espèces suivant
différentes position offre sans doute les meilleures conditions de
sécurité et de nutrition, et les effectifs de ses populations
fluctuent dans le temps suivant le niveau d'eau.
Notre étude qui chevauche sur les deux mois mai et
juin, la faible valeur de l'indice de diversité de SHANNON
(H'=2,31 bits) résultant d'une faible valeur de richesse
spécifique totale implique que le site durant cette période est
peu diversifié, et d'une valeur moyenne d'indice
d'équitabilité (E=0,66) qui l'on note
généralement la dominance d'un de nombre considérable
d'espèces sur l'ensemble des espèces recensées, elle
traduit un peuplement assez équilibré. La diminution de la
diversité dans le temps traduit probablement par la régression du
plan d'eau voire sa sécheresse totale du début de juin.
Le groupe des Charadriiformes est le plus important tenant
compte de l'effectif de ses populations. Il présente avec un total de
1617 individus soit 70,1% de l'ensemble de l'avifaune dénombrée,
suivant par le groupe des Anatidés qui englobe 286 individus
(Fc=12,4%). l'effectif de ce groupe est pratiquement égale
celle de Ciconiiformes (Fc=12%). Alors que, le groupe des
Phoenicopteriformes qui présente avec la seule espèce de flamant
rose Phoenicopterus ruber occupe le rang bas par ses effectifs parmi
les oiseaux d'eau (53 individus et Fc=2,3%). Les effectifs du flamant
diminuent dans le temps et sa population quittant vers d'autres sites pour la
nidification.
Les deux relevés réalisés au début
de la période d'étude se rapprochent le plus du point de vue
composition taxonomique du peuplement d'oiseaux recensés. Ces
relevés sont présenté par l'indice de similitude le plus
élevée (Qs=92,3%). Tandis que pour les deux dernier
relevés qui est présenté par la faible valeur de l'indice
de similitude (Qs=53,3%). Le site qui est totalement
asséché lors de derrière sortie accueil un peuplement
d'oiseaux dont la majorité sont des sédentaires voire nicheurs
sur le site.
L'analyse statistique n'a montré d'effet des
précipitations que sur les espèces de limicoles. Il n'y a pas
d'impact de précipitation sur les autres espèces aviennes.
Ce travail méritait d'être poursuivi par d'autres
travaux plus étalés dans le temps et dans l'espace. Ses
études particulières sur Frankenia thymifolia qui est
une espèce endémique de l'Afrique du Nord.
L'étude particulière du Flamant rose, des
limicoles ainsi que des rapaces (Buse féroce, Faucon crécerelle
et Faucon émerillon) serait intéressantes à mener.
L'exploitation des données dans ce travail constituerait un outil
important pour la gestion et la conservation de la biocénose du Chott El
Beida.
70
Références bibliographiques
REFERENCES BIBLIOGRAPHIQUES
1. ADJEL M.et MOUICI S., 2004. Cartographie de la
végétation et éco-éthologie de la Tadorne de belon,
Tadorna tadorna, dans la Sebkha de Djendli. Mém. Ing. Eco.,
Univ. Batna. 10p.
2. AIDOUD A., 2003. Fonctionnement des écosystèmes
Méditerranéens.3ème conférence.
Laboratoire d'Écologie végétale, Univ. Rennes 1. Complexe
Scientifique de Beaulieu, 35042, Rennes. 11, 13p.
3. ALIAT T., 2007. Les relations Sol-Végétation
dans le Chott El Beida, Hammam Sokhna, wilaya de Sétif. Thèse
Magister en Agronomie, Univ. Batna, 15, 29, 33p.
4. ANONYME, 2002. Principaux textes législatifs et
réglementaires relatifs à la protection de l'environnement.
Edition 2002.
Disponible sur :
www.droit-afrique.com/images/textes/.../Algerie_Environnement.pdf.
5. ANONYME, 2004. ATLAS4des zones humides
Algériennes d'importance internationale (4eédition).
Direction générale des forêts, Alger, 98-100p.
6. ANONYME, 2008. Contribution à la création de la
réserve naturelle communautaire la vallée du SITATUNGA :
écologie et inventaire de la faune vertébrée. Extrait de
publication des travaux de recherches, Bénin Afrique de l'Ouest. 4p.
7. ANONYME, 2010. Liste alphabétique des oiseaux
protégés. 5eme édition-octobre 2010,
Bruxelles.
8. ANONYME, 2011. La convention de Ramsar. 01p. disponible sur :
www.crpf-limousin.com/sources/.../economi_convention_ramsar.pdf
9. ANONYME1, 2008. Convention sur la conservation des
espèces migratrices appartenant à la faune sauvage. texte
originale, 0.451.46 : 16-17, 20-21p.
10. AYYAD M.A., 2003. Case studies in the conservation of
biodiversity: degradation and threats. Journal of Arid Environments. 54,
165-182p.
11. BAAZIZ N. et al., 2011. Statut phénologique
et reproduction des peuplements d'oiseaux d'eau dans l'éco-complexe des
zones humides de Sétif (Hauts plateaux, Est de l'Algérie).
Bulletin de l'institut scientifique, Rabat, section sciences de la vie, 2011,
N°33 (2).Algérie.77-87p.
12. BACHA B. et BECHIM L., 2005.Approche bioécologique
des zones humides et des oiseaux d'eau de la région Sud-Constantinoise.
Mém. Ing. Eco., Univ. Batna. 32, 37, 42-43, 75p.
13. BAGNOULS F. et Gaussen H., 1953. Saison sèche et
indice xérothermique. Bull. Soc. Hist. Nat. Toulouse (88). Pp :
193-239p.
14. BARBAULT R., 1981. Ecologie des populations et des
peuplements. Ed. Masson, Paris. 200p.
15. BARBERO M., BONNIN G., LOISEL R. et QUEZEL P., 1989.
Sclerophyllous Quercus forests of the mediterraan area: Ecological and
ethological significance. BielefelderOkolBeitr4: 1-23p.
71
Références bibliographiques
16. BECHET A. et SAMRAOUI B., 2010. Plan d'action pour le
Flamant rose Phoenicopterus roseus en Algérie. Centre de
recherche de la Tour du Valat, Arles, France. 5, 15p.
17. BECHTEL, 1975. Développement des ressources en eau
et de l'agriculture. Etude préliminaire et conditions de
réalisations. BECHTEL. Incorporated, USA. 4 volumes.
18. BEINTEMA A. J. et al., 1987. Nesting success of
birds breeding in Dutch agricultural grasslands. Journal of Applied Ecology,
24: 743-758p.
19. BENTAMER N., 1998. Disponibilités en ressources
entomologiques et modalités de leur utilisation par deux
échassiers : la Cigogne blanche (Ciconia ciconia) et le
Héron garde-boeufs (Bubulcus ibis) dans la vallée du
Sébaou (Kabylie, Algérie). Thèse Magister, lnst. Nat.
Agro., El-Harrach, 247 p.
20. BETIER G., ROYER L., et LAFFITTE R., 1959. Carte
géologique feuille n° 119, Saint Donat. Service de la carte
géologique de l'Algérie.
21. BIGOT L. et BODOT P., 1973. Contribution à
l'étude biocénotique de la garrigue à Quercus
coccifera : II-Composition biotique du peuplement des
invertébrées. Vie et Milieu, 23 : 229-249p.
22. BLONDEL J., 1975. Analyse des peuplements d'oiseaux
d'eau. Elément d'un diagnostic écologique I: La méthode
des échantillonnages fréquentiels progressifs (E.F.P.). Terre
et Vie.
23. BLONDEL J., 1979. Biologie et écologie. Ed.
masson, Paris, 173p.
24. BLONDEL J., 1986. Biogéographie évolutive.
Masson, Paris, 221 p.
25. BLONDEL J., 1990. Biogéographie évolutive
à différentes échelles : l'histoire des avifaunes
méditerranéennes. Acta 19, Congres sus international
isornithologici, 1 : 155-188p.
26. BLONDEL J., 1995. Biogéographie : Approche
écologique et évolutive. Masson, Paris. 297p.
27. BONTER et al., 2010. Invasive birds in a novel
landscape: habitat associations and effects on established species.
Ecography, 33 : 494-502p.
28. BOUAZZA M. et al., 2004. Evolution de la
végétation steppique dans le sud-ouest de l'Oranie
(Algérie). Rev. Ecol. Med., Tome 30. Fasc. 219-231p.
29. BOUAZZA M., BENABADJI N., LOISEL R. et METGE G., 2004.
Evolution de la végétation steppique dans le sud-ouest de
l'Oranie (Algérie). Rev. Ecol. Med. Tome 30. Fasc., 219-231P.
30. BOUDOUKHA A.R., 1988. Etude hydrogéologique et
modélisation du système aquifère fermé d'El.Eulma -
Ain Lahdjar (région Est de Sétif - Algérie), Thèse,
Doctorat, Univ. BESANÇON, 186p.
31. BOUKHEMZA M., 2000. Etude Bioécologique de la Cigogne
blanche (Ciconia ciconia L. 1775) et du Héron garde-boeufs
(Bubulcus ibis L. 1775) en Kabylie : Analyse démographique,
éthologique et essai d'interprétation des stratégies
trophiques. Thèse doctorat, Inst. Nat. Agro., El Harrach. (Alger), 188
p.
72
Références bibliographiques
32. BOUKHEMZA M., DOUMANDJI S., VOISIN C. et VOISINJ.F.,
2000. Disponibilités des ressources alimentaires et leur utilisation par
le Héron garde-boeufs Bubulcus ibis en Kabylie, Algérie.
Terre et Vie (Rev. Ecol.), 55 : 361-381p.
33. BOUKHEMZA M., DOUMANDJI S., VOISIN C. et VOISINJ.F.,
2004. Comparative utilization pattern of trophic resources by White storks
Ciconia ciconia and Cattle egrets Bubulcus ibis in Kabylia
(Algéria). Terre et Vie (Rev. Ecol.), 59: 559-580p.
34. BOUKHETECHE N., 2010. Etude de quelques
éléments de la niche écologique de la Cigogne blanche
(Ciconia ciconia) et du Héron garde-boeufs (Bubulcus
ibis) dans la région de Batna. Thèse Magister en Agronomie,
Univ. Batna.
35. BOULEKHSSAIM M., HOUHAMDI M. et SAMRAOUI B., 2006. Status
and diurnal behaviour of the Shelduck Tadorna Tadorna in the Hauts
Plateaux, Northeast Algeria. Wildfowl, 56, 65-78p.
36. BOULEKHSSAIM M., OULDJAOUI A., BAAZIZ N., ZEBSA R.,
SEKRANE N., AYAICHIA F., BOURIACH M., FRIHA R., HABES A. et SAMRAOUI B., 2009.
Mass reproduction of the Greater Flamingo at Ezzemoul, Algeria in 2009 the need
to reassess the role of North African wetlands. Flamingo, 17,
4853p.
37. BOUMEZBEUR A. et BOULAHLIB A., 2005. Fiche descriptive
sur les zones humides Ramsar (FDR), chott El-Beida. Conservation des
forêts de Sétif. Direction Générale des
Forêts, Alger. 2-4, 7, 10p.
38. BOUZENOUNE A., 2003. Étude portant projet de
classement du site d'Oglat Ed Daira en aire protégée wilaya de
Naama, Algérie. 37p.
39. BOUZID A., 2003. Bioécologie des oiseaux d'eau
dans les chotts d'Ain El Beida et d'Oum Er-Raneb (Région d'Ouargla).
Thèse de Magister en Agronomie. INA El Harrach, Alger. 136p.
40. BRITTON R. H. et CRIVELLI A. J., 1993. Wetlands of
southern Europe and North Africa: Mediterranean wetlands. In: WHIGHAM, D.F.,
DYKYJOVA', D., HEJNY, S. (Eds.), Wetlands of the World I. Kluwer, Netherlands,
pp. 129-194p.
41. Bureau National d'Etude pour le Développement
Rural (B.N.E.D.E.R), 2000. Etude agropédologique sur 120 000 ha (phase :
1, 2, 3). Dir. Ser. Agr. Sétif.
42. CALLADINE J., BAINES D. et WARREN P., 2002. Effets of
reduced grazing on population density and breeding success of blackgrouse in
northern England. Journal of Applied Ecology, 39 :772-78p.
43. CHENCHOUNI H., 2007. Diagnostic écologique d'un
site proposé Ramsar : Chott de Djendli (Batna-Algérie).
Mém. Ing. Eco. Univ. Batna. 17-18, 43-44, 92p.
44. CHENCHOUNI H., 2011. Diagnostic écologique et
évolution du patrimoine biologique du lac Ayata (Vallée de l'Oued
Righ : Sahara septentrional Algérien). Thèse Magister en
Biologie, Univ. Ouargla. 34, 45-46, 55-56, 85p.
73
Références bibliographiques
45. CHENCHOUNI H., 2012. Diversité floristique d'un
lac du bas-Sahara algérien. Department of Natural and Life Sciences,
Faculty of Exact Sciences and Natural and Life Sciences, University of Tebessa,
Tebessa, 12002, Algeria. 41p.
46. DAGET P., 1977 a. le bioclimat
méditerranéen : caractères généraux,
méthodes de classification. Vegetatio, 34 (1). 1-20p.
47. DAGET P., 1977 b. le bioclimat
méditerranéen : analyse des formes climatiques par le
système d'EMBERGER. Vegetatio, 34 (2). 87-103p.
48. DAJOZ R., 1975. Précis d'écologie. Ed.
DUNOD, Paris. 434p.
49. DAJOZ R., 1983. Précis d'écologie. Ed.
DOUNOD. Paris. 503p.
50. DAJOZ R., 1985. Précis d'écologie. Ed.
DUNOD. Paris. 505, 560p.
51. DAJOZ R., 2003. Précis d'écologie. Ed.
DUNOD. Paris. 615 p.
52. DAJOZ R., 2006. Précis d'écologie:
8eEdition, Ed. DUNOD, Paris. 631p.
53. DANIN A. et ORSHAN G., 1990. The distribution of
RAUNKIAER life forms in Palestine in relation to the environnement. J
VegetationSci1 :8-41p.
54. DARLEY B., 1985. Systématique des
vertébrés. Ed. Office des publications universitaires (O.P.U),
Alger.
55. DEMDOUM A., 2010. Etude hydrogéochimique et impact
de la pollution sur les eaux de la région d'el Eulma. Thèse
Doctorat, Univ. Constantine. 5-6, 66p.
56. DENALY S., 2007. Guidelines for participants in the
International Waterbird Census (IWC). Wetlands International edition,
Netherlands. 14p.
57. DI CASTRI F., 1981. Mediterranean type shrublands of the
world. In: DI CASTRI, F., GOODALL, D.W., Sprecht, R.L. (Eds.), Mediterranean
Type Shrublands. Elsevier, pp. 1-52p.
58. DI CASTRI F., 1981. -Mediterranean-type shrublands of the
world. In: DI CASTRI F., Goodall D.W. et SPETCH R.L. (eds), Ecosystems of the
world 11: -mediterranean-type shrublands, pp. 1-52. Elsevier, Amsterdam.
59. EMBERGER L., 1967. Réflexions sur le spectre
biologique de Raunkiaer. 147-156p in: EMBERGER L., 1971. Travaux de botanique
et d'écologie. - Mém. Soc. Bot. Fr. Paris.
60. FROCHET B. et ROCHÉ J., 2000. Les fonctions des
zones humides pour les oiseaux in Fonctions et valeurs des zones humides.
DUNOD, Paris, France. 13 : 268-269, 270, 275-276p.
61. GHBOULI et BENCHEIKI E., 2008. Origine de la
salinité des eaux souterraines-cas des hautes plaines sétifiennes
(Nord-Est Algérien). Document interne, Sciences & technologie
A-N°28 Décembre. (2008), pp. 37-46. Univ. Constantine.38p.
74
Références bibliographiques
62. GHEZLAOUI B. E., BENABADJI N., BENMANSOUR Dj. et MERZOUK
A., 2011. Analyse des peuplements végétaux Halophytes dans Le
chott El-Gharbi (Oranie-Algérie). Publié par Acta Botanica
Malacitana36. 113-124, Málaga 2011. 121p.
63. GOUAIDIA L., 2008. Influence de la lithologie et des
conditions climatiques sur la variation des paramètres physico-chimiques
des eaux d'une nappe en zone semi-aride, cas de la nappe de Meskiana Nord-Est
Algérien. Thèse Doctorat, Univ. Annaba. 25, 27p.
64. GOUMIDI N. et KAOUACHE S., 1995. Contribution à
l'étude hydrogéologique de la plaine de Hammam Sokhna (wilaya de
Sétif). Mém. Ing. Géo. Univ. Constantine. 151p.
65. GREEN A.J., EL HAMZAOUI M., EL AGBANI M.A., FRANCHIMONT
J., 2002. The conservation status of Moroccan wetlands with particular
reference to waterbirds and to changes since 1978. Biological Conservation 104.
71-82p.
66. HAFNER H., 1977. Contribution à l'étude
écologique de quatre espèces de hérons (Egretta g.
garzettaL., Ardeola r. ralloïdesScop., Ardeola i. ibis
L., Nycticorax n.nycticoraxL.) pendant leur nidification en
Camargue. Thèse doctorat, Uni. Paul Sabatier Toulouse. 183p.
67. HEIM de BAL SAC et MAYAUD N., 1962. Les oiseaux du
nord-ouest de l'Afrique (distribution géographie, écologie,
migration, et reproduction). Ed. PAUL LECHENALIER, Paris, France. 39, 57, 59,
60, 66, 71, 74, 78, 83, 85, 88, 89, 115, 117, 126, 128, 136, 244, 255, 396,
397p.
68. HEINZEL H., FITTER R. et PARSLOW J., 1992. Oiseaux d'eau
d'Europe, d'Afrique du Nord et du Moyen-Orient. Adaptation française :
MICHEL CUISIN. Société Ornithologique de France. Ed. Delachaux et
Niestlé S.A., Neuchâtel, Paris. France.
69. HOLLIS G. E. et SMART M., 1986. Les zones humides
Africaines : écologie, techniques d'étude et gestion. BIROE,
SLIMBRIDGE, GLOUCERTER, GK2 7DX, Angleterre. 85p.
70. HOUHAMDI M. et SAMRAOUI B., 2001. Diurnal time budget of
wintering Teal Anas crecca crecca L. at Lac des Oiseaux, Northeast
Algeria. Wildfowl, 52: 87-96p.
71. HOUHAMDI M., 1998. Ecologie du lac des oiseaux,
cartographie, palynothèque et utilisation de l'espace par l'avifaune
aquatique. Thèse Magister, Univ. Annaba. 198p.
72. HOUHAMDI M., 2002. Ecologie des peuplements aviens du Lac
des Oiseaux (Numidie orientale). Thèse de Doctorat d'Etat, Univ. Annaba.
138p.
73. HOUHAMDI M. et SAMRAOUI B., 2002. Occupation
spatio-temporelle par l'avifaune aquatique du Lac des Oiseaux (Algérie).
Alauda.
74. HOUHAMDI M. et SAMRAOUI B., 2003. Diurnal behaviour of
wintering Wigeon Anas penelope at Lac des oiseaux, Northeast Algeria.
Wildfowl, 54, 51-62p.
75. HOUHAMDI M. et SAMRAOUI B., 2008. Diurnal and nocturnal
behaviour of Ferruginous Duck Aythya nyrocaat Lac des Oiseaux,
Northeast Algeria. Ardeola, 55, 1, 59-69p.
75
Références bibliographiques
76. HOUHAMDI M., HAFID H., SEDDIK S., MAAZI M-C., BOUZEGAG
A., NOUIDJEM Y., BENSACI T. et SAHEB M., 2008. Hivernage des Grues
cendrées Grus grus dans le complexe des zones humides des
hautes plaines de l'Est algérien. Aves. 45, 2, 93-103p.
77. IONESCO T. et SAUVAGE Ch., 1962. Les types de
végétation du Maroc: essai de nomenclature et de
définition. Rev. Géogr. Maroc 1-2: 75-86.
78. ISENMANN P. et MOALI A., 2000. The birds of
Algeria-Les oiseaux d'Algérie. Soc. Etudes Ornithol. France,
Muséum Nat. Hist. Nat., Paris. 336p.
79. JOE Z., 2008. La liste rouge de l'UICN des espèces
menacées un outil fondamental pour la conservation. Commission de la
sauvegarde des espèces (CSE), disponible sur
www.iucn.org/redlist/.
01p.
80. KAABECHE, M., GHARZOULI, R., GEHU, J.M., 1993.
Observations phytosociologiques sur le Tell et Les Hautes Plaines de
Sétif (Algérie). Documents Phytosociologiques. N.S. XV.
Camerino.
81. KAZI TANI C., 2010. Contribution à l'étude
des communautés d'adventices Des cultures du secteur
phytogéographique oranais (nord-ouest Algérien) : aspects
botanique, agronomique et phytoécologique. Département des
Sciences Agronomiques et des Forêts, Faculté des Sciences de la
Nature et de la Vie et des Sciences de la Terre et de l'Univers,
Université Abou BekrBelkaïd, B.P. 119, 13000 Tlemcen,
Algérie. Publié dans "AFPP - 21e Conférence du COLUMA -
Journées internationales sur la lutte contre les mauvaises herbes, Dijon
: France (2010)". 2p.
82. KHADRAOUI A., 2006.Eaux et Sols en Algérie
(Gestion et impact sur l'environnement). Ed. EMPAC, Constantine,
Algérie. 392p.
83. KHAZNADAR M., VOGIATZAKIS I.N.et GRIFFITHS G.H., 2009.
Land degradation and vegetation distribution in chott El Beida wetland,
Algeria. Journal of Arid Environments 73 (2009) 369-377. 372p.
84. KRAIEM H., 2002. Biophysical and Socio-economic Impacts
of Climate Change onWetlands in the Mediterranean. Mediterranean Roundtable,
Athens.
85. KREBS C. J., 1989. Ecological methodology. Harper and
Row, New York. 386p.
86. LADJAL. M, 1995. Contribution à l'étude du
milieu et approche bioécologique de son avifauna: le chott de Tincilt.
Mém. Ing., Inst. Agro., Batna. 61p.
87. LAHMAR R., BATOUCHE S., LABIOD H. et MESLAM M., 1993. Les
sols et leur répartition dans les hautes plaines Sétifiennes,
Rev. N° 6, Eau et sol d'Algérie, Agence nationale des
ressourceshydr. Minist. Equip. pp : 60-70p.
88. LAMOTTE M. et BOURLIERE F., 1969. Problème
d'écologie : l'échantillonnage des peuplements animaux des
milieux terrestres. Ed. Masson et Cie, Paris.
89. LE HOUEROU H. N., 1979. La désertification des
régions arides. Rev. La recherche99: 336-334p.
76
Références bibliographiques
90. LE HOUEROU H. N., 1982. The arid bioclimates in the
Mediterranean isoclimatic zone. Ecol. Medit., vø (1/2), 103-114p.
91. LE HOUEROU H. N., 1989. Classification
écoclimatique des zones arides (s.l.) de l'Afrique du Nord. Ecologia
mediterranea, xv (3/4), 95-144p.
92. LE HOUEROU H. N., 1995. Bioclimatologie et
biogéographie des steppes arides du Nord de l'Afrique. Options
méditerranéennes, Série B, études et
recherches, 10, 396p.
93. LE HOUEROU H. N., 2004. An agro-bioclimatic
classification of arid and semi-arid land in isoclimatic Mediterranean
zones. Arid land research and management. 18, 301-346p.
94. LEDANT J. P., JACOBS P., MALHER F., OCHANDO B. et ROCHE
J., 1981. Mise à jour de l'avifaune Algérienne. Le
Gerfaut, 71 : 295-398p.
95. LEGENDRE L. et LEGENDRE P., 1979. Ecologie
numérique : la structure des données écologiques. Tome 2.
Ed. Masson. Paris. 255p.
96. MAAZI M-C., 2005. Eco-éthologie des
Anatidés hivernants dans Garaet de Timerganine (Oum
El-Bouaghi).Thèse de Magister, Univ. Oum El-Bouaghi. 108p.
97. MAAZI M-C., 2009. Eco-éthologie des
Anatidés hivernants dans l'étang de Timerganine (Ain Zitoune,
Wilaya d'Oum El-Bouaghi). Thèse de Doctorat, Univ. Annaba. 138p.
98. MADANI D., 2008. Relations entre le couvert
végétal et les conditions édaphiques en zone à
déficit hydrique. Thèse Magister enAgronomie. Univ. Batna.
47p.
99. MARTIN T.G. et POSSINGHAM H.P., 2005. Predicting the
impact of livestock grazing on birds using foraging height data -Journal of
Applied Ecology, 42: 400-408p.
100. MAYACHE B., HOUHAMDI M. et SAMRAOUI B., 2008. Ecologie
des Sarcelles d'hiver hivernants dans l'éco-complexe de zones humides de
Jijel (Algérie). Eur. J. Sci. Res. 21, 1, 104-119p.
101. MAGURRAN A. E., 2004. Measuring biological. Ed.
Wiley-Blackwell. 256p.
102. MELLAL F. et MESSAOUD A., 2006. Monographie
écologique d'une zone humide du sud constantinois (La mare de
Madgacen-Batna) Mém. Ing. Eco. Univ. Batna. 46p.
103. MERDAS S., 2007. Bilan des incendies de forêts
dans quelques wilayas de l'est Algérien ; cas de Bejaia, Jijel,
Sétif et Bordj Bou-Arreridj. Thèse Magister en Ecologie, Univ.
Constantine, 4p.
104. METALLAOUI S. et HOUHAMDI M., 2008. Données
préliminaires sur l'avifaune aquatique de la Garaet Hadj-Tahar (Skikda,
Nord-Est algérien). Bull. ABC. 1, 15, 71-76p.
105. METALLAOUI S., ATOUSSI S., MERZOUG A. et HOUHAMDI M.,
2009. Hivernage de l'Erismature à tête blanche (Oxyura
leucocephala) dans Garaet Hadj-Tahar (Skikda, Nord-Est de
l'Algérie). Aves. 3, 46, 136-140p.
106. MILLA A et al., 2012. Aperçu de
l'avifaune du sahel algérois. Algerian journal of arid environment vol.
2, n°1, Juin 2012: 3-15p.
77
Références bibliographiques
107. MOREAU SOPHIE D. et al, 2005. Plan de gestion du site de
TAGHIT-GUIR, Wilaya de Béchar. 91p.
108. MYERS N., MITTERMEIER R. A., MITTERMEIER C. G., FONSECA
G. A. B. et KENT J., 2001. Biodiversity hotspots for conservation
priorities. Nature. 403: 853-858p.
109. NASRI, 2000. Contribution à l'étude de
l'entomofaune du pommier dans la région de Bouhmamam (W. Khanchla).
Mém. Ing. Agr. Ins. D'agronomie Batna. 91p.
110. NATURA2000, 2010. Fiches habitats, espèces et
oiseaux validées. Document d'objectifs «Etang du Bagnas ». SIC
FR 9101412 & ZPS FR 9110034. 87, 118, 119p.
111. NEDJAHI M., 1992.Contribution à l'étude de
la situation écologique du Chott du Tincilt (Oum El Bouaghi) et de son
avifaune. Mém. Ing. Agro. Univ. Batna. 29p.
112. NEDJRAOUI D., HIRCHE A., BOUGHANI A., MOSTEFA S.,
ALAMANI F et BENARIAD M., 1999. Suivi diachronique des processus de
désertification in situ et par télédétection des
hautes plaines steppiques du Sud-ouest Oranais. U.R.B.T. et I.N.C.
Alger. 9-15p.
113. NICOLAI, SINGER et WOTHE, 1985. Gros plan sur les
oiseaux. Edition Nathan, Paris.
114. NORRIS D.R. et STUTCHBURY B., 2001. Extraterritorial
movements of a forest songbird in a fragmented landscape. Conservation Biology,
15: 729-736p.
115. O.T.I., 1974. Projet d'étude devant permettre la
définition de programme de développement sur lazone de
rénovation rurale des hautes plaines Sétifiennes.
Ingénieros Culsultores, Madrid, 3 Tomes. 692 p.
116. OCHANDO B., 1981. Méthodes de dénombrement
des oiseaux. Zool. Ina. El Harrach, N° 3: 14-19p.
117. OZENDA P., 1982. Flore du Sahara. Ed. Centre Nationale
des Recherches Scientifiques, Paris. 39p.
118. OZENDA P., 1991. Flore et végétation du
Sahara. 3ème édition. CNPRS. Paris. 222, 341p.
119. OZENDA P., 1994. Végétation du continent
européen. DELACHAUX et NIESTLE, Lausanne, Paris, 271 p. PITT M.D. et
HEADY H.F., 1978. Responses of annual vegetation to temperature and rainfall
patterns in Northern California. Ecology 59 : 336-350.
120. PIROT J. V., 1981. Partage alimentaire et spatial des
zones humides Camarguaises par cinq espèces de canards de surface en
hivernage et en transit. Univ. Pierre et Marie Curie. 135p.
121. PIROT J. V., CHESSELD et TAMISIER A., 1984. Exploitation
alimentaire des zones humides de Camargue par cinq espèces de canards de
surface en hivernage et en transit : modélisation spatiotemporelle. Rev.
Ecol. Terre et Vie, Vol. 39.
122. POUGET M., 1980. les relations
sol-végétation dans les steppes sud-Algéroises.
O.R.S.T.O.M. Paris. 135, 142p.
123. QUEZEL P., 1983. Flore et végétation de
l'Afrique du Nord, leur signification en fonction de l'origine, de
l'évolution et des migrations des flores et structures de
végétation passées. Bothalia, 14:411-416p.
78
Références bibliographiques
124. QUEZEL et SANTA, (1962, 1963). Nouvelle flore de
l'Algérie et des régions désertiques méridionales
(TOME 1, TOME 2). Éditions du centre national de la recherche
scientifique 15, quai Anatole-France - Paris 7°.
125. QUEZEL P., MEDAIL F., LOISEL R. et BARBERO M., 1999.
Biodiversity and conservation of forest species in the Mediterranean basin.
Unasylva 197: 21-28p.
126. RAMADE F., 1984. Eléments d'écologie :
Ecologie fondamentale. Ed. Mc. Graw-Hill, Paris. France. 397p.
127. RAMADE F., 2008. Dictionnaire encyclopédique des
sciences de la nature et de la biodiversité. DUNOD, Paris, France. 1,
181-182, 145, 546, 647p.
128. RAMADE F., 2009. Eléments d'écologie :
Ecologie fondamentale (4e Edition). DUNOD, Paris. 689p.
129. RAMOUSSE R., LE BERRE M. et LE GUELTE L., 1996.
Introduction aux Statistiques.
130. RAUNKIAER C., 1904. Om biologiske typer, med Hensyn til
Planternes Tilpasning til at overle ugunstige Aarister. Bot. Tidsskrift, 26.
1904.
131. RAUNKIAER C., 1934. The Life Forms of Plants and
Statistical Plant Geography, being the collected papers of RAUNKIEAR, Oxford
University Press, 1934. 2-104p.
132. SADINE S., 2012. Contribution à l'étude de
la faune scorpionique du Sahara septentrional Est Algérien (Ouargla et
El Oued). Thèse Magister en Agronomie, Univ. Ouargla. 22p.
133. SAHEB M., 2003. Cartographie de la
végétation des sebkhas de Guellif et Ougla Touila (Oum El
Bouagui) et écologie de l'avifaune. Thèse de Magistère.
Centre universitaire d'Oum El Bouagui.
134. SAHEB M., BOULEKHSSAIM M., OULDJAOUI A., HOUHAMDI M. et
SAMRAOUI B., 2006. Sur la nidification du Flamant rose Phoenicopterus
roseus en 2003 et 2004 en Algérie. Alauda, 74 : 3,
368371p.
135. SAMRAOUI B. et SAMRAOUI F., 2008. An ornithological
survey of the wetlands of Algeria: Important Birds Areas, Ramsar sites and
threatened species. Wildfowl, 58: 71-98p.
136. SAMRAOUI B., 2009. Ecologie et conservation de
l'avifaune des zones humides algériennes. Laboratoire de Recherche et de
Conservation des zones humides, Univ. Guelma, Algérie. D'après
CIPCA 03, 03-06 Octobre 2009, El Goléa, Algérie. 7p.
137. SAMRAOUI B., OULDJAOUI A., BOULKHSSAIM M., HOUHAMDI M.,
SAHEB M. et BECHET A., 2006. The first recorded reproduction of the Greater
Flamingo Phoenicopterus roseus in Algeria, behavioural and ecological
aspects. Ostrich, 77: 3-4, 153-159p.
138. SCHRICKE V., 1985. Les méthodes des
dénombrements hivernaux d'Anatidés et de Foulques de la
théorie à la pratique. La sauvagine et la chasse (253) : 4-6p.
79
Références bibliographiques
139. SEDDIK S., 2005. Occupation spatio-temporelle des
peuplements Laro-Limicoles et Echassiers dans les zones humides des hautes
plaines de l'Est algérien. Mémoire de Magister, Université
d'Oum El-Bouaghi, 78 p.
140. SELTZER P., 1946. Le climat d'Algérie. Trav. Ins.
Met. et Phy. Du Globe, Univ. Alger. 219p.
141. SI BACHIR A., 2007. Bio-écologie et facteurs
d'expansion du Héron garde-boeufs, Bubulcus ibis (Linné,
1758), dans la région de la Kabylie de la Soummam et en Algérie.
Thèse Doctorat d'Etat, Faculté des Sciences, Dépt. Bio.
Univ. Sétif. 243p.
142. SI BACHIR A., FERRAH F., BARBRAUD C. et CEREGHINO R.,
2011. The recent expansion of an avian invasive species (the Cattle Egret
Ardea ibis) in Algeria. J. Arid Environ. 75:1232-1236p.
143. SIEGFRIED W. R., 1971. The food of the Cattle egret.
Jour. Applic. Ecol., 8: 447-468p.
144. SIMONEAU P., 1961. Les centres d'études
d'irrigation du Sahara occidental. Essais et études de la campagne
1957-1958-1959-1960. Trav. Sect. Pédologie et Agrologie N°5 et 6.
Publ. Serv. Etudes scientifiques.
145. STEWART P., 1969. Quotient pluviothèrmique et
dégradation biosphérique : quelques réflexions. Bull.
Soc. Hist. Nat. Nord. 59 (1-4), 23-36p.
146. STEWART P., 1975. Un nouveau climagramme pour
l'Algérie et son application au barrage vert. Bull. Soc. Hist. Afr.
Nord. 65 (1/2). 239-252p.
147. TAMISIER A. et DEHORTER O., 1999. Camargue, Canards et
Foulques. Fonctionnement d'un prestigieux quartier d'hiver. Centre
Ornithologique du Gard, Nîmes, France. 369p.
148. TRABAUD L., 1994. Postfire plant community dynamics in
the Mediterranean basin. In : Moreno V.M. & Oechel W.C. (eds), The
rôle of the fire in mediterranean-type ecosystems. pp. 1-15.
Springer-Verlag, Berlin.
149. VICKERY P.D., HUNTER M.L. et MELVIN S.M., 1994. Effects
of habitat area on the distribution of grassland birds in Maine. Conservation
Biology, 8: 1087-1097p.
150. VILA J. M., 1977. Cartes géologiques, feuille
n° 118 Bir El Arch, feuille 145 Boughzel, feuille n° 144 Ain Lahdjar.
Edit. Sonatrach.
151. VILA J. M., 1980. La chaine alpine d'Algérie
orientale et des confins Algero-Tunisiens. Thèse. Doctorat ; Paris VI.
66p.
152. VON HUMBOLDT A., 1807. Essai sur la géographie
des plantes. Ed. Européennes Erasme.
153. VOOS K.H., 1960. Atlas of European birds. Ed Nelson.
London.
154. WHIGHAM D., DYKOJOVA D. et HEJNY S., 1993. Wetlands of
the World I: Inventory, Ecology, and Management. Kluwer Academic Publishers.
155. WILLIAMS M., 1990. Wetlands a Threatened Landscape.
Basil Blackwell, Oxford.
80
Références bibliographiques
156. YEANN B., 2006. Délimitation de l'espace
fonctionnel par fonction et par type de zones humides du bassin
Rhône-Méditerranée rapport annexe ; les fonctions des zones
humides : synthèse bibliographique. Document du travail ECOSPHERE/Agence
de l'eau RMC, Lyon, France.6p.
157. ZATOUT M., 2012. Etude géochimique et
minéralogique du Chott de Ain El Beida et de la Sebkha d'Oum Erraneb
Cuvette d'Ouargla-Bas Sahara. Thèse Magister en Géologie, Univ.
Ouargla. 33p.
SITES WEB
SITE WEB 01: http: //
www.tutiempo.net/en/Weater/africa.htm
SITE WEB 02:
www.telabotanica.org
SITE WEB 03:
http://inpn.mnhn.fr/accueil/index
SITE WEB 04:
www.wikepedia.org
SITE WEB 05:
http://floranet.pagesperso-orange.fr/tox/ranusce.htm
SITE WEB 06:
http://www.sahara-nature.com/plantes.php?aff=nom&plante=frankenia%20thymifolia
SITE WEB 07:
www.iucnredlist.org
SITE WEB 08: www.cms.int
SITE WEB 09:
www.cites.org
SITE WEB 10:
www.unep-aewa.org
SITE WEB 11:
http://www.cms.int/species/aewa/aewa_fr.htm
SITE WEB 12:
www.unepmap.org
SITE WEB 13:
http://www.sanctuaire-pelagos.org/admin/medias/docs/protocole-asp-fr.pdf
SITE WEB 14:
www.africa-union.org
SITE WEB 15:
http://www.minenv.gov.ma/PDFs/conv_anim_plant/6.pdf
SITE WEB 16:
http://www.xlstat.com/fr/
81
Annexes
ANNEXES
Annexe 1 : Position de la zone
d'étude dans les subdivisions phytogéographiques d'Algérie
d'après MAIRE (1926), QUEZEL et SANTA (1962-1963).
|
MAIRE
(1926)
|
QUEZEL et
SANTA
(1962-1963)
|
Numidien Secteur
Punique Kabyle et
Numidien
Algérois Algérois
Tell Secteur du Tell
|
Empire holarctique
|
Région
méditerranéenne
|
Sous-région Domaine
Méditerranéenne
Maghrébin-
Méditerranéen
|
|
|
Méridional constantinois
|
|
Secteur des hautes plaines constantinoises
|
Sous-secteur des hauts plateaux constantinois (zone
d'étude)
Oranais Oranais
Annexe 2 : Liste des espèces
protégées par la loi Algérienne (décret N°
83-509 du 20 août 1983) (ANONYME, 2005).
Nom commun Nom scientifique
Tadorne de Belon Tadorna tadorna
Flamant rose Phoenicopterus ruber
Echasse blanche Himantopus himantopus
Avocette élégante Recurvirostra
avosetta
Grue cendrée Grus grus
Busard des roseaux Circus aeruginosus
Cigogne blanche Ciconia ciconia
Huppe fasciée Upupa epops
Faucon crécerelle Falco Tinnuculus
Annexe 3 : Dénombrements hivernaux
annuels des oiseaux d'eau (ANONYME, 2005).
|
Espèces
|
|
|
|
Années
|
|
|
|
|
1991
|
1998
|
1999
|
2000
|
2001
|
2003
|
2004
|
|
Tadorne de BelonTadorna tadorna
|
2.000
|
-
|
23
|
1.542
|
-
|
650
|
780
|
|
Canard siffleur Anas penelope
|
800
|
-
|
291
|
1
|
-
|
-
|
-
|
|
Canard colvert Anas platyrhynchos
|
-
|
-
|
63
|
2
|
-
|
-
|
-
|
|
Canard souchet Anas clypeata
|
-
|
-
|
50
|
-
|
-
|
46
|
150
|
|
Flamant rose Phoenicopterus ruber
|
450
|
-
|
-
|
1.345
|
-
|
335
|
23
|
|
Grue cendréeGrus grus
|
-
|
-
|
-
|
72
|
3
|
-
|
-
|
Annexes
|
Bécassine des marais Gallinago gallinago -
|
12
|
- - - - -
|
|
Bécasseau Maubèche Calidris canitus -
-
|
1
|
- - - -
|
Echasse blanche Himantopus himantopus 7
Avocette élégante Recurvirostra avosetta
-
Mouette rieuse Anas penelope 15
- - - - - -
27 - - - - -
- - - - - -
|
Courlis cendré Numenius arquata - - -
|
5
|
- - -
|
Chevalier sp. Tringa sp. - - - - - 200 -
|
Bécasseau minute Calidris minuta - - -
|
3
|
- - -
|
82
Total 3.272 39 429 2.970 3 1.031 953
Annexe 4: Les familles des oiseaux
considérés comme oiseaux d'eau (DENALY, 2007).
Anatidae, Dromalidae, Burhinidae, Charadriidae, Glareolidae,
Haematopodidae, Jacanidae, Recurvirostridae, Rostratulidae, Scolopacidae,
Ciconiidae, Gaviidae, Gruidae, Heliornithidae, Rallidae, Laridae, Sternidae,
Anhingidae, Balaenicipitidae , Pelecanidae, Scopidae, Threskiornithidae,
Phoenicopteridae, Ardeidae, Podicipedidae, Phalacrocoracidae, Anhimidae,
Ibidorhynchidae, Pedionomidae, Thinocoridae, Rynchopidae, Eurypygidae, et
Aramidae.
Annexe 5 : Le concept du matorral
(AIDOUD, 2003).
Le matorral, terme d'origine espagnol a été
adopté par Ionesco et Sauvage (1962) pour décrire, au Maroc, les
formations de ligneux bas n'excédant pas 7 m de hauteur. Il
représente la forme considérée comme la plus typique de la
végétation méditerranéenne (DI CASTRI, 1981).
Différentes dénominations existent selon par exemple la taille,
la nature de la roche mère : garrigues et maquis français,
chaparrals californiens, mallee australien... Le matorral est
considéré comme issu de la régression de formations
forestières suite à différentes perturbations. Selon
TRABAUD (1994), ce sont les feux répétés et la
pauvreté du sol en éléments biogènes qui ont
favorisé la formation d'écosystèmes de ligneux bas dont
l'évolution est en général bloquée de façon
précoce. Parmi les principales espèces dominantes, citons, selon
OZENDA (1994), le chêne kermes (Q. coccifera), le lentisque
(Pistachia lentiscus), l'alaterne (Rhamnus alaternus), les
cistes (Cistus sp.), le romarin (Rosmarinus officinalis,
R. tourfortii). Leur dégradation extrême conduit aux
pelouses sèches.
83
Annexes
Annexe 6 : Renoncule
scélérate systématique et biologie (SITE WEB05) et des
personnelles photos de quelques espèces végétales.

Classification
? Nom latin : Ranunculus sceleratus L.
? Famille : Ranunculacées
? Noms communs : Herbe scélérate, herbe aux
vaches.
Source : (SITE WEB01). Renoncule scélérate dans la
bordure nord du Chott El Beida
(Cliché F. Radjai, Le :
16/05/2012).

L'embouchure de cours d'eau usé rejeté par le
centre d'assainissement de Hammam Sokhna (Cliché F. Radjai
: 16/05/2012).
84
Annexes

Jonc maritime (Juncus maritimus), autour le cours des
eaux usé (Cliché F. Radjai :
16/05/2012).
Salicorne (Salicornia fruticosa), berge nord du Chott
El Beida (cliché H. Bechini, 16/05/2012).
? Biologie
-Habitat : Prés humides,
marécages, bassins peu profonds, bord des ruisseaux à lent
débit, zones
boueuses des rivières et lacs, souvent près de
la mer, sur sol fertile, alluvial ou riche en éléments
basiques, à basse altitude.
-Floraison : Mai - septembre
-Fréquence : Commun, sauf dans le Midi
de la France.
-Type végétal : Herbacée
annuelle très variable, assez vigoureuse, presque entièrement
glabre.
-Taille : De 10 à 100 cm.
-Feuilles : Feuilles basales
pétiolées divisées en 3 segments, eux-mêmes
lobés et dentés ; feuilles
supérieures, sessiles, à 3 lobes ; toutes les
feuilles sont d'un vert assez brillant.
-Fleurs : Fleurs régulières
jaunes, 5-10 mm, groupées en grand nombre en grappes ramifiées ;
pétales de
même longueur que les sépales tournés vers
le bas ; partie femelle au centre de la fleur de forme ovoïde
allongée, proéminente.
-Fruits : Akènes glabres à bec
court et arrondi, en têtes allongées.
85
Annexes
-Toxicité : Essentiellement une toxicité
cutanée, la littérature ne signalant que de rares cas
d'intoxication par ingestion, la plante étant habituellement
dédaignée par le bétail.
-Nature du toxique : Glucoside appelé
ranunculine, dégradé par hydrolyse en une lactone irritante, la
proto-anémonine, rapidement inactivée en anémonine, par
dimérisation spontanée, ce qui explique la relative
innocuité de la plante à l'état sec.
-Organes incriminés : Plante
entière mais surtout les feuilles.
-Symptômes :
· Irritations cutanées plus ou moins graves
provoquées par simple contact : érythème avec
démangeaisons modérés, oedème, eczéma,
cloques
· Irritations locales du tube digestif par ingestion :
stomatite sévère avec inflammation, brûlures,
ulcérations Remarque :
· A noter l'existence d'autres espèces de
renoncules : R. flammula, petite douve, R. auricomus, renoncule à
tête d'or, R. sardous, renoncule des marais et R. thora, cabaret, ainsi
que de très nombreuses autres, toutes potentiellement toxiques.
· Dans l'antiquité, le poison extrait de R.
sardous fut utilisé au cours d'autosacrifices par les guerriers
ibères vaincus au combat. Les anciens (Dioscoride, Pline) l'avaient
baptisée "herbe sardonique", la supposant originaire de Sardaigne. Comme
elle provoquait une crispation caractéristique du visage au moment de la
mort, on parlait alors de "rire sardonique".
· R. thora (du grec phthora : destruction, perdition)
fut utilisée autrefois par les chasseurs des Alpes et des
Pyrénées pour empoisonner leur flèches.
Annexe 7 : Systématique et
biologie de Frankenia thymifolia (SITE WEB06).
|
Classification
-Non latin : Frankenia thymifolia.
-Famille : Frankeniacées.
-Nom français : Franquenne à
feuilles de thym.
|
|
Biologie
-Situation : Espèce endémique
nord-africaine commune dans les terrains salés, au bord des Chotts des
Hauts-plateaux et du Sahara septentrional. -Taille : 10
à 20 cm
|

Annexes
-Type de végétation : Plante
vivace à tiges ligneuses d'abord rampantes puis redressées.
-feuillage : Feuilles petites, aux bords enroulés en
dessous. Feuilles imbriquées les unes dans les autres. -Fleurs
: fleurs roses, petites, tout le long des rameaux.
Annexe 8 : Liste des espèces
aviaires par statut (BAAZIZ et al., 2011).
|
Liste 1 : Sédentaires nicheurs
Canard colvert (Anas platyrhynchos) Tadorne de
belon (Tadorna tadorna) Tadorne casarca (Tadorna ferruginea)
Buse féroce (Buteo rufinus)
Faucon crécerelle (Falco tinnunculus)
Étourneau unicolore (Sturnus unicolor) Totale : 6
|
|
Liste 2 : Sédentaires non nicheurs Héron
garde-boeufs (Ardeola ibis) Flamant rose (Phoenicopterus
ruber) Totale : 2
|
86
|
Liste 3 : Estivants
|
Liste 4 : Hivernants
|
Liste 5 : Migrateurs de passage
|
|
Cigogne blanche (Ciconia ciconia)
Echasse blanche (Himantopus himantopus)
Chevalier cul-blanc (Tringa ochropus)
Hirondelle de cheminée (Hirundo rustica)
Bergeronnette printanière (Motacilla flava)
Totale : 5
|
Héron cendré (Ardea cinerea) Canard
siffleur (Anas penelope)
Canard souchet (Anas clypeata)
Chevalier gambette (Tringa totanus)
Faucon émerillon (Falco columbarius)
Etourneau sansonnet (Sturnus vulgaris)
Totale : 6
|
Ibis falcinelle (Plegadis falcinellus)
Petit gravelot (Charadrius dubius
Vanneau huppé (Vanellus vanellus)
Totale : 3
|
Annexes

Le groupe de flamant rose (Phoenicopterus ruber)
observé sur le Chott (Cliché H. Touati,
08/05/2012).
Le groupe de flamant rose (Phoenicopterus ruber)
observé sur le Chott (Cliché H. Touati,
08/05/2012).
87
Annexe 9 : Le groupe de flamant rose
Phoenicopterus ruber observé sur le Chott.
88
Annexes
Annexe 10 : Le groupe de héron
garde boeufs Areola ibis observé dans le Chott.

Le Héron garde-boeufs en compagnie avec un troupeau de
bétail dans le Chott El Beida (cliché H.
Bechini, 16/05/2012)

Le Héron garde-boeufs en compagnie de la Cigogne
blanche sur les bordures du Chott (cliché H.
Bechini, 16/05/2012).
89
Annexes
Annexe 11 : Constance ou
fréquence d'occurrence des deux rapaces carnivores nicheurs du Chott El
Beida (DGF).
|
Dénombrement hivernal des oiseaux d'eau du Chott
El Beida (2003-2011)
|
|
Espèce
|
2003
|
2004
|
2005
|
2006
|
2007
|
2008
|
2009
|
2010
|
2011
|
|
Falco tinnunculus
|
0
|
0
|
0
|
9
|
3
|
1
|
3
|
0
|
0
|
|
Falco columbarius
|
0
|
0
|
2
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Dénombrement hivernal des oiseaux d'eau du Chott
El Beida (2003-2011)
|
|
Espèce
|
2003
|
2004
|
2005
|
2006
|
2007
|
2008
|
2009
|
2010
|
2011
|
Constance
|
|
Falco tinnunculus
|
-
|
-
|
-
|
+
|
+
|
+
|
+
|
-
|
-
|
44.44%
|
|
Falco columbarius
|
-
|
-
|
+
|
-
|
-
|
-
|
-
|
-
|
-
|
11.11%
|
Annexe 12 : Lois Algérienne et
conventions internationales pour la protection des oiseaux et de
l'environnement.
1. Quelques textes législatifs et
règlementaires relatifs à la protection de l'avifaune et son
environnement (ANONYME, 2002):
- Décret N° 63-344 de la 11/03/1963 portante
adhésion de loi République Algérienne démocratique
et
populaire à la convention internationale pour la
prévention des eaux de mer par les hydrocarbures ;
- Décret N° 63-345 de la 11/03/1963 portante
adhésion de la République Algérienne démocratique
et
populaire aux différentes conventions internationales pour
la sauvegarde de la vie humaine en mer ;
- Décret N° 81-03 du 17/01/1981 portant ratification
du protocole relatif à la coopération en matière de
lutte contre la pollution Méditerranée par les
hydrocarbures et autres substances en cas de situation
critique ;
- Loi n° 82-10 du 21 août 1982 relative à la
chasse
- Décret N° 83-458 du 23/07/83 portant le statut type
des parcs nationaux ;
- Décret n°83-509 du 20 août 1983, relatif aux
espèces animales non domestiques protégées ;
- Loi n° 83-03 du 05 février 1983 relative à
la protection de l'environnement
- Loi n° 83-17 du 16 juillet 1983 portant code des eaux
- Décret N° 84-378 du 16/12/84 fixant les conditions
de nettoiement d'enlèvement et du traitement des
déchets solides urbaines ;
- Décret n° 87-143 du 16 juin 1987 fixant les
règles et modalités de classement des parcs
nationaux et réserves naturelles
- Décret n° 87-144 du 16 juin 1987 fixant les
modalités de création et de fonctionnement des réserves
naturelles
- Décret N° 90-78 du 27/02/1990 relatifs aux
études d'impact sur l'environnement ;
- Décret N° 93-160 juillet 1993 réglementant
les rejets d'effluents liquides industriels ;
90
Annexes
- Décret N° 93-161 juillet 1993 réglementant
le déversement des huiles et lubrifiants dans le milieu
naturel ;
- Décret N° 93-163 de la 10/07/93 portante
institution d'un inventaire du degré de pollution des eaux
superficielles;
- Décret N° 93-164 du 10/07/93 définissant la
qualité requise des eaux de baignade;
- Décret N° 93-183 du 27/07/93 réglementant
l'émission des bruits ;
- Arrêté ministériel n° 02 de la
09/01/1994 portante création de la commission nationale
d'environnement et du développement durable.
- Arrêté du 17 janvier 1995, complétant la
liste des espèces animales non domestiques protégées ;
- Décret exécutif n°95.321 du 18 octobre 1995,
fixant les conditions et les modalités de délivrance
d'autorisation pour l'ouverture d'établissement
détenant des animaux non domestiques ;
- Décret exécutif n°95.322 du 18 octobre 1995
fixant les conditions et les modalités de capture
d'animaux non domestiques et de leur utilisation à des
fins de recherche scientifique ;
- Ordonnance n° 96-13 du 15 juin 1996 modifiant et
complétant la loi n° 83-17 du 16 juillet 1983
portant code des eaux
- Décret exécutif 98-216 du 24 juin 1998 modifiant
le décret n°83-458 du 23 juillet 1983 fixant le
statut-type des parcs nationaux
- Décret exécutif n°02-175 du 20 mai 2002,
portant création de l'agence nationale des déchets
- Décret exécutif n°02-263 du 17 août
2002, portant création d'un centre national des formations à
l'environnement
2. Quelques conventions internationales
auxquelles l'Algérie à adhérer (ANONYME, 2002) :
- Convention de Londres 1963 sur la prévention de la
pollution des eaux de la mer par les hydrocarbures ;
- Convention de l'UNESCO 1973 sur la protection du patrimoine
mondiale culturel et naturel ;
- Convention pour la protection de la mer
Méditerranée contre la pollution dite convention de Barcelone
1980 ;
- Protocole relatif à la protection de la mer
Méditerranée contre la pollution d'origine tellurique 1982 ; -
Protocole relatif aux aires spécialement protégées de la
Méditerranée 1985 ;
- Convention relative aux zones humides d'importance
internationale particulièrement comme habitat de la sauvagine dite
convention de RAMSAR 1982 ;
- Convention africaine sur la conservation de la nature et des
ressources naturelles dite convention d`Alger 1982 ;
Annexes
? Convention sur le commercer internationale des espèces
de faune et de la flore sauvages menacées d'extinction dite convention
de Washington 1988 ;
? Convention de Rio sur la biodiversité (13/06/1992) ;
? Convention des Nations Unis sur la lutte contre la
désertification (17 juin 1994).
Annexe 13 : L'inscription du Chott El Beida sur
la liste RAMSAR des zones humides d'importance internationale (Anonyme,
2004).
Le critère de convention de Ramsar qui caractérise
le mieux le site est le critère 6

Justification de critère d'inscription
:
Les effectifs du Tadorne de Belon Tadorna tadorna et
de Flamant rose Phoenicopterus ruber dépassent habituellement
le 1% de la population régionale méditerranéenne pour ces
deux espèces.
Pour le Tadorne de Belon la norme de 1% a été
dépassée en 1975, 1991, 2000 et 2004. Il est à signaler
que les dénombrements n'ont pas eu lieu de 1992 à 1997. Pour le
Flamant rose la norme de 1% a été dépassée en 2000
uniquement. L'intérêt écologique du complexe de zones
humides de la région de Sétif est important pour ces deux
espèces. la mobilité et la
dispersion des oiseaux sur le grand complexe de zones humides dit du
constantinois fait que les effectifs dénombrés en Janvier ne
dépassent que rarement la valeur de 1%. De plus la région d'Oum
El Bouaghi, située à l'Est de la wilaya de Sétif, abrite
habituellement plus de Tadorne de belon et de Flamant rose.
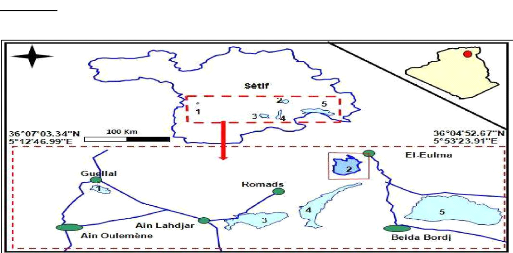
Annexe 14 : Situation
géographique de l'éco-complexe des zones humides de la
région de Sétif. 1: Sebkha Melloul, 2: Sebkha Bazer-Sakra, 3:
Sebkha El-Hamiet, 4: Sebkha El-Fraïne, 5: Chott El-Beida (BAAZIZ et
al., 2011).
91
Annexe 15 : Photos originales dans le
Chott El Beida.
92
Annexes

Photo de nid du gravelot sp trouvé dans le Chott El
Beida sur une touffe de salicornia fruticosa
(cliché H. Bechini, 18/06/2012).

La balance utilisée à mesurer le poids des oeufs de
gravelot (cliché H. Bechini, 18/06/2012).
Le pied à coulisse utilisé à mesurer les
dimensions du nu et des oeufs (Cliché F. Radjai
: 16/05/2012).
Résumé
Le Chott El-Beida est une zone humide, fait partie de
l'ensemble naturel des hautes plaines Sétifiennes, et plus
précisément du sous bassin du Chott El Beida (El-Eulma), qui se
situe dans l'Est Algérien, appartient du bassin versant des hauts
plateaux constantinois. La superficie totale du site s'étend sur
12223ha, avec une altitude de 874 à 887m.
Le présent travail s'articule principalement autour de
deux objectifs : Il s'agit de décrire la flore de bordure du Chott El
Beida avec une mise en évidence des catégories biologiques et
biogéographiques de la végétation en place. Le
deuxième objectif porte sur le recensement des oiseaux au niveau du
Chott, dans le but de connaitre, qualitativement, d'une part, en
caractérisant la structure du peuplement avien (espèces aviaires)
et quantitativement, d'autre part avec le nombre d'individus de chaque
espèce.
Nous avons recensé 45 espèces
végétales dont 6 non déterminées. Ces
espèces appartiennent à 18 familles et 39 genres
différents. La famille commune entre tous les sites salée est
celle des chénopodiacées, c'est une famille indicatrice du milieu
salé représenté par 5 espèces et 4 genres.
Notre recensement de l'avifaune effectué dans la
période d'étude au niveau du chott El Beida avec celles qui sont
fait par la direction générale des forêts entre 2003-2011
sont donné 24 espèces d'oiseaux, réparties sur 6 ordres,
13 familles, et 16 genres.
L'analyse statistique (ANOVA) n'a montré d'effet des
précipitations que sur les espèces de limicoles. Il n'y a pas
d'impact de précipitation sur les autres espèces aviennes.
Mots clés : Chott El-Beida,
végétation, avifaune, analyse statistique (ANOVA),
recensement.
ÙÔ
.ÁÇÖòÈáÇ ÙÔ
ÁÇØÛ ÌÐÍ ìáÇ
ÚÈÇÍ ÔËßÇ
ÍúÖúÈ ø
ÊòñÇØÖáÇ
ÇòáÚáÇ
ÈÇÖöáÇ ìáÇ
ÚÈÇÍ ÊÈØÓ
ÊÞØñå íÚ
ÉÓÇÈÚ
ÁÇÖòÈáÇ ÙÔ
Úå ÓÇÎßõ 32221
ÇõÓÐÞ ÊÏÇÖå
ìáÈÚ ÚÈÔÎñ
.ÊòñòØñÖÞáÇ
ÇòáÚáÇ
ÈÇÖöáÇ
ðÇÔÛÌáÇ
ÁÇØÛáá
ÚÈÇÍ
íÔÆÇÒÌáÇ
ÞÔÔáÇ ð ÚÞñ
ÁÇÖòÈáÇ
.ã
888
ø ã
888 íòÈ ÔÐÈáÇ
ÎØÕ ìáÚ
ÚÇÍÓÇ
:Çæõ
íòòÕÇÕÇ
íòÐõ ìáÚ
ÒßÍÔñ áæÚáÇ
ÇÒõ .ÙÔáÇ
ÇúÏ ìáÚ ÔòÚÍ
ðÎáÇ ø áæÚáÇ
ÇÒõ ð
ÇõÁÇÕÏÇ äÍ
ðÎáÇ
ËÇÎÈñáá
ÇòÇÔÛú
ÌúòÈáÇ ø
ÇòÌúáúßÇúòÈáÇ
ÊÕÇÓÏ :áÇøÇ
.áæÚáÇ ÊáÏÔå
ð ÉÏúÌúæáÇ
ÚÇúðáÇÇ
ÐñÐÐÍ Úå Úúð
áß ÏÇÔÇ ÏÐÚ
øÐÚÈ ßáÇÑ ø
ÙÔáÇ ÏøÇÔÍ
ðÎáÇ ÇõÔòÛ ø
ÊòÆÇæáÇ
ÓúòØáÇ
ÁÇÕÏÇ :ÇòðÇË
ÔñÌ 1 3 ø ÊáÆÇÚ 38
ìáÇ ðæÎñÍ
ÚÇúðáÇÇ òÒõ
.ðæáÚáÇ
äÕáÇÇ ÊÔÚå
ÔòÛ 6 Çöñå
ðÎáÇ ðÍÇÈð
Úúð 84ÇñòÕÏÇ
ÚÖÇúÎæáÇ
ÐöÌáÇ ÇÒöá
ÇÌÇÎð
. ÓÇñÌÇ
|
8 ø
|
ÊáÆÇÚ
|
3 1
|
áÆÇÕ
|
6 ìáÚ äÖÞñÍ
ðÎáÇ ø
|
ËÇÈÇÛáÇ
ìÇúÚÇ
ËÇÁÇÕÏÇ
ÈÇÖÎÏÇ Úå
ÇÔÆÇØ
|
.ÊáÎÎå
28ÇñòÕÏÇ
ÓúòØáÇ ÕÎñ
Çæò
|
|
.
|
øÐÚáÇ
|
(ANOVA)
|
ðÆÇÕÏáÅÇ
áòáÐÎáÇ
|
ÓúòØáÇ
ËÇÈñáÇ
ÁÇÖòÈáÇ
|
ÙÔ :
|
ÍÇÊãáÇ
ÊÇãáßáÇ
|
øÇòÈÇÌñÇ
íßñ äá
ÓúòØáÇ
ÚÇúðÇ áßá
ÏÇÔáÇÇ ÊÈÖð
ìáÚ
ÓÇØåáÇÇ
ËÇÔòÛÍ ÔòËÍ
ÊòðÇßåÇ óÈ
øíÐÎåÇ íÒáÇ
(ANOVA) ðÆÇÕÏáÅÇ
áòáÐÎáÇ
. ( LIMICOLES)
|
ËÇÚÞñÎÖæáÇ
ðñßÇÕ
ÓúòØáÇ
ÊÚúÌå íå
íòÚúð
|
ìáÚ áÇÇ
|



