|
UNIVERSITE DE LUBUMBASHI
FACULTE POLYTECHNIQUE
Département de
Métallurgie
|
|
INCIDENCE DU DEBIT D'ARROSAGE SUR LA
CONSOMMATION D'ACIDE
TOTALE (CAT) : CAS DE
LA LIXIVIATION EN TAS DES REJETS HMS
KAMBOVE
Par :
MAMBWE KAPALALE Alain
Projet présenté et défendu en vue de
l'obtention du grade de Bachelier Ingénieur civil en
Métallurgie
Directeur :
Prof Dr Ir Guy Nkulu Wa Ngoie
Année Académique : 2015 - 2016
Page | I
EPIGRAPHE
« La connaissance s'acquiert par l'expérience,
tout le reste n'est que de l'information »
« Quiconque prétend s'ériger en juge de la
vérité et du savoir s'expose à périr sous les
éclats de rire des dieux puisque nous ignorons comment sont
réellement les choses et que nous n'en connaissons que la
représentation que nous en faisons. »
Albert Einstein
Page | II
REMERCIEMENTS
Je tiens à remercier du fond du coeur le professeur Guy
NKULU pour avoir initié et dirigé ce mémoire dans un
climat convivial et fructueux. Son encadrement et son sens de
responsabilité nous a permis de travailler dur et d'aboutir à ce
présent travail.
J'adresse également mes remerciements à
l'Assistant Patrick TSHIBANDA, M. Alliance, M. Achille... et aux personnels du
département d'études métallurgiques (EMT) qui ont
contribués à notre formation et auprès de qui j'ai
trouvé une assistance et une franche collaboration.
Je tiens à remercier tous les collègues et amis
avec qui nous avons eu à travailler au laboratoire
hydrométallurgique du département d'études
métallurgiques à la GECAMINES pour leur participation aux
discussions scientifiques et assistances durant tout le temps que nous avions
à effectuer notre travail.
Je remercie infiniment mes parents qui ont fourni beaucoup
d'efforts pour mon instruction jusqu'à ce jour, je les remercie
également pour leur amour, affection, conseil ainsi que leur
confiance.
Je n'oublierai pas mes très cher(e)s frères et
soeurs : Denis KAPALALE, Harmonie KAPALALE, Prince KAPALALE, Judith KAPALALE,
Jérôme KAPALALE, sans oublié mes très chers oncles,
tantes, cousins, cousines, nièces et neveux pour leur soutien, conseil
et encouragements tout au long de mes études.
Aux ami(e)s, ceux qui l'ont été
fidèlement durant tout mon cursus et qui m'ont permis de
découvrir la richesse insoupçonnée d'une vraie
amitié ainsi que sa valeur. C'est avec un réel sentiment de
reconnaissance que je tiens à vous remercier pour tout le temps
passé ensemble qui a contribué à mon épanouissement
; je citerais ici : Gyress MAKINA, Bonny MWAMBA, SéphoraH KABWELE,
Antoine TAMBWE, Eliane KASONGO, Judith KALONJI, Agathe TSHIPAMA, Gracia LONGWA,
Sarah KITANIKA, Jean-Paul MALIZA, Dally MUKENKE, Jimmy UVWELE, Héritier
MAKINA, Joël KASONGO, etc.
Page | III
Je ne terminerais pas sans remercier le cercle culturel
l'ingénieur, qui aura été une seconde famille pour nous,
dans laquelle nous nous sommes épanouis et au travers laquelle nous
avons diversifié nos connaissances et avons ajouté un plus sur
notre formation universitaire.
Enfin, nos remerciements s'adressent à mon ami
fidèle qui a été un véritable compagnon de course
jusqu'ici en m'assistant et pourvoyant a tous mes besoins. Ainsi je remercie
mes bien-aimés frères et soeurs en Christ pour tous leurs
soutiens spirituels.
A toutes et à tous, je dédie ce travail.
Alain MAMBWE KAPALALE
Page | IV
RESUME
Cette recherche fait partie des efforts continuels que la
Générale des Carrières et des Mines (GCM) ne cesse de
mener pour perfectionner les méthodes et procédés
d'exploitation. Ce travail a été entrepris dans le but
d'étudier l'influence du débit d'arrosage de la solution
lixiviante sur la consommation d'acide totale : cas des rejets HMS du
concentrateur de Kambove. Ce rejet titrant environ 1,40 % en cuivre et 0,174 %
en cobalt.
La première partie de ce travail étudie
l'influence de la concentration d'acide sur le rendement de solubilisation.
Deux types d'essais de lixiviation ont été effectués :
lixiviation sans recirculation afin de voir la cinétique de lixiviation
ainsi qu'une lixiviation avec recirculation dans le but d'épuiser le
tas. Nos essais de lixiviation ont été réalisé dans
des petites colonnes de 9.5 cm de diamètre et 110.7 cm de hauteur dans
lequel on alimente 10kg de rejet HMS , on se fixe un débit de 25mL/min
pour différentes concentration d'acide (10, 25, 50 et 75g/l) et la
lixiviation a été réalisée pendant 144 heures. Les
résultats expérimentaux de ces essais ont montré que le
rendement de solubilisation est directement proportionnel à la variation
de la concentration d'acide, le rendement de lixiviation est passé de
59.8% à 75.8% Cuivre quand on varie la concentration d'acide de 10
à 75g/l.
La seconde partie a consisté à effectuer une
lixiviation avec une concentration d'acide de 75g/l, pendant 72 heures mais
tout en variant le débit d'arrosage (15, 20, 25, 30, 35mL/min). Ces
essais sont réalisés dans le but d'étudier l'influence du
débit d'arrosage sur la consommation d'acide totale(CAT) mais
également l'influence du débit sur le rendement de
solubilisation. Les résultats obtenus ont montré que les
rendements de solubilisation du cuivre et du cobalt ont atteint respectivement
de 76.98 % et 57,74 % et leurs consommations totales d'acide relatives de
443.18 kg/t et 255.45 kg/t. Ces essais ont montré que la consommation
d'acide est proportionnelle à la variation du débit, ainsi une
diminution du débit d'arrosage induit une augmentation importante du
temps de lixiviation avec comme avantage de diminuer sensiblement la
consommation en acide alors qu'une augmentation du débit diminue le
temps de lixiviation tout en augmentant sa consommation.
Page | V
TABLE DES MATIERES
EPIGRAPHE
REMERCIEMENTS II
RESUME IV
TABLE DES MATIERES V
LISTE DES FIGURES VII
LISTE DES TABLEAUX VIII
ABREVIATIONS IX
INTRODUCTION GENERALE 2
CHAPITRE I. GENERALIRE SUR LA LIXIVIATION 4
I.1. DEFINITION DE LA LIXIVIATION 4
I.2. TYPES DE LIXIVIATION 4
I.3. TECHNIQUE DE LIXIVIATION 5
I.3.1. LIXIVIATION PAR PERCOLATION 6
I.3.2. LIXIVIATION PAR AGITATION 8
CHAPITRE
II. LA LIXIVIATION
EN TAS 9
II.1. INTRODUCTION 9
II.2. MECANISMES DE PERCOLATION 11
II.2.1. INTRODUCTION 11
II.2.2. NOTION DE TRANSPORT 11
II.3. LES PARAMETRES INFLUENTS SUR LA LIXIVIATION EN TAS
13
II.3.1. PARAMETRES THERMODYNAMIQUE 13
II.3.2. PARAMETRES CINETIQUES 17
CHAPITRE III. MATERIELS ET METHODES 22
III.1. CARACTERISATION DE L'ECHANTILLON DU MINERAI
22
III.1.1. ORIGINE DE L'ECHANTILLON 22
III.1.2. PREPARATION DE L'ECHANTILLON 22
III.1.3. ANALYSE CHIMIQUE DE L'ECHANTILLON 22
Page | VI
III.1.4. ANALYSE GRANULOMETRIQUE DE L'ECHANTILLON 22
III.1.5. ANALYSE GRANULOCHIMIQUE 23
III.2. ESSAIS DE LIXIVIATION EN COLONNE 24
III.3. MATERIELS ET REACTIFS UTILISES 25
III.4. MODES OPERATOIRES DES ESSAIS DE LIXIVIATION EN TAS
26
III.4.1. TEST DE PERMEABILITE 26
III.4.2. TEST DE LIVIVIATION EN COLONNE SANS RECIRCULATION 27
III.4.3. TEST DE LIXIVIATION EN COLONNE AVEC RECIRCULATION 28
III.4.4. LAVAGE DU TAS 30
III.5. EVALUATION DE LA LIXIVIATION EN TAS 31
III.5.1. LE RENDEMENT DE SOLUBILISATION 31
III.5.2.. LA SOLUBILISATION 32
III.5.3. LA CONSOMMATION TOTALE D'ACIDE 32
CHAPITRE IV. RESULTATS ET DISCUSSION 34
IV.1. INTRODUCTION 34
IV.2. TESTS DE LIXIVIATION EN COLONNES 34
IV.2.1. ESSAIS DE LIXIVIATION AVEC VARIATION D'ACIDITE 34
IV.2.2. ESSAIS DE LIXIVIATION AVEC VARIATION DU DEBIT 44
CONCLUSION GENERALE 51
REFERERENCES BIBLIOGRAPHIQUES 53
? OUVRAGES 53
? ARTICLES 53
? THESES ET MEMOIRES 54
Page | VII
LISTE DES FIGURES
Figure 1: Différentes techniques industrielle
de lixiviation 5
Figure 2: Flow sheet général de la lixiviation
en tas 9
Figure 3: Technologies de valorisation du minerai en fonction
du minerai : oxydé et sulfuré .... 10
Figure 4: Diagramme d'équilibre tension - pH du
système Cu - H2O à 25°C 14
Figure 5: Diagramme d'équilibre tension - pH du
système Co - H2O à 25°C 16
Figure 6 : Diagramme d'équilibre tension - pH du
système Fe - H2O à 25°C 17
Figure 7: Petites colonnes de lixiviation avec leurs
systèmes 24
Figure 8: Schéma du test de perméabilité
26
Figure 9: Circuit de lixiviation en colonne avec recirculation
29
Figure 10: Evolution de la teneur du cuivre dans le PLS en
fonction du temps 36
Figure 11: Evolution de la teneur du cobalt dans le PLS en
fonction du temps 36
Figure 12: Evolution de la concentration du Cu et Co dans le
PLS en fonction du temps 38
Figure 13: Evolution de la concentration du Cu et Co dans le
PLS en fonction du temps 40
Figure 14: Evolution de la concentration du Cu et Co dans le
PLS en fonction du temps 42
Figure 15: Evolution du rendement de solubilisation du Cu et
Co en fonction du temps 43
Figure 16: Evolution de la concentration du Cu, Co et Fe dans
le PLS en fonction du temps 44
Figure 17: Evolution de la concentration du Cu, Co et Fe dans
le PLS en fonction du temps 45
Figure 18: Evolution de la concentration du Cu, Co et Fe dans
le PLS en fonction du temps 46
Figure 19: Evolution de la concentration du Cu, Co et Fe dans
le PLS en fonction du temps 47
Figure 20: Evolution de la concentration du Cu, Co et Fe dans
le PLS en fonction du temps 49
Figure 21: Evolution de la consommation d'acide en fonction du
débit d'arrosage 49
Page | VIII
LISTE DES TABLEAUX
Tableau 1: Composition chimique de l'échantillon de
rejets HMS 22
Tableau 2:Analyse granulométrique de
l'échantillon de rejets HMS 23
Tableau 3:Analyse granulochimique de l'échantillon de
rejets HMS 23
Tableau 4:Essais de perméabilité 27
Tableau 5:Cycle de lixiviation et condition de travail : cas
de la lixiviation sans recirculation 28
Tableau 6:Cycle de lixiviation et condition de travail :
Scénario 1 30
Tableau 7:Cycle de lixiviation et condition de travail :
Scénario 2 30
Tableau 8:Cycle de lavage après la lixiviation selon le
scénario 1 31
Tableau 9:Cycle de lavage après la lixiviation selon le
scénario 2 31
Tableau 10:Evolution de la concentration de cuivre dans le PLS
35
Tableau 11:Rendement sur solide de solubilisation de la
lixiviation en tas 36
Tableau 12:Evolution de la concentration de cuivre dans le PLS
37
Tableau 13:Rendement sur solide de solubilisation de la
lixiviation en tas 38
Tableau 14:Evolution de la concentration de cuivre dans le PLS
39
Tableau 15:Rendement sur solide de solubilisation de la
lixiviation en tas 40
Tableau 16:Evolution de la concentration de cuivre dans le PLS
41
Tableau 17:Rendement sur solide de solubilisation de la
lixiviation en tas 42
Tableau 18:Evolution de la concentration de cuivre dans le PLS
44
Tableau 19:Evolution de la concentration de cuivre dans le PLS
45
Tableau 20:Evolution de la concentration de cuivre dans le PLS
46
Tableau 21:Evolution de la concentration de cuivre dans le PLS
47
Tableau 22:Evolution de la concentration de cuivre dans le PLS
48
Page | IX
ABREVIATIONS
SOL : Solubilité
PLS : Pregnent Leach Solution
mL : Millilitre
K: Perméabilité
HMS: Heavy Medium Separation
GECAMINES : Générale des
Carrières et des Mines
EMT : Bureau d'Etudes Métallurgiques
de la Gécamines
E0 : Potentiel redox
DMS : Séparation en Milieux Dense
CAT : Consommation en Acide Totale
CAG : Consommation d'Acide par les
éléments de la Gangue
CAcu : Consommation d'Acide par le
Cuivre
CAco : Consommation d'Acide par le
Cobalt
C1 : Troisième Colonne
C1 : Quatrième Colonne
C1 : Première Colonne
C1 : Deuxième Colonne
# : Mesh
" : Pouce
Page | 1
PREMIERE PARTIE :
ETUDE BIBLIOGRAPHIQUE
Page | 2
INTRODUCTION GENERALE
Le concentrateur de Kambove produit les concentrés de
cuivre à partir des minerais tout venant qui subissent une adaptation de
la dimension par concassage pour la libération des minéraux
utiles, suivi d'une classification dimensionnelle pour l'orientation des
opérations de concentration. Les grains fins passent à la
concentration par spirale tandis que les grains grossiers passent à la
concentration en milieu dense. Le minerai est plongé dans un
mélange d'eau et des fines particules denses se comportant comme une
pseudo-solution appelée « milieu dense ». Les particules
légères surnagent alors que les particules lourdes plongent.
Cette séparation permet de produire une fraction
enrichie (concentré) et une fraction pauvre constituant le rejet. Ce
rejet faisant l'objet de notre étude titre environ 1.40 % de cuivre et
environ 0.174 % de cobalt.
Cette étude est faite afin d'analyser l'incidence du
débit d'arrosage de la solution lixiviante sur la consommation totale
d'acide. Par la même occasion nous verrons l'influence des
différents paramètres de lixiviation (débit d'arrosage,
d'acidité de la solution lixiviante et granulométrie) sur la
solubilisation de cuivre de ces rejets lors d'une lixiviation en tas.
Dans la finalité de notre travail, nous espérons
pouvoir aider la GECAMINES par son action de valorisation le rejet HMS de
Kambove par une lixiviation en tas, en lui permettant d'effectuer une
lixiviation d'une manière plus économiquement rentable.
Lors de notre travail, plusieurs essais seront
nécessaires pour déterminer le débit correspondant
à un rendement de lixiviation optimum avec une meilleure consommation en
acide.
Compte tenu du temps dont nous avons disposés, certains
paramètres n'intervenant pas directement dans notre travail seront
fixés selon notre lecture bibliographique.
- La première partie donne un aperçu de
l'étude bibliographique ou théorique sur la lixiviation en
général et la lixiviation en tas en particulier ;
Pour aborder cette étude, nous avons subdivisé le
présent travail en deux parties :
Page | 3
- La seconde partie présente les résultats
expérimentaux de la lixiviation en tas des rejets HMS de Kambove tout en
tenant comme des différents paramètres de lixiviation
(granulométrie des grains, acidité de la solution et débit
d'arrosage) mais aussi en étudiant l'influence du débit
d'arrosage sur la consommation totale en acide.
Nous finirons notre travail en donnant une conclusion
générale et des suggestions par rapport aux résultats
obtenus.
Page | 4
CHAPITRE I. GENERALITES SUR LA LIXIVIATION
I.1. DEFINITION DE LA LIXIVIATION
La lixiviation est une des opérations unitaires dans
les procédés hydrométallurgique qui consiste à
mettre en solution d'une manière sélective, sous forme ionique,
le ou les métaux recherchés d'un minerai ou d'un concentré
grâce à un solvant adéquat (acide ou basique ou encore
neutre). Le but est de déterminer le type de lixiviat optimal en termes
de consommation et de coût de réactif, de solubilisation minimale
d'impuretés et d'entretien du matériel (Roger R, 2006)
Le processus de lixiviation met en jeux une réaction
hétérogène du genre :
Solide1 + Liquide1 = Solide2 + Liquide2 [I.1]
Avec :
- Solide1 : le minerai ou concentré alimenté
- Liquide1 : le solvant utilisé pour la mise en solution
du métal a valorisé
- Solide2 : le résidu de lixiviation qui reste insolubles
après la mise en contact de Solide1 et
Liquide1.
- Liquide2 : la solution après lixiviation qui contient
les métaux dissout
I.2. TYPES DE LIXIVIATION
En fonction du métal à extraire et du solide
à traiter (impuretés présentes), différentes
solutions de lixiviation peuvent être employées ; les plus
courantes sont (Roger R, 2006) :
- l'eau ;
- les acides ;
- les bases ;
- des solutions oxydantes ;
- des solutions bactériennes.
Les produits devant être lixivier doivent répondre
à des critères tels que (Roger R, 2006) :
- une bonne solubilité pour le solvant choisi ;
- une moindre solubilité du matériau accompagnant
le métal utile ;
Page | 5
- un parfait contact par le degré de libération
et la granulométrie de la phase à lixivier avec le solvant.
Ainsi on distingue les types suivant de lixiviation :
- lixiviation acide
- lixiviation basique
- lixiviation bactérienne
- lixiviation ammoniacale
- lixiviation cyanurée
- lixiviation réductrice
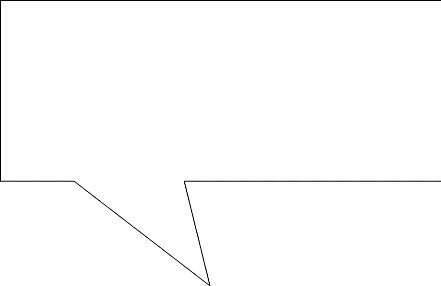
I.3. TECHNIQUE DE LIXIVIATION
Il existe plusieurs techniques de dissolution des
métaux de valeur à partir de leur minerai ; ces techniques
peuvent être regroupées en deux grandes classes à savoir :
la lixiviation par percolation et la lixiviation par agitation, chacune des
classes est subdivisée en plusieurs sous-classes telle que
représentée par la figure 1.
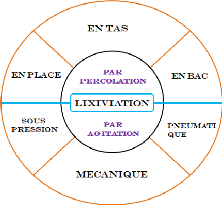
Figure 1: Différentes techniques industrielle de
lixiviation
(Source : Chiranjib K., 2003)
Page | 6
La mise en solution du métal nécessite la
réalisation du contact entre le composé contenant le métal
et le solvant idéalement choisi.
Ce contact doit être obtenu par une circulation
méthodique du solvant et peut être obtenu (Roger R, 2006):
1) Par percolation
Ce procédé est appliqué quand le minerai
selon, sa disposition, constitue un ensemble suffisamment et
uniformément poreux pour pouvoir être traversé d'une
manière permanente par la solution. La solution d'attaque passe à
travers la masse métallifère qui reste statique.
Le minerai est soit :
- en place ;
- disposé en tas ;
- broyé en disposé dans des tanks.
La percolation est généralement le mode de
lixiviation le plus économique.
2) Par agitation
Le minerai suffisamment broyé est mis en contact avec le
solvant dans des réacteurs où l'agitation peut être
uniquement pneumatique, on parlera de Pachuca mais si l'agitation est
mécano-pneumatique, on parlera alors d'agitateurs Dorr-0liver.
Ce type de lixiviation est appliqué sur des
concentrés ou minerai comportant une grande proportion de particules
fines qui rendraient la percolation difficile à réaliser.
I.3.1. LIXIVIATION PAR PERCOLATION
I.3.1.1. Lixiviation In Situ ou en place
Cette méthode, consistant en la lixiviation directe du
minerai en place, est utilisée lorsque la teneur en métal
à extraire est tellement faible qu'elle n'assure pas la
rentabilité des opérations de minage et de transport vers la
surface. Elle est aussi utilisée pour la lixiviation de l'uranium et du
cuivre [González M., (2000)].
Page | 7
I.3.1.2. Lixiviation en tas
Dans ce type d'opération, le matériel extrait de
la mine est disposé sur une surface préalablement nettoyée
et rendue imperméable, ayant une certaine pente pour permettre
l'écoulement de la solution riche vers l'extérieur du tas.
La solution de lixiviation est aspergée au-dessus du
tas et percole ensuite à travers ce dernier, tout en solubilisant le
métal de valeur. La solution riche est recueillie à
l'extrémité inférieure de la surface pour être
pompée aux bassins de récupération [Del Villar R.
(2006)].
La granulométrie du minerai varie de -1/4»
à -3/4», le choix de cette granulométrie dépend du
minerai lui-même et de sa réponse à la lixiviation.
Parmi les problèmes rencontrés lors d'une
opération de lixiviation en tas, on peut mentionner l'obstruction des
trous des tuyaux de collecte (avec de l'argile fine, des sulfates ou de
l'hydroxyde ferrique), les pertes par évaporation en surface du tas ou
par fissures dans la toile du fond et, finalement, la formation de chenaux
préférentiels qu'emprunte l'agent de lixiviation réduisant
ainsi son efficacité [Del Villar R. (2006)].
I.3.1.3. Lixiviation en cuve ou Vat Leaching
Le matériel à traiter est placé dans un
réservoir rectangulaire muni d'un faux plancher couvert d'une toile
poreuse [Del Villar R. (2006)].
Le minerai concassé (-3/4 »/+1/4») est
placé sur la base du réservoir et l'agent de lixiviation est
ensuite ajouté continuellement à la surface du minerai, pouvant
ainsi percoler à travers le lit et lixivier le métal
recherché ciblé. La condition indispensable pour assurer le
succès de ce type de lixiviation est une bonne percolation de l'agent de
lixiviation, ce qui est obtenu lorsque le minerai a une distribution
granulométrique étroite (idéalement une seule dimension de
particules).
La présence de particules fines et d'argile produit le
colmatage des espaces entre les particules et donc des canaux de
percolation.
Le temps nécessaire pour épuiser le minerai
contenu dans un tank varie entre 2 et 4 jours, le minerai est ensuite
retiré et remplacé par du minerai frais (Christian Al, 2006).
Page | 8
I.3.2. LIXIVIATION PAR AGITATION
Elle consiste à disperser le minerai finement
broyé dans de l'eau dans un réservoir muni d'un système
d'agitation. La pulpe ainsi produite contient entre 40 et 70% (poids) de
solides. L'agitation permet, principalement, d'éviter la
sédimentation des particules, mais elle favorise également la
cinétique lixiviation (étant donné que ces
réactions sont hétérogènes, le transfert de
matière, donc l'agitation, joue un rôle important) et la
dispersion des bulles de gaz (si des produits gazeux sont utilisés) [Del
Villar R. (2006)].
L'agitation peut être réalisée de trois
façons :
- agitation mécanique par le biais d'agitateurs ou de
turbines ;
- agitation par barbotage d'air comprimé (idéale
quand un apport d'air est nécessaire à la réaction) ;
- agitation mixte mécanique combinée à
l'insufflation d'air comprimé.
Page | 9
CHAPITRE
II. LA LIXIVIATION EN TAS
II.1. INTRODUCTION
Le processus de lixiviation en tas vise à dissoudre
chimiquement les métaux hors cours des mines, dans une solution
où les métaux sont récupérés par le biais de
plus de traitement chimique. L'agglomération peut être
appliqué sur le minerai concassé avant l'empilage afin
d'améliorer les caractéristiques de perméabilité de
minerai empilé et percolation subséquente de solution lixiviant
dans le tas.
Le flow sheet général de la lixiviation en tas est
donné par la figure suivante :
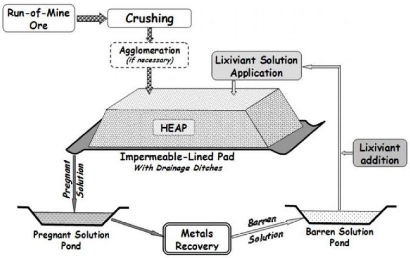
Figure 2: Le flow sheet général de la
lixiviation en tas
(Source : caner, 2012)
La lixiviation en tas des minerais est devenue un contributeur
majeur à l'extraction des métaux économiquement important,
notamment. La pointe dans la lixiviation en tas est revue en mettant l'accent
sur l'ingénierie des process. Le lessivage de la roche, y compris la
diffusion des pores de roche et minéraux cinétique,
écoulement de la solution et rétention dans des tas de minerai
au
Page | 10
cours de la percolation lessivage et bio-oxydation du minerai
sulfuré de son couvert. Le transport de l'oxygène dans le tas par
diffusion gazeuse, convection naturelle et ventilation forcée est
discuté.
Les stratégies d'optimisation de la lixiviation en tas
incluent concassage du minerai, l'agglomération de minerai, ventilation
d'air faible cout du tas de minerai de sulfure subissant à l'aide de la
bio-oxydation et l'utilisation des constantes de vitesse d'extraction. (Robert,
1997).
En considérant les types de minerai, d'une manière
générale la figure 3 montre différentes technologies de
valorisation du minerai applicables en fonction du minerai selon qu'il est
oxydé ou sulfuré.
Figure 3: Technologies de valorisation du minerai en fonction
du minerai : oxydé et sulfuré (Source : caner, 2012)
Elle consiste à :
? Déposer les minerais, préalablement
concassés et lavés (ou préalablement Agglomères),
sous forme de tas (heap) sur une surface inclinée et imperméable
;
? Asperger une solution lixiviante au-dessus du tas avec un
système d'arrosage, qui percole le heap par gravité, pour
être recueillie dans un bassin où est installé une pompe
qui entretient la recirculation continue du lixiviat jusqu'à
l'épuisement du tas en métaux utiles. [Alvayai, (2006)].
Page | 11
Voici les objectifs de la conception d'une configuration du pad
(bloc) en lixiviation en tas :
- Optimisation du site
- Fondation stable pour le tas
- Collecte du lixiviat
- Protection de l'environnement (sol et eau souterraine, la
qualité des eaux de surface)
II.2. MECANISMES DE PERCOLATION
II.2.1. INTRODUCTION
La percolation constitue le processus le plus présent
lors du contact entre le solvant et le rejet ou minerai afin de le
valoriser.
Les mécanismes hydrodynamiques et les processus
physiques sont (d'après Yeh et Tripathi, 1989, cités par Lanini,
1999) :
- la convection : est présente dans la porosité
percolant du minerai selon que les pores sont ouverts et connecté mais
aussi suivant que la perméabilité est suffisante.
- la diffusion : est le mécanisme de transport
principal dans la porosité intra-particules ou les pores semi-ouverts ou
mal connectés (dans les zones stagnantes).
La diffusion est également prépondérante
dans les zones stagnantes générées par un
écoulement non homogène dans la porosité percolant.
Selon Lanini (1999), cette classification est purement
théorique car la complexité des transferts en milieux poreux
naturels (hydrodynamiques, chimiques, biologiques et physiques) réside
dans le fait qu'ils sont fortement couplés et interdépendants.
Dans cette section, on s'attache à poser les bases mathématiques
de la description du transport de composés chimiques dans un flux de
solvant parcourant un milieu poreux.
II.2.2. NOTION DE TRANSPORT
Dans cette section, les équations de base pour traiter
les phénomènes de transport des solutés sont
rappelées. Tout d'abord, le flux F du solvant doit être
décrit. Il dépend de la conductivité hydraulique k du
milieu et du gradient hydraulique dh/dx (à une dimension, 1D), selon la
loi de Darcy qui peut s'exprimer sous la forme (Lassin A, 2002) :
- la variation de cette concentration due au mouvement convectif
de la solution (terme
) ;
Page | 12
F = -k h
Le "flux" F de Darcy (m/jour) correspond à une vitesse
moyenne globale du solvant dans le milieu. Le "flux" de Darcy est une vitesse
fictive. En réalité, l'eau évolue dans la porosité
avec une vitesse v supérieure à F.
Il s'agit également d'une vitesse moyenne, mais
ramenée à la porosité å du milieu, supposé
homogène :
v
Cette équation signifie que le chemin parcouru par le
solvant dans le milieu poreux est plus long que la simple ligne droite
considérée dans la loi de Darcy.
La conductivité hydraulique k dépend à la
fois d'une propriété intrinsèque du matériau,
appelée la perméabilité K, et de propriétés
caractérisant la solution, telles que la masse volumique ñ et la
viscosité cinématique õ (Lassin A, 2002):
L'équation générale à une dimension
de l'advection-dispersion-réaction, résultant de la conservation
de la masse d'une espèce chimique i transportée (i.e. soumise
à un flux convectif et dispersif), est :
DL )
Ci est la concentration de l'espèce i dans la solution,
t est le temps, v est la vitesse d'écoulement du solvant dans la
porosité définie par [II.1] et [II.2], x est la distance
parcourue, DL est le coefficient de dispersion hydrodynamique, qi correspond
à la concentration de l'espèce chimique i dans la phase solide et
disponible pour la solution (Lassin A, 2002).
L'équation [II.4] signifie que la variation de
concentration de l'espèce i au cours du temps ( )
est fournie par :
Page | 13
- la perturbation liée aux effets de diffusion et de
dispersion dans le milieu (terme DL ))
- la réactivité de l'espèce i
vis-à-vis du milieu (terme - ).
II.3. LES PARAMETRES INFLUENTS SUR LA LIXIVIATION EN
TAS
Le but d'une lixiviation est la solubilisation très
poussée de l'élément métal utile. Pour y parvenir,
plusieurs paramètres entrent en ligne de compte. Ces paramètres
sont classés suivant les avantages qu'ils donnent du point de vue
thermodynamique et cinétique.
II.3.1. PARAMETRES THERMODYNAMIQUE II.3.1.1.
Généralités
L'étude de l'aspect thermodynamique de lixiviation
s'avère importante car elle nous renseigne sur la stabilité ou
l'instabilité d'un composé chimique ; la possibilité ou
l'impossibilité d'une réaction chimique de se dérouler; le
sens dans lequel se déroule la réaction ainsi que le point
d'équilibre pour un système réactionnel donné
(Pourbaix, 1963).
Les conditions de mise en solution des espèces
métalliques (ion, oxyde, hydroxyde, métal, sulfure) sont
étudiées en fonction du pH et du potentiel
d'oxydoréduction de la solution grâce à un diagramme
appelé « diagramme de Pourbaix », spécifique pour
chaque métal.
II.3.1.2. Diagrammes de Pourbaix
Nous allons faire une approche thermodynamique à l'aide
des diagrammes de Pourbaix qui permettent de représenter dans un plan
tension-pH les domaines de prédominance des différentes
espèces d'un élément ; Cela pour faire une
prévision qualitative des réactions d'oxydoréduction dans
différents domaines de pH (Dulière, 2005).
Pour ce travail, nous allons nous intéresser aux
diagrammes de Pourbaix des systèmes Cu- H2O, Co-H2O et Fe- H2O à
25°C.
II.3.1.2.1. Diagramme d'équilibre tension - pH du
système Cu - H2O
Le diagramme donné à la figure 4 nous montre que
les ions Cu2+ sont stables en milieu acide et oxydant. L'oxyde ainsi
que les hydroxydes cuivrique peuvent être solubilisés en milieux
acide suivant les réactions de dissolutions chimiques [II.5] et [II.6].
:
Page | 14
- CuO + 2H+ = Cu2+ + H2O [II.5]
Avec log [Cu2+]= 7,89 - 2 pH [II.6]
- Cu(OH)2 + 2H+ = Cu2+ + 2H2O [II.7]
Avec log [Cu2+]= 7,89 - 2 pH [II.8]
On doit travailler à pH< 4,6 pour avoir les ions
Cu2+ afin d'éviter la précipitation de ces
derniers.
- Cu2O + 2H+? 2Cu2+ + H2O + 2e [II.9]
Avec E = 0,203 + 0,0591pH - log [Cu2+]
[II.10]
Cette réaction n'est possible qu'en présence d'un
oxydant, sinon on a la réaction :
- Cu2O+ 2H+? Cu2+ + Cu + H2O [II.11]
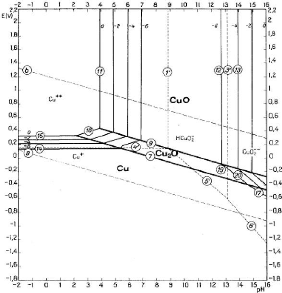
Figure 4: Diagramme d'équilibre tension - pH du
système Cu - H2O à 25°C
(Source : M Pourbaix,
1963)
Page | 15
2.1.1.1.1. Diagramme d'équilibre tension - pH du
système Co - H2O
Après observation et examen de la figure 5 qui suit, le
constat est que l'ion Coi+ne peut être présent que dans
des conditions très oxydantes et très acides. On procède
donc à la réduction du
+
Co en Col+partant du Co203 ; pour se
faire, il faut travailler en milieu acide avec usage d'un réducteur. La
réaction est la suivante:
- Co203 + 6H+ + 2e +
-* Co+ H [II.12]
Avec E0 = 1,746 - 0,1773 pH - 0,0591 1og[
Co3+] [II.13]
D'après la théorie, le Co2O3 ne peut
être stable à toute température et, d'après
Pourbaix, il peut être obtenu à l'état pur à partir
de l'hydroxyde de cobalt trivalent Co(OH) 3 qui lui est stable
à basse température. Bien que les propriétés
thermodynamiques de l'oxyde de cobalt trivalent hydraté soient peut
différentes de celles de Co2O3, leurs comportements
hydrométallurgique sont interprétées de la même
manière sur le diagramme.
Le CoO2 (oxyde de cobalt tétravalent) mentionné
dans le diagramme est instable dans la nature ; il se transforme en oxyde
trivalent.
On peut également obtenir l'ion cobalteux à partir
de la réaction [II.14]
- Co0 + 2H+-* Co' + H [II.14]
Page | 16
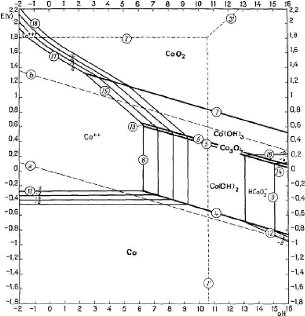
Figure 5: Diagramme d'équilibre tension - pH du
système Co - H2O à 25°C
(Source : M Pourbaix,
1963)
2.1.1.1.2. Diagramme d'équilibre tension - pH du
système Fe - H2O
Nous exploitons ce diagramme dans notre travail par ce que le
minéraux cuprifères sont toujours accompagnés du fer comme
impureté principale.
On constate sur la figure 6 que le fer sous forme
d'hématite est stable dans un domaine oxydant et moins acide. La
présence d'un réducteur en milieu acide favorise la formation de
l'ion ferreux suivant la réaction [II.16]:
- Fe203 + 6H+ + 2e - -* 2Fe2+ +
3H20 [II.15]
- Avec: E0 = 0,728 - 0,1773 pH - 0,0591 1og
[Fe3+] [II.16]
Le fer sous forme de Fe3O4 est stable à des pH
moins acide et à des potentiels plus oxydants que ceux de Fe2+
la réaction étant :
- Fe3O4 + 8H+ + 2e- ? 3Fe2+
+ 4H2O [II.17]
Il est à noter que la thermodynamique permet de
prédire si la lixiviation d'un métal donné est possible
dans une solution appropriée mais ne permet pas de dire à quelle
vitesse elle a lieu.
Page | 17
- Avec : E° = 0,980 - 0,2364 pH - 0,0886 log
(Fe2+) [II.18]
On peut aussi, par dissolution de , obtenir l'ion ferreux par la
réaction :
- --* [II.19]
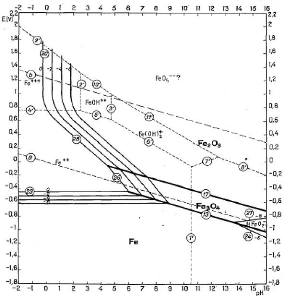
Figure 6 : Diagramme d'équilibre tension - pH du
système Fe - H2O à 25°C
(Source : M Pourbaix,
1963)
Il est donc à noter qu'il est conseillé de
travailler dans les conditions telles que les oxydes ne passent pas en
solution. Au cas où le fer passait en solution sous forme d'ions
ferreux, il faut l'oxydé en ions ferriques et porter le pH de la
solution entre 2 et 3 pour précipiter l'hydroxyde Fe(OH)3.
Mais cette précipitation de cet hydroxyde
Fe(OH)3, pour ce qui concerne la lixiviation en tas, elle peut
être à la base du blocage de la percolation de la solution.
II.3.2. PARAMETRES CINETIQUES
Page | 18
C'est plutôt la cinétique qui, grâce
à l'étude du processus de lixiviation et à la
détermination de la vitesse de l'étape la plus lente, permet de
dire si cette lixiviation vaut la peine d'être faite.
Ainsi, il existe un certain nombre des paramètres
caractérisant le minerai qui affectent la cinétique de la
lixiviation en tas. Ces paramètres se rapportent
généralement aux caractéristiques du minerai (dimensions
des particules, constitution chimique et minéralogique, etc.) ainsi
qu'aux caractéristiques de la solution lixiviante dans le tas
(débit d'arrosage, acidité, etc.).
Parmi les paramètres pris en compte lors de la lixiviation
en tas, nous citerons : II.3.3. Granulométrie et
porosité
La granulométrie du minerai est un facteur limitant la
cinétique de lixiviation, Par ailleurs, son influence diminue fortement
avec l'augmentation de l'acidité de la solution arrosée.
Le broyage du minerai va se traduire par une augmentation de
la surface de contact et générer un certain pourcentage de fines.
Dans certains cas, cela peut se traduire par une libération de phases
emprisonnées dans des structures protectrices.
Le minerai peut subir un prétraitement avant la
lixiviation :
1. Cure acide
Une solution de concentration raisonnable en acide sulfurique
est distribuée au travers du minerai ou utilisée pour
agglomérer le minerai. Celui-ci est étalé et gardée
ainsi pendant 4 à 7 jours. Ensuite une solution diluée d'acide
sulfurique (normalement du raffinat) est utilisée pour « rincer
» et lixivier. Appliquée pour les minerais oxydés.
2. Agglomération
Le minerai est concassé et puis mélangé,
soit dans un tambour tournant soit sur un système de bandes
transporteuses, avec une solution aqueuse à degré
d'humidité qui donne de petits agglomérés de petites
particules avec les grosses. Le degré d'humidité dépend du
minerai. La solution aqueuse peut être du raffinat ou un acide plus
concentré avec ou sans fer. La solution aqueuse peut aussi contenir des
bactéries.
[II.20]
Page | 19
Une forte porosité va augmenter la vitesse de transport
de la solution lixiviante à travers le matériau donc influe
positivement sur la vitesse de transport des espèces, et le début
du contact solide/liquide se traduira inévitablement par un nettoyage de
la surface (cognis, 2006).
II.3.3.2. Le débit d'arrosage
Le débit d'arrosage du tas est un paramètre
important dont dépend la conduite des opérations de lixiviation.
Un débit d'irrigation élevé fait migrer les particules
fines dans les parties inferieures du tas, ce qui cause une diminution de la
perméabilité du tas en créant des étangs de la
solution à la surface du tas. Si la vitesse de percolation est
inférieure à la vitesse d'arrosage, il se produit une
érosion du tas. Cela peut-être dû au bouchage des
tourniquets suite à la précipitation de sels ou à la
rupture de tête d'arrosage. Ceci conduit à l'apparition des zones
sèches et éventuellement des étangs de solution sur le tas
(Smith, 2008).
II.3.3.3. La perméabilité du
tas
La perméabilité est une caractéristique
physique qui représente la facilité qu'a un matériau
à permettre le transfert de fluide au travers d'un réseau
connecté. En considérant la lixiviation d'une masse des
particules, ce domaine peut être considéré comme
compressible et la valeur de la perméabilité peut varier en
fonction du changement du volume du vide dans le milieu.
Ce changement de volume de vide est le résultat du
tassement local du tas généralement fonction de la méthode
de constitution du tas.
Une perméabilité critique entraine un taux de
récupération des métaux ciblés faible dans le tas
car si le matériau mis en tas est trop compact, le temps
d'opération de lixiviation augmente au fur et à mesure que le
réactif lixiviant percole lentement à travers le tas. Par
ailleurs, si la perméabilité dans le tas est inégale, la
solution de lixiviation pourrait suivre des chemins de canalisation
préférentiels, laissant d'autres zones du tas non
traitées. (Thiel et al. 2009).
La perméabilité du tas est influencée
également par le taux d'irrigation du tas. La loi de Darcy permet de
décrire l'écoulement stationnaire d'un fluide incompressible
caractérisé par une viscosité dynamique et une masse
volumique au travers d'un milieu poreux.
La perméabilité peut-être calculé par
la relation suivante :
Page | 20
Avec :
Q [l/h] : Débit d'eau à la sortie de la colonne
S [m2] : Section intérieure de la colonne
T[h] : Temps de percer de l'eau au travers du tas
H[m]: Hauteur du tas
II.3.3.4. L'acidité
L'acidité étant liée directement au pH,
est un facteur à ajuster chaque fois pendant la lixiviation en tas car
elle varie au fur et à mesure que le processus évolue. Le pH doit
être fixé en tenant compte de l'élément
indésirable contenu dans la gangue dont la dissolution est à
éviter.
On ne doit donc pas avoir une solution très acide ni
moins acide (presque neutre) pour éviter la précipitation des
cations métalliques qui n'existent qu'en solution acide (Laffitte,
1991).
II.3.3.5. Le temps de contact
Le temps de contact a une influence sensible sur la
solubilisation du minerai ou du concentré ; il doit satisfaire le
rendement de récupération des métaux valorisables. Il ne
faudra pas non plus aller au-delà du temps nécessaire à la
réaction ; il risque de se livrer à des opérations trop
onéreuses. Donc le temps de contact minerai solvant résulte de la
dissolution maximale des éléments désirés et d'une
dissolution possible des impuretés.
Page | 21
DEUXIEME PARTIE :
ETUDE EXPERIMENTALE
Page | 22
CHAPITRE III. MATERIELS ET METHODES
III.1. CARACTERISATION DE L'ECHANTILLON DU
MINERAI
III.1.1. ORIGINE DE L'ECHANTILLON
L'échantillon de rejets étudié a
été prélevé par le service d'échantillonnage
du Département d'études Métallurgiques de la
Gécamines sur le site du concentrateur de HMS à Kambove. A notre
tour, nous avons eu à prélever 120kg d'échantillon dans le
dépôt d'échantillonnage ou ils ont été
entreposés.
III.1.2. PREPARATION DE L'ECHANTILLON
L'échantillon séché à
l'étuve a été homogénéisé dans le but
d'obtenir une composition chimique quasi uniforme afin d'avoir un
échantillon représentatif pour l'analyse chimique et les essais
de lixiviation.
III.1.3. ANALYSE CHIMIQUE DE L'ECHANTILLON
Les résultats de l'analyse chimique de
l'échantillon de rejets HMS sont présentés dans le tableau
1 ci-après.
Tableau 1: Composition chimique de l'échantillon de
rejets HMS
Elément ou composé Cu Co Fe Mn Ni
Zn
% 1.40 0.174 1.98 0.080 21.02 57.39
Cette analyse a été faite au spectromètre
à absorption atomique mais également à l'aide d'un
appareil infrarouge (le Niton).
III.1.4. ANALYSE GRANULOMETRIQUE DE L'ECHANTILLON
Les résultats de l'analyse granulométrique
effectuée sur un échantillon de 3.09 kg de rejets HMS sont
présentés dans le tableau 2 ci-après.
Page | 23
Tableau 2:Analyse granulométrique de
l'échantillon de rejets HMS
|
Tamis
|
Poids
|
|
Refus
|
Passant
|
|
g
|
%
|
|
|
+3/4"
|
615.32
|
19.88
|
19.88
|
80.11562487
|
|
+1/2"
|
986.62
|
31.88
|
51.77
|
48.23
|
|
+1/4"
|
896.01
|
28.96
|
80.72
|
19.28
|
|
+4#
|
355.3
|
11.48
|
92.20
|
7.80
|
|
+6#
|
59.94
|
1.94
|
94.14
|
5.86
|
|
+8#
|
69.65
|
2.25
|
96.39
|
3.61
|
|
+10#
|
34.76
|
1.12
|
97.52
|
2.484739004
|
|
-10#
|
76.89
|
2.48
|
100.00
|
0
|
|
Total
|
3094.49
|
100.00
|
|
|
L'analyse granulométrique effectuée sur
l'échantillon prélevé nous montre que 32% environ de la
matière a une dimension supérieur à 1/2». La
constitution du tas avec l'ensemble des tranches ne devrait pas poser de
problème de perméabilité du lit.
III.1.5. ANALYSE GRANULOCHIMIQUE
Cette analyse nous renseigne sur la teneur et la
répartition du cuivre et du cobalt dans différentes tranches
granulométriques. Le tableau 3 donne l'analyse granulochimique de notre
échantillon.
Tableau 3:Analyse granulochimique de l'échantillon
de rejets HMS
|
Tamis
|
poids
|
|
Refus
|
Passant
|
Cu
|
Co
|
|
g
|
%
|
|
+3/4"
|
615.32
|
19.88
|
19.88
|
80.11
|
0.48
|
0.08
|
|
+1/2"
|
986.62
|
31.88
|
51.77
|
48.23
|
1.31
|
0.15
|
|
+1/4"
|
896.01
|
28.96
|
80.72
|
19.28
|
0.82
|
0.12
|
|
+4#
|
355.3
|
11.48
|
92.20
|
7.80
|
0.84
|
0.14
|
|
+6#
|
59.94
|
1.94
|
94.14
|
5.86
|
0.91
|
0.14
|
|
+8#
|
69.65
|
2.25
|
96.39
|
3.61
|
0.99
|
0.14
|
|
+10#
|
34.76
|
1.12
|
97.52
|
2.48
|
1.14
|
0.16
|
|
-10#
|
76.89
|
2.48
|
100.00
|
0
|
2.17
|
0.20
|
|
Total
|
3094.49
|
100.00
|
|
|
|
|
Page | 24
III.2. ESSAIS DE LIXIVIATION EN COLONNE
Les lixiviations ont été effectuées dans
des colonnes en PVC de 9.5 cm de diamètre et 110.7 cm de hauteur. Des
masses de l'ordre de 9 à 10 kg ont été lixiviées.
Différents paramètres opératoires ont été
testés : granulométrie fixe, concentration d'acide sulfurique
(10, 25, 50 et 75 g/L), débit d'arrosage (10, 25, 50,75 et 100
L/hm2).
La solution de lixiviation est arrosée à l'aide
d'un système de goutte à goutte grâce à des
flexibles perforées et des vannes qui permettent un réglage du
débit comme la figure 7 le montre. Les solutions de percolation sont
collectées après chaque 6 heures, leurs volumes sont
mesurés puis on prélève un échantillon qui est
envoyé aux analyses chimiques (Cu, Co et Fe total) qui sont
effectuées à l'aide d'une spectroscopie d'absorption atomique.
Une fois l'essai achevé, la colonne est rincée
à un débit équivalent à celui de lixiviation
pendant environ 2 jours avec de l'eau de robinet. Le résidu ensuite est
séché, pesé et, finalement, analysé chimiquement
(Cu, Co et Fe total) par un analyseur thermique des métaux (niton
XRF).

Figure 7: Petites colonnes de lixiviation avec leurs
systèmes
Page | 25
III.3. MATERIELS ET REACTIFS UTILISES
Voici différents matériels que nous avons eu a
utilisés pour effectuer nos essais de lixiviation en tas :
? Comme appareillage :
- Une étuve;
- Une balance analytique;
- Un pH-mètre;
- Un chronomètre;
- Un rota mètre;
? Comme accessoires :
- Colonnes en pvc
- Flexibles
- Entonnoirs
- Bidons de 20 litres
- Eprouvettes de 1000 et 500 ml
- Spirales en flexibles perforer
- Pans
- Tamis
- Pissettes ;
- Spatule ;
- Filtre ;
- Sachets ;
- Flacons ;
? Réactifs
Nos tests de lixiviation en tas ont été
effectués à l'aide des réactifs suivant :
- l'acide sulfurique dont les caractéristiques sont
? pureté : 95% ? densité : 1.84
- l'eau
Page | 26
III.4. MODES OPERATOIRES DES ESSAIS DE LIXIVIATION EN
TAS
Les essais de lixiviation en tas en milieu acide ont
été effectué avec et sans recirculation du percolât
à l'aide d'une solution d'eau acidulée a différente
concentration (10, 25,50 et 75) en acide sulfurique et en variant le
débit d'arrosage selon le cas.
III.4.1. TEST DE PERMEABILITE III.4.1.1. But
Nous avons dit ci-haut que la perméabilité est une
caractéristique physique qui représente la facilité qu'a
un matériau à permettre le transfert de fluide au travers d'un
tas.
III.4.1.2. Mode opératoire
Ainsi dans le cadre de nos essais, voici la procédure
suivie et aussi la perméabilité de chaque tas :
- Mettre 10 litres d'eau dans un bidon de 20 litres
- Le placer en haut de la colonne
- Alimenter 10kg de minerai pour la prise d'essai
- Placer au bas de la colonne un récipient pour la
collecte du percolât
- Fixer la spirale d'alimentation au débit fixé
- Alimenter ainsi l'eau dans la colonne
- Observer le processus de percolation jusqu'à
l'apparition de la première gouttes
d'eau au bas de la colonne
- Arrêter d'alimenter l'eau
La figure suivante illustre le montage expérimental du
test de perméabilité.
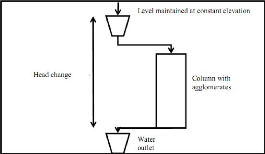
Figure 8: Schéma du test de
perméabilité
Source : (Alan E, 2008)
Page | 27
L'échantillon initial a une répartition
granulométrique constituée de plusieurs tranches
granulométrique dans les proportions telles que montre le tableau 2.
Apres l'essai de perméabilité voici le
résultat obtenu pour différentes colonnes :
Tableau 4:Essais de perméabilité
|
Colonne 1
|
Colonne 2
|
Colonne 3
|
Colonne 4
|
|
Temps de percer
|
55
|
45
|
35
|
20
|
|
Diamètre intérieur
|
9.5
|
9.5
|
9.5
|
9.5
|
|
Hauteur du tas
|
95.2
|
92.7
|
91.2
|
100.2
|
|
Debit sortie
|
-
|
-
|
-
|
-
|
Avec ces données nous sommes en mesure de calculer la
perméabilité selon la relation [II.22]. III.4.2. TEST DE
LIVIVIATION EN COLONNE SANS RECIRCULATION
III.4.2.1. But
Ce test nous a permis de voir la cinétique de la
lixiviation mais aussi optimiser les différents paramètres de
lixiviation tel que l'acidité, le temps de contact... cet essai
s'effectue à débit constant avec variation de l'acidité
dans quatre colonnes.
III.4.2.2. Mode opératoire
La procédure expérimentale des essais de
lixiviation en colonne sans recirculation comprend les étapes
successives ci-dessous :
- Placer 10 kilos de l'échantillon dans la colonne
- Préparer 20 litres de la solution d'acide d'attaque par
colonne à une concentration fixée par les conditions de travail
comme le tableau suivant le montre;
- Alimenter la solution d'attaque dans un bidon 20 litres sur
lequel sont fixés des flexible servant de conduite de la solution ;
- Fixer des flexibles en spirale perforé (asperseurs
d'alimentation) qui permettent l'écoulement de la solution sur le tas
;
- Recueillir le percolât au fond du tas à l'aide des
collecteurs puis l'évacuer ;
Ce test de recirculation ne fournit pas seulement l'avantage
d'épuiser le métal utile retenu dans le tas mais aussi les
avantages économique (consommation d'acide).
Page | 28
- Lancer le test de lixiviation en ouvrant la vanne
d'alimentation de la solution lixiviante, qui descend par gravité. On
veillera à garder le niveau de la solution lixiviante dans le
réservoir (bidon) constant pour éviter des variations du
débit ;
- Prélever le volume du percolât après
chaque six heures et prélever un échantillon
pour les analyses chimique au spectromètre à
absorption atomique.
- Arrêter le test de lixiviation après 72 heures.
Le tableau 5 reprend les conditions de travail ainsi que le cycle
de lixiviation.
Tableau 5:Cycle de lixiviation et condition de travail :
cas de la lixiviation sans recirculation
|
Conditions de travail
|
Colonne 1
|
Colonne 2
|
Colonne 3
|
Colonne 4
|
|
Temps de cycle (Jours)
|
3
|
3
|
3
|
3
|
|
Débit d'arrosage (mL/sec
m2)
|
25
|
25
|
25
|
25
|
|
[H2SO4] (g/L)
|
10
|
25
|
50
|
75
|
|
Direction décharge
|
Bassin PLS
C1
|
Bassin PLS
|
Bassin PLS
C3
|
Bassin PLS
C4
|
III.4.3. TEST DE LIXIVIATION EN COLONNE AVEC
RECIRCULATION III.4.3.1. But
Ces essais ont été réalisés en deux
scénarios :
? Scénario 1 : Dans le cadre d'une lixiviation avec
variation l'acidité comme le cas précèdent mais cette fois
la lixiviation se fait avec une recirculation du percolât.
? Scénario 2 : Dans ce scenario les essais de
lixiviation avec recirculation ont été réalisés
à débit d'arrosage variable (15, 20, 25, 30,35) mais avec une
acidité constante comme le démontre les conditions de travail au
tableau 7.
Ainsi les quatre débits d'arrosage des solutions
lixiviante de notre deuxième scénario ont été
choisis d'après les résultats obtenus lors des tests en colonnes
sans recirculation.
Page | 29
III.4.3.2. Mode opératoire
Ce test de lixiviation avec recirculation reprend toutes les
étapes du mode opératoire précèdent sauf que la
lixiviation avec recirculation permet de ramener le percolât en
tête du circuit. On effectue un réajustée du pH de notre
percolât avant d'effectuer la recirculation.
Le réajustage s'effectue comme suit :
- Homogénéisation du percolât global de la
colonne
- Prélèvement d'un échantillon de la
solution pour les analyses
- Ajustage avec l'acide sulfurique concentré de
l'acidité de la solution de lixiviation
selon chacune des concentrations de travail.
- Recirculation de la solution
Le percolât est récirculé dans le tas de
sorte à concentrer encore plus le cuivre (Cu2+) et le cobalt
(Co2+)dans la solution de lixiviation.
Le schéma ici-bas illustre le test de lixiviation en
colonne avec recirculation, dans le cadre de notre travail la recirculation
s'effectuer manuellement en lieu et place d'une pompe péristaltique
comme sur la figure 9.
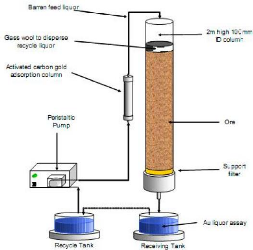
Figure 9. Circuit de lixiviation en colonne avec
recirculation
(Source. Alan E, 2008)
Page | 30
Les conditions de travail pour ces deux scénarios se
présentent comme suit : Tableau 6:Cycle de lixiviation et condition
de travail : Scénario 1
|
Conditions de travail
|
Colonne 1
|
Colonne 2
|
Colonne 3
|
Colonne 4
|
|
Temps de cycle (Jours)
|
3
|
3
|
3
|
3
|
|
Débit d'arrosage (mL/sec
m2)
|
25
|
25
|
25
|
25
|
|
[H2SO4] (g/L)
|
75
|
50
|
25
|
10
|
|
Direction décharge
|
Bassin PLS
C1
|
Bassin PLS
|
Bassin PLS
C3
|
Bassin PLS
C4
|
Tableau 7:Cycle de lixiviation et condition de travail :
Scénario 2
|
Conditions de travail
|
Colonne 1
|
Colonne 2
|
Colonne 3
|
Colonne 4
|
|
Temps de cycle (Jours)
|
3
|
3
|
3
|
3
|
|
Débit d'arrosage (mL/sec
m2)
|
15
|
20
|
30
|
35
|
|
[H2SO4] (g/L)
|
75
|
75
|
75
|
75
|
|
Direction décharge
|
Bassin PLS
C1
|
Bassin PLS
|
Bassin PLS
C3
|
Bassin PLS
C4
|
III.4.4. LAVAGE DU TAS
Apres que le cycle de lixiviation soit fini, une partie du PLS
reste retenue dans le tas causant ainsi une perte de la solution lixiviante et
du métal à récupérer.
En vue de récupérer cette partie du PLS retenus
dans le tas, on procède par un cycle de lavage dans les conditions
opératoires suivant, comme le montre les tableaux 8 et 9 (Copper cobalt,
357) :
Ou encore 1 )
? .
Cx
Li=1 P
x [III.2]
Page | 31
Tableau 8:Cycle de lavage après la lixiviation selon
le scénario 1
|
Colonne 1
|
Colonne 2
|
Colonne 3
|
Colonne 4
|
|
Temps de cycle (Jours)
|
2
|
2
|
2
|
2
|
|
Débit d'arrosage (mL/sec
m2)
|
25
|
25
|
25
|
25
|
|
Direction décharge
|
Bassin H2O
C1
|
Bassin H2O
|
Bassin H2O
C3
|
Bassin H2O
C4
|
Tableau 9:Cycle de lavage après la lixiviation selon
le scénario 2
|
Colonne 1
|
Colonne 2
|
Colonne 3
|
Colonne 4
|
|
Temps de cycle (Jours)
|
2
|
2
|
2
|
2
|
|
Débit d'arrosage (mL/sec
m2)
|
25
|
25
|
25
|
25
|
|
Direction décharge
|
Bassin H2O
C1
|
Bassin H2O
|
Bassin H2O
C3
|
Bassin H2O
C4
|
III.5. EVALUATION DE LA LIXIVIATION EN TAS
Une opération de lixiviation est
caractérisée par certains indicatifs qui jugent de son
efficacité. C'est notamment le rendement de lixiviation, la consommation
d'acide, la solubilisation, ... que nous présentons dans les paragraphes
qui suivants :
III.5.1. LE RENDEMENT DE SOLUBILISATION
Le rendement de lixiviation est le rapport exprimé en
pourcentage entre poids en gramme du concentré à lixivier et
poids en gramme du résidu de lixiviation selon la teneur du métal
à lixivier à l'alimentation ainsi que le résidu de
lixiviation, il s'exprime par la relation [III.1] :
) ( - ) X [III.1]
Page | 32
Avec :
- P1 : poids du minerai alimenté
- P2 : poids du résidu de lixiviation
- T1 : teneur de l'élément dans le minerai
alimenté
- T2 : teneur de l'élément dans le résidu de
lixiviation - Cm : concentration du métal dans le percolât
- V : volume du percolât recueilli
- P : poids du métal dans le minerai
III.5.2.. LA SOLUBILISATION
La solubilisation d'un minerai contenant un ou plusieurs
métaux est le rapport entre le poids du métal mis en solution et
son poids exprimé en kg par tonne de minerai lixivié, elle
s'exprime par la relation [3.3] :
SOL [kg/t] = [III.3]
III.5.3. LA CONSOMMATION TOTALE D'ACIDE
C'est la quantité d'acide consommée en
kilogramme rapportée à la tonne de minerai, elle s'exprime par la
relation [III.4] :
/ )
[III.4]
Avec :
- Ca : concentration de la solution d'attaque en g/l -
Cf : l'acidité du filtrat en g/l
- V1 : volume de la solution d'attaque en litre
- V2 : volume du filtrat en litre
Page | 33
Consommation spécifique d'acide par le métal
exprime la quantité d'acide consommée par le métal
à valoriser, contenu dans une tonne de minerai ou de concentré
lors de l'opération de lixiviation.
Par ailleurs, les expressions [3.5] et [3.6] donnent la
consommation d'acide par le cuivre et le cobalt en kg/tonne de minerai :
CACu = [solubilisation Cu X 1,54] [III.5]
CACo = [solubilisation Co X 1,66] [III.6]
Où 1,54 et 1,66 sont les équivalent acide du cuivre
et du cobalt. La Consommation d'acide par la gangue (en kg/tonne de minerai)
est donnée par la relation [3.7] :
CAG = CTA - (CACo + CACu) [III.7]
Page | 34
CHAPITRE IV. RESULTATS ET DISCUSSION
IV.1. INTRODUCTION
Des essais de percolation en colonnes en PVC de 9.5 cm de
diamètre et 110.7 cm de hauteur ont été
réalisés dans le but de déterminer l'incidence du
débit d'arrosage de la solution en lixiviation en tas du rejet HMS
Kambove sur la consommation totale d'acide sulfurique. Pour y parvenir, on
commence par définir les paramètres cinétiques de
lixiviation (les courbes cinétique) avant d'étudier l'influence
du débit sur la consommation d'acide sulfurique, qui est l'un des
principaux réactifs utilisés en lixiviation en tas.
Pour y arriver on a fait subir sur notre minerai une
série de test de lixiviation en variant différents
paramètres : la concentration d'acide au départ puis celle du
débit d'arrosage par la suite.
IV.2. TESTS DE LIXIVIATION EN COLONNES
IV.2.1. ESSAIS DE LIXIVIATION AVEC VARIATION D'ACIDITE
Les conditions opératoires sont données dans le
chapitre précèdent et voici dans les tableaux et figures qui
suivent au point IV.2.1.2 les résultats obtenus à l'issu de nos
essais.
IV.2.1.1. Objectifs :
Le but de ces essais était de voir :
- l'évolution du rendement de
récupération du cuivre et du cobalt en fonction des
différentes concentrations d'acide et aussi apprécier la vitesse
de dissolution du cuivre et du cobalt selon leur concentration en acide. Ceci
nous permet de déterminer le rendement de récupération
maximum de cuivre et de cobalt que nous pouvons avoir lors les essais. Nous
avons réalisés 4 essais à différentes
concentrations d'acide : 10g/l ; 25g/l ; 50g/l et 75g/L.
- Dans le souci d'avoir une solution imprégnante
suffisamment riche en cuivre, nous avons effectué 4 essais avec
recirculation du percolât, après un cycle de 72 heures où
nous avons gardé tous les paramètres à leur valeur
optimale.
Page | 35
IV.2.1.2. Résultats obtenus
Ces tableaux et figures ci-après présentent
l'évolution de la concentration du cuivre et du cobalt dans le PLS, ce
qui renseigne sur la cinétique de solubilisation, l'épuisement
(recirculation) du tas et l'évolution du rendement de solubilisation en
fonction du temps.
Essai 1 : Résultats de la lixiviation dans la
colonne 1
Tableau 10:Evolution de la concentration de cuivre dans le
PLS
|
Temps (heure)
|
Cu
|
Co
|
Fe
|
|
(g/l)
|
(g/l)
|
(g/l)
|
|
6
|
0,230
|
0,050
|
0,080
|
|
12
|
9,660
|
0,200
|
4,200
|
|
18
|
8,630
|
0,360
|
4,600
|
|
24
|
6,400
|
0,310
|
3,400
|
|
30
|
4,330
|
0,200
|
2,300
|
|
36
|
2,790
|
0,110
|
0,200
|
|
42
|
2,860
|
0,230
|
0,300
|
|
48
|
2,170
|
0,190
|
0,250
|
|
54
|
2,080
|
0,300
|
0,370
|
|
60
|
1,840
|
0,270
|
0,470
|
|
66
|
1,680
|
0,090
|
0,150
|
|
72
|
1,540
|
0,100
|
0,180
|
|
78
|
1,490
|
0,250
|
0,360
|
|
84
|
1,350
|
0,130
|
0,250
|
|
90
|
1,040
|
0,100
|
0,210
|
|
96
|
0,730
|
0,090
|
0,170
|
|
102
|
0,610
|
0,040
|
0,100
|
|
108
|
0,630
|
0,110
|
0,200
|
|
114
|
0,400
|
0,040
|
0,090
|
|
120
|
0,420
|
0,070
|
0,140
|
|
126
|
0,280
|
0,040
|
0,080
|
|
132
|
0,260
|
0,030
|
0,100
|
|
138
|
0,250
|
0,030
|
0,090
|
|
144
|
0,210
|
0,030
|
0,080
|
Page | 36
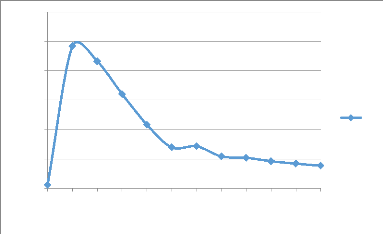
Teneur Cu dans le PLS en g/l
12
10
4
8
0
6
2
6 12 18 24 30 36 42 48 54 60 66 72 Temps de percolation,
Heures
Cu
Figure 10: Evolution de la teneur du cuivre dans le PLS en
fonction du temps
|
|
|
|
|
|
|
Teneur Co dans le PLS en g/l
|
1.500 1.200 0.900 0.600
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Co
|
|
|
|
|
0.300
0.000
|
|
|
|
6 12 18 24 30 36 42 48 54 60 66 72 Temps de percolation,
Heures
|
|
Figure 11: Evolution de la teneur du cobalt dans le PLS en
fonction du temps
Tableau 11:Rendement sur solide de solubilisation de la
lixiviation en tas
|
Désignation
|
% Cu
|
% Co
|
|
Alimentation
|
1.40
|
0.174
|
|
Résidu
|
0,44
|
0,085
|
|
Rendement(%)
|
75,8
|
57.74
|
Page | 37
Essai 2 : Résultats de la lixiviation dans la
colonne 2
Tableau 12:Evolution de la concentration de cuivre dans le
PLS
|
Temps (heure)
|
Cu
|
Co
|
Fe
|
|
(g/l)
|
(g/l)
|
(g/l)
|
|
6
|
4,22
|
0,15
|
0,38
|
|
12
|
3,01
|
0,35
|
0,66
|
|
18
|
2,55
|
0,12
|
0,23
|
|
24
|
2,16
|
0,35
|
0,72
|
|
30
|
2,12
|
0,29
|
0,57
|
|
36
|
2,01
|
0,21
|
0,44
|
|
42
|
1,92
|
0,21
|
0,41
|
|
48
|
1,92
|
0,21
|
0,41
|
|
54
|
1,92
|
0,23
|
0,57
|
|
60
|
1,91
|
0,18
|
0,66
|
|
66
|
1,9
|
0,3
|
0,09
|
|
72
|
1,89
|
0,19
|
0,45
|
|
78
|
1,89
|
0,19
|
0,45
|
|
84
|
1,88
|
0,11
|
0,96
|
|
90
|
1,84
|
0,23
|
0,96
|
|
96
|
1,74
|
0,32
|
0,73
|
|
102
|
1,74
|
0,32
|
0,73
|
|
108
|
1,65
|
0,07
|
0,16
|
|
114
|
1,11
|
0,02
|
0,58
|
|
120
|
1,02
|
0,04
|
0,17
|
|
126
|
0,77
|
0,06
|
0,12
|
|
132
|
0,66
|
0,08
|
0,21
|
|
138
|
0,61
|
0,1
|
0,22
|
|
144
|
0,59
|
0,1
|
0,2
|
Page | 38
Tableau 13:Rendement sur solide de solubilisation de la
lixiviation en tas
|
Désignation
|
% Cu
|
% Co
|
|
Alimentation
|
1.40
|
0.174
|
|
Résidu
|
0,52
|
0,089
|
|
Rendement(%)
|
61,4
|
52,06
|
6 12 18 24 30 36 42 48 54 60 66 72 78 84 90 96 102 108 114 120
126 132 138 144
Temps (h)
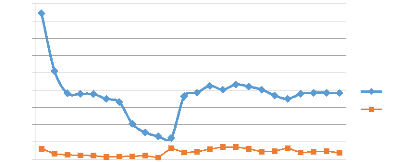
Concentration g/L
4.5
0.5
3.5
2.5
1.5
4
0
3
2
1
Cu Co
Figure 12: Evolution de la concentration du Cu et Co dans
le PLS en fonction du temps
Observation
L'allure de la solubilisation du cuivre est
décroissante les 72 premières heures puis crois
légèrement avec l'effet de la recirculation du percolât
après 72h de lixiviation. La solubilisation du cobalt quant à
elle, reste presque invariable dans le premier cycle et la recirculation
influence très peu sur sa mise en solution.
Page | 39
Essai 3 : Résultats de la lixiviation dans la
colonne 3
Tableau 14:Evolution de la concentration de cuivre dans le
PLS
|
Temps (heure)
|
Cu
|
Co
|
Fe
|
|
(g/l)
|
(g/l)
|
(g/l)
|
|
6
|
6,02
|
0,12
|
0,39
|
|
12
|
5,41
|
0,16
|
0,82
|
|
18
|
4,33
|
0,14
|
0,83
|
|
24
|
2,14
|
0,12
|
0,41
|
|
30
|
1,64
|
0,06
|
0,26
|
|
36
|
0,99
|
0,04
|
0,34
|
|
42
|
0,93
|
0,05
|
0,16
|
|
48
|
0,97
|
0,04
|
0,31
|
|
54
|
0,91
|
0,07
|
0,15
|
|
60
|
0,66
|
0,06
|
0,14
|
|
66
|
1,92
|
0,17
|
0,41
|
|
72
|
2,04
|
0,17
|
0,4
|
|
78
|
2,03
|
0,18
|
0,38
|
|
84
|
2,14
|
0,21
|
0,44
|
|
90
|
2,21
|
0,24
|
0,48
|
|
96
|
2,34
|
0,28
|
0,55
|
|
102
|
2,10
|
0,31
|
0,77
|
|
108
|
2,22
|
0,26
|
0,51
|
|
114
|
2,07
|
0,24
|
0,41
|
|
120
|
1,92
|
0,17
|
0,41
|
|
126
|
2,04
|
0,17
|
0,4
|
|
132
|
2,03
|
0,18
|
0,38
|
|
138
|
2,14
|
0,21
|
0,44
|
|
144
|
2,21
|
0,24
|
0,48
|
Quant au cobalt, sa solubilisation est faible comme la figure
le montre. Apres recirculation nous constatons une légère
remontée de la concentration en cobalt.
Page | 40
Tableau 15:Rendement sur solide de solubilisation de la
lixiviation en tas
|
Désignation
|
% Cu
|
% Co
|
|
Alimentation
|
1.40
|
0.174
|
|
Résidu
|
0,59
|
0,083
|
|
Rendement(%)
|
65,2
|
52,77
|
|
Cu Co
|
7
6
5
4
3
2
Concentration g/L
1
0
6 12 18 24 30 36 42 54 60 72 80 89 98 107116125134143152
Temps(h)
Figure 13: Evolution de la concentration du Cu et Co dans
le PLS en fonction du temps
Observation
Nous avons observé que la solubilisation du cuivre est
plus importante au premier cycle ou nous avons constaté des
concentrations allant à 6 g/L et cela serait dû à la
présence d'une grande quantité de cuivre dans le minerai au
départ. Mais pour le cycle de recirculation nous constatons que la
cinétique de solubilisation augmente légèrement ce qui est
dû à l'épuisement du cuivre.
Page | 41
Essai 4 : Résultats de la lixiviation dans la
colonne 4
Tableau 16:Evolution de la concentration de cuivre dans le
PLS
|
Temps (heure)
|
Cu
|
Co
|
Fe
|
|
(g/l)
|
(g/l)
|
(g/l)
|
|
6
|
2,57
|
0,05
|
0,52
|
|
12
|
2,56
|
0,05
|
0,51
|
|
18
|
2,38
|
0,06
|
0,57
|
|
24
|
2,51
|
0,07
|
0,32
|
|
30
|
1,28
|
0,04
|
0,37
|
|
36
|
1,36
|
0,4
|
0,16
|
|
42
|
1,17
|
0,05
|
0,32
|
|
48
|
1,08
|
0,06
|
0,18
|
|
54
|
0,85
|
0,05
|
0,29
|
|
60
|
3,17
|
0,04
|
0,31
|
|
66
|
1,99
|
0,15
|
0,75
|
|
72
|
2,73
|
0,22
|
1,1
|
|
78
|
2,93
|
0,26
|
1,18
|
|
84
|
3,37
|
0,36
|
1,52
|
|
90
|
1,80
|
0,21
|
0,66
|
|
96
|
2,01
|
0,24
|
0,72
|
|
102
|
3,02
|
0,28
|
0,58
|
|
108
|
1,98
|
0,31
|
0,44
|
|
114
|
3,80
|
0,26
|
0,96
|
|
120
|
1,99
|
0,15
|
0,75
|
|
126
|
2,73
|
0,22
|
1,1
|
|
132
|
3,93
|
0,26
|
1,18
|
|
138
|
3,37
|
0,36
|
1,52
|
|
144
|
3,80
|
0,21
|
0,66
|
Page | 42
Tableau 17:Rendement sur solide de solubilisation de la
lixiviation en tas
|
Désignation
|
% Cu
|
% Co
|
|
Alimentation
|
1.40
|
0.174
|
|
Résidu
|
0,69
|
0,074
|
|
Rendement(%)
|
59,1357
|
56,08
|
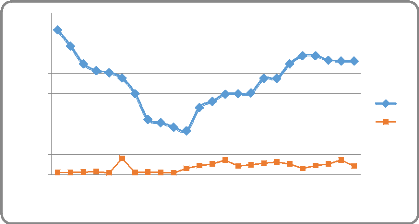
concentration g/L
0.5
3.5
2.5
1.5
4
0
3
2
1
6 12 18 24 30 36 42 48 54 60 66 72 78 84 90 96 102 108 114 120
126 132 138 144
Temps (h)
Cu Co
Figure 14: Evolution de la concentration du Cu et Co dans
le PLS en fonction du temps
Observation
La concentration était initialement de 2.6g/L
décroit sensiblement après le premier cycle de lixiviation puis
remonte avec la recirculation jusqu'à une concentration de 3.6 g/L.
L'effet de la recirculation influence sensiblement sur la concentration du
cuivre.
La concentration du cobalt reste constante durant le premier
cycle, dès le début du cycle de recirculation on observe une
remonté de la concentration en cobalt.
Page | 43
IV.2.1.3. Observation globale
A l'issu de nos quatre essais nous avons constaté
qu'une augmentation de l'acidité de la solution de percolation permet de
réduire significativement le temps de lixiviation. Le rendement de
solubilisation du cuivre augmente avec l'augmentation de l'acidité
pendant que celui du cobalt varie légèrement en fonction de la
concentration d'acide.
L'augmentation des rendements de solubilisation cuivre, cobalt
et fer avec l'augmentation de l'acidité s'expliquerait par une
étude thermodynamique à l'aide des diagrammes de POURBAIX des
systèmes Cu-H2O ; Co- H2O et Fe- H2O respectivement figure 4, 5 et 6.
Ces diagrammes révèlent en effet que dans des conditions
très acides, les rendements de solubilisation du cuivre, cobalt et fer
augmentent.
La figure suivante donne l'évolution du rendement de
lixiviation des quatre essais en fonction de leur concentration d'acide.
|
80 70 60 50 40 30 20 10 0
|
|
|
|
|
rendement %
|
|
Cu Co
|
|
|
|
|
C1 C3 C4
Acidité (g/L)
Figure 15: Evolution du rendement de solubilisation du Cu et
Co en fonction du temps
L'usage de solution plus diluées (10 g/L) permet de
réduire davantage la consommation d'acide. Néanmoins, cela
augmentera le temps de la lixiviation.
Apres cette observation nous retenons comme valeur optimum
d'acidité 75 g/l car elle nous donne un bon rendement en cuivre et en
cobalt.
Page | 44
IV.2.2. ESSAIS DE LIXIVIATION AVEC VARIATION DU DEBIT
IV.2.2.1. Influence du débit d'arrosage sur le rendement de
solubilisation
Les conditions opératoires sont données dans le
chapitre précédant et dont les résultats des
différents essais sont donnés dans les tableaux et figures
suivants.
Essai 1 : Résultats de la lixiviation dans la
colonne 1
Tableau 18:Evolution de la concentration de cuivre dans le
PLS
|
Poids rejets DMS : 10 kg
Eau acidulée : 75 g/L
Temps de lixiviation : 3 jours (72 heures)
Débit arrosage : 15 mL/min
Colonne 1
|
|
|
|
|
Temps
|
|
Concentration (g/L)
|
Rendement (%)
|
|
Heure
|
Cu
|
Co
|
Fe
|
Acide
|
Volume(l)
|
Cu
|
Co
|
|
8
|
8,6
|
0,47
|
0,36
|
22.56
|
5.2
|
12,9
|
5,67
|
|
16
|
5,1
|
0,29
|
0,43
|
-
|
2.2
|
20,5
|
9,17
|
|
32
|
2,84
|
0,21
|
0,2
|
45.86
|
6.9
|
24,8
|
11,7
|
|
40
|
7,31
|
0,32
|
0,48
|
-
|
3.3
|
35,7
|
15,5
|
|
56
|
6,86
|
0,31
|
0,42
|
-
|
7.7
|
46,0
|
19,3
|
|
72
|
6,66
|
0,3
|
0,4
|
43.12
|
10.5
|
56,0
|
32,9
|
|
10 8 6 4 2 0
|
|
|
|
|
Concentration g/L
|
|
Cu Co Fe
|
8 16 32 40 56 72
Temps (h)
Figure 16: Evolution de la concentration du Cu, Co et Fe
dans le PLS en fonction du temps
Observation
Nous remarquons comme dans le cas précèdent que
l'allure de notre courbe du cuivre reste quasi constante, plus on augmente le
temps moins il reste de cuivre dans le minerai, raison pour laquelle les
concentrations diminuent avec le temps puis augmente avant de se stabiliser
après recirculation. Les mêmes observations sont faites pour le
cobalt et le fer.
Figure 17: Evolution de la concentration du Cu, Co et Fe dans
le PLS en fonction du temps
Page | 45
Essai 2 : Résultats de la lixiviation dans la
colonne 2
Tableau 19:Evolution de la concentration de cuivre dans le
PLS
|
8 7 6 5 4 3 2 1 0
|
|
|
|
|
|
|
|
|
Concentration g/L
|
|
Cu Co Fe
|
8 16 32 40 56 72
Temps (h)
Poids rejets DMS : 10 kg
|
Eau acidulée : 75 g/L
Temps de lixiviation : 3 jours (72 heures)
Débit arrosage : 20 mL/min
Colonne 2
|
|
|
|
|
|
|
Concentration (g/L)
|
Rendement (%)
|
|
Heure
|
Cu
|
Co
|
Fe
|
Acide
|
Volume(l)
|
Cu
|
Co
|
|
8
|
7,12
|
0,16
|
1,14
|
40.12
|
10.8
|
15,76
|
2,85
|
|
16
|
5,13
|
0,13
|
0,2
|
-
|
5.4
|
27,12
|
5,16
|
|
32
|
4,36
|
0,16
|
0,29
|
51.13
|
11.2
|
36,77
|
8,01
|
|
40
|
5,15
|
0,24
|
0,43
|
-
|
11.6
|
48,18
|
12,29
|
|
56
|
4,61
|
0,18
|
0,35
|
56.64
|
12.1
|
58,39
|
15,50
|
|
72
|
4,78
|
0,2
|
0,36
|
51.45
|
15.6
|
63,97
|
29,06
|
Figure 18: Evolution de la concentration du Cu, Co et Fe dans
le PLS en fonction du temps
Page | 46
Observation
A ce débit, on observe une diminution de la concentration
du cuivre et du fer au cour du temps puis une brève augmentation avant
de se stabiliser. Pendant que la concentration du cobalt reste quasi
constante.
Essai 3 : Résultats de la lixiviation dans la
colonne 3
Tableau 20:Evolution de la concentration de cuivre dans le
PLS
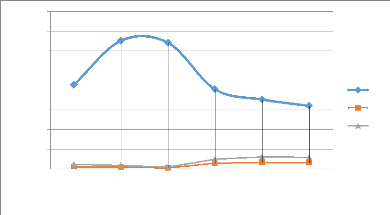
8 16 32 40 56 72
Temps (h)
Concentration g/L
0.5
3.5
2.5
1.5
4
0
3
2
1
Cu
Co
Fe
Poids rejets DMS : 10 kg
|
Eau acidulée : 75 g/L
Temps de lixiviation : 3 jours (72 heures)
Débit arrosage : 30 mL/min
Colonne 3
|
|
|
|
|
|
|
Concentration (g/L)
|
Rendement (%)
|
|
Heure
|
Cu
|
Co
|
Fe
|
Acide
|
Volume(l)
|
Cu
|
Co
|
|
8
|
2,14
|
0,06
|
0,12
|
50.08
|
17.4
|
12,2
|
2,75
|
|
16
|
0,77
|
0,05
|
0,09
|
-
|
11.6
|
16,6
|
5,07
|
|
32
|
0,61
|
0,03
|
0,05
|
58.92
|
19
|
20,2
|
6,49
|
|
40
|
2,03
|
0,15
|
0,25
|
-
|
11.6
|
31,9
|
13,4
|
|
56
|
3,26
|
0,17
|
0,32
|
73.54
|
16.9
|
50,8
|
21,3
|
|
72
|
3,21
|
0,16
|
0,3
|
51.94
|
23.9
|
69,33
|
38,8
|
Figure 19: Evolution de la concentration du Cu, Co et Fe dans
le PLS en fonction du temps
Page | 47
Observation
Nous observons une augmentation de la concentration du cuivre
pendant les 16 premières heures puis une elle se stabilise pendant les
16 heures à suivre avant de diminuer pendant les 40 heures
dernières heures restante. La même observation est faite pour le
cobalt et le fer.
Essai 4 : Résultats de la lixiviation dans la
colonne 4
Tableau 21:Evolution de la concentration de cuivre dans le
PLS
|
9 8 7 6 5 4 3 2 1 0
|
|
|
|
|
|
|
|
|
Concnetration g/L
|
|
Cu Co Fe
|
8 16 32 40 56 72
Temps (h)
Poids rejets DMS : 10 kg
|
Eau acidulée : 75 g/L
Temps de lixiviation : 3 jours (72 heures)
Débit arrosage : 35 mL/min
Colonne 4
|
|
|
|
|
|
|
Concentration (g/L)
|
Rendement (%)
|
|
Heure
|
Cu
|
Co
|
Fe
|
Acide
|
Volume
|
Cu
|
Co
|
|
8
|
8,33
|
0,2
|
1,32
|
26.9
|
18.5
|
24,3
|
4,71
|
|
16
|
1,63
|
0,07
|
0,33
|
-
|
9.8
|
29,1
|
6,36
|
|
32
|
4,24
|
0,29
|
1,08
|
42.5
|
19.1
|
41,5
|
13,1
|
|
40
|
3,96
|
0,31
|
1,18
|
-
|
15.3
|
53,1
|
20,5
|
|
56
|
3,91
|
0,3
|
1,06
|
73.1
|
18.8
|
64,6
|
27,5
|
|
72
|
4.00
|
0,3
|
1,10
|
75.4
|
24.6
|
76,3
|
44,6
|
Page | 48
Observation
Nous remarquons une diminution de la concentration du cuivre de
8.2g/L en fonction du temps jusqu'à une concentration inferieure
à 2g/L. L'effet de la recirculation du percolât influent
légèrement sur la concentration du cuivre.
Nous observons que pour ce cas-ci, la solubilisation du fer est
plus importante que dans les cas précédents.
IV.2.2.2. Influence du débit sur la consommation
d'acide
Les résultats des essais de lixiviation en colonne sont
donnés dans le tableau et les figures suivants.
Tableau 22:Evolution de la concentration de cuivre dans le
PLS
|
Poids rejets DMS : 10 kg
Eau acidulée : 75 g/L
Temps de lixiviation : 3 jours (72 heures)
|
|
Essais
|
Solubilisation (kg/t)
|
Consommation d'acide (kg/t)
|
|
Débit (mL/min)
|
Cu
|
Co
|
CIA
|
CAG
|
|
15
|
18.89
|
0.55
|
145.63
|
108.211
|
|
20
|
21.31
|
1.01
|
181.83
|
128.009
|
|
25
|
23.09
|
1.06
|
255.45
|
240.201
|
|
30
|
34.35
|
1.11
|
303.52
|
268.937
|
|
35
|
48.35
|
2.76
|
443.18
|
364.054
|
Figure 21: Evolution de la consommation d'acide en fonction
du débit d'arrosage
Page | 49
|
60 50 40 30 20 10 0
|
|
|
|
|
Solubilisation kg/t
|
|
Cu Co
|
15 20 25 30 35
Débit d'arrosage (mL/min)
Figure 20: Evolution de la concentration du Cu, Co et Fe
dans le PLS en fonction du débit
Observation
Nous constatons que la mise en solution du cuivre et même
celle du cobalt reste proportionnelle au débit d'arrosage
appliqué (15, 20, 25, 30,35 mL/min). Au-delà de ce point,
l'application d'un débit moindre (15 mL/min) favorise la
cinétique en diminuant le temps de lixiviation.
|
500 450 400 350 300 250 200 150 100 50
0
|
|
|
|
|
Consommation d'acide kg/t
|
|
CIA CAG
|
|
|
|
|
15 20 25 30 35
Débit d'arrosage (mL/min)
Ce phénomène s'explique par la diminution de
l'épaisseur de la couche limite formée entre la solution de
lixiviation et la particule solide, diminuant ainsi la barrière à
la diffusion des ions.
Page | 50
Observation
Comme on peut l'observer sur la figure 21, l'augmentation du
débit d'arrosage a un impact néfaste sur la consommation d'acide
mais un impact positif sur le rendement de solubilisation. Le constat est que
la consommation d'acide est proportionnelle au débit d'arrosage. La
dépendance vis-à-vis du temps s'explique simplement par la
différence de volumes de solution ayant percolé.
Ces essais ont démontré que le rendement de
solubilisation ainsi que la consommation d'acide sont proportionnels à
la variation du débit d'arrosage.
Page | 51
CONCLUSION GENERALE
L'objectif principal de ce travail était de voir
l'incidence du débit d'arrosage sur la consommation d'acide. Nous avons
effectué nos essais sur le rejet HMS Kambove titrant environ 1,40 % en
cuivre et 0,174 % en cobalt. Pour atteindre cet objectif, plusieurs tests de
lixiviation en colonne de 9.5 cm de diamètre et 110.7 cm de hauteur ont
été effectués.
La première étape a consisté à
effectuer des essais d'optimisation de la concentration en acide dans la
solution de lixiviation afin de voir la cinétique de lixiviation ainsi
que de déterminer le rendement de solubilisation du cuivre et du cobalt
se trouvant dans le rejet HMS. A la suite de nos essais, nous sommes
arrivés à nous fixer les conditions optimums permettant de
solubiliser une quantité importante du cuivre et du cobalt.
En travaillant avec un poids de 10kg de rejet HMS par colonne,
à un débit constant de 25mL/min pendant 144 heures, tout en
variant l'acidité (10, 25, 50 et 75g/l). Nous sommes passés d'un
rendement de lixiviation de 59.8% à 75.8% pour le cuivre et 52.08%
à 57.76% pour le cobalt. C'est la concentration de 75g/l d'acide que
l'on prend comme valeur optimum pour les essais suivants.
A l'issu de ces essais nous avons constaté que le
rendement de solubilisation du cuivre était proportionnel à la
concentration en acide pendant que celui du fer et du cobalt varié
légèrement en fonction de l'acidité.
Dans la seconde étude, nous avons effectué une
lixiviation en variant le débit d'arrosage (15, 20, 25, 30, 35mL/min)
tout en gardant constante la concentration en acide (75g/l), le poids du tas
(10kg) et le temps (72heures). Nous avons effectué 5 essais de
lixiviation dans le but d'évaluer principalement l'influence du
débit d'arrosage sur la consommation d'acide totale mais
également l'influence du débit sur le rendement de
solubilisation.
Page | 52
Les résultats obtenus au cours de cette série
d'essais ont montré que sous les conditions optimales (Acidité=75
g/L, t=72h, débit= 35mL/min) pour le cuivre et (Acidité=75 g/L,
t=72h, débit= 25mL/min) pour le cobalt ; les rendements de
solubilisation atteints respectivement sont de 76.98 % et 57,74 % et leurs
consommations totales d'acide relatives sont 443.18 kg/t et 255.45 kg/t.
Une diminution du débit d'arrosage induit une
augmentation importante du temps de lixiviation tout en représentant un
avantage en termes de gestion de la solution d'attaque dans la mesure où
elle produit une diminution sensible de la consommation en acide.
La vitesse de dissolution du cuivre dépend de l'apport
en acide par les solutions de lixiviation. La récupération du
cuivre contenu dans le rejet HMS est donc logiquement
accélérée par l'augmentation du débit de solution
arrosée.
En fin, cette étude montre qu'il est possible
d'effectuer une lixiviation en tas avec des grands débits dans le but
d'avoir des rendements de solubilisation important mais une question reste
posée quelle en sera la consommation d'acide? Nos essais ont
démontré que pour travailler d'une manière rentable il
faut faire une balance équitable des avantages et des
inconvénients de chaque paramètre car les meilleurs rendement de
lixiviation ne dépendent donc pas seulement du débit d'arrosage
mais également de la concentration en acide et aussi du temps.
Vu que les rendements de lixiviation du cobalt obtenus sont
relativement faibles, nous suggérons de compléter ce travail en
effectuant des essais de lixiviation avec ajout d'un réducteur afin
d'améliorer le rendement du cobalt. Ce travail peut encore être
compléter en tenant compte d'autres paramètres de lixiviation sur
lesquels nous n'avons pas tenu compte. Une gestion des impuretés lors de
la variation des paramètres de lixiviation en tas peut aussi
s'avérer d'une importance capitale.
Page | 53
REFERERENCES BIBLIOGRAPHIQUES
? OUVRAGES
[1]. M. POURBAIX, Atlas d'équilibre
électrochimiques à 25°C, Gauthier Villars & Cie,
Paris 1963.
[2]. Lassin A., Bodenan F., Piantone P., Blanc P. (2002) -
Essais de comportement des déchets à la lixiviation et
modélisation des processus « hydro-physico-chimie »
associés. Etude bibliographique. Rapport BRGM/RP-51518-FR,
pp35-44.
[3]. H. Salomon-de-Freiberg, Hydrometallurgical Copper
extraction : introduction and Leaching, pp 289-299.
[4]. Technical resource document: Extraction and
beneficietion of ores and minerales: volume 4, copper august 1994,
pp61-64.
[5]. R. Rumbu(2006), Métallurgie, pp59-70
? ARTICLES
[6]. F. Geffroy, Avancées technologiques en
lixiviation en tas, école des mines de paris, 2012, pp1-21.
[7]. RECORD, Etude du comportement à la lixiviation
de matériaux minéraux en scénarios, 2001, pp 84- 93
[8]. Alan ESCAKE, Leaching characteristics of sulphide
mineralisation from the kay tanda prospect, philippines, july 2008, rapport
M1499, pp12-16
[9]. L. RIZERT., P. CHARPENTIER, Métallurgie
extractive: Hydrométallurgie, technique de
l'ingénieur(M2235), pp3-4.
[10]. Copper cobalt Africa 2015 conference pp237-245
[11]. Cognis minig chemicals technology, Lixiviation du
cuivre
[12]. Kafumbila K., Kongolo K. et Mpoyo M. ; Nouvelle
stratégie d'amélioration des performances de l'usine
hydrométallurgique de shituru, département d'études
métallurgique, 2004.
Page | 54
? THESES ET MEMOIRES
[13]. Alvayai C., 2006, Traitement hydrométallurgique
des minerais du Katanga, université de liège, pp25-31,
pp67-78
[14]. Yixuan Han. Mise au point d'un essai de
caractérisation environnementale sur matériau monolithique par
percolation ascendante. Sciences de l'ingénieur [physics]. Ecole
Centrale de Lille, 2010. Français.
[15]. P. Kodali (2010), Pretreatment of copper ore prior to
heap leaching, the university of Utah, pp24-60
[16]. P. Musampa (2012-2013), Avant-projet technique
d'installation de la lixiviation en tas rejets fin de panda laverie,
université de Lubumbashi.
| 


