2.3. La méthodologie
2.3.1. Test de viabilité des spores du Metarhizium
acridum
Metarhizium acridum est produit et vendu sous
différents noms en Afrique et en Australie. Le produit
élaboré en Afrique, appelé Green Muscle®,
est manufacturé en Afrique du Sud et au Sénégal. Il peut
être fourni sous formes de spores sèches (formulation TC) ou de
concentré miscible à l'huile (formulation OF). Puisque le produit
peut être affecté par des températures
élevées pendant le transport et/ou le stockage, il est toujours
bon de tester la viabilité des pores avant emploi. Un échantillon
des spores sèches est prélevé avant et après
l'application pour déterminer le pourcentage de spores viables
utilisées.
Cet échantillon est dilué avec de l'eau
mélangé avec du Tween 80. La viabilité est mesurée
en estimant le pourcentage de germination des spores après une
incubation de 24 heures entre 25 et 26°C dans 5 boîtes de
Pétri contenant du Sabouraud Dextrose Agar (SDA). Après
l'incubation, le nombre de spores germées et non germées est
noté en utilisant le microscope (X40). Les pourcentages de germination
vont être calculés selon la formule suivante (Mohamed &
Diallo, 2007) :
% de germination = [a / (a + b)] * 100 a= nombre de spore
germées
b= nombre de spores non germées Avec a + b = 100
2.3.1.1. Préparation du milieu de culture

34

35
Le milieu de culture utilisé pour les tests de
viabilités des spores est le Sabouraud Dextrose Agar (SDA). La
préparation d'un litre de milieu de culture a consisté à
peser 45 g de SDA à l'aide d'une balance de précision (Toledo).
La quantité de SDA pesée a été versée dans
un erlenmeyer, chauffée avec une plaque chauffante et
homogénéisée à l'aide d'un barreau
magnétique jusqu'à la dissolution complète du SDA. Le
mélange obtenu est ensuite versé dans une éprouvette
graduée et ajustée à 1 litre avec de l'eau
distillée. Le milieu ainsi obtenu est réparti dans cinq
bouteilles de 250 ml, à raison de 200 ml par bouteille. Les bouteilles
ont été mises dans l'autoclave pour être
stérilisée à la chaleur humide à 121 ° C
pendant 45 minutes, puis refroidies dans un bain marie à 55°C. Une
seule bouteille a été utilisée pour le coulage dans nos 10
boîtes de Pétri et les 4 autres ont été
conservées pour une prochaine utilisation.
2.3.1.2. Préparation de l'inoculant fongique
Deux solutions mères ont été
préparées avec deux paquets différents de Green
Muscle®: l'un venant du congélateur et un second venant
du magasin de stockage. Une quantité de 0,01 g de poudre sèche de
Green Muscle® a été pesée et placée
dans un tube de Facon avec 10 ml d'eau distillée et du Tween 80.
Après homogénéisation à l'aide d'un vortex pendant
5 minutes, la technique de dilutions successives a été
utilisée pour ensuite ensemencer les boîtes de Pétri. La
dilution 10-2 a été utilisée pour le test de
viabilité des spores (Figure 4).
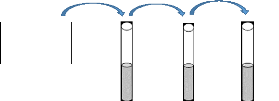
0,01 g de Metarhizium acridum
10 ml 9 ml 9 ml
Dilution = SM = 101 10-1 10-2
Figure 4: Technique des dilutions
successives
A l'aide de l'hémocytomètre, la concentration de
spores / ml a été déterminée pour les dilutions
10-1 et 10.2.
2.3.1.3. Calcul de la concentration en spores avec
l'hémocytomètre Cinq carrés ont
été comptés :
1. Compter le nombre de spores dans chacun des 5
grandes places.
2. Additionner le nombre total de spores comptés dans 5
carrés.
3. Répéter le comptage sur une seconde grille comme
indiqué ci-dessus
4. Calculer le nombre de spores moyen: Soient a
et b = total pour chaque grille.
Soit X = nombre moyen de 5 places.
X = (a + b) / 2
a = comptage des 5 carrés haut
b = comptage 5 carrés bas
X = moyenne des deux niveaux (haut et bas)
5. Utiliser 0,1 pl (microlitre) de suspension de
spores de plus de 25 carrés. Soit c =
concentration de spores par ml
c = X 5 x 104
Soit n = nombre de dilution
C = la concentration de spores dans la solution
d'origine
C = c x 10 n
| 


